Область техники
Настоящее изобретение относится к неизвестному до настоящего времени классу соединений, которые проявляют противовоспалительное действие, к фармацевтическим композициям, содержащим такие соединения, к дозированным формам таких композиций, а также к их применению для лечения и профилактики астмы, аллергии, артритов, включая ревматоидные артриты и спондилоартриты, подагры, атеросклероза, хронического воспалительного заболевания кишечника (болезнь Крона), пролиферативных и воспалительных заболеваний кожи, таких как псориаз и аллергический дерматит, увеита (воспаления слизистой оболочки глаз), септического шока, СПИДа и акне.
Уровень техники
Ранее был описан ряд близких по структуре аминобензофенонов (например, 4-(2-амино-4-нитрофениламино)бензофенон) (Hussein F.A. et al., Iraqi J. Sci., 22, 54-66 (1981)). Однако не было описано их применение. В PCT/DK98/00008 сообщается о аминобензофенонах – ингибиторах выделения интерлейкина 1β (IL-1β) и фактора некроза опухолей α (TNF-α) in vitro, указанные соединения являются потенциально пригодными для лечения таких воспалительных заболеваний, при которых патогенез связан с продуцированием цитокинов, например, таких как астма, ревматоидный артрит, псориаз, контактный дерматит и аллергический дерматит. Кроме того, соединения, описанные в PCT/DK98/00008, были протестированы in vivo в отношении противовоспалительных свойств на модели с 12-О-тетрадеканоилфорбол-13-ацетатом (ТРА), индуцирующим хроническое воспаление кожи у мышей (De Yong, L. M. et al., Agents Actions, 26, 335-341 (1989), Carlson, R.P. et al., Agents Actions, 17, 197-204 (1985); Alford, J.G. et al., Agents Actions, 37, (1992); Stanley P.L. et al., Skin Pharmacol., 4, 262-271 (1991)). Для этой модели хронического воспаления кожи эти соединения оказались столь же эффективными, как и известное соединение гидрокортизон.
Целью настоящего изобретения является получение других фармакологически активных производных аминобензофенона и родственных соединений.
Эта цель достигается благодаря новым производным аминобензофенона согласно общей формуле I, которые являются потенциальными ингибиторами секреции интерлейкина 1β (IL-1β) и фактора некроза опухолей α (TNF-α) in vitro, вследствие чего эти соединения потенциально пригодны для лечения таких воспалительных заболеваний, при которых секреция и регулирование уровня цитокинов, или более конкретно интерлейкина 1β (IL-1β) и фактора некроза опухолей α (TNF-α), являются частью патогенеза. Ингибирование или снижение уровня цитокинов, возможно, является следствием ингибирования МАР-киназ.
Сущность изобретения
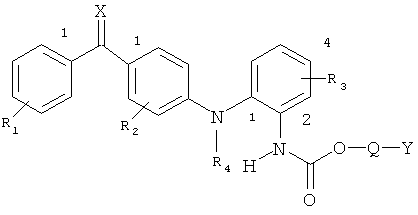
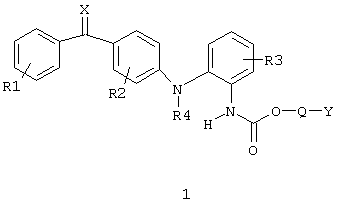
Соединения в соответствии с настоящим изобретением представлены приведенной ниже общей формулой I
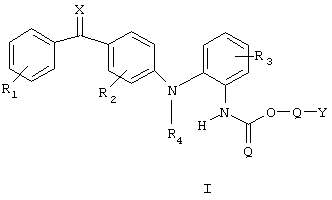
в которой R1 и R2 независимо представляют собой один или более одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, галогена, гидрокси, меркапто, трифторметила, амино, (C1-С3)алкила, (С2-С3)олефиновой группы, (C1-С3)алкокси, (C1-С3)алкилтио, (C1-С6)алкиламино, (C1-С3)алкоксикарбонил, циано, карбамоил, фенил или нитро;
R3 представляет собой водород, галоген, гидрокси, меркапто, трифторметил, амино, (C1-С3)алкил, (С2-С3)олефиновую группу, (C1-С3)алкокси, (C1-С3)алкилтио, (C1-С6)алкиламино, (C1-С3)алкоксикарбонил, фенил, циано, карбокси или карбамоил;
R4 представляет собой водород, (C1-С3)алкил или аллил;
Q представляет собой связь или -С(R6) (R7)(-О-С=О)-, в этой формуле R6 и R7 означают водород, трифторметил или (C1-C4)алкил;
Y представляет собой либо (C5-C15)алкил, (C2-C15)олефиновую группу, (С3-С10)моноциклический углеводород или фенил, каждый из которых может быть необязательно замещен одним или более одинаковыми или различными заместителями, представленными формулой R5, или (C1-C4)алкил, замещенный, по меньшей мере, одним или более заместителем формулы R5, или Y представляет собой группу формулы CH2(Z-О)n-Z, где Z представляет собой (C1-С3)алкил и где n представляет собой целое число >1 и нет никакой непрерывной линейной последовательности атомов в группе Y>15;
R5 представляет собой галоген, гидрокси, меркапто, трифторметил, амино, (C1-С3)алкокси, (C1-С3)алкилтио, (C1-С6)алкиламино, (C1-С3)алкоксикарбонил, циано, азидо, нитро, -СООН, -CONH2, -CONHR’ или -COONR’R’, где R’ означает (C1-С3)алкил;
Х означает кислород или серу,
а также его соли с фармакологически приемлемыми кислотами, гидраты и сольваты.
Подробное описание изобретения
Предпочтительные варианты изобретения
В соединениях формулы I R1 предпочтительно представляет собой один или более одинаковых или различных заместителей, выбранных из группы, состоящей из фтора, хлора, брома, гидрокси, трифторметила, амино, (C1-C)алкила, (С2-С3)алкенила, (C1-С3)алкокси, (C1-С3)алкоксикарбонила или циано. R2 предпочтительно представляет собой один или более одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, фтора, хлора, брома, гидрокси, трифторметила, амино, (C1-С3)алкила, (С2-С3)алкенила, (C1-С0)алкокси. R3 предпочтительно представляет собой один или более одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, галогена, гидрокси, трифторметила, (C1-С3)алкила, (С2-С3)алкенила, (C1-С3)алкокси, (C1-С3)алкоксикарбонила, циано или карбокси. R4 предпочтительно представляет собой водород, (C1-C2)алкил или аллил. Х предпочтительно представляет собой кислород. Q предпочтительно представляет собой связь или -СН2-O-С=O-.
Более предпочтительно Y представляет собой (C1-C4)алкил, замещенный одним или более одинаковыми или различными заместителями, выбранными из группы, представленной галогеном, гидрокси, амино, (C1-C2)алкокси, (C1-C4)алкиламино, (C1-С3)алкоксикарбонилом, циано, азидо, -СООН, -CONH2, -CONHR’ или -CONRR’, где R и R’ означают (C1-C2)алкил, или Y представляет собой (С5-С6)алкил, (С2-С6)алкенил, (С3-С6)циклоалкил, (C5-C8)циклоалкеновую группу, или фенил, каждый из которых необязательно замещен одним или более одинаковыми или различными заместителями, выбранными из группы, включающей галоген, гидрокси, амино, (C1-C2)алкокси, (C1-C4)алкиламино, (C1-С3)алкоксикарбонил, циано, азидо, -СООН, -CONH2, -CONHR’ или -CONRR’, где R и R’ означают (C1-C2)алкил.
Еще более предпочтительно, если R1 представляет собой один или более одинаковых или различных заместителей, выбранных из группы, состоящей из фтора, хлора, брома, гидрокси, метила или метокси, и R1 представляет собой один заместитель в положении 2, предпочтительно R1 означает 2-метил. R2 наиболее предпочтительно представляет собой один или более одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, фтора, хлора, брома, гидрокси, метила или метокси, и R2 представляет собой один заместитель в положении 2, предпочтительно R2 означает 2-Сl. R3 и R4 наиболее предпочтительно представляют собой водород. Y наиболее предпочтительно представляет собой (C1-С4)алкил, замещенный галогеном, гидрокси, амино, циано, азидо и -СООН, или Y представляет собой (С5-С6)алкил, (C5-C6)карбоциклическую группу или фенильную группу, каждая из которых может быть необязательно замещена одним или более одинаковыми или различными заместителями, выбранными из группы, включающей хлор, бром, гидрокси, амино, азидо, (C1-C2) алкоксикарбонил, циано, СООН, -CONH2, -СОN(СН3)2.
Наиболее предпочтительно Y представляет собой метил, 1-хлорметил, 2-азидоэтил, гексил, 6-хлоргексил или фенил.
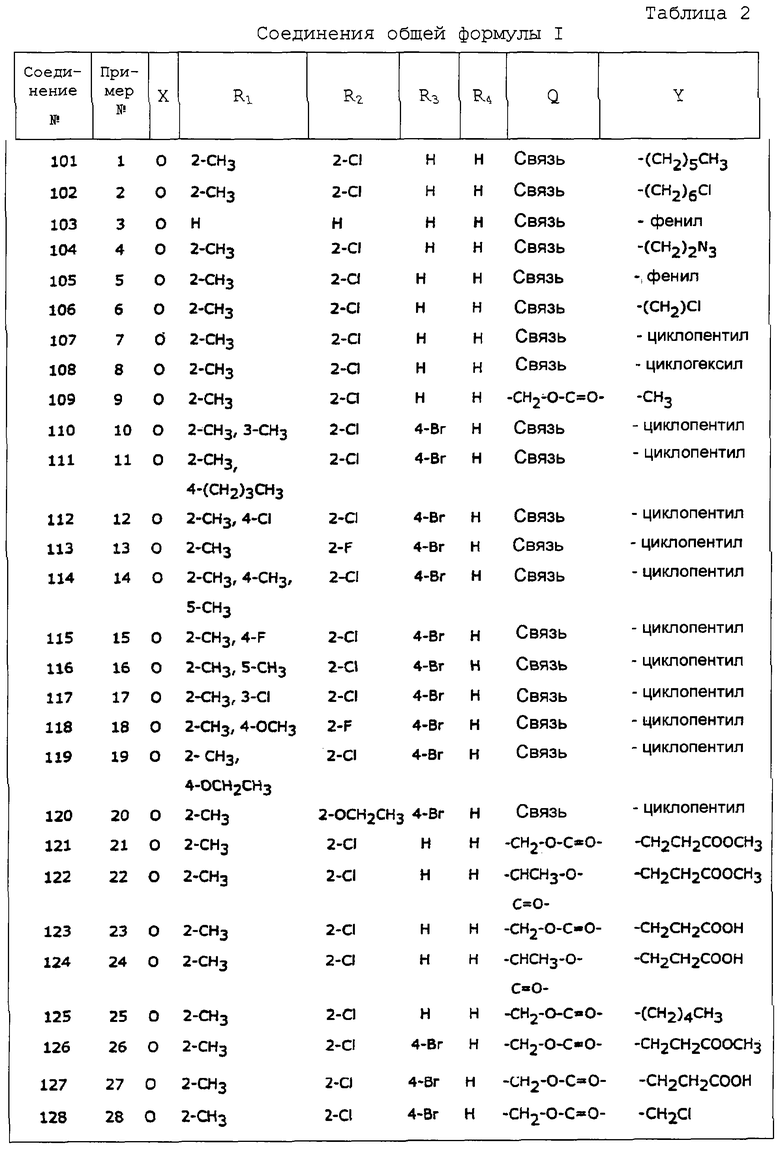
Конкретными соединениями в соответствии с настоящим изобретением являются
гексил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 101),
6-хлоргексил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 102),
фенил-N-[2-(4-бензоилфениламино)фенил]карбамат (соединение 103),
2-азидоэтил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 104),
фенил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 105),
1-хлорметил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 106),
циклопентил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 107),
циклогексил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 108),
1-ацетоксиметил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 109),
циклопентил-N-[5-бром-2-[3-хлор-4-(2,3-диметилбензоил)фениламино]фенил]карбамат (соединение 110),
циклопентил-N-[5-бром-2-[3-хлор-4-(4-н-бутил-2-метилбензоил)фениламино]фенил]карбамат (соединение 111),
циклопентил-N-[5-бром-2-[3-хлор-4-(4-хлор-2-метилбензоил)фениламино]фенил]карбамат (соединение 112),
циклопентил-N-[5-бром-2-[3-фтор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 113),
циклопентил-N-[5-бром-2-[3-хлор-4-(2,4,5-триметилбензоил)фениламино]фенил]карбамат (соединение 114),
циклопентил-N-[5-бром-2-[3-хлор-4-(4-фтор-2-метилбензоил)фениламино]фенил]карбамат (соединение 115),
циклопентил-N-[5-бром-2-[3-хлор-4-(2,5-диметилбензоил)фениламино]фенил]карбамат (соединение 116),
циклопентил-N-[5-бром-2-[3-хлор-4-(3-хлор-2-метилбензоил)фениламино]фенил]карбамат (соединение 117),
циклопентил-N-[5-бром-2-[3-фтор-4-(4-метокси-2-метилбензоил)фениламино]фенил]карбамат (соединение 118),
циклопентил-N-[5-бром-2-[3-хлор-4-(4-этокси-2-метилбензоил)фениламино]фенил]карбамат (соединение 119),
циклопентил-N-[5-бром-2-[3-этокси-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 120),
1-(3-(метоксикарбонил)пропаноилокси)метил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 121),
1-(3-(метоксикарбонил)пропаноилокси)этил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 122),
1-(3-карбоксипропаноилокси)метил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 123),
1-(3-карбоксипропаноилокси)этил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 124),
1-(гексаноилокси)метил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 125),
1-(3-(метоксикарбонил)пропаноилокси)метил-N-[5-бром-2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 126),
1-(3-карбоксипропаноилокси)метил-N-[5-бром-2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 127),
1-хлорметил-N-[5-бром-2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 128),
а также их соли с фармацевтически приемлемыми кислотами, гидраты и сольваты.
Другими предпочтительными соединениями общей формулы I являются соединения, в которых R1, R2 и R3 представляют один заместитель, R1 и R2 предпочтительно находятся в орто-положении.
В описании изобретения, если не указано иное, приведенные ниже термины имеют следующее значение.
“Алкил” относится к любой одновалентной группе, полученной из алкана в результате удаления атома водорода от любого атома углерода, и включает подклассы нормальных алкилов (н-алкилов) и первичные, вторичные, третичные алкильные группы, соответственно содержащие указанное число атомов углерода, включающие, например, (C1-С3)алкил, (C1-C4)алкил, (С5)алкил, (C5-C15)алкил, (С6-С10)алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Термин “алкан” относится к ациклическому разветвленному и неразветвленному углеводороду, соответствующему общей формуле СnН2n+2 и, следовательно, полностью состоящему из атомов водорода и насыщенных атомов углерода.
“Олефиновая группа” относится к линейному или разветвленному ациклическому углеводороду, содержащему одну или более углерод-углеродную двойную связь, по которой соединение имеет либо Е, либо Z стереохимическую конфигурацию, где это возможно, и имеющему указанное число атомов углерода. Данный термин включает, например, (C2-C15)олефиновую группу, предпочтительно (C2-C15)алкенил; (С2-С3)олефиновую группу, предпочтительно (С2-С3)алкенил; винил; аллил; 1-бутенил; 2-бутенил и 2-метил-2-пропенил. Предпочтительными являются олефиновые группы, содержащие только одну углерод-углеродную двойную связь, именуемые здесь "алкенил".
“Алкокси” в общем относится к радикалу формулы -OR, в которой R представляет собой алкил, как определено выше, например (C1-С3)алкокси, (C1-C2)алкокси, метокси, этокси, н-пропокси и подобные им радикалы.
“(C1-С3)алкилтио” в общем относится к радикалу формулы -SR, в которой R представляет собой алкил, как определено выше, и включает метилтио, этилтио, н-пропилтио и 2-пропилтио.
“(C1-С6)алкиламино” в общем относится к радикалу формулы -NHR или NR2, в котором R представляет собой алкил, как определено выше, содержащий от 1 до 6 атомов углерода, и включает, например, метиламино, диметиламино, ди(н-пропиламино) и н-бутил(этил)амино.
“(C1-С3)алкоксикарбонил” в общем относится к радикалу формулы -COOR, в котором R представляет собой алкил, как определено выше, и включает метоксикарбонил, этоксикарбонил, н-пропоксикарбонил и изо-пропоксикарбонил.
“(С3-С10)моноциклическая углеводородная группа” включает насыщенные циклоалканы и ненасыщенные циклические олефины, например, такие как циклоалкены, имеющие одну эндоциклическую двойную связь и содержащие от 3 до 10 атомов углерода, и включает, например, (С3-С8)циклоалкил, циклопропил, циклопентил, циклогексил и циклооктил, (С3-С8)циклоалкеновую группу и (С3-С10)циклоалкеновую группу. Конкретными примерами являются циклопроп-2-енил, циклобут-2-енил, циклопент-2-енил, циклогекс-3-енил и циклонон-4-енил.
“Амино” означает группу –NH2.
“Карбамоил” относится к любой из групп –CONH2, -CONHR или -CONRR’, где R и R’ означают алкил, как определено выше.
“Карбокси” относится к радикалу формулы -СООН.
“Галоген” означает, одинаковые или различные радикалы, фтор, хлор, бром и иод; фтор, хлор и бром являются предпочтительными.
Фенильная группа R1 и R2 может быть необязательно замещенной, например, гидрокси-, амино-, нитро-, цианогруппами; галогеном, предпочтительно фтором, хлором или бромом; метилом или метокси.
Соединения в соответствии с изобретением могут быть использованы в виде их солей, которые образованы с фармацевтически приемлемыми неорганическими или органическими кислотами, например, такими как хлористоводородная, бромистоводородная и иодистоводородная кислоты, фосфорная кислота, серная кислота, азотная кислота, п-толуолсульфоновая кислота, метансульфоновая кислота, муравьиная кислота, уксусная кислота и пропионовая кислота, лимонная кислота, винная кислота, янтарная кислота, бензойная кислота, малеиновая кислота, эти примеры рассматриваются как неограничивающие объем изобретения.
Фармакологические методы
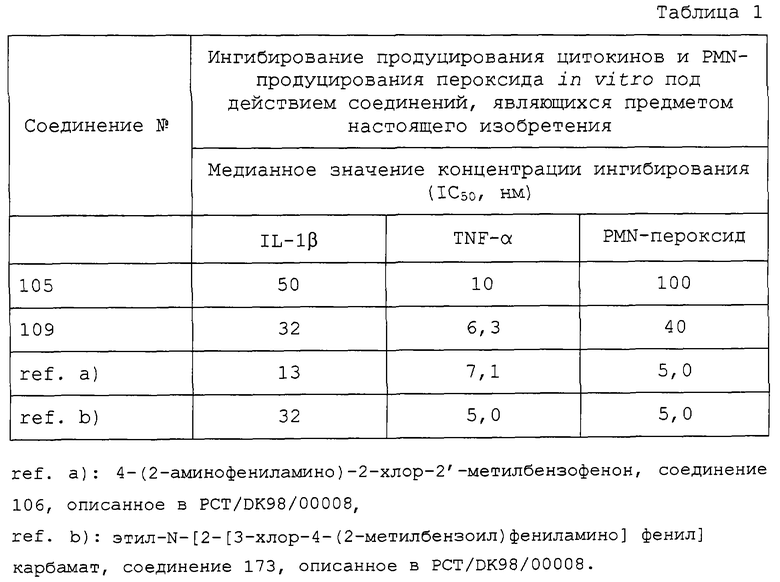
Для того чтобы исследовать действие соединения в соответствии с настоящим изобретением in vitro, оценивали ингибирование секреции IL-1β и TNF-α, используя следующую методику.
Продуцирование цитокина измеряли в среде мононуклеарных клеток периферической крови, стимулированных липополисахаридами (LPS). Мононуклеарные клетки выделяли из периферической крови человека фракционированием с использованием Lymphoprep® (фирма "Nycomed", Норвегия) и суспендировали в RPMI 1640 (среда роста) с фетальной телячьей сывороткой (FCS, 2%) при концентрации 5×105 клеток/мл. Клетки инкубировали в 24-луночном планшете для культур ткани в 1 мл аликвотах. Тестируемые соединения растворяли в диметилсульфоксиде (DMSO, 10 мМ) и разбавляли средой. Соединения добавляли к клеткам на 30 мин, затем добавляли LPS (конечная концентрация 1 мг/мл). Планшеты инкубировали в течение 18 ч и определяли концентрацию IL-1β и TNF-α в среде, используя твердофазный иммуноферментный анализ. Рассчитывали значение концентрации ингибирования (IС50) для соединений. Полученные результаты приведены в таблице 1.
Соединения в соответствии с настоящим изобретением также проявляли сходную активность, выраженную способностью ингибировать PMN (полиморфонуклеарную) секрецию пероксида, что также является признаком возможного использования в качестве противовоспалительных лекарственных средств. Соединения тестировали с использованием следующей методики.
Полиморфонуклеарные (PMN) гранулоциты выделяли из крови человека посредством осаждения декстраном, фракционирования с использованием Lymphoprep® и гипотонического лизиса загрязняющих эритроцитов.
Генерирование пероксид-аниона измеряли как восстановление феррицитохрома С, ингибируемое пероксиддисмутазой (Madhu, S.B. et al., Inflammation, 16, 241, (1992)). Клетки суспендировали в сбалансированном солевом растворе Хэнкса и инкубировали в течение 10 мин при 37°С с исследуемыми соединениями. Клетки первоначально обрабатывали добавлением TNF-α (конечная концентрация 3 нг/мл) в течение 10 мин и затем в течение 3 мин добавляли феррицитохром С (конечная концентрация 750 мкг/мл), бычий сывороточный альбумин (BSA, конечная концентрация 1 мг/мл) и формил-метионил-лейцил-фенилаланин (fMLP, конечная концентрация 10-7 М). Клетки охлаждали на льду и центрифугировали. С помощью спектрофотометра измеряли оптическую плотность свободного от клеток супернатанта. Рассчитывали значение концентрации ингибирования (IC50) для соединений. Полученные результаты приведены в таблице 1.
Эти результаты свидетельствуют о том, что соединения в соответствии с настоящим изобретением способны ингибировать продуцирование IL-1β, TNF-α и PMN-пероксида, вследствие чего эти соединения потенциально пригодны для лечения воспалительных заболеваний.
Для того чтобы исследовать in vivo соединения в соответствии с настоящим изобретением была использована модель с 12-О-тетрадеканоилфорбол-13-ацетатом (ТРА), индуцирующим хроническое воспаление кожи у мышей (De Yong L.M. et al., Agents Actions, 26, 335-241 (1989); Carlson R.P. et al., Agents Actions, 17, 197-204 (1985); Alford J.G. et al., Agents Actions, 37, (1992); Stanley P.L. et al., Skin Pharmacol., 4, 262-271 (1991)), перенесено описание метода из PCT/DK98/00008, включенного в настоящее описание в качестве ссылки. Полученные результаты свидетельствуют о том, что соединения в соответствии с настоящим изобретением обладают той же эффективностью в сравнении с известными описанными соединениями, например гидрокортизоном, обладающим известными побочными эффектами, в то время как соединения в соответствии с настоящим изобретением высокотолерантны и нетоксичны. Некоторым из данного класса соединений свойственна очень низкая абсорбция, вследствие чего эти соединения особенно полезны для лечения различных дерматологических заболеваний. Как правило, эти соединения могут быть введены, например, перорально, внутривенно, назально, местно и трансдермально.
Способ получения
Соединения в соответствии с настоящим изобретением могут быть получены рядом способов, хорошо известных специалистам в области органического синтеза. Соединения в соответствии с настоящим изобретением могут быть синтезированы с использованием методов, приведенных ниже, в сочетании с методами, известными в области органической химии, или с вариантами таких методов, как принято у специалистов в данной области техники. Предпочтительные методы включают описанные ниже, но не ограничиваются ими.
Новые соединения формулы I могут быть получены с использованием реакций и методик, описанных в данном разделе. Эти реакции проводят в среде растворителей, подходящих для используемых реагентов и веществ и для осуществления превращений. Также в случае синтетических методик, описанных ниже, следует понимать, что все предлагаемые условия реакций, включая выбор растворителя, газовой среды, в которой проводится реакция, температуры реакции, продолжительности эксперимента и методик выделения, подобраны таким образом, чтобы быть обычными для данной реакции, что может быть легко определено специалистами в данной области техники. Специалистам в области органического синтеза понятно, что функциональность, присущая различным частям образующейся молекулы, должна быть совместима с предполагаемыми реагентами и условиями проведения реакции. Не все соединения формулы I, попавшие в данный класс, могут быть совместимы с некоторыми из условий реакций, необходимыми для некоторых из описанных методов. Такие ограничения в отношении заместителей, которые необходимы для совместимости с условиями реакции, будут легко понятны специалистам в данной области техники, и в этом случае могут быть использованы альтернативные методы.
Схема 1
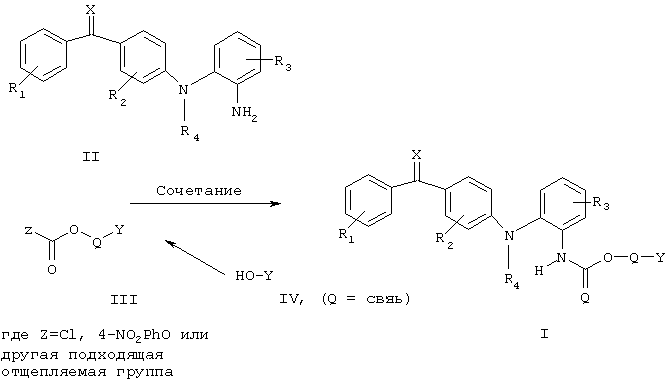
и R1, R2, R3, R4, Х и Y имеют указанные выше значения.
Соединения согласно настоящему изобретению могут быть получены способом, включающим взаимодействие амина формулы II со сложным хлорформиатным эфиром, со сложным 4-нитрофенилформиатным эфиром или другими подходящими активированными производными формулы III, как показано на схеме 1, где R1, R2, R3, R4, Х и Y являются такими, как определено в общей формуле I, с тем исключением, что любые заместители или функциональные группы, которые потенциально реакционноспособны в реакции сочетания, могут быть защищены перед проведением реакции сочетания, и впоследствии защита может быть удалена.
В особенности в том случае, когда Q представляет собой связь, соединения в соответствии с настоящим изобретением могут быть получены способом, согласно которому реакционноспособное промежуточное соединение формулы III сначала образуется in situ из соответствующего спирта общей формулы IV, например, при обработке фосгеном, бис(трихлорметил)карбонатом, ди(2-пиридил)карбонатом и тому подобным образом, с последующей обработкой амином общей формулы II, в которой R1, R2, R3, R4, Х и Y являются такими, как определено в общей формуле I, за исключением того, что любые заместители или функциональные группы, которые потенциально реакционноспособны в реакции сочетания, могут быть защищены перед проведением реакции сочетания, и впоследствии защита может быть удалена.
Соединения согласно настоящему изобретению, соответствующие общей формуле II (Х=O), могут быть получены несколькими способами, известными специалистам в области органического синтеза. Одна из полезных последовательностей реакций для получения продукта общей формулы VIII приведена на схеме 2, согласно которой ключевой способ включает взаимодействие амина формулы VII с фторидом, хлоридом, бромидом, иодидом или трифторметилсульфонатом общей формулы VIII, как показано на схеме 2, где R1, R2, R3, R4, являются такими, как определено в общей формуле I, с получением продукта общей формулы VI, за исключением того, что любые заместители или функциональные группы, которые потенциально реакционноспособны в реакции сочетания, могут быть защищены перед проведением реакции сочетания, и впоследствии защита может быть удалена. Это соединение VI может быть затем восстановлено до соответствующего амина общей формулы II путем обработки известными восстанавливающими агентами. Примеры таких восстанавливающих агентов включают дигидрат хлорида двухвалентного олова; водород, формиат аммония, гидразингидрат и каталитическое количество палладия на углероде, но не ограничиваются ими.
Схема 2
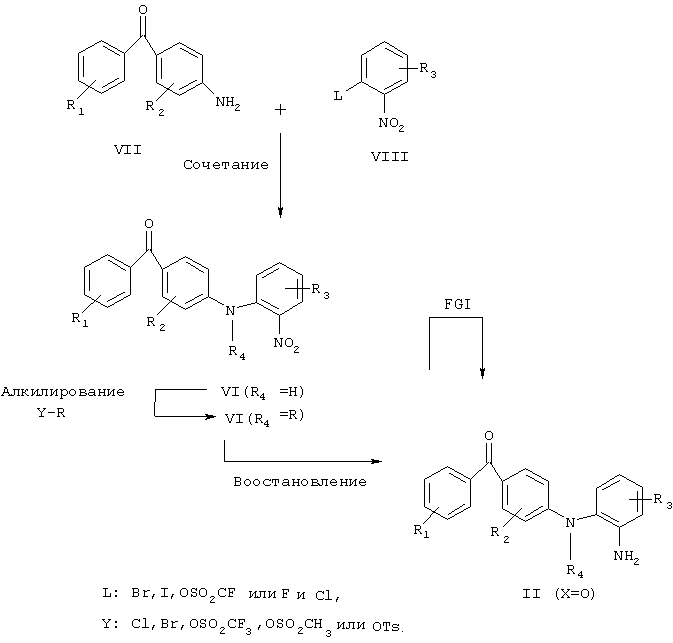
FGI: взаимопревращение функциональных групп и
R1, R2, R3, R4 имеют вышеуказанные значения.
Реакцию сочетания проводят, используя любой из методов получения дифениламинов, известных специалисту в области органического синтеза. Предпочтительным методом является метод нуклеофильного ароматического замещения, который включает сочетание амина с арилфторидом или арилхлоридом в присутствии основания в подходящем растворителе. Было подтверждено, что наилучшими основаниями для осуществления этого способа являются калий-трет-бутоксид (KOt-Bu), натрий-трет-бутоксид (NaOt-Bu), гидрид натрия (NaH) и гидрид калия (КН), но также могут быть использованы и другие основания.
Реакцию обычно проводят при комнатной температуре (20-25°С) в биполярных апротонных растворителях, например, таких как диметилсульфоксид (DMSO), диметилформамид (DMF) или N-метилпирролидон (NMP) в инертной атмосфере, такой как аргон или азот.
Альтернативно реакция сочетания может быть осуществлена методом катализируемого палладием аминирования, который включает взаимодействие амина с арилгалогенидом (иодидом, бромидом, трифторметансульфонатом или, в некоторых случаях, хлоридом) в присутствии основания, подходящего источника Pd и подходящего фосфинового лиганда в инертном растворителе.
Соединение палладия, используемое при осуществлении способа, особенно не ограничено, конкретные примеры представляют собой ацетат палладия(II), хлорид палладия(II), бромид палладия(II), дихлоробис(трифенилфосфин)палладий(II), тетракис(трифенилфосфин)палладий(0), трис(дибензилиденацетон)дипалладий(0). Предпочтительные лиганды включают, но не ограничиваются этим, рацемический или нерацемический 2,2’-бис(дифенилфосфино)-1,1’-бинафтил (здесь и далее обозначается как BINAP), три-о-толилфосфин, три-трет-бутилфосфин, 1,1’-бис(дифенилфосфино)ферроцен, бис[(2-дифенилфосфино)фенил]простой эфир (DPEphos), 2-дициклoгeкcилфocфaнил-2’-диметиламинобифенил, 2-(ди-трет-бутилфосфино)бифенил и 9,9-диметил-4,6-бис(дифенилфосфино)ксантен (Xantphos). Количество палладия и лиганда, используемых при осуществлении способа, обычно находится в интервале от 0,1 до 10 мол.% по отношению к количеству используемого ароматического галогенида (или трифторметансульфоната). Было показано, что наилучшими основаниями для использования в этом способе являются трет-бутоксид натрия (NaOt-Bu) и карбонат цезия (Сs2СО3), но также могут быть использованы и другие основания. Реакцию обычно проводят при повышенной температуре (80-120°С) в инертных растворителях, например, в таких как 1,4-диоксан, толуол, бензол и тетрагидрофуран, в инертной атмосфере, такой как аргон или азот.
Соединения согласно настоящему изобретению, в которых R4 не является водородом, могут быть получены способом, включающим взаимодействие амина формулы VI (R4 - H) с алкилирующим агентом, как показано на схеме 2, где R1, R2, R3, R4, являются такими, как определено в общей формуле I, с тем исключением, что любые заместители или функциональные группы, которые потенциально реакционноспособны в реакции сочетания, могут быть защищены перед проведением реакции сочетания и впоследствии защита может быть удалена.
Обычные алкилирующие агенты формулы R-Y включают, но не ограничиваются этим, иодиды (Y - I), бромиды (Y - Br), хлориды (Y - Cl) и сульфонаты (Y - OSO2R’, где R’ представляет собой метил, трифторметил или 4-метилфенил).
Соединения согласно настоящему изобретению в некоторых случаях могут быть получены простым взаимопревращением функциональных групп (FGI), означающим обычный способ, известный специалистам в области органического синтеза, где функциональная группа в соединении общей формулы I (или в любом другом описанном здесь промежуточном соединении) трансформируется в другую функциональную группу за одну или более стадий синтеза, что приводит к получению нового соединения общей формулы I. Примерами таких способов являются, но не ограничиваются этим, гидролиз сложного эфира в щелочных условиях с образованием кислоты; снятие защиты посредством простого метилового эфира с получением фенола при обработке, например, трибромидом бора (ВВr3); каталитическое гидрирование олефина с получением насыщенного углеводорода.
Соединения согласно настоящему изобретению, в которых С=Х представляет собой -(CS)-, могут быть получены из соединений согласно настоящему изобретению (или любого другого описанного здесь промежуточного соединения), в которых С=Х представляет собой -(СО)-, посредством способа, в котором используют тиокарбонилирующий агент, например, такой как пентасульфид фосфора (Р4S10) или реагент Лоуссона (2,4-бис(4-метоксифенил)-1,3,2,4-дитиафосфетан-2,4-дисульфид) или подобные реагенты.
Схема 3
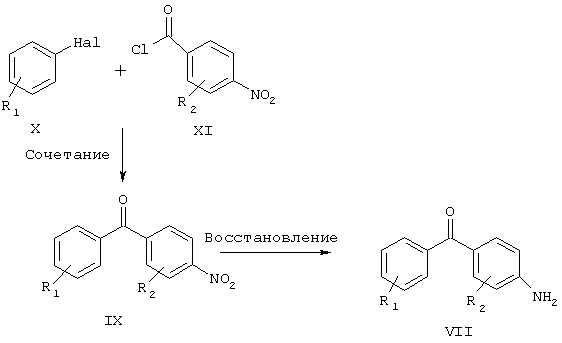
Наl - Br, I;
R1 и R2 имеют указанные выше значения.
Соединения согласно настоящему изобретению, соответствующие общей формуле VII, могут быть получены несколькими способами, известными специалистам в области органического синтеза. Одна из полезных последовательностей реакций для получения продукта общей формулы Х приведена на схеме 3. Ключевая стадия включает взаимодействие бромида (или иодида) общей формулы Х с хлорангидридом кислоты общей формулы XI с образованием бензофенона общей формулы IX. Это соединение IX может затем быть восстановлено до соответствующего амина общей формулы VII обработкой обычным восстанавливающим агентом. Примеры таких восстанавливающих агентов включают, но не ограничиваются этим, дигидрат хлорида двухвалентного олова; водород, формиат аммония, гидразингидрат и каталитическое количество палладия на углероде. Реакция сочетания осуществляется путем превращения бромида (X) в реакционноспособное металлоорганическое промежуточное соединение, например, обработкой бутиллитием, позволяющей получить производное лития, или обработкой магнием, позволяющей получить производное магния. Реакционная способность этого производного затем регулируется путем трансметаллирования, например, цинком, обработкой ZnCl2, ZnBr2 или ZnI2. Это цинкорганическое соединение затем взаимодействует с хлорангидридом общей формулы XI в присутствии комплекса палладия(0), используемого в каталитических количествах. Примеры такого катализатора включают, но не ограничиваются этим, тетракис(трифенилфосфин)палладий(0), тетракис(трифениларсин)палладий(0), дихлоробис(трифенилфосфин)палладий(II) или бензилхлоробис(трифенилфосфин)палладий(II).
В некоторых случаях может быть выгоднее видоизменить последовательность реакций в способах, описанных выше. Описанные стадии способа не рассматриваются как ограничивающие получение соединения общей формулы I, и изменение последовательности реакций является очевидной альтернативой для специалиста в области органического синтеза.
Данные соединения предполагается использовать в фармацевтических композициях, которые пригодны для лечения указанных выше заболеваний.
Необходимое для терапевтического действия количество соединения формулы I (здесь и далее обозначается как активный ингредиент) будет, безусловно, варьироваться в зависимости от конкретного соединения, способа введения и млекопитающего, подвергаемого лечению. Подходящая доза соединения формулы I для систематического лечения составляет от 0,1 до 200 мг/кг массы тела, наиболее предпочтительная доза составляет от 0,2 до 50 мг/кг массы тела млекопитающего, при введении один раз или более в день.
Хотя возможно вводить один активный ингредиент в виде собственно химического продукта, но предпочтительно использовать активный ингредиент в виде фармацевтической композиции. Удобно, когда количество активного ингредиента составляет от 0,1 до 100% по массе композиции. Удобно, когда дозированная форма композиции содержит от 0,07 мг до 1 г активного ингредиента. Для местного введения количество активного ингредиента предпочтительно составляет от 1 до 20% от массы композиции, но активный ингредиент может составлять до 50% (маc./маc.). Композиции, подходящие для назального или трансбуккального введения, могут включать от 0,1 до 20% (маc./маc.), например примерно 2% (маc./маc.), активного ингредиента.
Под термином “дозированная форма” понимается единичная, т.е. разовая доза, которая может быть введена пациенту, с которой удобно обращаться и которая может быть удобно упакована, оставаясь физически и химически стабильной разовой дозированной формой, включающей активное вещество как таковое или его смесь с твердыми или жидкими фармацевтическими разбавителями или носителями.
Композиции в соответствии с настоящим изобретением, предназначенные как для использования в ветеринарии, так и для использования при лечении человека, включают активный ингредиент в сочетании с фармацевтически приемлемым носителем и необязательно другой (другие) терапевтические ингредиенты. Носитель (носители) должны быть “приемлемыми” в том смысле, что должны быть совместимыми с другими ингредиентами композиции и не наносить вреда реципиенту.
Композиции включают такие компоненты в форме, пригодной для перорального, офтальмологического, ректального, парентерального (включая подкожное, внутримышечное и внутривенное введение), трансдермального, внутрисуставного, местного, назального или трансбуккального введения.
Композиции могут быть удобно представлены в виде разовой дозированной формы и могут быть приготовлены любыми способами, известными в области фармации. Все способы включают стадию связывания активного ингредиента с носителем, который состоит из одного или более дополнительных ингредиентов. Как правило, композиции получают путем однородного и тщательного перемешивания активного ингредиента с жидким носителем или тонко диспергированным твердым носителем, или с тем и другим, и последующего, если необходимо, придания формы для получения необходимой композиции.
Композиции в соответствии с настоящим изобретением, пригодные для перорального введения, могут находиться в форме дискретных разовых доз, таких как капсулы, саше, таблетки или пастилки, каждая из которых содержит заранее установленное количество активного ингредиента; в форме порошка или гранул; в форме раствора или суспензии в водной жидкости или в неводной жидкости или в форме эмульсии типа “масло в воде” или “вода в масле”. Активный ингредиент может также быть введен в форме шариков, электуария или пасты.
Композиции для ректального введения могут быть введены в форме суппозитория, включающего активный ингредиент и носитель, например, такой как масло какао, или в форме клизмы.
Композиции, подходящие для парентерального введения, удобно включают стерильное масло или водную композицию активного ингредиента, которая, предпочтительно изотонична крови реципиента.
Композиции, подходящие для внутрисуставного введения, могут быть в форме стерильной водной композиции активного ингредиента, который может находиться в микрокристаллической форме, например в форме водной суспензии микрокристаллического вещества. Липосомные препараты или системы биоразлагаемого полимера также могут быть использованы для введения активного ингредиента как в сустав, так и для офтальмологического введения.
Композиции, подходящие для местного применения, включая препараты для лечения глаз, включают жидкие или полужидкие препараты, такие как линименты, лосьоны, гели, аппликации, эмульсии типа “масло в воде” или “вода в масле”, например, такие как кремы, мази или пасты, или растворы или суспензии, например, такие как капли.
Композиции, подходящие для введения в нос или во внутриротовую полость, включают порошки, самораспыляющиеся и распыляемые композиции, например, такие как аэрозоли и распыляемые препараты.
Композиции могут дополнительно содержать другие терапевтически активные компоненты, применяемые для лечения вышеуказанных состояний, например глюкокортикоиды, витамины D, антигистаминные средства, антагонисты фактора активации тромбоцитов (PAF), антихолинергические средства, метилксантины, β-адренергические средства, салицилаты, индометацин, флуфенамат, напроксен, тимегадин, соли золота, пеницилламин, средства, понижающие содержание холестерина в сыворотке, ретиноиды, соли цинка и салицилазосульфапиридин (салазопирин).
Новые соединения в соответствии с изобретением представляют ценность для лечения человека и для ветеринарной практики как систематические и местные терапевтические средства для лечения и профилактики заболеваний. Новые соединения обладают свойствами против акне и, таким образом, противовоспалительными и цитокинрегулирующим действием, возможно, вследствие ингибирования МАР-киназы, и пригодны для лечения и профилактики астмы, аллергии, артритов, включая ревматоидные артриты и спондилоартриты, подагры, атеросклероза, хронического воспалительного заболевания кишечника (болезнь Крона), пролиферативных и воспалительных заболеваний кожи, например, таких как псориаз и аллергический дерматит, увеита (воспаление слизистой оболочки глаз), септического шока, СПИДа и остеопороза.
Далее изобретение будет проиллюстрировано следующими имеющими неограничивающий характер общими методиками, лекарственными средствами и примерами.
Общие методики, лекарственные средства и примеры.
Все примеры соединений формулы I приведены в таблице 2.
Все значения температуры плавления приведены без поправок. Для спектров ядерного магнитного резонанса 1H и 13С (ЯМР) (300 МГц) приведена величина химического сдвига (δ, в м.д.), если не указано иное, для раствора в дейтерированном хлороформе и в гексадейтеродиметилсульфоксиде относительно внутреннего стандарта тетраметилсилана (δ 0,00) или хлороформа (1Н ЯМР δ 7,25, 13С ЯМР δ 76,81). Значения для мультиплета (м), либо определенного дуплет (д), триплет (т), квартет (кв), либо нет, даются приблизительно в средней точке, если не указан интервал (с - синглет, шир - широкий). Используемые органические растворители являются безводными. Термин “хроматография” относится к колоночной хроматографии с использованием флэш-методики, хроматографирование осуществляется на силикагеле.
В описании используются следующие сокращения:
АgОАс Ацетат серебра
Ацетон – d6 Гексадейтероацетон
ВТС Бис(трихлорметил)карбонат
СDСl3 Дейтерохлороформ
DMF N,N-Диметилформамид
DMSO – d6 Гексадейтеродиметилсульфоксид
Et3N Триэтиламин
EtOAc Этилацетат
Et2O Диэтиловый эфир
НМРА Гексаметилфосфортриамид
Me Метил
NMM N-Метилморфолин
THF Тетрагидрофуран
TLC Тонкослойная хроматография
Используемая в таблице 2 нумерация соответствует нумерации в приведенной ниже формуле
Общая методика 1
Сочетание соединений общей формулы II с соединениями общей формулы III, приводящее к образованию соединения общей формулы I (Q=O) или его защищенного производного.
К охлажденному (0°С) раствору амина (1,0 ммоль) общей формулы II и N-этилдиизопропиламина (1,0 ммоль) в СН2Сl2 (10 мл) медленно добавляют хлороформиат (1,2 ммоль) общей формулы III. Перемешивание продолжают при комнатной температуре в течение 24 часов или до тех пор, пока, по данным ТСХ, не израсходуется исходное вещество. Реакционную смесь концентрируют в вакууме, получая при этом неочищенный продукт. Неочищенный продукт очищают хроматографией и/или перекристаллизовывают, получая при этом указанное в заголовке соединение.
Общая методика 2
Взаимодействие соединений общей формулы II с соединениями общей формулы IV (через соединение общей формулы III, с получением соединения общей формулы I (Q=O) или его защищенного производного).
К перемешиваемому раствору спирта (1,0 ммоль) общей формулы IV в СН2Сl2 (3,0 мл) добавляют ВТС (0,40 ммоль) и пиридин (1,0 ммоль) в CH2Cl2 (3,0 мл) при 0°С. Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 2 часов. Растворитель удаляют в вакууме, полученный остаток растворяют в EtOAc (10 мл) и перемешивают в течение 30 мин. Осадок отфильтровывают и удаляют растворитель в вакууме при 30°С, получая при этом неочищенный хлороформиат общей формулы III. Добавляют СН2Сl2 (5,0 мл) и охлаждают раствор до 0°С. Добавляют амин (0,50 ммоль) общей формулы II и К2СО3 (2,0 ммоль) и реакционную смесь перемешивают в течение 24 часов при комнатной температуре. Реакционную смесь выливают в воду и экстрагируют, используя СН2Сl2 или Et2O. Органические экстракты промывают раствором соли, сушат (Na2SO4), фильтруют и концентрируют в вакууме, получая при этом неочищенный продукт. Неочищенный продукт очищают хроматографией, получая при этом указанное в заголовке соединение.
Подготовительный пример 1
Метил-1-(4-нитрофенилоксикарбонил)окси)метилсукцинат (соединение 201)
Раствор иодметил-4-нитрофенилкарбоната (3,2 г, 10 ммоль) (J. Org. Chem., 1997, 62, 1356) в дихлорметане (50 мл) добавляют к перемешиваемой суспензии метилсукцината серебра (2,4 г, 10 ммоль) в дихлорметане (50 мл). Перемешивание продолжают в течение 24 ч при комнатной температуре. После фильтрования и концентрирования в вакууме получают неочищенный продукт. Дополнительную очистку осуществляют хроматографией, используя в качестве элюента смесь Et2O/гексан 4:1, получая при этом продукт в виде масла.
Подготовительный пример 2
Метил-1-(4-нитрофенилоксикарбонил)окси)этилсукцинат
(соединение 202)
Требуемое соединение получают в соответствии с методикой, описанной в подготовительном примере 1, но заменяя иодметил-4-нитрофенилкарбонат на 1-иодэтил-4-нитрофенилкарбонат.
Подготовительный пример 3
Бензил-1-(4-нитрофенилоксикарбонил)окси)метилсукцинат
(соединение 203)
Требуемое соединение получают в соответствии с методикой, описанной в подготовительном примере 1, но заменяя метилсукцинат серебра на бензилсукцинат серебра.
Подготовительный пример 4
1-(3-(Бензилоксикарбонил)пропаноилокси)метил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 204)
Требуемое соединение получают в соответствии с методикой, описанной в примере 21, но заменяя метил-1-(4-нитрофенилоксикарбонил)окси)метилсукцинат (соединение 201) на бензил-1-(4-нитрофенилоксикарбонил)окси)метилсукцинат (соединение 203). Очистку осуществляют хроматографией, используя в качестве элюента смесь Еt2O/гексан 4:1.
Подготовительный пример 5
Бензил-1-(4-нитрофенилоксикарбонил)окси)этилсукцинат (соединение 205)
Требуемое соединение получают в соответствии с методикой, описанной в подготовительном примере 1, но заменяя метилсукцинат серебра и иодметил-4-нитрофенилкарбонат на бензилсукцинат серебра и 1-иодэтил-4-нитрофенилкарбонат соответственно. Очистку осуществляют хроматографией, используя в качестве элюента смесь ЕtOАс/гексан 1:4.
Подготовительный пример 6
1-(3-(Бензилоксикарбонил)пропаноилокси)этил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 206)
Требуемое соединение получают в соответствии с методикой, описанной в примере 21, но заменяя метил-1-(4-нитрофенилоксикарбонил)окси)метилсукцинат (соединение 201) на бензил-1-(4-нитрофенилоксикарбонил)окси)этилсукцинат (соединение 205). Очистку осуществляют хроматографией, используя в качестве элюента смесь Et2O/гексан 4:1.
Подготовительный пример 7
Гексаноилоксиметил-4-нитрофенилкарбонат (соединение 207)
Требуемое соединение получают в соответствии с методикой, описанной в подготовительном примере 1, но заменяя метилсукцинат серебра на гексаноат серебра. Очистку осуществляют хроматографией, используя в качестве элюента смесь метанол/ ЕtO Ас/гексан 5:10:40.
Подготовительный пример 8
1-(Этилтио(карбонил)окси)метилметилсукцинат (соединение 208)
Метилсукцинат серебра (2,5 г, 10,5 ммоль) добавляют к перемешиваемому раствору О-иодметил-S-этилтиокарбоната (1,25 г, 5,1 ммоль) (Synthesis, 1990, 1159) в дихлорметане (50 мл). Перемешивание продолжают в течение 24 часов при комнатной температуре. После фильтрования и концентрирования в вакууме получают неочищенный продукт. Дополнительную очистку осуществляют хроматографией, используя в качестве элюента смесь Еt2O/гексан 1:2, получая при этом продукт в виде масла.
Подготовительный пример 9
О-(3-Метоксикарбонилпропаноилоксиметил)карбонохлоридат (соединение 209)
Дважды перегнанный сульфурилхлорид (0,81 мл, 10 ммоль) добавляют к 1-(этилтио(карбонил)окси)метилметилсукцинату (соединение 208) (2,5 г, 10 ммоль) при 0-5°С при перемешивании в течение 30 мин с последующим перемешиванием в течение двух часов. Реакционную смесь концентрируют в вакууме в течение 18 ч, получая при этом соединение в виде масла.
Подготовительный пример 10
Бензил-1-(этилтио(карбонил)окси)метилсукцинат (соединение 210)
Требуемое соединение получают в соответствии с методикой, описанной в подготовительном примере 8, но заменяя метилсукцинат серебра на бензилсукцинат серебра.
Подготовительный пример 11
О-(3-Бензилоксикарбонилпропаноилоксиметил)карбонохлоридат (соединение 211)
Требуемое соединение получают в соответствии с методикой, описанной в подготовительном примере 9, но заменяя 1-(этилтио(карбонил)окси)метилметилсукцинат (соединение 208) на бензил-1-(этилтио(карбонил)окси)метилсукцинат (соединение 210).
Подготовительный пример 12
1-(3-Бензилоксикарбонил-пропаноилокси)метил-N-[5-бромо-2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 212)
Требуемое соединение получают в соответствии с методикой, описанной в примере 26, но заменяя О-(3-метоксикарбонил-пропаноилоксиметил)карбонохлорид (соединение 209) на О-(3-(бензилоксикарбонилпропаноилоксиметил)карбонохлорид (со единение 211).
Пример 1
Гексил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 101)
Общая методика 2
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2’-метилбензофенон.
Исходное соединение VI: 1-гексанол.
Очистка: хроматография с использованием в качестве элюента CH2Cl2.
13С ЯМР (CDCl3): δ 196.9, 154.5, 149.4, 139.3, 138.0, 135.2, 133.7, 133.5, 131.4, 131.0, 130.7, 129.8, 129.0, 126.9, 126.0, 125.5, 125.0, 121.9, 116.3, 112.5, 66.1, 31.6, 29.0, 25.6, 22.7, 20.6, 14.2.
Пример 2
6-Хлоргексил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 102)
Общая методика 2
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2’-метилбензофенон.
Исходное соединение VI: 6-хлор-1-гексанол.
Очистка: хроматография с использованием в качестве элюента смеси EtOAc/пентан 1:4.
13С ЯМР (CDCl3): δ 196.6, 154.2, 149.2, 139.1, 137.9, 135.0, 133.5, 133.3, 131.3, 130.9, 130.5, 129.7, 129.0, 126.8, 125.9, 125.4, 124.8, 121.7, 116.1, 112.4, 65.6, 44.9, 32.4, 28.7, 26.5, 25.2, 20.4.
Пример 3
Фенил-N-[2-(4-бензоилфениламино)фенил]карбамат (соединение 103)
Общая методика 1
Исходное соединение II: 4-(2-аминофениламино)бензофенон
Исходное соединение III: фенилхлорформиат
Очистка: перекристаллизация из 2-пропанола. Тпл 145-146°С.
1Н ЯМР (ацетон-d6): δ 8.60 (шир с, 1Н), 7.89 (д, 1Н), 7.84 (м, 2Н), 7.70 (м, 4Н), 7.51 (м, 2Н), 7.40 (м, 3Н), 7.10-7.30 (м, 5Н), 6.91 (д, 2Н).
Пример 4
2-Азидоэтил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 104)
Общая методика 2
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2’-метилбензофенон.
Исходное соединение VI: 2-азидо-1-этанол.
Очистка: хроматография с использованием в качестве элюента смеси EtOAc/пентан 1:3.
13С ЯМР (СDСl3): δ 196.6, 153.4, 149.0, 139.0, 138.0, 135.0, 133.4, 133.0, 131.3, 130.9, 130.6, 129.8, 129.4, 127.0, 126.0, 125.4, 125.2, 121.8, 116.1, 112.6, 64.0, 50.0, 20.5.
Пример 5
Фенил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 105)
Общая методика 1
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2’-метилбензофенон.
Исходное соединение III: фенилхлорформиат.
Очистка: перекристаллизация из смеси толуола с циклогексаном. Тпл 99-108°С.
1H ЯМР (СDСl3): δ 7.93 (д, 1Н), 7.10-7.40 (м, 14Н), 6.76 (д, 1Н), 6.61 (дд, 1Н), 5.93 (с, 1Н), 2.44 (с, 3Н).
Пример 6
1-Хлорметил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 106)
К охлажденному (0°С) раствору хлорметилхлорформиата (4,27 ммоль) в EtOAc (20 мл) при перемешивании медленно добавляют раствор 4-(2-аминофениламино)-2-хлор-2’-метилбензофенона (4,0 ммоль) и триэтиламина (4,45 ммоль) в EtOAc (20 мл). Перемешивание продолжают при комнатной температуре в течение 4 час. Реакционную смесь промывают водой и 0,5 М раствором винной кислоты, сушат (Na2SO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают хроматографией, используя в качестве элюента смесь Et2O/гексан 4:1, получая при этом указанное в заглавии соединение в виде белых кристаллов. Тпл 152-153°С.
1H ЯМР (CDCl3): δ 7.93 (д, 1Н), 7.10-7.40 (м, 9Н), 6.72 (д, 1Н), 6.57 (дд, 1Н), 5.83 (с, 1Н), 5.80 (с, 2Н), 2.43 (с, 3Н).
Пример 7
Циклопентил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 107)
Общая методика 1
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2’-метилбензофенон.
Исходное соединение III: циклопентилхлорформиат.
Очистка: хроматография с использованием в качестве элюента смеси EtOAc/пентан 1:4 с последующей перекристаллизацией из Et2O. Тпл 115-117°С.
1H ЯМР (ДМСО-d6): δ 8.65 (с, 1Н), 8.30 (с, 1H), 7.60 (д, 1Н), 7.42 (м, 1H), 7.10-7.40 (м, 7Н), 6.76 (д, 1H), 6.69 (дд, 1Н), 5.04 (м, 1H), 2.29 (с, 3Н), 1.81 (м, 2Н), 1.56 (м, 6Н).
Пример 8
Циклогексил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 108)
Общая методика 1
Исходное соединение II: 4-(2-аминофениламино)-2-хлор-2’-метилбензофенон.
Исходное соединение III: циклогексилхлорформиат.
Очистка: перекристаллизация из Et2O и затем растирание с водой. Тпл 60-70°С.
1H ЯМР (ДМСО-d6): δ 8.67 (с, 1H), 8.32 (с, 1H), 7.60 (д, 1H), 7.41 (м, 1H), 7.10-7.35 (м, 7Н), 6.75 (д, 1H), 6.68 (дд, 1H), 4.57 (м, 1H), 2.29 (с, 3Н), 1.10-1.90 (м, 10Н).
Пример 9
1-Ацетоксиметил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 109)
К перемешиваемому раствору соединения 106 (1,0 ммоль) в ледяной уксусной кислоте (20 мл) в один прием добавляют АgОАс (3,0 ммоль). Реакционную смесь перемешивают в течение 72 ч при комнатной температуре. Затем реакционную смесь фильтруют через декалит, после чего выливают в воду и экстрагируют, используя Et2O. Органические экстракты промывают насыщенным раствором NаНСО3, раствором соли, сушат (Na2SO4), фильтруют и концентрируют в вакууме с получением неочищенного продукта. Неочищенный продукт очищают хроматографией, используя в качестве элюента смесь Еt2O/гексан 4:1, и получают указанное в заглавии соединение в виде белых кристаллов. Тпл 145-148°С.
1H ЯМР (СDСl3): δ 7.93 (д, 1Н), 7.10-7.40 (м, 9Н), 6.70 (д, 1Н), 6.58 (дд, 1Н), 5.85 (с, 1Н), 5.80 (с, 2Н), 2.44 (с, 3.Н), 2.12 (с, 3Н).
Пример 10
Циклопентил-N-[5-бром-2-[3-хлор-4-(2,3-диметилбензоил)фенил-амино]фенил]карбамат (соединение 110)
Общая методика 1
Исходное соединение II: 4-(2-амино-4-бромфениламино)-2-хлор-2’,3’-диметилбензофенон.
Исходное соединение III: циклопентилхлорформиат.
Очистка: перекристаллизация из Et2O.
13С ЯМР (СDСl3): δ 197.2, 153.6, 149.1, 140.2, 137.9, 135.6, 135.4, 135.2, 134.0, 132.2, 129.1, 128.8, 127.4, 127.3, 126.6, 125.0, 124.0, 119.9, 116.3, 112.4, 79.0, 32.7, 23.6, 20.2, 16.5.
Пример 11
Циклопентил-N-[5-бром-2-[3-хлор-4-(4-н-бутил-2-метилбензоил)фениламино]фенил]карбамат (соединение 111)
Общая методика 1
Исходное соединение II: 4-(2-амино-4-бромфениламино)-4’-н-бутил-2-хлор-2’-метилбензофенон.
Исходное соединение III: циклопентилхлорформиат.
Очистка: перекристаллизация из Et2O.
13С ЯМР (CDCl3): δ 196.6, 153.6, 148.5, 146.8, 138.7, 135.9, 135.2, 134.6, 132.9, 131.7, 130.7, 130.1, 129.0, 127.3, 125.4, 123.9, 119.8, 116.2, 112.6, 78.9, 35.6, 33.3, 32.7, 23.7, 22.4, 20.8, 13.9.
Пример 12
Циклопентил-N-[5-бром-2-[3-хлор-4-(4-хлор-2-метилбензоил)-фениламино]фенил]карбамат (соединение 112)
Общая методика 1
Исходное соединение II: 4-(2-амино-4-бромфениламино)-2,4’-дихлор-2’-метилбензофенон.
Исходное соединение III: циклопентилхлорформиат.
Очистка: перекристаллизация из Et2O.
13С ЯМР (CDCl3): δ 195.5, 153.6, 149.1, 140.1, 137.3, 136.9, 135.1, 135.0, 133.3, 131.3, 131.1, 129.0, 128.9, 127.4, 127.3, 125.6, 124.1, 119.9, 116.1, 112.6, 79.0, 32.7, 23.7, 20.4.
Пример 13
Циклопентил-N-[5-бром-2-[3-фтор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 113)
Общая методика 1
Исходное соединение II: 4-(2-амино-4-бромфениламино)-2-фтор-2’-метилбензофенон.
Исходное соединение III: циклопентилхлорформиат.
Очистка: перекристаллизация из Et2O.
13С ЯМР (CDCl3): δ 194.5, 163.5, 153.6, 151.5, 140.2, 136.3, 135.1, 133.9, 130.9, 130.3, 128.7, 128.1, 127.5, 127.4, 125.3, 124.2, 120.0, 118.1, 110.3, 101.5, 79.0, 32.7, 23.6, 19.9.
Пример 14
Циклопентил-N-[5-бром-2-[3-хлор-4-(2,4,5-триметилбензоил)фениламино]фенил]карбамат (соединение 114)
Общая методика 1
Исходное соединение II: 4’-(2-амино-4-бромфениламино)-2’-хлор-2,4,5-триметилбензофенон.
Исходное соединение III: циклопентилхлорформиат.
Очистка: перекристаллизация из Et2O.
13С ЯМР (CDCl3): δ 196.7, 153.6, 148.6, 140.4, 136.1, 135.9, 135.2, 134.6, 133.5, 133.0, 132.9, 131.6, 130.1, 129.1, 127.3, 127.2, 123.9, 119.7, 116.2, 112.5, 78.9, 32.7, 23.7, 20.1, 19.7, 19.1.
Пример 15
Циклопентил-N-[5-бром-2-[3-хлор-4-(4-фтор-2-метилбензоил)фениламино]фенил]карбамат (соединение 115)
Общая методика 1
Исходное соединение II: 4-(2-амино-4-бромфениламино)-2-хлор-4’-фтор-2’-метилбензофенон.
Исходное соединение III: циклопентилхлорформиат.
Очистка: перекристаллизация из Et2O.
13С ЯМР (CDCl3): δ 195.4, 164.0, 153.6, 148.9, 141.9, 135.1, 134.9, 134.8, 133.0, 132.6, 129.6, 129.0, 127.4, 127.3, 124.1, 119.9, 118.3, 116.1, 112.7, 112.4, 79.0, 32.7, 23.7, 20.8.
Пример 16
Циклопентил-N-[5-бром-2-[3-хлор-4-(2,5-диметилбензоил)фениламино]фенил]карбамат (соединение 116)
Общая методика 1
Исходное соединение II: 4-(2-амино-4-бромфениламино)-2-хлор-2’,5’-диметилбензофенон.
Исходное соединение III: циклопентилхлорформиат.
Очистка: перекристаллизация из Et2O.
13С ЯМР (СDСl3): δ 196.9, 153.6, 148.8, 138.8, 135.1, 134.9, 134.8, 133.4, 131.8, 131.2, 130.2, 129.5, 129.0, 127.3, 124.0, 119.9, 116.3, 112.5, 79.0, 32.7, 23.7, 20.8, 20.0.
Пример 17
Циклопентил-N-[5-бром-2-[3-хлор-4-(3-хлор-2-метилбензоил)фениламино]фенил]карбамат (соединение 117)
Общая методика 1
Исходное соединение II: 4-(2-амино-4-бромфениламино)-2,3’-дихлор-2’-метилбензофенон.
Исходное соединение III: циклопентилхлорформиат.
Очистка: перекристаллизация из Et2O.
13С ЯМР (CDCl3): δ 195.4, 153.6, 149.5, 141.9, 135.9, 135.7, 135.1, 135.0, 134.2, 131.3, 128.7, 128.2, 127.5, 127.4, 126.9, 126.4, 124.2, 120.0, 116.3, 112.5, 79.1, 32.7, 23.6, 17.1.
Пример 18
Циклопентил-N-[5-бром-2-[3-фтор-4-(4-метокси-2-метилбензоил)фениламино]фенил]карбамат (соединение 118)
Общая методика 1
Исходное соединение II: 4-(2-амино-4-бромфениламино)-2-фтор-4’-метокси-2’-метилбензофенон.
Исходное соединение III: циклопентилхлорформиат.
Очистка: перекристаллизация из Et2O.
13С ЯМР (CDCl3): δ 193.4, 162.9, 161.4, 153.7, 151.1, 140.4, 135.3, 133.4, 132.2, 132.0, 129.0, 127.5, 127.1, 123.9, 119.7, 118.8, 116.7, 110.4, 101.5, 78.8, 55.3, 32.7, 23.7, 20.8.
Пример 19
Циклопентил-N-[5-бром-2-[3-хлор-4-(4-этокси-2-метилбензоил)-фениламино]фенил]карбамат (соединение 119)
Общая методика 1
Исходное соединение II: 4-(2-амино-4-бромфениламино)-2-хлор-4’-этокси-2’-метилбензофенон.
Исходное соединение III: циклопентилхлорформиат.
Очистка: перекристаллизация из Et2O.
13С ЯМР (СDСl3): δ 195.7, 161.5, 153.6, 148.2, 142.1, 135.2, 134.1, 133.8, 132.3, 130.7, 130.5, 129.2, 127.2, 123.8, 119.7, 117.6, 116.0, 112.7, 110.9, 78.9, 63.6, 32.7, 23.7, 21.5, 14.7.
Пример 20
Циклопентил-N-[5-бром-2-[3-этокси-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 120)
Общая методика 1
Исходное соединение II: 4-(2-амино-4-бромфениламино)-2-этокси-2’-метилбензофенон.
Исходное соединение III: циклопентилхлорформиат.
Очистка: перекристаллизация из Et2O.
13С ЯМР (CDCl3): δ 197.1, 160.7, 153.6, 150.6, 142.4, 135.8, 135.2, 133.5, 130.4, 129.3, 127.5, 127.4, 127.1, 125.0, 123.8, 120.7, 119.7, 107.2, 98.3, 78.9, 63.8, 32.7, 23.6, 19.9, 13.8.
Пример 21
1-(3-(Метоксикарбонил)пропаноилокси)метил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 121)
К раствору 4-(2-аминофениламино)-2-хлор-2’-метилбензофенона (2,2 г, 6,5 ммоль) и метил-1-(4-нитрофенилоксикарбонил)окси)метилсукцината (соединение 201) (3,3 г, 10 ммоль) добавляют 3,4-дигидо-3-гидрокси-4-оксо-1,2,3-бензотриазин (1,7 г, 10 ммоль), а затем N-этилдиизопропиламин (1,8 мл, 10,5 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 20 ч реакционную смесь выливают на смесь лед/вода и экстрагируют диэтиловым эфиром. Эфирные экстракты промывают насыщенным раствором бикарбоната натрия, водой и солевым раствором и сушат над безводным сульфатом натрия. После фильтрации и концентрирования в вакууме получают неочищенный продукт. Этот продукт далее очищают хроматографией, используя в качестве элюента смесь метанол/ЕtOАс/гексан 5:10:40.
13С ЯМР (CDCl3): δ 196.6, 172.6, 171.4, 152.1, 149.0, 139.0, 138.0, 135.0, 133.4, 132.7, 131.3, 131.0, 129.8, 129.5, 127.0, 126.0, 125.5, 125.4, 121.7, 116.2, 112.6, 80.1, 52.0, 29.0, 28.6, 20.5.
Пример 22
1-(3-(Метоксикарбонил)пропаноилокси)этил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 122)
Требуемое соединение получают в соответствии с методикой, описанной в примере 21, но заменяя метил-1-(4-нитрофенилоксикарбонил)окси)метилсукцинат (соединение 201) на метил-1-(4-нитрофенилоксикарбонил)окси)этилсукцинат (соединение 202). Очистку осуществляют хроматографией, используя в качестве элюента смесь Еt2O/гексан 4:1.
1H ЯМР (СDСl3): δ 7.82 (д, 1Н), 7.42 (м, 8Н), 6.98 (с, 1Н), 6.93 (кв, 1Н), 6.79 (д, 1H), 6.65 (дд, 1Н), 6.07 (с, 1Н), 3.64 (с, 3Н), 2.64 (м, 4Н), 2.44 (с, 3Н), 1.53 (д, 3Н).
Пример 23
1-(3-Карбоксипропаноилокси)метил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 123)
1-(3-(Бензилоксикарбонил)пропаноилокси)метил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 204) (2,2 г, 3,6 ммоль) растворяют в ЕtОАс (500 мл), добавляют 10% Pd на углероде (750 мг) и реакционную смесь гидрируют (1 атм) при энергичном встряхивании до тех пор, пока не израсходуется исходное вещество, что контролируют методом ТСХ. Реакционную смесь очищают хроматографией, используя смесь метанол/хлороформ 1:9, получая при этом указанное в заголовке соединение.
13С ЯМР (СDСl3): δ 197.0, 176.7, 171.4, 152.2, 149.1, 138.9, 138.0, 135.0, 133.4, 132.7, 131.3, 131.0, 129.9, 129.2, 127.0, 126.1, 125.4, 121.7, 116.1, 112.5, 80.0, 28.8, 28.5, 20.5.
Пример 24
1-(3-Карбоксипропаноилокси)этил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 124)
Требуемое соединение получают в соответствии с методикой, описанной в примере 23, но заменяя 1-(3-(бензилоксикарбонил)пропаноилокси)метил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 204) на 1-(3-(бензилоксикарбонил)пропаноилокси)этил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 206). Очистку осуществляют хроматографией, используя в качестве элюента смесь Et2O/гексан 4:1.
1H ЯМР (CDCl3): δ 7.82 (д, 1Н), 7.43-7.00 (м, 9Н), 6.91 (кв, 1Н), 6.76 (д, 1H), 6.62 (дд, 1Н), 6.12 (с, 1Н), 2.62 (с, 4Н), 2.44 (с, 3Н), 1.50 (д, 3Н).
Пример 25
1-(Гексаноилокси)метил-N-[2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 125)
К раствору 4-(2-аминофениламино)-2-хлор-2’-метилбензофенона (305 мг, 1,0 ммоль) и гексаноилоксиметил-4-нитрофенилкарбоната (соединение 207) (3,3 г, 10 ммоль) в DMF (50 мл) добавляют 1-гидроксибензотриазол (270 мг, 2,0 ммоль), а затем N-этилдиизопропиламин (1,8 мл, 10,5 ммоль). Реакционную смесь перемешивают при комнатной температуре. Через 72 ч реакционную смесь выливают в смесь воды со льдом и экстрагируют диэтиловым эфиром. Эфирные экстракты промывают насыщенным раствором карбоната натрия, водой, раствором соли и сушат над безводным сульфатом натрия. После фильтрации и концентрирования в вакууме получают неочищенный продукт. Затем его очищают хроматографией, используя в качестве элюента смесь Et2O/гeкcaн 2:1.
1H ЯМР (СDСl3): δ 7.91 (д, 1Н), 7.46-7.05 (м, 9Н), 6.72 (д, 1Н), 6.60 (дд, 1Н), 5.88 (с, 1Н), 5.81 (с, 2Н), 2.44 (с, 3Н), 2.37 (т, 2Н), 1.64 (м, 2Н), 1.29 (м, 4Н), 0.87 (т, 3Н).
Пример 26
1-(3-(Метоксикарбонил)пропаноилокси)метил-N-[5-бром-2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 126)
Триметилхлорсилан (0,115 мл, 0,9 ммоль) по каплям добавляют к перемешиваемому раствору 4-(2-амино-5-бромфениламино)-2-хлор-2’-метилбензофенона (0,75 г, 1,8 ммоль) в диэтиловом эфире (10 мл). Через 30 мин добавляют в течение 15 мин раствор О-(3-метоксикарбонилпропаноилоксиметил)карбонохлоридата (соединение 209) (0,25 г, 1,1 ммоль) в диэтиловом эфире (5 мл) с последующим перемешиванием при комнатной температуре в течение 3 ч. После фильтрования и концентрирования в вакууме получают неочищенный продукт. Дальнейшую очистку проводят хроматографией, используя в качестве элюента смесь Et2О/гексан 2:1, и получают требуемое вещество в виде масла.
1H ЯМР (CDCl3): δ 8.17 (с, 1Н), 7.50-7.11 (м, 8Н), 6.72 (д, 1Н), 6.61 (дд, 1H), 5.85 (с, 1H), 5.82 (с, 2Н), 3.66 (с, 3Н), 2.67 (м, 4Н), 2.45 (с, 3Н).
Пример 27
1-(3-Карбоксипропаноилокси)метил-N-[5-бром-2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 127)
1-(3-(Бензилоксикарбонил)пропаноилоксиметил)-N-[5-бромо-2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 212) (580 мг, 0,9 ммоль) растворяют в тетрагидрофуране (50 мл), добавляют 10% Pd на углероде (200 мг) и гидрируют реакционную смесь (1 атм), энергично встряхивая, до тех пор пока не израсходуется исходное вещество, что контролируют методом ТСХ. Реакционную смесь очищают хроматографией, используя смесь метанол/хлороформ 1:9, с получением указанного в заглавии соединения.
1H ЯМР (СDСl3): δ 7.88 (с, 1Н), 7.46-7.05 (м, 8Н), 6.72 (д, 1Н), 6.59 (дд, 1Н), 6.20 (с, 1Н), 5.77 (с, 2Н), 2.61 (с, 4Н), 2.41 (с, 3Н).
Пример 28
1-Хлорметил-N-[5-бром-2-[3-хлор-4-(2-метилбензоил)фениламино]фенил]карбамат (соединение 128)
К охлажденному (0°С) раствору хлорметилхлорформиата (0,23 мл, 2,6 ммоль) в ацетонитриле (10 мл) при перемешивании медленно добавляют раствор 4-(2-амино-5-бромфениламино)-2-хлор-2’-метилбензофенона (1,04 г, 2,5 ммоль) и триэтиламина (0,37 мл, 2,6 ммоль) в ацетонитриле (10 мл). Перемешивание продолжают в течение 1,5 ч. Реакционную смесь фильтруют и неочищенный продукт растворяют в ЕtOАс. Органическую фазу промывают водой и раствором соли, сушат (Na2SO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают перекристаллизацией из ацетонитрила с получением указанного в заглавии соединения. Тпл 189-190°С.
1H ЯМР (ДМСО-d6): δ 9.60 (с, 1Н), 8.43 (с, 1Н), 7.81 (с, 1Н), 7.58-7.19 (м, 7Н), 6.83 (д, 1Н), 6.74 (дд, 1Н), 5.94 (с, 2Н), 2.50 (с, 3Н).
Пример 29
Таблетки, содержащие соединение 105, мг:
Соединение 105 (активное вещество) 50
Лактоза 125
Крахмал 12
Метилцеллюлоза 2
Натрийкарбоксиметилцеллюлоза 10
Стеарат магния 1
Активное вещество, лактозу и крахмал смешивают до гомогенного состояния в подходящем смесителе и увлажняют 5%-водным раствором метилцеллюлозы, 15 1/с. Смешение продолжают до тех пор, пока не образуются гранулы. Если необходимо, то сырые гранулы просеивают через походящее сито и высушивают в подходящей сушилке до содержания воды менее чем 1%, например, в псевдоожиженном слое или сушильном шкафу. Высушенные гранулы просеивают через сито (1 мм) и смешивают до гомогенного состояния с карбоксиметилцеллюлозой. Добавляют стеарат магния и продолжают смешение в течение короткого периода времени. Таблетки массой 200 мг получают путем грануляции с использованием подходящего аппарата для изготовления таблеток.
Пример 30
Препарат для инъекций, содержащий соединение 105, %:
Соединение 105 (активное вещество) 1
Хлорид натрия q.s.
Этанол 10
Вода для инъекций До 100
Активное вещество растворяют в этаноле (10%), затем добавляют изотонический раствор, приготовленный из воды для инъекций с использованием хлорида натрия. Затем этой смесью заполняют ампулы и стерилизуют.
Пример 31
Крем, содержащий соединение 105
Соединение 105 (10 г) растворяют в октилдодецилмиристате (250 мг), получая при этом часть А. Метилпарабен (1 г) и пропилпарабен (0,2 г) растворяют в феноксиэтаноле (6 г) и смешивают с 0,025 М фосфатным буфером, рН 7,5 (632,8 г), получая при этом часть В. Цетостеариловый спирт и ARLACEL 165® (50 г) размягчают в сосуде при температуре от 70 до 80°С. Добавляют часть А и нагревают до 60-70°С. Аналогичным образом нагревают до 60-70°С водную фазу и медленно добавляют к размягченной масляной фазе при перемешивании с высокой скоростью. Гомогенизированные компоненты охлаждают до комнатной температуры.
| название | год | авторы | номер документа |
|---|---|---|---|
| АМИНОБЕНЗОФЕНОНЫ КАК ИНГИБИТОРЫ IL-1β И TNF-α | 2000 |
|
RU2239628C2 |
| АМИНОБЕНЗОФЕНОНЫ КАК ИНГИБИТОРЫ IL-1 БЕТА И TNF-АЛЬФА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2000 |
|
RU2247719C2 |
| АМИНОБЕНЗОФЕНОНЫ | 2002 |
|
RU2361855C2 |
| АМИНОБЕНЗОФЕНОНЫ КАК ИНГИБИТОРЫ ИЛ-β И ТНФ-α | 2000 |
|
RU2260422C2 |
| АМИНОБЕНЗОФЕНОНЫ КАК ИНГИБИТОРЫ ИЛ-1 БЭТА И TNF-АЛЬФА | 2000 |
|
RU2238933C2 |
| БЕНЗОФЕНОНЫ КАК ИНГИБИТОРЫ IL-1БЕТА И TNF-АЛЬФА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 2001 |
|
RU2270194C2 |
| ИНГИБИТОР, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ ПРОИЗВОДНОЕ ПИРИДАЗИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2807611C2 |
| ЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ 11БЕТА-ГИДРОКСИСТЕРОИД-ДЕГИДРОГЕНАЗЫ 1 | 2009 |
|
RU2531272C2 |
| АЦИЛИРОВАННЫЕ ИНДАНИЛАМИНЫ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ФАРМАЦЕВТИЧЕСКИХ СРЕДСТВ | 2002 |
|
RU2339614C2 |
| СОЕДИНЕНИЯ С НЕМАТОЦИДНОЙ АКТИВНОСТЬЮ | 2012 |
|
RU2608217C2 |
Настоящее изобретение относится к соединениям формулы (I)
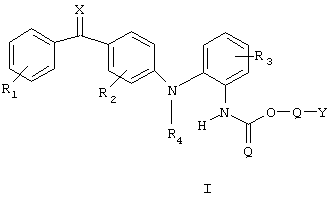
в которой R1, R2 и R3 независимо представляют собой один или более одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, галогена, гидрокси, меркапто, трифторметила, амино, (C1-С3)алкила, (С2-С3)олефиновой группы, (C1-С3)алкокси, (C1-С3)алкилтио, (C1-С6)алкиламино, (C1-С3)алкоксикарбонила, циано, карбамоила или фенила, R1 и R2 дополнительно представлены нитрогруппой, а R3 карбоксигруппой; R4 представляет собой водород, (C1-С3)алкил или аллил; Q представляет собой связь или -С(R6)(R7) (-О-C=О)-, в этой формуле R6 и R7 независимо означают водород, трифторметил или (C1-C4)алкил; Y представляет собой либо (C5-C15)алкил, (С2-C15)олефиновую группу, (С3-С10)моноциклический углеводород или фенил, каждый из которых может быть необязательно замещен одним или более одинаковыми или различными заместителями, представленными формулой R5, или Y представляет собой (С5-С6)алкил, (С2-С6)алкенил, (С3-С6)циклоалкил, (С5-С8)циклоалкеновую группу или фенил, каждый из которых необязательно замещен одним или более одинаковыми или различными заместителями, выбранными из группы, включающей галоген, гидрокси, амино, (С1-С2)алкокси, (С1-С4)алкиламино, (С1-С3)алкоксикарбонил, циано, азидо, -СООН, -CONH2, -CONHR’ или –CONRR’, где R и R’ означают (С1-С2)алкил, или Y представляет собой (С1-С4)алкил, замещенный, по меньшей мере, одним или более заместителями формулы R5 или –CONRR’, где R и R’ означают (С1-С2)алкил, или Y представляет собой группу формулы -СН2-(Z-О)n-Z, где Z представляет собой (C1-С3)алкил и где n представляет собой целое число > 1 и нет непрерывной линейной последовательности атомов в группе Y > 15; R5 представляет собой галоген, гидрокси, меркапто, трифторметил, амино, (C1-С3)алкокси, (C1-С3)алкилтио, (C1-С6)алкиламино, (C1-С3) алкоксикарбонил, циано, азидо, нитро, -СООН, -CONH2, -CONHR', -COONR'R', где R' означает (C1-С3)алкил; X означает кислород или серу, или к фармацевтически приемлемым солям этого соединения или гидратам этого соединения, или сольватам этого соединения, которые могут применяться для лечения человека и в ветеринарии. 4 н. и 4 з.п. ф-лы, 2 табл.
в которой R1 независимо представляет собой один или более одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, галогена, гидрокси, меркапто, трифторметила, амино, (C1-С3)алкила, (С2-С3) олефиновой группы, (C1-С3)алкокси, (C1-С3)алкилтио, (C1-С6)алкиламино, (C1-С3)алкоксикарбонила, циано, карбамоила, нитро или фенила, при условии, что в том случае, когда R1 представляет собой один заместитель, он находится в ортоположении, и в том случае, когда R1 представляет собой более, чем один заместитель, по меньшей мере, один заместитель R1 находится в ортоположении; R2 представляет один заместитель в ортоположении, указанный заместитель выбирают из группы, состоящей из водорода, галогена, гидрокси, меркапто, трифторметила, амино, (C1-С3)алкила, (С2-С3) олефиновой группы, (C1-С3)алкокси, (C1-С3)алкилтио, (C1-С6)алкиламино, (C1-С3)алкоксикарбонила, циано, карбамоила, нитро или фенила; R3 независимо представляет собой один или более одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, галогена, гидрокси, меркапто, трифторметила, амино, (C1-С3) алкила, (С2-С3) олефиновой группы, (C1-С3)алкокси, (C1-С3)алкилтио, (C1-С6)алкиламино, (C1-С3)алкоксикарбонила, циано, карбамоила, фенила или карбокси;
R4 представляет собой водород, (C1-С3)алкил или аллил;
Q представляет собой простую связь или -C(R6)(R7)(-O-С=O)-в этой формуле R6 и R7 независимо означают водород, трифторметил или (C1-C4) алкил;
Y представляет собой либо (C5-C15)алкил, (C2-C15) олефиновую группу, (С3-С10)моноциклический углеводород или фенил, каждый из которых может быть необязательно замещен одним или более одинаковыми или различными заместителями, представленными формулой R5;
или Y представляет собой (С5-С6)алкил, (С2-С6)алкенил, (С3-С6)циклоалкил, (С5-С8)циклоалкеновую группу или фенил; каждый из которых необязательно замещен одним или более одинаковыми или различными заместителями, выбранными из группы, включающей галоген, гидрокси, амино, (С1-С2)алкокси, (С1-С4)алкиламино, (С1-С3)алкоксикарбонил, циано, азидо, -СООН,-СОNН2, -СОNНR’ или –СОNRR’, где R и R’ означают (С1-С2)алкил;
или Y представляет собой (С1-С4)алкил, замещенный, по меньшей мере, одним или более заместителями формулы R5 или –СОNRR’, где R и R’ означают (С1-С2)алкил;
или Y представляет собой группу формулы -СН2-(Z-O)n-Z, где Z представляет собой (C1-С3)алкил, и где n представляет собой целое число > 1 и нет непрерывной линейной последовательности атомов в группе Y > 15;
R5 представляет собой галоген, гидрокси, меркапто, трифторметил, амино, (C1-С3) алкокси, (C1-С3) алкилтио, (C1-С6) алкиламино, (C1-С3)алкоксикарбонил, циано, азидо, нитро, -СООН, -CONH2, -CONHR' или -COONR'R', где R' означает (C1-С3)алкил;
Х означает кислород или серу;
или его фармацевтически приемлемая соль, гидрат или сольват.
R3 представляет собой один или более одинаковых или различных заместителей, выбранных из группы, состоящей из водорода, галогена, гидрокси, трифторметила, (C1-С3)алкила, (С2-С3)алкенила, (C1-С3)алкокси, (C1-С3) алкоксикарбонила, циано или карбокси; R4 представляет собой водород, (C1-C2)алкил или аллил; Х означает кислород; Q представляет собой связь или -СН2-O-С=O-; Y представляет собой (C1-C4)алкил, замещенный одним или более одинаковыми или различными заместителями, выбранными из группы, включающей галоген, гидрокси, амино, (C1-C2)алкокси, (C1-C4)алкиламино, (C1-С3)алкоксикарбонил, циано, азидо, -СООН, -CONH2, -CONHR' или -CONRR', где R и R' означают (C1-C2)алкил; или Y представляет собой (C5-С6)алкил, (С2-С6)алкенил, (С3-С6)циклоалкил, (C5-C8)циклоалкеновую группу или фенил; каждый из которых необязательно замещен одним или более одинаковыми или различными заместителями, выбранными из группы, включающей галоген, гидрокси, амино, (C1-C2)алкокси, (C1-C4)алкиламино, (C1-С3)алкоксикарбонил, циано, азидо, -СООН, -CONH2, -CONHR' или -CONRR', где R и R' означают (C1-C2) алкил.
а также их соли с фармацевтически приемлемыми кислотами, гидраты и сольваты.
| WO 9832730 A1, 30.07.1998 | |||
| Сельскохозяйственный агрегат | 1988 |
|
SU1535401A1 |
| Дихлор аминобензофенон как исходный продуктдля пОлучЕНия лЕКАРСТВЕННыХ пРЕпАРАТОВ C АНТигЕльМиНТНыМдЕйСТВиЕМ | 1979 |
|
SU790620A1 |
| US 4981970 A, 01.01.1991. | |||
Авторы
Даты
2004-11-27—Публикация
2000-07-11—Подача