Изобретение относится к новым замещенным диаминокарбоновым кислотам, способу их получения и их применению в качестве лекарственного средства.
В заявке на европейский патент ЕР 0606046, международной заявке WO 95/35276 и международной заявке WO 96/27583 описываются арилсульфонаминогидроксамовые кислоты и их действие в качестве ингибиторов матричной металлопротеиназы. Особые арилсульфонаминокарбоновые кислоты служат в качестве промежуточных продуктов для получения ингибиторов тромбина (европейский патент ЕР 0468231) и ингибиторов альдозы-редуктазы (европейский патент ЕР 0305947). В заявке на европейский патент ЕР 0757037 описывается также действие производных сульфониламинокарбоновой кислоты в качестве ингибиторов металлопротеиназы.
Далее, арилсульфонильная группа оказывается пригодной в качестве эффективной защитной группы аминной функции α-аминокарбоновых кислот [R. Roemmele, H. Rapoport, J. Org. Chem., 53, 2367-2371 (1988)].
В стремлении найти эффективные соединения для лечения заболеваний соединительных тканей в настоящее время обнаружено, что предлагаемые согласно изобретению диаминокарбоновые кислоты являются сильными ингибиторами матричных металлопротеиназ. При этом особенное значение придается ингибированию стромелизина (матричная металлопротеиназа 3) и нейтрофилезной коллагеназы (ММР-8), так как оба фермента в значительной степени принимают участие в разрушении протеогликанов как важнейших составных частей хрящевой ткани [A. J. Fosang и др., J. Clin. Invest., 98, 2292-2299 (1996)].
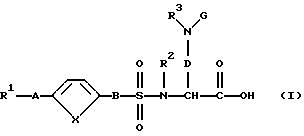
Поэтому изобретение относится к соединению формулы (I):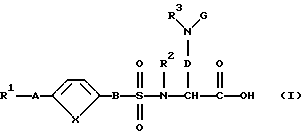
и/или стереоизомерной форме соединения формулы (I), и/или физиологически приемлемой соли соединения формулы (I), причем R1 означает:
1. фенил:
2. фенил, одно- или двукратно замещенный: (2.1) линейным, циклическим или разветвленным (C1-C7)-алкилом; (2.2) гидроксилом; (2.3) группой (C1-C6)-алкил-С(О)-О-; (2.4) группой (С1-С6)-алкил-O-; (2.5) группой (C1-C6)-алкил-O-(C1-С4)-алкил-O-; (2.6) галогеном; (2.7)-CF3; (2.8)-CN; (2.9)-NО2 ; (2.10) группой НО-С(О)-; (2.11) группой (С1-С6)-алкил-O-С(O)-; (2.12) метилендиоксогруппой; (2.13) группой R4- (R5)N-C (О)- или (2.14) группой R4-(R5)N-; или
3. гетероароматический остаток из нижеследующих групп (3.1) - (3.16), который незамещен или замещен, как описано в пп. (2.1) - (2.14), как остаток (3.1) пиррола; (3.2) пиразола; (3.3) имидазола; (3.4) триазола; (3.5) тиофена; (3.6) тиазола; (3.7) оксaзола; (3.8) изоксaзола; (3.9) пиридина; (3.10) пиримидина; (3.11) индола; (3.12) бензотиофена; (3.13) бензимидазола; (3.14) бензоксазола; (3.15) бензотиазола или (3.16) бензотриазола;
R2, R4 и R5 являются одинаковыми или разными и означают:
1. атом водорода;
2. (C1-C6) -алкил-;
3. НО-С(О)-(C1-C6)-алкил-;
4. фенил-(СН2)o-, где фенил незамещен или однократно или двукратно замещен, как описано в пп. (2.1) - (2.14), и где о означает целое число нуль, 1 или 2;
или
5. пиколил; или
6. R4 и R5 вместе с аминогруппой, являющейся заместителем цикла, образуют 4-7-членный цикл, где при необходимости один из атомов углерода заменен -О-, -S- или -NH-;
R3 и G являются одинаковыми или разными и означают:
1. атом водорода;
2. (C1-C6)-алкил, где алкил является линейным, разветвленным или циклическим;
3. (C2-C6)-алкенил;
4. фенил-(CH2)m-, где фенил незамещен или однократно или двукратно замещен, как описано в пп. (2.1) - (2.14), и m означает целое число нуль, 1, 2 или 3;
5. гетероарил-(СН2)m-, где гетероарил имеет указанное в пп. (3.1) - (3.16) значение и/или замещен, как описано в пп. (2.1) - (2.14), и m означает целое число нуль, 1, 2 или 3;
6. R6-C(O)-, где R6 означает:
6.1 (C1-С6)-алкил, где алкил незамещен или замещен, как описано в пп. (2.1) - (2.14), или (С3-С6)-циклоалкилом;
6.2. (С3-С6)-циклоалкил, где циклоалкил незамещен или замещен, как описано в пп. (2.1) - (2.14);
6.3 (С2-С6)-алкенил, где алкенил незамещен или от однократно до трехкратно замещен;
(6.3.1) фенилом, где фенил незамещен или от однократно до трехкратно замещен, как описано в пп. (2.1)-(2.14);
(6.3.2) гетероарилом, где гетероарил имеет указанное в пп. (3.1)- (3.16) значение и незамещен или от однократно до трехкратно замещен, как описано в пп. (2.1) -(2.14); или
(6.3.3) указанными в пп. (2.1) - (2.14) остатками;
6.4 фенил-(СН2)m-, где фенил незамещен или от однократно до трехкратно замещен, как описано в пп. (2.1) -(2.14), группой -O-СF3, -SO2-NH2, -NН-С(O)-СF3 или бензилом и при необходимости один атом водорода - (СН2)-остатка замещен остатком -СООН и m означает целое число нуль, 1, 2 или 3;
6.5 нафтил;
6.6 адамантил или
6.7 гетероарил-(CH2) m-, где гетероарил имеет указанное в пп. (3.1)-(3.16) значение и/или замещен, как описано в пп. (2.1) - (2.14), и m означает целое число нуль, 1, 2 или 3;
7. R6-O-C(O)-, где R6 имеет вышеуказанное значение;
8. R6-CH(NH2) -С (О) -, где R6 имеет вышеуказанное значение;
9. R8-N(R7)-C(O)-, где R8 означает:
9.1 атом водорода;
9.2 (С1-С6)-алкил;
9.3 фенил-(CH2)m-, где фенил незамещен или однократно или двукратно замещен, как описано в пп. (2.1) - (2.14), и m означает целое число нуль, 1, 2 или 3; или
9.4. гетероарил-(CH2)m-, где гетероарил имеет указанное в пп. (3.1)-(3.16) значение и/или замещен, как описано в пп. (2.1)-(2.14), и m означает целое число нуль, 1, 2 или 3; и
где R7 означает атом водорода или (C1-C6)-алкил; или где R7 и R8 вместе с атомом азота, с которым они связаны, образуют 4-7-членный цикл и цикл незамещен или один атом углерода в цикле заменен -О-, -S- или -NH-;
10. R6-SO2-, где R6 имеет вышеуказанное значение;
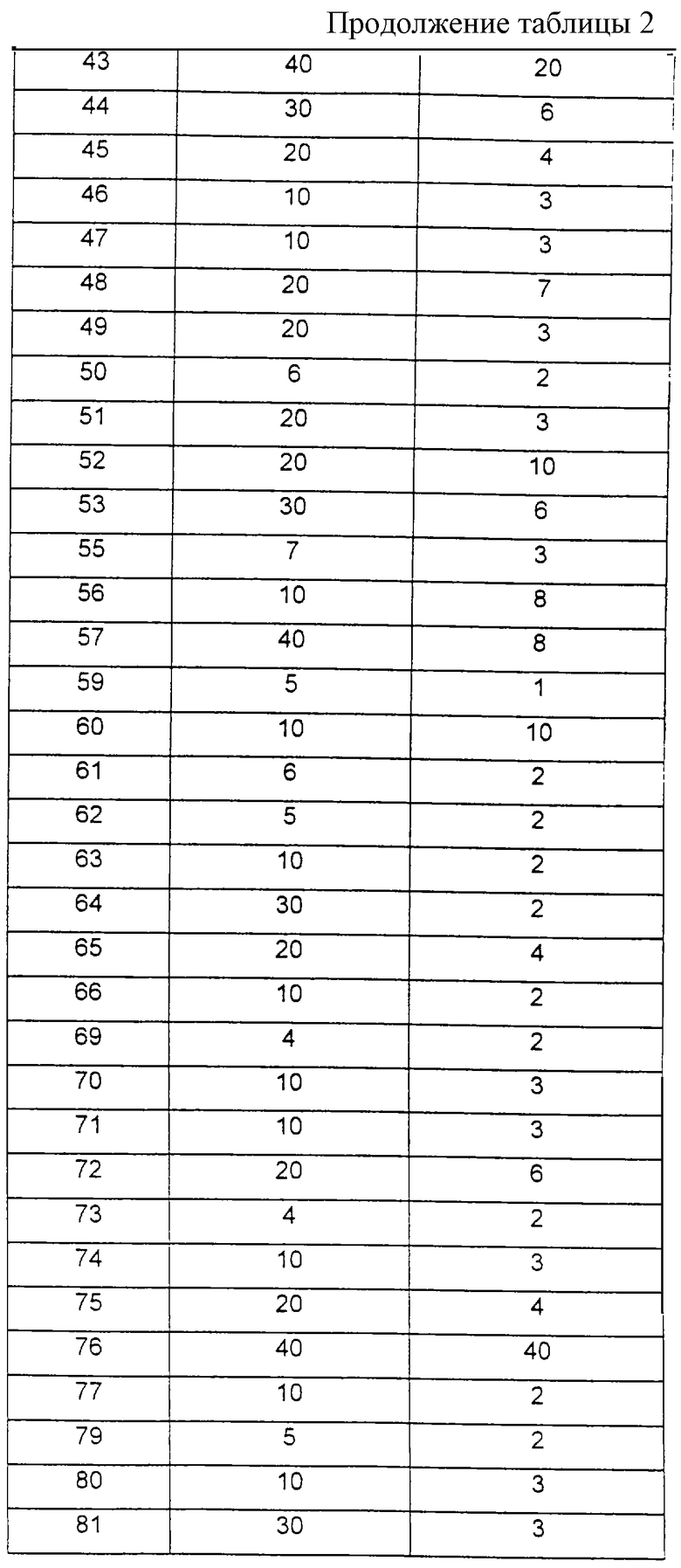
11. R6-SO2-N(R7)-C(O)-, где R6 и R7 имеют вышеуказанные значения;
12. R6-NH-C(= NR7) -, где R6 и R7 имеют вышеуказанные значения или означают:
(12.1) (С1-С6)-алкил-С(O)-; (12.2) нитрогруппу или (12.3) -SO2- (CH2)q-фенил, где фенил незамещен или однократно или двукратно замещен, как описано в пп. (2.1)-(2.14), и q означает целое число нуль, 1, 2 или 3;
13. группу формулы: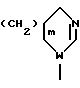
где m означает целое число нуль, 1, 2 или 3 и W означает атом азота, кислорода или серы; или
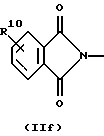
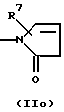
R3 и G вместе с атомом азота, с которым они связаны, образуют циклы частичных формул (IIа) - (IIp):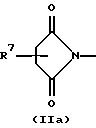

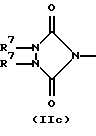
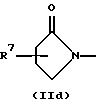

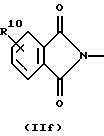
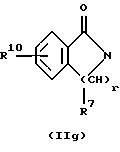
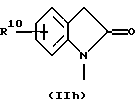

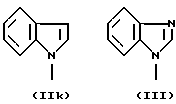
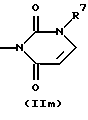

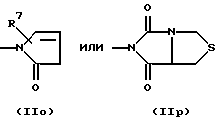
причем r означает целое число 1 или 2, R10 означает остаток, как описано в пп. (2.1) - (2.14), и R7 и m имеют вышеуказанное значение и при необходимости в частичной формуле (IIg) один атом углерода в цикле заменен атомом кислорода, серы, группой SO2 или незамещенным или замещенным с помощью R2 атомом азота;
А означает
а) ковалентную связь;
б) -О-;
в)СН=СН- или
г) 
В означает:
а) -(CH2)m-, где m имеет вышеуказанное значение;
б) -O-(CH2)q, где q означает целое число 1, 2, 3, 4 или 5; или
в) -СН = СН-;
D означает -(СН2)m, где m означает целое число 1, 2, 3, 4, 5 или 6 и при необходимости один из атомов углеродной цепи заменен возможно замещенной NH-группой, атомом кислорода или серы; и
Х означает -СН=СН-, атом кислорода или серы.
Предпочтительным является соединение формулы (I), причем R1 означает:
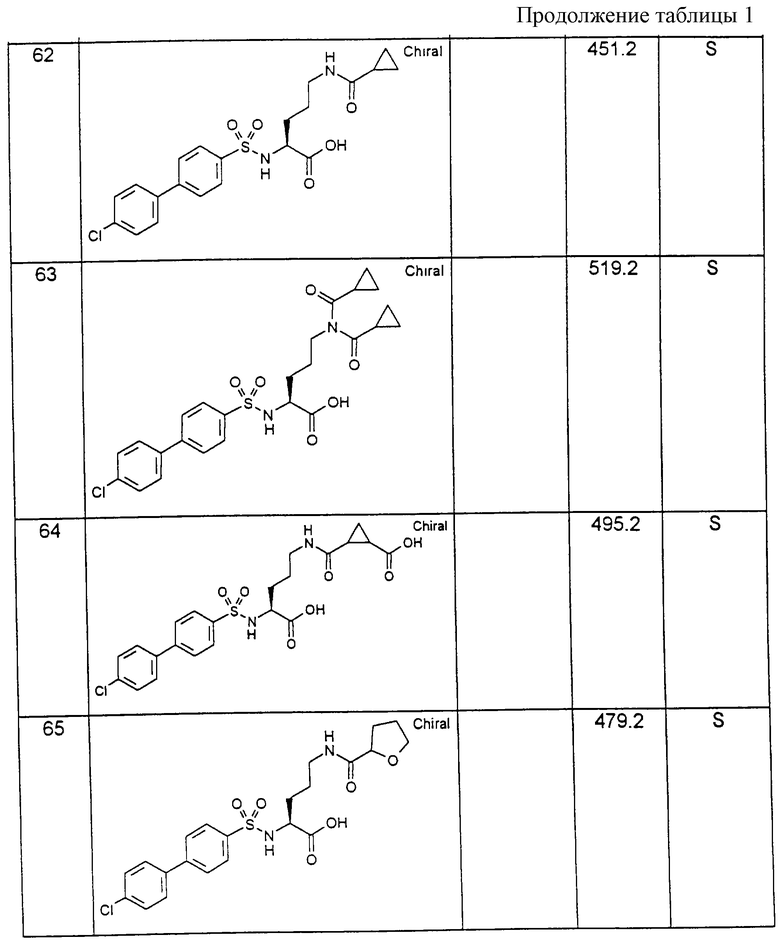
1. фенил или
2. фенил, однократно замещенный
1. галогеном, в особенности хлором или фтором; или
2. группой R4-(R5)N-, причем R4 и R5 являются одинаковыми или разными и означают (2.1) (C1-С3)-алкил или(2.2) R4 и R5 вместе с аминогрупой, являющейся заместителем цикла, образуют 5-6-членный цикл, причем при необходимости один из атомов углерода заменен -О- или -NH-;
R2 означает атом водорода;
G и R3 являются разными, причем
G означает атом водорода или (C1-C4)-алкил и
R3 означает:
1. фенил-(СН2)m, где фенил незамещен или однократно или двукратно замещен, как описано в пп. (2.1)-(2.14), и m означает целое число 1;
2. гетероарил-(СН2)n, где гетероарил имеет указанное в п. (3.10) значение и незамещен или замещен, как описано в пп. (2.1) - (2.14), и n означает нуль;
3. R6-C(O)-, где R6 означает:
3.1 (C1-C6)-алкил, где алкил является линейным; разветвленным или циклическим;
3.2 фенил-(СН2)r-, где фенил незамещен или однократно или двукратно замещен, как описано в пп. (2.1)-(2.14), и при необходимости один атом водорода -(CH2)-остатка заменен остатком -СООН и г означает нуль, 1, 2 или 3; или
3.3 гетероарил-(CH2)о-, где гетероарил имеет указанное в пп. (3.1)- (3.15) значение и незамещен или замещен, как описано в пп. (2.1)- (2.14), и о означает нуль, 1, 2 или 3;
4. R8-N(R7)-C(O)-, где
R8 и R7 вместе с атомом азота, с которым они связаны, образуют 5- или 6-членный цикл и цикл незамещен или один атом углерода цикла заменен атомом кислорода; или R3 и G вместе с атомом азота, с которым они связаны, образуют цикл частичной формулы (IIg), где г означает 1;
А означает ковалентную связь;
В означает -(CH2)p- и р означает нуль;
D означает -(CH2)q- и q означает целое число 2, 3 или 4; и
Х означает -СН = СН-.
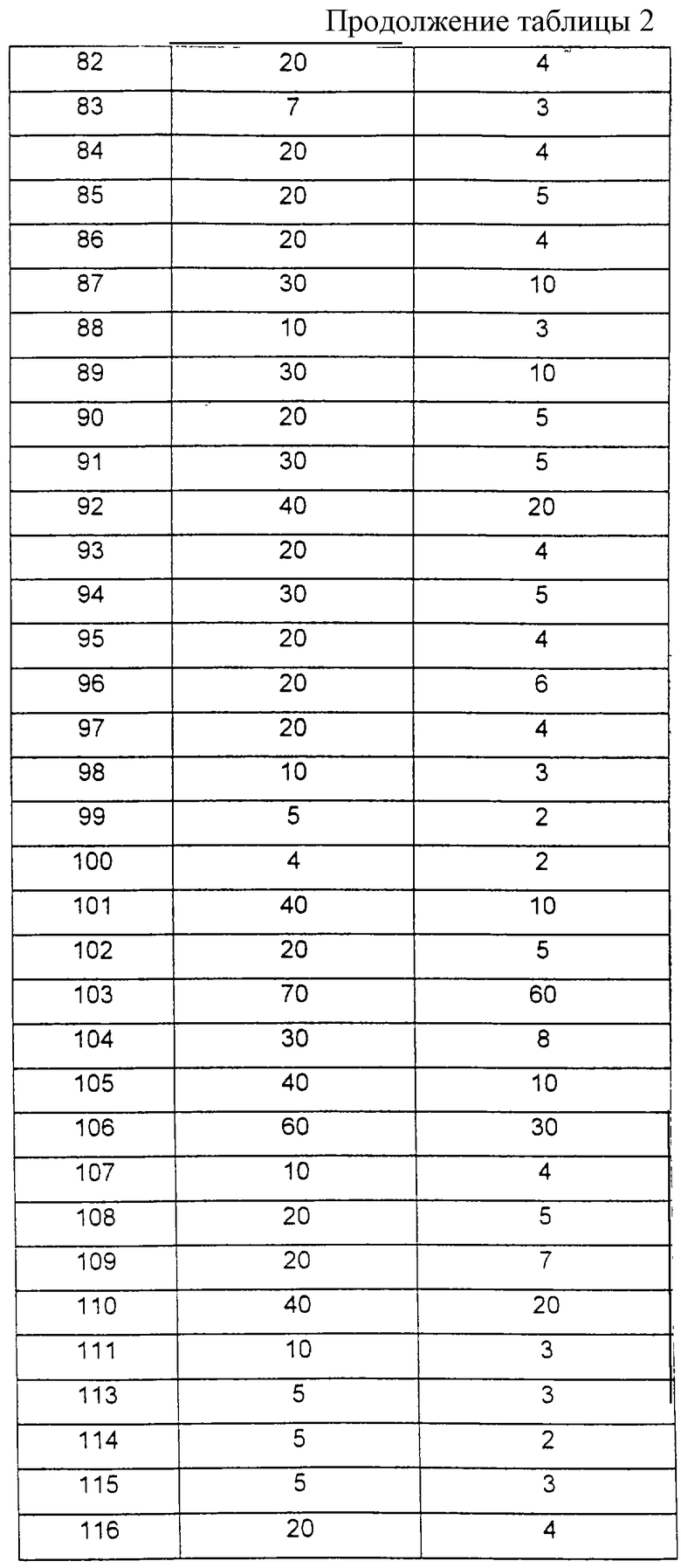
Под выражением "R4 и R5 вместе с аминогруппой, являющейся заместителем цикла, образуют 4-7-членный цикл и/или один из атомов углерода заменен -О-, -S- или -NH-" понимают остатки - производные, например, от пирролидина, пиперазина, морфолина, пиперидина или тиоморфолина. Под термином "галоген" понимают фтор, хлор, бром или йод. Под термином "алкил" или "алкенил" понимают углеводородные остатки, углеродные цепи которых являются линейными или разветвленными. Циклическими алкильными остатками являются, например, 3-6-членные моноциклы, как циклопропил, циклобутил, циклопентил или циклогексил. Далее, алкенильные остатки могут содержать также несколько двойных связей.
Исходные вещества для химических превращений известны или их можно легко получать известными из литературы способами.
Изобретение, далее, относится к способу получения соединения формулы (I) и/или стереоизомерной формы соединения формулы (I) и/или физиологически приемлемой соли соединения формулы (I), который отличается тем, что
а) диаминокарбоновую кислоту формулы (III):
где R2, R3, D и G имеют указанные для формулы (I) значения, вводят во взаимодействие с производным сульфокислоты формулы (IV):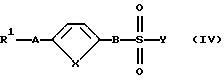
где R1, А и В имеют указанные для формулы (I) значения и Y означает атом галогена, имидазолил или -OR9, где R9 означает атом водорода, (C1-C6)-алкил, фенил, сукцинимидил, бензотриазолил или бензил, который может быть замещен, в присутствии основания или при необходимости водоотнимающего средства с получением соединения формулы (I); или
б) сложный эфир диаминокарбоновой кислоты формулы (V):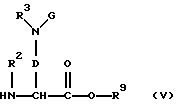
где R2, R3, D, С и R9 имеют вышеуказанное значение, вводят во взаимодействие с производным сульфокислоты формулы (IV) при вышеуказанных условиях с получением соединения формулы (VI):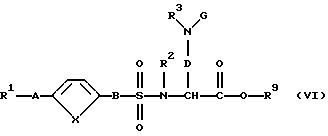
и соединение формулы (VI) путем отщепления остатка R9, предпочтительно в присутствии основания или кислоты, превращают в соединение формулы (I);
в) защищенные диаминокарбоновые кислоты формулы (VII):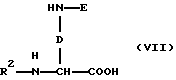
где R2 и D имеют вышеуказанные значения и Е означает защитную группу аминной функции, вводят во взаимодействие с производным сульфокислоты формулы (IV) с получением соединения формулы (VIII):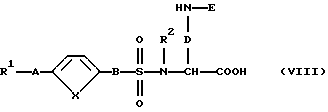
затем соединение формулы (VIII) путем отщепления защитной группы Е с помощью пригодного для отщепления реагента переводят в соединение формулы (I):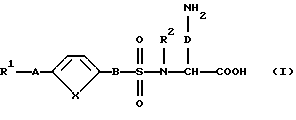
где R1, R2, А, В, D и Х имеют вышеуказанное значение и R3 и G означают атом водорода, и это соединение формулы (I) при необходимости вводят во взаимодействие с R3-Y, где R3 и Y имеют вышеуказанные значения, в присутствии основания с получением соединения формулы (I):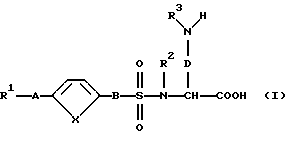
где R1, R2, R3, А, В и Х имеют вышеуказанные значения и G означает атом водорода;
или
г) в случае, если в качестве исходных соединений используют защищеные сложные эфиры диаминокислот формулы (IX):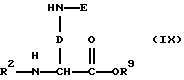
где R2, R9, D и Е имеют вышеуказанное значение, их таким же образом, как описано в варианте способа в), превращают в сложные эфиры формулы (X):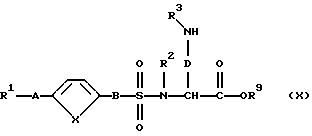
которые при необходимости по варианту способа б) превращают в соответствующие соединения формулы (I); или
д) диаминокарбоновую кислоту формулы (XI):
где D имеет указанное для формулы (I) значение и Е и F представляют собой отличающиеся друг от друга N-аминозащитные группы, с помощью ее карбоксильной группы через промежуточную цепь L связывают с полимерной смолой общей формулы PS, причем образуется соединение формулы (XII):
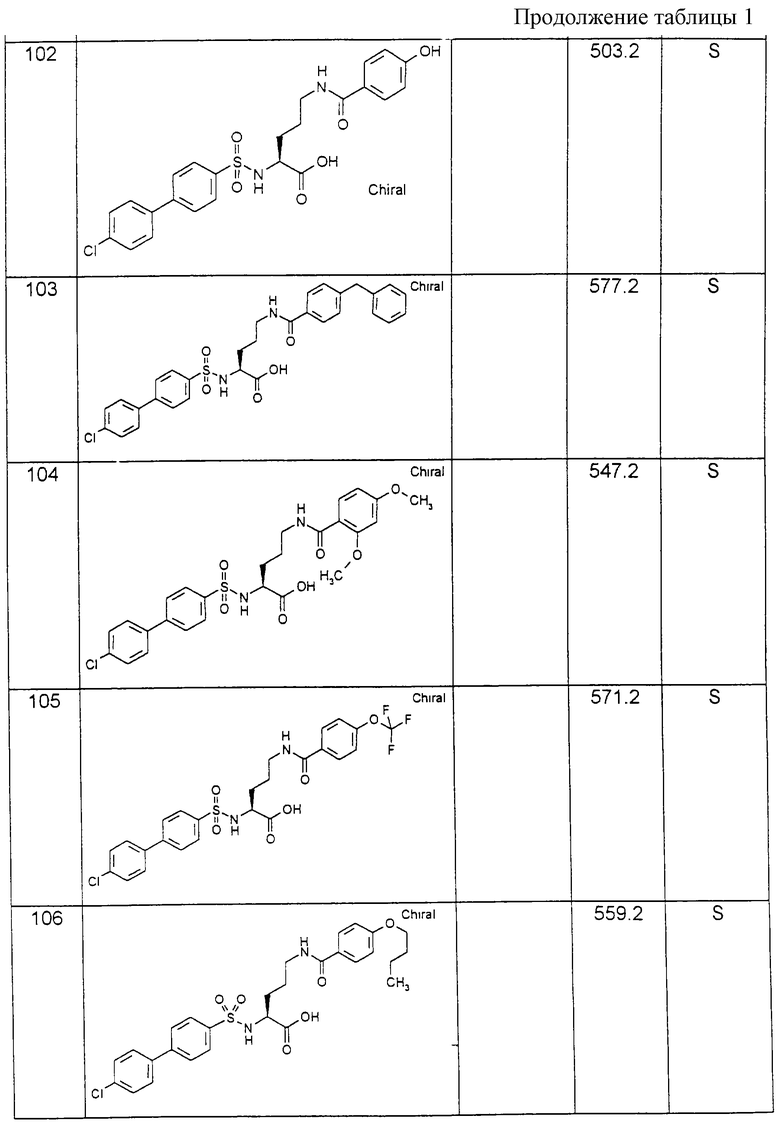
которое после селективного отщепления защитной группы F вводят во взаимодействие с производным сульфокислоты формулы (IV):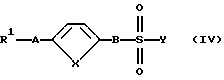
причем R1, А, В и Y имеют вышеуказанные значения в присутствии основания или при необходимости водоотщепляющего средства с получением соединения формулы (XIII):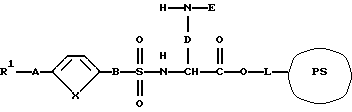
и соединение формулы (XIII) после отщепления защитной группы Е вводят во взаимодействие с производным карбоновой кислоты формулы (XIV):
R6-C(O)-Y, (XIV)
где R и Y имеют вышеуказанное значение, в присутствии основания или водоотнимающего средства с получением соединения формулы (XV):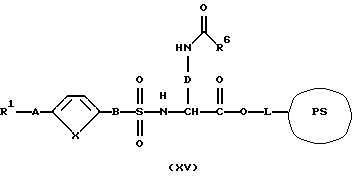
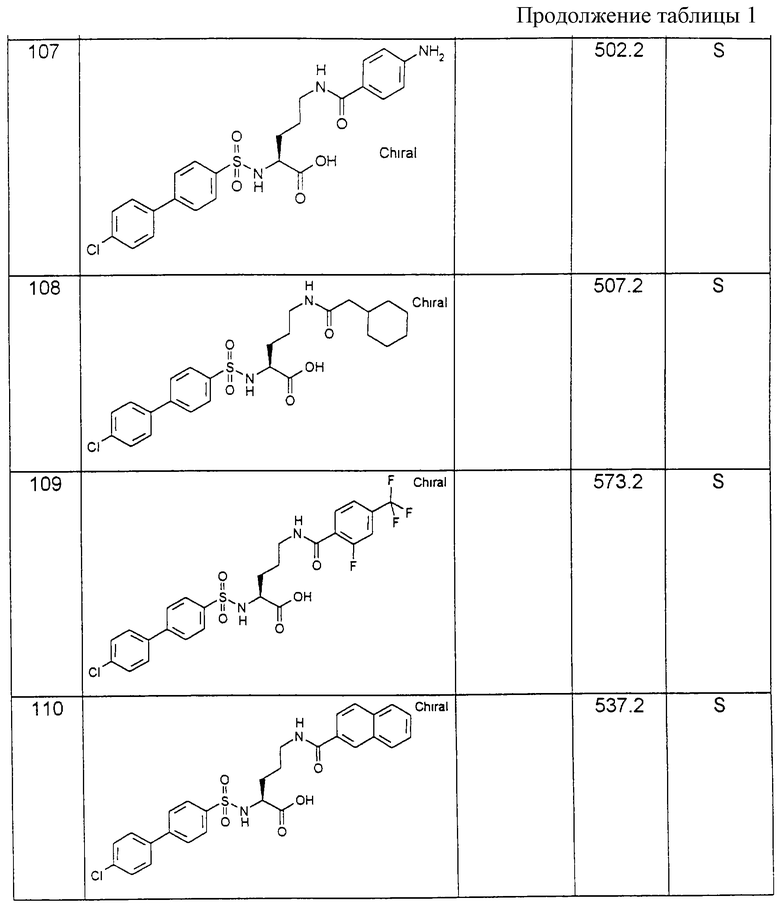
и это соединение после отщепления от носителя переводят в соединение формулы (I):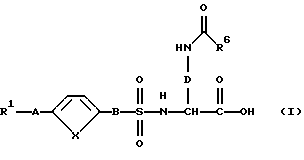
где R1, R6, А, В, D и Х имеют вышеуказанное значение.
В качестве исходных соединений формулы (III), в которых R2, R3 и G означают атом водорода, предпочтительно используют 2,3-диаминопропионовую кислоту, 2,4-диаминомасляную кислоту, орнитин, лизин и гомолизин. Если R3 и G вместе с аминной функцией представляют собой гуанидильную группу, то предпочтительно используют аргинин. Если, как в вариантах способа в), г) и д), аминные функции исходных соединений формул (VII), (IX) и (XI) содержат защитную группу Е или F, то эту селективную дериватизацию аминогрупп осуществляют по способам, описанным в руководстве Губен-Вейл "Методы органической химии", том 15/1.
В качестве пригодных защитных групп Е и F предпочтительно используют обычные в химии пептидов N-защитные группы, например защитные группы уретанового типа, как, например, бензилоксикарбонил (Z), трет-бутилоксикарбонил (Воc), 9-флуоренилметоксикарбонил (Fmoc) и аллилоксикарбонил (Aloc), или амидокислотного типа, в особенности формил, ацетил или трифторацетил, или алкильного типа, как бензил. Для этой цели также особенно пригодна (триметилсилил)этоксикарбонильная группа (Теос) (Р. Kocienski "Защитные группы", изд. Thieme, 1994).
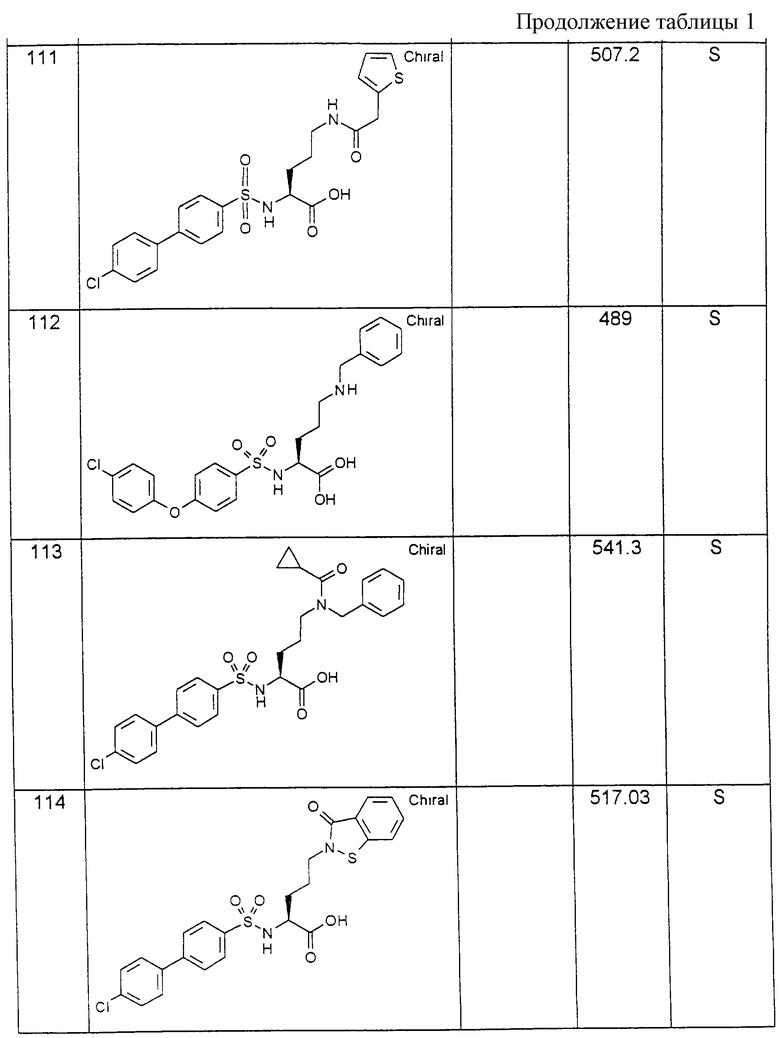
Многие селективно дериватизированные соединения также имеются в продаже, так что получение предлагаемых согласно изобретению соединений формулы (I), как описано в варианте способа в), состоит в том, что после введения эфира сульфокислоты во взаимодействие с α-аминогруппой отщепляют защитную группу боковой цепи Е, после чего при необходимости можно осуществлять многоступенчатую дериватизацию свободной аминогруппы в боковой цепи. Во время осуществления этого варианта способа карбоксильная группа может находиться в свободной форме или в виде сложного эфира с остатком -OR9. Тогда, когда в случае остатка -OR9 речь идет о линейном (C1-С3)-алкильном остатке, этот сложный эфир общей формулы (I) также можно использовать в этой форме в терапии (пролекарство). В случае, когда R9 обозначает трет-бутильный остаток, расщепление сложного эфира предпочтительно осуществляют в последней стадии синтеза по известным способам с помощью НСl в диэтиловом эфире или трифторуксусной кислоты.
В качестве исходных продуктов для получения производных сульфокислот формулы (IV) предпочтительно служат, например, сульфокислоты или их соли формул (XVIa) - (XVIg):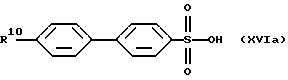
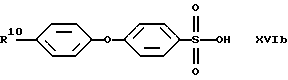
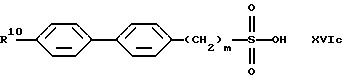
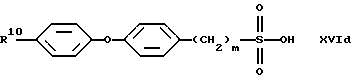
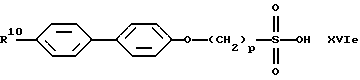
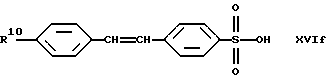

причем R10 означает остаток, описанный под обозначением фенил в пп. (2.1)-(2.14).
Для получения арилсульфокислот формул (XVI а) и (XVIb) предпочтительно используют описанные в руководстве Губен-Вейл "Методы органической химии", том 9, с. 450-546, способы сульфирования с помощью концентрированной серной кислоты, при необходимости в присутствии катализатора, триоксида серы или его аддуктов или галогенсульфокислот, как хлорсульфоновая кислота. Особенно в случае простого дифенилового эфира формулы (XVIb) используют концентрированную серную кислоту и уксусный ангидрид в качестве растворителя [см. С. М. Suter, J. Am. Chem. Soc., 53, 1114 (1931)] или проводят превращение с помощью избыточного количества хлорсульфоновой кислоты [J.P. Bassin, R. Cremlyn и F. Swinbourne, Phosphorus, Sulfur and Silicon, 72, 157 (1992)]. Сульфокислоты формул (XVIc), (XVId) или (XVIe) можно получать само по себе известным образом тем, что соответствующий арилалкилгалогенид вводят во взаимодействие с сульфитами, как сульфит натрия или сульфит аммония, в водном или водно-спиртовом растворе, причем взаимодействие может ускоряться в присутствии тетраорганоаммониевых солей, как тетрабутиламмонийхлорид.
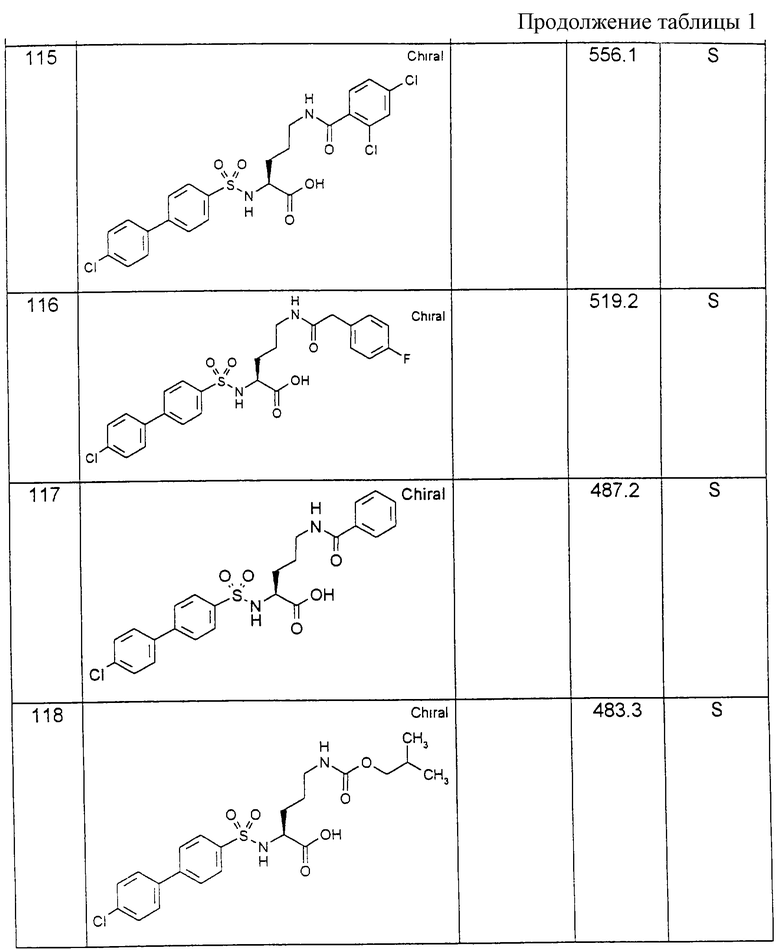
В качестве производных сульфокислот формулы (IV) находят применение в особенности хлорангидриды сульфокислот. Для их получения соответствующие сульфокислоты, также в виде их солей, как соли натрия, аммония или пиридиния, известным образом вводят во взаимодействие с пентахлоридом фосфора или тионилхлоридом без растворителя или в присутствии растворителя, такого как окситрихлорид фосфора, или инертного растворителя, как дихлорметан, циклогексан или хлороформ, при температурах от 20oС до температуры кипения используемой реакционной среды.
Взаимодействие производных сульфокислот формулы (IV) с аминокислотами формул (III), (V), (VII) или (IX) согласно вариантам способа а), б), в) или г) предпочтительно протекает по типу реакции Шоттен-Бауманна. В качестве основания пригодны особенно гидроксиды щелочных металлов, как гидроксид натрия, также ацетаты, гидрокарбонаты, карбонаты щелочных металлов и амины. Взаимодействие осуществляется в воде или в смешивающемся или несмешивающемся с водой растворителе, как тетрагидрофуран (ТГФ), ацетон, диоксан или ацетонитрил, причем температура реакции поддерживается в общем от -10oС до 50oС. В том случае, когда реакцию проводят в безводной среде, используют прежде всего тетрагидрофуран или дихлорметан, ацетонитрил или диоксан в присутствии основания, такого как триэтиламин, N-метилморфолин, N-этил- или диизопропилэтиламин, возможно в присутствии N,N-диметиламинопиридина в качестве катализатора.
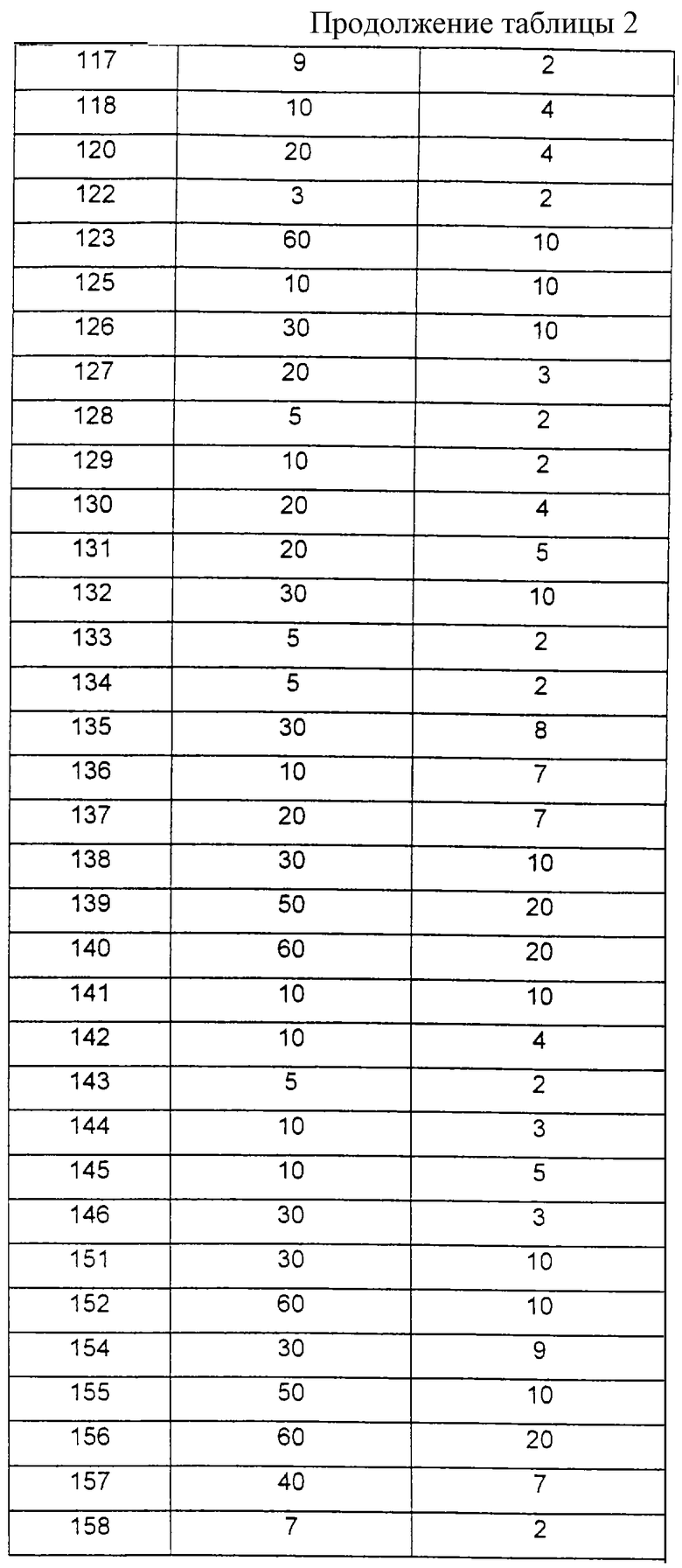
В другом варианте аминокарбоновые кислоты формул (III), (V), (VII) или (IX) сначала с помощью силилирующего средства, как бис-триметилсилилтрифторацетамид (BSTFA) можно переводить в их силилированную форму и затем вводить во взаимодействие с производными сульфокислот с получением соединений формулы (I).
Обозначенный как PS в формуле (XII) полимерный носитель представляет собой сшитую полистирольную смолу с обозначенным в качестве промежуточной цепи L связующим звеном, известную как смола Ванга [S.W.Wang "п-Бензиоксибензиловый спирт-полистирольная смола". Journal of the American Chemical Society, 1328 (1973)] . Альтернативно можно использовать другие полимерные носители, как стекло, хлопок или целлюлоза, с различными промежуточными цепями L.
Обозначаемая как L промежуточная цепь ковалентно связана с полимерным носителем и позволяет осуществлять обратимое, подобное сложноэфирному связывание с диаминокислотой формулы (XI), стабильность которого сохраняется во время дальнейшего взаимодействия со связанной диаминокарбоновой кислотой; однако в сильнокислых реакционных условиях, например в случае чистой трифторуксусной кислоты, связанная с промежуточной цепью группа снова высвобождается.
Высвобождение целевого соединения общей формулы (I) от промежуточной цепи происходит в различных местах реакционной последовательности:
1) в случае, если соединение общей формулы (I), где R3 и G обозначают водород, производное α-сульфониламино-ω-карбоновой кислоты высвобождают после отщепления защитной группы Е путем обработки смолы с помощью трифторуксусной кислоты;
2) если нужно получить соединение общей формулы (I), где R3 означает атом водорода и G означает группу R6-C(O)-, то высвобождение соединения от смолы осуществляют путем простого ацилирования с помощью R6-C(O)-Y, как описано в п. 1);
3) в случае соединения общей формулы (I), где R3 и G одинаково означают R6-C(O)-, отщепление происходит лишь после полного диацилирования при помощи катализатора ацилирования, например, диметиламинопиридина, как описано в п. 1);
4) далее, этот вариант способа допускает, что указанные в формуле (I) остатки 2-13 для R3 и G при использовании пригодных реагентов, как, например, алкилгалогениды, алкенилгалогениды, хлорформиаты, изоцианаты, производные сульфокислот или циклические ангидриды, в этом месте реакционной последовательности могут связываться с α-сульфониламино-ω-аминокарбоновой кислотой, связанной с твердым носителем. После отщепления полученных соединений от твердого носителя таким образом также получают, например, соответствующие замещенные амины, уретаны, мочевины, сульфонамиды или амиды.
А. Общая методика связывания защищенных диаминокарбоновых кислот формулы (XI) с твердым носителем по варианту способа д):
2 г смолы Ванга (Нова-Биохем; наполнение 0,5 ммоль/г) в 20 мл безводного дихлорметана оставляют набухать в течение 30 минут (шприц из полиэтилентерефталата емкостью 50 мл с тефлоновым фильтром в дне шприца). После отфильтровывания растворителя шприц наполняют раствором 3,5 ммоль соответствующей ω-Теос-α-Fmос-диаминокарбоновой кислоты (получают согласно D.H. Rich и др. Synthesis, 346 (198...)), 3,5 ммоль диизопропилкарбодиимида и 0,5 ммоль N, N-диметиламинопиридина примерно в 10 мл безводного дихлорметана и встряхивают в течение 16 часов при комнатной температуре.
После отфильтровывания реакционной смеси смолу многократно промывают дихлорметаном и для определения выхода высушивают и взвешивают.
Б. Отщепление α-Fmoc-защитной группы
Полученную в п. А. смолу подвергают набуханию в шприце примерно в 20 мл безводного диметилформамида и затем после отфильтровывания растворителя смешивают с 25%-ным раствором пиперидина в диметилформамиде и встряхивают в течение 45 минут при комнатной температуре. Образовавшуюся смесь отфильтровывают и оставшуюся в шприце смолу многократно промывают безводным диметилформамидом (фильтрат и все промывочные растворы можно сохранять для определения отщепления группы Fmoc; осуществление методики см.: Практическое руководство "Твердофазный синтез пептидов", Е. Atherton и R.C. Sheppard, IRL Press at Oxford University Press, 1989).
В. Сульфирование свободной α-аминогруппы
Содержимое шприца теперь равномерно распределяют, например, в 4 меньших по объему, снабженных вставленными фильтровальными пластинами шприца, смешивают с растворами различных производных сульфокислот формулы (IV) (в каждом случае 1 ммоль) и диизопропилэтиламином (в каждом случае 1 ммоль) в 3 мл безводного диметилформамида и встряхивают в течение 24 часов при комнатной температуре. Затем раствор реагентов вымывают и смолу многократно промывают диметилформамидом.
Г. Отщепление Теос-эащитной группы
Полученную в п. В. смолу смешивают с 1 М раствором N-тетрабутиламмонийфторида в диметилформамиде (в каждом случае примерно 3 мл) и встряхивают в течение двух часов при комнатной температуре. Растворы реагентов отфильтровывают и оставшуюся смолу многократно промывают диметилформамидом. Содержимое каждого из четырех отдельных шприцов теперь разделяют, например, в каждом случае на следующие 3 подготовленных шприца (в каждом случае 1•0,05 ммоль и 2•0,1 ммоль).
Д.:
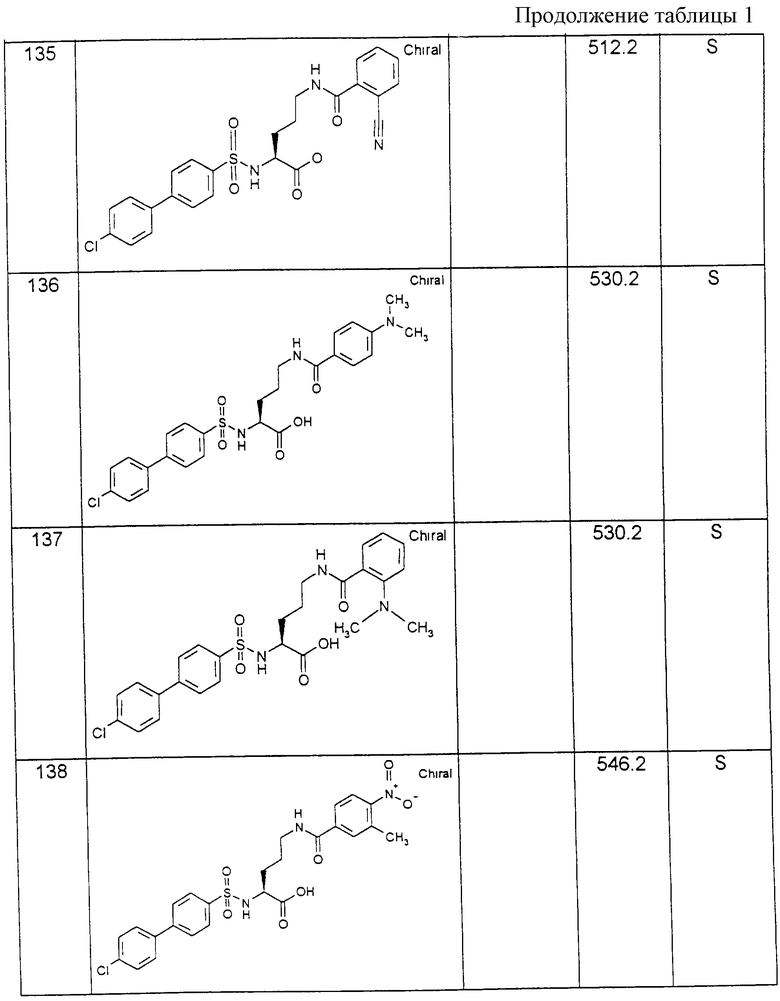
1: Отщепление от твердого носителя
В каждом случае примерно 1/5 содержимого шприца с целью отщепления вещества от твердого носителя промывают дихлорметаном (примерно 10 мл), высушивают и вместе примерно с 1 мл 95%-ного раствора трифторуксусной кислоты, 2% воды и 3% триизопропилсилана встряхивают в течение 1 часа при комнатной температуре. Отфильтрованный из шприца раствор выпаривают и осаждают с помощью диэтилового эфира. Твердый остаток для дальнейшей очистки отфильтровывают и высушивают.
2: Ацилирование с помощью производных карбоновых кислот формулы R6-C(О)-Y:
Остальные шприцы в каждом случае заполняют с помощью 1 М растворов ацетангидрида (1 эквивалент в расчете на высвободившийся амин или 3 эквивалента для бис-ацилирования) и соответствующего количества триэтиламина в диметилформамиде и встряхивают в течение 16 часов при комнатной температуре (полноту ацилирования можно определять, например, с помощью теста Кайзера с нингидрином; осуществление см.: Практическое руководство "Твердофазный синтез пептидов". Е. Atherton и R.C. Sheppard, JRL Press at Oxford University Press, 1989).
3: Отщепление соединений формулы (XV) от твердого носителя:
Полученные, как указано в п. 2, смолы, как описано в п. 1, промывают дихлорметаном, высушивают и обрабатывают смесью трифторуксусной кислоты с водой и триизопропилсиланом в соотношении 95:2:3 в течение 1 часа при комнатной температуре. Полученные растворы обрабатывают, как описано в п. 1.
Физиологически приемлемые соли способных к солеобразованию соединений формулы (I), включая их стереоизомерные формы, получают само по себе известным образом. Карбоновые кислоты с основными реагентами, как гидроксиды, карбонаты, гидрокарбонаты, алкоголяты, а также аммиак, или с органическими основаниями, как, например, триметил- или триэтиламин, этаноламин или триэтаноламин, или также с основными аминокислотами, как, например, лизин, орнитин или аргинин, образуют стабильные соли щелочных металлов, щелочноземельных металлов или при необходимости замещенные соли аммония. Если соединения формулы (I) содержат основные группы, то с помощью сильных кислот можно также получать стабильные соли присоединения кислот. Для этой цели используют как неорганические, так и органические кислоты, как соляная кислота, бромводородная кислота, серная кислота, фосфорная кислота, метансульфокислота, бензолсульфокислота, п-толуолсульфокислота, 4-бромбензолсульфокислота, циклогексиламидосульфокислота, трифторметилсульфокислота, уксусная кислота, щавелевая кислота, винная кислота, янтарная кислота или трифторуксусная кислота.
Изобретение относится также к лекарственному средству, отличающемуся тем, что оно содержит эффективное количество по крайней мере одного соединения формулы (I), и/или физиологически приемлемой соли соединения формулы (I), и/или при необходимости стереоизомерной формы соединения формулы (I) вместе с фармацевтически пригодным и физиологически приемлемым носителем, добавкой и/или другими биологически активными и вспомогательными веществами.
На основании фармакологических свойств предлагаемые согласно изобретению соединения пригодны для профилактики и лечения всех таких заболеваний, в протекании которых участвует усиленная активность металлопротеиназ, разрушающих матрицу. К таким заболеваниям относятся дегенеративные заболевания суставов, как остеоартрозы, спондилезы, атрофия хрящей после травмы суставов или более длительной иммобилизации суставов после повреждений мениска или коленной чашечки или разрывов связок. Далее, к ним относятся также заболевания соединительной ткани, как коллагенозы, периодонтальные заболевания, нарушения заживления ран и хронические заболевания двигательного аппарата, как воспалительные, обусловленные иммунологически или метаболизмом острые и хронические артриты, артропатии, миалгии и нарушения метаболизма костей. Далее, соединения формулы (I) пригодны для лечения изъязвления, атеросклероза и стенозов. Далее, соединения формулы (I) пригодны для лечения воспалений, раковых заболеваний, образования опухолевых метастаз, кахексии, анорексии и септического шока.
Предлагаемые согласно изобретению лекарственные средства, в общем, вводят перорально или парентерально. Также возможно ректальное или трансдермальное введение.
Изобретение относится также к способу получения лекарственного средства, который отличается тем, что по крайней мере одно соединение формулы (I) с помощью фармацевтически пригодного и физиологически приемлемого носителя и при необходимости других пригодных биологически активных веществ, добавок или вспомогательных веществ переводят в пригодную форму применения.
Пригодными твердыми или галеновыми формами композиций являются, например, грануляты, порошки, драже, таблетки, (микро)капсулы с лекарством, суппозитории, сиропы, соки, суспензии, эмульсии, капли или растворы для инъекции, а также препараты с пролонгированным высвобождением биологически активного вещества, при получении которых используют обычные вспомогательные средства, как носители, порофоры, связующие, средства для покрытия, способствующие набуханию средства, придающие скользкость (таблеткам) вещества или смазки, вкусовые вещества, подслащивающие вещества и агенты растворения. В качестве часто используемых вспомогательных веществ следует назвать карбонат магния, диоксид титана, лактозу, маннит и другие сахара, тальк, молочный белок, желатин, крахмал, целлюлозу и ее производные, животные и растительные масла, как рыбий жир, подсолнечное масло, арахисовое масло или кунжутное масло, полиэтиленгликоль и растворители, как, например, стерильная вода и одно- или многоатомные спирты, как глицерин.
Предпочтительно фармацевтические препараты получают и вводят в виде разовых доз, причем каждая такая разовая доза в качестве активной составной части содержит определенное количество предлагаемого согласно изобретению соединения формулы (I). В случае твердых разовых доз, как таблетки, капсулы с лекарством, драже или суппозитории, это количество может составлять вплоть до примерно 1000 мг, однако предпочтительно примерно 50-300 мг, а в случае растворов для инъекций - в форме ампул вплоть до примерно 300 мг, однако предпочтительно примерно 10-100 мг.
Для лечения взрослых пациентов массой примерно 70 кг в зависимости от активности соединений формулы (I) показаны суточные дозы примерно 20-1000 мг биологически активного вещества, предпочтительно примерно 100-500 мг. При известных обстоятельствах, однако, можно вводить также более высокие или более низкие суточные дозы. Суточную дозу можно вводить как путем однократного приема отдельной разовой дозы или, однако, нескольких более маленьких разовых доз, так и также путем многократного введения дробных доз в определенные интервалы времени.
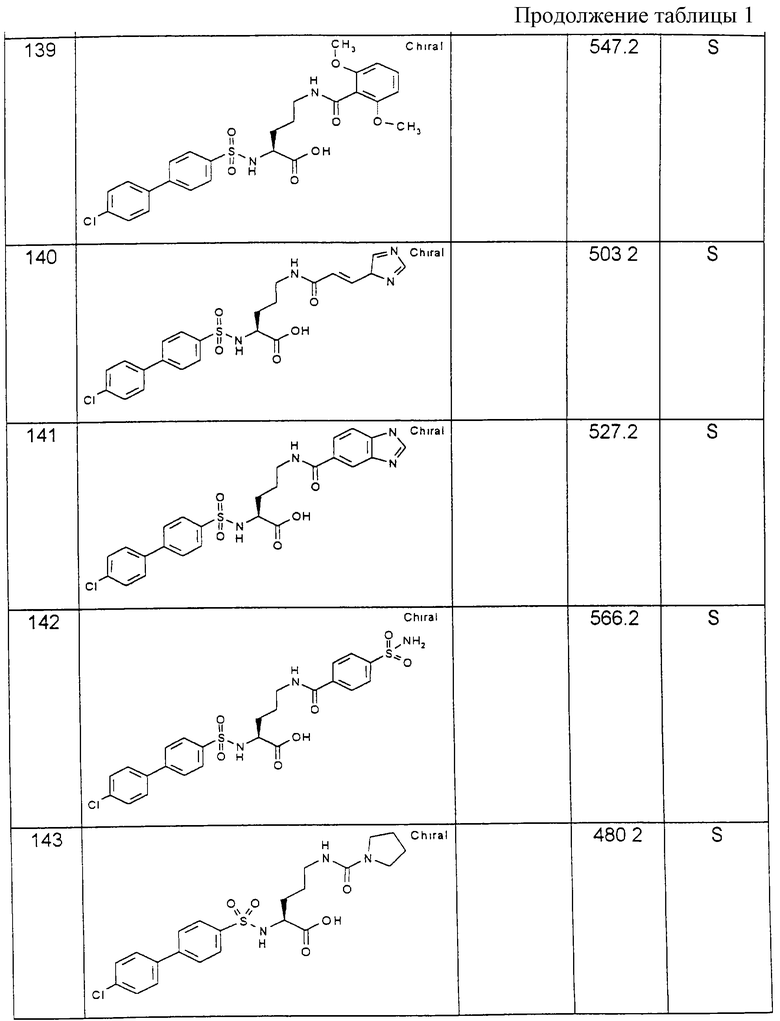
1H-ЯМР-спектры снимают на приборе фирмы Вариан при 200 МГц, как правило, при использовании тетраметилсилана (ТМС) в качестве внутреннего стандарта и при комнатной температуре. В каждом случае указываются используемые растворители. Целевые продукты, как правило, характеризуют с помощью масс-спектроскопических методов [бомбардировка быстрыми атомами (FAB), ионизация электронным распылением (ESI)]. Температурные данные приводятся в градусах Цельсия, RT обозначает комнатную температуру (22-26oС). Используемые аббревиатуры либо поясняются, либо соответствуют общепринятым.
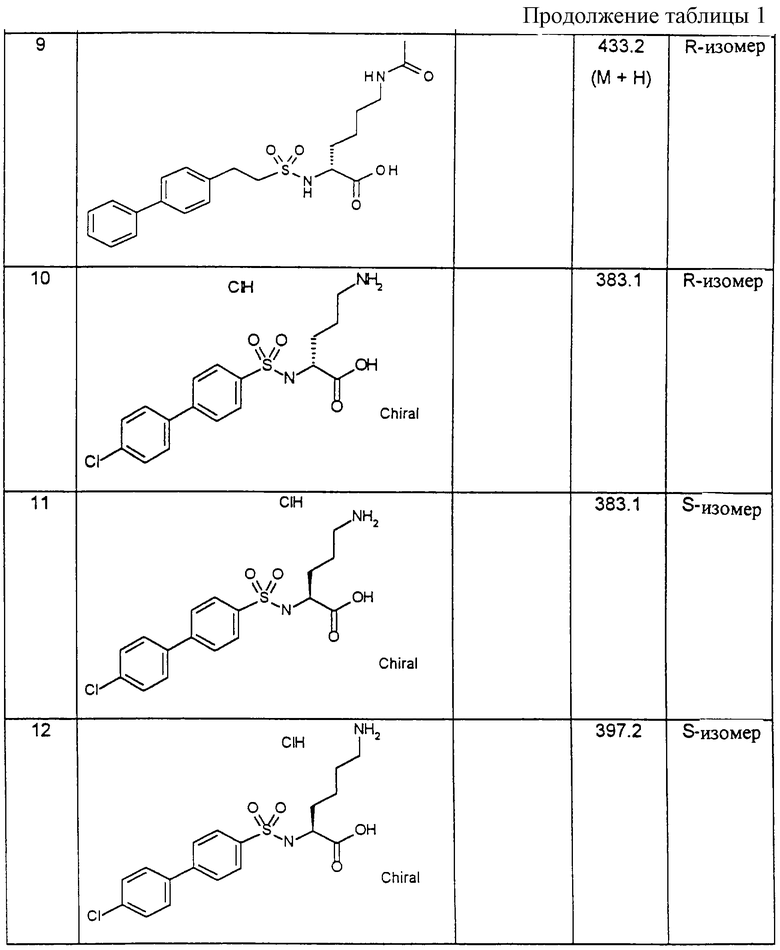
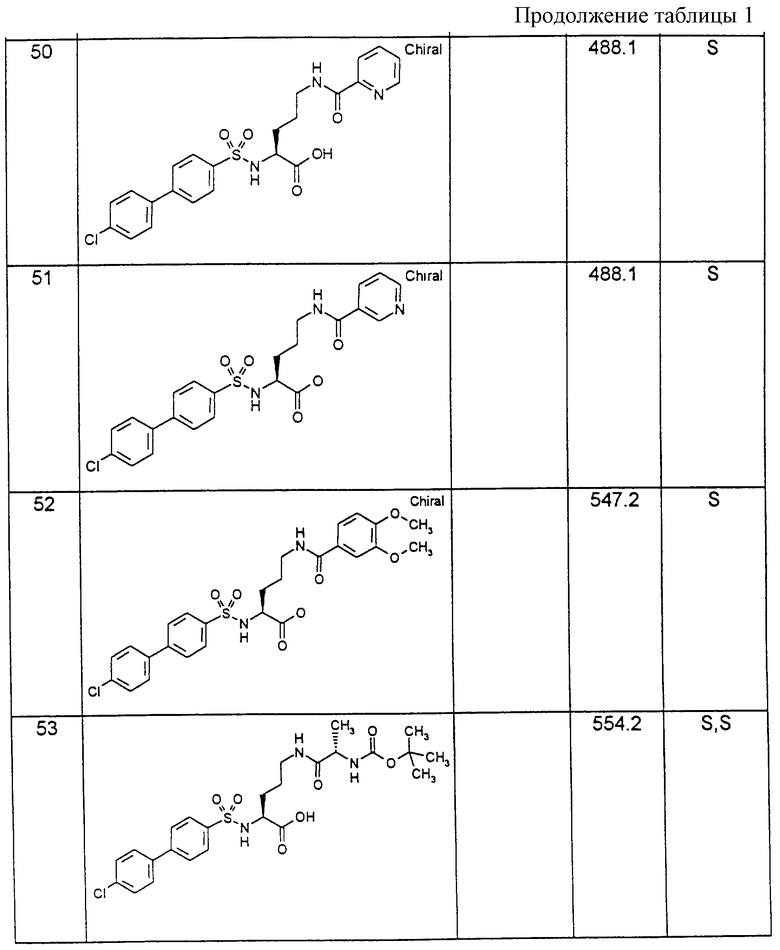
Пример 1: (R)-(4-Хлорбифенилсульфонил)цитруллин [получение по варианту способа а)]
1,7 г (9,7 ммоль) (R)-цитруллина растворяют в 19,4 мл 0,5 н. раствора гидроксида натрия и после добавления 40 мл тетрагидрофурана при температуре 0oС медленно смешивают со следующими 19,4 мл раствора гидроксида натрия и одновременно с 9,7 мл 1 М раствора хлорангидрида 4-хлорбифенилсульфокислоты. После перемешивания в течение 16 часов при комнатной температуре реакционную смесь концентрируют в ротационном испарителе и смешивают с 20 мл этилацетата. При подкислении с помощью 1 М соляной кислоты выпадает осадок белого цвета, который отсасывают и высушивают.
Выход: 2,26 г (54 % от теории).
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид); 1,2-1,7 (2м, 4Н); 2,9 (дд, 2Н); 3,7 (дд, 1Н); 5,4 (с, 2Н); 5,9 (т, 1Н); 7,5-7,9 (2д, с, 8Н); 8,2 (д, 1Н).
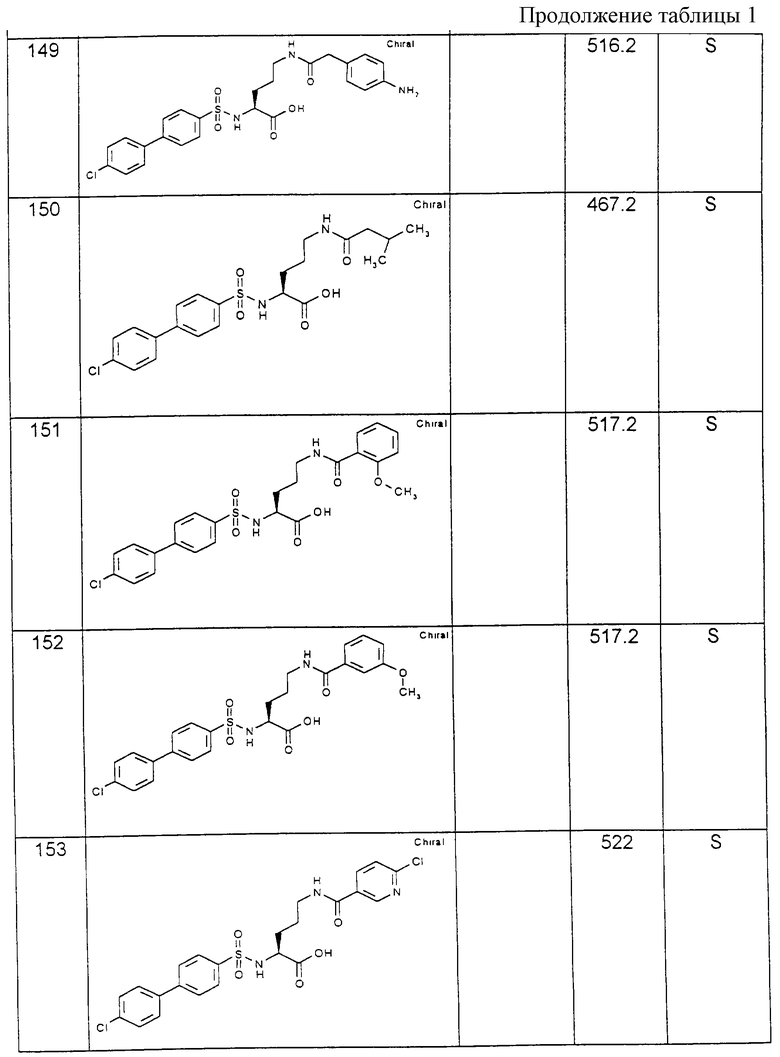
Пример 2: (R)-(4-Хлорбифенилсульфонил)-Lys(Воc)-ОН [получение по варианту способа в)]
Превращение 5,15 г (21 ммоль) H-D-Lys (Вос)-ОН в (4-хлорбифенилсульфонил)-R-Lуs(Вос)-ОН осуществляют, как описано в примере 1; однако обработку осуществляют путем экстрации с помощью этилацетата и выпаривания растворителя при пониженном давлении.
Выход: 9,3 г (89 % от теории).
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид): 1,1-1,7 (м, 15Н); 2,8 (дд, 2Н), 3,7 (м, 1Н); 6,7 (т, 1Н) ; 7,6; 7,8 (2д, 4Н); 7,9 (м, 4Н); 8,2 (д, 1Н).
Пример 3: (R)-(4-Хлорбифенилсульфонил)-Lys-OH
4,97 г (10 ммоль) соединения из примера 2 в течение 30 минут при комнатной температуре обрабатывают с помощью 15 мл 50 %-ной трифенилуксусной кислоты в дихлорметане. Выпаривание при пониженном давлении дает целевое соединение.
Выход 3,73 г (94% от теории).
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид): 1,1-1,7 (м, 6Н); 2,8 (дд, 2Н); 3,7 (м, 1Н); 6,6 (м, 2Н) 7,6; 7,8 (2д, 4Н); 7,9 (м, 4Н); 8,2 (д, 1Н).
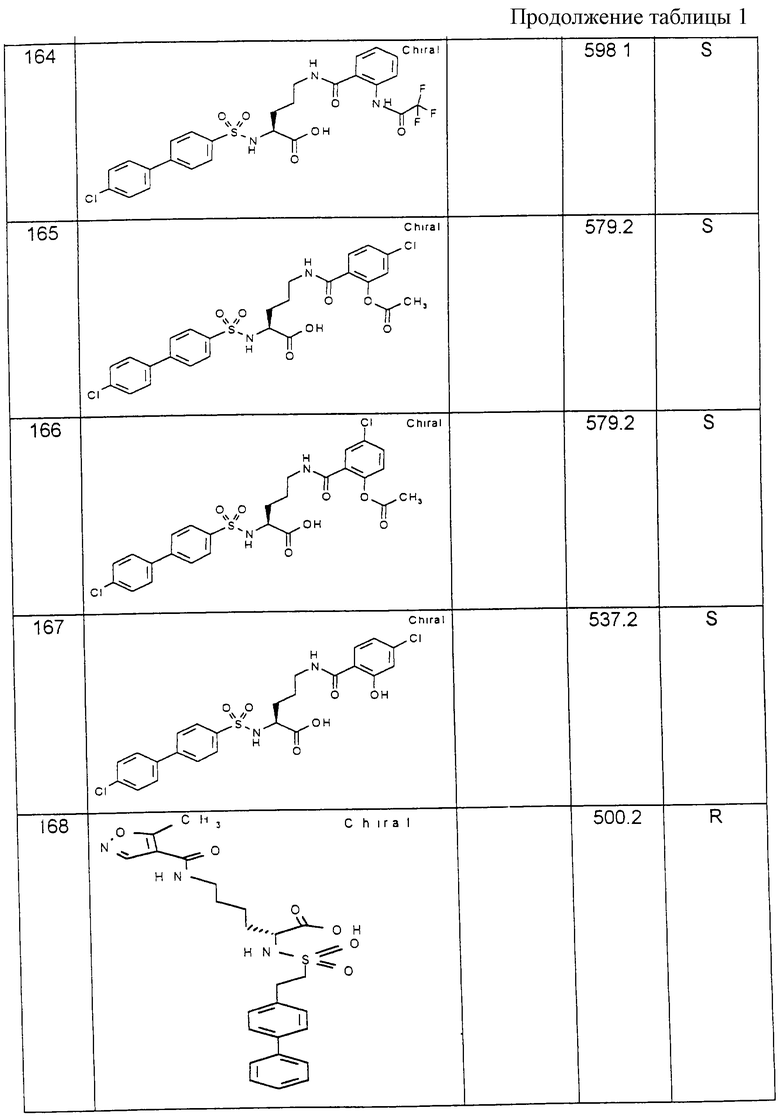
Пример 4: 4-Хлорбифенилсульфонил-N-ε-(5-метилизоксазол-4-карбонил)-Lys-OH
0,15 г (0,345 ммоль) (4-хлорбифенилсульфонил)-лизина из примера 3 вместе с 50,1 мг (0,345 ммоль) хлорангидрида 5-метилизоксазол-4-карбоновой кислоты и 86,9 мг (1,035 ммоль) гидрокарбоната натрия в 5 мл ацетонитрила перемешивают в течение 6 часов при комнатной температуре. Затем растворитель отгоняют при пониженном давлении, остаток обрабатывают этилацетатом и многократно встряхивают при подкислении соляной кислотой, затем при нейтральном значении рН. После высушивания органической фазы и отфильтровывания осушителя реакционную среду выпаривают при пониженном давлении. Выход: 0,11 г (63 % от теории).
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид): 1,1-1,7 (мм, 7Н) ; 2,6 (2с, 3Н); 2,8; 3,1 (2м, 2Н ; 3,7 (м, 1Н; 7,6; 7,8 (2д, 4Н); 7,9 (м, 5Н); 8,2 (д, 1Н); 8,8 (2с, 1Н).
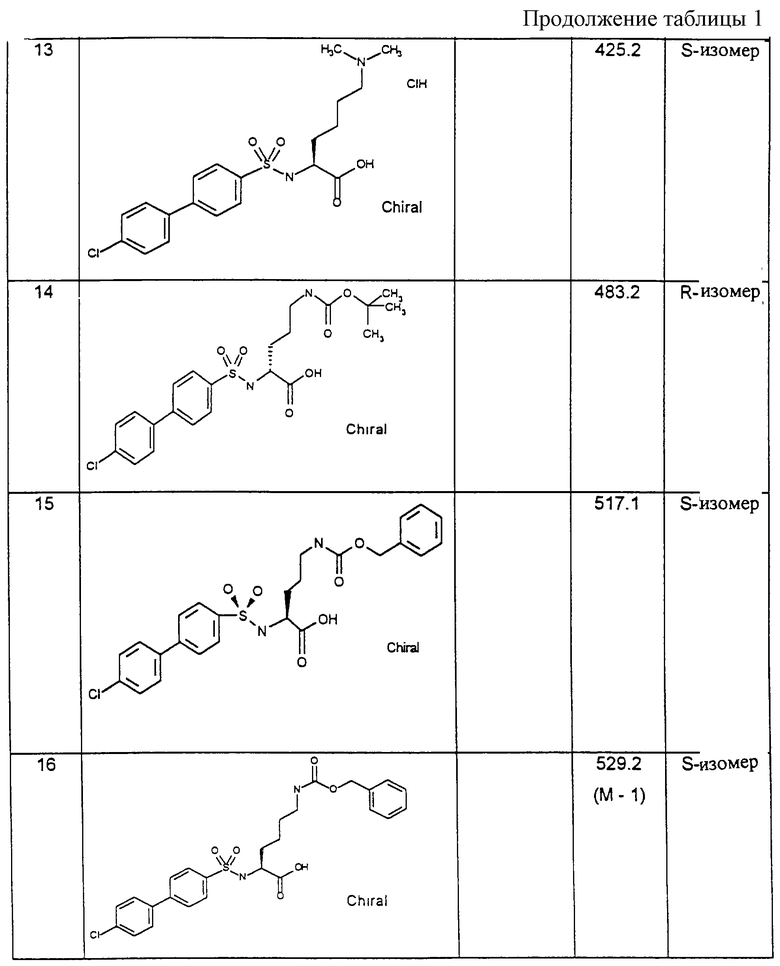
Пример 5: (4-Хлорбифенилсульфонил)-N-δ-фенилсульфониламинокарбонил)-Оrn-ОН [получение по варианту способа г)]
5а). Превращение H-Orn(Z)-O-tBu в 4-хлорбифенилсульфонил-Orn(Z)-O-tBu
11,27 г (31,4 ммоль) H-Orn(Z)OtBu-гидрохлорида вводят во взаимодействие с 9,02 г (31,4 ммоль) хлорангидрида хлорбифенилсульфокислоты и 10,7 мл (61,8 ммоль) диизопропилэтиламина в 200 мл тетрагидрофурана при температуре 0oС. Спустя 4 часа смесь выпаривают при пониженном давлении и остаток после внесения в этилацетат встряхивают при подкислении соляной кислотой, при нейтральном значении рН и при подщелачивании (раствор карбоната натрия). После высушивания органической фазы и выпаривания ее досуха получают целевой продукт.
Выход: 16,7 г (93% от теории).
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид): 1,5 (с, 9Н); 1,3-1,5 (м, 4Н); 2,9 (м, 2Н), 3,6 (м, 1Н); 5,0 (с, 2Н), 7,3 (м, 6Н); 7,5; 7,7 (2д, 4Н); 7,8 (с, 4Н); 8,2 (д, 1Н).
5б). Отщепление бензилоксикарбонильной защитной группы
16,7 г (29 ммоль) продукта из п. 5а) растворяют в смеси метанола с этилацетатом в соотношении 1:1 и в присутствии 4 г 10 %-ного палладия-на-угле гидрируют при слегка повышенном давлении в течение 16 часов. Затем катализатор отфильтровывают и остаток выпаривают при пониженном давлении.
Выход: 11,2 г (91 % от теории).
1H-ЯМР-спектр: характерные сигналы защитной группы отсутствуют (5,0; 7,3).
5в). Превращение соединения из стадии 5б) в производное фенилсульфонилмочевины
0,5 г (1,14 ммоль) указанного в п. 5б) соединения в диметилацетамиде при комнатной температуре вводят во взаимодействие с 0,23 мл фенилсульфонилизоцианата. Спустя 16 часов растворитель удаляют и осадившийся из этилацетата кристаллический продукт дополнительно обрабатывают диэтиловым эфиром. Остатки диэтилового эфира удаляют при пониженном давлении.
Выход: 0,53 г (75% от теории).
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид); 1,1 (с, 9Н); 1,3-1,5 (м, 4Н); 2,9 (м, 2Н); 3,6 (м, 1Н); 6,5 (т, 1Н); 7,4-7,9 (мм, 14Н); 8,2 (д, 1Н); 10,6 (с, 1Н).
5г). Отщепление защитной группы соединения примера 5в).
0,52 г вышеуказанного продукта стадии 5в) вместе с 5 мл трифторуксусной кислоты перемешивают в течение 45 минут при комнатной температуре. Трифторуксусную кислоту удаляют при пониженном давлении, остаток дважды выпаривают совместно с толуолом, полученный таким образом остаток суспендируют в диэтиловом эфире и отделяют, как в примере 5в), в виде белого кристаллического твердого вещества.
Выход: 0,4 г (84 % от теории).
1Н-ЯМР-спектр (гексадейтеродиметилсульфоксид): 1,3-1,5 (м, 4Н); 2,9 (м, 2Н); 3,6 (м, 1Н); 6,5 (т, 1Н); 7,4-7,9 (мм, 14Н); 8,2 (д, 1Н); 10,6 (с, 1Н).
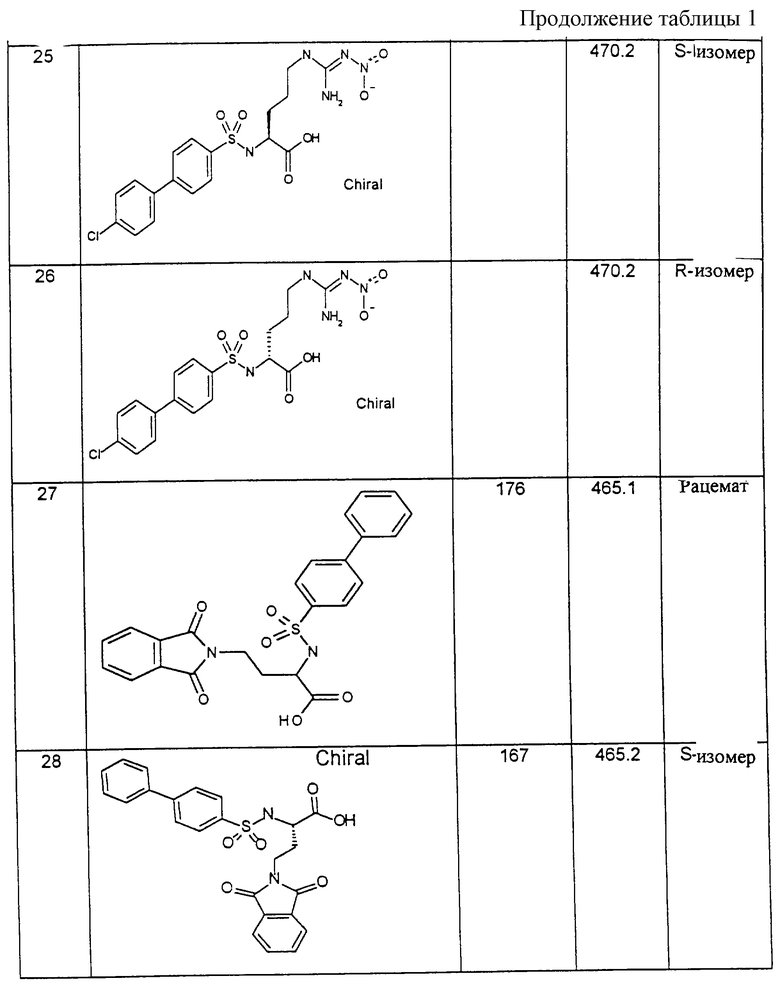
Пример 6: 2-(2R)-(4-Хлорбифенилсульфониламино)-5-фталимидоилпентановая кислота
0,7 г (1,67 ммоль) гидрохлорида 2-(2R)-(4-хлорбифенилсульфониламино)-5-аминопентановой кислоты [получают по варианту способа в)] вместе с 0,358 г (2,42 ммоль) ангидрида фталевой кислоты нагревают в течение 1 часа при температуре 150oС. После прекращения газовыделения реакционную смесь обрабатывают дихлорметаном и полученный раствор хроматографируют на силикагеле (элюирующее средство: смесь этилацетата с петролейным эфиром и ледяной уксусной кислотой в соотношении 10:10:1).
Выход: 29,6 мг (34,6 % от теории).
Т. пл. = 178oС.
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид): 1,3-1,7 (м, 4Н); 3,4-3,6 (т, 2Н); 3,7-3,8 (м, 1Н); 7,5 (д, 2Н); 7,7 (д, 2Н); 7,7-7,9 (м, 8Н); 8,2 (д, 1Н, NH); 12,6 (уш.с, 1Н, ОН).
Пример 7: 2-(2R)-(4-Хлорбифенилсульфониламино)-5-(1-оксо-1,3-дигидроизоиндол-2-ил) пентановая кислота
0,32 г (0,76 ммоль) гидрохлорида 2-(2R)-(4-хлорбифенилсульфониламино)-5-аминопентановой кислоты вместе с 0,186 г (1,35 ммоль) фталевого диальдегида растворяют в 30 мл ледяной уксусной кислоты и перемешивают в течение трех часов при температуре 100oС. Раствор охлаждают до 0oС, выпавший осадок отсасывают и хроматографируют на колонке с силикагелем (элюирующее средство: смесь этилацетата с петролейным эфиром и ледяной уксусной кислотой в соотношении 10:10:2).
Выход: 185 мг (52 % от теории).
Т. пл. выше 234oС (разложение).
1H-ЯМР-спектр (гексадейтеродиметилсульфоксид): 1,4-1,7 (м, 4Н); 3,1 (м, 1Н); 3,4-3,6 (м, 2Н); 4,4 (д, 1Н); 4,5 (д, 1Н); 6,9 (уш.с, 1Н, ОН); 7,4-7,9 (м, 13Н).
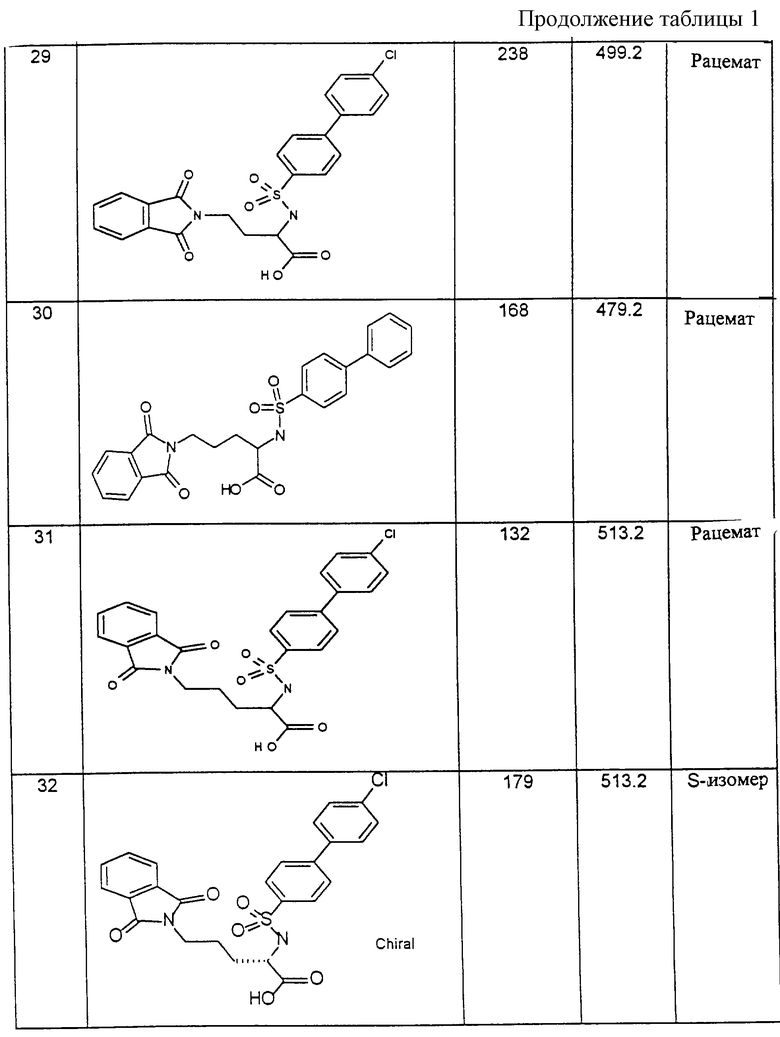
Пример 8: (R)-(4-Бифенилэтилсульфонил)Lys-OH [получение по варианту способа д)]
α-Fmoc-ε-Teoc-D-Lys-OH (0,18 ммоль) при вышеуказанных условиях связывают со 100 мг (0,05 ммоль) смолы Ванга и после отщепления (α-Fmoc-защитной группы вводят во взаимодействие с 0,18 ммоль 4-бифенилэтилсульфонилхлорида в диизопропилэтиламине. После отщепления ε-Теос-защитной группы с помощью 1 М раствора тетрабутиламмонийфторида в диметилформамиде и отщепления полученного производного лизина от смолы (смесь трифторуксусной кислоты с водой и триизопропилсиланом в соотношении 95:2:3) таким образом полученный раствор выпаривают. Твердый остаток промывают диэтиловым эфиром, растворяют в 10 %-ной водной уксусной кислоте, лиофилизируют досуха и получают 20 мг целевого соединения в виде аморфного белого порошка. ВЭЖХ (фаза RP 18; длина волны 210 нм): градиент 0-15 минут Б=5-70 % (А=100% воды с 0,1 % трифторуксусной кислоты, Б=100% ацетонитрила с 0,1% трифторуксусной кислоты). ТR=9,49 мин (95%).
Пример 9: (R)-(4-Бифенилэтилсульфонил)-N-ε-ацетил-Lуs-ОН
Следуя методике примера 8, 0,35 ммоль α-Fmoc-ε-Teoc-D-лизина связывают с 200 мг (0,10 ммоль) смолы Ванга, удаляют защитную группу Fmoc и вводят во взаимодействие с 4-бифенилэтилсульфонилхлоридом в диизопропилэтиламине. После отщепления защитной группы ε-Теос полученное производное лизина вместе с 0,15 ммоль ацетангидрида и 0,15 ммоль диизопропилэтиламина перемешивают в течение 15 часов при комнатной температуре. После обильной промывки диметилформамидом, дихлорметаном и высушивания смолы (0,1 Торр) в течение ночи целевое соединение отщепляют от твердого носителя с помощью смеси трифторуксусной кислоты с водой и триизопропилсиланом в соотношении 95:2:3 и обрабатывают, как описано в примере 8. Получают 40 мг соединения в виде аморфного белого порошка.
ВЭЖХ (фаза RP 18; длина волны 210 нм): градиент 0-15 мин; Б=5-70% (А= 100% воды с 0,1 % трифторуксусной кислоты; Б=100% ацетонитрила с 0,1% трифторуксусной кислоты); ТR=10,39 мин (93%).
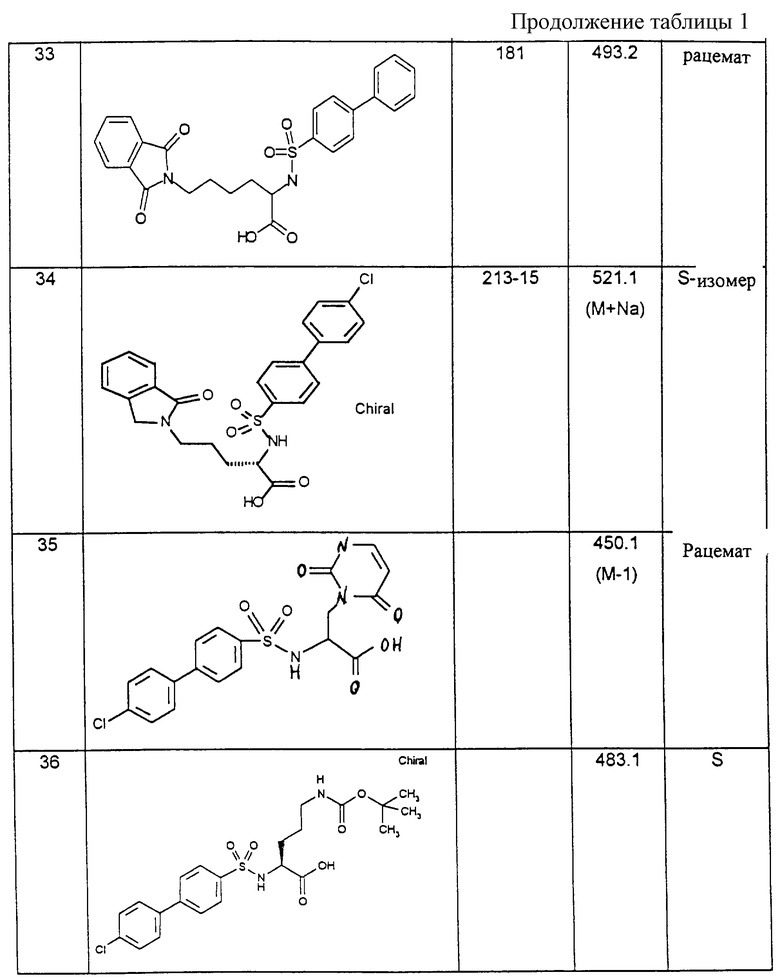
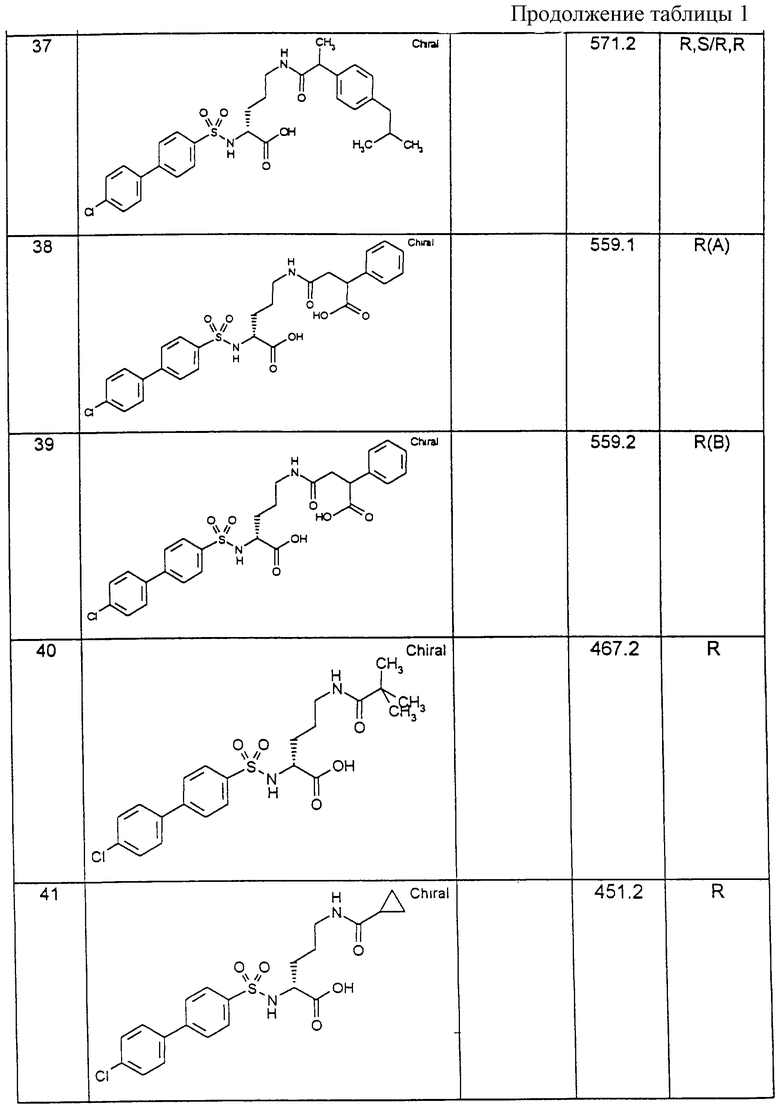
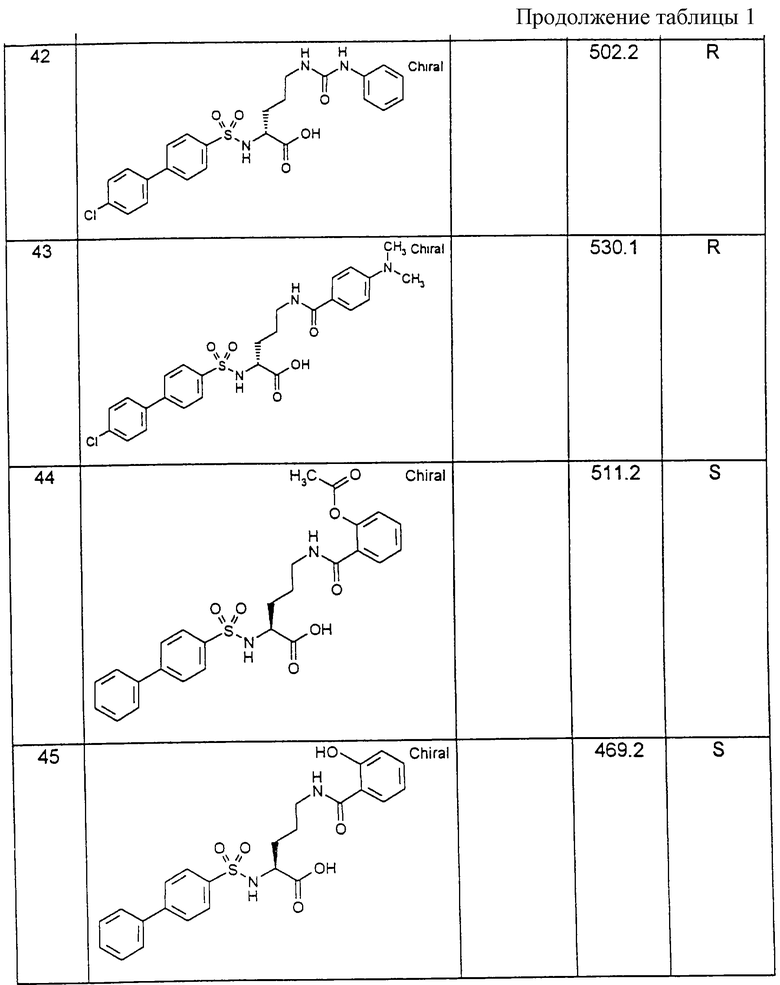
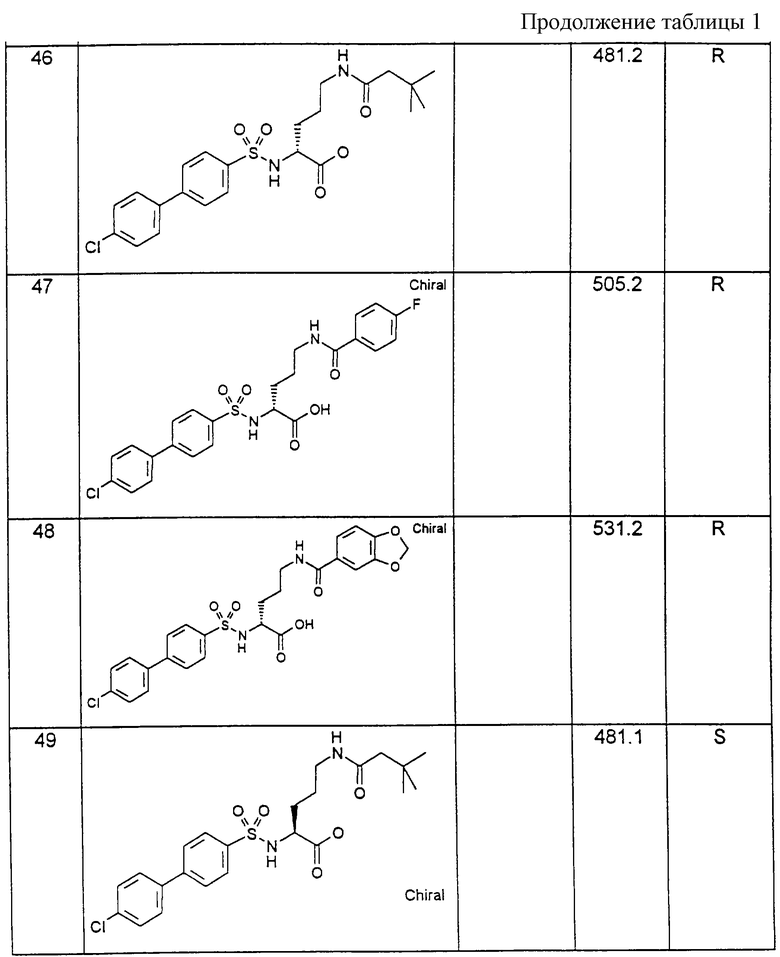
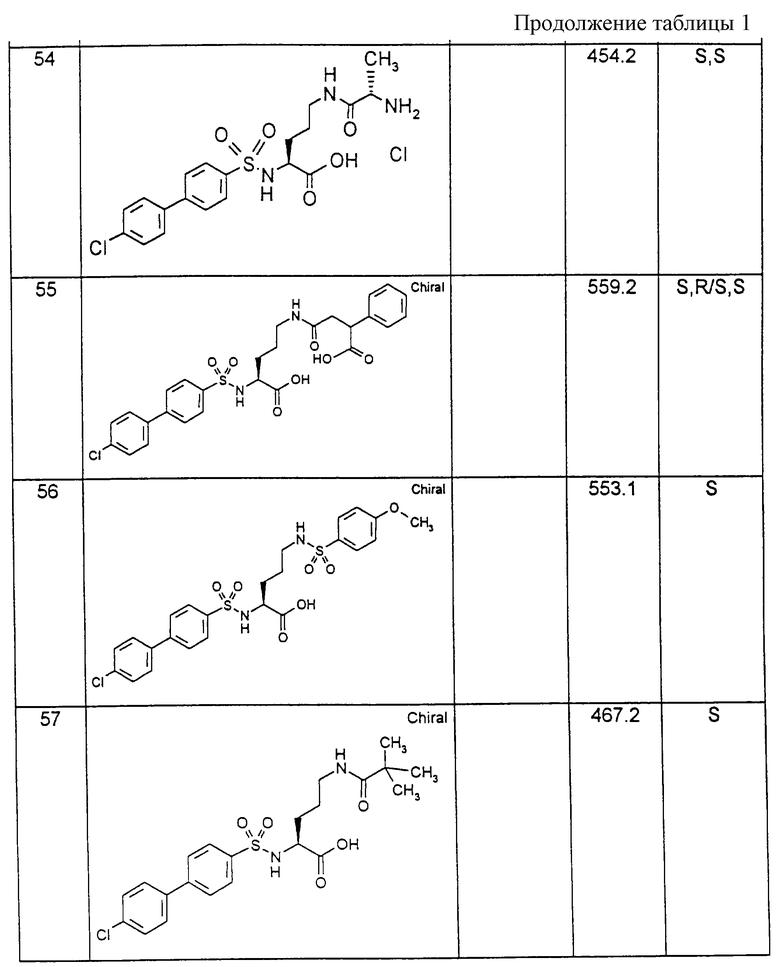
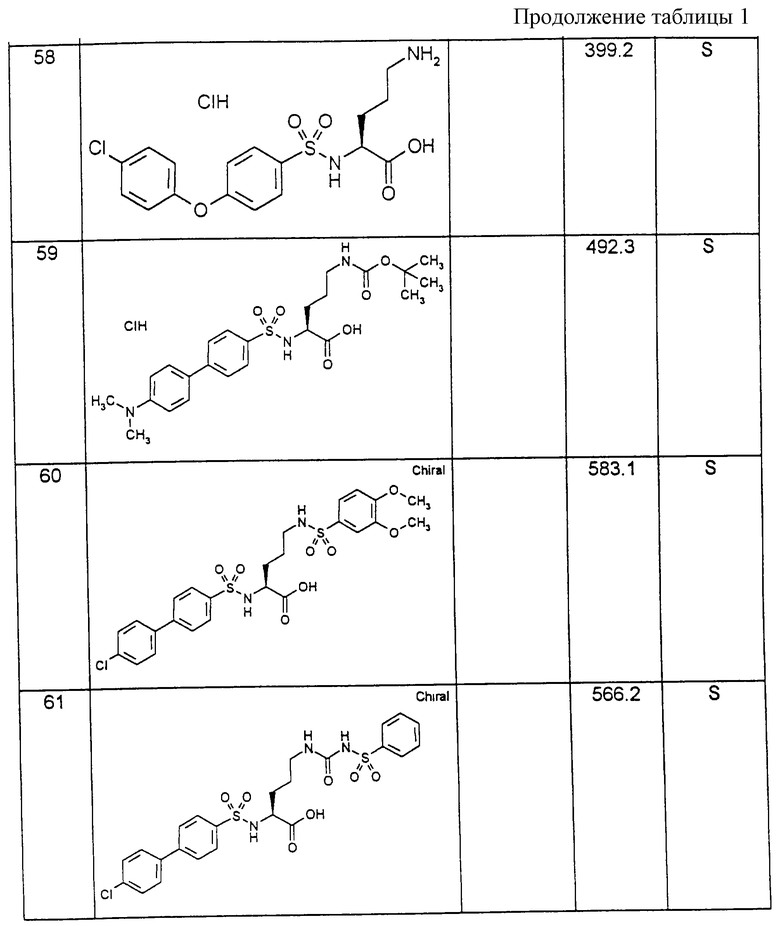
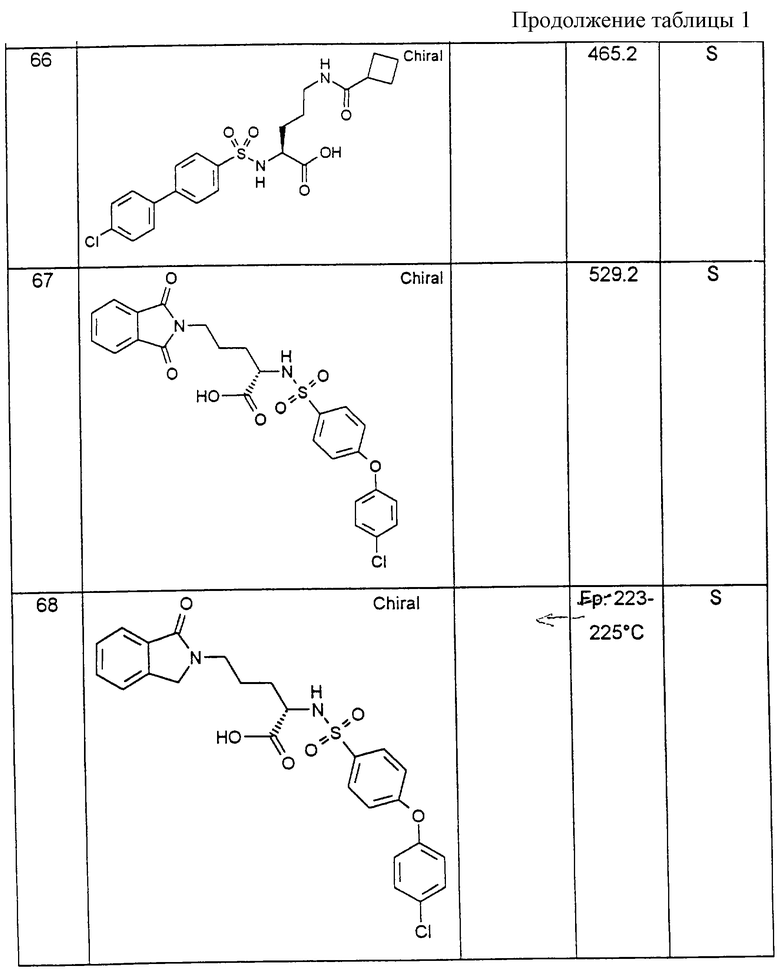
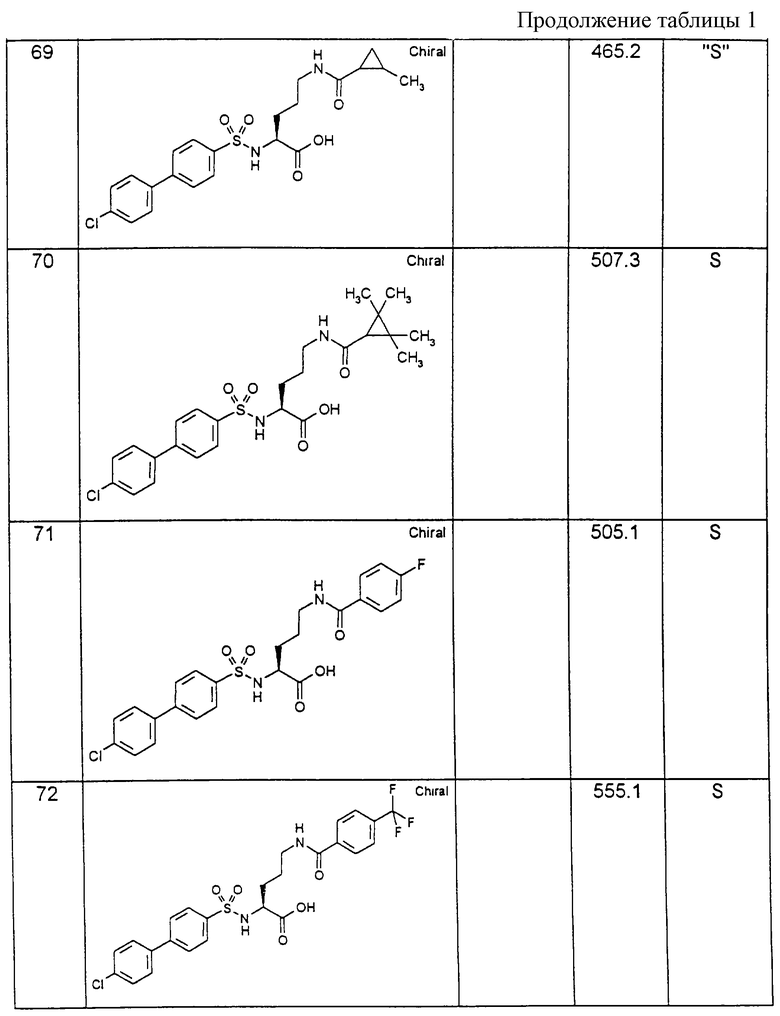
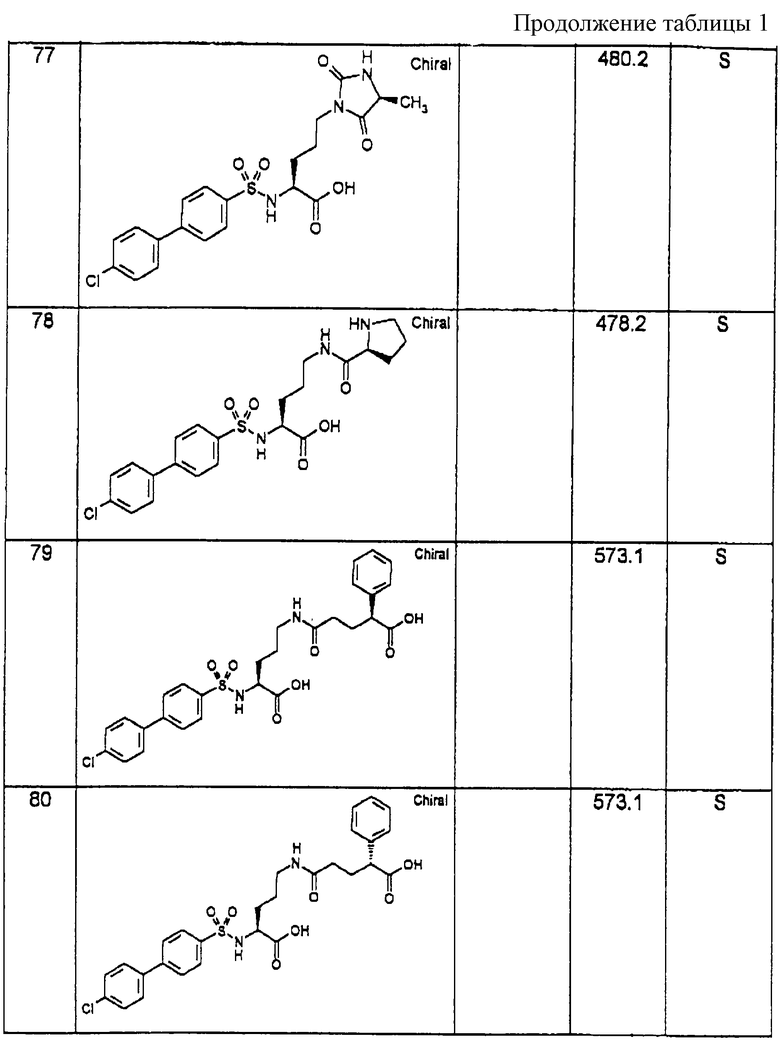
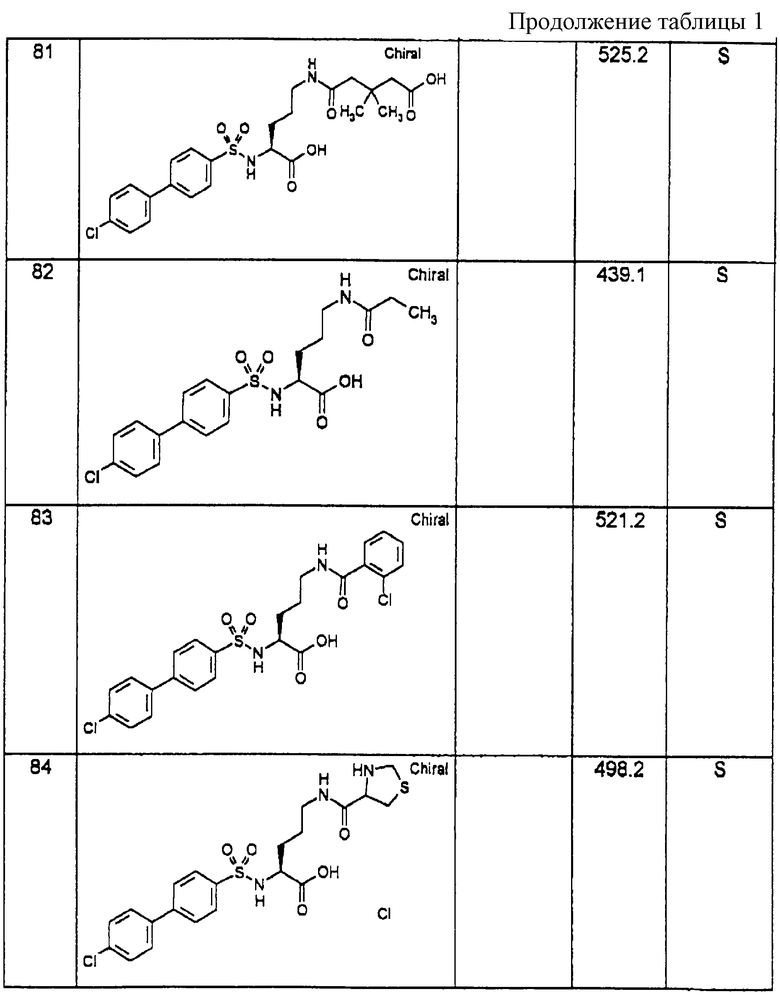
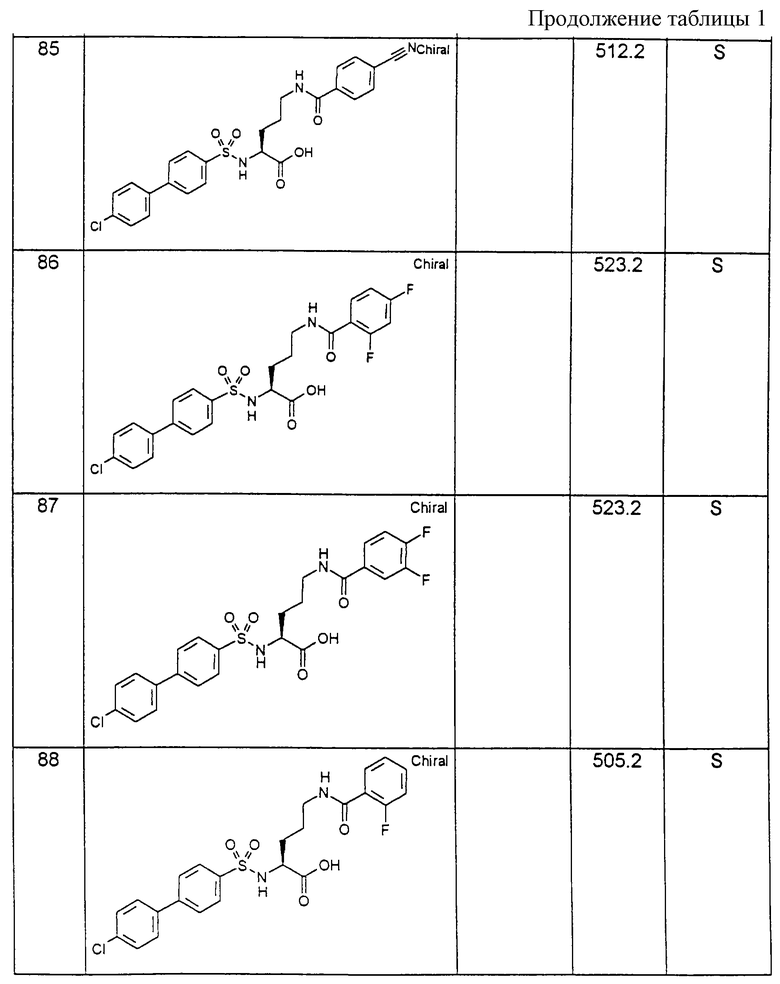
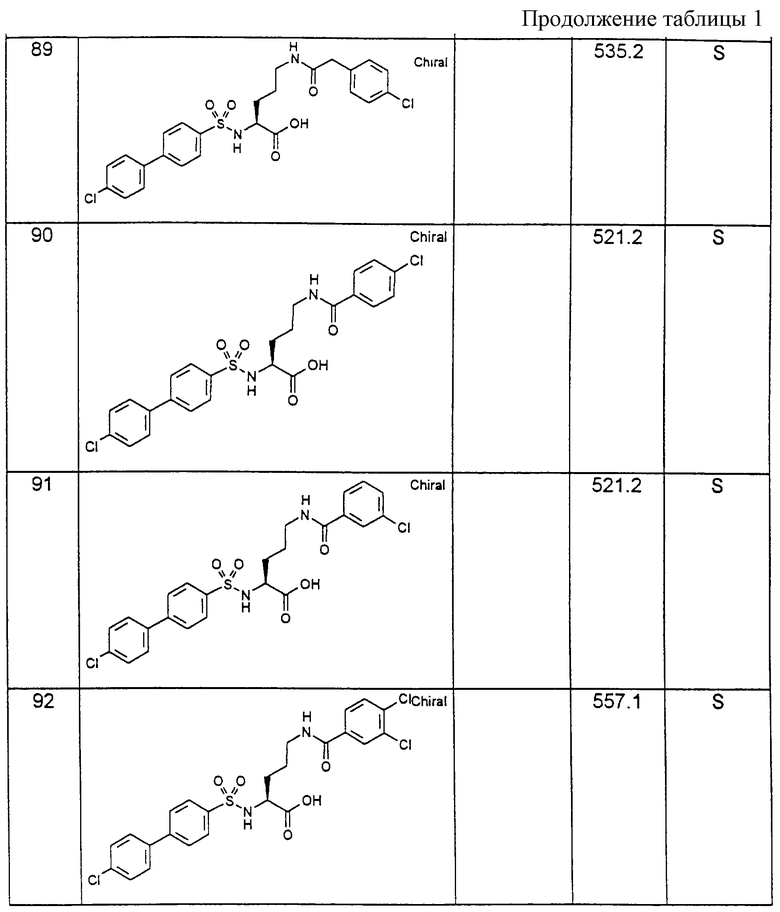
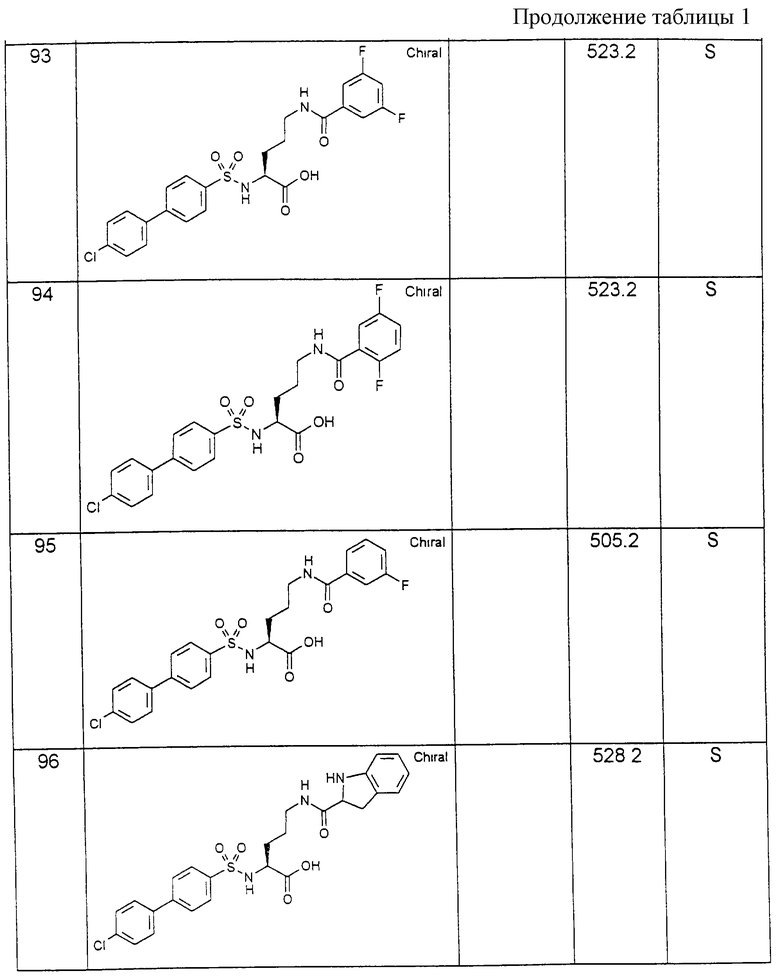
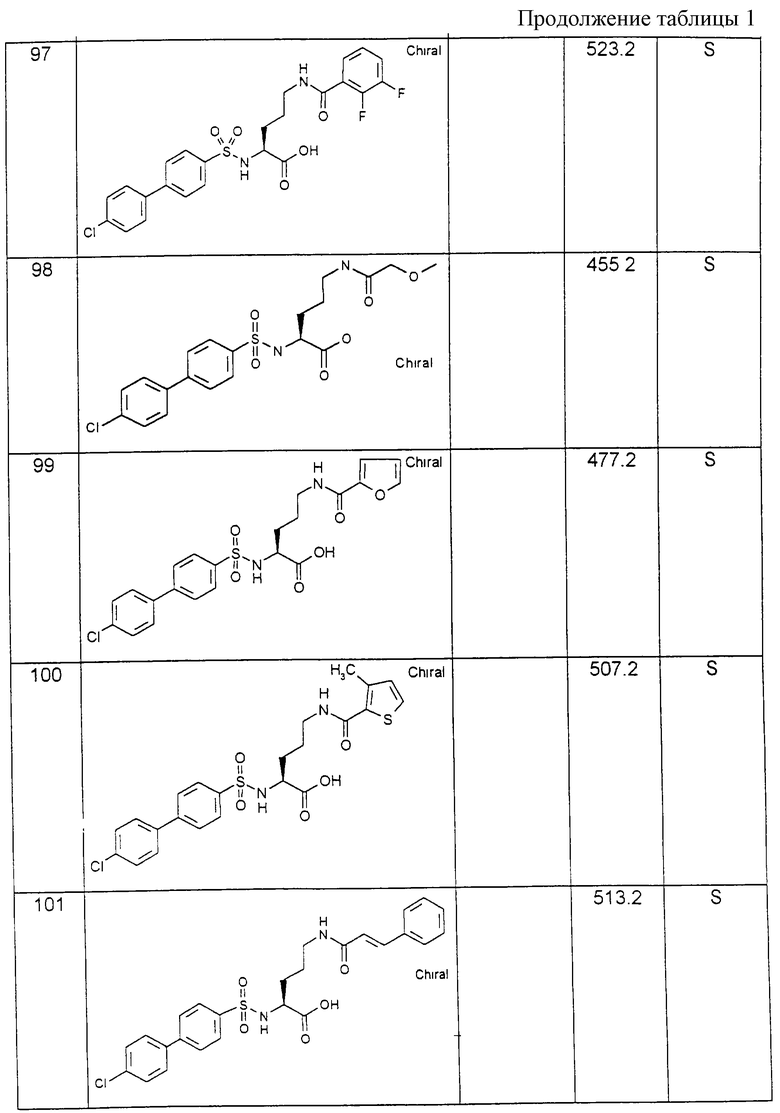
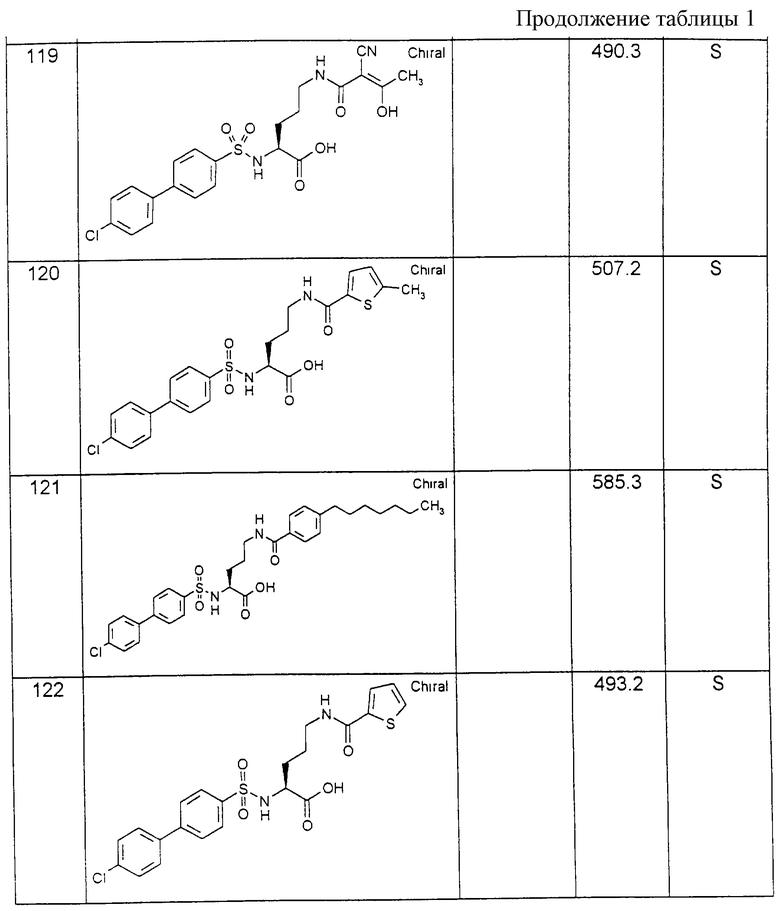
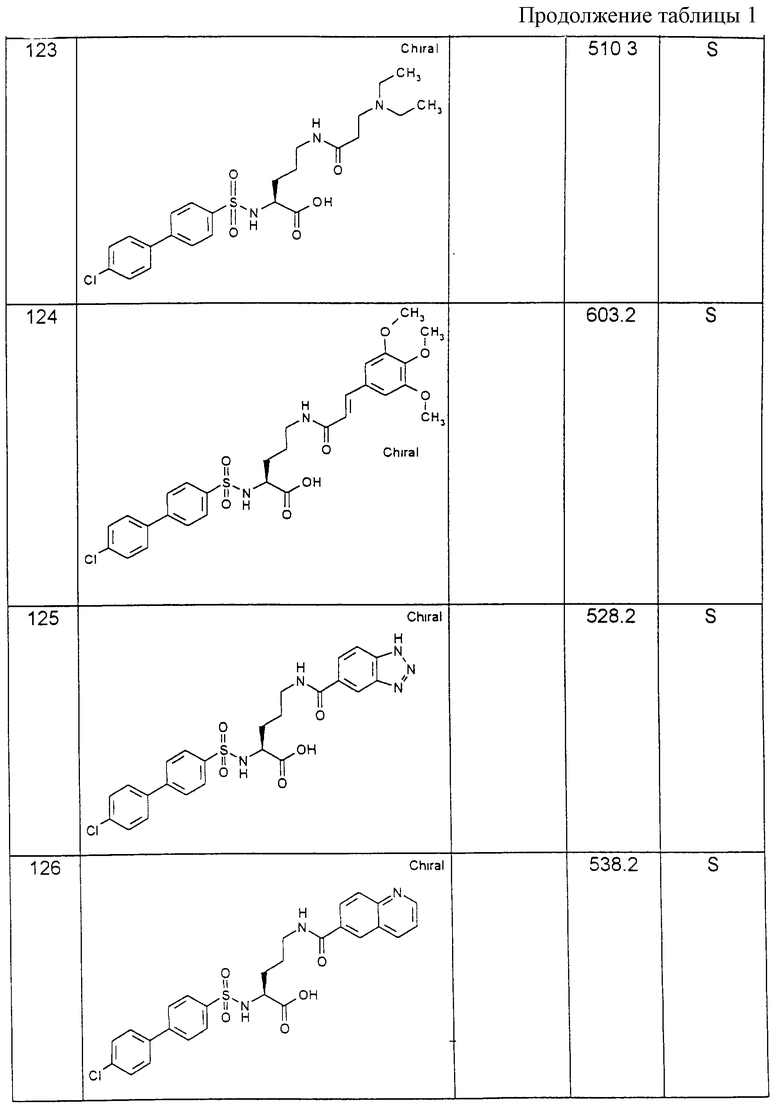
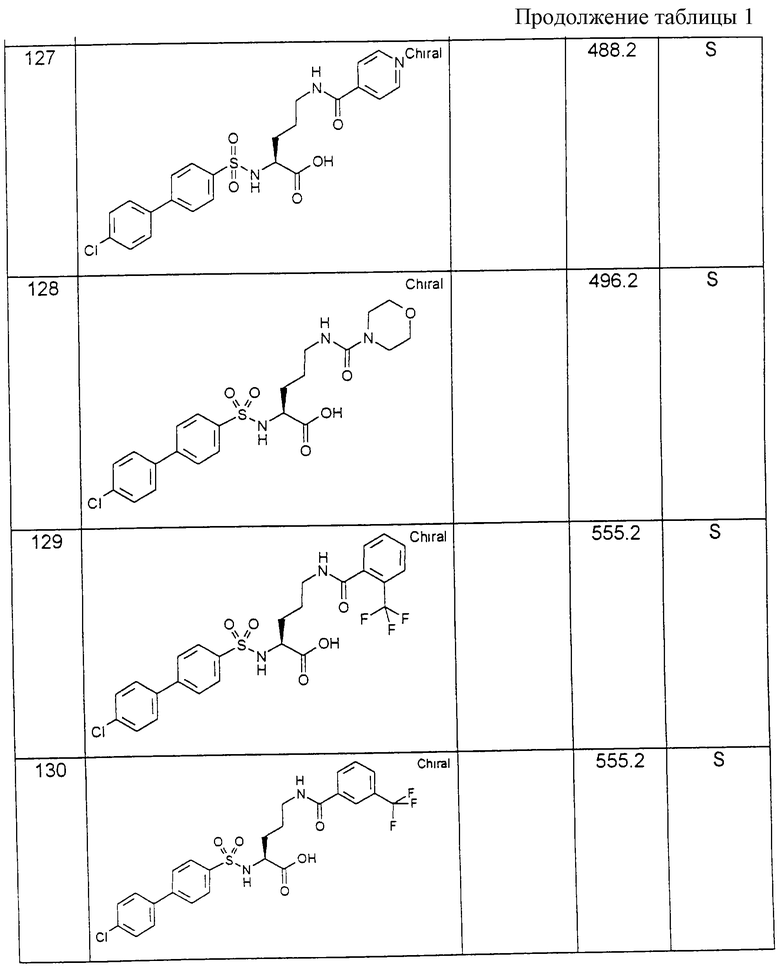
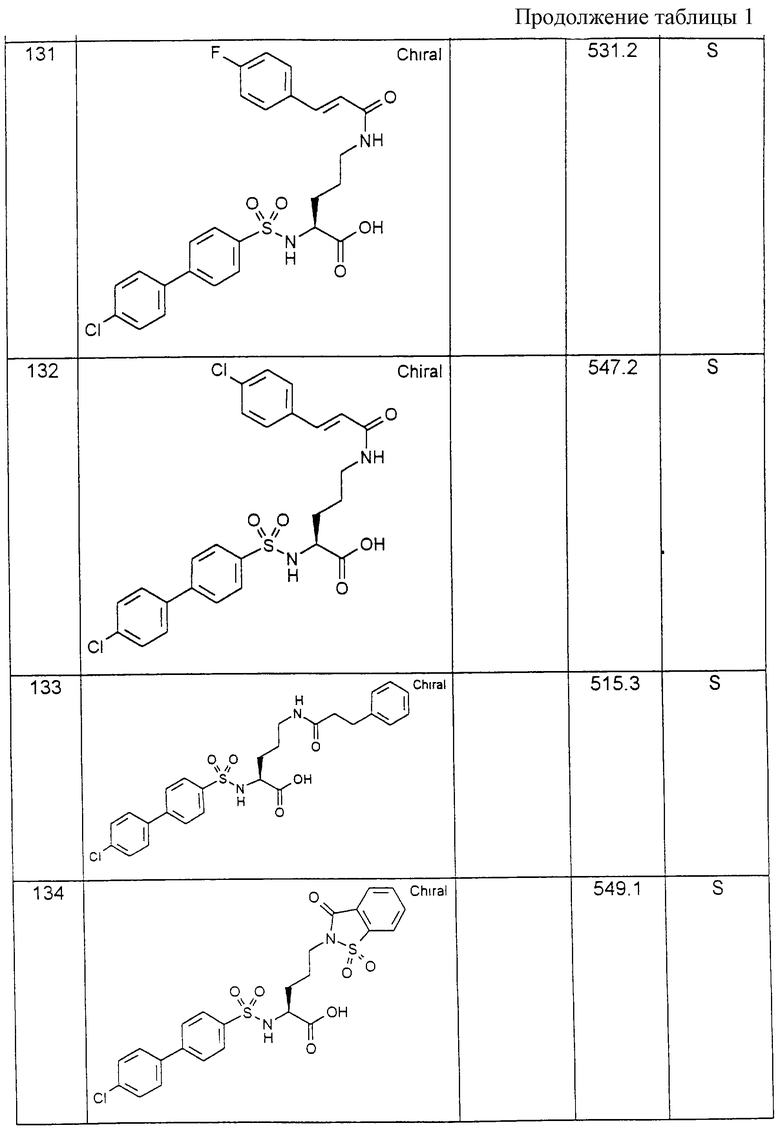
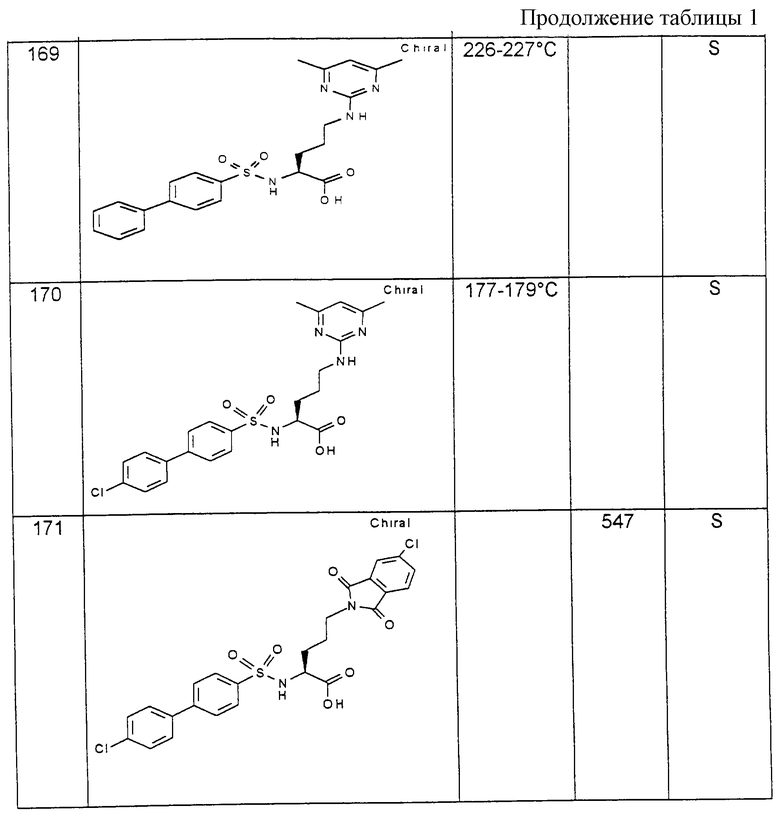
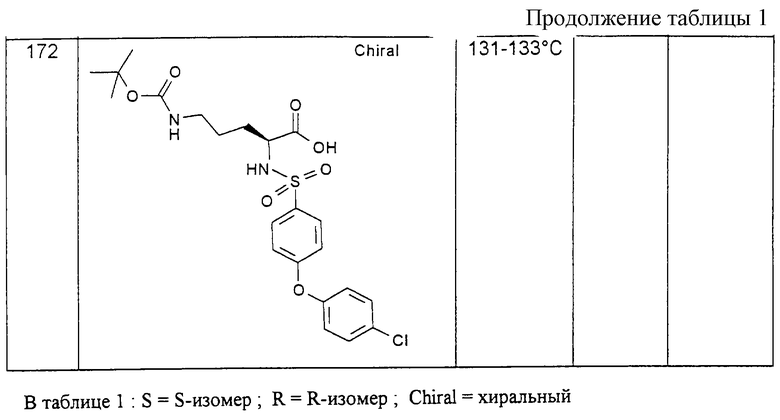
Соединения примеров, указанных в нижеприводимой таблице 1, получают по методикам предыдущих примеров.
Фармакологические примеры
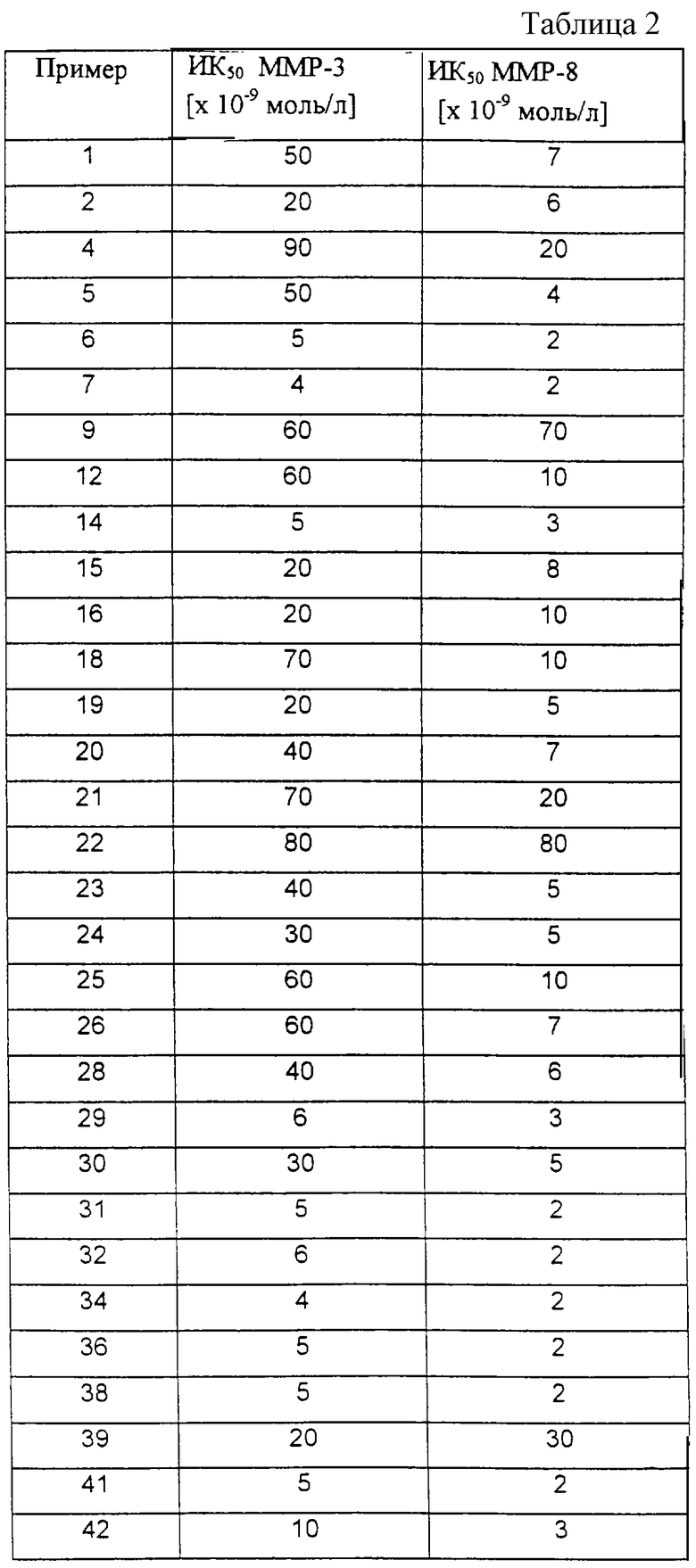
Получение и определение ферментативной активности каталитических доменов человеческого стромелизина и нейтрофидезной коллагеназы
Оба фермента - стромелизин (ММР-3) и нейтрофилезную коллагеназу (ММР-8) получают по способу Ye и др. [Biochemistry, 31, 11231-11235 (1992)]. Для определения ферментативной активности или действия ингибитора фермента 70 мкл буферного раствора и 10 мкл раствора фермента вместе с 10 мкл 10 %-ного (по объему) водного раствора диметилсульфоксида, который при необходимости содержит ингибитор фермента, инкубируют в течение 15 минут. После добавления 10 мкл 10 %-ного (по объему) водного раствора диметилсульфоксида, который содержит 1 ммоль/л субстрата, за ферментной реакцией наблюдают с помощью флуоресцентной спектроскопии (328 нм(еm)/393 нм(еm)).
Ферментативную активность получают в виде увеличения экстинкции в минуту. Указанные в таблице 2 значения ИК50 определяют как такие концентрации ингибитора, которые приводят в каждом случае к 50 %-ному ингибированию фермента.
Буферный раствор содержит 0,05 % Brij (Сигма, Дейзенхофен, Германия), а также 0,1 моль/л Трис-НСl; 0,1 моль/л NaCl; 0,01 моль/л CaCl2 и 0,1 моль/л пиперазин-N,N'-бис[2-этансульфокислоты] (рН = 6,5).
Раствор фермента содержит 5 мкг/мл одного из полученных Ye и др. доменов фермента. Раствор субстрата содержит 1 ммоль/л флюорогенного субстрата (7-метоксикумарин-4-ил)ацетил-Pro-Leu-Gly-Leu-3-(2', 4'-динитрофенил)-L-2,3-диамино-пропионил-Аla-Аrg-NН2 (Бахем, Гейдельберг, Германия).
| название | год | авторы | номер документа |
|---|---|---|---|
| СУЛЬФОНИЛАМИНОКАРБОНОВЫЕ КИСЛОТЫ | 1998 |
|
RU2193027C2 |
| ЗАМЕЩЕННЫЕ 6- И 7-АМИНОТЕТРАГИДРОИЗОХИНОЛИН-КАРБОНОВЫЕ КИСЛОТЫ | 1998 |
|
RU2212405C2 |
| Производные фосфиновых и фосфоновых кислот, способ их получения и фармацевтическая композиция на их основе | 1999 |
|
RU2224762C2 |
| ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ АДГЕЗИИ ЛЕЙКОЦИТОВ И VLA-4-АНТАГОНИСТОВ | 1997 |
|
RU2229296C2 |
| ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ С БИФЕНИЛСУЛЬФОНИЛЬНЫМ ЗАМЕЩЕНИЕМ, ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1998 |
|
RU2242466C2 |
| ЗАМЕЩЕННЫЕ БЕНЗИМИДАЗОЛЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2000 |
|
RU2261248C2 |
| ЦИКЛИЧЕСКИЕ И ГЕТЕРОЦИКЛИЧЕСКИЕ N-ЗАМЕЩЕННЫЕ α-ИМИНОГИДРОКСАМОВЫЕ И КАРБОНОВЫЕ КИСЛОТЫ | 1996 |
|
RU2164914C2 |
| ПРОИЗВОДНЫЕ ГИДРОКСИМЕТИЛФУРАЗАНКАРБОНОВОЙ КИСЛОТЫ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1994 |
|
RU2134687C1 |
| ЗАМЕЩЕННЫЕ ИНДОЛЫ | 2000 |
|
RU2255087C2 |
| СРЕДСТВО ДЛЯ ЗАЩИТЫ КУЛЬТУРНЫХ РАСТЕНИЙ ОТ ФИТОТОКСИЧЕСКОГО ПОБОЧНОГО ДЕЙСТВИЯ ГЕРБИЦИДОВ, N-АЦИЛСУЛЬФОНАМИДЫ | 1997 |
|
RU2182423C2 |






Изобретение относится к замещенным диаминокарбоновым кислотам формулы I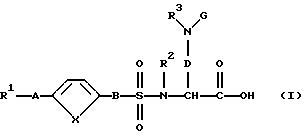
и/или стереоизомерной форме соединения формулы (I), и/или физиологически приемлемой соли соединения формулы (I), где R1 - фенил, фенил, одно- или двукратно замещенный линейным или разветвленным (С1-С7)-алкилом, гидроксилом, группой (С1-С6)-алкил-С(O)-O-, группой (С1-С6)-алкил-О-, галогеном, CN-группой, метилендиоксогруппой; группой R4 - (R5)N-, R2, R4 и R5 являются одинаковыми или разными и означают атом водорода, (С1-С6)-алкил-; R3 и G являются одинаковыми или разными и означают: 1. атом водорода; 2. (С1-С6)-алкил, где алкил является линейным разветвленным, 3. гетероарил - (СН2)m-, где гетероарил представляет собой пиримидин, который незамещен или замещен линейным или разветвленным C1-C7 алкилом, и m = 0, 4. R6-С(O)-, где R6 означает: 4.1. (C1-С6)-алкил, где алкил незамещен или замещен группой R4-(R5)N- или С3-С6 циклоалкилом; 4.2. (С3-С6)-циклоалкил, где циклоалкил незамещен или замещен линейным или разветвленным C1-C7 алкилом или группой R4-(R5)N-C(O); 4.3. (С2-С6)-алкенил, где алкенил незамещен или трехкратно замещен 4.3.1. гетероарилом, который является пиразолом, имидазолом или бензимидазолом, незамещенным или одно-трехкратно замещенным гидроксилом или CN-группой, 4.4. фенил (СН2)m-, где фенил незамещен или одно-трехкратно замещен гидроксилом, C1-С6-алкил-О-галогеном, группой-CN, метилендиоксогруппой, R4-(R5)N-группой, -SO2-NH2, и при необходимости один атом водорода -(СН2)m-остатка замещен остатком -СООН и m = 0, 4.5. нафтил; 4.6. адамантил или 4.7. гетероарил -(СН2)m-, где гетероарил является пирролом, тиазолом, оксазолом, изоксазолом, пиридином, пиримидином, бензимидазолом, бензотриазолом и m = 0, 5. R6-O-C(O)-, где R6 имеет вышеуказанное значение; 6. R6-CH(NH2)-С(О)-, где R6 имеет вышеуказанное значение; 7. R8-N(R7)-C(O)-, где R8 означает: 7.1. атом водорода; 7.2. (С1-С6)-алкил; где R7 означает водород или (С1-С6)-алкил; 8. R6-SO2-, где R6 имеет вышеуказанное значение; 9. R6-SO2-N(R7)-С(О)-, где R6 и R7 имеют вышеуказанные значения; R3 и G вместе с атомом азота, с которым они связаны, образуют циклы частичных формул
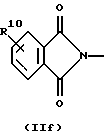
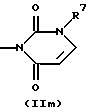
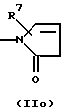
или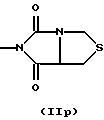
и R7 имеет вышеуказанное значение; А означает: а) ковалентную связь, б) -О-; В - -(СН2)m-, где m имеет вышеуказанное значение; или D означает -(СН2)m-, где m - 1, 2, 3, 4, 5 или 6; X - -СН=СН-. Соединения I являются сильными ингибиторами матричных металлопротеиназ, таких как стромелизин и нейтрофилезная коллагеназа. Соединения I получают из аналогичных соединений, где группа СООН заменена на группу COOR9, где R9 - фенил, C1-С6 алкил. Соединения I являются сильными ингибиторами матричных металлопротеиназ и могут быть использованы в качестве лекарственного средства. 2 с. и 1 з.п.ф-лы, 2 табл.
и/или стереоизомерная форма соединения формулы (I), и/или физиологически приемлемая соль соединения формулы (I),
где R1 означает: 1. фенил, 2. фенил, одно- или двукратно замещенный линейным или разветвленным (С1-С7) -алкилом, гидроксилом, группой (C1-C6)-алкил-С(О)-О-, группой (C1-C6)-алкил-O-, галогеном, CN-группой, метилендиоксогруппой, группой R4- (R5)N-;
R2, R4 и R5 являются одинаковыми или разными и означают атом водорода, (C1-C6)-алкил;
R3 и G являются одинаковыми или разными и означают: 1. атом водорода, 2. (C1-C6)-алкил, где алкил является линейным или разветвленным, 3. гетероарил-(СН2)m, где гетероарил представляет собой пиримидин, который незамещен или замещен линейным или разветвленным (С1-С7)-алкилом и m= 0, 4. R6-C(O)-, где R6 означает: 4.1 (C1-C6)-алкил, где алкил незамещен или замещен группой R4-(R5)N- или (С3-С6)-циклоалкилом, 4.2 (С3-C6)-циклоалкил, где циклоалкил незамещен или замещен линейным или разветвленным (С1-C7)-алкилом или группой R4-(R5)N-C(O), 4.3 (C2-C6)-алкенил, где алкенил незамещен или одно-трехкратно замещен 4.3.1 гетероарилом, который является пиразолом, имидазолом или бензимидазолом, незамещенным или одно-трехкратно замещенным гидроксилом или CN-группой, 4.4 фенил-(СН2)m-, где фенил незамещен или одно-трехкратно замещен гидроксилом, (C1-C6)-алкил-O, галогеном, группой -CN, метилендиоксогруппой, R4-(R5)N-группой, SO2-NH2, и в случае необходимости один атом водорода -(СН2)m-цепи замещен остатком -СООН и m= 0, 4.5 нафтил, 4.6 адамантил или 4.7 гетероарил-(СН2)m-, где гетероарил является пирролом, тиазолом, оксазолом, изоксазолом, пиридином, пиримидином, бензимидазолом или бензотриазолом и m= 0; 5. R6-O-C(O)-, где R6 имеет вышеуказанное значение; 6. R6-CH(NH2)-C(O) -, где R6 имеет вышеуказанное значение; 7. R8-N(R7)-C(O)-, где R8 означает: 7.1 атом водорода, 7.2 (С1-С6)-алкил; R7 - водород или (C1-C6)-алкил; 8. R6-SO2-, где R6 имеет вышеуказанное значение; 9. R6-SO2-N(R7)-С(О)-, где R6 и R7 имеют вышеуказанные значения;
R3 и G вместе с атомом азота, с которым они связаны, образуют циклы частичных формул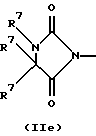

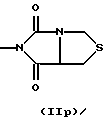
где R7 имеет вышеуказанное значение,
А означает: а) ковалентную связь; б) -О-;
В - (СН2)m, где m имеет вышеуказанное значение,
D - (СН2)m, где m= 1, 2, 3, 4, 5 или 6,
Х - группа -СН= СН-.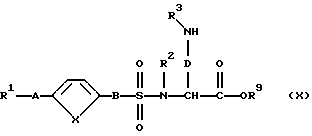
и/или стереоизомерная форма соединения формулы (X), и/или физиологически приемлемая соль соединения формулы (X), причем R1, А, X, В, R2, R3 и D имеют указанное для соединения формулы (I) по п. 1 значение, R9 - атом водорода, (C1-C6)-алкил, фенил.
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Прибор для определения упругих свойств трикотажа и т.п. | 1940 |
|
SU60646A1 |
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - Вильнюс, 1994, т.2, с.383. | |||
Авторы
Даты
2003-01-20—Публикация
1998-05-08—Подача