Изобретение относится к вариантам апротинина, которые являются лучшими ингибиторами ферментов, обладают улучшенными иммунологическими и фармакокинетическими свойствами.
Апротинин, который также обозначается как ингибитор трипсина поджелудочной железы быка, относится к семейству ингибиторов сериновых протеаз типа Кунитца. Спектр ингибируемых сериновых протеаз включает, например, трипсин, химотрипсин, плазмин и калликреин плазмы (W. Gebhard, H. Tschesche и Н. Fritz, Ингибиторы протеиназ. Barrett: и Salvesen (изд.), Elsevier Science Publ. BV 375-387, 1986).
Апротинин состоит из 58 аминокислот. Трехмерная структура белка была установлена с помощью рентгеноструктурного анализа и ЯМР-спектроскопии (Wlodawer и др., J.Mol. Biol. 198(3), 469-480, 1987; Wagner и др., J. Mol. Biol. 196(1), 227-231, 1987; Berndt и др.. Biochemistry 32 (17), 4564-4570, 1993).
Под торговым названием Трасилол® природный апротинин издавна применяется для лечения панкреатита. Сейчас Трасилол® используется при хирургии сердца, после того, как клинические исследования показали, что обработка апротинином существенно снижает потребность в переливании крови при подобных операциях и приводит к уменьшению вторичных кровотечений (D. Royston, J. Cardiothorac. Vasc. Anesth. 6, 76-100, 1992).
Удалось показать, что замена ответственной за специфичность ингибирования аминокислоты в положении 15 приводит к ценным вариантам апротинина с улучшенными ингибиторными свойствами (немецкий патент DE 3339693). В зависимости от введенной аминокислоты можно таким способом получить активные ингибиторы, которые, например, ингибируют эластазу из поджелудочной железы или из лейкоцитов.
Далее было показано, что ингибиторные свойства апротинина и полученных при замене в положении 15 вариантов определяют также и с помощью других аминокислотных остатков в месте контакта подвергающейся ингибированию целевой протеазы и молекулы ингибитора. Сюда относятся прежде всего дополнительные аминокислотные остатки в положениях 14, 16, 17, 18, 19, 34, 38 и 39. Варианты апротинина с улучшенными свойствами, полученные в результате замены одного или нескольких из этих аминокислотных остатков в области контакта, были среди прочего описаны, например, в следующих материалах: международная заявка на патент WO 89/01968, международная заявка на патент WO 89/10374, европейская заявка на патент ЕР 0307592, европейская заявка на патент ЕР 683229.
Интересным способом могли быть улучшены фармакокинетические свойства апротинина и его вариантов путем замены аминокислот, определяющих физико-химические свойства вещества. Так, удалось путем снижения общего положительного заряда молекулы значительно уменьшить связывание почками. Такие варианты были описаны в международной заявке на патент WO 92/06111.
На основании лучших технических возможностей получения выгодно в определенных случаях предпринять модификацию N-конца молекулы ингибитора. Такие модификации могут укорачивать N-концы, или удлинять, или приводить к удалению одной или нескольких аминокислот. Модифицированные по N-концу варианты апротинина были описаны в европейской заявке на патент ЕР 419878.
Целью изобретения является получение варианта апротинина с улучшенными свойствами.
Цель достигается предложенным вариантом апротенина с общим зарядом от +3 до -3 при рН 7 и с аминокислотами Arg15 или Arg15-Ala17 в участке связывания.
Желательно, чтобы вариант апротинина использовался для ингибирования сериновых протеаз.
Предпочтительно, чтобы вариант апротинина имел измененную N-концевую последовательность и удлинение или укорочение по N-концу или удлиненные аминокислоты при N-конце.
Аминокислотная последовательность, например, для некоторых вариантов представлена на чертеже.
Цель также достигается предложенным вариантом апротинина, выбранным из группы дез-Рrо2-Sеr10-Arg15-Аlа17-Аsр24-Тhr26-Glu3 l-Asn41-Glu53-апротинина, дез-Рrо2-Sеr10-Arg15-Asp24-Thr26-Glu3 l-Asn41-Glu53-апротинина, дез-Рrо2-Sеr10-Arg 15-Ser17-Asp24-Thr26-Glu31-Asn41-Glu53 -апротинина, дeз-Pro2-Ser10-Argl 5-Ala17-Thr26-Glu3 l-Asn41-Glu53-апротинина, дез-Рrо2-Sеr10-Аrg15-Ala17-Asp24-Thr26-Asn41 -Glu53-апротинина, Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина Ser10-Arg15-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина Ser10-Arg15-Ser17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина, Ser10-Arg15-Alal7-Thr26-Glu31-Аsn41-Glu53-апротинина и Ser10-Arg15-Ala17-Asp24-Thr26-Asn41-Glu53-апротинина.
Эти варианты апротинина могут также иметь аминокислоту пролин в положении 2.
Варианты апротинина согласно изобретению, однако, не ограничиваются указанными на чертеже примерами. К вариантам апротинина по изобретению относятся также варианты с удлинением по N-концу Аlа(-2)-Gln(-l), с остатком природной аминокислоты пролина в положении 2, с заменой других аминокислот, которые имеют положительный заряд по отношению к нейтральным или имеющим отрицательный заряд аминокислотным остаткам, или с заменой других нейтральных аминокислот по отношению к отрицательно заряженным аминокислотным остаткам. Выбор замены аминокислотных остатков осуществляют при этом по такому принципу, чтобы получаемое вещество обладало при физиологическом значении рН уменьшенным общим положительным зарядом, предпочтительно в области от +2 до -2. Упомянутые изменения в аминокислотной последовательности, включая удлинение, или укорочение, или удаление N-конца, могут использоваться в любых комбинациях друг с другом. К вариантам апротинина согласно изобретению относятся, таким образом, все соединения, для которых характерна комбинация вышеназванных признаков и которые обладают при физиологическом значении рН сниженным общим положительным зарядом.
Варианты апротинина имеют следующие признаки:
1. Замена одной или нескольких аминокислот в активном центре молекулы для повышения активности.
2. Замена аминокислот для понижения общего положительного заряда с целью улучшения иммунологических и фармакокинетических свойств.
3. Модификация N-концевой аминокислотной последовательности на основании технических возможностей получения.
Неожиданно было обнаружено, что комбинация двух или трех названных признаков ведет не только к получению, но частично даже к усилению четко выраженных отдельных признаков. В добавление к этому, могли быть проявлены новые свойства веществ, которые, например, относятся к иммунологическим, фармакокинетическим и поверхностным свойствам соединений. Новые варианты проявляют пониженную реактивность по отношению к поликлональным человеческим и кроличьим антисывороткам, которые получались при использовании апротинина. Далее, было найдено, что новые варианты ведут себя как менее активные иммуногены по сравнению с апротинином, то есть они вызывают пониженный иммунный ответ. Далее, было показано, что варианты согласно изобретению индуцируют незначительное высвобождение гистамина из клеток крови. Далее, новые варианты четко показали незначительное аккумулирование в почках по сравнению с апротинином. Кинетические константы ингибирования фермента (значения Ki) неожиданно были улучшены, несмотря на большое число изменений в молекуле по отношению к первоначальным вариантам молекулы.
Предпочтительны варианты, которые имеют общий заряд от +2 до -2, особенно предпочтительны с зарядом от +1 до -1.
Описанные новые ингибиторы протеиназ пригодны для лечения болезненных состояний, при которых, а также вследствие комплексных хирургических операций, как, например, при хирургии сердца или аллоартопластической замене суставов в трансплантационной медицине, это годится для активирования плазматических ферментных систем благодаря продолжительному или интенсивному контакту крови с чужеродной поверхностью.
Ингибиторы понижают кровопотерю при операциях, связанных с повышенным риском кровотечения (например, операции на сердце, хирургия костей и суставов). Они пригодны для терапии при шоке, множественных травмах и черепно-мозговых травмах, сепсисе, дессеминированной внутрисосудистой коагулопатии, поражении многих органов, воспалительных заболеваниях с участием системы калликреина, как, например, ревматические заболевания суставов, и астме. Они предотвращают инвазивный рост опухолей и метастазирование вследствие ингибирования плазмина. Они также пригодны для терапии болей и отеков благодаря ингибированию синтеза брадикинина, а также для лечения инсультов.
Они также полезны при терапии диализом и при искусственных органах для предотвращения воспалений и коагуляции и для уменьшения риска кровотечений.
Для получения вариантов апротинина согласно изобретению удобно использовать способы генной инженерии. Для этого с помощью общепринятых молекулярно-биологических способов вводят в подходящий микробный экспрессионный организм генно-инженерную информацию для синтеза в каждом определенном случае рассматриваемых вариантов апротинина. Рекомбинантный микроорганизм подвергают ферментации; путем выбора подходящих условий доставляют гетерологическую наследственную информацию для экспрессии. Экспримированные варианты апротинина получают по окончании из культурального бульона.
Подходящие организмы-хозяева для продуцирования вариантов апротинина согласно изобретению могут быть бактериями, дрожжами или грибами. Экспрессия может происходить внутриклеточно или внеклеточно при использовании подходящих секреторных систем. Варианты апротинина могут при правильной обработке или соединении быть экспримированы в пептидах или белках.
Подходящие системы для экспрессии вариантов апротинина были описаны в европейской заявке на патент ЕР 683229, в международных заявках на патент WO 89/02463, WO 90/10075 и в различных других, уже упомянутых выше патентных заявках.
Ферменты
Используемые ферменты (рестрикционные эндонуклеазы, щелочные фосфатазы из кишечника теленка, полинуклеотидкиназа фага Т4 и ДНК-лигаза фага Т4) были получены от фирм Берингер Маннхайм и ГИБКО, Бразилия, и применены согласно предписанию изготовителя.
Молекулярнобиологические методики
Обычные операции клонирования, как, например, выделение плазмидной ДНК из Е. coli (так называемая миниподготовка) и трансформацию Е. coli с помощью плазмидной ДНК осуществляли по Sambrook и др. (Молекулярное клонирование, Колд Спринг Харбор, 1989). В качестве организма-хозяина для трансформаций вводили штамм DH5α бактерий Е. coli (ГИБКО, Бразилия). Для выделения больших количеств плазмидной ДНК использовали Qiagen-концы (Qiagen). Экстракцию фрагментов ДНК из агарозных гелей проводили с помощью струйной сорбции в соответствии с указаниями изготовителя (Геномед).
Олигонуклеотиды для экспериментов с сайт-специфическим мутагенезом и праймер для полимеразной цепной реакции и секвенирующей реакции были получены с помощью "ДНК-синтезатора 380 А" фирмы Эплайд Байесистемс. Исследования мутагенеза проводились по способу Deng и Nickoloff (Deng и др. Anal. Biochem. 200. 81-88, 1992) при использовании набора фирмы Фармация Байетек (" Уникальный сайт - элиминационный мутагенез"). Все векторные конструкции и эксперименты по мутагенезу были подтверждены с помощью цикла секвенирования ДНК Taq с применением терминаторов с флюоресцирующей меткой на "Секвенаторе ABI 373 А" (Эплайд Байесистемс).
Трансформация Saccharomyces cerevisiae
Клетки дрожжей, например штамма JC34. 4D (МАТα, ura3-52, suc2), помещали в 10 мл YEPD (2% глюкоза; 2% пептон; 1% дрожжевой экстракт Difco) и получали значения оптической плотности от 0,16 до 0,8 при 600 нм. Клетки промывали 5 мл раствора А (1М сорбит, 10 мМ бицин, рН 8,35; 3% этиленгликоль), повторно суспендировали в 0,2 мл раствора А и выдерживали при -70oС.
К замороженным клеткам прибавляли плазмидную ДНК (5 мкг) и ДНК-носитель (5 мкг ДНК из спермы сельди). Клетки затем размораживали при встряхивании в течение 5 минут при 37oС. После прибавления 1,5 мл раствора Б (40% полиэтиленгликоль 1000; 200 мМ бицин, рН 8, 35) клетки инкубировали в течение 60 минут при 30oС, промывали 1,5 мл раствора В (0,15М хлористый натрий; 10 мМ бицин, рН 8,35) и заново суспендировали в 100 мкл раствора В. Выращивание осуществляли на селективной среде с 2% агара. Трансформанты получали после инкубирования в течение 3 дней при 30oС.
Питательные среды для ферментации
1. Среда SD2:
Бактодрожжевое азотистое основание - 6,7 г/л
Глюкоза* - 20 г/л
Первичный кислый фосфат калия - 6,7 г/л - рН 6,0
2. Среда SC5:
Глюкоза* - 20 г/л
Дрожжевой экстракт Difco - 20 г/л
Первичный кислый фосфат калия - 6,7 г/л
Сернокислый аммоний - 2,0 г/л
Сульфат магния гептагидрат - 1,0 г/л
Раствор микроэлементов SL4 - 1,0 г/л - рН 6,0
Раствор микроэлементов SL4:
Титриплекс III - 5 г/л
Сульфат железа(2) гептагидрат - 2 г/л
Сульфат цинка гептагидрат - 0,1 г/л
Двухлористый марганец тетрагидрат - 0,03 г/л
Ортоборная кислота - 0,3 г/л
Хлористый кобальт гексагидрат - 0,2 г/л
Хлористая медь(2) дигидрат - 0,01 г/л
Хлористый никель(2) гексагидрат - 0,02 г/л
Молибдат натрия дигидрат - 0,03 г/л
* = автоклавирутот раздельно
3. Среда в ферментере:
Глюкоза* - 2,0 г/л
Соевый пептон - 25,0 г/л
Первичный кислый фосфат калия - 1,4 г/л
Сульфат магния гептагидрат - 1,0 г/л
Тиаминхлорид - 5,1 мг/л
Инозит - 20 мг/л
Раствор микроэлементов - 3 мл/л
Раствор витаминов - 3 мл/л
Сернокислый аммоний - 3,8 г/л - рН 5,5
Питательный раствор:
Глюкоза* - 530 г/л
Сернокислый аммоний - 5,0 г/л
Первичный кислый фосфат калия - 2,9 г/л
Сульфат магния гептагидрат - 3,8 г/л
Тиаминхлорид - 13 мг/л
Инозит - 70 мг/л
Раствор микроэлементов - 6,8 мл/л
Раствор витаминов - 6,8 мл/л
Раствор микроэлементов:
Хлорид железа(3) гексагидрат - 13,5 г/л
Хлорид цинка тетрагидрат - 2,0 г/л
Ортоборная кислота - 0,5 г/л
Хлористый кобальт гексагидрат - 2,0 г/л
Сульфат меди(2) пентагидрат - 1,9 г/л
Молибдат натрия дигидрат - 2,0 г/л
Хлористый кальций дигидрат - 1,0 г/л
Концентрированная соляная кислота - 100 мл/л
* = автоклавируют раздельно
Раствор витаминов:
Рибофлавин - 0,42 г/л
Пантотенат кальция - 5,9 г/л
Никотиновая кислота - 6,1 г/л
Пиридоксин гидрохлорид - 1,7 г/л
Биотин - 0,06 г/л
Фолиевая кислота - 0,04 г/л
Получение рабочих сохраняющихся составов
200 мл среды SD2 засевали до 1% в колбе Эрленмейера емкостью в 1 л сохраняющимся штаммом. Культуру инкубировали 72 часа при 28oС на качалке со встряхиванием (260 об/мин). Затем помещали по 2 мл в сосуды для сохраняющихся составов и замораживали в жидком азоте.
Ферментация в колбах при встряхивании
В качестве предварительной культуры 200 мл среды SD2 в колбе емкостью 1 л засевали до 1% рабочим сохраняющимся составом и подвергали ферментации в течение 72 часов при 28oС на качалке со встряхиванием (260 об/мин). Вместе с предварительной культурой засевали также до 1% главными культурами (200 мл среды SC5 в колбе емкостью 1 л) и инкубировали 72-96 часов при встряхивании при 28oС.
Ферментация в биореакторах емкостью 10 л
В качестве предварительной культуры 200 мл среды SD2 засевали до 1% рабочим сохраняющимся составом в колбе емкостью 1 л и подвергали ферментации в течение 72 часов при 28oС на качалке со встряхиванием (260 об/мин). Основную культуру в ферментере подвергали ферментации с периодической подпиткой в течение 96 часов. В качестве питательной среды использовали среду для ферментера, начальный объем составлял 7 л. В ферментер засевали 200 мл предварительной культуры.
Условия ферментации:
Температура: 28oС
Число оборотов мешалки: 500 об/мин
Аэрация: 10 л/мин
рН: 5,5
Давление в незаполненном пространстве в верхней части: 200 мбар. После 7 часов ферментации начинали подпитку. Скорость подпитки регулировали с помощью дыхательного коэффициента (ДК) (дыхательный коэффициент = образовавшийся углекислый газ/потребленный кислород). Если ДК поднимался до значения > 1,15, скорость подпитки уменьшали, если он падал до значений <1,05, скорость подпитки увеличивали.
Через регулярные промежутки времени отбирали пробы из ферментера и определяли рост клеток путем измерения оптической плотности при 700 нм. Кроме этого, определяли концентрацию вещества "Bay 19-8757" в надосадочной жидкости путем измерения активности.
К концу ферментации рН понижали до 3,0 при прибавлении 50% (в/о) лимонной кислоты и ферментер нагревали 10 минут при 70oС. Затем клетки отделяли центрифугированием при 7500•g и надосадочную жидкость направляли на очистку белка.
Материалы для проведения химического анализа белка
Анализы последовательностей проводили с помощью секвенатора белков модели 473А фирмы Эплайд Байесистемс (Форстер Сити, США). Использовалась стандартная программа секвенирования. Секвенатор, различные программы секвенирования, а также система детектирования фенилтиогидантоина (ФТГ) описаны в деталях в справочном руководстве (Руководство по использованию модели 473 А системы секвенирования белка (1989). Фирма Эплайд Байесистемс, Форстер Сити, Калифорния 94404, США).
Реагенты для работы секвенатора и колонки для высокоэффективной жидкостной хроматографии (ВЭЖХ) для детектирования ФТГ получали от фирмы Эплайд Байесистемс.
Анализы с применением ВЭЖХ проводили с помощью ВЭЖХ-системы HP 1090 фирмы Хьюлетт Паккард (Вальдбронн, Германия). Для разделения была использована колонка с обращенной фазой RP-18 для ВЭЖХ (250 мм • 4,6 мм, материал 5 мк, диаметр пор 300 ангстрем) фирмы Бакербонд (Германия, Гросс Герау).
Модель 270 А-НТ для капиллярного электрофореза была от фирмы Эплайд Байесистемс (Форстер Сити, Калифорния 94404, США). Пробы инжектировали обычно гидродинамически через различные интервалы времени. Использовали капиллярную колонку (50 мкм • 72 см) фирмы Эплайд Байесистемс.
Анализы аминокислот проводили с помощью аминокислотного анализатора LC 3000 фирмы Еппендорф Биотроник (Германия, Майнталь). Использовалась легко модифицируемая стандартная программа разделения фирмы Биотроник. Программа для разделения и функция анализатора подробно описаны в руководстве к прибору.
Молекулярные веса определяли с помощью системы MALDI I фирмы Кратос/ Шимадзу (Германия, Дуйсбург). Электрофорез с использованием додецилсульфата натрия проводили с помощью системы для электрофореза фирмы Фармация (Германия, Фрайбург).
Определение кинетических данных проводили с помощью считывателя с планшетов для титрования микроорганизмов фирмы SLT (Германия, Крайлсхайм). Промывку планшетов для титрования проводили с помощью аппарата для промывки фирмы Динатек (Германия, Денкендорф).
Ферменты и субстраты были от фирмы Кэлбайекем (Германия, Бад Соден). Все остальные химикаты и реагенты были от фирмы Мерк (Германия, Дармштадт) или Сигма (Германия, Дайзенхофен). 96-ячеечные планшеты получали от фирмы Грайнер.
Поликлональные кроличьи антитела против апротинина вырабатывались у кроликов при иммунизации апротинином. Поликлональные антитела человека против апротинина получали от больных, которым давали апротинин.
Проведение химического анализа белка
Анализ N-концевой последовательности
На пластину секвенатора помещали 1-3 нмоля растворенного в воде ингибитора протеазы, предварительно проинкубированного с полибреном (гексадиметринбромидом). Белок подвергали секвенированию с помощью почти нормального секвенаторного цикла. ФТГ-аминокислоты идентифицировали с помощью 50 пмолей ФТГ-стандарта при использовании ВЭЖХ.
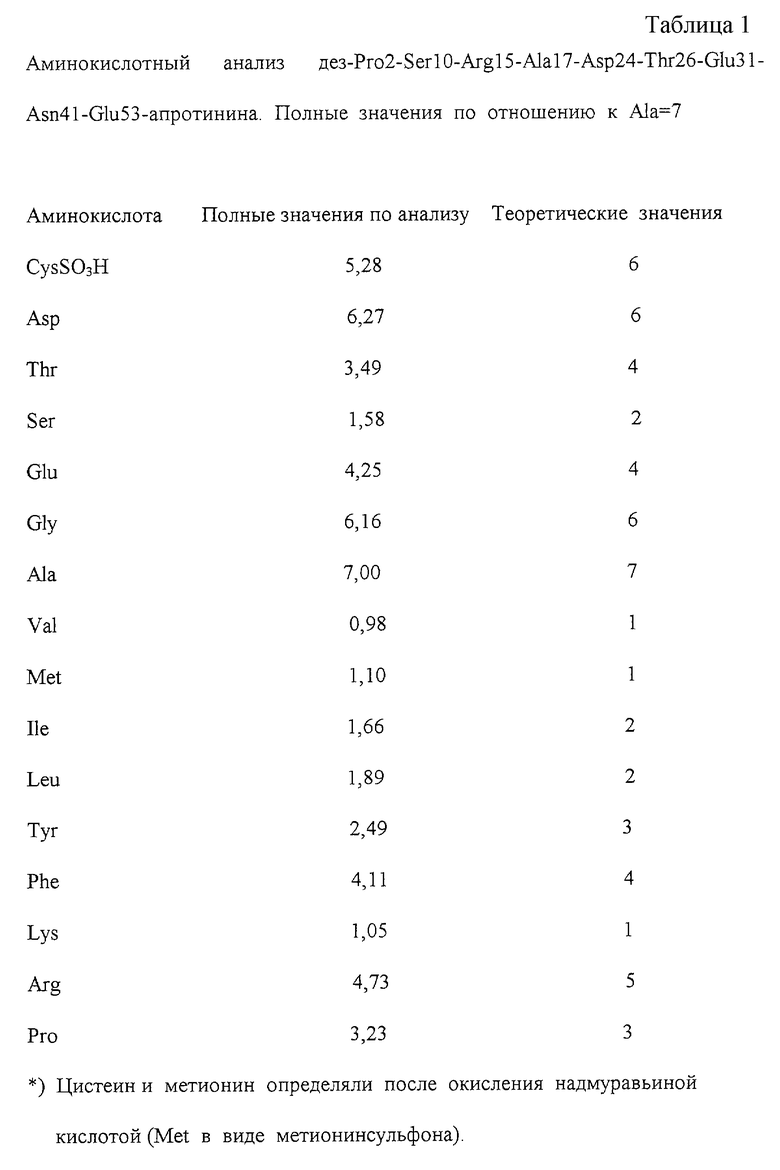
Аминокислотный анализ
200 мкг белка растворяли в 200 мкл 6 н. соляной кислоты и подвергали гидролизу в течение 1 часа при 166oС. Около 1 нмоля пробы прибавляли в аминокислотный анализатор. Количество аминокислоты определяли по отношению к 5 нмолям стандарта.
Электрофорез в геле с использованием додецилсульфата натрия
Электрофорез в геле с использованием додецилсульфата натрия проводили согласно Laemmli. Анализировали 10 мкг ингибитора протеазы с использованием 10-20%-ного геля в присутствии додецилсульфата натрия и проявляли при окрашивании серебром (Merril и др.).
U. K. Laemmli, Nature 227, 680-685 (1970). C.R. Merril, M.L. Dunau, D. Goldmann, Anal. Biochem. 100: 201-207 (1981).
Капиллярный электрофорез
8 нг ингибитора протеазы исследовали с помощью капиллярного электрофореза в стеклянной колонке (длина 72 см, внутренний диаметр 50 мкм). Условия: сила тока 90 мкА, температура колонки 25oС, 100 нМ фосфатный буфер, рН 3,0, детектирование при 210 нм, подача под давлением в течение 3 секунд.
Обращенно-фазовая хроматография
5 нмолей ингибитора протеазы хроматографировали на колонке для ВЭЖХ RP-18 фирмы Бакербонд (материал 5 мк, 4,6 нм • 250 мм, размер пор 300 ангстрем). В качестве элюента использовали градиент ацетонитрила/трифторуксусной кислоты. Условия: поток 0,7 мл/мин, температура колонки 40oС, детектирование при 40oС, растворитель А, 0,1% трифторуксусная кислота, растворитель Б, 0,1% трифторуксусная кислота/ 60% ацетонитрил; градиент: 0 мин 0% Б, 10 мин 0% Б, 70 мин 100% Б, 80 мин 0%Б.
Определение молекулярного веса
1 мкг ингибитора протеазы анализировали по методике MALDI. В качестве матрицы использовали синапиновую кислоту. Стандартами белков для калибровки массы служили инсулин крупного рогатого скота, цитохром С и мелиттин.
Содержание белка
Содержание белка определяют по способу с использованием бицинхониновой кислоты (БЦК-способ). При этом способе присутствующие в белке ионы двухвалентной меди превращают в ионы одновалентной меди, которые образуют комплекс с бицинхониновой кислотой, поглощающий при 560 нм.
Лиофилизированный белок доводят до состояния равновесной влажности и готовят раствор с концентрацией 1 мг/мл в 0,9% -ном растворе хлористого натрия. Приготавливают ряд разведении. К 50 мкл испытуемого раствора прибавляют 1000 мкл реагента БЦК для анализа (Pierce), пробирку плотно закрывают пробкой и инкубируют ровно 30 минут при 60oС. После охлаждения пробы в бане со льдом в течение 5 минут проводят измерение при температуре 25oС и длине волны 560 нм.
Активность: (тест ингибирования трипсина, титрометрический)
Активность определяли согласно модифицированному F.I.P.-тесту ингибирования трипсина. Вещество "Bay у 19-8757" ингибирует катализируемый трипсином гидролиз этилового эфира Nα-бензоил-L-аргинина (БАЭЭ). Образующиеся при реакции свободные карбоксильные группы определяются при титровании щелочью. Остаточная активность трипсина является мерой ингибиторной активности биологически активного вещества.
Лиофилизированный белок доводят до состояния равновесной влажности, готовят раствор с концентрацией 1 мг/мл в 0,9%-ном растворе хлористого натрия и приготавливают ряд разведении. К 1 мл испытуемого раствора прибавляют 2 мл буфера (15 мМ боратный буфер, рН 8,0, с 200 мМ хлористым кальцием) и 0,8 мл раствора трипсина (2 мг/мл) и инкубируют 5 минут при 25oС. Затем прибавляют 0,2 мл раствора БАЭЭ (6,8 мг/мл) и измеряют расход едкого кали через 5 минут.
Определение перекрестной реакции ингибиторов протеаз с оликлональными кроличьими антителами или антителами человека против апротинина
Подвергали связыванию 0,5-10 нг ингибитора протеазы или апротинина, растворенного в буфере для сочетания, в течение ночи при 4oС на планшете для титрования. Ячейки четырежды промывали по 200 мкл буфером для промывания и затем прибавляли 100 мкл блокирующего раствора. Планшет накрывали и инкубировали 1 час при 37oС. После промывки, соответствующей описанной выше, прибавляли поликлональные кроличьи антитела против апротинина (0,2 мкг/мл в 1% бычьем сывороточном альбумине в забуференном фосфатом физиологическом растворе) или поликлональные антитела человека (20 мкг/мл в 1% сывороточном альбумине человека в забуференном фосфатом физиологическом растворе). Планшеты накрывали и инкубировали 1 час при 37oС и затем промывали, как описано выше. Затем прибавляли 100 мкл биотинилированных анти-кроличьих или анти-человеческих антител (25 мкл + 10 мл 1% бычьего сывороточного альбумина или 1% сывороточного альбумина человека в забуференном фосфатом физиологическом растворе) и инкубировали 1 час при 37oС. Планшет промывали, как описано выше, и затем прибавляли в каждую ячейку 100 мкл комплекса стрептавидин-пероксидаза(50 мкл + 10 мл 1% бычьего сывороточного альбумина или 1% сывороточного альбумина человека в забуференном фосфатом физиологическом растворе). Планшет накрывали и инкубировали 1 час при 37oС, а затем промывали, как описано выше.
Субстратную реакцию проводили с 3,3',5,5'- тетраметилбензидином в качестве субстрата и раствором пероксидазы (1+1; 100 мкл на ячейку). Через 10 минут реакцию останавливали, прибавляя в каждую ячейку 100 мкл 2М фосфорной кислоты, и измеряли поглощение при 450 нм (эталон 570 нм).
Растворы:
1. Буфер для инкубирования: 15 нМ углекислый натрий, 35 мМ бикарбонат натрия, рН 9,6.
2. Буферы для проб: пробы растворяют в подходящей концентрации в буфере для инкубирования.
3. Раствор для промывки: 0,1% (о/о) Твин-20 в забуференном фосфатом физиологическом растворе.
4. Блокирующий буфер: 3% (в/о) бычий сывороточный альбумин или сывороточный альбумин человека в забуференном фосфатом физиологическом растворе.
Примеры
Пример 1
Получение экспрессирующего вектора дрожжей для секреции рекомбинантного дез-Рrо2-Sеr10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина
В качестве исходного вещества для получения гена дез-Рrо2-Sеr10-Аrg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина служил ген дез-Рrо2-Arg15-Alal 7, который под действием рестриктаз HindIII и ВаmHI был клонирован в вектор pUC18. Полученный вектор (pEM6.6.L) подвергался реакции мутагенеза по двойной цепи по способу U.S.E. (фирма Фармация Байетек) с праймером А для мутагенеза и селекционным праймером Scal/Mlul. Праймер А для мутагенеза имел следующую последовательность:
Праймер А
5'GGCTGCAGAGCTAACCGTAACAACTTCAAATCCGCGGAAGACTGCATGG AAACTTGCGGTGGTGCTTAG 3'. Этот праймер генерирует мутации Asn41 и Glu53 в гене дeз-Pro2-Arg15-Ala17-aпpoтининa. Анализ клона осуществляли с помощью рестрикционного расщепления ферментами Scal и SphI. Желаемая последовательность была, кроме того, подтверждена при установлении последовательности ДНК клона pEM31.8.L. Дальнейшие замены в области 5' гена (Ser10-Asp24-Thr26-Glu31) осуществляли с помощью методики полимеразной цепной реакции при использовании праймера Б и 'обратного 24-mer M13'-праймера, исходя из ДНК плазмиды pEM31.8.L. Праймер Б имел следующую последовательность:
Праймер Б
5'TGCCTCGAGCCGCCGTCTACTGGGCCCTGCAGAGCTATCATCCGTTACT TCTACGATGCAACTGCAGGCCTGTGTGAAACCTTCGTATACGGC 3'. Узнаваемая рестриктазой Xhol последовательность подчеркнута.
Смесь для полимеразной цепной реакции содержала 20 нг ДНК плазмиды рЕМ3 1.8.L, 20 пмолей 'обратного 24-mer M 13'-праймера, 60 пмолей праймера Б, 200 мкМ дезоксинуклеозид-5'-трифосфаты, 1 • реакционный буфер II для полимеразной цепной реакции (фирмы Перкин Элмер), 4 мМ хлористый магний и 2,5 Ед. ДНК-полимеразы фага Taq (фирмы Перкин Элмер) в общем объеме 100 мкл. Применяли следующие условия для цикла: 3 минуты при 94oС, 30 циклов, в каждом случае по 1 минуте при 94oС, 1 минуте при 55oС и 1 минуте при 72oС и затем инкубировали 5 минут при 72oС. Смесь для полимеразной цепной реакции разводили 1: 5 и лигировали с вектором pCRII (Инвитроген). С помощью смеси для лигирования трансформировали клетки DH5α бактерий Е. coli. Идентифицировали положительные клоны после рестрикционного расщепления ферментами XhoI иВаmHI и определяли последовательности некоторых клонов. Клон pES9.10.L содержал желаемую последовательность и его использовали для дальнейших исследований.
Вектор-челнок Е. coli/дрожжи (например, рА202) был использован для конструирования дрожжевого секреционного вектора, в котором последовательность дез-Рrо2-Sеr10-Arg15-Ala17-Asp24-Thr26-Glu31 -Asn41 -Glu53-апротинина соединяется с пре-про-последовательностью дрожжевого α-фактора.
Вектор рА202 переносит устойчивый к ампициллину ген (blа) и ген URA3 в качестве генов-маркеров для Е. coli и дрожжей. Другими важными элементами вектора являются Col El и исходная точка репликации в 2 мк (ori). Локус REP3 также находится в этой области. Фрагмент EcorI-HmdIII величиной в 1200 П.н. переносит промотор MFα1 и N-концевую пре-про-последовательность белка-предшественника α-фактора дрожжей (Kurjan и Herskowitz, Cell 30, 933-943, 1982). При введении модифицированной кДНК дeз-Pro2-Arg15-aпpoтининa в виде фрагмента HindIII-ВатHI были опять получены места узнавания для протеазы КехII ('Lys-Arg') внутри пре-про-последовательности α-фактора (европейская заявка на патент ЕР 0419878).
На конце 3' последовательности дeз-Pro2-Arg15-aпpoтининa вектор переносит фрагмент ВатHI-SaII дрожжевого гена URA3, который действует в этом положении как терминационный сигнал для транскрипции (Yarger и др., Mol. Cell. Biol. 6, 1095-1101, 1986).
Фрагмент ДНК величиной в 180 П.н. вырезают с помощью Xhol и ВаmHI из вектора pES9.10. L, очищают при электрофорезе в агарозном геле и клонируют в расщепленный также с помощью Xhol и BamHI и дефосфорилированный вектор рА202. Путем этого клонирования дез-Рго2-Arg15-апротинин в векторе рА202 заменяют дез-Рrо2-Sеr10-Arg15-Аlа17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинином. Дрожжевые клетки (JC34.4D) были трансформированы с помощью полученного в результате такого клонирования вектора pES13.10.L.
Другие векторы-челноки E.coli/дрожжи с различными промоторами, как, например, определяющий GAPDH или индуцируемый промотор GAL 10, могут быть получены аналогичным способом и приводят также к секреции дез-Pro2-Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина. Наряду с этим, само собой разумеется, что также возможно вставлять векторы-челноки с другими источниками репликации дрожжей, как, например, хромосомный автономно реплицирующийся сегмент (ars).
Подходящими селектируемыми генами-маркерами наряду с геном URA3 являются такие гены, которые доставляют ауксотрофный мутант дрожжей для прототрофии, например, гены LEU2, HIS3 или TRP1. Кроме этого, само собой разумеется, что могут быть вставлены также гены, продукты которых способствуют устойчивости против различных антибиотиков, как, например, аминогликозид G418.
Другие дрожжи, например метилотрофные дрожжи Pichia pastoris или Hansenula polymorpha, после трансформации с подходящими векторами также в состоянии продуцировать дeз-Pro2-Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Аsn41-Glu53-апротинин.
Пример 2
Получение экспрессирующего вектора дрожжей для секреции рекомбинантного Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина с природной N-концевой последовательностью 'Arg-Pro-Asp'
Для получения экспрессирующего вектора дрожжей, позволяющего осуществить секрецию Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина с природной N-концевой последовательностью 'Arg-Pro-Asp', сначала амплифицировали промотор MFα1 с препоследовательностью α-фактора и концом 5' гена апротинина (вплоть до узнаваемой рестриктазой Xhol последовательности) путем полимеразной цепной реакции и клонировали. Примененные праймеры имели следующие последовательности:
Праймер В:
5'GGGATATCTATTGATAAGATTTAAAGGTATTTGACAAG 3'. Узнаваемая рестриктазой EcorV последовательность подчеркнута.
Праймер Г:
5'GGGCTCGAGGCAGAAATCTGGTCTAGCCAAAGCAGAAGAAGCAGCGAA CAAGACAGCAGTGAAAATAGATGGAATCTCATTCTTTTAATCGTTTATATT 3'. Узнаваемая рестриктазой Xhol последовательность подчеркнута.
Смесь для полимеразной цепной реакции содержит 200 нг ДНК плазмиды рА202, 0,2 мкМ праймер В, 0,2 мкМ праймер Г, 200 мкМ дезоксинуклеозид-5'-трифосфаты, 1 • реакционный буфер для полимеразной цепной реакции 11 (Стратаген, Опти-ПраймТМ) и 2,5 Ед. ДНК-полимеразы фага Taq (фирмы Перкин Элмер) в общем объеме 50 мкл. Условия проведения цикла: 1 минута при 94oС, 30 циклов, в каждом случае 1 минута при 94oС, 1 минута при 50oС и 2 минуты при 72oС и затем инкубировали 5 минут при 72oС. Смесь для полимеразной цепной реакции разводили 1:5 и лигировали с вектором рСRII (Инвитроген). С помощью смеси для лигирования трансформировали клетки DH5α бактерий Е. coli. Положительные клоны идентифицировали после рестрикционного расщепления ферментом EcoRI и определяли последовательности некоторых клонов. Клон pIU20.11.L использовали для дальнейших работ.
Вектор-челнок E.coli/дрожжи pYES2 (Инвитроген) использовали для конструирования секреционного вектора дрожжей, в котором последовательность Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина непосредственно соединена с препоследовательностью α-фактора дрожжей. Сначала вектор pYES2 расщепляли рестрикционными ферментами SspI и ВаmHI, дефосфорилировали и очищали на геле. При этом удаляются находящиеся на векторе pYES2 промотор GAL 1 и fl ori. Фрагмент ДНК величиной около 1030 П.н. вырезался из вектора pIU20.11.L рестриктазами EcoRV и Xhol, подвергался очистке при электрофорезе на агарозном геле и подвергался клонированию вместе с фрагментом Xhol и ВаmHI величиной около 180 П.н. из вектора pES9.10.L в расщепленный рестриктазами SspI и ВаmHI вектор pYES2. Клетки DH5α бактерий E.coli трансформировались с помощью смеси для лигирования. Идентифицировали и устанавливали последовательность положительных клонов после рестрикционного расщепления ферментом Xhol. Клетки дрожжей (JC34.4D) трансформировались с помощью получающегося в результате этого клонирования вектора pIU28.11.L. Экспрессирующий вектор pIU28.11. L не содержит больше пропоследовательности α-фактора, так что процессинг Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина происходит исключительно благодаря сигнальной пептидазе и не зависит от расщепления протеазой KexII.
Пример 3
Ферментация Saccharomyces cerevisiae
Экспрессионный штамм Saccharomyces cerevisiae подвергали ферментации, как описано выше.
Пример 4
Очистка производных апротинина без общего заряда при нейтральном значении рН
1. Обзор подходящих способов очистки
После ферментации клетки отделяют центрифугированием и оставшуюся надосадочную жидкость фильтруют для удаления оставшихся клеток.
Устанавливают рН 3 для не содержащей клеток надосадочной жидкости при добавлении концентрированной лимонной кислоты. Раствор должен быть разведен подходящим образом очищенной водой, чтобы установить электропроводность менее, чем 8 мСм/см. Затем раствор наносят на катионообменную колонку, которую предварительно уравновешивают кислотным буфером. Несвязавшийся материал удаляют при обильном промывании начальным буфером. Продукт элюируют с использованием градиента соли. Полученные фракции исследовали на содержание продукта с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ) и теста на биологическую активность, при котором определяется ингибирование протеазы по содержанию ее продукта. Фракции, содержащие продукт, объединяют и наносят непосредственно на препаративную колонку для ОФ-ВЭЖХ. Колонку предварительно уравновешивают кислотным буфером. Несвязавшийся белок удаляют при промывании колонки начальным буфером. Продукт элюируют градиентом органического растворителя. Фракции заново исследуют, как было описано выше, на содержание продукта и те фракции, которые содержат продукт, объединяют. В зависимости от достигнутой чистоты продукта возможна необходимость повторной очистки объединенных фракций на колонке для ОФ-ВЭЖХ. Условия, в основном, подобны ранее описанным. Полученный раствор продукта разбавляли водой для инъекций, разливали на подходящие порции и подвергали сушке вымораживанием.
Другими способами очистки производных апротинина без общего заряда при нейтральном значении рН, которые могут быть скомбинированы с вышеописанными процессами, являются аффинная хроматография на иммобилизованном на сефарозе трипсине и гельпроникающая хроматография.
2. Очистка дез-Pro2-Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина
Материал ферментации в объеме 10 л очищали следующим способом. После окончания ферментации устанавливали рН 3 содержимого ферментера с помощью концентрированной лимонной кислоты и нагревали в течение 10 минут при 70oС. Затем клетки удаляли при центрифугировании (15 минут, 7500•g, центрифуга Гераеус) и полученную надосадочную жидкость фильтровали (8 мкм до 0,2 мкм, Миллипор, Германия). После этой стадии супернатант путем замораживания при -18oС можно хранить до дальнейшего использования. Раствор затем разводили при добавлении очищенной воды до электропроводности менее, чем 8 мСм/см, и наносили на колонку с SP-сефарозой FF (фирма Фармация, Швеция). Колонку предварительно уравновешивали 50 нМ буфером цитрат-едкий натр, рН 3. Несвязавшийся белок удаляли при интенсивном промывании таким же буфером. Затем продукт элюировали градиентом 1М хлористого натрия. Полученные фракции исследовали на содержание продукта с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии (ОФ-ВЭЖХ, С4) и тестов на ингибиторную активность в отношении протеаз. Фракции, содержащие желаемый продукт, объединяли.
Затем раствор продукта наносили прямо на первую колонку для ОФ-ВЭЖХ (исходная программа 15 обращенно-фазовой хроматографии, Фармация, Швеция), которую предварительно уравновешивали 0,1% трифторуксусной кислотой/водой. Несвязавшийся белок удаляли при интенсивном промывании тем же буфером. Продукт элюировали линейным градиентом ацетонитрила (0-70%). Полученные фракции заново исследовали на содержание продукта описанными выше способами, содержащие продукт фракции объединяли.
Для окончательной очистки раствор, содержащий продукт, разбавляли водой для инъекций и наносили на вторую колонку для ОФ-ВЭЖХ (Видак С8, фирма Видак, США), которую предварительно уравновешивали 0,1% трифторуксусной кислотой/водой. Несвязавшийся белок удаляли при интенсивном промывании тем же буфером. Продукт элюировали линейным градиентом ацетонитрила (0-70%). Полученные фракции заново анализировали на содержание продукта вышеописанными способами и фракции, содержащие продукт, объединяли.
Полученный раствор продукта разбавляли водой для инъекций, разливали на соответствующие порции (20, 10, 1 и 0,2 мг), лиофилизировали и анализировали.
Пример 5
Определение значения Ki при ингибировании калликреина плазмы человека дез-Рrо2-Sеr10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинином
1 Ед. калликреина плазмы человека разводили до 16 мл буфером (0,05 М Трис-/0,1М хлористый натрий, 0,05% Твин-20; рН 8,2). 200 мкл этого раствора фермента смешивали с уменьшающимися объемами буфера для испытания (250, 240, 230, 220, 200, 180, 170, 150, 100, 50 мкл) и затем добавляли возрастающие количества ингибитора в буфере для анализа (10, 20, 30, 50, 70, 80, 100, 150, 200 и 250 мкл; концентрация 0,7 мкг/мкл).
Раствор фермент/ингибитор прединкубировали 4 часа при комнатной температуре. Затем 180 мкл каждого раствора прибавляли в ячейку планшета для титрования и смешивали с 20 мкл раствора субстрата. Измеряли изменение поглощения при 405 нм за 10 минут. Определяли скорость ферментативной реакции и на основании этого рассчитывали значение Ki описанным методом (Biochemical Medicine 32: 387-97 (1984)).
Исходный раствор субстрата: 0,1М в диметилсульфоксиде
Раствор субстрата: 1•10-3М S-2302 в буфере для анализа.
Буфер для анализа: 0.05 М трис(гидроксиметил)аминометан, 0,1 М хлористый натрий, 0,05% Твин-20; рН 8,2; 1 мл бензилового спирта/ л.
Кинетические константы образования комплекса с фактором ХIа фермента плазмина, трипсином крупного рогатого скота и химотрипсином определяли одинаковыми способами. Субстратами являлись хромоцим PL для плазмина, HD-Pro-Phe-Arg-pNA для фактора XI, S-2444 для трипсина и Suc-Phe-Leu-Phe-pNA для химотрипсина.
Пример 6
Результаты химической характеристики белка дез-Pro2-Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина
Ингибитор протеазы, дез-Рrо2-Sеr10-Arg15-Аlа17-Аsр24-Тhr26-Glu31-Asn41-Glu53-апротинин, получали в результате секреции с помощью измененного генной инженерией дрожжевого организма. Его очищали до гомогенности из дрожжевого супернатанта с помощью различных хроматографических способов. Идентичность ингибитора с клонированной последовательностью подтверждают следующие далее аналитические исследования белка.
Анализ N-концевой последовательности
Последовательность ингибитора протеазы была полностью расшифрована в 57 этапов. Следующий список представляет определенную белковую последовательность, идентичную клонированной последовательности.
Анализ последовательности дез-Pro2-Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Аsn41-Glu53-апротинина осуществлен в 57 этапов.
Аминокислотный анализ
Аминокислотный анализ является важным количественным параметром для характеристики белка. Наряду с содержанием белка узнают при известной первичной структуре число отдельных аминокислот. Аминокислотный анализ дeз-Pro2-Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Аsn41-Glu53-апротинина находится в хорошем соответствии с теоретическими значениями, исходя из первичной структуры (Таблица 1).
Обращенно-фазовая хроматография
В случае белков, при высокоэффективной жидкостной хроматографии на химически связанных обращенных фазах происходит через гидрофобное обменное взаимодействие связывание белков на примененной фазе. Белки в соответствии с силой их связывания на стационарной фазе вытесняются органическими растворителями (подвижная фаза). На этом основании данный способ является хорошим критерием для оценки чистоты белка. Дeз-Pro2-Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинин элюируется с фазы RP-18 в виде отдельного пика. Было показано, что выделенный ингибитор протеазы является очень чистым.
Капиллярный электрофорез с хроматографией
Капиллярный электрофорез позволяет разделить пептиды и белки на основании их заряда в электрическом поле. Качество разделения зависит при этом от буфера, значения рН, температуры и использованных добавок. В качестве капилляров применяются колонки из так называемого "кварцевого стекла" с внутренним диаметром 50-100 мкм. Дез-Рrо2-Sеr10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинин разделяют на колонке из "кварцевого стекла" в электрическом поле. На электрофореграмме наблюдается узкий пик.
Определение молекулярного веса
Молекулярный вес дез-Pro2-Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина определяли в 6223 Д по методике MALDI. Найденный молекулярный вес находится при этом в хорошем соответствии с теоретическим значением 6215 Д в рамках точности способа измерения. В качестве матрицы использовали синапиновую кислоту.
Электрофорез в геле с использованием додецилсульфата натрия
Дез - Pro2-Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53 - апротинин подвергали анализу с помощью электрофореза с использованием додецилсульфата натрия в редуцирующих и нередуцирующих условиях. Обнаруживалась полоса в области около 6,5 кД.
Пример 7
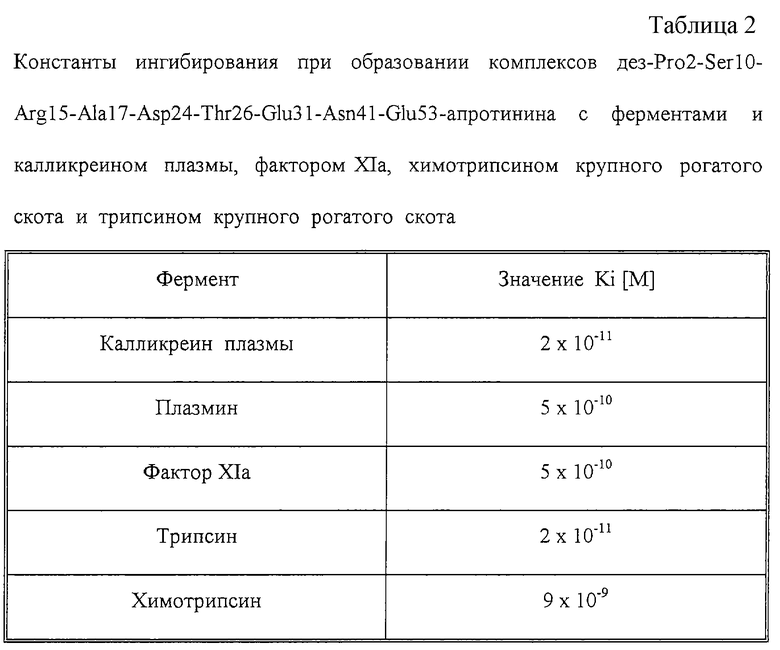
Определение значений Ki при образовании комплексов ферментов с дез-Pro2-Ser10-Arg15-Ala17-Asp24-Thr26-Glu31 -Asn41 -Glu53-апротинином
Константы ингибирования дез-Рrо2-Sеr10-Аrg15-Аlа17-Аsp24-Тhr26-Glu31-Asn41-Glu53-апротиннином определяли для различных ферментов. В таблице 2 приведены значения Ki.
Пример 8
Взаимодействие ингибиторов протеаз с поликлональными кроличьими или человеческими антителами против апротинина
Перекрестная реакционная способность рекомбинантно полученных ингибиторов протеаз исследовалась с поликлональными кроличьими или человеческими антителами против апротинина. Было установлено, что различные варианты ингибиторов протеаз лишь очень слабо взаимодействуют с антисыворотками к апротинину.
Протокол последовательности приведен в конце описания.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДЕЗОКСИРИБОНУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ БЕЛОК ГЛУТАТИОН-S-ТРАНСФЕРАЗУ IIIC И БЕЛОК С СООТВЕТСТВУЮЩЕЙ АМИНОКИСЛОТНОЙ ПОСЛЕДОВАТЕЛЬНОСТЬЮ | 1996 |
|
RU2169196C2 |
| ПАПИЛЛОМАВИРУСНЫЕ ВАКЦИНЫ | 1995 |
|
RU2206608C2 |
| ВАКЦИНА ПРОТИВ СВИНОГО И РЕПРОДУКТИВНОГО И РЕСПИРАТОРНОГО СИНДРОМА | 1995 |
|
RU2162710C2 |
| ЭКСПРЕССИОННЫЕ ВЕКТОРЫ С МОДИФИЦИРОВАННЫМ САЙТОМ ИНИЦИАЦИИ РЕПЛИКАЦИИ СolE1 ДЛЯ РЕГУЛИРОВАНИЯ КОЛИЧЕСТВА КОПИЙ ПЛАЗМИДЫ | 2001 |
|
RU2304618C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИНСУЛИНА ГЛАРГИНА | 2008 |
|
RU2495131C2 |
| СПОСОБЫ УСИЛЕНИЯ ДЕГРАДАЦИИ ИЛИ ПРЕВРАЩЕНИЯ ЦЕЛЛЮЛОЗНОГО МАТЕРИАЛА | 2006 |
|
RU2441912C2 |
| ПРИРОДНЫЙ И РЕКОМБИНАНТНЫЙ ИНГИБИТОРЫ ТРОМБИНА, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 1993 |
|
RU2183214C2 |
| СПОСОБЫ УЛУЧШЕНИЯ ЭФФЕКТИВНОСТИ БЕЛКОВ | 2008 |
|
RU2569106C2 |
| ПОЛИПЕПТИД, ИМЕЮЩИЙ ФЕРМЕНТАТИВНУЮ АКТИВНОСТЬ ФОСФОДИЭСТЕРАЗЫ | 1998 |
|
RU2272841C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФУНКЦИОНАЛЬНО АКТИВНОГО РЕКОМБИНАНТНОГО БЕЛКА ЛЕТАЛЬНОГО ФАКТОРА ЯЗВЫ (LF), РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pETHIS-LF, КОДИРУЮЩАЯ АКТИВНЫЙ БЕЛОК LF И ШТАММ ESCHERICHIA COLI BL-HISLF, ПРОДУЦИРУЮЩИЙ АКТИВНЫЙ БЕЛОК ЛЕТАЛЬНОГО ФАКТОРА СИБИРСКОЙ ЯЗВЫ | 2007 |
|
RU2361921C1 |




Изобретение относится к медицине, а именно к варианту апротинина с общим зарядом от +3 до -3 при рН 7 и с аминокислотами Arg15 или Arg15-Ala17 в участке связывания. Вариант апротинина имеет измененную N-концевую последовательность и удлинение или укорочение по N-концу или удаление аминокислоты при N-конце. Вариант апротинина выбирают из группы дез-Рrо2-Sеr10-Arg15-Ala17-Asp24-Thr26-Glu31 -Asn41 -Glu53-апротинина, дез-Рrо2-Sеr10-Arg15-Asp24-Thr26-Glu31 -Asn41 -Glu53-апротинина, дез-Рrо2-Sеr10-Arg15-Ser17-Asp24-Thr26-Glu31 -Asn41 -Glu53-апротинина, дез-Рrо2-Sеr10-Arg15-Alal 7-Thr26-Glu31-Asn41-Glu53-апротинина, дeз-Pro2-Ser10-Arg15-Ala17-Asp24-Thr26-Asn41 -Glu53-апротинина, Ser10-Arg15-Ala17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина, Ser10-Arg15-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина, Ser10-Arg15-Ser17-Asp24-Thr26-Glu31-Asn41-Glu53-апротинина, Ser10-Arg15-Ala17-Thr26-Glu31-Asn41-Glu53-апротинина и Ser 10-Arg15-Ala17-Asp24-Thr26-Asn41-Glu53-апротинина. Технический результат - расширение арсенала сериновых протеаз для коррекции состояния желудочно-кишечного тракта. 2 с. и 3 з.п. ф-лы, 2 табл. 1 ил.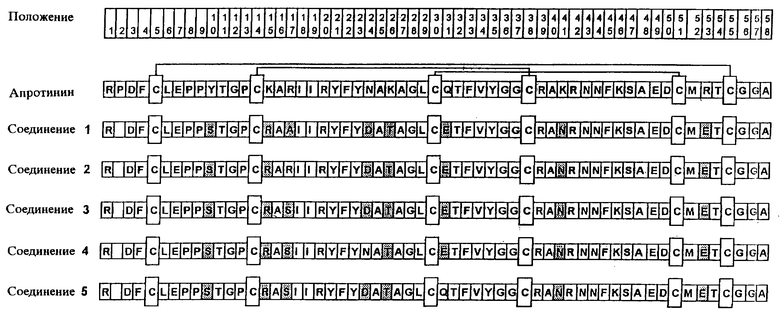
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| Wlodawer A | |||
| et al | |||
| "Structure offonn Ш crystals of bovine pancreatic trypsin inhibitor", J | |||
| Mol.Biol, 198(3), 469-489, 1987. | |||
Авторы
Даты
2003-02-10—Публикация
1997-07-24—Подача