Заявление относительно прав изобретений, выполненных в соответствии с федерально финансируемым исследованием и развитием
Это изобретение было выполнено при поддержке Правительства согласно NREL Subcontract No. ZCO-30017-02, Prime Contract DE-AC36-98GO10337, присужденному Министерством электроэнергии. Правительство имеет определенные права в этом изобретении.
Уровень техники
Область техники, к которой относится изобретение
Данное изобретение относится к способам деградации или превращения целлюлозного материала и получения вещества из целлюлозного материала.
Описание известного уровня техники
Целлюлоза является полимером простого сахара глюкозы, ковалентно связанного бета-1,4-связями. Многие микроорганизмы продуцируют ферменты, которые гидролизуют бета-связанные глюканы. Эти ферменты включают в себя эндоглюканазы, целлобиогидролазы и бета-глюкозидазы. Эндоглюканазы расщепляют полимер целлюлозы в случайных местоположениях, раскрывая его для атаки целлобиогидролазами. Целлобиогидролазы последовательно высвобождают молекулы целлобиозы с концов полимера целлюлозы. Целлобиоза является водорастворимым бета-1,4-связанным димером глюкозы. Бета-глюкозидазы гидролизуют целлобиозу до глюкозы.
Превращение исходных целлюлозных материалов в этанол имеет преимущества легкой доступности больших количеств исходного материала, возможности желательного избегания сжигания этих материалов или наполнения почвы этими материалами и чистоты этанольного топлива. Древесина, сельскохозяйственные остатки, травянистые культуры и муниципальные твердые отходы рассматриваются в качестве сырья для получения этанола. Эти материалы состоят прежде всего из целлюлозы, гемицеллюлозы и лигнина. После превращения целлюлозы в глюкозу эта глюкоза легко ферментируется дрожжами в этанол.
В данной области была бы выгодной возможность превращения целлюлозных исходных материалов.
Опубликованная заявка на патент США с регистрационным номером 2003/113734 раскрывает выделенный белок целлюлазы, идентифицированный как EGVII, и нуклеиновые кислоты, которые кодируют EGVII.
Целью данного изобретения является обеспечение выделенных полипептидов, имеющих целлюлолитическую активность, и выделенных последовательностей нуклеиновых кислот, кодирующих эти полипептиды, для улучшения превращения целлюлозных исходных материалов.
Сущность изобретения
Данное изобретение относится к способам деградации или превращения целлюлозного материала, предусматривающим: обработку целлюлозного материала эффективным количеством одного или более целлюлолитических белков в присутствии эффективного количества полипептида, имеющего целлюлолитическую усиливающую активность, где присутствие полипептида, имеющего целлюлолитическую усиливающую активность, увеличивает деградацию целлюлозного материала в сравнении с отсутствием полипептида, имеющего целлюлолитическую усиливающую активность, и где полипептид, имеющий целлюлолитическую усиливающую активность, выбран из группы, состоящей из:
(а) полипептида, содержащего [ILMV]-P-x(4,5)-G-x-Y-[ILMV]-x-R-x-[EQ]-x(3)-A-[HNQ], где х обозначает любую аминокислоту, х(4,5) обозначает любую аминокислоту в 4 или 5 смежных положениях и х(3) обозначает любую аминокислоту в 3 смежных положениях;
(b) полипептида, содержащего аминокислотную последовательность, которая имеет, по меньшей мере, 70% идентичность со зрелым полипептидом SEQ ID NO:2;
(с) полипептида, кодируемого полинуклеотидом, который гибридизуется, по меньшей мере, при условиях средней строгости с (i) кодирующей зрелый полипептид последовательностью SEQ ID NO:1, (ii) геномной последовательностью ДНК, содержащей кодирующую зрелый полипептид последовательность SEQ ID NO:1, или (iii) комплементарной цепью (i) или (ii); и
(d) варианта, содержащего консервативную замену, делецию и/или инсерцию одной или более аминокислот зрелого полипептида SEQ ID NO:2.
Данное изобретение относится также к способам получения вещества, предусматривающим:
(А) осахаривание целлюлозного материала эффективным количеством одного или более целлюлолитических белков в присутствии эффективного количества полипептида, имеющего целлюлолитическую усиливающую активность, где присутствие полипептида, имеющего целлюлолитическую усиливающую активность, увеличивает деградацию целлюлозного материала в сравнении с отсутствием полипептида, имеющего целлюлолитическую усиливающую активность, и где полипептид, имеющий целлюлолитическую усиливающую активность, выбран из группы, состоящей из:
(i) полипептида, содержащего [ILMV]-P-x(4,5)-G-x-Y-[ILMV]-x-R-x-[EQ]-x(3)-A-[HNQ], где х обозначает любую аминокислоту, х(4,5) обозначает любую аминокислоту в 4 или 5 смежных положениях и х(3) обозначает любую аминокислоту в 3 смежных положениях;
(ii) полипептида, содержащего аминокислотную последовательность, которая имеет, по меньшей мере, 70% идентичность со зрелым полипептидом SEQ ID NO:2;
(iii) полипептида, кодируемого полинуклеотидом, который гибридизуется, по меньшей мере, при условиях средней строгости с (a) кодирующей зрелый полипептид последовательностью SEQ ID NO:1, (b) геномной последовательностью ДНК, содержащей кодирующую зрелый полипептид последовательность SEQ ID NO:1, или (c) комплементарной цепью (a) или (b); и
(iv) варианта, содержащего консервативную замену, делецию и/или инсерцию одной или более аминокислот зрелого полипептида SEQ ID NO:2
(В) ферментирование осахаренного целлюлозного материала стадии (а) одним или несколькими ферментирующими микроорганизмами; и
(С) извлечение вещества из ферментации.
В предпочтительном аспекте, зрелый полипептид является аминокислотами 20-249 SEQ ID NO:2. В другом предпочтительном аспекте кодирующей зрелый полипептид последовательностью являются полинуклеотиды 77-766 SEQ ID NO:1.
Данное изобретение относится также к композициям детергентов, содержащим такие полипептиды, имеющие целлюлолитическую усиливающую активность.
Краткое описание фигур
Фигура 1 показывает последовательность кДНК и расшифрованную аминокислотную последовательность полипептида GH61B Trichoderma reesei RutC30 (ATCC 56765), имеющего целлюлолитическую усиливающую активность (SEQ ID NO:1 и 2 соответственно). Предсказанные интроны показаны курсивом. Предсказанный сигнальный пептид подчеркнут.
Фигура 2 показывает рестрикционную карту pTr3337.
Фигура 3 показывает рестрикционную карту pTr61B.
Фигура 4 показывает гидролиз PCS (P020502CS, автоклавированной при 100 МФ, 10 г/л) бульона Trichoderma reesei, экспрессирующего бета-глюкозидазу Aspergillus oryzae (CLF), с добавлением или без добавления GH61B Trichoderma reesei. Гидролиз проводили при 50оС, рН 5,0 в течение указанных периодов времени. Загрузка Celluclast Plus была равна 2,5 или 3,125 мг на грамм PCS, и эта смесь содержала 2,5 мг CLF и 0,625 мг GH61B на грамм PCS.
Фигура 5 показывает гидролиз PCS (P020502CS, автоклавированной при 100 МФ, 10 г/л) с использованием Celluclast Plus, дополненного белком GH61B. Бульон Aspergillus oryzae, не содержащий рекомбинантного белка (Jal250), добавляли в качестве контроля. Инкубирование выполняли в течение 115 часов при 50оС.
Определения
Целлюлолитическая усиливающая активность: Термин «целлюлолитическая усиливающая активность» определяется в данном контексте как биологическая активность, которая усиливает гидролиз целлюлозного материала белками, имеющими целлюлолитическую активность. Для целей данного изобретения целлюлолитическую усиливающую активность определяют измерением увеличения редуцирующих сахаров из гидролиза целлюлозного материала целлюлолитическим белком при следующих условиях: 5,0 мг целлюлолитического белка на г целлюлозы в PCS в течение 5-7 дней при 50оС в присутствии и в отсутствие 0,01-2,5 мг целлюлолитической усиливающей активности на г целлюлозы в PCS в сравнении с контрольным гидролизом с равной нагрузкой общего белка без целлюлолитической усиливающей активности (5,01-7,5 мг целлюлолитического белка на г целлюлозы в PCS). В предпочтительном аспекте, в качестве источника целлюлолитической активности используют смесь Celluclast® 1,5 л (Novozymes A/S, Bagsvaerd, Denmark) в присутствии 3% бета-глюкозидазы Aspergillus oryzae (продуцируемой рекомбинантно в Aspergillus oryzae в соответствии с WO 02/095014) или 3% бета-глюкозидазы Aspergillus fumigatus (продуцируемой рекомбинантно в Aspergillus oryzae в соответствии с примером 22 WO 02/095014) загрузки целлюлазного белка.
Полипептиды, имеющие целлюлолитическую усиливающую активность, имеют, по меньшей мере, 20%, предпочтительно, по меньшей мере, 40%, более предпочтительно, по меньшей мере, 50%, более предпочтительно, по меньшей мере, 60%, более предпочтительно, по меньшей мере, 70%, более предпочтительно, по меньшей мере, 80%, даже более предпочтительно, по меньшей мере, 90%, наиболее предпочтительно, по меньшей мере, 95% и даже наиболее предпочтительно, по меньшей мере, 100% целлюлолитической усиливающей активности полипептида зрелого полипептида SEQ ID NO:2.
Целлюлолитическая активность: Термин «целлюлолитическая активность» определяется здесь как биологическая активность, которая гидролизует целлюлозный материал. Для целей данного изобретения целлюлолитическую активность определяют измерением увеличения гидролиза целлюлозного материала целлюлолитической смесью при следующих условиях: 1-10 мг целлюлолитического белка на г целлюлозы в PCS в течение 5-7 дней при 50оС в сравнении с контрольным гидролизом без добавления целлюлолитического белка. В предпочтительном аспекте, в качестве источника целлюлолитической активности используют смесь Celluclast® 1,5 л (Novozymes A/S, Bagsvaerd, Denmark) в присутствии 3% бета-глюкозидазы Aspergillus oryzae (продуцируемой рекомбинантно в Aspergillus oryzae в соответствии с WO 02/095014) или 3% бета-глюкозидазы Aspergillus fumigatus (продуцируемой рекомбинантно в Aspergillus oryzae в соответствии с примером 22 WO 02/095014) загрузки целлюлазного белка.
Предобработанная кукурузная солома: Термин «PCS» или «предобработанная кукурузная солома» определяется здесь как целлюлозный материал, полученный из кукурузной соломы обработкой нагреванием и разбавленной кислотой. Для целей данного изобретения PCS получают по способу, описанному в примере 1, или его вариациям по времени, температуре и количеству кислоты.
Гликозидгидролаза Семейства 61: Термин «гликозидгидролаза Семейства 61» или «Семейства GH61» определяется здесь как полипептид, находящийся в Семействе 61 гликозидгидролаз в соответствии с Henrissat B., 1991, A classification of glycosyl hydrolase based on amino-acid sequence similarities, Biochem. J. 280: 309-316 и Henrissat B., and Bairoch A., 1996, Updating the sequence-based classification of glycosyl hydrolases, Biochem. J. 316: 695-696. В настоящее время Henrissat описывает Семейство GH61 как неклассифицированное, указывая на то, что такие свойства, как механизм, каталитические нуклеофил/основание, каталитические доноры протонов и трехмерная (3-D) структура полипептидов, принадлежащих к этому семейству, являются неизвестными.
Целлюлозный материал: Целлюлозным материалом может быть любой материал, содержащий целлюлозу. Целлюлоза обычно обнаруживается, например, в стеблях, листьях, скорлупках, шелухе и стержнях початков растений или листьях, ветвях и древесине деревьев. Целлюлозным материалом могут также быть, но не ограничиваются ими, травянистый материал, отходы сельскохозяйственного производства, отходы лесоводства, муниципальные твердые отходы, бумажные отходы и отходы целлюлозно-бумажных предприятий. При этом понятно, что целлюлоза может быть в форме лигноцеллюлозы, материала клеточных стенок растений, содержащего лигнин, целлюлозы и гемицеллюлозы в смешанном матриксе.
В предпочтительном аспекте, целлюлозным материалом является кукурузная солома. В другом предпочтительном аспекте, целлюлозным материалом является рисовая солома. В другом предпочтительном аспекте, целлюлозным материалом являются отходы бумажно-целлюлозного производства, в другом предпочтительном аспекте, целлюлозным материалом являются древесные или травянистые растения. В другом предпочтительном аспекте, целлюлозным материалом является багасса (жом сахарного тростника).
Этот целлюлозный материал может быть использован в том виде, в каком он находится, или может быть подвергнут предобработке с использованием общепринятых способов, известных в этой области. Например, физические способы предобработки могут включать в себя различные типы размола, облучения, обработку паром/паровой взрыв и гидротермолиз; химические способы могут включать в себя разбавленную кислоту, щелочь, органический растворитель, аммиак, диоксид серы, диоксид углерода и рН-регулируемый гидротермолиз; и биологические способы предобработки могут включать в себя применение лигнин-солюбилизирующих микроорганизмов (см., например, Hsu, T.-A. Pretreatment of biomass, in Handbook on Bioethanol: Production and Utilization, Wyman, C.E., ed., Taylor & Fransis, Washington, DC, 179-212; Ghosh, P., and Singh, A., 1993, Physicochemical and biological treatment for enzymatic/microbial conversion of lignocellulosic biomass, Adv. Appl. Microbiol. 39: 295-333; McMillan, J.D., 1994, Pretreating lignocellulosic biomass: a review, in Enzymatic Conversion of Biomass for Fuels Production, Himmel, M.E., Baker, J. O., and Overend, R.P., eds., ACS Symposium Series 566, American Chemical Society, Washington, DC, Chapter 15; Gong, C.S., Cao, N.J., Du, J., and Tsao, G.T., 1999, Ethanol production from renewable resources, in Advances in Biochemical Engineering/Biotechnology, Scheper, T., ed., Springer-Verlag Berlin Heidelberg, Germany, 65: 207-241; Olsson, L., and Hahn-Hagerdal, B., 1996, Fermеntation of lignocellulosic hydrolysates for ethanol production, Enz. Microb. Tech. 18: 312-331; и Vallander, L., and Erirsson, K.-E. L., 1990, Production of ethanol from lignocellulosic materials: State of the art, Adv. Biochem. Eng./Biotechnol. 42:63-95).
Выделенный полипептид: Термин «выделенный полипептид» относится в данном контексте к полипептиду, который является, по меньшей мере, на 20% чистым, предпочтительно, по меньшей мере, на 40% чистым, более предпочтительно, по меньшей мере, на 60% чистым, даже более предпочтительно, по меньшей мере, на 80% чистым, наиболее предпочтительно, по меньшей мере, на 90% чистым и даже наиболее предпочтительно, по меньшей мере, на 95% чистым, при определении электрофорезом в ДСН-ПААГ.
По существу чистый полипептид: Термин «по существу чистый полипептид» обозначает здесь препарат полипептида, который содержит самое большее 10 мас.%, предпочтительно самое большее 8 мас.%, более предпочтительно самое большее 6 мас.%, более предпочтительно самое большее 5 мас.%, более предпочтительно самое большее 4 мас.%, более предпочтительно самое большее 3 мас.%, даже более предпочтительно самое большее 2 мас.%, наиболее предпочтительно самое большее 1 мас.% и даже наиболее предпочтительно самое большее 0,5 мас.% другого полипептидного материала, с которым он ассоциирован в природе. Таким образом, предпочтительно по существу чистый полипептид является, по меньшей мере, на 92 мас.% чистым, предпочтительно, по меньшей мере, на 94 мас.% чистым, по меньшей мере, на 95 мас.% чистым, более предпочтительно, по меньшей мере, на 96 мас.% чистым, более предпочтительно, по меньшей мере, на 97 мас.% чистым, более предпочтительно, по меньшей мере, на 98 мас.% чистым, даже более предпочтительно, по меньшей мере, на 99 мас.% чистым, наиболее предпочтительно, по меньшей мере, на 99,5 мас.% чистым и даже наиболее предпочтительно, по меньшей мере, на 100 мас.% чистым в расчете на общий полипептидный материал, присутствующий в этом препарате.
Полипептиды, имеющие целлюлолитическую усиливающую активность, находятся предпочтительно в существенно очищенной форме. В частности, предпочтительно эти полипептиды находятся в «по существу чистой форме», т.е. этот препарат полипептида по существу не содержит другого полипептидного материала, с которым он ассоциирован в нативном состоянии. Это может быть достигнуто, например, получением этого полипептида при помощи хорошо известных рекомбинантных способов или классических способов очистки.
В данном контексте, термин «по существу чистый полипептид» является синонимом терминов «выделенный полипептид» и «полипептид в выделенной форме».
Зрелый полипептид: Термин «зрелый полипептид» определяется здесь как полипептид, имеющий целлюлолитическую усиливающую активность, который находится в его конечной форме после трансляции и любых посттрансляционных модификаций, таких как N-концевой процессинг, С-концевое укорочение, гликозилирование, фосфорилирование и т.д.
Кодирующая зрелый полипептид последовательность: Термин «кодирующая зрелый полипептид последовательность» определяется здесь как нуклеотидная последовательность, которая кодирует зрелый полипептид, имеющий целлюлолитическую усиливающую активность.
Идентичность: Родство между двумя аминокислотными последовательностями или между нуклеотидными последовательностями описывается параметром «идентичность».
Для целей данного изобретения, степень идентичности между двумя аминокислотными последовательностями определяют с использованием алгоритма Needleman-Wunsch (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), воплощенного в программе Needle EMBOSS со штрафом за открывание гэпа 10, штрафом за удлинение гэпа 0,5 и матрицей EBLOSUM62. Результат введенной Needle «самой длинной идентичности» используют здесь в виде процентной идентичности и рассчитывают следующим образом:
(Идентичные Остатки × 100)/(Длина Сопоставления - Количество Гэпов в Сопоставлении).
Для целей данного изобретения, степень идентичности между двумя нуклеотидными последовательностями определяют с использованием алгоритма Needleman-Wunsch (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453), воплощенного в программе Needle EMBOSS со штрафом за открывание гэпа 10, штрафом за удлинение гэпа 0,5 и матрицей EDNAFULL. Результат введенной Needle «самой длинной идентичности» используют здесь в виде процентной идентичности и рассчитывают следующим образом:
(Идентичные Остатки × 100)/(Длина Сопоставления - Количество Гэпов в Сопоставлении).
Гомологичная последовательность: Термин «гомологичная последовательность» определяется здесь как последовательности с величиной Е (оценки ожидания), меньшей чем 0,001, с использованием алгоритмов BLASTP (для баз данных белков) или TBLASTN (для баз данных нуклеиновых кислот) с матрицей BLOSUM62, размером слова 3, ценой существования гэпа 11, ценой удлинения гэпа 1, без фильтрации низкой комплексности и с последовательностью зрелого белка GH61B в качестве «запрашиваемой последовательности». См. Altschul et al., 1997, Nucleic Acids Res. 25: 3389-3402.
Полипептидный фрагмент: Термин «полипептидный фрагмент» определяется здесь как полипептид, имеющий одну или несколько аминокислот, делетированных из амино- и/или карбоксил-конца зрелого полипептида SEQ ID NO:2 или его гомологичной последовательности, где этот фрагмент имеет целлюлолитическую усиливающую активность. Предпочтительно, фрагмент зрелого полипептида SEQ ID NO:2 содержит, по меньшей мере, 200 аминокислотных остатков, более предпочтительно, по меньшей мере, 210 аминокислотных остатков и наиболее предпочтительно, по меньшей мере, 220 аминокислотных остатков.
Субпоследовательность: Термин «субпоследовательность» определяется здесь как нуклеотидная последовательность, имеющая один или несколько нуклеотидов, делетированных из 5'- и/или 3'-конца кодирующей зрелый полипептид последовательности SEQ ID NO:1 или ее гомологичной последовательности, где эта субпоследовательность кодирует полипептидный фрагмент, имеющий целлюлолитическую усиливающую активность. Предпочтительно, субпоследовательность кодирующей зрелый полипептид последовательности SEQ ID NO:1 содержит, по меньшей мере, 600 нуклеотидов, более предпочтительно, по меньшей мере, 630 нуклеотидов и наиболее предпочтительно, по меньшей мере, 660 нуклеотидов.
Аллельный вариант: Термин «аллельный вариант» обозначает здесь любую из двух или более альтернативных форм гена, занимающих один и тот же хромосомный локус. Аллельная вариация возникает природно посредством мутации и может приводить к полиморфизму в популяциях. Мутации генов могут быть молчащими (без изменения кодируемого полипептида) или могут кодировать полипептиды, имеющие измененные аминокислотные последовательности. Аллельный вариант полипептида является полипептидом, кодируемым аллельным вариантом гена.
Выделенный полинуклеотид: Термин «выделенный полинуклеотид» относится в данном контексте к полинуклеотиду, который является, по меньшей мере, на 20% чистым, предпочтительно, по меньшей мере, на 40% чистым, более предпочтительно, по меньшей мере, на 60% чистым, даже более предпочтительно, по меньшей мере, на 80% чистым, наиболее предпочтительно, по меньшей мере, на 90% чистым и еще более предпочтительно, по меньшей мере, на 95% чистым, при определении электрофорезом на агарозе.
По существу чистый полинуклеотид: Термин «по существу чистый полинуклеотид» обозначает здесь препарат полинуклеотида, не содержащий других посторонних или нежелательных нуклеотидов, который находится в форме, подходящей для использования в системах получения белка при помощи генной инженерии. Таким образом, по существу чистый полинуклеотид содержит самое большее 10 мас.%, предпочтительно самое большее 8 мас.%, более предпочтительно самое большее 6 мас.%, более предпочтительно самое большее 5 мас.%, более предпочтительно самое большее 4 мас.%, более предпочтительно самое большее 3 мас.%, даже более предпочтительно самое большее 2 мас.%, наиболее предпочтительно самое большее 1 мас.% и даже наиболее предпочтительно самое большее 0,5 мас.% другого полинуклеотидного материала, с которым он ассоциирован в природе. Однако по существу чистый полинуклеотид может включать в себя природно-встречающиеся 5'- и 3'-нетранслируемые районы, такие как промоторы и терминаторы. Предпочтительно, по существу чистый полипептид является, по меньшей мере, на 90 мас.% чистым, предпочтительно, по меньшей мере, на 92 мас.% чистым, предпочтительно, по меньшей мере, на 94 мас.% чистым, более предпочтительно, по меньшей мере, на 95% чистым, более предпочтительно, по меньшей мере, на 96 мас.% чистым, более предпочтительно, по меньшей мере, на 97 мас.% чистым, даже более предпочтительно, по меньшей мере, на 98 мас.% чистым, наиболее предпочтительно, по меньшей мере, на 99 мас.% чистым и даже более предпочтительно, по меньшей мере, на 99,5 мас.% чистым. Эти полинуклеотиды предпочтительно находятся в основном в чистой форме. В частности, предпочтительно описанные здесь полинуклеотиды находятся в «по существу чистой форме», т.е. препарат полинуклеотида по существу не содержит другого полинуклеотидного материала, с которым он ассоциирован в нативном состоянии. Здесь термин «по существу чистый полинуклеотид» является синонимом терминам «выделенный полинуклеотид» и «полинуклеотид в выделенной форме». Эти полинуклеотиды могут быть геномной ДНК, кДНК, РНК, полусинтетического, синтетического происхождения или любыми их комбинациями.
кДНК: Термин «кДНК» определяется здесь как молекула ДНК, которая может быть получена обратной транскрипцией из зрелой, сплайсированной молекулы мРНК, полученной из эукариотической клетки. кДНК не содержит последовательностей интронов, которые обычно присутствуют в соответствующей геномной ДНК. Исходный первичный РНК-транскрипт является предшественником мРНК, который процессируется посредством ряда стадий перед отжигом в виде зрелой сплайсированной мРНК. Эти стадии включают в себя удаление последовательностей интронов посредством процесса, названного сплайсингом. Таким образом, кДНК, полученная из мРНК, лишена любых последовательностей интронов.
Конструкция нуклеиновой кислоты: Термин «конструкция нуклеиновой кислоты» относится в этом контексте к молекуле нуклеиновой кислоты, либо одноцепочечной, либо двухцепочечной, которая выделена из природно-встречающегося гена или которая модифицирована так, что она содержит сегменты нуклеиновых кислот, таким образом, который в противном случае не мог бы существовать в природе. Термин конструкция нуклеиновой кислоты является синонимом термина «экспрессионная кассета», когда конструкция нуклеиновой кислоты содержит регуляторные последовательности, необходимые для экспрессии кодирующей последовательности.
Регуляторная последовательность: Термин «регуляторные последовательности» определяется здесь как последовательности, включающие в себя все компоненты, которые необходимы или полезны для экспрессии полинуклеотида, кодирующего полипептид. Каждая регуляторная последовательность может быть нативной или чужеродной относительно нуклеотидной последовательности, кодирующей этот полипептид, или нативной или чужеродной относительно друг друга. Такие регуляторные последовательности включают в себя, но не ограничиваются ими, лидер, последовательность полиаденилирования, пропептидную последовательность, промотор, последовательность сигнального пептида и терминатор транскрипции. Минимально, эти регуляторные последовательности включают в себя промотор и стоп-сигналы транскрипции и трансляции. Эти регуляторные последовательности могут быть обеспечены линкерами с целью введения специфических сайтов рестрикции, облегчающих лигирование регуляторных последовательностей с кодирующим районом нуклеотидной последовательности, кодирующей полипептид.
Функционально связанные: Термин «функционально связанные» обозначает здесь конфигурацию, в которой регуляторная последовательность помещена в подходящем положении относительно кодирующей последовательности этой полинуклеотидной последовательности, так что эта регуляторная последовательность управляет экспрессией кодирующей последовательности полипептида.
Кодирующая последовательность: В данном контексте термин «кодирующая последовательность» обозначает нуклеотидную последовательность, которая непосредственно определяет аминокислотную последовательность ее белкового продукта. Границы кодирующей последовательности обычно определяются открытой рамкой считывания, которая обычно начинается со стартового кодона ATG или альтернативных стартовых кодонов, таких как GTG и TTG, и заканчивается стоп-кодоном, таким как TAA, TAG и TGA. Кодирующей последовательностью может быть ДНК, кДНК или рекомбинантная нуклеотидная последовательность.
Экспрессия: Термин «экспрессия» включает в себя любую стадию, участвующую в продуцировании полипептида, в том числе, но не только, транскрипцию, посттранскрипционную модификацию, трансляцию, посттрансляционную модификацию и секрецию.
Экспрессирующий вектор: Термин «экспрессирующий вектор» определяется здесь как линейная или кольцевая молекула ДНК, которая содержит полинуклеотид, кодирующий полипептид этого изобретения и которая функционально связана с дополнительными нуклеотидами, которые обеспечивают ее экспрессию.
Клетка-хозяин: Термин «клетка-хозяин» в данном контексте включает в себя любой тип клеток, который является восприимчивым в отношении трансформации, трансфекции, трансдукции и т.п. конструкцией нуклеиновой кислоты или экспрессирующим вектором, содержащим полинуклеотид.
Модификация: Термин «модификация» обозначает здесь любую химическую модификацию полипептида, состоящего из зрелого полипептида SEQ ID NO:2 или его гомологичной последовательности; а также генетическую манипуляцию ДНК, кодирующей такой полипептид. Этой модификацей могут быть замены, делеции и/или инсерции одной или более аминокислот, а также замены боковых цепей одной или более аминокислот.
Искусственный вариант: В данном контексте, термин «искусственный вариант» обозначает полипептид, имеющий целлюлолитическую усиливающую активность, продуцируемый организмом, экспрессирующим модифицированную нуклеотидную последовательность кодирующей зрелый полипептид последовательности SEQ ID NO:1 или ее гомологичной последовательности. Эту модифицированную нуклеотидную последовательность получают вмешательством человека посредством модификации нуклеотидной последовательности, описанной в SEQ ID NO:1, или ее гомологичной последовательности.
Подробное описание изобретения
Данное изобретение относится к способам деградации или превращения целлюлозного материала, предусматривающим: обработку целлюлозного материала эффективным количеством целлюлолитического белка в присутствии эффективного количества полипептида, имеющего целлюлолитическую усиливающую активность, где присутствие полипептида, имеющего целлюлолитическую усиливающую активность, увеличивает деградацию целлюлозного материала в сравнении с отсутствием полипептида, имеющего целлюлолитическую усиливающую активность, и где полипептид, имеющий целлюлолитическую усиливающую активность, выбран из группы, состоящей из:
(а) полипептида, содержащего [ILMV]-P-x(4,5)-G-x-Y-[ILMV]-x-R-x-[EQ]-x(3)-A-[HNQ], где х обозначает любую аминокислоту, х(4,5) обозначает любую аминокислоту в 4 или 5 смежных положениях и х(3) обозначает любую аминокислоту в 3 смежных положениях;
(b) полипептида, содержащего аминокислотную последовательность, которая имеет, по меньшей мере, 70% идентичность со зрелым полипептидом SEQ ID NO:2;
(с) полипептида, кодируемого полинуклеотидом, который гибридизуется, по меньшей мере, при условиях средней строгости с (i) кодирующей зрелый полипептид последовательностью SEQ ID NO:1, (ii) геномной последовательностью ДНК, содержащей кодирующую зрелый полипептид последовательность SEQ ID NO:1, или (iii) комплементарной цепью (i) или (ii); и
(d) варианта, содержащего консервативную замену, делецию и/или инсерцию одной или более аминокислот зрелого полипептида SEQ ID NO:2.
Данное изобретение включает в себя также извлечение деградированного или превращенного целлюлозного материала. Растворимые продукты деградации или превращения целлюлозного материала могут быть отделены от нерастворимого целлюлозного материала с использованием технологии, хорошо известной в этой области, такой как центрифугирование, фильтрование и осаждение под действием гравитации.
Данное изобретение относится также к способам получения вещества, предусматривающим:
(А) осахаривание целлюлозного материала эффективным количеством одного или более целлюлолитических белков в присутствии эффективного количества полипептида, имеющего целлюлолитическую усиливающую активность, где присутствие полипептида, имеющего целлюлолитическую усиливающую активность, увеличивает деградацию целлюлозного материала в сравнении с отсутствием полипептида, имеющего целлюлолитическую усиливающую активность, и где полипептид, имеющий целлюлолитическую усиливающую активность, выбран из группы, состоящей из: (i) полипептида, содержащего [ILMV]-P-x(4,5)-G-x-Y-[ILMV]-x-R-x-[EQ]-x(3)-A-[HNQ], где х обозначает любую аминокислоту, х(4,5) обозначает любую аминокислоту в 4 или 5 смежных положениях и х(3) обозначает любую аминокислоту в 3 смежных положениях; (ii) полипептида, содержащего аминокислотную последовательность, которая имеет, по меньшей мере, 70% идентичность со зрелым полипептидом SEQ ID NO:2; (iii) полипептида, кодируемого полинуклеотидом, который гибридизуется, по меньшей мере, при условиях средней строгости с (a) кодирующей зрелый полипептид последовательностью SEQ ID NO:1, (b) геномной последовательностью ДНК, содержащей кодирующую зрелый полипептид последовательность SEQ ID NO:1, или (с) комплементарной цепью (а) или (b); и (iv) варианта, содержащего консервативную замену, делецию и/или инсерцию одной или более аминокислот зрелого полипептида SEQ ID NO:2; (В) ферментирование осахаренного целлюлозного материала стадии (а) одним или несколькими ферментирующими микроорганизмами; и (С) извлечение вещества из ферментации.
Полипептиды, имеющие целлюлолитическую усиливающую активность, и клетки-хозяева, описанные здесь, могут быть использованы в получении моносахаридов, дисахаридов и полисахаридов в качестве химических или ферментационных исходных веществ из биомассы для получения этанола, пластиков, других продуктов или промежуточных продуктов. В частности, эти полипептиды и клетки-хозяева могут быть использованы для увеличения количества остатков обработки (сушеной барды, дробины из пивоварения, багассы сахарного тростника и т.д.) посредством частичной или полной солюбилизации целлюлозы или гемицеллюлозы. В повышении переработки целлюлолитическими белками целлюлозного материала в глюкозу, ксилозу, маннозу, галактозу и арабинозу, их полимеров или полученных из них продуктов, описанных ниже, полипептиды, имеющие целлюлолитическую усиливающую активность, могут быть в форме неочищенного ферментационного бульона с клетками или без клеток или в форме полуочищенного или очищенного препарата фермента. Целлюлолитический усиливающий белок может быть монокомпонентным препаратом, например белком Семейства 61, мультикомпонентным препаратом белка, например несколькими белками Семейства 61, или комбинацией мультикомпонентного и монокомпонентного препаратов белка. Целлюлолитические усиливающие белки могут повышать активность целлюлолитических белков в кислом, нейтральном или щелочном диапазоне рН. Альтернативно, клетка-хозяин может быть использована в качестве источника такого полипептида в ферментационном процессе с биомассой. Эта клетка-хозяин может также содержать нативные или гетерологичные гены, которые кодируют целлюлолитический белок, а также другие ферменты, применимые в переработке биомассы.
Биомасса может включать в себя, но не ограничивается ими, древесные ресурсы, муниципальные твердые отходы, бумажные отходы, посевы и остатки посевов (см., например, Wiselogel et al., 1995, in Handbook on Bioethanol (Charles E. Wyman, editor), pp. 105-118, Taylor & Francis, Washington DC; Wyman, 1994, Bioresource Technology 50: 3-16; Lynd, 1990, Applied Biochemistry and Biotechnology 24/25: 695-719; Mosier et al., 1999, Recent Progress in Bioconversion of Lignocellulosics, in Advances in Biochemical Engineering/Biotechnology, T. Scheper, managing editor, Volume 65, pp. 23-40, Springer-Verlag, New York).
Преобладающим полисахаридом в первичной клеточной стенке биомассы является целлюлоза, вторичным наиболее преобладающим полисахаридом является гемицеллюлоза, и третьим полисахаридом является пектин. Вторичная клеточная стенка, образуемая после остановки роста клетки, также содержит полисахариды и укреплена полимерным лигнином, ковалентно сшитым с гемицеллюлозой. Целлюлоза является гомополимером ангидроцеллобиозы и, следовательно, линейным бета-(1-4)-D-глюканом, в то время как гемицеллюлозы включают в себя разные соединения, такие как ксиланы, ксилоглюканы, арабиноглюканы и маннаны в сложных разветвленных структурах со спектром заместителей. Хотя обычно являющаяся полиморфной, целлюлоза обнаруживается в ткани растений прежде всего в виде нерастворимого кристаллического матрикса параллельных глюкановых цепей. Гемицеллюлозы обычно связаны водородными связями с целлюлозой, а также с другими гемицеллюлозами, которые способствуют стабилизации матрикса клеточной стенки.
Полипептиды, имеющие целлюлолитическую усиливающую активность, и их полинуклеотиды
В первом аспекте, выделенные полипептиды, имеющие целлюлолитическую усиливающую активность, содержат следующий мотив:
[ILMV]-P-x(4,5)-G-x-Y-[ILMV]-x-R-x-[EQ]-x(3)-A-[HNQ], где x обозначает любую аминокислоту, x(4,5) обозначает любую аминокислоту в смежных положениях 4 и 5 и x(3) обозначает любую аминокислоту в 3 смежных положениях. В вышеуказанном мотиве используется общепринятое однобуквенное сокращение аминокислот IUPAC.
Во втором аспекте, выделенные полипептиды, имеющие целлюлолитическую усиливающую активность, имеют аминокислотную последовательность, которая имеет степень идентичности со зрелым полипептидом SEQ ID NO: 2 (т.е. зрелым полипептидом), по меньшей мере, 75%, предпочтительно, по меньшей мере, 80%, более предпочтительно, по меньшей мере, 85%, даже более предпочтительно, по меньшей мере, 90%, наиболее предпочтительно, по меньшей мере, 95% и даже наиболее предпочтительно, по меньшей мере, 96%, 97%, 98% или 99%, и имеют целлюлолитическую усиливающую активность (далее «гомологичные полипептиды»). В предпочтительном аспекте, эти гомологичные полипептиды имеют аминокислотную последовательность, которая отличается десятью аминокислотами, предпочтительно пятью аминокислотами, наиболее предпочтительно двумя аминокислотами и даже наиболее предпочтительно одной аминокислотой от зрелого полипептида SEQ ID NO:2.
Полипептид, имеющий целлюлолитическую усиливающую активность, данного изобретения предпочтительно включает аминокислотную последовательность SEQ ID NO:2 или ее аллельный вариант; или ее фрагмент, который имеет целлюлолитическую усиливающую активность. В предпочтительном аспекте, полипептид включает аминокислотную последовательность SEQ ID NO:2. В другом предпочтительном аспекте, полипептид включает зрелый полипептид SEQ ID NO:2. В другом предпочтительном аспекте, полипептид включает аминокислоты 20-249 SEQ ID NO:2 или ее аллельный вариант; или ее фрагмент, который имеет целлюлолитическую усиливающую активность. В другом предпочтительном аспекте, полипептид включает аминокислоты 20-249 SEQ ID NO:2. В другом предпочтительном аспекте, полипептид включает аминокислотную последовательность SEQ ID NO:2 или ее аллельный вариант; или ее фрагмент, который имеет целлюлолитическую усиливающую активность. В другом предпочтительном аспекте, полипептид включает аминокислотную последовательность SEQ ID NO:2. В другом предпочтительном аспекте, полипептид включает зрелый полипептид SEQ ID NO:2. В другом предпочтительном аспекте, полипептид включает аминокислоты 20-249 SEQ ID NO:2 или ее аллельный вариант; или ее фрагмент, который имеет целлюлолитическую усиливающую активность. В другом предпочтительном аспекте, полипептид включает аминокислоты 20-249 SEQ ID NO:2.
В третьем аспекте, данное изобретение относится к выделенным полипептидам, имеющим целлюлолитическую усиливающую активность, которые кодируются полинуклеотидами, которые гибридизуются, по меньшей мере, при условиях очень низкой строгости, предпочтительно, по меньшей мере, при условиях низкой строгости, более предпочтительно, по меньшей мере, при условиях средней строгости, более предпочтительно, по меньшей мере, при условиях средней-высокой строгости, даже более предпочтительно, по меньшей мере, при условиях высокой строгости и наиболее предпочтительно, по меньшей мере, при условиях очень высокой строгости с (i) кодирующей зрелый полипептид последовательностью SEQ ID NO:1, (ii) геномной последовательностью ДНК, содержащей кодирующую зрелый полипептид последовательностью SEQ ID NO:1, (iii) субпоследовательностью (i) или (ii), или (iv) комплементарной цепью (i), (ii) или (iii) (J. Sambrook, E. F. Fritsch, and T. Maniatus, 1989, Molecular Cloning, A Laboratory Manual, 2d edition, Cold Spring Harbor, New York). Субпоследовательность кодирующей зрелый полипептид последовательности SEQ ID NO:1 содержит, по меньшей мере, 100 смежных нуклеотидов или, по меньшей мере, 200 смежных нуклеотидов. Кроме того, эта субпоследовательность может кодировать полипептидный фрагмент, который имеет целлюлолитическую усиливающую активность. В предпочтительном аспекте, кодирующая зрелый полипептид последовательность является нуклеотидами 77-766 SEQ ID NO:1.
Нуклеотидная последовательность SEQ ID NO:1 или ее субпоследовательность; а также аминокислотная последовательность SEQ ID NO:2 или ее фрагмент могут быть использованы для конструирования зонда нуклеиновой кислоты для идентификации и клонирования ДНК, кодирующей полипептиды, имеющие целлюлолитическую усиливающую активность, из штаммов разных родов и видов в соответствии со способами, хорошо известными в этой области. В частности, такие зонды могут быть использованы для гибридизации с геномной ДНК или кДНК представляющего интерес рода или вида, в соответствии со стандартными процедурами блоттинга по Саузерну, для идентификации и выделения соответствующего гена в них. Такие зонды могут быть значительно более короткими, чем полная последовательность, но должны иметь длину, по меньшей мере, 14, предпочтительно, по меньшей мере, 25, более предпочтительно, по меньшей мере, 35 и наиболее предпочтительно, по меньшей мере, 70 нуклеотидов. Однако, предпочтительно, чтобы этот зонд нуклеиновой кислоты имел длину, по меньшей мере, 100 нуклеотидов. Например, зонд нуклеиновой кислоты может иметь длину, по меньшей мере, 200 нуклеотидов, предпочтительно, по меньшей мере, 300 нуклеотидов, более предпочтительно, по меньшей мере, 400 нуклеотидов или наиболее предпочтительно, по меньшей мере, 500 нуклеотидов. Могут быть использованы даже более длинные зонды, например зонды нуклеиновых кислот, которые имеют длину, по меньшей мере, 600 нуклеотидов, предпочтительно, по меньшей мере, 700 нуклеотидов, более предпочтительно, по меньшей мере, 800 нуклеотидов или наиболее предпочтительно, по меньшей мере, 900 нуклеотидов. Могут быть использованы как ДНК-, так и РНК-зонды. Эти зонды обычно метят для детектирования соответствующего гена (например, 32P, 3H, 35S, биотином или авидином). Такие зонды включены в данное изобретение.
Таким образом, библиотека геномной ДНК или кДНК, полученная из таких организмов, может быть подвергнута скринингу на ДНК, которая гибридизуется с описанными выше зондами и которая кодирует полипептид, имеющий целлюлолитическую усиливающую активность. Геномная или другая ДНК из таких других организмов может быть отделена электрофорезом в агарозном или полиакриламидном геле или другими способами отделения. ДНК из этих библиотек или отделенная ДНК может быть перенесена на нитроцеллюлозу или другой подходящий материал-носитель или иммобилизована на нем. Для идентификации клона или ДНК, которая гомологична с SEQ ID NO:1 или ее субпоследовательностью, этот материал-носитель используют в блоте по Саузерну.
Для целей данного изобретения, гибридизация показывает, что эта нуклеотидная последовательность гибридизуется с меченым зондом нуклеиновой кислоты, соответствующим кодирующей зрелый полипептид последовательности SEQ ID NO:1, последовательности геномной ДНК, содержащей кодирующую зрелый полипептид последовательность SEQ ID NO:1, ее комплементарной цепи или ее субпоследовательности, при условиях очень низкой - очень высокой строгости. Молекулы, с которыми гибридизуется этот зонд при этих условиях, могут быть детектированы с использованием, например, рентгеновской пленки.
В предпочтительном аспекте, этот зонд нуклеиновой кислоты является кодирующей зрелый полипептид последовательностью SEQ ID NO:1. В другом предпочтительном аспекте, зонд нуклеиновой кислоты является нуклеотидами 73 - 1259 SEQ ID NO:1. В другом предпочтительном аспекте, этот зонд нуклеиновой кислоты является полинуклеотидной последовательностью, которая кодирует полипептид SEQ ID NO:2 или его субпоследовательность. В другом предпочтительном аспекте, этот зонд нуклеиновой кислоты является SEQ ID NO:1. В другом предпочтительном аспекте, зонд нуклеиновой кислоты является полинуклеотидной последовательностью, содержащейся в плазмиде pTr3337, которая содержится в Escherichia coli NRRL B-30878, где эта полинуклеотидная последовательность кодирует полипептид, имеющий целлюлолитическую усиливающую активность. В другом предпочтительном аспекте, зонд нуклеиновой кислоты является кодирующим зрелый полипептид районом, содержащимся в плазмиде pTr3337, которая содержится в Escherichia coli NRRL B-30878.
Для длинных зондов с длиной, по меньшей мере, 100 нуклеотидов, условия очень низкой - очень высокой строгости определяются как предгибридизация и гибридизация при 42°C в 5X SSPE, 0,3% ДСН, 200 мкг/мл подвергнутой срезающему усилию и денатурированной ДНК спермы лосося и либо 25% формамиде для очень низкой и низкой строгости, 35% формамиде для средней - высокой строгости или 50% формамиде для высокой и очень высокой строгости в соответствии со стандартными процедурами блоттинга по Саузерну в течение 12-24 часов в оптимальном случае.
Для длинных зондов с длиной, по меньшей мере, 100 нуклеотидов, материал-носитель промывают в конце три раза, каждый раз в течение 15 минут, с использованием 2X SSC, 0,2% ДСН предпочтительно, по меньшей мере, при 45°C (очень низкая строгость), более предпочтительно, по меньшей мере, при 50°C (низкая строгость), более предпочтительно, по меньшей мере, при 55°C (средняя строгость), более предпочтительно, по меньшей мере, при 60°C (средняя-высокая строгость), даже более предпочтительно, по меньшей мере, при 65°C (высокая строгость) и наиболее предпочтительно, по меньшей мере, при 70°C (очень высокая строгость).
Для коротких зондов, которые имеют длину приблизительно 15 - приблизительно 70 нуклеотидов, условия строгости определяются как предгибридизация, гибридизация и постгибридизация с промыванием при приблизительно 5°C - приблизительно 10°C ниже рассчитанной Tm с использованием расчета согласно Bolton and McCarthy (1962, Proceedings of the National Academy of Sciences USA 48:1390) в 0,9 M NaCI, 0,09 M Tris-HCl, pH 7,6, 6 мM ЭДТА, 0,5% NP-40, 1X растворе Денхардта, 1 мМ пирофосфате натрия, 1 мМ одноосновном фосфате натрия, 0,1 мМ АТФ и 0,2 мг РНК дрожжей на мл в соответствии со стандартными процедурами блоттинга по Саузерну в течение 12-24 часов в оптимальном случае.
Для коротких зондов, которые имеют длину приблизительно 15 - приблизительно 70 нуклеотидов, материал-носитель промывают один раз в 6X SCC плюс 0,1% ДСН в течение 15 минут и два раза, в каждом случае в течение 15 минут, с использованием 6X SSC при 5°C-10°C ниже рассчитанной Tm.
В четвертом аспекте, полипептидами, имеющими целлюлолитическую усиливающую активность, могут быть искусственные варианты, содержащие консервативную замену, делецию и/или инсерцию одной или более аминокислот зрелого полипептида SEQ ID NO:2 или его гомологичной последовательности; или его зрелого полипептида. Предпочтительно, изменения аминокислот являются минорными изменениями, т.е. консервативными аминокислотными заменами или инсерциями, которые не влияют значимо на укладку и/или активность этого белка; малыми делециями, обычно одной - приблизительно 30 аминокислот; малыми амино- или карбоксил-удлинениями, такими как амино-концевой остаток метионина; малым линкерным пептидом до приблизительно 20-25 остатков; или малым удлинением, которое облегчает очистку изменением суммарного заряда или другой функции, таким как полигистидиновый участок, антигенный эпитоп или связывающий домен.
Примеры консервативных замен находятся в группе основных аминокислот (аргинин, лизин и гистидин), кислотных аминокислот (глутаминовая кислота и аспарагиновая кислота), полярных аминокислот (глутамин и аспарагин), гидрофобных аминокислот (лейцин, изолейцин и валин), ароматических аминокислот (фенилаланин, триптофан и тирозин) и малых аминокислот (глицин, аланин, серин, треонин и метионин). Аминокислотные замены, которые обычно не изменяют удельную активность, известны в данной области и описаны, например, H. Neurath and R.L. Hill, 1979, In, The Proteins, Academic Press, New York. Наиболее часто встречающимися заменами являются Ala/Ser, Val/lle, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Tyr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/lle, Leu/Val, Ala/Glu и Asp/Gly.
Кроме 20 стандартных аминокислот, нестандартные аминокислоты (такие, как 4-гидроксипролин, 6-N-метиллизин, 2-аминоизомасляная кислота, изовалин и альфа-метилсерин) могут заменять аминокислотные остатки полипептида дикого типа. Ограниченное количество неконсервативных аминокислот, аминокислот, которые не кодируются генетическим кодом, и неприродных аминокислот могут замещать аминокислотные остатки. «Неприродные аминокислоты» были модифицированы после синтеза белка и/или имеют химическую структуру в их боковой цепи (боковых цепях), отличающуюся от структуры стандартных аминокислот. Неприродные аминокислоты могут быть синтезированы химически и предпочтительно являются коммерчески доступными и включают в себя пипеколиновую кислоту, тиазолидинкарбоновую кислоту, дигидропролин, 3- и 4-метилпролин и 3,3-диметилпролин.
Альтернативно, аминокислотные изменения имеют такую природу, что изменяются физико-химические свойства этих полипептидов. Например, аминокислотные изменения могут улучшать теплостойкость полипептида, изменять оптимум рН и т.п.
Незаменимые аминокислоты в исходном полипептиде могут быть идентифицированы в соответствии с процедурами, известными в этой области, такими как сайт-направленный мутагенез или аланин-сканирующий мутагенез (Cunningham and Wells, 1989, Science 244: 1081-1085). В последнем способе отдельные мутации аланина вводят в каждом остатке в этой молекуле и полученные мутантные молекулы испытывают на биологическую активность (например, целлюлолитическую усиливающую активность) для идентификации аминокислотных остатков, которые являются решающими в отношении активности этой молекулы. См., также, Hilton et al., 1996, J. Biol. Chem. 271: 4699-4708. Активный центр фермента или другое биологическое взаимодействие могут быть также определены физическим анализом структуры, с использованием таких способов, как ядерный магнитный резонанс, кристаллография, дифракция электронов или фотоаффинное мечение, вместе с мутацией аминокислот предположительного сайта контакта. См., например, de Vos et al., 1992, Science 255: 306-312; Smith et al., 1992, J. MoI. Biol. 224: 899-904; Wlodaver et al., 1992, FEBS Lett. 309: 59-64. Идентичности незаменимых аминокислот могут быть также определены из анализа идентичностей с полипептидами, которые являются родственными полипептиду в соответствии с данным изобретением.
Замены единственной аминокислоты или множественных аминокислот могут быть произведены и тестированы с использованием известных способов мутагенеза, рекомбинации и/или перетасовки, с последующей релевантной процедурой скрининга, таких как способы, описанные Reidhaar-Olson and Sauer, 1988, Science 241: 53-57; Bowie and Sauer, 1989, Proc. Natl. Acad. Sci USA 86: 2152-2156; WO 95/17413 или WO 95/22625. Другие способы, которые могут быть использованы, включают в себя склонную к ошибкам ПЦР, фаговый дисплей (например, Lowman et al., 1991, Biochem. 30: 10832-10837; Патент США № 5223409; WO 92/06204), и район-направленный мутагенез (Derbyshire et al., 1986, Gene 46: 145; Ner et al., 1988, DNA 7: 127).
Способы мутагенеза/перетасовки могут быть комбинированы с высокопроизводительными способами скрининга для детектирования активности клонированных, мутагенизированных полипептидов, экспрессируемых клетками-хозяевами (Ness et al., 1999, Nature Biotechnology 17: 893-896). Молекулы мутагенизированной ДНК, которые кодируют активные полипептиды, могут быть извлечены из клеток-хозяев и быстро секвенированы с использованием стандартных способов этой области. Эти способы позволяют быстрое определение важности индивидуальных аминокислотных остатков в представляющем интерес полипептиде и могут быть применены к полипептидам неизвестной структуры.
Общее число аминокислотных замен, делеций и/или инсерций зрелого полипептида SEQ ID NO:2 равно 10, предпочтительно 9, более предпочтительно 8, более предпочтительно 7, более предпочтительно не более 6, более предпочтительно не более 5, более предпочтительно 4, даже более предпочтительно 3, наиболее предпочтительно 2 и даже наиболее предпочтительно 1.
Полипептид, имеющий целлюлолитическую усиливающую активность, данного изобретения может быть получен из микроорганизмов любого рода. Для целей данного изобретения, термин «получен из» в связи с конкретным источником будет в этом контексте означать, что полипептид, кодируемый конкретной нуклеотидной последовательностью, продуцируется источником или штаммом, в котором была встроена нуклеотидная последовательность из этого источника. В предпочтительном аспекте, полипептид, полученный из конкретного источника, секретируется внеклеточно.
Полипептид данного изобретения может быть бактериальным полипептидом. Например, этот полипептид может быть полипептидом грамположительной бактерии, таким как полипептид Bacillus, Streptococcus, Streptomyces, Staphylococcus, Enterococcus, Lactobacillus, Lactococcus, Clostridium, Geobacillus или Oceanobacillus, имеющий целлюлолитическую усиливающую активность, или полипептидом грамотрицательной бактерии, таким как полипептид E. coli, Pseudomonas, Salmonella, Campylobacter, Helicobacter, Flavobacterium, Fusobacterium, Ilyobacter, Neisseria или Ureaplasma, имеющий целлюлолитическую усиливающую активность.
В предпочтительном аспекте, этот полипептид является полипептидом Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus clausii, Bacillus coagulans, Bacillus firmus, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus pumilus, Bacillus stearothermophilus, Bacillus subtilis или Bacillus thuringiensis, имеющим целлюлолитическую усиливающую активность.
В другом предпочтительном аспекте, этот полипептид является полипептидом Streptococcus equisimilis, Streptococcus pyogenes, Streptococcus uberis или Streptococcus equi subsp. Zooepidemicus, имеющим целлюлолитическую усиливающую активность.
В другом предпочтительном аспекте, этот полипептид является полипептидом Streptomyces achromogenes, Streptomyces avermitilis, Streptomyces coelicolor, Streptomyces griseus или Streptomyces lividans, имеющим целлюлолитическую усиливающую активность.
Полипептид, имеющий целлюлолитическую усиливающую активность, может быть также грибным полипептидом и более предпочтительно полипептидом дрожжей, таким как полипептид Candida, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia, имеющим целлюлолитическую усиливающую активность; или более предпочтительно полипептидом мицелиальных грибов, таким как полипептид Acremonium, Aspergillus, Aureobasidium, Cryptococcus, Filibasidium, Fusarium, Humicola, Magnaporthe, Mucor, Myceliophthora, Neocallimastix, Neurospora, Paecilomyces, Penicillium, Piromyces, Schizophyllum, Talaromyces, Thermoascus, Thielavia, Tolypocladium или Trichoderma, имеющий целлюлолитическую усиливающую активность.
В предпочтительном аспекте, этот полипептид является полипептидом Saccharomyces carlsbergensis, Saccharomyces cerevisiae, Saccharomyces diastaticus, Saccharomyces douglasii, Saccharomyces kluyveri, Saccharomyces norbensis или Saccharomyces oviformis, имеющим целлюлолитическую усиливающую активность.
В другом предпочтительном аспекте, этот полипептид является полипептидом Aspergillus aculeatus, Aspergillus awamori, Aspergillus fumigatus, Aspergillus foetidus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger, Aspergillus oryzae, Coprinus cinereus, Diplodia gossyppina, Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides, Fusarium venenatum, Humicola insolens, Humicola lanuginosa, Magnaporthe grisea, Mucor miehei, Myceliophthora thermophila, Neurospora crassa, Penicillium purpurogenum, Phanerochaete chrysosporium, Pseudoplectania nigrella, Thermoascus aurantiacus, Thielavia terrestris, Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei, Trichoderma viride или Trichophaea saccata, имеющим целлюлолитическую усиливающую активность.
В более предпочтительном аспекте, этот полипептид является полипептидом Trichoderma reesei. В наиболее предпочтительном аспекте этот полипептид является полипептидом Trichoderma reesei RutC30 (ATCC 56765), например полипептидом с аминокислотной последовательностью SEQ ID NO:2, или его фрагментами, например зрелым полипептидом.
Должно быть понятно, что для вышеуказанных видов это изобретение включает в себя как безупречное, так и небезупречное состояния и другие таксономические эквиваленты, например анаморфы, независимо от названия вида, под которым они известны. Специалисты данной области легко узнают идентичность подходящих эквивалентов.
Штаммы этих видов являются легко доступными публично в ряде коллекций культур, таких как Американская Коллекция Типовых Культур (ATCC), Немецкая коллекция микроорганизмов и культур клеток GmbH (DSM), Центральное бюро плесневых культур (CBS) и Agricultural Research Service Patent Culture Collection, Northern Regional Research Center (NRRL).
Кроме того, такие полипептиды могут быть идентифицированы и получены из других источников, в том числе микроорганизмов, выделенных из природы (например, почвы, компостов, воды и т.д.) с использованием вышеуказанных зондов. Способы выделения микроорганизмов из природных местообитаний хорошо известны в данной области. Затем полинуклеотид может быть получен подобным образом при помощи скрининга библиотеки геномной ДНК или кДНК такого микроорганизма. После детектирования с использованием зонда (зондов) последовательности полинуклеотида, кодирующей полипептид, этот полинуклеотид может быть выделен или клонирован с использованием способов, которые хорошо известны специалистам данной области (см., например, Sambrook et al., 1989, supra).
Полипептиды, имеющие целлюлолитическую усиливающую активность, включают в себя слитые полипептиды или расщепляемые слитые полипептиды, в которых другой полипептид слит на N-конце или С-конце этого полипептида или его фрагмента, имеющего целлюлолитическую усиливающую активность. Слитый полипептид получают слиянием нуклеотидной последовательности (или ее части), кодирующей другой полипептид, с нуклеотидной последовательностью (или ее частью), кодирующей полипептид, имеющий целлюлолитическую усиливающую активность. Способы получения слитых полипептидов известны в этой области и включают в себя лигирование кодирующих последовательностей, кодирующих эти полипептиды, таким образом, что они находятся в рамке считывания и что экспрессия слитого полипептида находится под контролем одного и того же промотора (одних и тех же промоторов) и терминатора.
Полинуклеотиды, имеющие нуклеотидные последовательности, которые кодируют полипептиды, имеющие целлюлолитическую усиливающую активность, могут быть выделены и использованы для выполнения на практике способов данного изобретения, описанных здесь.
В предпочтительном аспекте, эта нуклеотидная последовательность представлена в SEQ ID NO:1. В другом более предпочтительном аспекте, эта нуклеотидная последовательность является последовательностью, содержащейся в плазмиде pTr3337, которая содержится в E. coli NRRL B-30878. В другом предпочтительном аспекте, эта нуклеотидная последовательность является кодирующим зрелый полипептид районом SEQ ID NO:1. В другом предпочтительном аспекте, эта нуклеотидная последовательность является нуклеотидами 77-766 SEQ ID NO:1. В другом более предпочтительном аспекте, эта нуклеотидная последовательность является кодирующим зрелый полипептид районом, содержащимся в плазмиде pTr3337, которая содержится в E. coli NRRL B-30878. Данное изобретение включает в себя также нуклеотидные последовательности, которые кодируют полипептид, имеющий аминокислотную последовательность SEQ ID NO:2 или ее зрелый полипептид, которые отличаются от SEQ ID NO:1 или ее кодирующей зрелый полипептид последовательности вследствие вырожденности генетического кода. Данное изобретение относится также к субпоследовательностям SEQ ID NO:1, которые кодируют фрагменты SEQ ID NO:2, имеющие целлюлолитическую усиливающую активность.
Данное изобретение относится также к мутантным полинуклеотидам, содержащим, по меньшей мере, одну мутацию в кодирующей зрелый полипептид последовательности SEQ ID NO:1, в которых эта мутантная нуклеотидная последовательность кодирует зрелый полипептид SEQ ID NO:2. В предпочтительном аспекте, этот зрелый полипептид является аминокислотами 20-249 SEQ ID NO:2.
Способы, используемые для выделения или клонирования полинуклеотида, кодирующего полипептид, известны в этой области и включают в себя выделение из геномной ДНК, получение из кДНК или их комбинаций. Клонирование полинуклеотидов из такой геномной ДНК может выполняться, например, с использованием хорошо известной полимеразной цепной реакции (ПЦР) или скрининга при помощи антител экспрессионных библиотек для детектирования клонированных фрагментов ДНК с общими структурными признаками. См., например, Innis et al., 1990, PCR: A Guide to Methods and Application, Academic Press, New York. Могут быть использованы другие процедуры амплификации нуклеиновых кислот, такие как лигазная цепная реакция (LCR), лигированная активированная транскрипция (LAT) и амплификация на основе нуклеотидной последовательности (NASBA). Эти полинуклеотиды могут быть клонированы в штамме Trichoderma или другом или родственном организме и, следовательно, могут быть, например, аллельным или видовым вариантом кодирующего полипептид района этой нуклеотидной последовательности.
В способах этого изобретения полинуклеотиды имеют нуклеотидные последовательности, которые имеют степень идентичности с кодирующей зрелый полипептид последовательностью SEQ ID NO:1 (т.е. нуклеотидами 388-1332), по меньшей мере, 75%, предпочтительно, по меньшей мере, 80%, более предпочтительно, по меньшей мере, 85%, даже более предпочтительно, по меньшей мере, 90%, наиболее предпочтительно, по меньшей мере, 95% и даже наиболее предпочтительно, по меньшей мере, 96%, 97%, 98% или 99%, которые кодируют активный полипептид.
Может быть необходима модификация нуклеотидной последовательности, кодирующей полипептид, имеющий целлюлолитическую усиливающую активность, для синтеза полипептидов, существенно сходных с этим полипептидом. Термин «существенно сходные» с этим полипептидом относится к не встречающимся в природе формам этого полипептида. Эти полипептиды могут отличаться некоторым сконструированным признаком от полипептида, выделенного из его природного источника, например искусственные варианты, которые отличаются по удельной активности, термостабильности, оптимуму рН или т. п. Эта вариантная последовательность может быть сконструирована на основе нуклеотидной последовательности, представленной в виде кодирующего полипептид района SEQ ID NO:1, например ее субпоследовательности, и/или введением нуклеотидных замен, которые не приводят к другой аминокислотной последовательности полипептида, кодируемого этой нуклеотидной последовательностью, но которые соответствуют использованию кодонов организма-хозяина, предназначенного для получения этого фермента, или введением нуклеотидных замен, которые могут привести к отличающейся аминокислотной последовательности. В отношении общего описания замены нуклеотидов см., например, Ford et al., 1991, Protein Expression and Purification 2: 95-107.
Специалисту данной области будет понятно, что такие замены могут быть произведены вне районов, критических для функции этой молекулы, но все еще приводить к активному полипептиду. Аминокислотные остатки, незаменимые для активности полипептида, кодируемого выделенным полинуклеотидом этого изобретения, и, следовательно, не подвергаемые замене, могут быть идентифицированы в соответствии с процедурами, известными в этой области, такими как сайт-направленный мутагенез или аланин-сканирующий мутагенез (см., например, Cunningham and Wells, 1989, Science 244: 1081-1085). В последнем способе, мутации вводят в каждом положительно заряженном остатке в этой молекуле и полученные мутантные молекулы испытывают на целлюлолитическую усиливающую активность для идентификации аминокислотных остатков, которые являются критическими в отношении активности этой молекулы. Сайты взаимодействия субстрат-фермент могут быть также определены анализом трехмерной структуры, определяемой такими способами, как анализ с использованием ядерного магнитного резонанса, кристаллография или фотоаффинное мечение (см., например, de Vos et al., 1992, Science 255: 306-312; Smith et al., 1992, Journal of Molecular Biology 224: 899-904; Wlodaver et al., 1992, FEBS Letters 309: 59-64).
Этим полинуклеотидом может быть полинуклеотид, кодирующий полипептид, имеющий целлюлолитическую усиливающую активность, который гибридизуется, по меньшей мере, при условиях очень низкой строгости, предпочтительно, по меньшей мере, при условиях низкой строгости, более предпочтительно, по меньшей мере, при условиях средней строгости, более предпочтительно, по меньшей мере, при условиях средней-высокой строгости, даже более предпочтительно, по меньшей мере, при условиях высокой строгости и наиболее предпочтительно, по меньшей мере, при условиях очень высокой строгости с (i) кодирующей зрелый полипептид последовательностью SEQ ID NO:1, (ii) геномной последовательностью ДНК, содержащей кодирующую зрелый полипептид последовательность SEQ ID NO:1, или (iii) комплементарной цепью (i) или (ii); или его аллельными вариантами и субпоследовательностями (Sambrook et al., 1989, supra), определенными здесь. В предпочтительном аспекте, кодирующая зрелый полипептид последовательность является нуклеотидами 77-766 SEQ ID NO:1.
Конструкции нуклеиновых кислот
Выделенный полинуклеотид, кодирующий полипептид, имеющий целлюлолитическую усиливающую активность, может быть подвергнут манипуляции различными путями для обеспечения экспрессии этого полипептида конструированием конструкции нуклеиновой кислоты выделенного полинуклеотида, кодирующего полипептид, имеющий целлюлолитическую усиливающую активность, функционально связанного с одной или несколькими регуляторными последовательностями, которые управляют экспрессией кодирующей последовательности, в подходящей клетке-хозяине при условиях, совместимых с этими регуляторными последовательностями. Манипуляция в отношении этой последовательности полинуклеотида перед его встраиванием в вектор может быть желательной или необходимой в зависимости от экспрессирующего вектора. Способы модификации полинуклеотидных последовательностей, использующие способы рекомбинантных ДНК, хорошо известны в данной области.
Регуляторная последовательность может быть подходящей промоторной последовательностью, нуклеотидной последовательностью, которая узнается клеткой-хозяином для экспрессии полинуклеотида, кодирующего полипептид, имеющий целлюлолитическую усиливающую активность. Эта промоторная последовательность содержит регуляторные последовательности транскрипции, которые опосредуют экспрессию этого полипептида. Этот промотор может быть любой нуклеотидной последовательностью, которая обнаруживает транскрипционную активность в выбранной клетке-хозяине, в том числе мутантным, усеченным и гибридным промоторами, и может быть получен из генов, кодирующих внеклеточные или внутриклеточные полипептиды, гомологичные или гетерологичные относительно этой клетки-хозяина.
Примерами подходящих промоторов для управления транскрипцией конструкций нуклеиновых кислот, в частности, в бактериальной клетке-хозяине являются промоторы, полученные из оперона lac E. coli, гена агаразы (dagA) Streptomyces coelicolor, гена левансахаразы (sacB) Bacillus subtilis, гена альфа-амилазы (amyL) Bacillus licheniformis, гена амилазы (amyM) Bacillus stearothermophilus maltogenic, гена альфа-амилазы (amyQ) Bacillus amyloliquefaciens, гена пенициллиназы (penP) Bacillus licheniformis, генов xylA and xylB Bacillus subtilis и прокариотического гена бета-лактамазы (Villa-Kamaroff et al., 1978, Proceedings of the National Academy of Sciences USA 75: 3727-3731), а также промотор tac (DeBoer et al., 1983, Proceedings of the National Academy of Sciences USA 80: 21-25). Дополнительные промоторы описаны в "Useful proteins from recombinant bacteria" in Scientific American, 1980, 242: 74-94; и в Sambrook et al., 1989, supra.
Примерами подходящих промоторов для управления транскрипцией конструкций нуклеиновых кислот в клетке-хозяине мицелиальных грибов являются промоторы, полученные из генов амилазы ТАКА Aspergillus oryzae, аспартатпротеиназы Rhizomucor miehei, нейтральной альфа-амилазы Aspergillus niger, кислотоустойчивой альфа-амилазы Aspergillus niger, глюкоамилазы (glaA) Aspergillus niger или Aspergillus awamori, липазы Rhizomucor miehei, щелочной фосфатазы Aspergillus oryzae, триозофосфатизомеразы Aspergillus oryzae, ацетамидазы Aspergillus nidulans, амилоглюкозидазы Fusarium venenatum (WO 00/56900), Fusarium venenatum Daria (WO 00/56900), Fusarium venenatum Quinn (WO 00/56900), трипсин-подобной протеазы Fusarium oxysporum (WO 96/00787), бета-глюкозидазы Trichoderma reesei, целлобиогидролазы I Trichoderma reesei, целлобиогидролазы II Trichoderma reesei, эндоглюканазы I Trichoderma reesei, эндоглюканазы II Trichoderma reesei, эндоглюканазы III Trichoderma reesei, эндоглюканазы IV Trichoderma reesei, эндоглюканазы V Trichoderma reesei, ксиланазы I Trichoderma reesei, ксиланазы II Trichoderma reesei, бета-ксилозидазы Trichoderma reesei, а также промотор NA2-tpi (гибрид промоторов из генов нейтральной альфа-амилазы Aspergillus niger и триозофосфатизомеразы Aspergillus oryzae); и их мутантные, укороченные и гибридные промоторы.
В клетках-хозявах дрожжей, применимые промоторы получают из генов энолазы (ENO-1) Saccharomyces cerevisiae, галактокиназы (GAL1) Saccharomyces cerevisiae, алкогольдегидрогеназы/глицеральдегид-3-фосфатдегидрогеназы (ADH1, ADH2/GAP) Saccharomyces cerevisiae, триозофосфатизомеразы (ТРI) Saccharomyces cerevisiae, металлотионеина (CUP1) Saccharomyces cerevisiae и 3-фосфоглицераткиназы Saccharomyces cerevisiae. Другие применимые промоторы для клеток-хозяев дрожжей описаны Romanos et al., 1992, Yeast 8: 423-488.
Регуляторная последовательность может быть также подходящей последовательностью терминатора транскрипции, последовательностью, узнаваемой клеткой-хозяином для терминации транскрипции. Эта терминаторная последовательность функционально связана с 3'-концом нуклеотидной последовательности, кодирующей полипептид. Любой терминатор, который является функциональным в выбранной клетке-хозяине, может быть использован в этом изобретении.
Предпочтительные терминаторы для клеток-хозяев мицелиальных грибов получают из генов амилазы ТАКА Aspergillus oryzae, глюкоамилазы Aspergillus niger, антранилатсинтазы Aspergillus nidulans, альфа-глюкозидазы Aspergillus niger и трипсин-подобной протеазы Fusarium oxysporum.
Предпочтительные терминаторы для клеток-хозяев дрожжей получают из генов энолазы Saccharomyces cerevisiae, цитохрома С (CYC1) Saccharomyces cerevisiae и глицеральдегид-3-фосфатдегидрогеназы Saccharomyces cerevisiae. Другие применимые терминаторы для клеток-хозяев дрожжей описаны Romanos et al., 1992, supra.
Регуляторная последовательность может быть также подходящей лидерной последовательностью, нетранслируемым районом мРНК, который важен для трансляции клеткой-хозяином. Эта лидерная последовательность функционально связана с 5'-концом нуклеотидной последовательности, кодирующей этот полипептид. Любая лидерная последовательность, которая функциональна в выбранной клетке-хозяине, может быть использована в данном изобретении.
Предпочтительные лидеры для клеток-хозяев мицелиальных грибов получают из генов амилазы ТАКА Aspergillus oryzae TAKA и триозофосфатизомеразы Aspergillus nidulans.
Подходящие лидеры для клеток-хозяев дрожжей получают из генов энолазы (ENO-1) Saccharomyces cerevisiae, 3-фосфоглицераткиназы Saccharomyces cerevisiae, альфа-фактора Saccharomyces cerevisiae и алкогольдегидрогеназы/глицеральдегид-3-фосфатдегидрогеназы (ADH2/GAP) Saccharomyces cerevisiae.
Регуляторная последовательность может быть также последовательностью полиаденилирования, последовательностью, функционально связанной с 3'-концом этой нуклеотидной последовательности, которая, при транскрипции, узнается клеткой-хозяином в качестве сигнала для добавления остатков полиаденозина к транскрибируемой мРНК. Любая последовательность полиаденилирования, которая функциональна в выбранной клетке-хозяине, может быть использована в этом изобретении.
Предпочтительные последовательности полиаденилирования для клеток-хозяев мицелиальных грибов получают из генов амилазы ТАКА Aspergillus oryzae, глюкоамилазы Aspergillus niger, антранилатсинтазы Aspergillus nidulans, трипсин-подобной протеазы Fusarium oxysporum и альфа-глюкозидазы Aspergillus niger.
Применимые последовательности полиаденилирования для клеток-хозяев дрожжей описаны Guo and Sherman, 1995, Molecular Cellular Biology 15: 5983-5990.
Регуляторная последовательность может быть также кодирующим сигнальный пептид районом, который кодирует аминокислотную последовательность, связанную с амино-концом полипептида, которая направляет кодируемый полипептид в секреторный путь клетки. 5'-конец этой кодирующей последовательности этой нуклеотидной последовательности может неотъемлемо содержать кодирующий сигнальный пептид район, природно связанный в трансляционной рамке считывания с сегментом кодирующего района, который кодирует секретируемый полипептид. Альтернативно, 5'-конец этой кодирующей последовательности может содержать кодирующий сигнальный пептид район, который является чужеродным относительно этой кодирующей последовательности. Этот кодирующий чужеродный сигнальный пептид район может быть необходимым, когда эта кодирующая последовательность природно не содержит кодирующего сигнальный пептид района. Альтернативно, этот кодирующий чужеродный пептид район может просто заменять природный кодирующий сигнальный пептид район для усиления секреции этого полипептида. Однако любой кодирующий сигнальный пептид район, который направляет экспрессируемый полипептид в секреторный путь выбранной клетки-хозяина, т.е. секретирует в культуральную среду, может быть использован в данном изобретении.
Эффективные кодирующие сигнальный пептид районы для бактериальных клеток-хозяев являются кодирующими сигнальный пептид районами, полученными из генов мальтогенной амилазы Bacillus NCIB 11837, альфа-амилазы Bacillus stearothermophilus, субтилизина Bacillus licheniformis, бета-лактамазы Bacillus licheniformis, нейтральных протеаз (nprT, nprS, nprM) Bacillus stearothermophilus и prsA Bacillus subtilis. Дополнительные сигнальные пептиды описаны Simonen and Palva, 1993, Microbiological Reviews 57: 109-137.
Эффективные кодирующие сигнальный пептид районы для клеток-хозяев мицелиальных грибов являются кодирующими сигнальный пептид районами, полученными из генов амилазы ТАКА Aspergillus oryzae, нейтральной амилазы Aspergillus niger, глюкоамилазы Aspergillus niger, аспартатпротеиназы Rhizomucor miehei, целлюлазы Humicola insolens, эндоглюканазы V Humicola insolens и липазы Humicola lanuginosa.
В предпочтительном аспекте, сигнальный пептид содержит аминокислоты 1-19 SEQ ID NO:2 или состоит из аминокислот 1-19 SEQ ID NO:2. В другом предпочтительном аспекте, кодирующий сигнальный пептид район содержит нуклеотиды 20-76 SEQ ID NO:1 или состоит из нуклеотидов 20-76 SEQ ID NO:1.
Применимые сигнальные пептиды для клеток-хозяев дрожжей получают из генов альфа-фактора Saccharomyces cerevisiae и инвертазы Saccharomyces cerevisiae. Другие применимые кодирующие сигнальный пептид районы описаны Romanos et al., 1992, supra.
Регуляторная последовательность может быть также кодирующим пропептид районом, который кодирует аминокислотную последовательность, расположенную на амино-конце полипептида. Полученный полипептид известен как профермент или прополипептид (или зимоген, в некоторых случаях). Прополипептид обычно является неактивным и может быть превращен в зрелый активный полипептид каталитическим или аутокаталитическим отщеплением пропептида от прополипептида. Кодирующий пропептид район может быть получен из генов щелочной протеазы (aprE) Bacillus subtilis, нейтральной протеазы (nrpT) Bacillus subtilis, альфа-фактора Saccharomyces cerevisiae, аспартатпротеиназы Rhizomucor miehei и лакказы Myceliophthora thermophila (WO 95/33836).
Когда при амино-конце полипептида присутствуют районы как сигнального пептида, так и пропептида, район пропептида расположен после амино-конца полипептида, а район сигнального пептида расположен после амино-конца района пропептида.
Может быть также желательным добавление регуляторных последовательностей, которые позволяют регуляцию экспрессии этого полипептида относительно роста клетки-хозяина. Примерами регуляторных систем являются регуляторные системы, которые вызывают включение или выключение экспрессии в ответ на химический или физический стимул, в том числе на присутствие регуляторного соединения. Регуляторные системы в прокариотических системах включают в себя системы операторов lac, tac и trp. В дрожжах может быть использована система ADH2 или система GAL1. В мицелиальных грибах, в качестве регуляторных последовательностей может быть использован промотор альфа-амилазы ТАКА, промотор глюкоамилазы Aspergillus niger и промотор глюкоамилазы Aspergillus oryzae. Другими примерами регуляторных последовательностей являются регуляторные последовательности, которые делают возможной амплификацию генов. В эукариотических системах они включают в себя ген дигидрофолатредуктазы, который амплифицируется в присутствии метотрексата, и гены металлотионеина, которые амплифицируются тяжелыми металлами. В этих случаях, нуклеотидная последовательность, кодирующая этот полипептид, может быть функционально связана с этой регуляторной последовательностью.
Экспрессирующие векторы
Различные нуклеиновые кислоты и регуляторные последовательности, описанные здесь, могут быть соединены вместе для получения рекомбинантного экспрессирующего вектора, содержащего полинуклеотид, кодирующий полипептид, имеющий целлюлолитическую усиливающую активность, промотор и стоп-сигналы транскрипции и трансляции. Эти экспрессирующие векторы могут включать в себя один или несколько подходящих сайтов рестрикции для создания возможности встраивания или замены нуклеотидной последовательности, кодирующей этот полипептид, в таких сайтах. Альтернативно, полинуклеотид, кодирующий полипептид, имеющий целлюлолитическую усиливающую активность, может быть экспрессирован встраиванием этой нуклеотидной последовательности или конструкции нуклеиновой кислоты, содержащей эту последовательность, в подходящий вектор для экспрессии. В создании этого экспрессирующего вектора кодирующую последовательность помещают в векторе таким образом, что эта кодирующая последовательность функционально связана с подходящими регуляторными последовательностями для экспрессии.
Рекомбинантным экспрессирующим вектором может быть любой вектор (например, плазмида или вирус), который может быть легко подвергнут процедурам рекомбинантных ДНК и может вызывать экспрессию нуклеотидной последовательности. Выбор вектора будет обычно зависеть от совместимости вектора с клеткой-хозяином, в которую должен быть введен этот вектор. Векторы могут быть линейными или замкнутыми кольцевыми плазмидами.
Вектор может быть автономно реплицирующимся вектором, т.е. вектором, который существует в виде внехромосомной частицы, репликация которой не зависит от хромосомной репликации, например плазмиды, внехромосомного элемента, минихромосомы или искусственной хромосомы. Вектор может содержать любое средство для гарантии саморепликации. Альтернативно, вектор может быть вектором, который, при введении в клетку-хозяина, интегрируется в ее геном и реплицируется вместе с хромосомой (хромосомами), в которые он был интегрирован. Кроме того, могут быть использованы единственный вектор, или единственная плазмида, или два или более векторов или плазмид, которые вместе содержат общую ДНК для введения в геном клетки-хозяина, или может быть использован транспозон.
Векторы содержат предпочтительно один или несколько селектируемых маркеров, которые делают возможным легкий отбор трансформированных, трансфицированных, трансдуцированных или т.п. клеток. Селектируемый маркер является геном продукта, который обеспечивает биоцидную или вирусную устойчивость, устойчивость к тяжелым металлам, прототрофию для ауксотрофов и т.п.
Примерами бактериальных селектируемых маркеров являются гены dal Bacillus subtilis или Bacillus licheniformis или маркеры, которые придают устойчивость к антибиотикам, например устойчивость к ампициллину, канамицину, хлорамфениколу или тетрациклину. Подходящими маркерами для клеток-хозяев дрожжей являются ADE2, HIS3, LEU2, LYS2, MET3, TRP1 и URA3. Селектируемые маркеры для использования в клетке-хозяине мицелиального гриба включают в себя, но не ограничиваются ими, гены amdS (ацетамидазы), argB (орнитинкарбамоилтрансферазы), bar (фосфинотрицинацетилтрансферазы), hph (гигромицинфосфотрансферазы), niaD (нитратредуктазы), pyrG (оротидин-5'-фосфатдекарбоксилазы), sC (сульфатаденилтрансферазы) и trpC (антранилатсинтазы), а также их эквиваленты. Предпочтительными для использования в клетке Aspergillus являются гены amdS и pyrG Aspergillus nidulans или Aspergillus oryzae и ген bar Streptomyces hygroscopicus.
Эти векторы предпочтительно содержат элемент (элементы), которые делают возможной интеграцию вектора в геном клетки-хозяина или автономную репликацию вектора в клетке независимо от генома.
Для интеграции в геном клетки-хозяина вектор может использовать полинуклеотидную последовательность, кодирующую этот полипептид, или любой другой элемент вектора для интеграции в геном гомологичной или негомологичной рекомбинацией. Альтернативно, вектор может содержать дополнительные нуклеотидные последовательности для выполнения интеграции гомологичной рекомбинацией в геном клетки-хозяина в точном местоположении (местоположениях) в хромосоме (хромосомах). Для увеличения вероятности интеграции в точном местоположении, интеграционные элементы должны предпочтительно содержать достаточное количество нуклеиновых кислот, например 100-10000 п.н., предпочтительно 400-10000 п.н. и наиболее предпочтительно 800-10000 п.н., которые имеют высокую степень идентичности с соответствующей последовательностью-мишенью, для увеличения вероятности гомологичной рекомбинации. Этими интеграционными элементами может быть любая последовательность, которая гомологична последовательности-мишени в геноме клетки-хозяина. Кроме того, интеграционными элементами могут быть некодирующие или кодирующие нуклеотидные последовательности. С другой стороны, вектор может быть интегрирован в геном клетки-хозяина негомологичной рекомбинацией.
Для автономной репликации вектор может дополнительно содержать сайт инициации репликации, позволяющий вектору реплицироваться автономно в рассматриваемой клетке-хозяине. Сайт инициации репликации может быть любым плазмидным репликатором, опосредующим автономную репликацию при функционировании в клетке. Термин «сайт инициации репликации» или «плазмидный репликатор» определяются здесь как нуклеотидная последовательность, которая позволяет плазмиде или вектору реплицироваться in vivo.
Примерами бактериальных сайтов инициации репликации являются сайты инициации репликации плазмид pBR322, pUC19, pACYC177 и pACYC184, делающие возможной репликацию в E. coli, pUB110, pE194, pTA106 и pAMβi, делающие возможными репликацию в Bacillus.
Примерами сайтов инициации репликации для применения в клетке-хозяине дрожжей являются сайт инициации репликации 2 микрон, ARS1, ARS4, комбинация ARS1 и CEN3 и комбинация ARS4 и CEN6.
Примерами сайтов инициации репликации, применимыми в клетке мицелиальных грибов, являются AMA1 и ANSI (Gems et al., 1991, Gene 98: 61-67; Cullen et al., 1987, Nucleic Acids Research 15: 9163-9175; WO 00/24883). Выделение гена AMA1 и конструирование плазмид и векторов, содержащих этот ген, могут выполняться в соответствии со способами, описанными в WO 00/24883.
Более чем одна копия полинуклеотида, кодирующего полипептид, имеющий целлюлолитическую усиливающую активность, может быть встроена в клетку-хозяина для увеличения продуцирования этого полипептида. Увеличение числа копий полинуклеотида может быть получено интеграцией, по меньшей мере, одной дополнительной копии последовательности в геном клетки-хозяина или включением амплифицируемого гена селектируемого маркера, и посредством этого дополнительные копии полинуклеотида могут быть отобраны культивированием этих клеток в присутствии подходящего селектируемого агента.
Процедуры, используемые для лигирования описанных выше элементов для конструирования рекомбинантных экспрессирующих векторов, хорошо известны специалисту в данной области (см., например, Sambrook et al., 1989, supra).
Клетки-хозяева
Рекомбинантные клетки-хозяева, содержащие полинуклеотид, кодирующий полипептид, имеющий целлюлолитическую усиливающую активность, могут быть выгодным образом использованы в рекомбинантном получении этого полипептида. Вектор, содержащий такой полинуклеотид, вводят в клетку-хозяина таким образом, что этот вектор поддерживается в виде хромосомного интегранта или в виде самореплицирующегося внехромосомного вектора, как описано ранее. Термин «клетка-хозяин» включает в себя любое потомство исходной клетки, которое не является идентичным исходной клетке вследствие мутаций, которые происходят во время репликации. Выбор клетки-хозяина будет в большой степени зависеть от гена, кодирующего этот полипептид, и его источника.
Клетка-хозяин может быть одноклеточным микроорганизмом, например прокариотом, или неодноклеточным микроорганизмом, например эукариотом.
Бактериальная клетка-хозяин может быть любой грамположительной бактерией или грамотрицательной бактерией. Грамположительные бактерии включают в себя, но не ограничиваются ими, Bacillus, Streptococcus, Streptomyces, Staphylococcus, Enterococcus, Lactobacillus, Lactococcus, Clostridium, Geobacillus и Oceanobacillus. Грамотрицательные бактерии включают в себя, но не ограничиваются ими, E. coli, Pseudomonas, Salmonella, Campylobacter, Helicobacter, Flavobacterium, Fusobacterium, Ilyobacter, Neisseria и Ureaplasma.
Бактериальная клетка-хозяин может быть любой клеткой Bacillus. Клетки Bacillus, применимые в практике данного изобретения, включают в себя, но не ограничиваются ими, клетки Bacillus alkalophilus, Bacillus amyloliquefaciens, Bacillus brevis, Bacillus circulans, Bacillus clausii, Bacillus coagulans, Bacillus firmus, Bacillus lautus, Bacillus lentus, Bacillus licheniformis, Bacillus megaterium, Bacillus pumilus, Bacillus stearothermophilus, Bacillus subtilis и Bacillus thuringiensis.
В предпочтительном аспекте, бактериальная клетка-хозяин является клеткой Bacillus amyloliquefaciens, Bacillus lentus, Bacillus licheniformis, Bacillus stearothermophilus или Bacillus subtilis. В более предпочтительном аспекте бактериальная клетка-хозяин является клеткой Bacillus amyloliquefaciens. В другом более предпочтительном аспекте бактериальная клетка-хозяин является клеткой Bacillus clausii. В другом более предпочтительном аспекте, бактериальная клетка-хозяин является клеткой Bacillus licheniformis. В другом более предпочтительном аспекте, бактериальная клетка-хозяин является клеткой Bacillus subtilis.
Бактериальная клетка-хозяин может быть также любой клеткой Streptococcus. Клетки Streptococcus, применимые в практике данного изобретения, включают в себя, но не ограничиваются ими, Streptococcus equisimilis, Streptococcus pyogenes, Streptococcus uberis и Streptococcus equi subsp. Zooepidemicus.
В предпочтительном аспекте, бактериальная клетка-хозяин является клеткой Streptococcus equisimilis. В другом предпочтительном аспекте, бактериальная клетка-хозяин является клеткой Streptococcus pyogenes. В другом предпочтительном аспекте, бактериальная клетка-хозяин является клеткой Streptococcus uberis. В другом предпочтительном аспекте, бактериальная клетка-хозяин является клеткой Streptococcus equi subsp. Zooepidemicus.
Бактериальная клетка-хозяин может быть также любой клеткой Streptomyces. Клетки Streptomyces, применимые в практике данного изобретения, включают в себя, но не ограничиваются ими, Streptomyces achromogenes, Streptomyces avermitilis, Streptomyces coelicolor, Streptomyces griseus и Streptomyces lividans.
В предпочтительном аспекте, бактериальная клетка-хозяин является клеткой Streptomyces achromogenes. В другом предпочтительном аспекте, бактериальная клетка-хозяин является клеткой Streptomyces avermitilis. В другом предпочтительном аспекте, бактериальная клетка-хозяин является клеткой Streptomyces coelicolor. В другом предпочтительном аспекте, бактериальная клетка-хозяин является клеткой Streptomyces griseus. В другом предпочтительном аспекте, бактериальная клетка-хозяин является клеткой Streptomyces lividans.
Введение ДНК в клетку Bacillus может, например, выполняться трансформацией протопластов (см., например, Chang and Cohen, 1979, Molecular General Genetics 168: 111-115), с использованием компетентных клеток (см., например, Young and Spizizen, 1961, Journal of Bacteriology 81: 823-829 или Dubnau and Davidoff-Abelson, 1971, Journal of Molecular Biology 56: 209-221), электропорацией (см., например, Shigekawa and Dower, 1988, Biotechniques 6: 742-751) или конъюгацией (см., например, Koehler and Thorne, 1987, Journal of Bacteriology 169: 5271-5278). Введение ДНК в клетку E. coli может, например, выполняться трансформацией протопластов (см., например, Hanahan, 1983, J. Mol. Biol. 166: 557-580) или электропорацией (см., например, Dower et al., 1988, Nucleic Acids Res. 16: 6127-6145). Введение ДНК в клетку Streptomyces может, например, выполняться трансформацией протопластов и электропорацией (см., например, Gong et al., 2004, Folia Microbiol. (Praha) 49: 399-405), конъюгацией (см., например, Mazodier et al., 1989, J. Bacteriol. 171: 3583-3585) или трансдукцией (см., например, Burke et al., 2001, Proc. Natl. Acad. Sci. USA 98:6289-6294). Введение ДНК в клетку Pseudomonas может, например, выполняться электропорацией (см., например, Choi et al., 2006, J. Microbiol. Methods 64: 391-397) или конъюгацией (см., например, Pinedo and Smets, 2005, Appl. Environ. Microbiol. 71: 51-57). Введение ДНК в клетку Streptococcus может, например, выполняться посредством природной компетентности (см., например, Perry and Kuramitsu, 1981, Infect. Immun. 32: 1295-1297), трансформацией протопластов (см., например, Catt and Jollick, 1991, Microbios. 68: 189-2070), электропорацией (см., например, Buckley et al., 1999, Appl. Environ. Microbiol. 65: 3800-3804) или конъюгацией (см., например, Clewell, 1981, Microbiol. Rev. 45: 409-436). Однако может быть использован любой способ, известный как способ для введения ДНК в клетку-хозяина.
Клетка-хозяин может также быть эукариотом, таким как клетка млекопитающего, насекомого, растения или гриба.
В предпочтительном аспекте, клетка-хозяин является грибной клеткой. Термин «грибы» включает в себя в данном контексте типы Ascomycota, Basidiomycota, Chytridiomycota и Zygomycota (определенные Hawksworth et al., In, Ainsworth and Bisby's Dictionary of The Fungi, 8th edition, 1995, CAB International, University Press, Cambridge, UK), а также Oomycota (цитируемые Hawksworth et al., 1995, supra, page 171) и все имеющие митоспоры грибы (Hawksworth et al., 1995, supra).
В более предпочтительном аспекте, грибная клетка-хозяин является дрожжевой клеткой. «Дрожжи» включают в себя в этом контексте аскоспорогенные дрожжи (Endomycetales), базидиоспорогенные дрожжи и дрожжи, принадлежащие к несовершенным дрожжам Fungi Imperfecti (Blastomycetes). Поскольку эта классификация дрожжей может изменяться в будущем, для целей этого изобретения, дрожжи будут определены, как описано в Biology and Activities of Yeast (Skinner, F.A., Passmore, S. M., and Davenport, R. R., eds, Soc. App. Bacteriol. Symposium Series No. 9, 1980).
В еще более предпочтительном аспекте клетка-хозяина дрожжей является клеткой Candida, Hansenula, Kluyveromyces, Pichia, Saccharomyces, Schizosaccharomyces или Yarrowia.
В наиболее предпочтительном аспекте, клетка-хозяин дрожжей является клеткой Saccharomyces carlsbergensis, Saccharomyces cerevisiae, Saccharomyces diastaticus, Saccharomyces douglasii, Saccharomyces kluyveri, Saccharomyces norbensis или Saccharomyces oviformis. В другом наиболее предпочтительном аспекте, клетка-хозяин дрожжей является клеткой Kluyveromyces lactis. В другом наиболее предпочтительном аспекте, клетка-хозяин дрожжей является клеткой Yarrowia lipolytica.
В другом более предпочтительном аспекте, грибная клетка-хозяин является клеткой мицелиальных грибов. «Мицелиальные грибы» включают в себя все мицелиальные формы подотделов Eumycota и Oomycota (определенных Hawksworth et al., 1995, supra). Мицелиальные грибы характеризуются обычно стенкой мицелия, состоящей из хитина, целлюлозы, глюкана, хитозана, маннана и других комплексных полисахаридов. Вегетативный рост является удлинением гифов, а катаболизм углерода является облигатно аэробным. В противоположность этому, вегетативный рост дрожжей, таких как Saccharomyces cerevisiae, осуществляется почкованием одноклеточного таллома, а катаболизм углерода может быть ферментативным.
В еще более предпочтительном аспекте, мицелиальная грибная клетка-хозяин является клеткой Acremonium, Aspergillus, Aureobasidium, Bjerkandera, Ceriporiopsis, Coprinus, Coriolus, Cryptococcus, Filibasidium, Fusarium, Humicola, Magnaporthe, Mucor, Myceliophthora, Neocallimastix, Neurospora, Paecilomyces, Penicillium, Phanerochaete, Phlebia, Piromyces, Pleurotυs, Schizophyllum, Talaromyces, Thermoascus, Thielavia, Tolypocladium, Trametes или Trichoderma.
В наиболее предпочтительном аспекте, мицелиальная грибная клетка-хозяин является клеткой Aspergillus awamori, Aspergillus fumigatus, Aspergillus foetidus, Aspergillus japonicus, Aspergillus nidulans, Aspergillus niger или Aspergillus oryzae. В другом наиболее предпочтительном аспекте, мицелиальная грибная клетка-хозяин является клеткой Fusarium bactridioides, Fusarium cerealis, Fusarium crookwellense, Fusarium culmorum, Fusarium graminearum, Fusarium graminum, Fusarium heterosporum, Fusarium negundi, Fusarium oxysporum, Fusarium reticulatum, Fusarium roseum, Fusarium sambucinum, Fusarium sarcochroum, Fusarium sporotrichioides, Fusarium sulphureum, Fusarium torulosum, Fusarium trichothecioides или Fusarium venenatum. В другом наиболее предпочтительном аспекте, мицелиальная грибная клетка-хозяин является клеткой Bjerkandera adusta, Ceriporiopsis aneirina, Ceriporiopsis aneirina, Ceriporiopsis caregiea, Ceriporiopsis gilvescens, Ceriporiopsis pannocinta, Ceriporiopsis rivulosa, Ceriporiopsis subrufa, Ceriporiopsis subvermispora, Coprinus cinereus, Coriolus hirsutus, Humicola insolens, Humicola lanuginosa, Mucor miehei, Myceliophthora thermophila, Neurospora crassa, Penicillium purpurogenum, Phanerochaete chrysosporium, Phlebia radiata, Pleurotus eryngii, Thielavia terrestris, Trametes villosa, Trametes versicolor, Trichoderma harzianum, Trichoderma koningii, Trichoderma longibrachiatum, Trichoderma reesei или Trichoderma viride.
Грибные клетки могут быть трансформированы способом, предусматривающим образование протопластов, трансформацию этих протопластов и регенерацию клеточной стенки известным per se способом. Подходящие процедуры для трансформации клеток-хозяев Aspergillus и Trichoderma описаны в EP 238 023 и Yelton et al., 1984, Proceedings of the National Academy of Sciences USA 81: 1470-1474. Подходящие способы для трансформации видов Fusarium описаны Malardier et al., 1989, Gene 78: 147-156 и WO 96/00787. Дрожжи могут быть трансформированы с использованием процедур, описанных Becker and Guarente, In Abelson, J.N. and Simon, M. I., editors, Guide to Yeast Genetics and Molecular Biology, Methods in Enzymology, Volume 194, p.182-187, Academic Press, Inc., New York; Ito et al., 1983, Journal of Bacteriology 153: 163; и Hinnen et al., 1978, Proceedings of the National Academy of Sciences USA 75: 1920.
Способы получения
Данное изобретение относится также к способам получения полипептида, имеющего целлюлолитическую усиливающую активность, предусматривающим (а) культивирование клетки, которая в форме ее дикого типа способна продуцировать этот полипептид, при условиях, способствующих продуцированию этого полипептида; и (b) извлечение этого полипептида. Предпочтительно, эта клетка является клеткой рода Trichoderma, более предпочтительно Trichoderma reesei и наиболее предпочтительно Trichoderma reesei RutC30.
Данное изобретение относится также к способам получения полипептида, имеющего целлюлолитическую усиливающую активность, предусматривающим (а) культивирование рекомбинантной клетки-хозяина при условиях, способствующих продуцированию этого полипептида; и (b) извлечение этого полипептида.
Данное изобретение относится также к способам получения полипептида, имеющего целлюлолитическую усиливающую активность, предусматривающим (а) культивирование клетки-хозяина при условиях, способствующих продуцированию этого полипептида, где эта клетка-хозяин содержит мутантную нуклеотидную последовательность, имеющую, по меньшей мере, одну мутацию в кодирующем зрелый полипептид районе SEQ ID NO:1, где эта мутантная нуклеотидная последовательность кодирует полипептид, который состоит из зрелого полипептида SEQ ID NO:2, и (b) извлечение этого полипептида. В предпочтительном аспекте, зрелый полипептид SEQ ID NO:2 является аминокислотами 20-249 SEQ ID NO:2.
В этих способах получения клетки культивируют в питательной среде, подходящей для получения этого полипептида с использованием способов, хорошо известных в данной области. Например, клетка может культивироваться культивированием во встряхиваемых колбах и ферментацией в малом масштабе или крупном масштабе (в том числе непрерывной, периодической, периодической с подпиткой ферментациями или ферментацией в твердом состоянии) в лабораторных или промышленных ферментерах в подходящей среде и при условиях, делающих возможными экспрессию и/или выделение этого полипептида. Культивирование проводят в подходящей питательной среде, содержащей источники углерода и азота и неорганические соли, с использованием процедур, известных в этой области. Подходящие среды доступны от коммерческих поставщиков или могут быть приготовлены в соответствии с опубликованными составами (например, в каталогах Американской Коллекции Типовых Культур). Если этот полипептид секретируется в питательную среду, он может быть извлечен непосредственно из этой среды. Если этот полипептид не секретируется в среду, он может быть извлечен из лизатов клеток.
Полипептиды, имеющие целлюлолитическую усиливающую активность, детектируют с использованием описанных здесь способов.
Полученный полипептид может быть извлечен с использованием известных в данной области способов. Например, этот полипептид может быть извлечен из питательной среды общепринятыми процедурами, включающими в себя, но не ограничивающимися ими, центрифугирование, фильтрование, экстракцию, распылительную сушку, выпаривание или осаждение.
Эти полипептиды могут быть очищены различными процедурами, известными в этой области, в том числе хроматографией (например, ионообменной, аффинной, гидрофобной хроматографией, хроматофокусированием и вытеснительной хроматографией), электрофоретическими процедурами (например, препаративным изоэлектрическим фокусированием), с использованием дифференциальной растворимости (например, осаждением сульфатом аммония), электрофорезом в ДСН-ПААГ или экстракцией (см., например, Protein Purification, J.-C. Janson and Lars Ryden, editors, VCH Publishers, New York, 1989), для получения по существу чистых полипептидов.
Целлюлолитические белки
В способах данного изобретения целлюлолитический белок может быть любым белком, участвующим в переработке целлюлозного материала в глюкозу или гемицеллюлозы в ксилозу, маннозу, галактозу и арабинозу, их полимеры или продукты, происходящие из них, как описано ниже. Этот целлюлолитический белок может быть монокомпонентным препаратом, например целлюлазой, мультикомпонентным препаратом, например эндоглюканазой, целлобиогидролазой, глюкогидролазой, бета-глюкозидазой, как определено ниже, или комбинацией мультикомпонентного и монокомпонентного белковых препаратов. Целлюлолитические белки могут иметь активность, т.е. гидролизовать целлюлозу, в кислом, нейтральном или щелочном диапазоне рН.
Целлюлолитический белок может быть грибного или бактериального происхождения и может быть получен или выделен и очищен из микроорганизмов, о которых известно, что они могут продуцировать целлюлолитические ферменты, например, видов Bacillus, Pseudomonas, Humicola, Coprinus, Thielavia, Fusarium, Myceliophthora, Acremonium, Cephalosporium, Scytalidium, Penicillium или Aspergillus (см., например, EP 458162), в частности ферменты, продуцируемые штаммом, выбранным из Humicola insolens (в новой классификации Scytalidium thermophilum, см., например, Патент США № 4435307), Coprinus cinereus, Fusarium oxysporum, Myceliophthora thermophila, Meripilus giganteus, Thielavia terrestris, Acremonium sp., Acremonium persicinum, Acremonium acremonium, Acremonium brachypenium, Acremonium dichromosporum, Acremonium obclavatum, Acremonium pinkertoniae, Acremonium roseogriseum, Acremonium incoloratum и Acremonium furatum; предпочтительно из Humicola insolens DSM 1800, Fusarium oxysporum DSM 2672, Myceliophthora thermophila CBS 117.65, Cephalosporium sp. RYM-202, Acremonium sp. CBS 478.94, Acremonium sp. CBS 265.95, Acremonium persicinum CBS 169.65, Acremonium acremonium AHU 9519, Cephalosporium sp. CBS 535.71, Acremonium brachypenium CBS 866.73, Acremonium dichromosporum CBS 683.73, Acremonium obclavatum CBS 311.74, Acremonium pinkertoniae CBS 157.70, Acremonium roseogriseum CBS 134.56, Acremonium incoloratum CBS 146.62 и Acremonium furatum CBS 299.70H. Целлюлолитические белки могут быть также получены из Trichoderma (в частности, Trichoderma viride, Trichoderma reesei и Trichoderma koningii), алкалофильного Bacillus (см., например, Патент США № 3844890 и EP 458162) и Streptomyces (см., например, EP 458162). Могут быть также использованы химически модифицированные или белковые сконструированные мутанты целлюлолитических белков.
Особенно подходящими целлюлолитическими белками являются щелочные или нейтральные целлюлазы. Примерами таких целлюлаз являются целлюлазы, описанные в EP 495257, EP 531372, WO 96/11262, WO 96/29397, WO 98/08940. Другими примерами являются варианты целлюлазы, такие как варианты, описанные в WO 94/07998, EP 531315, Патенте США № 4435307, Патенте США № 5457046, Патенте США № 5648263, Патенте США № 5686593, Патенте США № 5691178, Патенте США № 5763254, Патенте США № 5776757, WO 89/09259, WO 95/24471, WO 98/12307 и PCT/DK98/00299.
Целлюлолитические белки, используемые в способах этого изобретения, могут быть получены ферментацией вышеуказанных микробных штаммов на питательной среде, содержащей источники углерода и азота и неорганические соли, с использованием процедур, известных в данной области (см., например, Bennett, J.W. and LaSure, L. (eds.), More Gene Manipulations in Fungi, Academic Press, CA, 1991). Подходящие среды доступны от коммерческих поставщиков или могут быть получены в соответствии с опубликованными составами (например, в каталогах Американской Коллекции Типовых Культур). Диапазоны температур и другие условия, подходящие для роста и продуцирования целлюлолитического белка, известны в этой области (см., например, Bailey, J. E., and Ollis, D.F., Biochemical Engineering Fundamentals, McGraw-Hill Book Company, NY, 1986).
Ферментацией может быть любой способ культивирования клеток, приводящий к экспрессии или выделению целлюлолитического белка. Таким образом, ферментация может пониматься как культивирование во встряхиваемых колбах или ферментация малого масштаба или крупного масштаба (в том числе, непрерывная, периодическая, периодическая с подпиткой ферментация или ферментация в твердом состоянии) в лабораторных или промышленных ферментерах, выполняемая в подходящей среде и при условиях, делающих возможными экспрессию и/или выделение целлюлолитического белка или целлюлолитического усиливающего белка.
Полученные целлюлолитические белки, полученные вышеуказанными способами, могут быть извлечены из ферментационной среды и очищены общепринятыми процедурами, описанными здесь.
Целлюлолитический белок может гидролизовать или гидролизует карбоксиметилцеллюлозу (СМС), уменьшая посредством этого вязкость инкубационной смеси. Полученное снижение вязкости может быть определено вибрационным вискозиметром (например, MIVI 3000 из Sofraser, France). Определение целлюлазной активности, измеренной в виде Целлюлазных Единиц Вязкости (CEVU), определяет количественно величину каталитической активности в пробе посредством измерения способности этой пробы снижать вязкость раствора карбоксиметилцеллюлозы (СМС). Этот анализ выполняют при температуре и рН, подходящих для целлюлолитического белка и субстрата. Для Celluclast™ (Novozymes A/S, Bagsvaerd, Denmark) этот анализ проводят при 40°C в 0,1 M фосфатном буфере, pH 9,0 в течение 30 минут с СМС в качестве субстрата (33,3 г/л карбоксиметилцеллюлозы Hercules 7 LFD) и концентрации фермента приблизительно 3,3-4,2 CEVU/мл. CEVU-активность рассчитывают относительно стандарта названного фермента, такого как CELLUZYME™ Standard 17-1194 (полученного из Novozymes A/S, Bagsvaerd, Denmark).
Примеры целлюлолитических препаратов, подходящих для использования в данном изобретении, включают в себя, например, CELLUCLAST™ (доступный из Novozymes A/S) и NOVOZYM™ 188 (доступный из Novozymes A/S). Другие коммерчески доступные препараты, содержащие целлюлазу, которые могут быть использованы, включают в себя CELLUZYME™, CEREFLO™ и ULTRAFLO™ (Novozymes A/S), LAMINEX™ и SPEZYME™ CP (Genencor Int.) и ROHAMENT™ 7069 W (Rohm GmbH). Эти целлюлазные ферменты добавляют в эффективных количествах приблизительно 0,001 мас.% - приблизительно 5,0 мас.% твердых веществ, более предпочтительно приблизительно 0,025 мас.% - приблизительно 4,0 мас.% твердых веществ и наиболее предпочтительно приблизительно 0,005 мас.% - приблизительно 2,0 мас.% твердых веществ.
Как упоминалось выше, целлюлолитические белки или целлюлолитические усиливающие белки, используемые в способах данного изобретения, могут быть монокомпонентными препаратами, т.е. компонент по существу не содерджит других целлюлолитических компонентов. Этим единственным компонентом может быть рекомбинантный компонент, т.е. полученный клонированием последовательности ДНК, кодирующей этот единственный компонент, и последующей трансформацией клетки этой последовательностью ДНК и экспрессией в хозяине (см., например, WO 91/17243 и WO 91/17244). Другие примеры монокомпонентных целлюлолитических белков включают в себя, но не ограничиваются ими, целлюлолитические белки, описанные в JP-07203960-A и WO-9206209. Хозяином является предпочтительно гетерологичный хозяин (фермент является чужеродным для хозяина), но этот хозяин может при определенных условиях быть также гомологичным хозяином (фермент является нативным для хозяина). Монокомпонентные целлюлолитические белки могут быть также получены очисткой такого белка из ферментационного бульона.
Примеры монокомпонентных целлюлолитических белков, применимых в практике способов данного изобретения, включают в себя, но не ограничиваются ими, эндоглюканазу, целлобиогидролазу, глюкогидролазу и бета-глюкозидазу.
Термин «эндоглюканаза» определяется здесь как эндо-1,4-(1,3;1,4)-бета-D-глюкан-4-глюканогидролаза (E.C. No. 3.2.1.4), которая катализирует эндогидролиз 1,4-бета-D-гликозидных связей в целлюлозе, производных целлюлозы (таких, как карбоксиметилцеллюлоза и гидроксиэтилцеллюлоза), лихенин, бета-1,4-связей в смешанных бета-1,3-глюканах, таких как бета-D-глюканы или ксилоглюканы злаков и другого растительного материала, содержащего целлюлозные компоненты. Для целей этого изобретения, эндоглюканазную активность определяют с использованием гидролиза карбоксиметилцеллюлозы (СМС) в соответствии с процедурой Ghose, 1987, Pure and Appl. Chem. 59: 257-268.
Экзо-1,4-бета-D-глюканазы включают в себя как целлобиогидролазы, так и глюкогидролазы. Для целей этого изобретения, экзоглюканазную активность определяют в соответствии с процедурой, описанной Himmel et al., 1986, J. Biol. Chem. 261: 12948-12955.
Термин «целлобиогидролаза» определяется здесь как 1,4-бета-D-глюкан-целлобиогидролаза (E.C. 3.2.1.91), которая катализирует гидролиз 1,4-бета-D-гликозидных связей в целлюлозе, целлоолигосахаридах или любом бета-1,4-связанном содержащем глюкозу полимере, высвобождая целлобиозу из редуцирующих или нередуцирующих концов цепи. Для целей этого изобретения целлобиогидролазную активность определяют в соответствии с процедурами, описанными Lever et al., 1972, Anal. Biochem. 47: 273-279 и van Tilbeurgh et al., 1982, FEBS Letters 149: 152-156; van Tilbeurgh and Claeyssens, 1985, FEBS Letters 187: 283-288. В этом изобретении способ Lever et al. использовали для оценки гидролиза целлюлозы в кукурузной соломе, в то время как способ van Tilbeurgh et al. использовали для определения целлобиогидролазной активности на флуоресцентном производном дисахарида.
Термин «глюкогидролаза» определяется здесь как 1,4-бета-D-глюканглюкогидролаза (Е.С. 3.2.1.74), которая катализирует гидролиз 1,4-связей (O-гликозильных связей) в 1,4-бета-D-глюканах для удаления последовательных глюкозных звеньев.
Термин «бета-глюкозидаза» определяется здесь как бета-D-глюкозидглюкогидролаза (E.C. 3.2.1.21), которая катализирует гидролиз концевых нередуцирующих бета-D-глюкозных остатков с высвобождением бета-D-глюкозы. Для целей этого изобретения бета-глюкозидазную активность определяют в соответствии с основной процедурой, описанной Venturi et al., 2002, J. Basic Microbiol. 42: 55-66, за исключением того, что были использованы другие условия, описанные здесь. Одна единица бета-глюкозидазной активности определяется здесь как 1,0 мкмоль п-нитрофенола, продуцируемого в минуту при 50°C, pH 5 из 4 мМ п-нитрофенил-бета-D-глюкопиранозида в качестве субстрата в 100 мМ цитрате натрия, 0,01% Твине-20.
Переработка целлюлозного материала
Способы данного изобретения могут быть использованы для переработки целлюлозного материала во многие полезные вещества, например химикалии и виды топлива. Наряду с этанолом, некоторые химикалии предметов торговли и специального ассортимента, которые могут быть получены из целлюлозы, включают в себя ксилозу, ацетон, ацетат, глицин, лизин, органические кислоты (например, молочную кислоту), 1,3-пропандиол, бутандиол, глицерин, этиленгликоль, фурфураль, полигидроксиалканоаты и цис,цис-муконовую кислоту (Lynd, L. R., Wyman, C. E., and Gerngross, T. U., 1999, Biocommodity Engineering, Biotechnol. Prog., 15: 777-793; Philippidis, G. P., 1996, Cellulose bioconversion technology, in Handbook on Bioethanol: Production and Utilization, Wyman, C. E., ed., Taylor & Francis, Washington, DC, 179-212; и Ryu, D. D. Y., and Mandels, M., 1980, Cellulases: biosynthesis and applications, Enz. Microb. Technol., 2: 91-102). Потенциальные преимущества одновременного получения расширяются за пределы синтеза множественных органических продуктов из ферментируемого углевода. Богатые лигнином остатки, остающиеся после биологической переработки, могут быть превращены в произведенные из лигнина химикалии или использованы для получения энергии.
Общепринятые способы, используемые для переработки целлюлозного материала в соответствии со способами данного изобретения, хорошо известны специалистам данной области. Способы данного изобретения могут выполняться с использованием общепринятого устройства для обработки биомассы, сконструированного для эксплуатации в соответствии с данным изобретением.
Такое устройство может включать в себя периодически перемешиваемый реактор, перемешиваемый проточный реактор непрерывного действия с ультрафильтрацией, реактор с поршневым потоком (Gusakov, A. V., and Sinitsyn, A. P., 1985, Kinetics of the enzymatic hydrolysis of cellulose: 1. A mathematical model for a batch reactor process, Enz. Microb. Technol. 7: 346-352), истирающий реактор (Ryu, S. K., and Lee, J. M., 1983, Bioconversion of waste cellulose by using an attrition bioreactor, Biotechnol. Bioeng. 25: 53-65) или реактор с интенсивным перемешиванием, индуцируемым электромагнитным полем (Gusakov, A. V., Sinitsyn, A. P., Davydkin, I. Y., Davydkin, V. Y., Protas, O. V., 1996, Enhancement of enzymatic cellulose hydrolysis using a novel type of bioreactor with intensive stirring induced by electromagnetic field, Appl. Biochem. Biotechnol. 56: 141-153).
Общепринятые способы включают в себя, но не ограничиваются ими, осахаривание, ферментацию, раздельные гидролиз и ферментацию (SHF), одновременные осахаривание и коферментацию (SSCF), гибридные гидролиз и ферментацию (HHF) и прямое микробное превращение (DMC).
SHF использует отдельные стадии процесса сначала для ферментативного гидролиза целлюлозы до глюкозы и затем ферментирования глюкозы до этанола. В SSF, ферментативный гидролиз целлюлозы и ферментация глюкозы до этанола объединены в одной стадии (Philippidis, G. P., 1996, Cellulose bioconversion technology, in Handbook on Bioethanol: Production and Utilization, Wyman, C. E., ed., Taylor & Francis, Washington, DC, 179-212). SSCF включает в себя коферментацию множественных сахаров (Sheehan, J., and Himmel, M., 1999, Enzymes, energy and the environment: A strategic perspective on the U.S. Department of Energy's research and development activities for bioethanol, Biotechnol. Prog. 15: 817-827). HHF включает в себя две отдельные стадии, проводимые в одном и том же реакторе, но при разных температурах, т.е. высокотемпературное ферментативное осахаривание с последующей SSF при более низкой температуре, которую может переносить конкретный ферментационный штамм. DMC объединяет все три процесса (получение целлюлазы, гидролиз целлюлозы и ферментацию) в одной стадии (Lynd, L. R., Weimer, P. J., van ZyI, W. H., and Pretorius, I. S., 2002, Microbial cellulose utilization: Fundamentals and biotechnology, Microbiol. Mol. Biol. Reviews 66: 506-577).
«Ферментацией» или «ферментационным процессом» называют любой ферментационный процесс или любой процесс, включающий в себя стадию ферментации. Ферментационный процесс включает в себя, без ограничения, ферментационные процессы, используемые для получения ферментационных продуктов, в том числе спиртов (например, арабинита, бутанола, этанола, глицерина, метанола, 1,3-пропандиола, сорбита и ксилита); органических кислот (например, уксусной кислоты, ацетоновой кислоты, адипиновой кислоты, аскорбиновой кислоты, лимонной кислоты, 2,5-дикето-D-глюконовой кислоты, муравьиной кислоты, фумаровой кислоты, глюкаровой кислоты, глюконовой кислоты, глюкуроновой кислоты, глутаровой кислоты, 3-гидроксипропионовой кислоты, итаконовой кислоты, молочной кислоты, яблочной кислоты, малоновой кислоты, щавелевой кислоты, пропионовой кислоты, янтарной кислоты и ксилоновой кислоты); кетонов (например, ацетона); аминокислот (например, аспарагиновой кислоты, глутаминовой кислоты, глицина, лизина, серина и треонина); газов (например, метана, водорода (H2), диоксида углерода (CO2) и моноксида углерода (CO)). Ферментационные процессы включают в себя также ферментационные процессы, используемые в промышленности потребительского алкоголя (например, пива и вина), молочной промышленности (например, ферментируемых молочных продуктов), кожной промышленности и табачной промышленности.
Целлюлолитический усиливающий белок может быть монокомпонентным препаратом, например белком Семейства 61, мультикомпонентным белковым препаратом, например несколькими белками Семейства 61, или комбинацией мультикомпонентного и монокомпонентного белковых препаратов.
Рассматриваемым веществом может быть любое вещество, полученное из этой ферментации. В предпочтительном аспекте этим веществом является спирт. Будет понятно, что термин «спирт» включает в себя вещество, которое содержит один или несколько гидроксильных радикалов. В более предпочтительном аспекте, этим спиртом является арабинит. В другом более предпочтительном аспекте, этим спиртом является бутанол. В другом более предпочтительном аспекте, этим спиртом является этанол. В другом более предпочтительном аспекте, этим спиртом является глицерин. В другом более предпочтительном аспекте, этим спиртом является метанол. В другом более предпочтительном аспекте, этим спиртом является 1,3-пропандиол. В другом более предпочтительном аспекте, этим спиртом является сорбит. В другом более предпочтительном аспекте, этим спиртом является ксилит. См., например, Gong, C. S., Cao, N. J., Du, J., and Tsao, G. T., 1999, Ethanol production from renewable resources, in Advances in Biochemical Engineering/Biotechnology, Scheper, T., ed., Springer-Verlag Berlin Heidelberg, Germany, 65: 207-241; Silveira, M. M., and Jonas, R., 2002, The biotechnological production of sorbitol, Appl. Microbiol. Biotechnol. 59: 400-408; Nigam, P., and Singh, D., 1995, Processes for fermentative production of xylitol - a sugar substitute, Process Biochemistry 30 (2): 117-124; Ezeji, T. C, Qureshi, N. and Blaschek, H. P., 2003, Production of acetone, butanol and ethanol by Clostridium beijerinckii BA101 and in situ recovery by gas stripping, World Journal of Microbiology and Biotechnology 19 (6): 595-603.
В другом предпочтительном аспекте, этим веществом является органическая кислота. В другом предпочтительном аспекте, этой органической кислотой является уксусная кислота. В другом предпочтительном аспекте, этой органической кислотой является ацетоновая кислота. В другом предпочтительном аспекте, этой органической кислотой является адипиновая кислота. В другом предпочтительном аспекте, этой органической кислотой является аскорбиновая кислота. В другом предпочтительном аспекте, этой органической кислотой является лимонная кислота. В другом предпочтительном аспекте, этой органической кислотой является 2,5-дикето-D-глюконовая кислота. В другом предпочтительном аспекте, этой органической кислотой является муравьиная кислота. В другом предпочтительном аспекте, этой органической кислотой является фумаровая кислота. В другом предпочтительном аспекте, этой органической кислотой является глюкаровая кислота. В другом предпочтительном аспекте, этой органической кислотой является глюконовая кислота. В другом предпочтительном аспекте, этой органической кислотой является глюкуроновая кислота. В другом предпочтительном аспекте, этой органической кислотой является глутаровая кислота. В другом предпочтительном аспекте, этой органической кислотой является 3-гидроксипропионовая кислота. В другом предпочтительном аспекте, этой органической кислотой является итаконовая кислота. В другом предпочтительном аспекте, этой органической кислотой является молочная кислота. В другом предпочтительном аспекте, этой органической кислотой является яблочная кислота. В другом предпочтительном аспекте, этой органической кислотой является малоновая кислота. В другом предпочтительном аспекте, этой органической кислотой является щавелевая кислота. В другом предпочтительном аспекте, этой органической кислотой является пропионовая кислота. В другом предпочтительном аспекте, этой органической кислотой является янтарная кислота. В другом предпочтительном аспекте, этой органической кислотой является ксилоновая кислота. См., например, Chen, R., and Lee, Y. Y., 1997, Membrane-mediated extractive fermentation for lactic acid production from cellulosic biomass, Appl. Biochem. Biotechnol. 63-65: 435-448.
В другом предпочтительном аспекте, этим веществом является кетон. Будет понятно, что термин «кетон» включает в себя вещество, которое содержит один или несколько кетоновых групп. В другом более предпочтительном аспекте, этим кетоном является ацетон. См., например, Qureshi and Blaschek, 2003, supra.
В другом предпочтительном аспекте этим веществом является аминокислота. В другом более предпочтительном аспекте, этой аминокислотой является аспарагиновая кислота. В другом более предпочтительном аспекте, этой аминокислотой является глутаминовая кислота. В другом более предпочтительном аспекте, этой аминокислотой является глицин. В другом более предпочтительном аспекте, этой аминокислотой является лизин. В другом более предпочтительном аспекте, этой аминокислотой является серин. В другом более предпочтительном аспекте, этой аминокислотой является треонин. См., например, Richard, A., and Margaritis, A., 2004, Empirical modeling of batch fermentation kinetics for poly(glutamic acid) production and other microbial biopolymers, Biotechnology and Bioengineering 87 (4): 501-515.
В другом предпочтительном аспекте этим веществом является газ. В другом более предпочтительном аспекте этим газом является метан. В другом более предпочтительном аспекте этим газом является H2. В другом более предпочтительном аспекте этим газом является CO2. В другом более предпочтительном аспекте этим газом является CO. См., например, Kataoka, N., A. Miya, and K. Kiriyama, 1997, Studies on hydrogen production by continuous culture system of hydrogen-producing anaerobic bacteria, Water Science and Technology 36 (6-7): 41-47; и Gunaseelan V.N. in Biomass and Bioenergy, Vol. 13 (1-2), p. 83-114, 1997, Anaerobic digestion of biomass for methane production: A review.
Получение вещества из целлюлозного материала обычно требует четырех основных стадий. Этими четырьмя стадиями являются предобработка, ферментативный гидролиз, ферментация и извлечение. Ниже приведен в качестве примера процесс (способ) получения этанола, но должно быть понятно, что подобные процессы (способы) могут быть использованы для получения других веществ, например описанных выше веществ.
Предобработка. В стадии предобработки или пре-гидролиза целлюлозный материал нагревают для разрушения лигнина и структуры углеводов, солюбилизации большей части гемицеллюлозы и придания целлюлозной фракции доступности для целлюлолитических ферментов. Нагревание выполняют либо непосредственно паром, либо в суспензии, где к этому материалу может быть добавлен катализатор для ускорения реакций. Катализаторы включают в себя сильные кислоты, такие как серная кислота и SO2, или щелочь, например гидроксид натрия. Целью этой стадии предобработки является облегчение проникновения ферментов и микроорганизмов. Целлюлозная биомасса может быть также подвергнута предобработке гидротермальным паровым взрывом (См., например, Patent Application No. 20020164730).
Осахаривание. В стадии ферментативного гидролиза, также известной как осахаривание, описанные выше ферменты добавляют к предварительно нагретому материалу для превращения целлюлозной фракции в глюкозу и/или другие сахара. Осахаривание обычно выполняют в реакторах с мешалкой или ферментерах при регулируемых рН, температуре и условиях смешения. Стадия осахаривания может продолжаться до 200 часов. Осахаривание может проводиться при температурах приблизительно 30°C - приблизительно 65°C, в частности около 50°C, и при рН в диапазоне приблизительно 4 - приблизительно 5, в частности около pH 4,5. Для получения глюкозы, которая может метаболизироваться дрожжами, гидролиз обычно выполняют в присутствии бета-глюкозидазы.
Ферментация. В стадии ферментации сахара, высвобождаемые из целлюлозного материала в результате стадий предобработки и ферментативного гидролиза, ферментируются в этанол ферментирующим организмом, таким как дрожжи. Ферментация может также проводиться одновременно с ферментативным гидролизом в одном и том же сосуде, опять при регулируемых рН, температуре и условиях смешения. При выполнении осахаривания и ферментации одновременно в одном и том же сосуде этот процесс обычно называют одновременными осахариванием и ферментацией, или SSF.
Любой подходящий целлюлозный субстрат или сырьевой материал может быть использован в процессе (способе) ферментации в практике данного изобретения. Этот субстрат обычно выбирают на основе желаемого продукта ферментации, т.е. вещества, которое должно быть получено из этой ферментации, и этот процесс (способ) используют, как хорошо известно в этой области. Примеры субстратов, подходящих для применения в способах данного изобретения, включают в себя содержащие целлюлозу материалы, такие как остатки древесины или растений или низкомолекулярные сахара DP1-3, полученные из обрабатываемого целлюлозного материала, которые могут метаболизироваться ферментирующим микроорганизмом и которые могут подаваться прямым добавлением в ферментационную среду.
Будет понятно, что термин «ферментационная среда» относится к среде перед добавлением ферментирующего микроорганизма (ферментирующих микроорганизмов), такой как среда, полученная из процесса осахаривания, а также среда, используемая в процессе одновременных осахаривания и ферментации (SSF).
Будет понятно, что термин «ферментирующий микроорганизм» относится к любому микроорганизму, подходящему для использования в желаемом ферментационном процессе. Подходящие ферментирующие микроорганизмы в соответствии с этим изобретением способны ферментировать, т.е. превращать, сахара, такие как глюкоза, ксилоза, арабиноза, манноза, галактоза, или олигосахариды прямо или опосредованно в желаемый продукт ферментации. Примеры ферментирующих микроорганизмов включают в себя грибные организмы, например дрожжи. Предпочтительные штаммы дрожжей включают в себя Saccharomyces spp. и, в частности, Saccharomyces cerevisiae. Коммерчески доступные дрожжи включают в себя, например, Red Star®/™/Lesaffre Ethanol Red (доступные из Red Star/Lesaffre, USA), FALI (доступные из Fleischmann's Yeast, a division of Burns Philp Food Inc., USA), SUPERSTART (доступные из Alltech), GERT STRAND (доступные из Gert Strand AB, Sweden) и FERMIOL (доступные из DSM Specialties).
В предпочтительном аспекте, этими дрожжами являются Saccharomyces spp. В более предпочтительном аспекте, этими дрожжами является Saccharomyces cerevisiae. В другом более предпочтительном аспекте, этими дрожжами является Saccharomyces distaticus. В другом более предпочтительном аспекте, этими дрожжами является Saccharomyces uvarum. В другом более предпочтительном аспекте, этими дрожжами является Kluyveromyces. В другом более предпочтительном аспекте, этими дрожжами является Kluyveromyces marxianus. В другом более предпочтительном аспекте, этими дрожжами является Kluyveromyces fragilis. В другом более предпочтительном аспекте, этими дрожжами является Candida. В другом более предпочтительном аспекте, этими дрожжами является Candida pseudotropicalis. В другом более предпочтительном аспекте, этими дрожжами является Candida brassicae. В другом более предпочтительном аспекте, этими дрожжами является Clavispora. В другом более предпочтительном аспекте, этими дрожжами является Clavispora lusitaniae. В другом более предпочтительном аспекте, этими дрожжами является Clavispora opuntiae. В другом предпочтительном аспекте, этими дрожжами является Pachysolen. В другом более предпочтительном аспекте, этими дрожжами является Pachysolen tannophilus. В другом более предпочтительном аспекте, этими дрожжами является Bretannomyces. В другом более предпочтительном аспекте, этими дрожжами является Bretannomyces clausenii (Philippidis, G. P., 1996, Cellulose bioconversion technology, in Handbook on Bioethanol: Production and Utilization, Wyman, C. E., ed., Taylor & Francis, Washington, DC, 179-212).
Бактерии, которые могут эффективно ферментировать глюкозу до этанола, включают в себя, например, Zymomonas mobilis и Clostridium thermocellum (Philippidis, 1996, supra).
В данной области хорошо известно, что описанные выше организмы могут быть также использованы для получения других веществ, описанных здесь.
Клонирование гетерологичных генов в Saccharomyces cerevisiae (Chen, Z., Ho, N. W. Y., 1993, Cloning and improving the expression of Pichia stipitis xylose reductase gene in Saccharomyces cerevisiae, Appl. Biochem. Biotechnol. 39-40: 135-147; Ho, N. W. Y., Chen, Z, Brainard, A. P., 1998, Genetically engineered Saccharomyces yeast capable of effectively cofermenting glucose and xylose, Appl. Environ. Microbiol. 64: 1852-1859) или в бактериях, таких как Escherichia coli (Beall, D. S., Ohta, K., Ingram, L. O., 1991, Parametric studies of ethanol production from xylose and other sugars by recombinant Escherichia coli, Biotech. Bioeng. 38: 296-303), Klebsiella oxytoca (Ingram, L. O., Gomes, P. F., Lai, X., Moniruzzaman, M., Wood, B. E., Yomano, L. P., York, S. W., 1998, Metabolic engineering of bacteria for ethanol production, Biotechnol. Bioeng. 58: 204-214) и Zymomonas mobilis (Zhang, M., Eddy, C, Deanda, K., Finkelstein, M., and Picataggio, S., 1995, Metabolic engineering of a pentose metabolism pathway in ethanologenic Zymomonas mobilis, Science 267: 240-243; Deanda, K., Zhang, M., Eddy, C, and Picataggio, S., 1996, Development of an arabinose-fermenting Zymomonas mobilis strain by metabolic pathway engineering, Appl. Environ. Microbiol. 62: 4465-4470), привело к конструированию организмов, способных превращать гексозы и пентозы в этанол (при коферментации).
Дрожжи или другой микроорганизм обычно добавляют к деградированной целлюлозе или деградированному гидролизату и выполняют ферментацию в течение приблизительно 24 - приблизительно 96 часов, например приблизительно 35 - приблизительно 60 часов. Температура обычно равна приблизительно 26°C - приблизительно 40°C, в частности приблизительно 32°C, и при приблизительно pH 3 - приблизительно pH 6, в частности около pH 4-5.
В предпочтительном аспекте, дрожжи или другой микроорганизм наносят на деградированные целлюлозу или гидролизат и ферментацию выполняют в течение приблизительно 24 - приблизительно 96 часов, например обычно 35-60 часов. В предпочтительном аспекте, температура обычно равна приблизительно 26 - приблизительно 40°C, в частности приблизительно 32°C, и pH равен обычно приблизительно pH 3 - приблизительно pH 6, предпочтительно около pH 4-5. Дрожжи или другой микроорганизм предпочтительно наносят в количествах приблизительно 105-1012, предпочтительно приблизительно 107-1010, в частности приблизительно 5×107 жизнеспособных микроорганизмов на мл ферментационного бульона. Во время фазы продуцирования этанола количество клеток дрожжей должно находиться предпочтительно в диапазоне приблизительно 107-1010, в частности около приблизительно 2×108. Дополнительное руководство в отношении использования дрожжей для ферментации может быть найдено, например, в руководстве "The Alcohol Textbook" (Editors K. Jacques, T.P. Lyons and D. R. Kelsall, Nottingham University Press, United Kingdom 1999), включенном здесь в качестве ссылки.
Наиболее широко используемым способом (процессом) в этой области является способ одновременных осахаривания и ферментации (SSF), в котором нет отдельной стадии для осахаривания, в том смысле что дрожжи и фермент добавляют вместе.
Для получения этанола, после ферментации затор подвергают дистилляции для экстракции этанола. Этанол, полученный в соответствии со способом этого изобретения, может быть использован, например, как топливный этанол, питьевой этанол, т.е. пригодные для питья спиртные напитки, или промышленный этанол.
Может быть использован стимулятор ферментации в комбинации с любым из описанных здесь ферментационных процессов для дополнительного улучшения ферментационного процесса и, в частности, производительности ферментирующего микроорганизма, например увеличения скорости ферментации и выхода этанола. «Стимулятором ферментации» называют стимуляторы для роста ферментирующих микроорганизмов, в частности дрожжей. Предпочтительные стимуляторы ферментации для роста включают в себя витамины и минералы. Примеры витаминов включают в себя мультивитамины, биотин, пантотенат, никотиновую кислоту, мезоинозит, тиамин, пиридоксин, пара-аминобензойную кислоту, фолиевую кислоту, рибофлавин и Витамины A, B, C, D и E. См., например, публикацию Alfenore et al., Improving ethanol production and viability of Saccharomyces cerevisiae by a vitamin feeding strategy during fed-batch process, Springer-Verlag (2002), включенную здесь в качестве ссылки. Примеры минеральных соединений включают в себя минеральные соединения и минеральные соли, которые могут поставлять питательные вещества, содержащие P, K, Mg, S, Ca, Fe, Zn, Mn и Cu.
Извлечение. Спирт выделяют из ферментированного целлюлозного материала и очищают общепринятыми способами дистилляции. Может быть получен этанол с чистотой до приблизительно 96 об.%, который может быть использован, например, в качестве топливного этанола, питьевого этанола, например пригодных для питья нейтральных спиртных напитков, или промышленного этанола.
Для других веществ может быть использован любой способ, известный в этой области, в том числе, но не только, хроматография (например, ионообменная, аффинная, гидрофобная хроматография, хроматофокусирование и вытеснительная хроматография), электрофоретические процедуры (например, препаративное изоэлектрическое фокусирование), использование дифференциальной растворимости (например, осаждение сульфатом аммония), электрофорез в ДСН-ПААГ, дистилляция или экстракция.
В способах данного изобретения целлюлолитический белок (целлюлолитические белки) и целлюлолитический усиливающий полипептид (целлюлолитические усиливающие полипептиды) могут быть дополнены одним или несколькими дополнительными ферментными активностями для улучшения деградации целлюлозного материала. Предпочтительными дополнительными ферментами являются гемицеллюлазы, эстеразы (например, липазы, фосфолипазы и/или кутиназы), протеазы, лакказы, пероксидазы или их смеси.
В способах данного изобретения этот дополнительный фермент (дополнительные ферменты) могут быть добавлены до или во время ферментации, в том числе во время или после размножения ферментирующего микроорганизма (ферментирующих микроорганизмов).
Приведенные здесь ферменты могут происходить или могут быть получены из любого подходящего источника, в том числе могут быть бактериального, грибного, дрожжевого происхождения или происходить из млекопитающего. Термин «полученный» обозначает здесь, что данный фермент может быть выделен из организма, который природно продуцирует этот фермент в качестве нативного фермента. Термин «полученный» обозначает здесь также, что этот фермент может быть получен рекомбинантно в организме-хозяине, где этот рекомбинантно полученный фермент является либо нативным, либо чужеродным для организма-хозяина, или имеет модифицированную аминокислотную последовательность, например, имеющую одну или более аминокислот, которые делетированы, инсертированы и/или заменены, т.е. рекомбинантно полученным ферментом, который является мутантом и/или фрагментом нативной аминокислотной последовательности, или ферментом, полученным процессами перетасовки нуклеиновых кислот, известным в данной области. В термин «нативный фермент» включены природные варианты, а в термин «чужеродный фермент» включены варианты, полученные рекомбинантно, например сайт-направленным мутагенезом или перетасовкой.
Эти ферменты могут быть также очищены. Термин «очищенные» включает в себя, в данном контексте, ферменты, не содержащие других компонентов из организма, из которого они были получены. Термин «очищенные», в данном контексте, включает в себя также ферменты, не содержащие компонентов из нативного организма, из которого они были получены. Ферменты могут быть очищенными, имеющими только минорные количества присутствующих других белков. Выражение «другие белки» относится, в частности, к другим ферментам. Термин «очищенные» относится, в данном контексте, также к удалению других компонентов, в частности других белков, и, наиболее предпочтительно, других ферментов, присутствующих в клетке источника фермента этого изобретения. Фермент может быть «по существу чистым полипептидом», т.е. не содержащим других компонентов из организма, из которого он получен, т.е., например, организма-хозяина для рекомбинантно полученных ферментов.
Ферменты, использованные в данном изобретении, могут находиться в любой форме, подходящей для применения в описанных выше процессах, такой как, например, неочищенный ферментационный бульон с клетками или без клеток, сухой порошок или гранулят, жидкость, стабилизированная жидкость или защищенный фермент. Грануляты могут быть получены, например, как описано в Патентах США с номерами 4106991 и 4661452, и могут быть необязательно покрыты покрытием способом, известным в данной области. Жидкие препараты ферментов могут быть, например, стабилизированы добавлением стабилизаторов, таких как сахар, сахароспирт или другой полиол и/или молочная кислота или другая органическая кислота, в соответствии с установленным способом. Защищенные ферменты могут быть получены в соответствии со способом, описанным в EP 238216.
Гемицеллюлазы
Ферментативный гидролиз гемицеллюлоз может выполняться большим разнообразием грибов и бактерий. Сходный с деградацией целлюлозы, гидролиз гемицеллюлозы требует координированного действия многих ферментов. Гемицеллюлозы могут быть помещены в три общие категории: эндо-действующие ферменты, которые атакуют внутренние связи в цепи полисахарида, экзо-действующие ферменты, который действуют разрушающим образом либо от редуцирующего, либо от нередуцирующего конца полисахаридной цепи, и вспомогательные ферменты, ацетилэстеразы и эстеразы, которые гидролизуют гликозидные связи лигнина, такие как эстераза кумариновой кислоты и эстераза феруловой кислоты (Wong, K.K.Y., Tan, L. U. L., and Saddler, J. N., 1988, Multiplicity of β-1,4-xylanase in microorganisms: Functions and applications, Microbiol. Rev. 52: 305-317; Tenkanen, M., and Poutanen, K., 1992, Significance of esterases in the degradation of xylans, in Xylans and Xylanases, Visser, J., Beldman, G., Kuster-van Someren, M. A., and Voragen, A. G. J., eds., Elsevier, New York, NY, 203-212; Coughlan, M. P., and Hazlewood, G. P., 1993, Hemicellulose and hemicellulases, Portland, London, UK; Brigham, J. S., Adney, W. S., and Himmel, M. E., 1996, Hemicellulases: Diversity and applications, in Handbook on Bioethanol: Production and Utilization, Wyman, C. E., ed., Taylor & Francis, Washington, DC, 119-141).
Гемицеллюлазы включают в себя ксиланазы, арабинофуранозидазы, ацетилксиланэстеразу, глюкуронидазу, эндо-галактаназу, маннаназы, эндо- и экзо-арабиназы, экзо-галактаназы и их смеси. Примеры эндо-действующих гемицеллюлаз и вспомогательных ферментов включают в себя эндоарабинаназу, эндоарабиногалактаназу, эндоглюканазу, эндоманнаназу, эндоксиланазу и фераксанэндоксиланазу. Примеры экзо-действующих гемицеллюлаз и вспомогательных ферментов включают в себя α-L-арабинозидазу, β-L-арабинозидазу, α-1,2-L-фукозидазу, α-D-галактозидазу, β-D-галактозидазу, β-D-глюкозидазу, β-D-глюкуронидазу, β-D-маннозидазу, β-D-ксилозидазу, экзоглюкозидазу, экзоцеллобиогидролазу, экзоманнобиогидролазу, экзоманнаназу, экзоксиланазу, ксилан-α-глюкуронидазу и кониферин-β-глюкозидазу. Примеры эстераз включают в себя ацетилэстеразы (ацетилгалактанэстеразу, ацетилманнанэстеразу и ацетилксиланэстеразу) и арилэстеразы (эстеразу кумариновой кислоты и эстеразу феруловой кислоты).
Предпочтительно, гемицеллюлаза является экзо-действующей гемицеллюлазой и, более предпочтительно, экзо-действующей гемицеллюлазой, которая способна гидролизовать гемицеллюлозу при кислотных условиях ниже рН 7. Примером гемицеллюлазы, подходящим для использования в данном изобретении, является VISCOZYME™ (доступный из Novozymes A/S, Denmark). Эту гемицеллюлозу добавляют в эффективном количестве приблизительно 0,001 мас.% - приблизительно 5,0 мас.% твердых веществ, более предпочтительно приблизительно 0,025 мас.% - приблизительно 4,0 мас.% твердых веществ и, наиболее предпочтительно приблизительно 0,005 мас.% - приблизительно 2,0 мас.% твердых веществ.
Ксиланаза (E.C. 3.2.1.8) может быть получена из любого подходящего источника, в том числе грибных и бактериальных организмов, таких как Aspergillus, Disporotrichum, Penicillium, Neurospora, Fusarium, Trichoderma, Humicola, Thermomyces и Bacillus. Предпочтительные коммерчески доступные препараты, содержащие ксиланазу, включают в себя SHEARZYME®, BIOFEED WHEAT®, BIO-FEED Plus® L, CELLUCLAST®, ULTRAFLO®, VISCOZYME®, PENTOPAN MONO® BG и PULPZYME® HC (Novozymes A/S); и LAMINEX® и SPEZYME® CP (Genencor Int.).
Эстеразы
Эстеразы, которые могут быть использованы для биопревращения целлюлозы, включают в себя ацетилэстеразы, такие как ацетилгалактанэстераза, ацетилманнанэстераза и ацетилксиланэстераза, и эстеразы, которые гидролизуют гликозидные связи лигнина, такие как эстераза кумариновой кислоты и эстераза феруловой кислоты.
В данном контексте, термин «эстераза», известная так же как гидролиаза эфиров карбоновых кислот, относится к ферментам, действующим на сложноэфирные связи, и включает в себя ферменты, классифицированные в ЕС 3.1.1 Гидролазы Эфиров Карбоновых Кислот в соответствии с Номенклатурой Ферментов (Enzyme Nomenclature, 1992, Academic Press, San Diego, California, with Supplement 1 (1993), Supplement 2 (1994), Supplement 3 (1995), Supplement 4 (1997) and Supplement 5, in Eur. J. Biochem. 223: 1-5, 1994; Eur. J. Biochem. 232: 1-6, 1995; Eur. J. Biochem. 237: 1-5, 1996; Eur. J. Biochem. 250: 1-6, 1997 и Eur. J. Biochem. 264: 610-650, 1999 соответственно). Неограничивающие примеры эстераз включают в себя арилэстеразу, триацилглицероллипазу, ацетилэстеразу, ацетилхолинэстеразу, холинэстеразу, тропинэстеразу, пектинэстеразу, стеролэстеразу, хлорофиллазу, L-арабинонолактоназу, глюконолактоназу, уронолактоназу, танназу, ретинилпальмитатэстеразу, гидроксибутират-димергидролазу, ацилглицероллипазу, 3-оксоадипатеноллактоназу, 1,4-лактоназу, галактолипазу, 4-пиридоксолактоназу, ацилкамитингидролазу, аминоацил-тРНК-гидролазу, D-арабинолактоназу, 6-фосфоглюконолактоназу, фосфолипазу A1, 6-ацетилглюкозодеацетилазу, липопротеинлипазу, дигидрокумаринлипазу, лимонин-D-кольцо-лактоназу, стероидлактоназу, триацетатлактоназу, актиномицинлактоназу, орселлинатдепсидгидролазу, цефалоспорин-C-деацетилазу, хлорогенатгидролазу, эстеразу α-аминокислот, 4-метилоксалоацетатэстеразу, карбоксиметиленбутенолидазу, деоксилимонат-A-кольцо-лактоназу, 2-ацетил-1-алкилглицерофосфохолинэстеразу, фузаринин-C-омитинэстеразу, синапинэстеразу, гидролазу эфиров воска, форбол-диэфирную гидролазу, фосфатидилинозитолдеацилазу, сиалат O-ацетилэстеразу, ацетоксибутинилбитиофендеацетилазу, ацетилсалицилатдеацетилазу, метилумбеллиферилацетатдеацетилазу, 2-пирон-4,6-дикарбоксилатлактоназу, N-ацетилгалактозаминогликандеацетилазу, эстеразу ювенильного гормона, бис(2-этилгексил)фталатэстеразу, протеинглутаматметилэстеразу, 11-цис-ретинилпальмитатгидролазу, все-транс-ретинилпальмитатгидролазу, L-рамноно-1,4-лактоназу, 5-(3,4-диацетоксибут-1-инил)-2,2'-битиофендеацетилазу, синтазу этилового эфира жирной кислоты, ксилоно-1,4-лактоназу, N-ацетилглюкозаминилфосфатидилинозитолдеацетилазу, цетраксатбензилэстеразу, ацетилалкилглицеролацетилгидролазу и ацетилксиланэстеразу.
Предпочтительными эстеразами для использования в данном изобретении являются такие липолитические ферменты, как липазы (классифицированные как EC 3.1.1.3, EC 3.1.1.23 и/или EC 3.1.1.26) и фосфолипазы (классифицированные как EC 3.1.1.4 и/или EC 3.1.1.32, в том числе лизофосфолипазы, классифицированные как EC 3.1.1.5). Другими предпочтительными эстеразами являются кутиназы (классифицированные как EC 3.1.1.74).
Эстераза может добавляться в количестве, эффективном для получения желаемого преимущества для улучшения производительности ферментирующего микроорганизма, например для изменения состава/концентрации липидов внутри и/или вне ферментирующего микроорганизма или в клеточной мембране ферментирующего микроорганизма для получения улучшения в перемещении растворенных веществ в ферментирующие микроорганизмы и/или из ферментирующих микроорганизмов во время ферментации и/или для обеспечения более метаболизируемых источников энергии (например, превращением компонентов, таких как масло, из кукурузного субстрата в компоненты, полезные для ферментирующего микроорганизма, например ненасыщенные жирные кислоты и глицерин), для увеличения выхода этанола. Примерами эффективных количеств эстеразы являются количества приблизительно 0,01 - приблизительно 400 LU/г DS (сухих твердых веществ). Предпочтительно эстеразу используют в количестве приблизительно 0,1 - приблизительно 100 LU/г DS, более предпочтительно приблизительно 0,5 - приблизительно 50 LU/г DS и даже более предпочтительно приблизительно 1 - приблизительно 20 LU/г DS. Дополнительная оптимизация количества эстеразы может быть получена с использованием стандартных процедур, известных в этой области, описанных здесь далее.
Одна Липазная Единица (LU) является количеством фермента, которое высвобождает 1,0 мкмоль титруемой жирной кислоты в минуту с трибутирином в качестве субстрата и гуммиарабика в качестве эмульгатора при 30оС, рН 7,0 (в фосфатном буфере).
В предпочтительном аспекте, эстераза является липолитическим ферментом, более предпочтительно, липазой. В данном контексте, «липолитическим ферментом» называют липазы и фосфолипазы (в том числе лизо-фосфолипазы). Липолитический фермент предпочтительно является ферментом бактериального происхождения, в частности бактериального, грибного или дрожжевого происхождения. Используемый липолитический фермент может быть получен из любого источника, включающего в себя, например, штамм Absidia, в частности Absidia blakesleena и Absidia corymbifera, штамм Achromobacter, в частности Achromobacter iophagus, штамм Aeromonas, штамм Alternaria, в частности Alternaria brassiciola, штамм Aspergillus, в частности Aspergillus niger, Aspergillus oryzae, Aspergillus fumigatus и Aspergillus flavus, штамм Achromobacter, в частности Achromobacter iophagus, штамм Aureobasidium, в частности Aureobasidium pullulans, штамм Bacillus, в частности Bacillus pumilus, Bacillus stearothermophilus и Bacillus subtilis, штамм Beauveria, штамм Brochothrix, в частности Brochothrix thermosohata, штамм Candida, в частности Candida cylindracea {Candida rugosa), Candida paralipolytica и Candida antarctica, штамм Chromobacter, в частности Chromobacter viscosum, штамм Coprinus, в частности Coprinus cinereus, штамм Fusarium, в частности Fusarium graminearum, Fusarium oxysporum, Fusarium solani, Fusarium solani pisi, Fusarium roseum culmorum и Fusarium venenatum, штамм Geotricum, в частности Geotricum penicillatum, штамм Hansenula, в частности Hansenula anomala, штамм Humicola, в частности Humicola brevispora, Humicola brevis var. thermoidea и Humicola insolens, штамм Hyphozyma, штамм Lactobacillus, в частности Lactobacillus curvatus, штамм Metarhizium, штамм Mucor, штамм Paecilomyces, штамм Penicillium, в частности Penicillium cyclopium, Penicillium crustosum и Penicillium expansum, штамм Pseudomonas, в частности Pseudomonas aeruginosa, Pseudomonas alcaligenes, Pseudomonas cepacia (syn. Burkholderia cepacia), Pseudomonas fluorescens, Pseudomonas tragi, Pseudomonas maltophilia, Pseudomonas mendocina, Pseudomonas mephitica lipolytica, Pseudomonas alcaligenes, Pseudomonas plantari, Pseudomonas pseudoalcaligenes, Pseudomonas putida, Pseudomonas stutzeri и Pseudomonas wisconsinensis, шиамм Rhizooctonia, в частности Rhizooctonia solani, штамм Rhizomucor, в частности Rhizomucor miehei, штамм Rhizopus, в частности Rhizopus japonicus, Rhizopus microsporus и Rhizopus nodosus, штамм Rhodospohdium, в частности Rhodosporidium toruloides, штамм Rhodotorula, в частности Rhodotorula glutinis, штамм Sporobolomyces, в частности Sporobolomyces shibatanus, штамм Thermomyces, в частности Thermomyces lanuginosus (ранее Humicola lanuginosa), штамм Thiarosporella, в частности Thiarosporella phaseolina, штамм Trichoderma, в частности Trichoderma harzianum и Trichoderma reesei, и/или штамм Verticillium.
В предпочтительном аспекте, липолитический фермент получен из штамма Aspergillus, Achromobacter, Bacillus, Candida, Chromobacter, Fusarium, Humicola, Hyphozyma, Pseudomonas, Rhizomucor, Rhizopus или Thermomyces.
В более предпочтительных аспектах, этот липолитический штамм является липазой. Липазы могут применяться здесь вследствие их способности модифицировать структуру и состав триглицеридных масел и жиров в ферментационных средах (в том числе при ферментации дрожжей), например, происходящих из кукурузного субстрата. Липазы катализируют различные типы превращений триглицеридов, такие как гидролиз, этерификация и переэтерификация. Подходящие липазы включают в себя кислые, нейтральные и основные липазы, как хорошо известно в этой области, хотя кислые липазы (такие как, например, липаза G AMANO 50, доступная из Amano) являются, по-видимому, более эффективными при более низких концентрациях липазы в сравнении с нейтральными или основными липазами. Предпочтительные липазы для использования в данном изобретении включают в себя липазу Candida antarctica и липазу Candida cylindracea. Более предпочтительными липазами являются очищенные липазы, такие как липаза Candida antarctica (липаза A), липаза Candida antarctica (липаза B), липаза Candida cylindracea и липаза Penicillium camembertii.
Эта липаза может быть липазой, описанной в EP 258,068-A, или может быть вариантом липазы, таким как вариант, описанный в WO 00/60063 или WO 00/32758, включенных здесь в качестве ссылки.
Липазы предпочтительно добавляют в количествах приблизительно 1 - приблизительно 400 LU/г DS, предпочтительно приблизительно 1 - приблизительно 10 LU/г DS и более предпочтительно приблизительно 1 - приблизительно 5 LU/г DS.
В другом предпочтительном аспекте, эстеразой является кутиназа. Кутиназы являются ферментами, которые способны деградировать кутин. Кутиназы могут быть получены из любого источника. В предпочтительном аспекте, кутиназа получена из штамма Aspergillus, в частности Aspergillus oryzae, штамма Alternaria, в частности Alternaria brassiciola, штамма Fusarium, в частности Fusarium solani, Fusarium solani pisi, Fusarium roseum culmorum или Fusarium roseum sambucium, штамма Helminthosporum, в частности Helminthosporum sativum, штамма Humicola, в частности Humicola insolens, штамма Pseudomonas, в частности Pseudomonas mendocina или Pseudomonas putida, штамма Rhizooctonia, в частности Rhizooctonia solani, штамма Streptomyces, в частности Streptomyces scabies, или штамма Ulocladium, в частности Ulocladium consortiale. В наиболее предпочтительном аспекте, кутиназа происходит из штамма Humicola insolens, в частности штамма Humicola insolens DSM 1800. Кутиназа Humicola insolens описана в WO 96/13580, включенном здесь в качестве ссылки. Кутиназа может быть вариантом, таким как один из вариантов, описанных в WO 00/34450 и WO 01/92502, которые включены здесь в качестве ссылки. Предпочтительные варианты кутиназы включают в себя варианты, перечисленные в примере 2 WO 01/92502, включенном здесь специально в качестве ссылки. Эффективное количество кутиназы равно приблизительно 0,01 - приблизительно 400 LU/г DS, предпочтительно приблизительно 0,1 - приблизительно 100 LU/г DS и более предпочтительно приблизительно 1 - приблизительно 50 LU/г DS. Дополнительная оптимизация количества кутиназы может быть получена с использованием стандартных процедур, известных в этой области, как показано здесь далее.
В другом предпочтительном аспекте, эстераза является фосфолипазой. В данном контексте, термин «фосфолипаза» обозначает фермент, который имеет активность в отношении фосфолипидов, например гидролитическую активность. Фосфолипиды, такие как лецитин или фосфатидилхолин, состоят из глицерина, этерифицированного двумя жирными кислотами в наружном (sn-1) и средних (sn-2) положениях и этерифицированы фосфорной кислотой в положении 3. Фосфорная кислота может быть этерифицирована до аминоспирта. Могут быть выделены несколько типов фосфолипазной активности, в том числе фосфолипазы А1 и А2, которые гидролизуют одну ацильную группу жирной кислоты (в положении sn-1 и sn-2 соответственно) с образованием липофосфолипида; и лизофосфолипазу (или фосфолипазу B), которая гидролизует оставшуюся ацильную группу жирной кислоты в лизофосфолипиде. Фосфолипаза С и фосфолипаза D (фосфодиэстеразы) высвобождают диацилглицерин или фосфатидную кислоту соответственно).
Термин «фосфолипаза» включает в себя ферменты с фосфолипазной активностью, например активностью фосфолипазы А (А1 или А2), фосфолипазы В, активностью фосфолипазы С или активностью фосфолипазы D. Термин «фосфолипаза А», в данном контексте, включает в себя фермент с активностью фосфолипазы А1 и/или активностью фосфолипазы А2. Фосфолипазная активность может быть обеспечена также ферментами, имеющими другие активности, такими как, например, липаза с фосфолипазной активностью. Фосфолипазную активность может, например, иметь липаза с фосфолипазной побочной активностью. В других аспектах, фосфолипазная ферментативная активность обеспечивается ферментом, имеющим по существу только фосфолипазную активность, в котором эта фосфолипазная активность не является побочной активностью.
Фосфолипаза может быть фосфолипазой любого происхождения, например может происходить из животного (например, млекопитающего, например из поджелудочной железы коровы или свиньи) или из змеиного яда или пчелиного яда. Альтернативно, фосфолипаза может быть микробного происхождения, например происходить из мицелиальных грибов, дрожжей или бактерий, таких как Aspergillus, например A. awamori, A. foetidus, A. japonicus, A. niger или A. oryzae, Dictyostelium, например D. discoideum; Fusarium, например F. culmorum, F. graminearum, F. heterosporum, F. solani, F. Oxysporum или F. venenatum; Mucor, например M. javanicus, M. Mucedo или M. subtilissimus; Neurospora, например N. crassa; Rhizomucor, например R. pusillus; Rhizopus, например R. arrhizus, R. Japonicus или R. stolonifer; Sclerotinia, например, S. libertiana; Trichophyton, например T. rubrum; Whetzelinia, например W. sclerotiorum; Bacillus, например B. megaterium или S. subtilis; Citrobacter, например C. freundii; Enterobacter, например E. aerogenes или E. cloacae; Edwardsiella, E. tarda; Erwinia, например E. herbicola; Escherichia, например E. coli; Klebsiella, например K. pneumoniae; Proteus, например P. vulgaris; Providencia, например P. stuartii; Salmonella, например S. typhimurium; Serratia, например S. liquefasciens, S. marcescens; Shigella, например S. flexneri; Streptomyces, например S. violeceoruber; или Yersinia, например Y. enterocolitica.
Предпочтительные коммерческие фосфолипазы включают в себя LECITASE™ и LECITASE™ ULTRA (доступные из Novozymes A/S, Denmark).
Эффективное количество фосфолипазы предпочтительно равно приблизительно 0,01 - приблизительно 400 LU/г DS, предпочтительно приблизительно 0,1 - приблизительно 100 LU/г DS и более предпочтительно приблизительно 1 - приблизительно 50 LU/г DS. Дополнительная оптимизация количества фосфолипазы может быть получена с использованием стандартных процедур, известных в этой области, описанных далее.
Протеазы
В другом предпочтительном аспекте изобретения, используют, по меньшей мере, одно поверхностно-активное вещество и, по меньшей мере, один генерирующий углевод фермент в комбинации, по меньшей мере, с одной протеазой. Эта протеаза может быть использована, например, для расщепления белка с образованием свободного аминного азота (FAN). Такие свободные аминокислоты функционируют в качестве нутриентов для дрожжей, усиливая посредством этого рост дрожжей и, следовательно, продуцирование этанола.
Ферментирующий микроорганизм для использования в ферментационном процессе может быть получен размножением ферментирующего микроорганизма в присутствии, по меньшей мере, одной протеазы. Без ограничения какой-либо теорией действия, авторы считают, что размножение ферментирующего микроорганизма с эффективным количеством, по меньшей мере, одной протеазы уменьшает лаг-период ферментирующего микроорганизма при последующем использовании ферментирующего микроорганизма в ферментационном процессе в сравнении с ферментирующим микроорганизмом, который размножался при тех же самых условиях без добавления протеазы. Авторы считают, что действие протеазы в процессе размножения прямо или опосредованно приводит к супрессии или экспрессии генов, которые являются вредными или полезными соответственно для ферментирующего микроорганизма во время ферментации, уменьшая тем самым лаг-период и приводя к более быстрому ферментационному циклу.
Протеазы хорошо известны в этой области и являются ферментами, которые катализируют расщепление пептидных связей. Подходящие протеазы включают в себя грибные и бактериальные протеазы. Предпочтительные протеазы являются кислыми протеазами, т.е. протеазами, характеризуемыми способностью гидролизовать белки при кислотных условиях ниже рН 7. Подходящие кислые грибные протеазы включают в себя грибные протеазы, происходящие из Aspergillus, Mucor, Rhizopus, Candida, Coriolus, Endothia, Enthomophtra, Irpex, Penicillium, Sclerotium и Torulopsis. В частности, рассматриваются протеазы, полученные из Aspergillus niger (см., например, Koaze et al., 1964, Agr. Biol. Chem. Japan 28: 216), Aspergillus saitoi (см., например, Yoshida, 1954, J. Agr. Chem. Soc. Japan 28: 66), Aspergillus awamori (Hayashida et al., 1977, Agric. Biol. Chem. 42: 927-933), Aspergillus aculeatus (WO 95/02044) или Aspergillus oryzae; и кислые протеазы из Mucor pusillus или Mucor miehei.
Бактериальные протеазы, которые не являются кислыми протеазами, включают в себя коммерчески доступные продукты ALCALASE™ и NEUTRASE™ (доступные из Novozymes A/S). Другие протеазы включают в себя GC106 из Genencor International, Inc., USA и NOVOZYM™ 50006 из Novozymes A/S.
Предпочтительно, протеаза является протеазой аспарагиновой кислоты, описанной, например, в Handbook of Proteolytic Enzymes, Edited by A.J. Barrett, N. D. Rawlings and J. F. Woessner, Academic Press, San Diego, 1998, Chapter 270. Подходящие примеры протеазы аспарагиновой кислоты включают в себя, например, протеазы, описанные Berka et al., 1990, Gene 96: 313; Berka et al., 1993, Gene 125: 195-198; и Gomi et al., 1993, Biosci. Biotech. Biochem. 57: 1095-1100.
Пероксидазы
Другими соединениями, обладающими пероксидазной активностью, могут быть любая пероксидаза (EC 1.11.1.7) или любой фрагмент, имеющий пероксидазную активность, полученный из нее, проявляющий пероксидазную активность.
Предпочтительно, пероксидаза продуцируется растениями (например, пероксидаза хрена или пероксидаза сои) или микроорганизмами, такими как грибы или бактерии.
Некоторые предпочтительные грибы включают в себя штаммы, принадлежащие к подразделению Deuteromycotina, классу Hyphomycetes, например Fusarium, Humicola, Tricoderma, Myrothecium, Verticillum, Arthromyces, Caldariomyces, Ulocladium, Embellisia, Cladosporium или Dreschlera, в частности Fusarium oxysporum (DSM 2672), Humicola insolens, Trichoderma reesei, Myrothecium verrucaria (IFO 6113), Verticillum alboatrum, Verticillum dahlie, Arthromyces ramosus (FERM P-7754), Caldariomyces fumago, Ulocladium chartarum, Embellisia alii или Dreschlera halodes.
Другие предпочтительные грибы включают в себя штаммы, принадлежащие к подразделению Basidiomycotina, классу Basidiomycetes, например Coprinus, Phanerochaete, Coriolus или Trametes, в частности Coprinus cinereus f. microsporus (IFO 8371), Coprinus macrorhizus, Phanerochaete chrysosporium (например, NA-12) или Trametes (ранее называемый Polyporus), например T. versicolor (например, PR4 28-A).
Другие предпочтительные грибы включают в себя штаммы, принадлежащие к подразделению Zygomycotina, классу Mycoraceae, например Rhizopus или Mucor, в частности Mucor hiemalis.
Некоторые предпочтительные бактерии включают в себя штаммы отряда Actinomycetales, например Streptomyces spheroides (ATTC 23965), Streptomyces thermoviolaceus (IFO 12382) или Streptoverticillum verticillium ssp. verticillium.
Другие предпочтительные бактерии включают в себя Rhodobacter sphaeroides, Rhodomonas palustri, Streptococcus lactis, Pseudomonas purrocinia (ATCC 15958), Pseudomonas fluorescens (NRRL B-11) и штаммы Bacillus, например Bacillus pumilus (ATCC 12905) и Bacillus stearothermophilus.
Дополнительные предпочтительные бактерии включают в себя штаммы, принадлежащие к Myxococcus, например M. virescens.
Пероксидаза может быть также пероксидазой, которую получают по способу, предусматривающему культивирование клетки-хозяина, трансформированной ДНК-вектором, который несет последовательность ДНК, кодирующую пероксидазу, а также последовательности ДНК для экспрессии последовательности ДНК, кодирующей эту пероксидазу, в культуральной среде при условиях, позволяющих экспрессию этой пероксидазы и извлечение этой пероксидазы из культуры.
В предпочтительном аспекте, рекомбинантно продуцированной пероксидазой является пероксидаза, происходящая из Coprinus sp., в частности C. macrorhizus или C. cinereus, в соответствии с WO 92/16634.
В данном изобретении, соединения, обладающие пероксидазной активностью, включают в себя пероксидазные ферменты и активные фрагменты пероксидазы, полученные из цитохромов, гемоглобина или пероксидазных ферментов.
Одна пероксидазная единица (POXU) является количеством фермента, которое при следующих условиях катализирует превращение 1 мкмоля пероксида водорода в минуту при 30°C в 0,1 M фосфатном буфере pH 7,0, 0,88 мМ пероксиде водорода и 1,67 мМ 2,2'-азино-бис(3-этилбензотиазолин-6-сульфонате) (ABTS). Эту реакцию прослеживают в течение 60 секунд (15 секунд после смешивания) по изменению оптической плотности при 418 нм, которая должна быть в диапазоне 0,15 - 0,30. Для расчета активности используют коэффициент поглощения окисленного ABTS 36 мM-1 см-1 и стехиометрию 1 мкмоль H2O2, превращенного на 2 мкмоль окисленного ABTS.
Лакказы
В данном изобретении, лакказы и родственные лакказам ферменты включают в себя любой лакказный фермент, классифицированный как EC 1.10.3.2, любой катехолоксидазный фермент, классифицированный как EC 1.10.3.1, любой билирубиноксидазный фермент, классифицированный как EC 1.3.3.5, или любой монофенол-монооксигеназный фермент, классифицированный как EC 1.14.18.1.
Вышеупомянутые ферменты могут быть микробными, т.е. полученными из бактерий или грибов (в том числе мицелиальных грибов и дрожжей), или они могут быть получены из растений.
Подходящие примеры из грибов включают в себя лакказу, полученную из штамма Aspergillus, Neurospora, например N. crassa, Podospora, Botrytis, Collybia, Fomes, Lentinus, Pleurotus, Trametes, например T. villosa и T. versicolor, Rhizooctonia, например R. solani, Coprinus, например C. cinereus, C. comatus, C. friesii и C. plicatilis, Psathyrella, например P. condelleana, Panaeolus, например P. papilionaceus, Myceliophthora, например M. thermophila, Schytalidium, например S. thermophilum, Polyporus, например P. pinsitus, Pycnoporus, например P. cinnabarinus, Phlebia, например P. radita (WO 92/01046), или Coriolus, например C. hirsutus (JP 2-238885).
Подходящие примеры из бактерий включают в себя лакказу, полученную из штамма Bacillus.
Предпочтительной является лакказа, полученная из Coprinus, Myceliophthora, Polyporus, Pycnoporus, Scytalidium или Rhizoctonia; в частности лакказа, полученная из Coprinus cinereus, Myceliophthora thermophila, Polyporus pinsitus, Pycnoporus cinnabarinus, Scytalidium thermophilum или Rhizoctonia solani.
Коммерчески доступными лакказами являются NS51001 (лакказа Polyporus pinsitius, доступная из Novozymes A/S, Denmark) и NS51002 (лакказа Myceliopthora thermophila, доступная из Novozymes A/S, Denmark).
Лакказа или родственный лакказе фермент может быть также ферментом, который получают способом, предусматривающим культивирование клетки-хозяина, трансформированного рекомбинантным ДНК-вектором, который несет последовательность ДНК, кодирующую лакказу, а также последовательности ДНК для экспрессии последовательности ДНК, кодирующей лакказу, в культуральной среде при условиях, позволяющих экспрессию лакказного фермента и извлечение этой лакказы из культуры.
Лакказную активность (LACU) определяют из окисления сирингальдазина при аэробных условиях при рН 5,5. Полученную фиолетовую окраску измеряют при 530 нм. Аналитическими условиями являются 19 мМ сирингальдазин, 23 мМ ацетатный буфер, pH 5,5, 30°C, время реакции 1 минута. Одна лакказная единица (LACU) является количеством фермента, которое катализирует превращение 1,0 мкмоль сирингальдазина в минуту при вышеописанных условиях.
Лакказную активность (LAMU) определяют из окисления сирингальдазина при аэробных условиях при рН 7,5. Полученную фиолетовую окраску фотометрируют при 530 нм. Аналитическими условиями являются 19 мМ сирингальдазин, 23 мМ Трис/малеат, pH 7,5, 30°C, время реакции 1 минута. Одна лакказная единица (LAМU) является количеством фермента, которое катализирует превращение 1,0 мкмоль сирингальдазина в минуту при вышеописанных условиях.
Полипептиды, имеющие целлюлолитическую усиливающую активность, могут быть использованы вместе с вышеуказанными ферментами и/или целлюлолитическими белками для дополнительной деградации целлюлозного компонента субстрата биомассы (см., например, Brigham et al., 1995, in Handbook on Bioethanol (Charles E. Wyman, editor), p.119-141, Taylor & Francis, Washington DC; Lee, 1997, Journal of Biotechnology 56: 1-24).
Оптимальные количества полипептида, имеющего целлюлолитическую усиливающую активность, и целлюлолитических белков зависят от нескольких факторов, включающих в себя, но не ограничивающихся ими, конкретную смесь компонентов целлюлолитических белков, целлюлозного субстрата, концентрацию целлюлозного субстрата, предобработку (предобработки) целлюлозного субстрата, температуру, время, рН и включение ферментирующего организма (например, дрожжей для Одновременных Осахаривания и Ферментации).
В предпочтительном аспекте, эффективное количество полипептида (полипептидов), имеющих целлюлолитическую усиливающую активность в отношении целлюлозного материала, равно приблизительно 0,01 - приблизительно 2,0 мг, предпочтительно приблизительно 0,025 - приблизительно 1,5 мг, более предпочтительно приблизительно 0,05 - приблизительно 1,25 мг, более предпочтительно приблизительно 0,075 - приблизительно 1,25 мг, более предпочтительно приблизительно 0,1 - приблизительно 1,25 мг, даже более предпочтительно приблизительно 0,15 - приблизительно 1,25 мг и наиболее предпочтительно приблизительно 0,25 - приблизительно 1,0 мг на г целлюлозного материала.
В другом предпочтительном аспекте, эффективное количество целлюлолитического белка (целлюлолитических белков) в отношении целлюлозного материала, равно приблизительно 0,5 - приблизительно 50 мг, предпочтительно приблизительно 0,5 - приблизительно 40 мг, более предпочтительно приблизительно 0,5 - приблизительно 25 мг, более предпочтительно приблизительно 0,75 - приблизительно 20 мг, более предпочтительно приблизительно 0,75 - приблизительно 15 мг, даже более предпочтительно приблизительно 0,5 - приблизительно 10 мг и наиболее предпочтительно приблизительно 2,5 - приблизительно 10 мг на г целлюлозного материала.
В предпочтительном аспекте, эффективное количество полипептида (полипептидов), имеющих целлюлолитическую усиливающую активность в отношении целлюлозного материала, равно приблизительно 0,005 - приблизительно 1,0 г, предпочтительно приблизительно 0,01 - приблизительно 1,0 г, более предпочтительно приблизительно 0,15 - приблизительно 0,75 г, более предпочтительно приблизительно 0,15 - приблизительно 0,5 г, более предпочтительно приблизительно 0,1 - приблизительно 0,5 г, даже более предпочтительно приблизительно 0,1 - приблизительно 0,5 г и наиболее предпочтительно приблизительно 0,05 - приблизительно 0,2 г на г целлюлолитического белка (целлюлолитических белков).
Детергентные композиции
Полипептиды, имеющие целлюлолитическую усиливающую активность, могут добавляться к детергентной композиции и, следовательно, становиться компонентом детергентной композиции.
Детергентная композиция данного изобретения может быть приготовлена, например, в виде детергентной композиции для ручной или машинной стирки, в том числе композиции добавок для стирки, подходящей для предварительной обработки окрашенных тканей, и композиции для полоскания, дополненной смягчающим агентом для тканей, или может быть приготовлена в виде детергентной композиции для использования в операциях чистки твердых поверхностей домашнего хозяйства, или может быть приготовлена для операций ручной или машинной мойки посуды.
В конкретном аспекте, данное изобретение обеспечивает детергентную добавку, содержащую полипептид, имеющий целлюлолитическую усиливающую активность, описанный здесь. Эта детергентная добавка, а также детергентная композиция может содержать один или несколько ферментов, таких как протеаза, липаза, кутиназа, амилаза, карбогидраза, целлюлаза, пектиназа, маннаназа, арабиназа, галактаназа, ксиланаза, оксидаза, например лакказа, и/или пероксидаза.
Обычно, свойства выбранного фермента (выбранных ферментов) должны быть совместимы с выбранным детергентом (т.е. рН-оптимум, совместимость с другими ферментативными и неферментативными ингредиентами и т.д.), и этот фермент (эти ферменты) должны присутствовать в эффективных количествах.
Целлюлазы: Подходящие целлюлазы включают в себя целлюлазы бактериального или грибного происхождения. Включены также химически модифицированные или белковые сконструированные мутанты. Подходящие целлюлазы включают в себя целлюлазы из родов Bacillus, Pseudomonas, Humicola, Fusarium, Thielavia, Acremonium, например грибковые целлюлазы, получаемые из Humicola insolens, Myceliophthora thermophila и Fusarium oxysporum, описанные в Патенте США № 4435307, Патенте США № 5648263, Патенте США № 5691178, Патенте США № 5776757 и WO 89/09259.
Особенно подходящими целлюлазами являются щелочные или нейтральные целлюлазы, имеющие преимущества сохранения окраски. Примерами таких целлюлаз являются целлюлазы, описанные в EP 0 495 257, EP 0 531 372, WO 96/11262, WO 96/29397, WO 98/08940. Другими примерами являются варианты целлюлаз, такие как варианты, описанные в WO 94/07998, EP 0 531 315, Патенте США № 5457046, Патенте США № 5686593, Патенте США № 5763254, WO 95/24471, WO 98/12307 и PCT/DK98/00299.
Коммерчески доступные целлюлазы включают в себя Celluzyme™ и Carezyme™ (Novozymes A/S), Clazinase™ и Puradax HA™ (Genencor International Inc.) и KAC-500(B)™ (Kao Corporation).
Протеазы: Подходящие протеазы включают в себя протеазы животного, растительного или микробного происхождения. Предпочтительными являются микробные протеазы. Включены также химически модифицированные или белковые сконструированные мутанты. Эта протеаза может быть сериновой протеазой или металлопротеазой, предпочтительно щелочной микробной протеазой или трипсин-подобной протеазой. Примерами щелочных протеаз являются субтилизины, особенно субтилизины, полученные из Bacillus, например субтилизин Novo, субтилизин Carlsberg, субтилизин 309, субтилизин 147 и субтилизин 168 (описанный в WO 89/06279). Примерами трипсин-подобных протеаз являются трипсин (например, полученный из свиньи или коровы) и протеаза Fusarium, описанная в WO 89/06270 и WO 94/25583.
Примерами применимых протеаз являются варианты, описанные в WO 92/19729, WO 98/20115, WO 98/20116 и WO 98/34946, особенно варианты с заменами в одном или нескольких из следующих положений: 27, 36, 57, 76, 87, 97, 101, 104, 120, 123, 167, 170, 194, 206, 218, 222, 224, 235 и 274.
Предпочтительные коммерчески доступные протеазные ферменты включают в себя Alcalase™, Savinase™, Primase™, Duralase™, Esperase™ и Kannase™ (Novozymes A/S), Maxatase™, Maxacal™, Maxapem™, Properase™, Purafect™, Purafect OxP™, FN2™ и FN3™ (Genencor International Inc.).
Липазы: Подходящие липазы включают в себя липазы бактериального или грибного происхождения. Включены также химически модифицированные или белковые сконструированные мутанты. Примеры применимых липаз включают в себя липазы из Humicola (синоним Thermomyces), например из H. lanuginosa (T. lanuginosus), описанные в EP 258068 и EP 305216, или из H. insolens, описанные в WO 96/13580, липазу Pseudomonas, например из P. alcaligenes или P. pseudoalcaligenes (EP 218272), P. cepacia (EP 331376), P. stutzeri (GB 1372034), P. fluorescens, штамма Pseudomonas sp. SD 705 (WO 95/06720 и WO 96/27002), P. wisconsinensis (WO 96/12012), липазу Bacillus lipase, например из B. subtilis (Dartois et al., 1993, Biochemica et Biophysica Acta, 1131: 253-360), B. stearothermophilus (JP 64/744992) или S. pumilus (WO 91/16422).
Другими примерами являются варианты липаз, такие как варианты, описанные в WO 92/05249, WO 94/01541, EP 407 225, EP 260 105, WO 95/35381, WO 96/00292, WO 95/30744, WO 94/25578, WO 95/14783, WO 95/22615, WO 97/04079 и WO 97/07202.
Предпочтительные коммерчески доступные липазные ферменты включают в себя Lipolase™, Lipex™ и Lipolase Ultra™ (Novozymes A/S).
Амилазы: Подходящие амилазы (альфа и/или бета) включают в себя амилазы бактериального и грибного происхождения. Включены также химически модифицированные или белковые сконструированные мутанты. Амилазы включают в себя, например, α-амилазы, полученные из Bacillus, например специального штамма Bacillus licheniformis, описанного более подробно в GB 1296839.
Примерами применимых амилаз являются варианты, описанные в WO 94/02597, WO 94/18314, WO 96/23873 и WO 97/43424, особенно варианты с заменами в одном или нескольких из следующих положений: 15, 23, 105, 106, 124, 128, 133, 154, 156, 181, 188, 190, 197, 202, 208, 209, 243, 264, 304, 305, 391, 408 и 444.
Коммерчески доступными амилазами являются Duramyl™, Termamyl™, Fungamyl™ и BAN™ (Novozymes A/S) и Rapidase™ и Purastar™ (из Genencor International Inc.).
Пероксидазы/оксидазы: Подходящие пероксидазы/оксидазы включают в себя пероксидазы/оксидазы растительного, бактериального или грибного происхождения. Включены также химически модифицированные или белковые сконструированные мутанты. Примеры применимых пероксидаз включают в себя пероксидазы из Coprinus, например из C. cinereus, и их варианты, такие как варианты, описанные в WO 93/24618, WO 95/10602 и WO 98/15257.
Коммерчески доступные пероксидазы включают в себя Guardzyme™ (Novozymes A/S).
Детергентный фермент (детергентные ферменты) могут быть включены в детергентную композицию добавлением отдельных добавок, содержащих один или несколько ферментов, или добавлением объединенной добавки, содержащей все эти ферменты. Детергентная добавка этого изобретения, т.е. отдельная добавка или комбинированная добавка, может быть приготовлена, например, в виде гранулята, жидкости, суспензии и т.д. Предпочтительными препаратами детергентных добавок являются грануляты, в частности непылящие грануляты, жидкости, в частности стабилизированные жидкости, или суспензии.
Непылящие грануляты могут быть получены, например, как описано в Патенте США № 4106991 и 4661452, и могут быть необязательно покрыты покрытием способами, известными в данной области. Примерами воскообразных материалов покрытий являются продукты поли(этиленоксида) (полиэтиленгликоль, ПЭГ) со средними молярными массами 1000-20000; этоксилированные нонилфенолы, имеющие 16-50 этиленоксидных елиниц; этоксилированные жирные спирты, в которых спирт содержит 12-20 атомов углерода и в которых имеются 15-80 этиленоксидых единиц; жирные спирты; жирные кислоты и моно-, ди- и триглицериды жирных кислот. Примеры пленкообразующих материалов покрытий, подходящих для нанесения способами с использованием псевдоожиженного слоя, приведены в GB 1483591. Жидкие препараты ферментов могут быть, например, стабилизированы добавлением полиола, такого как пропиленгликоль, сахара или сахароспирта, молочной кислоты или борной кислоты в соответствии с установленными способами. Защищенные ферменты могут быть приготовлены в соответствии со способом, описанным в EP 238216.
Детергентная композиция данного изобретения может быть в любой удобной форме, например в виде бруска, таблетки, гранулы, пасты или жидкости. Жидкий детергент может быть водным, обычно содержащим до 70% воды и 0-30% органического растворителя, или неводным.
Детергентная композиция содержит один или несколько поверхностно-активных веществ, которые могут быть неионогенными, в том числе семиполярными (донорно-акцепторными), и/или анионогенными, и/или катионогенными, и/или цвиттерионными. Эти поверхностно-активные вещества обычно присутствуют при уровне 0,1 мас.% - 60 мас.%.
При включении в композицию детергент будет обычно содержать приблизительно 1% - приблизительно 40% анионогенного поверхностно-активного вещества, такого как линейный алкилбензолсульфонат, альфа-олефинсульфонат, алкилсульфат (сульфат жирного спирта), алкогольэтоксисульфат, вторичный алкансульфонат, метиловый эфир альфа-сульфожирной кислоты, алкил- или алкенилъянтарная кислота или мыло.
При включении в композицию детергент будет обычно содержать приблизительно 0,2% - приблизительно 40% неионогенного поверхностно-активного вещества, такого как алкогольэтоксилат, нонилфенолэтоксилат, алкилполигликозид, алкилдиметиламиноксид, этоксилированный моноэтаноламид этоксилированной жирной кислоты, моноэтаноламид жирной кислоты, амид полигидроксиалкилжирной кислоты или N-ацил- и N-алкилпроизводные глюкозамина («глюкамиды»).
Детергент может содержать 0-65% детергентного компонента или комплексообразующего агента, такого как цеолит, дифосфат, трифосфат, фосфонат, карбонат, цитрат, нитротриуксусная кислота, этилендиаминтетрауксусная кислота, диэтилентриаминпентауксусная кислота, алкил- или алкенилъянтарная кислота, растворимые силикаты или слоистые силикаты (например, SKS-6 из Hoechst).
Детергент может содержать один или несколько полимеров. Примерами являются карбоксиметилцеллюлоза, поли(винилпирролидон), поли(этиленгликоль), поливиниловый спирт), поли(винилпиридин-N-оксид), поли(винилимидазол), поликарбоксилаты, такие как полиакрилаты, сополимеры малеиновой кислоты и акриловой кислоты и сополимеры лаурилметакрилата и акриловой кислоты.
Детергент может содержать отбеливающую систему, которая может содержать источник H2O2, такой как перборат или перкарбонат, который может быть комбинирован с образующим перкислоту активатором отбеливания, таким как тетраацетилэтилендиамин или нонаноилоксибензолсульфонат. Альтернативно, эта отбеливающая система может содержать пероксикислоты, например, типа амида, имида или сульфона.
Фермент (ферменты) детергентной композиции данного изобретения могут быть стабилизированы с использованием общепринятых стабилизирующих агентов, например полиола, такого как пропиленгликоль или глицерин, сахара или сахароспирта, молочной кислоты, борной кислоты или производного борной кислоты, например ароматического эфира борной кислоты, или производного фенилбороновой кислоты, такого как 4-формилфенилбороновая кислота, и эта композиция может быть приготовлена, как описано, например, в WO 92/19709 и WO 92/19708.
Этот детергент может также содержать другие общепринятые детергентные ингредиенты, такие как кондиционеры ткани, включающие в себя глины, усилители образования пены, подавители мыльной пены, антикоррозионные агенты, суспендирующие грязь агенты, подавляющие повторное осаждение грязи агенты, красители, бактерициды, оптические осветлители, гидротропы, ингибиторы тусклости или отдушки.
В детергентных композициях любой фермент может быть добавлен в количестве, соответствующем 0,01-100 мг ферментного белка на литр моющей жидкости, предпочтительно 0,05-5 мг ферментного белка на литр моющей жидкости, в частности 0,1-1 мг ферментного белка на литр моющей жидкости.
В детергентных композициях полипептид, имеющий целлюлолитическую усиливающую активность, может быть добавлен в количестве, соответствующем 0,001-100 мг белка, предпочтительно 0,005-50 мг белка, более предпочтительно 0,01-25 мг белка, даже более предпочтительно 0,05-10 мг белка, наиболее предпочтительно 0,05-5 мг белка и даже наиболее предпочтительно 0,01-1 мг белка на литр моющей жидкости.
Полипептид этого изобретения, имеющий целлюлолитическую усиливающую активность, может быть также включен в детергентные композиции, описанные в WO 97/07202, включенном здесь в качестве ссылки.
Данное изобретение описывается далее следующими примерами, которые не должны рассматриваться как ограничивающие это изобретение.
ПРИМЕРЫ
Материалы
Химикалии, используемые в качестве буферов и субстратов, были коммерческими продуктами, относящимися, по меньшей мере, к категории реагентов.
Штаммы
Trichoderma reesei RutC30 (ATCC 56765; Montenecourt and Eveleigh, 1979, Adv. Chem. Ser. 181: 289-301 ) использовали в качестве источника гена Trichoderma reesei, кодирующего полипептид Семейства 61, имеющий целлюлолитическую усиливающую активность. Штамм Aspergillus oryzae JaL250 strain (WO 99/61651) использовали для экспрессии полипептида Семейсва 61 Trichoderma reesei, имеющего целлюлолитическую усиливающую активность.
Среды
PDA-чашки содержали 39 г на литр картофельного агара с декстрозой.
Среда MDU2BP содержала на литр 45 г мальтозы, 1 г MgSO4.7H2O, 1 г NaCl, 2 г K2SO4, 12 г KH2PO4, 7 г дрожжевого экстракта, 2 г мочевины и 0,5 мл раствора микроэлементов AMG, pH до 5,0.
Раствор микроэлементов АMG содержал на литр 14,3 г ZnSO4.7H2O, 2,5 г CuSO4.5H2O, 0,5 г NiCl2.6H2O, 13,8 g of FeSO4.7H2O, 8,5 г MnSO4·H2O и 3 г лимонной кислоты.
LB-чашки содержали на литр 10 г триптона, 5 г дрожжевого экстракта, 5 г хлорида натрия и 15 г Бакто Агара.
SOC-среда содержала на литр 2% триптон, 0,5% дрожжевой экстракт, 10 мМ NaCl, 2,5 мМ KCl, 10 мМ MgCl2 и 10 мМ MgSO4 и стерилизованную при помощи мембранного фильтра глюкозу до 20 мМ, добавляемую после автоклавирования.
Пример 1: Ферментация и мицелиальная ткань
Штамм Trichoderma reesei strain RutC30 культивировали в ферментационном резервуаре опытного масштаба в среде для выращивания, содержащей комплексный источник углерода. Источники углерода включали в себя глюкозу, целлюлозу или предобработанную кукурузную солому. Грибной мицелий собирали из пробы 1 литр и немедленно замораживали в жидком N2 и хранили при -800C.
Предобработанную кукурузную солому (PCS) получали из U.S. Department of Energy National Renewable Energy Laboratory (NREL). Водорастворимыми твердыми веществами в PCS являются 56,5% целлюлоза, 4,6% гемицеллюлоза и 28,4% лигнин. Условиями предобработки были кукурузная солома, 1,4% (масса/объем) серная кислота, 165°C, 107 фунтов на квадратный дюйм, в течение 8 минут. Перед анализом, PCS промывали большим объемом дистиллированной деионизованной воды на стеклянном фильтре. Затем PCS размалывали кофейной мельницей для уменьшения размера частиц и промывали дополнительно водой на Миллипоровом фильтре 22 мкм (6P Express Membrane, Stericup, Millipore, Billerica, MA). Промытую PCS ресуспендировали в деионизованной воде с получением суспензии 20 мг/мл и хранили при 4°C.
Пример 2: Направленное конструирование библиотеки кДНК Trichoderma reesei
Тотальную РНК получали из мицелиальных проб Trichoderma reesei, описанных в примере 1, экстракцией тиоцианатом гуанидиния с последующим центрифугированием через подушку 5,7 М CsCl (Chirgwin et al., 1979, Biochemistry 18: 5294-5299) с использованием следующих модификаций. Замороженный мицелий измельчали в жидком N2 до мелкоизмельченного порошка с использованием ступки и пестика с последующим измельчением в предварительно охлажденной кофейной мельнице и немедленно суспендировали в 5 объемах буфера для экстракции РНК (4 M тиоцианат гуанидиния, 0,5% лаурилсаркозин натрия, 25 мМ цитрат натрия, pH 7,0, 0,1 M β-меркаптоэтанол). Эту смесь перемешивали в течение 30 минут при комнатной температуре и центрифугировали (20 минут при 12000×g) для осаждения остатков клеток. Супернатант собирали, осторожно наслаивали на подушку 5,7 М СsCl (5,7 M CsCl, 10 мМ ЭДТА, pH 7,5, 0,1% диэтилпирокарбонат (DEPC); автоклавированный перед использованием) с использованием 26,5 мл супернатанта на 12,0 мл подушки CsCl и центрифугировали с получением общей РНК (ротор 28 Beckman SW, 25000 об/мин, комнатная температура, 24 часа). После центрифугирования супернатант осторожно удаляли и нижнюю часть пробирки, содержащей осадок РНК, отрезали и промывали 70% этанолом. Этот осадок тотальной РНК переносили в пробирку Эппендорфа, суспендировали в 500 мкл ТЭ (10 мМ Трис-0,1 мМ ЭДТА), pH 7,6 (если это было трудным, нагревали время от времени в течение 5 минут при 65°C), экстрагировали фенолом и осаждали этанолом в течение 12 часов при -20°C (2,5 объема этанола, 0,1 объем 3 M ацетата натрия, pH 5,2). РНК собирали центрифугированием (30 минут при 12000×g), промывали в 70% этаноле и ресуспендировали в минимальном объеме обработанной DEPC водой. Концентрацию тотальной РНК определяли измерением оптической плотности при 260 нм.
Поли(A)+ РНК выделяли аффинной хроматографией на олиго(dT)-целлюлозе (Aviv & Leder, 1972, Proceedings of the National Academy of Sciences USA 69: 1408-1412). В целом 0,2 г олиго(dT)-целлюлозы (Boehringer Mannheim, Indianapolis, IN) предварительно подвергали набуханию в 10 мл 1X колоночного буфера для нанесения (20 мМ Tris-Cl, pH 7,6, 0,5 M NaCl, 1 мМ ЭДТА, 0,1% ДСН), наносили на обработанную DEPC, закупоренную пластиковую колонку (Poly Prep Сhromatography Column, BioRad, Hercules, CA) и уравновешивали 20 мл 1X буфера для нанесения пробы. Тотальную РНК (1-2 мг) нагревали при 65°C в течение 8 минут, резко охлаждали на льду в течение 5 минут и после добавления 1 объема 2X колоночного буфера для нанесения наносили на колонку. Элюат собирали и повторно наносили 2-3 раза нагреванием пробы, как описано выше, и резким охлаждением на льду перед каждым нанесением. Олиго(dT)-колонку промывали 10 объемами 1Х буфера для нанесения, затем 3 объемами содержащего среднюю концентрацию соли буфера (20 мМ Трис-Cl, pH 7,6, 0,1 M NaCl, 1 мМ ЭДТА, 0,1% ДСН), с последующей элюцией поли(A)+ РНК 3 объемами буфера для элюции (10 мМ Трис-Cl, pH 7,6, 1 мМ ЭДТА, 0,05% ДСН), предварительно нагретого до 65°C, сбором фракций 500 мкл. Оптическую плотность при 260 нм считывали для каждой собранной фракции и содержащие мРНК фракции объединяли и осаждали этанолом при -200C в течение 12 часов. Эту поли(A)+ РНК собирали центрифугированием, ресуспендировали в обработанной DEPC воде и хранили в виде аликвот 5-10 мкг при -80°C.
Двухцепочечную EcoRI-Notl-направленную кДНК синтезировали из 5 мкг поли(А)+ РНК Trichoderma reesei RutC30 способом с использованием РНКазы H (Gubler and Hoffman 1983, Gene 25: 263-270; Sambrook et al., 1989, Molecular Cloning, a Laboratory Manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY) с использованием образующей шпильку модификации. Поли(A)+ РНК (5 мкг в 5 мкл обработанной DEPC воде) нагревали при 70°C в течение 8 минут в предварительно силицированной (диффузно покрытой кремнием) не содержащей РНКаз пробирке Эппендорфа, резко охлаждали на льду и объединяли в конечном объеме 50 мкл с буфером для обратной транскриптазы (50 мМ Трис-Cl, pH 8,3, 75 мМ KCl, 3 мМ MgCl2, 10 мМ ДТТ), содержащим 1 мМ dATP, dGTP и dTTP, 0,5 мМ 5-метил-dCTP, 40 единиц ингибитора рибонуклеаз плаценты человека (Promega, Madison, WI), 4,81 мкг олиго(dT)18-NotI I-праймера и 1000 единиц SuperScript II РНКазы H - обратной транскриптазы (Life Technologies, Inc., Rockville, MD). кДНК первой цепи синтезировали инкубированием реакционной смеси при 45°C в течение 1 часа. После синтеза, смесь гибрида mRNA:cDNA гель фильтровали через центрифугируемую колонку MicroSpin S-400 HR (Amersham Biosciences, Piscataway, NJ) в соответствии с инструкциями изготовителя.
После гель-фильтрации, эти гибриды разбавляли в 250 мкл буфера для второй цепи (20 мМ Трис-Cl, pH 7,4, 90 мM KCl, 4,6 мМ МgCl2, 10 мМ (NH4)2SO4, 0,16 мМ NAD+), содержащего 200 мкМ каждого dNTP, 60 единиц ДНК-полимеразы I E. coli (Amersham Biosciences, Piscataway, NJ), 5,25 единиц РНКазы H и 15 единиц ДНК-лигазы E. coli (New England Biolabs, Inc., Beverly, MA). Синтез кДНК второй цепи выполняли инкубацией реакционной пробирки при 16°C в течение 2 часов и дополнительно в течение 15 минут при 25°C. Реакцию останавливали добавлением ЭДТА до 20 мМ конечной концентрации с последующими экстракциями фенолом и хлороформом.
Двухцепочечную кДНК осаждали этанолом при -20°C в течение 12 часов добавлением 2 объемов 96% этанола и 0,2 объемом 10 М ацетата аммония, извлекали центрифугированием, промывали в 70% этаноле, сушили (SpeedVac) и ресуспендировали в 30 мкл буфера для нуклеазы маша (фасоли золотистой) (30 мМ ацетат натрия, pH 4,6, 300 мМ NaCl, 1 мМ ZnSO4, 0,35 мМ дитиотреитол, 2% глицерин), содержащего 25 единиц нуклеазы маша. Одноцепочечную содержащую шпильку ДНК скрепляли инкубированием реакционной смеси при 30°C в течение 30 минут, с последующим добавлением 70 мкл 10 мМ Трис-Cl, pH 7,5, 1 мМ ЭДТА, экстракцией фенолом и осаждением этанолом 2 объемами 96% этанола и 0,1 объемом 3 М ацетата натрия, pH 5,2, на льду в течение 30 минут.
Двухцепочечные кДНК извлекали центрифугированием (30000×g в течение 30 минут) и концы затупляли ДНК-полимеразой T4 в 30 мкл буфера для ДНК-полимеразы Т4 (20 мМ Трис-ацетат, pH 7,9, 10 мМ ацетат магния, 50 мМ ацетат калия, 1 мМ диэтилтреитол), содержащем 0,5 мМ каждого dNTP, и 5 единиц ДНК-полимеразы T4, инкубированием реакционной смеси при 16°C в течение 1 часа. Реакцию останавливали добавлением ЭДТА до 20 мМ конечной концентрации, с последующими экстракциями фенолом и этанолом в течение 12 часов при -20°C добавлением 2 объемов 96% этанола и 0,1 объема 3 М ацетата натрия, pH 5,2.
После реакции достраивания концов кДНК извлекали центрифугированием, как описано выше, промывали в 70% этаноле и осадок ДНК сушили в SpeedVac. Осадок кДНК ресуспендировали в 25 мкл буфера для лигирования (30 мМ Трис-Cl, pH 7,8, 10 мМ MgCl2, 10 мМ дитиотреитол, 0,5 мМ АТФ), содержащего 2 мкг адапторов EcoRI (0,2 мкг/мл, Amersham Biosciences, Piscataway, NJ) и 20 единиц T4 лигазы (Roche Molecular Biochemicals, Indianapolis, IN) инкубированием реакционной смеси при 16°C в течение 12 часов. Реакцию останавливали нагреванием при 65°C в течение 20 минут и затем помещали на лед на 5 минут. кДНК с адапторами расщепляли NotI добавлением 20 мкл автоклавированной воды, 5 мкл 10Х буфера для рестриктазы NotI и 50 единиц NotI с последующим инкубированием в течение 3 часов при 37°C. Реакцию останавливали нагреванием пробы при 65°C в течение 15 минут. Эти кДНК фракционировали по размеру электрофорезом в 0,8% агарозном геле на плавящемся при низкой температуре агарозном геле SeaPlaque GTG (FMC, Rockland, ME) в буфере ТБЭ (44 мМ Трис-основание, 44 мМ борной кислоты, 0,5 мМ ЭДТА (в автоклавированной воде)) для отделения нелигированных адапторов и малых кДНК. Гель-электрофорез проводили в течение 12 часов и кДНК отбирали по размеру с пределом отсечения 0,7 т.п.н. вырезанием нижней части из этого агарозного геля. Затем 1,5% агарозный гель заливали впереди кДНК-содержащего геля и двухцепочечные кДНК концентрировали электрофорезом в этом геле в обратном направлении, пока на геле не появлялась сжатая полоса. Этот содержащий кДНК участок геля вырезали из геля и кДНК экстрагировали из этого геля с использованием набора для очистки полос геля GFX (Amersham, Arlington Heights, IL) следующим образом. Подрезанный ломтик геля взвешивали в не содержащей нуклеаз микроцентрифужной пробирке на 2 мл (ISC BioExpress, Kaysville, UT). Затем добавляли 10 мл Захватывающего буфера (Amersham, Arlington Heights, IL) на каждые 10 мг ломтика геля. Этот ломтик геля растворяли инкубированием при 60°C в течение 10 минут до полной солюбилизации агарозы и затем эту пробу осаждали кратковременным центрифугированием (2 минуты при 8,000×g). Расплавленную пробу переносили в центрифугируемую колонку GFX, помещенную в пробирку для сбора, инкубировали при 25°C в течение 1 минуты и затем центрифугировали при полной скорости (15000×g) в микроцентрифуге в течение 30 секунд. Проходящую фракцию выбрасывали и колонку промывали 500 мкл промывочного буфера (GFX Gel Band Purification Kit, Amersham, Arlington Heights, IL) с последующим центрифугированием при полной скорости в течение 30 секунд. Пробирку для сбора выбрасывали и эту колонку помещали в пробирку Эппендорфа на 1,5 мл с последующей элюцией этой кДНК добавлением 50 мкл ТЭ, pH 7,5, в центр колонки, инкубированием при 25°C в течение 1 минуты и, наконец, центрифугированием в течение 1 минуты при максимальной скорости (15000×g). Элюированную кДНК хранили при -20°C до конструирования библиотеки.
Препарат плазмидной ДНК для содержащего EcoRI-NotI-инсерт клона кДНК pYES2.0 очищали с использованием QIAGEN Tip-100 в соответствии с инструкциями изготовителя (QIAGEN, Valencia, CA). В целом 10 мкл очищенной плазмидной ДНК расщепляли полностью NotI и EcoRI в общем объеме 60 мкл добавлением 6 мкл 10X NE-буфера для EcoRl (New England Biolabs, Beverly, MA), 40 единиц NotI и 20 единиц EcoRl с последующим инкубированием в течение 6 часов при 37°C. Реакцию останавливали нагреванием пробы при 65°C в течение 20 минут. Эту расщепленную плазмидную ДНК экстрагировали один раз смесью фенол-хлороформ с последующим осаждением этанолом в течение 12 часов при -20°C добавлением 2 объемов 96% этанола и 0,1 объема 3 М ацетата натрия, рН 5,2. Осажденную ДНК ресуспендировали в 25 мкл ТЭ, рН 7,5, наносили на 0,8 агарозный гель SeaKem в буфере ТБЭ и подвергали электрофорезу в течение 3 часов при 60 В. Расщепленный вектор вырезали из геля и ДНК экстрагировали из геля с использованием набора для очистки полос гелей GFX в соответствии с инструкциями изготовителя. После измерения концентрации ДНК по оптической плотности при 260 нм элюированный вектор хранили при -20°C до конструирования библиотек.
Для установления оптимальных условий лигирования для библиотеки кДНК выполняли четыре тест-лигирования в 10 мкл буфера для лигирования (30 мМ Трис-Cl, pH 7,8, 10 мМ MgCl2, 10 мМ ДТТ, 0,5 мМ АТФ), содержащего 7 мкл двухцепочечной кДНК (соответствующих приблизительно 1/10 общего объема в пробе кДНК), 2 единицы лигазы Т4 и 25 нг, 50 нг и 75 нг EcoRI-NotI-расщепленного вектора pYES2.0 (Invitrogen, Carlsbad, CA) соответственно. Реакция фонового контрольного лигирования содержала 75 нг EcoRI-NotI-расщепленного вектора pYES.0 без кДНК. Реакции лигирования выполняли инкубированием при 16оС в течение 12 часов, нагревали при 65°C в течение 20 минут и затем добавляли в каждую пробирку до 10 мкл автоклавированной воды. Один мкл смесей для лигирования электропорировали (200 Вт, 2,5 кВ, 25 мФ) в 40 мкл электрокомпетентных клеток E. coli DH 10B (Life Technologies, Gaithersburg, MD). После добавления 1 мл среды SOC (Birren et al., 1998. Genome Analysis, Vol. 2. Detecting Genes. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY) в каждую смесь трансформации эти клетки выращивали при 37°C в течение 1 часа. Затем 50 мкл и 5 мкл из каждой электропорации высевали на LB-чашки, дополненные ампициллином при 100 мкг на мл, и выращивали при 37°C в течение 12 часов. С использованием оптимальных условий библиотеку кДНК Trichoderma reesei RutC30, содержащую 1-2,5×107 независимых колониеобразующих единиц, устанавливали в E. coli с фоном вектора приблизительно 1%. Эту библиотеку кДНК хранили в виде (1) отдельных пулов (25000 КОЕ/пул) в 20% глицерине при -80°C; (2) осадков клеток тех же самых пулов при -20°C; (3) очищенной QIAGEN Tip 100 плазмидной ДНК из отдельных пулов при -20°C; и (4) направленной двухцепочечной кДНК при -20°C.
Пример 3: Получение EST-матриц Trichoderma reesei
Плазмидные ДНК из отдельных колоний E. coli из кДНК-библиотек, описанных в примере 2, очищали с использованием 96-луночной распределительной системы получения плазмид (QIAGEN, Valencia, CA) в соответствии с инструкциями, поставляемыми изготовителем.
Пример 4: Анализ данных последовательностей ДНК кДНК-клонов
Называние оснований, отнесение величин качества (уровней значимости) и приведение в порядок векторов выполняли при помощи программного обеспечения PHRED/PHRAP (University of Washington, Seattle, WA). Анализ гомологии последовательностей собранных EST-последовательностей против базы данных PIR выполняли с использованием программы Blastx (Altschul et. al., 1990, J. Mol. Biol. 215:403-410) на 32-узловом кластере Linux (Paracel, Inc., Pasadena, CA) с использованием матрицы BLOSUM 62 (Henikoff, 1992, Proc. Natl. Acad. ScL USA 89: 10915-10919).
Пример 5: Идентификация кДНК-клона, кодирующего полипептид Семейства 61, имеющий целлюлолитическую усиливающую активность (GH61B)
кДНК-клон, кодирующий полипептид Семейства 61, имеющий целлюлолитическую усиливающую активность (GH61B), был первоначально идентифицирован по сходству его транслированного продукта с другими известными полипептидами Семейства 61, присутствующими в публичных базах данных. Конкретно, этот анализ показал, что предсказанный полипептид был на 50% идентичен на уровне белка центральному домену (кор-домену) эндоглюканазы IV Trichoderma reesei, известного члена Семейства 61 (Saloheimo et al., 1997, Eur. J. Biochem. 249: 584-591). После этой начальной идентификации, EST-клон был получен из его исходной замороженной чашки и посеян штриховой разводкой на LB-чашки, дополненные 100 мкг ампициллина на мл. Эти чашки инкубировали в течение ночи при 37°C и на следующий день отдельную колонию из каждой чашки использовали для инокуляции 3 мл LB, дополненных 100 мкг ампициллина на мл. Эти жидкие культуры инкубировали в течение ночи при 37°C и плазмидную ДНК получали при помощи BioRobot 9600 (QIAGEN Inc., Valencia, CA). Плазмидную ДНК из каждого EST-клона секвенировали опять при помощи химического способа с использованием Big-Dye™-терминатора (Applied Biosystems, Inc., Foster City, CA), с применением прямого M13-праймера и Поли-T-праймера, показанных ниже, для секвенирования 3'-конца этого клона.
5'-TТТТТТТТТТТТТТТТТТТТТТТVN-3' (SEQ ID NO: 3),
где V=G, A или C и N=G, A, C или T.
Один клон, Trichoderma reesei EST Tr3337, названный pTr3337, был отобран для анализа нуклеотидной последовательности.
Пример 6: Характеристика кДНК-клона Trichoderma reesei, кодирующего полипептид, имеющий целлюлолитическую усиливающую активность
Три новых праймера, показанных ниже, были сконструированы для удлинения информации последовательности из EST pTr3337 (фигура 2).
5'-TGTCCATGGCCGAGA-3' (SEQ ID NO:4)
5'-ATACTGGTCACTTCCCCAA-3' (SEQ ID NO:5)
5'-GCGCTGGGTCAAGATT-3' (SEQ ID NO:6)
Секвенирование ДНК выполняли на Автоматизированном ДНК-секвенаторе Perkin-Elmer Biosystems Model 377 XL с использованием химического способа с красителем-терминатором (Giesecke et al., 1992, Journal of Virology Methods 38: 47-60). кДНК-фрагмент 1,17 т.п.н. секвенировали до величины качества (уровня значимости) Phred 36.
Нуклеотидная последовательность (SEQ ID NO:1) и расшифрованная аминокислотная последовательность (SEQ ID NO:2) кодирующего района кДНК-клона Trichoderma reesei GH61B показаны на фигуре 1. Эта кодирующая последовательность содержит 750 т.п.н., в том числе стоп-кодон. Кодируемый предсказанный белок содержит 249 аминокислот. Этот кодирующий район имеет 56,8% G+C. При помощи программы SignalP (Nielsen et al., 1997, Protein Engineering 10: 1-6) был предсказан сигнальный пептид из 19 остатков. Предсказанный зрелый белок содержит 230 аминокислот и имеет молекулярную массу 25,1 кДа и изоэлектрическую точку (pI 7,36).
Анализ зрелого пептида при помощи программы INTERPROSCAN (Zdobnov and Apweiler, 2001, Bioinformatics 17: 847-8) показал, что ген, кодируемый клоном Tr3337, содержал признак («сигнатуру последовательности») гликозилгидролазных белков Семейства 61. Этот признак («сигнатура последовательности»), известный как Pfam pattern PF03443 (Bateman et. al., 2004, Nucleic Acids Research 32: 138-141), расположен от остатка 20 до остатка 241, подтверждая, что клон Tr3337 кодирует ген Семейства 61 Trichoderma reseei.
Сравнительное парное глобальное сопоставление аминокислотных последовательностей определяли с использованием алгоритма Needleman-Wunsch (Needleman and Wunsch, 1970, supra), осуществленного в программе Needle EMBOSS со штрафом за открывание гэпа 10, штрафом за удлинение гэпа 0,5 и матрицей EBLOSUM62. Это сопоставление показало, что расшифрованная аминокислотная последовательность гена Trichoderma reesei, кодирующая зрелый полипептид GH61B, имеющий целлюлолитическую усиливающую активность, имела 100% и 62% идентичность (за исключением гэпов) с расшифрованными последовательностями двух гликозилгидролазных белков Семейства 61 из Trichoderma reesei (GeneSeP ADH34517) и Chaetomium globosum (UniProt Q2GPR1) соответственно.
Штамм E. coli, содержащий плазмиду pTr3337, был депонирован Agricultural Research Service Patent Culture Collection, Northern Regional Research Center, 1815 University Street, Peoria, Illinois, 61604, в виде NRRL B-30878, с датой депонирования 20 сентября 2005 года.
Пример 7: Конструирование экспрессирующего вектора Aspergillus oryzae для гена семейства GH61B Trichoderma reesei
Два синтетических олигонуклеотидных праймера, показанных ниже, конструировали для ПЦР-амплификации гена семейства GH61B Trichoderma reesei из этого кДНК-клона. Набор для клонирования InFusion (BD Biosciences, Palo Alto, CA) использовали для клонирования этого фрагмента непосредственно в экспрессирующий вектор, pAILo2 (WO 2005/074647), без необходимости получения и лигирования продуктов рестрикции.
Прямой праймер: 5'-ACTGGATTTACCATGAAGTCCTGCGCCATTCTTGC-3' (SEQ ID NO:7)
Обратный праймер: 5'-AGTCACCTCTAGTTAGCCTTGCCACAGGGCTGG-3' (SEQ ID NO:8)
Жирные буквы представляют кодирующую последовательность. Остальная последовательность гомологична сайтам инсерции pAILo2.
Пятьдесят пикомолей каждого из вышеуказанных праймеров использовали в ПЦР-реакции, содержащей 100 нг кДНК-клона Trichoderma reesei (полученного, как описано в примере 5), 1X буфер для амплификации Pfx Amplification Buffer (Invitrogen, Carlsbad, CA), 6 мкл 10 мМ смеси dATP, dTTP, dGTP и dCTP, 2,5 единицы ДНК-полимеразы Platinum Pfx (Invitrogen, Carlsbad, CA), 1 мкл 50 мМ MgSO4 и 5 мкл 10X Энхансерного Раствора pCRx (Invitrogen, Carlsbad, CA) в конечном объеме 50 мкл. Условиями амплификации были: один цикл при 94°C в течение 2 минут; и 30 циклов, каждый при 94°C в течение 15 секунд, 55°C в течение 30 секунд и 68°C в течение 3 минут. Затем следовал блок нагревания до цикла пропитывания 4°C.
Продукты реакции выделяли на 1% агарозном геле с использованием буфера (ТАЭ) (40 мМ Трис-основание - 20 мМ ацетат натрия - 1 мМ динатрий-ЭДТА), где полосу продукта 3 т.п.н. вырезали из этого геля и очищали при помощи набора для экстракции гелей (QIAGEN Inc., Valencia, CA) в соответствии с инструкциями изготовителя.
Затем этот фрагмент клонировали в pAILo2 с использованием набора для клонирования InFusion. Вектор расщепляли NcoI и PacI (при условиях, указанных изготовителем). Этот фрагмент очищали гель-электрофорезом и очисткой из геля QIAquick. Этот фрагмент гена и расщепленный вектор объединяли вместе в реакции с получением экспрессирующей плазмиды Tr61B (фигура 3), в которой транскрипция гена Семейства GH61B находилась под контролем промотора NA2-tpi (гибрида промоторов из генов нейтральной альфа-амилазы Aspergillus niger и триозофосфатизомеразы Aspergillus oryzae). Реакция рекомбинации (20 мкл) состояла из 1X буфера InFusion (BD Biosciences, Palo Alto, CA), 1X БСА (BD Biosciences, Palo Alto, CA), 1 мкл фермента InFusion (разбавленного 1:10) (BD Biosciences, Palo Alto, CA), 100 нг pAILo2, расщепленной NcoI и PacI, и 100 нг очищенного ПЦР-продукта GH61B Trichoderma reesei. Эту реакционную смесь инкубировали при комнатной температуре в течение 30 минут. Один мкл этой реакционной смеси использовали для трансформации клеток E. coli XL10 Solopac Gold (Stratagene, La Jolla, CA). Трансформант E. coli, содержащий pTr61B (ген GH61B), идентифицировали расщеплением рестриктазами и плазмидную ДНК получали с использованием QIAGEN BioRobot 9600.
Пример 8: Экспрессия кДНК Trichoderma reesei, кодирующих полипептиды Семейства GH61B, имеющие целлюлолитическую усиливающую активность в Aspergillus oryzae JaL250
Протопласты Aspergillus oryzae JaL250 получали в соответствии со способом Christensen et al., 1988, Bio/Technology 6: 1419-1422. Пять мкг pTr61B (а также pAILo2 в качестве векторного контроля) использовали для трансформации Aspergillus oryzae JaL250.
Трансформация Aspergillus oryzae JaL250 плазмидой pTr61B (гена GH61B) давала приблизительно 70 трансформантов. Десять трансформантов выделяли для отдельных PDA-чашек.
Конфлюэнтные PDA-чашки всех трансформантов промывали 5 мл 0,01% Твина 80 и инокулировали раздельно в 25 мл среды MDU2BP во встряхиваемые стеклянные колбы на 125 мл и инкубировали при 34°C, 200 об/мин. Спустя пять дней после начала инкубации, 5 мкл супернатанта из каждой культуры анализировали с использованием 8-16% Tрис-глицина и гелей для электрофореза в ДСН-ПААГ (Invitrogen, Carlsbad, CA) в соответствии с инструкциями изготовителя. Профили электрофореза в ДСН-ПААГ этих культур показали, что несколько трансформантов имели новую основную полосу приблизительно 25 кДа.
Конфлюэнтную чашку одного трансформанта (росшего на PDA) промывали 10 мл 0,01% Твина 20 и инокулировали в колбу Fernbach на 2 литра, содержащую 500 мл среды MDU2BP, для генерирования бульона для характеристики этого фермента. Эту колбу собирали в день 5 и фильтровали с использованием мембраны 0,22 мкм GP Express plus (Millipore, Bedford, MA).
Пример 9: Действие GH61B Trichoderma reesei на гидролиз предобработанной кукурузной соломы ферментационным бульоном Trichoderma reesei, экспрессирующим бета-глюкозидазу Aspergillus oryzae
GH61B Trichoderma reesei (рекомбинантно полученный в Aspergillus oryzae, как описано в примере 8) обессоливали и подвергали замене буфера 50 мМ ацетатом натрия, рН 5,0, с использованием центрифужного фильтра Centricon Plus-20 с мембраной Biomax-5 (5000 NMWL; Millipore, Bedford, MA) перед экспериментами по гидролизу. Бесклеточный ферментационный бульон Trichoderma reesei, экспрессирующий бета-глюкозидазу Aspergillus oryzae, полученный, как описано в WO 2005/074647, использовали в экспериментах по гидролизу без обессоливания или смены буфера.
Разведения фермента готовили непосредственно перед каждым экспериментом из исходных растворов фермента, которые хранили при -200C.
Редуцирующие сахара (RS) определяли с использованием анализа гидроксида п-гидроксибензойной кислоты (PHBAH) (Lever, M., 1972, A new reaction for colorimetric determination of carbohydrates, Anal. Biochem. 47: 273-279), который был модифицирован и адаптирован для формата 96-луночного микропланшета.
Аликвоту 90 мкл разведенной пробы помещали в каждую лунку имеющего 96 конических лунок микропланшета (Corning Inc., Acton, MA, Costar, прозрачный поликарбонат). Анализ начинали добавлением 60 мкл 1,25% РНВAH в 2% гидроксиде натрия в каждую лунку. Непокрытый планшет нагревали на изготовленном по заказу нагревательном блоке в течение 10 минут при 95°C. После охлаждения микропланшета до комнатной температуры, в каждую лунку добавляли 35 мкл деионизованной воды. Аликвоту 100 мкл извлекали из каждой лунки и переносили в плоскодонный 96-луночный планшет (Corning Inc., Acton, MA, Costar, умеренно связывающий полистерол). Оптическую плотность при 410 нм (A410) измеряли с использованием микропланшет-ридера SpectraMAX (Molecular Devices, Sunnyvale, CA). Величину A410 переводили в глюкозные эквиваленты при помощи калибровочной кривой.
Калибровочную кривую получали с шестью стандартами глюкозы (0,005, 0,010, 0,025, 0,050, 0,075 и 0,100 мг/мл), которые обрабатывали сходно с пробами. Глюкозные стандарты готовили разбавлением исходного раствора глюкозы 10 мг/мл деионизованной водой.
Степень превращения целлюлозы в редуцирующий сахар (превращение, %) рассчитывали с использованием следующего уравнения:
Превращение (%) = RS (мг/мл]) · 100 · 162 / (Целлюлоза (мг/мл) · 180) = RS (мг/мл) · 100 / (Целлюлоза (мг/мл) · 1,111).
В этом уравнении, RS является концентрацией редуцирующего сахара в растворе, измеряемой в глюкозных эквивалентах (мг/мл), а фактор 1,111 отражает прирост массы в превращении целлюлозы в глюкозу.
Гидролиз размолотой PCS (1% м/об. в расчете на сухую массу) бесклеточным бульоном Trichoderma reesei, экспрессирующим бета-глюкозидазу Aspergillus oryzae, проводили в планшетах с 96 глубокими лунками (Deepwell Plates 96, 1,2 мл, Brinkmann, Westbury, NY), закрытыми покрытиями Deepwell Mats 96 (Brinkmann, Westbury, NY). Все реакции с начальным объемом 1 мл выполняли в 50 мМ ацетате натрия рН 5,0 с периодическим перемешиванием при 50°C.
Реакции временного хода, содержащие ферментационный бульон Trichoderma reesei при 2,5 мг на г PCS, дополняли GH61B Trichoderma reesei (полученным рекомбинантно в Aspergillus oryzae, как описано здесь) при 0,625 мг на г PCS (нагрузка составляет 25% белка целлюлазы) и эти результаты сравнивали с результатами без добавления бульона Trichoderma reesei при 2,5 и 3,125 мг на г PCS или сравнивали только с белком GH61B Trichoderma reesei при 2,5 мг на г PCS.
Реакции с введением белка, содержащие ферментационный бульон Trichoderma reesei при 2,5 мг на г PCS, дополняли белком GH61B Trichoderma reesei (экспрессированным рекомбинантно в Aspergillus oryzae, как описано здесь) при 0,2, 0,4, 0,6 или 1,2 мг на г PCS и инкубировали in vivo 115 часов. Результаты сравнивали с недополняемым бульоном Trichoderma reesei при 2,5 и 3,5 мг на г PCS.
Аликвоты 20 мкл извлекали из реакций гидролиза PCS в указанных временных точках при помощи 8-канального пипеттора и добавляли к 180 мкл щелочной смеси (102 мМ Na2CO3 и 58 мМ NaHCO3) в 96-луночном фильтрационном планшете MultiScreen HV (Millipore, Bedford, MA) для завершения реакции. Пробы фильтровали в вакууме в другой плоскодонный планшет для удаления остатка PCS. После подходящего разведения, этот фильтрат анализировали на RS при помощи описанного ниже анализа PHBAH.
Эти результаты, показанные на фигуре 4, показывают, что дополнение ферментационного бульона Trichoderma reesei, экспрессирующего бета-глюкозидазу Aspergillus oryzae, белком GH61B Trichoderma reesei улучшало выход гидролиза при всех указанных временных точках. Это улучшение было более высоким, чем улучшение, наблюдаемое с равным введением белка только бульона Trichoderma reesei. Это улучшение не могло быть объяснено только гидролизом полипептида GH61B, так как оно увеличивалось только до 1,2% при 115 часах даже при гораздо более высоком введении белка 2,5 мг на г PCS.
Результаты, показанные на фигуре 5, показывают, что увеличение наблюдали на протяжении диапазона нагрузок белка полипептида GH61B, причем максимальное увеличение нагрузки белка было равно приблизительно 16% нагрузки белка ферментационного бульона Trichoderma reesei.
Депонирование биологического материала
Следующий биологический материал был депонирован согласно условиям Будапештского договора Agricultural Research Service Patent Culture Collection, Northern Regional Research Center, 1815 University Street, Peoria, Illinois, 61604, и ему был присвоен следующий номер доступа:
Этот штамм был депонирован при условиях, которые гарантируют, что доступ к этой культуре будет доступным во время нахождения на рассмотрении этой заявки на патент для лица, определенного Уполномоченным работником Патентного ведомства США, наделенным правом на это, в соответствии с параграфом 1,14 раздела 37 C.F.R. (Свода федеральных правил) и параграфом 122 раздела 35 Кодекса законов США. Этот депозит представляет собой по существу чистую культуру депонированного штамма. Этот депозит является доступным в соответствии с требованиями иностранных патентных законодательств в странах, в которых зарегистрированы копии рассматриваемой заявки или ее продолжения. Однако должно быть понятно, что доступность депозита не является лицензией на применение на практике предмета этого изобретения в умаление патентных прав, предоставленных правительственным решением.
Изобретение, описанное и заявленное здесь, не должно ограничиваться по объему конкретными описанными здесь аспектами, так как эти аспекты предназначены в качестве иллюстраций нескольких аспектов этого изобретения. Предполагается, что любые эквивалентные аспекты находятся в объеме этого изобретения. Действительно, различные модификации этого изобретения, наряду с показанными и описанными здесь, будут очевидными специалистам данной области из предыдущего описания. Предполагается, что такие модификации также попадают в объем прилагаемой формулы изобретения. В случае конфликта, он будет регулироваться данным описанием, в том числе, приведенными в нем определениями.
Здесь цитируются различные ссылки, описания которых включены ссылкой в их полном объеме.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПОВЫШЕНИЯ УСИЛИВАЮЩЕЙ ЦЕЛЛЮЛОЛИТИЧЕСКОЙ АКТИВНОСТИ ПОЛИПЕПТИДА | 2008 |
|
RU2510417C2 |
| ПОЛИПЕПТИДЫ С ПРОТИВОМИКРОБНОЙ АКТИВНОСТЬЮ И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ | 2005 |
|
RU2393224C2 |
| МОЮЩАЯ КОМПОЗИЦИЯ | 2015 |
|
RU2737535C2 |
| ПОЛИПЕПТИДЫ С ЛИЗОЦИМНОЙ АКТИВНОСТЬЮ И ПОЛИНУКЛЕОТИДЫ, КОДИРУЮЩИЕ ИХ | 2012 |
|
RU2619051C2 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ АНТИМИКРОБНОЙ АКТИВНОВНОСТЬЮ, И ПОЛИНУКЛЕОТИДЫ, КОДИРУЮЩИЕ ИХ | 2006 |
|
RU2512525C2 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ ЭНДОПЕПТИДАЗНОЙ АКТИВНОСТЬЮ, И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ | 2011 |
|
RU2583293C2 |
| Композиции, содержащие липазы, и способы обработки поверхности | 2013 |
|
RU2612215C2 |
| ПОЛИПЕПТИДЫ, ОБЛАДАЮЩИЕ ПРОТИВОМИКРОБНЫМ ДЕЙСТВИЕМ, И КОДИРУЮЩИЕ ИХ ПОЛИНУКЛЕОТИДЫ | 2006 |
|
RU2403260C2 |
| РЕКОМБИНАНТНАЯ ЭКСПРЕССИЯ ДЕФЕНСИНОВ В МИЦЕЛИАЛЬНЫХ ГРИБАХ | 2006 |
|
RU2404990C2 |
| ПРИМЕНЕНИЕ ВАРИАНТОВ ПРОТЕАЗЫ | 2010 |
|
RU2639534C2 |







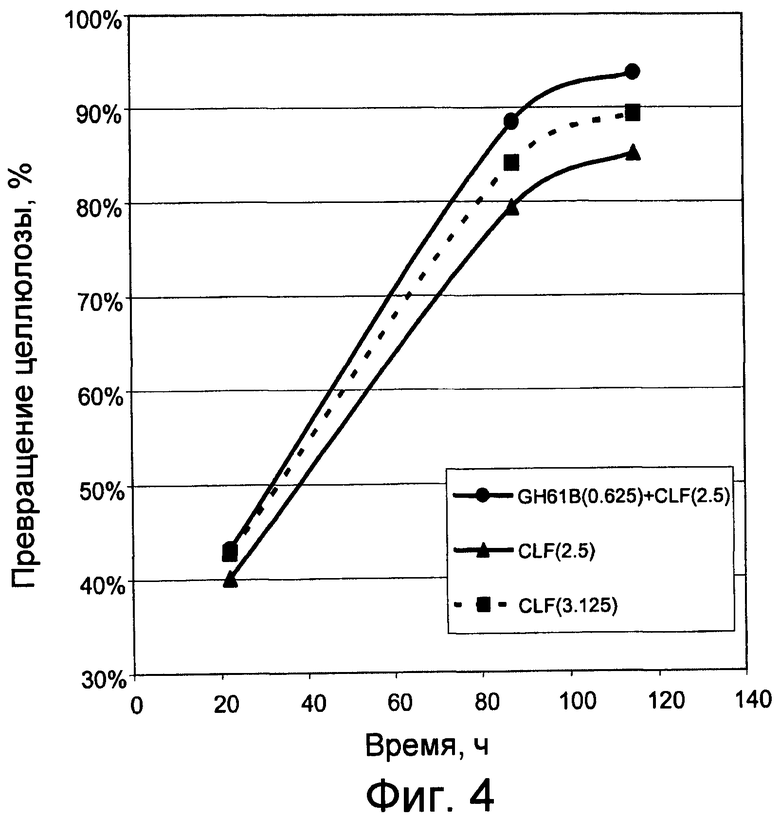

Изобретение относится к области биохимии и представляет собой способы разрушения целлюлозы и композиции, содержащие фермент, разрушающий целлюлозу, и усиливающий его белок. Предложен способ деградации или модификации целлюлозы, включающий обработку целлюлозного материала целлюлолитическими белками в присутствии белка с аминокислотной последовательностью, приведенной в описании, имеющего целлюлолитическую усиливающую активность. Также описан способ получения продукта ферментации, включающий следующие стадии: осахаривание целлюлолитического материала целлюлозами в присутствии указанного белка; ферментирование осахаренного материала и извлечение продукта ферментации из ферментации. Кроме того, описана моющая детергентная композиция, содержащая целлюлозу, белок, усиливающий целлюлолитическую активность, и поверхностно-активное вещество. Изобретение позволяет усилить активность целлюлаз за счет присутствия указанного белка в смеси. 3 н. и 19 з.п. ф-лы, 5 ил.
1. Способ деградации или превращения целлюлозного материала, предусматривающий: обработку целлюлозного материала эффективным количеством одного или более целлюлолитических белков в присутствии эффективного количества полипептида, имеющего целлюлолитическую усиливающую активность, где присутствие полипептида, имеющего целлюлолитическую усиливающую активность, увеличивает деградацию целлюлозного материала в сравнении с отсутствием полипептида, имеющего целлюлолитическую усиливающую активность, и где полипептид, имеющий целлюлолитическую усиливающую активность, выбран из группы, состоящей из:
(a) полипептида, содержащего аминокислотную последовательность, которая имеет предпочтительно, по меньшей мере, 90% идентичность, наиболее предпочтительно, по меньшей мере, 95% идентичность, и даже наиболее предпочтительно, по меньшей мере, 97% идентичность со зрелым полипептидом SEQ ID NO:2;
(b) полипептида, кодируемого полинуклеотидом, который гибридизуется предпочтительно, по меньшей мере, при условиях высокой строгости, и более предпочтительно, по меньшей мере, при условиях очень высокой строгости с (i) кодирующей зрелый полипептид последовательностью SEQ ID NO:1, (ii) геномной последовательностью ДНК, содержащей кодирующую зрелый полипептид последовательность SEQ ID NO:1, или (iii) полноразмерной комплементарной цепью (i) или (ii); и
(с) варианта, содержащего замену, делецию и/или инсерцию одной или более аминокислот зрелого полипептида SEQ ID NO:2.
2. Способ по п.1, где один или более целлюлолитических ферментов выбраны из группы, состоящей из целлюлазы, эндоглюканазы, целлобиогидролазы и бета-глюкозидазы.
3. Способ по п.1 или 2, дополнительно предусматривающий обработку целлюлозного материала эффективным количеством одного или более ферментов, выбранных из группы, состоящей из гемицеллюлазы, эстеразы, протеазы, лакказы, пероксидазы или их смеси.
4. Способ по п.1, дополнительно предусматривающий извлечение деградированного целлюлозного материала.
5. Способ по п.4, где деградированным целлюлозным материалом является сахар.
6. Способ по п.1, где целлюлолитический белок и/или полипептид, имеющий целлюлолитическую усиливающую активность, находятся в форме ферментационного бульона с клетками или без клеток.
7. Способ по п.1, где полипептид, имеющий целлюлолитическую усиливающую активность, содержит SEQ ID NO:2 или ее зрелый полипептид; или ее фрагмент, имеющий целлюлолитическую усиливающую активность, или состоит из SEQ ID NO:2 или ее зрелого полипептида; или ее фрагмента, имеющего целлюлолитическую усиливающую активность.
8. Способ по п.1, где полипептид, имеющий целлюлолитическую усиливающую активность, кодируется полинуклеотидом, содержащимся в плазмиде pTr3337, которая содержится в E. coli NRRL B-30878.
9. Способ по п.1, где кодирующая зрелый полипептид последовательность SEQ ID NO:1 является нуклеотидами 77-766 SEQ ID NO:1, а зрелый полипептид SEQ ID NO:2 является аминокислотами 20-249 SEQ ID NO:2.
10. Способ получения продукта ферментации, предусматривающий:
(A) осахаривание целлюлозного материала эффективным количеством одного или более целлюлолитических белков в присутствии эффективного количества полипептида, имеющего целлюлолитическую усиливающую активность, где присутствие полипептида, имеющего целлюлолитическую усиливающую активность, увеличивает деградацию целлюлозного материала в сравнении с отсутствием полипептида, имеющего целлюлолитическую усиливающую активность, и где полипептид, имеющий целлюлолитическую усиливающую активность, выбран из группы, состоящей из:
(i) полипептида, содержащего аминокислотную последовательность, которая имеет предпочтительно, по меньшей мере, 90% идентичность, наиболее предпочтительно, по меньшей мере, 95% идентичность, и даже наиболее предпочтительно, по меньшей мере, 97% идентичность со зрелым полипептидом SEQ ID NO:2;
(ii) полипептида, кодируемого полинуклеотидом, который гибридизуется предпочтительно, по меньшей мере, при условиях высокой строгости, и более предпочтительно, по меньшей мере, при условиях очень высокой строгости с (i) кодирующей зрелый полипептид последовательностью SEQ ID NO:1, (ii) геномной последовательностью ДНК, содержащей кодирующую зрелый полипептид последовательность SEQ ID NO:1, или (iii) полноразмерной комплементарной цепью (i) или (ii); и (iii) варианта, содержащего замену, делецию и/или инсерцию одной или более аминокислот зрелого полипептида SEQ ID NO:2;
(B) ферментирование осахаренного целлюлозного материала стадии (а) одним или более ферментирующими микроорганизмами; и
(C) извлечение продукта ферментации из ферментации.
11. Способ по п.10, где один или более целлюлолитических ферментов выбраны из группы, состоящей из целлюлазы, эндоглюканазы, целлобиогидролазы и бета-глюкозидазы.
12. Способ по п.10 или 11, дополнительно предусматривающий обработку целлюлозного материала эффективным количеством одного или более ферментов, выбранных из группы, состоящей из гемицеллюлазы, эстеразы, протеазы, лакказы, пероксидазы или их смеси.
13. Способ по п.10, где стадии (А) и (В) выполняют одновременно в одновременных осахаривании и ферментации.
14. Способ по п.10, где продуктом ферментации является спирт, органическая кислота, кетон, аминокислота или газ.
15. Способ по п.10, где целлюлолитический белок и/или полипептид, имеющий целлюлолитическую усиливающую активность, находятся в форме ферментационного бульона с клетками или без клеток.
16. Способ по п.10, где полипептид, имеющий целлюлолитическую усиливающую активность, содержит SEQ ID NO:2 или ее зрелый полипептид; или ее фрагмент, имеющий целлюлолитическую усиливающую активность, или состоит из SEQ ID NO:2 или ее зрелого полипептида; или ее фрагмента, имеющего целлюлолитическую усиливающую активность.
17. Способ по п.10, где полипептид, имеющий целлюлолитическую усиливающую активность, кодируется полинуклеотидом, содержащимся в плазмиде pTr3337, которая содержится в Е. coli NRRL B-30878.
18. Способ по п.10, где кодирующая зрелый полипептид последовательность SEQ ID NO:1 является нуклеотидами 77-766 SEQ ID NO:1, а зрелый полипептид SEQ ID NO:2 является аминокислотами 20-249 SEQ ID NO:2.
19. Детергентная композиция, содержащая один или более целлюлолитических белков и полипептид, имеющий целлюлолитическую усиливающую активность, выбранный из группы, состоящей из:
(а) полипептида, содержащего аминокислотную последовательность, которая имеет предпочтительно, по меньшей мере, 90% идентичность, наиболее предпочтительно, по меньшей мере, 95% идентичность, и даже наиболее предпочтительно, по меньшей мере, 97% идентичность со зрелым полипептидом SEQ ID NO:2;
(b) полипептида, кодируемого полинуклеотидом, который гибридизуется предпочтительно, по меньшей мере, при условиях высокой строгости, и более предпочтительно, по меньшей мере, при условиях очень высокой строгости с (i) кодирующей зрелый полипептид последовательностью SEQ ID NO:1, (ii) геномной последовательностью ДНК, содержащей кодирующую зрелый полипептид последовательность SEQ ID NO:1, или (iii) полноразмерной комплементарной цепью (i) или (ii); и
(c) варианта, содержащего замену, делецию и/или инсерцию одной или более аминокислот зрелого полипептида SEQ ID NO:2;
и поверхностно-активное вещество.
20. Детергентная композиция по п.19, где полипептид, имеющий целлюлолитическую усиливающую активность, содержит SEQ ID NO:2 или ее зрелый полипептид; или ее фрагмент, имеющий целлюлолитическую усиливающую активность, или состоит из SEQ ID NO:2 или ее зрелого полипептида; или ее фрагмента, имеющего целлюлолитическую усиливающую активность.
21. Детергентная композиция по п.19, где полипептид, имеющий целлюлолитическую усиливающую активность, кодируется полинуклеотидом, содержащимся в плазмиде pTr3337, которая содержится в Е. coli NRRL B-30878.
22. Детергентная композиция по п.19, где кодирующая зрелый полипептид последовательность SEQ ID NO:1 является нуклеотидами 77-766 SEQ ID NO:1, а зрелый полипептид SEQ ID NO:2 является аминокислотами 20-249 SEQ ID NO:2.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Распределительный механизм для железнодорожного пневматического круговоротчика и других аналогичным поршневых машин | 1925 |
|
SU3295A1 |
| EP 764226 B1, 05.12.2001 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Штамм гриба TRICHODERMA REESEI - продуцент целлюлолитических ферментов | 1991 |
|
RU2001949C1 |
Авторы
Даты
2012-02-10—Публикация
2006-09-29—Подача