Изобретение относится к способу введения различных препаратов в печень, пораженную опухолью, и может найти применение в противоопухолевой терапии.
Известен способ введения препаратов на примере фотодинамической терапии опухолей печени в печеночную артерию (R.Van Hillegersberg, J.P.A. Marijnissen, W. J. Kort, P.E. Zondervan, O.T. Terpstra // Interstitial photodynamic therapy in a rat liver metastasis model. Br. J. Cancer 1992, 66, p. 1005-1014). В качестве препарата используют фотофрин, а облучение проводят через 48 ч после введения.
Недостатком способа является распределение препаратов в системный кровоток, быстрое снижение их в регионе поражения и как следствие - повышение общей токсичности.
Задачей изобретения является разработка способа введения препаратов в долю-мишень (долю-опухоленоситель) печени, обеспечивающего преимущественное их накопление в доле-мишени печени в сочетании с малым распространением в системный кровоток. Это позволит снизить общее количество вводимого препарата и его токсичность.
Эта задача решается путем введения химиопрепарата в ветвь воротной вены при одновременной окклюзии афферентных (ветви воротной вены проксимальнее места пункции и ветви печеночной артерии) и эфферентных (долевой печеночной вены) сосудов доли-мишени печени на 5-15 мин. Таким образом, осуществляется прямой длительный контакт препарата с выключенной из кровообращения долей-мишенью печени.
Указанный способ позволяет при каталитической терапии вводить второй компонент бинарной пары - аскорбиновую кислоту (АК) сразу после снятия окклюзии при большом содержании терафтала (ТФ) в доле-мишени печени, а при фотодинамической терапии осуществлять облучение опухоли в ранние сроки после введения фотосенсибилизатора.
Практически способ осуществляют следующим образом.
Производят срединную лапаротомию, выделяют афферентные (ветвь воротной вены и печеночной артерии) и эфферентные (ветвь печеночной вены) сосуды доли-мишени печени. Берут их на турникеты. Производят пункцию ветви воротной вены, вводят в нее препарат, одновременно прекращая кровоток: приток крови - по ветви воротной вены (проксимальнее места пункции) и печеночной артерии, отток - по ветви печеночной вены. Восстановление кровотока осуществляют путем снятия зажимов с сосудов через 5-15 мин после введения препарата.
Нижеследующие данные иллюстрируют способ по изобретению.
В качестве препаратов использовали терафтал (ТФ) и фотосенс (ФС) (ГНЦ РФ "НИОПИК", Москва).
I. Изучение распределения терафтала при известном регионарном и предлагаемом способах введения.
Исследования проводили на беспородных крысах массой 150 г, полученных из разведения ОНЦ им. Н.В. Блохина и содержащихся в виварии этого института.
1/1. Распределение терафтала при известном регионарном введении.
Терафтал вводили однократно в общий ствол воротной вены в дозе 5 мг/кг (это составило 1 мг ТФ на крысу массой 200 г). Накопление препарата в печени, легких и уровень его в плазме крови оценивали спектрофотометрическим методом через 5, 35 и 240 мин после введения.
Результаты представлены в табл. 1. Из таблицы следует, что кинетика ТФ при известном регионарном введении носила биэкспоненциальный характер, типичный для системного внутривенного способа введения. В печени препарат накапливался постепенно и уже через 4 ч концентрация его падала. Значительное количество ТФ фиксировалось в легких.
1.2. Распределение терафтала при предлагаемом регионарном способе введения.
Терафтал в дозе 60 или 300 мкг/крысу в виде 0,6 мл 0,01 и 0,05% раствора вводили в ветвь воротной вены доли-мишени печени. Доза ТФ, вводимого этим способом, обоснована возможным объемом вводимой жидкости в долю-мишень и допускаемой концентрацией раствора ТФ, не вызывающего повреждения эндотелия сосудов. Таким образом, общее количество вводимого ТФ при предлагаемом способе введения было в 3,3 раза меньше (при концентрации 0,05%) и в 16,5 раз меньше (при концентрации 0,01%), чем при известном регионарном введении (соответственно 0,3 мг, 0,06 мг и 1 мг/крысу). Накопление препарата в доле-мишени (подвергнутой окклюзии) и интактной доле печени (не подвергнутой окклюзии), а также плазме крови исследовали через 5, 35 и 240 мин после введения препарата предлагаемым способом. Результаты представлены в табл. 2.
Как следует из табл. 2, при предлагаемом способе введения ТФ наблюдалось быстрое накопление препарата в доле-мишени печени, разница в уровне концентрации препарата в окклюзированной и интактной долях печени сохранялась на протяжении всего срока наблюдения - 4 ч. Концентрация ТФ в доле-мишени печени в первые минуты после введения предлагаемым способом была в 2 раза выше, чем при известном регионарном (см. табл. 1), тогда как доза вводимого ТФ при предлагаемом способе была в 16,5 раза меньше.
Результаты исследования влияния длительности периода окклюзии приводящих и отводящих сосудов доли-мишени печени на накопление в ней ТФ представлены в табл. 3.
Из табл. 3 следует, что как при 5, так и при 15-минутной окклюзии приводящих и отводящих сосудов доли-мишени печени содержание препарата было одинаковым как в этой доле, так и в интактной доле печени, т.е. увеличение времени окклюзии не приводило к большему накоплению ТФ в доле-мишени печени. В то же время, селективное введение ТФ в долевую ветвь воротной вены доли-мишени печени без окклюзии (контроль) сопровождалось равномерным распределением препарата в этой доле и интактной доле печени: содержание ТФ через 30 мин после введения соответственно составило 17 и 20 мкг/г, а уровень в плазме - 6 мкг/г сырой ткани.
Таким образом, предлагаемый регионарный (селективно-окклюзионный) способ введения ТФ в долю-мишень печени имеет преимущества перед известным регионарным, так как обеспечивает преимущественное накопление препарата в доле-мишени печени, снижает общее количество вводимого препарата и проникновение его в системный кровоток.
1.3. Каталитическая терапия опухолей печени системой "Терафтал+аскорбиновая кислота" (ТФ+АК) при использовании предлагаемого способа введения препаратов.
Опухоль печени моделировали путем прививки в центральную долю печени 0,1 мл 20% опухолевой взвеси перевитого подкожно альвеолярного слизистого рака печени (штамм РС-1). Каталитическую терапию (КТ) осуществляли через 2 недели после прививки опухоли. ТФ вводили предлагаемым способом в объеме 0,6 мл 0,01% раствора в ветвь воротной вены доли-опухоленосителя печени с последующей 5-минутной окклюзией афферентных и эфферентных сосудов этой доли, АК (весовое соотношение с ТФ - 2,2:1) вводили сразу после прекращения окклюзии в тот же сосуд, что и ТФ. В качестве контроля служили крысы с опухолью печени, которым лечение не проводили. Результаты оценивали на 21 сутки после лечения. Проводили измерение размеров опухоли, рассчитывали объем опухоли и показатель торможения роста опухоли (ТРО), а также проводили гистологическое исследование доли-опухоленосителя печени.
Объем опухоли рассчитывали по формуле (Carlsson SR G., Gullberg В. and Hafstron LO. //Estimation of liver tumor volume using different formulos - an experimental study in rats. J. Cancer Res. Clin. Oncol. 105, 20-23, 1983):
VОП=(AхB2)хπ/6
где VОП - объем опухоли;
A - максимальный диаметр опухоли;
В - минимальный диаметр опухоли;
π=3,14.
Показатель торможения роста опухоли рассчитывали по формуле (Экспериментальная оценка противоопухолевых препаратов в СССР и США. 1980. М., Медицина, с.71-106):
ТРО (%)=[(РОконтроль-РОопыт)/РОконтроль]х100%,
где ТРО - торможение роста опухоли;
РОопыт - объем опухоли (мм3) у крыс опытной группы;
РОконтроль - объем опухоли (мм3) у крыс контрольной группы.
Значимым терапевтическим эффектом считали торможение роста опухоли на 50%.
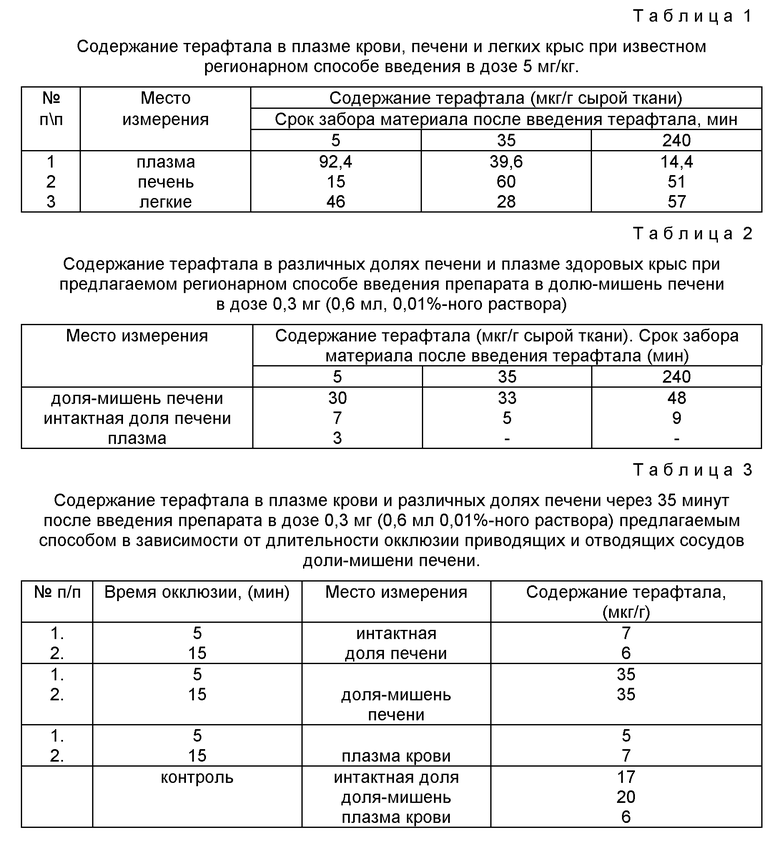
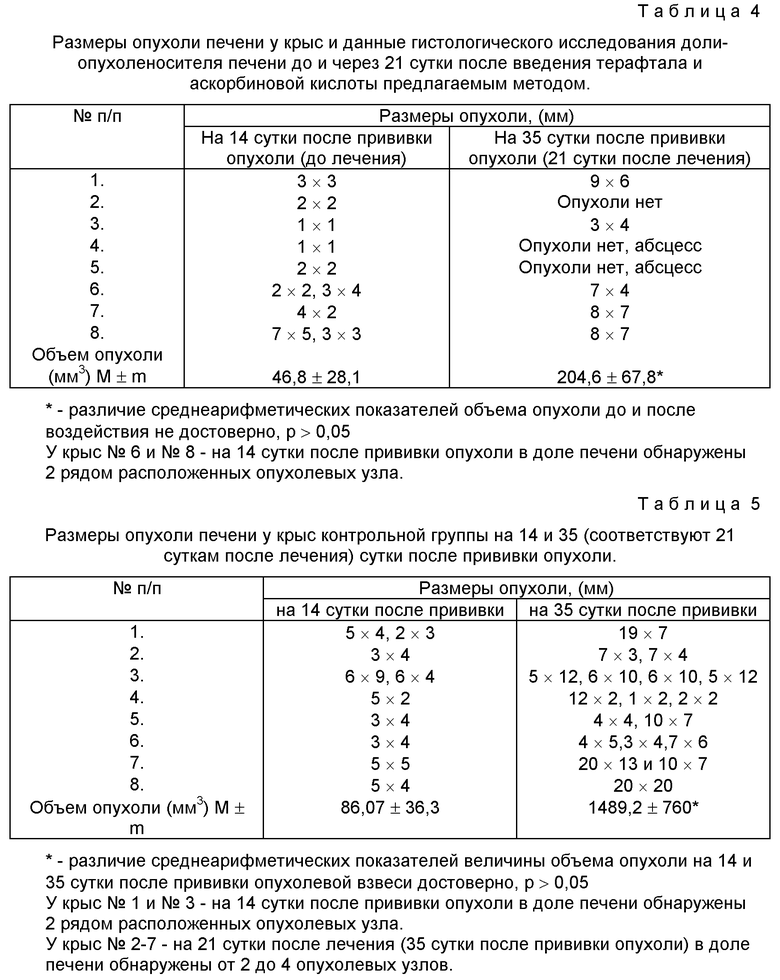
Результаты каталитической терапии представлены в табл. 4-5.
При сравнительном анализе результатов в основной и контрольной группах (см. табл. 4 и 5) выявлено, что до начала лечения (через 14 сут после прививки опухоли) размеры опухолей были сравнимы, составляя 46,8±28,1 и 86,1±36,3 мм3 соответственно (р>0,05).
В группе животных, которым лечение проводили по предлагаемому методу (см. табл. 4) у 3 из 8 крыс при гистологическом исследовании доли-опухоленосителя злокачественных клеток обнаружено не было, у других 5 животных не было достоверного увеличения опухоли: 46,8±28,1 мм3 (до лечения) и 204,6±67,8 мм3 (после лечения), р>0,05.
В контрольной группе (см. табл.5) размеры опухоли через 35 сут после прививки были достоверно больше, чем в опытной группе: 1489,2±760 мм3 и 304,6±67,8 мм3, р<0,05.
Показатель ТРО на 21 сут после лечения (35 сут после прививки опухоли) составил 86,3% при использовании предлагаемого способа введения препаратов каталитической бинарной пары.
II. Изучение распределения фотосенсибилизатора при предлагаемом способе введения.
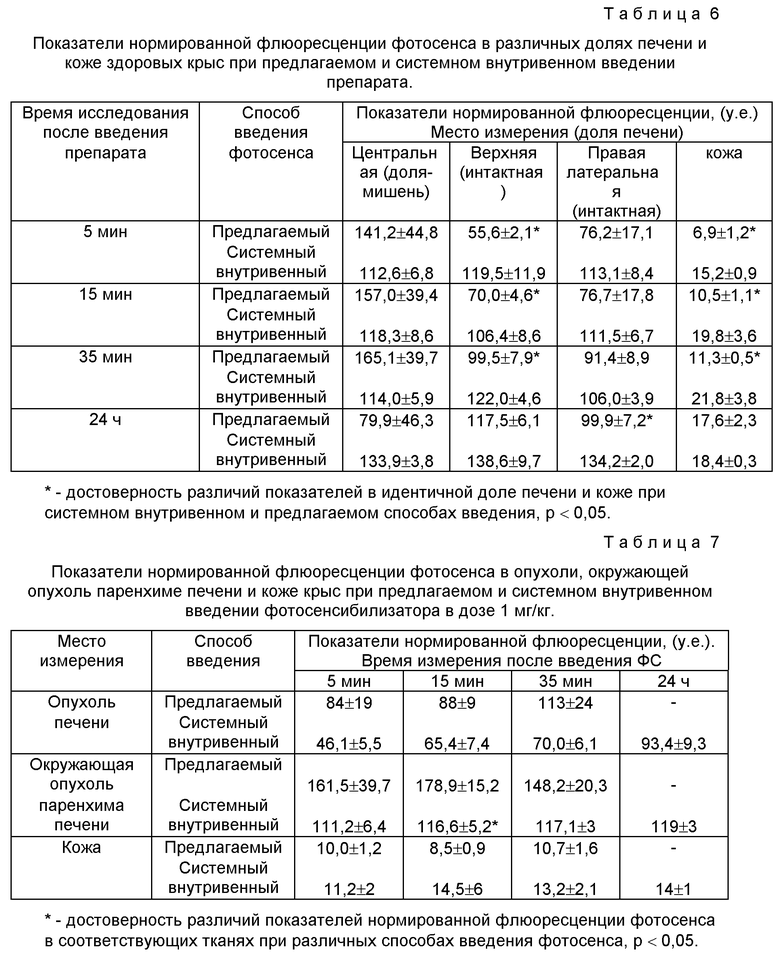
В качестве фотосенсибилизатора использовали препарат фотосенс (ФС) (ГНЦ "НИОПИК", Москва). Исследования проводили на беспородных крысах массой 150 г, полученных из питомника "Столбовая" и содержащихся в виварии МНИОИ им П. А. Герцена. Фотосенс вводили в дозе 1 мг/кг системно внутривенно (группа I) и по предлагаемому способу (группа 2). Распределение ФС в тканях изучали с помощью специфической флюоресценции контактным методом на лазерной диагностической установке "Спектр" (ТОО "Кластер"). Нормированную флуоресценцию (НФ) определяли через 5, 15, 35 мин и 24 ч после введения препарата. Результаты представлены в табл. 6 и 7. Как следует из табл. 6, при системном внутривенном введении (группа 1) ФС распределялся равномерно в центральной (доля-мишень) и верхней латеральной (интактная) долях печени. Отмечали быстрое накопление препарата в коже.
При введении препарата предлагаемым способом (группа 2) с последующей окклюзией отмечали достоверную разницу между показателями НФ в указанных долях печени: в доле-мишени содержание ФС было выше по сравнению с интактной долей. При этом содержание ФС в коже у крыс 2 группы было ниже, чем у животных 1 группы. Эти различия сохранялись на протяжении 35 мин после введения препарата, к 24 ч разница нивелировалась, что, вероятно, было связано с выходом ФС из окклюзированной доли печени.
При введении ФС предлагаемым способом крысам с опухолью печени также отмечено преимущественное накопление ФС в опухоли и окружающей опухоль паренхиме печени доли-опухоленосителя в ранние сроки после введения (см. табл. 7).
ФДТ в обеих группах проводили при одинаковых параметрах облучения: мощность 200 мВт/см2, световая доза 150 Дж/см2. Через 3 дня животных забивали, долю-опухоленоситель печени направляли на гистологическое исследование, которое показало, что у крыс 1 группы 1/3 площади опухоли оставалось сохранной, тогда как у животных 2 группы отмечали тотальные некрозы опухолевых узлов.
Результаты ФДТ изучали на 21 сут после облучения опухоли. Опытную группу составили крысы, которым проводили облучение после введения фотосенса предлагаемым способом. Контрольную группу составили животные, у которых через 2 недели после прививки опухоли при лапаротомии измеряли размеры опухоли, а ФДТ не производили. Результаты ФДТ представлены на чертеже.
На чертеже видно, что через 2 недели после прививки размеры опухоли в контрольной и опытной группах достоверно не отличались, составляя соответственно 45,6±16,5 и 76,9±29,5 мм3, р>0,05. На 21 сут размеры опухоли в контрольной группе достоверно увеличились до 397,04±41,7 мм3, р<0,05. Достоверного увеличения размеров опухоли в опытной группе не отметили, площадь опухоли составила 57,2±25,03 мм3, р>0,05. После ФДТ торможение роста опухоли составило 81,3%.
Таким образом, предлагаемый способ введения препаратов по сравнению с известным обеспечивает их преимущественное накопление в доле-мишени (доле-опухоленосителе) печени, малое проникновение в системный кровоток, что позволяет снизить дозу препарата и его общую токсичность.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ МЕТАСТАЗОВ ПЕЧЕНИ | 2011 |
|
RU2474423C1 |
| СПОСОБ МОДИФИКАЦИИ ФОТОДИНАМИЧЕСКОГО ЛЕЧЕНИЯ | 2010 |
|
RU2449821C1 |
| СУЛЬФОЗАМЕЩЕННЫЕ ФТАЛОЦИАНИНЫ КАК ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 1999 |
|
RU2183635C2 |
| СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 2012 |
|
RU2491930C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ БОЛЬНЫХ С ОПУХОЛЕВЫМИ МЕТАСТАТИЧЕСКИМИ ПЛЕВРИТАМИ | 2013 |
|
RU2514107C1 |
| СРЕДСТВО ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И СПОСОБ ЕЕ ПРОВЕДЕНИЯ | 2004 |
|
RU2271801C2 |
| ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2005 |
|
RU2282646C1 |
| ФАНТОМ БИОТКАНИ И ИНДИКАТОР СОДЕРЖАНИЯ ФОТОСЕНСИБИЛИЗАТОРА | 2001 |
|
RU2210315C2 |
| ВОДОРАСТВОРИМАЯ ЛЕКАРСТВЕННАЯ ФОРМА МЕЗО-ТЕТРА(3-ПИРИДИЛ)БАКТЕРИОХЛОРИНА ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2017 |
|
RU2663900C1 |
| СПОСОБ ЛЕЧЕНИЯ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА В ЭКСПЕРИМЕНТЕ | 2003 |
|
RU2255699C2 |
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения опухолей печени. Предложено вводить препарат в воротную вену доли мишени печени (доли-опухоленосителя) при окклюзии афферентных и эфферентных сосудов доли на 5-15 мин. В качестве препарата используют терафтал и после прекращения окклюзии дополнительно в ветвь воротной вены вводят аскорбиновую кислоту. Либо в качестве препарата используют фотосенс и через 10-35 мин после прекращения окклюзии производят лазерное облучение опухоли. Способ обеспечивает преимущественное накопление препаратов в доле-мишени печени, малое проникновение их в системный кровоток, что позволяет снизить дозу препарата и его общую токсичность. 2 з.п. ф-лы, 7 табл., 1 ил.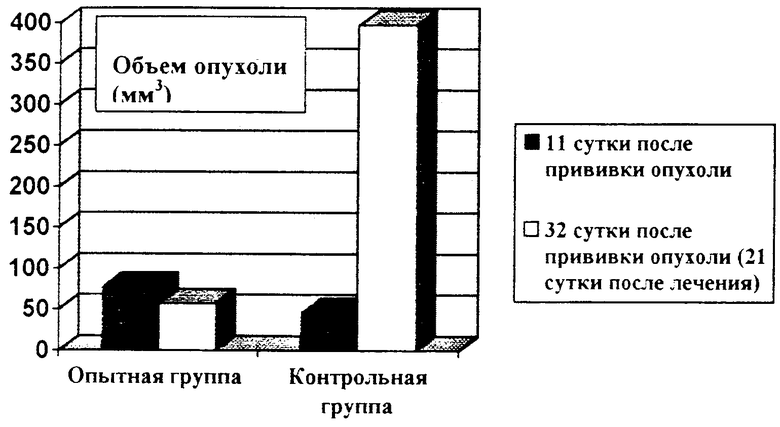
| R.VAN HILLEGERSBERG et al | |||
| "Intersticial photodynamic therapy in a rat liver metastasis mobel" Br | |||
| J | |||
| Cancer, 1992, 66, р.1005-1014 | |||
| Способ лечения злокачественных опухолей печени | 1986 |
|
SU1420696A1 |
| СПОСОБ ЛЕЧЕНИЯ ОПУХОЛЕЙ ПАРЕНХИМАТОЗНЫХ ОРГАНОВ | 1995 |
|
RU2065734C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ | 1997 |
|
RU2147249C1 |
| RAYNER A.A | |||
| et al "Total hepatic arterial perfusion after occlusion of variant lobar vessels: implications for hepatic arterial chemotherapy", Surgery, 1986, Jun; 99(6): 708-15. | |||
Авторы
Даты
2003-03-20—Публикация
2000-12-07—Подача