Данное изобретение направлено на создание новых производных 1, 3, 4-оксадиазол-2(3Н)-она, который является модулятором активированных кальцием калиевых (ВК) каналов большой проводимости и, следовательно, пригоден для защиты нервных клеток и для лечения заболеваний, вызванных дисфункцией поляризации и проводимости клеточной мембраны. Данное изобретение также предусматривает способ лечения при помощи новых производных замещенного оксадиазолона и относится к фармацевтическим композициям на их основе.
В настоящее время кровоизлияние считается третьей по степени распространенности причиной нетрудоспособности и смертных случаев среди взрослых в Соединенных Штатах Америки и в Европе. В последнее десятилетие было разработано несколько подходов к уменьшению степени повреждения мозга, связанного с кровоизлиянием, включая использование ингибиторов АМРА/каината, N-метил-D-аспартата (NMDA) и ингибиторов повторного поглощения аденозина.
Предметом настоящего изобретения является создание новых соединений, которые будут модулировать калиевые каналы, в частности, активированные кальцием калиевые (ВК) каналы большой проводимости, что является полезным для уменьшения нейронных повреждений во время ишемической болезни после кровоизлияния.
Калиевые каналы играют ключевую роль в процессе регулирования потенциала клеточной мембраны и модуляции возбудимости клеток. Калиевые каналы сами регулируются напряжением, клеточным метаболизмом, ионом кальция и процессами, опосредованными рецепторами [Cook, N.S., Trends in Pharmacol. Siences, 9, pp. 21-28 (1988); и Qast, U. and Cook, N.S., Trends in Pharmacol. Siences, 10, pp. 431-435 (1989)]. Активированные кальцием калиевые (КCa) каналы являются разновидностью ионных каналов, которым свойственна зависимость активности от внутриклеточных ионов кальция. Активность КCа каналов регулируется внутриклеточными [Са2+] потенциалом мембраны и фосфорилированием. На основе проводимости единичных каналов в симметричных К+ растворах КCa каналы подразделяются на три подкласса: высокая проводимость (ВК)>150 пСм; промежуточная проводимость 50-150 пСм; низкая проводимость <50 пСм ("пСм" обозначает пикосименс, единицу электрической проводимости). Активированные кальцием калиевые (ВК) каналы с большой проводимостью имеются во многих возбуждаемых клетках, включая нейроны, кардиальные клетки и различные типы клеток гладкой мускулатуры [Singer,J.J.and Walsh J.V., Pflugers Archiv., 408, pp. 98-111 (1987); Вато'J. , and Escande D., Pflugers Archiv., 414 (suppl. 1), pp. S168-S170 (1989) и Ahmed F. et al. Br.J. Pharmacol., 83, pp. 227-233 (1984)].
Ионы калия играют доминирующую роль в регулировании потенциала мембран в самых возбуждаемых клетках и в поддержании трансмембранного напряжения вблизи величины равновесного потенциала K+, равной примерно -90 мВ. Было показано, что открытие калиевых каналов сдвигает равновесие клеточной мембраны в сторону равновесного калиевого потенциала мембраны (Еk), что приводит к гиперполяризации клетки [Cook, N.S., Trends in Pharmacol. Siences, 9, pp.21-28 (1988)]. Гиперполяризованные клетки характеризуются сниженным ответом на потенциально вредные деполяризующие раздражители. ВК каналы, которые регулируются и напряжением и внутриклеточным Са2+, ограничивают деполяризацию и ввод кальция и могут быть особенно эффективными для блокировки вредных раздражителей. Следовательно, гиперполяризация клеток через открытие ВК каналов может привести к защите нервных клеток при ишемической болезни.
Роль калиевых каналов в функционировании гладкой мышцы мочевого пузыря человека рассматривается S. Trivedi et al. в Biochemical and Biophysical Research Communications, (1995), 213, 2, pp. 404-409.
Известен ряд синтетических и природных соединений, обладающих активностью, способствующей открытию ВК. Пирон, экстрагированный из посевного овса, является открывателем ВК каналов при использовании липидной двухслойной методики [международная заявка WO 93/08800, опубликованная 13 мая 1993]. Флаваноид флоретин влияет на открытие активированных кальцием калиевые каналы в миелинизированных нервных волокнах Xenopus laevis при использовании внешних накладок [Koh, D-S. , et al., Neurosience Lett., 165, pp.167-170 (1994)].
Патент США 3971803 на имя S. Rosenberger и К. Schwarzenbach от 27 июля 1976 года относится к соединениям формулы (i):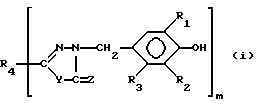
где R1 обозначает алкил, циклоалкил или аралкил;
R2 обозначает водород или R,;
R3 обозначает водород или С1-4 алкил;
Y и Z независимо обозначают О или S;
R4 обозначает (1), если m=1, C1-8 алкилен, -CxH2x-Q -СуН2у- (Q обозначает О или S, x и у обозначают целые числа, сумма которых равна 2-4), фенилен, дифенилен или нафталин или
или (2), если m= 2, алкилен, алкилен-простой эфир, алкилентиоэфирную группу, дифенилен или нафталин. Эти соединения являются антиоксидантами для органических полимеров.
В ЕР-0533276-А1, опубликованной 24 марта 1993 года, описаны соединения формулы (ii):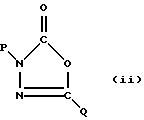
где один из Р или Q обозначает о-замещенную фенильную группу, а другой - замещенный бензил. Соединения формулы (ii) являются митицидани и инсектицидами.
А. Е. Wilder Smith и Arzneim. Forsch. (1967) 67, 17, pp. 768-772 описал получение и изучение соединений формулы (iii):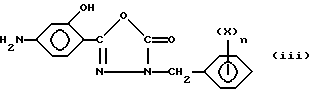
где Х обозначает Н или С1 и n равно 1 или 2. Соединения имеют туберкулостатические свойства. Соединения формулы (iii) не включают производные, замещенные в п-положении по отношению к гидроксильной группе.
J. L. Romine et al. в международной заявке WO 98/04135, опубликованной 5 февраля 1998 года, описал ряд дифенильных гетероциклов формулы (iv):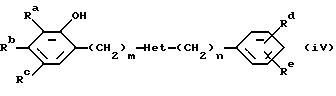
где Het обозначает гетероцикл, выбранный наряду с другими из оксадиазолонов. Соединения пригодны в качестве модуляторов активированных кальцием калиевых каналов с высокой проводимостью, описаны также исходные вещества для получения соединений по изобретению, где Het обозначает 1, 3, 4-оксаздиазол-2(3Н)-он, m=1 и n=0, Rс обозначает хлор, Rd обозначает трифторметил и Ra=Rb=Re=водород.
Данное изобретение предусматривает новые производные 1,3,4-оксадиазолона, имеющие общую формулу I (см. ниже), или их нетоксичные фармацевтически приемлемые соли или сольваты. Данное изобретение предусматривает также фармацевтические композиции, включающие указанные производные, и способ лечения нарушений, чувствительных к активности, способствующей открытию калиевых каналов, таких как ишемия, кровоизлияние, конвульсии, эпилепсия, астма, синдром воспаленной кишки, мигрень, травматическое повреждение мозга, повреждение спинного мозга, половое расстройство и недержание мочи.
Данное изобретение предусматривает новые производные 3-[(5-хлор-2-гидроксифенил) метил ]-5-[4-(трифторметил)фенил]-1, 3, 4-оксадиазол-2(3Н)-она, который является сильнодействующим открывателем активированных кальцием К+-каналов (ВК каналы) с высокой проводимостью, новые производные имеют общую формулу: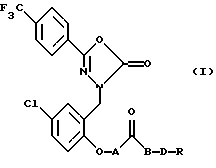
где А обозначает простую связь или -СН2О-;
В обозначает простую связь или кислород;
D обозначает -(CH2)n- или -СH2СНОНСН2-;
n - целое число от 1 до 4;
R обозначает -NR1R2 или -NR1R3 X, где Х является противоионом; и R1, R2 и R3 каждый независимо обозначает водород или С1-4 алкил; или их фармацевтически приемлемые соли или сольваты.
Данное изобретение также предусматривает способ лечения или защиты от расстройств, опосредованных открытием активированных кальцием калиевых каналов (ВК каналы) с высокой проводимостью, у млекопитающего, нуждающегося в этом, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы I или его нетоксичной фармацевтически приемлемой соли. Предпочтительно применять соединения формулы I для лечения ишемии, кровоизлияния, конвульсий, эпилепсии, астмы, синдрома раздраженной кишки, мигрени, травматического повреждения мозга, повреждения спинного мозга, полового расстройства, недержания мочи и других расстройств, чувствительных к активности, активизирующей ВК каналы.
Термин "С1-4 алкил", используемый в описании и в формуле изобретения (если иное не следует из контекста), означает линейные или разветвленные алкильные группы, например метил, этил, пропил, изопропил, бутил. Предпочтительно, чтобы эти группы содержали 1-2 атома углерода.
Термины "нетоксичная фармацевтически приемлемая соль" и "противоион", используемые в данном описании и формуле изобретения, обозначают нетоксичные соли присоединения и противоионы с неорганическими и органическими кислотами. Подходящие соли с кислотой и/или подходящими противоионами кислоты включают соли неорганических кислот, такие как гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат и т.п. и соли органических кислот и/или противоионы кислоты, такую как формиат, ацетат, малеат, цитрат, сукцинат, аскорбат, лактат, фумарат, метансульфонат и тартрат, которые использовались для образования солей основных аминов и четвертичных аминов.
Так как соединения по изобретению могут иметь асимметричный атом углерода, данное изобретение включает рацемат, а также индивидуальные энантиомерные формы соединений формулы I, описанных в описании и в формуле изобретения, например (D), (L) и (DL) формы норкамитина и камитина.
Вообще фармацевтически приемлемые соли по изобретению являются солями, в которых противоион не оказывает значительного влияния на токсичность или фармакологическую активность соли. В некоторых случаях они имеют физические свойства, которые делают их более желательными для фармацевтических препаратов, например растворимость, отсутствие гигроскопичности, способность к прессованию при получении таблеток и совместимость с другими ингредиентами, с которыми вещество может быть использовано для фармацевтических целей. Соли обычно получают путем смешения соединения формулы I с выбранной кислотой, предпочтительно при контакте в растворе с применением избытка обычно используемых инертных растворителей, таких как вода, простой эфир, диоксан, метиленхлорид, изопропанол, метанол, этанол, этилацетат и ацетонитрил. Они могут быть также получены путем метатезиса или обработки ионообменной смолой при условиях, в которых соответствующий ион соли соединения формулы I замещается другим ионом при условиях, которые позволяют произвести отделение нежелательных продуктов, например путем осаждения из раствора или экстракции в растворитель, или извлечения ионообменной смолы или удержания в ней.
Некоторые соединения по изобретению, включая их фармацевтически приемлемые соли, могут существовать в виде сольватированных форм, в том числе гидратированных форм, таких как моногидрат, дигидрат, гемигидрат, тригидрат, тетрагидрат и т. п. Продукты могут быть истинными сольватами, а в других случаях продукты могут просто удерживать случайный растворитель или быть смесью сольвата и некоторого количества случайного растворителя. Специалистам очевидно, что сольватированные формы эквивалентны несольватированным и входят в объем данного изобретения.
При осуществлении способа согласно данному изобретению термин "терапевтически эффективное количество" означает общее количество каждого активного компонента композиции, которое является достаточным для принесения пациенту значительной пользы, а именно излечивания острых состояний, характеризующихся открытием активированных кальцием калиевых каналов с высокой проводимостью или повышения скорости излечивания таких состояний. В отношении индивидуального активного ингредиента, примененного в отдельности, этот термин касается этого одного ингредиента. В применении к смеси этот термин относится к общему количеству активных ингредиентов, которое приводит к терапевтическому эффекту, независимо от того, применяются ли они в смеси последовательно или одновременно. Термин "лечение", используемый в данном описании и в формуле изобретения, означает профилактику или улучшение состояния при болезни, повреждении ткани и/или симптомах, связанных с дисфункцией поляризации и проводимости клеточной мембраны.
Согласно другому аспекту данное изобретение предусматривает водорастворимые пролекарства 3-[ (5-хлор-2-гидроксифенил)метил]-5-[4-(трифторметил)фенил] -1, 3, 4-окса-диазол-2(3Н)-она, который описан в WO 98/04135. Используемый в данном описании термин "пролекарство" означает производное активного лекарства, которое после введения снова превращается в активное лекарство. Более конкретно оно относится к производным 1, 3, 4-оксадиазол-2(3Н)-она, которые могут быть активными лекарственными веществами и/или которые способны гидролизоваться по сложноэфирным или метиленоксиэфирным группам или же расщепляться по эфирным группам с выделением активного свободного лекарства. Физиологически гидролизующиеся группы служат пролекарствами при гидролизе в теле пациента с образованием лекарства per se и таким образом водорастворимые пролекарства по изобретению предпочтительны при введении лекарства.
Согласно еще одному аспекту данное изобретение предусматривает способ лечения или защиты от нарушений, которые опосредованы открытием активированных кальцием калиевых каналов (ВК каналов) с высокой проводимостью у млекопитающих, нуждающихся в этом, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы I или его нетоксичных фармацевтически приемлемых соли, сольвата или гидрата.
Соединения формулы I предпочтительно применять при лечении ишемии, кровоизлияния, конвульсий, эпилепсии, астмы, синдрома раздраженной кишки, мигрени, травматического повреждения мозга, повреждения спинного мозга, недержания мочи и полового расстройства у мужчин (нарушение эрекции, например, вследствие сахарного диабета, повреждение спинного мозга, радикальная простатэктомия, психогенная этиология или другие причины) и у женщин путем улучшения притока крови к половым органам, особенно corpus cavernosum, и других расстройств, чувствительных к активности ВК каналов. Более предпочтительно соединения формулы I пригодны для лечения церебральной ишемии/кровоизлияния.
Согласно еще одному аспекту данное изобретение предусматривает фармацевтические композиции, содержащие, по меньшей мере, одно соединение формулы I в сочетании с фармацевтической добавкой, носителем или разбавителем.
Соединения формулы I могут быть получены различными способами, такими как описанные в примерах, на реакционных схемах, которые могут быть изменены, как это очевидно специалистам. Различные пролекарства соединений формулы I могут быть получены из активного лекарственного вещества формулы II, которое само может быть получено общим способом, описанным в WO 98/04135 и в примере 1, и используется в качестве исходного вещества при осуществлении способов, проиллюстрированных реакционными схемами 1-5 (см. в конце описания).
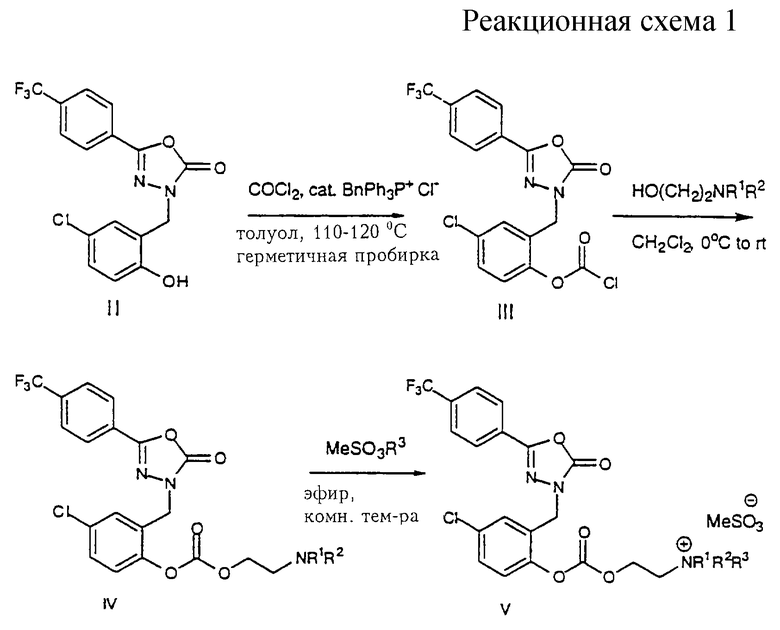
Получение производных 1, 3, 4-оксадиазол-2-(3Н)-она формулы V показано на реакционной схеме 1. Соединения формулы II обрабатывают фосгеном и каталитическим количеством реагента перехода фаз, например бензилтрифенилфосфонийхлорида, в толуоле и нагревают в герметичной пробирке с получением хлорформиата формулы III, который затем обрабатывают замещенным N, N-диалкиламиноспирта в инертном органическом растворителе, например метиленхлориде, с получением карбонатов формулы IV. Когда желательно получить соединения формулы V, аминосоединение формулы IV подвергают кватернизации при помощи метилирующего агента, такого как метилметансульфонат, с получением четвертичного амина формулы V обычными способами, хорошо известными специалисту.
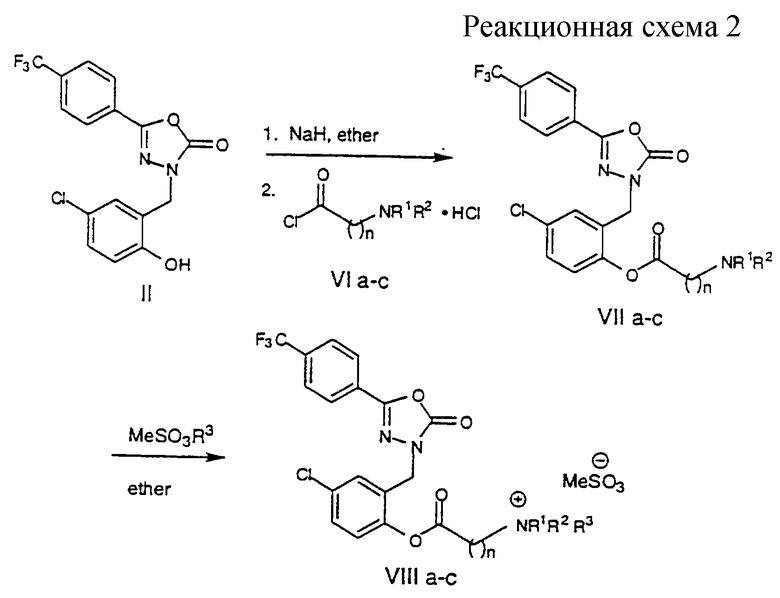
Когда желательно получить соединения формулы VIII, где n равно 1-4, соединения формулы II депротонируют основанием, например гидридом натрия, и затем ацилируют желательным хлорангидридом N, N-диалкиламинокислоты с получением сложного эфира формулы VII, которое кватернизируют алкилирующим агентом, таким как метилметансульфонат, с получением четвертичного амина формулы VIII.
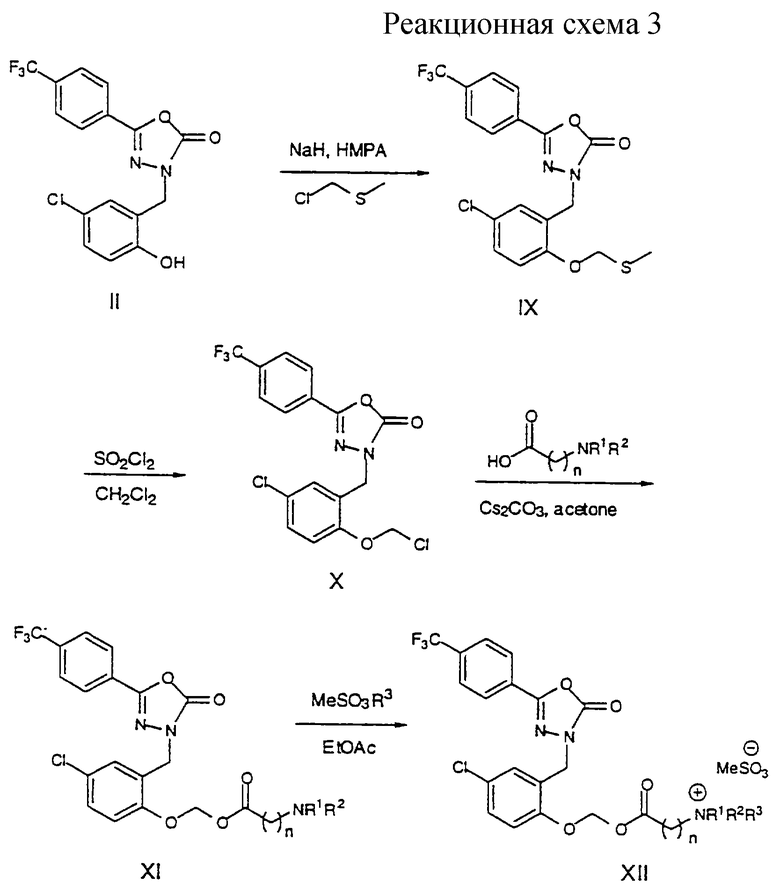
Получение соединений формулы XII показано на реакционной схеме 3, где R1, R2, R3 и n указаны в этом описании. Соединение формулы II депротонируют основанием, например гидридом натрия, и затем алкилируют хлорметилметилсульфидом с получением тиометилметилового эфира формулы IX. Обработка соединения формулы IX хлорирующим агентом, например сульфурилхлоридом, приводит к получению хлорметилового эфира формулы X, которое затем обрабатывают нужной N, N-диалкиламинокислотой в присутствии основания, например карбоната цезия, с получением соответствующего метоксиэфира формулы XI. Когда желательно получить соединения формулы XII, амин формулы XI кватернизируют метилирующим агентом, например метилметансульфонатом, с получением четвертичного амина формулы XII.
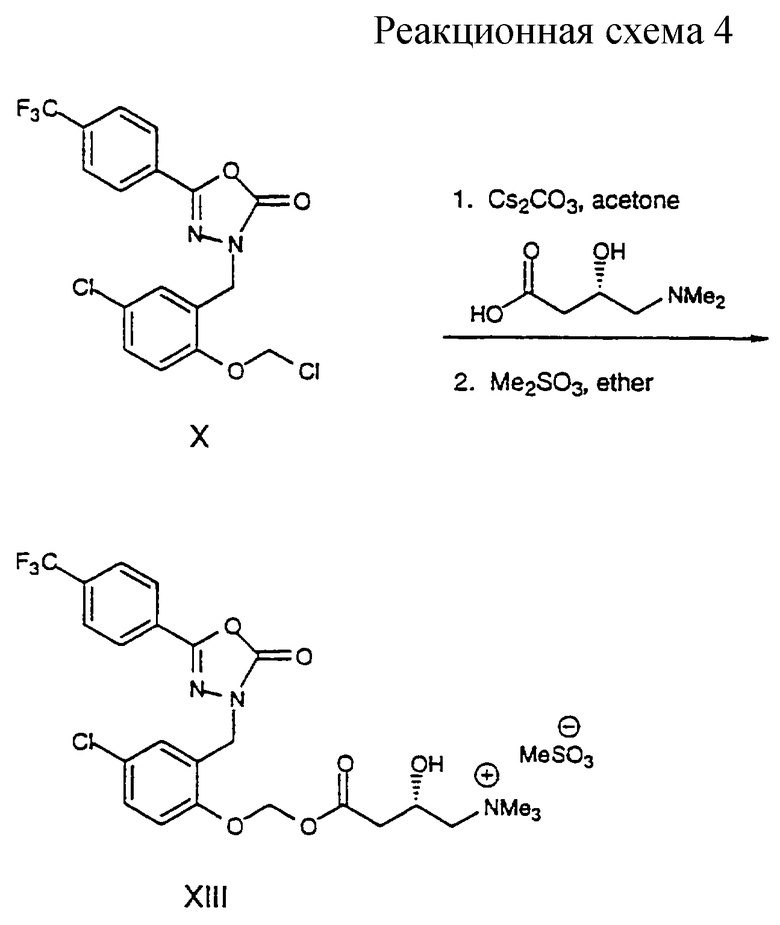
Получение соединения формулы XIII легко осуществляют обработкой хлорметилового эфира формулы Х камитином в присутствии основания, например карбоната цезия, и затем обработкой полученного продукта метилирующим агентом, например, метилметансульфонатом, с получением четвертичного амина формулы XIII.
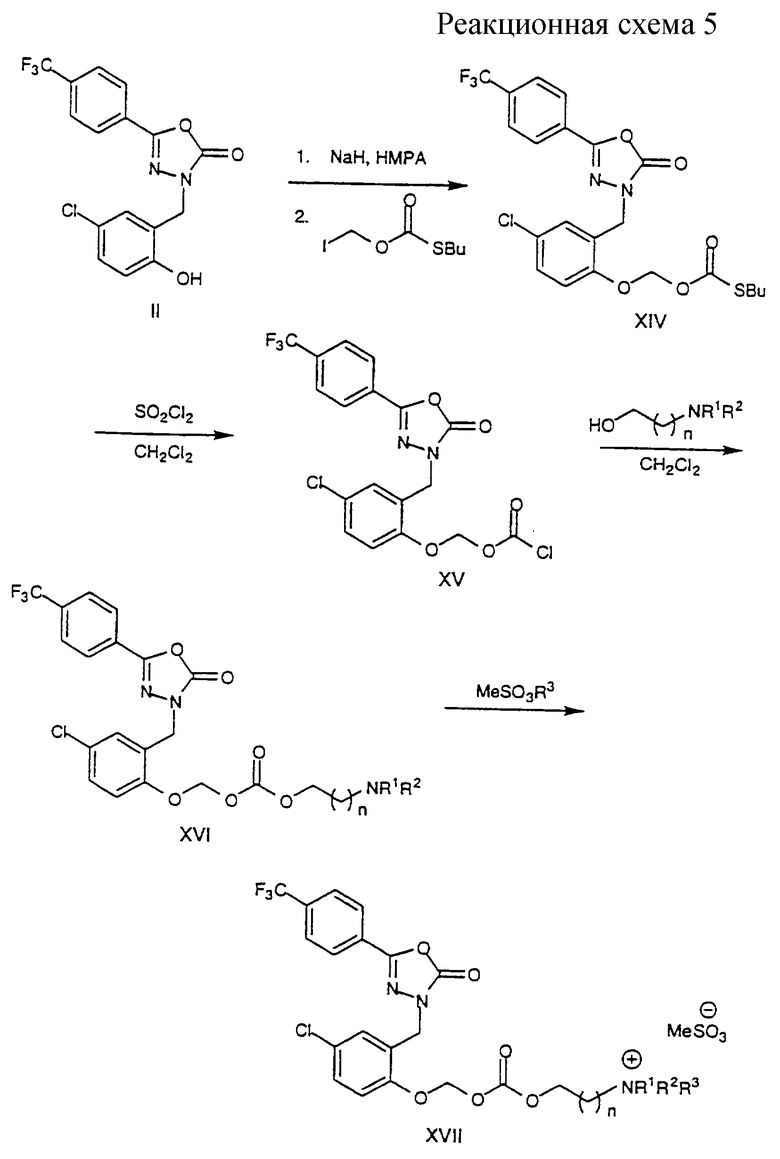
Получение соединений формулы XVII показано на схеме 5, где R1, R2, R3 и n указаны выше. Соединение формулы II депротонируют основанием, например гидридом натрия, и затем алкилируют иодметилбутилкарбононотиоатом с получением метокситиокарбоната формулы XIV. Обработка промежуточного соединения формулы XIV хлорирующим агентом, например сульфурилхлоридом, приводит к получению хлорформиата формулы XV, которое затем обрабатывают соответствующим N, N-диалкиламиноспиртом с получением соответствующего метоксикарбоната формулы XVI. Соединения формулы XVI могут затем алкилироваться метилирующим агентом, например метилметансульфонатом, с получением четвертичного амина формулы XVII.
Согласно предпочтительному варианту изобретения соединения формулы I имеют формулу Iа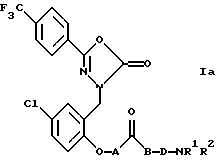
где А обозначает простую связь или -СН2О-; В обозначает простую связь или кислород; D обозначает -(СН2)n- или -СН2СНОНСН2-, где n=1-4; и R1 и R2 обозначают водород или С1-4 алкил; или являются нетоксичными фармацевтически приемлемыми солью или сольватом этих соединений. Более предпочтительно, когда А обозначает простую связь или -СН2О-; В обозначает простую связь; D обозначает -(СН2)n, где n равно 1, 2 или 3; и R1 и R2 обозначают метил или этил. Наиболее предпочтительно, когда А обозначает -СН2О-; В обозначает простую связь; D обозначает -(СН2)n-, где n равно 2 или 3; и R1 и R2 обозначают метил, или нетоксичные фармацевтически приемлемые соль или сольват этих соединений.
Согласно другому предпочтительному варианту соединения формулы I имеют формулу Ib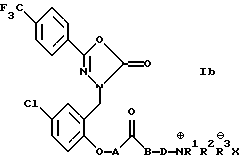
где А обозначает простую связь или -СН2О-; В обозначает простую связь или кислород; D обозначает -(СН2)n- или -СH2СНОНСН2-, где n равно 1-4; R1, R2 и R3 обозначают водород или C1-4 алкил; и Х обозначает противоион или же представляют собой нетоксичные фармацевтически приемлемые соль или сольват этих соединений. Более предпочтительно, когда А обозначает простую связь или -СН2О-; В обозначает простую связь; D обозначает -(СН2)n-, где n равно 1, 2 или 3; R1, R2 и R3 обозначают метил; и Х обозначает хлор, бром, сульфат, фосфат или метансульфонат. Наиболее предпочтительны соединения, когда А обозначает -СН2О-; В обозначает простую связь; D обозначает -(СН2)n, где n равно 3; R1, R2 и R3 обозначают метил; и Х обозначает метансульфонат или нетоксичные фармацевтически приемлемые соль или сольват этих соединений.
Согласно еще одному аспекту данное изобретение включает фармацевтические композиции, содержащие, по меньшей мере, одно соединение формулы I в сочетании с добавкой, носителем или разбавителем.
Согласно еще одному аспекту данное изобретение относится к способу лечения или профилактики расстройств, вызванных открытием калиевых каналов у млекопитающего, нуждающегося в этом, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы I или его нетоксичных фармацевтически приемлемых соли, сольвата или гидрата.
Согласно еще одному аспекту данное изобретение относится к способу лечения ишемии, конвульсий, эпилепсии, астмы, синдрома воспаленной кишки, мигрени, травматического повреждения головного мозга, повреждения спинного мозга, полового расстройства у мужчин и женщин, недержания мочи и особенно кровоизлияния у млекопитающего, которое нуждается в этом, который включает введение указанному млекопитающему терапевтически эффективного количества соединения формулы I или его нетоксичных фармацевтически приемлемых соли, сольвата или гидрата.
Биологическая активность
Калиевые (К+) каналы являются структурно и функционально разнообразными К+-селективными белками, которые повсеместно находятся в клетках, играя центральную роль в регулировании ряда ключевых функций клеток [Rudy В., Neuroscience, 25, pp. 729-249 (1988)]. Будучи широко распространены как класс К+ каналы дифференциально распределены как индивидуальные члены этого класса или как семейства [Gehlert, D.R., Neuroscience, 52, pp. 191-205 (1993)]. В общем активизация К+ каналов в клетках и особенно в возбуждаемых клетках, таких как нейроны и мускульные клетки, приводит к гиперполяризации клеточной мембраны или в случае деполяризованных клеток к реполяризации. Помимо действия в качестве вольт-кламма эндогенной мембраны K+ каналы могут отвечать на важные явления в клетках, такие как изменения внутриклеточной концентрации АТФ или внутриклеточной концентрации кальция [Са2+]. Центральная роль К+ каналов в регулировании многочисленных функций клетки делает их особенно важными мишенями для терапевтического вмешательства [Cook, N.S., Potassium channels: structure, classification, function and therapeutic potential. Ellis Horwood, Chinchester (1990)]. Один класс К+ каналов, активированных кальцием K+ каналов (ВК или ВК каналов), с высокой проводимостью регулирует траисмембранным напряжением, внутриклеточным Са2+ и рядом других факторов, таких как состояние фосфорилирования канального белка [Latorre, R. et al. , Ann. Rev. Physiol., 51, pp. 385-399 (1989)]. Высокая проводимость единичного канала (обычно > 150 пСм) и высокая степень специфичности для К+ ВК каналов показывает, что небольшое число каналов могут глубоко влиять на проводимость мембраны и возбуждаемость клеток. Кроме того, возрастание вероятности открытия с увеличением внутриклеточного Са2+ свидетельствует о вовлечении ВК каналов в модуляцию явлений, зависимых от Са2+, таких как секреция и сокращение мускулов [Asano M., et al., J. Pharmacol. Exp. Ther., 267, pp. 1277-1285 (1993)].
Открыватели ВК каналов проявляют свои клеточные эффекты путем увеличения вероятности открытия этих каналов [McKay, M.C., et al., J. NeurophysioL, 71, pp. 1873-1882 (1994)]; Olesen S-P., Exp. Opin. Invest. Drugs, 3, pp. 1181-1188 (1994)] . Это увеличение открытия индивидуальных ВК каналов приводит к гиперполяризации клеточных мембран, особенно в деполяризованных клетках, вызванной значительным увеличением проводимости всей клетки, опосредованной ВК.
Способность соединения по Примеру 1 открывать ВК каналы и повышать внешние токи всей клетки, опосредованные ВК, оценивали в условиях фиксации напряжения путем определения способности увеличивать внешний ток, опосредованный ВК у клонального млекопитающего (mSlo или hSlo), гетерогенно выраженный в ооцитах Xenopus [Butle r, A., et al., Sience, 261, pp. 221-224 (1993); Dworetzky, S.I., et al., Mol. Brain Res., 27, pp. 189-193 (1994)].
Два используемых ВК анаболита представляют собой почти структурно идентичные гомологические протеины и оказались фармакологически идентичными в наших опытах. Для изоляции ВК тока от естественного (не ВК) тока использовался специфический и сильнодействующий блокирующий ВК каналы токсин ибериотоксин (IBTX) [Galvez, A. , et al., J. Biol. Chem., 265, pp. 11083-11090 (1990)] в сверхмаксимальной концентрации (50 нМ). Относительный вклад тока в ВК каналах в общий ток определяли путем вычитания тока, остающегося в присутствии IBTX (не ток ВК), из профилей тока, полученного во всех других условиях опыта (контроль, лекарство и промывка). Было определено, что при испытуемой концентрации профилируемое соединение не влияло на не ВК естественные токи в ооцитах. Соединение по Примеру 1 b, по меньшей мере, 5 ооцитах при концентрации 1 мкМ увеличивало ВК ток до 126% от контрольного, чувствительного к IВТХ тока. Затем осуществлялись с применением стандартной методики фиксации напряжения с двумя электродами [Stuhmer, W., et al., Methods in Enzymology, 207, pp. 319-339 (1992)] ; протоколы вольт-кламма содержали стадию деполяризаций продолжительностью 500-750 мс от удерживающего потенциала -60 до +140 мВ скачками в 20 мВ. Среда во время эксперимента (модифицированный раствор Barth) состояла из (в мМ): NaCI (88), NаНСО3 (2,4), КС1 (1,0), HEPES (10), MgSO4, (0,82) Са(NO3)2 (0,33), СаС12(0,41); рН 7,5.
Быстрый скрининг для определения способности пролекарств к гидролизу и высвобождению лекарства (соединение по Примеру 1) проводили следующим образом. Исходный раствор (1 мг/мл) пролекарства приготавливают в дистиллированной воде или ацетонитрил или ПЭГ-400. Плазма крови крысы или человека используется в этом опыте. К 1 мл плазмы при 370С добавляют 10 мкл исходного раствора пролекарства и слегка перемешивают. Сразу же после смешения удаляют 100 мкл плазмы и добавляют 300 мкл ацетонитрила (образец нулевого времени). Образцы отбирают также через 30 мин и немедленно блокируют. Блокированные образцы центрифугируют с получением чистого супернатанта для анализа. Исходный раствор и образцы Т=0 и Т=30 анализировали методом ЖХВР, что позволяет отделить лекарство от пролекарства. На основе сравнительных площадей пика лекарства от пролекарства в этих образцах различные пролекарства характеризуются как быстро, умеренно и медленно высвобождающие агенты. Например, в этой модели соединение по Примеру 13 растворяли в ПЭГ-400 с концентрацией 1 мг/мл и инкубировали при 10 мг/мл в свежей плазме крысы при 37oС. Анализ раствора через 5 мин после инкубации показал превращение соединения по Примеру 13 в соединение Примера 1.
Для определения способности соединений по изобретению уменьшать потерю клеток, возникающую вследствие нейронной ишемии, индуцировали обычную очаговую церебральную ишемию путем перманентной окклюзии левой средней церебральной артерии (МСА) и обычной сонной артерии (ССА) с одночасовой окклюзией правой ССА у крысы Wistar. Хирургическое вмешательство осуществляют, применяя подход A. Tamura et a1. , J. Cereb. Blood Flow Metab., 1, pp. 53-60 (1981) и его модификации [К. Osborne et al., J. Neurol. Neurosurg. Psychiatry, 50, pp. 402-410 (487) и S. Menzies, et al., Neurosurgery, 31, pp. 100-107 (1992)].
Соединение по Примеру 13 испытывали в очаговой модели удара, включающей перманентную окклюзию левой МСА (МСМО) и ССА (ССАО) и временную окклюзию правой ССА у крысы Wistar. Эта процедура приводит к обширному неокортикальному инфаркту, который измеряется посредством исключения красителя в серийных срезах мозга через 24 ч после МСАО. В данном опыте соединения вводили внутривенно или внутрибрюшинно, но через 2 часа после окклюзии. Например, в этой модели соединение по Примеру 13 значительно уменьшало объем кортикального инфаркта примерно на 17% при внутривенном введении (1 мг/кг) в виде единичного болюса через 2 ч после окклюзии средней церебральной артерии по сравнению с контрольным обработанным носителем (водой).
Результаты вышеописанных испытаний in vitro и in vivo показывают, что новые 1, 3, 4-оксадиазол-2(3Н)-оны по изобретению пригодны для лечения расстройств у человека, возникающих вследствие дисфункции поляризации и проводимости клеточной мембраны, и предпочтительно показаны для лечения ишемии, кровоизлияния, конвульсий, эпилепсии, астмы, синдрома раздраженной кишки, мигрени, травматического повреждения головного мозга, повреждения спинного мозга, полового расстройства, недержания мочи и других расстройств, чувствительных к активности ВК каналов. Наиболее предпочтительны соединения формулы I при лечении церебральной ишемии/кровоизлияния.
Соединения формулы I или фармацевтические композиции на их основе пригодны при лечении, облегчении или устранении расстройств или других нарушений, связанных с ВК каналами. Такие расстройства включают ишемию, кровоизлияние, конвульсии, эпилепсию, астму, синдром раздраженной кишки, мигрень, травматическое повреждение мозга, повреждение спинного мозга, половое расстройство, недержание мочи и другие нарушения, чувствительные к открывателям калиевых каналов. Для терапевтических целей фармакологически активные соединения формулы I обычно вводят в виде фармацевтической композиции, включающей в качестве активного ингредиента, по меньшей мере, одно такое соединение в сочетании с твердым или жидким фармацевтически приемлемым носителем и необязательно с фармацевтически приемлемыми добавками и эксципиентами с применением обычных стандартных методов.
Фармацевтические композиции включают подходящие дозированные формы для орального, парентерального (включая подкожное, внутримышечное, внутрикожное и внутривенное), бронхиального или назального введения. Таким образом, если используется твердый носитель, препарат может таблетироваться, помещаться в твердую желатиновую капсулу в виде порошка или гранул или быть в виде пастилок или леденцов. Твердый носитель может содержать обычные эксципиенты, такие как связующие, наполнители, смазки, измельчители, смачивающие агенты и т. п. Если желательно, на таблетку может быть нанесено покрытие обычными методами. Если применяется жидкий носитель, препарат может быть в виде сиропа, эмульсии, мягкой желатиновой капсулы, стерильного средства для инъекции, водной и неводной, жидкой суспензии или может быть сухим продуктом для воссоздания водой или другим подходящим носителем перед применением. Жидкие препараты могут содержать обычные добавки, такие как суспендирующие агенты, эмульгаторы, смачивающие агенты, неводные носители (включая съедобные масла), стабилизаторы, а также вкусовые и/или красящие вещества. Для парентерального введения носитель обычно представляет собой стерильную воду, по меньшей мере, большую часть, хотя могут быть использованы солевые растворы, растворы глюкозы и т.п.Суспензии для инъекций также могут быть использованы, в этом случае можно использовать обычные суспендирующие агенты. В парентеральные дозированные формы могут быть также введены обычные стабилизаторы, буферные агенты и т.п.Особенно полезно введение соединения формулы I непосредственно в парентеральные составы. Фармацевтические композиции получают обычными методами, соответствующими желательному препарату, содержащему соответствующие количества активного ингредиента, то есть соединения формулы I согласно изобретению. См., например, Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, PA, 17-th edition, 1985.
Дозировка соединений формулы I с целью достижения терапевтического эффекта будет зависеть не только от таких факторов, как возраст, вес и пол пациента и способ введения, но также от степени желательной активности калиевого канала и действия используемого конкретного соединения в случае конкретного расстройства или болезни. Предполагается также, что метод лечения и дозировка конкретного соединения могут осуществляться с применением единичной дозированной формы и что единичная дозированная форма будет соответственно подобрана специалистом с учетом относительного уровня активности.
Решение о том, как конкретную дозировку следует применять (и сколько раз в день), принимает врач, и оно зависит от конкретных обстоятельств и желательного терапевтического эффекта.
Подходящая доза соединения формулы I или фармацевтической композиции на его основе для млекопитающего, включая человека, страдающего или который может страдать от любого расстройства, описанного выше, составляет 0,1 нг/кг -10 мг/кг веса тела. В случае парентерального введения доза может находиться в интервале 0,1 нг/кг - 1,0 мг/кг веса тела при внутривенном введении. Активный ингредиент предпочтительно вводится непрерывно или равными дозами от одного до четырех раз в день. Однако обычно вводится небольшая доза, и дозировку постепенно увеличивают до тех пор, пока не будет определена оптимальная доза для пациента. Однако ясно, что количество соединения, действительно вводимого пациенту, будет определяться врачом с учетом релевантных обстоятельств, включая вид болезни, выбор вводимого соединения, способ введения, возраст, вес и реакцию индивидуального пациента, а также степень тяжести заболевания.
Нижеследующие примеры приведены для иллюстрации изобретения и их не следует рассматривать как ограничивающие изобретение, возможны различные модификации этого изобретения.
В нижеследующих примерах температура дана в градусах Цельсия. Точки плавления записывались на капиллярном приборе Gallenkamp для определения точки плавления, величины точек плавления не корректировались. Протонный магнитный резонанс (1Н ЯМР) записывался на Bruker AC 300. Все спектры определялись в указанных растворителях, химические сдвиги приведены в единицах d в слабых полях по отношению к внутреннему стандарту тетраметилсилану (TMS), внутрипротонные контакты сочетания указаны в герцах (Hz). Сигналы обозначены следующим образом: s, синглет; d, дублет, t, триплет; q, квартет; m, мультиплет; br, уширенный пик; dd, дублет дублета; bd, уширенный дублет; dt, дублет триплета; bs, уширенный синглет; dq, дублет квартета. Инфракрасные (IR) спектры с применением бромида калия (КВr) снимали на спектрометре Perkin Elmer 781 от 4000 до 400 см -1, калибровали до абсорбции 1601 см -1 полистирольной пленки и они указаны в обратных сантиметрах (см -1). Масс-спектры низкого разрешения (MS) и кажущийся молекулярный (МН+) или (М-Н) - вес определяли на приборе Finnigen TSQ 7000. Масс-спектры высокого разрешения определяли при помощи Kratos MS50 при бомбардировке быстрыми атомами с использованием иодида цезия/глицерина в качестве внутреннего эталона. Данные элементного анализа приведены в % вес.
Следующие примеры иллюстрируют способы получения исходных веществ промежуточных соединений и соединений по изобретению. Специалистам очевидно, что соответствующая подходящая замена исходных материалов и способов, описанных в данном описании, также входит в объем данного изобретения.
Пример 1
3-[(5-Хлор-2-гидроксифенил)метил] -5-[4-(трифторметил)фенил] -1, 3, 4-оксадиазол-2(3Н)-он
Стадия А. 5-[4-(Трифторметил)фенил]-1, 3, 4-оксадиазол-2(3Н)-он.
4-(Трифторметил)бензойной кислоты гидразид (коммерчески доступный от Maybridge Chemicals) (5 г, 24,5 ммоль) растворяют в ТГФ (250 мл)/триэтиламине (2,7 мл, 26 ммол) в атмосфере азота и добавляют 1,1'-карбонилдиимидазол (4,2 г, 26 ммол). Раствор перемешивают в течение 18 ч при 24oС, концентрируют и остаток растворяют в этилацетате, промывают 1N раствором НС1, насыщенным раствором NаНСО3 и соляным раствором перед сушкой (MgSO4). Концентрация приводит к получению 5 г (89%) целевого соединения, образец которого перекристаллизовывают из смеси диэтиловый эфир/гексаны: т.пл. 214-216 oС. MS m/z: 231 (МН+).
IR (KBr) 3280, 1778, 1608, 1420, 1318, 1170, 1114 см -1;
1H ЯМР (DMSO-d6) d 7,87 (2Н, d, J=8,3 Гц), 7,96 (2Н, d, J=8,3 Гц), 12,77 (1H, br.s);
Стадия В. 3-[(5-Хлор-2-метоксифенил)метил]-5-[4-(трифторметил)фенил]-1, 3, 4-оксадиазол-2(3Н)-он
5-[4-(Трифторметил)фенил] -1, 3, 4-оксадиазол-2(3Н)-он(11,75г, 51 ммол), 5-хлор-2-мет-оксибензилбромид [N. Meanwell et.al, Bioorg.Med.Chem.Lett. 6, pp. 1641-1646 (1996)] (12,0 г, 51 ммоль) и 11,2 г (81 ммоль) карбоната калия добавляют к CH3CN (300 мл) в атмосфере азота и добавляют йодистый калий (0,2 г, 1,2 ммоль). Раствор кипятят с обратным холодильником в течение 16 ч, охлаждают, выливают в воду (1500 мл) и энергично перемешивают. Осадок отфильтровывают с получением твердого вещества, которое перекристаллизовывают из СН3СN, получая 15,2 г (78%) целевого соединения:
Т.пл. 144-145oС. MS(ESI) m/z 385 (МН+).
IR (KBr) 3440, 1782, 1492, 1324, 1248, 1168 см 1;
1H ЯМР (300 MHz, DMSO) d 3,79 (3H, s), 4,91 (2H, s), 7,07 (1H, d, J=8,8 Гц), 7,35-7,38 (2H, m), 7,88 (2H, d, J=8,4 Гц), 7,96 (2Н d, J=8,2 Гц);
Вычислено для C17H12ClF3N2O3 0,1•Н2О: С, 52,81; Н, 3,19; N, 7,25.
Найдено: С, 53,03; Н, 3,20; N, 7,31.
Стадия С. 3-[(5-Хлор-2-гидроксифенил)метил]-5-[4-(трифторметил)фенил]-1,3,4-оксадиазол-2(3Н)-он.
3-[(5-Хлор-2-метоксифенил)метил] -5-[4-(трифторметил)фенил] -1, 3, 4-оксадиазол-2(3Н)-он (15,2 г, 39,6 ммоль) смешивают с гидрохлоридом пиридина (19,7 г, 0,17 моль) и нагревают при 225oС в течение 2 ч. Горячий раствор выливают в 800 мл 1N HCI и перемешивают смесь в течение 10 мин. Собирают твердое вещество, промывают 1N HCI и сушат при 80oС под вакуумом с получением 13,1 г очень светлого твердого вещества. После перекристаллизации из ацетонитрила получают 10,8 г целевого продукта в виде пушистых иголок, т.пл. 217-218oС. MS m/z: 371 (МН+).
IR (КВr) 3354, 1762, 1500, 1324, 1068 см-1;
1H ЯМР (DMSO-d6) d 4,98 (2Н, s), 6,84 (1H, d, J=8,7 Гц), 7,20 (1H, dd, J= 8,7 Гц, 2,6 Гц), 7,30 (1H, d, J=2,5 Гц), 7,89 (2Н d, J=8,6 Гц); 7,97 (1H, d, J=8,6 Гц), 10,11 (1H, br.s).
Вычислено для C16H10ClF3N2O3: С, 51,84; Н, 2,72; N, 7,56.
Найдено: С, 51,88; Н, 2,58; N, 7,57.
Пример 2
3-[[5-Хлор-2-[[[[2-диметиламино)этил] окси] карбонил]окси]фенил]метил]-5-[4-(трифтор-метил)фенил]-1, 3, 4-оксадиазол-2(3Н)-он
Стадия А. 4-Хлор-2-[[5-[4-(трифторметил)фенил]-2,3-дигидро-2-оксо-1, 3, 4-оксадиазол-3-ил] метил ]фенилхлорформиат
Перемешиваемую суспензию 3-[(5-хлор-2-гидроксифенил)метил] -5-[4-(трифторметил)-фенил] -1, 3, 4-оксадиазол-2(3Н)-она (1 г, 2,69 ммоль) и ВnРh3РСl (25 мг) в 1,9 М растворе фосгена в толуоле (15 мл) нагревают при 120oС в течение ночи в герметичной пробирке. После удаления избытка фосгена толуольный раствор выпаривают в роторном испарителе досуха, получая целевой хлорформиат в виде белого полутвердого вещества (1,18 г).
Стадия В. 3-[[5-Хлор-2-[[[[2-(диметиламино)этил]окси]карбонил]окси]фенил]метил]-5-[4-(трифторметил)фенил]-1, 3, 4-оксадиазол-2(3Н)-он
К перемешиваемому холодному (0oС) раствору хлорформиата со стадии А (0,6 г, 0,15 ммоль) в безводном CH2Cl2 (5 мл) по каплям добавляют чистый 2-(диметиламино)этанол (0,41 г, 0,45 ммоль). Полученной смеси дают нагреться до комнатной температуры и выдерживают 2-3 ч. Метиленхлорид выпаривают в роторном испарителе при комнатной температуре и остаток разделяют между простым эфиром и 5% NаНСО3. Эфирный слой отделяют и промывают соляным раствором и затем сушат (MgSO4). Выпаривание растворителя приводит к получению продукта в виде светло-желтого масла (0,613 г). Реакция сырого продукта с безводным НС1 в среде эфира обеспечивает получение соответствующей гидрохлоридной соли 3-[[5-хлор-2-[[[[2-(диметиламино)-этил]окси]карбонил]окси]фенил]метил] -5-[4-(трифторметил)фенил]-1, 3, 4-оксадиазол-2(3Н)-она. Т.пл. 160-163oС; MS m/z: 486 (МН+).
Пример 3
2-[[[[4-хлор-2-[[5-[4-(трифторметил)фенил] -2, 3-дигидро-2-оксо-1, 3, 4-оксадиазол-3-ил ] метил ] фенокси ] карбонил ] окси ] этил]триметиламмонийметансульфонат
Сырой 3-[[5-хлор-2-[[[[2-(диметиламино)этил] окси] карбонил]окси]фенил] метил]-5-[4-три-фторметил)фенил]-1,3,4-оксадиазол-2(3Н)-он растворяют в смеси 1:1 эфир-этилацетат и добавляют чистый метилметансульфонат (2 экв). Смесь перемешивают в течение ночи при комнатной температуре. Осажденное твердое вещество отделяют фильтрацией, промывают эфиром и сушат в вакууме, получая целевое соединение в виде белого твердого вещества.
Т.пл. 190-195oС (разл.).
IR (КВr, см -1) 1193, 1318, 1765, 1777;
1H ЯМР (CDCl3) d 2,76 (s, 3H), 3,51 (s, 9H), 4,19 (m, 2H), 4,75 (m, 2H), 4,89 (s, 2H), 7,17 (d, J=8,6 Гц, 1H), 7,25 (s, 1H), 7,38 (dd, J=8,6 и 2,5 Гц, 1Н), 7,54 (d, J=2,5 Гц, 1H), 7,71 (d, J=8,4 Гц, 1H), 7,91 (d, J=8,1 Гц, 1H); MS m/z: 500 (MH+).
Общая методика синтеза в Примерах 4-11.
Ниже описана общая методика, используемая для получения соединений формулы VII а-с и VIII а-с, которая отражена на схеме 2. Хлорангидриды кислоты формулы VI а-с были получены взаимодействием соответствующих кислот с оксалилхлоридом и каталитическим количеством ДМФ в метиленхлориде. Хлорангидриды кислот формулы VIa-c выделяют в виде гидрохлоридной соли и используют без дальнейшей очистки. К перемешиваемой суспензии соединения по Примеру 1 (1 экв. ) и NaH (2 экв.) в безводном эфире добавляют соответствующий хлорангидрид кислоты формулы VI (1,2 экв.) и перемешивают смесь в течение 3-4 ч. Реакционную смесь разбавляют эфиром и этилацетатом, промывают 5% NаНСО3, водой, соляным раствором и затем сушат (MgSO4). Растворители выпаривают в роторном испарителе и остаток перекристаллизовывают из смеси эфир-гексаны с получением соединения формулы VIIa-c. К раствору соединения формулы VII а-с в смеси 1:1 эфир-этилацетат добавляют чистый метилметансульфонат и перемешивают смесь в течение ночи при комнатной температуре. Осажденное белое твердое вещество отфильтровывают, промывают эфиром и затем сушат в вакууме с получением соответствующего чистого соединения формулы VIII а-с.
Пример 4
4-Хлор-2-[[5-[4-(трифторметил)фенил] -2, 3-дигидро-2-оксо-1, 3, 4-оксадиазол-3-ил]-метил]фенил(диметиламино)ацетат (VIIa, n=l)
Т.пл. 112-113oС; MS m/z: 456 (МН+).
Вычислено для С20Н17С1F3N3O4: С, 52,70; Н, 3,76; N, 9,22. Найдено: С, 52,51; Н, 3,66; N, 9,10.
Пример 5
4-Хлор-2-[[5-[4-(трифторметил)фенил] -2,3-дигидро-2-оксо-1,3,4-оксадиазол-3-ил]-метил]фенил-3-(диметиламино)пропионат (VIIb, n=2).
Т.пл. 179-181oС; MS m/z: 498 (MH+).
Вычислено для С23Н23ClF3N3O4•HСl: С, 51,70; Н, 4,53; N, 8,86. Найдено: С, 51,46; Н, 4,67; N, 7,71.
Пример 6
4-Хлор-2-[[5-[4-(трифторметил)фенил]-2, 3-дигидро-2-оксо-1, 3, 4-оксадиазол-3-ил]-метил]фенил-4-(диметиламино)бутират (VIIc, n=3).
Т.пл. 162-164oС.
Вычислено для C22H21ClF3N3O4• HCl: С, 50,78; Н, 4,26; N, 8,08.
Найдено: С, 49,51; Н, 4,35; N, 7,80.
Пример 7
[[[4-Хлор-2-[[5-[4-(трифторметил)фенил]-2,3-дигидро-2-оксо-1, 3, 4-оксадиазол-3-ил] -метил ] фенокси]карбонил]метил]триметиламмонийметансульфонат (VIIIa, n=1).
Т.пл. 230-232oС; MS т/z: 470 (МН+).
Вычислено для С21H20ClF3N3O4• CH3SO4: С, 46,69; Н, 4,10; N, 7,42. Найдено: С, 46,06; Н, 4,06; N, 7,21.
Пример 8
2-[[[4-Хлор-2-[[5-[4-(трифторметил)фенил]-2, 3-дигидро-2-оксо-1, 3, 4-оксадиазол-3-ил] - метил] фенокси]карбонил]этил]диэтилметиламмонийметансульфонат (VIII b, n=2)
Т.пл. > 260oС.
Пример 9
3-[[[4-Хлор-2-[[5-[4-(трифторметил)фенил] -2, 3-дигидро-2-оксо-1, 3, 4- оксадиазол-3-ил] -2 метил]фенокси]карбонил]пропил]триметиламмонийметансульфонат (VIII с, n=3)
Т.пл. >260oС; MS m/z: 498 (МН+).
Вычислено для С23Н24СlF3N3О4 •СН3SО3: С, 48,53; Н, 4,58; N, 7,07.
Найдено: С, 48,61; Н, 4,58; N, 7,03.
Пример 10
4-Хлор-2-[[5-[4-(трифторметил)фенил]-2, 3-дигидро-2-оксо-1, 3, 4-оксадиазол-3-ил]-метил] фенил (метиламино) ацетат
Т.пл. 186-188oС (разл).
Пример 11
4-Хлор-2-[[5-[4-(трифторметил)фенил]-2, 3-дигидро-2-оксо-1, 3, 4-оксадиазол-3-ил]-метил]фенил-3-аминопропионат
Т.пл. 184-185oС (разл).
Пример 12
[4-Хлор-2-[[5-[4-(трифторметил)фенил] -2, 3-дигидро-2-оксо-1, 3, 4-оксадиазол-3-ил]-метил]фенокси]метил-4-(диметиламино)бутират (XI с, n=3)
Стадия А. 3-[[5-хлор-2-(метилтиометокси)фенил]метил]-5-[4-(трифторметил) фенил]-1, 3, 4-оксадиазол-2(3Н)-он (IX)
Раствор 3-[5-хлор-2-гидроксифенил)метил]-5-[4-(трифторметил)фенил]-1, 3, 4-оксадиазол-2(3Н)-она (6,0 г, 16,2 ммоль) в сухом НРМА (50 мл) добавляют по каплям в атмосфере азота к перемешиваемой суспензии гидрида натрия (0,77 г 60% дисперсии в минеральном масле, 19,4 ммоль) в НМРА (15 мл). Полученный желтый раствор перемешивают 30 мин и затем по каплям добавляют чистый хлорметилметилсульфид (1,49 мл, 17,8 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи и экстрагируют продукт этилацетатом (500 мл). Слой этилацетата промывают насыщенным раствором NаНСО3, водой, соляным раствором и затем сушат (MgSO4). Испарение этилацетата в роторном испарителе приводит к получению желтого полутвердого вещества, которое после перекристаллизации из смеси этилацетат/гексаны позволяет получить целевой продукт в виде белых кристаллов (4,4 г, 70%).
1H ЯМР (СDС13) d 2,28 (s, 3Н), 5,00 (s, 2H), 5,22 (s, 2H), 6,92 (d, J= 8,5 Гц, 1H), 7,3 (m, 2H), 7,74 (d, J=8,4 Гц, 2H), 7,96 (d, J=8,3 Гц, 2Н);
IR (KBr, см-1) 1779, 1608, 1494, 1328, 1238, 1176, 1126.
Вычислено для С18Н14СlF3N2О3S: С, 50,18; Н, 3,28; N, 6,50. Найдено: С, 50,19; Н, 3,32; N, 6,52.
Стадия В. 3-[[5-Хлор-2-(хлорметокси)фенил]метил]-5-[4-(трифторметил)фенил]-1, 3, 4-оксадиазол-2(3Н)-он (X)
Чистый сульфурилхлорид (0,78 мл, 9,75 ммоль) добавляют по каплям к перемешиваемому раствору соединения, полученного на стадии А (3,5 г, 8,12 ммоль), в метиленхлориде (40 мл) в атмосфере азота. Реакционную смесь перемешивают 4 ч при комнатной температуре. ТСХ показывает завершение реакции. После удаления избытка реагента и метиленхлорида в роторном испарителе продукт сушат под вакуумом с получением целевого продукта в виде очень светлого вещества (3,4 г, 100%).
MS m/z: 419 (МН+).
1H ЯМР (CDCl3) d 5,0 (s, 2H), 5,94 (s, 2H), 7,18 (d, J=9,2 Гц, 1H), 7,38 (m, 2H), 7,74 (d, J=8,4 Гц, 2H), 7,96 (d, J=8,3 Гц, 2Н);
IR (KBr, см-1) 1773, 1611, 1572, 1487, 1325, 1163, 1128.
Вычислено для С17Н11Сl2F3N2О3• 0,25 Н2О: С, 48,19; Н, 2,76; N, 6,61.
Найдено: С, 48,04; Н, 2,68; N, 6,53.
Стадия С. [4-Хлор-2-[[5-[4-(трифторметил)фенил]-2,3-дигидро-2-оксо-1, 3, 4-окса-диазол-3-ил]метил]фенокси]метил-4-(диметиламино)бутират (ХIс,n=3)
Хлорметоксипроизводное со cтадии В (0,8 г, 1,91 ммоль) добавляют к перемешиваемой суспензии Cs2CO3 (1,306 г, 4,01 ммоль) и 4-(диметиламино)масляной кислоты гидрохлорида (0,352 г, 2,1 ммоль) в ацетоне (20 мл). Реакционную смесь перемешивают при комнатной температуре в течение ночи. ТСХ показывает завершение реакции. Ацетон выпаривают в роторном испарителе и добавляют соляной раствор. Фильтрацией отделяют желтый осадок, промывают его водой и сушат воздухом. Сырой твердый продукт перекристаллизовывают из смеси этилацетат/гексаны и получают целевое соединение XI с в виде белого твердого вещества (0,64 г, 65%).
Т.пл. 115-117oС;
1H ЯМР (DMSO-d6) d 1,49 (m, 2H), 2,02 (t, J=7,0 Гц, 2Н), 2,25 (t, J=7,3 Гц, 2H), 3,32 (s, 6Н), 4,92 (s, 2H), 5,79 (s, 2H), 7,24 (d, J=8,8 Гц, 1Н); 7,43 (dd, J= 2,6, 8,8 Гц, 1Н), 7,50 (d, J=2,6 Гц, 1Н), 7,90 (d, J=8,5 Гц, 2H), 7,98 (d, J=8,3 Гц, 2Н).
IR (KBr, см -1) 1776, 1764, 1607, 1492, 1416, 1324, 1121.
Вычислено для С23Н23СlF3N3О5• 0,5H2O: С, 52,83; Н, 4,63; N, 8,04.
Найдено: С, 53,00; Н, 4,70; N, 8,04.
Пример 13.
3-[[[[4-Хлор-2-[[5-[4-(трифторметил)фенил] -2, 3-дигидро-2-оксо-1, 3, 4-оксадиазол-3-ил] -метил ] фенокси]метокси]карбонил] пропил ]триметиламмонийметансульфонат (ХIIс, n=3).
Соединение Примера 12 (XIc) (0,95 г, 1,85 ммоль) растворяют в этилацетате (10 мл) и по каплям добавляют чистый метилметансульфонат (0,32 мл, 3,7 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Собирают белый осадок и очищают тритурированием эфиром, получая целевое соединение в виде белого вещества (0,95 г, 82%). После перекристаллизации из смеси этанол/эфир получают белые кристаллы.
Т.пл. 156-158oC; MS m/z: 528 (МН+).
1H ЯМР (DMSO-d6) d 1,91 (m, 2H), 2,27 (s, 3H), 2,43 (t, J=7,1 Гц, 2Н), 3,01 (s, 9H), 3,22 (m, 2H), 4,91 (s, 2H), 5,81 (s, 2H), 7,24 (d, J=8,9 Гц, 1Н); 7,43 (dd, J=2,7, 8,8 Гц, 1Н), 7,49 (d, J=2,6 Гц, 1Н), 7,90 (d, J=8,5 Гц, 2H), 7,98 (d, J=8,4 Гц, 2H).
Вычислено для С24Н26С1F3N3O5•СН3SO3: С, 48,12; Н, 4,68; N, 6,73.
Найдено: С, 48,15; Н, 4,74; N, 6,71.
Пример 14
[[[[4-Хлор-2-[[5-[4-(трифторметил) фенил ] -2, 3-дигидро-2-оксо-1, 3, 4-оксадиазол-3-ил] -метил] фенокси] метокси] карбонил] метил] триметиламмонийметансульфонат (ХIIа, n=1).
К смеси соединения Х из Примера 12, стадия В (0,4 г, 0,95 ммоль), Сs2СО3 (0,342 г, 1,05 ммоль) и N, N-метилглицина (0,108 г, 1,05 ммоль) добавляют ацетон. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Ацетон выпаривают в роторном испарителе и затем добавляют соляной раствор. Белый осадок соединения XIa (n=l) собирают, растворяют в ацетонитриле и добавляют чистый метилметансульфонат (0,053 мл). Реакционную смесь перемешивают при комнатной температуре в течение 2 дней. Растворитель выпаривают и добавляют простой эфир. Осадок собирают и очищают перекристаллизацией из смеси ацетонитрил/эфир, получая целевое соединение в виде белого твердого вещества (0,13 г, 23% двухстад.).
Т.пл. 100-104oС; MS m/z: 500 (МН+).
1H ЯМР (DMSO-d6) d 2,27 (s, 3Н), 3,33 (s, 9Н), 4,60 (s, 2H), 5,09 (s, 2H), 5,48 (s, 2H), 7,24 (d, J=8,9 Гц, 1H); 7,52 (dd, J=2,6 Гц, 8,8 Гц, 1Н), 7,60 (d, J=2,6 Гц, 1Н), 7,90 (d, J=8,6 Гц, 2H), 7,97 (d, J=8,3 Гц, 2H).
Вычислено для С22Н22ClF3N3О5• СН3SО3• 1,5Н2О: С, 44,34; Н, 4,53; N, 6,74.
Найдено: С, 44,35; Н, 4,28; N, 6,46.
Пример 15
[4-Хлор-2-[[5-[4-(трифторметил)фенил] -2,3-дигидро-2-оксо-1,3,4-оксадиазол-3-ил] -метил] фенокси]метил-3-(диэтиламино)пропионатагидрохлорид (XI b, n=2)
К смеси соединения Х со cтадии В Примера 12 (0,4 г, 0,95 ммоль), Cs2CO3 (0,622 г, 1,91 ммоль) и 3-(диэтиламино)пропионовой кислоты гидрохлорида (0,108 г, 1,05 ммоль) добавляют ацетон (20 мл). Реакционную смесь перемешивают при комнатной температуре в течение 3 дней. Ацетон выпаривают в роторном испарителе и к остатку добавляют соляной раствор. Осажденное твердое вещество белого цвета (0,38 г, 75%) собирают. К перемешиваемому раствору этого сырого продукта (0,16 г, 0,30 ммоль) в этилацетате добавляют 1N HCI в эфире (0,36 мл, 0,36 ммоль) и выдерживают 3 ч при комнатной температуре. Фильтрацией отделяют гидрохлоридную соль целевого соединения XI b (0,11 г, 64%).
Т.пл. 165-167oС (разл.); MS m/z: 528 (МН+).
1H ЯМР (DMSO-d6) d 1,16 (t, J=7,2 Гц, 6Н), 2,93 (t, J=7,8 Гц, 2Н), 3,01-3,10 (m, 4H), 3,19-3,25 (m, 2Н), 4,93 (s, 2H), 5,84 (s, 2Н), 7,27 (d, J=8,8 Гц, 1Н); 7,44 (dd, J=2,6 Гц, 8,8 Гц, 1Н), 7,51 (d, J=2,6 Гц, 1Н), 7,91 (d, J=8,5 Гц, 2Н), 8,00 (d, J=8,3 Гц, 2H), 10,5 (s, br, 1H).
Вычислено для С24Н25С1F3N3O5• СН3• НСI: С, 51,08; Н, 4,64; N, 7,45.
Найдено: С, 46,94; Н, 4,42; N, 6,76.
Пример 16
3-[[[[4-Хлор-2-[[5-[4-(трифторметил)фенил] -2, 3-дигидро-2-оксо-1, 3, 4-оксадиазол-3-ил] -метил] фенокси] метокси] карбонил]-2-гидроксипропил]-триметиламмоний-метансульфонат (XIII)
К перемешиваемой суспензии соединения Х со cтадии В Примера 12 (0,4 г, 0,95 ммоль) и Сs2СО3 (0,342 г, 1,05 ммоль) в ацетоне (20 мл) добавляют (L)-норкамитин [Colucci, W.J., Tumbull, Jr., S.P., Gandour, R.D., Analytical Biochemistry, 162, pp. 459-462 (1987)] (0,155 г, 1,05 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Ацетон выпаривают в роторном испарителе, добавляют воду и затем осуществляют экстракцию эфиром. Экстракт затем промывают водой, соляным раствором и сушат (MgSO4). Выпаривание эфира приводит к получению желтоватого вспененного твердого вещества, которое растворяют в эфире, и добавляют 0,1 мл метилметансульфоната. Реакционную смесь перемешивают при комнатной температуре в течение ночи. Осажденный твердый продукт собирают и тритурируют смесью этилацетат/эфир с получением целевого соединения в виде очень светлого твердого вещества (0,2 г, 33% двухст.).
Т.пл. 98-101oС; MS m/z: 544 (МН+).
1Н ЯМР (DMSO-d6) d 2,30 (s, 3Н), 2,52-2,58 (m, 2H), 3,10 (s, 9H), 3,34-3,41 (m, 2H), 4,43 (m, 1H), 4.94 (s, 2H), 5,73 (d, J=6,2 Гц, 1H); 5,81 (d, J=5,5 Гц, 1Н), 5,84 (d, J=6,6 Гц, 1Н), 7,27 (d, J=8,8 Гц, 1Н), 7,44 (dd, J= 2,7 Гц, 8,8 Гц, 1H), 7,49 (d, J=2,6 Гц, 1Н), 7.91 (d, J=8,5 Гц, 2Н), 7.99 (d, J=8,3 Гц, 2Н);
IR (KBr, см -1) 3307, 1784, 1751, 1490, 1417, 1324, 1194, 1123, 1065.
Вычислено для C24H26ClF3N3O6• CH3SO3• 0,75H2O: С, 45,95; Н, 4,70; N, 6,43.
Найдено: С, 45,88; Н, 4,69; N, 6,13.
Пример 17
2-[[[[[4-Хлор-2-[[5-[4-(трифторметил)фенил] -2, 3- дигидро-2-оксо -1, 3, 4-оксадиазол-3-ил] -метил] фенокси] метокси]карбонил]окси]этил] триметиламмонийметансульфонат (XVII а, n=1)
Стадия А. 3-[[2-[[[(Бутилтио)карбонил]окси] метокси]-5-хлорфенил] метил] -5-[4-(три-фторметил)фенил]-1, 3, 4-оксадиазол-2(3Н)-он (XIV).
Гидрид натрия (60% в минеральном масле, 144 мг, 3,6 ммоль) добавляют к перемешиваемому холодному (0oС) раствору соединения формулы II (1,11 г, 3 ммоль) в сухом НМРА (6 мл) в атмосфере азота и затем оставляют нагреться до комнатной температуры. Через 30 мин полученный желтый раствор охлаждают до 0oС и затем по каплям добавляют чистый О-иодметил-S-бутилкарбонотиоат [Folkman, M. and Lund,F., Synthesis, pp.1159, (1990)] (1,0 г, 3,6 ммоль). Полученной смеси дают нагреться до комнатной температуры и перемешивают в течение ночи. К реакционной смеси добавляют насыщенный соляной раствор, осажденное белое твердое вещество отфильтровывают, промывают тщательно водой. Влажное твердое вещество растворяют в смеси 1:1:1 этилацетат-метиленхлорид-ТГФ и затем сушат (MgSO4). После фильтрования и выпаривания растворителей получают твердое вещество белого цвета (1,76 г), после перекристаллизации из эфира получают чистый XIV (693 мг, 62%).
Стадия В. [4-Хлор-2-[[5-[4-(трифторметил)фенил]-2, 3- дигидро-2-оксо-1, 3, 4-оксадиазол-3- ил]метил]фенокси]метилхлорформиат (XV)
Чистый сульфурилхлорид (80 мкл, 1 ммоль) добавляют к перемешиваемому раствору соединения со cтадии А (258 мг, 0,5 ммоль) в безводном метиленхлориде (2 мл) в атмосфере азота. Полученную смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь помещают в роторный испаритель и выпаривают при комнатной температуре досуха и затем выдерживают в условиях глубокого вакуума, получают желаемый хлорформиат формулы XV в виде твердого вещества белого цвета (0,23 г).
Стадия С. 3-[[5-Хлор-2-[[[[[2-(диметиламино)этил]окси]карбонил]окси]метокси]фенил]-
метил]-5-[4-(трифторметил)фенил]-1, 3, 4-оксадиазол-2(3Н)-он] (XVI а, n= 1)
Чистый сухой 2-(диметиламино)этанол (134 мг) добавляют к перемешиваемому раствору соединения формулы XV со cтадии В (0,23 г) в безводном метиленхлориде (5 мл) и перемешивают смесь в течение ночи. Реакционную смесь разбавляют CH2Cl2 и затем реакцию обрывают 5% NаНСО3. Органический слой отделяют, промывают водой, соляным раствором и затем сушат (MgSO4). Выпаривание CH2Cl2 приводит к получению целевого соединения в виде светло-желтого масла (0,21 г).
Стадия D. 2-[[[[[4-Хлор-2-[[5-[4-(трифторметил)фенил]-2, 3 -дигидро-2-оксо-1, 3, 4-оксадиазол-3-ил]метил]фенокси]метокси ]карбонил] окси]этил]-триметиламмонийметансульфонат (XVII а, n=1)
Технический продукт со cтадии С (0,2 г) растворяют в смеси 1:1 эфир-этилацетат (5 мл) и обрабатывают метилметансульфонатом (2 экв.). Смесь перемешивают при комнатной температуре в течение ночи и осажденное вещество белого цвета отфильтровывают, промывают эфиром и высушивают в вакууме, получают целевое соединение в виде белого вещества (94 мг). Т.пл. 145-150oС (разл. );
1H ЯМР (CDCl3) d 2,76 (s, 3Н), 3,45 (s, 9Н), 4,16 (m, 2H), 4,71 (m, 2H), 4,96 (s, 2H), 5,79 (s, 2H), 6,98 (d, J=8,4 Гц, IH); 7,31-7,34 (m, 2H), 7,75 (d, J=8,4 Гц, 2H), 7.97 (d, J=8,2 Гц, 2H);
MS m/z: 530 (MH+).
Изобретение относится к производным 1,3,4-оксадиазолота формулы I, где А - простая связь или -СН2О-; В - простая связь или кислород; D - -(СН2)n - или -СН2СНОНСН2-; n = 1 - 4, целое число; R - -NR1R2 или -NR1R2R3X, где Х является противоионом и R1, R2 и R3 каждый независимо - водород или С1-4 алкил, или их фармацевтически приемлемые соли или сольваты. Данное изобретение также предусматривает фармацевтическую композицию и способ лечения или защиты от расстройств, опосредованных открытием активированных кальцием калиевых каналов. 1,3,4-Оксадиазол-2(3Н)-оны пригодны для лечения у человека расстройств, возникающих вследствие дисфункции поляризации и проводимости клеточной мембраны, и предпочтительно показаны для лечения ишемии, кровоизлияния. 3 с. и 13 з.п.ф-лы.
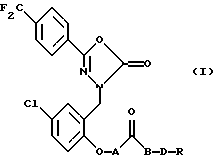
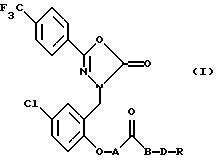
где А - простая связь или -СН2О-;
В - простая связь или кислород;
D - -(СН2)n- или -СН2СНОНСН2-;
n = 1 - 4, целое число;
R - -NR1R2 или -NR1R2R3X, где Х - противоион;
R1, R2 и R3 каждый независимо - водород или С1-4 алкил,
или его нетоксичные фармацевтически приемлемые соль или сольват.
4-хлор-2-[[5-[4-(трифторметил)фенил] -2,3-дигидро-2-оксо-1,3,4-оксадиазол-3-ил] -метил] фенил (диметиламино) ацетат;
4-хлор-2-[[5-[4-(трифторметил)фенил] -2,3-дигидро-2-оксо-1,3,4-оксадиазол-3-ил]-метил]фенил-3-(диметиламино)пропионат;
4-хлор-2-[[5-[4-(трифторметил)фенил] -2,3-дигидро-2-оксо-1,3,4-оксадиазол-3-ил]-метил]фенил-4-(диметиламино)бутират;
[[[4-хлор-2-[[5-[4-(трифторметил)фенил] -2,3-дигидро-2-оксо-1,3,4-оксадиазол-3-ил]метил]фенокси]карбонил]метил]триметиламмонийметансульфонат;
2-[[[4-хлор-2-[[5-[4-(трифторметил)фенил] -2,3-дигидро-2-оксо-1,3,4-оксадиазол-3-ил]метил]фенокси]карбонил]этил]диэтилметиламмонийметансульфонат;
3-[[[4-хлор-2-[[5-[4-(трифторметил)фенил] -2,3-дигидро-2-оксо-1,3,4-оксадиазол-3-ил]метил]фенокси]карбонил]пропил]триметиламмонийметансульфонат;
4-хлор-2-[[5-[4-(трифторметил)фенил] -2,3-дигидро-2-оксо-1,3,4-оксадиазол-3-ил]-метил]фенил(метиламино)ацетат и
4-хлор-2-[[5-[4-(трифторметил)фенил] -2,3-дигидро-2-оксо-1,3,4-оксадиазол-3-ил]-метил]фенил-3-аминопропионат;
или их нетоксичные фармацевтически приемлемые соль, противоион или сольват.
3-[[5-хлор-2-[[[[2-(диметиламино)этил] окси]карбонил]окси]фенил]метил]-5-[4-(трифторметил)фенил]-1,3,4-оксадиазол-2(3Н)-он.
2-[[[[4-хлор-2-[[5-[4-(трифторметил)фенил] -2,3-дигидро-2-оксо-1,3,4-оксадиазол-3-ил] метил] фенокси]карбонил]окси]этил]триметиламмонийметансульфонат,
или их нетоксичные фармацевтически приемлемые соль, противоион или сольват.
Приоритет по пунктам и признакам:
29.01.1998 по п.1 для случаев, когда D - -(CH2)n, по пп.2-8 и 13;
29.09.1998 по п.1 для случаев, когда D - -CH2CHOHCH2, по пп.9-12.
| RU 94042230, A1, 20.11.1996 | |||
| Способ получения на волокне оливково-зеленой окраски путем образования никелевого лака азокрасителя | 1920 |
|
SU57A1 |
Авторы
Даты
2003-04-20—Публикация
1999-01-15—Подача