Изобретение относится к области медицины и может быть использовано в иммунологии, в частности, для профилактики и лечения гнойно-септических заболеваний.
Известна стафило-протейно-псевдомонас вакцина (1), содержащая комплекс водорастворимых поверхностных антигенов, извлеченных из штаммов стафилококка, мирабельного протея и шести штаммов синегнойной палочки.
Однако она не предусматривает применения в профилактических целях и предназначена только для лечения неспецифических воспалительных заболеваний органов дыхания. При этом, ввиду низкой антигенности используемых компонентов, упомянутая вакцина требует многократности введения для достижения желаемого терапевтического эффекта, а потому не находит широкого применения.
Наиболее близкой из известных к описываемому изобретению является вакцина для профилактики инфекций, вызываемых условно-патогенными возбудителями (2), на основе антигенов условно-патогенных микроорганизмов. Известная стафило-протейно-синегнойная ассоциированная (СПСА, ВФС 42-2685-96) вакцина обеспечивает достаточно высокий протективный эффект, характеризуется некоторой иммуногенной активностью и рекомендована для использования в хирургических клиниках различного профиля.
Однако известная вакцина содержит значительное количество балластных субстанций, которые обуславливают реактогенность препарата и могут вызвать побочные эффекты. При этом, высокая белковая нагрузка антигенов является причиной аллергенности вакцины, а используемый носитель - гель гидроокиси алюминия - обладает свойством вызывать местное раздражающее действие, что снижает потребительские качества известного коммерческого препарата и делает его небезопасным для вакцинопрофилактики, особенно в послеоперационных условиях.
Кроме того, известная вакцина обладает относительно низкой иммуногенной активностью, и для создания необходимого иммунного ответа требуется введение достаточно высоких доз препарата.
Таким образом, технический результат, получаемый от реализации настоящего изобретения, состоит в создании безопасной, высокоиммуногенной вакцины против инфекций, вызываемых условно-патогенными возбудителями, в повышении ее профилактической эффективности при значительном снижении вакцинирующей дозы препарата.
Указанный технический результат достигается тем, что вакцина против инфекций, вызываемых условно-патогенными возбудителями, на основе антигенов условно-патогенных микроорганизмов представляет собой макромолекулярную систему, содержащую соединение антигенов условно-патогенных микроорганизмов с высокомолекулярным синтетическим носителем - сополимером N-окиси-1,4-этиленпиперазина и (N-карбоксиэтил)-1,4-этиленпиперазиний бромида молекулярной массы 30000-120000 Д, имеющее соотношение антигены:носитель 1:5-50 и общую формулу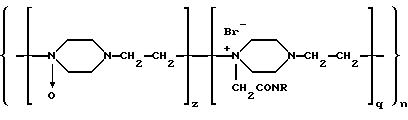
где R - место присоединения антигенов условно-патогенных возбудителей;
n=350-1000 - количество элементарных звеньев;
q=(0,2-0,4)n - количество алкилированных звеньев;
z=(0,6-0,8)n - количество окисленных звеньев;
При этом соединение антигенов условно-патогенных микроорганизмов с сополимером N-окиси-1,4-этиленпиперазина и (N-карбоксиэтил)-1,4-этиленпиперазиний бромида может быть получено в виде конъюгата с ковалентной связью между этими компонентами.
Вакцина может также представлять собой макромолекулярную систему, содержащую соединение условно-патогенных микроорганизмов с сополимером N-окиси-1,4-этиленпиперазина и (N-карбоксиэтил)-1,4-этиленпиперазиний бромида, полученное в результате реакции комплексообразования.
В качестве антигенов условно-патогенных возбудителей могут быть использованы цитоплазматический антиген стафилококка, протейный поливалентный антиген, анатоксин синегнойной палочки и анатоксин стафилококковый или их ассоциации.
В результате использования высокомолекулярного полимерного носителя - сополимера N-окиси-1,4-этиленпиперазина и (N-карбоксиэтил)-1,4-этиленпиперазиний бромида, обладающего самостоятельной иммунотропной активностью, данное изобретение обеспечивает высокую иммуногенность и стабильность антигенов условно-патогенных микроорганизмов, позволяет сформировать иммунную память, существенно (примерно в два раза по сравнению с общепринятым стандартом для аналогичных вакцин) снизить прививочную дозу антигенов, а также повысить устойчивость организма к другим инфекциям.
Вакцина в соответствии с настоящим изобретением характеризуется стабильным воспроизводством физико-химических параметров и физиологических свойств, обладает высокой стойкостью к внешним факторам.
Описываемая вакцина может быть получена в виде конъюгата с прочной ковалентной связью между вакцинными антигенами условно-патогенных возбудителей и водорастворимым высокомолекулярным синтетическим носителем, либо как комплексный препарат с устойчивой электростатической связью между этими компонентами.
Полученная химическим или электростатическим связыванием антиген-полимерная вакцина обеспечивает активацию иммуноцитов и фенотипическую коррекцию генного контроля иммунного ответа, характеризуется слабой реактогенностью и безвредна для вакцинации.
Для получения описываемой вакцины использовали следующие антигены условно-патогенных микроорганизмов:
- цитоплазматический антиген стафилококка (ЦПА), представляющий собой комплекс, выделенный из цитоплазмы микробной клетки стафилококка двукратным соляно-кислотным осаждением с последующим ферментативным гидролизом, и включающий 2-3 мг/мл белка, не менее 1,6 мг/мл нуклеиновых кислот, 0,6-0,8 мг/мл общих сахаров при сухом весе 5-6 мг/мл;
- анатоксин стафилококковый очищенный,
- протейный поливалентный антиген, представляющий собой смесь белково-липополисахаридных антигенных комплексов шести штаммов Pr. mirabilis, полученный ограниченным протеолизом микробной массы с последующей очисткой, ультрафильтрацией, осаждением этанолом, лиофильным высушиванием и растворением. Содержит в 1 мл 250 мг растворимых антигенов, взятых в равном соотношении. Препарат включает 52,5±6,7% белка и 21,6±6,3% углеводов;
- анатоксин синегнойной палочки (ВФС 42-2843-97, ЭПР 404-92), полученный путем обезвреживания анатоксина "А" формалином и теплом с последующей очисткой с помощью ультрафильтрации, включающий антигены экзотоксина, слизи и протеазы. Содержит в 1 мл 300 мг белка с молекулярной массой 70000 Д.
Эти антигены отвечают за процесс формирования антительного иммунного ответа и обеспечивают защиту против заражения соответствующими возбудителями, поскольку антитела к упомянутым антигенам обладают протективной активностью.
Сополимер N-окиси-1,4-этиленпиперазина и (N-карбоксиэтил)-1,4-этиленпиперазиний бромида получают путем синтеза бициклического мономера методом "живой" катионной полимеризации с последующей модификацией исходного полиамина путем полимераналогичных превращений (3). Полученное таким образом вещество представляет собой синтетическое водорастворимое, нетоксичное, биогенное соединение, обладающее собственной физиологической и фармакологической активностями, выраженными иммуномодулирующими свойствами.
Модификация вакцинных антигенов указанным высокомолекулярным водорастворимьм носителем - иммуномодулятором позволяет усилить иммуногенную активность субъединиц. За счет образования устойчивых ковалентных или электростатических (в зависимости от поставленной задачи и способа получения соединения) связей упомянутого выше полимерного носителя с вакцинными антигенами условно-патогенных микроорганизмов обеспечивается высокая стабильность последних и усиление их иммуногенности, что позволяет снизить прививочную дозу антигенов. При этом имеет место более эффективное формирование иммунологической памяти к указанным антигенам. Одновременно за счет повышения перекрестного действия повышаются защитные свойства организма к другим инфекциям, а следовательно, усиливается общая профилактическая эффективность вакцины. Кроме того, использование нетоксичного водорастворимого носителя способствует повышению безопасности вакцины, что улучшает переносимость, а следовательно, и потребительские качества препарата.
Вакцину на основе конъюгата протективных антигенов условно-патогенных возбудителей с сополимером N-окиси-1,4-этиленпиперазина и (N-карбоксиэтил)-1,4-этиленпиперазиний бромида (СПЛ) получают следующим образом.
Предварительно получают активированную форму СПЛ, с этой целью исходный СПЛ модифицируют гидразингидратом. Полученный после активации гидразид СПЛ смешивают с протективными антигенами условно-патогенных возбудителей в соотношении 5÷50 и проводят реакцию их взаимодействия азидным методом. В результате ковалентного связывания вакцинных антигенов с высокомолекулярным синтетическим носителем образуется устойчивая ковалентная амидная связь между карбоксильной группой полимерного носителя и первичной аминогруппой лизинового остатка молекул белков.
Описываемая вакцина может быть получена также путем реакции комплексообразования СПЛ с протективньми антигенами условно-патогенных возбудителей. Для этого СПЛ растворяют в фосфатном буфере при рН 5,8. К полученному раствору добавляют раствор вакцинных антигенов в том же буфере.
Реакцию комплексообразования проводят медленным добавлением раствора ассоциации антигенов к раствору полимера в соотношениях антигены:носитель 5÷50. При указанном значении рН макромолекулы полимерного носителя СПЛ и поверхностных антигенов условно-патогенных микроорганизмов заряжены противоположно и в результате описываемой реакции образуют устойчивую электростатическую связь.
Анализ состава полученных соединений и их специфических свойств с использованием таких методик, как SDS-электрофорез в ПААГ, электронная и флуоресцентная микроскопия, методы кругового дихроизма, позволил количественно оценить степень связывания белка с носителем, определить локализацию связи и подтвердить конформационную стабильность белка в составе конъюгата.
Оценка иммуногенных и протективных свойств полученных соединений проводилась путем исследования реакции иммунной системы и организма в целом на экспериментальных животных.
Для испытаний использовали экспериментальные серии вакцины при неизменном содержании СПЛ в составе соединений в виде конъюгата (препараты 1-3) с содержанием антигенов, соответствующим:
- дозе антигенов в СПСА-вакцине (препарат 1),
- дозе антигенов при двукратном разведении СПСА-вакцины (препарат 2),
- дозе антигенов при четырехкратном разведении СПСА-вакцины (препарат 3),
а также в виде полиэлектролитного комплекса (препарат 4) с содержанием антигенов, соответствующем дозе антигенов при двукратном разведении СПСА-вакцины.
Для сравнения во всех биологических экспериментах использовалась коммерческая СПСА-вакцина (препарат 5). Контрольные группы животных получали несорбированную стафило-протейно-синегнойную вакцину (препарат 6).
Ниже представлены конкретные примеры экспериментальной оценки биодоступности и эффективности описываемой вакцины.
Пример 1. Изучение токсичности, специфической безвредности и безопасности препарата.
Исследования токсичности проводились на белых мышах линии (СВАхС51B1/6)F1 . Препараты вводили однократно внутрибрюшинно в дозе 0,5 мл. Наблюдение осуществляли в течение 7 суток, отмечая изменение общего состояния и массы каждого животного.
По результатам исследований токсичности установлено, что реакций на месте введения описываемой вакцины не наблюдалось, признаков заболевания не выявлено. В то же время введение СПСА-вакцины у большинства морских свинок сопровождалось образованием подкожных уплотнений на месте инъекции в виде узелка размерами 5-10 мм.
Исследование специфической безвредности проводили на морских свинках. Препараты вводили подкожно по 1,5 мл в каждый бок животного. В течение 21 дня регистрировали изменения в состоянии здоровья, массы каждого животного и реакции на месте введения.
Установлено, что в первые сутки после введения препаратов у животных опытных и контрольной групп зарегистрирована потеря веса до 3,67%, который восстанавливался в течение первой недели наблюдения, что свидетельствует об отсутствии побочных эффектов при действии вакцины.
Программа доклинического изучения безопасности вакцины осуществлялась в соответствии с существующими нормативными и методическими документами и включала в себя оценку острой и хронической токсичности, местного раздражающего действия, пирогенности, влияния на кровеносную систему и на центральную нервную систему, в том числе с использованием фармакологических проб.
Установлено, что в течение всего времени наблюдения поведение и внешний вид, потребление корма и воды опытных животных не отличались от контрольных. Ежедневное введение указанных выше доз вакцины в течение 14 недель практически не оказало влияния на прирост массы тела опытных животных. Осмотр и вскрытие животных показали, что внешний вид, состояние шерсти, кожных покровов и скелета в подопытных группах животных не отличались от контрольных. На месте введения (кожа, подкожная клетчатка, мышцы) признаки деструкции и воспаления тканей отсутствовали. Расположение внутренних органов обычное. Полости тела выстланы гладкими, влажными, серовато-розовыми серозными оболочками, без экссудата.
Проведенные исследования показали, что описываемая вакцина не обладает раздражающим и аллергизирующим действием, не оказывает отрицательного действия на морфологические структуры кожи и внутренних органов, не вызывает общетоксического действия на организм подопытных животных. Животные не отставали в прибавлении веса от контрольных, были активны, подвижны, имели блестящую шерсть, хороший аппетит. При анализе влияния препарата-прототипа установлено аллергизирующее действие на животных, которое выражалось в нарушении пигментации отдельных участков кожи и расчесывании кожи. Таким образом, результаты клинических наблюдений и клинико-медицинских исследований свидетельствуют об отсутствии отрицательного воздействия описываемого препарата на организм подопытных животных.
Пример 2. Изучение иммуногенной активности препарата.
Испытания проводились в отношении вакцинных штаммов Pseudomonas Aeruginosa Pa-7, Proteus Pmirabilis 6 и 40, Staphylococcus Aureus Б-243.
Иммуногенность препаратов оценивали в тесте активной защиты мышей. Животных иммунизировали однократно внутрибрюшинно в дозе 0,5 мл. Инфицирование вакцинными штаммами проводили через 7 или 14 суток после иммунизации в дозах от 2 до 10 LD50. Иммуногенную активность оценивали по проценту выживших животных.
По результатам исследований установлено, что все экспериментальные препараты обладают выраженной иммуногенной активностью при заражении 2 LD50 культуры синегнойной палочки и протея, при этом выживаемость составляла 75-100%.
При заражении 2 LD50 культуры стафилококка преимущественной активностью обладали препараты 1 и 2.
При использовании больших доз синегнойной палочки (6,5 LD50) и протея (10 LD50 ) защитный эффект сохранялся.
Результаты, иллюстрирующие иммуногенные свойства экспериментальных серий описываемой вакцины, представлены в виде графиков на чертежах, где:
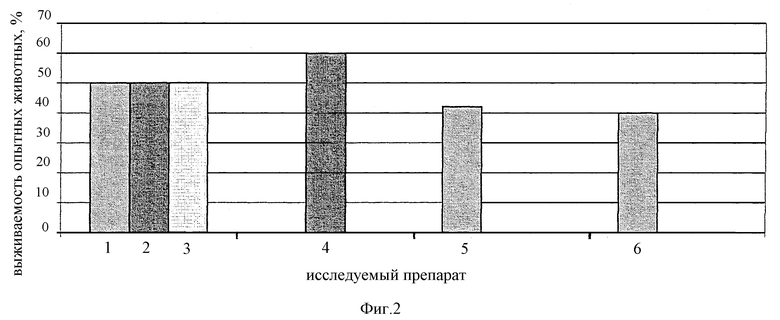
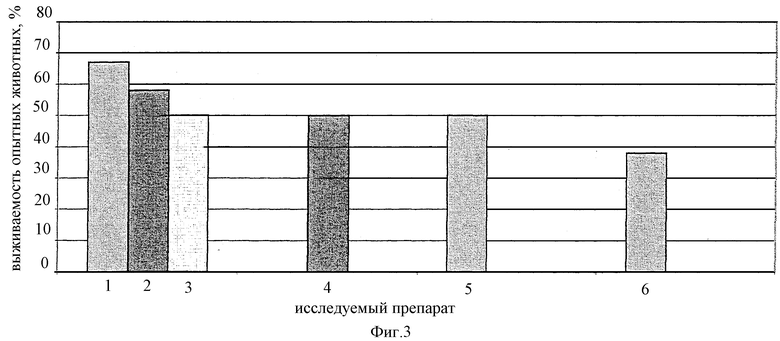
на фиг. 1 представлены данные, иллюстрирующие иммуногенную активность препаратов при заражении Pseudomonas Aeruginosa Pa-7 (6,5 LD50), на фиг. 2 - при заражении Proteus Pmirabilis 6 (10 LD50 ), на фиг 3 - при заражении Staphylococcus Aureus Б-243 (2 LD50 ). Полученные данные наглядно свидетельствуют о высокой иммуногенной активности изучаемой вакцины в условиях снижения вдвое доз стафило-протейно-синегнойных антигенов.
Пример 3. Изучение протективной активности вакцины.
Иммунизацию животных проводили аналогично примеру 2 препаратами 2 и 4, т. е. использовались серии вакцины с уменьшенными в два раза дозами стафило-протейно-синегнойных антигенов.
Результаты экспериментов показали высокую протективную активность препарата. Так, выживаемость животных при заражении 3-4 LD50 культуры синегнойной палочки и 2-3 LD50 культуры протея составила 90-100%, а при заражении 2-2,5 LD50 культуры стафилококка - 60-70%, что свидетельствует о возможности уменьшения антигенной нагрузки в препарате без потери его протективной активности.
Пример 4. Изучение перекрестной протективной активности вакцины.
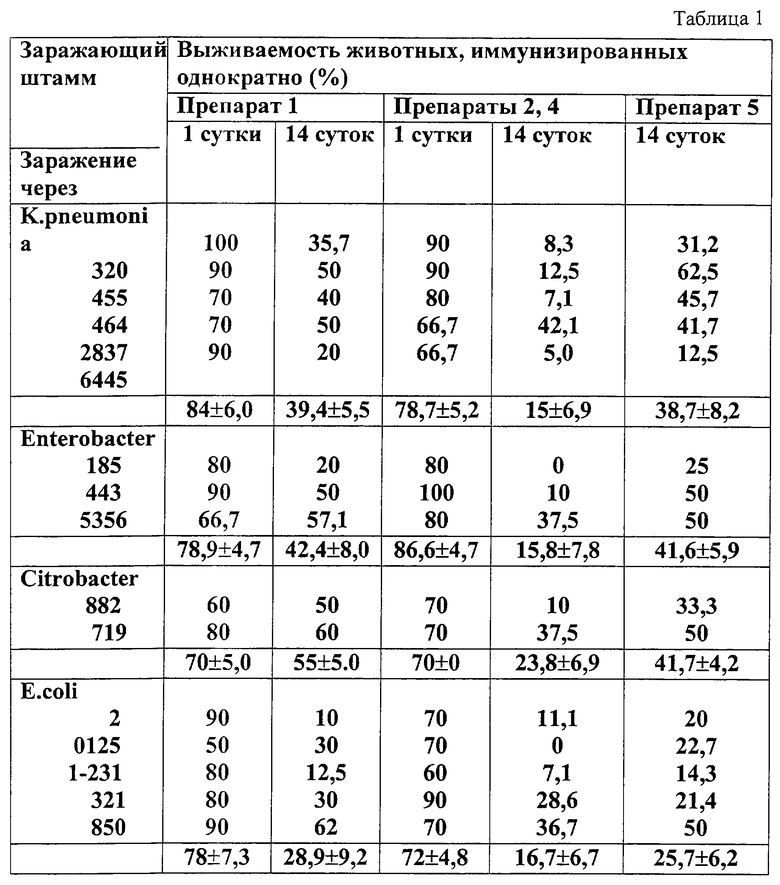
Исследования проводили путем активной защиты групп мышей в отношении бактерий - возбудителей гнойно-воспалительных заболеваний семейства Enterobacteriactae, выделенных в клиниках. Животных иммунизировали однократно внутрибрюшинно препаратами 1, 2, 4 и 5 дозой 0,5 мл. Через 1 и 14 суток после вакцинации мышей заражали 5 штаммами E.coli, 5 штаммами К. Pneumoniae, 3 штаммами Enterobacterr spp., 2 штаммами Citrobacter spp. Протективную активность оценивали по проценту выживших животных. Каждый опыт сопровождался контролем вирулентности заражающего штамма.
Данные, приведенные в табл. 1, свидетельствуют о перекрестном эффекте, выраженном в способности вакцины повышать иммунитет к другим инфекциям.
Особенно высокую защиту животных (50-100%) исследуемые препараты обеспечивали при введении 2-3 LD50 культур через сутки после иммунизации.
Пример 5. Изучение аллергизирующего действия вакцины.
Оценку аллергизирующих свойств описываемой вакцины производили по способности препарата индуцировать аллергические реакции немедленного и замедленного типа при повторном контакте организма экспериментальных животных с вакциной.
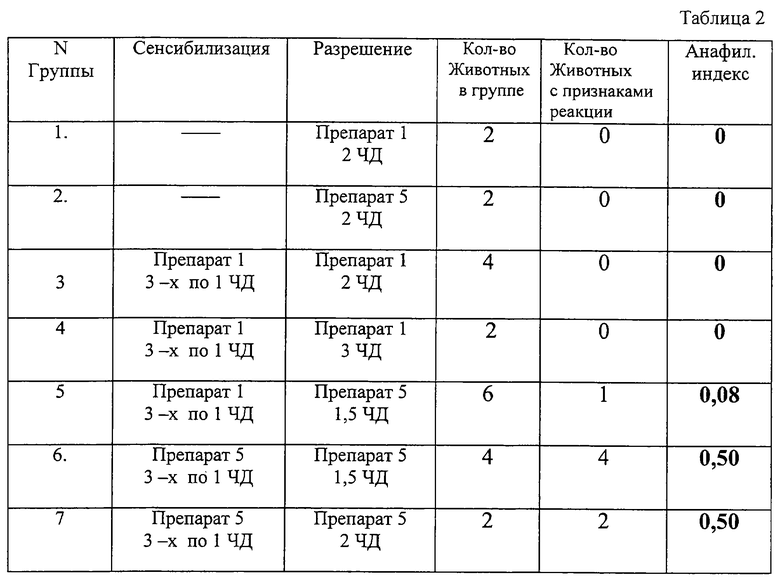
Исследования аллергизирующего действия вакцины в реакции гиперчувствительности немедленного типа проводили на морских свинках в системной анафилактической реакции, развивающейся при повторном контакте с веществами, содержащими аллерген. Количество вводимых препаратов определялось из условий рекомендуемых для введения человеку доз (ЧД) - 0,7 мл описываемой вакцины и 1,0 мл СПСА-вакцины.
Сенсибилизацию морских свинок массой тела 250-300 г осуществляли по оптимальной для выявления аллергизации схеме: 3- кратно через день по одной человеческой дозе (ЧД) - одна инъекция подкожно, две последующие инъекции внутримышечно. На 21 сутки от начала сенсибилизации внутрисердечно вводили разрешающую дозу препарата. Для исследуемой вакцины она составляла 2 или 3 ЧД. Для СПСА-вакцины аналогичные объемы внутрисердечного препарата составляли 1,5 и 2 ЧД.
Оценку возможных аллергизирующих свойств описываемой вакцины проводили с применением дополнительной схемы: сенсибилизация морских свинок исследуемой вакциной с последующей разрешающей инъекцией известной вакциной. Для оценки неспецифических, псевдоаллергических реакций при введении животным обеих вакцин несенсибилизированным морским свинкам внутрисердечно вводили вакцины в указанных дозах.
Оценку реакции проводили на основании принятой 4-балльной системы, регистрируя в течение 10 мин после разрешающей инъекции различную степень проявления системной анафилактической реакции (от почесывания мордочки до смерти животного) с вычислением среднего анафилактического индекса (4).
По результатам эксперимента установлено, что у вакцины согласно изобретению анафилактогенных свойств не обнаружено, в то время как известная вакцина проявляет некоторые анафилактогенные свойства, выражающиеся в почесывании мордочки и/или "жевании" животных.
Условия эксперимента и результаты представлены в табл. 2.
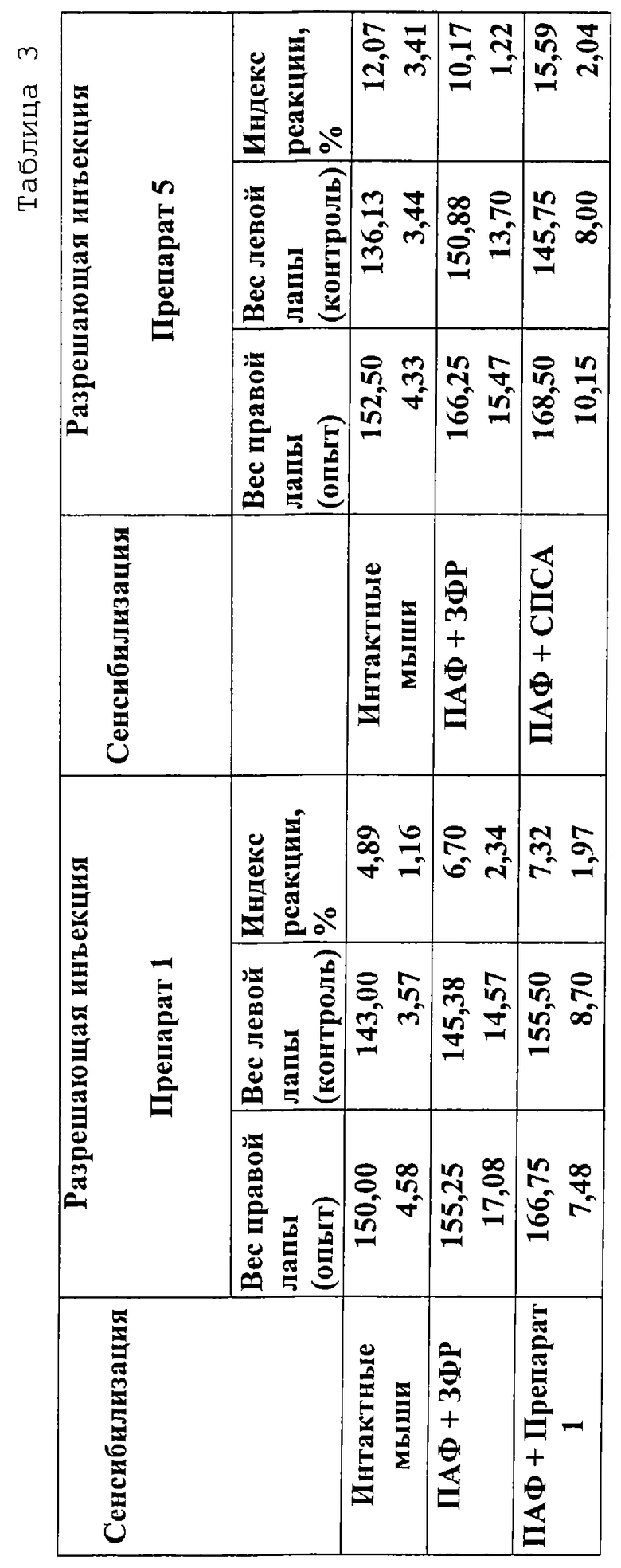
Исследование возможности индукции реакции гиперчувствительности замедленного типа (ГЗТ) при введении вакцин проводили в планетарном тесте в условиях интенсивной сенсибилизации мышей указанными вакцинами подкожно в полном адъюванте Фрейда (ПАФ). Для этого по 0,1 мл вакцин смешивали с 0,1 мл ПАФ и вводили мышам в объеме 0,2 мл в основание хвоста. Использовались мыши гибриды (СВАхC57B1/6)F1, массой 19-21 г. Контрольным животным вводили ПАФ с забуференным физиологическим раствором (ЗФР) в соотношении 1:1. Через 5 дней производили разрешающую инъекцию вакцин в подушечку задней лапы в объеме 50 мкл, в контрольную лапку вводили в том же объеме физиологический раствор. Индекс реакции определяли через 24 ч как отношение разницы масс опытной и контрольной лапок к массе контрольной лапки и выражали в процентах.
Представленные в табл. 3 данные свидетельствуют о том, что введение вакцины в соответствии с настоящим изобретением в подушечку лап интактных животных практически не приводит к развитию местной воспалительной реакции (индекс реакции не превышает 5%), в то время как индекс реакции, зарегистрированный для СПСА-вакцины (более 10%), позволяет сделать вывод о наличии у СПСА-вакцины местного раздражающего действия.
Проведенные эксперименты не выявили способности вакцины индуцировать реакции гиперчувствительности замедленного типа, что свидетельствует об отсутствии аллергизирующего действия вакцины против инфекций, вызываемых условно-патогенными возбудителями.
Таким образом, вакцина для профилактики и лечения инфекций, вызываемых условно-патогенными возбудителями,Ю в соответствии с настоящим изобретением является безопасным, нетоксичным препаратом, позволяющим значительно снизить дозы антигенов при сохранении его высокой иммуногенности.
Источники информации:
1. Крейнин Л.С., Егорова Н.Б. и др. Ассоциированная стафило-протейно-псевдомонас вакцина. Сообщение 11. Токсичность вакцины в "хронических" опытах и ее способность защищать животных от заражения протеем и стафилококком. Журнал микробиологии, эпидемиологии и иммунобиологии, 1983, 5, с.87-92.
2. Патент РФ 2035189, МКИ А 61 К 39/116, oпубл. 95 г.
3. Патент РФ 2073031, МКИ А 61 К 31/785, oпубл 97 г.
4. Weigle et. al, J. Immunol., 1960, 95, 5.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА ПРОТИВ ВИРУСА ГРИППА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2000 |
|
RU2164148C1 |
| ВАКЦИНА ПРОТИВ ГЕЛЬМИНТОЗОВ | 1996 |
|
RU2095082C1 |
| ПРЕПАРАТ ДЛЯ ЛЕЧЕНИЯ ПАТОЛОГИЧЕСКИХ СОСТОЯНИЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ | 1997 |
|
RU2112542C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИ-1,4-ЭТИЛЕНПИПЕРАЗИНА И ЕГО ПРОИЗВОДНЫХ | 2000 |
|
RU2185388C2 |
| СПОСОБ ПРОФИЛАКТИКИ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ОСЛОЖНЕНИЙ СЛУЧАЙНЫХ ТРАВМАТИЧЕСКИХ И ОПЕРАЦИОННЫХ РАН | 2000 |
|
RU2193890C2 |
| ИММУНОМОДУЛИРУЮЩЕЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1996 |
|
RU2112543C1 |
| АЛЛЕРГОТРОПИН ДЛЯ ЛЕЧЕНИЯ ПОЛИНОЗОВ И СПОСОБ ЛЕЧЕНИЯ ПОЛИНОЗОВ | 2001 |
|
RU2205661C2 |
| ВАКЦИНА ПРОТИВ ТУБЕРКУЛЕЗА | 1999 |
|
RU2153354C1 |
| СПОСОБ ПОЛУЧЕНИЯ АССОЦИИРОВАННОЙ ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ ИНФЕКЦИЙ, ВЫЗЫВАЕМЫХ УСЛОВНО-ПАТОГЕННЫМИ БАКТЕРИЯМИ | 1986 |
|
RU2035189C1 |
| СПОСОБ ЛЕЧЕНИЯ ПОСЛЕОПЕРАЦИОННЫХ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ОСЛОЖНЕНИЙ, ОБУСЛОВЛЕННЫХ НОЗОКОМИАЛЬНОЙ ИНФЕКЦИЕЙ | 2003 |
|
RU2246273C2 |
Изобретение относится к медицине и касается вакцины против инфекций, вызываемых условно-патогенными возбудителями, и может быть использовано для профилактики и лечения гнойно-септических заболеваний. Вакцина представляет собой соединение антигенов условно-патогенных микроорганизмов с высокомолекулярным синтетическим носителем - сополимером N-окиси-1,4-этиленпиперазина и N-карбоксиэтил)-1,4-этиленпиперазиний бромида молекулярной массы 30000-120000 Д, имеющее соотношение антигены : носитель 1 : 5-50, при этом соединение представлено конъюгатом или получено в результате реакции комплексообразования. Преимущество изобретения заключается в повышении иммуногенности. 3 з.п. ф-лы, 3 табл., 3 ил.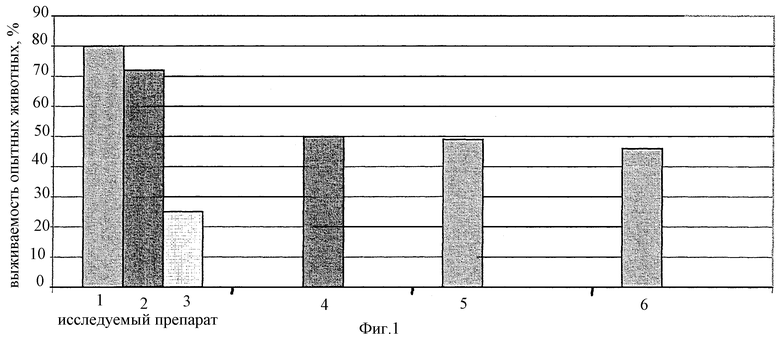
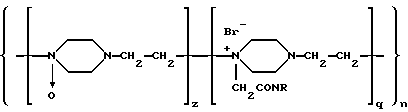
где R - место присоединения антигенов условно-патогенных микроорганизмов;
n = 350-1000 - количество элементарных звеньев;
q = (0,2-0,4)n - количество алкилированных звеньев;
z = (0,6-0,8)n - количество окисленных звеньев.
| СПОСОБ ПОЛУЧЕНИЯ АССОЦИИРОВАННОЙ ВАКЦИНЫ ДЛЯ ПРОФИЛАКТИКИ ИНФЕКЦИЙ, ВЫЗЫВАЕМЫХ УСЛОВНО-ПАТОГЕННЫМИ БАКТЕРИЯМИ | 1986 |
|
RU2035189C1 |
| ВАКЦИНА ПРОТИВ ВИРУСА ГРИППА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2000 |
|
RU2164148C1 |
| ВАКЦИНА ПРОТИВ ТУБЕРКУЛЕЗА | 1999 |
|
RU2153354C1 |
| Некрасов А.В | |||
| Тетрациклические амины и их производные | |||
| Синтез, свойства, пути практического использования в медицине | |||
| Автореферат на соискание ученой степени доктора хим | |||
| наук | |||
| - М., 1985, с.10-19. | |||
Авторы
Даты
2003-05-20—Публикация
2001-06-29—Подача