Изобретение относится к области устойчивых к лекарственным препаратам микобактерий.
Настоящее изобретение относится к зондам, праймерам, содержащим их способам и комплектам для выявления нуклеиновых кислот микобактериального происхождения в биологических образцах.
Распознавание большинства важных для клинической практики видов Myсоbacterium, в частности Mycobacterium tuberculosis, является утомительным и требующим много времени из-за процедур выращивания культур, которые могут отнимать до 6 недель. Быстрый диагноз инфекции Mycobaсterium очень важен, так как болезнь может быть опасной для жизни и в высокой степени контагиозной. Только недавно были разработаны некоторые способы, в каждом из которых используется тот или иной процесс амплификации, для выявления и идентификации видов Mycobaсterium, не требующие выращивания культуры (Claridge et al., 1993). Большая часть этих способов до сих пор находится на стадии испытаний, и их полезность для повседневного практического применения остается под вопросом. Более того, эти способы не решают проблему обнаружения устойчивости Myсоbacterium к лекарственным препаратам, которое до сих пор основывается на выращивании культуры.
Поскольку частота случаев туберкулеза с устойчивостью одновременно к ряду лекарственных препаратов постоянно увеличивается (Culliton, 1992), в настоящее время ясно, что раннее диагностирование М.tuberculosis и быстрое распознавание устойчивости к главным туберкулостатическим средствам является существенным для лечения и оптимального контроля за вспышками эпидемии. Антибиотиками, используемыми для лечения инфекций М.tuberculosis, в основном являются изониазид (isoniazid) и рифампицин, которые вводят либо по отдельности, либо в виде комбинации их обоих. Иногда используются пиразинамид (pyrazinanude), этамбутол (ethambutol) и стрептомицин; в будущем могут стать предпочтительными иные классы антибиотиков, подобные (фторо)хинолонам.
Так как у большинства микобактерий, устойчивых одновременно к ряду лекарственных препаратов, утрачена также восприимчивость к рифампицину, устойчивость к рифампицину рассматривается как потенциальный маркер для случаев туберкулеза, устойчивого одновременно к ряду лекарственных препаратов. По этой причине выявление устойчивости к рифампицину может быть особенно важным.
Для большинства штаммов М.tuberculosis, исследованных до сих пор, был выяснен механизм, ответственный за устойчивость к рифампицину (и аналогам, подобным рифабутину). Рифампицин (и аналоги) блокирует РНК-полимеразу путем взаимодействия с β-субъединицей этого энзима. Telenti et al. (1993a) обнаружили, что мутации в ограниченной области β-субъединицы РНК-полимеразы М.tuberculosis приводят к росту нечувствительности РНК-полимеразы к воздействию рифампицина. Эта область ограничивается участком из 23 кодонов в гене rроВ. Авторы описывают 17 изменений аминокислот, провоцирующих устойчивость к рифампицину (Telenti et al., 1993b). Эти изменения аминокислот вызываются точечными мутациями или делениями в 15 нуклеотидах или 8 аминокислотных кодонах соответственно, рассеянных на участке из 67 нуклеотидов или 23 аминокислотных кодонов.
Telenti et al. (1993а и b) описан метод PCR-SSCP для отбора подходящих мутаций, ответственных за устойчивость к рифампицину (SSCP обозначает полиморфизм однонитевой конформации). SSCP-анализ может выполняться либо путем использования радиоактивности, либо путем использования флуоресцентного маркера. В последнем случае требуется сложное и дорогостоящее оборудование (автоматизированное устройство для секвенирования ДНК). Описанный SSCP-подход имеет также иные ограничения в отношении к специфичности и чувствительности, которые могут затруднять его повседневное использование. Образец может непосредственно анализироваться с получением адекватного результата только в том случае, если микроскопически наблюдается значительная масса бактерий (микроскопический показатель: > 90 организмов/область), и могут наблюдаться артефакты на неочищенных образцах ДНК, связанные с разделением нитей, которые усложняют интерпретацию результатов.
Kapur et al. (1994) описывают 23 различных аллеля, связанные с устойчивостью к рифампицину. В дополнение к мутациям, описанным Telenti et al. (1993a), описаны некоторые новые мутантные аллели rроВ. Однако наиболее часто встречающимися аллелями остаются те же аллели, что описаны ранее.
Молекулярная основа для устойчивости к рифампицину в М.leprae описана Ноnоrе и Cole (1993). Здесь также устойчивость возникает в результате мутаций в гене rроВ, который кодирует бета-субъединицу РНК-полимеразы М.leprae. Анализировалось лишь ограниченное число устойчивых штаммов М.leprae (9), и в большей части их (8/9) устойчивость имела место вследствие мутации, оказывающей воздействие на остаток Ser-425.
У важных для клинической практики микобактерий, иных чем М.tuberculosis и М.leprae, часто проявляется врожденная устойчивость к рифампицину, которая является переменной. Это имеет место в случае М.aviuт и М.intracellulare патогенов человека, в отношении которых доступен лишь ограниченный выбор способов лечения. Guerrero et al. (1994) сравнивали последовательности гена rроВ различных изолятов М.avium и М.intracellulare с таковыми М. tuberculosis. Различия имеются на уровне нуклеотидов, однако обнаружена полная идентичность аминокислот с чувствительным к рифампицину М.tuberculosis. Эти данные предполагают, что для М.avium и М.intracellulare имеет место другой механизм устойчивости, возможно барьер проницаемости.
Специфичное обнаружение точечных мутаций или малых делений может быть изящно выполнено с использованием методик гибридизации, таких как проба на обратную гибридизацию. Однако сложность, наблюдаемая в соответствующей (относящейся к механизму устойчивости к лекарственным препаратам) части гена rроВ, не дает возможности прямой разработки зонда. Как будет в дальнейшем показано на примерах, одна из целей настоящего изобретения состояла в разработке специфического подхода, дающего возможность выявления большинства, если не всех, обнаруженных до сих пор мутаций быстрым и удобным способом без необходимости в сложном оборудовании.
Механизм устойчивости к изониазиду (INH) значительно более сложен, чем таковой для рифампицина. По крайней мере, два генных продукта вовлекаются в механизм устойчивости к изониазиду. Во-первых, имеется каталаза-пероксидаза, которая, как полагают, превращает изониазид в активированную молекулу. Таким образом, штаммы, которые не производят каталазу-пероксидазу вследствие дефектного или удаленного гена katG, уже не восприимчивы к изониазиду (Zhang et al. , 1992; Stoeckle et al., 1993). В этом контексте следует упомянуть, что связь между устойчивостью к изониазиду и потерей активности каталазы уже отмечалась в пятидесятые годы (Middlebrook, 1954а и b; Youatt, 1969).
Вторая молекула, вовлеченная в механизм устойчивости, является продуктом гена inhA, который, как полагают, играет роль в биосинтезе миколовой кислоты. Принимают, что активированная молекула изониазида взаимодействует либо непосредственно, либо опосредованно с этим продуктом и, вероятно, препятствует правильному биосинтезу миколовой кислоты. Эта гипотеза основана на недавнем наблюдении, что сверхэкспрессия гена inhA немутантного типа или изменение определенной аминокислоты (S94a) в гене inhA придает устойчивость к изониазиду (Banerjee et al., 1994).
Вкратце и в некоторой степени упрощенно мы можем утверждать, что в определенных штаммах М.tuberculosis устойчивость к изониазиду может быть опосредована
- потерей активности каталазы-пероксидазы;
- наличием определенных изменений аминокислот в белке inhA;
- уровнем экспрессии белка inhA природного типа.
Также, иные механизмы могли бы участвовать в обеспечении устойчивости к изониазиду и связанным с ним лекарственным препаратам. Важность этих факторов в общем спектре механизмов устойчивости к изониазиду еще необходимо оценить. Эту проблему можно пытаться решить при помощи методик с использованием зондов ДНК, если надежные зонды ДНК могут быть выработаны из имеющихся в распоряжении ДНК-последовательностей типа katG (EMBL no X68081) и гена inhA (EMBL no U02492) М.tuberculosis. Эти зонд-тесты могли бы также применяться для выявления устойчивости к лекарственным образцам в биологических препаратах.
Для выявления устойчивости к стрептомицину и (фторо)хинолонам может применяться тот же подход, что и в случае рифампицина. Устойчивость к этим антибиотикам также вызывается точечными мутациями в ограниченной области одного или более генов. Точечные мутации в гене гиразы придают устойчивость к (фторо)хинолонам (EMBL no L27512). Устойчивость к стрептомицину коррелирует с мутациями либо в гене 16S рРНК, либо в гене рибосомного белка S12 (rpsL) (Finken et al., 1993; Douglas and Steyn, 1993; Nair et al., 1993).
Устойчивость вследствие изменений нуклеотидов в генах katG, rpoB и rpsL описывается в международной заявке WO 93/22454. Для каждого из различных генов в М.tuberculosis подробно описана только одна из многих возможных мутаций, а именно R461L для katG, S425L (эквивалентна мутации S531L, описанной Telenti et al. и в настоящем изобретении) для rpoB и K42R для rpsL.
Целью настоящего изобретения является разработка быстрого и надежного способа обнаружения, предназначенного для определения устойчивости к антибиотикам видов микобактерий, присутствующих в биологическом образце.
Более определенно, цель настоящего изобретения состоит в том, чтобы разработать быстрый и надежный метод определения устойчивости к рифампицину (и/или к рифабутину) вида М.tuberculosis, присутствующего в биологическом образце.
Целью настоящего изобретения является также разработка методов, дающих возможность обнаружения и идентификации видов Mycobaсterium в биологическом образце, непосредственно связанных с отслеживанием спектра устойчивости к антибиотикам.
Более определенно, цель настоящего изобретения состоит в том, чтобы разработать метод выявления присутствия вида Mycobaсtenum tuberculosis в биологическом образце, непосредственно связанный с выявлением устойчивости к рифампицину (и/или к рифабутину).
Более определенно, цель настоящего изобретения состоит в том, чтобы разработать метод выявления присутствия вида Mycobaсterium leprae в биологическом образце, непосредственно связанный с выявлением устойчивости к рифампицину (и/или к рифабутину).
Целью настоящего изобретения является также выбор определенных зондов, способных отличать последовательности немутантного типа от мутировавших последовательностей, придающих устойчивость к одному или более лекарственным препаратам.
Более определенно, целью настоящего изобретения является выбор определенных зондов, способных отличать последовательности немутантного типа от мутировавших последовательностей, придающих устойчивость к рифампицину (и/или к рифабутину).
Более определенно, целью настоящего изобретения является выбор определенного набора зондов, способных отличать последовательности немутантного типа от мутировавших последовательностей, придающих устойчивость к рифампицину (и/или к рифабутину), причем этот определенный набор зондов используется в одних и тех же условиях гибридизации и промывки.
Сверх того, целью настоящего изобретения является объединение набора выбранных зондов, способных отличать последовательности немутантного типа от мутировавших последовательностей, придающих устойчивость к рифампицину (и/или к рифабутину), с другим набором выбранных зондов, способных идентифицировать виды микобактерий, присутствующие в биологическом образце, в силу чего все зонды могли бы использоваться в одних и тех же условиях гибридизации и промывки.
Целью настоящего изобретения является также выбор праймеров, дающих возможность амплификации фрагмента(-ов) гена, определяющего(-их) представляющие интерес особенности устойчивости к антибиотикам.
Более конкретно, целью настоящего изобретения является выбор праймеров, дающих возможность амплификации фрагмента(-ов) гена, определяющего(-их) представляющие интерес особенности устойчивости к антибиотикам.
Более конкретно, целью настоящего изобретения является выбор праймеров, дающих возможность амплификации фрагмента гена rроВ, определяющего устойчивость к рифампицину (и аналогам).
Другой целью настоящего изобретения является создание комплектов для обнаружения устойчивости микобактерий к антибиотикам, по возможности объединенного с идентификацией рассматриваемых видов микобактерий.
Все цели настоящего изобретения были удовлетворены при помощи следующих конкретных вариантов реализации.
Выбор предпочтительных зондов согласно настоящему изобретению основан на принципе линейного зондового анализа (LiPA), который представляет собой обратный гибридизационный анализ с использованием олигонуклеотидных зондов, иммобилизованных в виде параллельных линий на полоске твердофазной подложки (Stuyver et al., 1993; международная заявка WO 94/12670). Этот способ имеет особые преимущества, так как он является быстрым и простым по выполнению. Схема обратной гибридизации и, более конкретно, способ LiPA имеет много практических преимуществ по сравнению с другими ДНК-методиками или схемами гибридизации, в особенности в том случае, когда является необходимым или неизбежным использование сочетания зондов для получения требуемой информации.
Однако необходимо понимать, что любой другой тип теста на гибридизацию или схемы гибридизации, в котором используется любой из выбранных зондов, как описывается далее в изобретении, также охватывается настоящим изобретением.
Способ обратной гибридизации предполагает, что зонды иммобилизованы на твердофазной подложке и что ДНК-мишень помечена для того, чтобы дать возможность обнаружения образующихся гибридов.
Следующие определения служат для того, чтобы проиллюстрировать термины и выражения, используемые в описании настоящего изобретения.
Вещество-мишень в настоящих примерах может представлять собой либо ДНК, либо РНК, например, геномную ДНК, или информационную РНК, или их амплифицированные варианты. Эти молекулы называются также полинуклеиновыми кислотами.
Термин "зонд" обозначает однонитевые специфичные в отношении последовательности олигонуклеотиды, в которых имеется последовательность, комплементарная к последовательности-мишени, которую необходимо обнаружить.
Термин "комплементарный", как он используется в настоящем описании, обозначает, что последовательность однонитевого зонда в точности комплементарна к последовательности однонитевой мишени, причем мишень определена как последовательность, в которой локализована мутация, которую необходимо обнаружить. Так как в соответствии с настоящей заявкой требуется обнаружение ошибочных спариваний оснований, для гибридизации требуются очень строгие условия, допускающие, в принципе, только гибридизацию в точности комплементарных последовательностей. Однако возможны вариации в длине зондов (см. ниже) и следует отметить, что поскольку для гибридизационных свойств зонда является существенной его центральная часть, то допустимы возможные отклонения последовательности зонда по отношению к последовательности мишени в начальной (головной) и конечной (хвостовой) части зонда, если используются более длинные последовательности зонда. Однако эти вариации, которые могут быть поняты на основе общих знаний в данной области технологии, всегда следует оценивать экспериментально, для того чтобы проверить, приводят ли они к эквивалентным характеристикам гибридизации по сравнению с точно комплементарными зондами.
Предпочтительно зонды имеют длину приблизительно от 5 до 50 нуклеотидов, предпочтительно приблизительно от 10 до 25 нуклеотидов. Нуклеотиды, как они используются в настоящем изобретении, могут быть рибонуклеотидами, дезоксирибонуклеотидами и модифицированными нуклеотидами, такими как инозин, содержащими модифицированные группы, которые существенно не изменяют их гибридизационные свойства. Последовательности зондов представлены во всем описании как однонитевые ДНК-олигонуклеотиды с окончанием от 5' до 3'. Для квалифицированного специалиста ясно, что любой из определенных ниже зондов может использоваться как таковой, либо в его комплементарной форме, либо в его РНК-форме (в которой Т замещено на U).
Зонды, согласно изобретению, могут быть получены клонированием рекомбинантных плазмид, содержащих вставки, включающие соответствующие последовательности нуклеотидов, в случае необходимости посредством отщепления последних от клонированных плазмид с использованием адекватных нуклеаз и их выделения, например, путем фракционирования в соответствии с молекулярной массой. Зонды, согласно настоящему изобретению, могут быть также синтезированы химически, например, стандартным фосфо-триэфирным методом.
Термин "твердофазная подложка" может относиться к любому субстрату, с которым может быть связан олигонуклеотидный зонд, при условии, что он сохраняет гибридизационные свойства, и при условии, что фоновый уровень гибридизации остается низким. Обычно твердофазный субстрат представляет собой титрационный микропланшет, мембрану (например, найлоновую или нитроцеллюлозную) или микросферу (бусинку). Перед нанесением на мембрану или фиксацией может быть удобным модифицировать зонд на основе нуклеиновой кислоты, чтобы облегчить фиксацию или улучшить эффективность гибридизации. Такие модификации могут заключаться в гомополимерном наращивании, связывающем с различными реакционноспособными группами, такими как алифатические группы, NН2-группы, SH-группы, карбоксильные группы, или связывающем с биотином, гаптенами или белками.
Термин "меченый" относится к использованию меченых нуклеиновых кислот. Мечение может быть проведено путем использования меченых нуклеотидов, включаемых в ходе полимеразной стадии амплификации, так как это описано Saiki et al. (1988) или Bej et al. (1990), или мечеными праймерами, или любым другим методом, известным квалифицированным специалистам. Метки могут иметь изотопную (32P, 35S и т.д.) или неизотопную (биотин, дигоксигенин и т.д.) природу.
Термин "праймер" относится к однонитевой олигонуклеотидной последовательности, которая способна выступать в качестве центра инициации синтеза продукта удлинения праймера, который является комплементарным к копируемой нити нуклеиновой кислоты. Длина и последовательность праймера должны быть такими, чтобы они давали возможность служить затравкой для синтеза продуктов удлинения. Предпочтительно праймер имеет длину около 5-50 нуклеотидов. Конкретная длина и последовательность будут зависеть от сложности требуемых ДНК- или РНК-мишеней, а также от условий использования праймеров, таких как температура и ионная сила.
Тот факт, что праймеры амплификации не должны в точности подходить к соответствующей шаблонной последовательности, чтобы гарантировать должную амплификацию, неоднократно подтвержден в литературе (Kwok et al., 1990).
Используемый метод амплификации может представлять собой либо полимеразную цепную реакцию (PCR; Saiki et al., 1988), лигазную цепную реакцию LCR; Landgren et al. , 1988; Wu & Wallace, 1989; Barany, 1991), амплификацию на основе последовательности нуклеиновых кислот (NASBA; Guatelli et al., 1990; Compton, 1991), систему амплификации на основе транскрипции (TAS; Kwoh et al. , 1989), амплификацию замещением нити (SDA; Duck, 1990; Walker et al., 1992), либо амплификацией при посредстве Qβ-репликазы (Lizardi et al., 1988; Lomely et al. , 1989), или любым другим подходящим способом амплификации молекул нуклеиновых кислот, известным в технологии.
Олигонуклеотиды, используемые в качестве праймеров или зондов, могут также включать аналоги нуклеотидов, такие как фосфоротиаты (Matsukura et al. , 1987), алкилфосфоротиаты (Miller et al., 1979), или пептидные нуклеиновые кислоты (Nielsen et al., 1991; Nielsen et al., 1993), или могут содержать интеркаляционные агенты (Asseline et al., 1984).
Как и большинство других вариаций и модификаций, вводимых в исходные последовательности ДНК, согласно изобретению эти вариации требуют адаптации по отношению к условиям, в которых следует использовать нуклеотиды, чтобы получить требуемую специфичность и чувствительность. Однако конечные результаты гибридизации будут существенно теми же, что и результаты, полученные с немодифицированными олигонуклеотидами.
Введение этих модификаций может давать преимущества в смысле положительного влияния на свойства, такие как кинетика гибридизации, обратимость образования гибрида, биологическая стабильность олигонуклеотидных молекул и т.д.
"Образец" может быть любым биологическим материалом, взятым либо непосредственно из организма инфицированного человека (или животного), либо после культивирования (обогащения). Биологический материал может представлять собой, например, мокроты любого вида, продукты бронхиального лаважа, кровь, ткань кожи, биопсии, материал в виде культуры лимфоцитов крови, колонии, жидкие культуры, экскременты, фекальные образцы, мочу и т.п.
Зонды, согласно настоящему изобретению, конструируются для достижения оптимальных рабочих характеристик в одних и тех же условиях гибридизации, так что они могут использоваться в наборах для одновременной гибридизации; это значительно повышает полезность этих зондов и приводит к значительному выигрышу в затратах времени и труда. Очевидно, если предпочтительными являются другие условия гибридизации, все зонды следует адаптировать соответствующим образом путем добавления или удаления нуклеотидов на их краях. Следует понимать, что эти соответствующие адаптации должны давать существенно тот же результат, а именно тот, что соответственные зонды будут все же специфично гибридизироваться с определенными мишенями. Такие адаптации могут также быть необходимыми, если амплифицируемый материал является по своей природе РНК, а не ДНК, как в случае системы NASBA.
Для конструирования зондов с желательными свойствами могут применяться следующие полезные приемы, известные квалифицированным специалистам.
Поскольку на степень и специфичность реакций гибридизации, таких как реакции, описанные в данной заявке, оказывает влияние ряд факторов, управление одним или более из этих факторов будет определять точное значение чувствительности и специфичности определенного зонда независимо от того, является ли он полностью комплементарным к своей мишени или нет. Важность и эффект различных условий испытаний, объясняемых далее, известны квалифицированным специалистам.
Во-первых, стабильность гибрида нуклеиновых кислот [зонд:мишень] следует выбирать таким образом, чтобы она была совместима с условиями испытаний. Этого можно достичь посредством избегания длинных последовательностей, содержащих много пар AT, посредством завершения гибридов парами оснований G:C и посредством конструирования зонда с подходящим Тm. Начальный и конечный участки зонда следует выбирать таким образом, чтобы длина и % GC приводили к Тm приблизительно на 2-10oС выше, чем температура, при которой будет проводиться заключительное испытание. Имеет значение состав оснований зонда, поскольку пары оснований G-C имеют более высокую термическую стабильность по сравнению с парами оснований А-Т благодаря дополнительной водородной связи. Таким образом, гибридизация, включающая комплементарные нуклеиновые кислоты с более высоким содержанием G-C, будет стабильна при более высоких температурах.
При конструировании зонда следует также принять во внимание такие условия, при которых будет использоваться зонд, как ионная сила и температура инкубации. Известно, что гибридизация будет возрастать по мере того, как возрастает ионная сила реакционной среды, и что термическая стабильность гибридов будет повышаться при повышении ионной силы. С другой стороны, химические реагенты, такие как формамид, мочевина, ДМСО и спирты, которые разрушают водородные связи, будут повышать жесткость условий гибридизации. Дестабилизация водородных связей такими реагентами может сильно снизить Тm. В целом, оптимальная гибридизация для синтетических олигонуклеотидных зондов длиной около 10-50 оснований происходит при температуре приблизительно на 5oС ниже температуры плавления данного дуплекса. Инкубация при температурах ниже оптимальной может дать возможность гибридизации ошибочно спаренных оснований, и может, следовательно, привести к пониженной специфичности.
Желательно иметь зонды, которые гибридизуются только в очень жестких условиях. В условиях высокой жесткости будут образовываться только высококомплементарные гибриды нуклеиновых кислот; гибриды без достаточной степени комплементарности образовываться не будут. Соответственно, жесткость условий испытаний определяет количество необходимых комплементарностей между двумя нитями нуклеиновых кислот, образующих гибрид. Степень жесткости выбирают так, чтобы максимизировать различия в стабильности между гибридом, образованным с мишенью, и с нуклеиновой кислотой, не являющейся мишенью. В настоящем случае требуется обнаружить изменения в единственной паре оснований, что требует условий очень высокой степени жесткости.
Во-вторых, зонды следует располагать таким образом, чтобы минимизировать стабильность гибрида нуклеиновых кислот [зонд:не-мишень). Это может быть выполнено путем минимизации длины полной комплементарности к не являющимся мишенями организмам, посредством избегания содержащих много пар GC областей гомологии с последовательностями, не являющимся мишенями, и посредством позиционирования зонда так, чтобы охватить настолько много дестабилизирующих ошибочных спариваний, насколько это возможно. Является ли последовательность зонда пригодной для того, чтобы обнаруживать только конкретный вид организма, зависит, по большей части, от различия в термической стабильности между гибридами [зонд: мишень] и гибридами [зонд:не-мишень]. При конструировании зондов различия в этих значениях Тm должны быть настолько большими, насколько это возможно (например, по меньшей мере 2oС и предпочтительно 5oС).
Длина последовательности нуклеиновой кислоты, являющейся мишенью, и, соответственно, длина последовательности зонда также могут быть важны. В некоторых случаях могут иметься некоторые последовательности из определенной области, различающиеся по расположению и длине, которые будут давать зонды с желательными гибридизационными свойствами. В других случаях одна последовательность может быть значительно лучше, чем другая, которая отличается лишь единственным основанием. Хотя и для нуклеиновых кислот, которые не полностью комплементарны, возможна гибридизация, обычно стабильность гибрида в первую очередь определяет наиболее длинный отрезок полностью комплементарной последовательности оснований. Хотя могут использоваться олигонуклеотидные зонды различной длины и состава входящих в них оснований, предпочтительные олигонуклеотидные зонды согласно настоящему изобретению имеют длину от около 5 до 50 (более определенно 10-25) оснований и имеют значительный фрагмент в последовательности, который является полностью комплементарным к последовательности нуклеиновой кислоты, являющейся мишенью.
В-третьих, области в ДНК- и РНК-мишенях, о которых известно, что они образуют прочные внутренние структуры, тормозящие гибридизацию, являются менее предпочтительными. Подобно этому следует избегать зондов с большой самокомплементарностью. Как объяснялось выше, гибридизация представляет собой ассоциацию двух одиночных нитей комплементарных нуклеиновых кислот с образованием связанной водородной связью двойной нити. Подразумевается, что, если одна из двух нитей полностью или частично включается в гибрид, то она будет в меньшей степени способной принимать участие в образовании нового гибрида. Могут существовать интрамолекулярные и интермолекулярные гибриды, образуемые молекулами зонда одного типа, если он является в достаточной степени самокомплементарным. Следует избегать таких структур в процессе тщательного конструирования зонда. Путем конструирования зонда таким образом, чтобы существенная часть представляющей интерес последовательности была однонитевой, скорость и степень гибридизации могут быть значительно повышены. Имеются компьютерные программы для поиска этого типа взаимодействия. Однако в некоторых случаях может оказаться невозможным избежать этого типа взаимодействия.
Настоящее изобретение предусматривает в своей наиболее общей форме способ выявления спектра устойчивости к антибиотикам присутствующих в образце видов Mycobacterium, объединенного, возможно, с идентификацией содержащихся видов Mycobaсterium, включающий стадии
(i) если необходимо, высвобождение, выделение или концентрирование полинуклеиновых кислот, присутствующих в образце;
(ii) если необходимо, амплифицирование соответствующей части генов, присутствующих в указанном образце, по крайней мере, с одной парой подходящих праймеров;
(iii) гибридизация полинуклеиновых кислот согласно стадии (i) или (ii), по крайней мере, с одним из зондов на основе гена rроВ, как упомянуто в таблице 2, в подходящих условиях гибридизации и промывки;
(iv) обнаружение гибридов, образовавшихся на стадии (iii);
(v) составление заключения о спектре устойчивости Mycobacterium к антибиотикам и, возможно, о содержащихся видах Mycobacterium из дифференциального сигнала (сигналов) гибридизации, полученного на стадии (iv).
Под соответствующей частью генов понимают области в генах rpoB, katG, inhA, 16S т-РНК, rpsL и гиразы, в которых находятся мутации, вызывающие устойчивость к рифампицину, изониазиду, стрептомицину и (фторо)хинолонам, как описано выше.
В соответствии с предпочтительным вариантом реализации изобретения стадия (iii) выполняется с использованием набора зондов, тщательно сконструированных таким образом, что они дают желаемые результаты гибридизации при использовании в одних и тех же условиях гибридизации и промывки.
Более конкретно, в настоящем изобретении предусматривается способ выявления устойчивости присутствующего в биологическом образце М.tuberculosis, к рифампицину (и/или к рифабутину), включающий стадии:
(i) если необходимо, высвобождение, выделение или концентрирование полинуклеиновых кислот, присутствующих в образце;
(ii) если необходимо, амплифицирование соответствующей части гена rpoB, присутствующего в указанных полинуклеиновых кислотах, по крайней мере, с одной парой подходящих праймеров;
(iii) гибридизация полинуклеиновых кислот согласно стадии (i) или (ii), с выбранным набором зондов на основе rроВ немутантного типа в подходящих условиях гибридизации и промывки, причем указанный набор включает, по крайней мере, один из следующих зондов (см. таблицу 2):
S1 - (SEQ ID NO 1)
S11 - (SEQ ID NO 2)
S2 - (SEQ ID NO 3)
S3 - (SEQ ID NO 4)
S33 - (SEQ ID NO 5)
S4 - (SEQ ID NO 6)
S44 - (SEQ ID NO 7)
S444 - (SEQ ID NO 43)
S4444 - (SEQ ID NO 8)
S5 - (SEQ ID NO 9)
S55 - (SEQ ID NO 10)
S555 - (SEQ ID NO 39)
S5555 - (SEQ ID NO 40)
S55C - (SEQ ID NO 44)
S55M - (SEQ ID NO 45)
S6 - (SEQ ID NO 11)
S66 - (SEQ ID NO 12)
(iv) обнаружение гибридов, образовавшихся на стадии (iii);
(v) составление заключения о восприимчивости (чувствительность в соотношении с устойчивостью) присутствующего в образце М. tuberculosis к рифампицину из дифференциального сигнала (сигналов) гибридизации, полученного на стадии (iv).
Термин "восприимчивость" относится к фенотипическому свойству штамма М. tuberculosis быть устойчивым либо чувствительным к лекарственному средству, как это определяется культуральными методами in vitro, более конкретно к рифампицину (и/или рифабутину). Устойчивость к рифампицину обнаруживается по отсутствию гибридизации, по крайней мере, с одним из S-зондов.
Стандартными условиями гибридизации и промывки являются, например, следующие: 3Х SSC (раствор хлорида и цитрата натрия), 20% деионизированный FA (формамид) при 50oС. Могут также применяться другие растворы (SSPE (хлорид, фосфат и этилендиаминтетраацетат натрия), ТМАС1 (хлорид тетраметиламмония) и т.д.) и температуры при условии, что сохраняется специфичность и чувствительность зондов. Если это необходимо, нужно провести легкую модификацию зондов в отношении длины или последовательности, чтобы сохранить специфичность и чувствительность, требуемые в данных обстоятельствах. При использовании зондов, согласно изобретению, изменение условий на 1,4Х SSC, 0,07% SDS (додецилсульфат натрия) при 62oС ведет к таким же результатам гибридизации, как результаты, полученные в стандартных условиях, без необходимости адаптировать последовательность или длину зондов.
Подходящие пары праймеров могут быть выбраны из списка пар праймеров, как описано ниже.
В более предпочтительном варианте реализации вышеупомянутые полинуклеиновые кислоты, полученные на стадии (i) или (ii), подвергают гибридизации с, по крайней мере, с двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью, одиннадцатью, двенадцатью, тринадцатью, четырнадцатью, пятнадцатью, шестнадцатью или семнадцатью из вышеупомянутых S-зондов, предпочтительно с 5 или 6 S-зондами, которые, вместе взятые, покрывают область мутации гена rpoB.
Термин "область мутации" обозначает область в последовательности гена rpoB, где расположено большинство, если не все мутации, ответственные за устойчивость к рифампицину. Эта область мутации представлена на фиг.1.
В более предпочтительном варианте реализации изобретения полинуклеиновые кислоты, полученные на стадии (i) или (ii), подвергают гибридизации с выбранным набором зондов rроВ немутантного типа, причем указанный набор включает, по крайней мере, один, а предпочтительно все, из следующих зондов (см. таблицу 2):
S11 - (SEQ ID NO 2)
S2 - (SEQ ID NO 3)
S33 - (SEQ ID NO 5)
S4444 - (SEQ ID NO 8)
S55 или S5555 - (SEQ ID NO 10 или 40)
В другом конкретном варианте реализации набор S-зондов, как описано выше, или, по крайней мере, один из них, может быть объединен с одним или более SIL-зондов, выявляющих молчащие мутации в гене rроВ. Предпочтительным SIL-зондом является зонд SIL-1 (SEQ ID NO 13, см. таблицу 2).
В другом варианте реализации изобретения набор S-зондов и, возможно, SIL-зондов может объединяться с, по крайней мере, одним R-зондом, обнаруживающем специфичную мутацию, связанную с устойчивостью к рифампицину.
R-зонды выбирают из следующей группы зондов (см. таблицу 2):
R1 - (SEQ ID NO 46)
R2 - (SEQ ID NO 14)
R2B - (SEQ ID NO 47)
R2C - (SEQ ID NO 48)
R3 - (SEQ ID NO 49)
R4A - (SEQ ID NO 15)
R44A - (SEQ ID NO 16)
R444A - (SEQ ID NO 17)
R4B - (SEQ ID NO 18)
R44B - (SEQ ID NO 19)
R444B - (SEQ ID NO 20)
R4C - (SEQ ID NO 50)
R4D - (SEQ ID NO 51)
R4E - (SEQ ID NO 52)
R5 - (SEQ ID NO 21)
R55 - (SEQ ID NO 22)
R5B - (SEQ ID NO 53)
R5C - (SEQ ID NO 54)
Предпочтительно набор S-зондов и, возможно, SIL-зондов может объединяться с, по крайней мере, с двумя, тремя, четырьмя, пятью, шестью или более R-зондов.
Наиболее предпочтительно набор S-зондов и, возможно, SIL-зондов объединяют с, по крайней мере, одним R-зондом, из следующей ограниченной группы зондов:
R2 - (SEQ ID NO 14)
R444A - (SEQ ID NO 17)
R444B - (SEQ ID NO 20)
R55 - (SEQ ID NO 22)
В случае, когда S- и R-зонды объединяются, устойчивость к рифампицину обнаруживают по отсутствию гибридизации с одним из S-зондов и, возможно, по положительному сигналу гибридизации с соответствующим R-зондом.
Так как некоторые мутации могут встречаться более часто, чем другие, например, в определенных географических районах (см., например, таблицу 5) или в специфических обстоятельствах (например, в достаточно замкнутых сообществах), может быть целесообразным производить отбор только конкретных мутаций с использованием выбранных наборов S- и/или R-зондов. Это привело бы к более простому тесту, который удовлетворял бы требованиям в определенных обстоятельствах. Согласно Telenti et al. (1993а и b), большинство мутаций, описанных в его публикации, относительно редки (3% или менее); преобладающими мутациями являются S531L (51,6%), H526Y (12,5%), D516V (9,4%) и H526D (7,8%).
В конкретном варианте реализации изобретения используется выбранный набор из двух или трех S-зондов, при этом соответственные наборы зондов таковы:
S4444 - (SEQ ID NO 8)
S55 или S5555 - (SEQ ID NO 10 или 40)
или
S2 - (SEQ ID NO 3)
S4444 - (SEQ ID NO 8)
S55 или S5555 - (SEQ ID NO 10 или 40)
Используя эти ограниченные наборы зондов, можно выявить большинство случаев устойчивости к рифампицину по отсутствию сигнала гибридизации с, по крайней мере, одним из этих зондов.
В другом предпочтительном варианте реализации изобретения используют, по крайней мере, один из R-зондов, возможно, объединенный с выбранным набором из двух или трех S-зондов, как описано выше, причем указанный R-зонд выбирают из следующего списка зондов:
R2 - (SEQ ID NO 14)
R444A - (SEQ ID NO 17)
R444B - (SEQ ID NO 20)
R55 - (SEQ ID NO 22)
В этом случае вывод о присутствии конкретной мутации, ответственной за устойчивый к рифампицину фенотип, может быть сделан на основе положительного сигнала гибридизации с одним из R-зондов и/или отсутствия гибридизации с соответствующим S-зондом.
В другом варианте реализации изобретения вышеупомянутые S-, SIL- или R-зонды могут объединяться с, по крайней мере, одним зондом, специфичным к видам М. tubercolosis, позволяющим проводить одновременную идентификацию Mycobaсterium tubercolosis и обнаружение устойчивости к рифампицину, причем указанный вид-специфичный зонд выбирается из следующей группы зондов (см. таблицу 2):
MT-POL-1 - (SEQ ID NO 23)
MT-POL-2 - (SEQ ID NO 24)
MT-POL-3 - (SEQ ID NO 25)
MT-POL-4 - (SEQ ID NO 26)
MT-POL-5 - (SEQ ID NO 27)
Более предпочтительно специфичный к видам М.tubercolosis зонд представляет собой
MT-POL-1 - (SEQ ID NO 23)
Еще в одном варианте реализации вышеупомянутые S-, SIL-, R- или MT-POL-зонды могут объединяться с, по крайней мере, одним зондом, специфичным к видам M.paratubercolosis, М.avium, М.scrophulaceum, М.Kansasii, М.intracellutare (и штаммы MAC) или M.leprae, причем указанные зонды являются, соответственно, MP-POL-1 (SEQ ID NO 28), MA-POL-1 (SEQ ID NO
29), MS-POL-1 (SEQ ID NO 38), MK-POL-1 (SEQ ID NO 55), MI-POL-1 (SEQ 10 NO 68), ML-POL-1 (SEQ ID NO 57) (см. таблицу 2В) или с любым вид-специфичным зондом, произведенным из последовательности соответствующей части гена rpoB M. paratubercolosis (SEQ ID NO 35), M.avium (SEQ ID NO 36), M.scrophulaceum (SEQ ID NO 37), M.kansasii (SEQ ID NO 56) или штаммов MAC (SEQ ID NO 69), как представлено, соответственно, на фиг.5, 6, 7, 8 и 11. Следует отметить, что последовательности, представленные на фиг.5-8 и 11, являются новыми. Последовательность фрагмента гена rpoB M.intracellulare и M.leprae уже описана в других работах (Guerrero et al., 1994; Honore and Cole, 1993).
Термин "штаммы MAC" обозначает штаммы "комплекса M.avium, известные квалифицированным специалистам в области таксономии микобактерий. Эта довольно разнородная группа штаммов MAC может, однако, содержать штаммы, которые генотипически весьма похожи на M.intracellulare. Это также имеет место в случае изолята ITG 926, последовательность гена rpoB которого показана на фиг. 11. Последовательность MI-POL-1, полученная из SEQ ID NO 69, и опубликованная последовательность rpoB M.intracellulare являются, таким образом, специфичными совместно для M.intracellulare и некоторых штаммов MAC.
Следует подчеркнуть, что все вышеупомянутые зонды, включая вид-специфичные зонды, содержатся в последовательности rpoB и, более определенно, в последовательности амплифицированного фрагмента rроВ. Более того, как иллюстрируется далее в примерах, зонды, описанные выше как "предпочтительные", сконструированы таким образом, что все они могут использоваться одновременно, в одних и тех же условиях гибридизации и промывки. Эти два критерия подразумевают, что достаточно единственной стадии амплификации и гибридизации для одновременного обнаружения устойчивости к рифампицину и идентификации имеющихся микобактериальных видов.
В предпочтительном варианте реализации и в качестве примера раскрывается метод обнаружения М. tubercolosis и его устойчивости к рифампицину, включающий стадии
(i) если необходимо, высвобождение, выделение или концентрирование полинуклеиновых кислот, присутствующих в образце;
(ii) если необходимо, амплифицирование соответствующей части гена rроВ, по крайней мере, с одной парой подходящих праймеров;
(iii) гибридизация полинуклеиновых кислот согласно стадии (i) или (ii), со следующим набором зондов в подходящих условиях гибридизации и промывки:
MT-POL-1
S11
S2
S33
S4444
S55 или S5555
R2
R444A
R444B
R55
(iv) обнаружение гибридов, образовавшихся на стадии (iii);
(v) составление заключения о присутствии в образце М.tuberculosis и его восприимчивости к рифампицину из дифференциального сигнала (сигналов) гибридизации, полученного на стадии (iv).
Для того, чтобы выявить микобактериальные организмы и/или их рисунки устойчивости при помощи выбранного набора олигонуклеотидных зондов, может использоваться любой известный в технологии метод гибридизации (стандартный дот-блоттинг, саузернблоттинг, метод сэндвича и т.д.).
Однако для того чтобы получить результаты быстрым и удобным способом в том случае, если используется множество зондов, наиболее удобной может быть схема обратной гибридизации.
В предпочтительном варианте реализации выбранный набор зондов иммобилизуют на твердофазной подложке. В другом предпочтительном варианте реализации выбранный набор зондов иммобилизуют на мембранной полоске в линейной форме. Указанные зонды могут быть иммобилизованы индивидуально или в виде смесей в определенных местоположениях на твердофазной подложке.
Конкретным и весьма удобным для пользователя вариантом реализации вышеуказанного предпочтительного способа является метод LiPA, в котором вышеупомянутый набор зондов иммобилизуют в виде параллельных линий на мембране, как описано далее в примерах.
Вышеупомянутые R-зонды обнаруживают мутации, которые уже были описаны в имеющихся источниках, относящихся к соответствующей области технологии (Telenti et al., 1993a и 1993b). Однако как показывается далее в примерах, в настоящем изобретении раскрыты четыре новых мутации, связанные с устойчивостью М.tuberculosis к рифампицину, еще не описанные другими авторами. Новые мутации, как и мутации, уже описанные в имеющихся источниках, относящихся к соответствующей области технологии, можно определить, используя S-зонды, согласно настоящему изобретению. Замечательная идея использования набора S-зондов, охватывающих полностью всю область мутаций в гене rроВ, позволяет обнаруживать большинство, если не все мутации, в гене rроВ, ответственные за устойчивость к рифампицину, даже те мутации, которые до сих пор еще не были описаны.
Четыре новых мутации rроВ (D516G, Н526С, Н526Т и R529Q) помечены в таблице 1 звездочками. В качестве примера на фиг.2 представлена последовательность rроВ-мутантной аллели Н526С (SEQ 10 NO 34).
Изобретение предусматривает также любые зонды или наборы праймеров, сконструированные для того, чтобы специфически обнаруживать или амплифицировать в особенности эти мутации гена rроВ, и любой метод или комплекты оборудования, включающие указанные наборы праймеров или зонды.
В другом варианте реализации изобретение предусматривает также способ обнаружения устойчивости к рифампицину (и/или рифабутину) М.leprae, присутствующего в биологическом образце, включающий стадии
(i) если необходимо, высвобождение, выделение или концентрирование полинуклеиновых кислот, присутствующих в образце;
(ii) если необходимо, амплифицирование соответствующей части гена rроВ, по крайней мере, с одной парой подходящих праймеров;
(iii) гибридизация полинуклеиновых кислот согласно стадии (i) или (ii) с выбранным набором зондов rроВ немутантного типа в подходящих условиях гибридизации и промывки, причем указанный набор включает, по крайней мере, один из следующих зондов (см. таблицу 2):
ML-S1 (SEQ ID NO 58)
ML-S2 (SEQ ID NO 59)
ML-S3 (SEQ ID NO 60)
ML-S4 (SEQ ID NO 61)
ML-S5 (SEQ ID NO 62)
MT-S6 (SEQ ID NO 63)
(iv) обнаружение гибридов, образовавшихся на стадии (iii);
(v) составление заключения о восприимчивости (чувствительность в соотношении с устойчивостью) присутствующего в образце М.leprae к рифампицину из дифференциального сигнала (сигналов) гибридизации, полученного на стадии (iv).
Устойчивость к рифампицину определяют по отсутствию гибридизации с, по крайней мере, одним из ML-S-зондов.
В другом варианте реализации изобретения вышеупомянутые ML-S-зонды могут объединяться со специфичным к виду М.leprae зондом ML-POL-1, давая возможность одновременной идентификации М.leprae и выявления устойчивости к рифампицину, причем указанный вид-специфичный зонд представлен последовательностью SEQ ID NO 57.
Следует отметить, что вышеупомянутые зонды ML-S и зонд ML-POL-1 все содержатся в одном и том же амплифицированном фрагменте гена rpoB M.leprae и сконструированы таким образом, что все они могут использоваться в одних и тех же условиях гибридизации и промывки.
Кроме того, изобретением предусматривается любой из зондов, описанных выше, а также композиции, содержащие, по крайней мере, один из этих зондов.
Изобретение предусматривает также набор праймеров, дающих возможность амплификации области мутаций гена rpoB M. tuberculosis. Наборы праймеров могут выбираться из следующей группы наборов (см. таблицу 2):
Р1 и Р5 (SEQ ID NO 30 и 33)
Р3 и Р4 (SEQ ID NO 31 и 32)
Р7 и Р8 (SEQ ID NO 41 и 42)
Р2 и Р6, в сочетании с (Р1 и Р5), или (Р3 и Р4), или (Р7 и Р8).
Наиболее предпочтительным набором праймеров является следующий:
Р3 и Р4 (SEQ ID NO 31 или 32)
Изобретение предусматривает также набор праймеров, дающих возможность амплификации области мутаций гена rроВ в микобактериях в целом, т.е., по крайней мере, в М.tuberculosis, M.avium, M.paratuberculosis, М.intracellulare, M. leprae, M. scrofulaceum. Эти общие праймеры могут использоваться, например, в образцах, в которых предполагается присутствие иных, чем М.tuberculosis, микобактерий и где желательно иметь более общий метод обнаружения. Набор праймеров состоит из 5'-праймера, выбираемого из следующего набора:
MGRPO-1 (SEQ ID NO 64)
MGRPO-2 (SEQ ID NO 65)
и 3'-праймера, выбираемого из следующего набора:
MGRPO-3 (SEQ ID NO 66)
MGRPO-4 (SEQ ID NO 67)
Последовательность этих праймеров показана в таблице 2В.
Праймеры могут быть помечены меткой выбора (например, биотином). Могут использоваться различные системы амплификации мишеней на основе праймеров, и предпочтительно PCR-амплификация, как представлено в примерах. Может использоваться PCR (цепная полимеразная реакция) в один круг или гнездная PCR.
Изобретением предусматривается также комплект, предназначенный для того, чтобы сделать заключение о спектре устойчивости к антибиотикам присутствующих в биологическом образце микобактерий, возможно в сочетании с одновременной идентификацией соответствующих видов микобактерий, включающий следующие компоненты:
(i) средства, если они нужны, для высвобождения, выделения или концентрирования полинуклеиновых кислот, присутствующих в образце;
(ii) по крайней мере, один из вышеупомянутых наборов праймеров, если он нужен;
(iii) по крайней мере, один из зондов, определенных выше, возможно зафиксированных на твердофазной подложке;
(iv) буфер гибридизации или компоненты, необходимые для получения указанного буфера;
(v) промывочный раствор или компоненты, необходимые для получения указанного раствора;
(vi) средства, если они нужны для обнаружения гибридов, образующихся в результате предшествовавшей гибридизации.
Термин "буфер гибридизации" обозначает буфер, дающий возможность происходить реакции гибридизации между зондами и полинуклеиновыми кислотами, присутствующими в образце, или амплифицированными продуктами в условиях подходящей степени жесткости.
Термин "промывочный раствор" обозначает раствор, дающий возможность промывать гибриды, образующиеся в условиях подходящей степени жесткости.
Более конкретно, изобретение предусматривает описанный выше комплект для одновременного обнаружения М. tuberculosis и его устойчивости к рифампицину.
В другом конкретном случае изобретение предусматривает описанный выше комплект для одновременного обнаружения М.leprae и его устойчивости к рифампицину.
ПОДПИСИ И ОБОЗНАЧЕНИЯ К ТАБЛИЦАМ
В таблице 1 суммированы изменения нуклеотидов и аминокислот (описанные Telenti et al. (1993а и b), Kapur et al., 1994 и в настоящем изобретении) во фрагменте гена rроВ устойчивых к рифампицину изолятов М. tuberculosis. Нумерация кодонов является такой же, как на фиг.1. Новые мутации, описанные в настоящем изобретении, помечены звездочкой (*).
Список обозначений аминокислот:
Arg - аргинин,
Asp - аспарагиновая кислота,
Asn - аспарагин,
Суs - цистеин,
Gln - глутамин,
Glu - глутаминовая кислота,
His - гистидин,
Ley - лейцин,
Lys - лизин,
Met - метионин,
Phe - фенилаланин,
Pro - пролин,
Ser - серии,
Thr - треонин,
Trp - триптофан,
Туr - тирозин,
Val - валин.
В таблице 2 перечисляются последовательности праймеров и зондов, выбираемых из гена rроВ.
2А: М. tuberculosis
2В: другие виды микобактерий
В таблице 3 показаны результаты гибридизации с зондом MT-POL-1, полученные с ДНК из различных микобактериальных и немикобактериальных видов.
В таблице 4 показаны некоторые репрезентативные результаты, полученные методом LiPA для некоторых изолятов М.tuberculosis, которые были секвенированы, и интерпретация различных рисунков LiPA.
В таблице 5 показана встречаемость различных мутаций rроВ в М.tuberculosis в различных географических районах.
Сокращения:
Бел. - Бельгия,
Бнгл. - Бангладеш,
Бен. - Бенин,
Бур-Фа - Буркина Фасо,
Бур. - Бурунди,
Кан. - Канада,
Кол. - Колумбия,
Ег. - Египет,
Гв. - Гвинея,
Гон. - Гондурас,
Пак. - Пакистан,
Руа. - Руанда,
Тун. - Тунис.
В таблице 6 дано сравнение результатов LiPA с определением устойчивости к рифампицину в культуре М.tuberculosis.
Чувств. = чувствительный,
Уст. = устойчивый.
ПОДПИСИ И ОБОЗНАЧЕНИЯ К РИСУНКАМ
На фиг. 1 представлена последовательность нуклеотидов и последовательность аминокислот области мутаций, соответственно, гена rроВ и β-субъединицы РНК-полимеразы штамма Mycobacterium tuberculosis (ITG 9081) немутантного типа (т. е. , неустойчивого). Нумерация кодонов (аминокислот) соответствует таковой у Telenti et al. (1993a). Нуклеотиды или аминокислоты, входящие в число изменений, которые вызывают устойчивость, подчеркнуты. Наблюдаемые мутации заключены в рамку. Горизонтальные полосы указывают положения некоторых из олигонуклеотидных зондов (указано по одному зонду из каждой группы).
На фиг. 2 показана частичная нуклеотидная последовательность вновь описанного мутантного аллеля rроВ штамма М.tuberculosis ITG 9003 (SEQ ID NO 34).
На фиг.3 показаны результаты, полученные на полосках LiPA с зондами S44 и S4444, нанесенными в различных концентрациях на мембранную полоску. В качестве материала-мишени использовали штаммы М.tuberculosis ITG 8872 и ITG 9081.
На фиг.4 дано сравнение характеристики зондов S44 и S4444 в форме линейного зондового анализа. Зонды на полосках А и В являются идентичными, за исключением зондов S44 и S4444. Гибридизацию выполняли с использованием амплифицированного материала, происходящего из штамма М.tuberculosis ITG 8872.
На фиг. 5 показана частичная нуклеотидная последовательность предполагаемого гена rроВ штамма M.paratuberculosis 316F (SEQ ID NO 35).
На фиг. 6 показана частичная нуклеотидная последовательность предполагаемого гена rроВ штамма М.avium ITG 5887 (SEQ ID NO 36).
На фиг. 7 показана частичная нуклеотидная последовательность предполагаемого гена rроВ штамма M.scrofulaceum ITG 4979 (SEQ ID NO 37).
На фиг. 8 показана частичная нуклеотидная последовательность предполагаемого гена rроВ штамма M.kansasii ITG 4987 (SEQ ID NO 56).
На фиг. 9 показаны некоторые мутации rроВ в M.tuberculosis и соответствующие им фиг. LiPA. Система обозначений мутаций соответствует таковой в таблице 1.
Система обозначений рисунков LiPA следующая:
wt = положительная гибридизация со всеми S-зондами и отрицательная гибридизация со всеми R-зондами;
ΔS1-5 = отсутствие гибридизации с соответственным S-зондом;
R2, 4А, 4, 5В = положительная гибридизация с соответственными R-зондами и отсутствие гибридизации с соответствующим S-зондом;
С = положительная контрольная линия: должна быть положительной при правильном проведении теста;
Mtb = зонд MT-POL.
Из каждой группы упомянут только один зонд, однако он представляет всю группу: например, S5 представляет S5, S55, S555, S5555, S55C, S55M.
На фиг.10 показана частота различных мутаций, встречающихся в устойчивых к рифампицину штаммах, анализировавшихся методом LiPA. Система обозначений соответствует таковой на фиг.9.
"Mix" обозначает, что в образце присутствовала смесь штаммов.
"Double" обозначает присутствие двух мутаций в одном штамме.
На фиг. 11 показана частичная нуклеотидная последовательность предполагаемого гена rроВ штамма штамма MAC ITG 926 (SEQ ID NO 69).
Пример 1: Амплификация фрагмента гена rpoB M.tuberculosis
После экстракции нуклеиновой кислоты из микобактериальных изолятов (либо культивированных, либо присутствующих в ткани или жидкой среде тела) использовали 2 мкл продукта, чтобы амплифицировать соответствующую часть гена rpoB путем использования одного или более сочетаний 5'-праймеров (PI (SEQ ID NO 30), Р2, Р3 (SEQ ID NO 31) и Р7 (SEQ ID NO 41)) и 3'-праймеров (Р4 (SEQ ID NO 32), P5 (SEQ ID NO 33), P6 и P8 (SEO ID NO 42)).
Последовательность этих праймеров дана в таблице 2.
P1, Р3, Р4, P5, Р7 и P8 являются новыми последовательностями праймеров, описанными в настоящем изобретении. Р2 и P6 были описаны ранее (Telenti et al., 1993а).
Эти праймеры могут быть помечены меткой выбора (например, биотином). Могут использоваться различные системы амплификации мишеней на основе праймеров. Условия, использовавшиеся для амплификации с применением PCR, описаны ниже. Амплификация в один круг с праймерами Р1 и P5 включала 35 циклов 45 с/94oС, 45 с/58oС, 45 с/72oС. Если предпочтительной являлась гнездная PCR, то во втором круге использовали праймеры Р3 и Р4 и выполняли 25 циклов (45 с/94oС, 60 с/68oС), исходя из 1 мкл продукта первого круга.
Если Р3 и Р4 использовались в амплификации PCR в один круг, то использовался следующий порядок проведения циклов: 30 циклов по 1 мин/95oС, 1 мин/55oС, 1 мин/72oС. Такой же порядок проведения циклов использовали для наборов праймеров Р2/Р6.
PCR обычно выполняли в общем объеме 50 мкл, содержащем 50 мМ КСl, 10 мМ Tris-HCl (pH 8,3), 2,2 мМ MgCl2, no 200 мкл дезоксинуклеозидтрифосфата, 0,01% желатина и 1 U Taq полимеразы.
Концентрации праймеров изменялись между 10 и 25 пмоль/реакция.
Так как набор праймеров Р3/Р4 давал гораздо более сильные сигналы после гибридизации, чем набор праймеров Р2/Р6, первый набор праймеров использовали для всех дальнейших экспериментов по гибридизации. Набор праймеров Р2/Р6 использовали для секвенирования. Гнездную PCR с использованием Р2 и Р6 в качестве внешних праймеров и Р3 и Р4 в качестве внутренних (биотинилированных) праймеров использовали только для прямого обнаружения в клинических образцах (мокротах и биопсиях).
Длина амплифицированных продуктов, контролировавшаяся при помощи гель-электрофореза с агарозой, имела следующие значения:
набор праймеров Р1/Р5: 379 пар оснований;
набор праймеров Р3/Р4: 257 пар оснований;
набор праймеров Р2/Р6: 411 пар оснований;
набор праймеров Р7/Р8: 339 пар оснований.
Пример 2: Секвенирование фрагментов гена rpoB M.tuberculosis
ДНК, экстрагированные из микобактериальных изолятов, о которых известно, что они являются устойчивыми или чувствительными к рифампицину, амплифицировали с использованием праймеров Р2/Р6 (из которых Р6 был биотинилирован на конце 5'). Прямое секвенирование однонитевого продукта PCR выполняли с использованием покрытых стрептавидином бусинок и комплекта Taq Dye Deoxy Terminator/Cycle Sequencing на ДНК-секвенаторе ABI373A (Applied Biosystems, Forster City, CA, USA) в соответствии с рекомендациями производителя. Праймеры, использовавшиеся для секвенирования, были теми же, что использовались для амплификации (Р2 или Р6).
Как и ожидалось, все чувствительные (= чувствительные в культуре и чувствительные по рисунку LiPA) секвенировавшиеся штаммы (7) давали последовательность дикого типа (без мутаций). В большинстве устойчивых штаммов мутации могут быть идентифицированы. Большинство мутаций было описано ранее (Telenti et а1., 1993а и 1993b, Kapur et al., 1994). Однако 4 новые мутации описаны в настоящем изобретении: D516G, Н526С, Н526Т и R529Q (см. также таблицу 1 (*)). Полная последовательность амплифицированного фрагмента rpoB мутантного аллеля Н526С (изолят ITG 9003) показана на фиг.2 (SEQ ID NO 34) в качестве образца.
Несколько штаммов (3/180, см. таблицу 6) были устойчивы к рифампицину в культуре, однако давали картину LiPA немутантного типа. После секвенирования у всех этих изолятов проявлялась последовательность гена немутантного типа, подтверждая результаты гибридизации. Таким образом, возможно, что для этих изолятов применим иной молекулярный механизм устойчивости к рифампицину.
Пример 3: Разработка полоски для линейного зондового анализа (LiPA-полоски)
Принцип и порядок выполнения линейного зондового анализа были такими, как описано ранее (Stuyver et al., 1993), за несколькими исключениями. Вместо внедрения биотинилированного дУТФ использовали биотинилированные праймеры и проводили гибридизацию и обязательную промывку при 50oС в 3•SSC/20% деионизированного формамида.
Мутации в гене rроВ, приводящие к устойчивости к рифампицину, локализованы главным образом в малой области гена, охватывающей 67 нуклеотидов (23 аминокислотных кодона). По крайней мере, 17 нуклеотидов, равномерно распределенных в этой области, связаны с мутациями, ведущими, по крайней мере, к 28 различным изменениям аминокислот. Такая сложность в изменениях нуклеотидов ставит задачи обнаружения всех этих изменений за одну стадию гибридизации. В принципе, на каждый мутировавший сайт был бы необходим один зонд немутантного типа, а на каждое изменение нуклеотида - один мутантный зонд, специфично обнаруживающий эту конкретную мутацию. Следовательно, тест на гибридизацию включал бы, по крайней мере, около 35 специфичных к последовательности олигонуклеотидных зондов, которые сделали бы этот тест сложным в изготовлении и использовании, и, следовательно, менее притягательным коммерчески.
Поэтому был разработан особый метод, в котором используются тщательно отобранные (S-) зонды немутантного типа, охватывающие, каждый из них, более чем один полиморфный сайт и полностью перекрывающие всю исследуемую область (см. фиг.1). При таком подходе набор из, по крайней мере, 10 зондов немутантного типа может быть сведен к общему числу зондов пять или шесть. Эти зонды экспериментально тщательно настроены таким образом, чтобы наличие каждой вызывающей устойчивость мутации в rроВ мутантном районе приводило к четко обнаруживаемому снижению стабильности гибрида между мишенью и, по крайней мере, одним из этих зондов в одних и тех же условиях гибридизации и промывки.
Так как при помощи этого сочетания зондов могут быть обнаружены все описанные до сих пор соответствующие мутации, можно контролировать устойчивость изолятов Mycobaсkerium tuberculosis к рифампицину. Этот набор зондов способен также обнаружить присутствие неописанных мутаций, например, мутацию TGC в положении 526 в штамме ITG 9003.
Хотя при строгом подходе добавление мутантных (R-) зондов к выбранной панели зондов немутантного типа является малоупотребительным, для научных целей может быть информативным выявление того, какая именно точечная мутация имеет место. Поэтому были сконструированы 4 мутантных зонда (R2, R4A, R4B, R5), которые соответствуют наиболее часто встречающимся мутациям и и которые, взятые совместно, способны положительно определять более чем 70% всех случаев устойчивости (см. фиг.10). К этому набору из 4 зондов могут быть добавлены дополнительные мутантные зонды (например, R1, R2B, R2C, R3, R4C, R4D, R4E, R5B, R5C), для того, чтобы положительно идентифицировать наиболее важные в клинической практике случаи устойчивости. Добавление этих зондов приводит также к повышению надежности испытания, так как появление мутантного зонда должно неизбежно приводить к исчезновению зонда немутантного типа, если только речь не идет о смешанных инфекциях. В некоторых случаях в клинической практике может быть важным отличать разные мутации, которые, возможно, присутствуют. Этот случай может, например, иметь место в аминокислотном положении 516. Если присутствующая в этом положении нормальная (немутантного типа) аминокислота (аспарагиновая кислота) заменяется валином или тирозином, это вызывает высокий уровень устойчивости или промежуточный уровень устойчивости к рифампицину; однако неопубликованные данные, по-видимому, указывают на то, что чувствительность к рифабутину сохраняется на том же уровне. Следовательно, при инфекции, вызываемой штаммами с этой мутацией, рифабутин может все еще быть эффективным, тогда как рифампицин - уже нет. То же может быть справедливым для колена 511, но, согласно нашим сведениям, эти положения являются единственными сайтами мутаций, для которых влияние рифампицина и рифабутина может быть различным; обычно штаммы, устойчивые к рифампицину, являются также устойчивыми к рифабутину.
Для того чтобы разработать LiPA-полоску для обнаружения мутаций, порождающих устойчивость к рифампицину (и/или рифабутину) у М.tuberculosis, олигонуклеотидные зонды общим числом 36 были синтезированы и испытаны в тесте на обратную гибридизацию. Последовательность этих зондов перечислена в таблице 2А (мутантные зонды и зонды немутантного типа). Первый набор тестировавшихся зондов был следующий: S1, S2, S3, S4, S5, R2, R4A, R4B и R5. В условиях, используемых для обратной гибридизации, большинство зондов не действовали так, как ожидалось теоретически, и оказалось необходимым ввести модификации, ведущие к синтезу и оценке следующих дополнительных зондов: S11, S33, S44, S4444, S5555, R44A, R444A, R44B, R444B, R55. Из общей панели зондов для дальнейшего использования выбирали зонды, у которых в одних и тех же экспериментальных условиях проявлялись самые оптимальные свойства в том, что касается специфичности и чувствительности.
Предпочтительными зондами с последовательностями немутантного типа (S-зонды), которые совместно перекрывают полную область rроВ, представляющую интерес, являются следующие: S11, S2, S33, S4444 и S55 или S5555 (см. таблицу 2).
Предпочтительными мутантными зондами (R-зонды) являются R2, R444A, R444B и R55 (см. таблицу 2). В некоторых случаях устойчивости отсутствие сигнала гибридизации с S-зондами может сопровождаться положительным сигналом гибридизации с соответствующим R-зондом.
В качестве примера на фиг.9 показаны некоторые из мутаций rроВ и соответствующий им рисунок LiPA.
Хотя зонды из одной и той же группы (например, зонды S4, S44, S444 и S4444) лишь слегка отличаются друг от друга, их гибридизационные характеристики могут значительно различаться. В качестве примера это иллюстрируется в эксперименте, в котором рабочие характеристики зондов S44 и S4444 сравниваются с использованием продуктов PCR, происходящих из двух штаммов М.tuberculosis (ITG 8872 и ITG 9081), демонстрирующих оба штамма, последовательность немутантного типа в области мишени зондов S44 и S4444. Различие между обоими зондами
Зонд S44 выбирали на теоретической основе, исходя из известной последовательности гена (Telenti et al., 1993а). Этот зонд теоретически мог бы быть наилучшим зондом для дискриминации несоответствий в кодоне САС (подчеркнут), так как этот кодон находится в центральной части зонда. Однако в противоположность общим правилам, рабочие характеристики зонда S4444 оказались значительно лучше (как описано в следующем эксперименте).
Оба зонда наносили на нитроцеллюлозные полоски в различных количествах (2,4, 1,2 и 0,6 пмоль/полоска). После фиксации и блокирования полосок зонды подвергали гибридизации биотинилированными фрагментами PCR (из штаммов ITG 8872 и ITG 9081), как описано ранее. Результаты на фиг.3.
В использовавшихся условиях гибридизации (3•SSC, 20% деионизированный формамид, 50oС) сигналы, полученные с зондам S44, очень слабы. С другой стороны, зонд S4444 производит очень сильные и надежные сигналы. Следовательно, зонд S4444 более предпочтителен, чем S44, для использования в LiPA-полоске. Этот яркий эффект не может быть приписан только различию в длине обоих зондов, но, по-видимому, местоположение также имеет значение. Скорее всего, вторичная структура области мишени зондов сильно влияет на гибридизационные свойства.
На фиг. 4 показаны результаты другого эксперимента, в котором рабочие характеристики обоих зондов сравнивают в окружении других зондов. Обе полоски А и В идентично обрабатывали с использованием амплифицированного продукта, происходящего из штамма ITG 8872. Обе полоски являлись почти идентичными, за исключением того, что полоска А содержала зонд S44 (0,6 пмоль), а полоска В - зонд S4444 (0,1 пмоль), различен порядок зондов, нанесенных на полоску. На полоске А зонд S44 дает негативный результат, в то время как на полоске В зонд S4444 дает явно положительный результат, хотя в обоих случаях имеется полное соответствие между мишенью и зондом, и в обоих случаях следовало бы ожидать положительного результата.
Эти результаты ясно показывают, что устройство зонда, особенно в фиксированных условиях схемы обратной гибридизации (одни и те же условия для каждого зонда) не является непосредственно очевидным, и зонды следует тщательно оценивать перед тем, как их можно будет использовать в схеме обратной гибридизации.
В целом, мы можем констатировать, что подходящие зонды не всегда могут быть просто произведены на теоретической основе из известной последовательности гена.
Присутствие молчащих мутаций, хотя и не обнаруженное среди изолятов, тестировавшихся в настоящем изобретении, может привести к рисунку устойчивости на полоске (пропуск одного зонда немутантного типа), хотя штамм является чувствительным. До настоящего времени было описано только одно молчащее замещение (в кодоне 528: CGC-->CGT; Telenti et al., 1993a). Эта мутация привела бы к дестабилизации гибрида с зондом S4444. Однако путем добавления к полоске зонда, специфичного к молчащей мутации (зонд SIL-1, таблица 2), эта молчащая мутация может быть выделена из мутаций, вызывающих устойчивость, и возможность неверной интерпретации наблюдаемых рисунков будет предотвращена. Более того, SIL-зонды могут наноситься на полоску в то же местоположение, что и соответствующие S-зонды (смешанные зонды). При таком подходе не будет наблюдаться отсутствие сигналов гибридизации в результате молчащей мутации.
Для того чтобы обнаружить мутации со вставкой, сообщающие устойчивость к рифампицину, 514insF и 514insFM (см. фиг.1) были сконструированы два новых типа зондов, S6 и S66, последовательность которых представлена в таблице 2. Гибридизация с нуклеиновыми кислотами, происходящими из штаммов, содержащих эти мутации со вставкой, приводит к отсутствию сигнала гибридизации с S6 и S66 (см. также таблицу 1).
Для того, чтобы положительно идентифицировать больше мутаций, чем можно обнаружить при помощи набора зондов R2, R4A, R4B и R5, был сконструирован ряд дополнительных R-зондов, которые могут быть добавлены на LiPA-полоску, при использовании одних и тех же условий гибридизации и промывки. Совместно с описанными выше R-зондами дополнительные R-зонды (R1, R2B, R2C, R3, R4C, R4D, R4E, R5B, R5C) дают возможность положительной идентификации мутаций, наиболее часто встречающихся в коллекции штаммов, испытывавшихся в настоящей заявке.
Пример 4: Зонд, специфичный к комплексу М.tuberculosis
Для того чтобы получить возможность одновременного обнаружения мутаций, вызывающих устойчивость к рифампицину, прямо объединенного с обнаружением патогенного in casu M.tuberculosis, было разработано испытание с линейным зондом.
Так как является крайне выгодным иметь возможность одновременного обнаружения присутствия М.tuberculosis и присутствия либо отсутствия гена или мутации, вызывающих устойчивость к лекарственным препаратам, цель состояла в том, чтобы разработать зонд к М.tuberculosis, содержащийся в том же фрагменте PCR, что и, по крайней мере, один из имеющих отношение к устойчивости маркеров, которые будут идентифицироваться. Поэтому были подвергнуты секвенированию гены rроВ изолятов, не являющихся М.tuberculosis. Эти организмы представляли собой М. paratubercolosis 316F, М.avium ITG 5887, M.scrofulaceum ITC 4979 и М.kansasii ITG 4987. Последовательности соответствующих фрагментов гена rроВ показаны на фиг. с 5 по 8, соответственно. Кроме того, последовательности фрагментов гена rроВ М.leprae и М.intracellulare известны из литературы (Honore and Cole, 1993; Guerrero et al., 1994). Сравнение этих последовательностей с последовательностью гена rроВ М.tuberculosis позволяет провести очерчивание конкретной области (вне области, ответственной за устойчивость) во фрагменте гена rроВ, для которой представляется осуществимым получение из нее зондов, которые потенциально специфичны к М.tuberculosis. Олигонуклеотидный зонд (далее обозначаемый как MT-POL-1), произведенный из этой области со следующей последовательностью:
GCA CGT GGA GGG GAT САС АСС (SEQ ID NO 23)
оценивали далее в отношении его чувствительности и специфичности путем гибридизации на LiPA-полосках. Условия амплификации и гибридизации были такими же, как описано выше. Результаты суммированы в таблице 3. В дополнение к четырем штаммам М.tuberculosis, перечисленным в таблице 3, было протестировано еще 521 клинических изолятов М.tuberculosis: все изоляты дали положительный сигнал гибридизации. Очевидно, с зондом гибридизуются также штаммы М.bovis, однако для данной цели не является важным в клиническом отношении отличать М. tuberculosis от M.bovis. Фактически, во всей заявке термин "" можно заменить на термин "комплекс М.tuberculosis", относящийся к собственно М.tuberculosis, M.bovis, М.africanum и M.microti, без влияния на значимость результатов.
Хотя, используя наборы праймеров, описанные в примере 1, можно получить продукт PCR с ДНК некоторых других видов Mycobacterium и даже некоторых не связанных генетически микроорганизмов, которые также могут присутствовать в дыхательном тракте, ни для одной из этих бактерий не проявляется гибридизация с выбранным зондом МТ-POL-l. В заключение мы можем констатировать, что выбранный зонд является высоко специфичным к штаммам комплекса М.tuberculosis и на 100% чувствительным к М.tuberculosis. Для специфичного обнаружения штаммов комплекса М.tuberculosis также могут быть полезны другие зонды из этой области, такие как: KT-POL-2, MT-POL-3, MT-POL-4 и MT-POL-5 (см. таблицу 2).
Подобным же образом, следующие зонды могут использоваться для того, чтобы отличить штаммы М.avium, M.paratubercolosis, М.scrofulaceum, M.kansasii, М. intracellulare и M. leprae друг от друга и от других микобактерий: MA-POL-1, MP-POL-1, MS-POL-1, MK-POL-1, MI-POL-1 и ML-POL-1, соответственно (см. таблицу 2В).
Пример 5: Оценочные испытания LiPA-полосок для М.tuberculosis
Были приготовлены LiPA-полоски, несущие следующие зонды (в дополнение к линии положительного контроля): MT-POL-1, S11, S2, S33, S4444, S5555, R2, R444A, R444B, R55.
Эти полоски гибридизовали с продуктами PCR из штаммов М.tubercolosis, для которых была определена соответствующая последовательность гена rроВ. Некоторые репрезентативные результаты суммированы в таблице 4.
Результаты гибридизации полностью коррелируют с результатами секвенирования, показывая, что используемые зонды могут осуществлять дискриминацию на уровне единичного несоответствия. Каждая отбираемая мутация может быть обнаружена либо по отсутствию одного из зондов немутантного типа (S-зондов), либо по отсутствию зонда немутантного типа совместно с присутствием соответствующего мутантного зонда (R-зонда). В последнем случае из результатов гибридизации можно определить, какая именно мутация имеет место. Однако знать, какая именно мутация имеет место, не является необходимым для того, чтобы определить, имеют ли дело с устойчивым к рифампицину штаммом или нет, так как каждая отбираемая мутация вызывает такую устойчивость. Чувствительные штаммы, т.е. штаммы без мутаций в соответствующей части гена rроВ, дают положительные реакции на все S-зонды, в то время как все R-зонды дают отрицательные значения (= wt-рисунок).
Пример 6: Прямое определение штаммов М.tuberculosis и устойчивости к рифампицину в клинических образцах
Анализу подвергались шестьдесят восемь клинических образцов различного географического происхождения (13 и 35 образцов мокроты из Бельгии и Руанды соответственно, и 20 биопсий из лимфоузлов из Бурунди), все дающие положительные результаты на М. tubercolosis в культуре и сохранявшиеся при -20oС. Приготовление образцов для амплификации основывалось на методике Boom et al. (1990), модифицированной De Beenhouwer et al. (представлено на рассмотрение). Метод гнездной PCR для соответствующей области гена rроВ реализовывали при помощи биотинилированных внутренних праймеров (Р3 и Р4). После цикла термической обработки амплифицированный продукт подвергали инкубации с LiPA-полосками. Устойчивость к рифампицину определяли по Левенштайну-Дженсену  с использованием метода пропорций Canetti et al. (1963). Для устойчивых штаммов определяли MIC (минимальную тормозящую концентрацию) на агаре 7Н10 (Heifets, 1988). По данным микроскопии 20 образцов (29,4%) были отрицательными, 15 (22,1%) в слабой степени положительными (1+ или менее согласно шкале American Thoracic Society) и 33 (48,5%) в сильной степени положительными (≥+2) при окрашивании по методу Циля-Нельсена.
с использованием метода пропорций Canetti et al. (1963). Для устойчивых штаммов определяли MIC (минимальную тормозящую концентрацию) на агаре 7Н10 (Heifets, 1988). По данным микроскопии 20 образцов (29,4%) были отрицательными, 15 (22,1%) в слабой степени положительными (1+ или менее согласно шкале American Thoracic Society) и 33 (48,5%) в сильной степени положительными (≥+2) при окрашивании по методу Циля-Нельсена.
Анализ методом LiPA обнаружил чувствительность к рифампицину в 49 образцах (положительны только зонды на М.tubercolosis и зонды немутантного типа) и устойчивость в 19 образцах (зонд на М. 11:22 tubercolosis положителен, один из зондов немутантного типа пропущен и, наконец, один из мутантных зондов положителен). Тестирование на восприимчивость к рифампицину in vitro подтвердило эти результаты, за тремя исключениями. Для всех чувствительных штаммов наблюдался рисунок чувствительного зонда, показывая, что возможные молчащие мутации в этой серии не были обнаружены. При помощи стандартных методик было найдено, что все штаммы, у которых проявляется картина устойчивости, являются устойчивыми. Для трех образцов (от трех устойчивых одновременно к ряду лекарственных препаратов пациентов из Руанды) в результате PCR-LiPA был получен рисунок чувствительности, хотя у культуры имела место устойчивость (MIC ≥ 2 мкг/мл на 7Н10). Секвенирование области rроВ этих штаммов подтвердило наличие последовательности гена немутантного типа, что, возможно, предполагает в этих случаях другой механизм устойчивости к рифампицину или мутацию в другой части гена rроВ.
Интересно также отметить, что система с гнездной PCR давала положительные результаты для всех тестировавшихся образцов, положительных в культуре, включая 20 образцов, отрицательных по Цилю-Нельсену. В другом эксперименте (данные не представлены), охватывавшем 17 отрицательных по мазкам образцов мокроты из отрицательных в культуре случаев клинического подозрения на туберкулез, при применении системы LiPA вообще не было получено сигналов, показывая, что, скорее всего, инфекции были вызваны не M.tubercolosis.
В последующем эксперименте тестировали при помощи LiPA большую коллекцию клинических образцов различного географического происхождения. Результаты показаны в таблице 5. Из 137 найденных устойчивых штаммов абсолютное большинство можно было отнести к одной из мутаций, представляемых R-зондами (R2, R4A, R4B, R5). Интересно, что некоторые мутации, по-видимому, более часто встречаются в некоторых странах по сравнению с другими (например, в Тунисе и Египте: R4B (=H526D), в
Руанде: R5 (S531L). Это может в итоге вести к различным схемам тестов в различных странах.
Из общего числа 213 устойчивых к рифампицину штаммов, анализировавшихся при помощи LiPA в настоящей заявке, 151 (71%) может быть отнесен к мутациям S531L, H526D, D516V или H526Y и, таким образом, их можно было обнаружить по положительному отклику с зондами R5, R4B, R2 и R4A соответственно (см. фиг. 10).
Из общего числа 180 штаммов, анализировавшихся как в культуре, так и при помощи LiPA, правильная идентификация (чувствительный/устойчивый) была сделана для 164 (91,1%) штаммов (см. таблицу 6). Для трех устойчивых штаммов результаты LiPA и секвенирования показали наличие фрагмента гена rроВ немутантного типа, что говорит о том, что механизм устойчивости к рифампицину не мог быть приписан мутациям в исследованной части гена rроВ.
Тринадцать из 180 анализировавшихся штаммов были устойчивыми согласно LiPA, но, по-видимому, чувствительными в культуре. Однако после рекультивирования 2 из этих 13 штаммов в синтетической среде 7Н11 вместо традиционной среды Левенштайна-Дженсена оказалось, что они так или иначе устойчивы к рифампицину. Эти до сих пор не публиковавшиеся данные показывают, что стандартная среда Левенштайна-Дженсена не рекомендуется для определения восприимчивости микобактерий к антибиотикам (возможно, вследствие присутствия следов антибиотиков, найденных в имеющихся в продаже яйцах, используемых для приготовления среды Левенштайна-Дженсена). Таким образом, ожидается, что процент штаммов с противоречивыми свойствами, которые устойчивы согласно LiPA, но чувствительны в культуре (в данном случае 13/180 = 7,2%) будет много ниже (и, возможно, составит 0%) в том случае, если культивирование производится на синтетической среде, подобной 7Н11.
Интересно, что большинство устойчивых к рифампицину изолятов, исследованных в настоящей заявке, было, к тому же, устойчиво к изониазиду, и, таким образом, одновременно устойчиво к ряду лекарственных препаратов (определение устойчивости к ряду лекарственных препаратов = устойчивость, по крайней мере, к изониазиду и рифампицину). Таким образом, устойчивость к рифампицину можно рассматривать как потенциальный маркер устойчивости одновременно к ряду лекарственных препаратов, и, следовательно, описанный выше тест LiPA может быть важным средством контроля случаев устойчивого к ряду лекарственных препаратов туберкулеза.
В итоге, описанный выше метод дает возможность корректной идентификации М. tubercolosis и одновременного обнаружения устойчивости к рифампицину непосредственно в клинических образцах без предварительного культивирования. Он дает возможность легко обнаруживать устойчивость к рифампицину непосредственно в клинических образцах в течение менее чем 24 часов.
Пример 7: Обнаружение устойчивости к рифампицину в M.leprae
Описанный выше способ обнаружения может также применяться для обнаружения присутствия М.leprae в биологических образцах, объединенного с выявлением его устойчивости к рифампицину. Последовательность гена rроВ М.1eprae была описана ранее Ноnоrе и Cole (1993). Они идентифицировали лишь ограниченное число мутаций, ответственных за устойчивость М.leprae к рифампицину. Резонно было бы ожидать, что, подобно М.tubercolosis, ряд других мутаций может вызывать устойчивость М.leprae к. рифампицину, и что большая часть из этих мутаций будет локализована в весьма ограниченной области гена rроВ, соответствующей "области мутаций", описанной ранее в настоящей заявке.
Поэтому выбирали набор зондов немутантного типа, перекрывающий предполагаемую область мутаций в гене rроВ М.leprae (см. таблицу 2В):
ML-S1 (SEQ ID NO 58)
ML-S2 (SEQ ID NO 59)
ML-S3 (SEQ ID NO 60)
ML-S4 (SEQ ID NO 61)
ML-S5 (SEQ ID NO 62)
ML-S6 (SEQ ID NO 63).
Устойчивость к рифампицину устанавливали по отсутствию гибридизации с, по крайней мере, одним из этих ML-зондов. Этот набор ML-зондов будет определять вызывающие устойчивость к рифампицину мутации в этой области, даже если последовательность этих мутаций еще не определена.
Вышеупомянутые ML-S-зонды тщательно сконструированы таким образом, что все они могут использоваться в одних и тех же условиях гибридизации и промывки. То же самое распространяется на видоспецифичные зонды ML-POL-1, с которыми могут объединяться ML-S-зонды, чтобы получить возможность одновременного обнаружения М.leprae и его устойчивости к рифампицину.
Все зонды, упомянутые в данном примере, содержатся в одном и том же фрагменте гена rpoB M.leprae, который может быть получен при помощи PCR с использованием набора праймеров, выбранных из MGRPO-1 или MGRPO-2 (5'-праймеры) и MGRPO-3 или MGRPO-4 (3'-праймеры).




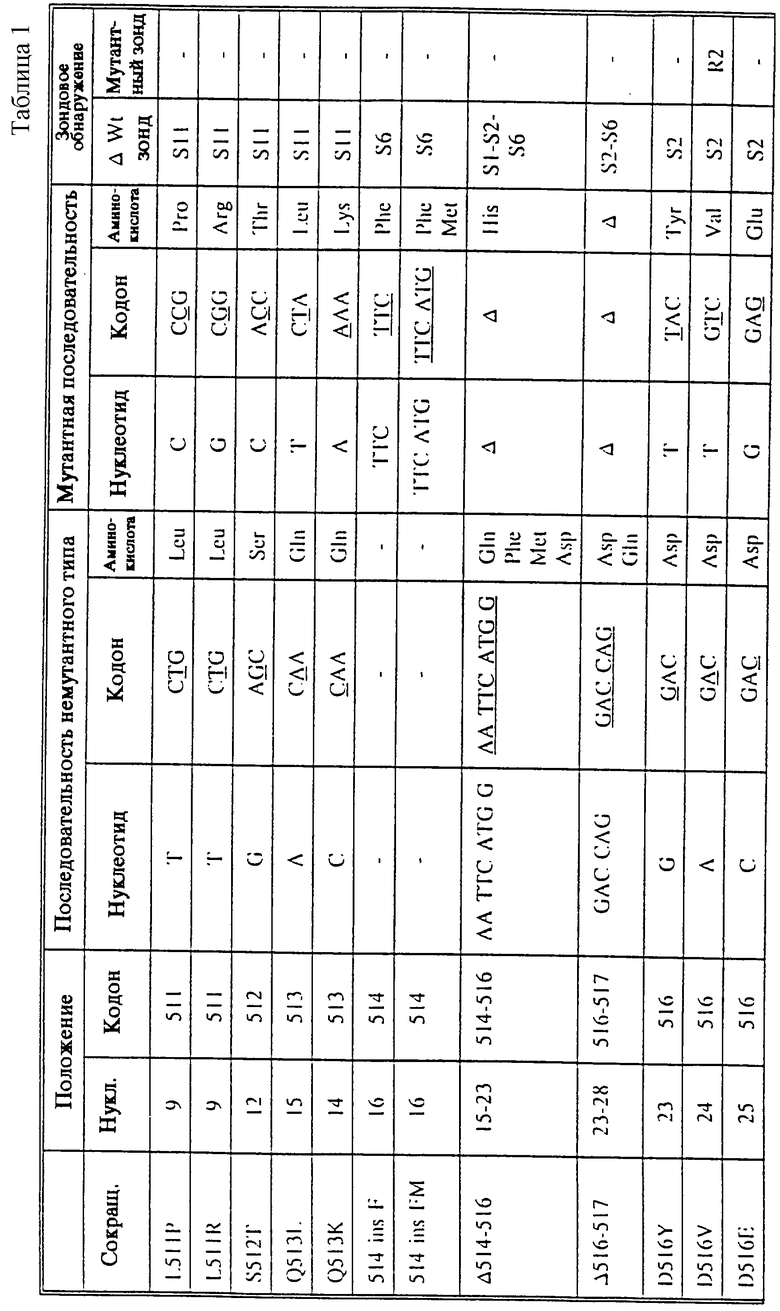
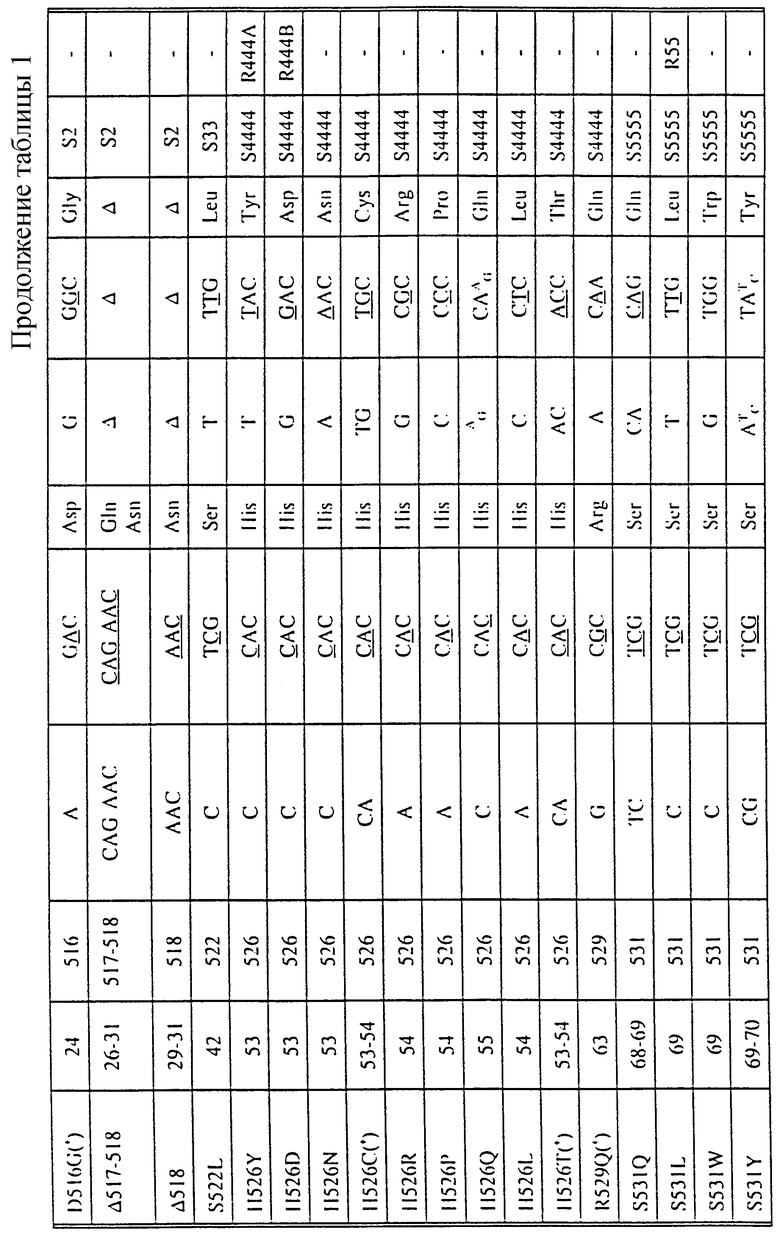
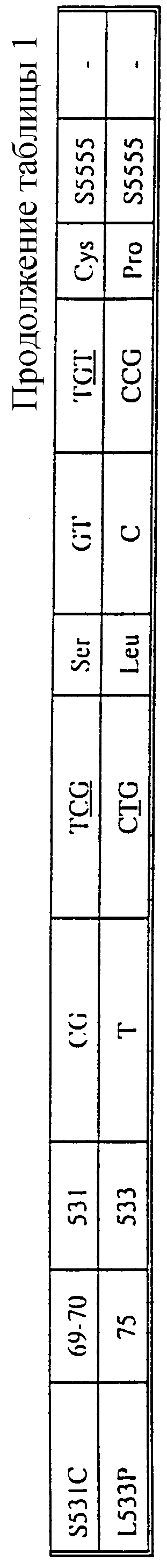


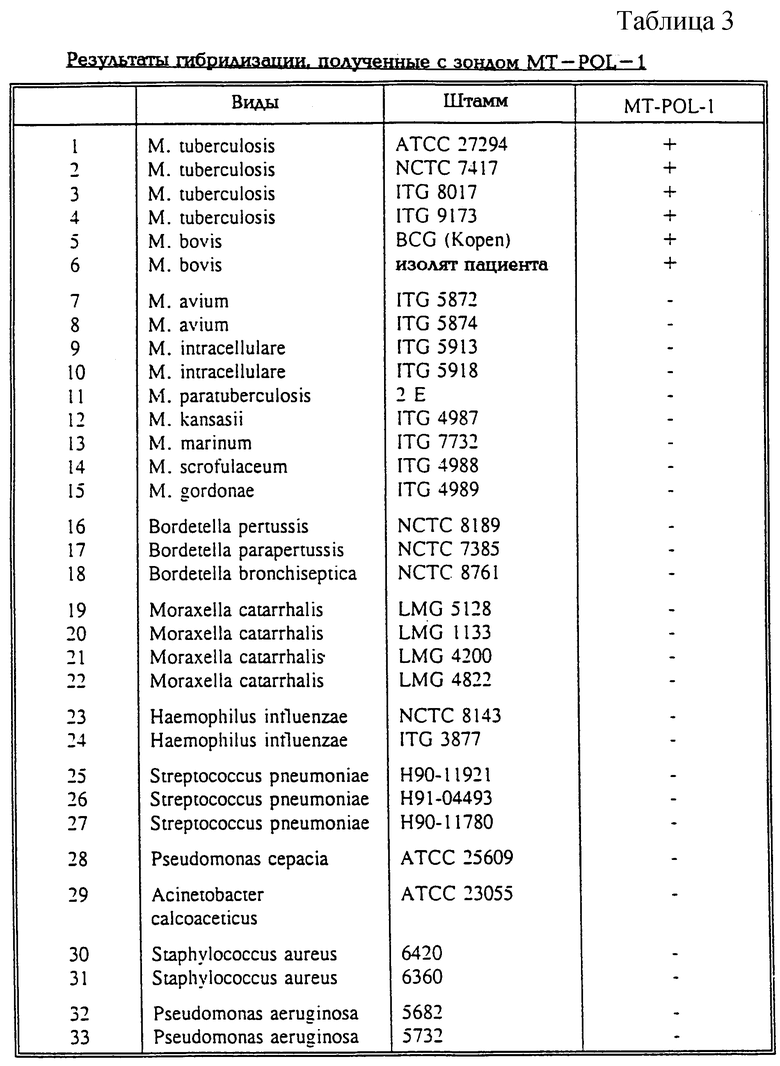
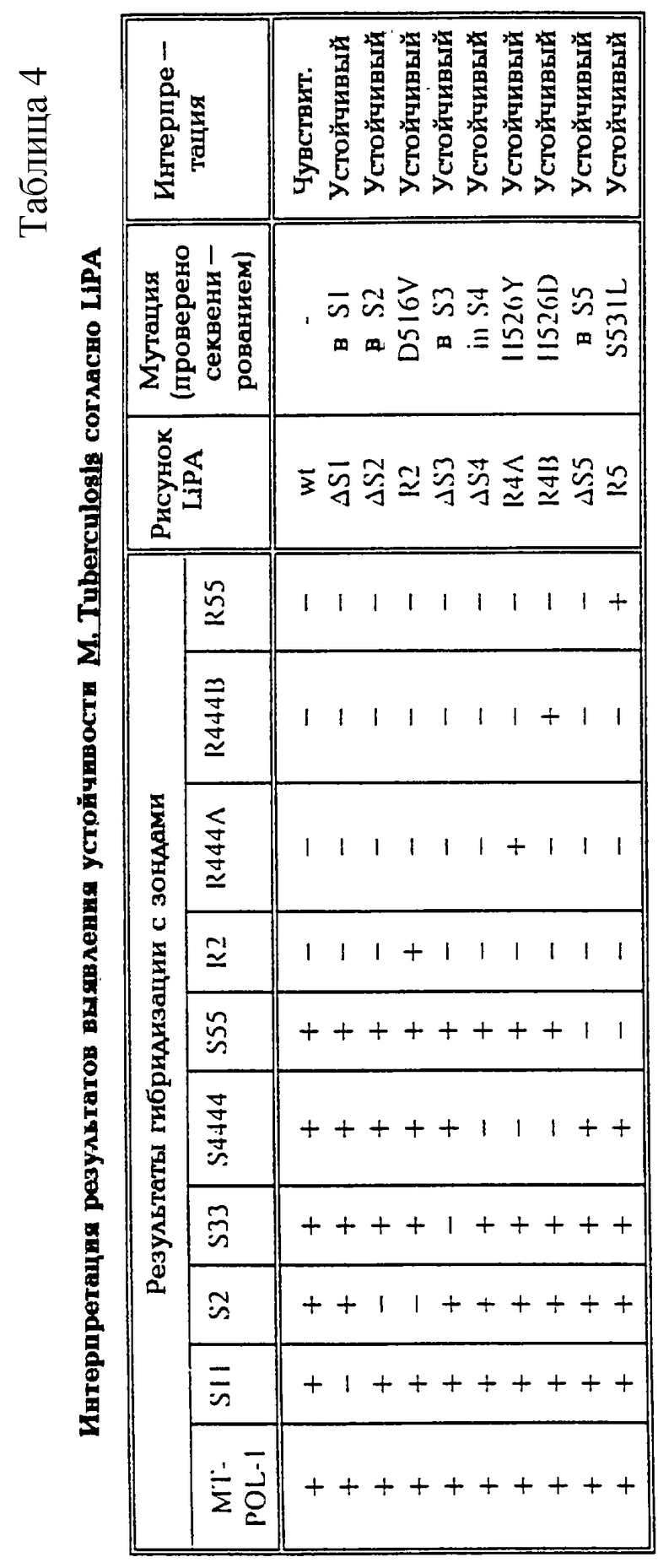
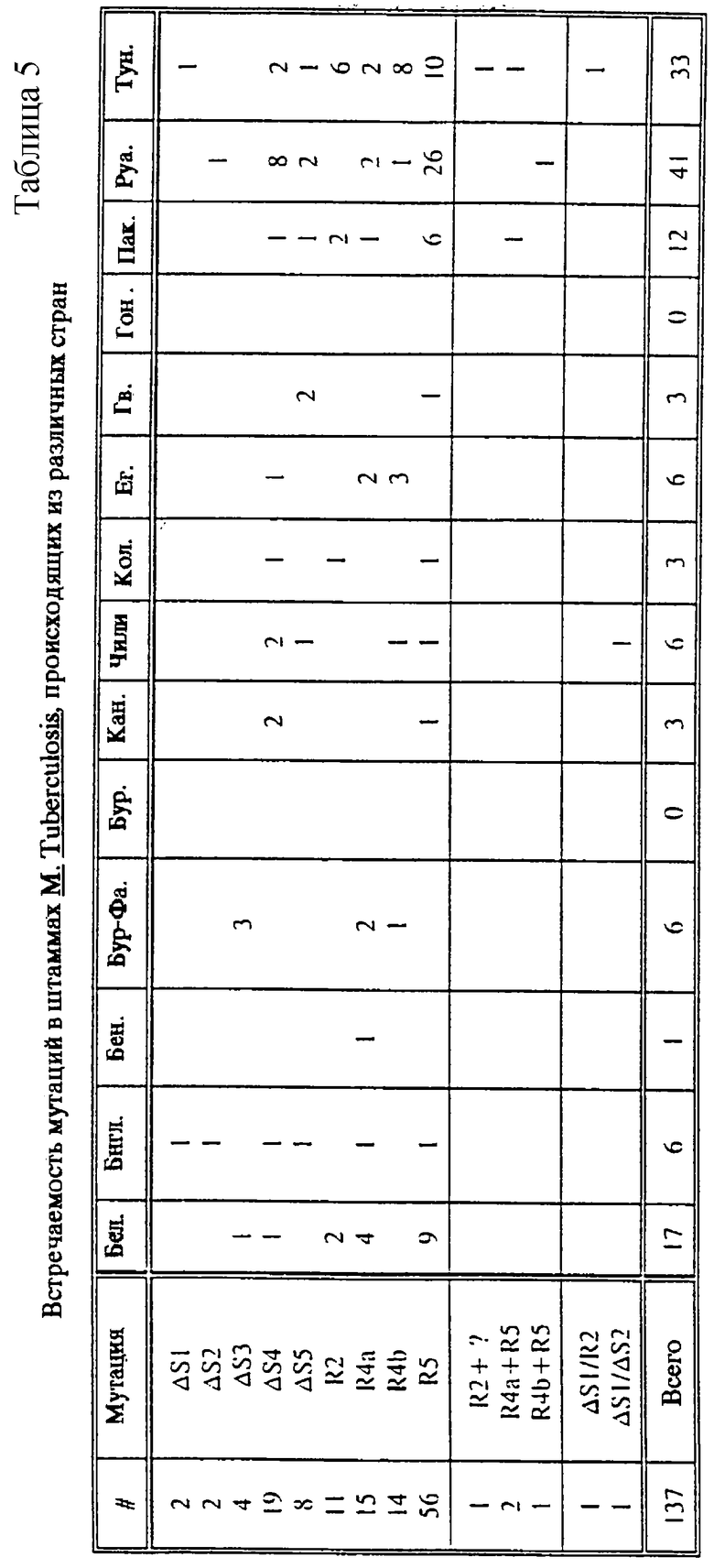


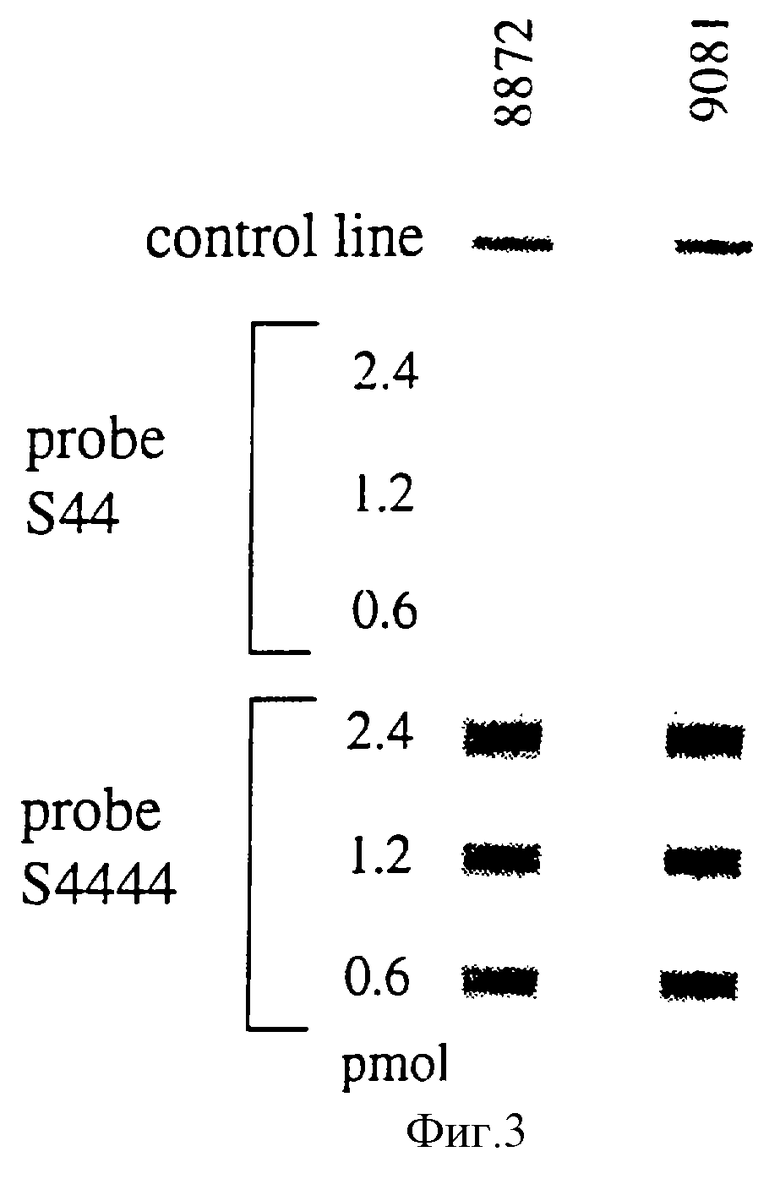






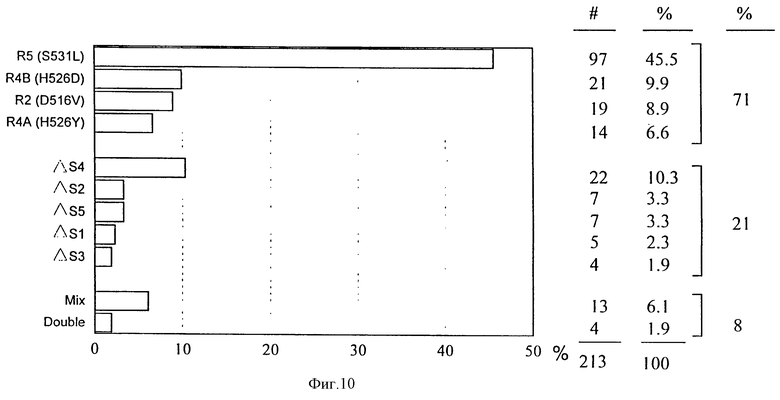
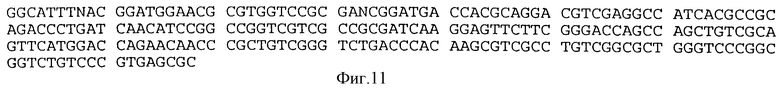
Изобретение относится к области медицинской микробиологии и может быть использовано для диагностики заболеваний, вызванных микобактериями, а также лечения данных заболеваний с помощью антибиотиков. Способ выявления устойчивости микобактерий к рифампицину и его аналогам позволяет одновременно идентифицировать и виды микобактерий. Способ основан на исследовании ДНК микобактерий, гибридизации их с одним из зондов на основе гена rpoB (сведения о последовательностях нуклеотидов приведены в тексте описания) с последующим выявлением гибридов. Для осуществления способа созданы зонды и наборы праймеров. Сконструирована диагностическая композиция для выявления устойчивости микобактерий к рифампицину и диагностики туберкулеза и лепры. Использование изобретения позволяет унифицировать способ, осуществить раннюю диагностику заболеваний и ускорить распознавание устойчивости к туберкулостатическим средствам, что является существенным для лечения и оптимального контроля за вспышками эпидемии. 7 с. и 20 з.п.ф-лы, 11 ил., 6 табл.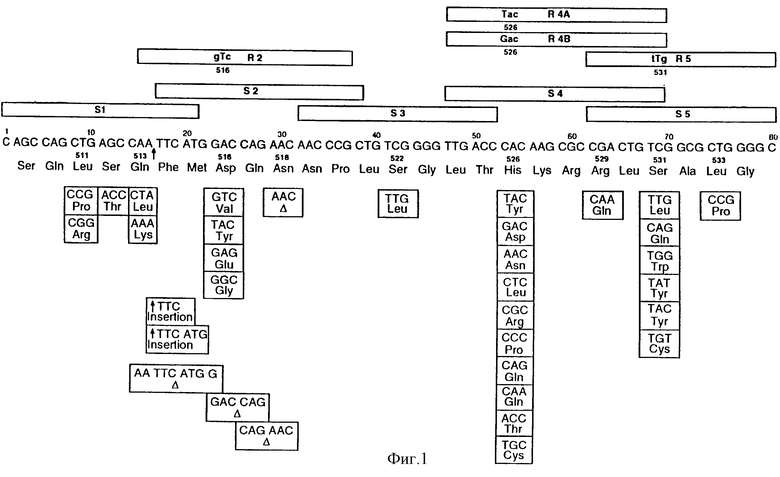
(vi) при необходимости средства для обнаружения гибридов, образующихся в результате предшествовавшей гибридизации.
| WO 9322454 А, 11.11.1993 | |||
| Справочник по микробиологическим и вирусологическим методам исследования./ Под ред | |||
| М.О | |||
| БИРГЕРА | |||
| - М.: Медицина, 1982, с.271-276. |
Авторы
Даты
2003-05-20—Публикация
1995-06-09—Подача