Текст описания приведен в факсимильном виде.


















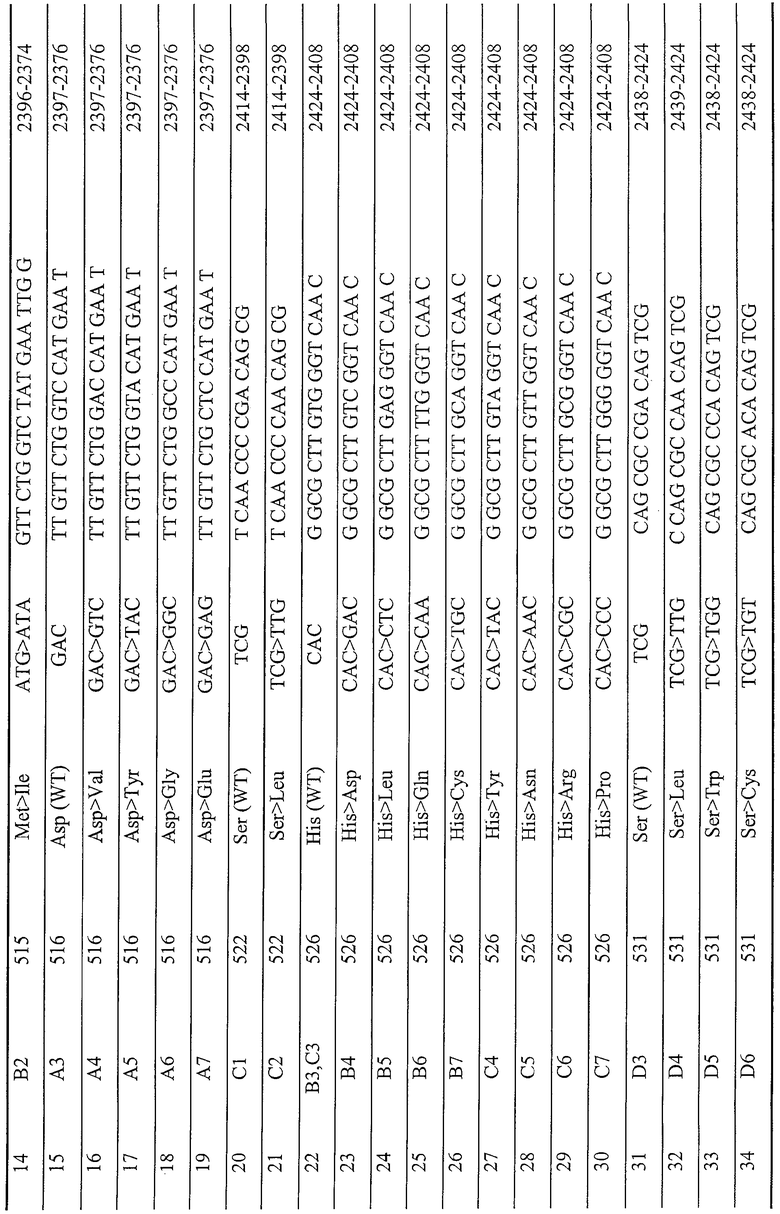





































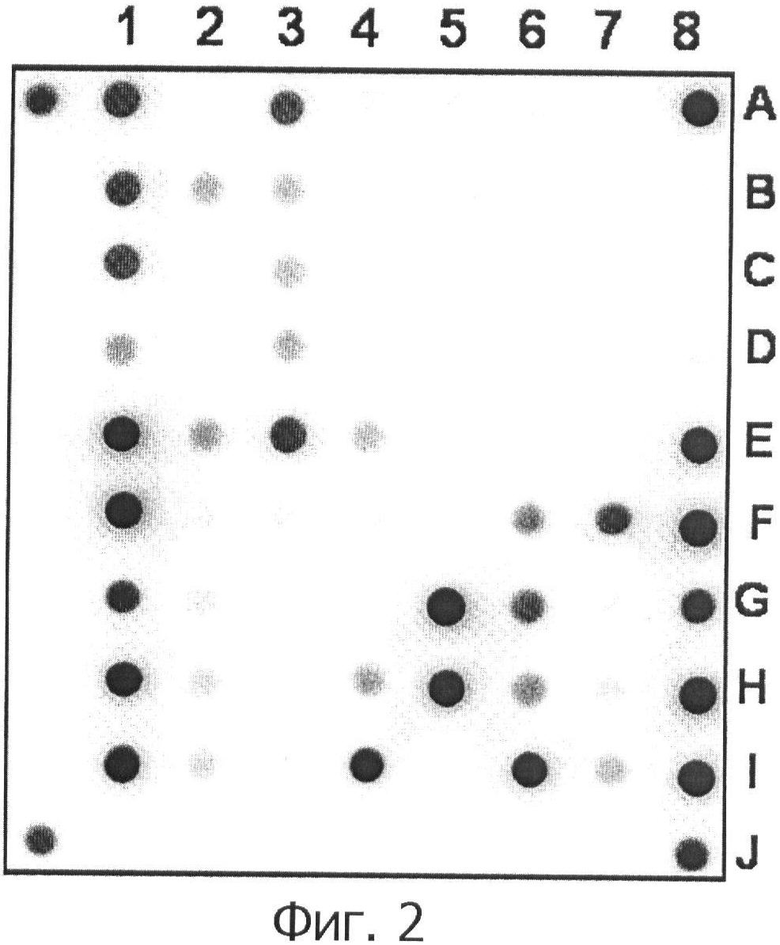

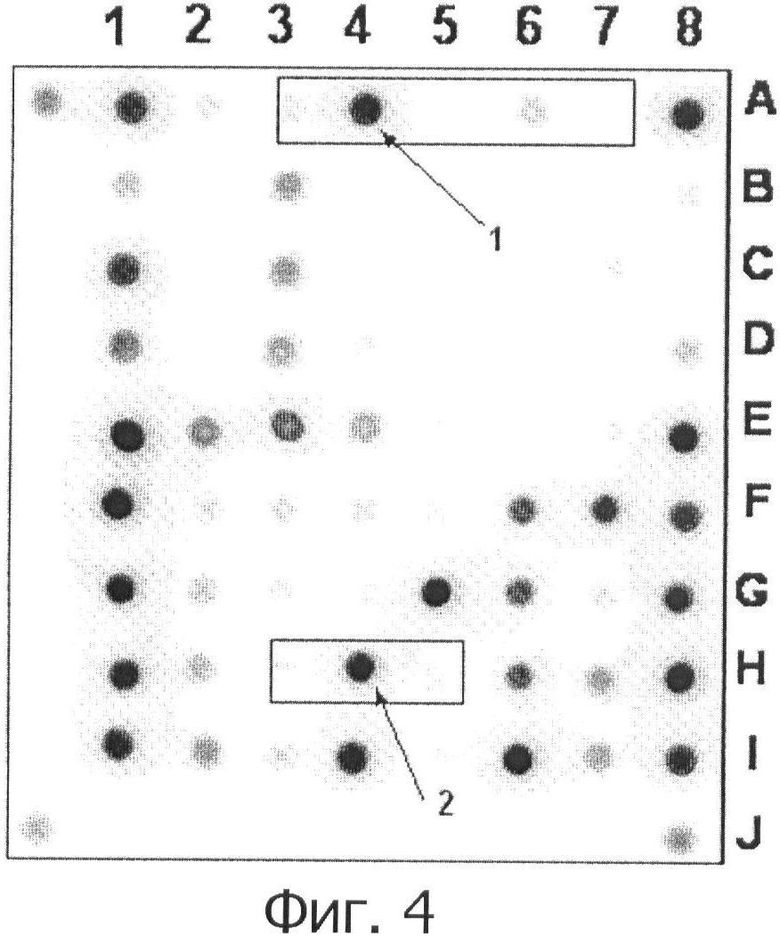


Способ по изобретению основан на двустадийной мультиплексной ПЦР с получением флуоресцентно меченных фрагментов ДНК с последующей гибридизацией этих фрагментов на микрочипе, содержащем набор специфичных дискриминирующих олигонуклеотидов с определенной нуклеотидной последовательностью. Определение устойчивости микобактерий туберкулеза к рифампицину и изониазиду проводят путем выявления точечных нуклеотидных замен в ДНК микроорганизма. Изобретение также касается набора праймеров, биочипа и набора олигонуклеотидных зондов, используемых при осуществлении способа. Изобретение позволяет проводить анализ непосредственно из клинического образца, определять одновременно несколько мутаций, снизить себестоимость анализа и сократить время его проведения. 4 н. и 5 з.п. ф-лы, 6 ил., 2 табл.
1. Способ одновременного обнаружения микобактерий туберкулезного комплекса и идентификации мутаций в ДНК микобактерий, приводящих к устойчивости микроорганизмов к рифампицину и изониазиду, в клинических образцах, включающий:
(A) - мультиплексную амплификацию фрагментов генов rpoB, katG, inhA, ahpC, мобильного элемента IS6110 с использованием набора пар специфичных праймеров для первой стадии ПЦР, последовательности которых представлены SEQ ID NO: 70, 71, 74, 75, 77, 78, 80, 81, 83, 84;
(Б) - мультиплексную амплификацию фрагментов генов rроВ, katG, inhA, ahpC, мобильного элемента IS6110 с использованием в качестве матрицы продукта ПЦР, полученного на стадии (А), и набора пар специфичных праймеров для второй стадии ПЦР, последовательности которых представлены SEQ ID N0:72, 73, 74, 76, 77, 79, 80, 82, 83, 85, причем один праймер в каждой паре праймеров является флуоресцентно меченным, с получением преимущественно одноцепочечных флуоресцентно меченых фрагментов;
(B) - обеспечение биочипа для одновременного обнаружения микобактерий туберкулезного комплекса и идентификации мутаций, приводящих к устойчивости к рифампицину и изониазиду, представляющего собой подложку с гелевыми элементами, в которых иммобилизованы олигонуклеотидные зонды, последовательности которых представлены SEQ ID NO: 1-69, причем в каждом из гелевых элементов иммобилизован индивидуальный олигонуклеотидный зонд, имеющий последовательность, выбранную из группы, включающей последовательности: а) соответствующие последовательности фрагмента гена rроВ дикого типа; б) соответствующие последовательности фрагмента мутантного варианта гена rpoВ, приводящего к устойчивости микроорганизмов к рифампицину; в) комплементарные последовательностям, охарактеризованным в а) и б); г) соответствующие последовательности фрагмента гена katG дикого типа; д) соответствующие последовательности фрагмента мутантного варианта гена katG, приводящего к устойчивости микроорганизмов к изониазиду; е) комплементарные последовательностям, охарактеризованным в г) и д); ж) соответствующие последовательности фрагмента гена inhA дикого типа; з) соответствующие последовательности фрагмента мутантного варианта гена inhA, приводящего к устойчивости микроорганизмов к изониазиду; и) комплементарные последовательностям, охарактеризованным в ж) и з); к) соответствующие последовательности фрагмента гена ahpC дикого типа; л) соответствующие последовательности фрагмента мутантного варианта гена ahpC, приводящего к устойчивости микроорганизмов к изониазиду; м) комплементарные последовательностям, охарактеризованным в к) и л); н) соответствующие последовательности фрагмента мобильного элемента IS6110; о)комплементарные последовательности, охарактеризованной в н);
(Г) - гибридизацию амплифицированных меченных продуктов, полученных на стадии (Б), на биочипе в условиях, обеспечивающих разрешение в один нуклеотид между образующимися в результате гибридизации совершенными и несовершенными дуплексами;
(Д) - регистрацию и интерпретацию результатов гибридизации путем сравнения интенсивности флуоресценции сигналов в пределах одной группы ячеек, в которых образовались совершенные и несовершенные гмбридизационные дуплексы, при этом максимальный сигнал флуоресценции свидетельствует об образовании совершенного гибридизационного дуплекса, на основании чего делают вывод о наличии устойчивости/чувствительности к рифампицину и изониазиду, причем такая процедура проводится для каждой группы ячеек с иммобилизованными зондами.
2. Способ по п.1, характеризующийся тем, что на второй стадии мультиплексной ПЦР (Б), с целью получения преимущественно одноцепочечных флуоресцентно меченных фрагментов для всех используемых пар праймеров, флуоресцентно меченный праймер используют в молярном избытке по отношению ко второму праймеру, составляющему ту же пару.
3. Способ по п.1, характеризующийся тем, что амплификацию фрагментов генов и мобильного элемента IS6110 проводят, используя непосредственно материал клинического образца (мокроту, экссудат, смыв, бронхо-альвеолярный лаваж) или предварительно выращенную культуру микроорганизмов.
4. Способ по п.1, характеризующийся тем, что, с целью обеспечения разрешения в один нуклеотид между образующимися в результате гибридизации совершенными и несовершенными дуплексами, используют гибридизационный буфер, позволяющий проводить гибридизацию в расширенном интервале температур.
5. Способ по п.1, характеризующийся тем, что регистрацию результатов на стадии (Д) проводят с помощью портативного анализатора флуоресценции и программного обеспечения, что позволяет использовать программную обработку интенсивностей сигналов с последующей интерпретацией результатов.
6. Способ по п.1, характеризующийся тем, что интерпретированные результаты могут быть применены для подтверждения клинического диагноза туберкулез и целей эпидемиологического генотипирования, используя в качестве маркера наличие той или иной мутации.
7. Набор специфичных пар праймеров для осуществления способа одновременного обнаружения микобактерий туберкулезного комплекса и идентификации мутаций в ДНК микобактерий, приводящих к их устойчивости к рифампицину и изониазиду, в клинических образцах, причем последовательности праймеров представлены SEQ ID NO: 70-85.
8. Биочип, используемый в способе одновременного обнаружения микобактерий туберкулезного комплекса и идентификации мутаций в ДНК микобактерий, приводящих к устойчивости к рифампицину и изониазиду, в клинических образцах, представляющий собой подложку с гелевыми элементами, в каждом из которых иммобилизован уникальный олигонуклеотидный зонд, причем последовательности зондов представлены SEQ ID NO: 1-69.
9. Набор олигонуклеотидных зондов, используемый для получения биочипа, используемого в способе одновременного обнаружения микобактерий туберкулезного комплекса и идентификации мутаций в ДНК микобактерий, приводящих к устойчивости к рифампицину и изониазиду, в клинических образцах, причем зонды имеют последовательности SEQ ID NO: 1-69.
| CN 1341752, 27.03.2002 | |||
| US 2003108881 A, 12.06.2003 | |||
| JP 2005087132 A, 07.04.2005 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ ТОЧЕЧНЫХ НУКЛЕОТИДНЫХ ЗАМЕН В ДНК МИКОБАКТЕРИЙ, СПОСОБ ДИАГНОСТИКИ УСТОЙЧИВОСТИ МИКОБАКТЕРИЙ К РИФАМПИЦИНУ, БИОЧИП ДЛЯ ОСУЩЕСТВЛЕНИЯ ЭТИХ СПОСОБОВ | 2000 |
|
RU2175015C1 |
| RU 2200323 C1, 10.03.2003 | |||
| СПОСОБ ВЫЯВЛЕНИЯ УСТОЙЧИВОСТИ МИКОБАКТЕРИЙ К РИФАМПИЦИНУ С ВОЗМОЖНОЙ ИХ ИДЕНТИФИКАЦИЕЙ, СПОСОБ ГИБРИДИЗАЦИИ, ЗОНД И КОМПОЗИЦИЯ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ, НАБОР ПРАЙМЕРОВ (ВАРИАНТЫ) | 1995 |
|
RU2204608C2 |
| JP 2004154125 A, 03.06.2004 | |||
| ГИДРАВЛИЧЕСКИЙ ПРЕСС | 1966 |
|
SU222872A1 |
Авторы
Даты
2009-12-20—Публикация
2005-12-26—Подача