Изобретение относится к области биотехнологии и медицины, а именно к препаратам для лечения заболеваний сердечно-сосудистой системы и способам их применения, в частности к антитромботическим препаратам, полученным на основе моноклональных антител (монАТ).
Внутрисосудистое тромбообразование является серьезным осложнением различных сердечно-сосудистых заболеваниях. Тромбоз сосудов артериального русла приводит к развитию инфаркта миокарда, нестабильной стенокардии, инсульта, а также часто осложняет проведение ангиопластики, которая в настоящее время часто применяется для лечения сердечной недостаточности.
Для профилактики и лечения тромбозов применяются (Машковский М.Д. Лекарственные средства. - М.: Медицина, 2000, т. 2 с. 73-76; Энциклопедия лекарств, изд. 8, М.: РЛС, 2001, 1503 с.; Справочник ВИДАЛЬ, М.: АстраФармСервис, 2001, 725 с.):
- препараты, действующие на свертывающую систему крови и ингибирующие образование фибрина (гепарин и его производные, герудин, непрямые антикоагулянты);
- тромболитики, действие которых направлено на активацию фибринолитической системы крови и растворение тромба (стрептокиназа, урокиназа, тканевой активатор плазминогена и их производные и аналоги);
- препараты, ингибирующие активность тромбоцитов (аспирин, тиенопиридины - тиклид и клопидогрель, антагонисты рецептора фибриногена тромбоцитов).
Т. к. эти лекарства действуют на разные системы, участвующие в регуляции процесса тромбообразования, они применяются не только по отдельности, но и совместно в различных сочетаниях в зависимости от состояния больного и клинических показаний.
Известно, что инициация тромбоза в условиях артериального кровотока происходит в результате активации и последующей агрегации тромбоцитов в местах патологического повреждения сосудистой стенки (чаще всего вследствие атеросклеротического поражения). Впоследствии такие тромбоцитарные агрегаты стабилизируются нитями фибрина, что приводит к образованию полноценного тромба и прекращению кровотока (окклюзии) в поврежденном сосуде. В связи с тем, что именно тромбоциты играют ключевую роль на начальных стадиях тромбообразования, очевидно, что ингибирование активности тромбоцитов представляет собой один из наиболее эффективных способов профилактики и терапии тромбоза.
Главная реакция в процессе агрегации тромбоцитов - взаимодействие фибриногена с его рецептором на поверхности тромбоцитов, комплексом гликопротеидов IIb-IIIa (ГП IIb-IIIa). Этот рецептор приобретает способность к связыванию фибриногена в результате локальной активации тромбоцитов в местах повреждения сосудов такими соединениями, как АДФ, тромбоксан A2, коллаген, тромбин и другие протромбогенные агонисты. Фибриноген образует молекулярные "мостики" между активированными тромбоцитами, что приводит к "склеиванию" тромбоцитов и образованию агрегатов. Частичное подавление процесса агрегации возможно в результате воздействия препаратов, ингибирующих различные пути активации тромбоцитов, например аспирина, предотвращающего образование в тромбоцитах тромбоксана А2, или тиенопиридинов, блокирующих рецептор АДФ. Однако наиболее эффективное и полное блокирование агрегации наблюдается при ингибировании конечной и ключевой стадии процесса, т.е. связывания фибриногена с ГП IIb-IIIa.
В последние годы были разработаны несколько препаратов антагонистов ГП IIb-IIIa, механизм действия которых основан на ингибировании рецепторной активности ГП IIb-IIIa (Coller. Thromb Haemost 2001; 86: 427-443;. Topol et al. Lancet 1999; 353: 227-231). Два из них - Интегрилин (Эптифибатид) ("Cor Theraupetics"/"Key Pharmaceuticals"/"Shermg Plough") и Тирофибан (Аграстат) ("Merck") представляют собой низкомолекулярные соединения и имеют соответственно пептидную и непептидную органические структуры. Они применяются, в первую очередь, для предотвращения тромботических осложнений при ангиопластике, но могут быть также использованы для лечения острого коронарного синдрома.
Более эффективный препарат - РеоПро (абциксимаб, Fab c7E3) ("Centocor"/"Eli Lilly") был создан на основе монАТ 7ЕЗ против ГП IIb-IIIa, специфически блокирующего участок связывания лиганда в этом рецепторе. Этот препарат представляет собой Fab фрагмент рекомбинантного химерного (мышь/человек) монАТ c7E3, состоящего из вариабельных участков мышиного монАТ 7ЕЗ и константных участков человеческого иммуноглобулина G (The EPIC Investigators. New Engl. J. Med. 1994; 330: 956-961). Конечный препарат представляет собой раствор Fab фрагментов c7E3 в фосфатно-солевом буфере в концентрации 2 мг/мл. Для достижения клинического эффекта (уменьшения количества тромботических осложнений) при коронарной ангиопластике РеоПро вводят внутривенно в виде болюса 0,25 мг/кг с последующей инфузией 0,125 мкг/кг в минуту в течение 12 часов. Указанный способ лечения является наиболее близким по достигаемому эффекту к заявляемому способу лечения.
Недостатком РеоПро является необходимость использования значительного количества препарата (общая доза 0,34 мг/кг) и поддерживающей инфузии, что усложняет процедуру его введения пациентам. Эти недостатки обусловлены недостаточной эффективностью ингибирования агрегации тромбоцитов и недостаточно прочным связыванием РеоПро с тромбоцитами.
Наиболее близким к заявляемому препарату является ранее полученная авторами композиция на основе F(ab')2 фрагментов антител FraMon к ГП IIb-IIIa [A.B. Мазуров и др. Терапевтический архив, 2001, 9, с. 66-73], продуцируемых штаммом гибридных клеток FraMon [патент РФ 2070928, 1995, кл. C 12 N 5/12]. Препарат представлял собой апирогенный стерильный раствор, содержащий в 1 мл водного раствора: 7,5 мг F(ab')2 фрагментов антител FraMon; 150 mM NaCl, 10 mМ Na2HPO4/NaH2PO4. Препарат вводили здоровым донорам внутривенно однократно болюсом в 5-10 мл физиологического растворе в дозе 0,025-0,2 мг/кг. Для лечения больных данный препарат в рамках прототипа не применялся.
Недостатком применяемого состава, выявленным на последующих стадиях исследований, являлось образование при концентрациях F(ab')2 фрагментов антител более 5 мг/мл микроагрегатов фрагментов, что существенным образом может осложнять внутривенное использование препарата в связи с высоким риском внутрисосудистой агглютинации тромбоцитов при взаимодействие с микроагрегатами.
Задачей, стоявшей перед авторами настоящей группы изобретений, являлась разработка более эффективного антитромботического препарата и способа профилактики и лечения тромбозов, в частности, при проведении процедуры коронарной ангиопластики.
Препарат, получивший условное наименование ФРАМОН, содержит следующие ингредиенты:
F(аb')2-фрагменты антитела FraMon -1-5 мг/мл;
растворитель - остальное.
В качестве растворителя используется, как правило, фосфатно-солевой буфер (ФСБ) (150 мМ NaCl, 10 mМ Na2HPO4/NaH2PO4, pH 7,3) или физиологический раствор.
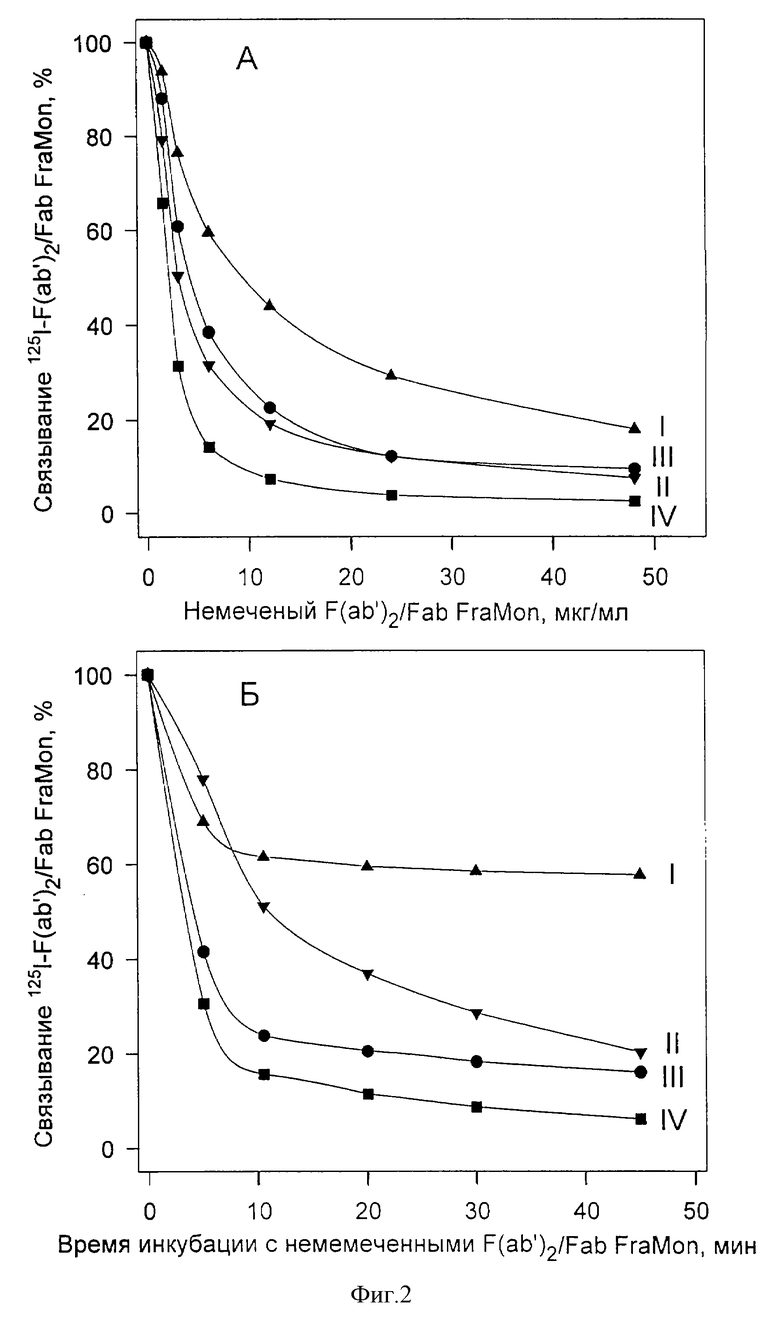
Как показали исследования in vitro, препарат с концентрацией от 1 до 10 мг/мл F(ab')2 фрагментов одинаково эффективно ингибирует агрегацию тромбоцитов (пример 1). Однако использование концентраций более 5 мг/мл связано с риском образования микроагрегатов фрагментов (пример 2). Образование таких микроагрегатов существенным образом может осложнять внутривенное использование препарата в связи с высоким риском внутрисосудистой агглютинации тромбоцитов при взаимодействии с микроагрегатами. Кроме того, при применении высоких концентраций фрагментов необходимо ампулировать препарат в очень небольших объемах для его более полного и экономичного использования.
Использование концентраций фрагментов менее 1 мг/мл нецелесообразно, т. к. в этом случае появляется необходимость внутривенного введения больному большого объема препарата для достижения клинически эффективной дозы.
Способ профилактики и лечения тромбозов заявляемым препаратом заключается во введении его внутривенно в форме болюса в дозе не ниже 0,25 мг/кг веса за 10-30 мин до начала коронарной ангиопластики на фоне приема аспирина и введения гепарина.
При более низкой дозе препарата (0,2 мг/кг) полное ингибирование агрегации достигается не у всех больных (см. пример 3). Этот способ отличается от того, который используется при применении прототипа - препарата РеоПро, по свойством вводимого фрагмента, общей дозе и режиму введения лекарства. (Препарат РеоПро вводят внутривенно в виде болюса 0,25 мг/кг с последующей инфузией 0,125 мкг/кг в минуту в течение 12 часов при общей дозе 0,34 мг/кг).
При использовании без поддерживающей инфузии ФРАМОН оказывает такое же ингибирующее действие на агрегационную активность тромбоцитов больных и снижает количество неблагоприятных исходов, в частности во время и после проведения ангиопластики, в такой же степени, что и РеоПро.
При заявляемом способе применения препарат ФРАМОН не вызывает нежелательных побочных явлений (аллергических реакций, кровотечений, выраженной тромбоцитопении) и характеризуется низкой иммуногенностью.
Сопоставление свойств используемых фрагментов антител с РеоПро, прототипом по способу применения, свидетельствует о наличии между ними существенных отличий.
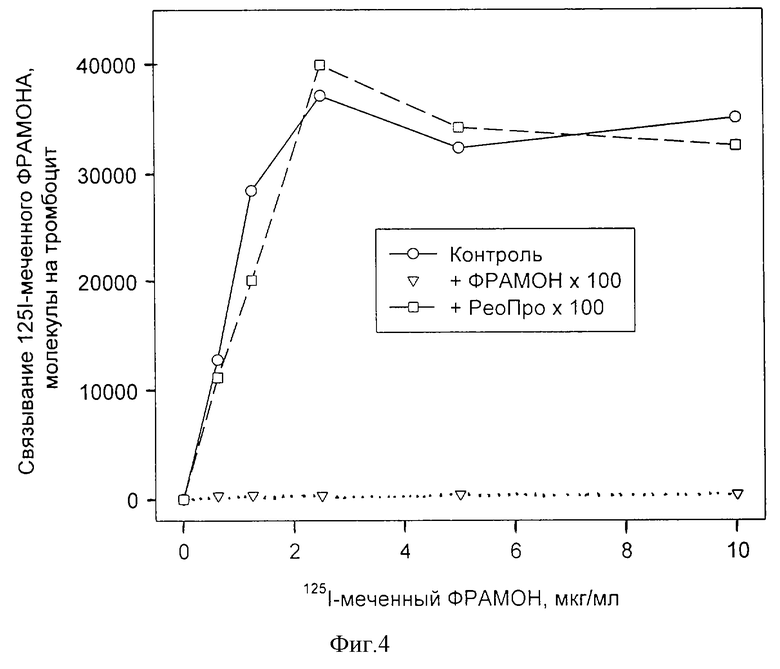
Во-первых, антитело FraMon, на основе которого сделан препарат ФРАМОН, отличается от антитела 7Е3, на основе которого сделан препарат РеоПро. Фрагменты этих антител (препараты ФРАМОН и РеоПро) не конкурируют друг с другом за связывание с тромбоцитами, т.е. взаимодействуют с разными участками в молекуле ГП IIb-IIIa. (На фиг. 4)показано связывание 125I-меченного ФРАМОНА с тромбоцитами в присутствии избытка немеченого ФРАМОНА и РеоПро. 125I-меченный ФРАМОН в различных концентрациях инкубировали с отмытыми от плазмы тромбоцитами в отсутствие добавок (контроль) и в присутствии 100-кратного избытка немеченого ФРАМОНА (+ ФРАМОН•100) или 100-кратного избытка немеченого РеоПро (+РеоПро•100) инкубации в течение 30 мин при 37oС. Отсутствие снижения связывания 125I-меченного ФРАМОНА с тромбоцитами при добавлении избытка РеоПро свидетельствует о том, что ФРАМОН и РеоПро связываются с разными участками (эпитопами) в молекуле ГП IIb-IIIa.)
Во-вторых, в заявляемом препарате в качестве основы использованы F(ab')2 фрагменты антитела против ГП IIb-IIIa, а не Fab фрагменты, как в случае препарата РеоПро.
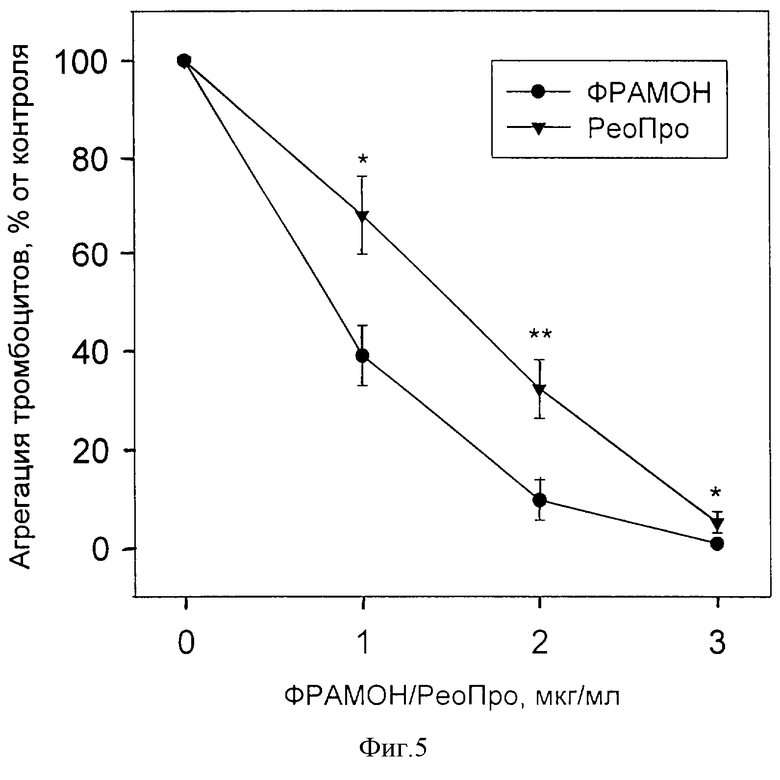
В-третьих заявляемый препарат оказывал несколько более выраженное действие на агрегацию тромбоцитов, чем препарат РеоПро. (На фиг.5 показано сопоставление ингибирующих эффектов ФРАМОНА и РеоПро на АДФ-индуцированную агрегацию тромбоцитов. Агрегацию индуцировали 20 мкМ АДФ в ОТП в отсутствие или в присутствии разных концентраций ФРАМОНА или РеоПро. За 100% принимали уровень агрегации в отсутствие препаратов. Представлены средние ± ошибки среднего (n≥6). *р<0,05; **р<0,01 - достоверность различий между соответствующими концентрациями ФРАМОНА и РеоПро (t-критерий Стьюдента для средних)).
Сопоставление заявляемого способа с известным способом введения препарата ФРАМОН показало различия в дозе введения и во времени введения препарата (т. к. эксперименты проводились на здоровых добровольцах, было невозможно установить точно оптимальное время введения и его режим).
Существо и промышленная применимость изобретений (в клинической практике) иллюстрируется следующими примерами.
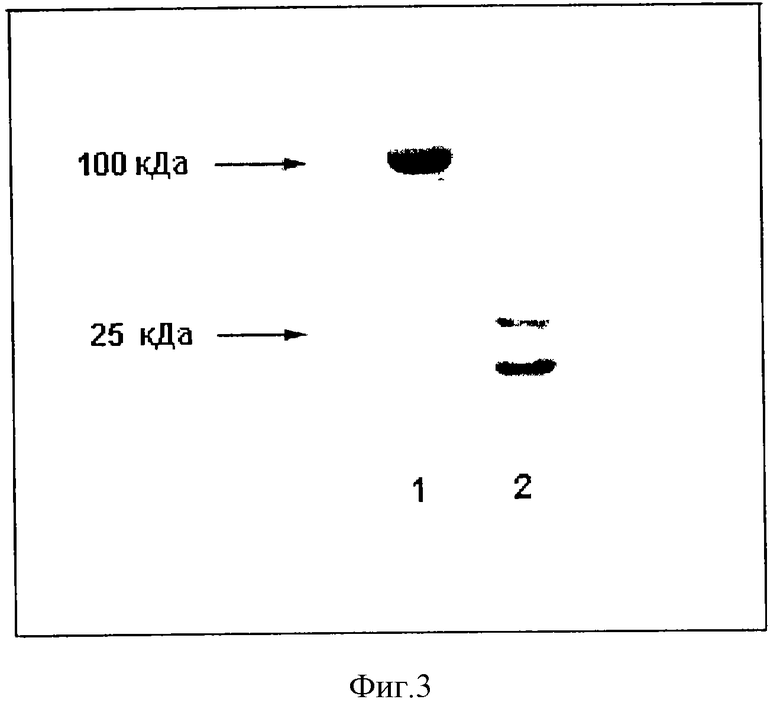
Пример 1. Исследовали действие препарата ФРАМОН, содержащего F(ab')2 фрагменты антитела FraMon в концентрациях 1, 5 и 10 мг/мл в фосфатно-солевом буфере (ФСБ), на агрегацию тромбоцитов в условиях in vitro. F(ab')2 фрагменты получали путем пепсинового гидролиза очищенных антител FraMon и затем очищали с помощью гидрофобной и ионообменной хроматографии. Чистоту фрагментов контролировали с помощью ЭФ в ПААГ (фиг. 3). Активность препарата тестировали по способности ингибировать агрегацию тромбоцитов. Получение обогащенной тромбоцитами плазмы (ОТП) из крови здоровых доноров и измерение агрегации проводили в соответствии с методами, описанными ранее (Виноградов и др. Биохимия, 1991, т. 56, с. 787-794; Mazurov et al. Thromb. Haemost., 1991, v. 66 pp. 494-499). Агрегацию тромбоцитов в ОТП измеряли по изменению светопропускания суспензии тромбоцитов с помощью агрегометра "Agregation Analaizer" (БИОЛА, Россия) при концентрации тромбоцитов 2,5•108/мл, температуре 37oС и скорости перемешивания 800 об/мин В кювету агрегометра вносили 300 мкл ОТП, добавляли препарат ФРАМОН, так чтобы конечная концентрация F(ab')2 фрагментов антитела "FraMon" составляла 1, 2, 3, или 4 мкг/мл или соответствующее количество ФСБ, и после 2-минутной инкубации стимулировали агрегацию добавлением 10 мкМ АДФ. Дозозависимая кривая действия ФРАМОНА на агрегацию тромбоцитов в диапазоне концентраций 1-3 мкг/мл представлена на фиг. 1 (кривая F(ab')2 FraMon). У всех обследованных доноров (n=33) препарат полностью ингибировал агрегацию тромбоцитов в концентрации менее или равной 4 мкг/мл. При этом у 90% доноров полное ингибирование наблюдалось при концентрации 3 мкг/мл и ниже. Степень ингибирования агрегации не зависела от начальной концентрации F(ab')2 фрагментов антитела FraMon (1,5 и 10 мг/мл) в препарате.
Пример 2. Появление микроаггрегатов в стерильном растворе F(ab')2 фрагментов с концентрацией от 1 до 10 мг/мл (1, 2,5, 5, 7,5 и 10 мг/мл) при их хранении оценивали по изменению концентрации фрагментов после фильтрования через фильтр с размером пор 0,22 мкм. После приготовления соответствующие растворы фрагментов антител фильтровали через фильтр 0,22 мкм, отбирали стерильно аликвоту, в которой измеряли содержание белка по поглощению при 280 нм и затем хранили в стерильных условиях при температуре 37oС в течение 1 месяца. Затем вновь фильтровали растворы через фильтр 0,22 мкм и проводили повторное измерение белка. Результаты измерений представлены в таблице 1. Как видно из этой таблицы, хранение препарата в концентрации выше 5 мг/мл приводит к 10-15% потерям белка после фильтрования, что связано с образованием микроагрегатов, задерживающихся на фильтре. Наличие микроагрегатов в препарате после его внутривенного введения может приводить, во-первых, к агглютинации тромбоцитов в сосудистом русле и соответственно возможной окклюзии сосудов такими конгломератами и, во вторых, к развитию тромбоцитопении вследствие удаления таких микроагрегатов из кровотока. Применение фильтра при внутривенном введении для удаления микроагрегатов приведет к их удалению, однако в этом случае снизится общее количество препарата, поступившего в кровоток. В связи с этим для приготовления препарата была выбрана концентрация F(ab')2 фрагментов не выше 5 мг/мл.
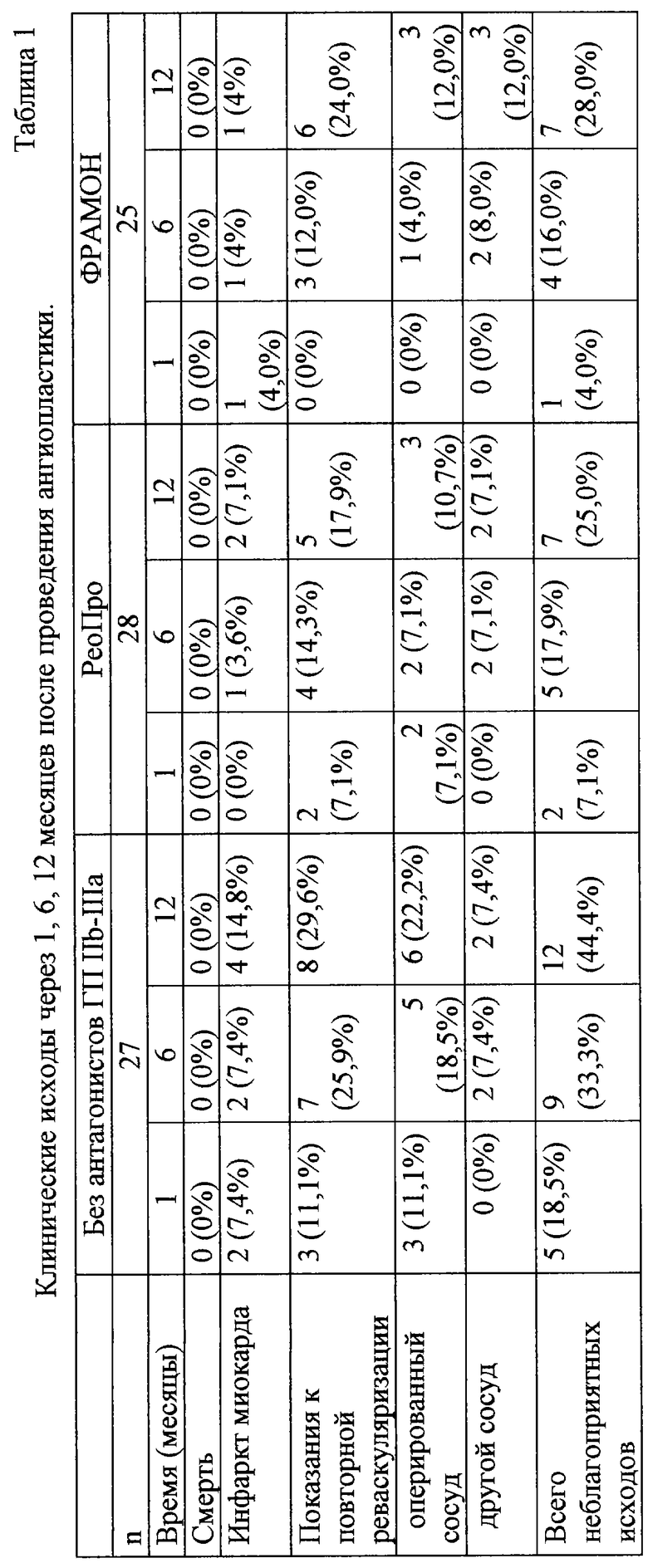
Пример 3. В рамках проведения клинических испытаний исследовали безопасность применения, динамику ингибирования агрегации тромбоцитов и клинические эффекты ФРАМОНА при коронарной ангиопластике высокого риска.
В исследование было включено 83 больных с ишемической болезнью сердца. 27 больным ангиопластику проводили с применением препарата ФРАМОН, 29 - с применением препарата РеоПро и 28 - без антагонистов ГП IIb-IIIa. У всех больных, включенных в исследование, проведение ангиопластики было связано с высоким риском тромботических осложнений (в соответствии с критериями Американской ассоциации по изучению сердца). Существенных различий по основным параметрам (пол, возраст, факторы риска, клинические характеристики больных и характер поражения коронарных сосудов) между группами не было. Значительная часть больных во всех группах (60-70%) была включена в исследование после госпитализации в связи с развитием острого коронарного синдрома. После проведения ангиопластики больные наблюдались в течение 12 месяцев. В качестве неблагоприятных исходов после 1, 6 и 12 месяцев рассматривались: смерть от любых причин; инфаркт миокарда; показания к реваскуляризации (повторная ангиопластика или коронарное шунтирование (КШ)).
Коронарную ангиопластику проводили по стандартной методике (Groentzig AR. Semin Roentgenol 1981; 16: 152-153). Количество больных, которым проводили установку стента, было приблизительно одинаковым во всех группах (70-80%).
ФРАМОН вводили внутривенно за 10-30 мин до начала ангиопластики. Все больные принимали аспирин (100 мг/сутки). Гепарин вводили внутривенно непосредственно перед проведением вмешательства и при необходимости в процессе вмешательства в виде болюса или дробными дозами так, чтобы активированное время свертывания (АВС) было > 200 с, но не выше 300 с. После проведения ангиопластики введение гепарина прекращали.
При проведении первых 17 ангиопластик ФРАМОН вводили в виде болюса в дозе 0,2 мг/кг. В связи с тем, что не у всех больных наблюдалось полное ингибирование агрегации через час после введения препарата, при проведении следующих 12 процедур доза была увеличена до 0,25 мг/кг.
В первой группе сравнения ангиопластику проводили с применением РеоПро, который вводили по стандартной схеме, предложенной производителем - болюс 0,25 мг/кг с последующей инфузией 0,125 мкг/кг в мин в течение 12 ч. Остальные условия были такими же, как в группе с применением препарата ФРАМОН. Во второй группе сравнения коронарную ангиопластику проводили без применения антагонистов ГП IIb-IIIa. В этом случае инфузия гепарина продолжалась в течение 16-24 ч (активированное частичное тромбопластиновое время (АЧТВ) в период инфузии - 60-80 с).
Все больные в течение первых суток наблюдались в блоке интенсивной терапии. Больным проводилось физикальное обследование, включая оценку и регистрацию геморрагии, мониторирование ЭКГ, артериального давления, частоты сердечных сокращений, измерение температуры. В дальнейшем эти показатели оценивались ежедневно в течение всего периода госпитализации. Регулярно проводился лабораторный контроль за изменением состава крови больных (общий и биохимический анализ крови).
Введение ФРАМОНа хорошо переносилось всеми больными. Не было отмечено аллергических реакций, изменений артериального давления, частоты сердечных сокращений и других признаков индивидуальной непереносимости. Ни у одного из больных, которым вводили ФРАМОН, не отмечалось крупных кровотечений и значимых изменений показателей красной крови. У всех больных этой группы показатели общего и биохимического анализа крови и гемокоагулологические показатели были в пределах нормы, в то время как у двух больных, которым вводили РеоПро, наблюдалось снижение гемоглобина и гематокрита.
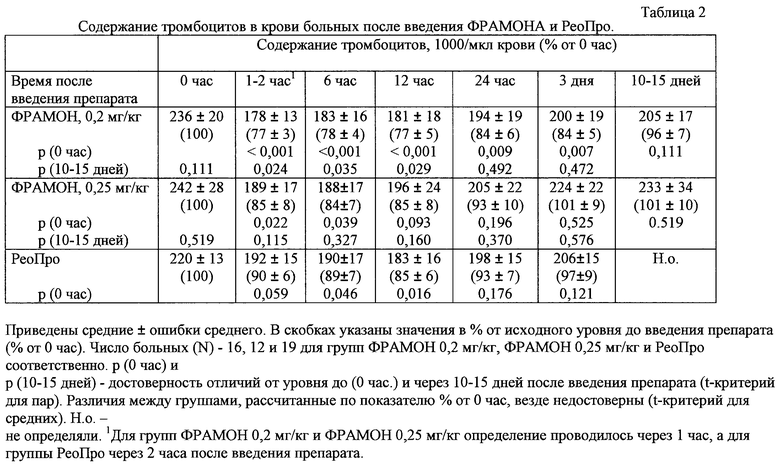
После введения ФРАМОНА в первые сутки наблюдалось снижение содержания тромбоцитов в среднем на 15-20% по сравнению с нормальными показателями, регистрируемыми до и через 10-15 дней после применения препарата (таблица 2). Ни у одного больного содержание тромбоцитов не снижалось ниже 50000/мкл, ни в одном случае развитие тромбоцитопении не сопровождалось кровотечениями и не потребовало переливания тромбоцитов. В группе больных, которым вводили РеоПро, в первые сутки также наблюдалось незначительное снижение числа тромбоцитов - в среднем на 10-15% по сравнению с исходным уровнем. Статистически значимых различий между средними показателями у больных, которым вводили РеоПро и ФРАМОН (обе дозы) обнаружено не было.
Полученные данные указывают, что применение ФРАМОНА сопровождается временным и клинически незначительным снижением содержания тромбоцитов (в среднем на 10-25%), сравнимым с тем, которое наблюдается при применении РеоПро.
Иммуногенность ФРАМОНА оценивали по частоте выработки антител против препарата. Антитела против ФРАМОНА определяли по связыванию иммуноглобулинов из плазмы больных с иммобилизованным на пластике препаратом с помощью иммуноферментного метода. ФРАМОН в концентрации 10 мкг/мл в 100 мкл фосфатно-солевого буфера (ФСБ) сорбировали на пластик в 96-луночных планшетах типа "Maxisorb" ("Costar", США) в течение 1 ч при 37oС, затем отмывали несорбированный белок ФСБ, содержащим 0,05% Твин 20 (ФСБ/Твин) и блокировали пластик 2% бычьим сывороточным альбумином в 150 мкл ФСБ (ФСБ/БСА) в течение 1 ч при 37oС. В лунки добавляли плазму испытуемых в различных разведениях (плазму разводили ФСБ/БСА) и инкубировали 30 мин при комнатной температуре, промывали лунки ФСБ/Твином, добавляли меченные пероксидазой антитела козла против IgG человека ("ICN", США) в разведении предложенным изготовителем, инкубировали 30 мин при комнатной температуре, промывали лунки и оценивали уровень связывания вторых антител с помощью хромогенного субстрата (о-фенилендиамина), измеряя оптическую плотность при 492 нм.
При определении антител против ФРАМОНА сравнивали связывание IgG из плазмы с иммобилизованным на пластике препаратом до (0 дней) и через 2-4 недели (22 пациента) или более длительный срок (до 3 месяцев) (5 пациентов) после введения препарата. У 24 из 27 больных уровни ответов при проведении иммуноферментного анализа не повышались после введения ФРАМОНА. Повышение связывание иммуноглобулинов было зарегистрировано у 3 больных, однако только у одной пациентки эта реакция ингибировалось добавлением к плазме избытка растворимого ФРАМОНА, т.е. имела специфический характер и была обусловлена выработкой антител к препарату. У двух других больных ответы были повышены в меньшей степени и не ингибировались растворимым ФРАМОНОМ, т.е., очевидно, имели неспецифический характер. Таким образом, выработка специфических антител против ФРАМОНА была зарегистрирована лишь у одной больной из 27 пациентов, что указывает на низкую иммуногенность препарата.
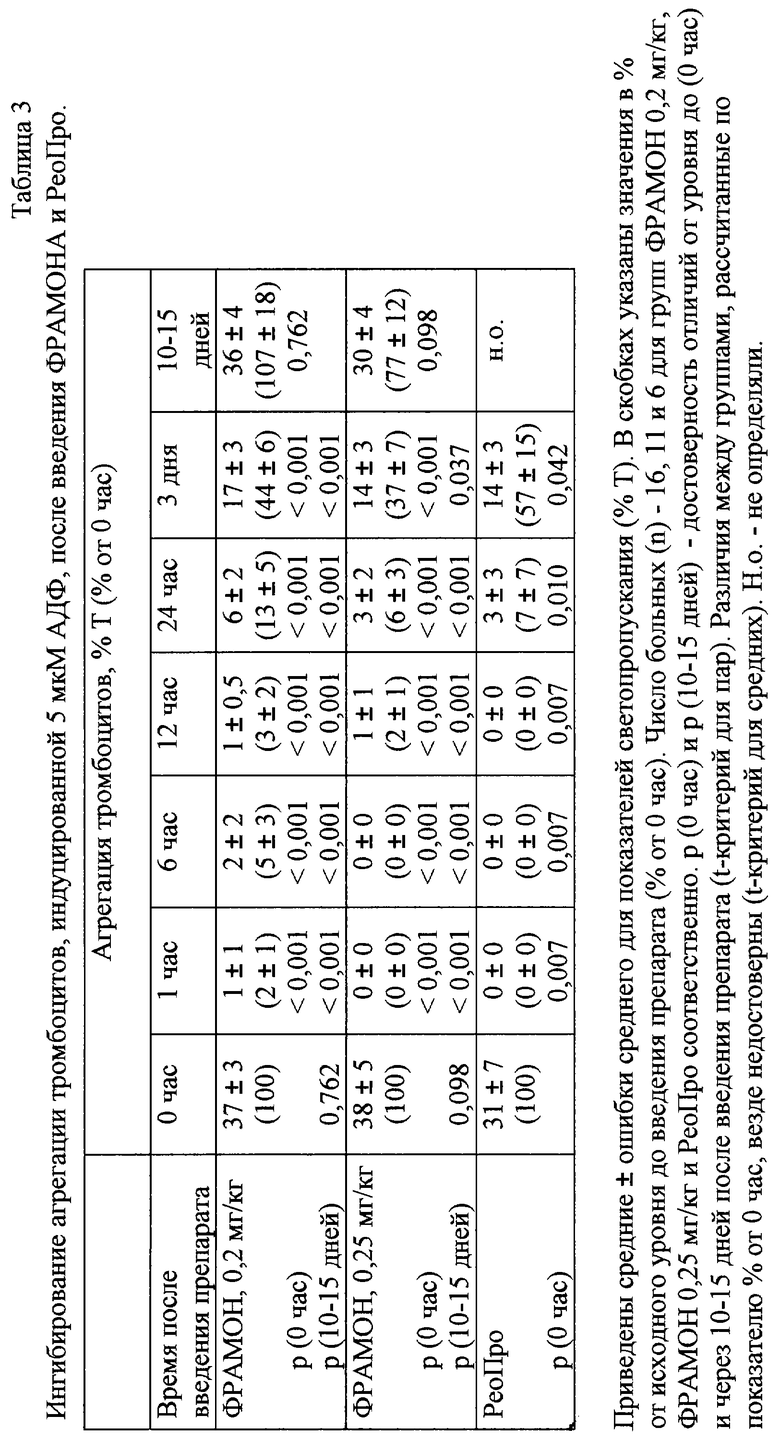
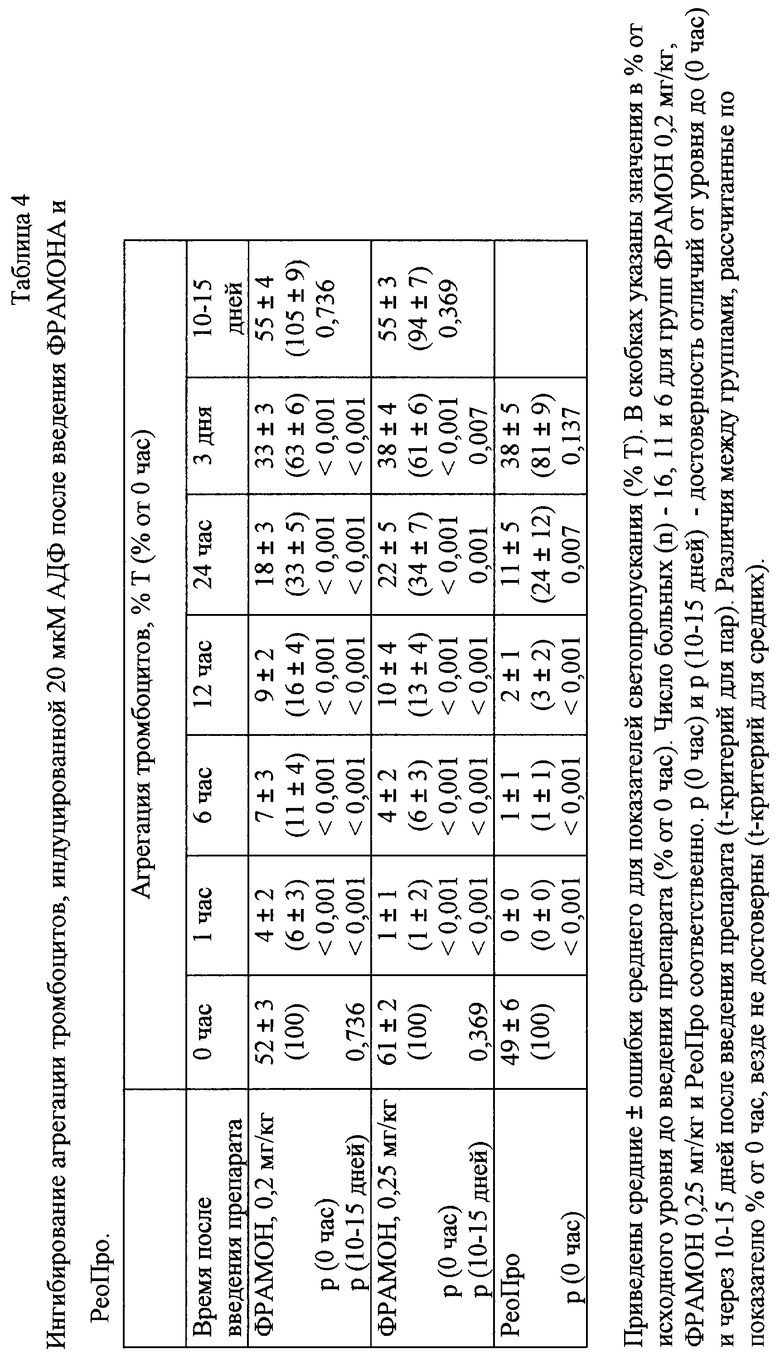
Антитромботические эффекты препарата ФРАМОН связаны с его способностью ингибировать агрегацию тромбоцитов. В связи с этим через различные промежутки времени после введения ФРАМОНА проверяли способность тромбоцитов больных к агрегации, индуцируемой АДФ в концентрации 20 мкМ. Агрегацию тромбоцитов исследовали в ОТП с помощью анализатора тромбоцитов БИОЛА (Россия) при 37oС и перемешивании со скоростью 800 об/мин по изменению светопропускания (Т%), используя в качестве индуктора АДФ в концентрации 20 мкМ. Агрегацию регистрировали в течение 4,5 мин после добавления индуктора и определяли максимальный уровень светопропускания.
Первой группе больных (16 человек, одному их которых препарат вводили дважды в период исследования) ФРАМОН вводили в дозе 0,2 мг/кг. Через 1 ч после инъекции у большинства больных наблюдалось 100% ингибирование агрегации тромбоцитов. Неполное ингибирование агрегационного ответа было зарегистрировано у 4 из 16 (25%) пациентов, а средний показатель составил 6% от исходного уровня до введения препарата (таблица 3). Хорошо выраженное и достоверное снижение агрегации сохранялось в течение первых трех суток после введения препарата. В течение первых 12 ч после введения препарата уровень агрегации был ниже 20%, а через 24 ч составлял приблизительно 30-40% от исходного уровня. Достоверное, хотя и менее выраженное (около 60% от исходного уровня) снижение агрегации было зарегистрировано и на 3 сутки после введения. Через 10-15 дней после начала исследования способность тромбоцитов к агрегации полностью восстанавливалась (таблица 3).
В связи с тем, что при дозе ФРАМОНА 0,2 мг/кг через 1 ч после введения не у всех больных наблюдалось 100% ингибирование агрегации тромбоцитов, был сделан вывод, что при данной дозировке полная блокада ГП IIb-IIIа достигается не во всех случаях.
Учитывая, что при дозе 0,2 мг/кг ни у одного из обследованных больных не наблюдалось признаков индивидуальной непереносимости препарата, следующим 12 больным препарат вводили по аналогичной схеме в дозе 0,25 мг/кг Исследование агрегации проводили у 11 больных. Несмотря на 20% увеличение дозы препарата динамика ингибирования агрегационного ответа существенно не изменялась. В течение 12 ч средний уровень агрегационных ответов был ниже 20%, через 24 ч приблизительно 30-40%, а через трое суток около 60% от исходного (таблица 2). Так же, как и при использовании ФРАМОНА в дозе 0,2 мг/кг, при дозе 0,25 мг/кг способность тромбоцитов к агрегации через 10-15 дней полностью восстанавливалась (таблица 3).
Несмотря на то, что при сравнении двух дозировок препарата ни в одной временной точке при обеих концентрациях АДФ не было получено достоверных различий между средними уровнями агрегации, можно отметить следующее. При дозе ФРАМОНА 0,25 мг/кг неполное подавление агрегационного ответа наблюдалось лишь в 1 из 11 случаев (9%), а при дозе 0,2 мг/кг в 4 из 16 случаев (25%). Эти результаты позволяют предположить, что повышение дозы ФРАМОНА до 0,25 мг/кг способствует более эффективному подавлению рецепторной активности ГП IIb-IIIa. Полное подавление агрегации тромбоцитов практически у всех больных при дозе 0,25 мг/кг указывает на то, что дальнейшее увеличение дозы возможно, но, как правило, является нецелесообразным.
Динамику ингибирования агрегации тромбоцитов исследовали также у 6 больных, которым ангиопластику проводили с применением препарата РеоПро по стадандартной схеме - 0,25 мг/кг болюс с последующей инфузией в течение 12 ч в дозе 0,125 мкг/мин на 1 кг. Как видно из таблицы 3, эффективность ингибирования агрегации при применении ФРАМОНА и РеоПро была приблизительно одинаковой. Достоверных различий между уровнем ингибирования агрегации не наблюдалось ни в одной временной точке.
Проведенный анализ динамики ингибирования агрегации тромбоцитов свидетельствует о том, что ФРАМОН при применении ингибирует агрегационную способность тромбоцитов не менее эффективно, чем РеоПро при введении в виде болюса с последующей 12-часовой инфузией.
Клиническую эффективность препарата ФРАМОН оценивали по его способности снижать количество неблагоприятных исходов (смерть, инфаркт миокарда и показания к повторной реваскуляризации, т.е. развития рестеноза оперированного или стеноза других сосудов) через 1, 6 и 12 месяцев после проведения ангиопластики. Сравнение проводили с группой, в которой проведение ангиопластики осуществляли без применения антагонистов ГП IIb-IIIa, и с группой, в которой при проведении ангиопластики использовали препарат РеоПро. В анализ были включены только те больные у которых ангиопластика была признана удачной, т. е. удалось уменьшить стеноз до < 50%, а при установке стента до 20%.
В течение 1 месяца после проведения процедуры (острый период) неблагоприятный исход при использовании ФРАМОНА были зарегистрирован у одного из 25 больных (4,0%). У этого больного развился инфаркт миокарда на вторые сутки после ангиопластики. При использовании РеоПро у 2 больных из 28 (7,1%) в связи с рецидивом ангинозных приступов на основании ангиографии возникли показания к повторной реваскуляризации миокарда. В группе без использования блокаторов ГП IIb-IIIa неблагоприятные исходы были отмечены у большего числа больных - 5 из 27 (18,5%). У двоих больных развился инфаркт миокарда и у 3 рецедивировала стенокардия в связи рестенозом в соответствии с данными коронарографии (таблица 4). Через 6 месяцев после коронарной ангиопластики количество неблагоприятных исходов было приблизительно одинаковым в группах с применением ФРАМОНА и РеоПро - 4 из 25 (16%) и 5 из 28 (17,9%) соответственно, а в группе без использования антагонистов ГП IIb-IIIa оно было приблизительно в 2 раза выше - 9 из 27 (33,3%) (таблица 3). Подобная тенденция сохранилась и через 1 год после процедуры. Суммарное число конечных точек в группе с применением ФРАМОНА составило 7 из 25 (28,0%), а в группе с применением РеоПро - 7 из 28 (25,0%). Неблагоприятные исходы в группе, где ангиопластика проводилась без использования блокаторов ГП IIb-IIIa отмечались у 12 из 27 больных (44,4%) (таблица 4).
Результаты использования препарата ФРАМОН при проведении коронарной ангиопластики с высоким риском тромботических осложнений показали безопасность его применения, способность к высокоэффективному и длительному ингибированию агрегации тромбоцитов и снижению количества неблагоприятных исходов во время и после проведения ангиопластики. Сравнительная оценка безопасности применения, действия на агрегацию тромбоцитов и предварительная оценка клинической эффективности позволяют предположить, что по своим характеристикам ФРАМОН не уступает препарату РеоПро, а по некоторым показателям (более низкая общая дозировка и отсутствие поддерживающей инфузии) превосходит последний.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРОМБОЦИТСПЕЦИФИЧНЫЙ ХИМЕРНЫЙ ИММУНОГЛОБУЛИН И МЕТОДЫ ЕГО ИСПОЛЬЗОВАНИЯ | 1994 |
|
RU2158135C2 |
| Средство с антиагрегационной активностью и способ его получения | 2021 |
|
RU2778686C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ АНТИАГРЕГАНТНОЙ АКТИВНОСТЬЮ | 2019 |
|
RU2709017C1 |
| СРЕДСТВО, ПРОЯВЛЯЮЩЕЕ АНТИТРОМБОТИЧЕСКИЙ ЭФФЕКТ ПОСРЕДСТВОМ БЛОКИРОВАНИЯ РЕЦЕПТОРОВ ТРОМБОЦИТОВ ГП IIb-IIIa (ВАРИАНТЫ) | 2016 |
|
RU2643336C1 |
| Средство, проявляющее антиагрегационную активность | 2019 |
|
RU2727508C1 |
| ТРАНСДЕРМАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ И ВВЕДЕНИЕ ТИРОФИБАНА | 2010 |
|
RU2539398C2 |
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО ИНФАРКТА МИОКАРДА | 2008 |
|
RU2365380C1 |
| Производные триазола, проявляющие антиагрегационную активность | 2021 |
|
RU2770405C1 |
| КОМБИНАЦИЯ ТРОМБОЛИТИЧЕСКИ АКТИВНЫХ БЕЛКОВ И АНТИКОАГУЛЯНТОВ | 1995 |
|
RU2166326C2 |
| СПОСОБ ИНГИБИРОВАНИЯ ТРОМБООБРАЗОВАНИЯ И УСКОРЕНИЯ ФИБРИНОЛИЗА С ПОМОЩЬЮ ДНК АПТАМЕРОВ, ИНГИБИРУЮЩИХ АКТИВНОСТЬ ТРОМБИНА, В ЭКСПЕРИМЕНТЕ | 2014 |
|
RU2559545C1 |
Изобретение относится к области биотехнологии и медицины, а именно к препаратам для лечения заболеваний сердечно-сосудистой системы и способам их применения, в частности к антитромботическим препаратам, полученным на основе моноклональных антител. Сущностью изобретения является антитромботический препарат, содержащий F(ab')2 фрагменты антитела FraMon в концентрации 1-5 мг/мл, а также способ профилактики и лечения тромбозов путем внутривенного введения раствора, содержащего 1-5 мг на мл F(ab')2 фрагментов антитела FraMon в виде болюса в дозе не ниже 0,25 мг/кг веса. Техническим результатом является разработка эффективного антитромботического препарата и способа профилактики и лечения тромбозов, в т.ч. при проведении коронарной ангиопластики. 2 с. и 2 з.п.ф-лы, 4 табл., 5 ил.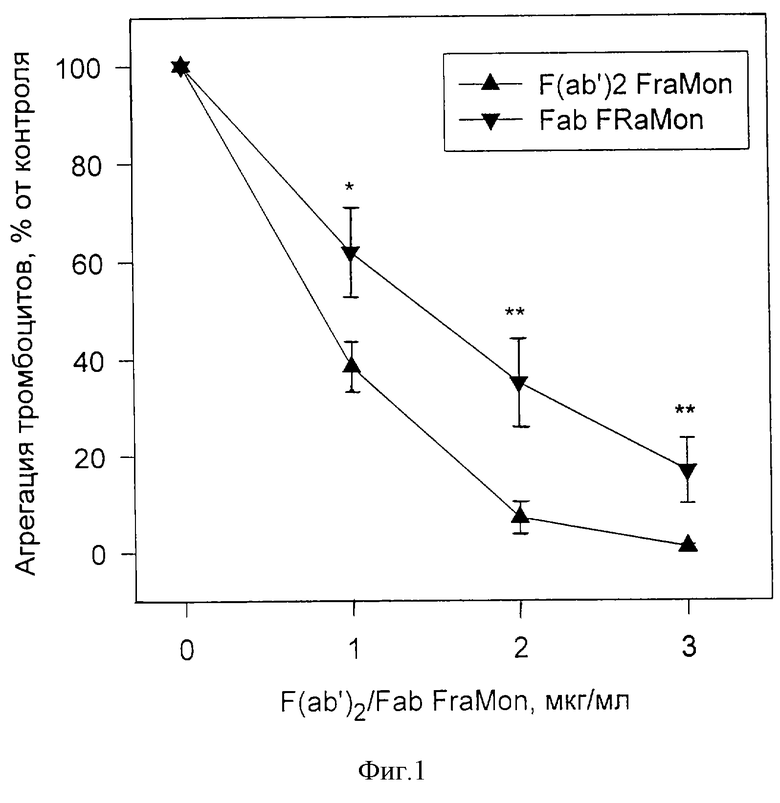
| МАЗУРОВ А.В | |||
| и др | |||
| Нефтяной конвертер | 1922 |
|
SU64A1 |
| - Терапевтический архив, 2001, 73 (9), с | |||
| Приспособление для соединения пучка кисти с трубкою или втулкою, служащей для прикрепления ручки | 1915 |
|
SU66A1 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Телеграфный коммутатор | 1921 |
|
SU792A1 |
| RU 2070928 C1, 27.12.1996 | |||
| MODDERMAN P.W | |||
| et al A monoclonal antibody to the human platelet glycoprotein IIb/IIIa complex induces platelet activation | |||
| - Tromb Haemost, 1988, Aug 30; 60(1), p | |||
| Способ получения смеси хлоргидратов опийных алкалоидов (пантопона) из опийных вытяжек с любым содержанием морфия | 1921 |
|
SU68A1 |
Авторы
Даты
2003-05-27—Публикация
2002-05-16—Подача