Изобретение относится к области медицины и биотехнологии, а именно к способам ингибирования тромбообразования и ускорения фибринолиза с помощью ДНК аптамеров (олигонуклеотидов), ингибирующих активность тромбина, и может быть использовано для повышения эффективности антитромботической и фибринолитической терапии.
Тромбообразование является причиной развития таких заболеваний, как инфаркт миокарда, ишемический инсульт, тромботические поражения сосудов нижних конечностей. Именно эти патологии являются главной причиной смертности и инвалидизации в развитых странах, в том числе в Российской Федерации.
Тромбин является центральной протеазой свертывающего каскада крови. После активации протромбина X фактором, образующийся тромбин, катализирует превращение фибриногена в фибрин и стимулирует агрегацию тромбоцитов - две ключевые реакции в процессе образования внутрисосудистых тромбов. В связи с этим ингибиторы тромбина относятся к эффективным антитромботическим средствам. Наиболее распространенные антитромбиновые препараты - гепарин и его низкомолекулярные производные ингибируют функции тромбина, активируя антитромбин III. Прямые ингибиторы тромбина действуют непосредственно на сам фермент. Бивалентные ингибиторы, такие как полипептид гирудин и его производные (бивалирудин), подавляют активность тромбина, взаимодействуя с активным центром и участком связывания субстратов (экзосайт 1), а одновалентные синтетические ингибиторы (аргатробан, дабигатран) ингибируют только его активный центр. Кроме того, в отличие от гепарина, прямые ингибиторы не взаимодействуют с другими (кроме тромбина) плазменными и клеточными белками и не вызывают развития такого нежелательного побочного эффекта, как тромбоцитопения.
Тромбин по принципу отрицательной обратной связи также стимулирует и некоторые антикоагулянтные реакции в сосудистом русле. В частности, он активирует систему протеина С и активируемый тромбином ингибитор фибринолиза (АТИФ). Эта активность тромбина направлена на локализацию тромботических реакций исключительно в зоне повреждения сосудистой стенки.
В современной клинической практике для профилактики и лечения тромбозов используется три класса лекарств, с различным механизмом действия: (1) антикоагулянты - лекарства, ингибирующие реакции свертывания крови и препятствующие образованию фибрина; (2) тромболитики - препараты, способствующие растворению уже образовавшегося тромба; и (3) антитромбоцитарные препараты или антиагреганты - ингибиторы активации и агрегации тромбоцитов [Федеральное руководство по использованию лекарственных средств. Выпуск X. (Чучалин А.Г., Белоусов Ю.Б., Яснецов В.В. ред.) Министерство здравоохранения и социального развития Российской федерации. Фонд «Здоровье». Москва. 2009. Стр. 63-78 и 137-150].
Все известные ингибиторы тромбина относятся к классу антикоагулянтов. Недостатком этих препаратов является то, что они действуют на активный центр тромбина. В связи с этим они могут подавлять не только прокоагулянтные, но и известные антикоагулянтные реакции тромбина (См. выше). Недостатками наиболее широко применяемого антикоагулянта - гепарина (и его производных) также является то, что (1) он оказывает свое действие опосредованно, потенцируя действие антитромбина III, и (2) он взаимодействует с другими (кроме тромбина) плазменными и клеточными белками, и вызывает развитие такого нежелательного побочного эффекта, как тромбоцитопения.
Известен также способ ингибирования тромбообразования путем внутривенного введения раствора, содержащего 1-5 мг на мл F(ab′)2 фрагментов антитела FraMon в виде болюса в дозе не ниже 0,25 мг/кг веса, за 10-30 мин до начала коронарной ангиопластики, на фоне приема аспирина и введения гепарина.
(Патент РФ №2205027, МПК А61K 39/395, опубл. 27.05.2003, Бюл. №15).
Недостатком данного способа является недостаточность ингибирования тромбообразования, т.к. воздействие происходит только на тромбоциты и не влияет на систему свертывания крови. Кроме того, антитела и их фрагменты являются иммуногенными препаратами.
Задачей изобретения является создание эффективного способа ингибирования тромбообразования и ускорения фибринолиза с помощью ДНК аптамеров (олигонуклеотидов), ингибирующих активность тромбина, позволяющего препятствовать образованию тромбов и улучшать растворение фибринового сгустка.
Технический результат изобретения - повышение эффективности антитромботической и фибринолитической терапии при лечении тромбозов различной локализации.
Это достигается в заявляемом способе ингибирования тромбообразования и ускорения фибринолиза с помощью ДНК аптамеров (олигонуклеотидов), ингибирующих активность тромбина путем использования раствора модифицированного аптамера, характеризующегося нуклеотидной последовательностью GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC и конъюгированного по 5′ или 3′ концу с NH2 группой и/или с полиэтиленгликолем (PEG), и отвечающего общей формуле
d-R- GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC-R,
где d - дезоксирибоза, при этом олигонуклеотид содержит дезоксирибозу во всех позициях, R - NH2 группа и/или PEG.
Один из способов создания новых антитромботических лекарственных субстанций, включая прямые ингибиторы тромбина, связан с использованием соединений, называемых аптамерами. Аптамеры представляют собой ДНК или РНК олигонуклеотиды (длиной до нескольких десятков оснований), которые могут образовывать сложные трехмерные структуры, и благодаря этому способны специфически взаимодействовать с различными молекулами мишенями. Некоторые аптамеры могут не только узнавать свои мишени, но и ингибировать их биологическую активность. В последние годы аптамеры рассматривают как потенциальные фармакологические субстанции, которые могут быть использованы для разработки лекарственных препаратов. Аптамеры по специфичности и аффинности взаимодействия с молекулами мишенями не уступают моноклональным антителам. Однако как фармакологические соединения, они имеют ряд существенных преимуществ перед антителами. Аптамеры неиммуногенны, их можно производить с помощью химического синтеза, не используя биологических продуцентов, а кроме того, для аптамерных препаратов достаточно легко создаются антидоты (на основе комплементарных последовательностей) для срочной блокады возможных нежелательных побочных реакций. Для увеличения жизни аптамеров в кровотоке их можно модифицировать путем введения различных защитных группировок по концам базового олигонуклеотида.
Одно из направлений, связанное с возможностью фармакологического использования аптамеров, - создание на их основе антитромботических препаратов. В частности, можно использовать аптамеры для подавление протромботических реакций тромбина. В отличие от известных антикоагулянтов - прямых ингибиторов тромбина и, в том числе ингибитора для внутривенного введения - бивалирудина, ДНК аптамеры не действуют на активный центр тромбина, а взаимодействуя с экзосайтом I, блокируют его связывание с субстратами (фибриноген, клеточные рецепторы тромбина и др.)
В настоящем изобретении продемонстрирована возможность использования модифицированного аптамера, отвечающего общей формуле
d-R- GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC-R,
где d - дезоксирибоза, при этом олигонуклеотид содержит дезоксирибозу во всех позициях, R - NH2 группа и/или PEG,
для подавления артериального тромбообразования и ускорения фибринолиза в эксперименте.
Пример 1. Антитромботическое действие модифицированного аптамера NH2-RE31-PEG в моделях тромбоза на животных.
Использовали аптамер NH2-RE31-PEG, представляющий собой базовый аптамер (олигонуклеотид) с условным названием RE31 (олигонуклеотидная последовательность - GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC), коньюгированный с NH2 группой и PEG по 5′ и 3′ концам соответственно, который растворяли в 0,9% натрия хлорида. Исследование антитромботического действия модифицированного аптамера NH2-RE31-PEG проводили на крысах, используя FeCl3 модель.
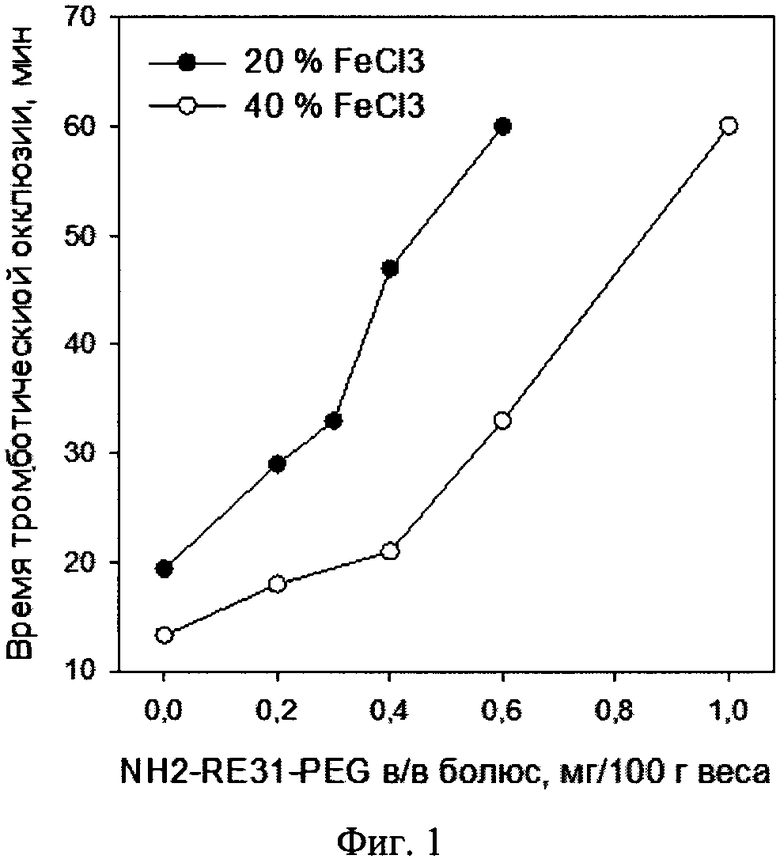
У анестезированных крыс самцов линии Sprague Dawley (питомник лабораторных животных, г. Пущино, Московская обл.) весом 400-500 г изолировали каротидную артерию и повреждали сосуд наложением на 15 мин сегмента фильтровальной бумаги, смоченной раствором FeCl3. FeCl3 использовали в двух концентрациях - 20% и 40%. Кровоток регистрировали с помощью датчика Холла, наложенного выше места повреждения сосуда. В каждом эксперименте измеряли время полной остановки кровотока, проводя эксперимент в течение 60 мин после начала воздействия FeCl3. Аптамер NH2-RE31-PEG вводили лабораторному животному внутривенно через 5 мин после наложения FeCl3.
Результаты эксперимента показаны на графике (фиг. 1 Действие модифицированного аптамера NH2-RE31-PEG на артериальное тромбообразование. Крысы, FeCl3 модель. Каждая точка соответствует среднему значению из 2 экспериментов.), где видно, что у контрольных животных в зависимости от концентрации FeCl3 тромботическая окклюзия наступало приблизительно через 12 и 18 мин при использовании 20% и 40% раствора соответственно.
При использовании обеих дозировок FeCl3 модифицированный аптамер NH2-RE31-PEG дозозависимо удлинял время тромботической окклюзии, а при максимальных дозировках полностью предотвращал остановку кровотока в течение времени эксперимента (60 мин). При увеличении концентрации FeCl3, т.е. при более выраженном повреждении артерии, увеличивались и дозировки модифицированного аптамера NH2-RE31-PEG, необходимые для подавления тромбоза.
Следовательно, полученные результаты указывают на возможность подавления артериального тромбообразования с помощью антитромбинового модифицированного аптамера NH2-RE31-PEG.
Пример 2. Влияние модифицированного аптамера PEG-RE31-NH2 на стимулированный тканевым активатором плазминогена лизис фибрина.
Тромбин играет важную роль не только в образовании фибрина, но и в обеспечении его механической и протеолитической стабильности. Во-первых, с увеличением концентрации тромбина увеличивается плотность упаковки протофибрилл, что снижает скорость диффузии плазминогена и его активаторов внутрь тромба. Во-вторых, в число макромолекулярных субстратов тромбина, которые играют важную роль в стабилизации фибрина, входят фактор XIII и активируемый тромбином ингибитором фибринолиза (АТИФ). Фактор XIII образует межмолекулярные сшивки между мономерами фибрина и между фибрином и α2-антиплазмином, а АТИФ отщепляет С-концевые остатки лизина, образующиеся в ходе лизиса фибрина и обеспечивающие высокоафинное связывание плазминогена и тканевого активатора плазминогена (тАП) с фибрином. Все эти данные позволяют предположить, что антитромбиновые аптамеры могут не только ингибировать образование тромбов, но и ускорять их лизис.
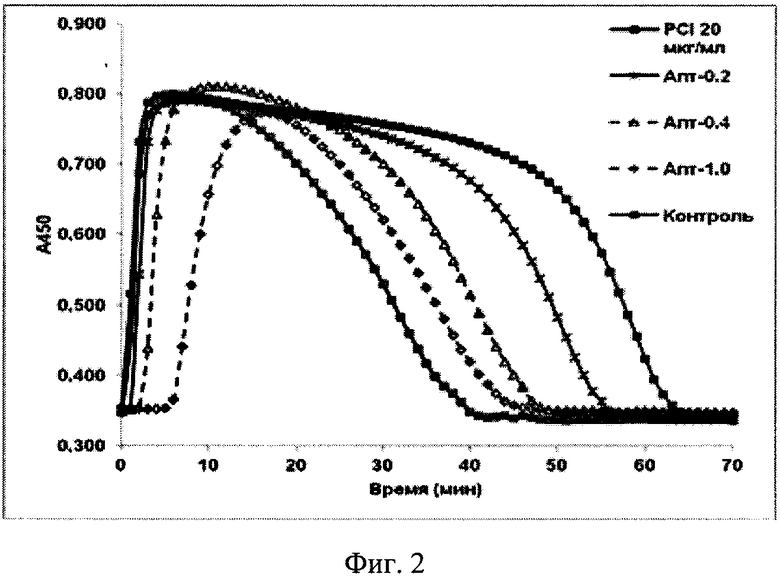
Использовали аптамер PEG-RE31-NH2, представляющий собой базовый аптамер (олигонуклеотид) с условным названием RE31 (олигонуклеотидная последовательность - GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC), коньюгированный с PEG группой и NH2 по 5′ и 3′ концам соответственно, который растворяли в 0,9% натрия хлорида. Для исследования профибринолитического действия модифицированного аптамера PEG-RE31-NH2 применяли модификацию предложенного ранее турбидиметрического метода регистрации образования и лизиса сгустков плазмы in vitro. При проведении экспериментов использовали следующие реактивы. Ингибитор карбоксипептидазы из клубней картофеля (PCI) производства "Sigma", HEPES - "Serva", NaCl и KCl - "Реахим", Thromborel S - "Siemens", 25 мМ CaCl2 - "Stago", тАП (Актилизе) - "Boehringer Ingelheim". В ячейки 96-луночной плашки вносили последовательно 60 мкл раствора аптамера PEG-RE31-NH2 (конечная концентрация от 0 до 1 мкМ), или PCI (конечная концентрация - 20 мкг/мл), приготовленные на 25 мМ HEPES, pH 7.4, содержащем 140 мМ NaCl и 5 мМ KCl, и 70 мкл Thromborel S (разбавленного 1:500 25 мМ CaCl2, содержащем 5 мМ KCl). Плашку инкубировали 10 мин при 37°C в планшетном термостате-шейкере "Elmi". Реакцию стартовали добавлением 70 мкл пула плазм доноров, к которому был добавлен тАП (конечная концентрация - 25 нг/мл). Плашку помещали в термостатируемый при 37°C планшетный фотометр Multiscan Go "Thermo Scientific" и с интервалом в 1 мин регистрировали изменения оптической плотности (А450 нм) в течение 120 мин.
На фиг. 2 показаны кривые изменения оптической плотности (А450) в ходе образования и лизиса фибринового сгустка плазмы. Представлены данные по динамике образования и лизиса сгустка 2 контрольных образцов (без ингибиторов (контроль) и в присутствие пептидного ингибитора карбоксипептидазы В (PCI 20 мкг/мл) и 3 из 5 использованных концентраций аптамера PEG-RE31-NH2 - апт. 0,2, 0,4, и 1 мкМ (данные по 0,1 и 0,6 мкМ не представлены в целях упрощения визуализации).
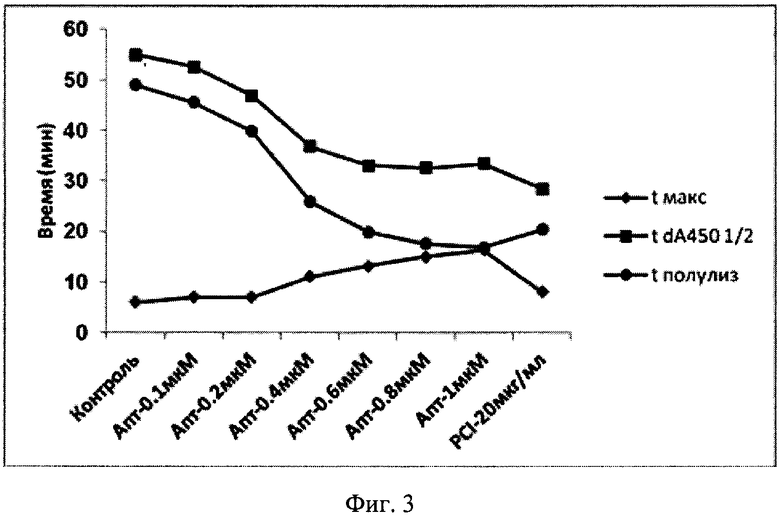
На фиг. 3 показаны основные параметры динамики образования и лизиса фибрина. Обозначения: tmax - время достижения максимального поглощения; tdA4501/2 - время от начала реакции до точки, при которой снижение А450 составляло 1/2 от максимальной амплитуды; t полулизиса - [tdA4501/2-tmax].
Как показано на фиг. 2, изменения А450 в ходе реакции характеризуются наличием 2-х фаз - быстрого повышения, обусловленного образованием рассеивающего свет фибрина, и снижения, обусловленного его лизисом. Время достижения максимального А450 увеличивалось с увеличением концентрации модифицированного аптамера PEG-RE31-NH2, а время лизиса - сокращалось. Это свидетельствует о том, что антитромботическое влияние исследуемого аптамера включает 2 эффекта - ингибирование образования фибрина и стимуляция его лизиса. Использованный в качестве препарата сравнения PCI, представляющий собой полипептид (мол. масса ~4,2 КД), блокирующий активные центры ряда карбоксипептидаз, включая АТИФ, проявлял только профибринолитическое действие.
Важно подчеркнуть, что в условиях данного эксперимента основной профибринолитический эффект как пептида, ингибирующего активированную форму АТИФ, так и аптамера, ингибирующего и образование фибрина и активацию АТИФ, заключался в сокращении лаг-фазы процесса фибринолиза. На максимальную скорость лизиса, которая пропорциональна тангенсу угла наклона касательной к нисходящей части кривых изменения оптической плотности, исследованные ингибиторы практически не влияли (фиг. 2 и 3). Ведущим фактором, определяющим максимальную скорость лизиса фибрина, является активность образующегося плазмина, которая зависит в основном от соотношения между плазминогеном и α2-антиплазмином в исследуемой плазме.
Пример 3. Ингибирование модифицированным аптамером PEG-RE31-NH2 активации АТИФ.
В число макромолекулярных субстратов тромбина, которые играют важную роль в стабилизации фибрина входят фактор XIII и прокарбоксипептидаза В, идентифицированная в 1995 г. как активируемый тромбином ингибитор фибринолиза (АТИФ). АТИФ может активироваться рядом трипсиноподобных протеаз, но наиболее эффективным активатором является комплекс тромбин-тромбомодулин.
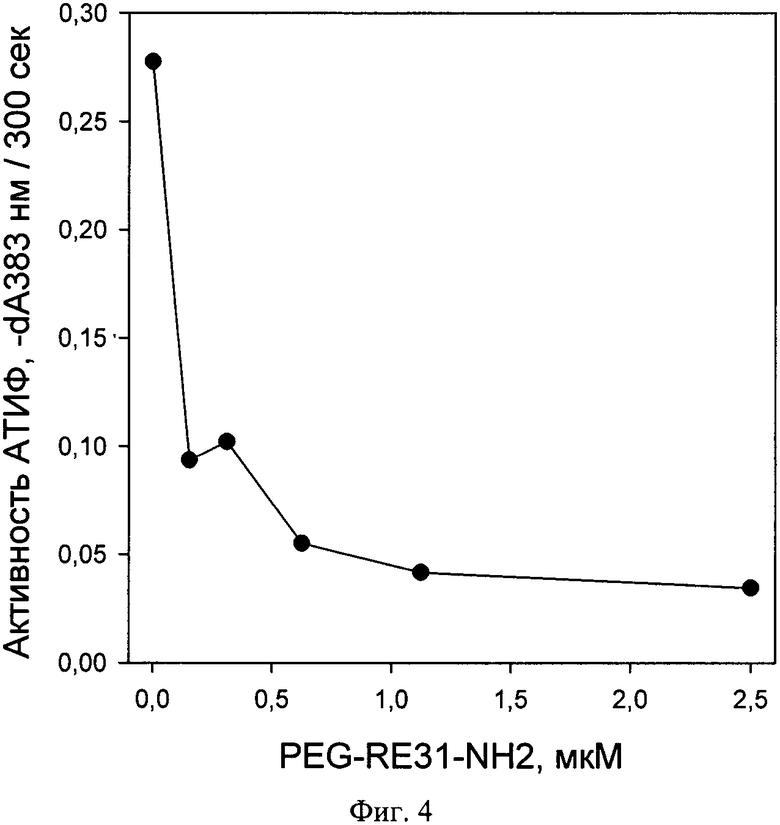
Для исследования влияния аптамера PEG-RE31-NH2 на активацию АТИФ использовали методику и набор реактивов STA Stachrom TAFI производства Diagnostica Stago (Франция). Принцип метода заключается в активации АТИФ комплексом тромбин-тромбомодулин в присутствии пептидного субстрата. Образующийся в ходе активации АТИФа (а - активированный) выполняет промежуточное расщепление субстрата, при котором его окраска не меняется. Количество расщепленного субстрата определяется во второй хромогенной реакции, катализируемой карбоксипептидазой А, в результате которой происходит обесцвечивание субстрата. Реакцию проводили в термостатируемом планшетном фотомерте Multiskan Go, производства Thermo Scientific (Финляндия).
В ячейки 96-луночной плашки вносили по 20 мкл плазмы PreciClot I, разведенной 1:20 буфером Оврена (pH 7,35), содержащей модифицированный аптамер PEG-RE31-NH2 в конечной концентрации (с учетом разведения другими компонентами реакции) до 5 мкМ. Затем в ячейки добавляли по 40 мкл раствора тромбин-тромбомодулин (0,25 NIH/мл) и субстрата SBS 02.98 (7,5 мкМ). Плашку инкубировали 10 мин при при 37°C, затем стартовали хромогенную реакцию добавлением 160 мкл раствора карбоксипептидазы А, в ходе которой регистрировали изменение поглощения при 383 нМ.
На фиг. 4. показано влияние аптамера PEG-RE31-NH2 на активацию АТИФ комплексом тромбин-тромбомодулин, где видно, что уже при концентрации PEG-RES31-NH2 0,5 мкМ наблюдается практически полное ингибирование активации АТИФ, а даже при самой низкой из исследованных концентраций - 0,156 мкМ степень его активации не превышала 30% от максимальной.
Представленные в примерах варианты модифицированных аптамеров, созданных на основе базового аптамера RE31 (GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC), являются иллюстративными и не исключают возможности использования иных вариантов указанного аптамера.
Полученные данные доказывают способность указанного аптамера эффективно ингибировать активацию АТИФ комплексом тромбин-тромбомодулин, что является главной причиной ускорения фибринолиза в его присутствии.
Таким образом, модифицированные аптамеры, созданные на основе базового аптамера RE31 (GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC), подавляют артериальное тромбообразование в модели тромбоза у лабораторных животных. При внутривенном введении они удлиняют время образования окклюзирующего тромба при повреждении артерий у крыс с помощью FeCl3, а при высоких дозировках полностью препятствуют образованию таких тромбов. Эти аптамеры также улучшают растворение фибринового сгустка с помощью тканевого активатора плазминогена (тАП) путем подавления активации АТИФ-эндогенного ингибитора фибринолиза. Продемонстрированные свойства модифицированных аптамеров могут быть использованы при создании на их основе новых антитромботических лекарственных препаратов. Такие препараты возможно использовать как для подавления артериального тромбообразования (например при проведении чрескожных коронарных вмешательств с высоким риском тромботических осложнений), так и для повышения эффективности фибринолитической терапии при растворении тромбов различной локализации.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДИФИЦИРОВАННЫЕ ДНК АПТАМЕРЫ, ИНГИБИРУЮЩИЕ АКТИВНОСТЬ ТРОМБИНА | 2009 |
|
RU2410432C1 |
| АПТАМЕРНЫЙ ОЛИГОНУКЛЕОТИД - ПРЯМОЙ ИНГИБИТОР ТРОМБИНА | 2008 |
|
RU2401306C2 |
| ДНК-АПТАМЕРЫ, ВЗАИМОДЕЙСТВУЮЩИЕ С ПРОТРОМБИНОМ | 2018 |
|
RU2703799C1 |
| КОМБИНАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДНК-АПТАМЕРНЫХ ИНГИБИТОРОВ ТРОМБИНА И АПТАМЕРНЫЕ ОЛИГОНУКЛЕОТИДЫ (ВАРИАНТЫ) | 2013 |
|
RU2520094C1 |
| ПРИМЕНЕНИЕ 2-ФЕНИЛ-3-АРОИЛБЕНЗОТИОФЕНОВ ДЛЯ ИНГИБИРОВАНИЯ ТРОМБОТИЧЕСКОГО РАССТРОЙСТВА, ДЛЯ УВЕЛИЧЕНИЯ АКТИВАЦИИ ПРОТЕИНА С | 1994 |
|
RU2190405C2 |
| ПРЕДОТВРАЩЕНИЕ ОБРАЗОВАНИЯ И/ИЛИ СТАБИЛИЗАЦИИ ТРОМБОВ | 2005 |
|
RU2514878C2 |
| ДНК-АПТАМЕРЫ, ИНГИБИРУЮЩИЕ ТРОМБИН, И СПОСОБ СТАБИЛИЗАЦИИ ИХ СТРУКТУРЫ | 2009 |
|
RU2429293C1 |
| ПРИМЕНЕНИЕ 2-ФЕНИЛ-3-АРОИЛБЕНЗОТИОФЕНОВ ДЛЯ УВЕЛИЧЕНИЯ ЭКСПРЕССИИ ТРОМБОМОДУЛИНА | 1994 |
|
RU2125450C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ С ФИБРИЛЛЯЦИЕЙ ПРЕДСЕРДИЙ НЕКЛАПАННОГО ГЕНЕЗА | 2024 |
|
RU2830800C1 |
| АНТИКОАГУЛЯНТ ПРЯМОГО ДЕЙСТВИЯ НА ОСНОВЕ МОДУЛЬНОГО БИВАЛЕНТНОГО ДНК АПТАМЕРА, СЕЛЕКТИВНОГО К ТРОМБИНУ | 2016 |
|
RU2631829C1 |
Изобретение относится к биотехнологии. Описан способ ингибирования тромбообразования и ускорения фибринолиза с помощью ДНК аптамеров (олигонуклеотидов), ингибирующих активность тромбина. В способе использован ДНК аптамер, характеризующийся нуклеотидной последовательностью GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC и конъюгированный по 5′ или 3′ концу с NH2 группой и/или с полиэтиленгликолем (PEG), и отвечающий общей формуле d-R-GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC-R, где d - дезоксирибоза, при этом олигонуклеотид содержит дезоксирибозу во всех позициях, R - NH2 группа и/или PEG. Изобретение может быть использовано для повышения эффективности антитромботической и фибринолитической терапии. 4 ил., 3 пр.
Способ ингибирования тромбообразования и ускорения фибринолиза с помощью ДНК аптамеров, ингибирующих активность тромбина, отличающийся тем, что используют раствор модифицированного аптамера, характеризующегося нуклеотидной последовательностью GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC и конъюгированного по 5′ или 3′ концу с NH2 группой и/или с полиэтиленгликолем (PEG), и отвечающего общей формуле
d-R- GTGACGTAGGTTGGTGTGGTTGGGGCGTCAC -R,
где d - дезоксирибоза, при этом олигонуклеотид содержит дезоксирибозу во всех позициях, R - NH2 группа и/или PEG.
| СПИРИДОНОВА В.А | |||
| "Структура аптомерных ДНК/РНК - как основа для создания лекарственных препаратов и регуляторных последовательностей" диссертация на соискание ученой степени доктора биологических наук, Москва 2011, раздел 1.3, подраздел 1.3.1 | |||
| МОДИФИЦИРОВАННЫЕ ДНК АПТАМЕРЫ, ИНГИБИРУЮЩИЕ АКТИВНОСТЬ ТРОМБИНА | 2009 |
|
RU2410432C1 |
Авторы
Даты
2015-08-10—Публикация
2014-05-29—Подача