Изобретение относится к макроинкапсулированию секреторных клеток в гидрофильном геле, к терапевтическим методам, в которых применяются макроинкапсулированные секреторные клетки, и к сохранению секреторных клеток посредством макроинкапсулирования.
Предпосылки создания изобретения
Секреторные клетки это клетки, характеризующиеся тем, что они выделяют биологические продукты, такие как (но не только) гормоны (например, инсулин), стимуляторы роста, цитокины и т.д. Их роль в биологических процессах хорошо известна и здесь не излагается. Ряд болезней и паталогических состояний связаны с нарушениями нормальной работы секреторных клеток, такими как недостаточное продуцирование секреторных продуктов, например гипотиреоз и кретиническая карликовость, оба связанные с дефицитом гормона щитовидной железы, гипофизарная карликовость, связанная с дефицитом гормона гипофиза, синдром Леша-Найхана, связанный с дефицитом гипоксантин-гуанин-фосфорибозилтрансферазы, молниеносная печеночная недостаточность в связи с дефицитом гепатотрофического фактора, болезнь внеклеточного матрикса из-за дефицита хондроцитов и сахарный диабет в результате дефицита инсулина.
Одним из подходов при лечении подобных состояний является трансплантация секреторных клеток пациенту. Для того чтобы пересаженный материал был клинически безопасен и эффективен, он должен: (1) быть неиммуногенным, нетромбогенным, биологически устойчивым и абсолютно не токсичным по отношению к клеткам и тканям реципиента; (2) поддерживать жизнеспособность клеток в течение долгого периода времени; (3) обеспечивать свободное прохождение питательных веществ, средств, усиливающих (стимулирующих) секрецию, и продуктов клеток; (4) облегчать хирургическую имплантацию и пересев клеток; (5) легко закрепляться и изыматься.
Трансплантация панкреатических островков для лечения сахарного диабета неоднократно представляла и представляет интерес в связи с достижениями в технологии выделения островков Лангерганса. Напомним, что поджелудочная железа человека содержит островки Лангерганса (в дальнейшем именуемые "панкреатическими островками"), которые разбросаны по всей экзокринной поджелудочной железе и несколько сконцентрированы вблизи протоков. Панкреатические островки в совокупности можно рассматривать как единый эндокринный орган, занимающий около 1% объема поджелудочной железы. Внутри поджелудочной железы мелкие островки (до 160 мкм в диаметре) стремятся распределиться по всей экзокринной ткани. Эти мелкие островки представляют 75% всего количества островков, но только около 15% их объема. Островки более 250 мкм в диаметре составляют только 15% всего количества островков, но 60% их объема. Эти островки находятся вблизи более крупных протоков и кровеносных сосудов и не окружены ацинозной тканью. В поджелудочной железе человека может содержаться более 1 миллиона островков, а каждый островок обычно состоит из нескольких тысяч клеток. Каждый островок содержит центральное ядро из бета-клеток (В-клеток), продуцирующих инсулин, и окружающую мантию из альфа-клеток (А-клеток), содержащих глюкагон, дельта-клеток (D-клеток), выделяющих соматостатин, РР-клеток, содержащих панкреатический полипептид. В-клетки, продуцирующие инсулин, составляют большинство клеток и около 80% островков в организме человека.
Применение трансплантации панкреатических островков в клинике было ограниченным из-за невозможности предотвратить аллотрансплантат-ксенотрансплантат отторжение островков, т.е. отторжение пересаженных панкреатических островков в результате их атаки иммунной системой реципиента. Чтобы противодействовать отторжению, панкреатические островки пересаживались в сочетании с применением иммунодепрессантов.
Однако терапия с применением иммунодепрессантов оказалась обоюдоострым оружием: уменьшая риск отторжения, она ухудшает общую иммунологическую защиту организма. Многочисленные исследователи изучали разнообразные методы защиты пересаженной ткани от иммунной реакции реципиента. Из дальнейшего рассмотрения следует, что, несмотря на временные успехи (см. Lacy, Diabetes Reviews 1 (1): 76 (1993)), эффективных долговременных методов пока не найдено.
Все пять основных подходов к защите пересаженной ткани от иммунной реакции реципиента связаны с попытками изолировать пересаженную ткань от иммунной системы реципиента. Иммунноизоляционные процедуры, применяемые в настоящее время, включают камеры для экстраваскулярной диффузии, камеры для интраваскулярной диффузии, камеры для интраваскулярной инфильтрации, микроинкапсулирование и макроинкапсулирование. Однако все эти методы оказались безуспешными по следующим причинам: фиброзная реакция реципиента на материал имплантата, нестабильность материала имплантата, ограниченная диффузия питательных веществ через полупроницаемые мембраны, ограниченная проницаемость для средств, стимулирующих секрецию, и продуктов, а также временная задержка при диффузии через барьеры полупроницаемых мембран.
Например, Лим разработал в 1978 году процедуру микроинкапсулирования для заключения в оболочку жизнеспособных клеток, тканей и других лабильных биологических мембран внутри полупроницаемой мембраны (Lim, Research Report to Damon Corporation (1978)). Для инкапсулирования островков Лангерхана Лим использовал микрокапсулы из альгината и поли-L-лизина. О первом успешном применении этой новой процедуры в живом организме при исследовании диабета было сообщено в 1980 году (Lim et al., Science 210:908 (1980)). Имплантация этих микроинкапсулированных островков Лангерхана поддержала состояние эугликемии у животных, больных диабетом. Тем не менее, другие исследователи при повторе этих экспериментов обнаружили, что альгинат вызывает реакцию ткани, и не смогли воспроизвести результаты Лима и сотрудников (Lamberti et al., Applied Biochemistry and Biotechnology 10:101 (1984); Dupuy et al., Jour. Biomed. Material and Res. 22:1061 (1988); Weber et al., Transplantation 49: 396 (1990); и Soon-Shiong et al. , Transplantation Proceedings 22:754 (1990)). В настоящее время считают, что растворимость этих полимеров в воде является причиной ограниченной стабильности и биосовместимости этих микрокапсул в живом организме. (Dupuy et al., см. выше, Weber et al., см. выше, и Smidsrod, Faraday Discussion of Chemical Society 57:263 (1974)).
Недавно Ивата и др. (Iwata et al., Jour.Biomedical Material and Res. 26: 967 (1992)) использовали агарозу для микроинкапсулирования аллогенных панкреатических островков и обнаружили, что она может применяться в качестве среды для изготовления микрогранул. В их исследовании 1500-2000 островков были микроинкапсулированы по отдельности в 5% агарозе и имплантированы мышам, больным диабетом, вызванным стрептозотоцином. Трансплантат сохранял жизнеспособность в течение долгого времени, а у реципиентов нормогликемия сохранялась неограниченно.
Однако метод Ивата и др. имеет ряд недостатков. Он громоздок и неточен. Например, многие гранулы покрыты агарозой лишь частично, а несколько сотен гранул оказываются пустыми. Поэтому требуется дополнительное время для отделения инкапсулированных островков от пустых гранул. Вдобавок, большинство имплантированных микрогранул собирается в полости таза, и для обеспечения нормогликемии нужно большое число островков в полностью покрытых отдельных гранулах. Кроме того, пересаженные гранулы трудно извлечь обратно, т.к. они хрупкие, и островки легко выделяются из гранул при малейшем повреждении.
Процедура макроинкапсулирования также была испытана. Для иммуноизоляции островков Лангерхана были изготовлены макрокапсулы из различных материалов: поли-2-гидроксиэтилметакрилата, поливинилхлоридкоакриловой кислоты и ацетата целлюлозы (см. Altman et al., Diabetes, 35:625 (1986); Altman et al., Transplantation American Society of Artificial Internal Organs 30:382 (1984); Ronel et al., Jour.Biomedical Material Research 17:855 (1983); Klomp et al., Journal Biomedical Material Research 17:865-871 (1983)).
Во всех этих исследованиях достигалась только временная нормализация гликемии.
Арчер и др. (Archer et al., Journal of Surgical Research, 28:77 (1980)) использовали полые волокна акрилового сополимера. Они сообщили, что диспергированные неонатальные панкреатические имплантаты мышей долгое время сохраняли жизнеспособность в полых волокнах, пересаженных хомякам, больным диабетом. Недавно Лейси и др. (Lacy et al., Science 254:1782-1784 (1991)) подтвердили эти результаты, но обнаружили, что состояние эугликемии является преходящей фазой. Лейси и др. обнаружили, что когда островки впрыскиваются в волокна, они образуют агрегаты внутри полой трубки и вызывают омертвление в центральной части массы островков. Центральное омертвление сокращало срок жизни имплантата. Однако этот эксперимент не был широко повторен. Поэтому функция мембраны как среды для трансплантации островков в организм человека остается под вопросом.
Таким образом, существует необходимость в осуществлении трансплантации секреторных клеток, в частности в достижении выживания аллотрансплантата и ксенотрансплантата панкреатических островков без использования хронических иммунодепрессантов.
Авторы настоящего изобретения неожиданно открыли, что макроинкапсулирование секреторных клеток в гидрофильном геле дает функциональную, неиммуногенную макрогранулу, которая может быть пересажена животным и сохраняться в течение больших периодов времени. Макроинкапсулирование секреторных клеток согласно изобретению дает более эффективную и удобную процедуру для трансплантации секреторных клеток. Процедура макроинкапсулирования может быть использована также для макроинкапсулирования других биологических агентов, таких как ферменты, микроорганизмы, пищевые агенты, в том числе пищевые агенты, полученные путем рекомбинации, цитотоксические агенты и химико-терапевтические агенты. Макроинкапсулированные биологические агенты могут применяться для лечения состояний, которые заведомо дают реакцию на биологический агент.
Краткое изложение сущности изобретения
Целью настоящего изобретения является создание макрогранул с секреторными клетками, которые могут быть пересажены животным для лечения состояний, вызываемых нарушенным функционированием секреторных клеток у реципиента.
Еще одной целью настоящего изобретения является создание макрогранул с секреторными клетками, которые могут храниться в течение долгих периодов времени.
Для достижения этих и других целей, в соответствии с одним их аспектов данного изобретения, разработан метод получения макрогранул с секреторными клетками, изготовленных из агарозы и покрытых агарозой.
В соответствии с другим аспектом изобретения разработан метод лечения пациента, состояние которого характеризуется дефицитом продукта секреторных клеток, заключающийся в том, что указанному пациенту пересаживают терапевтически эффективное количество макрогранул с секреторными клетками, покрытых агарозой и изготовленных из агарозы.
Другие цели, особенности и преимущества настоящего изобретения станут очевидны из последующего подробного описания. Следует иметь в виду, что подробное описание и конкретные примеры, показывающие предпочтительные варианты реализации изобретения, носят только иллюстративный характер, поскольку возможны различные изменения и модификации, не выходя за пределы сущности и объема изобретения, как легко поймут специалисты в данной области из подробного описания.
Краткое описание чертежей
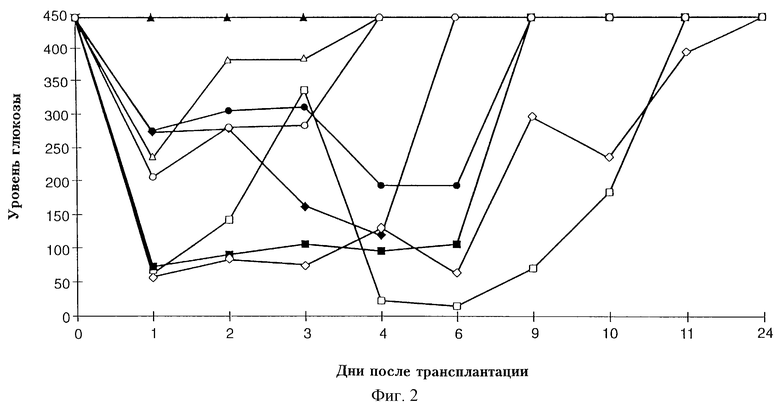
На фигуре 1 показаны уровни глюкозы у мышей, больных диабетом, которым были пересажены макрогранулы с панкреатическими островками, покрытые агарозой и изготовленные из агарозы.
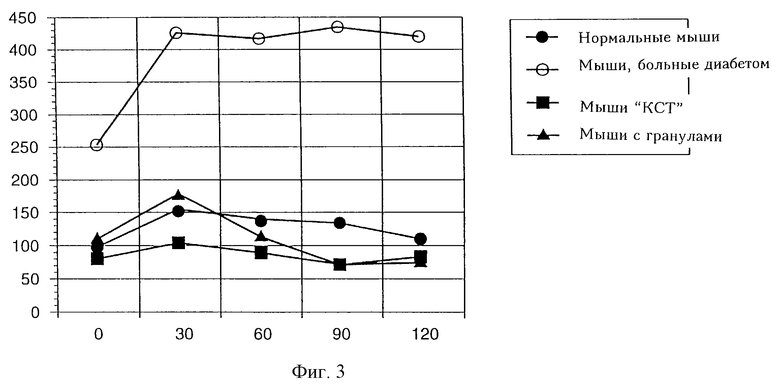
На фигуре 2 показаны уровни глюкозы у мышей, больных диабетом, которым были пересажены свободные панкреатические островки.
Фигура 3 иллюстрирует тест на переносимость глюкозы для нормальных мышей, для мышей больных диабетом, вызванным стрептозотоцином, получавших аллотрансплантат в почечной капсуле "(мыши КСТ)", и для мышей, больных диабетом, вызванным стрептозотоцином, получавших макрогранулы с панкреатическими островками, покрытые агарозой и изготовленные из агарозы (все такие мыши в дальнейшем называются "мышами с гранулами").
Подробное описание изобретения
Данное изобретение относится к макроинкапсулированию биологических агентов, предпочтительно секреторных клеток, в гидрофильный гель, к терапевтическим методам, в которых используются макроинкапсулированные биологические агенты, предпочтительно секреторные клетки, и к сохранению биологических агентов, предпочтительно секреторных клеток, путем макроинкапсулирования. Гидрофильный гель включает агарозу и сочетания агарозо-коллагена и губчатого желатина агарозы. В дальнейшем губчатый желатин будет называться пенистым гелем.
Термином биологический агент обозначается живой организм и его продукты, например белки, ферменты, гормоны, полипептиды, сыворотка, антитела, антибиотики, а также клетки, полученные методами генной инженерии. Биологические агенты включают ферменты, например глюкозооксидазу, комплекс лактазы, микроорганизмы, например Klebsiella aerogenes, для выведения аммиака и мочевины, пищевые агенты, в том числе пищевые агенты, полученные рекомбинантным путем, например полученный рекомбинантным путем гормон роста, и цитотоксические агенты.
Термин секреторная клетка включает панкреатический островок, хотя технически панкреатический островок не секреторная клетка, а чаще всего кластер секреторных клеток, рассеянных по всей поджелудочной железе и составляющих ее эндокринную часть. В организме человека панкреатические островки состоят по крайней мере из четырех типов секреторных клеток: альфа-клеток, выделяющих гипергликемический фактор глюкагон; бета-клеток, наиболее многочисленных (70-80%) и выделяющих инсулин; дельта-клеток, выделяющих соматостатин, и полипентидных клеток, выделяющих полипептидный гормон.
Как объяснялось ранее, пересаженный материал должен быть совместимым с реципиентом. Агароза давно применяется в биологических исследованиях и ее качество хорошо контролируется. Коллаген является наиболее распространенным протеином у млекопитающих, он обеспечивает прочную механическую поддержку и служит биологическим пространством для размножения клеток, их дифференциации, органогенеза, индивидуального роста и заживления ран. Коллаген также обладает хорошей биосовместимостью. Пенистый гель неиммуногенен и широко применяется в хирургических процедурах. Он также хорошо переносится секреторными клетками.
Биологические агенты, предпочтительно секреторные клетки, сначала выделяют с помощью хорошо известных процедур. В предпочтительном варианте изобретения панкреатические островки культивируют при 40oС, 24oС или при 37oС перед макроинкапсулированием. Этот метод позволяет выбрать только те островки, которые выжили после травмы в результате выделения. Кроме того, островки становятся менее иммуногенными вследствие того, что макрогранулы защищают от фиброза.
Согласно изобретению биологический агент, предпочтительно панкреатические островки, а еще предпочтительнее около 50.000 - 700.000 панкреатических островков, помещают в раствор агарозы, содержащий около 0,5-5%, предпочтительно около 1% агарозы. Затем смесь превращается в макрогранулу путем контактирования смеси с минеральным маслом или тефлоном. После этого макрогранулу переносят в среду антибиотика, промывают и инкубируют в течение ночи, предпочтительно при 37oС в увлажненной атмосфере с 5% углекислого газа.
Макрогранулы равномерно покрываются агарозой, предпочтительно путем вращения гранулы 3-4 раза в ложке из тефлона, содержащей приблизительно 500-2.000 мкл 5-10% агарозы. Аналогично, термин макрогранулы с биологическим агентом используется здесь для обозначения макроинкапсулирования биологических агентов в форме гранул.
Макрогранулы могут использоваться для доставки биологического агента в организм, где этот агент выполнит свою известную функцию. В одной грануле можно инкапсулировать биологические агенты нескольких типов. Например, макрогранула может содержать сложные ферменты, такие как гемоглобин и глюкозооксидаза. Такую гранулу можно применить для выведения билирубина. Эти гранулы могут применяться для перорального введения пищеварительных ферментов (комплекса лактазы), или для выборочного выведения нежелательных аминокислот из организма. Инкапсулирование ферментов также предотвратит их разрушение на свету. Кроме того, с помощью инкапсулирования можно надежно ввести в организм рекомбинантные гены.
Например, ген K.aerogenes можно макроинкапсулировать в макрогранулы для выведения аммиака и мочевины. В тех случаях, когда биологический агент иммуногенен по отношению к реципиенту, макрогранула позволяет применять биологический агент, не прибегая к иммунодепрессантам, или используя их в меньших количествах.
Макрогранулы с секреторными клетками можно использовать для лечения состояний, вызванных ухудшением функций секреторных клеток субъекта, например сахарного диабета, нарушений в результате дефицита фактора роста и гормональных нарушений, путем пересадки макрогранул с секреторными клетками субъекту. Для соответствующего лечения макрогранулы могут вводиться в соответствующее место. Например, макрогранулы, содержащие гепатоциты, могут быть имплантированы в брюшную полость для лечения болезней, связанных с отсутствием функции печени. Предпочтительное применение состоит в трансплантации пациенту для лечения сахарного диабета 5-10 макрогранул с панкреатическими островками, каждая из которых содержит 50.000-700.000 панкреатических островков. Макрогранулы могут быть введены в брюшную полость.
Макрогранулы с секреторными клетками пересаживаются пациенту в количестве, достаточном для лечения. Количество, адекватное для достижения этой цели, определяется как "терапевтически эффективное количество" или "эффективное количество". Количества, эффективные для такого применения, зависят от степени тяжести болезненного состояния, общего состояния пациента, путей применения, размещения макрогранул и от того, применяются ли макрогранулы с секреторными клетками в сочетании с другими лекарствами.
Макрогранулы с секреторными клетками могут быть использованы для аллогенной и ксеногенной трансплантации в сочетании с иммунодепрессантами или, предпочтительно, без иммунодепрессантов. В предпочтительном варианте осуществления изобретения пациенты, страдающие хроническим или острым сахарным диабетом, лечатся путем ксенотрансплантации пациенту, без применения иммунодепрессантов, панкреатических островков из организмов животных, например, панкреатических островков из организма свиньи, быка, мыши, крысы, дятла или других подходящих видов. Макрогранулы с секреторными клетками могут также назначаться в сочетании с другими терапевтическими препаратами, например с обычно применяемым методом лечения тройкой препаратов (циклоспорин, азатиоприн и гидрокортизон), рапамицином, дезоксипергуалином или антителами.
Макрогранулы могут также использоваться как средство для хранения биологических агентов, предпочтительно секреторных клеток, в течение долгого времени. Для поддержания жизнеспособности биологических агентов и предпочтительно секреторных клеток биологические агенты и предпочтительно макрогранулы с секреторными клетками инкубируют до тех пор, пока они не пересаживаются животному.
Когда секреторные клетки являются панкреатическими островками, макрогранулы с панкреатическими островками инкубируют при температуре от 24oС до 37oС.
ПРИМЕРЫ
Пример I. Выделение панкреатических островков
Панкреатические островки выделяли из мышей при помощи видоизмененного метода, описанного в статье Гото и др. (Gotoh et al., Transplantation 40:437 (1985)).
Раствор коллагеназы (коллагеназа Типа XI, Сигма Кемикл, Сен Луи, Миссури 1 мг/мл содержит 2 мг/мл Сигмы Типа Y, альбумина бычьей сыворотки и 1 мг/мл хлористого кальция) впрыскивали в поджелудочную железу через общий желчный проток. (Gotoh et al., Transplantation 40:437 (1985), см. выше). Поджелудочную железу изымали и помещали в колбу на льду. После того как было собрано 4 поджелудочных железы крыс, колбу помещали на водяную баню при 38oС на 30 минут. Полученную переработанную ткань промывали 4 раза в холодном (8oС) сбалансированном солевом растворе Хенка (HBSS, Hank's Balanced Salts Solution).
Непереработанную ткань, крупные лимфатические узлы и прочий посторонний материал устраняли многократной мобилизацией ткани и последующим удалением надосадочной жидкости. Очищенные островки отделяли, используя прерывистый градиент Фиколла (discontinuous Ficoll gradient), состоящий из 25%, 23%, 21%, и 11% слоев Фиколла, приготовленных в растворе Евро-Коллинз (Frescenius AG, Gluchen Steinweg, Homburg V.D.H.) и центрифугировали со скоростью 2000 оборотов в мин в течение 16 минут. Островки собирали на границе раздела между 11% и 21% слоями Фиколла и между 21% и 23% слоями Фиколла. Островки каждой фракции объединяли и промывали четыре раза в растворе HBSS, содержащем 10% сыворотки из эмбриона теленка.
Объединенные островковые клетки переносили в чашки Петри, содержащие полную среду RPMI, т.е. холодную среду RPMI 1640 (GIBCO, Грэнд Айленд, Нью Йорк), с добавлением 25 мМ HEPES (N-2-гидроксиэтилпиперазин-N'-этилсульфоновой кислоты), сыворотки из эмбриона теленка (10%), инактивированной нагреванием, и антибиотического - антигрибкового раствора (1 мл/100 мл), содержащего 100 мкг/мл пенициллина, 100 мкг/мл сульфата стрептомицина и 25 мкг/мл амфотерицина В. Любая оставшаяся неостровковая ацинозная ткань, ткань сосудов, протоков, или лимфатических узлов распознавалась под препаровальной лупой и тщательно устранялась при помощи стерильной пипетки с тонким кончиком. Окончательная чистота оценивалась окрашиванием препарата островков дифенилтиокарбазоном.
После выделения островки инкубировали в течение 4 дней в бактериологических пластмассовых чашках (100 мм), содержащих 10 мл среды RPMI, при 37oС, в увлажненной атмосфере, содержащей 5% углекислого газа. Среда сменялась ежедневно, а островки после инкубации либо непосредственно пересаживали, либо макроинкапсулировали.
Пример II. Приготовление агарозных макрогранул с панкреатическими островками, покрытых агарозой
Тысячу панкреатических островков, полученных способом, описанным в Примере I, сначала промывали 4 раза антибиотической средой RPMI. Затем панкреатические островки переносили в пробирку, содержащую 50 мкл антибиотической среды RPMI, и суспендировали в этой среде. После этого в пробирку добавляли 100 мкл 1% раствора агарозы. Все содержимое пробирки немедленно переносили в виде одной крупной капли или в стерилизованное минеральное масло, или на лист тефлона. Через 1 минуту капля затвердевала, и образовывалась макрогранула. Эту макрогранулу переносили в антибиотическую среду RPMI, температура которой поддерживалась равной 37oС. Затем масло устранялось троекратной промывкой макрогранулы той же средой и двукратным прополаскиванием в полной среде RPMI. Макрогранулы инкубировали в течение ночи при 37oС в увлажненной атмосфере, содержащей 5% углекислого газа.
На следующий день эти макрогранулы переносили в тефлоновую ложку с 1 мл 5% агарозы или в среде RPMI, или в среде MEM. Для равномерного покрытия макрогранул агарозой макрогранулы аккуратно переворачивали в агарозе 2-3 раза. Затем макрогранулы переносили в минеральное масло, на тефлоновую чашку, прежде чем агароза затвердевала. Через 60 секунд гранулы вынимали из масла и промывали три раза в антибиотической среде RPMI и два раза в полной среде RPMI. Затем гранулы инкубировали в течение ночи.
Пример III. Пересадка мышам макрогранул с панкреатическими островками
А. Мыши-реципиенты и крысы-доноры
Использовались мыши-самцы линий C57BL/6 и BALB/c. Мыши-реципиенты заболевали диабетом в результате однократной внутривенной инъекции стрептозотоцина (170-200 мг/кг).
Уровни глюкозы плазмы в отсутствие голодания определялись до индуцирования диабета. Все уровни сахара в крови у мышей-реципиентов наблюдались в пробах венозной крови из хвоста с помощью прибора ExacTech Sensor. Использовались только те мыши, у которых уровень глюкозы в сыворотке в день пересадки был >400 мг/дл.
Донорами для ксенотрансплантации служили крысы линии Wistar Furth.
Б. Ксенотрансплантация макрогранул с панкреатическими островками в брюшную полость
Во время трансплантации макрогранулы с панкреатическими островками, полученные в Примере II, соответственно, аккуратно переносились на отдельные пластины с антибиотической средой RPMI. Для устранения всех сывороточных белков среда сменялась три раза. Мышей-реципиентов, больных диабетом, анастезировали авертином. Для введения одной макрогранулы с панкреатическими островками в свободную брюшную полость делался надрез по средней линии. Двуслойное закрытие надреза осуществлялось рассасывающимся швом. Контрольные мыши получали либо пустую макрогранулу внутрибрюшинно, или пустую макрогранулу вместе со свободными донорскими панкреатическими островками.
После трансплантации уровень глюкозы в крови каждого реципиента проверялся ежедневно или через день до достижения нормального диапазона; после этого уровень глюкозы в крови проверялся только 2-3 раза каждую неделю. Трансплантаты считались технически успешными, если содержание сывороточной глюкозы было <200 мг/дл и оставалось таким при последующих кровопусканиях. Считалось, что трансплантат отторгнут, если концентрация сывороточной глюкозы поднималась выше 200 мг/дл после периода преходящей нормогликемии. Трансплантаты считались неудачными или ставшими "первично нефункционирующими", если уровень глюкозы в крови вообще не становился нормальным (т.е. постоянно оставался >200 мг/дл).
В. Тест на внутрибрюшинную переносимость глюкозы
Приблизительно 70-84 дня после имплантации проводились тесты на переносимость глюкозы. Раствор глюкоз (1,0 г/кг веса тела) вводился внутрибрюшинно мышам, голодавшим в течение 6 часов (с 9 утра до 3 дня). Для определения уровня глюкозы плазмы на приборах ExacTech Sensors брались пробы крови до и после инъекции (0, 30, 60 и 120 мин).
Для сравнения тесты на переносимость глюкозы проводились на нормальных мышах линий C57BL/6 и BALB/c, на мышах линий C57BL/6 и BALB/c, у которых диабет вызывался стрептозотоцином и которым не пересаживали панкреатических островков, и на мышах линии BALB/c, больных диабетом, вызванным стрептозотоцином, которым свободные панкреатические островки пересаживались в почечную капсулу (мыши "КСТ").
Проводились контрольные опыты с целью убедиться в том, что эугликемическое состояние у мышей, больных диабетом, достигалось посредством макроинкапсулированных панкреатических островков, а не макрогранул как таковых. Поэтому приготавливались пустые макрогранулы из пенистого геля, покрытые агарозой, как описано в Примере II.
Г. Результаты внутрибрюшинной ксенотрансплантации и тест на переносимость глюкозы
Изменения в уровне глюкозы плазмы при отсутствии голодания у мышей линии C57BL/6, больных STZ диабетом, вызванным стрептозотоцином, наблюдаемые после имплантации им макрогранул с панкреатическими островками, показаны на фигуре 1. Когда были пересажены макрогранулы, изготовленные из агарозы, с панкреатическими островками и покрытые агарозой, 2 из 6 животных приобрели нормогликемическое состояние через 21-33 дня после трансплантации, и после этого их состояние оставалось эугликемическим.
У всех остальных животных, которым были пересажены пустые макрогранулы, эугликемическое состояние не наступало и уровень глюкозы в крови не изменялся.
Когда свободные панкреатические островки пересаживались внутрибрюшинно, у 6 из 7 животных с трансплантатами состояние становилось нормогликемическим через 1 день после пересадки, однако это состояние сохранялось только в течение 3-10 дней (фигура 2).
Результаты тестов на переносимость глюкозы представлены на фигуре 3. У нормальных мышей линий BALB/c, C57BL/6 и у мышей "КСТ" уровень глюкозы в плазме достиг максимума через 30 минут и вернулся к базовому значению через 120 минут.
Аналогичные результаты были получены в тестах при трансплантации макроинкапсулированных панкреатических островков и неинкапсулированных панкреатических островков, пересаженных в почечную капсулу.
Результаты этих опытов показывают, что макрогранулы с панкреатическими островками, покрытые агарозой и изготовленные из агарозы, обладают свойствами, предъявляемыми к гибридному искусственному органу. Кроме того, гранулы не вызывали вредных воздействий. Макрогранулы оставались свободными в брюшной полости, не вызывали тканевой реакции и не прилипали к какому-либо органу. Таким образом, эти биогибридные панкреатические островки выполняют свою функцию в макроинкапсулированных гранулах столь же эффективно, как и в месте их естественного обитания, поджелудочной железе.
У всех мышей уровень глюкозы в плазме достигал максимума через 30 минут и возвращался к базовому значению через 120 минут.
Пример IV. Продолжительное хранение панкреатических островков
Макроинкапсулированные гранулы, изготовленные как описано в Примере II, инкубированные в течение 4 недель при 37oС в полной среде RPMI, испытывались на долгое хранение in vivo и in vitro. Оказалось, что макроинкапсулированные панкреатические островки, инкубированные в течение 4 недель, функционально аналогичны макроинкапсулированным панкреатическим островкам, инкубированным в течение 1 дня.
Этот пример показывает, что способ макроинкапсулирования в соответствии с настоящим изобретением может использоваться для сохранения секреторных клеток, предпочтительно панкреатических островков.
Изобретение относится к макроинкапсулированию секреторных клеток и способу лечения заболеваний, вызванных нарушением функционирования секреторных клеток. Макрогранулу с секреторными клетками, в частности панкреатическими островками, формируют из агарозы и покрытием из агарозы. Выделенные секреторные клетки суспендируют на агарозу в антибиотической среде, сформированную макрогранулу инкубируют в увлажненной атмосфере, содержащей углекислый газ, и покрывают агарозой, окунанием ее в минеральное масло. Для лечения инсулинзависимого диабета полученные макрогранулы с эффективным количеством секреторных клеток имплантируют пациенту. Изобретение обеспечивает функциональность и неиммуногенность макрогранулы, которая после пересадки сохраняется в течение большого периода времени. 3 с. и 17 з.п.ф-лы, 3 ил.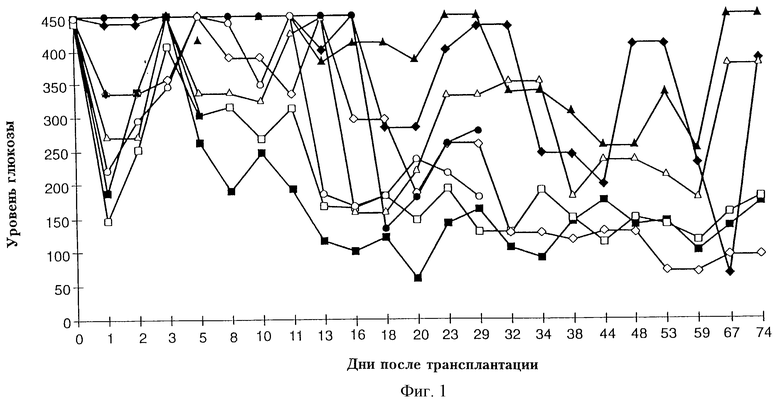
| US 5053332, 01.10.1991 | |||
| US 4663286, 05.05.1987 | |||
| Способ получения биокатализатора в полисахаридном носителе | 1990 |
|
SU1742330A1 |
| BRODELIUS et al | |||
| Entrapment of plant cells in different matrices | |||
| FEBS Letters, 1980, v.122, №3, р | |||
| Способ обработки шкур | 1921 |
|
SU312A1 |
| WATA et al | |||
| J | |||
| Biomed Material and Res, 1992, 26, 967 | |||
| КУЛИК В.П | |||
| и др | |||
| К механизму действия имплантантов фетальной поджелудочной железы на реципиента в кн | |||
| Нарушение механизмов регуляции и их коррекция | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
Авторы
Даты
2003-07-20—Публикация
1995-01-12—Подача