ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Изобретение относится к применению специфического класса соединений для предупреждения развития цитотоксичности, вызываемой глютаматом.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Глютамат представляет собой основной возбуждающий нейротрансмиттер центральной нервной системы (Hollmann М., Heinemann S., Annu. Rev. Neursci. 11, 31-108, 1994), и повсеместное распространение рецепторов глютамата по всей ЦНС утверждает тот факт, что глютамат выполняет центральную роль в механизме различных физиологических и патологических явлений (Watkins J.C., Collingridge G.L., The NMDA receptor, IRL Oxford, 1989).
Согласно весьма состоятельным теориям и отдельным экспериментальным данным можно предположить центральную роль зависимой от глютамата нейротрансмиссии в таких функциях организма, как обучение, распознавание образов и память (Bliss T.V.P, Collingridge G.L., Nature 361, 31-39, 1993).
Кроме того, в последние десятилетия были получены данные о том, что глютамат токсичен для нейронов как in vivo, так и в культуре клеток, и что функционирование рецептора глютамата является решающим для развития многочисленных заболеваний и поражений мозга (Appel S.H., Trends Neurosci. 16, 3-5, 1993). Многие неврологические заболевания, включая апоплексический удар или эпилептические припадки, приводят к поражению мозга вследствие усиленной стимуляции его глютаматом, а дегенеративные заболевания, среди которых можно назвать болезни Альцгеймера, Гентингтона, Паркинсона и амиотрофический боковой склероз (АБС), сопровождаются гибелью нейрональных клеток, вызванной избыточной активацией рецепторов глютамата.
ЦЕЛИ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является обеспечение специфического класса соединений для модулирования вызванной глютаматом нейротрансмиссии и нейротоксичности, которые делали бы возможным лечение острых и хронических нейродегенеративных заболеваний.
Другой целью настоящего изобретения является обеспечение специфического класса соединений, делающих возможным модулирование связанных с глютаматом физиологических функций, к которым принадлежат боль, гормональный баланс, давление крови, терморегуляция, дыхание, обучение, распознавание образов и память.
Еще одной целью настоящего изобретения является обеспечение специфического класса соединений, которые могли бы использоваться в качестве фармакологического инструмента для предупреждения цитотоксичности, вызываемой глютаматом.
Еще одной целью настоящего изобретения является обеспечение специфического класса соединений, которые представляли бы действительную фармакологическую альтернативу для описанных ранее соединений, таких как конкурентные антагонисты (антиметаболиты) и неконкурентные антагонисты глютамата, ганглиозиды и факторы роста, для лечения острых и хронических неврологических заболеваний, связанных с глютаматом.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Эти и другие цели, а также связанные с ними преимущества, которые более четко обозначены в приведенном ниже описании, могут быть достигнуты при использовании соединений, которые являются агонистами или антагонистами Р2-пуриноцепторов, для предупреждения цитотоксичности, вызываемой глютаматом.
Существенная новизна настоящего изобретения заключается в выявлении корреляции между биологическими явлениями, вызываемыми глютаматом, и модуляторами Р2-пуриноцептора (агонистами или антагонистами). И рецепторы глютамата, и Р2-пуриноцепторы обладают общим свойством, на основе которого их можно отнести как к ионотропным, так и метаботропным видам рецепторов.
В качестве примера выбраны соединения базиленовый синий E-3G (также называемое Реактив синий 2) и цибакрон синий 3GA, которые являются антагонистами Р2-пуриноцепторов. Эти соединения могут быть получены, например, от компании Сигма (Sigma), а их молекулярные структуры и основные характеристики описаны в распространяемом в Италии каталоге компании Сигма 1995 года, соответственно на странице 149 для базиленового синего E-3G и на странице 266 для цибакрона синего 3GA. В качестве другого соединения был выбран 5-аденилилимидодифосфат (AMPPNP), который является агонистом Р2-пуриноцепторов. Это соединение может быть получено от компании Сигма, а его молекулярная структура и основные характеристики описаны на странице 52 каталога Сигмы, опубликованного в Италии в 1995 году.
В соответствии с настоящим изобретением эти соединения используются для предупреждения вызванной глютаматом цитотоксичности в клетках центральной нервной системы, в частности в нейронах ЦНС. В качестве модельной клеточной системы для нейронов ЦНС использовались мозжечковые нейроны постнатальных крыс. Эти клетки, относящиеся к числу наиболее хорошо охарактеризованных первичных нейрональных культур, в случае выделения их из мозжечка постнатальных крыс (Lasher R.S., and Zagon I.S., Brain Res. 41, 428-438, 1972) при росте in vitro образуют зрелый фенотип в виде интернейронов, которые используют глютамат в качестве нейротрансмиттера и, кроме того, представляют собой прекрасную модельную систему для исследования опосредованной глютаматом цитотоксичности.
Воздействие на гранулярные нейроны глютамата в количестве 100 мкМ в течение 15-30 минут приводит (через 15-20 часов) к гибели 80-100% клеток от общего их числа. Обнаружено, что антагонист Р2-пуриноцептора базиленовый синий, называемый также реактивом синим 2 (производное антрахинон-сульфоновой кислоты), при введении его в гранулярные нейроны в количестве 100 мкМ при условии одновременного присутствия глютамата полностью поддерживает выживание клеток, устраняя таким образом цитотоксическое действие глютамата. Воздействие базиленового синего на морфологию гранулярных клеток мозжечка демонстрирует, несмотря на присутствие глютамата, который в ином случае индуцирует полную гибель клеток, вполне здоровый вид клеточных телец, которые участвуют в функционировании густой сети в высшей степени разветвленных процессов. Базиленовый синий способствует также сохранению адгезии и фасцикуляции нейтритов. Острая реакция, характеризующаяся быстрым набуханием клеточного тела и потерей блеска, которая обычно наблюдается в гранулярных нейронах в течение первых пяти минут с момента обработки глютаматом, также может быть предупреждена добавлением базиленового синего, и это позволяет предположить, что это соединение действуют, по всей видимости, на очень ранней стадии в цепи событий, наступающих сразу же вслед за воздействием на ЕАА-рецептор (рецептор, возбуждаемый аминокислотами).
Важно подчеркнуть, что базиленовый синий вплоть до самой высокой исследованной концентрации, составляющей 300 мкМ, не является токсичным для клеток, а при введении его в гранулярные нейроны на период от 0,5 до 26 часов не воздействует на проницаемость плазматической мембраны (что измеряется по уровню поглощения этидиумбромида) или на клеточный метаболизм (что определяют по превращению МТТ (3-(4,5-диметилазол-2-ил)-2,5-дифенил-тетразолил бромид) в формазан за счет митохондриальной дегидрогеназной активности). Базиленовый синий препятствует гибели клеток, вызываемой глютаматом, демонстрируя значение ИK50 в диапазоне 10-20 мкМ, которое в основном согласуется с концентрациями соединения, приведенного в качестве антагониста Р2-пуриноцептора.
Другой коммерчески доступный изомер сульфонового производного антрахинона (цибакрон синий) также эффективен в этом отношении. Кофеин - антагонист Р2-пуриноцептора вплоть до концентрации 100 мкМ не устраняет цитотоксическое действие глютамата.
Защитное действие базиленового синего от цитотоксичности характеризуется линейной зависимостью от времени, а также определяется способом введения соединения. При добавлении базиленового синего к клеткам через 10 минут после глютамата, а также при инкубировании гранулярных нейронов в их присутствии в течение только 15 минут он (базиленовый синий) защищает от гибели 60-70% клеток от общего числа клеток нейрональной популяции; если же его вводят только в течение последних пяти минут обработки клеток глютаматом, базиленовый синий обеспечивает выживание 25-40% всех нейронов. Если вместо этого режима добавляют базиленовый синий через 1-2 минуты, или через 30 минут. или через 2 часа после воздействия на гранулярные нейроны глютаматом (и затем инкубируют с ним клетки в течение следующих 20 часов), он защищает от гибели соответственно 55-70%, 30% и 10% от общего числа клеток нейрональной популяции. Если базиленовый синий добавляют до (не во время или после) воздействия глютамата на гранулярные нейроны, то требуется предварительная обработка им в течение по крайней мере 20-25 часов для того, чтобы на 70-80% предотвратить цитоксическое воздействие глютамата. При проведении таких обработок не удается достичь ингибирования поглощения аспартата. Независимо от способа введения в гранулярные нейроны профилактика цитотоксичности под действием базиленового синего не зависит от нового синтеза белка, поскольку она не чувствительна к таким ингибиторам, как актиномицин D (используемый в концентрации 10 мкМ) или анизомицин (используемый в концентрации 100 мкМ).
Базиленовый синий ингибирует связывание [3Н]-АТФ с мембранами гранулярных нейронов со значением ИK50 около 10 мкМ, что соответствует значению ИK50, при котором достигается предупреждение развития цитотоксичности, вызываемой глютаматом. Исследование связывания с [3Н]-АТФ проводились также непосредственно на интактных клетках, при этом было показано, что базиленовый синий также эффективен.
Было проведено культивирование клеток при постоянном присутствии (от первого дня, но не позже, чем со второго дня in vitro) 100 мкМ 5-аденилилимидодифосфата (AMPPNP) в качестве известного агониста Р2-пуриноцептора. При такой обработке индуцированная глютаматом цитотоксичность ингибируется примерно на 50-60%. Острое воздействие на клетки 100 мкМ AMPPNP (одновременно с глютаматом) не эффективно в этом отношении. Тот факт, что при культивировании нейронов в условиях постоянного присутствия AMPPNP достигается тот же самый эффект, который имеет место при остром воздействии базиленового синего, поддерживает гипотезу о непосредственном включении пуриноцепторов в процесс развития глютаматзависимой нейротоксичности; кроме того, предполагается также, что в гранулярных клетках мозжечка скорее всего имеет место явление десенсибилизации пуриноцепторов.
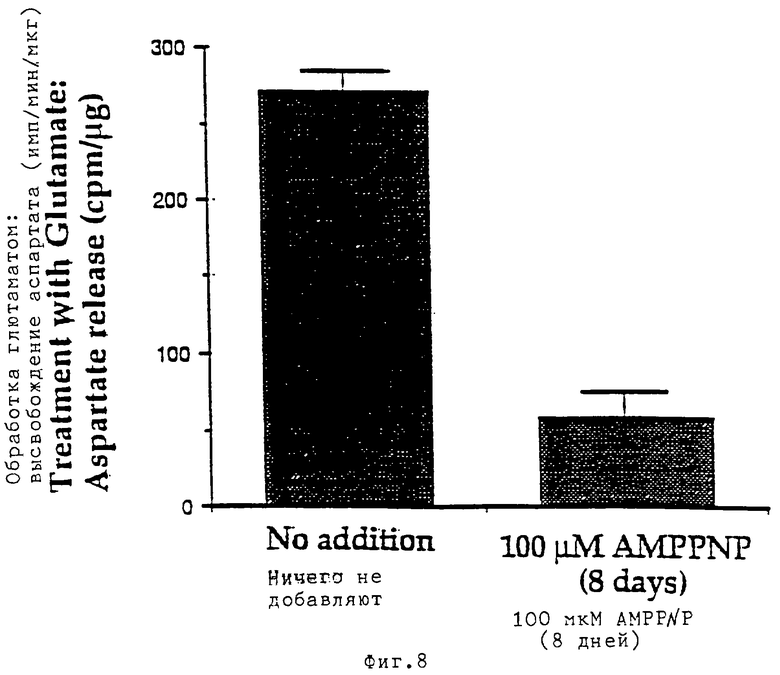
Поскольку высвобождение D-[3Н]-аспартата часто используется для оценки функционального состояния гранулярных нейронов мозжечка, культивируемых in vitro, а высвобождение аспартата, индуцированное деполяризацией или глютаматом, представляет собой способность, прогрессивно приобретаемую этими клетками вместе с созреванием нейронов, было решено исследовать этот параметр для более глубокого изучения биологических эффектов и возможного механизма действия базиленового синего, который используется для предупреждения гибели клеток. Обнаружено, что базиленовый синий ингибирует глютаматиндуцированное высвобождение [3Н] -аспартата со значением ИК50 около 10 мкМ. Ингибирование является практически полным, но оно не влияет на основное высвобождение, которое имеет место при измерении высвобождения в течение одной минуты, в течение более длительного периода (3, 10 и 25 минут) и даже в присутствии Мg2+. Хроническое воздействие на гранулярные нейроны в течение 8 дней AMPPNP в количестве 100 мкМ также приводит к ингибированию на 70-80% глютаматиндуцированного высвобождения [3Н]-аспартата.
Глютаматзависимая нейротоксичность часто сопровождается повышением в гранулярных нейронах мозжечка внутриклеточного содержания Са2+ как результат многоступенчатого процесса. Базиленовый синий, в отличие от кофеина, практически полностью устраняет вызванное глютаматом, но не основное поглощение Са2+ со значением ИK50 примерно 10 мкМ. Это значение находится также в соответствии со значением ИК50, показанным в отношении ингибирования связывания АТФ, цитотоксичностью и высвобождением аспартата. Зависимое от базелинового синего ингибирование имеет место при измерении поглощения Ca2+ в течение короткого (1 минута) или более длительного периода времени (3, 10 и 25 минут). Хроническое воздействие на гранулярные нейроны в течение 8 дней 100 мкМ AMPPNP приводит к ингибированию на 50-70% глютаматиндуцированного притока Ca2+ аналогично процессу ингибирования цитотоксичности и высвобождения аспартата.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
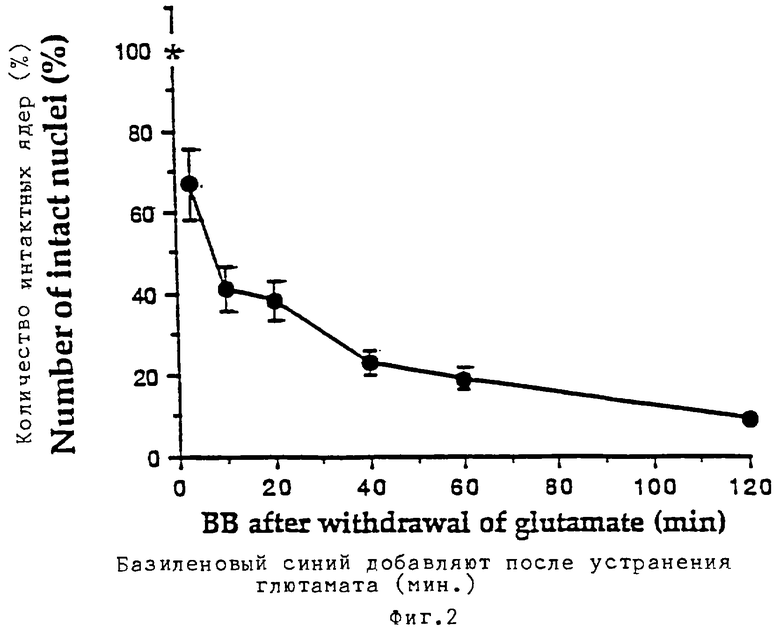
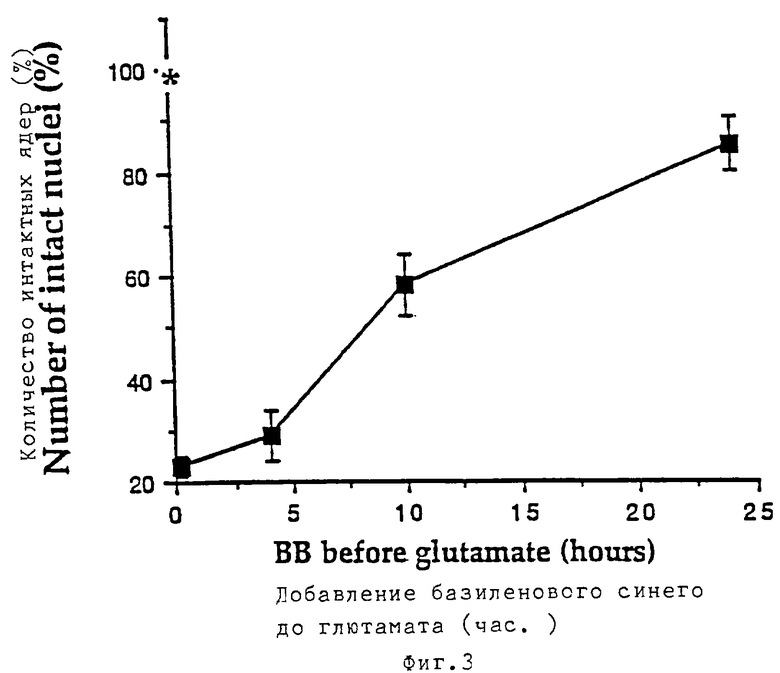
Базиленовый синий предупреждает развитие цитотоксичности, индуцированной глютаматом, в первичной культуре гранулярных клеток мозжечка: показана зависимость эффекта от дозы и способа введения. Реплицирующиеся культуры гранулярных клеток мозжечка при разведении в 8 DIV подвергали воздействию в течение 25 минут 100 мкМ глютамата при одновременном присутствии различных концентраций базиленового синего (фиг.1). Через 20 часов оценивали выживаемость клеток в культуре путем прямого подсчета интактных жизнеспособных ядер. Звездочкой отмечен процент ядер, наблюдаемых при одновременном добавлении к клеткам 100 мкМ глютамата и 100 мкМ кофеина. На фиг.2 реплицирующиеся культуры гранулярных клеток мозжечка при 8 DIV подвергались воздействию в течение 25 минут 100 мкМ глютамата. В различные периоды времени после отбора глютамата к среде добавляли базиленовый синий (100 мкМ) и через 20 часов в клеточных культурах оценивали степень выживаемости клеток путем непосредственного подсчета количества жизнеспособных интактных ядер. Звездочкой отмечен процент ядер, получаемых при одновременном добавлении к клеткам 100 мкМ глютамата и 100 мкМ базиленового синего. На фиг.3 реплицирующиеся культуры предварительно обрабатывали 100 мкМ базиленового синего в течение различных периодов времени перед добавлением на 25 минут 100 мкМ глютамата (осуществляют в отсутствие базиленового синего). Через 20 часов в культурах оценивали выживание клеток.
Звездочкой отмечен процент ядер, наблюдаемых при одновременном добавлении к клеткам 100 мкМ глютамата и 100 мкМ базиленового синего. Результаты подсчета представлены в виде среднего значения ±СКО (n=4), а 100% жизнеспособных клеток соответствует общему количеству 1,75-2•106 клеток.
МЕТОДЫ. Примерно через 20 часов после экспозиции гранулярных клеток с глютаматом культуральную среду удаляли и замещали ее 1 мл лизирующего раствора, содержащего детергент (0,5% этил-гексадецилдиметила - бромида аммония, 0,28% - уксусной кислоты, 0,5% - Тритона Х-100, 3 мМ - NaCl, 2 мM - MgCl2, в ФБР с рН 7,4, разведенном 1/10).
Через 1-2 минуты клетки растирали в течение некоторого времени, обеспечивая однородную суспензию интактных жизнеспособных ядер. Количество последних определяли путем подсчета в гемоцитометре. Разрушенные или поврежденные ядра в результаты подсчета не включались.
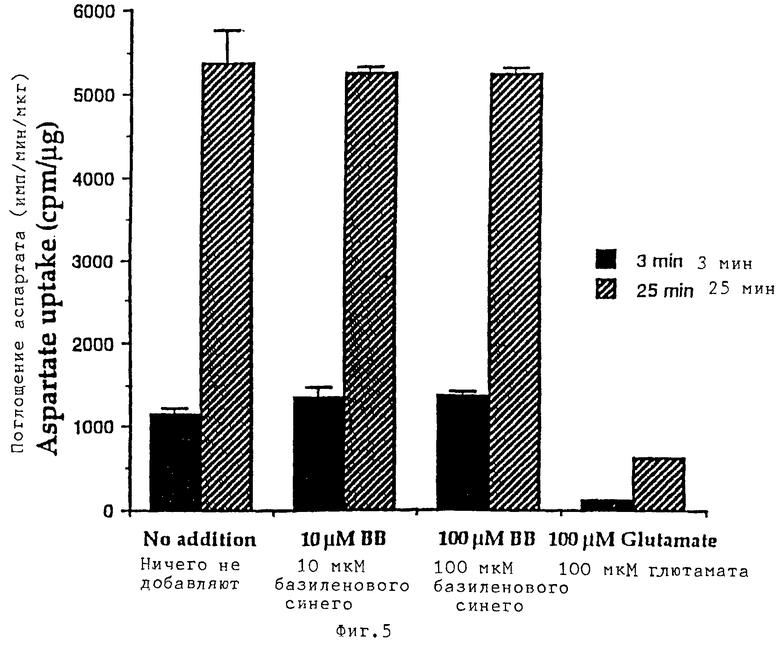
Базиленовый синий ингибирует связывание АТФ с мембранами гранулярных клеток мозжечка, но не поглощение аспартата. Мембраны получали из гранулярных клеток мозжечка при разведении 8 DIV и инкубировали 20 мкг белка с [3Н] -АТФ (0,5 мкКюри/мл, конечная концентрация 14 нМ) (фиг.4) в присутствии различных концентраций базиленового синего в течение одного часа при 4oС. Показано специфическое связывание, а приведенные значения подсчета соответствуют среднему значению ±СКО (n=3). Звездочка обозначает связывание, осуществляемое в присутствии 100 мкМ кофеина. На фиг.5 реплицирующиеся культуры гранулярных клеток мозжечка при 8 DIV дважды промывали и инкубировали в течение различных периодов времени в растворе Локка с [3Н]-D-2,3-аспарагиновой кислотой (1 мкКюри/мл, конечная концентрация 40 нМ) в присутствии различных концентраций базиленового синего. После двух промываний клетки растворяли в 0,1 М NaOH и определяли количество включенной радиоактивности путем жидкостного сцинтилляционного подсчета. Представленные значения приведены в виде числа импульсов в минуту на 1 (мкг имп/мин/мкг)(cpm/μg) и представляют собой средние значения ±СКО (n=3). Концентрацию белка определяли по методу Бредфорда с использованием в качестве стандарта овечьего сывороточного альбумина.
МЕТОДЫ. Реплицирующиеся гранулярные клетки мозжечка при 8DIV собирали в охлажденном во льду буфере А (50 мМ Трис с 1 мМ ЭДТА, доведенном до рН 7,4 с помощью НСl, содержащем также 2 мМ фенил-метилсульфонилфторида, 200 КИЕ/мл апротинина и 1 мкг/мл лейпептина) и центрифугировали при 35000 x g в течение 20 мин при 4oС. Осадок ресуспендировали в буфере А до получения концентрации белка в пределах 5-6 мг/мл и сразу же использовали для исследования процесса связывания. После связывания с [3Н]-АТФ образцы (1 мл) фильтровали под вакуумом через стекловолокнистые фильтры Ватман GF/B (Whatraan GF/B) и затем сразу же промывали фильтры (3•4 с) пятью миллилитрами 50 мМ Трис-НСl буфера (рН 7,4), высушивали на воздухе и на жидкостном сцинтилляционном счетчике оценивали уровень специфического связывания радиоактивности.
Культивирование гранулярных клеток мозжечка в присутствии AMPPNP: модулирование глютаматзависимой гибели клеток, поглощение Са++ и высвобождение аспартата. Получали первичные культуры гранулярных клеток мозжечка и, начиная с 1 DIV, к некоторым из них ежедневно добавляли 100 мкМ AMPPNP.
(Фиг. 6): при 8 DIV после двух промываний некоторые из культур инкубировали при 20oС в течение 25 мин с 100 мкМ глютамата. На следующий день проводили оценку уровня выживания клеток, как было описано ранее.
(Фиг. 7): реплицирующиеся культуры гранулярных клеток мозжечка при 8 DIV инкубировали в течение одной минуты в растворе Локка в присутствии 45 Са++ (1 мкКюри/мл) в присутствии или в отсутствие 100 мкМ глютамата, а затем оценивали поток Са++.
(Фиг. 8): реплицирующиеся культуры гранулярных клеток мозжечка при 8 DIV инкубировали в течение 5 минут в растворе Локка в присутствии [3Н]-D-2,3-аспарагиновой кислотой (1 мкКюри/мл, конечная концентрация 40 нМ) и затем оценивали уровень высвобождения аспартата в присутствии или в отсутствие 100 мкМ глютамата. Приведенные данные представляют собой средние значения ±СКО (n=3).
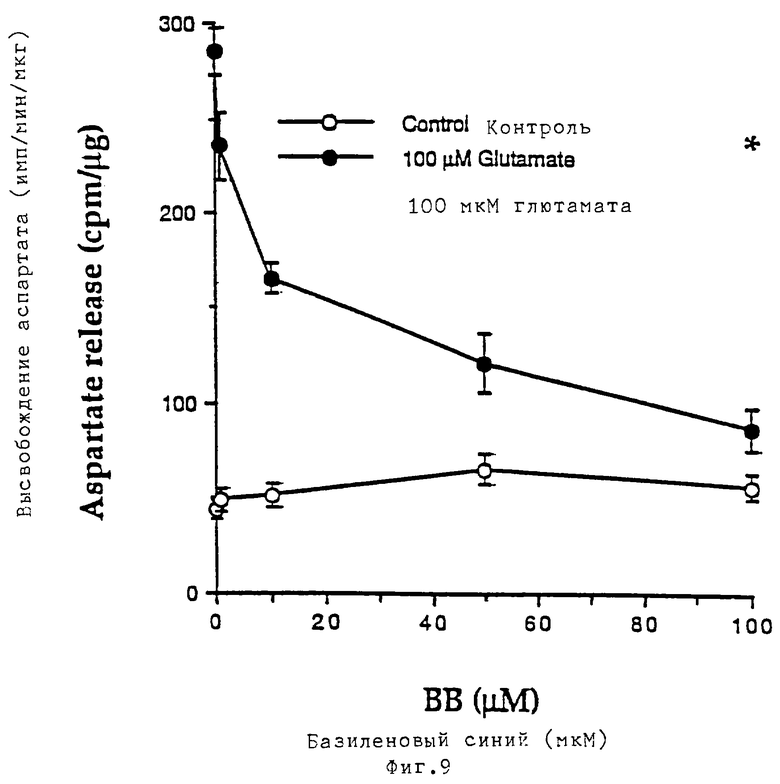
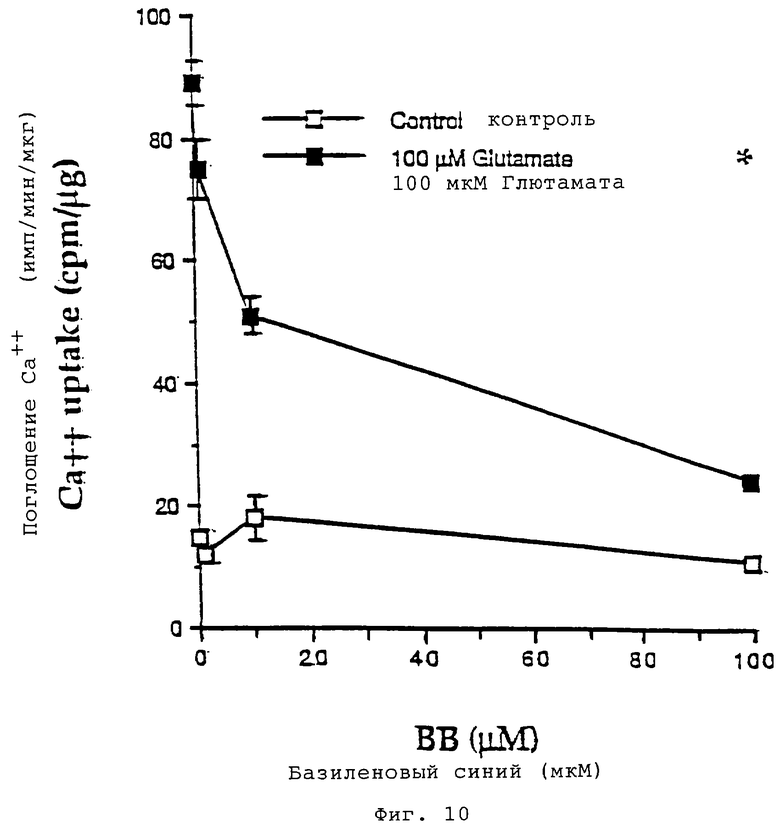
Базиленовый синий ингибирует высвобождение аспартата и поглощение Ca++, индуцированные глютаматом в гранулярных клетках мозжечка.
(Фиг. 9): реплицирующиеся культуры гранулярных клеток мозжечка при 8 DIV инкубировали в течение 5 минут в растворе Локка в присутствии [3Н]-D-2,3-аспарагиновой кислотой (1 мкКюри/мл, конечная концентрация 40 нМ). После двух промываний культуры инкубировали в течение одной минуты в растворе Локка в присутствии или в отсутствие 100 мкМ глютамата и в присутствии различных концентраций базиленового синего. Буфер, удаляемый из культуры во время фазы высвобождения, собирали во флаконы и определяли уровень радиоактивности. Звездочкой отмечено значение высвобождения аспартата, полученное при одновременном присутствии 100 мкМ глютамата и 100 мкМ кофеина. Клетки растворяли в 0,1 М NaOH и определяли концентрацию белка по методу Бредфорда с использованием в качестве стандарта бычьего сывороточного альбумина.
(Фиг.10): реплицирующиеся культуры гранулярных клеток мозжечка при 8 DIV инкубировали в течение одной минуты в растворе Локка в присутствии 45 Са++ (1 мкКюри/мл), в присутствии или в отсутствие 100 мкМ глютамата и при одновременном присутствии различных концентраций базиленового синего. После двух промываний охлажденным во льду 154 мМ холин-хлоридом с 2 мМ ЭДТА клетки лизировали в 0,1М NaOH и собирали аликвоты для определения потока Са++ (путем подсчета радиоактивности) и определения концентрации белка. Звездочка указывает на величину потока Ca++, полученную в случае одновременного присутствия 100 мкМ глютамата и 100 мкМ кофеина. Данные представляют собой средние значения ±СКО (n=3).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЧИСТКИ ОТ ЖЕЛЕЗА И ЕГО СОЕДИНЕНИЙ КАОЛИНА ИЛИ КВАРЦЕВОГО ПЕСКА | 1991 |
|
RU2042654C1 |
| КОЛЛЕКТОР ДЛЯ СЕЛЕКТИВНОЙ ФЛОТАЦИИ СУЛЬФИДНЫХ РУД И СПОСОБ СЕЛЕКТИВНОЙ ФЛОТАЦИИ СУЛЬФИДНЫХ РУД | 1992 |
|
RU2102154C1 |
| ИНЪЕЦИРУЕМЫЙ КОМПОЗИТНЫЙ МАТЕРИАЛ, ПРИГОДНЫЙ ДЛЯ ИСПОЛЬЗОВАНИЯ В КАЧЕСТВЕ ЗАМЕНИТЕЛЯ КОСТНОЙ ТКАНИ | 2006 |
|
RU2407552C2 |
| ПРОДУКТЫ ДЛЯ ДОСТАВКИ ТЕРАПЕВТИЧЕСКИХ/ДИАГНОСТИЧЕСКИХ СОЕДИНЕНИЙ К СЕРДЦУ | 2015 |
|
RU2721778C2 |
| ПРИМЕНЕНИЕ 5А-АНДРОСТАН-3В,5,6В-ТРИОЛА ДЛЯ ИЗГОТОВЛЕНИЯ НЕЙРОПРОТЕКТОРНЫХ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2011 |
|
RU2541093C2 |
| КСЕНОН - АНТАГОНИСТ NMDA | 2000 |
|
RU2257902C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2009 |
|
RU2540470C9 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ КОМБИНАЦИЮ МЕМАНТИНА И МЕЛАТОНИНА | 2016 |
|
RU2623865C1 |
| НЕЙРОПРОТЕКТОРНОЕ СРЕДСТВО | 2016 |
|
RU2614697C1 |
| ГИБРИДНЫЙ МАТЕРИАЛ, СОДЕРЖАЩИЙ ВСПЕНЕННЫЙ ПОЛИМЕР И НЕОРГАНИЧЕСКОЕ СВЯЗУЮЩЕЕ, ИМЕЮЩИЙ РЕГУЛИРУЕМУЮ ПЛОТНОСТЬ И МОРФОЛОГИЮ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2007 |
|
RU2458078C2 |



Изобретение относится к медицине, конкретно к фармакологии. Предложено: применение агонистов или антагонистов Р2-пуриноцепторов для предупреждения цитотоксичности, вызываемой глютаматом, для модулирования вызываемых глютаматом физиологических функций, и фармакологическая композиция с указанными новыми свойствами. При этом к агонистам Р2-пуриноцепторов относятся 5-аденилилимидодифосфат, к антагонистам - реактив базиленовый синий и цибакрон синий 3GA. Впервые выявлено включение пуриноцепторов в процесс развития глютаматзависимой нейротоксичности. Изобретение расширяет арсенал средств указанного назначения. 5 с. и 6 з.п.ф-лы, 10 ил.
| КРУТИЦКАЯ З.И | |||
| и др | |||
| Структурно-функциональная организация G-белков и связанных с ними рецепторов "Цитология" | |||
| - СПб., 1992, т.34, №11/12, с.24-45 | |||
| DE 4230493 А1, 17.03.1994 | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| et al | |||
| Effects of exogenous ATP and related analogues on the proliferation rate of dissociated primary culture of rat astoocytes | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| et al | |||
| Characterisation of the facilitatory prejunetional purinoceptor on adrenergic nerves of the rabbit ear artery | |||
| J - Pharmacol | |||
| - Exp | |||
| - Ther | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
Авторы
Даты
2003-09-10—Публикация
1996-07-24—Подача