Область техники
Данное изобретение относится к синтетическому хинолоновому антибактериальному агенту, который полезен в качестве медицинского средства, лекарственного средства для животных, лекарственного средства для применения в рыбоводстве и антибактериального консерванта.
Таким образом, изобретение относится к синтетическому хинолоновому антибактериальному агенту, у которого структура заместителя в положении 7 хинолонового основного скелета или соответствующем положении (например, положение 7 1,4-дигидро-4-оксохинолинового скелета, положение 10 2,3-дигидро-7-оксо-7Н-пиридо[1,2,3-de][1,4]бензоксазинового скелета и тому подобное) оказывает большое влияние на антибактериальную активность, а именно к хинолоновому производному, имеющему в качестве заместителя 3-[1-амино-1-замещенный ароматической группой]метилпирролидин-1-ил, который может обеспечить превосходную антибактериальную активность, и к антибактериальному агенту и антибактериальной фармацевтической композиции, которые содержат данное соединение.
Изобретение дополнительно относится к синтетическому хинолоновому антибактериальному лекарственному средству, а именно 3-[1-амино-1-замещенный ароматической группой] метилпирролидину, который имеет структуру, способную обеспечить превосходную антибактериальную активность, и является полезным в качестве промежуточного соединения, и к его защищенному соединению.
Предпосылки изобретения
С момента открытия норфлоксацина значительно была улучшена антибактериальная активность и фармакокинетика синтетических хинолоновых антибактериальных агентов, и сейчас многие соединения применяются в клинической области в качестве химиотерапевтических средств, которые являются эффективными при большинстве системных инфекционных заболеваний.
В последние годы в клинической области возросла генерация бактерий, имеющих низкую чувствительность к синтетическим хинолоновым антибактериальным агентам. Например, подобно Staphylococcus aureus (MRSA) и пневмококкам (PRSP), которые нечувствительны к антибиотикам β -лактамового ряда, и энтерококкам (VRE), которые нечувствительны к аминогликозидным антибактериальным агентам, возрастает число случаев, когда грамположительные бактерии, первоначально резистентные к иным средствам, чем синтетические хинолоновые антибактериальные агенты, также становились низкочувствительными к синтетическим хинолоновым антибактериальным агентам. Следовательно, в области клиники требуется разработка средства, имеющего, кроме того, высокую эффективность.
Кроме того, выявлен также побочный эффект, выражающийся в том, что при одновременном применении нестероидного противовоспалительного средства появляются судороги, а также другие побочные эффекты, такие как фототоксичность и тому подобное, таким образом, в данной области требуется разработка синтетического хинолонового антибактериального агента, имеющего, кроме того, дополнительную высокую безопасность.
Известно, что структуры заместителей в положении 7 и положении 1 в большой степени имеют отношение к антибактериальной активности, фармакокинетике и безопасности синтетических хинолоновых антибактериальных агентов. Уже известно, что хинолоновое производное, имеющее в качестве заместителя 3-(аминометил)пирролидинил в положении 7, проявляет высокую антибактериальную активность в отношении грамотрицательных и грамположительных бактерий. Например, им является производное 7-[3-(аминометил)пирролидин-1-ил]хинолон-карбоновой кислоты [Journal of Medicinal Chemistry, vol. 29, p. 445 (1986)]. Также известно производное 7-[3-(1-аминометил)пирролидин-1-ил]хинолонкарбоновой кислоты [Journal of Medicinal Chemistry, vol. 36, p. 871 (1993)], производное 7-[3-(1-амино-1-метилэтил)пирролидин-1-ил]хинолонкарбоновой кислоты [Journal of Medicinal Chemistry, vol. 37, p. 733 (1994)], производное 7-[3-(1-аминоалкил)пирролидин-1-ил] хинолонкарбоновой кислоты [Chemical & Pharmaceutical Bulletin, vol. 42, p. 1442 (1994)] и подобные в качестве производных хинолонкарбоновой кислоты, имеющих заместитель в аминометильной группе 3-(аминометил)пирролидин-1-ила.
Однако заместителями в аминометильной группе известного в настоящее время 3-(аминометил)пирролидин-1-ила являются только алкильные группы, и неизвестно хинолоновое соединение, имеющее ароматическую группу в качестве заместителя, которое относится к настоящему изобретению.
Также в качестве примера можно сослаться на производные хииолонокарбоновой кислоты, имеющие циклический заместитель в аминометильной группе 3-(аминометил)пирролидин-1-ила, например, JP-W-3-502452 (термин "JP-W", используемый здесь, означает "не прошедшую экспертизу опубликованную международную патентную заявку Японии"), и в ней описываются соединения, представленные двумя общими формулами, показанными ниже. Однако циклический заместитель в аминометильной группе 3-(аминометил)пирролидин-1-ила, описываемый в указанной заявке, ограничивается циклическим алкилом, и не раскрывается 3-[1-амино-1-замещенный ароматической группой]метилпирролидин-1-ил, относящийся к данному изобретению.
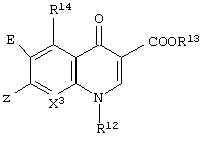
[В указанной выше формуле R12 представляет алкил, имеющий от 1 до 4 атомов углерода, винил, галогеналкил, гидроксиалкил, имеющий от 2 до 4 атомов углерода, циклоалкил, имеющий от 3 до 6 атомов углерода, фенил или фенил, замещенный галогеном, алкилом, группой NH2 или ОН, R14 представляет прямой, разветвленный или циклический низший алкил, имеющий от 1 до 3 атомов углерода, и X3 представляет СН, CF, CCl, CBr, N, ССF3, CNH2, CNO2, CR или COR' (в данных формулах R представляет низший алкил, и R' представляет атом водорода или низший алкил)].
В указанной выше формуле Z представляет
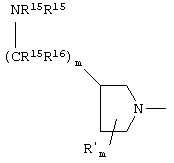
(в которой m равно целому числу от 0 до 4, и R15 и R16, каждый независимо представляет атом водорода, низший алкил или циклоалкил). В данной связи определения заместителей и тому подобное для двух указанных выше формул не относятся к таковым для соединения по данному изобретению, даже если используются те же обозначения.
Кроме того, в JP-W-9-503783 раскрываются производные 2-пиридонкарбоновой кислоты 4Н-4-оксохинолизонового скелета и подобные, представленные следующей формулой. Однако хинолоновое соединение по данному изобретению, имеющее ароматический заместитель в аминометильной группе 3-(аминометил)пирролидин-1-ила, относящееся к изобретению, также не приводится в качестве примера в указанной заявке.
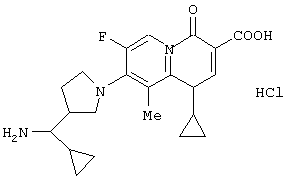
Раскрытие изобретения
В свете изложенного выше изобретатели настоящей заявки провели интенсивные исследования с целью получения превосходных хинолоновых соединений. В результате совершенно неожиданно было установлено, что производное замещенного ароматической группой аминометилпирролидина, представленное формулой (I), описанное ниже, его соли и их гидраты могут проявлять высокую антибактериальную активность в отношении широкого ряда грамотрицательных и грамположительных бактерий, включая резистентные к лекарствам бактерии, что в итоге привело к созданию данного изобретения.
Изобретатели установили, что соединение, представленное формулой (I), в котором производное замещенного ароматической группой аминометилпирролидина вводится в положение 10 2,3-дигидро-3-(S)-метил-7-оксо-7Н-пиридо[1,2,3-de][1,4]бензоксазинового скелета или положение 7 6-фтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолинового скелета, его соли и их гидраты, имеющие превосходную безопасность, могут проявлять широкого спектра и превосходную антибактериальную активность в отношении любых из грамотрицательных или грамположительных бактерий. В то же время было установлено, что оно может проявлять высокую антибактериальную активность в отношении резистентных к лекарствам грамположительных бактерий, включая MRSA, PRSA и VPE, которая не предполагалась до изобретения.
Следовательно, данное изобретение относится к соединению, представленному следующей формулой (I), его солям и их гидратам
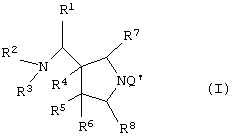
{в которой R1 представляет арил, имеющий от 6 до 10 атомов углерода, или гетероарил,
где гетероарил может быть пятичленным кольцом или шестичленным кольцом и может включать от 1 до 4 гетероатомов, необязательно выбранных из атома азота, атома кислорода и атома серы,
где данные арил и гетероарил могут иметь один или более заместителей, выбранных из группы, состоящей из алкила, имеющего от 1 до 6 атомов углерода, атома галогена, гидроксила, тиола, амино, нитро, циано, карбоксила, карбамоила, фенила, алкоксила, имеющего от 1 до 6 атомов углерода, алкилтио, имеющего от 1 до 6 атомов углерода, алкоксикарбонила, имеющего от 2 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода и гетероарила (данный гетероарил может быть пятичленным кольцом или шестичленным кольцом и может включать от 1 до 4 гетероатомов, необязательно выбранных из атома азота, атома кислорода и атома серы),
где указанные среди них алкил, алкоксил, алкилтио, алкоксикарбонил, ацил, фенил и гетероарил могут иметь один или более заместителей, выбранных из группы, состоящей из атома галогена, гидроксила, алкоксила, имеющего от 1 до 6 атомов углерода, и алкилтио, имеющего от 1 до 6 атомов углерода, и
аминогруппа может иметь один или два заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода, и алкоксикарбонила, имеющего от 2 до 5 атомов углерода,
R2 и R3, каждый независимо представляет атом водорода или алкил, имеющий от 1 до 6 атомов углерода,
где алкил может иметь один или более заместителей, выбранных из группы, состоящей из гидроксила, атома галогена, алкилтио, имеющего от 1 до 6 атомов углерода, и алкоксила, имеющего от 1 до 6 атомов углерода,
R4, R5 и R6, каждый независимо представляет атом водорода, гидроксил, атом галогена, карбамоил, алкил, имеющий от 1 до 6 атомов углерода, алкоксил, имеющий от 1 до 6 атомов углерода, или акилтио, имеющий от 1 до 6 атомов углерода,
где указанный среди них алкил может иметь один или более заместителей, выбранных из группы, состоящей из гидроксила, атома галогена и алкоксила, имеющего от 1 до 6 атомов углерода,
R7 и R8, каждый независимо представляет атом водорода или алкил, имеющий от 1 до 6 атомов углерода,
Q представляет неполную структуру, представленную следуюей формулой
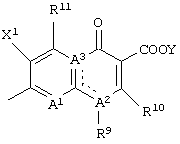
[в которой R9 представляет алкил, имеющий от 1 до 6 атомов углерода, алкенил, имеющий от 2 до 6 атомов углерода, галогеналкил, имеющий от 1 до 6 атомов углерода, циклический алкил, имеющий от 3 до 6 атомов углерода, который может иметь заместитель, арил, который может иметь заместитель, гетероарил, который может иметь заместитель, алкоксил, имеющий от 1 до 6 атомов углерода, или алкиламино, имеющий от 1 до 6 атомов углерода,
R10 представляет атом водорода или алкилтио, имеющий от 1 до 6 атомов углерода,
в которой R10 и указанный выше R9 могут быть объединены с образованием кольцевой структуры включением части основного скелета, и образованное таким образом кольцо может включать атом серы в качестве составляющего кольцо атома, и кольцо может также иметь в качестве заместителя алкил, имеющий от 1 до 6 атомов углерода,
R11 представляет атом водорода, амино, гидроксил, тиол, галогенметил, алкил, имеющий от 1 до 6 атомов углерода, алкенил, имеющий от 2 до 6 атомов углерода, алкинил, имеющий от 2 до 6 атомов углерода, или алкоксил, имеющий от 1 до 6 атомов углерода,
где аминогруппа может иметь один или два заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, и ацила, имеющего от 2 до 6 атомов углерода,
когда R11 представляет амино, гидроксил или тиол, они могут быть защищены защитной группой,
X1 представляет атом галогена или атом водорода,
А1 представляет атом азота или неполную структуру, представленную формулой (II)
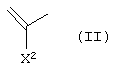
[в которой X2 представляет атом водорода, амино, атом галогена, циано, галогенметил, галогенметоксил, алкил, имеющий от 1 до 6 атомов углерода, алкенил, имеющий от 2 до 6 атомов углерода, алкинил, имеющий от 2 до 6 атомов углерода, или алкоксил, имеющий от 1 до 6 атомов углерода,
где указанная среди них аминогруппа может иметь один или два заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, и ацила, имеющего от 2 до 5 атомов углерода, и
X2 и указанный выше R9 могут быть объединены с образованием кольцевой структуры включением части основного скелета, и образованное таким образом кольцо может включать атом кислорода, атом азота и атом серы в качестве составляющего кольцо атома, и кольцо может также иметь в качестве заместителя алкил, имеющий от 1 до 6 атомов углерода],
А2 и А3, каждый независимо представляет атом азота или атом углерода, и А2 и А3 и атом углерода, с которым они связаны, образуют неполную структуру
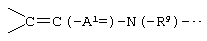
или неполную структуру
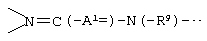
(в которых > означает наличие 2 связей с атомом азота или атомом углерода, то же будет использоваться в последующем), и
Y представляет атом водорода, фенил, ацетоксиметил, пивалоилоксиметил, этоксикарбонил, холин, диметиламиноэтил, 5-инданил, фталидинил, 5-алкил-2-оксо-1,3-диоксол-4-илметил, 3-ацетокси-2-оксобутил, алкил, имеющий от 1 до 6 атомов углерода, алкоксиметил, имеющий от 2 до 7 атомов углерода, или фенилалкил (состоящий из алкилена, имеющего от 1 до 6 атомов углерода, и фенила)]}.
Изобретение также относится к соединению формулы (I), его солям или их гидратам, где Q в формуле (I) имеет структуру, представленную формулой:
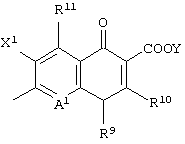
или формулой
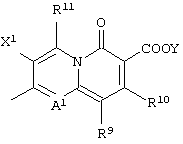
(в которых A1, R9, R10, R11, X1 и Y имеют значения, определенные выше);
соединению формулы (I), его солям или их гидратам, где Q в формуле (I) имеет структуру, представленную формулой:
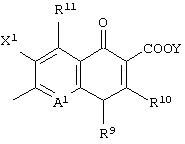
(в которой A1, R9, R10, R11, X1 и Y имеют значения, определенные выше);
соединению формулы (I), его солям или их гидратам, где Q в формуле (I) представляет 6-карбокси-9-фтор-2,3-дигидро-3-(S)-метил-7-оксо-7Н-пиридо[1,2,3-de][1,4]бензоксазин-10-ил; [представленный следующей формулой:
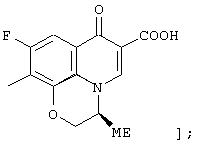
соединению формулы (I), его солям или их гидратам, где Q в формуле (I) представляет 8-амино-6-карбокси-9-фтор-2,3-дигидро-3-(S)-метил-7-оксо-7Н-пиридо[1,2,3-de][1,4]бензоксазин-10-ил;
[представленный следующей формулой;
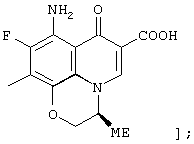
соединению формулы (I), его солям или их гидратам, где Q в формуле (I) представляет 3-карбокси-6-фтор-1-[2-(3)-фтор-1-(R)-циклопропил]-1, 4-дигидро-4-оксо-1,8-нафтиридин-7-ил;
[представленный следующей формулой:
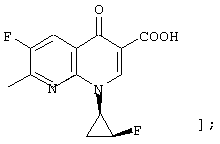
соединению формулы (I), его солям или их гидратам, где Q в формуле (I) представляет 3-карбокси-8-хлор-6-фтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-7-ил;
[представленный следующей формулой:
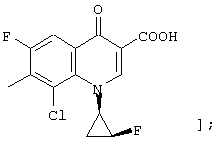
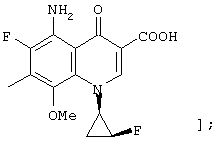
соединению формулы (I), его солям или их гидратам, где Q в формуле (I) представляет 3-карбокси-6-фтор-1-[2-(S)-фтор-1-(R)-циклопропил]-8-метокси-1,4-дигидро-4-оксохинолин-7-ил;
[представленный следующей формулой:
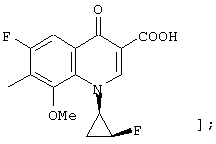
соединению формулы (I), его солям или их гидратам, где Q в формуле (I) представляет 3-карбокси-1-[2-(S)-фтор-1-(R)-циклопропил]-8-метокси-1,4-дигидро-4-оксохинолин-7-ил;
[представленный следующей формулой:
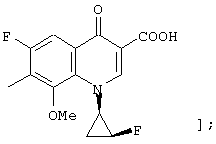
соединению формулы (I), его солям или их гидратам, где Q в формуле (I) представляет 3-карбокси-6-фтор-1-[2-(S)-фтор-1-(R)-циклопропил]-8-дифторметокси-1,4-дигидро-4-оксохинолин-7-ил; [представленный следующей формулой:
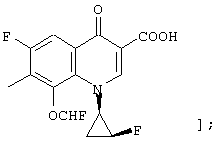
соединению формулы (I); его солям или их гидратам, где Q в формуле (I) представляет 3-карбокси-1-[2-(S)-фтор-1-(R)-циклопропил]-8-дифторметокси-1,4-дигидро-4-оксохинолин-7-ил;
[представленный следующей формулой:
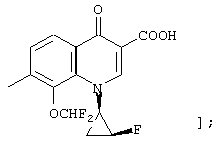
соединению формулы (I), его солям или их гидратам, где Q в формуле (I) представляет 3-карбокси-6-фтор-1-[2-(S)-фтор-1-(R)-циклопропил]-8-метил-1,4-дигидро-4-оксохинолин-7-ил;
[представленный следующей формулой:

соединению формулы (I), его солям или их гидратам, где Q в формуле (I) представляет 5-амино-3-карбокси-6-фтор-1-[2-(S)-фтор-1-(R)-циклопропил]-8-метокси-1,4-дигидро-4-оксохинолин-7-ил; [представленный следующей формулой:
соединению формулы (I), его солям или их гидратам, где Q в формуле (I) представляет 5-амино-3-карбокси-6-фтор-1-[2-(S)-фтор-1-(R)-циклопропил]-8-метил-1,4-дигидро-4-оксохинолин-7-ил;
[представленный следующей формулой:
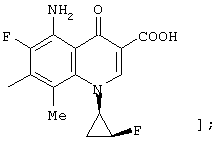
соединению формулы (I), его солям или их гидратам, где Q в формуле (I) представляет 5-амино-3-карбокси-6,8-дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-7-ил;
[представленный следующей формулой:
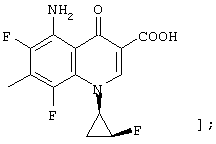
соединению формулы (I), его солям или их гидратам, где R1 в формуле (I) представляет арил, имеющий от 6 до 10 атомов углерода, который может иметь заместитель;
соединению формулы (I), его солям или их гидратам, где R1 в формуле (I) представляет арил, имеющий от 6 до 10 атомов углерода, который может иметь заместитель, и его арильная группа является фенилом или нафтилом;
соединению формулы (I), его солям или их гидратам, где R1 в формуле (I) представляет гетероарил, который может иметь заместитель;
соединению формулы (I), его солям или их гидратам, где R1 в формуле (I) представляет гетероарил, который может иметь заместитель, и его гетероарильная группа представляет фурил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, пиразолил, фуразанил, пиридил, пиразинил, пиримидил, пиридазинил, триазинил или тетразинил;
соединению формулы (I), его солям или их гидратам, где соединение формулы (I) представляет стереохимически чистое соединение;
соединению формулы (I), его солям или их гидратам, где R9 представляет циклопропил, имеющий атом галогена в качестве заместителя;
соединению формулы (I), его солям или их гидратам, где циклопропил, имеющий атом галогена в качестве заместителя, представляет 1,2-цис-галогенциклопропил;
соединению формулы (I), его солям или их гидратам, где циклопропил, имеющий атом галогена в качестве заместителя, представляет стереохимически чистый заместитель;
соединению формулы (I), его солям или их гидратам, где циклопропил, имеющий атом галогена в качестве заместителя, представляет (1R,2S)-2-галогенциклопропил;
соединению формулы (I), его солям или их гидратам, где атом галогена циклопропила, имеющего атом галогена в качестве заместителя, является атомом фтора; соединению формулы (I), его солям или их гидратам, где каждый из R4, R5, R6, R7 и R8 в формуле (I) представляет атом водорода;
соединению формулы (I), его солям или их гидратам, где R1 в формуле (I) представляет арил, имеющий от 6 до 10 атомов углерода, который может иметь заместитель, или гетероарил из пятичленного кольца или шестичленного кольца, которое включает от 1 до 4 гетероатомов, необязательно выбранных из атома азота, атома кислорода или атома серы, и может иметь заместитель;
соединению формулы (I), его солям или их гидратам, где R1 представляет фенил или нафтил;
соединению формулы (I), его солям или их гидратам, где R1 представляет фурил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, пиразолил, фуразанил, пиридил, пиразинил, пиримидил, пиридазинил, триазинил или тетразинил;
лекарственному средству, которое включает соединение формулы (I), его соли или их гидраты в качестве активного ингредиента;
антибактериальному агенту, который включает соединение формулы (I), его соли или их гидраты в качестве активного ингредиента;
терапевтическому агенту для лечения инфекционного заболевания, который включает соединение формулы (I), его соли или их гидраты в качестве активного ингредиента;
способу лечения заболевания, включающему введение соединения формулы (I), его солей или их гидратов;
способу лечения инфекционного заболевания, включающему введение соединения формулы (I), его солей или их гидратов;
способу получения лекарственного средства, включающему введение в его состав соединения формулы (I), его солей или их гидратов в качестве активного ингредиента;
способу получения антибактериального агента, включающему введение в его состав соединения формулы (I), его солей или их гидратов в качестве активного ингредиента;
способу получения терапевтического агента для лечения инфекционного заболевания, включающему введение в его состав соединения формулы (I), его солей или их гидратов в качестве активного ингредиента;
применению соединения формулы (I), его солей или их гидратов при получении лекарственного средства;
применению соединения формулы (I), его солей или их гидратов при получении антибактериального агента;
применению соединения формулы (I), его солей или их гидратов при получении терапевтического агента для лечения инфекционного заболевания;
и так далее.
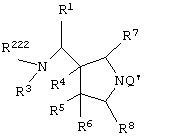
Изобретение также относится к каждому из следующих пунктов. Т.е. соединению, представленному следующей формулой, его солям и их гидратам
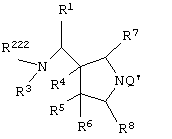
{в которой R1 представляет арил, имеющий от 6 до 10 атомов углерода, или гетероарил,
где гетероарил может быть пятичленным кольцом или шестичленным кольцом и может включать от 1 до 4 гетероатомов, необязательно выбранных из атома азота, атома кислорода и атома серы,
где данные арил и гетероарил могут иметь один или более заместителей, выбранных из группы, состоящей из атома галогена, гидроксила, тиола, амино, нитро, циано, карбоксила, карбамоила, фенила, алкила, имеющего от 1 до 6 атомов углерода, алкоксила, имеющего от 1 до 6 атомов углерода, аклкилтио, имеющего от 1 до 6 атомов углерода, алкоксикарбони-ла, имеющего от 2 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода, и гетероарила (данный гетероарил может быть пятичленным кольцом или шестичленным кольцом и включать от 1 до 4 гетероатомов, необязательно выбранных из атома азота, атома кислорода и атома серы),
где указанные среди них алкил, алкоксил, алкилтио, алкоксикарбонил, ацил, фенил и гетероарил могут иметь один или более заместителей, выбранных из группы, состоящей из атома галогена, гидроксила, алкоксила, имеющего от 1 до 6 атомов углерода, и алкилтио, имеющего от 1 до 6 атомов углерода, и
аминогруппа может иметь один или два заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода, и алкоксикарбонила, имеющего от 2 до 5 атомов углерода,
R222 представляет атом водорода, алкил, имеющий от 1 до 6 атомов углерода, или аминозащитную группу,
R3 представляет атом водорода или алкил, имеющий от 1 до 6 атомов углерода,
где алкильная группа R222 и R3 может иметь один или более заместителей, выбранных из группы, состоящей из гидроксила, атома галогена, алкилтио, имеющего от 1 до 6 атомов углерода, и алкоксила, имеющего от 1 до 6 атомов углерода,
R4, R5 и R6, каждый независимо представляет атом водорода, гидроксил, атом галогена, карбамоил, алкил, имеющий от 1 до 6 атомов углерода, алкоксил, имеющий от 1 до 6 атомов углерода, или акилтио, имеющий от 1 до 6 атомов углерода,
где указанный среди них алкил может иметь один или более заместителей, выбранных из группы, состоящей из гидроксила, атома галогена и алкоксила, имеющего от 1 до 6 атомов углерода,
R7 и R8, каждый независимо представляет атом водорода или алкил, имеющий от 1 до 6 атомов углерода, и
Q' представляет аминоэащитную группу];
соединению указанной выше формулы, его солям или их гидратам, где аминозащитная группа является защитной группой, выбранной из группы, состоящей из алкоксикарбонила, который может иметь заместитель, аралкилоксикарбонила, который может иметь заместитель, ацила, который может иметь заместитель, алкила, который может иметь заместитель, аралкила, который может иметь заместитель, и замещенных силильных групп;
соединению указанной выше формулы (I), его солям или их гидратам, где аминозащитная группа представляет защитную группу, выбранную из группы, состоящей из трет-бутоксикарбонила, 2,2,2-трихлорэтоксикарбонила и подобных алкоксикарбонильных групп; бензилоксикарбонила, пара-метоксибензилоксикарбонила, пара-нитробензилоксикарбонила и подобных аралкилоксикарбонильных групп; ацетила, метоксиацетила, трифторацетила, хлорацетила, пивалоила, формила, бензоила и подобных ацильных групп; трет-бутила, бензила, пара-нитробензила, пара-метоксибензила, трифенилметила и подобных алкильных групп или аралкильных групп; метоксиметила, трет-бутоксиметила, тетрагидропиранила, 2,2,2-трихлорэтоксиметила и подобных простых эфиров; триметилсилила, изопропилдиметилсилила, трет-бутилдиметилсилила, трибензилсилила, трет-бутилдифенилсилила и подобных замещенных силильных групп;
соединению указанной выше формулы, его солям или их гидратам, в которой R222 и Q' не являются одинаковыми;
соединению указанной выше формулы, его солям или их гидратам, в которой R1 представляет арил, имеющий от 6 до 10 атомов углерода, который может иметь заместитель;
соединению указанной выше формулы, его солям или их гидратам, в которой R1 представляет арил, имеющий от 6 до 10 атомов углерода, который может иметь заместитель, и его арильная группа является фенилом или нафтилом;
соединению указанной выше формулы, его солям или их гидратам, в которой R1 представляет гетероарил, который может иметь заместитель;
соединению указанной выше формулы, его солям или их гидратам, в которой R1 представляет гетероарил, который может иметь заместитель, и его гетероарильная группа представляет фурил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, пиразолил, фуразанил, пиридил, пиразинил, пиримидил, пиридазинил, триазинил или тетразинил;
соединению указанной выше формулы, его солям или их гидратам, в которой каждый из R4, R5, R6, R7 и R8 представляет атом водорода;
и так далее.
Изобретение также относится к каждому из следующих пунктов. Т.е. соединению, представленному следующей формулой, его солям или их гидратам
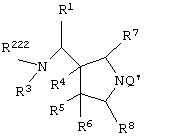
[в которой R1 представляет арил, имеющий от 6 до 10 атомов углерода, или гетероарил,
где гетероарил может быть пятичленным кольцом или шестичленным кольцом и может включать от 1 до 4 гетероатомов, необязательно выбранных из атома азота, атома кислорода и атома серы,
где данные арил и гетероарил могут иметь один или более заместителей, выбранных из группы, состоящей из атома галогена, гидроксила, тиола, амино, нитро, циано, карбоксила, карбамоила, фенила, алкила, имеющего от 1 до 6 атомов углерода, алкоксила, имеющего от 1 до 6 атомов углерода, алкилтио, имеющего от 1 до 6 атомов углерода, алкоксикарбонила, имеющего от 2 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода, и гетероарила (данный гетероарил может быть пятичленным кольцом или шестичленным кольцом и может включать от 1 до 4 гетероатомов, необязательно выбранных из атома азота, атома кислорода и атома серы),
где указанные среди них алкил, алкоксил, алкилтио, алкоксикарбонил, ацил, фенил и гетероарил могут иметь один или более заместителей, выбранных из группы, состоящей из атома галогена, гидроксила, алкоксила, имеющего от 1 до 6 атомов углерода, и алкилтио, имеющего от 1 до 6 атомов углерода и
аминогруппа может иметь один или два заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода, и алкоксикарбонила, имеющего от 2 до 5 атомов углерода,
R222 представляет атом водорода, алкил, имеющий от 1 до 6 атомов углерода, или аминозащитную группу,
R3 представляет атом водорода или алкил, имеющий от 1 до 6 атомов углерода,
где алкильная группа R222 и R3 может иметь один или более заместителей, выбранных из группы, состоящей из гидроксила, атома галогена, алкилтио, имеющего от 1 до 6 атомов углерода, и алкоксила, имеющего от 1 до 6 атомов углерода,
R4, R5 и R6, каждый независимо представляет атом водорода, гидроксил, атом галогена, карбамоил, алкил, имеющий от 1 до 6 атомов углерода, алкоксил, имеющий от 1 до 6 атомов углерода, или акилтио, имеющий от 1 до 6 атомов углерода,
где указанный среди них алкил может иметь один или более заместителей, выбранных из группы, состоящей из гидроксила, атома галогена и алкоксила, имеющего от 1 до 6 атомов углерода, и
R7 и R8, каждый независимо представляет атом водорода или алкил, имеющий от 1 до 6 атомов углерода];
соединению указанной выше формулы, его солям или их гидратам, в которой аминозащитная группа является защитной группой, выбранной из группы, состоящей из алкоксикарбонила, который может иметь заместитель, аралкилоксикарбонила, который может иметь заместитель, ацила, который может иметь заместитель, алкила, который может иметь заместитель, аралкила, который может иметь заместитель, и замещенных силильных групп;
соединению указанной выше формулы, его солям или их гидратам, в которой аминозащитная группа представляет защитную группу, выбранную из группы, состоящей из трет-бутоксикарбонила, 2,2,2-трихлорэтоксикарбонила и подобных алкоксикарбонильных групп; бензилоксикарбонила, пара-метоксибензилоксикарбонила, пара-нитробензилоксикарбонила и подобных аралкилоксикарбонильных групп; ацетила, метоксиацетила, трифторацетила, хлорацетила, пивалоила, формила, бензоила и подобных ацильных групп; трет-бутила, бензила, пара-нитробензила, пара-метоксибензила, трифенилметила и подобных алкильных групп или аралкильных групп; метоксиметила, трет-бутоксиметила, тетрагидропиранила, 2,2,2-трихлорэтоксиметила и подобных простых эфиров; триметилсилила, изопропилдиметилсилила, трет-бутилдиметилсилила, трибензилсилила, трет-бутилдифенилсилила и подобных замещенных силильных групп;
соединению указанной выше формулы, его солям или их гидратам, в которой R1 представляет арил, имеющий от 6 до 10 атомов углерода, который может иметь заместитель;
соединению указанной выше формулы, его солям или их гидратам, в которой R1 представляет арил, имеющий от 6 до 10 атомов углерода, который может иметь заместитель, и его арильная группа является фенилом или нафтилом;
соединению указанной выше формулы, его солям или их гидратам, в которой R1 представляет гетероарил, который может иметь заместитель;
соединению указанной выше формулы, его солям или их гидратам, в которой R1 представляет гетероарил, который может иметь заместитель, и его гетероарильная группа представляет фурил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, пиразолил, фуразанил, пиридил, пиразинил, пиримидил, пиридазинил, триазинил или тетразинил;
соединению указанной выше формулы, его солям или их гидратам, в которой каждый из R4, R5, R6, R7 и R8 представляет атом водорода;
и так далее.
Изобретение также относится к способу получения хинолонового соединения, включающему удаление Q' из соединения, представленного следующей формулой, его солей и их гидратов
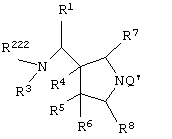
[в которой R1 представляет арил, имеющий от 6 до 10 атомов углерода, или гетероарил,
где гетероарил может быть пятичленным кольцом или шестичленным кольцом и может включать от 1 до 4 гетероатомов, необязательно выбранных из атома азота, атома кислорода и атома серы,
где данные арил и гетероарил могут иметь один или более заместителей, выбранных из группы, состоящей из атома галогена, гидроксила, тиола, амино, нитро, циано, карбоксила, карбамоила, фенила, алкила, имеющего от 1 до 6 атомов углерода, алкоксила, имеющего от 1 до 6 атомов углерода, алкилтио, имеющего от 1 до 6 атомов углерода, алкоксикарбонила, имеющего от 2 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода, и гетероарила (данный гетероарил может быть пятичленным кольцом или шестичленным кольцом и может включать от 1 до 4 гетероатомов, необязательно выбранных из атома азота, атома кислорода и атома серы),
где указанные среди них алкил, алкоксил, алкилтио, алкоксикарбонил, ацил, фенил и гетероарил могут иметь один или более заместителей, выбранных из группы, состоящей из атома галогена, гидроксила, алкоксила, имеющего от 1 до 6 атомов углерода, и алкилтио, имеющего от 1 до 6 атомов углерода, и
аминогруппа может иметь один или два заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода, и алкоксикарбонила, имеющего от 2 до 5 атомов углерода,
R222 представляет атом водорода, алкил, имеющий от 1 до 6 атомов углерода, или аминозащитную группу,
R3 представляет атом водорода или алкил, имеющий от 1 до 6 атомов углерода,
где алкильная группа R222 и R3 может иметь один или более заместителей, выбранных из группы, состоящей из гидроксила, атома галогена, алкилтио, имеющего от 1 до 6 атомов углерода, и алкоксила, имеющего от 1 до 6 атомов углерода,
R4, R5 и R6, каждый независимо представляет атом водорода, гидроксил, атом галогена, карбамоил, алкил, имеющий от 1 до 6 атомов углерода, алкоксил, имеющий от 1 до 6 атомов углерода, или акилтио, имеющий от 1 до 6 атомов углерода,
где указанный среди них алкил может иметь один или более заместителей, выбранных из группы, состоящей из гидроксила, атома галогена и алкоксила, имеющего от 1 до 6 атомов углерода,
R7 и R8, каждый независимо представляет атом водорода или алкил, имеющий от 1 до 6 атомов углерода,
Q' представляет аминозащитную группу],
если необходимо, выделение и очистку,
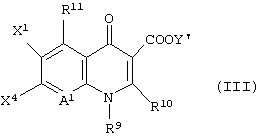
и последующее его взаимодействие с соединением формулы (III):
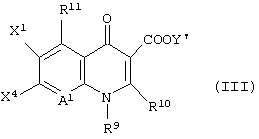
[в которой X1 представляет атом галогена или атом водорода,
X4 представляет заместитель, функционирующий в качестве уходящей группы, такой как атом фтора, атом хлора, атом брома, замещенный или незамещенный фенилсульфонил или замещенный или незамещенный алкилсульфонил, имеющий от 1 до 3 атомов углерода,
Y1 представляет атом водорода, фенил, ацетоксиметил, пивалоилоксиметил, этоксикарбонил, холин, диметиламиноэтил, 5-инданил, фталидинил, 5-алкил-2-оксо-1,3-диоксол-4-илметил, 3-ацетокси-2-оксобутил, алкил, имеющий от 1 до 6 атомов углерода, алкоксиметил, имеющий от 2 до 7 атомов углерода, или фенилалкил (состоящий из алкилена, имеющего от 1 до 6 атомов углерода, и фенила) или борсодержащий заместитель, представленный формулой (IV):
-B(Y)11Y12 (IV)
(в которой каждый из Y11 и Y12 представляет атом фтора или алкилкарбонилокси, имеющий от 2 до 4 атомов углерода),
R9 представляет алкил, имеющий от 1 до 6 атомов углерода, алкенил, имеющий от 2 до 6 атомов углерода, галогеналкил, имеющий от 1 до 6 атомов углерода, циклический алкил, имеющий от 3 до 6 атомов углерода, который может иметь заместитель, арил, который может иметь заместитель, гетероарил, который может иметь заместитель, алкоксил, имеющий от 1 до 6 атомов углерода, или алкиламино, имеющий от 1 до 6 атомов углерода,
R10 представляет атом водорода или алкилтио, имеющий от 1 до 6 атомов углерода,
где R10 и указанный выше R9 могут быть объединены с образованием кольцевой структуры включением части основного скелета, и образованное таким образом кольцо может включать атом серы в качестве составляющего кольцо атома, и кольцо может также иметь в качестве заместителя алкил, имеющий от 1 до 6 атомов углерода,
R11 представляет атом водорода, амино, гидроксил, тиол, галогенметил, алкил, имеющий от 1 до 6 атомов углерода, алкенил, имеющий от 2 до 6 атомов углерода, алкинил, имеющих от 2 до 6 атомов углерода, или алкоксил, имеющий от 1 до 6 атомов углерода,
где аминогруппа может иметь один или два заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, и ацила, имеющего от 2 до 6 атомов углерода,
когда R11 представляет амино, гидроксил или тиол, они могут быть защищены защитной группой,
А1 представляет атом азота или неполную структуру, представленную формулой (II)
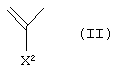
[в которой X2 представляет атом водорода, амино, атом галогена, циано, галогенметил, галогенметоксил, алкил, имеющий от 1 до 6 атомов углерода, алкенил, имеющий от 2 до б атомов углерода, алкинил, имеющий от 2 до 6 атомов углерода, или алкоксил, имеющий от 1 до 6 атомов углерода,
где указанная среди них аминогруппа может иметь один или два заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, и ацила, имеющего от 2 до 5 атомов углерода, и
X2 и указанный выше R9 могут быть объединены с образованием кольцевой структуры включением части основного скелета, и образованное таким образом кольцо может включать атом кислорода, атом азота и атом серы в качестве составляющего кольцо атома, и кольцо может также иметь в качестве заместителя алкил, имеющий от 1 до 6 атомов углерода)],
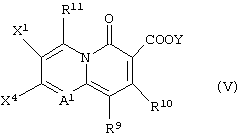
или с соединением, представленным формулой (V):
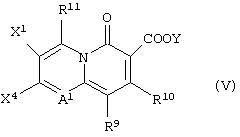
(в которой X1, X4, R9, R10, R11, А1 и Y имеют значения, определенные выше),
в присутствии основания и затем проведение снятия защиты, если необходимо.
Изобретение также относится к способу получения хинолонового соединения, включающему взаимодействие соединения, представленного следующей формулой, его солей или их гидратов
(в которой R1 представляет арил, имеющий от 6 до 10 атомов углерода, или гетероарил,
где гетероарил может быть пятичленным кольцом или шестичленным кольцом и может включать от 1 до 4 гетероатомов, необязательно выбранных из атома азота, атома кислорода и атома серы,
где данные арил и гетероарил могут иметь один или более заместителей, выбранных из группы, состоящей из атома галогена, гидроксила, тиола, амино, нитро, циано, карбоксила, карбамоила, фенила, алкила, имеющего от 1 до 6 атомов углерода, алкоксила, имеющего от 1 до 6 атомов углерода, алкилтио, имеющего от 1 до 6 атомов углерода, алкоксикарбонила, имеющего от 2 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода, и гетероарила (данный гетероарил может быть пятичленным кольцом или шестичленным кольцом и может включать от 1 до 4 гетероатомов, необязательно выбранных из атома азота, атома кислорода и атома серы),
где указанные среди них алкил, алкоксил, алкилтио, алкоксикарбонил, ацил, фенил и гетероарил могут иметь один или более заместителей, выбранных из группы, состоящей из галогена, гидроксила, алкоксила, имеющего от 1 до 6 атомов углерода, и алкилтио, имеющего от 1 до 6 атомов углерода, и
аминогруппа может иметь один или два заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода, и алкоксикарбонила, имеющего от 2 до 5 атомов углерода,
R222 представляет атом водорода, алкил, имеющий от 1 до 6 атомов углерода, или аминозащитную группу,
R3 представляет атом водорода или алкил, имеющий от 1 до 6 атомов углерода,
где алкильная группа R222 и R3 может иметь один или более заместителей, выбранных из группы, состоящей из гидроксила, атома галогена, алкилтио, имеющего от 1 до 6 атомов углерода, и алкоксила, имеющего от 1 до 6 атомов углерода,
R4, R5 и R6, каждый независимо представляет атом водорода, гидроксил, атом галогена, карбамоил, алкил, имеющий от 1 до 6 атомов углерода, алкоксил, имеющий от 1 до 6 атомов углерода, или акилтио, имеющий от 1 до 6 атомов углерода,
где указанный среди них алкил может иметь один или более заместителей, выбранных из группы, состоящей из гидроксила, атома галогена и алкоксила, имеющего от 1 до 6 атомов углерода,
R7 и R8, каждый независимо представляет атом водорода или алкил, имеющий от 1 до 6 атомов углерода)
с соединением, представленным формулой (III):
[в которой Х1 представляет атом галогена или атом водорода,
X4 представляет заместитель, функционирующий в качестве уходящей группы, такой как атом фтора, атом хлора, атом брома, замещенный или незамещенный фенилсульфонил, или замещенный или незамещенный алкилсульфонил, имеющий от 1 до 3 атомов углерода,
Y1 представляет атом водорода, фенил, ацетоксиметил, пивалоилоксиметил, этоксикарбонил, холин, диметиламиноэтил, 5-инданил, фталидинил, 5-алкил-2-оксо-1,3-диоксол-4-илметил, 3-ацетокси-2-оксобутил, алкил, имеющий от 1 до 6 атомов углерода, алкоксиметил, имеющий от 2 до 7 атомов углерода, или фенилалкил, состоящий из алкилена, имеющего от 1 до 6 атомов углерода, и фенила, или борсодержащий заместитель, представленный формулой (IV):
-В(Y11)Y12 (IV)
(в которой каждый из Y11 и Y12 представляет атом фтора или алкилкарбонилокси, имеющий от 2 до 4 атомов углерода),
R9 представляет алкил, имеющий от 1 до 6 атомов углерода, алкенил, имеющий от 2 до 6 атомов углерода, галогеналкил, имеющий от 1 до 6 атомов углерода, циклический алкил, имеющий от 3 до 6 атомов углерода, который может иметь заместитель, арил, который может иметь заместитель, гетероарил, который может иметь заместитель, алкоксил, имеющий от 1 до 6 атомов углерода, или алкиламино, имеющий от 1 до 6 атомов углерода,
R10 представляет атом водорода или алкилтио, имеющий от 1 до 6 атомов углерода,
где R10 и указанный выше R9 могут быть объединены с образованием кольцевой структуры включением части основного скелета, и образованное таким образом кольцо может включать атом серы в качестве составляющего кольцо атома, и кольцо может также иметь в качестве заместителя алкил, имеющий от 1 до 6 атомов углерода,
R11 представляет атом водорода, амино, гидроксил, тиол, галогенметил, алкил, имеющий от 1 до 6 атомов углерода, алкенил, имеющий от 2 до 6 атомов углерода, алкинил, имеющий от 2 до 6 атомов углерода, или алкоксил, имеющий от 1 до 6 атомов углерода,
где аминогруппа может иметь один или два заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, и ацила, имеющего от 2 до 6 атомов углерода,
когда R11 представляет амино, гидроксил или тиол, они могут быть защищены защитной группой,
А1 представляет атом азота или неполную структуру, представленную формулой (II):
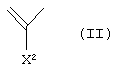
(в которой X2 представляет атом водорода, амино, атом галогена, циано, галогенметил, галогенметоксил, алкил, имеющий от 1 до 6 атомов углерода, алкенил, имеющий от 2 до 6 атомов углерода, алкинил, имеющий от 2 до 6 атомов углерода, или алкоксил, имеющий от 1 до 6 атомов углерода,
где указанная среди них аминогруппа может иметь один или два заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, и ацила, имеющего от 2 до 5 атомов углерода, и
X2 и указанный выше R9 могут быть объединены с образованием кольцевой структуры включением части основного скелета, и образованное таким образом кольцо может включать атом кислорода, атом азота и атом серы в качестве составляющего кольцо атома, и кольцо может также иметь в качестве заместителя алкил, имеющий от 1 до 6 атомов углерода)],
или с соединением, представленным формулой (V):
(в которой X1, X4, R9, R10, R11, А1 и Y имеют значения, определенные выше),
в присутствии основания и затем проведение снятия защиты, если это необходимо.
(Вариант осуществления изобретения)
Описываются заместители в соединении по изобретению, представленном формулой (I).
Заместитель R1 представляет ароматическую группу (ароматический заместитель). Соединение по изобретению отличается тем, что в данном положении находится ароматический заместитель. Данный ароматический заместитель может быть углеводородной группой (арилом) или гетероциклической группой (гетероарил). В случае углеводородной группы она может быть моноциклической или бициклической. В случае гетероциклической группы она также может быть моноциклической или бициклической. В случае моноциклической гетероциклической группы она представляет пятичленное или шестичленное кольцо, и в случае бициклической гетероциклической группы она представляет бензоконденсированную кольцевую систему или другую, отличную от нее, и в качестве примера можно привести 6-5-конденсированную кольцевую систему или 6-6-конденсированную кольцевую систему. Кроме того, в случае гетероциклической системы число входящих гетероатомов составляет 1-4, необязательно выбранных из атома азота, атома кислорода и атома серы.
Т.е. заместитель R1 представляет ароматический заместитель, такой как арил, имеющий от 6 до 10 атомов углерода, или гетероарил.
В данном случае гетероарил представляет пятичленное кольцо или шестичленное кольцо и может включать от 1 до 4 гетероатомов, необязательно выбранных из атома азота, атома кислорода и атома серы.
Данные арил и гетероарил могут иметь один или более заместителей, выбранных из группы, состоящей из атома галогена, гидроксила, тиола, амино, нитро, циано, карбоксила, карбамоила, фенила, алкила, имеющего от 1 до 6 атомов углерода, алкоксила, имеющего от 1 до 6 атомов углерода, алкилтио, имеющего от 1 до 6 атомов углерода, алкоксикарбонила, имеющего от 2 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода, и гетероарила (пятичленное кольцо или шестичленное кольцо, которое включает от 1 до 4 гетероатомов, необязательно выбранных из атомов азота, атома кислорода и атома серы).
Алкил, алкоксил, алкилтио, алкоксикарбонил, ацил, фенил и гетероарил в качестве заместителей арила или гетероарила могут иметь один или более заместителей, выбранных из группы, состоящей из атома галогена, гидроксила, алкоксила, имеющего от 1 до 6 атомов углерода, и алкилтио, имеющего от 1 до 6 атомов углерода.
Кроме того, аминогруппа может иметь один или два заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода, и алкоксикарбонила, имеющего от 2 до 5 атомов углерода.
Как пример арила, имеющего от 6 до 10 атомов углерода, в качестве ароматического заместителя, можно привести фенил, пенталенил, нафтил, азуленил и тому подобное, из которых фенил, 1-нафтил и 2-нафтил являются предпочтительными.
Как пример гетероарила из пятичленного кольца или шестичленного кольца, которое включает от 1 до 4 гетероатомов, необязательно выбранных из атома азота, атома кислорода и атома серы, в качестве ароматического заместителя, можно привести фурил, тиенил, пирролил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, пиразолил, фуразанил, пиридил, пиразинил, пиримидил, пиридазинил, триазинил, тетразинил или тому подобное. Среди них предпочтительные включают 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-оксазолил, 2-тиазолил, 2-имидазолил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиразинил, 2-пиримидил, 4-пиримидил, 5-пиримидил и 3-пиридазинил. В качестве более предпочтительных примеров можно привести 2-фурил, 3-фурил, 2-тиенил, 2-оксазолил, 2-тиазолил, 2-имидазолил, 2-пиридил и 4-пиридил.
Заместитель в кольцах данных арила и гетероарила может быть выбран из группы, состоящей из атома галогена, гидроксила, тиола, амино, нитро, циано, карбоксила, карбамоила, фенила, алкила, имеющего от 1 до 6 атомов углерода, алкоксила, имеющего от 1 до 6 атомов углерода, алкилтио, имеющего от 1 до 6 атомов углерода, алкокси-карбонила, имеющего от 2 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода, и гетероарила (данный гетероарил может быть пятичленным кольцом или шестичленным кольцом, которое включает от 1 до 4 гетероатомов, необязательно выбранных иэ атома азота, атома кислорода и атома серы). Среди данных групп предпочтительными являются алкил, алкоксил, алкилтио, атом галогена, гидроксил, амино, карбамоил, алкоксикарбонил и фенил, особенно предпочтительными заместителями являются алкил, алкоксил, алкилтио, атом галогена, гидроксил и аминогруппа.
Описываются замещенный арил и замещенный гетероарил в случае, когда алкил, алкоксил, алкилтиогруппа, атом галогена, гидроксил и аминогруппа являются предпочтительными в качестве заместителей в кольце арила и гетероарила.
Когда арил или гетероарил имеют в качестве заместителя алкил, алкил может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, его предпочтительные примеры включают метил, этил, прямой пропил и изопропил.
Когда алкил имеет в качестве заместителя атом галогена, алкил может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и атом фтора является предпочтительным в качестве замещающего атома галогена. Что касается числа атомов фтора, то оно может быть любым от монозамещения до перфторзамещения. Его примеры включают монофторметил, дифторметил, трифторметил, 2,2,2-трифторэтил и тому подобное.
Когда алкил дополнительно имеет в качестве заместителя гидроксил, алкил может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода. Хотя положение замещения гидроксилом особым образом не ограничивается, может быть предпочтительным замещение на концевом атоме углерода алкила. В качестве алкила, имеющего гидроксил, предпочтительными являются таковые, имеющие до 3 атомов углерода, и предпочтительны гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил и тому подобное.
Когда алкил дополнительно имеет в качестве заместителя алкоксил, алкил может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и замещающий алкоксил также может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода. Хотя положение замещения алкоксилом особым образом не ограничивается, может быть предпочтительным замещение на концевом атоме углерода алкила. Предпочтительными являются алкоксиметил, алкоксиэтил и алкоксипропил в качестве алкила, имеющего алкоксил, и предпочтительно алкоксил может иметь до 3 атомов углерода. Более предпочтительные примеры включают метоксиметил, этоксиметил и метоксиэтил.
Когда алкил дополнительно имеет в качестве заместителя алкилтиогруппу, алкил может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и замещающая алкилтиогруппа также может быть прямой или разветвленной, имеющей от 1 до 6 атомов углерода. Хотя положение замещения алкилтиогруппой особым образом не ограничивается, может быть предпочтительным замещение на концевом атоме углерода алкила. В качестве алкила, имеющего алкилтиогруппу, предпочтительными являются алкилтиометил, алкилтиолэтил и алкилтиопропил, и предпочтительно алкилтиогруппа может иметь от 1 до 3 атомов углерода. Более предпочтительные примеры включают метилтиометил, этилтиометил и метилтиоэтил.
В указанных выше ариле и гетероариле, имеющих в качестве заместителя "алкил, который может иметь заместитель", число алкильных групп может быть любым от монозамещения до пералкилзамещения. Когда присутствуют два или более алкила, то они могут быть одинаковыми или различными. В случае замещения алкилыюй группой подходит моно-, ди- и тризамещение.
Когда арил и гетероарил имеют в качестве заместителя алкоксил, данный алкоксил может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и его предпочтительные примеры включают метоксил и этоксил.
Когда алкоксил дополнительно имеет в качестве заместителя атом галогена, алкоксил может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и атом фтора является предпочтительным в качестве замещающего атома галогена. Что касается числа атомов фтора, то оно может быть любым от монозамещения до перфторзамещения. Его примеры включают монофторметоксил, дифторметоксил, трифторметоксил, 2,2,2-трифторэтоксил и тому подобное.
Когда алкоксил дополнительно имеет в качестве заместителя гидроксил, алкоксил может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода. Хотя положение замещения гидроксилом особым образом не ограничивается, может быть предпочтительным замещение на концевом атоме углерода алкоксила. В качестве алкоксила, имеющего гидроксил, предпочтительными являются таковые, имеющие до 3 атомов углерода, и предпочтительны 1-гидроксиэтоксил, 2-гидроксиэтоксил, 2-гидроксипропоксил, 3-гидроксипропоксил и тому подобное.
Когда алкоксил дополнительно имеет в качестве заместителя алкоксильную группу, алкоксил может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и замещающая алкоксильная группа также может быть прямой или разветвленной, имеющей от 1 до 6 атомов углерода. Хотя положение замещения алкоксильной группой особым образом не ограничивается, может быть предпочтительным замещение на концевом атоме углерода алкоксила. В качестве алкоксила, имеющего алкоксильную группу, предпочтительными являются алкоксиметоксил и алкоксиэтоксил, и алкоксил может предпочтительно иметь до 3 атомов углерода. Более предпочтительные примеры включают 2-метоксиэтоксил и 2-этоксиэтоксил.
Когда алкоксил дополнительно имеет в качестве заместителя алкилтиогруппу, алкоксил может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и замещающая алкилтиогруппа также может быть прямой или разветвленной, имеющей от 1 до 6 атомов углерода. Хотя положение замещения алкилтиогруппой особым образом не ограничивается, может быть предпочтительным замещение на концевом атоме углерода алкоксила. В качестве алкоксила, имеющего алкилтиогруппу, предпочтительным является алкилтиоэтоксил, и алкилтиогруппа может предпочтительно иметь от 1 до 3 атомов углерода. Более предпочтительные примеры включают 2-метилтиоэтоксил и 2-этилтиоэтоксил.
В указанных выше ариле и гетероариле, имеющих в качестве заместителя "алкоксил, который может иметь заместитель", число алкоксильных групп может быть любым от монозамещения до пералкоксилзамещения. Когда присутствуют два или более алкоксила, то они могут быть одинаковыми или различными. В случае замещения алкоксильной группой подходит моно-, ди- и тризамешение.
Когда арил и гетероарил имеют в качестве заместителя алкилтиогруппу, алкилтиогруппа может быть прямой или разветвленной, имеющей от 1 до 6 атомов углерода, и ее предпочтительные примеры включают метилтиогруппу и этилтиогруппу.
Когда алкилтиогруппа имеет в качестве заместителя атом галогена, алкилтиогруппа может быть прямой или разветвленной, имеющей от 1 до 6 атомов углерода, и атом фтора является предпочтительным в качестве атома галогена. Что касается числа атомов фтора, то оно может быть любым от моноэамещения до перфторзамещения. Ее примеры включают монофторметилтиогруппу, дифторметилтиогруппу, трифторметилтиогруппу, 2,2,2-трифтор-этилтиогруппу и тому подобное.
Когда алкилтиогруппа дополнительно имеет в качестве заместителя гидроксил, алкилтиогруппа может быть прямой или разветвленной, имеющей от 1 до 6 атомов углерода. Хотя положение замещения гидроксилом особым образом не ограничивается, может быть предпочтительным замещение на концевом атоме углерода алкилтиогруппы. В качестве алкилтиогруппы, имеющей гидроксил, предпочтительными являются таковые, имеющие до 3 атомов углерода, и предпочтительны 1-гидроксиэтилтиогруппа, 2-гидроксиэтилгруппа, 2-гидроксипропилтиогруппа, 3-гидроксипропилтиогруппа и тому подобное.
Когда алкилтиогруппа дополнительно имеет в качестве заместителя алкоксил, алкилтиогруппа может быть прямой или разветвленной, имеющей от 1 до 6 атомов углерода, и замещающий алкоксил также может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода. Хотя положение замещения алкоксилом особым образом не ограничивается, может быть предпочтительным замещение на концевом атоме углерода алкилтио группы. В качестве алкилтиогруппы, имеющей алкоксил, предпочтительными являются алкоксиэтилтиогруппа и алкоксипропилтиогруппа, и алкоксил может предпочтительно иметь до 3 атомов углерода. Более предпочтительные примеры включают 2-метоксиэтилтиогруппу и 2-этоксиэтилтиогруппу.
Когда алкилтиогруппа дополнительно имеет в качестве заместителя алкилтиогруппу, алкилтиогруппа может быть прямой или разветвленной, имеющей от 1 до 6 атомов углерода, и замещающая алкилтиогруппа также может быть прямой или разветвленной, имеющей от 1 до 6 атомов углерода. Хотя положение замещения алкилтиогруппой особым образом не ограничивается, может быть предпочтительным замещение на концевом атоме углерода алкилтиогруппы. В качестве алкилтиогруппы, имеющей алкилтиогруппу, предпочтительной является алкилтиоэтилтиогруппа, и алкилтиогруппа может предпочтительно иметь от 1 до 3 атомов углерода. Более предпочтительные примеры включают 2-метилтиоэтилтиогруппу и 2-этилтиоэтилтиогруппу.
В данных ариле и гетероариле, имеющих в качестве заместителя "алкилтиогруппу, которая может иметь заместитель", число алкилтиогрупп может быть любым от монозамещения до пералкилтиозамещения. Когда присутствуют две или более алкилтиогрупп, то они могут быть одинаковыми или различными. Монозамещение подходит в качестве алкилтиозамещения.
Когда арил и гетероарил имеют в качестве заместителя атом галогена, предпочтительными являются атом фтора, атом хлора и атом брома в качестве атома галогена. Атом фтора является особенно предпочтительным, и число атомов фтора в этом случае может быть любым от монозамещения до перфторзамещения.
Их примеры включают 2-фторфенил, 3-фторфенил, 4-фторфенил, 2,4-дифторфенил, 2, 5-дифторфенил, 2,6-дифторфенил, 3,4-дифторфенил, 3,5-дифторфенил, 2,4,6-трифторфенил, 3,4,5-трифторфенил, 2,3,5,6-тетрафторфенил, пентафторфенил, 4-фтор-1-нафтил, 7-фтор-1-нафтил, 3-фтор-2-пиридил, 6-фтор-2-пиридил, 2,4,5,6-тетрафтор-3-пиридил, 2,3,5,6-тетрафтор-4-пиридил и тому подобное.
Когда арил и гетероарил имеют в качестве заместителя гидроксил, арил, замещенный гидроксилом, является предпочтительным, и замещенный фенил особенно предпочтителен. В качестве примера можно привести 2-гидроксифенил, 3-гидроксифенил, 4-гидроксифенил, 2,4-дигидроксифенил и тому подобное.
Когда арил и гетероарил имеют в качестве заместителя аминогруппу, замещенный аминогруппой арил является предпочтительным, и замещенный аминогруппой фенил особенно предпочтителен. В данном случае аминогруппа может иметь 1 или 2 заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода, и алкоксикарбонила, имеющего от 2 до 5 атомов углерода, и моноалкиламинозамещенный фенил, диалкиламинозамещенный фенил (алкильные группы в данном случае могут быть одинаковыми или различными) и ациламинозамещенный фенил являются предпочтительными.
В качестве примера можно привести 2-аминофенил, 3-аминофенил, 4-аминофенил, 2-метиламинофенил, 4-метиламинофенил, 2-диметиламинофенил, 4-диметиламинофенил, 4-ацетоксиаминофенил и тому подобное.
Когда арил и гетероарил имеют два или более заместителей, их комбинация может быть комбинацией, необязательно выбранной из группы, состоящей из атома галогена, гидроксила, тиола, амино, нитро, циано, карбоксила, карбамоила, фенила, алкила, имеющего от 1 до 6 атомов углерода, алкоксила, имеющего от 1 до 6 атомов углерода, алкилтио, имеющего от 1 до 6 атомов углерода, алкоксикарбонила, имеющего от 2 до 6 атомов углерода, ацила, имеющего от 2 до 5 атомов углерода, и гетероарила (пятичленное кольцо или шестичленное кольцо и включает от 1 до 4 гетероатомов, необязательно выбранных из атома азота, атома кислорода и атома серы), но предпочтительно, чтобы один из них был выбран из алкила, алкоксила, атома галогена, гидроксила и амино. В качестве атома галогена атом фтора является особенно предпочтительным.
В качестве примеров случая, когда арил и гетероарил имеют два или более заместителей, можно привести 2-фтор-4-гидрокси-фенил, 3-амино-4,6-дифторфенил, 4,6-дифтор-3-метиламинофенил, 2,6-дифтор-4-метоксифенил, 4-фтор-2-метилфенил, 4-гидрокси-3,5-диметилфенил, 3,5-диметил-4-метоксифенил, 6-амино-3,5-дифтор-2-пиридил, 5-хлор-6-метил-4-пиримидинил и тому подобное.
В данной связи атом углерода, с которым связан R1, становится асимметричным углеродом, образующим изомеры, и все такие изомеры включены в данное изобретение.
Кроме того, заместитель R1 представляет (замещенный) фенил или биарильного типа (замещенный) гетероарил из пятичленного кольца или шестичленного кольца, содержащего 1-4 гетероатома, необязательно выбранных из атома азота, атома кислорода и атома серы (термин "(замещенный)" означает, что может быть заместитель), он образует изомеры, возникающие за счет осевой хиральности, и все такие изомеры включены в данное изобретение.
Заместители R2 и R3, каждый независимо представляет атом водорода или алкил, имеющий от 1 до 6 атомов углерода, и алкил может иметь один или более заместителей, выбранных из группы, состоящей из гидроксила, атома галогена, алкилтио, имеющего от 1 до 6 атомов углерода, и алкоксила, имеющего от 1 до 6 атомов углерода.
В случае алкила он может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и его предпочтительные примеры включают метил, этил, прямой пропил и изопропил.
Когда алкил дополнительно имеет в качестве заместителя гидроксил, алкил может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода. Хотя положение замещения гидроксилом особым образом не ограничивается, может быть предпочтительным замещение на концевом атоме углерода алкила. В качестве алкила, имеющего гидроксил, желатемым являются таковые, имеющие до 3 атомов углерода, и предпочтительны гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил и тому подобное.
Когда алкил дополнительно имеет в качестве заместителя атом галогена, алкил может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и атом фтора является предпочтительным в качестве атома галогена. Что касается числа атомов фтора, то оно может быть любым от монозамещения до перфторзамещения. Его примеры включают монофторметил, дифторметил, трифторметил, 2,2,2-трифторэтил и тому подобное.
Когда алкил дополнительно имеет в качестве заместителя алкилтиогруппу, алкил может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и замещающая алкилтиогруппа также может быть прямой или разветвленной, имеющей от 1 до 6 атомов углерода. Хотя положение замещения алкилтиогруппой особым образом не ограничивается, может быть предпочтительным замещение на концевом атоме углерода алкила. В качестве алкила, имеющего алкилтиогруппу, предпочтительными являются алкилтиометил, алкилтиолэтил и алкилтиопропил, и предпочтительно алкилтиогруппа может иметь от 1 до 3 атомов углерода. Более предпочтительные примеры включают метилтиометил, этилтиометил и метилтиоэтил.
Когда алкил имеет в качестве заместителя алкоксил, алкил может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и замещающий алкоксил также может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода. Хотя положение замещения алкоксилом особым образом не ограничивается, может быть предпочтительным замещение на концевом атоме углерода алкила. В качестве алкила, имеющего алкоксил, предпочтительными являются алкоксиметил, алкоксиэтил и алкоксипропил, и предпочтительно алкоксил может иметь до 3 атомов углерода. Более предпочтительные примеры включают метоксиметил, этоксиметил и метоксиэтил.
R4, R5 и R6, каждый независимо представляет атом водорода, гидроксил, атом галогена, карбамоил, алкил, имеющий от 1 до 6 атомов углерода, алкоксил, имеющий от 1 до 6 атомов углерода, или алкилтио, имеющей от 1 до 6 атомов углерода, и указанный среди них алкил может иметь один или более заместителей, выбранных из группы, состоящей из гидроксила, атома галогена и алкоксила, имеющего от 1 до 6 атомов углерода. Кроме того, R5 и R6 объединяются в полиметиленовую цепь, имеющую от 3 до 6 атомов углерода (образует спирокольцевую систему вместе с кольцом пирролидина), гидроксииминогруппу или алкилоксииминогруппу, имеющие от 1 до 6 атомов углерода.
В качестве атома галогена предпочтительным является атом фтора или атом хлора.
Что касается алкила, то он может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и его предпочтительные примеры включают метил, этил, прямой пропил и изопропил.
Что касается алкоксила, то он может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и его предпочтительные примеры включают метоксил и этоксил.
Что касается акилтиогруппы, то она может быть прямой или разветвленной, имеющей от 1 до 6 атомов углерода, и ее предпочтительные примеры включают метилтиогрулпу и этилтиогруппу.
Когда гидроксил присутствует в качестве заместителя в алкиле, имеющем от 1 до 6 атомов углерода, алкил может быть прямым или разветвленным. Хотя положение замещения гидроксилом особым образом не ограничивается, может быть предпочтительным замещение на концевом атоме углерода алкила. Предпочтительные примеры замещенного гидроксилом алкила, имеющего от 1 до 6 атомов углерода, включают гидроксиметил, 2-гидроксиэтил и 3-гидроксипропил.
В качестве атома галогена алкила, имеющего атом галогена, предпочтительными являются атомы фтора и хлора, и атом фтора особенно предпочтителен. Алкил может быть прямым или разветвленным.
В содержащем алкоксил алкиле, имеющем от 1 до 6 атомов углерода, каждая из алкильных групп может быть прямой или разветвленной, и предпочтительными являются алкоксиметил или алкоксиэтил. В качестве более предпочтительных примеров можно привести метоксиметил, этоксиметил и 2-метоксиэтил.
Когда заместители R5 и R6 объединены с образованием полиметиленовой цепи, кольцо из трех-шестичленного кольца вновь добавляется к кольцу пирролидина с образованием спирокольцевой структуры. Что касается размера вновь образованного кольца, то предпочтительным является кольцо циклопропила или кольцо циклобутила, имеющее 2 или 3 атома углерода.
Кроме того, когда заместители R5 и R6 объединены в алкилоксииминогруппу, представленную следующей формулой:
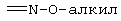
алкил может быть прямым или разветвленным. В качестве алкилоксииминогруппы предпочтительными являются метоксииминогруппа и этоксииминогруппа.
Заместители R7 и R8, каждый независимо представляет атом водорода или алкил, имеющий от 1 до 6 атомов углерода. Что касается алкила, то он может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и предпочтительно является метилом, этилом, прямым пропилом или изопропилом. Предпочтительным является случай, когда каждый из них представляет атом водорода.
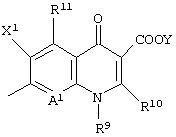
Q представляет неполную структуру, представленную следующей формулой:
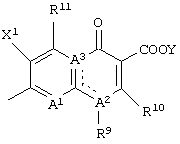
В данной структурной формуле А2 и А3, каждый независимо представляет атом азота или атом углерода, и А2 и А3 и атомы углерода, с которыми они связаны, связаны с образованием неполной структуры
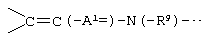
или неполной структуры
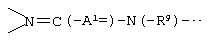
Конденсированная гетероциклическая неполная структура, представленная следующей формулой:
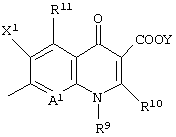
или следующей формулой:
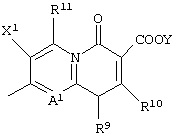
является предпочтительной в качестве структуры Q.
Заместитель R9 представляет алкил, имеющий от 1 до 6 атомов углерода, алкенил, имеющий от 2 до 6 атомов углерода, галогеналкил, имеющий от 1 до 6 атомов углерода, циклический алкил, имеющий от 3 до 6 атомов углерода, который может иметь заместитель, арил, который может иметь заместитель, гетероарил, который может иметь заместитель, алкоксил, имеющий от 1 до 6 атомов углерода, или алкиламиногруппу, имеющую от 1 до 6 атомов углерода.
В данном случае особенно предпочтительным является этил в качестве алкила, имеющего от 1 до 6 атомов углерода. В качестве алкенила, имеющего от 2 до 6 атомов углерода, предпочтительным является винил или 1-изопропенил. 2-Фторэтил является предпочтительным в качестве галогеналкила, имеющего от 1 до 6 атомов углерода. Циклопропил является особенно предпочтительным в качестве циклического алкила, и атом галогена, особенно атом фтора, является предпочтительным в качестве заместителя циклического алкила.
Примеры арила, который может иметь заместитель, включают фенил или подобную группу, которая может иметь от 1 до 3 заместителя, выбранных из группы, состоящей, например, из атома фтора, атома хлора, атома брома и подобного атома галогена, гидроксила, амино, нитро, алкила, имеющего от 1 до 6 атомов углерода, и алкоксила, имеющего от 1 до 6 атомов углерода, и его предпочтительные примеры включают фенил, 2-фторфенил, 4-фторфенил, 2,4-дифторфенил, 2-фтор-4-гидроксифенил, 3-амино-4,6-дифторфенил и 4,6-дифтор-3-метиламинофенил. Данный арил может быть одинаковым с арилом заместителя R1 или отличаться от него.
Гетероарил представляет производное пятичленного или шестичленного ароматического гетероциклического соединения, которое включает один или более гетероатомов, выбранных из атома азота, атома кислорода и атома серы. Данный гетероарил может быть одинаковым с гетероарилом заместителя R1 или отличаться от него. В качестве примера гетероарила заместителя R9 можно привести пиридил, пиримидил и тому подобное. В качестве заместителя в данных кольцах предпочтительными являются алкил, атом галогена или тому подобное. Особенно предпочтительным является 6-амино-3,5-дифтор-2-пиридил.
Метоксил является предпочтительным в качестве алкоксила, имеющего от 1 до 6 атомов углерода. Метиламиногруппа является предпочтительной в качестве алкиламиногруппы, имеющей от 1 до 6 атомов углерода.
В качестве заместителя R9 предпочтительными являются циклический алкил или галогенциклоалкил. Среди данных групп предпочтительными являются циклопропил или 2-галогенцикло-пропил. В качестве атома галогена предпочтительным является атом фтора.
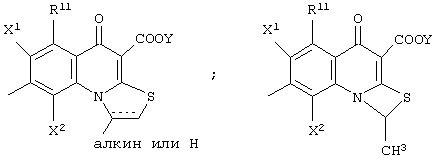
Заместитель R10 представляет атом водорода или алкилтиогруппу, имеющую от 1 до 6 атомов углерода, или R9 и R10 могут быть объединены с образованием углеводородной кольцевой структуры включением части основного скелета (а именно, включением атома углерода, с которым R10 связан, и А2). Образованное таким образом кольцо может включать атом серы в качестве составляющего атома, и кольцо может дополнительно иметь в качестве заместителя алкил, имеющий от 1 до 6 атомов углерода. Образованное таким образом кольцо может иметь размер от четырехчленного кольца до шестичленного кольца, и кольцо может быть насыщенным или ненасыщенным. В качестве примера конденсированной кольцевой структуры, образованной таким образом, можно привести следующие:
Заместитель Х1 представляет атом галогена или атом водорода, и атом фтора является предпочтительным в случае атома галогена. Среди данных атомов атом фтора или атом водорода являются предпочтительными в качестве заместителя.
Заместитель R11 представляет атом водорода, аминогруппу, гидроксил, тиол, галогенметил, алкил, имеющий от 1 до 6 атомов углерода, алкенил, имеющий от 2 до 6 атомов углерода, алкинил, имеющий от 2 до 6 атомов углерода, и алкоксил, имеющий от 1 до 6 атомов углерода, и указанная среди них аминогруппа может иметь один или два заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, и ацила, имеющего от 2 до 6 атомов углерода.
Что касается алкила, то он может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и его предпочтительные примеры включают метил, этил, прямой пропил и изопропил. Алкенил может быть прямым или разветвленным, имеющим от 2 до 6 атомов углерода, и он предпочтительно представляет винил. Что касается алкинила, то он может быть прямым или разветвленным, имеющим от 2 до 6 атомов углерода, и он предпочтительно представляет этинил. Атом фтора является особенно предпочтительным в качестве галогена в галогенметильной группе, и его число может составлять от 1 до 3. Алкоксил может иметь от 1 до 6 атомов углерода и предпочтительно представляет метоксил.
Заместитель R11 предпочтительно представляет атом водорода, алкил или амино, из которых метил или незамещенная аминогруппа являются предпочтительными.
Когда заместитель R11 представляет амино, гидроксил или тиол, они могут быть защищены обычно используемыми защитными группами.
Примеры таких защитных групп включают трет-бутоксикарбонил, 2,2,2-трихлорэтоксикарбонил и подобные (замещенные) алкоксикарбонильные группы; бензилоксикарбонил, пара-метоксибензилоксикарбонил, пара-нитробензилоксикарбонил и подобные (замещенные)аралкилоксикарбонильные группы; ацетил, метоксиацетил, трифторацетил, хлорацетил, пивалоил, формил, бензоил и подобные (замещенные)ацильные группы; трет-бутил, бензил, пара-нитробензил, пара-метоксибензил, трифенилметил и подобные (замещенные)алкильные группы или (замещенные)аралкильные группы; метоксиметил, трет-бутоксиметил, тетрагидропиранил, 2,2,2-трихлорэтоксиметил и подобные (замещенные)простые эфиры; и триметилсилил, изопропилдиметилсилил, трет-бутилдиметилсилил, трибензилсилил, трет-бутилдифенилсилил и подобные (алкил и/или аралкил)замещенные силильные группы. Соединения, имеющие заместители, защищенные данными заместителями, являются особенно предпочтительными в качестве промежуточных соединений для получения.
Когда А1 представляет неполную структуру следующей формулы (II)
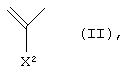
X2 представляет атом водорода, амино, атом галогена, циано, галогенметил, галогенметоксил, алкил, имеющий от 1 до 6 атомов углерода, алкенил, имеющий от 2 до 6 атомов углерода, алкинил, имеющий от 2 до 6 атомов углерода, или алкоксил, имеющий от 1 до 6 атомов углерода, где аминогруппа может иметь один или два заместителя, выбранных из группы, состоящей из формила, алкила, имеющего от 1 до 6 атомов углерода, и ацила, имеющего от 2 до 5 атомов углерода.
Что касается алкила, то он может быть прямым или разветвленным, имеющим от 1 до 6 атомов углерода, и его предпочтительные примеры включают метил, этил, прямой пропил и изопропил. Алкенил может быть прямым или разветвленным, имеющим от 2 до 6 атомов углерода, и он предпочтительно представляет винил. Алкинил может быть прямым или разветвленным, имеющим от 2 до 6 атомов углерода, и он предпочтительно представляет этинил. Атом фтора является особенно предпочтительным в качестве галогена в галоген-метильной группе, и его число может составлять от 1 до 3. Что касается алкоксила, то он может иметь от 1 до 6 атомов углерода, и он предпочтительно представляет метоксил. Атом фтора является особенно предпочтительным в качестве галогена в галогенметоксильной группе, и его число может равняться от 1 до 3.
Среди данных заместителей алкил или алкоксил являются предпочтительными. Более предпочтительными являются метил и этил. Последние являются предпочтительными заместителями, особенно, когда Q представляет неполную структуру, представленную следующей формулой:
Кроме того, данный Х2 и указанный выше R9 могут быть объединены с образованием углеводородной кольцевой структуры (размер кольца может быть от четырехчленного кольца до семичленного кольца, и оно может быть насыщенным или ненасыщенным) включением части основного скелета (а именно включением атома углерода, с которым X2 связан, и А2), и образованное таким образом кольцо может включать атом кислорода, атом азота или атом серы в качестве составляющего атома, и кольцо также может иметь в качестве заместителя алкил, имеющий от 1 до 6 атомов углерода. Примерами конденсированной кольцевой структуры, образованной таким образом, могут быть следующие:
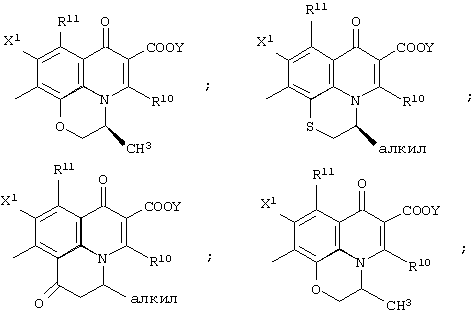
Среди данных конденсированных кольцевых систем 2,3-дигидро-7-оксо-7Н-пиридо[1,2,3-de][1,4]бензоксазин-6-карбоновая кислота-10-ил, особенно его (S)-метильная форма в положении 3 является предпочтительной.
Что касается Q, то неполная структура следующей формулы:
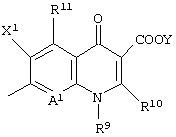
является предпочтительной. Также в данном случае предпочтительно, чтобы А1 был неполной структурой формулы (II).
Когда Q представляет неполную структуру, описанную выше, и А1 является неполной структурой формулы (II), предпочтительной комбинацией R11 и X2 является случай, когда R11 представляет амино, атом водорода, гидроксил или алкил, имеющий от 1 до 6 атомов углерода, и X2 является алкилом, имеющим от 1 до 6 атомов углерода, алкоксилом, имеющим от 1 до 6 атомов углерода, галогенметоксилом или атомом водорода.
Более предпочтительной комбинацией является случай, когда R11 представляет амино, атом водорода, гидроксил или метил, и X2 представляет метил, метоксил, дифторметоксил или атом водорода.
Наиболее предпочтительной комбинацией является случай, когда R11 представляет амино, атом водорода, гидроксил или метил, и X2 представляет метил или метоксил.
Для данных R11 и X2, атом фтора является предпочтительным в качестве X1.
Когда заместители Х1 и X2 представляют атомы галогена, атом фтора является особенно предпочтительным в качестве X1, и атом фтора или атом хлора является предпочтительным в качестве X2.
Когда Q представляет неполную структуру, представленную следующей формулой:
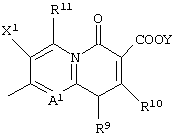
и А1 представляет неполную структуру формулы (II), предпочтительной комбинацией R11 и X2 является случай, когда R11 представляет амино, атом водорода, гидроксил или алкил, имеющий от 1 до 6 атомов углерода, и X2 представляет алкил, имеющий от 1 до 6 атомов углерода, алкоксил, имеющий от 1 до 6 атомов углерода, галогенметоксил или атом водорода.
Более предпочтительной комбинацией является случай, когда R11 представляет амино, атом водорода, гидроксил или метил, и X2 представляет метил, метоксил, дифторметоксил или атом водорода.
Наиболее предпочтительной комбинацией является случай, когда R11 представляет амино, атом водорода, гидроксил или метил, и X2 представляет метил или метоксил.
Когда заместители X1 и X2 представляют атомы галогена, атом фтора является особенно предпочтительным в качестве X1, и атом фтора или атом хлора является предпочтительным в качестве X2.
Далее описывается галогенциклопропил R9.
В качестве примера замещающего атома галогена можно привести атом фтора и атом хлора, из которых атом фтора является особенно предпочтительным.
Касаясь стерического окружения в данной группе, особенно предпочтительно, чтобы атом галогена и группа пиридонкарбоновой кислоты имели цис-конфигурацию в циклопропановом кольце.
Так называемые энантиомерные изомеры присутствуют только за счет одного цис-2-галогенциклопропильного фрагмента R9, и сильная антибактериальная активность и высокая безопасность была установлена у обоих изомеров.
Соединение по изобретению показывает превосходные свойства благодаря наличию пирролидинилового заместителя структуры, представленной ниже.
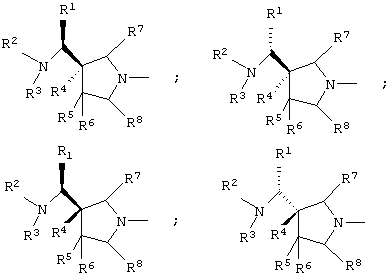
B данном заместителе указанные выше четыре изомера образуются за счет асимметричного атома углерода в кольце пирролидина, с которым связаны заместитель -СН(-R1)N(-R2)-R3 и заместитель R4, и асимметричного атома углерода, с которым связан R1.
С другой стороны, всязь между структурой и активностью у четырех оптически активных соединений за счет пространственной конфигурации заместителя в положении 7 у производного 7-[3-(1-аминоэтил)пирролидин-1-ил]хинолонкарбоновой кислоты описана в Chemical & Pharmaceutical Bulletin, vol. 42, р. 1442 (1994). Описано, что 3-(S)-[1-(R)-аминоэтил]пирролидин-1-ил обладает наиболее высокой антибактериальной активностью среди четырех оптически активных соединений.
Настоящие изобретатели полагают, что
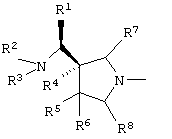
является наиболее предпочтительным среди четырех оптически активных соединений, имеющих структуры, представленные выше.
Т.е. соединение по изобретению отличается тем, что производное замещенного ароматической группой аминометилпирролидина, представленное формулой (I), его соли и их гидраты проявляют широкого спектра и высокую антибактериальную активность в отношении грамотрицательных и грамположительных бактерий, и проявляет высокую антибактериальную активность в отношении резистентных штаммов грамположительных бактерий, включая MRSA, PRSP и VRE.
В частности, соединение, представленное формулой (I), в котором производное замещенного ароматической группой аминометилпирролидина, имеющее указанную выше структуру, введено в положение 10 2,3-дигидро-3-(S)-метил-7-оксо-7Н-пиридо[1,2,3-de][1,4]бензоксазинового скелета или положение 7 6-фтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолинового скелета, имея превосходную безопасность, его соли и их гидраты проявили широкого спектра и высокую антибактериальную активность в отношении как грамотрицательных, так и грамположительных бактерий, включая резистентные к лекарствам штаммы, что не предполагалось до изобретения.
Когда соединение формулы (I) по изобретению имеет структуру, в которой присутствуют диастереоизомеры, и когда подобное соединение по изобретению вводят человеку или животным, то предпочтительно вводить соединение, которое включает один диастереоизомер. Термин “включает один диастереоизомер”, использованный здесь, означает не только случай, когда оно полностью свободно от другого диастереоизомера, но и случай, когда оно химически чистое. Другими словами, следует толковать, что другой диастереоизомер может присутствовать в такой степени, чтобы он не оказывал влияния на физические константы и физиологическую активность соединения.
Кроме того, термин “стереохимически чистый”, использованный здесь, означает, что, когда соединение или подобное существует во многих изомерных формах за счет присутствия асимметричных атомов углерода, соединение включает только один из них. Термин “чистый” в данном случае также следует рассматривать таким же образом, как описано выше.
Производное пиридонкарбоновой кислоты по изобретению можно применять в его свободной форме или в виде аддитивной соли кислоты или соли по его карбоксильной группе. Примеры аддитивной соли кислоты включают гидрохлорид, сульфат, нитрат, гидробромид, гидройодид, фосфат и подобные соли неорганических кислот, или ацетат, метансульфонат, бензолсульфонат, толуолсульфонат, цитрат, малеат, фумарат, лактат и подобные соли органических кислот.
Соль по карбоксильной группе может быть неорганической или органической солью, и ее примеры включают соль лития, соль натрия, соль калия и подобные соли щелочных металлов, соль магния, соль кальция и подобные соли щелочно-земельных металлов, соль аммония или соль триэтиламина, соль N-метилглюкамина, соль трис-(гидроксиметил)аминометана и тому подобное.
Кроме того, данные свободная форма, аддитивные соли кислоты и соли по карбоксильной группе соединения по изобретению могут находиться в виде гидратов.
С другой стороны, хинолоновое производное, в котором фрагмент карбоновой кислоты является сложным эфиром, полезно в качестве промежуточного соединения при синтезе или пролекарства. Например, алкиловые, бензиловые, алкоксиалкиловые, фенилалкиловые и фениловые сложные эфиры полезны в качестве промежуточных соединений при синтезе.
Кроме того, в качестве пролекарства следует использовать сложный эфир, который легко гидролизуется в живом организме, и образует свободную карбоновую кислоту, и его примеры включают ацетоксиметиловый эфир, пивалоилоксиметиловый эфир, этоксикарбониловый эфир, холиновый эфир, диметиламиноэтиловый эфир, 5-инданиловый эфир, фталидиниловый эфир, и 5-алкил-2-оксо-1,3-диоксол-4-илметиловый, 3-ацетокси-2-оксобутиловый и подобный оксоалкиловый сложный эфир.
Соединение по изобретению, представленное формулой (I), можно получить различными способами, и в предпочтительном примере его можно получить, например, при взаимодействии соединения, представленного формулой (III):
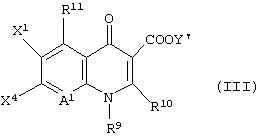
[в которой X4 представляет заместитель, который функционирует в качестве уходящей группы, такой как атом фтора, атом хлора, атом брома, замещенный или незамещенный фенилсульфонил или замещенный или незамещенный алкилсульфонил, имеющий от 1 до 3 атомов углерода,
Y1 представляет Y, имеющий значения, определенные для формулы (I), или борсодержащую группу, представленную формулой (IV):
-B(Y)11Y12 (IV)
(в которой Y11 и Y1, каждый представляет атом фтора или алкилкарбонилокси, имеющий от 2 до 4 атомов углерода), и R9, R10, R11, А1 и X1 имеют значения, определенные для формулы (I)]
или соединения, представленного формулой (V):
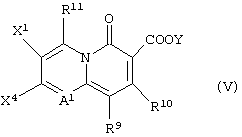
[в которой X4 представляет заместитель, который функционирует в качестве уходящей группы, такой как атом фтора, атом хлора, атом брома, замещенный или незамещенный фенилсульфонил или замещенный или незамещенный алкилсульфонил, имеющий от 1 до 3 атомов углерода, и R9, R10, R11, А1, X1 и Y имеют значения, определенные для формулы (I)]
с соединением, представленным следующей формулой (VI)
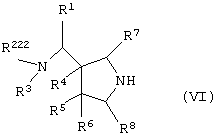
[в которой R222 является одинаковым с R2, имеющим значения, определенные для формулы (I)], и R1, R3, R4, R5, R6, R7 и R8 имеют значения, определенные для формулы I, или его аддитивной солью.
Реакцию можно проводить с использованием и без использования растворителя. Растворителем, который используется в реакции, может быть любой растворитель, который является инертным в условиях реакции, и его примеры включают диметилсульфоксид, пиридин, ацетонитрил, этанол, хлороформ, диметилформамид, диметилацетамид, N-метилпирролидон, тетрагидрофуран, вода и 3-метоксибутанол или их смеси.
Предпочтительно проводить реакцию в присутствии рецептора кислоты, такого как неорганическое основание или органическое основание, и его примеры включают карбонат или бикарбонат щелочного металла или щелочно-земельного металла или триэтиламин, пиридин, 1,8-диазабициклоундецен, N,N-диизопропилэтиламин или подобное органическое основное соединение.
Реакцию можно проводить в основном при температуре от комнатной температуры до 200° С, предпочтительно от 25 до 150° С. Реакцию проводят в течение периода времени от 30 мин до 48 ч и заканчивают в основном спустя примерно 30 мин-2 ч.
Что касается аминозащитной группы, то она может быть любой защитной группой, обычно используемой в данной области, и ее примеры включают трет-бутоксикарбонил, 2,2,2-трихлор-этоксикарбонил и подобные (замещенные)алкоксикарбонильные группы; бензилоксикарбонил, пара-метоксибензилоксикарбонил, пара-нитробензилоксикарбонил и подобные (замещенные) аралкилоксикарбонильные группы; ацетил, метоксиацетил, трифторацетил, хлорацетил, пивалоил, формил, бензоил и подобные (замещенные)ацильные группы; трет-бутил, бензил, пара-нитробензил, пара-метоксибензил, трифенилметил и подобные (замещенные)алкильные группы или (замещенные)аралкильные группы; метоксиметил, трет-бутоксиметил, тетрагидропиранил, 2,2,2-трихлорэтоксиметил и подобные (замещенные)простые эфиры; и триметилсилил, изопропилдиметилсилил, трет-бутилдиметилсилил, трибензилсилил, трет-бутилдифенилсилил и подобные (алкил и/или аралкил)замещенные силильные группы.
Когда каждый из Y и Y1 представляет алкил, имеющий от 1 до 6 атомов углерода, алкоксиметил, имеющий от 2 до 7 атомов углерода, или фенилалкил, состоящий из алкилена, имеющего от 1 до 6 атомов углерода, и фенила, его можно превратить в соответствующую карбоновую кислоту обработкой его в кислых или основных условиях, которые обычно используются для гидролиза эфиров карбоновых кислот.
Когда Y1 представляет структуру формулы (IV), ее превращение в соответствующую карбоновую кислоту можно проводить при взаимодействии соединения (III) или соединения (V) с соединением (VI) и затем обработкой в кислых или основных условиях.
Кроме того, когда необходимо снятие защиты, интересующее соединение, представленное формулой (I), можно получить удалением защитной группы в условиях, подходящих для данной защитной группы.
Соединение формулы (VI) можно получить различными способами, например, его можно синтезировать способом, представленным в ссылочных примерах в качестве предпочтительного примера, но не ограничиваясь этим.
Соединение формулы (VI) можно получить удалением Q' из соединения, представленного следующей формулой
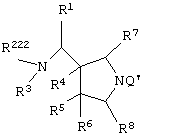
[в которой R222 является одинаковым с R2, имеющим значения, определенные для формулы (I), или представляет аминозащитную группу, R1, R3, R4, R5, R6, R7 и R8 имеют значения, определенные для формулы (I),
Q' представляет аминозащитную группу,
где аминозащитная группа может быть выбрана из группы, состоящей из (замещенного)алкоксикарбонила, (замещенного)аралкилоксикарбонила, (замещенного)ацила, (замещенного)алкила, (замещенного)аралкила и замещенных силильных групп].
Соединение, описанное выше, может находиться в виде его соли, его гидрата или гидрата соли. В качестве примеров аддитивных солей кислоты можно привести соль неорганической кислоты и соль органической кислоты. Их иллюстративные примеры включают гидрохлорид, сульфат, гидробромид, гидройодид, фосфат и подобные соли неорганических кислот или метансульфонат, бензолсульфонат, толуолсульфонат (соли сульфоновой кислоты), ацетат, цитрат, малеат, фумарат, лактат (соли карбоновых кислот) и подобные соли органических кислот.
Когда R222 и Q' представляют аминозащитные группы, то они могут быть одинаковыми или различными, но подходящи для получения соединения (I), чтобы каждая удалялась при различных реакционных условиях,
Можно привести следующие примеры для R222 и Q' в качестве аминозащитных групп. Т.е. они представляют (замещенный)алкоксикарбонил, (замещенный)аралкилоксикарбонил, (замещенный)ацил, (замещенный)алкил, (замещенный)аралкил и замещенные силильные группы.
Их иллюстративные примеры включают трет-бутоксикабонил, 1,2,2-трихлорэтоксикарбонил и подобные (замещенные)алкоксикарбонильные группы; бензилоксикарбонил, пара-метоксибензилоксикарбонил, пара-нитробензилоксикарбонил и подобные (замещенные)аралкилоксикарбонильные группы; ацетил, метоксиацетил, трифторацетил, хлорацетил, пивалоил, формил, бензоил и подобные (замещенные)ацильные группы; трет-бутил, бензил, пара-нитробензил, пара-метоксибензил, трифенилметил и подобные (замещенные)алкильные группы или (замещенные)аралкильные группы; метоксиметил, трет-бутоксиметил, тетрагидропиранил, 2,2,2-трихлорэтоксиметил и подобные (замещенные)простые эфиры; триметилсилил, изопропилдиметилсилил, трет-бутилдиметилсилил, трибензилсилил, трет-бутилдифенилсилил и подобные замещенные силильные группы.
Когда соединение (I) получают, используя указанное выше соединение, имеющее Q' в качестве защитной группы, необходимо проводить реакцию удаления защитной группы Q'. В данном случае его взаимодействие с соединением (III) или (V) можно проводить в основном в одном реакторе или взаимодействие можно проводить сразу же после выделения соединения (VI) удалением защитной группы.
Цис-2-фторциклопропиламин, состоящий из одного изомера, который является предпочтительным для синтеза соединения формулы (I), состоящего из одного изомера, можно синтезировать, например, способом, описанным в JP-A-2-231475 (термин “JP-A”, использованный здесь, означает “не прошедшую экспертизу опубликованную заявку на патент Японии). Синтез соединения формулы (I), состоящего из одного изомера, с использованием оптически активного производного цис-2-фторциклопропиламина, полученного таким образом в качестве исходного соединения, можно проводить способом, описанным, например в JP-A-2-231475.
Поскольку соединение по изобретению обладает высоким антибактериальным действием, оно может быть полезным в качестве лекарственных средств для применения на людях, животных и рыбах или в качестве консервантов сельскохозяйственных химикатов и продуктов питания,
Когда соединение по изобретению применяется в качестве лекарственного средства для людей, его доза находится в пределах от 50 мг до 1 г, предпочтительно от 100 мг до 500 мг в день для взрослого человека.
Кроме того, его доза для применения на животных варьирует в зависимости от цели его назначения (лечение или профилактика), вида и размера каждого животного, которое подвергается лечению, и вида и количества каждых инфекционных патогенных бактерий, но в основном находится в пределах от 1 до 200 мг, предпочтительно от 5 до 100 мг на 1 кг массы тела каждого животного в качестве суточной дозы.
Суточную дозу вводят один раз в день или ее делят на 2-4 дозы в день. Если того требуют обстоятельства, суточная доза может быть выше указанного предела.
Поскольку соединение по изобретению является активным против широкого ряда микроорганизмов, которые вызывают различные инфекционные заболевания, оно может лечить, предупреждать или ослаблять заболевания, вызываемые данными патогенами.
В качестве примеров бактерий или бактериоподобных микроорганизмов, в отношении которых эффективно соединение по изобретению, можно привести род Staphylococcus, Streptococcus pyogens, гемолитические стрептококки, энтерококки, пневмококки, род Peptostreptococcus, Neisseria gonorrhoeae, Escherichia coli, рода Citrobacter, род Shigelia, Klebsiella pneumoniae, рода Enterobacter, род Serratia, род Proteus, Pseudomonas aeruginosa, Haemophilus influenzae, род Acinetobacter, род Campylobacter, Chlamydia trachomatis и тому подобное.
Кроме того, в качестве примеров заболеваний, вызываемых данными патогенами, можно привести фолликулит, фурункул, карбункул, рожу, флегмону, лимфангит, панариций, подкожный абсцесс, гидраденит, шаровидные угри, инфекционную атерому, околоректальный абсцесс, мастит, поверхностные вторичные инфекции после травмы, ожоговую травму, операционную рану и тому подобное, фарингит, острый бронхит, тонзиллит, хронический бронхит, бронхоэктаз, диффузный бронхолитиаз, вторичную инфекцию при хроническом респираторном заболевании, пневмонию, пиелонефрит, цистит, простатит, эпидидимит, гонококковый уретрит, неспецифический уретрит, холецистит, холангит, бациллярную дизентерию, энтерит, воспаление придатков матки, внутриматочную инфекцию, бартолинит, блефарит, ячмень, дакриоцистит, тарзаденит, язву роговицы, воспаление среднего уха (octitis media), синусит, периодентит, перикоронит, инфекцию челюсти, перитонит, эндокардит, сепсис, менингит, кожную инфекцию и тому подобное.
Оно также эффективно против различных микроорганизмов, которые вызывают инфекционные заболевания у животных, таких как род Escherichia, род Salmonella, род Pasteurella, род Haemophilus, род Bordetella, род Staphylococcus, род Mycoplasma и тому подобное.
Иллюстративные примеры таких заболеваний включают колибактериоз, пуллуроз, паратиф птиц, холера птиц, контагиозный катар верхних дыхательных путей, стафилококкоз, инфекцию, вызываемую микоплазмами, и тому подобное в случае птиц, колибактериоз, салмонеллез, пастереллез, инфекцию, вызываемую бактериями Haemophilus, атрофический ринит, экссудативный эпидермит, инфекцию, вызываемую микоплазмами, и тому подобное в случае свиней, колибактериоз, салмонеллез, геморрагический сепсис, инфекцию, вызываемую микоплазмами, плевропневмонию крупного рогатого скота, мастит у коров и тому подобное в случае крупного рогатого скота, колисепсис, салмонеллез, геморрагический сепсис, эмпиему матки, цистит и тому подобное в случае собак и экссудативный плеврит, цистит, хронический ринит, инфекцию, вызываемую бактериями Haemophilus, диарею у котят, инфекцию, вызываемую микоплазмами, и тому подобные в случае кошек.
Антибактериальную композицию, которая включает соединение по изобретению, можно получить при выборе соответствующей композиции в зависимости от каждого способа введения и при использовании обычно применяемых способов получения. Что касается лекарственной формы антибактериальной композиции, в которой используется соединение по изобретению в качестве ее действующего начала, то в качестве примеров для перорального введения можно привести таблетки, порошки, гранулы, капсулы, растворы, сиропы, эликсиры, масляные или водные суспензии и тому подобное. Что касается инъекций, то в данной композиции можно использовать стабилизирующий агент, антисептик и солюбилизирующий агент или раствор, возможно содержащий указанные вспомогательные агенты, который может находиться в контейнере и быть превращен в твердую композицию сушкой вымораживанием или подобным образом, которую перед использованием следует растворить повторно. Кроме того, единичная доза может находиться в отдельном контейнере или в том же контейнере могут находиться многократные дозы.
Кроме того, в качестве примера композиции для наружного применения можно привести растворы, суспензии, эмульсии, мази, гели, кремы, примочки, спреи и тому подобное.
Твердые композиции могут содержать фармацевтически приемлемые добавки вместе с активным соединением, и они могут быть приготовлены, например, смешением соединения с добавками, необязательно выбранными из наполнителей, разбавителей, связующих веществ, дузинтеграторов, усиливающих солюбилизацию агентов, увлажняющих, смазывающих агентов и тому подобное.
В качестве примеров жидких композиций можно привести растворы, суспензии, эмульсии и тому подобное, которые могут включать в качестве добавок суспендирующий агент, эмульгатор и тому подобное.
Примеры способа введения соединения по изобретению животным включают способ, при котором его вводят перорально непосредственно или при смешении с кормом, способ, при котором из него готовят раствор и затем вводят перорально непосредственно или при смешении с водой для питья или кормом, и способ, при котором его вводят инъекцией. Что касается фармацевтических композиций для введения соединения по изобретению животным, то его можно необязательно включать в порошки, мелкие частицы, растворимые порошки, сиропы, растворы и инъекционные растворы с использованием способов, обычно применяемых в данной области.
Примеры фармацевтических композиций приводятся в табл.1
Наилучший способ осуществления изобретения
Последующее описывает изобретение, основываясь на примерах по изобретению и ссылочных примерах, хотя изобретение не ограничивается ими.
[Ссылочный пример 1]
N-Метил-N-метокси-1-[1-(R)-фенилэтил]-5-оксопирролидин-3-(R)-карбоксамид
При охлаждении льдом добавляли оксалилхлорид (6,54 мл, 0,075 мл) и диметилформамид (3 капли) к раствору 1-[1-(R)-фенилэтил]-5-оксопирролидин-3-(R)-карбоновой кислоты (11,66 г, 0,05 моль) в дихлорметане (200 мл) и перемешивали в течение ночи при комнатной температуре. После отгонки растворителя при пониженном давлении добавляли толуол (100 мл) и растворитель вновь отгоняли при пониженном давлении. Остаток смешивали с дихлорметаном (200 мл) и гидрохлоридом N,O-метилгидроксиламина (5,47 г, 0,055 моль), к смеси добавляли по каплям раствор триэтиламина (17,4 мл, 0,125 моль) в дихлорметане (50 мл) и смесь перемешивали при охлаждении льдом в течение 15 мин. Последнюю перемешивали при охлаждении льдом в течение 30 мин и затем перемешивали при комнатной температуре 3 ч. Реакционный раствор промывали 10% водным раствором лимонной кислоты (100 мл), водой (100 мл) и насыщенным водным раствором бикарбоната натрия (100 мл) в данном порядке и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью хлороформ: метанол от (50:1) до (20:1) получали 11,32 г (82%) указанного в заголовке соединения в виде коричневого масла.
1H-ЯМР (400 МГц, СDСl3)δ : 1,54 (3Н, д, J=6,84 Гц), 2,65 (1Н, дд, J=9,77, 7,09 Гц), 2,77 (1Н, дд, J=8,79, 7,09 Гц), 3,12-3,18 (1Н, м), 3,20 (3Н, с), 3,37-3,48 (1Н, м), 3,55-3,64 (1H, м), 3,65 (3Н, с), 5,50 (1H, kb, J=6,84 Гц), 7,28-7,37 (5Н, м).
[Ссылочный пример 2]
4-(R)-Фенилкарбонил-1-[1-(R)-фенилэтил]-2-пирролидон
В атмосфере азота фенилмагнийбромид (3 моль/л раствор в диэтиловом эфире, 15 мл) добавляли по каплям к раствору N-метил-N-метокси-1-[1-(R)-фенилэтил]-5-оксопирролидин-3-(R)-карбоксамида (2,49 г, 9,0 ммоль) в тетрагидрофуране (50 мл) и смесь перемешивали при комнатной температуре в течение 30 мин. Реакционный раствор смешивали с 1 моль/л соляной кислотой (50 мл) при охлаждении льдом и затем экстрагировали этилацетатом (8 мл × 2). Органический слой промывали насыщенным раствором соли (100 мл) и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан:этилацетат (1:1) получали 2,36 г (89%) указанного в заголовке соединения в виде светлого желтого масла.
1H-ЯМР (400 МГц, СDСl3)δ : 1,55 (3Н, д, J=6,83 Гц), 2,79 (1Н, дд, J=17,09, 9,77, Гц), 2,81 (1Н, дд, J=17,09, 7,81 Гц), 3,23 (1Н, дд, J=9,76, 8,79 Гц), 3,71 (1Н, дд, J=9,76, 6,35 Гц), 3,97-4,05 (1Н, м), 5,54 (1Н, kb, J=6,83 Гц), 7,27-7,38 (5Н, м), 7,42-7,50 (2Н, м), 7,55-7,61 (1Н, м), 7,88-7,90 (2Н, м).
[Ссылочный пример 3]
4-(R)-[1-Гидрокси-1-фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидон [F1], [F2]
При охлаждении льдом боргидрид натрия (280 мг) добавляли к раствору 4-(R)-фенилкарбонил-1-[1-(R)-фенилэтил]-2-пирролидона (2,17 г, 7,40 ммоль) в безводном этаноле (40 мл) и смесь перемешивали при той же температуре в течение 1 ч. Реакционный раствор смешивали с 10% лимонной кислотой (50 мл) при охлаждении льдом и затем этанол отгоняли при пониженном давлении. Остаток экстрагировали хлороформом (80 мл× 2), органический слой промывали насыщенным раствором соли (100 мл) и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан:этилацетат (1:3) до этилацетата (100%) получали соответственно 892 мг (41%) указанного в заголовке соединения с низкой полярностью [F1] и затем 1,163 г (53%) указанного в заголовке соединения с высокой полярностью [F2] в виде светлого желтого масла.
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,46 (3Н, д, J=6,84 Гц), 2,03-2,14 (2Н, м), 2,44-2,54 (1Н, м), 3,05-3,09 (1H, м), 3,36-3,40 (1Н, м), 3,47 (1H, уш.с), 4,45 (1Н, д, J=7,81 Гц), 5,38 (1H, kb, J=6,84 Гц), 7,22-7,31 (10Н, м).
[F2];
1H-ЯМР (400 МГц, CDCl3)δ : 1,37 (ЗН, д, J=7,32 Гц), 2,26-2,32 (1H, м), 2,40-2,55 (2Н, м), 2,73-2,77 (1H, м), 3,00-3,04 (1H, м), 4,32 (1H, уш.с), 4,42 (1H, д, J=6,8 Гц), 5,33 (1H, kb, J=7,32 Гц), 7,15-7,27 (10Н, м).
[Ссылочный пример 4]
4-(R)-[1-Азидо-1-фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидон [F1], [F2]
При охлаждении льдом триэтиламин (0,46 мл) и метансульфонилхлорид (217 мкл, 2,80 ммоль) добавляли к раствору 4-(R)-[1-гидрокси-1-фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (738 мг, 2,50 ммоль) в дихлорметане (10 мл) и смесь перемешивали при той же температуре в течение 1 ч. Реакционный раствор смешивали с 10% лимонной кислотой (20 мл) при охлаждении льдом и экстрагировали хлороформом (30 мл × 2). Органический слой промывали насыщенным раствором соли (100 мл) и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, полученный остаток растворяли в N,N-диметилформамиде (10 мл), смешивали с азидом натрия (488 мг, 7,50 ммоль) и затем нагревали при 60° С в течение 1,5 ч. После самопроизвольного охлаждения реакционный раствор смешивали с водой (50 мл) и экстрагировали этилацетатом (70 мл × 3), органический слой промывали насыщенным раствором соли (150 мл) и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан: этилацетат (3:2) получали 701 мг (87%) указанного в заголовке соединения в виде бесцветного масла.
Аналогичную реакцию проводили исходя из 4-(R)-[1-гидрокси-1-фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (77%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,46 (3Н, д, J=7,32 Гц), 2,53-2,66 (3Н, м), 2,82 (1Н, дд, J=9,76, 7,81 Гц), 2,94 (1Н, дд, J=9,76, 5,86 Гц), 4,37 (1Н, д, J=7,81 Гц), 5,47 (1H, kb, J=7,32 Гц), 7,21-7,42 (10Н, м).
[F2];
1Н-ЯМР (400 МГц, СDСl3)δ : 1,54 (3Н, д, J=7,33 Гц), 2,14 (1H, дд, J=17,09, 7,81 Гц), 2,26 (1H, дд, J=17,09, 8,78 Гц), 2,55-2,65 (1H, м), 3,14 (1H, дд, J=10,26, 7,81 Гц), 3,32 (1H, дд, J=10,26, 6,34 Гц), 4,36 (1H, д, J=9,28 Гц), 5,49 (1H, kb, J=7,33 Гц), 7,26-7,43 (10Н, м).
[Ссылочный пример 5]
4-(R)-[1-Трет-бутоксикарбониламино-1-фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидон [F1], [F2]
Раствор 4-(R)- [1-азидо-1-фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (641 мг, 2,0 ммоль) в этаноле (30 мл) смешивали с катализатором 10% палладием на угле (влажность 53,8%, 600 мг) и проводили каталитическое гидрирование при комнатной температуре в течение 6 ч при нормальном давлении. Реакционный раствор фильтровали и растворитель отгоняли при пониженном давлении. Остаток растворяли в дихлорметане (20 мл), смешивали с ди-трет-бутилдикарбонатом (655 мг) и триэтиламином (560 мкл) и затем перемешивали при комнатной температуре в течение 13 ч. К реакционному раствору добавляли хлороформ (50 мл), промывали 10% лимонной кислотой (8 мл) и водой (8 мл) и полученный органический слой сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан: этилацетат от (1:1) до (2:3) получали 629 мг (80%) указанного в заголовке соединения в виде бесцветного масла.
Аналогичную реакцию проводили исходя из 4-(R)-[1-азидо-1-фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (76%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,41 (9Н, с), 1,46 (3Н, д, J=7,32 Гц), 2,47-2,76 (3Н, м), 2,76-2,89 (1Н, м), 2,95-3,08 (1Н, м), 4,62-4,73 (1Н, м), 4,99-5,11 (1Н, м), 5,47 (1Н, kb, J=7,32 Гц), 7,20-7,34 (10Н, м).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,37 (9Н, с), 1,51 (3Н, д, J=7,32 Гц), 2,08-2,26 (2Н, м), 2,52-2,65 (1Н, м), 3,06-3,18 (1Н, м), 3,24-3,32 (1Н, м), 4,52-4,66 (1Н, м), 5,01-5,11 (1Н, м), 5,47 (1Н, kb, J=7,32 Гц), 7,19-7,35 (10Н, м).
[Ссылочный пример 6]
3-(R)-[1-Трет-бутоксикарбониламино-1-фенилметил]-1-[1-(R)-фенилэтил]пирролидин [F1]
В атмосфере азота 1М комплекс боран-тетрагидрофуран (4,6 мл) добавляли по каплям к раствору 4-(R)-[1-трет-бутоксикарбониламино-1-фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (600 мг, 1,52 ммоль) в тетрагидрофуране (10 мл) при охлаждении льдом и затем смесь перемешивали при комнатной температуре в течение 13 ч. После отгонки растворителя при пониженном давлении полученный остаток смешивали с 80% водным этанолом (15 мл) и триэтиламином (3 мл) и кипятили с обратным холодильником в течение 5 ч. После самопроизвольного охлаждения растворитель отгоняли при пониженном давлении и к полученному остатку добавляли хлороформ (30 мл). Последнее промывали водой (10 мл) и насыщенным раствором соли (10 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью хлороформ:метанол (20:1) получали 510 мг (88%) указанного в заголовке соединения в виде бесцветных кристаллов.
Аналогичную реакцию проводили исходя из 4-(R)-[1-трет-бутоксикарбониламино-1-фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (86%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,34 (3Н, д, J=6,35 Гц), 1,47 (9Н, с), 1,60-1,78 (2Н, м), 2,18-2,39 (3Н, м), 2,42-2,54 (1Н, м), 2,83-2,95 (1Н, м), 3,11 (1Н, kb, J=6,35 Гц), 4,47-4,57 (1Н, м), 6,06-6,18 (1Н, м), 7,16-7,33 (10Н, м).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,41 (3Н, д, J=6,35 Гц), 1,46 (9Н, с), 1,67-1,78 (1Н, м), 1,89-2,02 (1Н, м), 2,04-2,17 (1Н, м), 2,17-2,28 (1Н, м), 2,37-2,50 (2Н, м), 3,01-3,19 (2Н, м), 4,48-4,58 (1Н, м), 6,62-6,73 (1Н, м), 7,07-7,34 (10Н, м).
[Ссылочный пример 7]
3-(R)-[1-Трет-бутоксикарбониламино-1-фенилметил]пирролидин [F1]
Раствор 3-(R)-[1-трет-бутоксикарбониламино-1-фенилметил]-1-[1-(R)-фенилэтил]пирролидина [F1] (495 мг, 1,30 ммоль) в этаноле (20 мл) смешивали с катализатором 10% палладием на угле (влажность 53,8%, 500 мг) и проводили каталитическое гидрирование при нормальном давлении в течение 4 ч при одновременном нагревании при температуре 50° С. Фильтрованием реакционного раствора и отгонкой растворителя получали 359 мг (количественно) сырого указанного в заголовке соединения в виде бесцветных кристаллов. Последнее использовали на следующей стадии без очистки.
Аналогичную реакцию проводили исходя из 3-(R)-[1-трет-бутоксикарбониламино-1-фенилметил]-1-[1-(R)-фенилэтил]пирролидина [F2] (количественно).
[Пример по изобретению 1]
5-Амино-7-[3-(R)-(1-амино-1-фенилметил)-1-пирролидинил]-6,8-дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота [F1]
3-(R)-[1-Трет-бутоксикарбониламино-1-фенилметил] пирролидин [F1] (332 мг, 1,2 ммоль) добавляли к суспензии 5-амино-6,1,8-трифтор-1-[2-(S)-фтор-1-(S)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (316 мг, 1,0 ммоль) в ацетонитриле (15 мл) и смесь кипятили с обратным холодильником в течение 14 ч в присутствии триэтиламина (2 мл). После самопроизвольного охлаждения растворитель отгоняли при пониженном давлении и полученный остаток растворяли в хлороформе (50 мл). Последнее промывали 10% лимонной кислотой (30 мл × 2) и насыщенным раствором соли (20 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, полученный остаток смешивали с концентрированной соляной кислотой (15 мл) и перемешивали при комнатной температуре в течение 10 мин. Данный солянокислый раствор промывали хлороформом (20 мл × 3), доводили до щелочной реакции добавлением 30% водного раствора гидроксида натрия при охлаждении льдом и затем перемешивали при комнатной температуре в течение 1 ч. Данную суспензию доводили до рН 7,6 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (100 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Последнее очищали перекристаллизацией из смеси этанол-диэтиловый эфир с получением 241 мг (51%) указанного в заголовке соединения в виде светлых желтых кристаллов.
1Н-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,28-1,43 (2Н, м), 1,53-1,66 (1Н, м), 2,16-2,28 (1Н, м), 2,31-2,42 (1Н, м), 2,86-2,96 (1Н, м), 3,09-3,20 (1H, м), 3,39-3,50 (2Н, м), 3,58-3,70 (2Н, м), 4,64-4,71 (0,5Н, м), 4,78-4,96 (0,5Н, м), 7,27-7,40 (5Н, м), 8,10 (1H, с).
Точка плавления: 111,8-114,3° С (с разложением).
Элементный анализ: для С24Н23F3N4O3·0,25Н2O
Вычислено: С, 60,44; Н, 4,97; N, 11,75.
Найдено: С, 60,31; Н, 4,92; N, 11,74.
[Пример по изобретению 2]
5-Амино-7-[3-(R)-(1-амино-1-фенилметил)-1-пирролидинил]-6,8-дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота [F2]
3-(R)-[1-Трет-бутоксикарбониламино-1-фенилметил]пирролидин [F2] (332 мг, 1,2 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(S)-фтор-1-(S)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (316 мг, 1,0 ммоль) в ацетонитриле (15 мл) и смесь кипятили с обратным холодильником в течение 14 ч в присутствии триэтиламина (2 мл). После самопроизвольного охлаждения растворитель отгоняли при пониженном давлении и полученный остаток растворяли в хлороформе (50 мл). Полученное промывали 10% лимонной кислотой (30 мл× 2) и насыщенным раствором соли (20 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, полученный остаток смешивали с концентрированной соляной кислотой (15 мл) и перемешивали при комнатной температуре в течение 10 мин. Данный солянокислый раствор промывали хлороформом (20 мл × 3), доводили до щелочной реакции добавлением 30% водного раствора гидроксида натрия при охлаждении льдом и затем перемешивали при комнатной температуре в течение 1 ч. Данную суспензию доводили до рН 7,6 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (100 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Последнее очищали перекристаллизацией из смеси этанол-диэтиловый эфир с получением 388 мг (82%) указанного в заголовке соединения в виде светлых желтых кристаллов.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,19-1,58 (5Н, м), 2,27-2,43 (1Н, м), 3,27-3,41 (1Н, м), 3,46-3,74 (4Н, м), 4,71-5,12 (1Н, м), 7,21-7,41 (5Н, м), 8,18 (1Н, с).
Точка плавления: 202,3-205,1° С (с разложением).
Элементный анализ: для C24H23F3N4O3·0,25H2O
Вычислено: С, 60,44; Н, 4,97; N, 11,75.
Найдено: С, 60,31; Н, 4,89; N, 11,84.
[Пример по изобретению 3]
7-[3-(R)-(1-Амино-1-фенилметил)-1-пирролидинил]-6-фтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-8-метокси-4-оксохинолин-3-карбоновая кислота [F2]
3-(R)-[1-Трет-бутоксикарбониламино-1-фенилметил]пирролидин [F2] (304 мг, 1,1 ммоль) и триэтиламин (0,42 мл) добавляли к раствору BF2 хелата 6,7-дифтор-1-[2-(3)-фтор-1-(R)-циклопропил]-1,4-дигидро-8-метокси-4-оксохинолин-3-карбоновой кислоты (325 мг, 0,9 ммоль) в диметилсульфоксиде (3 мл) и смесь перемешивали при 30° С в течение 19 ч. Растворитель отгоняли при пониженном давлении, полученный остаток смешивали с 80% водным этанолом (10 мл) и триэтиламином (2 мл) и кипятили с обратным холодильником в течение 3 ч. После самопроизвольного охлаждения растворитель отгоняли, полученный остаток смешивали с хлороформом (50 мл), промывали 10% лимонной кислотой (40 мл × 2) и водой (50 мл), сушили над безводным сульфатом натрия и затем растворитель отгоняли. Полученный остаток смешивали с концентрированной соляной кислотой (10 мл) и перемешивали при комнатной температуре в течение 10 мин/ затем полученный водный слой промывали хлороформом (20 мл × 3) и подщелачивали добавлением 30% водного раствора гидроксида натрия при охлаждении льдом. Последний доводили до рН 7,6 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (80 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Последнее очищали перекристаллизацией из этанола с получением 294 мг (70%) указанного в заголовке соединения в виде светлых желтых кристаллов.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,23-1,61 (5Н, м), 2,42-2,57 (1Н, м), 3,32-3,44 (1Н, м), 3,51 (3Н, с), 3,54-3,64 (1Н, м), 3,69-3,79 (2Н, м), 3,93-4,03 (1Н, м), 4,85-4,93 (0,5Н, м), 4,99-5,09 (0,5Н, м), 7,26-7,44 (5Н, м), 7,65 (1Н, д, J=14,16 Гц), 8,40 (1Н, с).
Точка плавления: 141,8-144,2° С (с разложением).
Элементный анализ: для С25H25F2N3O4·0,5H2O
Вычислено: С, 62,75; Н, 5,48; N, 8,78.
Найдено: С, 63,00; Н, 5,35; N, 8,78.
[Пример по изобретению 4]
10-[3-(R)-(1-Амино-1-фенилметил)-1-пирролидинил]-9-фтор-2,3-дигидро-3-(S)-метил-7-оксо-7Н-пиридо[1,2,3-de][1,4]бензоксазин-6-карбоновая кислота [F2]
3-(R)-[1-Трет-бутоксикарбониламино-1-фенилметил] пирролидин [F2] (304 мг, 1,1 ммоль) и триэтиламин (0,42 мл) добавляли к раствору BF2 хелата 9,10-дифтор-2,3-дигидро-3-(S)-метил-7-оксо-7Н-пиридо[1,2,3-de][1,4]бензоксазин-6-карбоновой кислоты (296 мг, 0,9 ммоль) в диметилсульфоксиде (3 мл) и смесь перемешивали при 30° С в течение 19 ч. Растворитель отгоняли при пониженном давлении и полученный остаток смешивали с 80% водным этанолом (10 мл) и триэтиламином (2 мл) и кипятили с обратным холодильником в течение 3 ч. После самопроизвольного охлаждения растворитель отгоняли, полученный остаток смешивали с хлороформом (50 мл), промывали 10% лимонной кислотой (40 мл × 2) и водой (50 мл), сушили над безводным сульфатом натрия и затем растворитель отгоняли. Полученный остаток смешивали с концентрированной соляной кислотой (10 мл) и перемешивали при комнатной температуре в течение 10 мин, затем полученный водный слой промывали хлороформом (20 мл × 3) и подщелачивали добавлением 30% водного раствора гидроксида натрия при охлаждении льдом, Последний доводили до рН 7,6 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (80 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Последнее очищали перекристаллизацией из этанола с получением 158 мг (40%) указанного в заголовке соединения в виде светлых желтых кристаллов,
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,35-1,61 (5Н, м), 2,48-2,61 (1Н, м), 3,29-3,38 (1Н, м), 3,53-3,77 (4Н, м), 4,21-4,29 (1Н, м), 4,41-4,48 (1H, м), 4,52-4,61 (1Н, м), 7,28-7,42 (5Н, м), 7,51 (1Н, д, J=13,18 Гц), 8,32 (1Н, с).
Точка плавления: 169,3-171,0° С (с разложением).
Элементный анализ: для С24Н24FN3O4·0,25Н2О
Вычислено: С, 65,22; Н, 5,59; N, 9,51.
Найдено: С, 65,50; Н, 5,50; N, 9,52.
[Пример по изобретению 5]
5-Амино-7-[3-(R)-(1-амино-1-фенилметил)-1-пирролидинил]-6-фтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновая кислота [F2]
3-(R)-[1-Трет-бутоксикарбониламино-1-фенилметил] пирролидин [F2] (414 мг, 1,5 ммоль) и триэтиламин (2 мл) добавляли к раствору 5-амино-6,7-дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-6-метил-4-оксохинолин-3-карбоновой кислоты (312 мг, 1,0 ммоль) в диметилсульфоксиде (3 мл) и смесь перемешивали при 130° С в течение 5 суток в атмосфере азота. Растворитель отгоняли и полученный остаток смешивали с хлороформом (60 мл), промывали 10% лимонной кислоты (40 мл × 2), сушили над безводным сульфатом натрия и затем растворитель отгоняли. Полученный остаток смешивали с концентрированной соляной кислотой (10 мл) и перемешивали при комнатной температуре в течение 10 мин, затем полученный водный слой промывали хлороформом (30 мл × 3) и подщелачивали добавлением 30% водного раствора гидроксида натрия при охлаждении льдом. Последний доводили до рН 7,6 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (80 мл × 3). Полученный органический слой сушили над сульфатом натрия, растворитель отгоняли и затем полученный остаток подвергали препаративной ТСХ. Последний подвергали разделению и очистке развитием в нижнем слое из смеси хлороформ:метанол:вода=7:3:1, получив тем самым 148 мг (32%) сырого указанного в заголовке соединения. Последнее очищали перекристаллизацией из смеси этанол-гексан с получением 79 мг (17%) указанного в заголовке соединения в виде светлых желтых кристаллов.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 0,90-1,09 (2Н, м), 1,22-1,51 (3Н, м), 2,16 (3Н, с), 2,34-2,49 (1Н, м), 2,99-3,09 (1Н, м), 3,35-3,46 (1Н, м), 3,42-3,62 (1Н, м), 3,62-3,73 (1Н, м), 3,78-3,89 (1Н, м), 4,79-4,88 (0,5Н, м), 4,94-5,04 (0,5Н, м), 7,22-7,41 (5Н, м), 8,26 (1H, с).
Точка плавления: 179,4-183,6° С (с разложением).
Элементный анализ: для С25Н26F2N4O3
Вычислено: С, 64,09; Н, 5,59; N, 11,96.
Найдено: С, 63,91; Н, 5,40; N, 11,96.
[Пример по изобретению 6]
7-[3-(R)-(1-Амино-1-фенилметил)-1-пирролидинил]-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-8-метокси-4-оксохинолин-3-карбоновая кислота [F2]
3-(R)-[1-Трет-бутоксикарбониламино-1-фенилметил]пирролидин [F2] (304 мг, 1,1 ммоль) и триэтиламин (1 мл) добавляли к раствору 7-фтор-1-[2-(8)-фтор-1-(R)-циклопропил] -1,4-дигидро-8-метокси-4-оксохинолин-3-карбоновой кислоты (266 мг - 0,9 ммоль) в диметилсульфоксиде (5 мл) и смесь перемешивали при 100° С в течение 14 ч. Растворитель отгоняли при пониженном давлении, полученный остаток смешивали с хлороформом (50 мл), промывали 10% лимонной кислотой (40 мл × 2) и водой (50 мл), сушили над сульфатом натрия и затем растворитель отгоняли. Полученный остаток смешивали с концентрированной соляной кислотой (10 мл) и перемешивали при комнатной температуре в течение 10 мин, затем полученный водный слой промывали хлороформом (20 мл × 3) и подщелачивали добавлением 30% водного раствора гидроксида натрия при охлаждении льдом. Последний доводили до рН 7,2 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (80 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Последнее очищали перекристаллизацией из смеси этанол-гексан с получением 274 мг (67%) указанного в заголовке соединения в виде светлую желтых кристаллов.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,25-1,67 (4Н, м), 2,48-2,61 (1Н, м), 3,30-3,49 (3Н, м), 3,49 (3Н, с), 3,61-3,71 (1Н, м), 3,71-3,79 (2Н, м), 3,94-4,02 (IH, м),- 4,88-4,94 (0,5Н, м), 5,03-5,10 (0,5Н, м), 7,00 (1Н, д, J=9,28 Гц), 7,31-7,43 (5Н, м), 7,92 (1Н, д, J=9,28 Гц), 8,39 (1Н, с).
Точка плавления: 116,8-120,4° С (с разложением).
Элементный анализ: для С25Н26FN3O4·0,25Н2O
Вычислено: С, 65,85; Н, 5,86; N, 9,21.
Найдено: С, 66,14; Н, 5,80; N, 9,18.
[Ссылочный пример 8]
4-(R)-(2-Метокси)фенилкарбонил-1-[1-(R)-фенилэтил]-2-пирролидон
В атмосфере азота 1 моль/л 2-метоксифенилмагнийбромид (38 мл), полученный из 2-броманизола, добавляли по каплям к раствору N-метил-N-метокси-1-[1-(R)-фенилэтил]-5-оксопирролидин-3-карбоксамида (6,20 г, 22,4 ммоль) в тетрагидрофуране (50 мл) и смесь перемешивали при комнатной температуре в течение 5 мин. Реакционный раствор смешивали с 1 моль/л соляной кислотой (40 мл) при охлаждении льдом и затем экстрагировали этилацетатом (80 мл × 2). Органический слой промывали насыщенным раствором соли (100 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан: этилацетат от (1:2) до (1:3) получали 2,45 г (33%) указанного в заголовке соединения в виде светлого желтого масла,
1H-ЯМР (400 МГц, СDСl3)δ : 1,54 (3Н, д, J=6,84 Гц), 2,73 (2Н, д, J=8,30 Гц), 3,18 (1H, дд, J=8,79, 9,77 Гц); 3,66 (1Н, дд, J=6,34, 9,77 Гц), 3,82 (ЗН, с), 4,04 (1Н, дд, J=6,34, 8,79 Гц), 5,51 (1Н, kb, J=6,84 Гц), 6,94 (1H, д, J=8,30Гц), 7,00-7,04 (1H, м), 7,27-7,38 (5Н, м), 7,47-7,51 (1H, м), 7,68-7,70 (1H, м).
[Ссылочный пример 9]
4-(R)-[1-Азидо-1-(2-метокси)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидон [F1], [F2]
При охлаждении льдом боргидрид натрия (150 мг) добавляли к раствору 4-(R)-(2-метокси)фенилкарбонил-1-[1-(R)-фенилэтил]-2-пирролидона (2,45 г, 7,57 ммоль) в этаноле (30 мл) и смесь перемешивали при той же температуре в течение 20 мин. Реакционный раствор смешивали с водой (30 мл), перемешивали при комнатной температуре в течение 30 мин и затем экстрагировали хлороформом (80 мл× 3). Органический слой промывали насыщенным раствором соли (100 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью 2% метанол-хлороформ получали 1,97 г (6,05 ммоль) промежуточного соединения 4-(R)-[1-(2-метокси)фенил-1-гидроксиметил]-1-[1-(R)-фенилэтил]-2-пирролидона в виде бесцветного масла (смесь изомеров 1:1). Последнее переносили в дихлорметан (35 мл), смешивали с метансульфонилхлоридом (900 мг, 7,87 ммоль) и триэтиламином (1,8 мл) и затем перемешивали при комнатной температуре в течение 50 ч. Реакционный раствор промывали водой (30 мл) и насыщенным раствором соли (50 мл), органический слой сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в N,N-диметилформамиде (40 мл), смешивали с азидом натрия (2,11 г) и затем кипятили при 80° С в течение 13 ч. После самопроизвольного охлаждения, реакционный раствор смешивали с водой (50 мл) и экстрагировали этилацетатом (70 мл × 3), полученный органический слой промывали насыщенным раствором соли (150 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан: этилацетат (2:1) последовательно получали 621 мг (29%) указанного в заголовке соединения с низкой полярностью [F1] и 1,0 (47%) указанного в заголовке соединения с высокой полярностью [F2], каждое в виде бесцветного масла.
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,47 (3Н, д, J=6,83 Гц), 2,49-2,55 (2Н, м), 2,66-2,73 (1Н, м), 2,85-2,94 (1Н, м), 2,97-3,05 (1Н, м), 3,83 (3Н, с), 4,95 (1Н, д, J=7,81 Гц), 5,49 (1H, kb, J=6,83 Гц), 6,92 (1Н, д, J=8,30 Гц), 6,97-7,01 (1H,- м), 7,23-7,34 (7Н, м).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,55 (3Н, д, J=6,84 Гц), 2,18-2,34 (2Н, м), 2,63-2,74 (1Н, м), 3,10 (1H, дд, J= 8,30, 10,25 Гц), 3,30 (1H, дд, J=6,84, 10,25 Гц), 3,84 (3Н, с), 4,94 (1H, д, J=9,28 Гц), 5,49 (1H, kb, J - 6,84 Гц), 6,92 (1H, д, J= 8,30 Гц), 6,98-7,01 (1H,- м), 7,25-7,36 (7Н, м).
[Ссылочный пример 10]
4-(R)-[1-Трет-бутоксикарбониламино-1-(2-метокси)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидон [F1], [F2]
Раствор 4-(R) -[1-азидо-1-(2-метокси)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (621 мг, 1,77 ммоль) в этаноле (40 мл) смешивали с катализатором 10% палладием на угле (влажность 53,8%, 700 мг) для проведения каталитического гидрирования при комнатной температуре в течение 1 ч при нормальном давлении. Реакционный раствор фильтровали и фильтрат упаривали при пониженном давлении. Полученный остаток растворяли в дихлорметане (40 мл), смешивали с ди-трет-бутилдикарбонатом (600 мг) и триэтиламином (1 мл) и затем перемешивали при комнатной температуре в течение 15 ч. Реакционный раствор упаривали при пониженном давлении, полученный остаток смешивали с хлороформом (20 мл), промывали водой (10 мл) и затем органический слой сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле (силикагель, 20 г). Элюированием смесью н-гексан:этилацетат (1:2) получали 589 мг (78%) указанного в заголовке соединения в виде бесцветного аморфного вещества.
Аналогичную реакцию проводили исходя из 4-(R)-[1-азидо-1-(2-метокси)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (80%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,42 (9Н, с), 1,47 (3Н, д, J=6,84 Гц), 2,50-2,54 (2Н, м), 2,70-2,86 (2Н, м), 2,92-3,01 (1Н, м), 3,82 (3Н, с), 4,73-4,80 (1Н, м), 5,45-5,56 (2Н, м), 6,85-6,93 (2Н, м), 7,12-7,30 (7Н, м).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,41 (9Н, с), 1,54 (3Н, д, J=7,33 Гц), 2,03-2,15 (2Н, м), 2,68-2,81 (1Н, м), 3,00-3,13 (1Н, м), 3,22-3,35 (1Н, м), 3,84 (3Н, с), 4,60-4,72 (1Н, м), 5,39-5,56 (2Н, м), 6,79-6,96 (2Н, м), 7,05-7,38 (7Н, м).
[Ссылочный пример 11]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2-метокси)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидин [F1], [F2]
В атмосфере азота 1М комплекс боран-тетрагидрофуран (5,5 мл) добавляли по каплям к раствору 4-(R)-[1-трет-бутоксикарбониламино-1-(2-метокси)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (589 мг, 1,39 ммоль) в тетрагидрофуране (20 мл) при охлаждении льдом и затем смесь перемешивали при комнатной температуре в течение 17 ч. После добавления метанола (10 мл) при охлаждении льдом и последующем перемешивании при комнатной температуре в течение 20 мин растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в 80% водном этаноле (40 мл) и кипятили с обратным холодильником в течение 30 мин в присутствии триэтиламина (3 мл). После самопроизвольного охлаждения реакционного раствора растворитель отгоняли при пониженном давлении, к полученному остатку добавляли хлороформ (30 мл), полученный органический слой промывали водой (10 мл) и насыщенным раствором соли (10 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью 3% метанол-хлороформ, получали 488 мг (86%) указанного в заголовке соединения в виде бесцветного масла.
Аналогичную реакцию проводили исходя из 4-(R)-[1-трет-бутоксикарбониламино-1-(2-метокси)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (99%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,32 (3Н, д, J=6,34 Гц), 1,45 (9Н, с), 1,66-1,74 (2Н, м), 2,18-2,31 (3Н, м), 2,70-2,85 (2Н, м), 3,11 (1Н, кв, J=6,34 Гц), 3,79 (3Н, с), 4,70 (1Н, т, J=7,32 Гц), 6,17 (1Н, ушд, J=6,35 Гц), 6,80-6,91 (2Н, м), 7,17-7,33 (7Н, м).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,40 (3Н, д, J=6,83 Гц), 1,45 (9Н, с), 1,80-1,92 (1Н, м), 2,17-2,30 (3Н, м), 2,32-2,42 (1Н, м), 2,53-2,61 (1Н, м), 2,75-2,82 (1Н, м), 2,89-2,98 (1Н, м), 3,10-3,18 (1Н, м), 3,79 (3Н, с), 4,74 (1Н, т, J=6,83 Гц), 6,78 (1Н, д, J=7,81 Гц), 6,97-7,35 (8Н, м).
[Ссылочный пример 12]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2-метокси)фенилметил] пирролидин [F1], [ F2 ]
Раствор 3-(R)-[1-трет-бутоксикарбониламино-1-(2-метокси) фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидина [F1] (488 мг, 1,19 ммоль) в этаноле (30 мл) смешивали с катализатором 10% палладием на угле (влажность 53,8%, 500 мг) и подвергали 3-часовому каталитическому гидрированию при нормальном давлении при одновременном нагревании при 50° С. Реакционный раствор фильтровали и фильтрат упаривали при пониженном давлении с получением 353 мг (97%) сырого указанного в заголовке соединения в виде бесцветных кристаллов. Последнее использовали в последующей реакции без очистки.
Аналогичную реакцию проводили исходя из 3-(R)-[1-трет-бутоксикарбониламино-1-(2-метокси)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидина [F2] (97%).
[Пример по изобретению 7]
5-Амино-7-[3-(R)-(1-амино-1-(2-метокси)фенилметил}-1-пирролидинил]-6,8-дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота [F1]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2-метокси)фенилметил]пирролидин [F1] (353 мг, 1,15 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-ди-гидро-2-оксохинолин-3-карбоновой кислоты (316 мг, 1,0 ммоль) в ацетонитриле (15 мл) и смесь кипятили с обратным холодильником в течение 11 ч в присутствии триэтиламина (3 мл). После самопроизвольного охлаждения растворитель реакционного раствора отгоняли при пониженном давлении и полученный остаток растворяли в хлороформе (50 мл). Последнее промывали 10% лимонной кислотой (30 мл × 2) и насыщенным раствором соли (20 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, полученный остаток смешивали с концентрированной соляной кислотой (3 мл) и перемешивали при комнатной температуре в течение 5 мин. Данный солянокислый раствор промывали хлороформом (20 мл × 3), доводили до щелочной реакции добавлением 30% водного раствора гидроксида натрия при охлаждении льдом и затем перемешивали при комнатной температуре в течение 1 ч. Данную суспензию доводили до рН 7,4 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (80 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением 482 мг сырого указанного в заголовке соединения. Последнее очищали перекристаллизацией из смеси метанол-этанол с получением 213 мг указанного в заголовке соединения.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,18-1,38 (2Н, м), 1,41-1,55 (1Н, м), 2,05-2,18 (1Н, м), 2,28-2,40 (1Н, м), 2,77-2,88 (1Н, м), 3,02-3,16 (1H, м), 3,15-3,33 (2Н, м), 3,43-3,52 (1H, м), 3,64 (3Н, с), 3,78-3,85 (1H, м), 4,48-4,55 (0,5Н, м), 4,65-4,73 (0,5Н, м), 6,84-6,88 (2Н, м), 7,12-7,20 (2Н, м), 8,08 (1Н, с).
Точка плавления: 114,8-126,6° С.
Элементный анализ: для C25H25F3N4O4·1,25H2O
Вычислено: С, 57,19; Н, 5,28; N, 10,67.
Найдено: С, 57,18; Н, 5,12; N, 10,61.
[Пример по изобретению 8]
5-Амино-7-[3-(R)-(1-амино-1-(2-метокси)фенилметил)-1-пирролидинил]-6,8-дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота [F2]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2-метокси)фенилметил]пирролидин [F2] (353 мг, 1,15 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (316 мг, 1,0 ммоль) в ацетонитриле (15 мл) и смесь кипятили с обратным холодильником в течение 11 ч в присутствии триэтиламина (3 мл). После самопроизвольного охлаждения растворитель реакционного раствора отгоняли при пониженном давлении и полученный остаток растворяли в хлороформе (50 мл). Полученное промывали 10% лимонной кислотой (30 мл × 2) и насыщенным раствором соли (20 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, полученный остаток смешивали с концентрированной соляной кислотой (3 мл) и перемешивали при комнатной температуре в течение 5 мин. Данный солянокислый раствор промывали хлороформом (20 мл × 3), доводили до щелочной реакции добавлением 30% водного раствора гидроксида натрия при охлаждении льдом и затем перемешивали при комнатной температуре в течение 1 ч. Данную суспензию доводили до рН 7,4 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (80 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением 468 мг сырого указанного в заголовке соединения. Последнее очищали перекристаллизацией из смеси метанол-этанол с получением 226 мг указанного в заголовке соединения.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,05-1,48 (4Н, м), 2,19-2,38 (1Н, м), 3,05-3,58 (5Н, м), 3,52 (3Н, с), 3,72-3,80 (1Н, м), 4,52-4,60 (0,5Н, м), 4,70-4,79 (0,5Н, м), 6,65-6,80 (2Н, м), 6,94-7,10 (2Н, м), 8,12 (1Н, с).
Точка плавления: 251,1-253,2° С.
Элементный анализ: для С25Н25F3N4O4.
Вычислено: С, 59,76; Н, 5,01; N, 11,15.
Найдено: С, 59,89; Н, 5,05; N, 11,12.
[Ссылочный пример 13]
4-(R)-(2,4-Дифтор)фенилкарбонил-1-[1-(R)-фенилэтил]-2-пирролидон
В атмосфере азота 1 моль/л 2,4-дифторфенилмагнийбромид (54,3 мл), полученный из 2,4-дифторбромбензола, добавляли по каплям к раствору N-метил-N-метокси-1-[1-(R)-фенилэтил]-5-оксопирролидин-3-карбоксамида (5,50 г, 19,9 ммоль) в тетрагидрофуране (110 мл) и смесь перемешивали при 50° С в течение 4 ч. Реакционный раствор смешивали с 1 моль/л соляной кислотой (150 мл) при охлаждении льдом и экстрагировали этилацетатом (150 мл × 2), затем органический слой промывали насыщенным раствором соли (100 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан: этилацетат от (2:1) до (1:1) получали 2,00 г (29%) указанного в заголовке соединения в виде бесцветного светлого желтого масла.
1H-ЯМР (400 МГц, СDСl3)δ : 1,55 (3Н, д, J=6,83 Гц), 2,70-2,85 (2Н, м), 3,21 (1Н, т, J=9,28 Гц), 3,71-3,75 (1Н, м), 3,85-3,90 (1Н, м), 5,52 (1Н, kb, J=6,83 Гц), 6,85-6,91 (1Н, м), 6,98-7,03 (1Н, м), 7,26-7,92 (5Н, м), 7,94-7,97 (1Н, м).
[Ссылочный пример 14]
4-(R)-[1-Азидо-1-(2,4-дифтор)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидон [F1], [F2]
При охлаждении льдом боргидрид натрия (332 мг, 8,77 ммоль) добавляли к раствору 4-(R)-(2,4-дифтор)фенилкарбонил-1-[1-(R)-фенилэтил]-2-пирролидона (2,89 г, 8/78 ммоль) в метаноле (60 мл) и смесь перемешивали при той же температуре в течение 30 мин. Реакционный раствор смешивали с насыщенным водным раствором хлорида аммония (3 мл) и перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь экстрагировали этилацетатом (80 мл × 3), органический слой промывали насыщенным раствором соли (100 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан: этилацетат от (2:1) до (1:2) получали 2,09 г (72%) промежуточного соединения 4-(R)-[1-(2,4-дифтор)фенил-1-гидроксиметил]-[1-(R)-фенилэтил]-2-пирролидона в виде бесцветного масла (смесь изомеров 1:1). 1,76 г (5,30 ммоль) Данного соединения растворяли в дихлорметане (35 мл), раствор смешивали с триэтиламином (1,04 мл, 7,46 ммоль) и метансульфонилхлоридом (492 мкл, 6,36 ммоль) при охлаждении льдом и затем перемешивали при той же температуре в течение 30 мин. Реакционный раствор промывали насыщенным водным раствором хлорида аммония (30 мл) и насыщенным раствором соли (50 мл), органический слой сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в N,N-диметилформамиде (17 мл), смешивали с азидом натрия (862 мг, 13,3 ммоль) и затем нагревали при 50° С в течение 14 ч. После самопроизвольного охлаждения реакционный раствор смешивали с водой (50 мл), экстрагировали этилацетатом (70 мл × 2), полученный органический слой промывали водой (50 мл × 3) и насыщенным раствором соли (150 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан:этилацетат (2:1) последовательно получали 913 мг (40%) указанного в заголовке соединения с низкой полярностью [F1] и 894 мг (39%) указанного в заголовке соединения с высокой полярностью [F2], каждое в виде бесцветного масла.
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,49 (3Н, д, J=7,32 Гц), 2,-53-2,-65 (3Н, м), 2,86-2,91 (1H, м),- 2,96-2,99 (1H, м), 4,77 (1Н, д, J=8,30 Гц), 5,49 (1Н, кв, J=7,32 Гц), 6,85-6,90 (1Н, м), 6,93-6,97 (1Н, м), 7,23-7,36 (6Н, м).
[F2];
1Н-ЯМР (400 МГц, СDСl3)δ : 1,55 (3Н, д, J= 7,32 Гц), 2,17 (1Н, дд, J=8,06, 16,85 Гц), 2,31 (1H, дд, J=9,04, 16,85 Гц), 2,61-2,67 (1Н, м), 3,13 (1H, дд, J=8,06, 10,25 Гц), 3,29 (1Н, дд, J=6,35, 10,25 Гц), 4,75 (1Н, д, J=9,28 Гц), 5,49 (1H, kb, J=7,32 Гц), 6,65-6,91 (1H,м), 6,93-6,97 (1Н, м), 7,26-7,36 (6Н, м).
[Ссылочный пример 15]
4-(R)-[1-Трет-бутоксикарбониламино-1-(2,4-дифтор)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидон [F1], [F2]
Раствор 4-(R)-[1-азидо-1-(2,4-дифтор)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (913 мг/ 2,56 ммоль) в этаноле (20 мл) смешивали с катализатором 10% палладием на угле (влажность 53,8%, 900 мг) для проведения каталитического гидрирования при комнатной температуре в течение 1 ч при нормальном давлении. Реакционный раствор фильтровали и растворитель фильтрата отгоняли при пониженном давлении. Полученный остаток растворяли в дихлорметане (20 мл), смешивали с ди-трет-бутилдикарбонатом (647 мкл, 2,81 ммоль) и триэтиламином (464 мкл, 3,33 ммоль) и затем перемешивали при комнатной температуре в течение 24 ч. Реакционный раствор упаривали при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан:этилацетат (1:1) получали 567 мг (52%) указанного в заголовке соединения [F1] в виде бесцветного аморфного вещества.
Аналогичную реакцию проводили, исходя из 4-(R)-[1-азидо-1-(2,4-дифтор)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (84%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,41 (9Н, с), 1,48 (3Н, д, J=6,84 Гц), 2,44-2,95 (5Н, м), 4,78-4,80 (1Н, м), 5,04-5,07 (1Н, м), 5,49 (1Н, kb, J=6,84 Гц), 6,78-6,87 (2Н, м), 7,18-7,32 (6Н, м).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,40 (9Н, с), 1,5 (3Н, д, J=7,33 Гц), 2,08 (1Н, дд, J=8,06, 17,09 Гц), 2,22 (1Н, дд, J=8,79, 17,09 Гц), 2,65-2,67 (5Н, м), 3,10-3,14 (1H, м), 3,25-3,29 (1H, м), 4,70-4,72 (1H, м), 4,99-5,01 (1H, м), 5,49 (1H, kb, J=7,33 Гц), 6,79-6,89 (2Н, м), 7,26-7,37 (6Н, м).
[Ссылочный пример 16]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2,4-дифтор)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидин [F1], [F2]
В атмосфере азота 1М комплекс боран-тетрагидрофуран (9,60 мл) добавляли по каплям к раствору 4-(R)-[1-трет-бутоксикарбониламино-1-(2,4-дифтор)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (560 мг, 1,30 ммоль) в тетрагидрофуране (12 мл) при охлаждении льдом и затем смесь перемешивали при комнатной температуре в течение 17 ч. После отгонки растворителя при пониженном давлении полученный остаток растворяли в 80% водном этаноле (10 мл) и нагревали с обратным холодильником в течение 1 ч в присутствии триэтиламина (1 мл). После самопроизвольного охлаждения реакционного раствора растворитель отгоняли при пониженном давлении, к полученному остатку добавляли хлороформ (30 мл), затем полученный органический слой промывали насыщенным раствором хлорида аммония (10 мл) и насыщенным раствором соли (10 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан:этилацетат (1:1) получали 485 мг (90%) указанного в заголовке соединения в виде бесцветного масла.
Аналогичную реакцию проводили исходя из 4-(R)-[1-трет-бутоксикарбониламино-1-(2,4-дифтор)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (82%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,37 (3Н, д, J=6,84 Гц), 1,48 (9Н, с), 1,67-1,69 1(1Н, м), 2,20-2,24 (1Н, м), 2,36-2,39 (1Н, м), 2,57-2,59 (1Н, м), 3,01-3,15 (1Н, м), 4,67-4,72 (1Н, м), 6,35-6,39 (1Н, м), 6,71-6,83 (2Н, м), 7,22-7,36 (6Н, м).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,41 (3Н, д, J=6,84 Гц), 1,48 (9Н, с), 1,74-1,76 (1Н, м), 2,01-2,04 (2Н, м), 2,19-2,23 (1Н, м), 2,35-2,44 (1Н, м), 3,14-3,17 (2Н, м), 4,71-4,73 (1Н, м), 6,68-6,70 (1H, м), 6,89-6,95 (2Н, м), 7,26-7,34 (6Н, м).
[Ссылочный пример 17]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2,4-дифтор)фенилметил]пирролидин [F1], [F2]
Раствор 3-(R)-[1-трет-бутоксикарбониламино-1-(2,4-дифтор) фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидина [F1] (243 мг, 0,58 ммоль) в этаноле (10 мл) смешивали с катализатором 10% палладием на угле (влажность 53,8%, 245 мг) и подвергали каталитическому гидрированию в течение 2 ч при нормальном давлении при одновременном нагревании при 50° С. Реакционный раствор фильтровали и растворитель фильтрата отгоняли при пониженном давлении с получением 200 мг сырого указанного в заголовке соединения в виде бесцветных кристаллов. Последнее использовали в последующей реакции без очистки.
Аналогичную реакцию проводили исходя из 3-(R)-[1-трет-бутоксикарбониламино-1-(2,4-дифтор)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидина [F2].
[Пример по изобретению 9]
5-Амино-7-[3-(R)-(1-амино-1-(2,4-дифтор)фенилметил)-1-пирролидинил]-6,8-дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота [F1]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2,4-дифтор)фенилметил]пирролидин [F1] (0,58 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (183 мг, 0,58 ммоль) в ацетонитриле (10 мл) и смесь кипятили с обратным холодильником в течение 15 ч в присутствии триэтиламина (0,5 мл). После самопроизвольного охлаждения растворитель из реакционного раствора отгоняли при пониженном давлении. Полученный остаток растворяли в хлороформе (50 мл), промывали 10% лимонной кислотой (30 мл) и насыщенным раствором соли (20 мл), сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Полученный остаток смешивали с концентрированной соляной кислотой (5 мл) при охлаждении льдом, затем смешивали с 1 моль/л водным раствором соляной кислоты (5 мл) при комнатной температуре и затем промывали хлороформом (50 мл × 3) и нерастворимое вещество удаляли фильтрованием. Данный солянокислый раствор доводили до щелочной реакции добавлением 10 моль/л водного раствора гидроксида натрия при охлаждении льдом и затем перемешивали при комнатной температуре в течение 1 ч. Данную суспензию доводили до рН 7,4 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (80 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением сырого указанного в заголовке соединения в виде светлых желтых кристаллов. Последнее очищали перекристаллизацией из этанола с получением 125 мг (42%) указанного в заголовке соединения.
1H-ЯМР (400 МГц, СDСl3)δ : 1,40-1,51 (2Н, м), 1,84-1,89 (1Н, м), 2,28-2,29 (1Н, м), 2,57-2,59 (1Н, м), 3,35-3,90 (5Н, м), 4,13 (1Н, д, J=9,28 Гц), 4,79 (1Н, ушд, J=62,50 Гц), 6,38 (1Н, с), 6,79-6,91 (2Н, м), 7,37-7,41 (1Н, м), 8,51 (1H, с).
Точка плавления: 182-183° С.
Элементный анализ: для C24H21F5N4O3·0,25H2O
Вычислено: С, 56,20; Н, 4,22; N, 10,92.
Найдено: С, 56,30; Н, 4,39; N, 10,77.
[Пример по изобретению 10]
5-Амино-7-[3-(R)-(1-амино-1-(2,4-дифтор)фенилметил)-1-пирролидинил]-6,8-дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота [F2]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2,4-дифтор)фенилметил]пирролидин [F2] (0,50 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(3)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (158 мг, 0,50 ммоль) в ацетонитриле (7 мл) и смесь кипятили с обратным холодильником в течение 15 ч в присутствии триэтиламина (0,5 мл). После самопроизвольного охлаждения растворитель реакционного раствора отгоняли при пониженном давлении. Полученный остаток растворяли в хлороформе (50 мл), промывали 10% лимонной кислотой (30 мл) и насыщенным раствором соли (20 мл), сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Полученный остаток смешивали с концентрированной соляной кислотой (5 мл) при охлаждении льдом, затем смешивали с 1 моль/л водным раствором соляной кислоты (5 мл) при комнатной температуре, затем промывали хлороформом (50 мл) и нерастворимое вещество удаляли фильтрованием. Данный солянокислый раствор доводили до щелочной реакции добавлением 10 моль/л водного раствора гидроксида натрия при охлаждении льдом и затем перемешивали при комнатной температуре в течение 1 ч. Данную суспензию доводили до рН 7,4 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (80 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением сырого указанного в заголовке соединения в виде светлых желтых кристаллов. Последнее очищали перекристаллизацией из этанола с получением 165 мг (65%) указанного в заголовке соединения.
1H-ЯМР (400 МГц, СDСl3)δ : 1,53-1,60 (3Н, м), 1,69-1,71 (1Н, м), 2,52-2,58 (1Н, м), 3,66-3,91 (5Н, м), 4,08 (1Н, д, J=9,76 Гц), 4,83 (1Н, ушд, J=62,75 Гц), 6,42 (1Н, с), 6,80-6,93 (2Н, м), 7,34-7,40 (1Н, м), 8,54 (1Н, с).
Точка плавления: 218-220° С (с разложением).
Элементный анализ: для C24H21F5N4O3
Вычислено: С, 56,69; Н, 4,16; N, 11,02.
Найдено: С, 56,20; Н, 4,22; N, 10,92.
[Ссылочный пример 18]
4-(R)-(2-Фурил)карбонил-1-[1-(R)-фенилэтил]-2-пирролидон
В атмосфере азота 0,5 моль/л 2-фурилмагнийбромид (180 мл), полученный из фурана, добавляли по каплям к раствору N-метил-N-метокси-1-[1-(R)-фенилэтил]-5-оксопирролидин-3-карбоксамида (8,30 г, 30,0 ммоль) в тетрагидрофуране (160 мл) и смесь перемешивали в течение 30 мин. Реакционный раствор смешивали с 1 моль/л соляной кислотой (200 мл) при охлаждении льдом, экстрагировали этилацетатом (200 мл × 2), затем органический слой промывали насыщенным раствором соли (100 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан:этилацетат от (1:1) до (1:2) получали 3,94 г (46%) указанного в заголовке соединения в виде светлого желтого масла,
1H-ЯМр (400 МГц, CDCl3)δ : 1,55 (3Н, д, J=6,84 Гц), 2,72-2,87 (2Н, м), 3,20-3,25 (1Н, м), 3,67 (1Н, дд, J=6,83, 9,77 Гц), 3,80-389 (1Н, м), 5,53 (1H, kb, J=6,84 Гц), 6,57 (1H, дд, J=1,46, 3,42 Гц), 7,18-7,38 (6Н, м), 7,60 (1H, д, J=0,98 Гц).
[Ссылочный пример 19]
4-(R)-[1-Амино-1-(2-фурил)метил]-1-[1- (R)-фенилэтил]-2-пирролидон [F1], [F2]
При охлаждении льдом боргидрид натрия (522 мг, 13,8 ммоль) добавляли к раствору 4-(R)-(2-фурил)карбонил-1-[1-(R)-фенилэтил]-2-пирролидона (3,90 г, 13,8 ммоль) в метаноле (80 мл) и смесь перемешивали при той же температуре в течение 30 мин. Реакционный раствор смешивали с насыщенным водным раствором хлорида аммония (50 мл), перемешивали при комнатной температуре в течение 30 мин и затем экстрагировали хлороформом (100 мл × 3). Органический слой промывали насыщенным раствором соли (100 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью толуол: этилацетат (1:2) получали 3,64 г (12,7 ммоль) промежуточного соединения 4-(R)-[1-(2-фурил)-1-гидроксиметил]-1-[1-(R)-фенилэтил]-2-пирролидона в виде бесцветного масла (смесь изомеров 1:1). Последнее переводили в дихлорметан (90 мл), смешивали с триэтиламином (5,97 мл, 42,8 ммоль) и метансульфонилхлоридом (2,83 мл, 36,7 ммоль) при охлаждении льдом и перемешивали при комнатной температуре в течение 24 ч. Реакционный раствор промывали насыщенным водным раствором хлорида аммония (100 мл) и насыщенным раствором соли (100 мл), органический слой сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в N,N-диметилформамиде (45 мл), смешивали с азидом натрия (4,97 г, 76,45 ммоль) и затем нагревали при 50° С в течение 3 ч. После охлаждения льдом реакционный раствор смешивали с водой (100 мл), экстрагировали этилацетатом (100 мл × 2), полученный органический слой промывали водой (80 мл × 3) и насыщенным раствором соли (100 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан:этилацетат от (2:1) до (1:1) получали 4,02 г (12,7 ммоль) промежуточного соединения 4-(R)-[1-азидо-1-(2-фурил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона в виде бесцветного масла (смесь изомеров 1:1). Последнее переводили в этанол (100 мл) и смешивали с катализатором 10% палладием на угле (влажность 53,8%, 4,80 мг) и затем проводили каталитическое гидрирование при комнатной температуре в течение 2 ч при нормальном давлении. Реакционный раствор фильтровали и растворитель из полученного фильтрата отгоняли при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью хлороформ:метанол от (98:2) до (95:5) последовательно получали 1,42 г (39%) указанного в заголовке соединения с низкой полярностью [F2] и 1,75 г (49%) указанного в заголовке соединения с высокой полярностью [F1], каждое в виде бесцветного масла.
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,46 (3Н, д, J=6,84 Гц), 2,47-2,65 (3Н, м), 2,93-2,91 (1Н, м), 3,13 (1Н, дд, J=5,86, 9,76 Гц), 3,87 (1H, д, J=6,84 Гц), 5,46 (1H, kb, J=6,84 Гц), 6,14 (1H, д, J=2,93 Гц), 6,29-6,31 (1H, м), 7,26-7,34 (6Н, м).
[F2];
1H-ЯМР (400 МГц, CDCl3)δ : 1,50 (3Н, д, J=7,32 Гц), 2,28 (1H, дд, J=7,81, 17,09 Гц), 2,41 (1H, дд, J=8,79, 17,09 Гц), 2,54-2,59 (1H, м), 3,17 (1H, дд, J=8,30, 10,01 Гц), 3,32 (1H, дд, J=6,35, 10,01 Гц), 3,79 (1H, д, J=8,30 Гц), 5,48 (1H, kb, J=7,32 Гц), 6,13 (1H, д, J=2,93 Гц), 6,30 (1Н, дд, J=1,96, 2,93 Гц), 7,26-7,36 (6Н, м).
[Ссылочный пример 20]
4-(R)-[1-Трет-бутоксикарбониламино-1-(2-фурил)метил]-1-[1-(R) -фенилэтил]-2-пирролидон [F1], [F2]
Раствор 4-(R)-[1-амино-1-(2-фурил)метил]1-[1-(R)-фенилэтил]-2-пирролидона [F1] (2,00 г, 7,03 ммоль) в дихлорметане (40 мл) смешивали с ди-трет-бутилдикарбонатом (1,95 мл, 8,44 ммоль) и триэтиламином (1,38 мл, 9,84 ммоль) и перемешивали при комнатной температуре в течение 8 ч. Реакционный раствор концентрировали при пониженном давлении и полученный остаток подвергали колоночной хроматографии силикагеле. Элюированием смесью н-гексан:этилацетат (1:1) получали 2,32 г (86%) указанного в заголовке соединения [F1] в виде бесцветного аморфного вещества.
Аналогичную реакцию проводили исходя из 4-(R)-[1-амино-1-(2-фурил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (78%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,44 (1Н, с), 1,47 (3Н, д, J=7,32 Гц), 2,43 (1Н, дд, J=7,08, 17,3 Гц), 2,56 (1Н, дд, J=9,04, 17,33 Гц), 2,44-2,77 (1Н, м), 2,97-2,99 (1H, м), 3,12-3,14 (1H, м), 4,82-4,92 (2Н, м), 5,47 (1H, д, J=7,32 Гц), 6,18 (1H, д, J=3,41 Гц), 6,29-6,31 (1H, м), 7,26-7,33 (6Н, м).
[F2];
1H-МР (400 МГц, СDСl3)δ : 1,43 (9Н, с), 1,49 (ЗН, д, J=6,84 Гц), 2,27 (1H, дд, J=7,32, 17,09 Гц), 2,41 (1H, дд, J=8,79, 17,09 Гц), 2,67-2,69 (1H, м), 3,05-3,06 (1H, м), 3,23 (1Н, дд, J=5,86, 10,25 Гц), 4,75-4,84 (2Н, м), 5,47 (1Н, д, J=6,84 Гц), 6,21 (1Н, с), 6,31 (1H, дд, J=1,95, 2,93 Гц), 7,26-7,36 (6Н, м).
[Ссылочный пример 21]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2-фурил)метил]-1-[1-(R)-фенилэтил]-2-пирролидин [F1], [F2]
В атмосфере азота 1М комплекс боран-тетрагидрофуран (14,8 мл) добавляли по каплям к раствору 4-(R)-[1-трет-бутокси-карбониламино-1-(2-фурил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (2,03 г, 5,28 ммоль) в тетрагидрофуране (40 мл) при охлаждении льдом и затем смесь перемешивали при комнатной температуре в течение 17 ч. После отгонки растворителя при пониженном давлении полученный остаток растворяли в 80% водном этаноле (40 мл) и кипятили с обратным холодильником в течение 1 ч в присутствии триэтиламина (1 мл). После самопроизвольного охлаждения реакционного раствора растворитель отгоняли при пониженном давлении, к полученному остатку добавляли хлороформ (100 мл), затем полученный органический слой промывали насыщенным водным раствором хлорида аммония (80 мл) и насыщенным раствором соли (80 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием хлороформом до смеси хлороформ:метанол (97:3) получали 1,54 г (79%) указанного в заголовке соединения в виде белых кристаллов.
Аналогичную реакцию проводили исходя из 4-(R)-[1-трет-бутоксикарбониламино-1-(2-фурил)метил]-1-[1-(R)-фенилэтил]-2-ирролидона [F2] (63%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,35 (3Н, д, J=6,84 Гц), 1,47 (9Н, с), 1,67-1,73 (1Н, м), 1,83-1,85 (1н, м), 2,25-2,31 (3Н, м), 2,45-2,47 (1Н, м), 2,60-2,62 (1Н, м), 2,76-2,78 (1Н, м), 3,13-3,15 (1Н, м), 4,60-4,62 (1Н, м), 5,64-5,66 (1Н, м), 6,13 (1Н, с), 6,27 (1Н, дд, J=1,965, 2,93 Гц), 7,22-7,31 (6Н, м).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,38 (3Н, д, J=6,34 Гц), 1,46 (9Н, с), 1,63-1,65 (1Н, м), 1,90-1,99 (1н, м), 2,30-2,59 (4Н, м), 2,85-2,87 (1Н, м), 3,16-3,18 (1Н, м), 4,60-4,62 (1Н, м), 6,01 (1Н, с), 6,22 (1Н, дд, J=1,95, 2,93 Гц), 7,23-7,32 (6Н, м).
[Ссылочный пример 22]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2-фурил)метил]-1-бензилоксикарбонилпирролидин [F1], [F2]
В атмосфере азота бензилхлорформиат (761 мкл, 5,31 ммоль) добавляли по каплям к раствору 3-(R)-[1-трет-бутоксикарбониламино-1-(2-фурил)метил]-1-[1-(R)-фенилэтил]-2-пирролидина [F1] (658 мг, 1,77 ммоль) в дихлорэтане (15 мл) при охлаждении льдом и затем смесь кипятили с обратным холодильником в течение 30 ч. После отгонки растворителя при пониженном давлении остаток подвергали колоночной хроматографии на силикагеле. Элюированием хлороформом до смеси хлороформ: метанол (97:3) получали 526 мг (74%) указанного в заголовке соединения в виде белых кристаллов.
Аналогичную реакцию проводили исходя из 3-(R)-[1-трет-бутоксикарбониламино-1-(2-фурил)метил]-1-[1-(R)-фенилэтил] пирролидина [F2] (количественно).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,43 (9Н, с), 1,76-1,87 (1Н, м), 2,03-2,05 (1Н, м), 2,55-2,65 (1Н, м), 3,05-3,13 (1Н, м), 3,32-3,59 (1Н, м), 4,70-4,72 (1Н, м), 4,92-4,94 (1Н, м), 5,11 (2Н, с), 6,18 (1Н, с), 6,31 (1Н, с), 7,26-7,38 (6Н, м).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,43 (9Н, с), 1,58-1,61 (1Н, м), 1,84-1,86 (1Н, м), 2,26-2,29 (1Н, м), 3,24-3,34 (2Н, м), 3,52-3,64 (2Н, м), 4,76-4,78 (1Н, м), 4,89-4,91 (1Н, м), 5,13 (2Н, с), 6,19 (1Н, с), 6,30 (1Н, с), 7,26-7,36 (6Н, м).
[Ссылочный пример 23]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2-фурил)метил]пирролидин [F1], [F2]
Раствор 3-(R)-[1-трет-бутоксикарбониламино-1-(2-фурил) метил]-1-бензилоксикарбонилпирролидина [F1] (507 мг, 1,37 ммоль) в этаноле (10 мл) смешивали с катализатором 10% палладием на угле (влажность 53,8%, 500 мг) и проводили каталитическое гидрирование при комнатной температуре в течение 4 ч при нормальном давлении. Реакционный раствор фильтровали и растворитель фильтрата отгоняли при пониженном давлении с получением 358 мг сырого указанного в заголовке соединения в виде бесцветных кристаллов. Последнее использовали на последующей стадии без очистки.
Аналогичную реакцию проводили исходя из 3-(R)-[1-трет-бутоксикарбониламино-1-(2-фурил)метил]-1-бензилоксикарбонилпирролидина [F2].
[Пример по изобретению 11]
5-Амино-7-{3-(R)-[1-амино-1-(2-фурил)метил]-1-пирролидинил}-6,8-дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота [F1]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2-фурил)метил] пирролидин [F1] (1,30 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (316 мг, 1,00 ммоль) в ацетонитриле (10 мл) и смесь кипятили с обратным холодильником в течение 19 ч в присутствии триэтиламина (0,5 мл). После охлаждения растворитель реакционного раствора отгоняли при пониженном давлении. Полученный остаток растворяли в хлороформе (150 мл), промывали 10% лимонной кислотой (80 мл) и насыщенным раствором соли (80 мл), сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Полученный остаток смешивали с концентрированной соляной кислотой (10 мл) при охлаждении льдом, затем смешивали с 1 моль/л водным раствором соляной кислоты (5 мл) при комнатной температуре и затем промывали хлороформом (50 мл × 4) и нерастворимое вещество удаляли фильтрованием. Данный солянокислый водный раствор доводили до щелочной реакции добавлением 10 моль/л водного раствора гидроксида натрия при охлаждении льдом и затем перемешивали при комнатной температуре в течение 1 ч. Данную суспензию доводили до рН 7,4 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (150 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением сырого указанного в заголовке соединения в виде светлых желтых кристаллов. Последнее очищали перекристаллизацией из этанола с получением 294 мг (64%) указанного в заголовке соединения.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,34-1,56 (3Н, м), 2,35-2,39 (1Н, м), 2,06-2,08 (1Н, м), 3,18-3,20 (2Н, м), 3,40-3,42 (1Н, м), 3,48-3,50 (1H, м), 3,58-3,60 (1H, м), 3,69 (1H, Д, J=9,28 Гц), 4,76 (1H, ушд, J=62,50 Гц), 6,18 (1H, д, J=3,42 Гц), 6,34 (1H, с), 7,37 (1H, с), 8,07 (1H, с).
Точка плавления: 188-189° С.
Элементный анализ: для C22H21F3N4O4
Вычислено: С, 57,14; Н, 4,58; N, 12,12.
Найдено: С, 57,14; Н, 4,78; N, 12,07.
[Пример по изобретению 12]
5-Амино-7-{3-(R)-[1-амино-1-(2-фурил)метил]-1-пирролидинил]-6,8-дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота [F2]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2-фурил)метил]пирролидин [F2] (0,749 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (215 мг, 0,681 ммоль) в ацетонитриле (10 мл) и смесь кипятили с обратным холодильником в течение 19 ч в присутствии триэтиламина (0,5 мл). После охлаждения растворитель реакционного раствора отгоняли при пониженном давлении. Полученный остаток растворяли в хлороформе (150 мл), промывали 10% лимонной кислотой (80 мл) и насыщенным раствором соли (80 мл), сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Полученный остаток смешивали с концентрированной соляной кислотой (10 мл) при охлаждении льдом, затем смешивали с 1 моль/л водным раствором соляной кислоты (5 мл) при комнатной температуре, затем промывали хлороформом (50 мл × 4) и нерастворимое вещество удаляли фильтрованием. Данный солянокислый водный раствор доводили до щелочной реакции добавлением 10 моль/л водного раствора гидроксида натрия при охлаждении льдом и затем перемешивали при комнатной температуре в течение 1 ч. Данную суспензию доводили до рН 7,4 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (150 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением сырого указанного в заголовке соединения в виде светлых желтых кристаллов. Последнее очищали перекристаллизацией из этанола с получением 120 мг (38%) указанного в заголовке соединения.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,24-1,43 (3Н, м), 1,57-1,59 (1Н, м), 2,27-2,29 (1Н, м), 3,27-3,29 (1Н, м), 3,35-3,37 (1Н, м), 3,51-3,56 (3Н, м), 3,63 (1Н, д, J=8,79 Гц), 4,79 (1H, ушд, J=62,99 Гц), 6,13 (1H, д, J=2,93 Гц), 6,31 (1H, с), 7,34 (1H, с), 8,09 (1H, с).
Точка плавления: 187-188° С.
Элементный анализ: для С22Н21F3N4O4·0,5H2O
Вычислено: С, 56,05; Н, 4,70; N, 11,88.
Найдено: С, 56,06; Н, 4,89; N, 11,62.
[Ссылочный пример 24]
4-(R)-(Тиазол-2-ил)карбонил-1-[1-(R)-фенилэтил]-2-пирролидон
В атмосфере азота и при -78°С н-бутиллитий (20,4 мл, 30,0 ммоль, 1,47М раствор в гексане) добавляли по каплям к раствору 2-бромтиазола (4,92 г, 30,0 ммоль) в тетрагидрофуране (200 мл) в течение 10 мин и смесь перемешивали при той же температуре в течение 1 ч. К этому добавляли по каплям раствор N-метил-N-метокси-1-[1-(R)-фенилэтил]-5-оксопирролидин-3-карбоксамида (6,91 г, 25,0 ммоль) в тетрагидрофуране (50 мл) в течение 10 мин, смесь перемешивали при -78° С в течение 30 мин и затем при охлаждении льдом в течение 1 ч. Реакционный раствор смешивали с 1 моль/л соляной кислотой (150 мл) при охлаждении льдом и экстрагировали этилацетатом (100 мл × 2), полученный органический слой промывали насыщенным раствором соли (300 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан: этилацетат (1:1) получали 2,70 г (36%) указанного в заголовке соединения в виде светлого желтого масла,
1H-ЯМР (400 МГц, СDСl3)δ : 1,55 (3Н, д, J=7,32 Гц), 2,04-2,92 (2Н, м), 3,33-3,38 (1Н, м), 3,63-3,68 (1Н, м), 4,26-4,35 (1Н, м), 5,53 (1Н, Д, J=7,32 Гц), 7,27-7,38 (5Н, м), 7,73 (1Н, д, J=2,93 Гц), 8,00 (1Н, д, J=2,93 Гц).
[Ссылочный пример 25]
4-(R)-[1-Гидрокси-1-(тиазол-2-ил)метил]-1-[1-(R)-фенилэтил]-2-пирролидон [F1], [F2]
При охлаждении льдом боргидрид натрия (409 мг) добавляли к раствору 4-(R)-(тиазол-2-ил)карбонил-1-[1-(R)-фенилэтил]-2-пирролидона (3,24 г, 10,80 ммоль) в этаноле (50 мл) и смесь перемешивали при той же температуре в течение 30 мин. Реакционный раствор смешивали с 10% лимонной кислотой (50 мл) при охлаждении льдом, этанол отгоняли при пониженном давлении и затем полученный остаток экстрагировали хлороформом (80 мл× 2). Органический слой промывали насыщенным раствором соли (100 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием этилацетатом последовательно получали 1,28 г (39%) указанного в заголовке соединения с низкой полярностью [F1] и 1,38 г (42%) указанного в заголовке соединения с высокой полярностью [F2] соответственно в виде светлых желтых кристаллов и светлого желтого масла,
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,47 (3Н, д, J=7,32 Гц), 2,46 (1Н, дд, J=9,77, 7,09 Гц), 2,61 (1Н, дд, J=7,32, 7,09 Гц), 2,73-2,83 (1Н, м), 3,06 (1Н, дд, J=10,26, 8,30 Гц), 3,40 (1Н, дд, J=10,26, 6,34 Гц), 3,55 (1H, д, J=5,37 Гц), 4,98 (1H, т, J=5,37 Гц), 5,46 (1H, kb, J=7,32 Гц), 7,26-7,35 (6Н, м), 7,73 (1H, д, J=2,23 Гц).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,48 (3Н, д, J=6,84 Гц), 2,49 (2Н, д, J=8,30 Гц), 2,79-2,88 (1H, м), 2,96-3,01 (1H, м), 3,38 (1H, дд, J=9,77, 5,86 Гц), 4,97 (1H, дд, J=5,37, 4,96 Гц), 5,27 (1H, ушс), 5,43 (1H, kb, J=6,84 Гц), 7,23-7,32 (6Н, м), 7,66 (1H, д, J=3,42 Гц).
[Ссылочный пример 26]
4-(R)-[1-Азидо-1-(тиазол-2-ил)метил]-1-[1-(R)-фенилэтил]-2-пирролидон [F1], [F2]
При охлаждении льдом триэтиламин (725 мкл) и метансульфонилхлорид (341 мкл, 4,40 ммоль) добавляли к раствору 4-(R)-[1-гидрокси-1-(тиазол-2-ил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (1,21 г, 4,00 ммоль) в дихлорметане (20 мл) и смесь перемешивали при той же температуре в течение 1 ч. Реакционный раствор смешивали с 10% лимонной кислотой (30 мл) при охлаждении льдом, экстрагировали хлороформом (30 мл × 2), органический слой промывали насыщенным раствором соли (100 мл) и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, полученный остаток растворяли в N,N-диметилформамиде (30 мл), смешивали с азидом натрия (780 мг, 12,0 ммоль) и затем нагревали при 60° С в течение 15 ч. После самопроизвольного охлаждения реакционный раствор смешивали с водой (70 мл), экстрагировали этилацетатом (80 мл × 3), органический слой промывали насыщенным раствором соли (200 мл) и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан:этилацетат от (1:2) до (1:3) получали 1,263 г (96%) указанного в заголовке соединения в виде светлого желтого масла.
Аналогичную реакцию проводили исходя из 4-(R)-[1-гидрокси-1-(тиазол-2-ил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (85%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,52 (3Н, д, J=7,32 Гц), 2,37 (1H, дд, J=7,32, 7,09 Гц), 2,52 (1Н, дд, J=8,79, 7,09 Гц), 2,84-2,96 (1Н, м), 3,13 (1H, дд, J=10,25, 8,30 Гц), 3,36 (1Н, дд, J=10,25, 6,35 Гц), 4,81 (1H, д, J=7,81 Гц), 5,48 (1H, kb, J=7,32 Гц), 7,26-7,37 (5Н, м), 7,39 (1H, д, J=3,42 Гц), 7,81 (1H, д, J=3,42 Гц).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,48 (3Н, д, J=7,32 Гц), 2,60 (2Н, д, J=7,81 Гц), 2,82-2,91 (1H, м), 3,05 (1H, дд, J=10,25, 8,30 Гц), 3,22 (1H, дд, J=10,25, 5,86 Гц), 4,81 (1H, д, J=7,81 Гц), 5,48 (1H, kb, J=7,32 Гц), 7,25-7,34 (5Н, м), 7,38 (1H, д, J=3,41 Гц), 7,80 (1H, д, J=3,41 Гц).
[Ссылочный пример 27]
4-(R)-[1-Трет-бутоксикарбониламино-1-(тиазол-2-ил)метил]-1-[1-(R)-фенилэтил]-2-пирролидон [F1], [F2]
Раствор 4-(R)-[1-азидо-1-(тиазол-2-ил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (1,18 г, 3,60 ммоль) в этаноле (50 мл) смешивали с катализатором 10% палладием на угле (влажность 53,8%, 1,20 г) и проводили каталитическое гидрирование при комнатной температуре в течение 3 ч при нормальном давлении. Реакционный раствор фильтровали и растворитель отгоняли при пониженном давлении. Остаток растворяли в дихлорметане (30 мл), смешивали с ди-трет-бутилдикарбонатом (1,179 г) и триэтиламином (1 мл) и затем перемешивали при комнатной температуре в течение 14 ч. К реакционному раствору добавляли хлороформ (50 мл), промывали 10% лимонной кислотой (80 мл) и водой (80 мл) и полученный органический слой сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан:этилацетат (1:3) получали 1,205 г (83%) указанного в заголовке соединения в виде бесцветного аморфного вещества.
Аналогичную реакцию проводили исходя из 4-(R)-[1-азидо-1-(тиазол-2-ил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (75%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,44 (9Н, с), 1,51 (3Н, д, J=6,84 Гц), 2,38 (1Н, дд, J=17,09, 7,82 Гц), 2,49 (1Н, дд, J=17,09, 9,28 Гц), 2,83-2,95 (1Н, м), 3,08 (1H, дд, J=9,77, 8,30 Гц), 3,28 (1H, дд, J=9,77, 6,84 Гц), 5,01-5,09 (1H, м), 5,19-5,26 (1H, м), 5,48 (1H, kb, J=6,84 Гц), 7,26-7,35 (6Н, м), 7,73 (1H, д, J=2,93 Гц)
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,44 (3Н, д, J=7,33 Гц), 1,45 (9Н, с), 2,42 (1Н, дд, J=17,09, 6,84 Гц), 2,56 (1Н, дд, J=17,09, 9,28 Гц), 2,90-3,00 (1Н, м), 3,09 (1H, дд, J=9,76, 8,79 Гц), 3,28 (1H, дд, J=9,76, 5,85 Гц), 5,07-5,13 (1H, м), 5,38-5,46 (1H, м), 5,45 (1H, kb, J=7,33 Гц), 7,25-7,34 (6Н, м), 7,71 (1H, д, J=2,92 Гц)
[Ссылочный пример 28]
3-(R)-[1-Трет-бутоксикарбониламино-1-(тиазол-2-ил)метил]-1-[1-(R)-фенилэтил]-2-пирролидин [F1], [F2]
В атмосфере азота 1М комплекс боран-тетрагидрофуран (8,1 мл) добавляли по каплям к раствору 4-(R)-[1-трет-бутокси-карбониламино-1-(тиазол-2-ил)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (1,084 г, 2,70 ммоль) в тетрагидрофуране (20 мл) при охлаждении льдом и затем смесь перемешивали при комнатной температуре в течение 14 ч. После отгонки растворителя при пониженном давлении полученный остаток смешивали с 80% водным этанолом (20 мл) и триэтиламином (4 мл) и кипятили с обратным холодильником в течение 4 ч. После самопроизвольного охлаждения растворитель отгоняли при пониженном давлении, к полученному остатку добавляли хлороформ (30 мл), затем промывали водой (10 мл) и насыщенным раствором соли (10 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью хлороформ:метанол (20:1) получали 984 г (94%) указанного в заголовке соединения в виде бесцветного масла.
Аналогичную реакцию проводили исходя из 4-(R)-[1-трет-бутоксикарбониламино-1-(тиазол-2-ил)фенилметил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (85%).
[F1];
1H-ЯМР (400 МГц, CDCl3)δ : 1,40 (3Н, д, J=6,35 Гц), 1,51 (9Н, с), 1,58-1,71 (1Н, м), 1,76-1,89 (1Н, м), 2,02-2,30 (2Н, м), 2,40-2,50 (1Н, м), 2,74-2,85 (1Н, м), 3,08-3,23 (1Н, м), 40,82-4,90 (1Н, м), 7,09 (1Н, д, J=3,42 Гц), 7,20-7,32 (5Н, м), 7,63 (1Н, д, J=3,42 Гц).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,38 (3Н, д, J=6,35 Гц), 1,52 (9Н, с), 1,68-1,82 (2Н, м), 2,11-2,23 (1Н, м), 2,23-2,34 (1Н, м), 2,45-2,55 (1Н, м), 2,79-2,92 (1Н, м), 3,03-3,21 (2Н, м), 4,83-4,91 (1Н, м), 6,64-6,73 (1Н, м), 7,20 (1Н, д, J=3,41 Гц), 7,22-7,32 (5Н, м), 7,70 (1Н, д, J=3,41 Гц).
[Ссылочный пример 29]
3-(R)-[1-Трет-бутоксикарбониламино-1-(тиазол-2-ил)метил]-1-бензилоксикарбонилпирролидин [F1], [F2]
В атмосфере азота бензилхлорформиат (628 мкл, 4,40 ммоль) добавляли по каплям к раствору 3-(R)-[1-трет-бутоксикарбониламино-1-(тиазол-2-ил)метил]-1-[1-(R)-фенилэтил]-2-пирролидина [F1] (852 мг, 2,20 ммоль) в дихлорэтане (15 мл) при охлаждении льдом и затем смесь кипятили с обратным холодильником в течение 16 ч. После самопроизвольного охлаждения реакционный раствор смешивали с хлороформом (50 мл), промывали насыщенным водным раствором бикарбоната натрия (5 мл) и затем органический слой сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле. Элюированием смесью н-гексан:этилацетат (1:1) получали 646 мг (70%) указанного в заголовке соединения в виде бесцветного масла.
Аналогичную реакцию проводили исходя из 3-(R)-[1-трет-бутоксикарбониламино-1-(тиазол-2-ил)метил]-1-[1-(R)-фенил-этил]-2-пирролидина [F2] (83%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,43 (9Н, с), 1,65-1,84 (1Н, м), 1,84-2,00 (1Н, м), 2,75-2,91 (1Н, м), 3,22-3,39 (2Н, м), 3,47-3,68 (2Н, м), 4,98-5,12 (1Н, м), 5,12 (2Н, с), 5,53-5,62 (1Н, м), 7,24-7,35 (6Н, м), 7,71 (1Н, д, J=3,42 Гц).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,43 (9Н, с), 1,74-1,91 (1Н, м), 1,95-2,09 (1Н, м), 2,76-2,89 (1Н, м), 3,14-3,2 (1Н, м), 3,29-3,39 (2Н, м), 3,49-3,64 (2Н, м), 4,97-5,09 (1Н, м), 5,11 (2Н, с), 5,38-5,47 (1Н, м), 7,25-7,35 (6Н, м), 7,71 (1Н, д, J=3,42 Гц).
[Ссылочный пример 30]
Ди-трифторацетат 3-(R)-[1-амино-1-(тиазол-2-ил)метил]-1-пирролидина [F1], [F2]
3-(R)-[1-Трет-бутоксикарбониламино-1-(тиазол-2-ил)метил]-1-бензилоксикарбонилпирролидин [F1] (480 мг, 1,15 ммоль) смешивали с трифторуксусной кислотой (10 мл), смесь перемешивали при комнатной температуре в течение 1 ч и затем кипятили с обратным холодильником в течение 17 ч. После самопроизвольного охлаждения растворитель отгоняли при пониженном давлении и полученный остаток смешивали с толуолом (10 мл). Вновь при отгонке растворителя при пониженном давлении получали 473 мг (количественно) сырого указанного в заголовке соединения в виде бесцветного масла. Последнее использовали в последующей реакции без очистки.
Аналогичную реакцию проводили исходя из 3-(R)-[1-трет-бутоксикарбониламино-1-(тиазол-2-ил)метил]-1-бензилоксикарбонилпирролидина [F2].
[Пример по изобретению 13]
5-Амино-7-[3-(R)-(1-амино-1-(тиазол-2-ил)метил)-1-пирролидинил]-6,8-дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота [F1]
Ди-трифторацетат 3-(R)-[1-амино-1-(тиазол-2-ил)метил] пирролидина [F1] (473 мг, 1,15 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (253 мг, 0,8 ммоль) в ацетонитриле (10 мл) и смесь кипятили с обратным холодильником в течение 18 ч в присутствии триэтиламина (3 мл). После самопроизвольного охлаждения растворитель реакционного раствора отгоняли при пониженном давлении, полученный остаток смешивали с концентрированной соляной кислотой (15 мл) и перемешивали при комнатной температуре в течение 5 мин. Данный солянокислый водный раствор промывали хлороформом (20 мл × 3) и затем доводили до щелочной реакции добавлением 30% водного раствора гидроксида натрия при охлаждении льдом. Данную суспензию доводили до рН 7,6 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (100 мл × 3). Органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Последнее очищали двойной перекристаллизацией из этанола с получением 73 мг (19%) указанного в заголовке соединения в виде светлых желтых кристаллов.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,46-1,62 (2Н, м), 1,74-1,86 (1Н, м), 1,89-2,00 (1Н, м), 2,71-2,84 (1Н, м), 3,51-3,88 (5Н, м), 4,85-4,92 (0,5Н, м), 5,01-5,08 (0,5Н, м), 5,15 (1Н, д, J=3,42 Гц), 7,50 (1Н, д, J=3,42 Гц), 7,72 (1Н, д, J=3,42 Гц), 8,19 (1Н, с).
Точка плавления: 237, 2-241, 6° С (с разложением).
Элементный анализ: для C21H20F3N5O3S· 1,25H2O
Вычислено: С, 50,25; Н, 4,52; N, 13,95.
Найдено: С, 50,10; Н, 4,52; N, 14,09.
[Пример по изобретению 14]
5-Амино-7-[3-(R)-(1-амино-1-(тиазол-2-ил)метил)-1-пирролидинил]-6,8-дифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота [F2]
Ди-трифторацетат 3-(R)-[1-Амино-1-(тиазол-2-ил)метил] пирролидина [F2] (473 мг, 1,15 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (253 мг, 0,8 ммоль) в ацетонитриле (10 мл) и смесь кипятили с обратным холодильником в течение 18 ч в присутствии триэтиламина (3 мл). После самопроизвольного охлаждения растворитель реакционного раствора отгоняли при пониженном давлении, полученный остаток смешивали с концентрированной соляной кислотой (15 мл) и перемешивали при комнатной температуре в течение 5 мин. Данный солянокислый раствор промывали хлороформом (20 мл × 3) и затем доводили до щелочной реакции добавлением 30% водного раствора гидроксида натрия при охлаждении льдом. Данную суспензию доводили до рН 7,6 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (100 мл × 3). Органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении. Последнее очищали двойной перекристаллизацией из этанола с получением 113 мг (29%) указанного в заголовке соединения в виде светлых желтых кристаллов.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,46-1,62 (2Н, м), 1,74-1,86 (1Н, м), 1,90-2,00 (1Н, м), 2,73-2,85 (1Н, м), 3,58-3,88 (5Н, м), 4,84-4,92 (0,5Н, м), 5,01-,08 (0,5Н, м), 5,15 (1Н, д, J=9,27 Гц), 7,50 (1Н, д, J=3,42 Гц), 7,72 (1Н, д, J=3,42 Гц), 8,19 (1Н, с).
Точка плавления: 236,4-239,8° С (с разложением).
Элементный анализ: для C21H20F3N5O3S· 1,0Н2О
Вычислено: С, 50,70; Н, 4,46; N, 14,08.
Найдено: С, 50,90; Н, 4,42; N, 14,16.
[Ссылочный пример 31]
1-[1-(R)-Фенилэтил]-4-(R)-[(2-пиридил)карбонил]-2-пирролидон
В атмосфере азота и при -78° С н-бутиллитий (1,5 моль/л раствор в тетрагидрофуране; 13,2 мл, 19,9 ммоль) добавляли по каплям к раствору 2-бромпиридина (1,94 мл, 19,9 ммоль) в тетрагидрофуране (40 мл) и затем смесь перемешивали в течение 10 мин. Затем к последней при -78° С добавляли по каплям раствор N-метил-N-метокси-1-[1-(R)-фенилэтил]-5-оксопирролидин-3-(R)-карбоксамида (3,66 г, 13,2 ммоль) в тетрагидрофуране (20 мл) и смесь перемешивали в течение 30 мин. Реакционный раствор смешивали с 1 моль/л соляной кислотой (200 мл), подогревали до комнатной температуры и затем экстрагировали диэтиловым эфиром (200 мл × 2). Полученный органический слой промывали насыщенным раствором соли (100 мл) и сушили над безводным сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток подвергали колоночной хроматографии на силикагеле (силикагель, 100 г). Элюированием смесью н-гексан:этилацетат от (3:1) до (1:1) получали 1,97 г (52%) указанного в заголовке соединения в виде светлого желтого масла.
1H-ЯМР (400 МГц, СDСl3)δ : 1,54 (3Н, д, J=7,08 Гц), 2,80-2,83 (2Н, м), 3,35 (1Н, т, J=9,37 Гц), 3,61 (1Н, дд, J=6,35, 9,37 Гц), 4,49-4,54 (1Н, м), 5,54 (1H, kb, J - 7,08 Гц), 7,25-7,38 (5Н, м), 7,47-7,50 (1H, м), 7,86 (1H, дт, J=1,71, 7,81 Гц), 8,08 (2Н, д, J=7,81 Гц), 8,64-8,65 (1H, м).
[Ссылочный пример 32]
4-(R)-[1-Азидо-1-(2-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидон [F1], [F2]
При охлаждении льдом боргидрид натрия (233 мг, 6,15 ммоль) добавляли к раствору 1-[1-(R)-фенилэтил]-4-(R)-[(2-пиридил)карбонил]-2-пирролидона (1,81 г, 6,15 ммоль) в метаноле (40 мл) и смесь перемешивали при той же температуре в течение 30 мин. Реакционный раствор смешивали с насыщенным водным раствором хлоридом аммония (50 мл), перемешивали при комнатной температуре в течение 30 мин и затем экстрагировали хлороформом (100 мл × 3). Органический слой промывали насыщенным раствором соли (50 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении с получением 2,23 г (количественно) 4-(R)-[1-гидрокси-1-(2-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона в виде бесцветного масла (смесь изомеров 1:1). Последнее переводили в дихлорметан (40 мл), смешивали с триэтиламином (1,20 мл, 8,61 ммоль) и метансульфонилхлоридом (0,571 мл, 7,38 ммоль) при охлаждении льдом и перемешивали при комнатной температуре в течение 30 мин. Реакционный раствор промывали насыщенным водным раствором хлорида аммония (50 мл) и насыщенным раствором соли (50 мл), органический слой сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в N,N-диметилформамиде (15 мл), смешивали с азидом натрия (1,00 г, 15,4 ммоль) и затем нагревали при 50° С в течение 15 ч. После охлаждения льдом реакционный раствор смешивали с водой (50 мл) и экстрагировали этилацетатом (50 мл × 2), полученный органический слой промывали водой (40 мл × 3) и насыщенным раствором соли (40 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле (силикагель, 100 г). Элюированием смесью н-гексан: этилацетат от (1:1) до (1:3) последовательно получали 754 мг (38%) указанного в заголовке соединения с низкой полярностью [F1] и 651 мг (33%) указанного в заголовке соединения с высокой полярностью [F2], каждое в виде бесцветного масла.
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,48 (3Н, д, J=7,20 Гц), 2,52-2,55 (2Н, м), 2,86-2,95 (2Н, м), 3,13 (1Н, дд, J=5,62, 9,28 Гц), 4,50 (1Н, д, J=7,32 Гц), 5,47 (1Н, kb, J=7,20 Гц), 7,23-7,34 (7Н, м), 7,75 (1H, дт, J=1,71, 7,69 Гц), 8,58-8,60 (1Н, м).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,53 (3Н, д, J=7,21 Гц), 2,23 (1H, дд, J=7,81, 17,09 Гц), 2,34 (1Н, дд, J=9,03, 17,09 Гц), 2,86-2,96 (1Н, м), 3,13 (1Н, дд, J=8,06, 10,13 Гц), 3,36 (1Н, дд, J=6,35, 10,13 Гц), 4,45 (1Н, д, J=8,55 Гц), 5,48 (1Н, kb, J=7,21 Гц), 7,26-7,36 (7Н, м), 7,75 (1H, дт, J=1,71, 7,69 Гц), 8,62 (1H, д, J=3,91 Гц).
[Ссылочный пример 33]
4-(R)-[1-Трет-бутоксикарбониламино-1-(2-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидон [F1], [F2]
Раствор 4-(R)-[1-азидо-1-(2-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (619 мг, 1,93 ммоль) в этаноле (30 мл) смешивали с катализатором 10% палладием на угле (влажность 53,8%, 620 мг) и проводили каталитическое гидрирование при комнатной температуре в течение 20 мин при нормальном давлении. Реакционный раствор фильтровали и растворитель фильтрата отгоняли при пониженном давлении. Раствор полученного остатка в дихлорметане (20 мл) смешивали с ди-трет-бутилдикарбонатом (463 мг, 2,12 ммоль) и триэтиламином (350 мкл, 2,51 ммоль) и перемешивали при комнатной температуре в течение 17 ч. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле (силикагель, 40 г). Элюированием смесью н-гексан: этилацетат от (1:1) до (1:3) получали 750 мг (87%) указанного в заголовке соединения [F1] в виде бесцветного аморфного вещества.
Аналогичную реакцию проводили исходя из 4-(R)-[1-азидо-1-(2-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (50%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,39 (3Н, д, J=7,20 Гц), 1,44 (9Н, с), 2,37-2,42 (1Н, м), 2,48-2,54 (1Н, м), 2,77-2,79 (1Н, м), 2,89-2,94 (1Н, м), 3,25-3,27 (1Н, м), 4,82-4,84 (1Н, м), 5,40 (1Н, kb, J=7,20 Гц), 5,89 (1Н, д, J=7,32 Гц), 7,19-7,32 (7Н, м), 7,65 (1Н, дт, J=1,79, 7,69 Гц), 8,53 (1Н, д, J=4,39 Гц).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,42 (9Н, с), 1,52 (3Н, д, J=7,10 Гц), 2,24-2,26 (1H, м), 2,66-2,72 (1Н, м), 3,01 (1Н, дд, J=8,33, 10,04 Гц), 3,35 (1Н, дд, J=6,61, 10,04 Гц), 4,72 (1Н, т, J=8,33 Гц), 5,46 (1Н, kb, J=7,10 Гц), 5,61 (1Н, д, J=8,33 Гц), 7,19-7,34 (7Н, м), 7,64 (1H, дт, J=1,72, 7,72 Гц), 8,52-8,54 (1H, м).
[Ссылочный пример 34]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидин [F1], [F2]
В атмосфере азота 1М комплекс боран-тетрагидрофуран (6,76 мл, 6,76 ммоль) добавляли по каплям к раствору 4-(R)-[1-трет-бутоксикарбониламино-1-(2-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (668 мг, 1,69 ммоль) в тетрагидрофуране (15 мл) при охлаждении льдом и затем смесь перемешивали при комнатной температуре в течение 16 ч. После отгонки растворителя при пониженном давлении полученный остаток смешивали с 80% водным этанолом (15 мл) и кипятили с обратным холодильником в течение 4 ч в присутствии триэтиламина (1 мл). После самопроизвольного охлаждения реакционного раствора растворитель отгоняли при пониженном давлении, к полученному остатку добавляли хлороформ (50 мл) и затем органический слой промывали водой (40 мл) и насыщенным раствором соли (40 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле (силикагель, 20 г). Элюированием смесью хлороформ:метанол от (100:0) до (95:5) получали 600 мг (93%) указанного в заголовке соединения в виде белых кристаллов.
Аналогичную реакцию проводили исходя из 4-(R)-[1-трет-бутоксикарбониламино-1-(2-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (87%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,34 (3Н, д, J=6,43 Гц), 1,47 (9Н, с), 1,67-1,70 (1Н, м), 2,23-2,35 (4Н, м), 2,67-2,69 (1Н, м), 2,86-2,91 (1Н, м), 3,13 (1Н, кв, J=6,43 Гц), 4,62 (1Н, т, J=6,00 Гц), 6,35 (1H, с), 7,10-7,13 (1Н, м), 7,13-7,33 (6Н, м), 7,57-7,62 (1Н, м), 8,50 (1Н, д, J=4,16 Гц).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,39 (3Н, д, J=6,61 Гц), 1,46 (9Н, с), 1,71-1,74 (1Н, м), 1,91-1,94 (1Н, м), 2,22-2,36 (4Н, м), 2,66 (1Н, с), 2,94-2,95 (1Н, м), 3,15-3,17 (1Н, м), 4,60-4,63 (1Н, м), 6,60-6,69 (1H, м), 7,04-7,08 (1Н, м), 7,21-7,32 (6Н, м), 7,51 (1H, дт, J=1,71, 7,72 Гц), 8,47 (1H, Д, J=4,16 Гц).
[Ссылочный пример 35]
3-(R)-[1-Трет-бутоксикарбониламино-1 -(2-пиридил)метил]-1-бензилоксикарбонилпирролидин [F1], [F2]
В атмосфере азота бензилхлорформиат (728 мкл, 5,09 ммоль) добавляли по каплям к раствору 3-(R)-[1-трет-бутоксикарбониламино-1-(2-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидина [F1] (648 мг, 1,70 ммоль) в дихлорэтане (20 мл) при охлаждении льдом и затем смесь кипятили с обратным холодильником в течение 30 ч. После отгонки растворителя при пониженном давлении остаток подвергали колоночной хроматографии на силикагеле (силикагель, 40 г). Элюированием смесью хлороформ: метанол от (100:0) до (97:3) получали 500 мг (72%) указанного в заголовке соединения в виде белых кристаллов.
Аналогичную реакцию проводили исходя из 3-(R)-[1-трет-бутоксикарбониламино-1-(2-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидина [F2] (61%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,40-1,45 (1Н, м), 1,42 (9, с), 1,86-1,94 (1Н, м), 2,59-2,62 (1H, м), 3,04-3,11 (1Н, м), 3,22-3,33 (2Н, м), 3,54-3,58 (1H, м), 4,66-4,72 (1H, м), 5,09 (2Н, с), 5,71-5,73 (1H, м), 7,16-7,34 (7Н, м), 7,63 (1H, дт, J=1,71, 7,59 Гц), 8,53 (1H, д, J=3,92 Гц).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,42 (9, с), 1,58-1,67 (2Н, м), 2,61-2,67 (1H, м), 3,27-3,55 (4Н, м), 4,70-4,80 (1H, м), 5,10 (1H, с), 5,12 (1H, с), 5,71-5,78 (1H, м), 7,17-7,36 (7Н, м), 7,60-7,63 (1H, м), 8,55 (1H, с).
[Ссылочный пример 36]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2-пиридил)метил] пирролидин [F1], [F2]
Раствор 3-(R)-[1-трет-бутоксикарбониламино-1-(2-пиридил)-метил]-1-бензилоксикарбонилпирролидина [F1] (500 мг, 1,22 ммоль) в этаноле (20 мл) смешивали с катализатором 10% палладием на угле (влажность 53,8%, 500 мг) и проводили каталитическое гидрирование при комнатной температуре в течение 18 ч при нормальном давлении. Реакционный раствор фильтровали и растворитель фильтрата отгоняли при пониженном давлении с получением сырого указанного в заголовке соединения в виде бесцветных кристаллов. Последнее использовали в последующей реакции без очистки.
Аналогичную реакцию проводили исходя из 3-(R)-[1-трет-бутоксикарбониламино-1-(2-пиридил)метил]-1-бензилоксикарбонилпирролидина [F2].
[Пример по изобретению 15]
5-Амино-7-{3-(R)-[1-амино-1-(2-пиридил)метил]-1-пирролидинил}-6,8-дифтор-1-[(1R,2S)-2-фторциклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота [F2]
3-(R)-[1-Трет-бутоксикарбониламино-1-(2-пиридил)метил]пирролидин [F1] (339 мг, 1,22 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (316 мг, 1,00 ммоль) в ацетонитриле (10 мл) и смесь кипятили с обратным холодильником в течение 14 ч в присутствии триэтиламина (0,5 мл). После охлаждения растворитель реакционного раствора отгоняли при пониженном давлении. Полученный остаток растворяли в хлороформе (150 мл), промывали 10% лимонной кислотой (80 мл) и насыщенным раствором соли (80 мл), сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Полученный остаток смешивали с концентрированной соляной кислотой (10 мл) при охлаждении льдом, затем смешивали с 1 моль/л водным раствором соляной кислоты (5 мл) при комнатной температуре, и затем промывали хлороформом (50 мл × 4) и нерастворимое вещество удаляли фильтрованием. Данный солянокислый водный раствор доводили до щелочной реакции добавлением 10 моль/л водным раствором гидроксида натрия. Данную суспензию доводили до рН добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (150 мл × 4). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением сырого указанного в заголовке соединения в виде светлых желтых кристаллов. Последнее очищали перекристаллизацией из этанола с получением 316 мг (67%) указанного в заголовке соединения.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,45-1,47 (2Н, м), 1,75-1,77 (1Н, м), 2,25-2,27 (1Н, м), 2,48-2,50 (1Н, м), 2,97-3,00 (1Н, м), 3,30-3,83 (5Н, м), 4,76 (1Н, ушд, J=62,50 Гц), 7,35-7,44 (2Н, м), 8,52 (1H, т, J=7,81 Гц), 8,12 (1H, с), 8,46 (1H, д, J=4,39 Гц).
Точка плавления: 194-196° С.
Элементный анализ: для С23H22F3N5O3·0,5EtOH· 0,5H2O
Вычислено; С, 57,03; Н, 5,18; N, 13,85.
Найдено: С, 57,03; Н, 5,11; N, 13,85.
[Пример по изобретению 16]
5-Амино-7-{3-(R)-[1-амино-1-(2-пиридил)метил]-1-пирролидинил}-6,8-дифтор-1-[(1R,2S)-2-фторциклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота
3-(R)-[1-Трет-бутоксикарбониламино-1-(2-пиридил)метил]пирролидин [F2] (0,535 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (169 мг, 0,534 ммоль) в ацетонитриле (5 мл) и смесь кипятили с обратным холодильником в течение 19 ч в присутствии триэтиламина (0,5 мл). После охлаждения растворитель реакционного раствора отгоняли при пониженном давлении. Полученный остаток растворяли в хлороформе (50 мл), промывали 10% лимонной кислотой (40 мл) и насыщенным раствором соли (40 мл), сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Полученный остаток смешивали с концентрированной соляной кислотой (5 мл) при охлаждении льдом, дополнительно смешивали с 1 моль/л водным раствором соляной кислоты (5 мл) при комнатной температуре и затем промывали хлороформом (50 мл × 5). Данный солянокислый водный раствор доводили до щелочной реакции добавлением 10 моль/л водного раствора гидроксида натрия и затем перемешивали при комнатной температуре в течение 1 ч. Данную суспензию доводили до рН 7,4 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (150 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением сырого указанного в заголовке соединения в виде светлых желтых кристаллов. Последнее очищали перекристаллизацией из этанола с получением 136 мг (54%) указанного в заголовке соединения.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,52-1,54 (3Н, м), 2,49-2,51 (2Н, м), 3,41-3,86 (6Н, м), 4,69-4,77 (1Н, м), 7,35-7,42 (2Н, м), 7,82-7,86 (1Н, м), 8,17 (1Н, с), 8,46 (1Н, с).
Точка плавления: 178-180° С.
Элементный анализ: для С23Н22F3N5O3·0,75Н2O
Вычислено: С, 56,73; Н, 4,86; N, 14,38.
Найдено: С, 56,50; Н, 4,81; N, 14,29.
[Пример по изобретению 17]
5-Амино-7-{3-(R)-[1-амино-1-(2-пиридил)метил]-1-пирролидинил}-6-фтор-1-[(1R,23)-2-фторциклопропил]-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновая кислота (F2: D91-5400)
3-(R)-[1-Трет-бутоксикарбониламино-1-(2-пиридил)метил]-пирролидин [F2] (1,00 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(8)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (284 мг, 0,910 ммоль) в диметилсульфоксиде (3 мл) и смесь перемешивали при 80°С в течение 93 ч в присутствии N-метилпиперидина (0,146 мл, 1,09 ммоль). После охлаждения растворитель реакционного раствора отгоняли при пониженном давлении. Полученный остаток растворяли в хлороформе (50 мл), промывали 10% лимонной кислотой (50 мл) и насыщенным раствором соли (40 мл), сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Полученный остаток подвергали колоночной хроматографии на силикагеле (силикагель, 40 г), элюировали смесью хлороформ:метанол от (100:0) до (98:2) и затем растворитель в элюате отгоняли при пониженном давлении. Полученный остаток смешивали с концентрированной соляной кислотой (5 мл) при охлаждении льдом, затем смешивали с 1 моль/л водным раствором соляной кислотой (5 мл) при комнатной температуре и затем промывали хлороформом (50 мл × 4). Данный солянокислый водный раствор доводили до щелочной реакции добавлением 10 моль/л водным раствором гидроксида натрия. Данную суспензию доводили до рН 7,4 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (150 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия, растворитель отгоняли при пониженном давлении и затем полученный остаток частично очищали ТСХ на бумаге (Ватман, PLK5F, 150  ) с получением сырого указанного в заголовке соединения в виде светлых желтых кристаллов. Полученное очищали перекристаллизацией из изопропилового спирта с получением 70,0 мг (16%) указанного в заголовке соединения.
) с получением сырого указанного в заголовке соединения в виде светлых желтых кристаллов. Полученное очищали перекристаллизацией из изопропилового спирта с получением 70,0 мг (16%) указанного в заголовке соединения.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,02-1,11 (1Н, м), 1,46-1,59 (2Н, м), 2,20-2,26 (1Н, м), 2,23 (1H, с), 2,58-2,61 (1Н, м), 3,13-3,17 (1H, м), 3,45-3,64 (3Н, м), 3,87-3,92 (2Н, м), 4,78-4,83 (1H, м), 7,34-7,45 (2Н, м), 7,85-7,87 (1H, м), 8,27 (1H, с), 8,45 (1H, с).
Точка плавления: 127-129° С.
Элементный анализ: для С24Н25F2Н5O3·1,25H2O
Вычислено: С, 58,59; Н, 5,63; N, 14,23.
Найдено: С, 58,69; Н, 5,52; N, 14,25.
[Ссылочный пример 37]
1-[1-(R)-Фенилэтил]-4-(R)-[(3-пиридил)карбонил]-2-пирролидон
В атмосфере азота и при -78° С н-бутиллитий (1,5 моль/л раствор в тетрагидрофуране; 18,1 мл, 27,2 ммоль) добавляли по каплям к раствору 3-бромпиридина (2,61 мл, 27,2 ммоль) в тетрагидрофуране (200 мл) и затем смесь перемешивали в течение 10 мин. Затем к последней добавляли по каплям при -78° С раствор N-метил-N-метокси-1-[1-(R)-фенилэтил]-5-оксопирролидин-3-карбоксамида (5,00 г, 18,1 ммоль) в тетрагидрофуране (15 мл) и смесь перемешивали в течение 30 мин. Реакционный раствор смешивали с 1 моль/л соляной кислотой (100 мл), подогревали до комнатной температуры, экстрагировали хлороформом (200 мл × 2), затем полученный органический слой промывали насыщенным раствором соли (100 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении, и полученный остаток подвергали колоночной хроматографии на силикагеле (силикагель, 100 г). Элюированием смесью н-гексан: этилацетат от (1:4) до (0:100) получали 2,16 г (41%) указанного в заголовке соединения в виде светлого желтого масла.
1H-ЯМР (400 МГц, СDСl3)δ : 1,56 (3Н, д, J=7,32 Гц), 2,82 (2Н, д, J=7,32 Гц), 3,20-3,27 (1Н, м), 3,70-3,74 (1Н, м), 3,97-4,01 (1Н, м), 5,51-5,55 (1Н, м), 7,26-7,47 (6Н, м), 8,21 (1Н, д, J=8,06 Гц), 8,81 (1Н, д, J=4,39 Гц), 9,09 (1Н, с).
[Ссылочный пример 38]
4-(R)-[1-Азидо-1-(3-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидон [F1], [F2]
При охлаждении льдом боргидрид натрия (580 мг, 15,3 ммоль) добавляли к раствору 1-[1-(R)-фенилэтил]-4-(R)-[(3-пиридил) карбонил]-2-пирролидона (4,51 г, 15,3 ммоль) в метаноле (90 мл) и смесь перемешивали при той же температуре в течение 30 мин. Реакционный раствор смешивали с насыщенным водным раствором хлорида аммония (50 мл), перемешивали в течение 30 мин и затем экстрагировали этилацетатом (100 мл × 3). Органический слой промывали насыщенным раствором соли (50 мл) и затем сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении с получением 3,88 г (86%) промежуточного соединения 4-(R)-[1-гидрокси-1-(3-пиридил) метил]-1-[1-(R)-фенилэтил]-2-пирролидона в виде бесцветного масла. Последнее переводили в дихлорметан (100 мл), смешивали с триэтиламином (3,10 мл, 22,3 ммоль) и метансульфонилхлоридом (1,52 мл, 19,7 ммоль) при охлаждении льдом и затем перемешивали при комнатной температуре в течение 30 мин. Реакционный раствор промывали насыщенным водным раствором хлорида аммония (100 мл) и насыщенным раствором соли (100 мл), органический слой сушили над безводным сульфатом натрия, и затем растворитель отгоняли при пониженном давлении. Полученный остаток растворяли в N,N-диметилформамиде (30 мл), смешивали с азидом натрия (2,49 г, 32,8 ммоль) и затем нагревали при 40° С в течение 14 ч. После охлаждения льдом реакционный раствор смешивали с водой (100 мл) и экстрагировали этилацетатом (100 мл × 2), полученный органический слой промывали водой (80 мл × 3) и насыщенным раствором соли (80 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле (силикагель, 100 г). Элюированием смесью н-гексан: этилацетат (3:5), этилацетатом и смесью хлороформ:метанол (90:10) последовательно получали 976 мг (23%) указанного в заголовке соединения с низкой полярностью [F1] и 1,73 г (41%) указанного в заголовке соединения с высокой полярностью [F2], каждый в виде бесцветного масла.
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,48 (3Н, д, J=7,08 Гц), 2,54-2,64 (3Н, м), 2,82-2,86 (1Н, м), 2,96 (1Н, дд, J=5,86, 10,01 Гц), 4,44 (1Н, д, J=7,33 Гц), 5,48 (1Н, kb, J=7,08 Гц), 7,21-7,62 (6Н, м), 7,64 (1H, д, J=6,10 Гц), 8,54 (1H, д, J=1,95 Гц), 8,63 (1H, дд, J=1,47, 4,86 Гц).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,54 (3Н, д, J=7,08 Гц), 2,11-2,18 (1H, м), 2,26-2,33 (1H, м), 2,56-2,68 (1H, м), 3,13-3,29 (2Н, м), 4,43 (1H, д, J=9,28 Гц), 5,46-5,53 (1H, м), 7,24-7,38 (6Н, м), 7,63 (1H, дт, J=1,95, 7,81 Гц), 8,57 (1H, д, J=2,20 Гц), 8,64 (1H, дд, J=1,71, 4,88 Гц).
[Ссылочный пример 39]
4-(R)-[1-Трет-бутоксикарбониламино-1-(3-пиридил)метил 3-1-[1-(R)-фенилэтил]-2-пирролидон [F1], [F2]
Раствор 4-(R)-[1-азидо-1-(3-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (976 мг, 3,04 ммоль) в этаноле (30 мл) смешивали с катализатором 10% палладием на угле (влажность 53,8%, 1,00 г) и проводили каталитическое гидрирование при комнатной температуре в течение 1 ч при нормальном давлении. Реакционный раствор фильтровали и растворитель фильтрата отгоняли при пониженном давлении. Раствор полученного остатка в дихлорметане (20 мл) смешивали с трет-бутилдикарбонатом (729 мг, 3,34 ммоль) и триэтиламином (551 мкл, 3,95 ммоль) и перемешивали при комнатной температуре в течение 16 ч. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле (силикагель, 20 г). Элюированием смесью хлороформ: метанол от (100:0) до (95:5) получали 654 мг (54%) указанного в заголовке соединения [F1] в виде бесцветного аморфного вещества.
Аналогичную реакцию проводили исходя из 4-(R)-[1-азидо-1-(3-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (36%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,41 (9Н, с), 1,47 (3Н, д, J=7,32 Гц), 2,44-2,50 (1Н, м), 2,57-2,64 (1Н, м), 2,63-2,67 (1Н, м), 2,83-2,87 (1Н, м), 2,97-3,01 (1Н, м), 4,68-4,72 (1Н, м), 4,91-4,92 (1Н, м), 5,48 (1Н, кв, J=7,32 Гц), 7,21-7,32 (6Н, м), 7,55 (1Н, д, J=7,81 Гц), 8,52-8,55 (1Н, м).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,39 (9Н, с), 1,53 (3Н, д, J=7,17 Гц), 2,13 (1Н, дд, J=8,08, 16,9 Гц), 2,27 (1Н, дд, J=8,57, 16,4 Гц), 2,61-2,65 (1H/ м), 3,11-3,16 (1Н, м), 3,25-3,30 (1Н, м), 4,62-4,66 (1H, м), 4,77-4,81 (1Н, м), 5,48 (1H, kb, J=7,17 Гц), 7,26-7,36 (6Н, м), 7,54 (1H, д, J=7,35 Гц), 8,54 (2Н, дд, J=1,71, 4,90 Гц).
[Ссылочный пример 40]
3-(R)-[1-Трет-бутоксикарбониламино-1-(3-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидин [F1], [F2]
В атмосфере азота 1М комплекс боран-тетрагидрофуран (7,74 мл, 7,74 ммоль) добавляли по каплям к раствору 4-(R)-[1-трет-бутоксикарбониламино-1-(3-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона [F1] (612 мг, 1,55 ммоль) в тетрагидрофуране (12 мл) при охлаждении льдом и затем смесь перемешивали при комнатной температуре в течение 18 ч. После отгонки растворителя при пониженном давлении полученный остаток растворяли в 80% водном этаноле (20 мл) и кипятили с обратным холодильником в течение 4 ч в присутствии триэтиламина (1 мл). После самопроизвольного охлаждения реакционного раствора растворитель отгоняли при пониженном давлении, к полученному остатку добавляли хлороформ (40 мл), затем полученный органический слой промывали водой (30 мл) и насыщенным раствором соли (30 мл) и сушили над безводным сульфатом натрия. Растворитель отгоняли при пониженном давлении и полученный остаток подвергали колоночной хроматографии на силикагеле (силикагель, 10 г). Элюированием смесью хлороформ: метанол от (100:0) до (97:3) получали 461 мг (78%) указанного в заголовке соединения в виде белых кристаллов.
Аналогичную реакцию проводили исходя из 4-(R)-[1-трет-бутоксикарбониламино-1-(3-пиридил)метил]-1-[1-(R)-фенилэтил]-2-пирролидона [F2] (71%).
[F1];
1H-ЯМР (400 МГц, СDСl3)δ : 1,37 (3Н, д, J=6,59 Гц), 1,49 (9Н, с), 2,17-2,25 (2Н, м), 2,42-2,45 (2Н, м), 2,95-3,16 (2Н, м), 4,53-4,57 (1Н, м), 6,44-6,48 (1Н, м), 7,21-7,35 (6Н, м), 7,52-7,54 (1Н, м), 8,46 (1Н, дд, J=1,47, 4,88 Гц), 8,50 (1Н, с).
[F2];
1H-ЯМР (400 МГц, СDСl3)δ : 1,41 (3Н, д, J=6,59 Гц), 1,47 (9Н, с), 2,00-2,04 (2Н, м), 2,20-2,26 (1Н, м), 2,36-3,41 (2Н, м), 3,14-3,21 (1Н, м), 4,53-4,56 (1Н, м), 6,99-7,01 (1Н, м), 7,10-7,13 (1Н, м), 7,26-7,35 (6Н, м), 8,35-8,39 (2Н, м).
[Ссылочный пример 41]
3-(R)-[1-Трет-бутоксикарбониламино-1-(3-пиридил)метил] пирролидин [F1], [F2]
Раствор 3-(R)-[1-трет-бутоксикарбониламино-1-(3-пиридил) метил]-1-[1-(R)-фенилэтил]пирролидин [F1] (105 мг, 0,275 ммоль) в этаноле (10 мл) смешали с катализатором 10% палладием на угле (влажность 53,8%, 105 мг) и проводили каталитическое гидрирование при 40°С в течение 23 ч при нормальном давлении. Реакционный раствор фильтровали и растворитель фильтрата отгоняли при пониженном давлении с получением сырого указанного в заголовке соединения в виде бесцветных кристаллов. Последнее непосредственно использовали на последующей стадии.
Аналогичную реакцию проводили исходя из 3-(R)-[1-трет-бутоксикарбониламино-1-(3-пиридил)метил]-1-[1-(R)-фенилэтил]пирролидина [F2].
[Пример по изобретению 18]
5-Амино-7-{3-(R)-[1-амино-1-(3-пиридил)метил]-1-пирролидинил}-6,8-дифтор-1-[(1R,2S)-2-фторциклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота
3-(R)-[1-Трет-бутоксикарбониламино-1-(3-пиридил)метил]пирролидин [F1] (70 мг, 0,252 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (87,0 мг, 0,275 ммоль) в ацетонитриле (3 мл) и смесь кипятили с обратным холодильником в течение 19 ч в присутствии триэтиламина (0,3 мл). После охлаждения растворитель реакционного раствора отгоняли при пониженном давлении. Полученный остаток растворяли в хлороформе (50 мл), промывали 10% лимонной кислотой (40 мл) и насыщенным раствором соли (40 мл), сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Полученный остаток смешивали с концентрированной соляной кислотой (2 мл) при охлаждении льдом, затем смешивали с 1 моль/л водным раствором соляной кислоты (2 мл) при комнатной температуре, затем промывали хлороформом (30 мл × 4) и нерастворимое вещество удаляли фильтрованием. Данный солянокислый раствор доводили до щелочной реакции добавлением 10 моль/л водного раствора гидроксида натрия. Данную суспензию доводили до рН 7,4 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (150 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением сырого указанного в заголовке соединения в виде светлых желтых кристаллов. Последнее очищали перекристаллизацией из смеси этанолводный аммиак с получением 65,1 мг (54%) указанного в заголовке соединения.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,32-1,38 (2Н, м), 1,54-1,58 (1Н, м), 2,19-2,21 (1Н, м), 2,30-2,35 (1Н, м), 2,79-2,81 (1H, м), 3,08-3,10 (1H, м), 3,34-3,69 (41Н, м), 4,77-4,81 (1Н, дм), 7,43 (1H, д, J=7,57 Гц), 7,79 (1H, д, J=7,57 Гц), 8,12 (1H, с), 8,43-8,45 (2Н, м).
Точка плавления: 263-265° С (с разложением).
Элементный анализ: для С23Н22F3N5O3·0,25Н2O
Вычислено: С, 57,80; Н, 4,74; N, 14,65.
Найдено: С, 57,62; Н, 4,81; N, 14,30.
[Пример по на обретению 19]
5-Амино-7-{3-(R)-[1-амино-1-(3-пиридил)метил]-1-пирролидинил}-6,8-дифтор-1-[(1R,2S)-2-фторциклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота
3-(R)-[1-Трет-бутоксикарбониламино-1-(3-пиридил)метил]пирролидин [F2] (0,461 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-диги-дро-4-оксохинолин-3-карбоновой кислоты (156 мг, 0,493 ммоль) в ацетонитриле (5 мл) и смесь кипятили с обратным холодильником в течение 19 ч в присутствии триэтиламина (0,5 мл). После охлаждения растворитель реакционного раствора отгоняли при пониженном давлении. Полученный остаток растворяли в хлороформе (50 мл), промывали 10% лимонной кислотой (40 мл) и насыщенным раствором соли (40 мл), сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Полученный остаток смешивали с концентрированной соляной кислотой (5 мл) при охлаждении льдом, затем смешивали с 1 моль/л водным раствором соляной кислоты (5 мл) при комнатной температуре и затем промывали хлороформом (50 мл × 5). Данный солянокислый водный раствор доводили до щелочной реакции добавлением 10 моль/л водного раствора гидроксида натрия, затем доводили до рН 7,4 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (150 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении с получением сырого указанного в заголовке соединения в виде светлых желтых кристаллов. Полученное очищали перекристаллизацией из этанола с получением 71,5 мг (32%) указанного в заголовке соединения.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,36-1,45 (2Н, м), 1,53-1,59 (2Н, м), 2,42-2,47 (1Н, м), 3,40-3,81 (6Н, м), 4,95-5,01 (1H, дм), 7,46 (1H, д, J=6,35 Гц), 7,83 (1H, д, J=7,57 Гц), 8,18 (1H, с), 8,44-8,48 (2Н, м).
Точка плавления: 123-126° С.
Элементный анализ: для C23H22F3N5O3·1H2O
Вычислено: С, 56,21; Н, 4,92; N, 14,25.
Найдено: С, 56,43; Н, 4,87; N, 14,05.
[Пример по изобретению 20]
5-Амино-7-{3-(R)-[1-амино-1-(3-пиридил)метил]-1-пирролидинил}-6-фтор-1-[(1R,2S)-2-фторциклопропил]-1,4-дигидро-4-оксохинолин-3-карбоновая кислота
3-(R)-[1-Трет-бутоксикарбониламино-1-(3-пиридил)метил] пирролидин [F2] (1,60 ммоль) добавляли к суспензии 5-амино-6,7,8-трифтор-1-[2-(S)-фтор-1-(R)-циклопропил]-1,4-дигидро-8-метил-4-оксохинолин-3-карбоновой кислоты (427 мг, 1,33 ммоль) в диметилсульфоксиде (3 мл) и смесь перемешивали при 80° С в течение 161 ч в присутствии N-метилпиперидина (0,356 мл, 2,93 ммоль). После охлаждения растворитель реакционного раствора отгоняли при пониженном давлении. Полученный остаток растворяли в хлороформе (100 мл), промывали 10% лимонной кислотой (50 мл) и насыщенным раствором соли (40 мл), сушили над безводным сульфатом натрия и затем растворитель отгоняли при пониженном давлении. Полученный остаток смешивали с концентрированной соляной кислотой (5 мл) при охлаждении льдом, затем смешивали с 1 моль/л водным раствором соляной кислоты (5 мл) при комнатной температуре и затем промывали хлороформом (30 мл× 4). Данный солянокислый водный раствор доводили до щелочной реакции добавлением 10 моль/л водного раствора гидроксида натрия. Данную суспензию доводили до рН 7,4 добавлением концентрированной соляной кислоты и 1 моль/л соляной кислоты и затем экстрагировали хлороформом (150 мл × 3). Полученный органический слой сушили над безводным сульфатом натрия и растворитель отгоняли при пониженном давлении, затем полученный остаток частично очищали ТСХ на бумаге (Ватман, PLK5F, 150  ) с получением 100 мг сырого указанного в заголовке соединения в виде светлых желтых кристаллов. Последнее очищали перекристаллизацией из изопропилового спирта с получением 62,2 мг (10%) указанного в заголовке соединения.
) с получением 100 мг сырого указанного в заголовке соединения в виде светлых желтых кристаллов. Последнее очищали перекристаллизацией из изопропилового спирта с получением 62,2 мг (10%) указанного в заголовке соединения.
1H-ЯМР (400 МГц, 0,1 мол/л NaOD)δ : 1,04-1,06 (1Н, м), 1,11-1,13 (1H, м), 1,45-1,49 (2Н, м), 1,58-1,60 (1H, м), 2,23 (3Н, с), 2,56-2,59 (1H, м), 3,14-3,16 (1H, м), 3,49-3,51 (1H, м), 3,59-3,62 (2Н, м), 3,85-3,89 (2Н, м}, 4,88-5,04 (1H, дм), 7,46 (1H, с), 7,86 (1H, д, J=7,34 Гц), 8,27 (1H, с), 8,45 (1H, д, J=4,89 Гц), 8,51 (1H, с).
Точка плавления: 213-215° С.
Элементный анализ: для C24H25F2N5O3·0,5H2O
Вычислено: С, 60,24; Н, 5,48; N, 14,64.
Найдено: С, 60,46; Н, 5,46; N, 14,55.
Антибактериальную активность соединений по изобретению определяли стандартным методом, описанным Японским Обществом Химиотерапии с результатами, представленными в табл.2 в виде значений MIC (мкг/мл). В данной связи также представлены значения MIC для левофлоксацина (LVFX), ципрофлоксацина (CPFX) и 5-амино-7-[3-(R)-[1-(S)-аминоэтил] пирролидин-1-ил]-6-фтор-1-[2-(S)-фтор-1-(R)-циклопропил-8-метил-1,4-дигидро-4-оксохинолин-3-карбоновой кислоты (контрольное лекарство 1), описанной в WO 9623782, для сравнения со значениями MIC соединений по изобретению.
LVFX – левофлоксацин
CPFX - ципрофлоксацин
Промышленная применимость
Соединения по изобретению являются хинолоновым соединением, представленным следующей формулой:
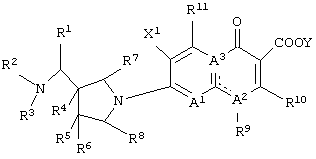
и хинолоновым соединением, представленным следующей формулой:
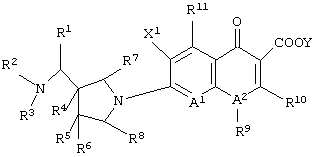
или следующей формулой:
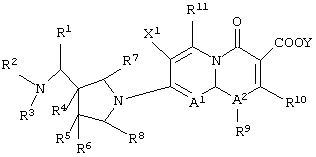
в которых заместитель R1 представляет ароматический заместитель, которые полезны в качестве антибактериальных соединений за счет их превосходной антибактериальной активности против грамотрицательных бактерий и грамположительных бактерий, а также против различных резистентных к препаратам штаммов.
Изобретение относится к новым производным аминометилпирролидина, формулы (I), их солям или их гидратам:
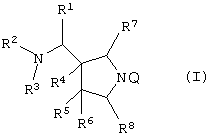
где R1 представляет арил, имеющий от 6 до 10 атомов углерода, или гетероарил,
где гетероарил является пятичленным кольцом или шестичленным кольцом и включает от 1 до 2 гетероатомов, выбранных из азота, кислорода и атома серы,
где арил и гетероарил могут иметь один или более заместителей, выбранных из группы, состоящей из атома галогена или С1-С6алкоксила;
R2, R3, R4, R5, R6, R7, R8 каждый независимо означает H;
Q представляет неполную структуру, представленную следующей формулой:
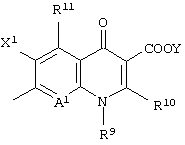
в которой R9 означает С3-С6циклический алкил, который может быть замещен галогеном;
R10 означает Н;
R11 означает H, NH2;
Х1 означает галоген;
А1 представляет неполную структуру, представленную формулой (II)
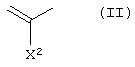
в которой X2 означает H, галоген, галогенметоксил, С1-С6алкил, или С1-С6алкоксил;
X2 и указанный выше R9 могут быть объединены с образованием кольцевой структуры включением части основного скелета, и образованное таким образом кольцо включает атом кислорода, атом азота или атом серы в качестве составляющего кольцо атома, и кольцо может также иметь в качестве заместителя С1-С6алкил;
Y означает H;
Соединения формулы I обладают антибактериальным действием, что позволяет их использовать для получения терапевтического агента. 2 табл.
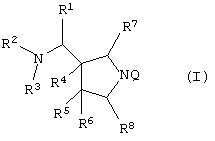
в которой R1 представляет арил, имеющий от 6 до 10 атомов углерода, или гетероарил, где гетероарил является пятичленным кольцом или шестичленным кольцом и включает от 1 до 2 гетероатомов, выбранных из атома азота, атома кислорода и атома серы,
где арил и гетероарил могут иметь один или более заместителей, выбранных из группы, состоящей из атома галогена или алкоксила, имеющего от 1 до 6 атомов углерода;
R2 и R3 каждый независимо представляет атом водорода;
R4, R5 и R6 каждый представляет атом водорода;
R7 и R8 каждый представляет атом водорода;
Q представляет неполную структуру, представленную следующей формулой:
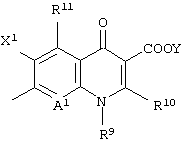
в которой R9 представляет циклический алкил, имеющий от 3 до 6 атомов углерода, который может быть замещен галогеном;
R10 представляет атом водорода,
R11 представляет атом водорода или аминогруппу:
X1 представляет атом галогена,
А1 представляет неполную структуру, представленную формулой (II)
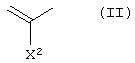
в которой X2 представляет атом водорода, атом галогена, галогенметоксил, алкил, имеющий от 1 до 6 атомов углерода или алкоксил, имеющий от 1 до 6 атомов углерода, и
X2 и указанный выше R9 могут быть объединены с образованием кольцевой структуры включением части основного скелета и образованное таким образом кольцо включает атом кислорода, атом азота или атом серы в качестве составляющего кольцо атома и кольцо может также иметь в качестве заместителя алкил, имеющий от 1 до 6 атомов углерода), и
Y представляет атом водорода.
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| АЭРОЗОЛЬНЫЙ ИНГАЛЯТОРФШДЖОЕГТ! | 0 |
|
SU341493A1 |
| Способ размножения копий рисунков, текста и т.п. | 1921 |
|
SU89A1 |
| ПРОИЗВОДНЫЕ 7-ИЗОИНДОЛИНИЛХИНОЛОНА И 7-ИЗОИНДОЛИНИЛНАФТИРИДОНА | 1993 |
|
RU2111964C1 |
Авторы
Даты
2005-07-10—Публикация
2000-03-09—Подача