Изобретение относится к области ветеринарной вирусологии и биотехнологии и может быть использовано при изготовлении средств для специфической профилактики синдрома гидроперикардита кур (СГПК).
СГПК (болезнь Ангара, болезнь Личи) - это остро протекающая инфекционная болезнь кур вирусной этиологии, наносящая значительный экономический ущерб развитому птицеводству многих стран мира.
Вирус СГПК вызывает заболевание молодняка кур, преимущественно в возрасте от 10 до 50 суток, которое характеризуется внезапной гибелью птицы, скоплением избыточного количества жидкости в перикардиальной полости, поражением печени и почек, депрессией, диареей, а в некоторых случаях и анемией.
В августе 1987 года в Пакистане на бройлерной ферме в местности Angara Goth близ Карачи зарегистрировали болезнь с признаками гепатита с тельцами-включениями и поражением сердца (гидроперикардит). Заболевание отмечалось, как правило, у птиц 3÷6-недельного возраста, но иногда встречалось у более молодых, либо более старших птиц, смертность достигала 50÷70%. Первоначально заболеванию дали название "болезнь Ангара" в соответствии с географической местностью, где впервые зарегистрировали вспышку инфекции. Позднее заболеванию присвоили название "синдром гидроперикардита" в связи с тем, что при вскрытии трупов птиц отмечали скопление жидкости (до 20 мл) в сердечной сорочке, обусловленное нарушением кровообращения в сердечно-сосудистой системе. Подобное заболевание регистрировалось в Ираке, Индии, Мексике, Кувейте, Австралии, Японии и Чили (1).
С начала 90-х гг. вспышки СГПК с высоким уровнем смертности регистрируются на территории России (2). Отсутствие в отечественной ветеринарной практике средств и методов диагностики и специфической профилактики СГПК нанесло значительный экономический ущерб птицехозяйствам. Экономические потери, которые несут птицеводческие хозяйства от вспышек СГПК, складываются из падежа птиц (от 10 до 60%), гибели развивающихся эмбрионов кур во время инкубации, снижения продуктивности и оплаты корма, а также средств, затраченных на проведение внеплановых ветеринарно-санитарных мероприятий и др. (3). Вакцинопрофилактика СГПК занимает ведущее место в борьбе с этим заболеванием. Для профилактики СГПК применяют как живые, так и инактивированные вакцины, методы изготовления которых не отличаются от методов изготовления любых других вирусных вакцин. Все вакцины по способам репродукции вируса распределяются на три вида:
1) вакцины, приготовленные в организме птиц (цыплята);
2) вакцины, приготовленные с использованием вируссодержащей экстраэмбриональной жидкости куриных эмбрионов (КЭ);
3) вакцины, приготовленные из вируса, репродуцированного в первичной культуре клеток печени и почек КЭ (4).
Однако вакцины, приготовленные из печени цыплят, содержат большое количество балластных веществ, которые иногда вызывают тяжелые осложнения общего и местного характера, часто заканчивающиеся гибелью птиц. Также вакцины, приготовленные из вируссодержащей суспензии, обычно имеют малое количество специфического антигена в сравнении с количеством сопутствующих балластных белков.
Получение более безопасных вакцин для профилактики СГПК стало возможным после отработки методов культивирования вируса СГПК в культуре клеток. Адаптация полевых изолятов вируса СГПК к первичной культуре клеток печени и почек КЭ открыла перспективу культуральных вакцин против СГПК (5). Однако эти вакцины не лишены недостатков. Так, использование для репродукции вируса первичной культуры клеток печени КЭ сопровождается значительными материальными затратами при культивировании в промышленном масштабе.
В настоящее время в мировом промышленном птицеводстве для профилактики СГПК широко используют инактивированные эмульсионные вакцины, полученные из ткани инфицированной печени цыплят или первичной культуры клеток печени КЭ (6÷15).
Однако проблема повышения их иммуногенной активности и безвредности продолжает оставаться актуальной и является основным направлением исследований по их совершенствованию.
Известна инактивированная эмульсионная вакцина против СГПК, содержащая антигенный материал в виде очищенной 10÷20% вируссодержащей суспензии печени цыплят, формальдегид и масляный адъювант в эффективных количествах (6).
Известна инактивированная эмульсионная вакцина против СГПК, содержащая антигенный материал из штамма "Adeno-PAK" вируса СГПК, выращенного в культуре клеток, формальдегид и масляный адъювант в эффективных количествах (7).
Известна инактивированная эмульсионная вакцина против СГПК, содержащая антигенный материал из аденовируса кур 4 серотипа, выращенного в первичной культуре клеток печени куриных эмбрионов (КЭ) SPF-кур, β-пропиолоктон и масляный адъювант в эффективных количествах (5).
Недостатки известных вакцин состоят в их низкой иммуногенной активности.
Наиболее близкой предлагаемому изобретению по совокупности существенных признаков является инактивированная эмульсионная вакцина против СГПК, содержащая антигенный материал в виде очищенной суспензии вируса СГПК, выращенного в чувствительной биологической системе, инактивант формальдегид и масляный адъювант в эффективных количествах (15, 16).
Вакцина-прототип имеет существенные недостатки:
- в качестве инактиванта используют формальдегид, вызывающий деструктивные изменения вирусных белков и снижающий иммуногенную активность вакцины. Также велика вероятность неполной инактивации вируса при обработке формальдегидом вирусной суспензии, содержащей значительное количество балластного белка;
- вакцина-прототип обладает низкой антигенной и иммуногенной активностью и не обеспечивает удовлетворительной защиты против эпизоотического вируса СГПК, циркулирующего на территории Российской Федерации.
В задачу создания настоящего изобретения входила разработка высокоиммуногенной и безвредной инактивированной эмульсионной вакцины, создающей защиту против вируса СГПК, циркулирующего на территории Российской Федерации.
Технический результат от использования предлагаемого изобретения заключается в повышении антигенной и иммуногенной активности и безвредности целевого продукта.
Указанный технический результат достигнут созданием инактивированной эмульсионной вакцины против СГПК, охарактеризованной следующей совокупностью признаков:
1. Инактивированная эмульсионная вакцина против СГПК.
2. Антигенный материал в виде очищенной 5÷10% суспензии вируса СГПК, выращенного в чувствительной биологической системе.
3. Из антигенного материала штамм КР95 114 вируса СГПК в эффективном количестве.
4. Штамм КР95 114 вируса СГПК, выращенный в печени 5÷50-суточных цыплят.
5. Штамм КР95 114 вируса СГПК, выращенный в печени 5÷50-суточных цыплят, с биологической активностью 3,25÷5,0 lg ЛД50/0,2 см3.
6. Штамм КР95 114 вируса СГПК, выращенный в первичной культуре клеток печени эмбрионов SPF-кур.
7. Штамм КР95 114 вируса СГПК, выращенный в первичной культуре клеток печени эмбрионов SPF-кур, с биологической активностью 3,25÷5,0 lg ЛД50/0,2 см3.
8. Инактивант.
9. Из инактивантов димер этиленимина (ДЭИ).
10.ДЭИ в виде 10% водного раствора.
11. ДЭИ в концентрации 0,15÷0,4%.
12. Масляный адъювант.
13. Из масляных адъювантов масляный адъювант "Монтанид ИЗА 70".
14. Из масляных адъювантов масляный адъювант "Монтанид ИЗА 206".
15. Антигенный материал из штамма КР95 114 вируса СГПК, ДЭИ и масляный адъювант в соотношении, мас. %:
Антигенный материал 25,0÷50,0;
ДЭИ (10% водный раствор) 0,15÷0,4;
Масляный адъювант до 100,0.
Предлагаемое изобретение включает следующую совокупность существенных признаков, обеспечивающих получение технического результата во всех случаях, на которые испрашивается правовая охрана:
1. Инактивированная эмульсионная вакцина против СГПК.
2. Антигенный материал в виде очищенной суспензии вируса СГПК, выращенного в чувствительной биологической системе.
3. Из антигенного материала штамм КР95 114 вируса СГПК в эффективном количестве.
4. Инактивант.
5. Масляный адъювант.
Предлагаемое изобретение характеризуется также другими признаками, выражающими конкретные формы выполнения или особые условия его использования:
1. Штамм КР95 114 вируса СГПК, выращенный в печени 5÷50-суточных цыплят.
2. Антигенный материал в виде очищенной 5÷10% суспензии штамма КР95 114 вируса СГПК, выращенного в печени 5÷50-суточных цыплят, с биологической активностью 3,25-5,0 lg ЛД50/0,2 см3.
3. Штамм КР95 114 вируса СГПК, выращенный в первичной культуре клеток печени эмбрионов SPF-кур.
4. Антигенный материал в виде очищенной 5-10% суспензии штамма КР95 114 вируса СГПК, выращенного в первичной культуре клеток печени эмбрионов SPF-кур, с биологической активностью 3,25-5,0 lg ЛД50/0,2 см3.
5. Из инактивантов ДЭИ.
6. ДЭИ в концентрации 0,15÷0,4%.
7. ДЭИ в виде 10% водного раствора.
8. Из масляных адъювантов масляный адъювант "Монтанид ИЗА 70".
9. Из масляных адъювантов масляный адъювант "Монтанид ИЗА 206".
10. Антигенный материал из штамма КР95 114 вируса СГПК, ДЭИ и масляный адъювант в соотношении, мас.%:
Антигенный материал 25,0÷50,0;
ДЭИ (10% водный раствор) 0,15÷0,4;
Масляный адъювант до 100,0.
Признаками изобретения, характеризующими предлагаемую вакцину и совпадающими с признаками прототипа, в том числе родовое понятие, отражающее назначение, являются:
1. Инактивированная эмульсионная вакцина против СГПК.
2. Антигенный материал в виде очищенной суспензии вируса СГПК, выращенного в чувствительной биологической системе.
3. Инактивант.
4. Масляный адъювант.
По сравнению с вакциной-прототипом существенными отличительными признаками изобретения является то, что предлагаемая вакцина содержит антигенный материал из штамма КР95 114 вируса СГПК, взятого в эффективном количестве.
Предлагаемое изобретение характеризуется также другими отличительными признаками, выражающие конкретные формы выполнения или особые условия его использования:
1. Штамм КР95 114 вируса СГПК, выращенный в печени 5÷50-суточных цыплят.
2. Антигенный материал в виде очищенной 5÷10% суспензии штамма КР95 114 вируса СГПК, выращенного в печени 5÷50-суточных цыплят, с биологической активностью 3,25-5,0 lg ЛД50/0,2 см3.
3. Штамм КР95 114 вируса СГПК, выращенный в первичной культуре клеток печени эмбрионов SPF-кур.
4. Антигенный материал в виде очищенной 5÷10% суспензии штамма КР95 114 вируса СГПК, выращенного в первичной культуре клеток печени эмбрионов SPF-кур, с биологической активностью 3,25÷5,0 lg ЛД50/0,2 см3.
5. Из инактивантов ДЭИ.
6. ДЭИ в виде 10% водного раствора.
7. ДЭИ в концентрации 0,15÷0,4%.
8. Из масляных адъювантов масляный адъювант "Монтанид ИЗА 70".
9. Из масляных адъювантов масляный адъювант "Монтанид ИЗА 206".
10. Антигенный материал из штамма КР95 114 вируса СГПК, ДЭИ и масляный адъювант в соотношении, маc.%:
Антигенный материал 25,0÷50,0;
ДЭИ (10% водный раствор)0,15÷0,40;
Масляный адъювант до 100,0.
Предлагаемая вакцина обладает по сравнению с вакциной-прототипом более высокой антигенной и иммуногенной активностью и безвредностью.
Достижение технического результата от использования предлагаемого изобретения объясняется тем, что в состав эмульсионной инактивированной вакцины против СГПК введен антигенный материал из нового штамма КР95 114 вируса СГПК.
Дополнительный технический результат от использования предлагаемого изобретения достигается за счет того, что вакцина содержит ДЭИ в качестве инактиванта, что позволяет значительно снизить трудо- и энергозатраты на изготовление вакцины и повысить качество антигенного материала.
Дополнительный технический результат от использования предлагаемого изобретения в части повышения антигенной и иммуногенной активности достигается также за счет использования масляных адъювантов "Монтанид ИЗА 70" и "Монтанид ИЗА 206".
Исходный вирус для получения штамма КР95 114 выделен из печени больных бройлеров на птицефабрике "Красноярская" Красноярского края в 1995 году. Производственный штамм КР95 114 получен путем многократных последовательных пассажей на цыплятах. Штамм КР95 114 депонирован в Государственной коллекции микроорганизмов Всероссийского государственного научно-исследовательского института контроля, стандартизации и сертификации ветеринарных препаратов (ВГНКИ) 14.12.2000 г. под регистрационным шифром КР95 114 - ДЕП. Штамм является вирулентным и обладает высокой антигенной и иммуногенной активностью после инактивации. Экспериментально подтверждена возможность его использования для изготовления инактивированной вакцины против СГПК.
Штамм КР95 114 вируса СГПК характеризуется следующими признаками и свойствами.
Морфологические свойства
Штамм КР95 114 вируса СГПК относится к семейству Adenoviridae, роду Aviadenovirus, группе 1, серотипу 4, обладает морфологическими признаками, характерными для аденовирусов: как у всех прочих вирусов этого семейства, лишенных суперкапсидной оболочки, диаметр вириона штамма КР95 114 и нуклеокапсида равны. Размер вириона равен 75-80 нм. Вирион обладает икосаэдрическим типом симметрии. Вирион представлен нуклеотидом, состоящим из нуклеиновой кислоты и сердцевинных белков, и капсидной белковой оболочкой. Капсид содержит 252 капсомера, которые расположены в 20 фасетках, имеющих форму равносторонних треугольников. На ребрах равносторонних треугольных граней, общих для соседних треугольников, лежит по шесть капсомеров; длина ребра составляет около 42 нм. Каждый из 240 капсомеров капсидной оболочки, формирующих равносторонние треугольники, находится в окружении шести таких же капсомеров и носит название гексон. Каждый из 12 капсомеров, расположенных в вершинах икосаэдра, окружен лишь пятью соседними капсомерами и носит название пептон. Каждый капсомер (кроме сложно устроенного пептона) представляет собой призматическую частицу диаметром 6-7 нм с центральной полостью размером 1,5-2 нм. Способ укладки капсомеров в капсид является уникальным для вирусов с икосаэдрическим типом симметрии и отличается геометрической упорядоченностью. Гексоны представляют собой основной растворимый компонент возбудителя при его репродукции в чувствительных клетках.
С пептонами связывают их способность агглютинировать эритроциты, что обусловлено присутствием в их составе полного гемагглютина.
Сердцевина вириона содержит двухцепочную молекулу ДНК и два внутренних белка. ДНК имеет в своем составе около 60 генов, несущих информацию, которая достаточна для кодирования от 30 до 50 белков.
Антигенные свойства
По своим антигенным свойствам штамм КР95 114 относится к группе 1 птичьих аденовирусов. Вирус стабильно нейтрализуется гомологичной антисывороткой. Вирус не проявляет гемагглютинирующей активности. При вакцинации вирусный антиген индуцирует образование специфических антител, выявляемых в РДП в разведении 1:2-1:64.
Биотехнологические характеристики
Штамм КР95 114 является вирулентным и обладает высокой биологической активностью в нативном виде, а также проявляет высокие антигенные и иммуногенные свойства после инактивации.
Штамм КР95 114 предназначен для использования в качестве сырья для изготовления инактивированной вакцины, а также диагностических биопрепаратов. Штамм КР95 114 репродуцируется на цыплятах 5-90-суточного возраста. В течение 48-120 часов инкубирования вирус накапливается в печени цыплят в титре 3,25-5,0 lg ЛД50/0,2 см3. Штамм КР95 114 является стабильным.
Хемо- и генотаксономическая характеристика
Сердцевина вириона содержит двухцепочечную молекулу ДНК и два внутренних белка. Масса нуклеиновой кислоты достигает 17,3% массы вириона.
Основная масса белков вируса СГПК сосредоточена в капсидной оболочке вириона. На долю сердцевинных белков приходится до 20% всех протеинов вируса. Сердцевинный белок "1" с молекулярной массой 46•103 г/моль легко отделяется от внутреннего нуклеопротеида, содержащего ДНК в комплексе с богатым аргинином сердцевинным белком "2".
Гексон, основание пептона и его нить (фибер) вируса К95 114 построены из полипептидов с молекулярными массами 120•103, 70•103, 62•103 г/моль соответственно.
Белковые структуры вируса штамма КР95 114 формируют несколько антигенов. В составе структурного вирусного антигена у них обнаружены типоспецифические, группоспецифические, подгруппоспецифические антигены полипептидов гексона, основания пептона и подгруппоспецифические и типоспецифические антигены нити пептона.
В составе структурного вирусного антигена выявлено три основных компонента, обозначенных А, В и С. Антиген А структурно связан с гексоном, антиген В - с пептоном, антиген С - с нитями вириона (фибер). Связанный с гексоном компонент А содержит группоспецифический антиген (α) и типоспецифический антиген (ε). Антигенный фактор, связанный с пептоном, назван антигеном (β), а с нитью вириона (фибер) - (γ).
Физические свойства
Масса вириона - 252•103 г/моль. Плавучая плотность 1,32-1,35 г/мл в градиенте CsCl. Константа седиментации зрелого вириона равна 810•10-13-910•10-13 с.
Устойчивость к внешним факторам
Штамм КР95 114 устойчив к действию эфира, хлороформа, сапонина и дезоксихолата натрия, чувствителен к формальдегиду, β-пропиолактону, гидроксиламину, производным этиленимина, УФ-облучению, γ-облучению.
Штамм КР95 114 довольно устойчив к нагреванию и к изменению рН среды в широком интервале, резистентен к действию 0,25% раствора трипсина, 2% раствора фенола и 50% раствора этилового спирта. Абсолютный этанол, как и его йодный раствор, вызывает полную инактивацию вируса.
Штамм КР95 114 устойчив к многократному повторению циклов замораживания и оттаивания, не теряет инфекционных свойств при сублимационном высушивании.
Дополнительные признаки и свойства
Иммуногенная активность - 100%.
Патогенность выражена.
Вирулентность выражена.
Контагиозность выражена.
Онкогенность отсутствует.
Исходя из полученных данных можно утверждать, что штамм КР95 114 по антигенному и иммунологическому спектрам является оригинальным, в таксономическом отношении новым, ранее неизвестным вариантом вируса СГПК. Для снижения его эпизоотической опасности необходима своевременная вакцинопрофилактика вновь возникающих очагов болезни, для этого необходима высокоактивная и безвредная вакцина.
Проведенный заявителем анализ уровня техники, включающий поиск по патентным и научно-техническим источникам информации и выявление источников, содержащих сведения об аналогах предлагаемого изобретения, позволил установить, что заявитель не обнаружил источники, характеризующиеся признаками, тождественными (идентичными) всем существенным признакам предлагаемого изобретения. Определение из перечня выявленных аналогов прототипа как наиболее близкого по совокупности признаков аналога позволило установить совокупность существенных по отношению к усматриваемому заявителем техническому результату отличительных признаков предлагаемой вакцины, изложенных в независимом пункте формулы изобретения.
Следовательно, заявляемое изобретение соответствует условию патентоспособности "новизна".
Для проверки соответствия предлагаемого решения условию патентоспособности "изобретательский уровень" проведен дополнительный поиск известных решений для выявления признаков, включенных в отличительную часть независимого пункта формулы изобретения. Результаты поиска показали, что предлагаемое решение не вытекает для специалиста явным образом из известного уровня техники, изложенного в соответствующем разделе описания (не выявлены решения, имеющие признаки, совпадающие с отличительными признаками предлагаемого изобретения), а также не выявлено влияние предусматриваемых существенными признаками предлагаемого изобретения преобразований для достижения технического результата.
Следовательно, предлагаемая вакцина соответствует условию патентоспособности "изобретательский уровень".
Сущность предлагаемого изобретения пояснена примерами его исполнения.
Пример 1.
Для получения эмульсионной вакцины из штамма КР95 114 матровым вирусом внутримышечно в объеме 1 см3 заражают 5÷50-суточных SPF-цыплят, или цыплят, полученных из благополучных по инфекционным заболеваниям хозяйств. Цыплят содержат 120 часов после заражения. У больных и павших цыплят отбирают печень. Печень подвергают размолу на коллоидной мельнице в течение 10÷12 минут, затем вируссодержащую массу смешивают с фосфатным буферным раствором, получая в результате 5-10% вируссодержащую суспензию с биологической активностью 3,25-5,0 lg ЛД50/0,2 cм3. Вируссодержащую суспензию очищают от балластных примесей известным образом. Для этого можно использовать низкоскоростное центрифугирование, обработку суспензии различными детергентами (фреон-113, хлороформ) и флокулянтом высокомолекулярным полигексаметиленгуанидингидрохлоридом (ВПГ) в сочетании с низкоскоростным центрифугированием или сепарированием. Очистку вируссодержащей суспензии от балластных белков проводят при 6-12oС. Очищенную суспензию подают в стерильный реактор. Для инактивации вируса используют димер этиленимина (ДЭИ). Предварительно готовят 10% раствор ДЭИ на деминерализованной воде рН 7,9-8,0. Затем в подогретую до 28-34oС вируссодержащую суспензию вносят 10% раствор ДЭИ до концентрации 0,15-0,4%. Смесь тщательно перемешивают и выдерживают при 35-36oС в течение 24 часов. По окончании инактивации антигенный материал охлаждают до 2-8oС. К охлажденному антигену при постоянном помешивании добавляют масляный адъювант. В качестве масляного адъюванта используют препараты фирмы "Сеппик" (Франция): Монтанид ИЗА 70 и Монтанид ИЗА 206. Масляный адъювант и инактивированный антиген смешивают на гомогенизаторе согласно следующим режимам:
1) при использовании масляного Монтанида ИЗА 70 - гомогенизация в течение 4-5 мин при скорости вращения винта 3000 об/мин и температуре 10oС при этом получают однородную эмульсию белого цвета типа "вода-масло";
2) при использовании масляного адъюванта Монтанид ИЗА 206 - гомогенизация в течение 3-4 мин при скорости вращения винта 600 об/мин и температуре 30oС. Тип получаемой эмульсии "вода-масло-вода". При изготовлении вакцин антиген соединяют с масляным адъювантом в следующем соотношении: адъювантом Монтанид ИЗА 70, по меньшей мере, 1:3, а с адъювантом Монтанид ИЗА 206, по меньшей мере, 1:1 соответственно.
Вязкость вакцин определяют на вискозиметре ВПЖ-2. Образцы вакцин контролируют на стабильность эмульсии центрифугированием при 3000 об/мин в течение 30 мин и хранением в термостате при 37oС в течение 14 суток. Стабильная эмульсия в результате центрифугирования и хранения в термостате не должна расслаиваться на масляную и водную фазу. Контроль эмульсионной формы инактивированной вакцины против СГПК осуществляют определением стерильности, полноты инактивации вируса, безвредности, антигенной, иммуногенной активности и протективности препарата. Стерильность вакцины определяют в соответствии с (17).
Авирулентность и безвредность препарата определяют путем введения 10÷15-суточным цыплятам вакцины в двойной дозе. Полученная вакцина представляет собой эмульсию светло-бежевого цвета.
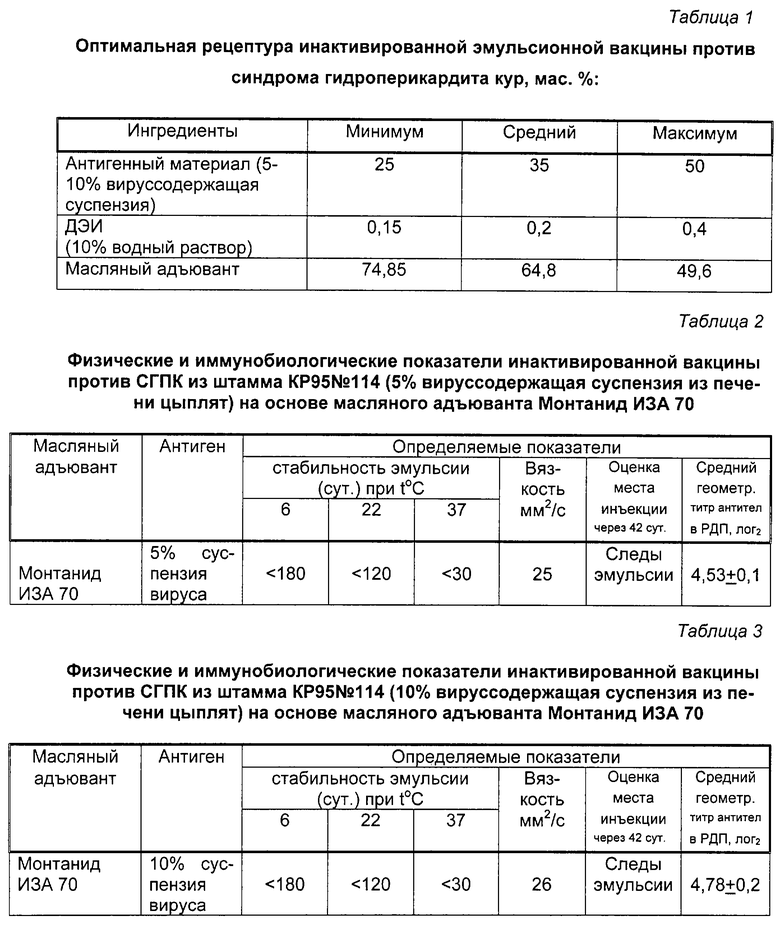
Полученная вакцина против СГПК имеет оптимальный компонентный состав (рецептура), представленный в таблице 1.
Содержание антигена в вакцине, в указанных в таблице 1 пределах, является эффективным количеством в препарате, обеспечивающим достижение технического результата.
Пример 2.
Проведены исследования по определению антигенной активности инактивированной эмульсионной вакцины против СГПК, полученной так, как описано в примере 1, содержащей, маc.%:
Очищенный антигенный материал из штамма КР95 114 вируса СГПК, репродуцированного в организме 30-суточных цыплят с титром инфекционной активности 3,3 lg ЛД50/0,2 см3 (5% суспензия) 0,25
ДЭИ (10% водный раствор) 0,15
Масляный адъювант (Монтанид ИЗА 70) 74,95
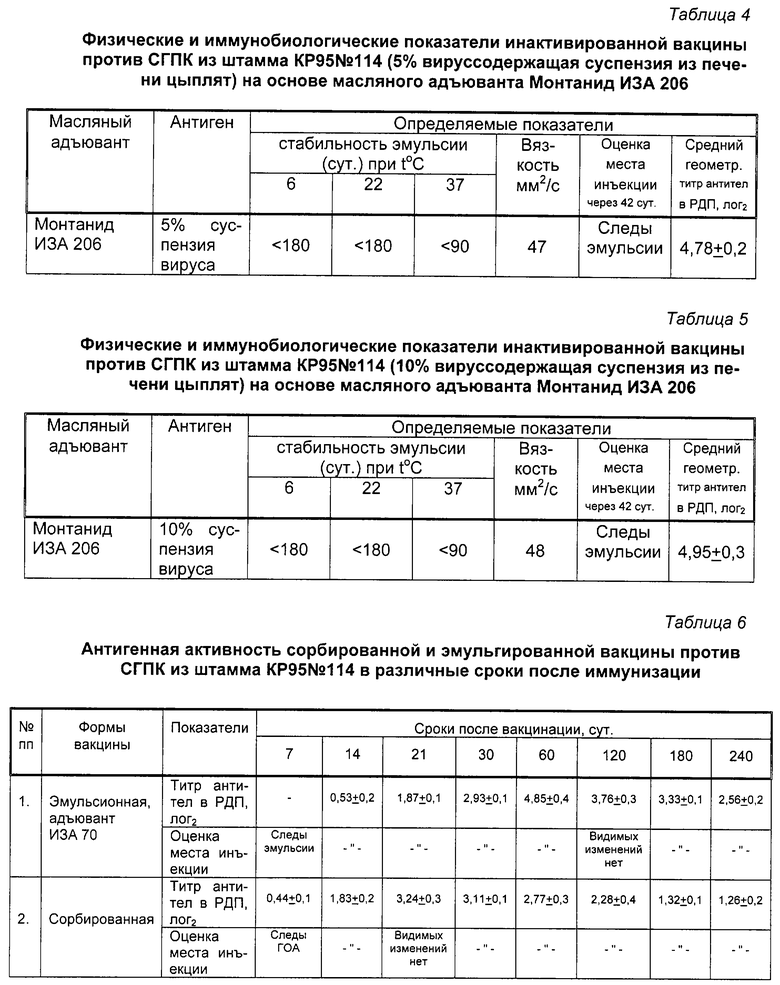
Определение антигенной активности полученной вакцины проводили на цыплятах 12-суточного возраста, свободных от антител к вирусу СГПК. Вакцину вводили в дозе 0,3 см3 в мышцу бедра. Через 21 сутки после вакцинации у птиц отбирали кровь, получали сыворотки и их исследовали в РДП на наличие антител к вирусу СГПК. Результаты исследований представлены в таблице 2.
Результаты, представленные в таблице 2, свидетельствуют о высокой антигенной активности инактивированной эмульсионной вакцины против СГПК из штамма КР95 114.
Пример 3.
Проведены исследования по определению антигенной активности инактивированной эмульсионной вакцины против СГПК, полученной так, как описано в примере 1, и содержащий, маc.%:
Очищенный антигенный материал из штамма КР95 114 вируса СГПК, репродуцированного в организме 30-суточных цыплят с титром инфекционной активности 3,54 lg ЛД50/0,2 cм3 (10% суспензия) 25,0
ДЭИ (10% водный раствор) 0,15
Масляный адъювант (Монтанид ИЗА 70) 74,95
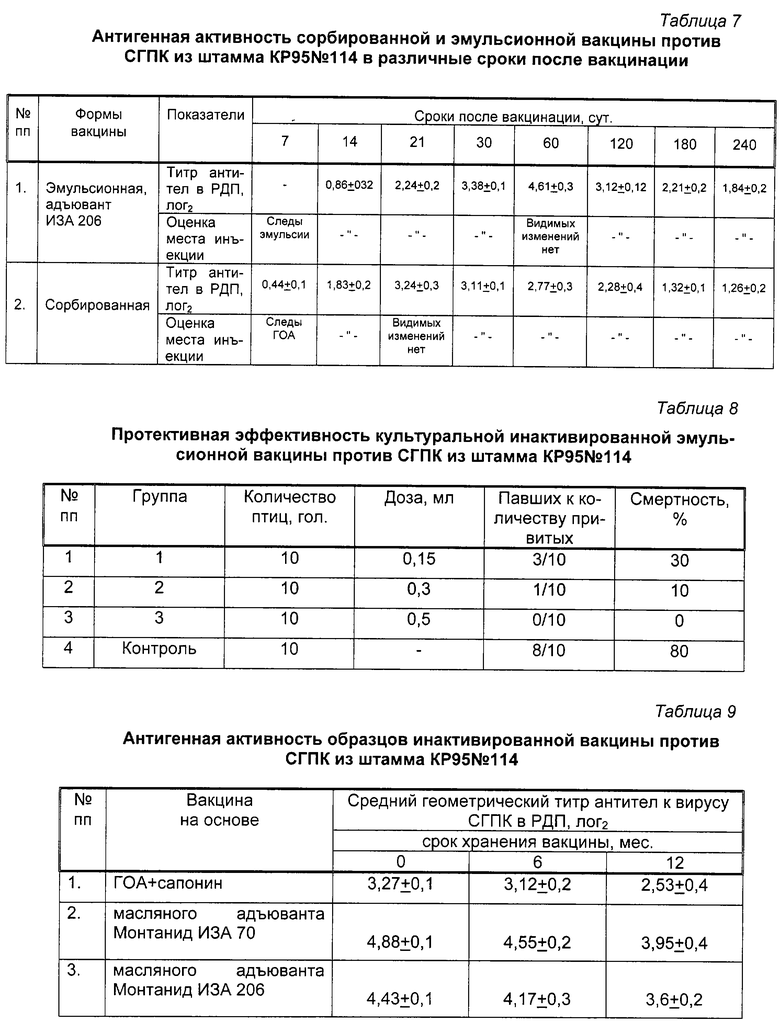
Определение антигенной активности проводили так, как описано в примере 2, результаты исследований представлены в таблице 3.
Результаты, представленные в таблице 3, свидетельствуют о высокой антигенной активности полученной вакцины против СГПК из штамма КР95 114.
Пример 4.
Проведены исследования по определению антигенной активности инактивированной эмульсионной вакцины против СГПК, полученной так, как описано в примере 1, и содержащей, маc.%:
Очищенный антигенный материал из штамма КР95 114 вируса СГПК, репродуцированного в организме 30-суточных цыплят с титром инфекционной активности 3,25 lg ЛД50/0,2 см3 (5% суспензия) 50,0
ДЭИ (10% водный раствор) 0,4
Масляный адъювант (Монтанид ИЗА 206) 49,6
Антигенную активность полученной вакцины определяли на цыплятах суточного возраста, свободных от антител к вирусу СГПК. Вакцину вводили внутримышечно в объеме 0,3 см3 в область бедра. Через 21 сутки после вакцинации у цыплят отбирали кровь, получали сыворотки и их исследовали в РДП на наличие антител к вирусу СГПК, результаты исследований представлены в таблице 4.
Результаты, представленные в таблице 4, свидетельствуют о высокой антигенной активности полученной вакцины против СГПК из штамма КР95 114.
Пример 5.
Проведены исследования по определению антигенной активности инактивированной эмульсионной вакцины против СГПК, полученной так, как описано в примере 1, содержащей, мас.%:
Очищенный антигенный материал из штамма КР95 114 вируса СГПК, репродуцированного в организме 30-суточных цыплят с титром инфекционной активности 3,25 lg ЛД50/0,2 см3 (10% суспензия) 50,0
ДЭИ (10% водный раствор) 0,4
Масляный адъювант (Монтанид ИЗА 70) 49,6
Антигенную активность полученной вакцины определяли так, как описано в примере 4. Результаты исследований представлены в таблице 5.
Результаты, представленные в таблице 5, свидетельствуют о высокой антигенной активности полученной вакцины против СГПК из штамма КР95 114.
Пример 6.
Проведены сравнительные испытания иммуногенной активности инактивированной сорбированной вакцины против СГПК из штамма КР95 114 и инактивированной эмульсионной вакцины против СГПК, полученной так, как описано в примере 1, и содержащей, мас.%:
Очищенный антигенный материал из штамма КР95 114 вируса СГПК, репродуцированного в организме 30-суточных цыплят с титром инфекционной активности 3,25 lg ЛД50/0,2 см3 (10% суспензия) 50,0
ДЭИ (10% водный раствор) 0,4
Масляный адъювант (Монтанид ИЗА 206) 49,6
Испытания проводили на цыплятах в возрасте 20 суток, свободных от антител к вирусу СГПК. Вакцины вводили птице однократно в грудную мышцу в дозе 0,5 см3. За птицей вели наблюдение в течение 8 месяцев. На 7, 14, 21 и 30 сутки и через 2, 4, 6 и 8 месяцев проводили убой части подопытной птицы с целью визуального осмотра места введения и получения сывороток крови для серологического исследования. Данные опыта представлены в таблице 6. Результаты эксперимента показали, что все образцы инактивированной вакцины были антигенно активны на протяжении всего периода исследования. Однако вакцина на основе адъюванта Монтанид ИЗА 70 обладала более выраженной антигенной активностью и индуцировала в организме образование более высокого уровня специфических антител против вируса СГПК в сравнении с препаратом на основе адъюванта Монтанид ИЗА 206 (см. таблицу 7) и сорбированной формой вакцины.
Изучение динамики накопления антител у привитой птицы показало, что иммунный ответ в группе птиц, которым вводили сорбированную вакцину проявлялся уже на 7 сутки после вакцинации, достигая максимальных значений в РДП к 21 дню, а в группах цыплят, иммунизированных вакцинами на основе масляных адъювантов, иммунная реакция проявлялась на 14 сутки и достигала высоких значений к 30-60 суткам после вакцинации. При всех формах инактивированной вакцины у привитой птицы стабильно удерживался высокий уровень антител к вирусу СГПК в течение 8 месяцев (срок наблюдения).
Контроль клинического состояния подопытной птицы в ходе эксперимента не выявил патологических признаков общего и местного характера в группах вакцинированной птицы. Контрольное взвешивание птицы в разных группах показало, что средняя живая масса курицы в вакцинированных группах существенно не отличалась от таковой в контрольной группе.
Пример 7.
Проведены сравнительные испытания иммуногенной активности инактивированной сорбированной вакцины против СГПК из штамма КР95 114 и инактивированной эмульсионной вакцины против СГПК, полученной так, как описано в примере 1, и содержащей, маc.%:
Очищенный антигенный материал из штамма КР95 114 вируса СГПК, репродуцированного в организме 30-суточных цыплят с титром инфекционной активности 3,54 lg ЛД50/0,2 см3 (10% суспензия) 25,0
ДЭИ (10% водный раствор) 0,15
Масляный адъювант (Монтанид ИЗА 70) 74,95
Испытания проводили на цыплятах в возрасте 20 суток, свободных от антител к вирусу СГПК. Испытания проводили так, как описано в примере 6. Результаты исследований представлены в таблице 7.
Пример 8.
Для приготовления эмульсионной вакцины используют штамм КР95 114 вируса СГПК, репродуцированный в первичной культуре клеток печени эмбрионов SPF-кур, с биологической активностью 3,25÷5,0 lg ЛД50/0,2 см3. Полученный вирус очищают от балластных примесей, инактивируют и смешивают с масляным адъювантом так, как описано в примере 1. Контроль полученной вакцины осуществляют определением стерильности, полноты, инактивации вируса, безвредности, антигенной, иммуногенной активности и протективности препарата. Стерильность вакцины определяют в соответствии с (17). Авирулентность и безвредность препарата определяют путем введения 10-15-суточным цыплятам вакцины в двойной дозе.
Пример 9.
Проведены исследования по определению иммуногенной активности инактивированной эмульсионной вакцины против СГПК, полученной так, как описано в примере 8, и содержащей, мас.%:
Очищенный антигенный материал из штамма КР95 114 вируса СГПК, репродуцированного в первичной культуре клеток печени эмбрионов SPF-кур с титром инфекционной активности 3,25 lg ЛД50/0,2 см3 50,0
ДЭИ (10% водный раствор) 0,4
Масляный адъювант (Монтанид ИЗА 206) 49,6
Исследования проводили на 10-суточных цыплятах кросса "Хайсекс белый", не имеющих антител к вирусу СГПК. Птицу разделили на три опытные и одну контрольную группы, по 10 голов в каждой. Цыплят 1, 2 и 3 опытных групп прививали однократно внутримышечно инактивированной эмульсионной вакциной в дозах 0,15; 0,3 и 0,5 мл соответственно. Цыплят каждой группы содержали в индивидуальных клетках. Через 21 сутки после вакцинации всех цыплят подвергли контрольному заражению вирусом СГПК в дозе 1 см3 с титром инфекционной активности 3,75 lg ЛД50/0,2 см3. За птицей вели наблюдение в течение 7 суток. Результаты опыта по изучению иммуногенной активности полученной вакцины представлены в таблице 8. Из данных таблицы 8 видно, что после контрольного заражения 100% защиту наблюдали в группе цыплят, привитых вакциной в дозе 0,5 см3. В группах подопытных цыплят, которым вводили эмульсионную вакцину в дозах 0,15 и 0,3 см3 на голову, уровень защиты составил 70 и 90% соответственно. Падеж в контрольной группе вакцинированных цыплят, после заражения вирусом СГПК, составил 80%.
При патологоанатомическом вскрытии павших цыплят наблюдали изменения, характерные для СГПК. При осмотре места введения вакцины морфологических изменений в виде воспаления, очагов некроза и гранулем, выявлено не было.
На основании результатов проведенного исследования можно сделать вывод, что инактивированная эмульсионная вакцина против СГПК, изготовленная из вируса, культивированного в первичной культуре клеток печени эмбрионов SPF-кур, обладает протективным эффектом при отсутствии побочных реакций на месте введения препарата. Однократная прививка цыплят в дозе 0,3 или 0,5 см3 обеспечивает 90÷100% защиту птиц от контрольного заражения.
Пример 10.
Проведены исследования по определению иммуногенной активности инактивированной эмульсионной вакцины против СГПК, полученной так, как описано в примерах 8, и содержащей, мас.%:
Очищенный антигенный материал из штамма КР95 114 вируса СГПК, репродуцированного в первичной культуре клеток печени эмбрионов SPF-кур с титром инфекционной активности 3,3 lg ЛД50/0,2 см3 25,0
ДЭИ (10% водный раствор) 0,15
Масляный адъювант (Монтанид ИЗА 70) 74,95
Определение иммуногенной активности полученного препарата проводили так, как описано в примере 9, с получением аналогичных результатов.
Пример 11.
Были изготовлены и испытаны образцы инактивированной вакцины против СГПК различного ингредиентного состава и проведены испытания препаратов на антигенную активность в зависимости от сроков хранения.
Испытания вакцин проводили после изготовления и через 6 и 12 месяцев хранения при температуре 2÷8oС.
Исследования проводили на цыплятах 25-суточного возраста, не имеющих антител к вирусу СГПК, которых разделили на три группы. Одну группу прививали инактивированной вакциной против СГПК из штамма КР95 114, приготовленной на основе гидроокиси алюминия и сапонина, вторую - препаратом на основе масляного адъюванта Монтанид ИЗА 70, приготовленного так, как описано в примерах 1, 2 и 3, и третью - вакциной с адъювантом Монтанид ИЗА 206, приготовленной так, как описано в примере 4 и 5.
Иммунный ответ оценивали по приросту антител в РДП через 21 сутки после введения вакцины.
Результаты исследований представлены в таблице 9.
Данные таблицы 9 показывают, что все образцы инактивированной вакцины против СГПК показали высокую активность при хранении в течение 6 месяцев, а при исследовании через 12 месяцев хранения антигенная активность препаратов несколько снизилась. Однако уровень различий был невысок. Данный факт свидетельствует о сохраняемости антигенной активности вакцин сорбированной и масляной форм в интервале температур от 2 до 8oС.
Таким образом, результаты исследований по антигенной активности, в зависимости от сроков хранения инактивированной вакцины против СГПК, полученной на основе различных адъювантов, показали, что оба варианта препарата, как эмульсионная, так и ГОА-вакцина обладали выраженной антигенной активностью в течение 12 месяцев после изготовления.
Таким образом, приведенная выше информация свидетельствует о выполнении при использовании предлагаемого изобретения следующей совокупности условий
- инактивированная эмульсионная вакцина против СГПК, воплощающая предлагаемое изобретение, предназначена для использования в сельском хозяйстве, а именно в ветеринарной вирусологии и биотехнологии;
- для предлагаемого изобретения в том виде, как оно охарактеризовано в независимом пункте формулы изобретения, подтверждена возможность его осуществления с помощью приведенных в описании или известных до даты приоритета средств и методов;
- при использовании предлагаемой вакцины против СГПК достигнут технический результат, предусмотренный задачей создания изобретения.
Следовательно, предлагаемое изобретение соответствует условию патентно-способности "промышленная применимость".
Источники информации
1. Cower B.S., Lu H. et al. Charatirization studies of fowl adenoviruces associated with inclusion body hepatitis/hydropericardium syndrome in chickens, presented at the 68-th Northeastern Conference in Avian Diseases, June 10-12, 1996, р. 14.
2. Лагуткин Н.А, Арсентьев А.Р. и др. Массовый гидроперикардит у мясных цыплят раннего возраста. Вопросы ветеринарной вирусологии, микробиологии и эпизоотологии: Материалы научн. конф. ВНИИВВиМ. - Покров, 1992, ч.2, 248-251.
3. Borisov V. V. , Borisov A. V. et al. Hidropericardium syndrome in chickens in Russia//Proc. of the 11th Int. Congress of the world Vet. Ponlt. Ass.August 18-22, Budapest, Hungary. - 1997. - P.258.
4. Winterfield R.M., Fadly A.M. et al. Immunization of chicken against adenovirus infection. Poult, Sci., 1977. - V. 56, N 5, 1481-1486.
5. Le Gros F. X. , Bouguet J.F., Gaudry D. Hydropericardium-hepatitis syndrome: potency of an inactivated vaccine produced on cell cultures. Proc. of the 45th Western Poult. Dis. Conf. May 1-5. Cancun, Mexico. - 1996. - P. 140-142.
6. Survashe B.D., Pandid S.V. et al. Inclusion body hepatitis/Hydropericardium syndrome (Leechy heart disease) in India - an overwiew. Proc. of the 20th world's Poult. Congress. September 2-5 New Delhi. India. - 1996. - V. 2. - P. 375-380.
7. Khusi M., Chaudry H.M., Vanmarcke J. Efficacy trial with an inactivated oiladjuvant vaccine against Hydropericardium syndrome. Proc. of the 20th world's Poult. Congress. September 2-5. New Delhi, India. - V.1. - P. 347-348.
8. Gay G.M. у Soto P.E. Valoracion comparativa de une vacuna emulsionada experimental contra la hepatitis con cuerpos de inclusion. Memorias de la XX Convencion Nacional Aneca. - 1995. - P. 82-84.
9. Lucio D. E. Comparacion de la respuesta serologica у proteccion al desafio entre autovacunas producidas con molienda de higado у una vacuna elaborada en embrion de pollo SPF contra el syndrome del hidropericardio. XIX Convencion Annual Aneca-Mexico. - 1994. - P.110-115.
10. Soto P.E., Borrego J.L. et al. Prevencion у control de la HCI/SHP en Mexico. XII Curso de Actualizacion Avimex. Mexico. - 1995. - P. 57-59.
11. Gay G.M., Soto P.E. et al. Protection conferred by an inclusion body hepatitis commercial vaccine in birds challenged with several group I adenoviruses. Proc. of the 45th Western Polt. Conf. May 1-5. Cancun. Mexico. - 1996. - P. 167-170.
12. Soto P. E. , Gay G.M. et al. Experiences with an adjuvanted killed inclusion body hepatitis vaccine. Proc. of the 46th Western Poult. Dis. Conference, March 1-4. Sacramento, California. - 1997. - P. 19-20.
13. Grimes T.M. Cause and control of a parachute from of inclusion body hepapipis. Proc. of the 41th Western Poult. Dis Conf. March 1-3. Sacramento, California. - 1992.-P.42-44.
14. Villegas P. Adenovirus and inclusion body hepatitis in chickens. Proc. of the 45th Western Poult. Dis Conference. May 1-5. Cancun, Mexico. - 1996. P. 62.
15. Mashkoor S. , Hameed A. et.al. Immune response of Angara disease (Hydropericardium syndrome) vaccines in broilers. Veterinarski Archiv. - 1994. - V. 64. - N 4-6. - P. 103-107 (прототип).
16. Ahmad L. , Ahmad R., Malik M.I. Comparative efficacy of different Angara disease vaccine in broilers. Zootecnica International. - 1991. - V. 30. - N 6. - P. 67-69.
17. ГОСТ 28085-89.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ЭМУЛЬСИОННОЙ ВАКЦИНЫ ПРОТИВ СИНДРОМА ГИДРОПЕРИКАРДИТА КУР | 2002 |
|
RU2213576C1 |
| ШТАММ КР 95 № 114 ВИРУСА СИНДРОМА ГИДРОПЕРИКАРДИТА КУР ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИННЫХ ПРЕПАРАТОВ | 2001 |
|
RU2193062C1 |
| ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ СИНДРОМА ГИДРОПЕРИКАРДИТА КУР | 2001 |
|
RU2195959C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ВАКЦИНЫ ПРОТИВ СИНДРОМА ГИДРОПЕРИКАРДИТА КУР | 2001 |
|
RU2199342C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ВАКЦИНЫ ПРОТИВ СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ-76 ПТИЦ | 2003 |
|
RU2239452C2 |
| ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ-76 ПТИЦ | 2003 |
|
RU2233671C1 |
| ШТАММ "БИСС № 113" ВИРУСА СИНДРОМА СНИЖЕНИЯ ЯЙЦЕНОСКОСТИ - 76 ПТИЦ ДЛЯ ИЗГОТОВЛЕНИЯ ВАКЦИННЫХ ПРЕПАРАТОВ | 2002 |
|
RU2221865C1 |
| ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ | 2004 |
|
RU2283137C2 |
| ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ ВАКЦИНА ПРОТИВ ПАРВОВИРУСНОЙ ИНФЕКЦИИ СВИНЕЙ | 2002 |
|
RU2214276C1 |
| ИНАКТИВИРОВАННАЯ ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ ПТИЦ | 1998 |
|
RU2127603C1 |
Изобретение относится к ветеринарной вирусологии и биотехнологии. Вакцина содержит антигенный материал в виде 5-10% вируссодержащей суспензии из штамма КР95 114 вируса СГПК, инактивант димер этиленимина и масляный адъювант в эффективном соотношении. Штамм депонирован в коллекции микроорганизмов ВГНКИ под регистрационным шифром КР95 114 ДЕП. Штамм КР95 114 репродуцируется в печени 5-50-суточных цыплят или в первичной культуре клеток печени эмбрионов SPF-кур с биологической активностью 3,25÷5,0 lg ЛД50/0,2 см3. Вакцина является нереактогенной, безвредной для привитой птицы, титр антител при этом достигает в РДП 4,61-4,85 лог2. 8 з.п. ф-лы, 9 табл.
7. Инактивированная эмульсионная вакцина по п. 1, отличающаяся тем, что из масляных адъювантов она содержит масляный адъювант "Монтанид ИЗА 70".
Антигенный материал - 25,0-50,0
Димер этиленимина - 0,15-0,4
Масляный адъювант - до 100,0
| Мashkoor S., Hameed A | |||
| et.al | |||
| Immune response of Angara disease (Hydropericardium syndrome) vaccines in broilers | |||
| Veterinarski Archiv | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| ШТАММ "АДВ" ВИРУСА ГИДРОПЕРИКАРДИТА ПТИЦ СЕМЕЙСТВА ADENOVIRIDAE | 1996 |
|
RU2120993C1 |
| 0 |
|
SU156478A1 | |
Авторы
Даты
2003-11-20—Публикация
2002-01-22—Подача