Настоящее изобретение относится к соединениям формулы I
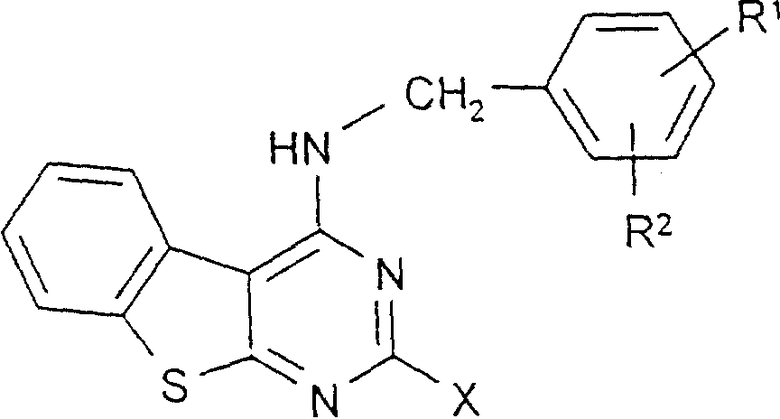
в которой
R1, R2 каждый независимо друг от друга обозначает Н, А, ОА или Hal, R1 и R2 вместе обозначают также алкилен с 3-5 С-атомами, -О-СН2-СН2-, -СН2-О-СH2-, -O-СН2-О- или -О-СН2-СН2-О-,
Х обозначает однозамещенный заместителем R7, R4, R5 или R6,
R4 обозначает линейный либо разветвленный алкилен с 1-10 С-атомами, где одна или две СН2-группы могут быть заменены на -СН=СН-группы,
R5 обозначает циклоалкил или циклоалкилалкилен с 5-12 С-атомами,
R6 обозначает фенил или фенилметил,
R7 обозначает СООН, СООА, CONH2, CONHA, CON (А) г или CN,
А обозначает алкил с 1-6 С-атомами и
Hal обозначает F, C1, Вr или I,
а также к их физиологически приемлемым солям.
Производные пиримидина известны, например, из заявок ЕР 201188 или WO 93/06104.
В основу изобретения была положена задача получить новые соединения с ценными свойствами, прежде всего такие, которые были бы пригодны для изготовления соответствующих лекарственных средств. Как было установлено, соединения формулы I и их соли наряду с хорошей совместимостью обладают очень ценными фармакологическими свойствами. Прежде всего они проявляют специфическое ингибирование цикло-GМР-фосфодиэстеразы (PDE V).
Хиназолины с подавляющей цикло-GМР-фосфодиэстеразу активностью описаны, например, в Journ. Med. Chem. 36. стр. 3765 (1993) и в том же журнале 37, стр. 2106 (1994).
Биологическая активность соединений формулы I может быть подтверждена с помощью методов, описанных, в частности, в международной заявке WO 93/06104. Сродство предлагаемых в изобретении соединений к цикло-GMP- и цикло-АМР-фосфодиэстеразе выявляют, определяя их IC50-значения (концентрация ингибитора, требуемая для достижения 50%-ного подавления активности фермента).
Для проведения указанных исследований могут использоваться ферменты, которые выделяют с помощью известных методов (см., например, W.J. Thompson и др., Biochem. 10 (1971), стр. 311). Для проведения опытов можно применять модифицированный "групповой" ("batch") метод Томпсона и Эпплемана (W.J. Thompson и М.М. Appleman, Biochem. 18 (1979), стр. 5228).
С учетом вышеизложенного соединения по изобретению могут применяться для лечения заболеваний сердечно-сосудистой системы, прежде всего сердечной недостаточности, и для лечения и/или терапии нарушений потенции (дисфункция эрекции).
Применение замещенных пиразолопиримидинонов для лечения импотенции описано, например, в международной заявке WO 94/28902.
Соединения по изобретению эффективны в качестве ингибиторов индуцированных фенилэфрином сокращений в образцах, приготовленных из кавернозного тела зайцев. Это биологическое действие может быть подтверждено, например, с помощью метода, описанного Холмквистом (F. Holmquist) и другими авторами в Journ. Urol. 150, стр. 1310-1315 (1993). Такое ингибирование сокращений является доказательством эффективности предлагаемых соединений при терапии и/или лечении нарушений потенции.
Соединения формулы I могут применяться в качестве активных веществ в лекарственных средствах, предназначенных для использования в медицине и ветеринарии. Кроме того, возможно и их применение в качестве промежуточных продуктов для получения других активных веществ с последующим использованием последних в лекарственных средствах.
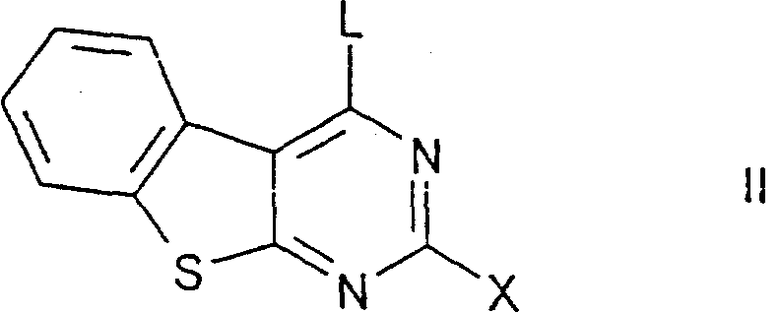
Объектом изобретения в соответствии с этим являются соединения формулы I, а также способ получения соединений формулы I по пункту 1 и их солей. Способ отличается тем, что
а) соединение формулы II
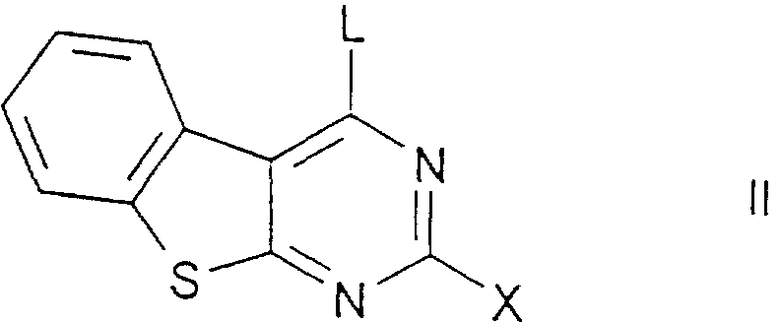
где
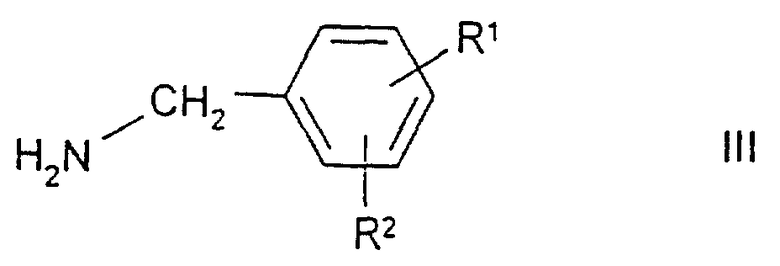
Х имеет указанные выше значения, a L обозначает С1, Вr, ОН, SСН3 или реакционноспособную этерифицированную ОН-группу, подвергают взаимодействию с соединением формулы III
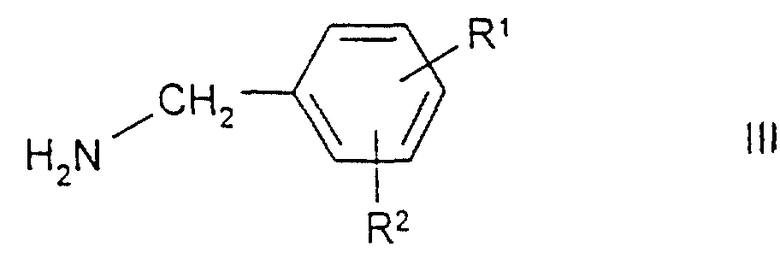
где R1 и R2 имеют указанные выше значения, или
б) в соединении формулы I один остаток Х превращают в другой остаток X, например путем гидролиза сложноэфирной группы до СООН-группы или путем превращения СООН-группы в амид либо в цианогруппу, и/или что соединение формулы I переводят в одну из его солей.
Выше и в последующем R1, R2, R3, R4, R5, R6, R7, Х и L, если не указано иное, имеют значения, приведенные при расшифровке формул I, II и III.
А обозначает алкил с 1-6 С-атомами.
В приведенных выше формулах алкил является предпочтительно неразветвленным, имеет 1, 2, 3, 4, 5 или 6 С-атомов и представляет собой предпочтительно метил, этил либо пропил, кроме того, предпочтительно изопропил, бутил, изобутил, втор-бутил либо трет-бутил, а также н-пентил, неопентил, изопентил либо гексил.
Х обозначает однозамещенный заместителем R7, R4, R5 либо R6.
R4 обозначает линейный либо разветвленный алкиленовый остаток с 1-10 С-атомами, при этом алкиленовый остаток представляет собой предпочтительно, например метилен, этилен, пропилен, изопропилен, бутилен, изобутилен, втор-бутилен, пентилен, 1-, 2- либо 3-метилбутилен, 1,1-, 1,2- либо 2,2-диметилпропилен, 1-этилпропилен, гексилен, 1-, 2-, 3- либо 4-метилпентилен, 1,1-, 1,2-, 1,3-, 2,2-, 2,3- либо 3,3-диметилбутилен, 1- либо 2-этилбутилен, 1-этил-1-метилпропилен, 1-этил-2-метилпропилен, 1,1,2- либо 1,2,2-триметил-пропилен, линейный либо разветвленный гептилен, октилен, нонилен или децилен.
R4 обозначает также, например, бут-2-енилен или гекс-3-енилен. Наиболее предпочтительны этилен, пропилен или бутилен.
R5 обозначает циклоалкилалкилен с 5-12 С-атомами, предпочтительно, например, циклопентилметилен, циклогексилметилен, циклогексилэтилен, циклогексилпропилен или циклогексилбутилен.
R5 обозначает также циклоалкил, предпочтительно с 5-7 С-атомами. Циклоалкил представляет собой, например, циклопентил, циклогексил или циклогептил.
Hal обозначает предпочтительно F, Cl или Вr, а также I.
Остатки R1 и R2 могут быть идентичными или разными и находятся предпочтительно в положении 3 либо 4 фенильного кольца. Каждый из них независимо друг от друга обозначает, например, Н, алкил, F, Cl, Вr или I либо оба вместе они обозначают алкилен, такой, например, как пропилен, бутилен или пентилен, кроме того, этиленокси-, метилендиокси- или этилендиоксигруппу. Предпочтительно они представляют собой соответственно также алкоксигруппу, такую, например, как метокси, этокси или пропокси.
Остаток R7 обозначает предпочтительно, например, СООН, СООСН3, СООС2Н5, CONH2, СОN(СН3)2, СОNНСН3 или CN.
Для изобретения в целом справедливо следующее: все остатки, неоднократно присутствующие в соединениях, могут быть идентичными или разными, т.е. иметь соответствующие значения независимо друг от друга.
В соответствии с этим объектом изобретения являются прежде всего такие соединения формулы I, в которых по меньшей мере один из названных остатков имеет одно из указанных выше предпочтительных значений. Некоторые предпочтительные группы соединений могут быть представлены следующими субформулами Ia-Id, которые подпадают под формулу I и в которых не расшифрованные более подробно остатки имеют значения, указанные в формуле I, однако имеются и определенные отличия, а именно:
в Iа Х обозначает замещенный группой СООН, СООА, CONH2, CONA2, CONHA или CN R4, фенил или фенилметил,
в id R1 и R2 вместе обозначают алкилен с 3-5 С-атомами, -О-СН2-СН2-, -О-СН2-О- или -О-СН2-СН2-О-,
Х обозначает замещенный группой СООН, СООА, CONH2, CONA2, CONHA или CN R4, фенил или фенилметил,
в Ic R1, R2 каждый независимо друг от друга обозначает Н, А, ОА, или Hal,
R1 и R2 вместе обозначают алкилен с 3-5 С-атомами, -О-СН2-СН2-, -O-CH2-O- или -О-СН2-СН2-О-,
Х обозначает замещенный группой СООН, СООА, CONH2, CONA2, CONHA или CN R4, фенил или фенилметил,
в Id R1, R2 каждый независимо друг от друга обозначает Н, А, ОА или Hal,
R1 и R2 вместе обозначают алкилен с 3-5 С-атомами, -О-СН2-СН2-, -О-СН2-О- или -О-СН2-СН2-О-,
Х обозначает однозамещенный заместителем R7 алкилен с 2-5 С-атомами, циклогексил, фенил или фенилметил,
R7 обозначает СООН или СООА,
А обозначает алкил с 1-6 С-атомами,
Hal обозначает F, Cl, Вr или I.
Соединения формулы I, равно как и исходные вещества для их получения, в остальном получают с помощью известных методов, описанных в литературе (например, в таких основополагающих публикациях, как Houben-Weyl, Methoden der organischen Chemie, изд-во Georg-Thieme-Verlag, Stuttgart), a именно, при соблюдении условий, известных и пригодных для проведения указанных реакций. При этом могут использоваться также известные, не поясняемые в данном описании более подробно варианты.
В соединениях формул II или III R1, R2, R3, R4 и Х имеют указанные выше значения, прежде всего значения, указанные в качестве предпочтительных.
Если L обозначает реакционноспособную этерифицированную ОН-группу, то последняя представляет собой предпочтительно алкилсульфонилоксигруппу с 1-6 С-атомами (предпочтительно метилсульфонилокси) либо арилсульфонилоксигруппу с 6-10 С-атомами (предпочтительно фенил- или п-толилсульфонилокси, а также 2-нафталинсульфонилокси).
Предпочтительно получать соединения формулы I взаимодействием соединений формулы II с соединениями формулы III.
Исходные вещества при необходимости могут быть образованы также in situ, что исключает их обязательное выделение из реакционной смеси и дает возможность непосредственно превращать их в соединения формулы I. В то же время реакцию можно проводить и по стадийному механизму.
Исходные вещества формул II и III в принципе известны. Если же они окажутся неизвестными, то их можно получить по известным методам. Так, например, соединения формулы II могут быть получены взаимодействием с РОСl3 из соответствующих гидроксипиримидинов, которые синтезируют из производных тиофена и CN-замещенных эфиров алкиленкарбоновых кислот (см. Europ. Journ. Med. Chem. 23 (1988), стр. 453). Процесс получения гидроксипиримидинов осуществляют либо путем дегидрирования соответствующих тетрагидробензтиенопиримидиновых соединений, либо путем обычной для получения производных пиримидима циклизации производных 2-аминобензтио-фен-3-карбоновой кислоты с помощью альдегидов или нитрилов (см., например, Houben-Weyl E9b/2).
Конкретно взаимодействие соединений формулы II с соединениями формулы III осуществляют в присутствии инертного растворителя либо в его отсутствии при температурах в интервале от порядка -20 до порядка +150°C, предпочтительно от 20 до 100°С.
Целесообразным может оказаться введение добавок связывающего кислоту агента, например гидроксида, карбоната либо бикарбоната щелочного или щелочноземельного металла или какой-либо другой соли слабой кислоты щелочных или щелочноземельных металлов, предпочтительно калия, натрия или кальция, или добавок органического основания, такого как триэтиламин, диметиламин, пиридин либо хинолин, или же добавок аминного компонента в избыточном количестве.
В качестве инертных растворителей в указанных целях пригодны среди прочих углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен, 1,2-дихлорэтан, тетрахлорметан, хлороформ или дихлорметан; спирты, такие как метанол, этанол, изопропанол, н-пропанол, н-бутанол или трет-бутанол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан; простые гликолевые эфиры, такие как монометиловый либо моноэтиловый эфир этиленгликоля (метилгликоль либо этилгликоль), диметиловые эфиры этиленгликоля (диглимы); кетоны, такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид, N-метилпирролидон или диметилформамид (ДМФ); нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид (ДМСО); нитросоединения, такие как нитрометан или нитробензол; сложные эфиры, такие как этилацетат, либо смеси указанных растворителей.
Кроме того, один остаток Х в соединении формулы I можно превращать в другой остаток X, например, гидролизуя сложный эфир либо цианогруппу до СООН-группы. Сложноэфирные группы можно омылять, например с помощью NaOH или КОН в воде, в смеси воды и ТГФ либо воды и диоксана при температурах в интервале от 0 до 100°С.
Карбоновые кислоты можно превращать, например с помощью тионил-хлорида, в соответствующие хлорангидриды карбоновых кислот и эти последние превращать в амиды карбоновых кислот. За счет осуществляемого известным путем отщепления воды из этих амидов получают карбонитрилы.
Кислоту формулы I можно переводить с помощью основания в соответствующую кислотно-аддитивную соль, например, взаимодействием эквимолярных количеств кислоты и основания в инертном растворителе, таком как этанол, и последующим упариванием. Для осуществления этой реакции пригодны прежде всего основания, образующие физиологически приемлемые соли. Так, в частности, кислоту формулы I можно превращать с помощью основания (например, гидроксида или карбоната натрия либо калия) в соответствующую соль металла, прежде всего в соль щелочного либо щелочноземельного металла, или в соответствующую аммониевую соль. Для осуществления указанной реакции пригодны в первую очередь также такие органические основания, которые образуют физиологически приемлемые соли, такие, например, как этаноламин.
С другой стороны, возможны и варианты, согласно которым основание формулы I переводят с помощью кислоты в соответствующую кислотно-аддитивную соль, например, взаимодействием эквимолярных количеств основания и кислоты в инертном растворителе, таком как этанол, и последующим упариванием. Для осуществления указанной реакции пригодны в первую очередь кислоты, которые образуют физиологически приемлемые соли. Так, в частности, могут использоваться такие неорганические кислоты, как серная кислота, азотная кислота, галогеноводородные кислоты, например хлористо-водородная кислота или бромистоводородная кислота, фосфорные кислоты, такие как ортофосфорная кислота, сульфаминовая кислота, а также органические кислоты, прежде всего алифатические, алициклические, аралифатические, ароматические или гетероциклические одно- либо многоосновные карбоновые, сульфоновые или серные кислоты, например муравьиная кислота, уксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метан- либо этансульфокислота, этандисульфокислота, 2-гидроксиэтансульфокислота, бензолсульфокислота, п-толуолсульфокислота, нафталинмоно- либо - дисульфокислоты и лаурилсерная кислота. Соли же физиологически неприемлемых кислот, например пикраты, могут использоваться для выделения и/или очистки соединений формулы I.
Объектом изобретения является далее применение соединений формулы I и/или их физиологически приемлемых солей для получения фармацевтических композиций, прежде всего нехимическим путем. При этом из них совместно с по меньшей мере одним твердым, жидким и/или полужидким носителем или вспомогательным веществом и необязательно в сочетании с одним либо несколькими другими активными веществами может изготавливаться соответствующая дозированная форма.
Еще одним объектом изобретения являются также лекарственные средства формулы I и их физиологически приемлемые соли в качестве ингибиторов фосфодиэстеразы V.
Объектом изобретения являются далее фармацевтические композиции, содержащие в своем составе по меньшей мере одно соединение формулы I и/или одну из его физиологически приемлемых солей. Эти композиции могут применяться в качестве лекарственных средств в медицине или ветеринарии. В качестве носителей в них можно использовать органические или неорганические субстанции, пригодные для энтерального (например орального), парентерального либо местного введения и не вступающие в реакцию с новыми соединениями, например вода, масла растительного происхождения, бензиловые спирты, алкиленгликоли, полиэтиленгликоли, триацетат глицерина, желатин, углеводы, такие как лактоза или крахмал, стеарат магния, тальк, вазелины. Для орального введения могут назначаться прежде всего таблетки, пилюли, драже, капсулы, порошки, грануляты, сиропы, микстуры или капли, для ректального введения - суппозитории, для парентерального введения - растворы, предпочтительно масляные либо водные растворы, кроме того, суспензии, эмульсии или имплантаты, для местного применения - мази, кремы или пудра. Новые соединения можно также подвергать лиофилизации и полученные лиофилизаты использовать, например, для изготовления препаратов для инъекций. Указанные композиции можно стерилизовать и/или они могут содержать в своем составе вспомогательные вещества, такие как замасливатели, консерванты, стабилизаторы и/или смачиватели, эмульгаторы, соли для регуляции осмотического давления, буферные субстанции, красители, вкусовые добавки и/или несколько других активных веществ, например один либо несколько витаминов.
Соединения формулы I и их физиологически приемлемые соли могут применяться для борьбы с болезнями, при которых повышение уровня цГМФ (циклогуанозинмонофосфата) способствует подавлению или предотвращению воспалительных процессов и релаксации (расслаблению) мышц. Особенно эффективно предлагаемые в изобретении соединения могут применяться также при лечении заболеваний сердечно-сосудистой системы и лечения и/или терапии нарушений потенции. При этом субстанции, как правило, назначают предпочтительно в дозировках от приблизительно 1 до 500 мг, прежде всего от 5 до 100 мг на одну унифицированную дозу. Суточная доза составляет предпочтительно от порядка 0,02 до 10 мг/кг веса тела. Однако специальная доза, назначаемая тому или иному пациенту, зависит от самых разных факторов, в частности от эффективности применяемого соединения, от возраста пациента, веса его тела, общего состояния здоровья, пола, особенностей питания, от времени и методики введения препарата, от скорости выделения, комбинации лекарственных средств и степени тяжести соответствующего заболевания, для которого предназначается данная терапия. Предпочтительным является оральное введение.
Выше и в последующем все температуры указаны в градусах Цельсия. В приведенных ниже примерах под понятием "обычная переработка" имеются в виду следующие операции: при необходимости добавляют воду, при необходимости, в зависимости от структурных особенностей конечного продукта, значения рН устанавливают в пределах от 2 до 10, экстрагируют этилацетатом или дихлорметаном, фазы разделяют, органическую фазу сушат над сульфатом натрия, упаривают и очищают посредством хроматографии на силикагеле и/или путем кристаллизации.
Масс-спектрометрия (МC):EI (ионизация электронным ударом) М+; FAB (бомбардировка ускоренными атомами) (М+Н)+.
Пример 1
Метиловый эфир 3-(4-хлорбензотиено- [2,3-d] -пиримидин-2-ил)пропионовой кислоты [получаемый циклизацией метилового эфира 2-амино-5,6,7,8-тетрагидробензотиофен-3-карбоновой кислоты действием метилового эфира 3-цианопропионовой кислоты, дегидрированием с помощью серы и последующим хлорированием фосфороксихлоридом/диметиламином] и 3-хлор-4-метоксибензиламин (соединение "А") в N-метилпирролидоне перемешивают в течение 5 часов при 110°C. Затем растворитель удаляют и проводят обычную переработку. В результате получают метиловый эфир 3-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил]пропионовой кислоты в виде бесцветного масла.
Аналогичным путем взаимодействием соединения "А" с метиловым эфиром 2-(4-хлорбензотиено- [2,3-d]-пиримидин-2-ил) уксусной кислоты получают метиловый эфир 2-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] уксусной кислоты.
Аналогичным путем взаимодействием 3,4-метилендиоксибензиламина с метиловым эфиром 3-(4-хлорбензотиено-[2,3-d]-пиримидин-2-ил)пропионовой кислоты получают метиловый эфир 3-[4-(3,4-метилендиокси-бензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] пропионовой кислоты.
Аналогичным путем взаимодействием соединения "А" с метиловым эфиром 4-(4-хлорбензотиено-[2,3-d]-пиримидин-2-ил)масляной кислоты получают метиловый эфир 4- [4-(3-хлор-4-метоксибензиламино)бензотиено- [2,3-d] -пиримидин-2-ил] масляной кислоты.
Аналогичным путем взаимодействием 3,4-метилендиоксибензиламина с метиловым эфиром 4-(4-хлорбензотиено-[2,3-d]-пиримидин-2-ил)масляной кислоты получают метиловый эфир 4- [4-(3,4-метилендиоксибензилами-но)бензотиено-[2,3-d]-пиримидин-2-ил] масляной кислоты.
Аналогичным путем взаимодействием соединения "А" с метиловым эфиром 5-(4-хлорбензотиено- [2,3-d]-пиримидин-2-ил)валериановой кислоты получают метиловый эфир 5-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] валериановой кислоты.
Аналогичным путем взаимодействием 3,4-метилендиоксибензиламина с метиловым эфиром 5-(4-хлорбензотиено- [2,3-d]-пиримидин-2-ил) валериановой кислоты получают метиловый эфир 5-[4-(3,4-метилендиокси-бензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] валериановой кислоты.
Аналогичным путем взаимодействием соединения "А" с метиловым эфиром 7-(4-хлорбензотиено-[2,3-d]-пиримидин-2-ил) гептановой кислоты получают метиловый эфир 7-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] гептановой кислоты.
Аналогичным путем взаимодействием 3,4-метилендиоксибензиламина с метиловым эфиром 7-(4-хлорбензотиено-[2,3-d]-пиримидин-2-ил) гептановой кислоты получают метиловый эфир 7-[4-(3,4-метилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] гептановой кислоты.
Аналогичным путем взаимодействием соединения "А" с метиловым эфиром 2- [4-(4-хлорбензотиено-[2,3-d]-пиримидин-2-ил) циклогексил-1 -ил] уксусной кислоты получают метиловый эфир 2-{4-[4-(3-хлор-4-метоксибензилами-но)бензотиено-[2,3-d]-пиримидин-2-ил] циклогексил-1-ил} уксусной кислоты.
Аналогичным путем взаимодействием 3,4-метилендиоксибензиламина с метиловым эфиром 2-[4-(4-хлорбензотиено-[2,3-d]-пиримидин-2-ил)циклогексил-1-ил] уксусной кислоты получают метиловый эфир 2- [4- [4-(3,4-метилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] циклогексил-1 -ил} уксусной кислоты.
Аналогичным путем взаимодействием бензиламина
с метиловым эфиром 3-(4-хлорбензотиено-[2,3-d]-пиримидин-2-ил)пропионовой кислоты получают метиловый эфир 3-(4-бензиламинобензотиено-[2,3-d] -пиримидин-2-ил)пропионовой кислоты;
с метиловым эфиром 4-(4-хлорбензотиено- [2,3-d]-пиримидин-2-ил) масляной кислоты получают метиловый эфир 4-(4-бензиламинобензотиено-[2,3-d]-пиримидин-2-ил) масляной кислоты;
с метиловым эфиром 5-(4-хлорбензотиено-[2,3-d]-пиримидин-2-ил)валериановой кислоты получают метиловый эфир 5-(4-бензиламинобензотиено-[2,3-d]-пиримидин-2-ил)валериановой кислоты.
Аналогичным путем взаимодействием соединения "А" с метиловым эфиром 4-(4-хлорбензотиено- [2,3-d]-пиримидин-2-ил)циклогексанкарбоновой кислоты получают метиловый эфир 4-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил]циклогексанкарбоновой кислоты, а взаимодействием с 3,4-метилендиоксибензиламином получают метиловый эфир 4- [4- (3,4-метилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] циклогексанкарбоновой кислоты.
Пример 2
Метиловый эфир 3-[4-(3-хлор-4-метоксибензиламино)бензотиено- [2,3-d]-пиримидин-2-ил] пропионовой кислоты растворяют в монометиловом эфире этиленгликоля и после добавления 32%-ного NaOH перемешивают в течение 5 часов при 110°С. После добавления 20%-ной НС1 экстрагируют дихлорметаном. Добавив петролейный эфир, получают 3-[4-(3-хлор-4-метоксибензиламино)бензотиено- [2,3-d]-пиримидин-2-ил] пропионовую кислоту с tпл 218°С.
Выпавшие кристаллы растворяют в изопропаноле, примешивают этаноламин и после кристаллизации получают 3-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] пропионовую кислоту, этаноламиновую соль.
Аналогичным путем получают следующие соединения:
4-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] масляную кислоту, tпл 225°C;
5-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] валериановую кислоту, tпл 210°C;
4-[4-(3,4-метилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] масляную кислоту, гидрохлорид, tпл 245°C.
Аналогичным путем из сложных эфиров, указанных в примере 1, получают следующие карбоновые кислоты:
2-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] уксусную кислоту,
3-[4-(3,4-метилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] пропионовую кислоту,
5-[4-(3,4-метилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] валериановую кислоту,
7-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] гептановую кислоту,
7-[4-(3,4-метилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] гептановую кислоту,
2-{4-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] циклогексил-1-ил} уксусную кислоту,
2-{4-[4-(3,4-метилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] циклогексил-1-ил} уксусную кислоту,
3-(4-бензиламинобензотиено- [2,3-d] -пиримидин-2-ил)пропионовую кислоту,
4-(4-бензиламинобензотиено-[2,3-d]-пиримидин-2-ил) масляную кислоту,
5-(4-бензиламинобензотиено-[2,3-d]-пиримидин-2-ил) валериановую кислоту,
4-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] циклогексанкарбоновую кислоту,
4-[4-(3,4-метилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] циклогексанкарбоновую кислоту.
Пример 3
Смесь из 1,5 г метилового эфира 4-(4-хлорбензотиено)- [2,3-d]-пиримидин-2-ил)фенилкарбоновой кислоты (соединение "Б"), получаемого путем дегидрирования соответствующего 5,6,7,8-тетрагидробензотиено- [2,3-d] -пиримидинового соединения серой и последующего хлорирования фосфороксихлоридом/диметиламином, и 1,5 г 3-хлор-4-метоксибензиламина в 20 мл N-метилпирролидона нагревают в течение 4 часов до 110°C. После охлаждения проводят обычную переработку. В результате получают 2,6 г метилового эфира 4-[4-(3-хлор-4-метоксибензиламино)-[1]бензотиено-[2,3-d]-пиримидин-2-ил]бензойной кислоты с tпл 203-204°C.
Аналогично примеру 2 из 1,2 г вышеуказанного эфира получают 1,0 г 4-[4-(3-хлор-4-метоксибензиламино) - [1] бензотиено- [2,3-d] -пиримидин-2-ил]бензойной кислоты, этаноламиновую соль с tпл 189-190°C.
Аналогично примеру 1 из соединения "Б" и 3,4-метилендиоксибензиламина получают метиловый эфир 4-[4-(3,4-метилендиоксибензиламино)-[1] бензотиено-[2,3-d]-пиримидин-2-ил] бензойной кислоты, а из этого эфира путем его гидролиза получают 4- [4-(3,4-метилендиоксибензиламино)-[1] бензотиено-[2,3-d]-пиримидин-2-ил] бензойную кислоту, натриевую соль с tпл>260°C.
Аналогичным путем получают соединения
4-[4-(3-хлор-4-метоксибензиламино)-[1]бензотиено-[2,3-d]-пиримидин-2-ил]фенилуксусную кислоту, этаноламиновую соль с tпл 202°C и
4-[4-(3,4-метилендиоксибензиламино)-[1]бензотиено-[2,3-d]-пиримидин-2-ил]фенилуксусную кислоту.
Пример 4
1 эквивалент 3-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] пропионовой кислоты и 1,2-эквивалента тионилхлорида перемешивают в течение 2 часов в дихлорметане. Затем растворитель удаляют и в результате получают хлорангидрид 3-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] пропионовой кислоты. Далее его переводят в водный аммиак, перемешивают в течение одного часа и после обычной переработки получают амид 3-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил]пропионовой кислоты.
Пример 5
1 эквивалент ДМФ и 1 эквивалент оксалилхлорида растворяют при 0°C в ацетонитриле. Затем добавляют 1 эквивалент амида 3-[4-(3-хлор-4-метоксибензиламино)бензотиено-[2,3-d] -пиримидин-2-ил] пропионовой кислоты. Далее перемешивают в течение одного часа и после обычной переработки получают 3-[4-(3-хлор-4-метоксибензиламино)бензотиено- [2,3-d]-пиримидин-2-ил] пропионитрил.
Пример 6
Аналогично примерам 1, 2 и 3 взаимодействием соответствующих производных хлорпиримидина с 3,4-этилендиоксибензиламином получают следующие карбоновые кислоты:
4-[4-(3,4-этилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] масляную кислоту,
3-[4-(3,4-этилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] пропионовую кислоту,
5-[4-(3,4-этилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] валериановую кислоту,
7-[4-(3,4-этилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] гептановую кислоту,
2-{4- [4-(3,4-этилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил]циклогексил-1-ил} уксусную кислоту,
4-[4- (3,4-этилендиоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] циклогексановую кислоту,
4-[4-(3,4-этилендиоксибензил)- [1]бензотиено-[2,3-d]-пиримидин-2-ил]бензойную кислоту, разложение при 220-230°C,
4-[4-(3,4-этилендиоксибензил) -[1]бензотиено-12,3-d]-пиримидин-2-ил] фенилуксусную кислоту.
Аналогичным путем взаимодействием с 3,4-дихлорбензиламином получают следующие соединения:
4-[4-(3,4-дихлорбензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] масляную кислоту,
3-[4-(3,4-дихлорбензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] пропионовую кислоту,
5-[4-(3,4-дихлорбензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] валериановую кислоту,
7-[4-(3,4-дихлорбензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] гептановую кислоту,
2-{4-[4-(3,4-дихлорбензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] циклогексил-1-ил] уксусную кислоту,
4-[4- (3,4-дихлорбензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] циклогексанкарбоновую кислоту,
4-[4-(3,4-дихлорбензиламино)-[1] бензотиено-[2,3-d]-пиримидин-2-ил] бензойную кислоту,
4-[4-(3,4-дихлорбензиламино)-[1] бензотиено-[2,3-d]-пиримидин-2-ил] фенилуксусную кислоту.
Аналогичным путем взаимодействием с3-хлор-4-этоксибензиламином получают следующие соединения:
4- [4-(3-хлор-4-этоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] масляную кислоту,
3-[4-(3-хлор-4-этоксибензиламино) бензотиено-[2,3-d]-пиримидин-2-ил] пропионовую кислоту,
5-[4-(3-хлор-4-этоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] валериановую кислоту,
7-[4-(3-хлор-4-этоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] гептановую кислоту,
2-{4- [4-(3-хлор-4-этоксибензиламино)бензотиено- [2,3-d]-пиримидин-2-ил] циклогексил-1-ил} уксусную кислоту,
4-[4-(3-хлор-4-этоксибензиламино)бензотиено- [2,3-d]-пиримидин-2-ил] циклогексанкарбоновую кислоту,
4-[4- (3-хлор-4-этоксибензиламино)-[1] бензотиено- [2,3-d]-пиримидин-2-ил] бензойную кислоту, tпл 185-187°C;
4-[4-(3-хлор-4-этоксибензиламино)-[1] бензотиено-[2,3-d]-пиримидин -2-ил]фенилуксусную кислоту.
Аналогичным путем взаимодействием с 3-хлор-4-изопропоксибензиламином получают следующие соединения:
4-[4-(3-хлор-4-изопропоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] масляную кислоту,
3-[4-(3-хлор-4-изопропоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] пропионовую кислоту,
5-[4-(3-хлор-4-изопропоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] валериановую кислоту,
7-[4-(3-хлор-4-изопропоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] гептановую кислоту,
2-{4-[4-(3-хлор-4-изопропоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] циклогексил-1-ил} уксусную кислоту,
4- [4-(3-хлор-4-изопропоксибензиламино)бензотиено-[2,3-d]-пиримидин-2-ил] циклогексанкарбоновую кислоту,
4- [4-(3-хлор-4-изопропоксибензиламино) - [1] бензотиено-[2,3-d] -пиримидин-2-ил] бензойную кислоту, tпл 240-241°C,
4- [4- (3-хлор-4-изопропоксибензиламино) - [1] бензотиено-[2,3-d]-пиримидин-2-ил] фенилуксусную кислоту.
В нижеследующих примерах представлены фармацевтические композиции и технология их приготовления в соответствующих дозированных формах.
Пример А: Склянки для инъекционных растворов
Раствор из 100 г активного вещества формулы I и 5 г гидрофосфата динатрия в 3 л дважды дистиллированной воды с помощью 2 н. соляной кислоты устанавливают на рН 6,5, стерильно фильтруют, заполняют склянки, лиофилизуют в стерильных условиях и стерильно укупоривают. В каждой склянке содержится 5 мг активного вещества.
Пример Б: Суппозитории
Вначале приготавливают смесь из 20 г активного вещества формулы I, 100 г соевого лецитина и 1400 г масла какао, затем смесь расплавляют, разливают в формы и дают застыть. Каждый суппозиторий содержит 20 мг активного вещества.
Пример В: Раствор
Приготавливают раствор из 1 г активного вещества формулы I, 9,38 г NaH2PО4·2H2O, 28,48 г Nа2НРO4·12Н2О и 0,1 г хлорида бензалкония в 940 мл дважды дистиллированной воды. Затем устанавливают на рН 6,8, доводят до объема 1 л и стерилизуют облучением. Этот раствор может применяться в виде глазных капель.
Пример Г: Мазь
При соблюдении асептических условий приготавливают смесь из 500 мг активного вещества формулы I и 99,5 г вазелина.
Пример Д: Таблетки
Приготавливают смесь из 1 кг активного вещества формулы I, 4 кг лактозы, 1,2 кг картофельного крахмала, 0,2 кг талька и 0,1 кг стеарата магния, которую затем таблетируют по обычной технологии таким образом, что каждая таблетка содержит 10 мг активного вещества.
Пример Е: Драже
Аналогично примеру Д прессуют таблетки, которые затем по обычной технологии покрывают оболочкой из сахарозы, картофельного крахмала, талька, траганта и красителя.
Пример Ж: Капсулы
Из 2 кг активного вещества формулы I по обычной технологии изготавливают капсулы с твердожелатиновым покрытием таким образом, что каждая капсула содержит 20 мг активного вещества.
Пример 3: Ампулы
Раствор из 1 кг активного вещества формулы I в 60 л дважды дистиллированной воды стерильно фильтруют, разливают в ампулы, в стерильных условиях лиофилизуют и стерильно укупоривают. В каждой ампуле содержится 10 мг активного вещества.
Пример И: Ингаляционный спрей
14 г активного вещества формулы I растворяют в 10 л изотонического NaCl-раствора и затем этот раствор разливают в обычные, коммерчески доступные баллончики, снабженные насосным приспособлением. Раствор может применяться для ингаляции полости рта и носа. Выдаваемая из баллончика за одно нажатие порция (примерно 0,1 мл) соответствует дозе приблизительно 0,14 мг.
ФАРМАКОЛОГИЧЕСКИЙ ОТЧЕТ
Заявленные соединения тестировались на фармакологическую активность в отношении ингибирования фосфодиэстеразы V.
Испытания были проведены в соответствии с методикой, описанной P.Hamet и др. (1983) “Быстрая активация od cAMP фосфодиэстеразы в тромбоцитах крыс”. Can. J. Biochem. Cell Biol. 61: 1158-65.
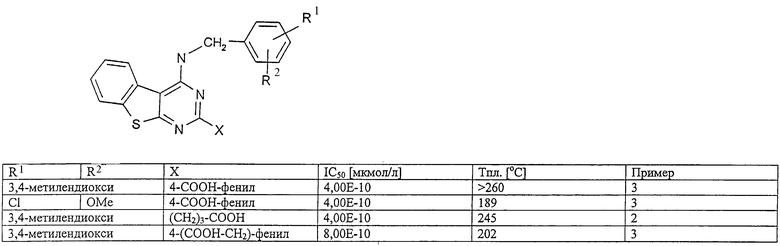
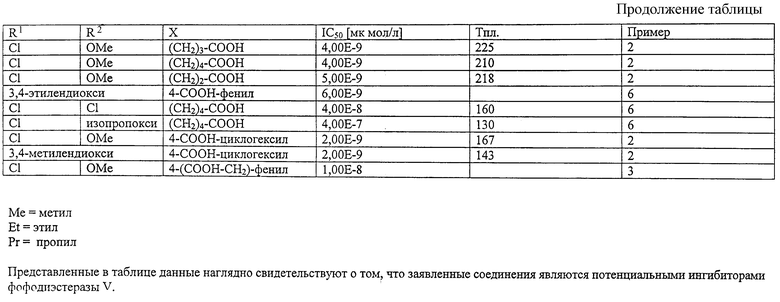
В нижеследующей таблице приведены тестируемые соединения, значения показателя их фармакологической активности IС50, температура плавления (Тпл) или данные масс-спектрометрии (EI-M+) для этих соединений, а также примеры,в которых описан синтез этих соединений.
Значения показателя IC50 (концентрация в мкмол/л; то есть 50% ингибирование фосфодиэстеразы V) были получены для следующих соединений формулы I
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРАЗОЛО[4,3-D] ПИРИМИДИНЫ | 2000 |
|
RU2249594C2 |
| ТИЕНОПИРИМИДИНЫ С ИНГИБИРУЮЩИМ ДЕЙСТВИЕМ ПО ОТНОШЕНИЮ К ФОСФОДИЭСТЕРАЗЕ V (PDE V), СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2197492C2 |
| ТИЕНОПИРИМИДИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ ДЕЙСТВИЕМ ИНГИБИТОРОВ ФОСФОДИЭСТЕРАЗЫ V | 1998 |
|
RU2217431C2 |
| ТИЕНОПИРИМИДИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1997 |
|
RU2199541C2 |
| ТИЕНОПИРИМИДИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2000 |
|
RU2238274C2 |
| ПРОИЗВОДНЫЕ БЕТА-АЛАНИНА | 2000 |
|
RU2234496C2 |
| 2-АМИНОАЛКИЛТИЕНО[2,3-D]ПИРИМИДИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2261863C2 |
| ПРОИЗВОДНЫЕ 10,10-ДИАЛКИЛПРОСТАНОВОЙ КИСЛОТЫ ДЛЯ СНИЖЕНИЯ ВНУТРИГЛАЗНОГО ДАВЛЕНИЯ | 2004 |
|
RU2336081C2 |
| СПОСОБ ПОЛУЧЕНИЯ БЕНЗО[b]ТИОФЕНОВ | 2001 |
|
RU2260004C2 |
| БИЦИКЛИЧЕСКИЕ АРОМАТИЧЕСКИЕ АМИНОКИСЛОТЫ | 1998 |
|
RU2187506C2 |
Изобретение относится к новым конденсированным тиенопиримидинам формулы I и их физиологически приемлемым солям, обладающим действием ингибиторов фосфодиэстеразы V(PDE V), и которые могут применяться для лечения заболеваний сердечно-сосудистой системы и для лечения и/или терапии нарушений потенции. В соединениях формулы IR1, R2 каждый независимо друг от друга обозначает Н, ОА или Hal, R1 и R2 - вместе обозначают также алкилен с 3-5 С-атомами, -О-СН2-СН2-, -СН2-О-СН2-, -О-СН2-О- или -О-СН2-СН2-О-, Х обозначает R4, R5 или R6, однократно замещенные заместителем R7, R4 обозначает линейный либо разветвленный алкилен с 1-10 С-атомами, R5 обозначает циклоалкил или циклоалкилалкилен с 5-12 С-атомами, R6 обозначает фенил или фенилметил, R7 обозначает СООН или СООА, А обозначает алкил с 1-6 С-атомами, и Hal обозначает F, Cl, Br или I. Изобретение также относится к способу получения соединений формулы I. Способ получения заключается в том, что соединение формулы II, где Х имеет указанные выше значения, a L обозначает Cl, Br, ОН, SCH3 или реакционноспособную этерифицированную ОН-группу, подвергают взаимодействию с соединением формулы III, где R1 и R2 имеют указанные выше значения, с последующим, в случае необходимости, превращением в полученном соединении формулы I одного остатка Х в другой остаток X, например, путем гидролиза сложноэфирной группы до СООН-группы, и/или переводом соединения формулы I в одну из его физиологически приемлемых солей. 3 с. и 3 з.п. ф-лы, 1 табл.
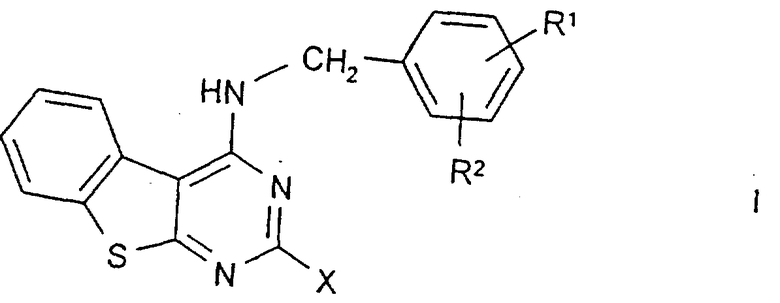
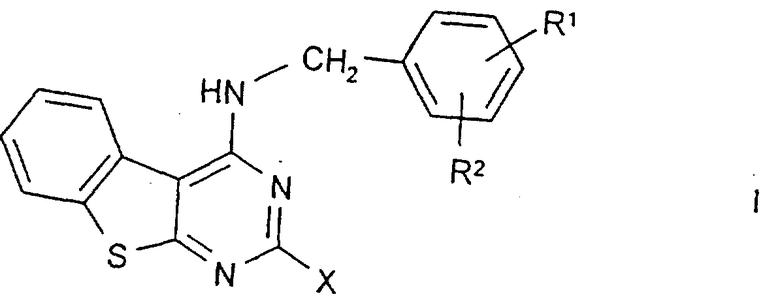
в которой R1, R2 каждый независимо друг от друга обозначает Н, ОА или Hal;
R1 и R2 - вместе обозначают также алкилен с 3-5 С-атомами, -О-СН2-СН2-,
-СН2-О-СН2-, -О-СН2-О- или -О-СН2-СН2-О-;
Х обозначает R4, R5 или R6, однократно замещенные заместителем R7;
R4 обозначает линейный либо разветвленный алкилен с 1-10 С-атомами;
R5 обозначает циклоалкил или циклоалкилалкилен с 5-12 С-атомами;
R6 обозначает фенил или фенилметил;
R7 обозначает СООН или СООА;
А обозначает алкил с 1-6 С-атомами;
Hal обозначает F, Cl, Вr или I,
а также их физиологически приемлемые соли.
(а) 3-[4-(3-хлор-4-метоксибензиламино)бензо[4,5]тиено[2,3-d]пиримидин-2-ил]пропионовая кислота;
(б) 4-[4-(3,4-метилендиоксибензиламино)бензо[4,5]тиено[2,3-d]пиримидин-2-ил] масляная кислота;
(в) 7-[4-(3,4-метилендиоксибензиламино)бензо[4,5]тиено-[2,3-d]пиримидин-2-ил]гептановая кислота;
(г) 7-[4-(3-хлор-4-метоксибензиламино)бензо[4,5]тиено[2,3-d]пиримидин-2-ил] гептановая кислота;
(д) 5-[4-(3-хлор-4-метоксибензиламино)бензо[4,5]тиено[2,3-d]пиримидин-2-ил] валериановая кислота;
(е) 2-{4-[4-(3-хлор-4-метоксибензиламино)бензо[4,5]тиено[2,3-d]пиримидин-2-ил]циклогексил-1- ил}уксусная кислота;
(ж) 4-[4-(3,4-метилендиоксибензиламино)бензо[4,5]тиено[2,3-d]пиримидин-2-ил] циклогексанкарбоновая кислота;
(з) 4-[4-(3,4-метилендиоксибензиламино)бензо[4,5]тиено[2,3-d]пиримидин-2-ил] бензойная кислота;
(и) 4-[4-(3,4-метилендиоксибензиламино)бензо[4,5]тиено[2,3-d]пиримидин-2-ил] фенилуксусная кислота;
(к) 4-[4-(3-хлор-4-метоксибензиламино)бензотиено[2,3-d]пиримидин-2-ил] циклогексанкарбоновая кислота;
а также их физиологически приемлемые соли.
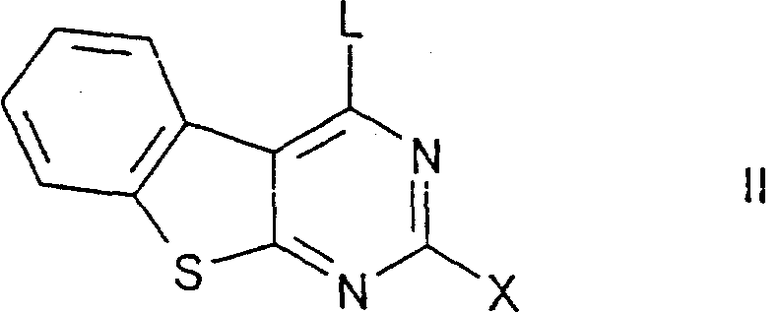
где Х имеет указанные выше значения, a L обозначает Сl, Вr, ОН, SCH3 или реакционноспособную этерифицированную ОН-группу, подвергают взаимодействию с соединением формулы III
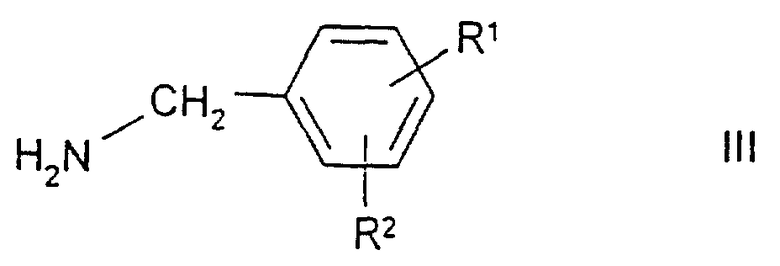
где R1 и R2 имеют указанные выше значения, с последующим, в случае необходимости, превращением в полученном соединении формулы I одного остатка Х в другой остаток X, например, путем гидролиза сложноэфирной группы до СООН-группы, и/или переводом соединения формулы I в одну из его физиологически приемлемых солей.
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
Авторы
Даты
2004-02-27—Публикация
1999-04-23—Подача