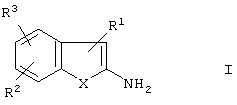
Изобретение относится к способу получения бензо-слитых гетероциклов общей формулы I:

в которой
Х представляет собой S, О или NH,
R1 представляет собой CN, NO2, Ac, COAr, COOAr, COOH, СООА или CONR4R5,
R2 и R3 независимо друг от друга, каждый представляет собой Н, А, NO2, CN, ОН, ОА или Ас,
R4 и R5 независимо друг от друга, каждый представляет собой Н, А, Ar или Ас, или
R4 и R5 совместно представляют собой -(CH2)-(CH2)n-(CH2)-,
А представляет собой алкил, имеющий 1-6 атомов С,
Ас представляет собой ацил, имеющий 1-6 атомов С,
Ar представляет собой незамещенный фенил или фенил, замещенный А, NO2, CN, ОН или ОА, и
n представляет собой 2, 3 или 4,
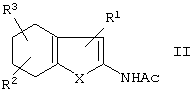
при помощи реакции тетрагидробензо-слитых гетероциклов формулы II:
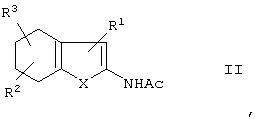
в которой
Х представляет собой S, О или NH,
R1 представляет собой CN, NO2, Ac, COAr, COOAr, COOH, СООА или CONR4R5,
R2 и R3 независимо друг от друга, каждый представляет собой Н, A, NO2, CN, ОН, ОА или Ас,
R4 и R5 независимо друг от друга, каждый представляет собой Н, А, Ar или Ас, или
R4 и R5 совместно представляют собой -(CH2)-(СН2)n-(CH2)-,
А представляет собой алкил, имеющий 1-6 атомов С,
Ас представляет собой ацил, имеющий 1-6 атомов С,
Ar представляет собой незамещенный фенил или фенил, замещенный А, NO2, CN, ОН или ОА, и
n представляет собой 2, 3 или 4,
с каталитическим количеством катализатора из благородного металла в присутствии акцептора водорода, а затем деацилированием ацилированной аминогруппы действием амина.
Бензо-слитые гетероциклы формулы I являются важными промежуточными продуктами в промышленном органическом синтезе, напр., в производстве тонких химикалий, красителей и агентов для защиты растений. Они также являются важными промежуточными продуктами в производстве лекарств. Бензо-слитые гетероциклы формулы I, в которой Х представляет собой S, особенно важны в производстве ингибиторов PDE-V, которые известны из WO 99/55708 и WO 00/78767. В частности, этил 2-аминобензо[b]-тиофен-3-карбоксилат является промежуточным продуктом синтеза 4-[4-(3-хлоро-4-метоксибензиламино)бензо-[4,5]тиено[2,3-d]пиримидин-2-ил]циклогексанкарбоновой кислоты, которая известна из WO 99/55708, или 4-[4-(3-хлоро-4-гидроксибензиламино)бензо[4,5]тиено[2,3-d]-пиримидин-2-ил]циклогексанкарбоновой кислоты, которая известна из WO 00/78767.
Согласно классическому синтезу тетрагидробензо-слитые соединения ароматизируются при помощи реакции с элементарной серой при высоких температурах (литература: Gewald и др., Chem. Ber. 1968, 101, 1933). Недостатками этого способа являются высокие энергетические затраты, которые являются следствием высоких температур реакций, выброс сероводорода, который представляет собой неудобство в виде неприятного запаха, а также проблемы, которые возникают при очистке, потому что элементарная сера растворяется лишь в CS2, который является чрезвычайно воспламенимым.
Одним частным примером уровня техники является реакция соединения 2-ацетиламино-3-метокси-карбонил-4,5-тетраметилентиофена с 2 эквивалентами серы и диметил фталата при температурах между 200 и 220°С, согласно G. Hallas и др.., Dyes Pigm. 1997, 35, 219-237. 2-Ацетиламино-3-метокси-карбонилбензо[b]тиофен выделяют и затем, на второй стадии, деацитилируют в этаноле при помощи реакции с водным раствором гидроксида калия.
Другой известной возможностью ароматизации тетрагидробензо-слитого соединения является проведение реакции его с эквимолярным количеством катализатором гидрогенации. Один частный пример, а именно дегидрогенация метил 2-ацетиламинотетрагидробензотиофен-3-карбоксилата с приблизительно эквимолярным количеством палладия-на-углероде (10% Pd/C) в хлороформе в качестве растворителя, описана в Eiden и др., Arch. Pharm. 1984, 317, 675-680.
По экологическим причинам реакции с элементарной серой являются непрактичными в промышленном масштабе.
Во втором варианте количество катализатора гидрогенации, которое применяется, необходимо выдерживать как можно меньшим по экономическим причинам. Также бензо-слитые гетероциклы, которые образуются при дегидрогенации, часто лишь плохо растворимы в растворителях, которые применяют для осаждения, когда гетерогенная реакционная смесь охладится. Это делает отделение благородного металла-катализатора более сложным, и для экстракции продукта из катализатора благородного металла требуются существенные количества растворителя.
Целью изобретения было, таким образом, разработать способ получения бензо-слитых гетероциклов формулы I, который имеет преимущество по сравнению с известными в уровне техники способами.
Неожиданно было обнаружено, что тетрагидробензо-слитые соединения формулы II могут быть ароматизированы при помощи каталитического количества катализатора гидрогенации в присутствии акцептора водорода. Немедленное деацилирование аминогруппы во 2 позиции гетероцикла при помощи добавления амина дает бензо-слитые соединения формулы I в качестве быстрорастворимых продуктов, что дает возможность отделения катализатора из благородного металла при помощи простой реакции. Способ по изобретению является одноемкостным процессом, т.е. ароматизация и дециклизация происходят последовательно без выделения промежуточного продукта, который в этом случае представляет собой бензо-слитый гетероцикл с ацилированной аминогруппой.
Значения всех радикалов, которые встречаются несколько раз, напр., А или Ас, являются независимыми друг от друга.
Радикал А представляет собой алкил и имеет от 1 до 6, предпочтительно 1, 2, 3 или 4 и особенно предпочтительно 1 или 2 атома С. Алкил, таким образом, представляет собой особенно метил, также этил, н-пропил, изопропил, н-бутил, втор-бутил или трет-бутил, или также пентил, 1-, 2- или 3-метилбутил, 1,1-, 1,2- или 2,2-диметилпропил, 1-этилпропил, гексил, 1-, 2-, 3- или 4-метилпентил, 1,1-, 1,2-, 1,3-, 2,2-, 2,3- или 3,3-диметилбутил, 1- или 2-этилбутил, 1-этил-1-метилпропил, 1-этил-2-метилпропил или 1,1,2- или 1,2,2-триметилпропил. А особенно предпочтительно представляет собой метил или этил.
Ас представляет собой ацил и предпочтительно имеет 1-6 атомов С. Ас представляет собой, напр., формил, ацетил, пропионил, бутирил, пентаноил или гексаноил, или также трифтороацетил. Ас особенно предпочтительно представляет собой ацетил.
Ar представляет собой незамещенный фенил или фенил, замещенный A, NO2, CN, ОН или ОА.
Ar представляет собой, таким образом, предпочтительно фенил, о-, м- или п-метилфенил, о-, м- или п-этилфенил, о-, м- или п-пропилфенил, о-, м- или п-изопропилфенил, о-, м- или п-трет-бутилфенил, о-, м- или п-гидроксифенил, о-, м- или п-метоксифенил, о-, м- или п-этоксифенил, о-, м- или п-нитрофенил или о-, м- или п-цианофенил. Ar особенно предпочтительно представляет собой незамещенный фенил.
COAr представляет собой ароил, Ar представляет собой группу, как было указано выше. COAr особенно предпочтительно представляет собой бензоил.
COOAr представляет собой арилоксикарбонил, Ar представляет собой группу, как указано выше. COOAr особенно предпочтительно представляет собой феноксикарбонил.
Х представляет собой S, О или NH, S является особенно предпочтительным.
R1 представляет собой CN, NO2, Ac, COAr, COOAr, СООН, СООА или CONR4R5, А, Ас и Ar, которые указаны выше, и R4 и R5 имеют значения, указанные выше. R1 особенно предпочтительно представляет собой CN или СООА и чрезвычайно предпочтительно СООА.
R2 и R3 независимо друг от друга каждый представляют собой Н, A, NO2, CN, ОН, ОА или Ас, А и Ас представляют собой группы, как указано выше. R2 и R3 особенно предпочтительно представляют собой Н.
R4 и R5 независимо друг от друга, каждый представляет собой Н, А, Ar или Ас, А, Ar и Ас представляет собой группу, как указано выше. R4 и R5 особенно предпочтительно представляют собой Н.
R4 и R5 совместно представляют собой также -(CH2)-(СН2)n-(СН2)-, для n возможны значения 2, 3 или 4. R4 и R5 совместно особенно предпочтительно представляют собой -(CH2)-(СН2)2-(СН2)- или -(СН2)-(СН2)3-(СН2)- и чрезвычайно предпочтительно -(СН2)-(СН2)3-(СН2)-.
Катализаторы гидрогенации (или, что синонимично, катализаторы из благородных металлов), которые применяются, могут быть благородными металлами, такими как палладий, платина или родий, на подходящей основе, такой как углерод, активированный уголь, оксид алюминия, карбонат бария, сульфат бария, карбонат кальция или карбонат стронция. Доля благородного металла в катализаторе из благородного металла составляет между 1 и 20%, предпочтительно между 5 и 10%, и особенно предпочтительно - 5%.
Палладий на активированном угле, углероде, оксиде алюминия, карбонате бария, сульфате бария, карбонате кальция или карбонате стронция, платина на активированном угле, углероде или оксиде алюминия или родий на углероде или оксиде алюминия могут применяться, в частности, для способа по изобретению. Особенно предпочтительным является применение палладия на активированном угле (5% Pd).
Другой возможностью является применение солей благородных металлов, которые могут быть восстановлены in situ при помощи восстановителя и давать in situ мелко измельченные виды палладия (0). Примерами пригодных солей благородных металлов являются ацетат палладия, бромид палладия или хлорид палладия, а примерами пригодных восстановителей являются водород, гидразин, борогидрид натрия или форматы.
Изобретение далее относится к способу получения бензо-слитых гетероциклов общей формулы I по пункту 1 или 2 формулы изобретения, который отличается тем, что применяется катализатор из благородного металла, выбираемый из группы, включающей палладий на активированном угле, углероде, оксиде алюминия, карбонате бария, сульфате бария, карбонате кальция или карбонате стронция, платина на активированном угле, углероде или оксиде алюминия или родий на углероде или оксиде алюминия.
Недорогие акцепторы водорода, такие, как известные специалисту в данной области техники, являются особенно пригодными для способа по изобретению, примерами недорогих органических акцепторов водорода являются стирол, α-метилстирол, стильбен, толаны, эфиры коричной кислоты или циклогексен. Особенно предпочтительно применять α-метилстирол.
Другими акцепторами водорода, пригодными для способа по изобретению, являются кислород или смеси кислород/газ, газ следует понимать как обозначающий азот или благородные газы, такие как гелий, неон, аргон или ксенон. Доля кислорода в смеси кислород/газ составляет между 1 и 99%, предпочтительно между 10 и 50%, и особенно предпочтительно от 15 до 25%.
Смесь кислород/газ особенно предпочтительно представляет собой воздух.
Органический акцептор водорода может претерпевать реакции полимеризации при ароматизации. Образование этих побочных продуктов, т.е., полимеров, можно снизить, добавляя акцептор водорода в небольших количествах, последовательно (полунепрерывно) или непрерывно во время реакции.
Изобретение также относится к способу получения бензо-слитых гетероциклов общей формулы I по одному или более пунктам с 1 по 3, который отличается тем, что применяемый акцептор водорода выбирают из группы, которая включает стирол, α-метилстирол, стильбен, толаны, сложные эфиры коричной кислоты, например, метил или этил циннамат, циклогексен, кислород и смеси кислород/газ.
Дегидрогенацию - таким образом, ароматизацию - с применением каталитического количества катализатора гидрогенации преимущественно необходимо проводить в атмосфере инертного газа с целью избежания взрывов, поэтому более преимущественно применять органические акцепторы водорода, выбираемые из группы, которая включает стирол, α-метилстирол, стильбен, толаны, сложные эфиры коричной кислоты и циклогексен.
Для деацилирования ацилированной аминогруппы соединений общей формулы II, а также бензо-слитого промежуточного продукта после ароматизации к реакционной смеси добавляют первичный или вторичный амин, кипящий при между 50 и 200°С, предпочтительно при между 50 и 150°С. Особенно предпочтительно применять пирролидин, пиперидин, пиперазин, морфолин или диоктиламин, а наиболее предпочтительно применять пирролидин.
Изобретение относится к способу, описанному выше, отличающемуся тем, что первичный или вторичный амин, кипящий при температуре между 50 и 200°С, выбирают для деацилирования.
Ароматизация и деацилирование предпочтительно имеют место в инертном растворителе с высокой точкой кипения, предпочтительными инертными растворителями с высокой точкой кипения являются бензол, толуол, ксилен, мезитилен, дифениловый эфир или сульфолан. Ксилен предпочтительно применяется в качестве изомерной смеси. Изомеры о-, м- или п-ксилен также пригодны. Особенно предпочтительным является применять ксилен.
Изобретение относится к способу, описанному выше, который отличается тем, что реакции проводят в инертном растворителе с высокой точкой кипения.
Дегидрогенация и деацилирование предпочтительно происходят при диапазоне температур от 50° до 250°С, диапазон температур для дегидрогенации предпочтительно составляет между 100° и 250°С, и особенно предпочтительно между 140° и 200°С, а диапазон температур для деацилирования предпочтительно составляет между 50° и 200°С, и особенно предпочтительно между 80°С и 150°С.
Изобретение относится к способу, описанному выше, который отличается тем, что реакции проводят при температурах между 50 и 200°С.
В способе по изобретению выходы бензо-слитых гетероциклов формулы I нормально составляют между 65% и 80%, включая стадию деацилирования.
Способ по изобретению, как описано выше, особенно пригоден для получения метил или этил 2-аминобензо[b]тиофен-3-карбоксиата. По изобретению, это осуществляют при помощи реакции метил или этил 2-ацетиламинотетрагидробензотиофен-3-карбоксилата с каталитическим количеством катализатора из благородного металла в присутствии акцептора водорода, а затем деацилирования ацилированной аминогруппы при помощи добавления амина.
Изобретение также относится к применению метил или этил 2-аминобензо[b]тиофен-3-карбоксиата, полученного по способу, описанному выше, в качестве промежуточного продукта синтеза 4-[4-(3-хлоро-4-метоксибензиламино)-бензо[4,5]тиено[2,3-d]пиримидин-2-ил]циклогексанкарбоновой кислоты, которая известна из WO 99/55708. Другими промежуточными продуктами при синтезе 4-[4-(3-хлоро-4-метоксибензиламино)бензо[4,5]тиено[2,3-d]пиримидин-2-ил]циклогексанкарбоновой кислоты, исходя из метил 2-аминобензо[b]тиофен-3-карбоксиата, являются метил 4-(4-гидроксибензо[4,5]тиено[2,3-d]пиримидин-2-ил)цикло-гексанкарбоксилат, метил 4-(4-хлоробензо[4,5]тиено-[2,3-d]пиримидин-2-ил)циклогексанкарбоксилат и метил 4-[4-(3-хлоро-4-метоксибензиламино)бензо[4,5]тиено-[2,3-d]пиримидин-2-ил]циклогексанкарбоксилат.
Способ, известный из WO 99/55708 для получения 4-[4-(3-хлоро-4-метоксибензиламино)бензо[4,5]-тиено[2,3-d]пиримидин-2-ил]циклогексанкарбоновой кислоты включает следующие стадии:
Стадия а) метил 2-аминотетрагидробензотиофен-3-карбоксилат сначала циклизируют с метил 4-циано-циклогексанкарбоксилатом;
Стадия b) тетрагидробензотиофеновую единицу образовавшегося промежуточного продукта дегидрогенируют при помощи серы с получением соединения метил 4-(4-гидроксибензо[4,5]-тиено[2,3-d]пиримидин-2-ил)циклогексанкарбоксилата;
Стадия с) гидроксильную группу хлорируют при помощи реакции с хлорирующим агентом, предпочтительно POCl3;
Стадия d) соединение метил 4-(4-хлоробензо[4,5]-тиено[2,3-d]пиримидин-2-ил)циклогексанкарбоксилат со стадии с) подвергают реакции с 3-хлоро-4-метокси-бензиламином с получением сложного эфира метил 4-[4-(3-хлоро-4-метоксибензиламино)бензо[4,5]тиено[2,3-d]-пиримидин-2-ил]циклогексанкарбоксилата;
Стадия е)сложный эфир со стадии d) омыляют; и
Стадия f) свободную кислоту переводят в фармакологически приемлемую соль.
По экологическим причинам, однако, реакция с элементарной серой является непрактичной в промышленном масштабе.
Изобретение, таким образом, относится к способу получения 4-[4-(3-хлоро-4-метоксибензиламино)-бензо[4,5]тиено[2,3-d]пиримидин-2-ил]циклогексанкарбоновой кислоты или одной из ее фармацевтически приемлемых солей, который отличается тем, что включает следующие стадии:
Стадия а) алкил 2-ацетиламинотетрагидробензотиофен-З-карбоксилат подвергают реакции по одному или более п.п. с 1 по 7 с каталитическим количеством катализатора из благородного металла в присутствии акцептора водорода, а ацетилированную аминогруппу затем деацитилируют, добавляя амин, с получением соединения алкил 2-аминобензо[b]тиофен-3-карбоксилата;
Стадия b) алкил 2-аминобензо[b]тиофен-3-карбоксилат циклизируют при помощи реакции с алкил 4-цианоциклогексанкарбоксилатом;
Стадия с) гидроксильную группу соединения алкил 4-(4-гидроксибензо[4,5]тиено[2,3-d]пиримидин-2-ил)-циклогексанкарбоксилата со стадии b) хлорируют при помощи хлорирующего агента;
Стадия d) соединение алкил 4-(4-хлоробензо[4,5]тиено-[2,3-d]пиримидин-2-ил) циклогексанкарбоксилат со стадии с) подвергают реакции с 3-хлоро-4-метоксибензиламином с получением сложного эфира алкил 4-[4-(3-хлоро-4-метокси-бензиламино)-бензо[4,5]тиено[2,3-d]пиримидин-2-ил]-циклогексанкарбоксилата;
Стадия е)сложный эфир со стадии d) омыляют; и
Стадия f) свободную кислоту переводят в фармакологически приемлемую соль.
Алкиловый сложный эфир, например, представляет собой метиловый, этиловый, пропиловый или бутиловый эфир. Предпочтительно в качестве алкил 2-ацетиламинотетрагидробензотиофен-3-карбоксилата применять метил или этил 2-ацетиламинотетрагидробензотиофен-3-карбоксилат и все последующие промежуточные продукты, которые основываются на этой сложноэфирной единице. Предпочтительно в качестве алкил 4-цианоциклогексанкарбоксилата применять метил транс-4-цианоциклогексанкарбоксилат и все последующие промежуточные продукты, которые основываются на этой сложноэфирной единице.
Реакционные условия циклизации b) в получении по изобретению 4-[4-(3-хлоро-4-метоксибензиламино)бензо[4,5]тиено[2,3-d]-пиримидин-2-ил]циклогексанкарбоновой кислоты известны из Eur. J. Med. Chem. 1988, 23, 453.
Примерами пригодных хлорирующих агентов являются POCl3, SOCl2 или цианмочевой хлорид. Хлорирование при помощи POCl3 или SOCl2 происходит при условиях реакции, известных специалисту в данной области техники. Реакция предпочтительно происходит в инертном растворителе, например в толуоле, метиленхлориде или диметилформамиде.
Реакции метил 4-(4-хлоробензо[4,5]тиено-[2,3-d]пиримидин-2-ил)циклогексанкарбоксилата на стадиях d) и е) способа по изобретению получения 4-[4-(3-хлоро-4-метоксибензил-амино)бензо[4,5]тиено[2,3-d]пиримидин-2-ил]циклогексанкарбоновой кислоты, как описано выше, и стадии f) известны из WO 99/55708, Пример 1, стр. 11-12, и Пример 2, стр. 14.
Изобретение также относится к применению метил или этил 2-аминобензо[b]тиофен-3-карбоксилата, получаемого по способу, описанному выше, в качестве промежуточного продукта при синтезе 4-[4-(3-хлоро-4-гидроксибензиламино)-бензо[4,5]тиено[2,3-d]пиримидин-2-ил]циклогексанкарбоновой кислоты, которая известна из WO 00/78767. Другие промежуточные продукты при синтезе 4-[4-(3-хлоро-4-гидроксибензиламино)бензо[4,5]тиено[2,3-d]пиримидин-2-ил]-циклогексанкарбоновой кислоты, исходя из метил 2-аминобензо[b]тиофен-3-карбоксилата, представляют собой метил 4-(4-гидроксибензо[4,5]тиено[2,3-d]пиримидин-2-ил)-циклогексанкарбоксилат, метил 4-(4-хлоробензо[4,5]-тиено[2,3-d]пиримидин-2-ил)циклогексанкарбоксилат и метил 4-[4-(3-хлоро-4-гидроксибензиламино)бензо[4,5]-тиено[2,3-d]пиримидин-2-ил]циклогексанкарбоксилат.
В способе, известном из WO 00/78767 для получения 4-[4-(3-хлоро-4-гидроксибензиламино)-бензо[4,5]тиено[2,3-d]пиримидин-2-ил]циклогексанкарбоновой кислоты, метил 4-(4-хлоробензотиено[2,3-d]-пиримидин-2-ил)циклогексанкарбоксилат подвергают реакции с 3-хлоро-4-гидроксибензиламином, получая метил 4-(4-хлоробензо тиено [2,3-d]пиримидин-2-ил)циклогексанкарбоксилат, как также описано в WO 99/55708, при помощи циклизации метил 2-амино-5,6,7,8-тетрагидро-бензотиофен-3-карбоксилата с метил 3-циано-циклогексанкарбоксилатом. Дегидрогенации с серой и последующим хлорированием с оксидом фосфора/диметиламином.
По экологическим причинам, однако, реакция с элементарной серой является непрактичной в промышленном масштабе.
Изобретение, таким образом, относится к способу получения 4-[4-(3-хлоро-4-гидроксибензиламино)-бензо[4,5]тиено[2,3-d]пиримидин-2-ил]циклогексанкарбоновой кислоты или одной из ее фармацевтически приемлемых солей, который отличается тем, что включает следующие стадии:
Стадия а) алкил 2-ацетиламинотетрагидробензотиофен-3-карбоксилат подвергают реакции по одному или более п.п. с 1 по 7 с каталитическим количеством катализатора из благородного металла в присутствии акцептора водорода, а ацетилированную аминогруппу затем деацитилируют, добавляя амин, с получением соединения алкил 2-аминобензо[b]тиофен-3-карбоксилата;
Стадия b) алкил 2-аминобензо[b]тиофен-3-карбоксилат циклизируют при помощи реакции с алкил 4-цианоциклогексанкарбоксилатом;
Стадия с) гидроксильную группу соединения алкил 4-(4-гидроксибензо[4,5]тиено[2,3-d]пиримидин-2-ил)-циклогексанкарбоксилата со стадии b) хлорируют при помощи хлорирующего агента;
Стадия d) соединение алкил 4-(4-хлоробензо[4,5]тиено-[2,3-d]пиримидин-2-ил) циклогексанкарбоксилат со стадии с) подвергают реакции с 3-хлоро-4-гидроксибензиламином с получением сложного эфира алкил 4-[4-(3-хлоро-4-гидрокси-бензиламино) бензо [4,5] тиено [2,3-d] пиримидин-2-ил] -циклогексанкарбоксилата;
Стадия е)сложный эфир со стадии d) омыляют; и
Стадия f) свободную кислоту переводят в фармакологически приемлемую соль.
Определения термина алкиловый сложный эфир и условий реакций циклизации и хлорирования, как описано выше для 4-[4-(3-хлоро-4-метоксибензиламино)бензо[4,5]тиено[2,3-d]пиримидин-2-ил]циклогексанкарбоновой кислоты, также относятся к соединению 4-[4-(З-хлоро-4-гидроксибензиламино)бензо-[4,5]тиено[2,3-d]пиримидин-2-ил]циклогексанкарбоновая кислота. Условия реакций стадий с d) по f) известны из WO 99/55708, Примеры 1 и 2, и из WO 00/78767, Примеры 1 и 7.
В нижеследующих примерах, а также в вышеприведенных пояснениях температуры приведены в °С. В примерах "традиционная обработка" имеет следующее значение: при необходимости добавляют воду, рН устанавливают на от 2 до 10, при необходимости, в зависимости от состава конечного продукта, проводят экстракцию этилацетатом или дихлорометаном и органическую фазу отделяют, сушат над сульфатом натрия, выпаривают и очищают при помощи хроматографии на силикагеле и/или кристаллизации.
Пример 1:
Суспензию 22,9 г палладия на активированном угле (5% Pd/C) (Degussa-Huls; E 101 Rw 5%, 53,9% - содержание влаги) в 260 мл ксилена выдерживают при температуре флегмы в водном сепараторе до окончания отделения воды. Раствор 49,7 г N-ацетилтиофеннитрила в 210 мл ксилена добавляют к этой реакционной смеси при комнатной температуре и реакционную смесь нагревают до 143°С. 48 г α-метилстирола добавляют через 2 ч и еще 25 г α-метилстирола добавляют через 96 ч. Деацилирование начинают, добавляя 47 г пирролидина после протекания реакции на протяжении 127 ч, температуру удерживают при 137°С. После протекания реакции на протяжении 48 ч смесь фильтруют в горячем состоянии и остаток промывают при помощи 100 мл этилацетата и 200 мл 10% раствора HCl. Органическую фазу промывают при помощи дистиллированной воды до достижения рН промываний 4. Органический растворитель отгоняют с получением 2-аминобензо-[b]тиофен-3-карбонитрила с выходом 81%.
Пример 2:
2 г палладиевого катализатора (5% Pd/C, прибл. 50% влагосодержание; Degussa-Hiils; E 101 RW 5%) добавляют к раствору 10 г этил 2-ацетиламинотетрагидро-бензотиофенкарбоксилата в 80 мл мезитилена и смесь нагревают до 170° в атмосфере азота. 2 г этилциннамата отмеряют в реакционную смесь на протяжении 30 мин, а перемешивание продолжают на протяжении 21 часа. Температуру затем понижают до 100°С и добавляют 10 мл пирролидина. Реакционную смесь перемешивают на протяжении 25 ч в атмосфере азота. Катализатор затем отфильтровывают и промывают 60 г этанола. Растворы объединяют и растворитель отгоняют. Остаток отбирают в этилацетат и дважды промывают 1Н HCl и один раз - водой. После отгонки растворителя и последующей кристаллизации из 2-пропанола получают этил 2-аминобензо[b]тиофен-3-карбоксилат с выходом 64%.
Пример 3:
14,4 г катализатора гидрогенации (Degussa-Huls; E 101 R/W 5%) добавляют к раствору 36 г этил 2-ацетиламинотетрагидробензотиофен-3-карбоксилата в 250 мл ксилена (смесь изомеров) и смесь нагревают до постоянной температуры в от 139°С до 141°С. 47 г α-метилсилана отмеряют в реакционную смесь на протяжении периода в 5 ч. Смесь затем выдерживают при температуре флегмы еще 36 ч. Ее охлаждают до 102°С, добавляют 32 г пирролидина и смесь снова возвращают на точку флегмы (127°С); ее перемешивают на протяжении 20 ч при этой температуре. После охлаждения до 20°С Pd/углероде отфильтровывают, фильтрат концентрируют до получения остатка, а остаток отбирают в 75 мл этилацетата и промывают три раза по 12 мл. 10% соляной кислоты. Органическую фазу дважды промывают по 5 мл воды и затем концентрируют до получения остатка. Его рекристаллизируют из 50 мл изопропанола с получением 21 г этил 2-аминобензотиофен-3-карбоксилата в виде желтоватых кристаллов(70,5% - выход).
Другие стадии синтеза известны из Eur. J. Med. Chem. 1988, 23, 453 и WO 99/55708, Пример 1, стр. 11-12, и Пример 2, стр. 14.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТИЕНОПИРИМИДИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2000 |
|
RU2238274C2 |
| Конденсированные тиенопиримидины с ингибирующим фосфодиэстеразу V действием, способ их получения и фармацевтическая композиция | 1999 |
|
RU2224760C2 |
| ТИЕНОПИРИМИДИНЫ С ИНГИБИРУЮЩИМ ДЕЙСТВИЕМ ПО ОТНОШЕНИЮ К ФОСФОДИЭСТЕРАЗЕ V (PDE V), СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2197492C2 |
| 2-АМИНОАЛКИЛТИЕНО[2,3-D]ПИРИМИДИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2261863C2 |
| ПИРАЗОЛО[4,3-D] ПИРИМИДИНЫ | 2000 |
|
RU2249594C2 |
| Новое производное гидразона, в котором концевая аминогруппа замещена арильной группой или гетероарильной группой, и его применение | 2018 |
|
RU2802444C2 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ТИОФЕНИЛАМИДА | 2013 |
|
RU2644565C2 |
| НОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2004 |
|
RU2412190C2 |
| КОНДЕНСИРОВАННОЕ ПРОИЗВОДНОЕ ТИОФЕНА, ПРОИЗВОДНОЕ БЕНЗОТИОФЕНА, ПРОИЗВОДНОЕ ТИЕНОБЕНЗОКСАЗЕПИНОНА, ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2197491C2 |
| ТИЕНОПИРИМИДИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1997 |
|
RU2199541C2 |
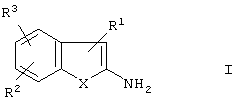
Настоящее изобретение относится к способу получения бензо[b]тиофенов формулы I
в которой
Х представляет собой S,
R1 представляет собой CN или СООА,
R2 и R3 каждый представляют собой водород,
А представляет собой алкил, имеющий 1-6 атомов С,
путем дегидрогенизации тетрагидробензотиофена формулы II:
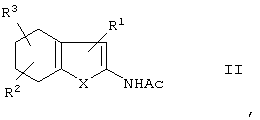
в которой
R1-R3 и Х имеют указанные выше значения,
Ас представляет собой ацил, имеющий 1 - 6 атомов С,
в присутствии каталитического количества катализатора на основе благородного металла и акцептора водорода с последующим деацилированием ацилированной аминогруппы действием амина. Соединения формулы I являются промежуточными продуктами в производстве красителей, агентов для защиты растений, в производстве лекарств. 6 з.п. ф-лы.
в которой Х представляет собой S,
R1 представляет собой CN или СООА,
R2 и R3 каждый представляет собой водород,
А представляет собой алкил, имеющий 1-6 атомов С,
путем дегидрогенизации тетрагидробензотиофена формулы II
в которой
R1-R3 и Х имеют указанные выше значения,
Ас представляет собой ацил, имеющий 1-6 атомов С,
в присутствии каталитического количества катализатора на основе благородного металла и акцептора водорода с последующим деацилированием ацилированной аминогруппы действием амина.
| SU, 791239, 23.12.1980 | |||
| WO, 95/55708, А, 04.11.1999 | |||
| US, 4885432, А, 19.12.1989. |
Авторы
Даты
2005-09-10—Публикация
2001-03-09—Подача