Область техники
Данное изобретение относится к новым производным карбамата и фунгициду для использования в сельском хозяйстве/садоводстве, содержащему указанные производные в качестве активного ингредиента.
Уровень техники
До настоящего времени сообщалось о многих производных карбаминовой кислоты, но не было известно, что производные карбаминовой кислоты, имеющие простую оксимэфирную группу в фенильной группе, как соединения настоящего изобретения, обладают превосходной фунгицидной активностью.
Объектом данного изобретения являются новые производные карбамата и фунгицид сельского хозяйства/садоводства, содержащий указанные производные в качестве активного ингредиента.
Описание изобретения
Авторы данного изобретения провели обширные исследования с целью получения нового фунгицида для использования в сельском хозяйстве/садоводстве, и в результате обнаружили, что производные карбамата данного изобретения (далее обозначаемые как соединения данного изобретения) являются новыми соединениями, не описанными в каком-либо источнике, и проявляют выдающееся действие в качестве фунгицида сельского хозяйства/садоводства, и наконец завершили данное изобретение. А именно, данное изобретение относится к
(1) производным карбамата, представленным общей формулой [I]:
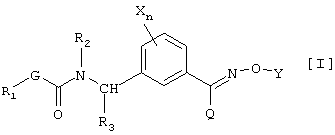
в которой Х является атомом галогена, C1-C6 алкильной группой, C1-С6 алкоксигруппой, C1-C6 галоидалкильной группой или C1-С6 галоидалкоксигруппой, n равно 0 или целому числу от 1 до 4, R1 является C1-C6 алкильной группой, R2 является атомом водорода, C1-C6 алкильной группой, C2-C6 алкенильной группой, C2-C6 алкинильной группой, C1-C6 алкоксигруппой, C1-C6 алкокси C1-C6 алкильной группой, C1-C6 алкилкарбонильной группой, C1-C6 алкоксикарбонильной группой, C1-C6 алкилкарбонил C1-C6 алкильной группой или бензильной группой, которая может быть замещена, R3 является атомом водорода или C1-C6 алкильной группой, G является атомом кислорода, серы или -NR4- группой [в которой R4 является атомом водорода или C1-C6 алкильной группой], Y является атомом водорода, C1-С10 алкильной группой (указанная группа может быть замещена одинаковыми или различными заместителями, по крайней мере, одним атомом галогена, цианогруппой, нитрогруппой, гидроксильной группой, С3-С6 циклоалкильной группой, C1-C6 алкоксигруппой, аминогруппой, моно-C1-C6 алкиламиногруппой, ди-С1-С6 алкиламиногруппой, C1-C6 алкилтиогруппой, C1-C6 алкилсульфинильной группой, карбоксильной группой, C1-C6 алкилкарбонильной группой, C1-C6 алкоксикарбонильной группой, C1-C6 алкоксииминогруппой или C(O)NR5R6 (где каждый из R5 и R6, которые являются одинаковыми или различными, представляют атом водорода или C1-C6 алкильную группу)), С2-С10 алкенильной группой (указанная группа может быть замещена одинаковыми или различными заместителями, по крайней мере, одним атомом галогена, цианогруппой, нитрогруппой, гидроксильной группой, C1-С6 алкоксигруппой, аминогруппой, моно-C1-C6 алкиламиногруппой, ди-С1-С6 алкиламиногруппой, C1-C6 алкилтиогруппой, C1-С6 галоидалкильной группой, C1-С6 алкилкарбонильной группой, C1-C6 алкоксикарбонильной группой или C(O)NR5R6 (где каждый из R5 и R6, которые являются одинаковыми или различными, представляют атом водорода или C1-C6 алкильную группу)), С2-С10 алкинильной группой (указанная группа может быть замещена одинаковыми или различными заместителями, по крайней мере, одним атомом галогена, цианогруппой, нитрогруппой, циклоалкильной группой, гидроксильной группой, C1-С6 алкоксигруппой, аминогруппой, моно-C1-C6 алкиламиногруппой, ди-С1-С6 алкиламиногруппой, C1-C6 алкилтиогруппой, C1-C6 галоидалкильной группой, C1-C6 алкилкарбонильной группой, C1-C6 алкоксикарбонильной группой или C(O)NR5R6 (где каждый из R5 и R6, которые являются одинаковыми или различными, представляют атом водорода или C1-C6 алкильную группу)), C3-C6 циклоалкильной группой (указанная группа может быть замещена одинаковыми или различными заместителями, по крайней мере, одним атомом галогена, цианогруппой, нитрогруппой, C1-C6 алкильной группой, C2-C6 алкенильной группой, C2-C6 алкинильной группой, гидроксильной группой, C1-C6 алкоксигруппой, аминогруппой, моно-C1-C6 алкиламиногруппой, ди-C1-C6 алкиламиногруппой, C1-C6 алкилтиогруппой, C1-C6 галоидалкильной группой, C1-C6 алкилкарбонильной группой, C1-C6 алкоксикарбонильной группой или C(O)NR5R6 (где каждый из R5 и R6, которые являются одинаковыми или различными, представляют атом водорода или C1-C6 алкильную группу)), С3-С6 циклоалкенильной группой (указанная группа может быть замещена одинаковыми или различными заместителями, по крайней мере, одним атомом галогена, цианогруппой, нитрогруппой, C1-C6 алкильной группой, C2-C6 алкенильной группой, гидроксильной группой, C2-C6 алкинильной группой, аминогруппой, моно-C1-C6 алкиламиногруппой, ди-C1-C6 алкиламиногруппой, C1-C6 алкоксигруппой, C1-C6 алкилтиогруппой, C1-C6 галоидалкильной группой, C1-C6 алкилкарбонильной группой, C1-C6 алкоксикарбонильной группой или C(O)NR5R6 (где каждый из R5 и R6, которые являются одинаковыми или различными, представляют атом водорода или C1-C6 алкильную группу)), фенацильной группой указанная группа может быть замещена одинаковыми или различными заместителями, по крайней мере, одним атомом галогена, C1-C6 алкильной группой, C1-C6 алкоксигруппой, C1-C6 галоидалкильной группой, C1-C6 алкилкарбонильной группой или C1-C6 алкоксикарбонильной группой), арильной группой (указанная группа может быть замещена одинаковыми или различными заместителями, по крайней мере, одним атомом галогена, цианогруппой, нитрогруппой, C1-C6 алкильной группой, C2-C6 алкенильной группой, C2-C6 алкинильной группой, гидроксильной группой, C1-C6 алкоксигруппой, аминогруппой, моно-C1-C6 алкиламиногруппой, ди-C1-C6 алкиламиногруппой, C1-C6 алкилтиогруппой, C1-C6 галоидалкильной группой, C1-C6 алкилкарбонильной группой, C1-C6 алкоксикарбонильной группой или C(O)NR5R6 (где каждый из R5 и R6, которые являются одинаковыми или различными, представляют атом водорода или C1-C6 алкильную группу)), гетероарильной группой (указанная группа может быть замещена одинаковыми или различными заместителями, по крайней мере, одним атомом галогена, цианогруппой, нитрогруппой, C1-C6 алкильной группой, C2-C6 алкенильной группой, C2-C6 алкинильной группой, гидроксильной группой, C1-C6 алкоксигруппой, аминогруппой, моно-C1-C6 алкиламиногруппой, ди-C1-C6 алкиламиногруппой, C1-C6 алкилтиогруппой, C1-C6 галоидалкильной группой, C1-C6 алкилкарбонильной группой, C1-C6 алкоксикарбонильной группой или C(O)NR5R6 (где каждый из R5 и R6, которые являются одинаковыми или различными представляют атом водорода или C1-C6 алкильную группу)), арил-C1-C6 алкильной группой (арил в указанной группе может быть замещен одинаковыми или различными заместителями, по крайней мере, одним атомом галогена, цианогруппой, нитрогруппой, C1-C6 алкильной группой, C2-C6 алкенильной группой, C2-C6 алкинильной группой, феноксигруппой, которая может быть замещена, гидроксильной группой, C1-C6 алкоксигруппой, аминогруппой, моно-C1-C6 алкиламиногруппой, ди-C1-C6 алкиламиногруппой, C1-C6 алкилтиогруппой, C1-C6 галоидалкильной группой, C1-C6 галоидалкоксигруппой, C1-C6 алкилкарбонильной группой, C1-C6 алкоксикарбонильной группой, C1-C6 алкоксиимино C1-C6 алкильной группой или C(O)NR5R6 (где каждый из R5 и R6, которые являются одинаковыми или различными, представляют атом водорода или C1-C6 алкильную группу)), арил-C2-C6 алкенильной группой (арил в указанной группе может быть замещен одинаковыми или различными заместителями, по крайней мере, одним атомом галогена, цианогруппой, нитрогруппой, C1-C6 алкильной группой, C2-C6 алкенильной группой, C2-C6 алкинильной группой, гидроксильной группой, C1-C6 алкоксигруппой, аминогруппой, моно-C1-C6 алкиламиногруппой, ди-C1-C6 алкиламиногруппой, C1-C6 алкилтиогруппой, C1-C6 галоидалкильной группой, C1-C6 алкилкарбонильной группой, C1-C6 алкоксикарбонильной группой или C(O)NR5R6 (где каждый из R5 и R6, которые являются одинаковыми или различными представляют атом водорода или C1-C6 алкильную группу)), или гетероциклической C1-C6 алкильной группой (гетероцикл в указанной группе может быть замещен одинаковыми или различными заместителями, по крайней мере, одним атомом галогена, цианогруппой, нитрогруппой, C1-C6 алкильной группой, C2-C6 алкенильной группой, C2-C6 алкинильной группой, гидроксильной группой, C1-C6 алкоксигруппой, аминогруппой, моно-C1-C6 алкиламиногруппой, ди-C1-C6 алкиламиногруппой, C1-C6 алкилтиогруппой, C1-C6 галоидалкильной группой, C1-C6 алкилкарбонильной группой, C1-C6алкоксикарбонильной группой или C(O)NR5R6 (где каждый из R5 и R6, которые являются одинаковыми или различными представляют атом водорода или C1-C6 алкильную группу)), и Q является атомом водорода, галоидалкильной группой, цианогруппой, C1-C6 алкильной группой, C3-C6 циклоалкильной группой, C1-C4 алкилтиогруппой, C1-C4 алкилсульфинильной группой, C1-C4 алкилсульфонильной группой или фенильной группой (указанная группа может быть замещена одинаковыми или различными заместителями, по крайней мере, одним атомом галогена, цианогруппой, нитрогруппой, C1-C4 алкильной группой, C3-C4 алкенильной группой, С2-С4 алкинильной группой, гидроксильной группой, C1-C4 алкоксигруппой, C1-C4 галоидалкильной группой, C1-C4 галоидалкоксигруппой, C1-C4 алкилкарбонильной группой или C1-C4 алкоксикарбонильной группой), и
(2) фунгициду сельского хозяйства/садоводства, содержащему указанные производные в качестве активного ингредиента.
Символы и термины, используемые в данном описании, объясняются ниже.
Атом галогена представляет атом фтора, хлора, брома или йода.
Обозначение, такое как C1-C10, указывает на то, что количество атомов углерода в заместителе, следующем за данным обозначением, составляет от 1 до 10 в данном случае.
C1-С6 алкильная группа представляет алкильную группу с прямой или разветвленной цепью и может быть, например, метилом, этилом, н-пропилом, изопропилом, н-бутилом, изобутилом, втор-бутилом, трет-бутилом, н-пентилом, изопентилом, неопентилом, н-гексилом, 1,1-диметилпропилом или 1,1-диметилбутилом.
C1-C10 алкильной группой может, например, быть указанная выше C1-C6 алкильная группа или группа, такая как гептил, октил, 1,1-диэтилбутил, нонил или децил.
C3-C6 циклоалкильной группой может быть, например, такая группа, как циклопропил, циклобутил, циклопентил или циклогексил.
C3-C6 циклоалкенильной группой может быть, например, такая группа, как 1-циклопентен-1-ил, 2-циклопентен-1-ил, 1-циклогексен-1-ил или 2-циклогексен-1-ил.
C1-C6 галоидалкильная группа представляет алкильную группу с прямой или разветвленной цепью, замещенную атомом галогена и может быть, например, такой группой, как фторметил, хлорметил, дифторметил, дихлорметил, трифторметил или пентафторэтил.
C2-C10 алкенильная группа представляет алкенильную группу с прямой или разветвленной цепью и может быть, например, винилом, 1-пропенилом, 2-пропенилом, изопропенилом, 1-бутенилом, 2-бутенилом, 1-гексенилом или 1-октенилом.
C2-C10 алкинильная группа представляет алкинильную группу с прямой или разветвленной цепью и может быть, например, такой группой, как этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 4-метил-1-пентинил или 3-метил-1-пентинил.
C1-C6 алкоксигруппа представляет алкилоксигруппу, в которой алкильная часть имеет указанное выше значение, и может быть, например, такой группой, как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси, н-пентилокси, изопентилокси и н-гексилокси.
C1-C6 галоидалкоксигруппа представляет галоидалкилоксигруппу, в которой галоидалкильная часть имеет указанное выше значение, и может быть, например, такой группой, как фторметокси, дифторметокси, трифторметокси или пентафторэтокси.
C1-C6 алкоксииминогруппа представляет алкоксииминогруппу, в которой алкокси часть имеет указанное выше значение, и может быть, например, такой группой, как метоксиимино.
C1-C6 алкоксиимино C1-C6 алкильная группа представляет алкоксииминоалкильную группу, в которой алкокси часть и алкильная часть имеют указанные выше значения, и может быть, например, такой группой, как 1-метоксииминоэтил.
C1-C6 алкилкарбонильная группа представляет алкилкарбонильную группу, в которой алкильная часть имеет указанное выше значение, и может быть, например, такой группой, как ацетил, пропионил, бутирил, изобутирил, пивалоил или гексаноил.
C1-C6 алкоксикарбонильная группа представляет алкоксикарбонильную группу, в которой алкокси часть имеет указанное выше значение, и может быть, например, такой группой, как метоксикарбонил, этоксикарбонил, изопропоксикарбонил или гексилоксикарбонил.
C1-C6 алкилкарбонил C1-C6 алкильная группа представляет алкилкарбонилалкильную группу, в которой алкильная часть имеет указанное выше значение, и может быть, например, такой группой, как 2-оксипропильная группа, 3-оксобутильная группа, 3-оксопентильная группа или 3,3-диметил-2-оксобутильная группа.
Арильная группа представляет ароматическую углеводородную группу и может быть, например, такой группой, как фенил, 1-нафтил или 2-нафтил.
Гетероциклическая C1-C6 алкильная группа представляет 3-10-членный цикл, в котором алкильная часть является -СН2-, -CH2CH2-, -СН2СН2СН2-, -(СН)Ме-, -С(Me)2-, -CH(Et)- или аналогичными, а гетероциклическая часть содержит от 2 до 9 атомов углерода, от 0 до 3 атомов азота, от 0 до 3 атомов кислорода и от 0 до 3 атомов серы, и может быть, например, такой группой, как пирролил, фурил, тиенил, пиразолил, изоксазолил, изотиазолил, имидазолил, оксазолил, тиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, триазинил, индолил, бензофурил, бензотиенил, бензимидазолил, бензоксазолил, бензотиазолил, хинолил, изохинолил, морфолино, оксиранил или диоксациклопентил.
Гетероарильная группа представляет 5-10-членное гетероциклическое ароматическое кольцо, состоящее из 2-9 атомов углерода, 0-3 атомов азота, 0-3 атомов кислорода и 0-3 атомов серы, и может быть, например, гетероциклом, таким как пирролил, фурил, тиенил, пиразолил, изоксазолил, изотиазолил, имидазолил, оксазолил, тиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, триазинил, индолил, бензофурил, бензотиенил, бензимидазолил, бензоксазолил, бензотиазолил, хинолил или изохинолил.
C1-C6 алкокси C1-C6 алкильная группа представляет группу, в которой алкильная часть и алкокси часть имеют указанные выше значения, и может быть, например, такой группой, как метоксиметил, этоксиметил, изопропоксиметил, пентилоксиметил, метоксиэтил или бутоксиэтил.
Moно-C1-C6 алкиламиногруппа представляет группу, в которой алкильная часть имеет указанное выше значение, и может быть группой, такой как метиламино, этиламино, изопропиламино, бутиламино или трет-бутиламино.
Ди-C1-C6 алкиламиногруппа представляет группу, в которой каждая из алкильных частей, которые являются одинаковыми или различными, имеет указанное выше значение, и может быть, например, такой группой, как диметиламино, диэтиламино, метилэтиламино, метилизопропиламино или дигексиламино.
C1-C6 алкилтиогруппа представляет группу, в которой алкильная часть имеет указанное выше значение, и может быть группой, такой как метилтио, этилтио, изопропилтио, бутилтио или гексилтио.
C1-C6 алкилсульфинильная группа представляет группу, в которой алкильная часть имеет указанное выше значение, и может быть группой, такой как метилсульфинил, этилсульфинил, изопропилсульфинил, бутилсульфинил или гексилсульфинил.
C1-C6 алкилсульфонильная группа представляет группу, в которой алкильная часть имеет указанное выше значение, и может быть группой, такой как метилсульфонил, этилсульфонил, изопропилсульфонил, бутилсульфонил или гексилсульфонил.
Арил-C1-C6 алкильная группа представляет группу, в которой арильная часть имеет указанное выше значение, а алкильная часть является -CH2-, -CH2CH2-, -СН2СН2СН2-, -(СН)Ме-, -С(Ме)2, -CH(Et)- или аналогичными.
Арил-C1-C6 алкенильная группа представляет группу, в которой арильная часть имеет указанное выше значение, а алкенильная часть является -СН=СН-, -СН=СНСН2-, -С(Ме)=СН-, -CH(Et)=(CH)-, -С(Ме)=СНСН2- или аналогичными.
Гетероарил-С1-С6 алкильная группа представляет группу, в которой гетероарильная часть имеет указанное выше значение, а алкильная часть является -СН2-, -СН2СН2-, -CH2CH2CH2-, -(CH)Me-, -С(Me)2-, -СН(Et)- или аналогичными.
Наилучший способ осуществления изобретения
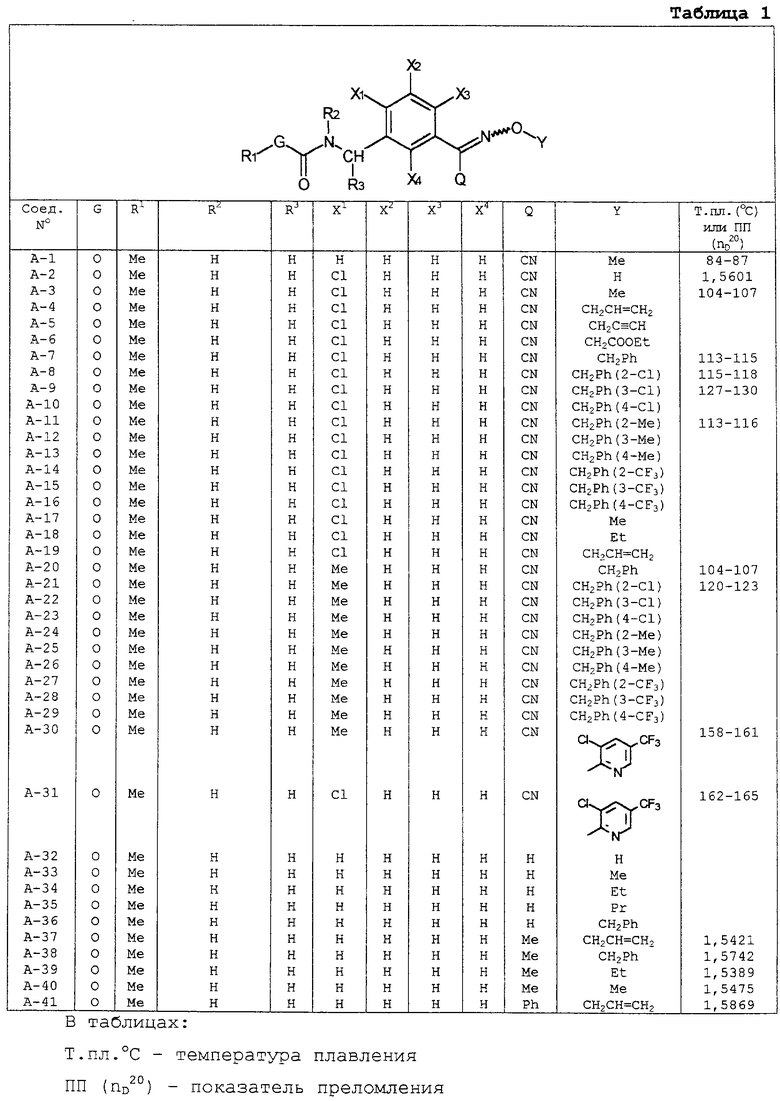
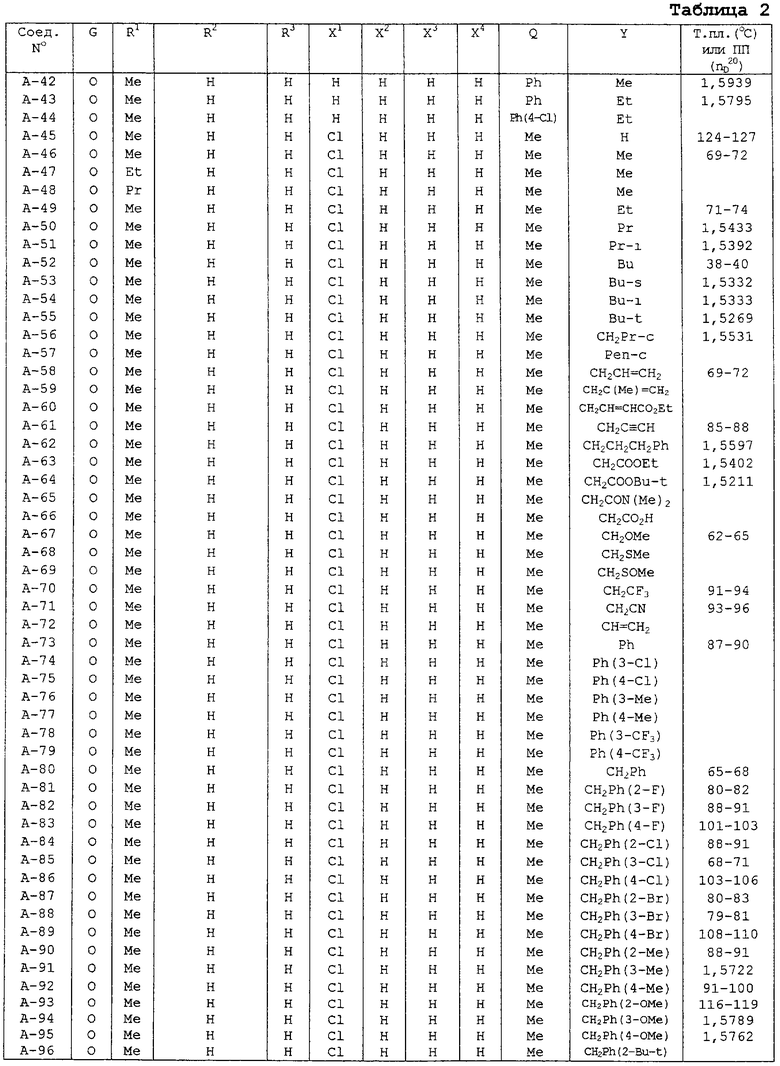
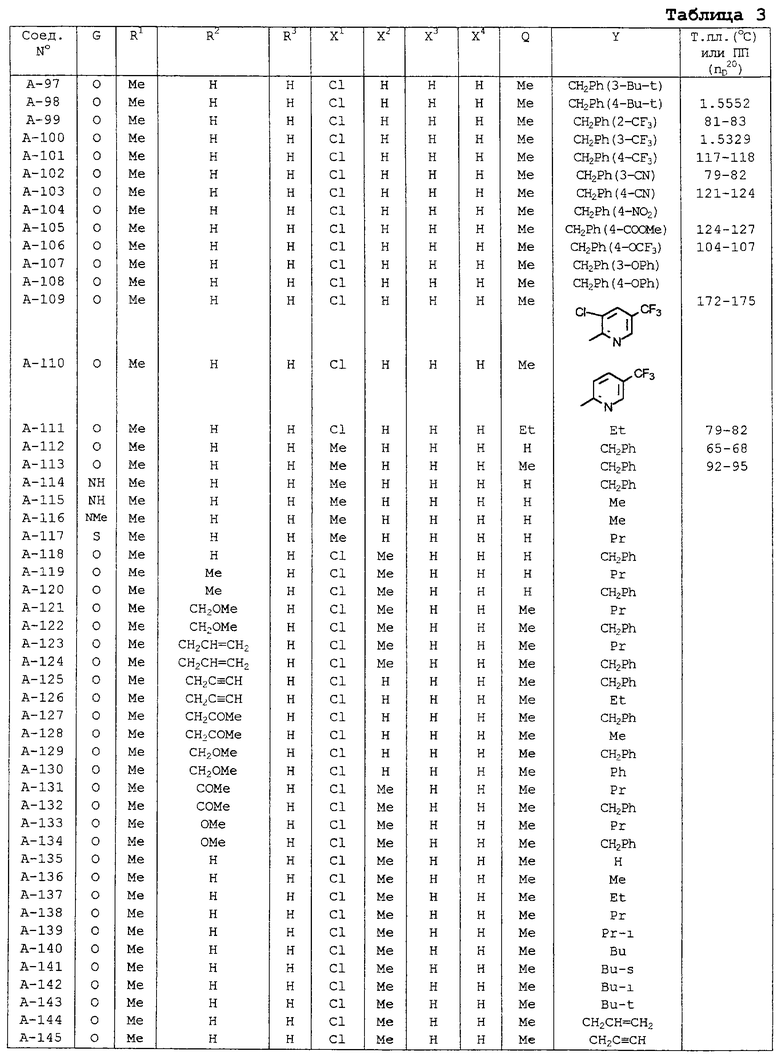
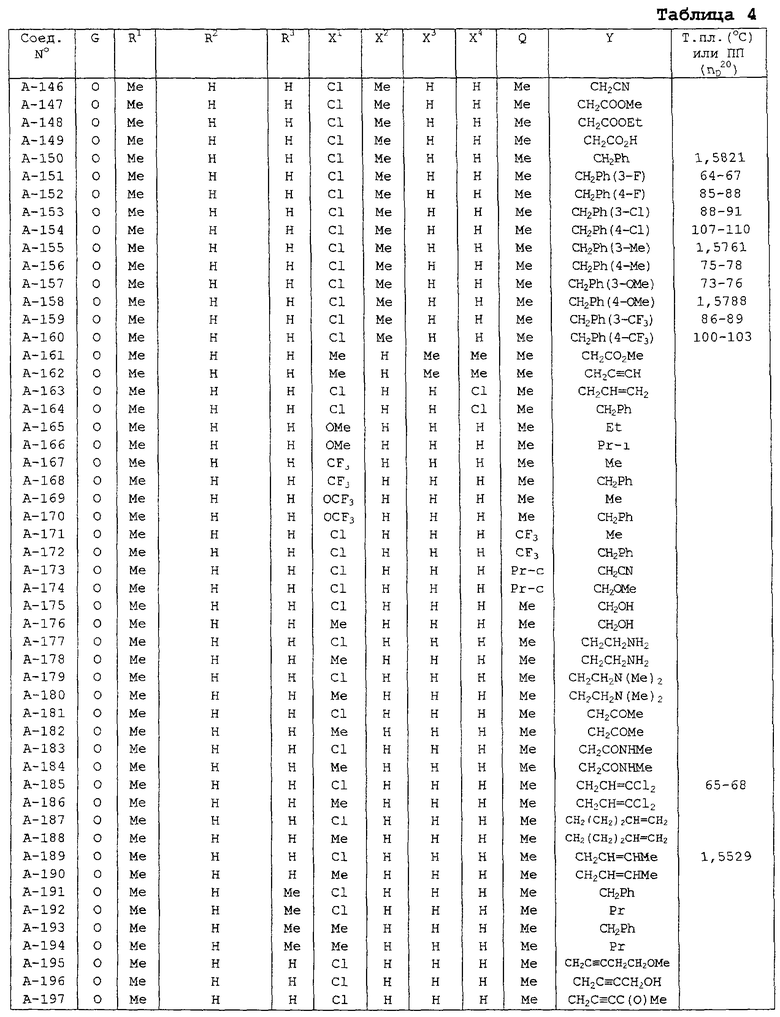
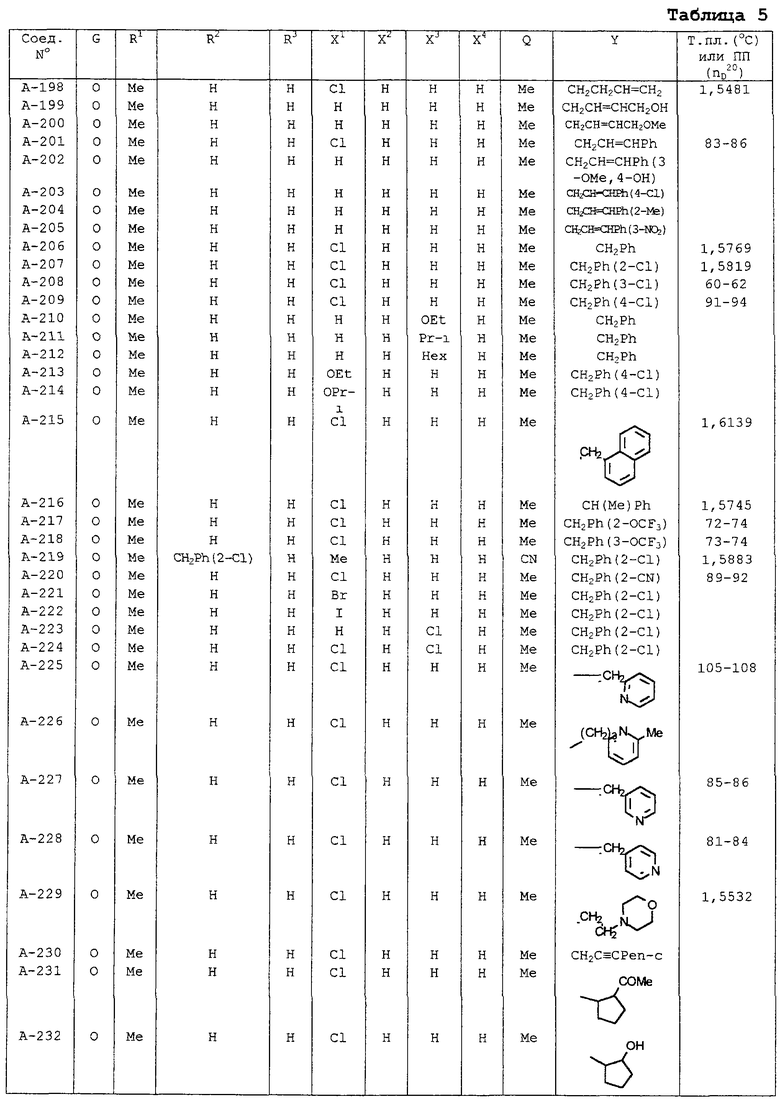
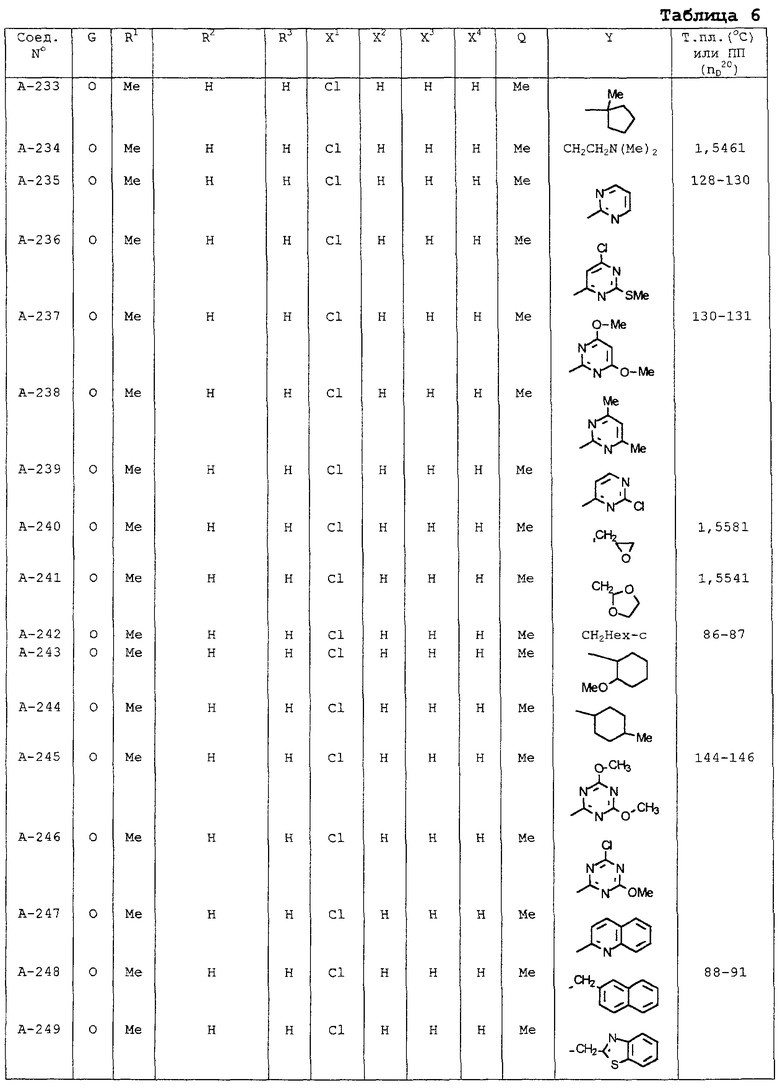
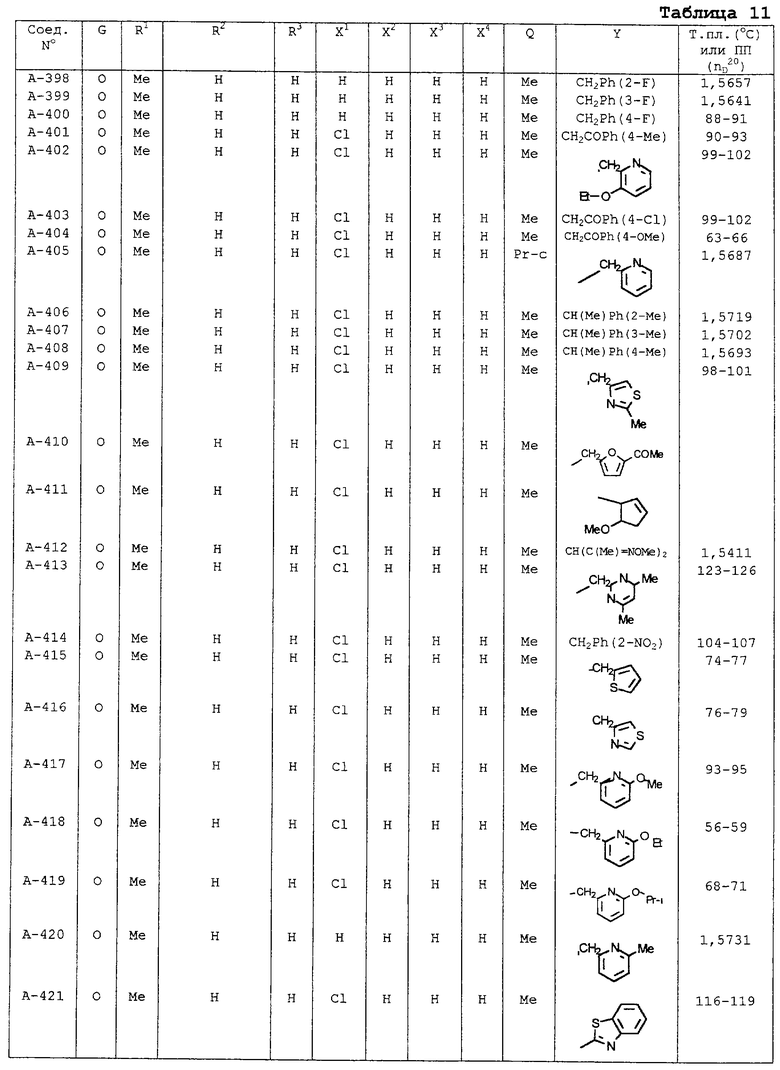
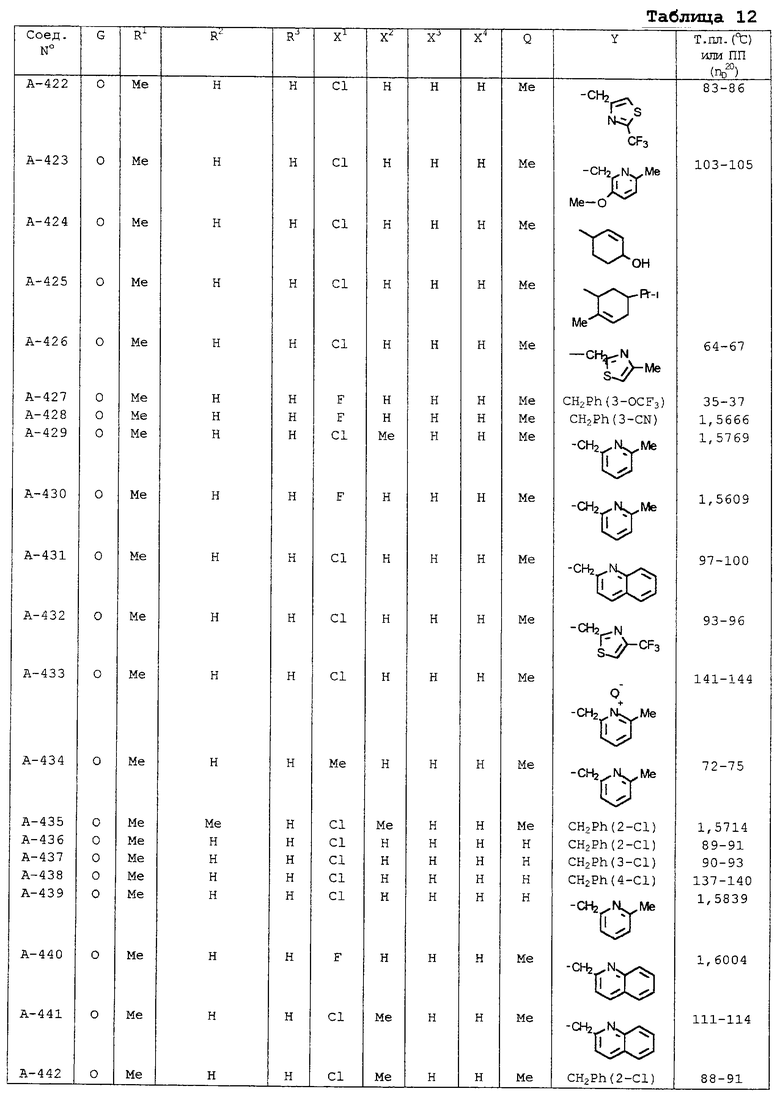
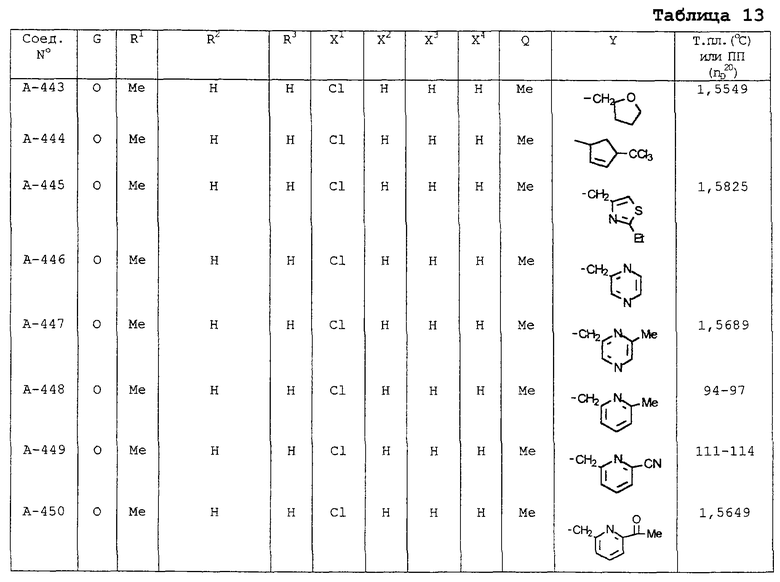
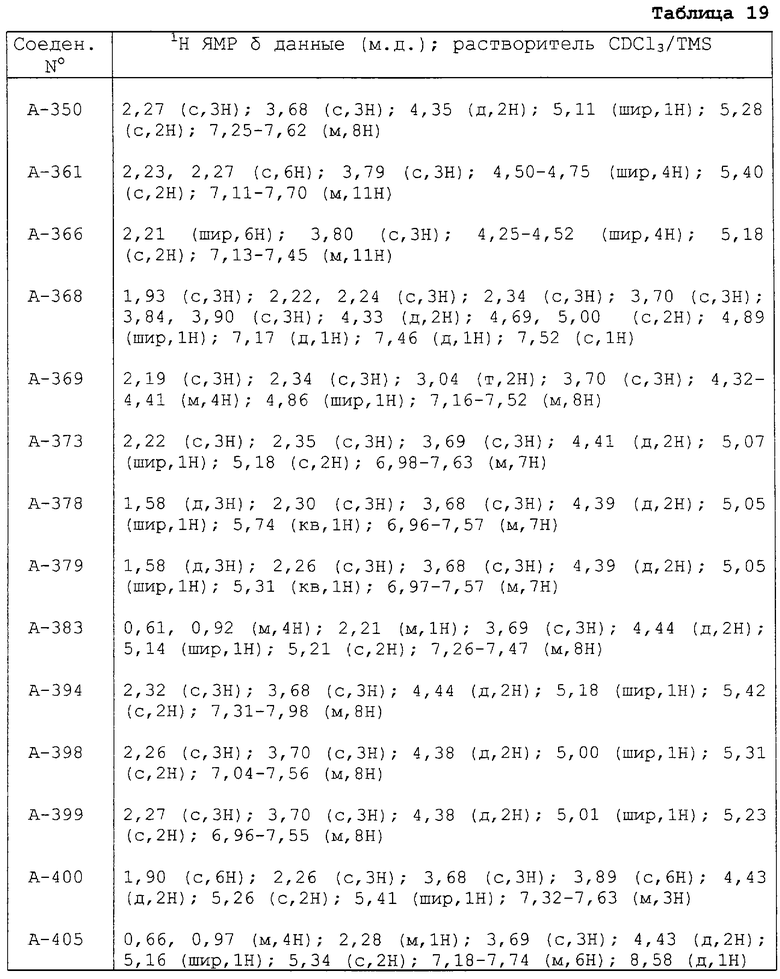
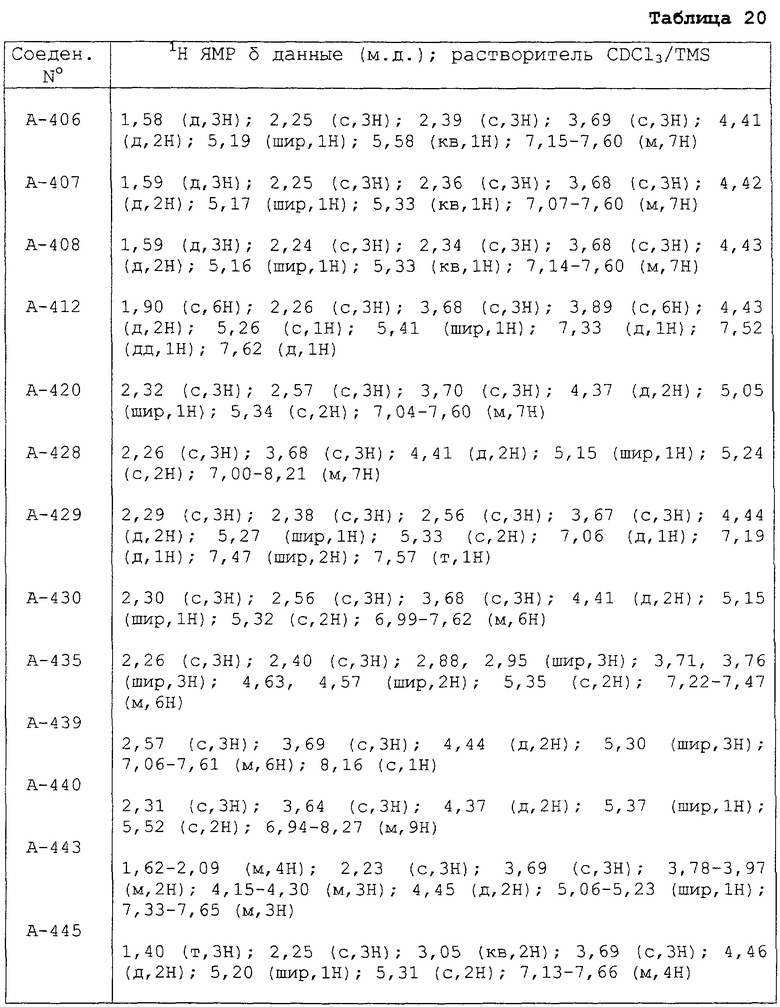
В таблицах 1-13 описаны конкретные примеры соединений данного изобретения, представленных общей формулой [I]. Однако соединения данного изобретения не ограничены указанными соединениями. Ссылки на указанные здесь номера соединений будут даваться в последующем описании.
Символы в таблице имеют следующие значения, соответственно. Me обозначает метильную группу, Et обозначает этильную группу, Рr обозначает н-пропильную группу, Pr-i обозначает изопропильную группу, Вu обозначает н-бутильную группу, Bu-i обозначает изобутильную группу, Bu-s обозначает втор-бутильную группу, Bu-t обозначает трет-бутильную группу, Hex обозначает н-гексильную группу, Рr-с обозначает циклопропильную группу, Реn-с обозначает циклопентильную группу, Нех-с обозначает циклогексильную группу и Ph обозначает фенильную группу. Далее, Рh(4-Сl) обозначает 4-хлорфенильную группу, например.
Некоторые из соединений данного изобретения, представленных общей формулой [I], имеют одну или 2-3 двойных связи, относящиеся E/Z изомерам их молекул и, следовательно, для таких соединений имеют место смеси E/Z изомеров. Чистые отдельные Е-формы и Z-формы и их смеси также охватываются соединениями данного изобретения. Следующие пары соединений являются геометрическими изомерами относительно двойной связи оксимной части (А-80 и А-206, А-84 и А-207, А-85 и А-208, А-86 и А-209, А-286 и А-448).
Типичные способы получения производных карбамата, представленных общей формулой [I], таких как соединения данного изобретения, будут описаны ниже. В данном случае новые соединения, представленные общей формулой [I], имеют C=N двойную связь и, следовательно, в некоторых случаях могут образовывать смесь E/Z изомеров. Смесь изомеров может быть разделена на отдельные компоненты методом очистки, таким как кристаллизация или хроматография на колонке. Отдельные изомеры и их смеси включены в данное изобретение.
Способ получения 1
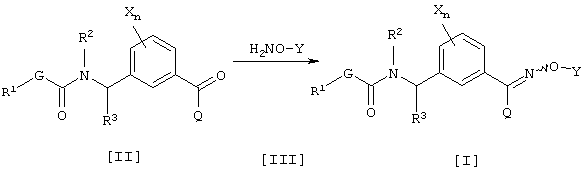
где каждый из G, R1, R2, R3, Q, X, Y и n имеют значения, определенные выше.
Соединение [I] данного изобретения может быть получено взаимодействием соединения [II] и соединения [III] в инертном растворителе (см., например, Jikken kagaku Kouza (Experimental Chemical Lecture), четвертое издание, том 20, стр. 349-355 (The Chemical Society of Japan)). Соединение [III], используемое в данном способе получения, может образовывать соль, например, с хлористоводородной кислотой или серной кислотой. Соединение [III] может быть получено согласно известному способу (см., например, Jikken kagaku Kouza, четвертое издание, том 20, стр. 342-349).
Что касается количества соединения, используемого в данной реакции, соединение [III] соответственно выбирают в интервале от 1 до 50 эквивалентов в расчете на соединение [II], предпочтительно от 1 до 10 эквивалентов. Инертным растворителем, который может использоваться в данном способе получения, является, например, спирт, такой как метанол, этанол, пропанол или изопропанол, простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, ароматический углеводород, такой как бензол, хлорбензол, нитробензол или толуол, или вода. Указанные инертные растворители могут использоваться по одному или в смеси.
В данном способе получения могут сосуществовать кислота, такая как хлористоводородная кислота или уксусная кислота, или основание, такое как ацетат натрия, карбонат натрия или гидрокарбонат натрия, и они могут использоваться по одному или в сочетании. Количество соответственно выбирают в интервале 0,001 до 50 эквивалентов в расчете на соединение [II], предпочтительно, от 0,01 до 10 эквивалентов. Температура реакции составляет интервал от -10°С до температуры кипения используемого инертного растворителя, и предпочтительно составляет от 0°С до температуры кипения используемого инертного растворителя. Время реакции варьирует в зависимости, например, от температуры реакции и количества реагентов, и в общем может составлять от 1 до 48 часов. После завершения реакции желаемый продукт выделяют из реакционной среды обычными методами и он может быть подвергнут очистке, например, хроматографией на колонке или перекристаллизацией, в зависимости от конкретного случая.
Способ получения 2
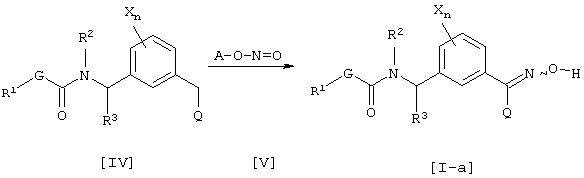
где каждый из G, R1, R2, R3, Х и n имеют значения, определенные выше, Q’ является цианогруппой или нитрогруппой и А является C1-С10 алкильной группой.
Соединение [I-а] данного изобретения может быть получено взаимодействием соединения [IV] и сложного эфира нитрита [V] в присутствии основания (см., например. Organic Syntheses, том 6, стр. 199 (1988)). Что касается количества соединения, используемого в данной реакции, соединение [V] соответственно выбирают в интервале от 1 до 50 эквивалентов в расчете на соединение [IV], предпочтительно, от 1 до 10 эквивалентов.
Основанием, используемым в данном способе получения, например, может быть алкоголят щелочного металла, такой как метилат натрия, этилат натрия или трет-бутилат калия, или неорганическое основание, такое как гидроксид натрия, гидроксид калия, карбонат натрия или карбонат калия, и количество основания соответственно выбирают в интервале 0,5 до 50 эквивалентов в расчете на соединение [IV], предпочтительно от 1 до 10 эквивалентов.
В данном способе получения может использоваться инертный растворитель, который не ингибирует ход данного процесса получения, например, простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, 1,2-диметоксиэтан или диметиловый эфир диэтиленгликоля, галогенированный углеводород, такой как дихлорметан, хлороформ, четыреххлористый углерод или тетрахлорэтан, ароматический углеводород, такой как бензол, хлорбензол или толуол, или спирт, такой как метанол, этанол, пропанол или изопропанол. Данные инертные растворители могут использоваться по одному или в смеси.
Температура реакции составляет интервал от -70°С до температуры кипения используемого инертного растворителя, и предпочтительно от -20°С до температуры кипения используемого инертного растворителя. Время реакции варьирует в зависимости, например, от температуры реакции и количества реагентов, в общем, оно может составлять от 1 до 100 часов, предпочтительно от 12 до 75 часов.
После завершения реакции желаемый продукт выделяют из реакционной среды обычными методами и он может быть подвергнут очистке, например, хроматографией на колонке или перекристаллизацией, в зависимости от конкретного случая.
Способ получения 3
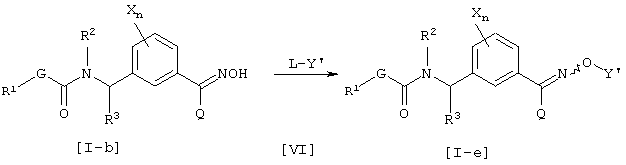
где каждый из G, R1, R2, R3, X, Q и n имеют значения, определенные выше, Y’ имеет указанное выше значение для Y за исключением водорода и L является уходящей группой и представляет атом галогена или сульфонат, такой как тозилокси или мезилокси.
Соединение [I-е] данного изобретения может быть получено взаимодействием соединения [I-b] и соединения [VI] в присутствии основания.
Что касается количества соединения, используемого в данной реакции, соединение [VI] соответственно выбирают в интервале от 1 до 50 эквивалентов в расчете на соединение [I-b], предпочтительно, от 1 до 5 эквивалентов.
В некоторых случаях в данном способе получения может использоваться инертный растворитель. Им может быть инертный растворитель, который не ингибирует ход данной реакции, и кетон, такой как ацетон, метилэтилкетон или циклогексанон, простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, сложный эфир, такой как этилацетат или метилацетат, галогенированный углеводород, такой как дихлорметан, хлороформ или четыреххлористый углерод, ароматический углеводород, такой как бензол, хлорбензол, нитробензол или толуол, нитрил, такой как ацетонитрил, или N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолинон или диметилсульфоксид. Данные инертные растворители могут использоваться по одному или в смеси.
Основанием, используемым в данном способе получения, например, может быть гидрид щелочного металла, такой как гидрид натрия, алкоголят щелочного металла, такой как трет-бутилат калия, или неорганическая соль, такая как карбонат натрия или карбонат калия. Количество основания соответственно выбирают в интервале 1 до 50 эквивалентов в расчете на соединение [I-b], предпочтительно от 1 до 10 эквивалентов.
Температура реакции составляет интервал от -70°С до температуры кипения используемого инертного растворителя, предпочтительно от 0°С до температуры кипения используемого инертного растворителя. Время реакции варьирует в зависимости, например, от температуры реакции и количества реагентов, и в общем может составлять от 1 до 72 часов. После завершения реакции желаемый продукт выделяют из реакционной среды обычными методами и он может быть подвергнут очистке, например, хроматографией на колонке или перекристаллизацией, в зависимости от конкретного случая.
Способ получения 4
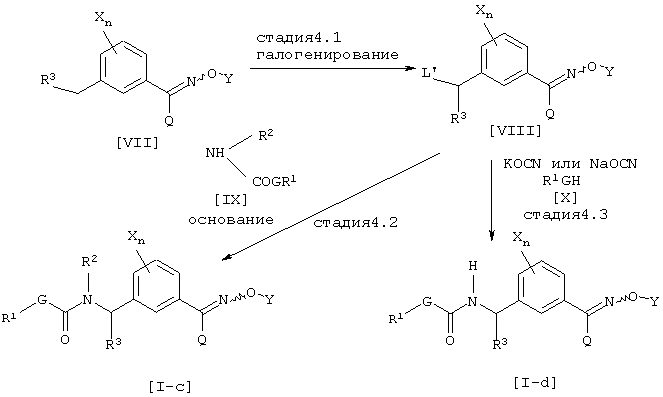
где каждый из G, Q, R1, R2, R3, X, Y и n имеют значения, определенные выше и L’ является атомом галогена.
Соединение [VIII] может быть получено галогенированием соединения [VII] известным методом (см., например, Jikken kagaku Kouza, четвертое издание, том 19, стр. 416-482 (The Chemical Society of Japan)) (Стадия 4.1). Соединение [I-c] данного изобретения может быть получено взаимодействием соединения [VIII] с соединением [IX] в присутствии основания в инертном растворителе (Стадия 4.2). Далее, соединение [I-d] данного изобретения может быть получено взаимодействием соединения [VIII] с цианатной солью щелочного металла и соединением [X] в инертном растворителе (см., например, Journal of the Chemical Society of Japan, том 87, № 5, стр. 486 (1966)) (Стадия 4.3).
Галогенирующим агентом, который может использоваться на стадии 4.1 данного способа получения, может быть, например, N-бромсукцинимид, N-хлорсукцинимид или трихлоризоциануровая кислота. Количество галогенирующего агента соответственно выбирают в интервале от 0,5 до 10 эквивалентов в расчете на соединение [VII], предпочтительно от 1 до 3 эквивалентов. На данной стадии может использоваться катализатор, такой как азобисизобутиронитрил или бензоилпероксид, в количестве соответственно в интервале от 0,001 до 10 эквивалентов в расчете на соединение [VII], предпочтительно от 0,001 до 1 эквивалента.
Инертным растворителем может быть растворитель, который не ингибирует ход стадии 4.1, и может использоваться, например, галогенированный углеводород, такой как дихлорметан, хлороформ или четыреххлористый углерод, или ароматический углеводород, такой как бензол или хлорбензол.
Температура реакции составляет интервал от 0°С до температуры кипения используемого инертного растворителя. Время реакции варьирует в зависимости, например, от температуры реакции и количества реагентов, и в общем может составлять от нескольких минут до 48 часов. После завершения реакции желаемый продукт выделяют из реакционной среды обычными методами, и он может быть подвергнут очистке, например, хроматографией на колонке или перекристаллизацией, в зависимости от конкретного случая.
Что касается количества соединения [IX], используемого на стадии 4.2 данного способа получения, его соответственно выбирают в интервале от 1 до 50 эквивалентов в расчете на соединение [VIII], предпочтительно от 1 до 10 эквивалентов.
Используемым основанием может быть неорганическая соль, такая как карбонат натрия, карбонат калия или гидрокарбонат натрия, или гидрид щелочного металла, такой как гидрид натрия, и количество, соответственно выбирают в интервале от 0,5 до 100 эквивалентов в расчете на соединение [VIII], предпочтительно от 1 до 10 эквивалентов.
Используемым инертным растворителем может быть растворитель, который не ингибирует ход реакции на стадии 4.2, например, кетон, такой как ацетон, метилэтилкетон или циклогексанон, простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, моноглим или диглим, сложный эфир, такой как этилацетат или метилацетат, галогенированный углеводород, такой как дихлорметан, хлороформ или четыреххлористый углерод, ароматический углеводород, такой как бензол, хлорбензол, нитробензол или толуол, нитрил, такой как ацетонитрил, спирт, такой как метанол, этанол или бутанол, или N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолинон или диметилсульфоксид, данные инертные растворители могут использоваться по одному или в смеси.
Температура реакции составляет интервал от -70°С до температуры кипения используемого инертного растворителя, предпочтительно от -10°С до температуры кипения используемого инертного растворителя. Время реакции варьируют в зависимости, например, от температуры реакции и количества реагентов, и в общем может составлять от нескольких минут до 48 часов. После завершения реакции желаемый продукт выделяют из реакционной системы обычными методами, и он может подвергаться очистке, например, хроматографией на колонке или перекристаллизацией, в зависимости от конкретного случая.
Цианатной солью щелочного металла, которая может использоваться на стадии 4.3 данного способа получения, может быть, например, цианат калия или цианат натрия. Количество используемого цианата металла соответственно выбирают в интервале от 1 до 50 эквивалентов в расчете на соединение [VIII], предпочтительно от 1 до 10 эквивалентов, а количество соединения [X] соответственно выбирают в интервале 1 до 100 эквивалентов в расчете на соединение [VIII], предпочтительно, от 1 до 20 эквивалентов. Инертным растворителем, который может использоваться, может быть растворитель, который не ингибирует ход реакции стадии 4.3, например, кетон, такой как ацетон, метилэтилкетон или циклогексанон, простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, моноглим или диглим, сложный эфир, такой как этилацетат или метилацетат, галогенированный углеводород, такой как дихлорметан, хлороформ или четыреххлористый углерод, ароматический углеводород, такой как бензол, хлорбензол, нитробензол или толуол, нитрил, такой как ацетонитрил, спирт, такой как метанол, этанол или бутанол, или N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолинон или диметилсульфоксид, данные инертные растворители могут использоваться по одному или в смеси.
Температура реакции составляет интервал от 0°С до температуры кипения используемого инертного растворителя. Время реакции варьирует в зависимости, например, от температуры реакции и количества реагентов, и в общем может составлять от 1 часа до 48 часов. После завершения реакции желаемый продукт выделяют из реакционной среды обычными методами, и он может быть подвергнут очистке, например, хроматографией на колонке или перекристаллизацией, в зависимости от конкретного случая.
Способ получения 5
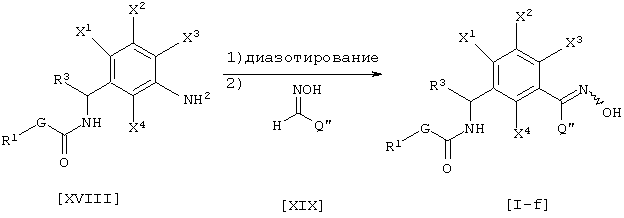
где каждый из G, R1 и R3 такой, как определен выше, каждый из Х1, X2, X3 и X4 является атомом водорода, атомом галогена, C1-C6 алкильной группой, C1-C6 алкоксигруппой, C1-C6 галоидалкильной группой или C1-C6 галоидалкоксигруппой, Q’’ является атомом водорода, галоидалкильной группой, C1-C6 алкильной группой, C3-C6 циклоалкильной группой или фенильной группой (указанная группа может быть замещена, по крайней мере, одним атомом галогена, цианогруппой, нитрогруппой, C1-C4 алкильной группой, C2-C4 алкенильной группой, С2-С4 алкинильной группой, гидроксильной группой, C1-C4 алкоксигруппой, C1-C4 галоидалкильной группой, C1-C4 галоидалкоксигруппой, C1-C4 алкилкарбонильной группой или C1-C4 алкоксикарбонильной группой).
Соединение [I-f] данного изобретения может быть получено диазотированием соединения [XVIII] нитритом натрия в присутствии, например, хлористоводородной кислоты, согласно известному способу, и взаимодействием соединения [XIX] с ним в присутствии, например, ацетата натрия и сульфата меди (см., например Organic Synthesis, том 5, стр. 139 (1973)).
Что касается количества соединения, используемого в данной реакции, соединение [XIX] соответственно выбирают в интервале от 1 до 50 эквивалентов в расчете на соединение [XVIII], предпочтительно, от 1 до 5 эквивалентов.
Растворителем, который может использоваться в данном способе получения, может быть растворитель, который не ингибирует ход данной реакции. Например, может использоваться простой эфир, такой как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан или диметиловый эфир диэтиленгликоля, сложный эфир, такой как этилацетат или метилацетат, галогенированный углеводород, такой как дихлорметан, хлороформ или четыреххлористый углерод, ароматический углеводород, такой как бензол, хлорбензол, нитробензол или толуол, органическая кислота, такая как уксусная кислота или трифторуксусная кислота, или вода, и данные инертные растворители могут использоваться по одному или в смеси.
В качестве кислоты на стадии 1) диазотирования, данного способа получения, вместо указанной выше хлористоводородной кислоты может использоваться сильная кислота, такая как серная кислота, тетрафторборная кислота, бромистоводородная кислота или трифторуксусная кислота. Ее количество соответственно выбирают в интервале 1 до 50 эквивалентов в расчете на соединение [XVIII], предпочтительно, от 2 до 4 эквивалентов. Далее вместо указанного выше нитрита натрия может использоваться нитритный эфир, такой как изоамилнитрит или метилнитрит. Его количество, соответственно выбирают в интервале 1 до 50 эквивалентов в расчете на соединение [XVIII], предпочтительно от 1 до 2 эквивалентов. Температура реакции составляет интервал от -20°С до 30°С, предпочтительно от -5°С до 5°С. Время реакции варьирует в зависимости, например, от температуры реакции и количества реагентов, и в общем может составлять от 30 минут до 2 часов. В качестве соединения меди на стадии 2) сочетание, в данной реакции, вместо указанного выше сульфата меди может использоваться соль меди, такая как хлорид меди (I) или ацетат меди (II). Ее количество соответственно выбирают в интервале 0,02 до 2 эквивалентов в расчете на соединение [XVIII], предпочтительно от 0,02 до 0,5 эквивалентов. Количество ацетата натрия соответственно выбирают в интервале 1 до 50 эквивалентов в расчете на соединение [XVIII], предпочтительно, от 4 до 10 эквивалентов. Температура реакции составляет интервал от -20°С до 30°С, предпочтительно от -5°С до 25°С. Время реакции варьирует в зависимости, например, от температуры реакции и количества реагентов, и в общем может составлять от 30 минут до 2 часов. После завершения реакции желаемый продукт выделяют из реакционной среды обычными методами, и он может быть подвергнут очистке, например, хроматографией на колонке или перекристаллизацией, в зависимости от конкретного случая.
Соединение [II], являющееся промежуточным соединением для соединения [I] данного изобретения, может быть получено, например, согласно следующему известному способу, но не ограничиваясь им.
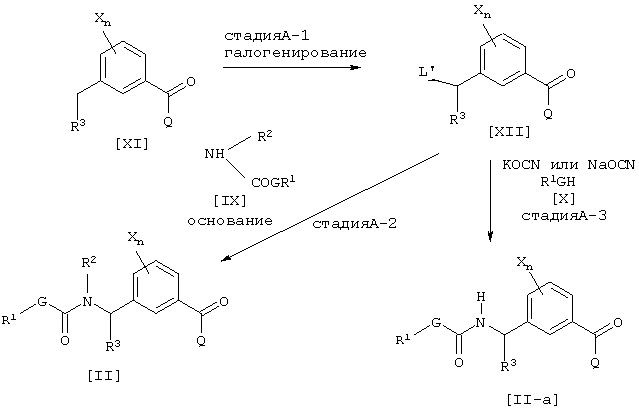
где каждый из L’, G, Q, R1, R2, R3, Х и n имеют значения, определенные выше.
Соединение [XII] может быть получено галогенированием соединения [XI] (см., например, Jikken kagaku Kouza, четвертое издание, том 19, стр. 416-482 (The Chemical Society of Japan)) (Стадия А-1). Далее промежуточное соединение [II] может быть получено взаимодействием соединения [XII] с соединением [IX] в присутствии основания (например, неорганической соли, такой как карбонат натрия, карбонат калия или гидрокарбонат натрия, или гидрида щелочного металла, такого как гидрид натрия) (Стадия А-2). Далее промежуточное соединение [II-а] может быть получено взаимодействием соединения [XII] с цианатной солью щелочного металла и соединением [X] в присутствии инертного растворителя (см., например. Journal of the Chemical Society of Japan, том 87, № 5, стр. 486 (1966)) (стадия А-3).
Соединения [II] и [IV-a], являющиеся промежуточными соединениями для соединения [I] данного изобретения, могут быть получены, например, согласно следующему известному способу, но не ограничиваясь им.
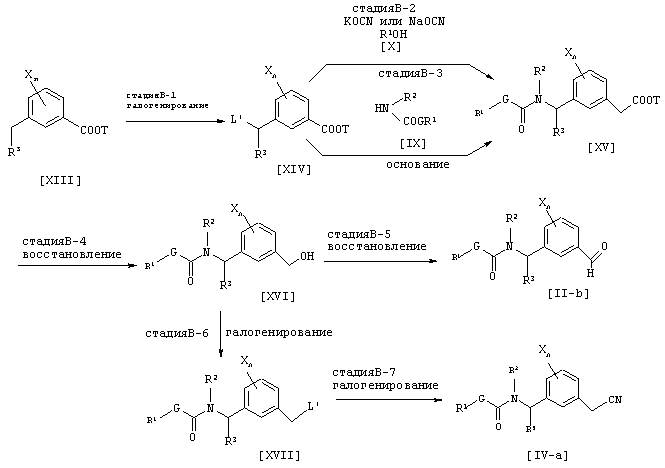
где каждый из G, Q, R1, R2, R3, X, L’ и n имеют значения, определенные выше, и Т является C1-C6 алкильной группой.
Соединение [XVI] может быть получено галогенированием соединения [XIII] (см., например, Jikken kagaku Kouza, четвертое издание, том 19, стр. 416-482 (The Chemical Society of Japan)) (Стадия В-1). Соединение [XV] может быть получено взаимодействием соединения [XIV] с соединением [X] и цианатной солью щелочного металла (см., например. Journal of the Chemical Society of Japan, том 87, №5 , стр. 486 (1966)) (стадия В-2). Альтернативно, соединение [XV] может быть получено взаимодействием соединения [XIV] с соединением [IX] в присутствии неорганической соли, такой как карбонат натрия, карбонат калия или гидрокарбонат натрия, или основания, такого как гидрид щелочного металла, такой как гидрид натрия (Стадия В-3). Соединение [XVI] может быть получено восстановлением соединения [XV] согласно известному способу (см., например, Jikken kagaku Kouza, четвертое издание, том 26, стр. 159-266 (The Chemical Society of Japan)) (B-4). Соединением [II-b] может быть получено окислением соединения [XVI] согласно известному способу (см., например, Jikken kagaku Kouza, четвертое издание, том 21, стр. 2-23 (The Chemical Society of Japan)) (Стадия B-5). Соединение [XVII] может быть получено галогенированием соединения [XVI] согласно известному способу (см., например, Jikken kagaku Kouza, четвертое издание, том 19, стр. 416-482 (The Chemical Society of Japan)) (Стадия B-6).
Соединение [IV-a] может быть получено цианированием соединения [XVII] согласно известному способу (см., например, Jikken kagaku Kouza, четвертое издание, том 20, стр. 437-462 (The Chemical Society of Japan)) (Стадия B-7).
Соединение [VII], промежуточное соединение для соединения [I] данного изобретения, может быть получено, например, согласно следующему известному способу, но не ограничиваясь им.
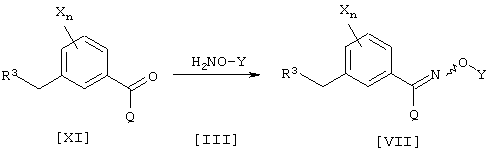
где каждый из R3, Q, X, Y и n имеют значения, определенные выше.
Соединение [VII] данного изобретения может быть получено взаимодействием соединения [XI] и соединения [III] (см., например, Jikken kagaku Kouza, четвертое издание, том 20, стр. 349-355 (The Chemical Society of Japan)). В данном случае, соединение [III], используемое в данном способе получения, может образовывать соль, например, с хлористоводородной кислотой или серной кислотой.
Соединение [XVIII], промежуточное соединение для соединения [I] данного изобретения, может быть получено, например, согласно следующему известному способу, но не ограничиваясь им.
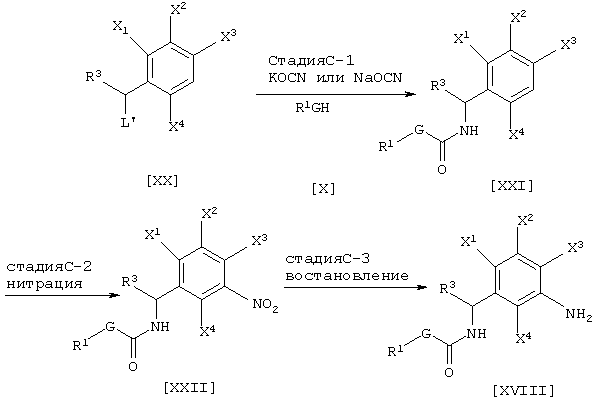
где каждый из G, R1, R2, R3, L’, Х1, X2, X3 и X4 имеют значения, определенные выше.
Промежуточное соединение [XXI] может быть получено взаимодействием соединения [XX] цианатной солью щелочного металла и соединением [X] в инертном растворителе (см., например, Journal of the Chemical Society of Japan, том 87, № 5, стр. 486 (1966)) (стадия С-1). Промежуточное соединение [XXIII] может быть получено нитрованием соединения [XXII], например, азотной кислотой, ацетилнитратом или нитратом натрия (см., например, Jikken kagaku Kouza, четвертое издание, том 20, стр. 394-399 (The Chemical Society of Japan)) (Стадия C-2). Промежуточное соединение [XVIII] может быть получено восстановлением соединения [XXI] согласно известному методу (см., например, Jikken kagaku Kouza, четвертое издание, том 26, стр. 159-266 (The Chemical Society of Japan)) (Стадия C-3).
Примеры
Далее способы получения соединений данного изобретения, способы получения препаративных форм и применение описаны в примерах.
Символы, используемые в примерах, имеют следующие значения.
1H ЯМР: протонный ядерно-магнитный резонанс
СОСl3: Дейтерированный хлороформ
ТМС: тетраметилсилан
с: синглет, д: дублет, т: триплет, кв: квартет, квинт: квинтет, м: мультиплет, шир: широкий, дд: двойной дублет
Пример получения 1
Получение 2-[4-хлор-3-(метоксикарбониламинометил)фенил]-2-гидроксииминоацетонитрила (соединение № А-2)
0,15 г Гидроксида натрия и 0,60 г метил N-(2-хлор-5-цианометилбензил)карбамата добавляют к 5 мл этанола и к смеси добавляют 0,40 г трет-бутилнитрита при комнатной температуре с последующим перемешиванием в течение 72 часов. После завершения реакции раствор выливают в воду, экстрагируют этилацетатом с последующим промыванием водой и органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Wakogel С-200, элюент: гексан/этилацетат = 3/1) с получением 0,46 г 2-[4-хлор-3-(метоксикарбониламинометил)фенил]-2-гидроксииминоацетонитрила в виде бесцветной вязкой жидкости.
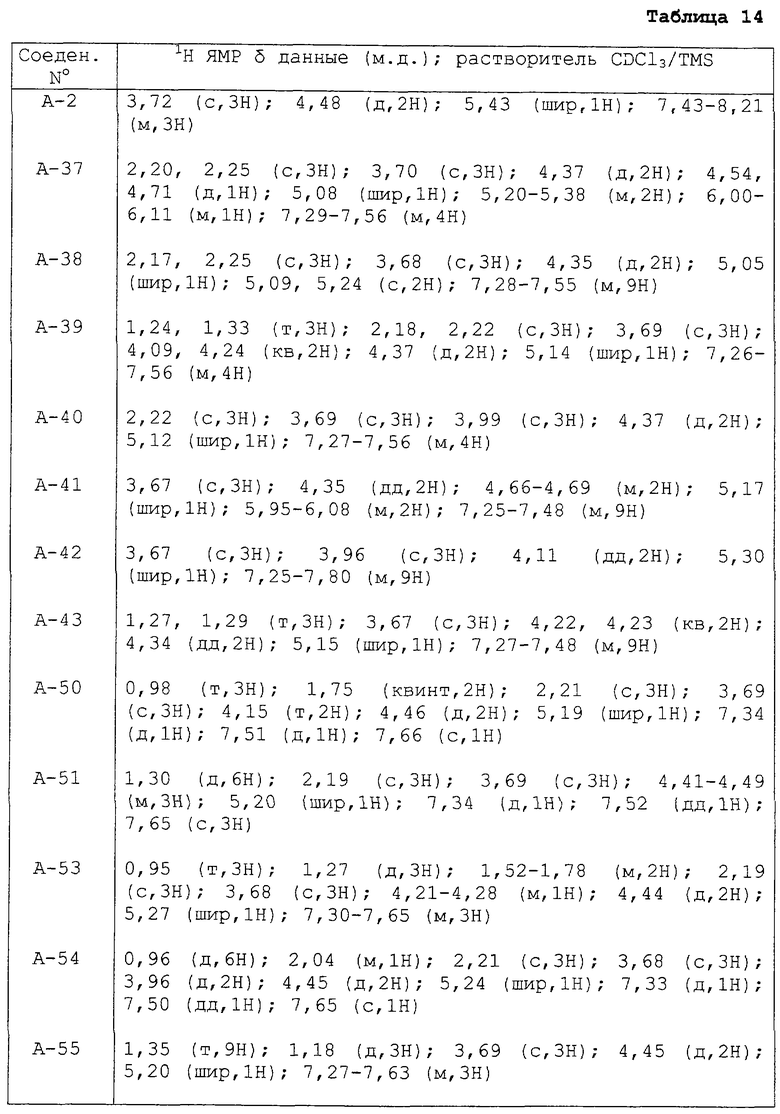
1H ЯМР: (CDCl3/TMS, δ (м.д.))
3,72 (с, 3Н); 4,48 (д, 2Н); 5,43 (шир, 1Н); 7,43-8,21 (м, 3Н); 10,51, 11,15 (шир, 1Н).
Пример получения 2
Получение 2-[4-хлор-3-(метоксикарбониламинометил)фенил]-2-метоксииминоацетонитрила (соединение № А-3)
0,36 г 2-[4-хлор-3-(метоксикарбониламинометил)фенил]-2-гидроксииминоацетонитрила и 0,54 г 28% раствора метилата натрия в метаноле добавляют к 5 мл метанола и к смеси добавляют 0,49 г метилйодида с последующим перемешиванием при комнатной температуре в течение 24 часов. Реакционный раствор концентрируют в вакууме, растворитель отгоняют, к остатку добавляют воду, экстрагируют этилацетатом и органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Wakogel С-200, элюент: гексан/этилацетат = 4/1-5/1) с получением 0,18 г 2-[4-хлор-3-(метоксикарбониламинометил)фенил]-2-метоксииминоацетонитрила в виде бесцветных кристаллов (температура плавления 104-107°С).
1H ЯМР: (CDCl3/TMS, δ (м.д.))
3,71 (с, 3Н); 4,22 (с, 3Н); 4,48 (д, 2Н); 5,23 (шир, 1Н); 7,43-8,05 (м, 3Н).
Пример получения 3
Получение метил N-[2-хлор-5-(1-гидроксииминоэтил)бензил]карбамата (соединение № А-45)
5,0 г Метил N-(2-хлор-5-ацетилбензил)карбамата растворяют в 10 мл этанола и к смеси добавляют 1,5 г гидрохлорида гидроксиламина, 3,0 г ацетата натрия и 5 мл воды с последующим кипячением с обратным холодильником в течение 4 часов. После завершения реакции к реакционной смеси добавляют воду, экстрагируют этилацетатом, органический слой сушат над безводным сульфатом магния и растворитель отгоняют при пониженном давлении. Полученные кристаллы промывают гексаном с получением 5,2 г метил N-[2-хлор-5-(1-гидроксииминоэтил)бензил]карбамата в виде бесцветных кристаллов (температура плавления 124-127°С).
1H ЯМР: (CDCl3/TMS, δ (м.д.))
2,25 (с, 3Н); 3,70 (с, 3Н); 4,46 (д, 2Н); 5,31 (шир, 1Н); 7,27-7,63 (м, 3Н).
Пример получения 4
Получение метил N-[3-(1-метоксииминоэтил)бензил]карбамата (соединение № А-40)
0,40 г Метил N-(3-ацетилбензил)карбамата растворяют в 10 мл этанола и к смеси добавляют 0,36 г гидрохлорида метоксиамина и 5 мл водного раствора 0,54 г ацетата натрия с последующим кипячением с обратным холодильником в течение 8 часов. После завершения реакции к реакционной смеси добавляют воду, экстрагируют этилацетатом, органический слой сушат над безводным сульфатом магния и растворитель отгоняют при пониженном давлении. Полученные кристаллы промывают гексаном с получением 0,40 г метил N-[3-(1-метоксииминоэтил)бензил]карбамата в виде бледно-желтого маслянистого вещества.
1H ЯМР: (CDCl3/TMS, δ (м.д.))
2,22 (с, 3Н); 3,69 (с, 3Н); 3,99 (с, 3Н); 4,37 (д, 2Н); 5,12 (шир, 1Н); 7,27-7,56 (м, 4Н).
Пример получения 5
Получение метил N-{2-хлор-5-[1-(4-фторбензилоксиимино)этил]бензил}карбамата (соединение № А-83)
0,70 г Метил N-[2-хлор-5-(1-гидроксииминоэтил)бензил]карбамата растворяют в 10 мл N,N-диметилформамида и к смеси добавляют 0,13 г 60% гидрида натрия при охлаждении на льду с последующим перемешиванием в течение 1 часа. 0,57 г 4-Фторбензилбромида растворяют в 2 мл N,N-диметилформамида и по каплям добавляют к реакционной смеси при охлаждении на льду. После завершения добавления по каплям, смесь перемешивают при комнатной температуре в течение 16 часов. После завершения реакции реакционный раствор выливают в воду, экстрагируют этилацетатом с последующим промыванием водой и органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Wakogel С-200, элюент: гексан/этилацетат = 5/1) с получением 0,75 г метил N-{2-хлор-5-[1-(4-фторбензилоксиимино)этил]бензил}карбамата (температура плавления 101-103°С) в виде бесцветных кристаллов.
1H ЯМР: (CDCl3/TMS, δ (м.д.))
2,22 (с, 3Н); 3,69 (с, 3Н); 4,45 (д, 2Н); 5,10 (шир, 1Н); 5,18 (с, 2Н); 7,02-7,65 (м, 7Н).
Пример получения 6
Получение метил N-[2-хлор-5-(1-гидроксииминоэтил)бензил]карбамата (соединение № А-45)
10,7 г Метил N-[5-амино-2-хлорбензил]карбамата растворяют в 33 г 14% хлористоводородной кислоты с последующим перемешиванием при комнатной температуре в течение 1 часа. К раствору по каплям добавляют 7 мл водного раствора 3,8 г нитрита натрия при перемешивании при температуре от 0 до 5°С. Полученную соль диазония по каплям добавляют к смешанному растворителю вода/этилацетат/толуол (80 мл/40 мл/40 мл) с 21,7 г ацетата натрия, 2,6 г сульфата меди и 5,9 г ацетальдоксима при энергичном перемешивании при температуре от 0 до 5°С в течение 15 минут, с последующим перемешиванием при комнатной температуре в течение еще 2 часов. Реакционный раствор подкисляют хлористоводородной кислотой, экстрагируют этилацетатом с последующим промыванием водой и органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, полученные неочищенные кристаллы промывают смешанным растворителем эфир/этилацетат с получением 2,8 г метил N-[2-хлор-5-(1-гидроксииминоэтил)бензил]карбамата в виде бесцветных кристаллов (температура плавления 124-127°С).
1H ЯМР: (CDCl3/TMS, δ (м.д.))
2,25 (с, 3Н); 3,70 (с, 3Н); 4,46 (д, 2Н); 5,31 (шир, 1Н); 7,27-7,63 (м, 3Н).
Пример получения 7
Получение метил N-{2-метил-5-[1-(6-метилпиридин-2-ил-метокси)иминоэтил]бензил}карбамата (соединение №А-434)
0,43 г Метил N-[2-метил-5-(1-гидроксииминоэтил)бензил]карбамата растворяют в 15 мл N,N-диметилформамида и к смеси добавляют 0,75 г карбоната калия и 0,32 г гидрохлорида 2-хлор-6-метилпиридина с последующим перемешиванием при нагревании при температуре от 90 до 100°С в течение 8 часов. После завершения реакции реакционный раствор выливают в воду, экстрагируют этилацетатом с последующим промыванием водой и органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Wakogel С-200, элюент: гексан/этилацетат = 4/1) с получением 0,30 г метил N-{2-метил-5-[1-(6-метилпиридин-2-ил-метокси)иминоэтил]бензил}карбамата (температура плавления 72-75°С) в виде бледно-желтых кристаллов.
1H ЯМР: (CDCl3/TMS, δ (м.д.))
2,30 (с, 3Н); 2,32 (с, 3Н); 2,56 (с, 3Н); 3,69 (с, 3Н); 4,35 (д, 2Н); 4,94 (шир, 1Н); 5,33 (с, 2Н); 7,04-7,59 (м, 6Н).
Далее в таблицах 14-20 представлены данные 1H ЯМР (CDCl3/TMC, δ м.д.) для некоторых примеров соединений данного изобретения.
Далее в качестве ссылочных примеров представлены примеры получения промежуточных соединений для синтеза соединений данного изобретения.
Ссылочный пример 1
Получение метил 4-хлор-3-(метоксикарбониламинометил) бензоата
40,4 г метил 4-хлор-3-метилбензоата, 39 г N-бромсукцинимида и 1 г азобисизобутиронитрила добавляют к 300 мл четыреххлористого углерода с последующим кипячением с обратным холодильником в течение 4 часов. После завершения реакции реакционную смесь охлаждают до комнатной температуры, нерастворимые вещества собирают фильтрованием и фильтрат концентрируют. Полученные неочищенные кристаллы промывают гексаном с получением 34,3 г метил 3-бромметил-4-хлорбензоата в виде белых кристаллов. 16,0 г полученного метил 3-бромметил-4-хлорбензоата, 15,0 г цианата калия и 35 мл метанола добавляют к 200 мл N,N-диметилформамида с последующим перемешиванием при температуре 90°С в течение 4 часов. После завершения реакции к реакционной смеси добавляют воду, экстрагируют этилацетатом и органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и полученные неочищенные кристаллы промывают изопропанолом с получением 25,2 г метил 4-хлор-3-(метоксикарбониламинометил)бензоата в виде белых кристаллов.
1H ЯМР: (CDCl3/TMS, δ (м.д.))
3,70 (с, 3Н); 3,90 (с, 3Н); 4,48 (д, 2Н); 5,29 (шир, 1Н); 7,43 (д, 1Н); 7,89 (дд, 1Н); 8,05 (с, 1Н).
Ссылочный пример 2
Получение метил N-(2-хлор-5-гидроксиметилбензил)карбамата
10,3 г Метил 4-хлор-3-(метоксикарбониламинометил)бензоата растворяют в 80 мл безводного тетрагидрофурана, к полученному раствору по каплям добавляют 100 мл гидрида диизобутилалюминия (0,95 М раствор в гексане) в атмосфере азота при температуре от -50°С до -30°С и после завершения добавления смесь перемешивают при комнатной температуре в течение 16 часов. После завершения реакции к реакционной смеси по каплям добавляют разбавленную хлористоводородную кислоту при температуре 0°С, к полученному раствору добавляют воду, экстрагируют этилацетатом и органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Wakogel C-200, элюент: гексан/этилацетат = 1/1) с получением 6,5 г метил N-(2-xлop-5-гидроксиметилбензил)карбамата в виде белых кристаллов.
1H ЯМР: (CDCl3/TMS, δ (м.д.))
2,20 (шир, 1Н); 3,67 (с, 3Н); 4,43 (д, 2Н); 4,65 (с, 2Н); 5,26 (шир, 1Н); 7,21-7,37 (м, 3Н).
Ссылочный пример 3
Получение метил N-(5-бромметил-2-хлорбензил)карбамата
6,2 г Метил N-(2-хлор-5-гидроксиметилбензил)карбамата растворяют в 50 мл диметилового эфира этиленгликоля и к полученному раствору по каплям добавляют 2,7 г трибромида фосфора при температуре -20°C с последующим перемешиванием при комнатной температуре в течение 1 часа. После завершения реакции к реакционной смеси добавляют воду, экстрагируют этилацетатом с последующим промыванием водным раствором гидрокарбоната натрия и органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении с получением 6,1 г метил N-(5-бромметил-2-хлорбензил)карбамата в виде белых кристаллов.
1H ЯМР: (CDCl3/TMS, δ (м.д.))
3,70 (с, 3Н); 4,37 (д, 2Н); 4,49 (с, 2Н); 5,20 (шир, 1Н); 7,25-7,40 (м, 3Н).
Ссылочный пример 4
Получение метил N-(2-хлор-5-цианометилбензил)карбамата
2,3 г Метил N-(5-бромметил-2-хлорбензил)карбамата, полученного в ссылочном примере 3, растворяют в 20 мл N,N-диметилформамида и к полученному раствору добавляют 0,43 г цианида натрия при температуре 0°С. Смесь перемешивают при температуре 0oС в течение 1 часа и далее при комнатной температуре в течение 4 часов, затем к реакционной смеси добавляют воду, экстрагируют этилацетатом и органический растворитель сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и полученные неочищенные кристаллы промывают гексаном с получением 1,3 г метил N-(2-хлор-5-цианометилбензил)карбамата в виде белых кристаллов.
1H ЯМР: (CDCl3/TMS, δ (м.д.))
3,70 (с, 3Н); 3,73 (с, 2Н); 4,44 (д, 2Н); 5,21 (шир, 1Н); 7,24-7,40 (м, 3Н).
Ссылочный пример 5
Получение метил N-(2-хлор-5-ацетилбензил)карбамата
25,0 г 4-хлор-3-метилацетофенона, 26,6 г N-бромсукцинимида и каталитическое количество азобисизобутиронитрила добавляют к 150 мл четыреххлористого углерода с последующим кипячением с обратным холодильником в течение 2 часов. После завершения реакции реакционную смесь охлаждают до комнатной температуры, нерастворимые частицы собирают фильтрованием и фильтрат концентрируют при пониженном давлении. Полученный остаток, 18,0 г цианата калия и 38 мл метанола добавляют к 150 мл N,N-диметилформамида с последующим перемешиванием при температуре 90°С в течение 4 часов. После завершения реакции к реакционной смеси добавляют воду, экстрагируют этилацетатом и органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Wakogel C-200, элюент: гексан/этилацетат) и промывают изопропиловым эфиром с получением 6,8 г метил N-(2-хлор-5-ацетилбензил)карбамата в виде бесцветных кристаллов.
1H ЯМР: (CDCl3/TMS, δ (м.д.))
2,59 (с, 3Н); 3,70 (с, 3Н); 4,50 (д, 2Н); 5,31 (шир, 1Н); 7,46 (д, 1Н); 7,81 (дд, 1Н); 7,97 (с, 1Н).
Ссылочный пример 6
Получение метил N-(2-хлор-5-ацетилбензил)карбамата
25,0 г 4-хлор-3-метилацетофенона и 13,9 г трихлоризоциануровой кислоты суспендируют в 150 мл хлорбензола. К полученной суспензии добавляют каталитическое количество азобисизобутиронитрила с последующим перемешиванием при нагревании при температуре от 85 до 90°С в течение 12 часов. После завершения реакции реакционную смесь охлаждают до комнатной температуры, и нерастворимые частицы собирают фильтрованием. Фильтрат промывают водным раствором гидроксида натрия и водой в указанном порядке и органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении, и полученный остаток, 12,2 г цианата калия и 14,4 г метанола добавляют к 150 мл N,N-диметилформамида с последующим перемешиванием при температуре 90°С в течение 4 часов. После завершения реакции к реакционной смеси добавляют воду, экстрагируют этилацетатом и органический слой сушат над безводным сульфатом магния. Растворитель отгоняют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем (Wakogel С-200, элюент: гексан/этилацетат = 3/1). Полученные кристаллы промывают изопропиловым эфиром с получением 6,0 г метил N-(2-хлор-5-ацетилбензил)карбамата в виде бесцветных кристаллов.
1H ЯМР: (CDCl3/TMS, δ (м.д.))
2,59 (с, 3Н); 3,70 (с, 3Н); 4,50 (д, 2Н); 5,31 (шир, 1Н); 7,46 (д, 1Н); 7,81 (дд, 1Н); 7,97 (с, 1Н).
Фунгициды для сельского хозяйства/садоводства данного изобретения содержат производные карбамата, представленные общей формулой [I], в качестве активного ингредиента. Когда соединения данного изобретения используются как фунгициды сельского хозяйства/садоводства, активный ингредиент может использоваться в подходящей препаративной форме, в зависимости от цели. Активный ингредиент обычно разбавляют инертной жидкостью или твердым разбавителем и используют в виде подходящей дозированной формы, такой как дуст, смачиваемый порошок, эмульгируемый концентрат или гранулы, смешивая его с поверхностно-активными веществами и другими ингредиентами, в зависимости от использования. Количества для смешивания активного ингредиента обычно выбирают в зависимости от конкретного случая. Однако предпочтительные количества составляют от 0,1 до 20% (мас.) для дуста или гранул, и от 5 до 80% (мас.) для эмульгируемых концентратов или смачиваемых порошков.
Предпочтительные примеры носителей включают твердые носители, такие как тальк, бентонит, глина, каолин, диатомовая земля, белая сажа, вермикулит, гашеная известь, кремнеземный песок, сульфат аммония и мочевина, и жидкие носители, такие как изопропиловый спирт, ксилол, циклогексанон и метилнафталин. Примеры поверхностно-активных веществ и диспергаторов включают динафтилметансульфонаты, соли сложных эфиров спирта и серной кислоты, алкиларилсульфонаты, лигнинсульфонат, полиоксиэтиленгликолевые эфиры, полиоксиэтиленалкилариловые эфиры и полиоксиэтиленсорбитанмоноалкилат. Примеры адъювантов включают карбоксиметилцеллюлозу и подобные.
Фунгициды сельского хозяйства/садоводства данного изобретения применяют после разбавления указанных препаративных форм или используют непосредственно для обработки листвы, семян, почвы, воды для затопления или в питомниках. Доза зависит от типа используемого соединения, заболевания, с которым борятся, тенденции развития заболевания, степени повреждения, условий окружающей среды, типа используемой препаративной формы и так далее. Например, для непосредственного использования в виде дуста или гранул, дозу активного ингредиента выбирают в интервале от 0,1 кг до 5 кг, предпочтительно от 1 г до 1 кг, на 10 ар. При использовании в жидком состоянии в виде эмульгируемых концентратов или смачиваемых порошков, дозу выбирают в интервале от 0,1 част./млн до 10000 част./млн, предпочтительно от 10 до 3000 част./млн.
Соединение данного изобретения в указанных выше препаративных формах может подавлять заболевания растений, вызываемые Oomycetes, Ascomycetes, Basidiomycetes и Deuteromycetes. Определенные, но не ограничивающие примеры микроорганизмов представлены ниже. Род Pseudoperonospora, такие как Pseudoperonospora cubensis, род Venturia, такие как Venturia inaequalis, род Erysiphe, такие как Erysiphe graminis, род Pyricularia, такие как Pyricularia oryzae, род Botrytis, такие как Botrytis cinerea, род Rhizoctonia, такие как Rhizoctonia solani, род Puccinia, такие как Puccinia recondita, род Septoria, такие как Septoria nodorum и Sclerotinia, такие как Sclerotinia sclerotiorum.
Соединения данного изобретения могут использоваться в сочетании с инсектицидами, другими фунгицидами, гербицидами, регуляторами роста растений или удобрениями, в зависимости от конкретной необходимости. Далее со ссылкой на примеры препаративных форм будут описаны типичные препаративные формы фунгицидов сельского хозяйства/садоводства данного изобретения. В указанных примерах “%” означает “мас.%”.
Пример препаративной формы 1.
Дуст 2% Соединения (А-30), 5% диатомовой земли и 93% глины смешивают до однородного состояния и распыляют с получением дуста.
Пример препаративной формы 2.
Смачиваемый порошок 50% Соединения (А-31), 45% диатомовой земли, 2% динафтилметандисульфоната натрия и 3% лигнинсульфоната натрия смешивают до однородного состояния и распыляют с получением смачиваемого порошка.
Пример препаративной формы 3.
Эмульгируемый концентрат 30% Соединения (А-109), 20% циклогексанона, 11% полиоксиэтиленалкиларилового эфира, 4% алкилбензолсульфоната натрия и 35% метилнафталина растворяют до однородного состояния с получением эмульгируемого концентрата.
Пример препаративной формы 4.
Гранулы 5% Соединения (А-45), 2% натриевой соли сложного эфира лаурилового спирта и серной кислоты, 5% лигнинсульфоната натрия, 2% карбоксиметилцеллюлозы и 86% глины смешивают до однородного состояния и распыляют. Полученную смесь перемешивают с 20% воды, гранулируют до 14-32 меш с помощью экструзионного гранулятора и сушат с получением гранул.
Далее со ссылкой на конкретные примеры испытаний будет описана эффективность фунгицидов сельского хозяйства/садоводства данного изобретения.
Пример испытания 1
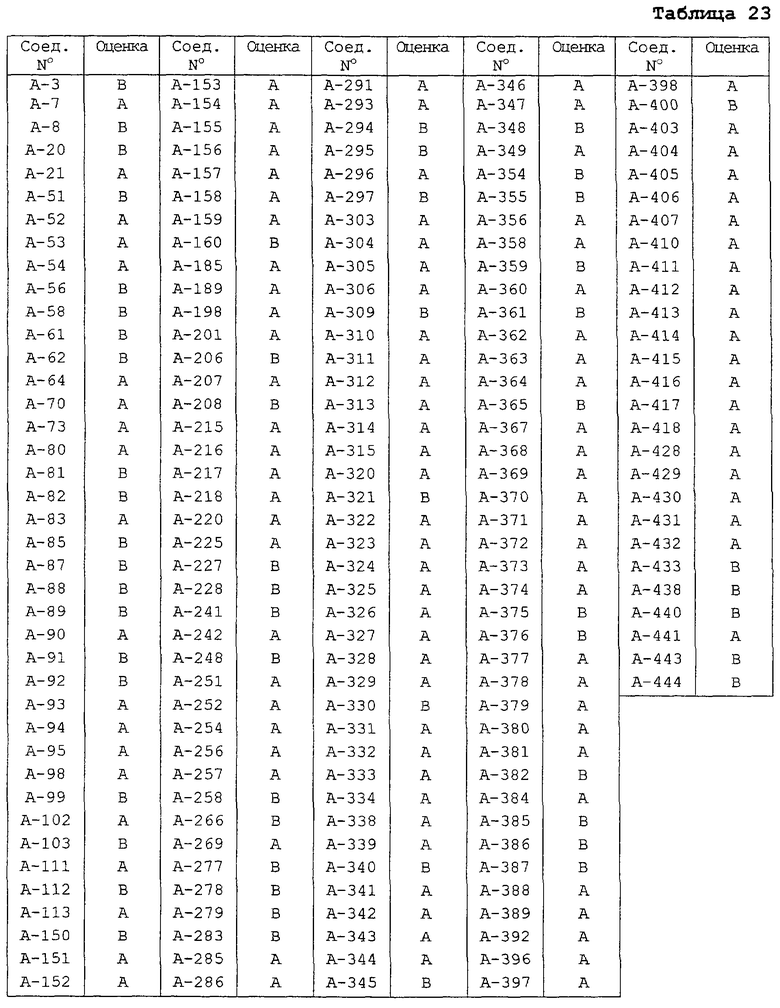
Испытание на профилактическое действие в отношении мучнистой росы пшеницы 10 семян пшеницы (разновидность: Norin-61-go) высевают в отдельные пластиковые горшки диаметром 6 см и выращивают в теплице. Сеянцы пшеницы, которые достигают стадии второго листа, обрабатывают, в количестве 10 мл на горшок, водными концентратами смачиваемых порошков, полученных согласно методике примера препаративной формы 2, в концентрации 500 част./млн активного ингредиента и сушат на воздухе. Затем сеянцы инокулируют спорами Erysiphe graminis и контролируют их развитие в теплице. Через 10 дней после инокуляции определяют общую площадь поражения первых листьев в каждом горшке и оценивают эффективность на основе критериев, показанных в таблице 21. Результаты показаны в таблице 22.


Пример испытания 2
Испытание на профилактическое действие в отношении пятнистости листьев пшеницы, вызванной Septoria 10 семян пшеницы (разновидность: Norin-61-go) высевают в отдельные пластиковые горшки диаметром 6 см и выращивают в теплице. Сеянцы пшеницы, которые достигают стадии второго листа, обрабатывают в количестве 10 мл на горшок водными концентратами смачиваемых порошков, полученных согласно методике примера препаративной формы 2, в концентрации 50 част./млн активного ингредиента, и сушат на воздухе. Затем сеянцы инокулируют пикнидами Septoria nodorum и контролируют их развитие в теплице. Через 10 дней после инокуляции определяют общую площадь поражения первых листьев в каждом горшке и оценивают эффективность на основе критериев, показанных в таблице 21. Результаты показаны в таблице 23.
Пример испытания 3
Испытание на профилактическое действие в отношении серой плесени огурцов 4 семени огурцов (разновидность: Sagami-hanziro) высевают в отдельные пластиковые горшки диаметром 6 см и выращивают в теплице. Сеянцы огурцов по достижении стадии семядоли обрабатывают в количестве 10 мл на горшок водными концентратами смачиваемых порошков, полученных согласно методике примера препаративной формы 2, в концентрации 500 част./млн активного ингредиента и сушат на воздухе. Затем сеянцы инокулируют спорами Botrytis cinerea помещением бумажного диска, пропитанного суспензией спор, на поверхность семядоли огурца и сеянцы немедленно помещают во влажную камеру с температурой 22°С. Через 3 дня после инокуляции определяют общую площадь поражения семядолей в каждом горшке и оценивают эффективность на основе критериев, показанных в таблице 24. Результаты показаны в таблице 25.

Промышленная применимость
Фунгициды сельского хозяйства/садоводства данного изобретения оказывают высокое подавляющее действие на ложную мучнистую росу огурцов, паршу яблони, мучнистую росу пшеницы, пирикуляриоз риса, серую плесень на огурцах, гниль оболочки риса, бурую ржавчину пшеницы, пятнистость листьев пшеницы, вызванную Septoria, и стеблевую гниль огурцов, и имеют превосходную остаточную эффективность и стойкость к дождю, не вызывая повреждения растений, и таким образом, они являются полезными фунгицидами сельского хозяйства/садоводства.
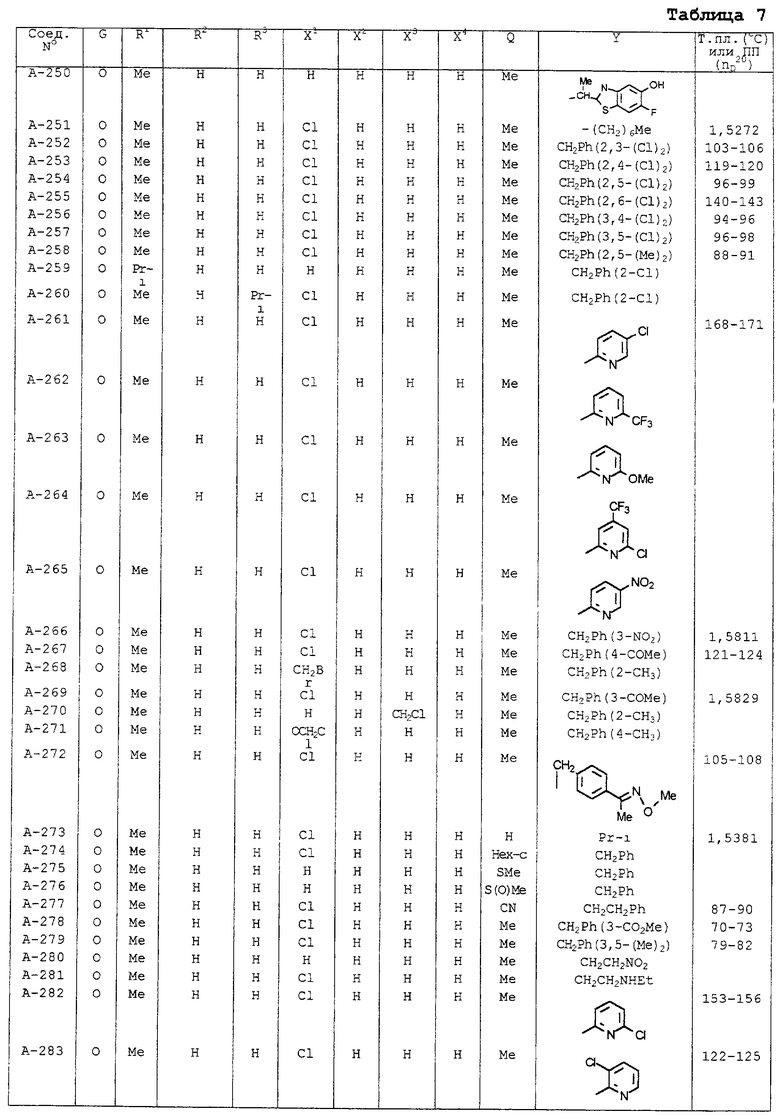
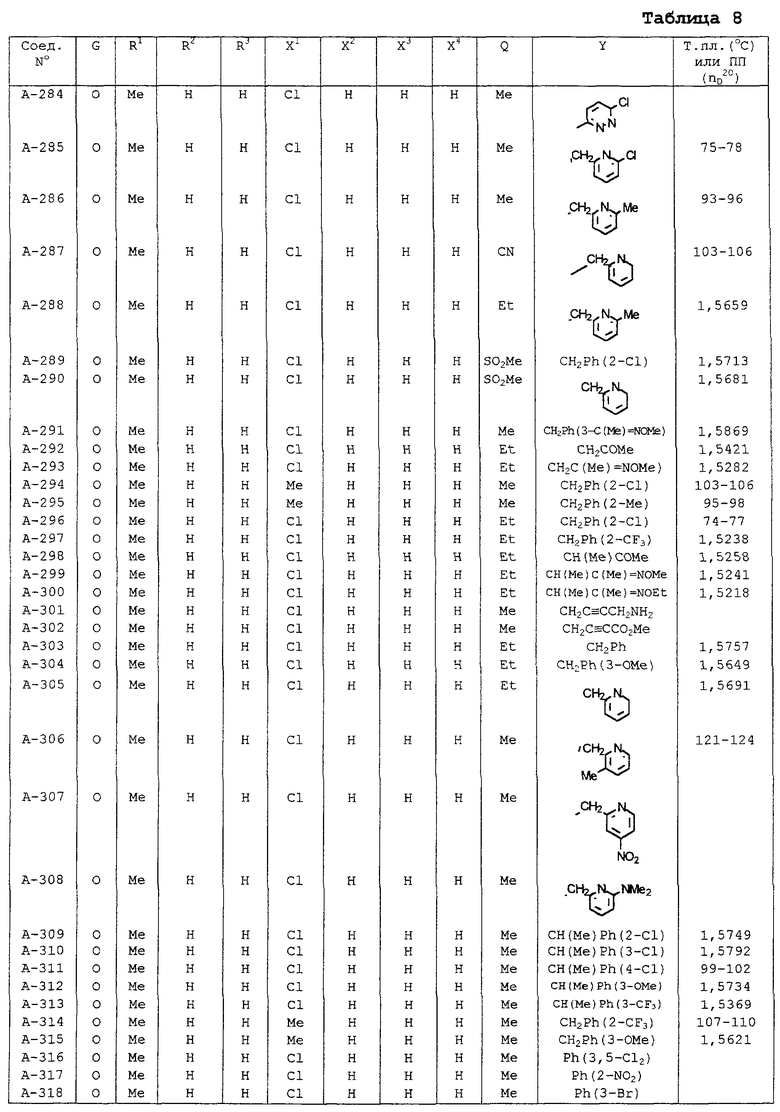
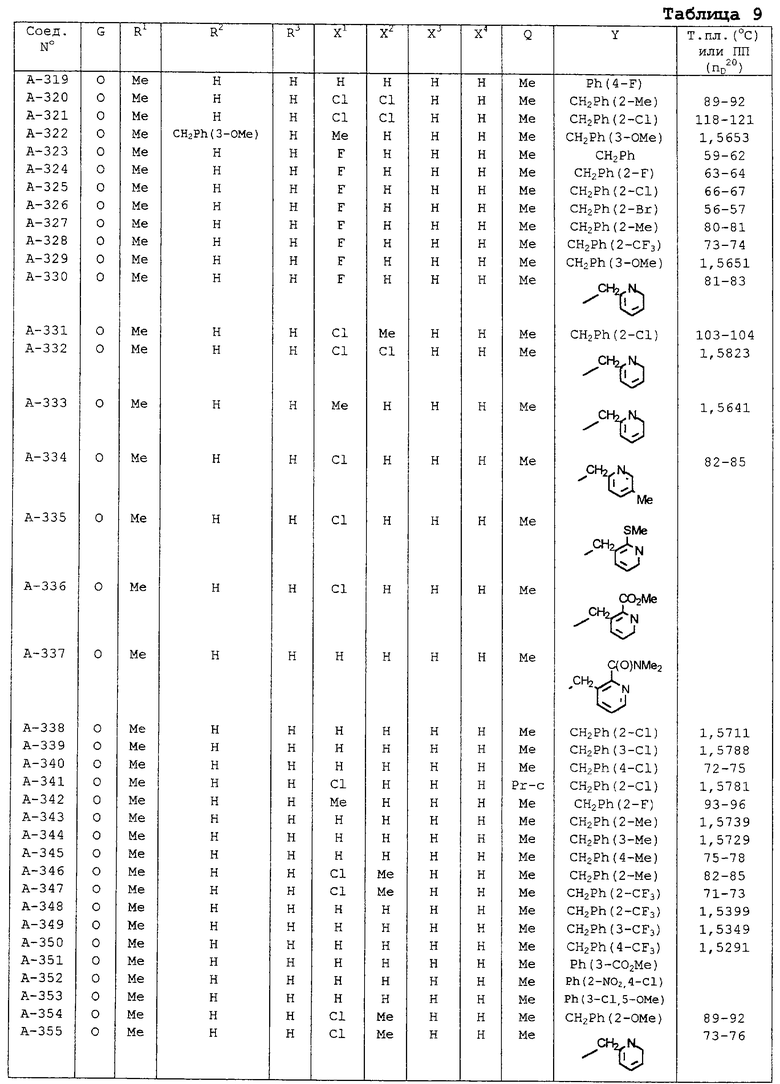
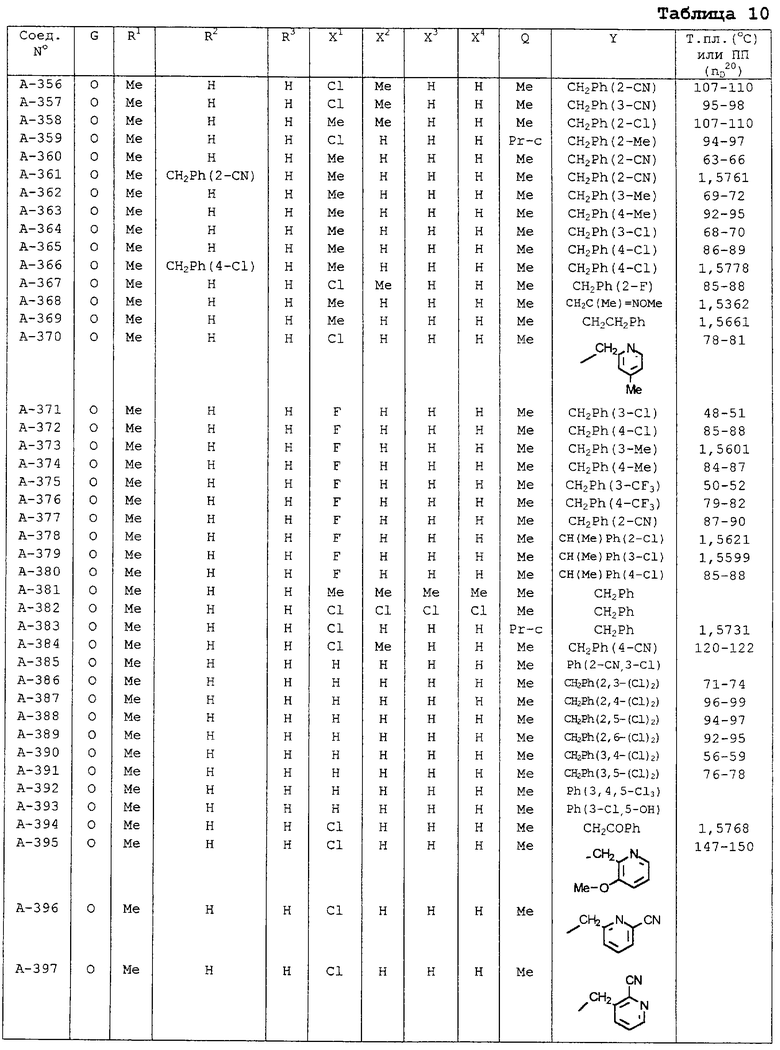

| название | год | авторы | номер документа |
|---|---|---|---|
| ИЗОКСАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ И ГЕРБИЦИДЫ, СОДЕРЖАЩИЕ ИХ В КАЧЕСТВЕ АКТИВНЫХ ИНГРЕДИЕНТОВ | 2000 |
|
RU2237664C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНИЛОКСИАЛКАНАМИДОВ И ФУНГИЦИДЫ ДЛЯ СЕЛЬСКОГО ХОЗЯЙСТВА ИЛИ САДОВОДСТВА | 1997 |
|
RU2194040C2 |
| ПРОИЗВОДНЫЕ ФЕНИЛАЛКАНАМИДА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И СЕЛЬСКОХОЗЯЙСТВЕННЫЙ ИЛИ САДОВЫЙ ФУНГИЦИД | 1996 |
|
RU2156235C2 |
| ПРОИЗВОДНОЕ БЕНЗИЛСУЛЬФИДА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПЕСТИЦИД | 1996 |
|
RU2170728C2 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНИЛБЕНЗИМИДАЗОЛА И ТРИАЗИНИЛБЕНЗИМИДАЗОЛА И СОДЕРЖАЩИЙ ИХ ФУНГИЦИД ДЛЯ СЕЛЬСКОГО ХОЗЯЙСТВА/САДОВОДСТВА | 1999 |
|
RU2222536C2 |
| ПРОИЗВОДНОЕ ИЗОКСАЗОЛИНА И ГЕРБИЦИД, СОДЕРЖАЩИЙ ЕГО В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2002 |
|
RU2286989C2 |
| ИНСЕКТИЦИД, АКАРИЦИД И НЕМАТОЦИД, СОДЕРЖАЩИЕ В КАЧЕСТВЕ АКТИВНОГО КОМПОНЕНТА ПРОИЗВОДНОЕ 3-ТРИАЗОЛИЛФЕНИЛСУЛЬФИДА | 2005 |
|
RU2394819C2 |
| ПРОИЗВОДНЫЕ АМИДА N-СУЛЬФОНИЛКАРБОНОВОЙ КИСЛОТЫ, ВКЛЮЧАЮЩИЕ N-СОДЕРЖАЩЕЕ 6-ЧЛЕННОЕ АРОМАТИЧЕСКОЕ КОЛЬЦО, ФУНГИЦИДНАЯ И ГЕРБИЦИДНАЯ КОМПОЗИЦИИ И СПОСОБЫ БОРЬБЫ С СОРНЯКАМИ И ФИТОПАТОГЕННЫМИ ГРИБКАМИ | 1993 |
|
RU2117662C1 |
| ПРОИЗВОДНЫЕ АМИДОВ АМИНОКИСЛОТ, СПОСОБ ПОЛУЧЕНИЯ, ФУНГИЦИДНАЯ КОМПОЗИЦИЯ ДЛЯ СЕЛЬСКОГО ХОЗЯЙСТВА И САДОВОДСТВА | 1994 |
|
RU2128186C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ 5-АЛКОКСИ-4-ГИДРОКСИМЕТИЛПИРАЗОЛА | 2007 |
|
RU2451677C2 |
Описывается производное карбамата общей формулы [I]:
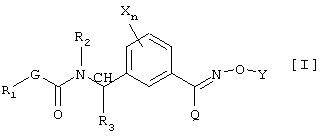
в которой Х является атомом галогена, С1-С6 алкильной группой; n является 0 или целым числом 1 или 2, R1 является С1-С6 алкильной группой; R2 является атомом водорода, С1-С6 алкильной группой или бензильной группой; R3 является атомом водорода; G является атомом кислорода; Y является атомом водорода,
С1-С10 алкильной группой, С2-С10 алкенильной группой, С2-С10 алкинильной группой, фенацильной группой, фенилом, нафтилом, пиридилом, пиридазинилом, пиримидинилом, триазинилом, бензотиазолилом, фенил-С1-С6 алкильной группой, нафтил-С1-С6 алкильной группой, тиенил-С1-С6 алкильной группой, тиазолил-С1-С6 алкильной группой, пиридил-С1-С6 алкильной группой,
хинолил-С1-С6 алкильной группой, морфолино-С1-С6 алкильной группой, оксиранил-С1-С6 алкильной группой, диоксоланил-С1-С6 алкильной группой, тетрагидрофуранил-С1-С6 алкильной группой; Q является атомом водорода, цианогруппой, С1-С6 алкильной группой, С3-С6 циклоалкильной группой, С1-С4 алкилсульфонильной группой или фенильной группой. Описывается также фунгицид сельского хозяйства, содержащий производное карбаматаформулы [I] в качестве активного ингредиента. Технический результат заключается в получении фунгицида, оказывающего высокое подавляющее действие на заболевания растений, в частности на мучнистую росу пшеницы и серую гниль огурцов, не оказывая при этом отрицательного действия на культуры. 2 с. и 2 з.п. ф-лы, 25 табл.
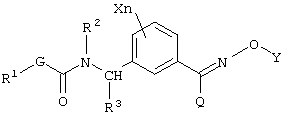
в которой Х является атомом галогена, С1-С6 алкильной группой;
n=0, 1 или 2;
R1 является С1-С6 алкильной группой;
R2 является атомом водорода, С1-С6 алкильной группой или бензильной группой, которая может быть замещена атомом галогена, С1-С6 алкоксигруппой, цианогруппой;
R3 является атомом водорода;
G является атомом кислорода;
Y является атомом водорода, С1-С10 алкильной группой (указанная группа может быть замещена одинаковыми или различными заместителями, по крайней мере одним атомом галогена, цианогруппой, С3-С6 циклоалкильной группой, С1-С6 алкоксигруппой, ди-С1-С6 алкиламиногруппой, С1-С6 алкилкарбонильной группой, С1-С6 алкоксикарбонильной группой или С1-С6 алкоксииминогруппой), С2-С10 алкенильной группой (указанная группа может быть замещена по крайней мере одним атомом галогена), С2-С10 алкинильной группой, незамещенной, фенацильной группой (указанная группа может быть замещена одинаковыми или различными заместителями, по крайней мере атомом галогена, С1-С6 алкильной группой, С1-С6 алкоксигруппой группой), фенилом, нафтилом, незамещенными, пиридилом, пиридазинилом, пиримидинилом, триазинилом, бензотиазолилом (указанные группы могут быть замещены одинаковыми или различными заместителями, по крайней мере одним атомом галогена, С1-С6 алкильной группой, С1-С6 алкоксигруппой, С1-С6 алкилтиогруппой, С1-С6 галоидалкильной группой), фенил-С1-С6 алкильной группой, нафтил-С1-С6 алкильной группой (фенил и нафтил в указанной группе могут быть замещены одинаковыми или различными заместителями, по крайней мере одним атомом галогена, цианогруппой, нитрогруппой, С1-С6 алкильной группой, С1-С6 алкоксигруппой, С1-С6 галоидалкоксигруппой, С1-С6 алкилкарбонильной группой, С1-С6 алкоксикарбонильной группой, С1-С6 алкоксиимино С1-С6 алкильной группой), тиенил-С1-С6 алкильной группой, тиазолил-С1-С6 алкильной группой, пиридил-С1-С6 алкильной группой, хинолил-С1-С6 алкильной группой, морфолино-С1-С6 алкильной группой, оксиранил-С1-С6 алкильной группой, диоксоланил-С1-С6 алкильной группой, тетрагидрофуранил-С1-С6 алкильной группой (гетероцикл в указанной группе может быть замещен одинаковыми или различными заместителями, по крайней мере одним атомом галогена, цианогруппой, С1-С6 алкильной группой, С1-С6 алкоксигруппой, С1-С6 галоидалкильной группой, С1-С6 алкилкарбонильной группой);
Q является атомом водорода, цианогруппой, С1-С6 алкильной группой, С3-С6 циклоалкильной группой, С1-С4 алкилсульфонильной группой или фенильной группой (указанная группа может быть замещена по крайней мере одним атомом галогена).
| DE 4424788 A1, 29.06.1995.RU 2098408 C1, 10.12.1997. |
Авторы
Даты
2004-05-10—Публикация
2000-08-03—Подача