Уровень техники
1. Область техники.
Настоящее изобретение относится к новому производному изоксазолина и к гербициду, содержащему производное изоксазолина в качестве активного ингредиента.
2. Описание предшествующего уровня техники.
Гербицидная активность производных изоксазолина описана, например, в публикациях JP-A-8-22558, JP-A-9-328477 и JP-A-328483. Однако соединение настоящего изобретения, описанное более подробно ниже, не представлено в этих публикациях.
Желательно, чтобы гербициды, применяемые на полезных культурах, (а) могли быть применены на почве или по листве, (б) проявляли достаточное гербицидное действие при низких количествах ингредиента и (в) обладали высокой селективностью для культуры и сорняков. С этой точки зрения, соединения, описанные в приведенных выше публикациях, не являются полностью удовлетворительными.
Сущность изобретения
С учетом описанной выше ситуации заявителями настоящего изобретения изучен гербицидный эффект и селективность для культуры и сорняков различных соединений. В результате заявители изобретения установили, что новое производное изоксазолина обладает прекрасным гербицидным действием и прекрасной селективностью для культуры и сорняков. Указанное открытие привело к настоящему изобретению.
Настоящее изобретение предлагает следующее.
(1) Производное изоксазолина, представленное следующей общей формулой [I], или его фармацевтически приемлемую соль
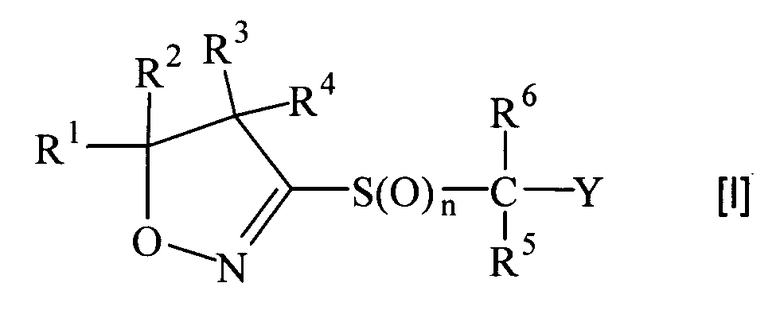
где
R1 и R2 могут быть одинаковыми или разными, и каждый из них представляет собой атом водорода, С1-С10-алкильную группу, С3-С8-циклоалкильную группу или С3-С8-циклоалкил-С1-С3-алкильную группу, или заместители R1 и R2 могут быть соединены друг с другом с образованием С3-С7-спирокольца вместе с атомами углерода, с которыми они связаны;
R3 и R4 могут быть одинаковыми или разными и каждый из них представляет собой атом водорода, С1-С10-алкильную группу или С3-С8-циклоалкильную группу; или заместители R3 и R4 могут быть соединены друг с другом с образованием С3-С7-спирокольца вместе с атомами углерода, с которыми они связаны; или заместители R1, R2, R3 или R4 могут образовывать 5-8-членное кольцо вместе с атомами углерода, с которыми они связаны;
R5 и R6 могут быть одинаковыми или разными и каждый из них представляет собой атом водорода или С1-С10-алкильную группу;
Y представляет собой 5-6-членную ароматическую гетероциклическую группу или конденсированную ароматическую гетероциклическую группу, содержащую один или несколько гетероатомов, выбранных из атома азота, атома кислород и атома серы, причем гетероциклическая группа может быть замещена 0-6 одинаковыми или разными группами, выбранными из следующей группы заместителей α; когда гетероциклическая группа замещена в двух соседних положениях двумя алкильными группами, двумя алкоксигруппами, алкильной группой и алкоксигруппой, алкильной группой и алкилтиогруппой, алкильной группой и алкилсульфонильной группой, алкильной группой и моноалкиламиногруппой, или алкильной группой и диалкиламиногруппой, которые все выбраны из группы заместителей α, две группы могут образовывать вместе с атомами, с которыми они связаны, 5-8-членное кольцо, которое может быть замещено 1-4 атомами галогена; гетероатом гетероциклической группы, когда он представляет собой атом азота, может быть окислен до N-оксида;
n принимает целые значения от 0 до 2.
[Группа заместителей α]
Гидроксильная группа; тиольная группа; атомы галогена; С1-С10-алкильные группы; С1-С10-алкильные группы, каждая из которых монозамещена группой, выбранной из следующей группы заместителей β; С1-С4-галогеналкильные группы; С3-С8-циклоалкильные группы; С1-С10-алкоксигруппы; С1-С10-алкоксигруппы, каждая из которых монозамещена группой, выбранной из следующей группы заместителей γ; С1-С4-галогеналкоксигруппы; С3-С8-циклоалкоксигруппы; С3-С8-циклоалкил-С1-С3-алкоксигруппы; С1-С10-алкилтиогруппы; С1-С10-алкилтиогруппы, каждая из которых монозамещена группой, выбранной из следующей группы заместителей γ; С1-С4-галогеналкилтиогруппы; С2-С6-алкенильные группы; С2-С6-алкенилоксигруппы; С2-С6-алкинильные группы; С2-С6-алкинилоксигруппы; С1-С10-алкилсульфинильные группы; С1-С10-алкилсульфинильные группы, каждая из которых монозамещена группой, выбранной из следующей группы заместителей γ; С1-С10-алкилсульфонильные группы; С1-С10-алкилсульфонильные группы, каждая из которых монозамещена группой, выбранной из следующей группы заместителей γ; С1-С4-галогеналкилсульфинильные группы; С1-С10-алкилсульфонилоксигруппы, каждая из которых монозамещена группой, выбранной из следующей группы заместителей γ; С1-С4-галогеналкилсульфонильные группы; С1-С10-алкилсульфонилоксигруппы; С1-С4-галогеналкилсульфонилоксигруппы; необязательно замещенная фенильная группа; необязательно замещенная феноксигруппа; необязательно замещенная фенилтиогруппа; необязательно замещенные ароматические гетероциклические группы; необязательно замещенные ароматические гетероциклические оксигруппы; необязательно замещенные ароматические гетероциклические тиогруппы; необязательно замещенные фенилсульфинильные группы; необязательно замещенные фенилсульфонильные группы; необязательно замещенные ароматические гетероциклические сульфонильные группы; необязательно замещенные фенилсульфонилоксигруппы; ацильные группы; С1-С4-галогеналкилкарбонильные группы; необязательно замещенная бензилкарбонильная группа; необязательно замещенная бензоильная группа; карбоксильная группа; С1-С10-алкоксикарбонильные группы; необязательно замещенная бензилоксикарбонильная группа; необязательно замещенная феноксикарбонильная группа; цианогруппа; карбамоильная группа (причем ее атом азота может быть замещен одинаковыми или разными группами, выбранными из С1-С10-алкильных групп и необязательно замещенной фенильной группы); С1-С6-ацилоксигруппы; С1-С4-галогеналкилкарбонилоксигруппы; необязательно замещенная бензилкарбонилоксигруппа; необязательно замещенная бензоилоксигруппа; нитрогруппа и аминогруппа (причем ее атом азота может быть замещен одинаковыми или разными группами, выбранными из С1-С10-алкильных групп, необязательно замещенной фенильной группы, С1-С6-ацильных групп, С1-С6-галогеналкилкарбонильных групп, необязательно замещенной бензилкарбонильной группы, необязательно замещенной бензоильной группы, С1-С10-алкилсульфонильной группы, С1-С4-галогеналкилсульфонильных групп, необязательно замещенной бензилсульфонильной группы и необязательно замещенной фенилсульфонильной группы).
[Группа заместителей β]
Гидроксильная группа; С3-С8-циклоалкильные группы, которые могут быть замещены атомом галогена или алкильной группой; С1-С10-алкоксигруппы; С1-С10-алкилтиогруппы; С1-С10-алкилсульфонильные группы; С1-С10-алкоксикарбонильные группы; С2-С6-галогеналкенильные группы; аминогруппа (причем ее атом азота может быть замещен одинаковыми или разными группами, выбранными из С1-С10-алкильных групп, С1-С6-ацильных групп, С1-С4-галогеналкилкарбонильных групп, С1-С10-алкилсульфонильных групп и С1-С4-галогеналкилсульфонильных групп); карбамоильная группа (причем ее атом азота может быть замещен одинаковыми или разными С1-С10-алкильными группами); С1-С6-ацильные группы; С1-С4-галогеналкилкарбонильные группы; С1-С10-алкоксииминогруппы; цианогруппа; необязательно замещенная фенильная группа и необязательно замещенная феноксигруппа.
[Группа заместителей γ]
С1-С10-алкоксикарбонильные группы; необязательно замещенная фенильная группа; необязательно замещенные ароматические гетероциклические группы; цианогруппа; и карбамоильная группа (причем ее атом азота может быть замещен одинаковыми или разными С1-С10-алкильными группами).
(2) Производное изоксазолина по п. (1), где группа заместителей α в гетероцикле, который может быть замещен 0-6 одинаковыми или разными группами, включает гидроксильную группу; атомы галогена; С1-С10-алкильные группы; С1-С10-алкильные группы, каждая из которых монозамещена группой, выбранной из группы заместителей β; С1-С4-галогеналкильные группы; С3-С8-циклоалкильные группы; С1-С10-алкоксигруппы; С1-С10-алкоксигруппы, каждая из которых монозамещена группой, выбранной из группы заместителей γ; С1-С4-галогеналкоксигруппы; С3-С8-циклоалкилоксигруппы; С3-С8-циклоалкил-С1-С3-алкилоксигруппы; С1-С10-алкилтиогруппы; С1-С10-алкилтиогруппы, каждая из которых монозамещена группой, выбранной из группы заместителей γ; С1-С4-галогеналкилтиогруппы; С2-С6-алкенильные группы; С2-С6-алкенилоксигруппы; С2-С6-алкинильные группы; С2-С6-алкинилоксигруппы; С1-С10-алкилсульфонильные группы; С1-С4-галогеналкилсульфонильные группы; необязательно замещенную феноксигруппу; необязательно замещенную фенилтиогруппу; необязательно замещенные ароматические гетероциклические группы; необязательно замещенные ароматические гетероциклические оксигруппы; необязательно замещенные ароматические гетероциклические тиогруппы; необязательно замещенные фенилсульфонильные группы; необязательно замещенные ароматические гетероциклические сульфонильные группы; С1-С6-ацильные группы; С1-С4-галогеналкилкарбонильные группы; необязательно замещенную бензилкарбонильную группу; необязательно замещенную бензоильную группу; карбоксильную группу; С1-С10-алкоксикарбонильные группы; цианогруппу; карбамоильную группу (причем ее атом азота может быть замещен одинаковыми или разными группами, выбранными из С1-С10-алкильных групп и необязательно замещенной фенильной группы); нитрогруппу и аминогруппу (причем ее атом азота может быть замещен одинаковыми или разными группами, выбранными из С1-С10-алкильных групп, необязательно замещенной фенильной группы, С1-С6-ацильных групп, С1-С4-галогеналкилкарбонильных групп, необязательно замещенной бензилкарбонильной группы, необязательно замещенной бензоильной группы, С1-С10-алкилсульфонильной группы, С1-С4-галогеналкилсульфонильных групп, необязательно замещенной бензилсульфонильной группы и необязательно замещенной фенилсульфонильной группы); когда гетероциклическая группа замещена по двум соседним положениями двумя алкильными группами, двумя алкоксигруппами, алкильной группой и алкоксигруппой, алкильной группой и алкилтиогруппой, алкильной группой и алкилсульфонильной группой, алкильной группой и моноалкиламиногруппой или алкильной группой и диалкиламиногруппой, которые все выбраны из группы заместителей α, две группы могут образовывать вместе с атомами, с которыми они связаны, 5-8-членное кольцо, которое может быть замещено 1-4 атомами галогена.
(3) Производное изоксазолина по п. (2), где группа заместителей α в гетероцикле, который может быть замещен 0-6 одинаковыми или разными группами, включает атомы галогена; С1-С10-алкильные группы; С1-С4-галогеналкильные группы; С1-С10-алкокси-С1-С3-алкильные группы; С3-С8-циклоалкильные группы, которые могут быть замещены атомом галогена или алкильной группой; С1-С10-алкоксигруппы; С1-С4-галогеналкоксигруппы; С3-С8-циклоалкил-С1-С3-алкилоксигруппы; необязательно замещенную феноксигруппу; С1-С10-алкилтиогруппы; С1-С10-алкилсульфонильные группы; ацильные группы; С1-С4-галогеналкилкарбонильные группы; С1-С10-алкоксикарбонильные группы; цианогруппу и карбамоильную группу (причем ее атом азота может быть замещен одинаковыми или разными С1-С10-алкильными группами).
(4) Производное изоксазолина по любому из пп. (1), (2) или (3), где заместители R1 и R2 могут быть одинаковыми или разными, и каждый из них представляет собой метильную группу или этильную группу; и каждый из заместителей R3, R4, R5 и R6 представляет собой атом водорода.
(5) Производное изоксазолина по любому из пп. (1), (2), (3) или (4), где Y представляет собой 5- или 6-членную ароматическую гетероциклическую группу, содержащую гетероатом, выбранный из атома азота, атома кислорода и атома серы.
(6) Производное изоксазолина по п. (5), где Y представляет собой тиенильную группу, пиразолильную группу, изоксазолильную группу, изотиазолильную группу, пиридильную группу или пиримидильную группу.
(7) Производное изоксазолина по п. (6), где Y представляет собой тиофен-3-ильную группу, пиразол-4-ильную группу, пиразол-5-ильную группу, изоксазол-4-ильную группу, изотиазол-4-ильную группу, пиридин-3-ильную группу или пиримидин-5-ильную группу.
(8) Производное изоксазолина по п. (7), где Y представляет собой тиофен-3-ильную группу, и тиофеновое кольцо в положениях 2 и 4 замещено заместителем из группы заместителей α.
(9) Производное изоксазолина по п. (7), где Y представляет собой пиразол-4-ильную группу, и пиразольное кольцо замещено в положениях 3 и 5 заместителем из группы заместителей α, а в положении 1 атомом водорода, С1-С10-алкильной группой, С1-С10-алкильной группой, монозамещенной группой, выбранной из группы заместителей β, С1-С4-галогеналкильной группой, С3-С8-циклоалкильной группой, С2-С6-алкенильной группой, С2-С6-алкинильной группой, С1-С10-алкилсульфинильной группой, С1-С10-алкилсульфонильной группой, С1-С10-алкилсульфонильной группой, монозамещенной группой, выбранной из группы заместителей γ, С1-С4-галогеналкилсульфонильной группой, необязательно замещенной фенильной группой, необязательно замещенной ароматической гетероциклической группой, необязательно замещенной фенилсульфонильной группой, необязательно замещенной ароматической гетероциклической сульфонильной группой, ацильной группой, С1-С4-галогеналкилкарбонильной группой, необязательно замещенной бензилкарбонильной группой, необязательно замещенной бензоильной группой, С1-С10-алкоксикарбонильной группой, необязательно замещенной бензилоксикарбонильной группой, необязательно замещенной феноксикарбонильной группой, карбамоильной группой (причем ее атом азота может быть замещен одинаковыми или разными группами, выбранными из С1-С10-алкильных групп и необязательно замещенной фенильной группы), или аминогруппой (причем ее атом азота может быть замещен одинаковыми или разными группами, выбранными из С1-С10-алкильных групп, необязательно замещенной фенильной группы, ацильных групп, С1-С4-галогеналкилкарбонильных групп, необязательно замещенной бензилкарбонильной группы, необязательно замещенной бензоильной группы, С1-С10-алкилсульфонильных групп, С1-С4-галогеналкилсульфонильных групп, необязательно замещенной бензилсульфонильной группы и необязательно замещенной фенилсульфонильной группы).
(10) Производное изоксазолина по п. (7), где Y представляет собой пиразол-5-ильную группу, и пиразольное кольцо замещено в положении 4 заместителем из группы заместителей α, а в положении 1 атомом водорода, С1-С10-алкильной группой, С1-С10-алкильной группой, монозамещенной группой, выбранной из группы заместителей β, С1-С4-галогеналкильной группой, С3-С8-циклоалкильной группой, С2-С6-алкенильной группой, С2-С6-алкинильной группой, С1-С10-алкилсульфинильной группой, С1-С10-алкилсульфонильной группой, С1-С10-алкилсульфонильной группой, монозамещенной группой, выбранной из группы заместителей γ, С1-С4-галогеналкилсульфонильной группой, необязательно замещенной фенильной группой, необязательно замещенной ароматической гетероциклической группой, необязательно замещенной фенилсульфонильной группой, необязательно замещенной ароматической гетероциклической сульфонильной группой, ацильной группой, С1-С4-галогеналкилкарбонильной группой, необязательно замещенной бензилкарбонильной группой, необязательно замещенной бензоильной группой, С1-С10-алкоксикарбонильной группой, необязательно замещенной бензилоксикарбонильной группой, необязательно замещенной феноксикарбонильной группой, карбамоильной группой (причем ее атом азота может быть замещен одинаковыми или разными группами, выбранными из С1-С10-алкильных групп и необязательно замещенной фенильной группы), или аминогруппой (причем ее атом азота может быть замещен одинаковыми или разными группами, выбранными из С1-С10-алкильных групп, необязательно замещенной фенильной группы, ацильных групп, С1-С4-галогеналкилкарбонильных групп, необязательно замещенной бензилкарбонильной группы, необязательно замещенной бензоильной группы, С1-С10-алкилсульфонильных групп, С1-С4-галогеналкилсульфонильных групп, необязательно замещенной бензилсульфонильной группы и необязательно замещенной фенилсульфонильной группы).
(11) Производное изоксазолина по п. (7), где Y представляет собой изоксазол-4-ильную группу, и изоксазольное кольцо замещено в положениях 3 и 5 заместителем из группы заместителей α. (12) Производное изоксазолина по п. (7), где Y представляет собой изотиазол-4-ильную группу, и изотиазольное кольцо замещено в положениях 3 и 5 заместителем из группы заместителей α.
(13) Производное изоксазолина по п. (7), где Y представляет собой пиридин-3-ильную группу, и пиридиновое кольцо замещено в положениях 2 и 4 заместителем из группы заместителей α.
(14) Производное изоксазолина по п. (7), где Y представляет собой пиримидин-5-ильную группу, и пиримидиновое кольцо замещено в положениях 4 и 6 заместителем из группы заместителей α.
(15) Производное изоксазолина по любому из пп. (1)-(14), где n равно 2.
(16) Производное изоксазолина по любому из пп. (1)-(14), где n равно 1.
(17) Производное изоксазолина по любому из пп. (1)-(14), где n равно 0.
(18) Гербицид, содержащий в качестве активного ингредиента производное изоксазолина, представленное в любом из пп. (1)-(17), или его фармацевтически приемлемую соль.
Подробное описание изобретения
Определение терминов, используемых в настоящем описании, приведено ниже.
Выражение «С1-С10» и т.д. показывает, что заместитель, появляющийся после этого выражения, содержит от 1 до 10 атомов углерода в случае «С1-С10».
Атом галогена означает атом фтора, атом хлора, атом брома или атом иода.
Определение «С1-С10-алкильная группа» относится к линейной или разветвленной алкильной группе из 1-10 атомов углерода, если не оговорено особо; могут быть названы, например, метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, изобутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, изопентильная группа, неопентильная группа, н-гексильная группа, изогексильная группа, 3,3-диметилбутильная группа, гептильная группа и октильная группа.
Определение «С3-С8-циклоалкильная группа» относится к циклоалкильной группе из 3-8 атомов углерода; могут быть названы, например, циклопропильная группа, циклобутильная группа, циклопентильная группа и циклогексильная группа.
Определение «С3-С8-циклоалкил-С1-С3-алкильная группа» (которая может быть замещена атомом галогена или алкильной группой), если не оговорено особо, относится к С1-С3-алкильной группе, замещенной С3-С8-циклоалкильной группой, которая может быть замещена 1-4 одинаковыми или разными атомами галогена или С1-С3-алкильной группой; могут быть названы, например, циклопропилметильная группа, 1-циклопропилэтильная группа, 2-циклопропилэтильная группа, 1-циклопропилпропильная группа, 2-циклопропилпропильная группа, 3-циклопропилпропильная группа, циклобутилметильная группа, циклопентилметильная группа, циклогексилметильная группа, 2-хлорциклопропилметильная группа, 2,2-дихлорциклопропилметильная группа, 2-фторциклопропилметильная группа, 2,2-дифторциклопропилметильная группа, 2-метилциклопропилметильная группа, 2,2-диметилциклопропилметильная группа и 2-метилциклопропилэтильная группа.
Определение «С3-С8-циклоалкил-С1-С3-алкильная группа» относится к алкильной группе из 1-3 атомов углерода, замещенной циклоалкильной группой из 3-8 атомов углерода; могут быть названы, например, циклопропилметильная группа, 1-циклопропилэтильная группа, 2-циклопропилэтильная группа, 1-циклопропилпропильная группа, 2-циклопропилпропильная группа, 3-циклопропилпропильная группа, циклобутилметильная группа, циклопентилметильная группа и циклогексилметильная группа.
Определение «С1-С4-галогеналкильная группа» относится, если не оговорено особо, к линейной или разветвленной алкильной группе из 1-4 атомов углерода, замещенной 1-9 одинаковыми или разными атомами галогена; могут быть названы, например, фторметильная группа, хлорметильная группа, бромметильная группа, дифторметильная группа, трифторметильная группа, 2,2-дифторэтильная группа, 2,2,2-трифторэтильная группа и пентафторэтильная группа.
Определение «С2-С6-алкенильная группа» относится к линейной или разветвленной алкенильной группе из 2-6 атомов углерода; могут быть названы, например, этенильная группа, 1-пропенильная группа, 2-пропенильная группа, изопропенильная группа, 1-бутенильная группа, 2-бутенильная группа, 3-бутенильная группа и 2-пентенильная группа.
Определение «С2-С6-алкинильная группа» относится к линейной или разветвленной алкинильной группе из 2-6 атомов углерода; могут быть названы, например, этинильная группа, 2-пропинильная группа, 1-метил-2-пропинильная группа, 2-бутинильная группа, 3-бутинильная группа и 2-метил-3-бутинильная группа.
Определение «С2-С6-галогеналкенильная группа» относится, если не оговорено особо, к линейной или разветвленной алкенильной группе из 2-6 атомов углерода, замещенной 1-4 одинаковыми или разными атомами галогена; могут быть названы, например, 3-хлор-2-пропенильная группа и 2-хлор-2-пропенильная группа.
Определение «С1-С10-алкоксигруппа» относится к (алкил)-О-группе, где алкильный остаток имеет определенные выше значения и могут быть названы, например, метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, трет-бутоксигруппа, н-бутоксигруппа, втор-бутоксигруппа и изобутоксигруппа.
Определение «С1-С4-галогеналкоксигруппа» относится к (галогеналкил)-О-группе, где галогеналкильный остаток имеет определенные выше значения; можно назвать, например, дифторметоксигруппу, трифторметоксигруппу, 2,2-дифторэтоксигруппу и 2,2,2-трифторэтоксигруппу.
Определение «С3-С8-циклоалкилоксигруппа» относится к (циклоалкил)-О-группе, где циклоалкильный остаток имеет определенные выше значения; могут быть названы, например, циклопропилоксигруппа, циклобутилоксигруппа, циклопентилоксигруппа и циклогексилоксигруппа.
Определение «С3-С8-циклоалкил-С1-С3-алкилоксигруппа» относится к (циклоалкилалкил)-О-группе, где циклоалкилалкильный остаток имеет определенные выше значения; и могут быть названы, например, циклопропилметоксигруппа, 1-циклопропилэтоксигруппа, 2-циклопропилэтоксигруппа, 1-циклопропилпропоксигруппа, 2-циклопропилпропоксигруппа, 3-циклопропилпропоксигруппа, циклобутилметоксигруппа, циклопентилметоксигруппа и циклогексилметоксигруппа.
Определения «С2-С6-алкенилоксигруппа» и «С2-С6-алкинилоксигруппа», соответственно, относятся к (алкенил)-О-группе и (алкинил)-О-группе, в каждой из которых алкенильный или алкинильный остаток имеет определенные выше значения; могут быть названы, например, 2-пропенилоксигруппа и 2-пропинилоксигруппа.
Определение «С1-С10-алкоксииминогруппа» относится к (алкокси)-N-руппе, где алкоксиостаток имеет определенные выше значения; могут быть названы, например, метоксииминогруппа и этоксииминогруппа.
Определения «С1-С10-алкилтиогруппа», «С1-С10-алкилсульфинильная группа» и «С1-С10-алкилсульфонильная группа», соответственно, относятся к (алкил)-S-группе, (алкил)-SO-группе и (алкил)-SO2-группе, в каждой из которых алкильный остаток имеет определенные выше значения; могут быть названы, например, метилтиогруппа, этилтиогруппа, н-пропилтиогруппа, изопропилтиогруппа, метилсульфинильная группа, метилсульфонильная группа, этилсульфонильная группа, н-пропилсульфонильная группа и изопропилсульфонильная группа.
Определение «С1-С10-алкилсульфонилоксигруппа» относится к (алкилсульфонил)-О-группе, где алкилсульфонильный остаток имеет определенные выше значения; могут быть названы, например, метилсульфонилоксигруппа и этилсульфонилоксигруппа.
Определение C1-C10-алкоксикарбонильная группа относится к (алкокси)-СО-группе, в которой алкоксиостаток имеет определенные выше значения, и могут быть названы, например, метоксикарбонильная группа, этоксикарбонильная группа, н-пропоксикарбонильная группа и изопропоксикарбонильная группа.
Определение «С1-С6-ацильная группа» относится к линейной или разветвленной алифатической ацильной группе из 1-6 атомов углерода, и могут быть названы, например, формильная группа, ацетильная группа, пропионильная группа, изопропионильная группа, бутирильная группа и пивалоильная группа.
Определение «С1-С10-алкоксигруппа» относится к (ацил)-О-группе, в которой ацильный остаток имеет определенные выше значения; могут быть названы, например, ацетоксигруппа, пропионилоксигруппа, изопропионилоксигруппа и пивалоилоксигруппа.
Определения «С1-С4-галогеналкилкарбонильная группа», «С1-С4-галогеналкилтиогруппа» и «С1-С4-галогеналкилсульфонильная группа» относятся соответственно к (галогеналкил)-СО-группе, (галогеналкил)-S-группе и (галогеналкил)-SО2-группе, в каждой из которых галогеналкильный остаток имеет определенные выше значения, и могут быть названы, например, хлорацетильная группа, трифторацетильная группа, пентафторпропильная группа, дифторметилтиогруппа, трифторметилтиогруппа, хлорметилсульфонильная группа, дифторметилсульфонильная группа и трифторметилсульфонильная группа.
Определения «С1-С4-галогеналкилкарбонилоксигруппа» и «С1-С4-галогеналкилсульфонилоксигруппа» соответственно относятся к (галогеналкилкарбонил)-О-группе и (галогеналкилсульфонил)-О-группе, в каждой из которых галогеналкилкарбонильный остаток или галогеналкилсульфонильный остаток имеет определенные выше значения; и могут быть названы, например, хлорацетилоксигруппа, трифторацетилоксигруппа, хлорметилсульфонилоксигруппа и трифторметилсульфонилоксигруппа.
Определение «необязательно замещенная» в определениях (необязательно замещенная) фенильная группа, (необязательно замещенная) ароматическая гетероциклическая группа, (необязательно замещенная) феноксигруппа, (необязательно замещенная) ароматическая гетероциклическая оксигруппа, (необязательно замещенная) фенилтиогруппа, (необязательно замещенная) ароматическая гетероциклическая тиогруппа, (необязательно замещенная) фенилсульфонильная группа, (необязательно замещенная) фенилсульфонилоксигруппа, (необязательно замещенная) ароматическая гетероциклическая сульфонильная группа, (необязательно замещенная) бензилкарбонильная группа, (необязательно замещенная) бензилкарбонилоксигруппа, (необязательно замещенная) бензилсульфонильная группа, (необязательно замещенная) бензоильная группа, (необязательно замещенная) бензоилоксигруппа, (необязательно замещенная) бензилоксикарбонильная группа и (необязательно замещенная) феноксикарбонильная группа, относится к группе, необязательно замещенной, например, атомом галогена, С1-С10-алкильной группой, С1-С4-галогеналкильной группой, С1-С10-алкоксиалкильной группой, С1-С10-алкоксигруппой, С1-С10-алкилтиогруппой, С1-С10-алкилсульфонильной группой, ацильной группой, С1-С10-алкоксикарбонильной группой, цианогруппой, карбамоильной группой (причем ее атом азота может быть замещен одинаковыми или разными С1-С10-алкильными группами), нитрогруппой или аминогруппой (причем ее атом азота может быть замещен одинаковыми или разными группами, выбранными из С1-С10-алкильных групп, С1-С6-ацильных групп, С1-С4-галогеналкилкарбонильных групп, С1-С10-алкилсульфонильных групп и С1-С4-галогеналкилсульфонильных групп).
Определение "5-6-членная ароматическая гетероциклическая группа, содержащая гетероатом, выбранный из атома азота, атома кислорода и атома серы", включает, например, фурильную группу, тиенильную группу, пирролильную группу, пиразолильную группу, изоксазолильную группу, изотиазолильную группу, оксазолильную группу, тиазолильную группу, имидазолильную группу, пиридильную группу, пиридазинильную группу, пиримидинильную группу, пиразинильную группу, триазинильную группу, триазолильную группу, оксадиазолильную группу и тиадиазолильную группу, каждая из которых содержит 1-3 гетероатома.
Определение "конденсированная ароматическая гетероциклическая группа" относится к группе, содержащей от 1 до 3 гетероатомов, произвольно выбранных из атома азота, атома кислорода и атома серы; могут быть названы, например, бензофурильная группа, бензотиенильная группа, индолильная группа, бензоксазолильная группа, бензотиазолильная группа, бензимидазолильная группа, бензизоксазолильная группа, бензизотиазолильная группа, индазолильная группа, хинолильная группа, изохинолильная группа, фталазинильная группа, хиноксалинильная группа, хиназолинильная группа, циннолинильная группа и бензотриазолильная группа.
Определение "ароматический гетероцикл" в (необязательно замещенной) ароматической гетероциклической группе, (необязательно замещенной) ароматической гетероциклической оксигруппе, (необязательно замещенной) ароматической гетероциклической тиогруппе и (необязательно замещенной) ароматической гетероциклической сульфонильной группе, относится к 5-6-членной группе, содержащей от 1 до 3 гетероатомов, выбранных случайным образом из атома азота, атома кислорода и атома серы; могут быть названы, например, фурильная группа, тиенильная группа, пирролильная группа, пиразолильная группа, изоксазолильная группа, изотиазолильная группа, оксазолильная группа, тиазолильная группа, имидазолильная группа, пиридильная группа, пиридазинильная группа, пиримидинильная группа, пиразинильная группа, триазинильная группа, триазолильная группа, оксадиазолильная группа и тиадиазолильная группа.
Фармацевтически приемлемая соль представляет собой соль соединения общей формулы [I], содержащую в структуре гидроксильную группу, карбоксильную группу, аминогруппу или другие подобные группы, с металлом или органическим основанием или с минеральной кислотой или органической кислотой. В качестве металлов могут быть названы щелочные металлы, такие как натрий, калий и др., и щелочноземельные металлы, такие как магний, кальций и др. В качестве органического основания можно назвать триэтиламин, диизопропиламин и др. В качестве минеральных кислот могут быть упомянуты соляная кислота, серная кислота и др. В качестве органической кислоты можно назвать уксусную кислоту, метансульфоновую кислоту, п-толуолсульфоновую кислоту и др.
В приведенной выше формуле [I] предпочтительно, когда
R1 и R2 могут быть одинаковыми или разными, и каждый из них представляет собой метильную группу или этильную группу;
каждый из R3, R4, R5 и R6 представляет собой атом водорода;
n равно 2; и
Y представляет собой тиофен-3-ильную группу [2- и 4-ое положения группы замещены одинаковыми или разными группами, выбранными из атомов галогена, алкильных групп, галогеналкильных групп, алкоксиалкильных групп, циклоалкильных групп, алкоксигрупп, галогеналкоксигрупп, ацильных групп, галогеналкилкарбонильных групп, алкоксикарбонильных групп, цианогрупп и карбамоильной группы (причем ее атом азота может быть замещен одинаковыми или разными алкильными группами)], или
пиразол-4-ильную группу [3- и 5-ое положения группы замещены одинаковыми или разными группами, выбранными из атомов галогена, алкильных групп, галогеналкильных групп, алкоксиалкильных групп, циклоалкильных групп, алкоксигрупп, галогеналкоксигрупп, циклоалкилалкилоксигрупп, необязательно замещенной феноксигруппы, алкилтиогрупп, алкилсульфонильных групп, ацильных групп, галогеналкилкарбонильных групп, алкоксикарбонильных групп, цианогруппы и карбамоильной группы (причем ее атом азота может быть замещен одинаковыми или разными алкильными группами); 1-ое положение замещено атомом водорода, алкильной группой, алкильной группой, монозамещенной группой, выбранной из группы заместителей β, галогеналкильной группой, циклоалкильной группой, алкенильной группой, алкинильной группой, алкилсульфонильной группой, алкилсульфонильной группой, монозамещенной группой, выбранной из группы заместителей γ, галогенсульфонильной группой, необязательно замещенной фенильной группой, необязательно замещенной ароматической гетероциклической группой, необязательно замещенной фенилсульфонильной группой, необязательно замещенной ароматической гетероциклической сульфонильной группой, ацильной группой, галогеналкилкарбонильной группой, необязательно замещенной бензилкарбонильной группой, необязательно замещенной бензоильной группой, алкоксикарбонильной группой, необязательно замещенной бензилоксикарбонильной группой, необязательно замещенной феноксикарбонильной группой или карбамоильной группой (причем ее атом азота может быть замещен одинаковыми или разными группами, выбранными из алкильных групп и необязательно замещенной фенильной группы)], или
пиразол-5-ильную группу [4-ое положение группы замещено атомом галогена, алкильной группой, галогеналкильной группой, алкоксиалкильной группой, галогеналкоксигруппой, ацильной группой, галогеналкилкарбонильной группой, алкоксикарбонильной группой, цианогруппой или карбамоильной группой (причем ее атом азота может быть замещен одинаковыми или разными алкильными группами); 1-ое положение замещено атомом водорода, алкильной группой, алкильной группой, монозамещенной группой, выбранной из группы заместителей β, галогеналкильной группой, циклоалкильной группой или необязательно замещенной фенильной группой], или
изоксазол-4-ильную группу [3- и 5-ое положения группы замещены одинаковыми или разными группами, выбранными из атомов галогена, алкильных групп, галогеналкильных групп, алкоксиалкильных групп, циклоалкильных групп, алкоксигрупп, галогеналкоксигрупп, алкилтиогрупп, алкилсульфонильных групп ацильных групп, галогеналкилкарбонильных групп, алкоксикарбонильных групп, цианогруппы и карбамоильной группы (причем ее атом азота может быть замещен одинаковыми или разными алкильными группами)], или
изотиазолил-4-ильную группу [3- и 5-ое положения группы замещены одинаковыми или разными группами, выбранными из атомов галогена, алкильных групп, галогеналкильных групп, алкоксиалкильных групп, циклоалкильных групп, алкоксигрупп, галогеналкоксигрупп, необязательно замещенной феноксигруппы, алкилтиогрупп, алкилсульфонильных групп, ацильных групп, галогеналкилкарбонильных групп, алкоксикарбонильных групп, цианогруппы и карбамоильной группы (причем ее атом азота может быть замещен одинаковыми или разными алкильными группами)], или
пиридин-3-ильную группу [2- и 4-ое положения группы замещены одинаковыми или разными группами, выбранными из атомов галогена, алкильных групп, галогеналкильных групп, алкоксиалкильных групп, циклоалкильных групп, алкоксигрупп, галогеналкоксигрупп, алкилтиогрупп, алкилсульфонильных групп, ацильных групп, галогеналкилкарбонильных групп, алкоксикарбонильных групп, цианогруппы и карбамоильной группы (причем атом азота может быть замещен одинаковыми или разными алкильными группами)], или
пиримидин-5-ильную группу [(4- и 6-ое положения группы замещены одинаковыми или разными группами, выбранными из атомов галогена, алкильных групп, галогеналкильных групп, алкоксиалкильных групп, циклоалкильных групп, алкоксигрупп, галогеналкоксигрупп, алкилтиогрупп, алкилсульфонильных групп, ацильных групп, галогеналкилкарбонильных групп, алкоксикарбонильных групп, цианогруппы и карбамоильной группы (причем ее атом азота может быть замещен одинаковыми или разными алкильными группами)].
Далее типичные примеры соединения настоящего изобретения, представленные формулой [I], приведены в таблицах 1-10. Однако рассматриваемое соединение не ограничено этими примерами.
Приведенные ниже сокращенные выражения, используемые в таблицах, относятся к следующим группам:
Например, (4-Cl)Ph означает 4-хлорфенильную группу и 3-Hex означает 3-гексильную группу.
Когда настоящее изобретение содержит гидроксильную группу в качестве заместителя, могут существовать кето-енольные таутомеры. Любые из этих таутомеров и любые смеси этих таутомеров относятся к настоящему соединению.
Соединение настоящего изобретения, представленное общей формулой [I], может быть получено в соответствии со способами, представленными ниже; однако соединение может быть получено также и другими способами.
<Способ получения 1>
Стадия 1 - стадия 5
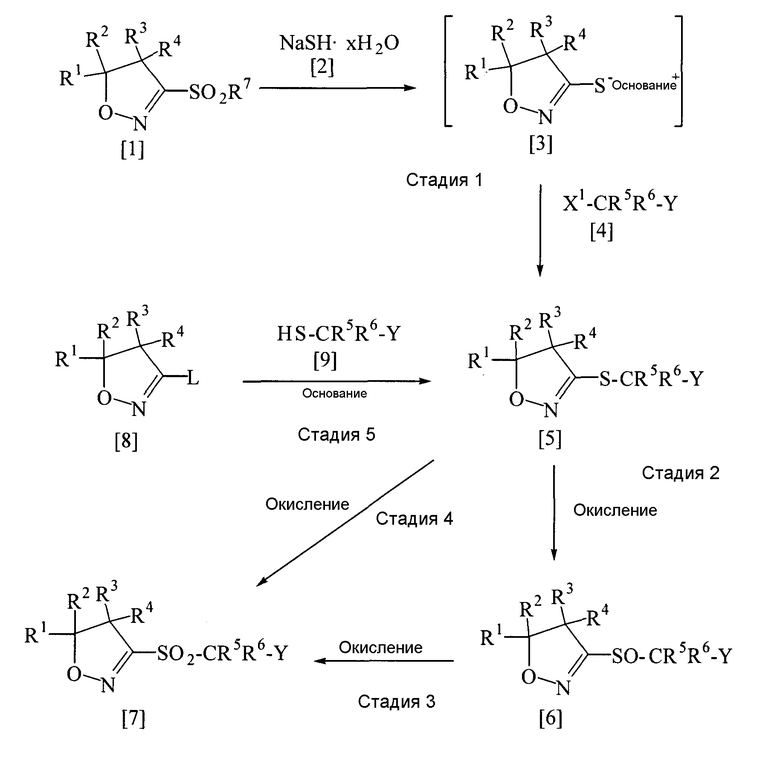
В приведенной выше схеме получения заместители R1, R2, R3, R4, R5, R6 и Y имеют определения, данные выше; Х1 представляет собой атом галогена; R7 представляет собой С1-С4-алкильную группу, необязательно замещенную фенильную группу или необязательно замещенную бензильную группу; L представляет собой уходящую группу, такую как атом галогена, С1-С4-алкилсульфонильную группу, необязательно замещенную фенилсульфонильную группу, необязательно замещенную бензилсульфонильную группу и др.; целое число х равно 1 или более.
Приведенный выше способ получения ниже описан более подробно на каждой стадии.
(Стадия 1)
Сульфидное производное, представленное общей формулой [5], может быть получено реакцией соединения, представленного общей формулой [1], с гидратом гидросульфида натрия, представленным общей формулой [2], в присутствии или в отсутствие растворителя (предпочтительно в подходящем растворителе) в присутствии соли с получением основания меркаптана, представленного общей формулой [3], в реакционной системе, а затем без выделения соль меркаптана [3] вводят в реакцию с галогенированным производным, представленным общей формулой [4] (в этом случае может быть добавлен агент, образующий радикал, например ронгалит: СН2(ОН)SO2Na.2Н2О).
Температура реакции в каждой реакции равна любой температуре между 0°С и температурой кипения с обратным холодильником каждой реакционной системы и предпочтительно равна 10-100°С. Время реакции меняется в зависимости от используемых соединений, и обычно составляет от 0,5 до 24 час.
Что касается количеств используемых в каждой реакции реагентов, то каждое соединение, представленное общей формулой [2], и соединение, представленное общей формулой [4], используются в количестве от 1 до 3 эквивалентов на эквивалент соединения, представленного общей формулой [1], и когда используется основание, то оно используется в количестве от 0,5 до 3 эквивалентов.
В качестве растворителя можно назвать, например, простые эфиры, такие как диоксан, тетрагидрофуран (ТГФ) и др.; галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлорбензол, дихлорбензол и др.; амиды, такие как N,N-диметилацетамид, N,N-диметилформамид, N-метил-2-пирролидон и др.; сернистые соединения, такие как диметилсульфоксид, сульфолан и т.д.; ароматические углеводороды, такие как бензол, толуол, ксилол и т.д.; спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, трет-бутанол и т.д.; кетоны, такие как ацетон, 2-бутанон и т.д.; нитрилы, такие как ацетонитрил и т.д.; воду, а также их смеси.
В качестве основания можно использовать, например, гидриды металлов, такие как гидрид натрия и т.д.; амиды щелочных металлов, такие как амид натрия, диизопропиламид лития и т.д.; органические основания, такие как пиридин, триэтиламин, 1,8-диазабицикло[5.4.0]-7-ундецен и т.д.; гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия и т.д.; гидроксиды щелочноземельных металлов, такие как гидроксид кальция, гидроксид магния и т.д.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия и т.д.; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия и др., и алкоголяты металлов, такие как метоксид натрия, трет-бутоксид калия и т.д.
(Стадия 2)
Сульфоксидное производное, представленное общей формулой [6], может быть получено при взаимодействии сульфидного производного, представленного общей формулой [5], с окисляющим агентом в подходящем растворителе.
Температура реакции равна любой температуре между 0°С и температурой кипения с обратным холодильником каждой реакционной системы и предпочтительно равна 0-60°С. Время реакции меняется в зависимости от используемых соединений и обычно составляет от 1 до 72 час.
Что касается количеств реагентов, используемых в каждой реакции, то окисляющий агент используют в количестве от 1 до 3 эквивалентов на эквивалент соединения, представленного общей формулой [5].
В качестве растворителя можно назвать, например, галогенированные углеводороды, такие как дихлорметан, хлороформ, дихлорэтан, тетрахлорид углерода, хлорбензол, дихлорбензол и т.д.; простые эфиры, такие как диоксан, тетрагидрофуран (ТГФ), диметоксиэтан, диэтиловый эфир и др.; амиды, такие как N,N-диметилацетамид, N,N-диметилформамид, N-метил-2-пирролидон и др.; спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, трет-бутанол и т.д.; кетоны, такие как ацетон, 2-бутанон и т.д.; нитрилы, такие как ацетонитрил и т.д.; уксусная кислота; вода, а также их смеси.
В качестве окисляющего агента можно назвать, например, органические пероксиды, такие как м-хлорнадбензойная кислота, надмуравьиная кислота, надуксусная кислота и т.д., и неорганические пероксиды, такие как перекись водорода, перманганат калия, периодат натрия и т.д.
(Стадия 3)
Сульфоновое производное, представленное общей формулой [7], может быть получено при взаимодействии сульфоксидного производного, представленного общей формулой [6], с окисляющим агентом в подходящем растворителе.
Температура реакции равна любой температуре между 0°С и температурой кипения с обратным холодильником реакционной системы и предпочтительно равна 0-60°С. Время реакции меняется в зависимости от используемых соединений и обычно составляет от 1 до 72 час.
Что касается количеств реагентов, используемых в реакции, то окисляющий агент используют в количестве от 1 до 3 эквивалентов на эквивалент соединения, представленного общей формулой [6].
В качестве растворителя и окисляющего агента могут быть названы те же растворители и окисляющие агенты, которые приведены для стадии 2.
(Стадия 4)
Сульфоновое производное, представленное общей формулой [7], может быть получено при взаимодействии сульфидного производного, представленного общей формулой [5], с соответствующим количеством окисляющего агента в подходящем растворителе без выделения сульфоксидного производного, представленного общей формулой [6].
Температура реакции равна любой температуре между 0°С и температурой кипения с обратным холодильником реакционной системы и предпочтительно равна 0-60°С. Время реакции меняется в зависимости от используемых соединений и обычно составляет от 1 до 72 час.
Что касается количеств реагентов, используемых в реакции, то окисляющий агент используют в количестве от 1 до 3 эквивалентов на эквивалент соединения, представленного общей формулой [5].
В качестве растворителя и окисляющего агента могут быть названы те же растворители и окисляющие агенты, которые приведены для стадии 2.
(Стадия 5)
Сульфидное производное, представленное общей формулой [5], может быть получено реакцией соединения, представленного общей формулой [8], с меркаптановым производным, представленным общей формулой [9], в присутствии или в отсутствие растворителя (предпочтительно в подходящем растворителе) в присутствии основания.
Температура реакции равна любой температуре между 0°С и температурой кипения с обратным холодильником реакционной системы и предпочтительно составляет от 10 до 100°С. Время реакции меняется в зависимости от используемых соединений и составляет от 0,5 до 24 часов.Что касается количеств используемых в реакции реагентов, то соединение, представленное общей формулой [9], используется в количестве от 1 до 3 эквивалентов на эквивалент соединения, представленного общей формулой [8], а основание используется в количестве от 0,5 до 3 эквивалентов.
В качестве растворителя можно назвать, например, простые эфиры, такие как диэтиловый эфир, диметоксиэтан, диоксан, тетрагидрофуран (ТГФ) и др.; галогенированные углеводороды, такие как дихлорметан, хлороформ, тетрахлорид углерода, дихлорэтан, хлорбензол, дихлорбензол и др.; амиды, такие как N,N-диметилацетамид, N,N-диметилформамид, N-метил-2-пирролидинон и т.д.; серусодержащие соединения, такие как диметилсульфоксид, сульфолан и т.д.; ароматические углеводороды, такие как бензол, толуол, ксилол и т.д.; спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, трет-бутанол и т.д.; кетоны, такие как ацетон, 2-бутанон и т.д.; нитрилы, такие как ацетонитрил и т.д.; воду, а также их смеси.
В качестве основания можно назвать, например, гидриды металлов, такие как гидрид натрия и т.д.; амиды щелочных металлов, такие как амид натрия, диизопропиламид лития и т.д.; органические основания, такие как пиридин, триэтиламин, 1,8-диазабицикло[5.4.0]-7-ундецен и т.д.; гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия и т.д.; гидроксиды щелочноземельных металлов, такие как гидроксид кальция, гидроксид магния и т.д.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия и т.д.; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия и т.д., а также алкоголяты металлов, такие как метоксид натрия, трет-бутоксид калия и т.д.
Соединение общей формулы [8], в котором L представляет собой атом галогена, то есть соединение [12], может быть получено способом, представленным следующей стадией 6. Если необходимо, то смесь соединения [12] и соединения [13] подвергают разделению и очистке с целью выделения соединения [12].
(Стадия 6)
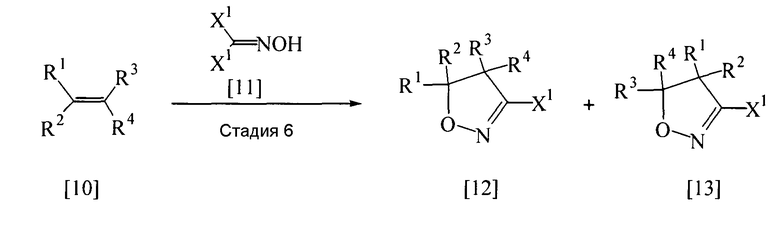
В приведенной выше реакции заместители X1, R1, R2, R3 и R4 имеют те же определения, которые приведены выше.
Изоксазолиновые соединения, представленные общими формулами [12] и [13], могут быть получены реакцией олефинового производного, представленного общей формулой [10], с производным оксима, представленным общей формулой [11], в присутствии или в отсутствие растворителя (предпочтительно в подходящем растворителе) в присутствии основания. Когда каждый из заместителей R3 и R4 представляет собой атом водорода, предпочтительно может быть получено изоксазолиновое соединение, представленное общей формулой [12].
Температура реакции равна любой температуре между 0°С и температурой кипения с обратным холодильником реакционной системы и предпочтительно составляет от 10 до 80°С. Время реакции меняется в зависимости от используемых соединений и составляет от 0,5 час до 2 недель.
Что касается количеств используемых в реакции реагентов, то соединение, представленное общей формулой [10], используется в количестве от 1 до 3 эквивалентов на один эквивалент соединения, представленного общей формулой [11].
В качестве растворителя можно назвать, например, простые эфиры, такие как диметиловый эфир этиленгликоля, диэтиловый эфир этиленгликоля, диэтиловый эфир, диоксан, тетрагидрофуран и т.д.; галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлорбензол, дихлорбензол и т.д.; ароматические углеводороды, такие как бензол, толуол, ксилол и т.д.; эфиры уксусной кислоты, такие как этилацетат, бутилацетат и т.д.; воду, а также их смеси.
В качестве основания можно назвать, например, гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия и т.д.; гидроксиды щелочноземельных металлов, такие как гидроксид кальция, гидроксид магния и т.д.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия и т.д.; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия и т.д.; ацетаты щелочных металлов, такие как ацетат натрия, ацетат калия и др.; фториды щелочных металлов, такие как фторид натрия, фторид калия и др.; и органические основания, такие как пиридин, триэтиламин, 1,8-диазабицикло[5.4.0]-7-ундецен и др.
В приведенном выше способе получения соединение, представленное общей формулой [10], используемое в качестве промежуточного соединения, может быть доступно в продаже или может быть получено известной реакцией, такой как реакция Виттига или др. Соединение, представленное общей формулой [11], может быть получено, например, способом, описанным в Liebigs Annalen der Chemie, 985 (1989).
Соединение, представленное общей формулой [1], может быть получено из названного выше соединения, представленного общей формулой [12], следующим способом.
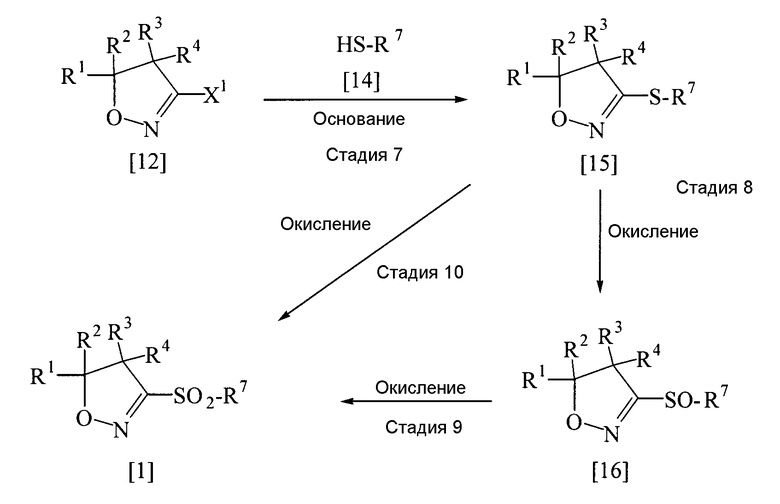
В приведенной выше реакции заместители Х1, R1, R2, R3, R4 и R7 имеют определения, приведенные выше.
Соединение, представленное общей формулой [15], может быть получено с помощью описанной выше стадии 5; соединение, представленное общей формулой [16], может быть получено описанной выше стадией 2, и соединение, представленное общей формулой [1], может быть получено из соединения [15] с помощью описанной выше стадии 4 или из соединения [16] с помощью описанной выше стадии 3.
В качестве растворителя, основания и окисляющего агента могут быть использованы те же растворители, основания и окисляющие агенты, которые были перечислены для стадий 2, 3, 4 или 5.
Соединение, представленное общей формулой [4], где заместитель R6 представляет собой атом водорода, то есть соединение, представленное общей формулой [21], может быть получено следующим способом.
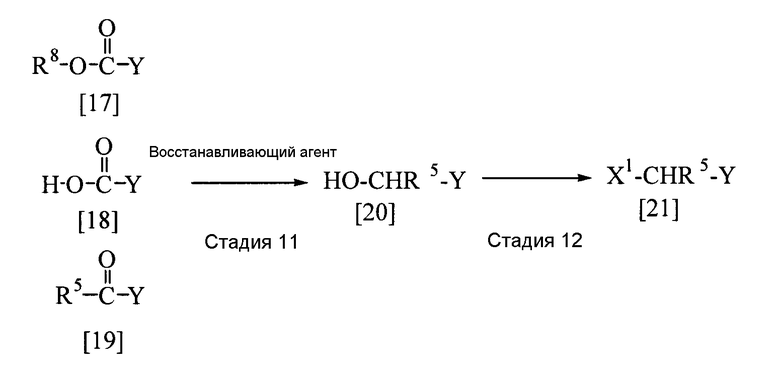
В приведенной выше реакции заместители R5, Х1 и Y имеют определения, приведенные выше, и заместитель R8 представляет собой алкильную группу.
(Стадия 11)
Соединение, представленное общей формулой [20], может быть получено реакцией соединения [17], [18] или [19] с восстанавливающим агентом в растворителе.
Эту реакцию обычно проводят при температуре от -60 до 150°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то восстанавливающий агент используют в количестве желательно от 0,5 до 2 эквивалентов на эквивалент соединения [17], [18] или [19]; однако количество может меняться соответствующим образом в зависимости от условий реакции.
В качестве восстанавливающего агента могут быть названы, например, гидриды металлов (например, диизобутилалюминийгидрид) и комплексные соединения металлов и водорода (например, борогидрид натрия и литийалюминийгидрид), при получении соединения [20] из соединения [17], и гидриды металлов (например, диизобутилалюминийгидрид), комплексные соединения металлов и водорода (например, борогидрид натрия и литийалюминийгидрид) и диборан, при получении соединения [20] из соединения [18] или [19].
В качестве растворителя можно назвать, например, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан и т.д.; ароматические углеводороды, такие как бензол, толуол и т.д., и спирты, такие как метанол, этанол и т.д.
(Стадия 12)
Соединение, представленное общей формулой [21], может быть получено реакцией соединения [20] с галогенирующим агентом в растворителе.
Эту реакцию обычно проводят при температуре от -50 до 100°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то галогенирующий агент используют в количестве желательно от 1 до 3 эквивалентов на эквивалент соединения [20]; однако количество может меняться соответствующим образом в зависимости от условий реакции.
В качестве галогенирующего агента можно назвать, например, хлорид водорода, бромид водорода, трихлорид фосфора, трибромид фосфора и тионилхлорид.
В качестве растворителя могут быть упомянуты, например, галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода и т.д.; кислоты, такие как уксусная кислота и т.д., и простые эфиры, такие как тетрагидрофуран и т.д.
Соединение, представленное общей формулой [4], может быть получено следующим способом.
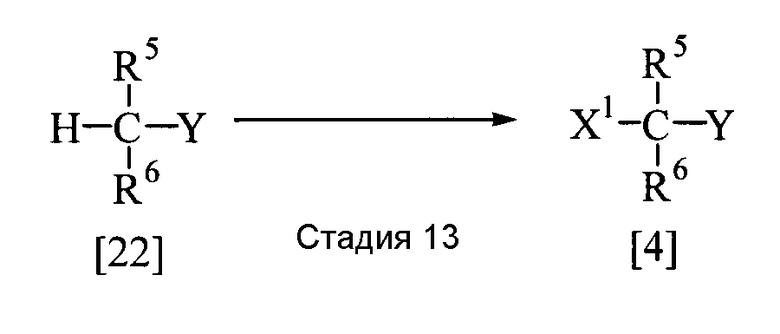
В приведенной выше реакции заместители R5, R6, Х1 и Y имеют определения, приведенные выше.
Соединение, представленное общей формулой [4], может быть получено реакцией соединения [22] с галогенирующим агентом в растворителе в присутствии или в отсутствие катализатора.
Эту реакцию обычно проводят при температуре от 30 до 150°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то галогенирующий агент используют в количестве желательно от 1 до 10 эквивалентов на один эквивалент соединения [22]; однако количество галогенирующего агента может меняться соответствующим образом в зависимости от условий реакции. Катализатор используют в количестве от 0,01 до 0,5 эквивалентов.
В качестве галогенирующего агента могут быть названы, например, галогены, такие как бром, хлор и т.д.; N-галогенсукцинимиды, такие как N-бромсукцинимид и т.д., и соли пиридина, такие как пербромид пиридиния и т.д.
В качестве растворителя могут быть названы, например, галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлорбензол, дихлорбензол и т.д.; амиды, такие как N,N-диметилацетамид, N,N-диметилформамид, N-метил-2-пирролидинон и т.д.; серосодержащие соединения, такие как диметилсульфоксид, сульфолан и т.д., и карбоновые кислоты, такие как муравьиная кислота, уксусная кислота и т.д.
В качестве катализатора могут быть названы, например, перекись бензоила, α,α-азобисизобутиронитрил, а также их смесь.
Соединение, представленное общей формулой [4], в которой каждый из заместителей R5 и R6 представляет собой атом водорода, то есть соединение, представленное общей формулой [24], может быть получено следующим способом.
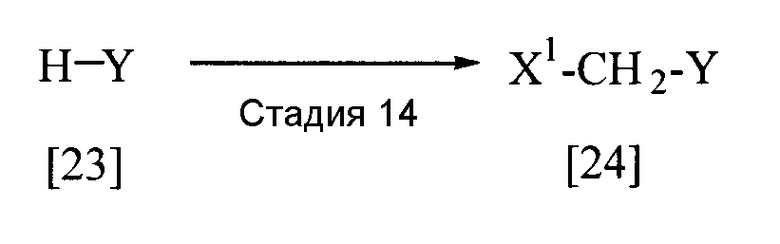
В приведенной выше реакции заместители Х1 и Y имеют определения, приведенные выше.
Соединение, представленное общей формулой [24], может быть получено реакцией соединения [23], галогенида водорода и формальдегида или параформальдегида в растворителе в присутствии или в отсутствие кислоты Льюиса в соответствии со способом, описанным в публикациях Org. Synth., III, 557 (1955), или J. Am. Chem. Soc., 72, 2216 (1950), или при взаимодействии соединения [23] с галогенметиловым эфиром в растворителе в присутствии кислоты Льюиса в соответствии со способом, описанным в публикации J. Am. Chem. Soc., 97, 6155 (1975).
Эту реакцию обычно проводят при температуре от -40 до 150°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то галогенид водорода, формальдегид, параформ, кислота Льюиса или галогенметиловый эфир используют в количестве желательно от 1 до 2 эквивалентов на эквивалент соединения [23]; однако количество первого может меняться соответствующим образом в зависимости от условий реакции.
В качестве кислоты Льюиса можно назвать, например, тетрахлорид титана, хлорид цинка, хлорид алюминия и бромид цинка.
В качестве галогенида водорода можно назвать хлора водород, брома водород и иода водород.
В качестве растворителя могут быть названы, например, галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлороформ и т.д.; алифатические углеводороды, такие как гексан, гептан и т.д.; простые эфиры, такие как диоксан, тетрагидрофуран и т.д.; карбоновые кислоты, такие как уксусная кислота и т.д.; дисульфид углерода, а также их смеси.
Соединение, представленное общей формулой [19], в котором заместитель R5 представляет собой атом водорода, то есть соединение, представленное общей формулой [25], может быть получено следующим способом.
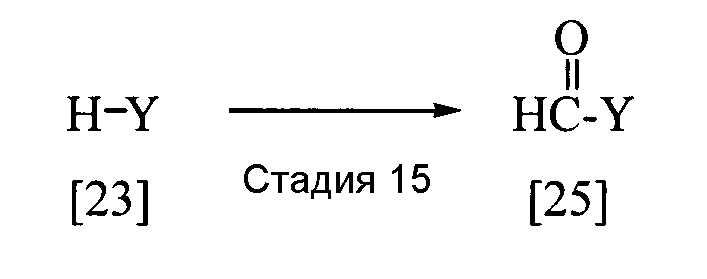
В приведенной выше реакции заместители Y имеют определения, приведенные выше.
Соединение, представленное общей формулой [25], может быть получено реакцией соединения [23] с N,N-диметилформамидом в присутствии фосфорилхлорида, фосгена или тионилхлорида в присутствии или в отсутствие растворителя по Вильсмейеру, как описано в Org. Synth., IV, 831 (1963), или при взаимодействии соединения [23] с дигалогенметиловым эфиром в растворителе в присутствии кислоты Льюиса, а затем проведением гидролиза в соответствии со способом, описанным в Chem. Ber., 93, 88 (1960).
Эту реакцию обычно проводят при температуре от -40 до 150°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то фосфорилхлорид, фосген, тионилхлорид, N,N-диметилформамид, кислота Льюиса или галогенметиловый эфир используют в количестве желательно от 1 до 2 эквивалентов на эквивалент соединения [23]; однако количество первого может меняться соответствующим образом в зависимости от условий реакции.
В качестве кислоты Льюиса можно назвать, например, тетрахлорид титана, тетрахлорид олова, хлорид цинка, хлорид алюминия и бромид цинка.
В качестве растворителя могут быть названы, например, галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлороформ и т.д.; алифатические углеводороды, такие как гексан, гептан и т.д.; простые эфиры, такие как диоксан, тетрагидрофуран и т.д.; карбоновые кислоты, такие как уксусная кислота и т.д.; амиды, такие как N,N-диметилформамид и т.д.; дисульфид углерода, а также их смеси.
Соединения, представленные общими формулами [17], [18], [19] и [20] могут быть получены следующим способом.
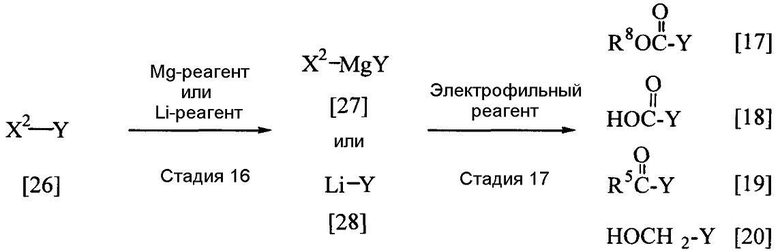
В приведенной выше реакции заместители R5, R8 и Y имеют определения, приведенные выше, и Х2 представляет собой атом хлора, атом брома или атом иода.
Соединения, представленные общими формулами [17], [18], [19] и [20], могут быть получены реакцией соединения [26] с магниевым реагентом в присутствии или в отсутствие растворителя, с получением соединения [27], а затем при взаимодействии соединения [27] с электрофильным реагентом в соответствии со способом, описанным в J.Org. Chem., 65, 4618 (2000), или при взаимодействии соединения [26] c н-бутиллитием в растворителе с получением соединения [28], а затем реакцией соединения [28] с электрофильным реагентом в соответствии со способом, описанным в Synth. Commun., 24(2), 253 (1994).
Эту реакцию обычно проводят при температуре от -100 до 150°С в течение от 10 мин до 24 час.Что касается количеств используемых в реакции реагентов, то количество магниевого реагента или литиевого реагента составляет желательно от 1 до 5 эквивалентов на эквивалент соединения [26], а количество электрофильного реагента составляет желательно от 1 до 5 эквивалентов; однако эти количества могут меняться соответствующим образом в зависимости от условий реакции.
В качестве магниевого реагента можно назвать, например, металлический магний, изопропилмагнийбромид и диизопропилмагний.
В качестве литиевого реагента можно назвать, например, н-бутиллитий, втор-бутиллитий и трет-бутиллитий.
В качестве электрофильного реагента могут быть названы, например, сложные эфиры, такие как этилформиат, этилцианоформиат, этилацетат и т.д.; галогенангидриды кислот, такие как ацетилхлорид, метилхлорформиат и т.д.; амиды, такие как N,N-диметилформамид и т.д.; альдегиды, такие как параформальдегид и т.д., и диоксид углерода.
В качестве растворителей могут быть названы, например, галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлороформ и т.д.; алифатические углеводороды, такие как гексан, пентан и т.д.; простые эфиры, такие как диоксан, тетрагидрофуран и т.д., а также их смеси.
Среди соединений, представленных общими формулами [4], [17], [18], [19], [20], [22], [23], [26], [29] или [34], соединение, представленное общей формулой [31], может быть получено следующим способом.
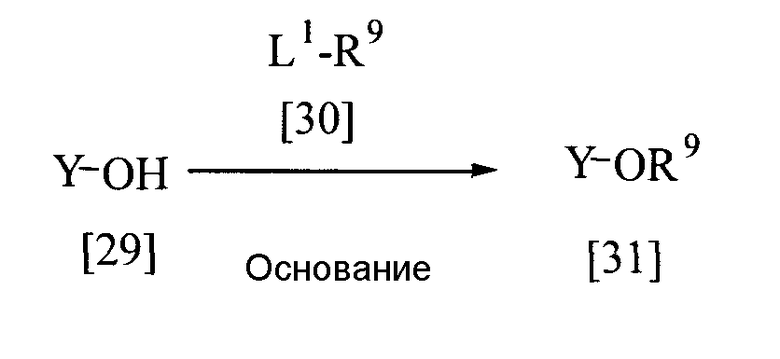
В приведенной выше реакции Y имеет определения, приведенные выше; R9 представляет собой алкильную группу, галогеналкильную группу, циклоалкильную группу, циклоалкилалкильную группу, алкоксикарбонилалкильную группу, необязательно замещенную бензильную группу, необязательно замещенную гетероциклическую алкильную группу, алкенил, необязательно замещенный гетероциклической алкильной группой, алкенильную группу, алкинильную группу, алкилсульфонильную группу, галогеналкилсульфонильную группу, необязательно замещенную ароматическую гетероциклическую группу, необязательно замещенную фенилсульфонильную группу, ацильную группу, галогеналкилкарбонильную группу, необязательно замещенную бензилкарбонильную группу или необязательно замещенную бензоильную группу; и L1 представляет собой уходящую группу, такую как атом галогена, С1-С4-алкилсульфонатную группу, С1-С4-алкилсульфонильную группу, необязательно замещенную бензилсульфонильную группу, необязательно замещенную фенилсульфонатную группу, необязательно замещенную бензилсульфонатную группу и т.д. Когда заместитель R9 представляет собой галогеналкильную группу, L1 представляет собой уходящую группу, имеющую более высокую реакционную способность, чем атом галогена, остающийся после галогеналкилирования. Например, когда заместитель R9 представляет собой CHF2-группу, L1 представляет собой атом хлора или атом брома, и когда заместитель R9 представляет собой CH2СF3-группу, L1 представляет собой атом хлора, атом брома, п-толуолсульфонилоксигруппу или метилсульфонилоксигруппу.
Соединение, представленное общей формулой [31], может быть получено при взаимодействии соединения [29] с соединением [30] в растворителе в присутствии основания.
Эту реакцию обычно проводят при температуре от 0 до 120°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то количество соединения [30] составляет от 1 до 20 эквивалентов на эквивалент соединения [29], а количество основания составляет от 1 до 3 эквивалентов.
В качестве основания могут быть названы, например, карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия и т.д.; гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия и т.д.; гидриды щелочных металлов, такие как гидрид калия, гидрид натрия и т.д.; алкоголяты щелочных металлов, такие как этоксид натрия, метоксид натрия и т.д., и органические основания, такие как 1,8-диазабицикло[5.4.0]-7-ундецен и т.д.
В качестве растворителя могут быть названы, например, галогенированные углеводороды, такие как дихлорметан, хлороформ и т.д.; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и т.д.; ароматические углеводороды, такие как бензол, толуол и т.д.; алифатические углеводороды, такие как гексан, гептан и т.д.; кетоны, такие как ацетон, метилизобутилкетон и т.д.; сложные эфиры, такие как этилацетат, метилацетат и т.д.; амиды, такие как N-метилпирролидон, N,N-диметилформамид и т.д.; сернистые соединения, такие как диметилсульфоксид, сульфолан и т.д.; нитрилы, такие как ацетонитрил и т.д., а также их смеси.
Среди соединений, представленных общими формулами [4], [17], [18], [19], [20], [22], [23], [26], [29] или [31], соединение, представленное общей формулой [34], может быть получено следующим способом.
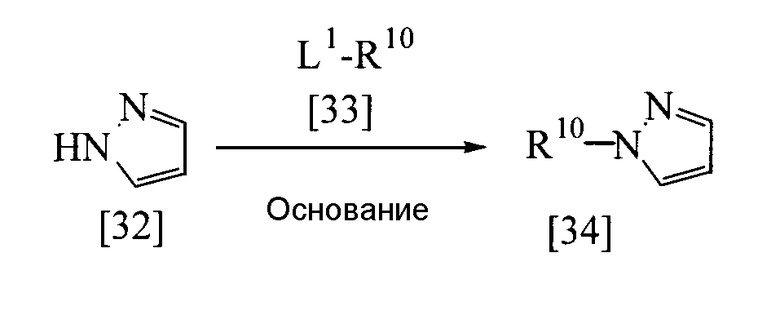
В приведенной выше реакции L1 имеет те же определения, которые приведены выше; заместитель R10 представляет собой алкильную группу, алкильную группу, монозамещенную группой, выбранной из группы заместителей β, галогеналкильную группу, циклоалкильную группу, алкенильную группу, алкинильную группу, алкилсульфинильную группу, алкилсульфонильную группу, алкилсульфонильную группу, монозамещенную группой, выбранной из группы заместителей γ, галогеналкилсульфонильную группу, необязательно замещенную фенильную группу, необязательно замещенную ароматическую гетероциклическую группу, необязательно замещенную фенилсульфонильную группу, необязательно замещенную ароматическую гетероциклическую сульфонильную группу, ацильную группу, галогеналкилкарбонильную группу, необязательно замещенную бензилкарбонильную группу, необязательно замещенную бензоильную группу, алкоксикарбонильную группу, необязательно замещенную бензилоксикарбонильную группу, необязательно замещенную феноксикарбонильную группу или карбамоильную группу (причем ее атом азота может быть замещен одинаковыми или разными группами, выбранными из алкильных групп и необязательно замещенной фенильной группы). Атомы углерода пиразольного кольца могут быть замещены 1-2 одинаковыми или разными группами, выбранными из группы заместителей α.
Соединение, представленное общей формулой [34], может быть получено при взаимодействии соединения [32] с соединением [33] в растворителе в присутствии основания.
Эту реакцию обычно проводят при температуре от 0 до 120°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то количество соединения [33] составляет от 1 до 20 эквивалентов на эквивалент соединения [32], а количество основания составляет от 1 до 3 эквивалентов.
В качестве основания и растворителя можно назвать, например, те же основания и растворители, которые упомянуты при получении соединения [31] из соединения [29].
Введение трифторметильной группы в Y может быть проведено в соответствии или на основании, например, способов, описанных в J. Chem. Soc. Perkin Trans., 1, 8, 2293-2299 (1990); J. Fluorine Chem., 50 (3), 411-426 (1990); J. Chem. Soc. Chem. Commun., 18, 1389-1391 (1993); J. Chem. Soc. Chem. Commun., 1, 53-54 (1992); Chem. Lett., 1719-1720 (1981); Chem. Pharm. Bull., 38 (9), 2446-2458 (1990); J. Chem. Soc. Perkin Trans., 1, 921-926 (1988); Heterocycles, 37 (2), 775-782 (1994); Tetrahedron Lett., 30 (16), 2133-2136 (1989); J. Chem. Soc. Perkin Trans., 1, 2755-2761 (1980); Heterocycles, 22 (1), 117-124 (1984); Eur. J. Med. Chem. Chim. Ther., 24, 249-258 (1989); Acta Chem. Scand. Ser. B, 38 (6), 505-508 (1984); J. Fluorine Chem., 21, 495-514 (1982); J. Chem. Soc. Chem. Commun., 10, 638-639 (1988); J. Fluorine Chem., 67 (1), 5-6 (1994); J. Heterocycl. Chem., 31 (6), 1413-1416 (1994); Chem. Heterocycl. Compd., 30 (5), 576-578 (1994); J. Fluorine Chem., 78 (2), 177-182 (1996); J. Heterocycl. Chem., 34 (2), 551-556 (1997); Tetrahedron, 55 (52), 15067-15070 (1999), и Synthesis, 11, 932-933 (1980).
Соединения, представленные общими формулами [4], [17], [18], [19], [20], [21], [22], [23], [24], [25], [26], [29] или [31], могут быть получены в соответствии или на основании, например, способов, описанных в Methoden der Organischen Chemie, Е6а, 16-185 (1994), когда Y представляет собой фурильную группу; Methoden der Organischen Chemie, Е6а, 186-555 (1994), когда Y представляет собой тиенильную группу; Methoden der Organischen Chemie, Е6а, 556-798 (1994), когда Y представляет собой пирролильную группу; Methoden der Organischen Chemie, Е8b, 399-763 (1994) и JP-A-2000-219679, когда Y представляет собой пиразолильную группу; Methoden der Organischen Chemie, Е8а, 45-225 (1993), когда Y представляет собой изоксазолильную группу; Methoden der Organischen Chemie, Е8а, 668-798 (1993), когда Y представляет собой изотиазолильную группу; Methoden der Organischen Chemie, Е8а, 891-1019 (1993), когда Y представляет собой оксазолильную группу; Methoden der Organischen Chemie, Е8b, 1-398 (1994), когда Y представляет собой тиазолильную группу; Methoden der Organischen Chemie, Е8с, 1-215 (1994), когда Y представляет собой имидазолильную группу; Methoden der Organischen Chemie, Е7а, 286-686 (1992), когда Y представляет собой пиридильную группу; Methoden der Organischen Chemie, Е9а, 557-682 (1997), когда Y представляет собой пиридазинильную группу; Methoden der Organischen Chemie, Е9b/1, 1-249 (1998), когда Y представляет собой пиримидинильную группу; Methoden der Organischen Chemie, Е9b/1, 250-372 (1998), когда Y представляет собой пиразинильную группу; Methoden der Organischen Chemie, Е9с, 530-796 (1998), когда Y представляет собой триазинильную группу; Methoden der Organischen Chemie, Е8d, 305-405 и 479-598 (1994), когда Y представляет собой триазолильную группу; Methoden der Organischen Chemie, Е8с, 397-818 (1994), когда Y представляет собой оксадиазолильную группу; Methoden der Organischen Chemie, Е8d, 59-305 (1994), когда Y представляет собой тиадиазолильную группу; Methoden der Organischen Chemie, Е6b1, 33-216 (1994), и в Международной патентной публикации WO-1997/29105, когда Y представляет собой бензофурильную группу; Methoden der Organischen Chemie, Е6b1, 217-322 (1994), когда Y представляет собой бензотиенильную группу; Methoden der Organischen Chemie, Е6b1, 546-848 (1994), Methoden der Organischen Chemie, Е6b2, 849-1336 (1994), и в Международной патентной публикации WO-1997/42188-А1, когда Y представляет собой индолильную группу; Methoden der Organischen Chemie, Е8а, 1020-1194 (1993), когда Y представляет собой бензоксазолильную группу; Methoden der Organischen Chemie, Е8b, 865-1062 (1994), когда Y представляет собой бензотиазолильную группу; Methoden der Organischen Chemie, Е8с, 216-391 (1994), когда Y представляет собой бензимидазолильную группу; Methoden der Organischen Chemie, Е8а, 226-348 (1993), когда Y представляет собой бензизоксазолильную группу; Methoden der Organischen Chemie, Е8а, 799-852 (1993), когда Y представляет собой бензизотиазолильную группу; Methoden der Organischen Chemie, Е8b, 764-864 (1994), когда Y представляет собой индазолильную группу; Methoden der Organischen Chemie, Е7а, 290-570 (1991), когда Y представляет собой хинолильную группу; Methoden der Organischen Chemie, Е7а, 571-758 (1991), когда Y представляет собой изохинолильную группу; Methoden der Organischen Chemie, Е9а, 744-789 (1997), когда Y представляет собой фталазинильную группу; Methoden der Organischen Chemie, Е9b/2, 93-265 (1998), когда Y представляет собой хиноксалинильную группу; Methoden der Organischen Chemie, Е9b/2, 1-192 (1998), когда Y представляет собой хиназолинильную группу; Methoden der Organischen Chemie, Е9а, 683-743 (1997), когда Y представляет собой циннолинильную группу, и Methoden der Organischen Chemie, Е8d, 406-478 (1994), когда Y представляет собой бензотриазолильную группу.
<Способ получения 2>
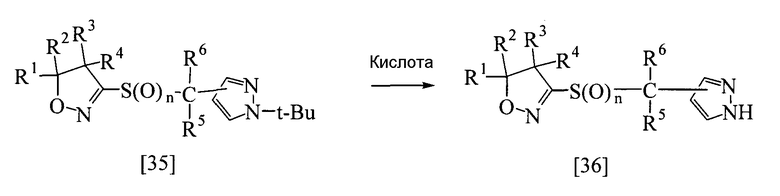
В приведенной выше реакции заместители R1, R2, R3, R4, R5 и R6 имеют определения, приведенные выше. Атомы углерода пиразольного кольца могут быть замещены 1-2 одинаковыми или разными группами, выбранными из группы заместителей α.
Соединение настоящего изобретения, представленное общей формулой [36], может быть получено реакцией соединения [35] настоящего изобретения, полученного способом получения 1, с кислотой в растворителе.
Эту реакцию обычно проводят при температуре от 0 до 120°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то количество кислоты составляет от 1 до 10 эквивалентов на эквивалент соединения [35]; однако это количество может меняться соответствующим образом в зависимости от условий реакции.
В качестве кислоты могут быть упомянуты, например, хлористоводородная кислота, бромистоводородная кислота и трифторуксусная кислота.
В качестве растворителя могут быть названы, например, галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлорбензол, дихлорбензол и т.д.; амиды, такие как N,N-диметилацетамид, N,N-диметилформамид, N-метил-2-пирролидинон и т.д.; серосодержащие соединения, такие как диметилсульфоксид, сульфолан и т.д.; карбоновые кислоты, такие как муравьиная кислота, уксусная кислота и т.д., и вода.
<Способ получения 3>
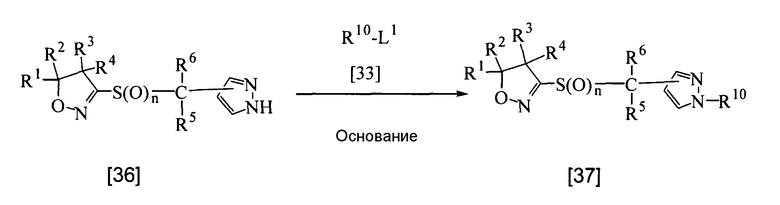
В приведенной выше реакции n, L1, R1, R2, R3, R4, R5, R6 и R10 имеют определения, приведенные выше. Атомы углерода пиразольного кольца могут быть замещены 1-2 одинаковыми или разными группами, выбранными из группы заместителей α.
Соединение настоящего изобретения, представленное общей формулой [37], может быть получено реакцией соединения настоящего изобретения [36] с соединением [33] в растворителе в присутствии основания.
Что касается количеств используемых в реакции реагентов, то количество соединения [33] составляет от 1 до 3 эквивалентов на эквивалент соединения, представленного общей формулой [36], а количество основания составляет от 1 до 3 эквивалентов.
В качестве растворителей могут быть названы, например, простые эфиры, такие как диоксан, тетрагидрофуран (ТГФ) и др.; галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлорбензол, дихлорбензол и др.; амиды, такие как N,N-диметилацетамид, N,N-диметилформамид, N-метил-2-пирролидинон и т.д.; серосодержащие соединения, такие как диметилсульфоксид, сульфолан и т.д.; ароматические углеводороды, такие как бензол, толуол, ксилол и т.д.; спирты, такие как метанол, этанол, пропанол, изопропанол, бутанол, трет-бутанол и т.д.; кетоны, такие как ацетон, 2-бутанон и т.д.; нитрилы, такие как ацетонитрил и т.д.; вода, а также их смеси.
В качестве основания можно назвать, например, гидриды металлов, такие как гидрид натрия и т.д.; амиды щелочного металла, такие как амид натрия, диизопропиламид лития и т.д.; органические основания, такие как пиридин, триэтиламин, 1,8-диазабицикло[5.4.0]-7-ундецен и т.д.; гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия и т.д.; гидроксиды щелочноземельных металлов, такие как гидроксид кальция, гидроксид магния и т.д.; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия и т.д.; гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия, гидрокарбонат калия и т.д., а также алкоголяты металлов, такие как метоксид натрия, трет-бутоксид калия и т.д.
<Способ получения 4>
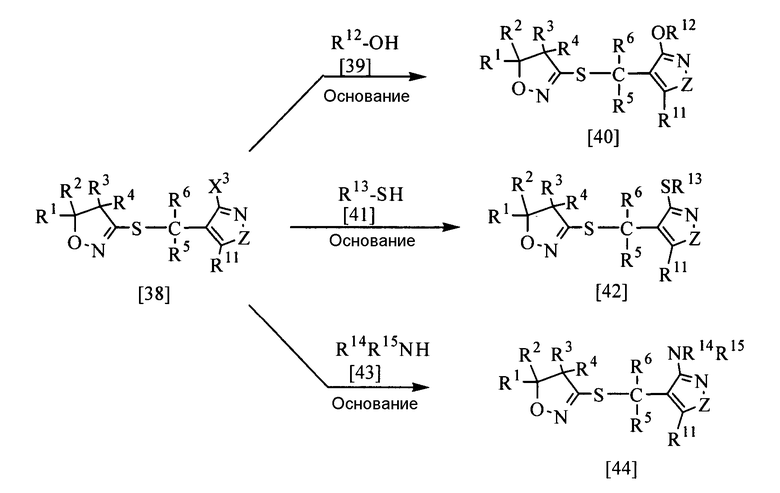
В приведенной выше реакции заместители R1, R2, R3, R4, R5 и R6 имеют определения, приведенные выше; заместитель R11 представляет собой атом водорода или группу заместителей α, которая описана выше; заместитель Х3 представляет собой атом хлора, атом фтора, алкилсульфонильную группу или необязательно замещенную бензилсульфонильную группу; заместитель R12 представляет собой алкильную группу, галогеналкильную группу, циклоалкильную группу, циклоалкилалкильную группу, алкенильную группу, алкинильную группу, необязательно замещенную фенильную группу, необязательно замещенную ароматическую гетероциклическую группу, алкоксикарбонилалкильную группу, необязательно замещенную гетероциклическую алкильную группу или необязательно замещенную бензильную группу; заместитель R13 представляет собой алкильную группу, галогеналкильную группу, необязательно замещенную фенильную группу, необязательно замещенную ароматическую гетероциклическую группу, алкоксикарбонилалкильную группу или необязательно замещенную бензильную группу; заместители R14 и R15 могут быть одинаковыми или разными и каждый из них представляет собой атом водорода, алкильную группу, необязательно замещенную фенильную группу, ацильную группу, галогеналкилкарбонильную группу, необязательно замещенную бензилкарбонильную группу, необязательно замещенную бензоильную группу, алкилсульфонильную группу, галогеналкилсульфонильную группу, необязательно замещенную бензилсульфонильную группу или необязательно замещенную фенилсульфонильную группу, и Z представляет собой атом кислорода, атом серы, N=CR11a, CR11a=N, CR11a=CR11b или N-R16 (где заместитель R16 представляет собой атом водорода или имеет те же значения, что и заместитель R10, а заместители R11a и R11b имеют те же значения, что и R11).
Соединения настоящего изобретения, представленные общими формулами [40], [42] и [44], могут быть получены реакцией соединения настоящего изобретения, представленного общей формулой [38], с соединением [39], соединением [41] и соединением [43] соответственно в присутствии или в отсутствие растворителя и обязательно в присутствии основания.
Эту реакцию обычно проводят при температуре от 20 до 200°С, предпочтительно от 30 до 180°С, в течение от 10 мин до 48 час и при необходимости под давлением.
Что касается количеств используемых в реакции реагентов, то количество соединения [39], соединения [41] или соединения [43] составляет от 1 до 20 эквивалентов на эквивалент соединения [38].
Так как использование основания необходимо, можно назвать, например, гидроксиды щелочных металлов, такие как гидроксид калия, гидроксид натрия и т.д.; гидриды щелочных металлов, такие как гидрид калия, гидрид натрия и т.д.; алкоголяты щелочных металлов, такие как этоксид натрия, метоксид натрия и т.д., и органические основания, такие как 1,8-диазабицикло[5.4.0]-7-ундецен и т.д.
В качестве растворителей могут быть названы, например, галогенированные углеводороды, такие как хлороформ и др.; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и др.; ароматические углеводороды, такие как бензол, толуол и т.д.; алифатические углеводороды, такие как гексан, гептан и т.д.; кетоны, такие как ацетон, метилизобутилкетон и т.д.; сложные эфиры, такие как этилацетат и т.д.; амиды, такие как N-метилпирролидон, N,N-диметилформамид и т.д.; серосодержащие соединения, такие как диметилсульфоксид, сульфолан и т.д.; ацетонитрил, а также их смеси.
<Способ получения 5>
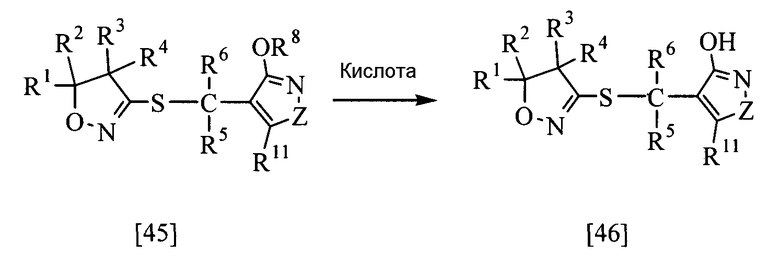
В приведенной выше реакции заместители R1, R2, R3, R4, R5, R6, R8, R11 и Z имеют те же определения, которые приведены выше.
Соединение настоящего изобретения, представленное общей формулой [46], может быть получено при взаимодействии соединения [45] настоящего изобретения с кислотой в растворителе.
Эту реакцию обычно проводят при температуре от 0 до 120°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то количество кислоты составляет желательно от 1 до 10 эквивалентов на эквивалент соединения [45]; однако это количество может меняться соответствующим образом в зависимости от условий реакции.
В качестве кислоты и растворителя можно назвать те же кислоты и растворители, которые упоминались в способе получения 2.
<Способ получения 6>
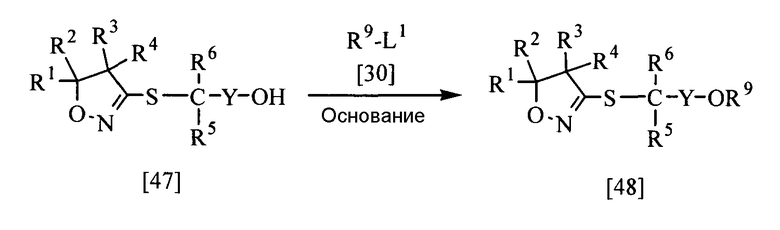
В приведенной выше реакции заместители Y, R1, R2, R3, R4, R5, R6, R9 и L1 имеют те же определения, которые приведены выше. Y может быть замещен 1-5 одинаковыми или разными группами, выбранными из группы заместителей α.
Соединение, представленное общей формулой [48], в соответствии с настоящим изобретением может быть получено при взаимодействии соединения [47] настоящего изобретения с соединением [30] в растворителе в присутствии основания.
Эту реакцию обычно проводят при температуре от 0 до 150°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то количество кислоты составляет желательно от 1 до 1,2 эквивалентов на эквивалент соединения [47]; однако это количество может меняться соответствующим образом в зависимости от условий реакции.
В качестве основания и растворителя можно назвать те же основания и растворители, которые упоминались в способе получения 3.
<Способ получения 7>
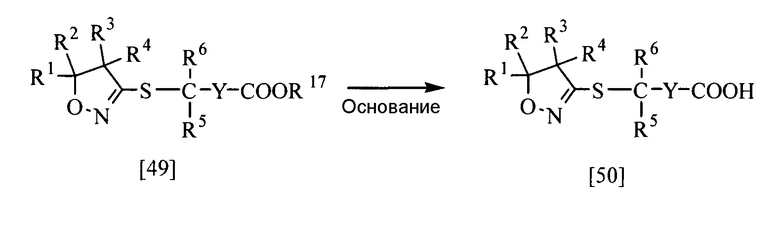
В приведенной выше реакции заместители Y, R1, R2, R3, R4, R5 и R6 имеют те же определения, которые приведены выше, и заместитель R17 представляет собой алкильную группу, необязательно замещенную бензильную группу или необязательно замещенную фенильную группу. Y может быть замещен 1-5 одинаковыми или разными группами, выбранными из группы заместителей α.
Соединение, представленное общей формулой [50], в соответствии с настоящим изобретением может быть получено гидролизом соединения [49] настоящего изобретения в воде или в смешанном растворителе из воды и другого растворителя в присутствии или в отсутствие основания.
Эту реакцию обычно проводят при температуре от 0 до 100°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то количество основания, если оно используется, составляет желательно от 1 до 2 эквивалентов на эквивалент соединения [49]; однако это количество может меняться соответствующим образом в зависимости от условий реакции.
В качестве основания можно назвать, например, неорганические основания, такие как карбонат калия, гидрид натрия, гидроксид натрия и т.д., и органические основания, такие как 1,8-диазабицикло[5.4.0]-7-ундецен и т.д.
В качестве другого растворителя, смешанного с водой, можно назвать, например, спирты, такие как метанол, этанол и т.д.; простые эфиры, такие как тетрагидрофуран и т.д.; кетоны, такие как ацетон, метилизобутилкетон и т.д.; амиды, такие как N,N-диметилформамид и т.д.; серосодержащие соединения, такие как диметилсульфоксид, сульфолан и т.д.; ацетонитрил, и их смеси.
<Способ получения 8>
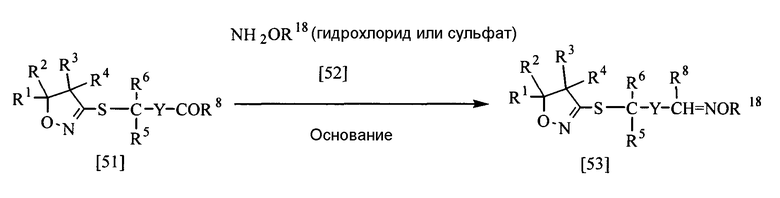
В приведенной выше реакции заместители Y, R1, R2, R3, R4, R5, R6 и R8 имеют те же определения, которые приведены выше, и заместитель R18 представляет собой алкильную группу. Y может быть замещен 1-5 одинаковыми или разными группами, выбранными из группы заместителей α.
Соединение, представленное общей формулой [53], в соответствии с настоящим изобретением может быть получено реакцией соединения [51] настоящего изобретения с соединением [52] в растворителе в присутствии основания.
Эту реакцию обычно проводят при температуре от 0 до 100°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то количество гидрохлорида или сульфата соединения [52] составляет желательно от 1 до 5 эквивалентов на эквивалент соединения [51], а количество основания составляет желательно от 1 до 10 эквивалентов; однако это количество может меняться соответствующим образом в зависимости от условий реакции.
В качестве основания можно назвать, например, карбонаты металлов, такие как карбонат калия, карбонат натрия и т.д.; ацетаты металлов, такие как ацетат калия, ацетат натрия и т.д., и органические основания, такие как триэтиламин, диметиламин, 1,8-диазабицикло[5.4.0]-7-ундецен и т.д.
В качестве растворителя можно назвать, например, спирты, такие как метанол, этанол и т.д.; простые эфиры, такие как тетрагидрофуран и т.д.; амиды, такие как N,N-диметилформамид и т.д., и их смеси.
<Способ получения 9>
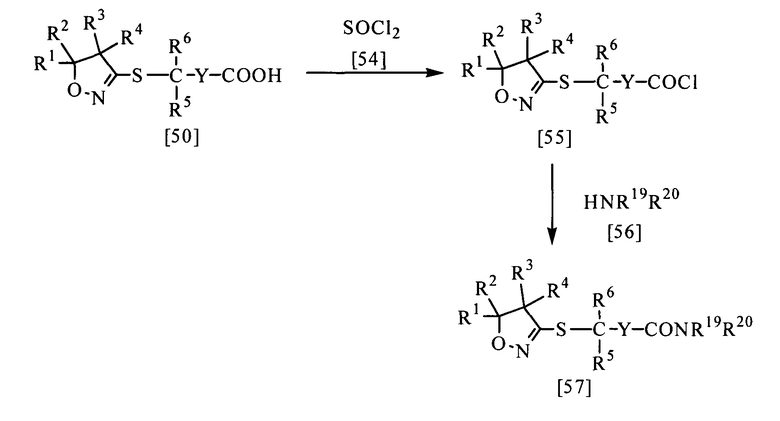
В приведенной выше реакции заместители Y, R1, R2, R3, R4, R5 и R6 имеют те же определения, которые приведены выше; а каждый из заместителей R19 и R20 представляет собой атом водорода или алкильную группу. Y может быть замещен 1-5 одинаковыми или разными группами, выбранными из группы заместителей α.
Соединение, представленное общей формулой [57], в соответствии с настоящим изобретением может быть получено реакцией соединения [50] настоящего изобретения с тионилхлоридом в присутствии или в отсутствие растворителя с получением соединения [55], а затем реакцией соединения [55] с соединением [56] в присутствии или в отсутствие растворителя.
Реакцию от соединения [50] до соединения [55] обычно проводят при температуре от 0 до 100°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то количество тионилхлорида [54] составляет желательно от 1 до 100 эквивалентов на эквивалент соединения [50], но оно может меняться соответствующим образом в зависимости от условий реакции.
В качестве растворителя можно назвать, например, галогенированные углеводороды, такие как дихлорметан, хлороформ и т.д.; простые эфиры, такие как диэтиловый эфир, тетрагидрофуран и т.д., и ароматические углеводороды, такие как бензол, толуол и т.д.
Реакцию от соединения [55] до соединения [57] обычно проводят при температуре от 0 до 100°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то количество соединения [56] составляет желательно от 1 до 100 эквивалентов на эквивалент соединения [55], но оно может меняться соответствующим образом в зависимости от условий реакции.
В качестве растворителя можно назвать, например, те же растворители, которые используются в реакции от соединения [50] до соединения [55].
<Способ получения 10>
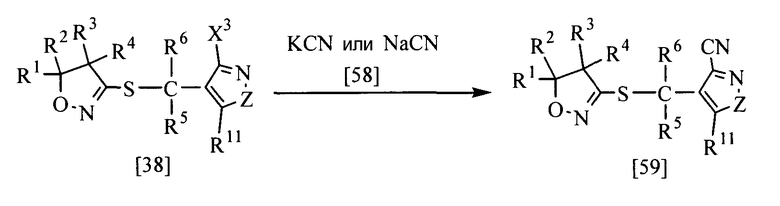
В приведенной выше реакции заместители Z, R1, R2, R3, R4, R5, R6, R11 и Х3 имеют те же определения, которые приведены выше.
Соединение, представленное общей формулой [59], в соответствии с настоящим изобретением может быть получено реакцией соединения [38] настоящего изобретения с соединением [58] в растворителе.
Эту реакцию обычно проводят при температуре от 0 до 100°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то количество соединения [58] составляет желательно от 1 до 2 эквивалентов на эквивалент соединения [38], но оно может меняться соответствующим образом в зависимости от условий реакции.
В качестве растворителя можно назвать, например, простые эфиры, такие как диоксан, тетрагидрофуран (ТГФ) и др.; галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлорбензол, дихлорбензол и др.; амиды, такие как N,N-диметилацетамид, N,N-диметилформамид, N-метил-2-пирролидинон и т.д.; серосодержащие соединения, такие как диметилсульфоксид, сульфолан и т.д.; кетоны, такие как ацетон, 2-бутанон и т.д.; нитрилы, такие как ацетонитрил и т.д.; воду; а также их смеси.
<Способ получения 11>
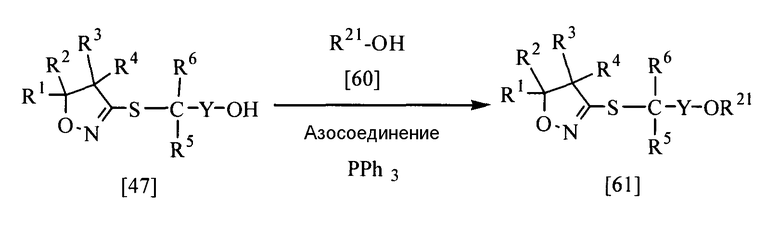
В приведенной выше реакции заместители Y, R1, R2, R3, R4, R5 и R6 имеют те же определения, которые приведены выше, и заместитель R21 представляет собой алкильную группу, галогеналкильную группу, циклоалкильную группу, циклоалкилалкильную группу, алкенильную группу, алкинильную группу, алкоксикарбонилалкильную группу, необязательно замещенную гетероалкильную группу или необязательно замещенную бензильную группу. Y может быть замещен 1-5 одинаковыми или разными группами, выбранными из группы заместителей α.
Соединение, представленное общей формулой [61], в соответствии с настоящим изобретением может быть получено реакцией соединения настоящего изобретения [47] с соединением [60] в присутствии азосоединения и трифенилфосфина в растворителе в соответствии с известным способом [Synthesis 1-28 (1981)].
Эту реакцию обычно проводят при температуре от 0 до 100°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то количества соединения [60], азосоединения и трифенилфосфина составляют желательно от 1 до 1,5 эквивалентов на эквивалент соединения [47], но эти количества могут меняться соответствующим образом в зависимости от условий реакции.
В качестве растворителя можно назвать, например, простые эфиры, такие как диоксан, тетрагидрофуран (ТГФ) и др.; галогенированные углеводороды, такие как дихлорэтан, тетрахлорид углерода, хлорбензол, дихлорбензол и др.; амиды, такие как N,N-диметилацетамид, N,N-диметилформамид, N-метил-2-пирролидинон и т.д.; серосодержащие соединения, такие как диметилсульфоксид, сульфолан и т.д.; ароматические углеводороды, такие как бензол, толуол, ксилол и т.д.; ацетонитрил, а также их смеси.
В качестве азосоединения можно назвать, например, диэтилазодикарбоксилат и диизопропилазодикарбоксилат.
<Способ получения 12>
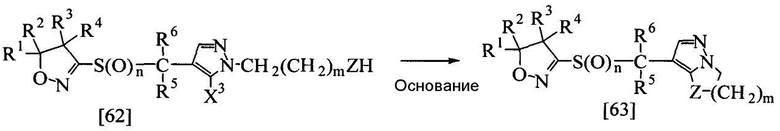
В приведенной выше реакции заместители Х3, n, R1, R2, R3, R4, R5, R6 и Z имеют те же определения, которые приведены выше, а m принимает целые значения от 1 до 4. Атом углерода в 3-м положении пиразольного кольца может быть замещен группой, выбранной из группы заместителей α.
Соединение, представленное общей формулой [63], в соответствии с настоящим изобретением может быть получено реакцией соединения настоящего изобретения [62] в присутствии основания в растворителе.
Эту реакцию обычно проводят при температуре от 0 до 120°С в течение от 10 мин до 24 час.
Что касается количеств используемых в реакции реагентов, то количество основания составляет желательно от 1 до 3 эквивалентов на эквивалент соединения [62], но это количество может меняться соответствующим образом в зависимости от условий реакции.
В качестве основания и растворителя могут быть названы те же основания и растворители, которые упоминались в способе получения 3.
Кроме того, сульфидное соединение, упомянутое в способе получения 2 или способах получения 4-11, может быть превращено в сульфоксидное соединение или сульфоновое соединение путем окисления в соответствии со способом, описанным в способе получения 1. Кроме того, сульфидное соединение, упомянутое в способе получения 2 или способах получения 4-11, в котором заместитель Y замещен С1-С10-алкилтиогруппой, С1-С10-алкилтиогруппой, монозамещенной группой, выбранной из группы заместителей γ, или С1-С4-галогентиогруппой, может быть превращено в сульфоксидное соединение или сульфоновое соединение в соответствии со способом, описанным в способе получения 1, путем добавления от эквимолярного количества до избытка окисляющего агента к сульфидному соединению; с одновременным окислением заместителя, замещающего заместитель Y (С1-С10-алкилтиогруппа, С1-С10-алкилтиогруппа, монозамещенная группой, выбранной из группы заместителей γ, или С1-С4-галогеналкилтиогруппа), и превращением этого заместителя в сульфоксидную группу или сульфоновую группу.
Далее с помощью примеров приведено конкретное описание способа получения соединения настоящего изобретения, способа получения рассматриваемого гербицида и способа применения рассматриваемого гербицида. Также приведено описание способа получения каждого промежуточного соединения настоящего изобретения.
<Пример 1>
Получение 3-(5-хлор-1-фенил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0001)
К раствору 2,3 г (13,1 ммоль) 5,5-диметил-3-метилсульфонил-2-изоксазолина в 20 мл N,N-диметилформамида добавляют 2,1 г гидрата гидросульфида натрия (чистота 70%, 26,2 ммоль). Смесь перемешивают 2 час. К смеси добавляют 1,8 г (13,1 ммоль) безводного карбоната калия, 2,0 г (13,1 ммоль) ронгалита и 3,6 г (10,5 ммоль) 4-бромметил-5-хлор-1-фенил-3-трифторметил-1Н-пиразола. Полученную смесь перемешивают при комнатной температуре 15 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 2,7 г (выход 65,5%) 3-(5-хлор-1-фенил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в виде белых кристаллов (температура плавления 89-90°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 7,55-7,50 (5Н, м), 4,33 (2Н, с), 2,83 (2Н, с), 1,45 (2Н, с).
<Пример 2>
Получение 3-(5-хлор-1-фенил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0002)
К раствору 0,4 г (1,0 ммоль) 3-(5-хлор-1-фенил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина, растворенного в 15 мл хлороформа, добавляют 0,63 г м-хлорнадбензойной кислоты (чистота 70%, 2,6 ммоль) при охлаждении льдом. Смесь перемешивают при комнатной температуре 22 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученные кристаллы промывают гексаном, получают 0,4 г (выход: 83,2%) 3-(5-хлор-1-фенил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина в виде белых кристаллов (температура плавления 132-133°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 7,60-7,51 (5Н, м), 4,37 (2Н, с), 3,14 (2Н, с), 1,53 (2Н, с).
<Пример 3>
Получение 3-(5-хлор-1-метил-3-фенил-1Н-пиразол-4-илметилсульфинил)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0003)
К раствору 0,85 г (2,53 ммоль) 3-(5-хлор-1-метил-3-фенил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в 30 мл хлороформа добавляют 0,87 г м-хлорнадбензойной кислоты (чистота 70%, 3,54 ммоль) при охлаждении льдом. Смесь перемешивают при комнатной температуре 1 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 0,48 г (выход 53,9%) 3-(5-хлор-1-метил-3-фенил-1Н-пиразол-4-илметилсульфинил)-5,5-диметил-2-изоксазолина в виде прозрачного вязкого вещества.
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 7,63-7,60 (2Н, м), 7,48-7,37 (3Н, м), 4,29 (2Н, кв), 3,91 (3Н, с), 3,12 (1Н, д), 2,79 (1Н, д), 1,41 (3Н, с), 1,35 (3Н, с).
<Пример 4>
Получение 5,5-диметил-3-(5-фтор-1-фенил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина (соединение настоящего изобретения № 3-0021)
К раствору 18,7 г (105,7 ммоль) 5,5-диметил-3-метилсульфонил-2-изоксазолина (соединение изобретения № 2-1) в 300 мл N,N-диметилформамида добавляют 9,3 г гидрата гидросульфида натрия (чистота 70%, 116,3 ммоль). Смесь перемешивают 2 час. Реакционную систему охлаждают льдом. К смеси добавляют раствор 30,3 г (93,8 ммоль) 4-бромметил-5-фтор-1-фенил-3-трифторметил-1Н-пиразола в 200 мл N,N-диметилформамида. Смесь перемешивают при 0°С в течение 30 мин для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 13,11 г (выход 37,4%) 5,5-диметил-3-(5-фтор-1-фенил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина в виде желтого масляного вещества.
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 7,65-7,39 (5Н, м), 4,24 (2Н, с), 2,81 (2Н, с), 1,43 (6Н, с).
<Пример 5>
Получение 5,5-диметил-3-(5-этилтио-1-фенил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина (соединение настоящего изобретения № 3-0022)
К раствору 0,25 г (4,0 ммоль) этантиола в 10 мл N,N-диметилформамида добавляют 0,2 г (4,0 ммоль) гидроксида натрия и 1 мл воды. Смесь перемешивают при комнатной температуре 30 мин. К смеси добавляют раствор 0,5 г (1,4 ммоль) 5,5-диметил-3-(5-фтор-1-фенил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина в 5 мл N,N-диметилформамида. Полученную смесь перемешивают 1 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 0,6 г (выход 100%) 5,5-диметил-3-(5-этилтио-1-фенил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина.
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 7,62-7,47 (5Н, м), 4,44 (2Н, с), 2,83 (2Н, с), 2,50 (2Н, кв), 1,45 (6Н, с), 1,02 (3Н, т).
<Пример 6>
Получение 5,5-диметил-3-(5-этилсульфонил-1-фенил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-2-изоксазолина (соединение настоящего изобретения № 3-0004)
К раствору 0,6 г (1,3 ммоль) 5,5-диметил-3-(5-этилтио-1-фенил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина в 10 мл хлороформа добавляют 1,7 г м-хлорнадбензойной кислоты (чистота 70%, 6,7 ммоль) при охлаждении льдом. Смесь перемешивают при комнатной температуре 16 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученные кристаллы промывают гексаном, получают 0,6 г (выход 93,0%) 5,5-диметил-3-(5-этилсульфонил-1-фенил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-2-изоксазолина в виде светло-желтых кристаллов (температура плавления 158-160°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 7,58-7,54 (5Н, м), 5,16 (2Н, с), 3,18 (2Н, с), 3,15 (2Н, кв), 1,55 (6Н, с), 1,24 (3Н, т).
<Пример 7>
Получение 5,5-диметил-3-(5-диметиламино-1-фенил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина (соединение настоящего изобретения № 3-0023)
К раствору 0,5 г (1,3 ммоль) 5,5-диметил-3-(5-фтор-1-фенил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина растворенного в 10 мл N,N-диметилформамида добавляют 0,8 г (6,7 ммоль) 40%-ного водного раствора диметиламина. Смесь перемешивают в запаянной трубке при 100°С в течение 9 час. К смеси добавляют 3,0 г (26,6 ммоль) 40%-ного водного раствора диметиламина и полученную смесь перемешивают 9 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 0,4 г (выход 80,6%) 5,5-диметил-3-(5-диметиламино-1-фенил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина.
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 7,58-7,38 (5Н, м), 4,35 (2Н, с), 2,82 (2Н, с), 2,77 (6Н, с), 1,45 (6Н, с).
<Пример 8>
Получение 5,5-диметил-3-(5-диметиламино-1-фенил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-2-изоксазолина (соединение настоящего изобретения № 3-0005)
К раствору 0,4 г (1,1 ммоль) 5,5-диметил-3-(5-диметиламино-1-фенил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина в 10 мл хлороформа добавляют 0,7 г м-хлорнадбензойной кислоты (чистота 70%, 2,7 ммоль) при охлаждении льдом. Смесь перемешивают при комнатной температуре 20 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученные кристаллы промывают гексаном, получают 0,2 г (выход 52,0%) 5,5-диметил-3-(5-диметиламино-1-фенил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-2-изоксазолина в виде белого порошка (температура плавления 150-151°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 7,61-7,38 (5Н, м), 4,75 (2Н, с), 3,13 (2Н, с), 2,76 (6Н, с), 1,53 (6Н, с).
<Пример 9>
Получение 3-(1-трет-бутил-5-хлор-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0006)
К раствору 24,1 г (136,0 ммоль) 5,5-диметил-3-метилсульфонил-2-изоксазолина в 200 мл N,N-диметилформамида добавляют 21,8 г гидросульфида натрия (чистота 70%, 272,5 ммоль). Смесь перемешивают 1 час. К смеси добавляют 18,8 г (136,2 ммоль) безводного карбоната калия и 21,0 г (136,2 ммоль) ронгалита. Полученную смесь перемешивают 2 час. К смеси при охлаждении льдом добавляют 40 г (125 ммоль) 4-бромметил-1-трет-бутил-5-хлор-3-трифторметил-1Н-пиразола. Полученную смесь перемешивают при комнатной температуре 2 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 23,0 г (выход 57,1%) 3-(1-трет.-бутил-5-хлор-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в виде светло-розовых кристаллов (температура плавления: 79,0-81,0°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,24 (2Н, с), 2,80 (2Н, с), 1,71 (9Н, с), 1,43 (6Н, с).
<Пример 10>
Получение 3-(5-хлор-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0007)
Добавляют 19,8 г (53,4 ммоль) 3-(1-трет-бутил-5-хлор-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина к 170 мл 25%-ного раствора бромистый водород/уксусная кислота. Полученную смесь перемешивают при 40-50°С в течение 2 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 12,0 г (выход 60,6%) 3-(5-хлор-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в виде светло-желтых кристаллов (температура плавления: 120,0-122,0°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,26 (2Н, с), 2,81 (2Н, с), 1,44 (6Н, с).
<Пример 11>
Получение 3-(5-хлор-1-дифторметил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0008) и 3-(3-хлор-1-дифторметил-5-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0009)
К раствору 2,3 г (7,3 ммоль) 3-(5-хлор-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в 50 мл N,N-диметилформамида добавляют 3,1 г (22,5 ммоль) безводного карбоната калия. Смесь продувают хлордифторметаном. Полученную смесь перемешивают при 130-140°С 3 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 0,69 г (выход 25,8%) 3-(5-хлор-1-дифторметил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в виде светло-желтых кристаллов (температура плавления 41,0-42,0°С) и 0,54 г (выход 20,2%) 3-(3-хлор-1-дифторметил-5-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в виде белого порошка (температура плавления 89,0-90,0°С).
Для 3-(5-хлор-1-дифторметил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 7,22 (1Н, т), 4,25 (2Н, с), 2,80 (2Н, с), 0,44 (6Н, с).
Для 3-(3-хлор-1-дифторметил-5-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 7,19 (1Н, т), 4,28 (2Н, с), 2,80 (2Н, с), 1,44 (6Н, с).
<Пример 12>
Получение 3-(5-хлор-1-дифторметил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0010)
К раствору 0,69 г (1,9 ммоль) 3-(5-хлор-1-дифторметил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина в 20 мл хлороформа добавляют 1,4 г м-хлорнадбензойной кислоты (чистота 70%, 8,1 ммоль) при охлаждении льдом. Смесь перемешивают 1 час, а затем 12 час при комнатной температуре для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия, водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученное твердое вещество промывают н-гексаном, получают 0,4 г (выход 53,3%) 3-(5-хлор-1-дифторметил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина в виде белого порошка (температура плавления 126,0-127,0°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 7,26 (1Н, т), 4,68 (2Н, с), 3,11 (2Н, с), 1,53 (6Н, с).
<Пример 13>
Получение 3-(3-хлор-1-дифторметил-5-трифторметил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0011)
К раствору 0,54 г (1,5 ммоль) 3-(3-хлор-1-дифторметил-5-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в 20 мл хлороформа добавляют 1,1 г м-хлорнадбензойной кислоты (чистота 70%, 6,4 ммоль) при охлаждении льдом. Смесь перемешивают 1 час и затем при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия, водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученное твердое вещество промывают н-гексаном, получают 0,47 г (выход 79,7%) 3-(3-хлор-1-дифторметил-5-трифторметил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина в виде белого порошка (температура плавления 136,0-137,0°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 7,23 (1Н, т), 4,71 (2Н, с), 3,11 (2Н, с), 1,53 (6Н, с).
<Пример 14>
Получение 5,5-диметил-3-(3-метокси-1-метил-5-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина (соединение настоящего изобретения № 3-0024)
К раствору 3,3 г (17,3 ммоль) 5,5-диметил-3-этилсульфонил-2-изоксазолина в 10 мл N,N-диметилформамида добавляют 3,1 г гидрата гидросульфида натрия (чистота 70%, 22,0 ммоль). Смесь перемешивают 2 час. К смеси добавляют 3,1 г (22,0 ммоль) безводного карбоната калия, 2,7 г (17,5 ммоль) ронгалита и 4,0 г (17,5 ммоль) 4-хлорметил-3-метокси-1-метил-5-трифторметил-1Н-пиразола. Полученную смесь перемешивают при комнатной температуре 2 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 2,8 г (выход 52,0%) 5,5-диметил-3-(3-метокси-1-метил-5-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина.
<Пример 15>
Получение 5,5-диметил-3-(3-гидрокси-1-метил-5-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина (соединение настоящего изобретения № 3-0025)
К 20 мл 25%-ного раствора бромистого водорода в уксусной кислоте добавляют 3,3 г (10,6 ммоль) 5,5-диметил-3-(3-метокси-1-метил-5-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина. Смесь перемешивают при 50°С 3 час для протекания реакции. По окончании реакции реакционную смесь подвергают вакуумной перегонке для удаления содержащегося в ней растворителя. Остаток выливают в воду. Полученные кристаллы отфильтровывают, промывают водой и сушат, получают 3,1 г (выход 96,0%) целевого 5,5-диметил-3-(3-гидрокси-1-метил-5-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина.
<Пример 16>
Получение 5,5-диметил-3-(3-этокси-1-метил-5-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина (соединение настоящего изобретения № 3-0026)
К раствору 0,30 г (1,0 ммоль) 5,5-диметил-3-(3-гидрокси-1-метил-5-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина в 10 мл N,N-диметилфорамида добавляют 0,20 г (1,3 ммоль) безводного карбоната калия и 0,20 г (1,5 ммоль) этилиодида. Смесь перемешивают при 50°С 3 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 0,30 г (выход 92,0%) названного 5,5-диметил-3-(3-этокси-1-метил-5-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина.
<Пример 17>
Получение 5,5-диметил-3-(3-этокси-1-метил-5-трифторметил-1Н-пиразол-4-илметилсульфонил)-2-изоксазолина (соединение настоящего изобретения № 3-0012)
К раствору 0,30 г (0,92 ммоль) 5,5-диметил-3-(3-этокси-1-метил-5-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина в 10 мл хлороформа добавляют 0,68 г м-хлорнадбензойной кислоты (чистота 70%, 2,76 ммоль) при охлаждении льдом. Смесь перемешивают при комнатной температуре 5 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученные кристаллы промывают гексаном, получают 0,24 г (выход 73,0%) 5,5-диметил-3-(3-этокси-1-метил-5-трифторметил-1Н-пиразол-4-илметилсульфонил)-2-изоксазолина в виде белых кристаллов (температура плавления 124-125°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,50 (2Н, с), 4,27 (2Н, кв), 3,86 (3Н, с), 3,04 (2Н, с), 1,49 (6Н, с), 1,39 (3Н, т).
<Пример 18>
Получение 5,5-диметил-3-(5-фтор-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина (соединение настоящего изобретения № 3-0027)
К раствору 21,3 г (120,3 ммоль) 5,5-диметил-3-метилсульфонил-2-изоксазолина в 200 мл N,N-диметилформамида добавляют 19,3 г гидросульфида натрия (чистота 70%, 344,6 ммоль). Смесь перемешивают 1 час. К смеси добавляют 16,7 г (121,0 ммоль) безводного карбоната калия и 18,6 г (120,7 ммоль) ронгалита. Полученную смесь перемешивают 2 час. К смеси при охлаждении льдом добавляют 31,4 г (102,3 ммоль) 4-бромметил-5-фтор-1-метил-3-трифторметил-1Н-пиразола. Полученную смесь перемешивают при комнатной температуре 2 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 29,0 г (выход 90,3%) 5,5-диметил-3-(5-фтор-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина в виде желтого маслянистого вещества.
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,24 (2Н, с), 3,90 (3Н, с), 2,78 (2Н, с), 1,42 (6Н, с).
<Пример 19>
Получение 5,5-диметил-3-(5-метокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина (соединение настоящего изобретения № 3-0028)
К раствору 0,5 г (1,6 ммоль) 5,5-диметил-3-(5-фтор-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина в 20 мл метанола добавляют 0,77 г (4,0 ммоль) метоксида натрия (28%-ный метанольный раствор). Смесь перемешивают в течение 2 час при кипении с обратным холодильником для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 0,5 г (выход 96,7%) 5,5-диметил-3-(5-метокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина в виде желтого маслянистого вещества.
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,26 (2Н, с), 4,07 (3Н, с), 3,72 (3Н, с), 2,80 (2Н, с), 1,43 (6Н, с).
<Пример 20>
Получение 5,5-диметил-3-(5-метокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-2-изоксазолина (соединение настоящего изобретения № 3-0013)
К раствору 0,5 г (1,5 ммоль) 5,5-диметил-3-(5-метокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина в 20 мл хлороформа добавляют 1,3 г м-хлорнадбензойной кислоты (чистота 70%, 7,5 ммоль) при охлаждении льдом. Смесь перемешивают 1 час и затем при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия, водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученное твердое вещество промывают н-гексаном, получают 0,31 г (выход 58,2%) 5,5-диметил-3-(5-метокси-1-метил-5-трифторметил-1Н-пиразол-4-илметилсульфонил)-2-изоксазолина в виде белого порошка (температура плавления 113,0-114,0°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,60 (2Н, с), 4,11 (3Н, с), 3,79 (3Н, с), 3,10 (2Н, с), 1,51 (6Н, с).
<Пример 21>
Получение 3-(5-(2-хлорфенокси)-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0029)
К раствору 0,44 г (3,4 ммоль) 2-хлорфенола в 30 мл N,N-диметилформамида добавляют 0,2 г (8,3 ммоль) гидрида натрия (чистота 60%) при охлаждении льдом. Смесь перемешивают 1 час. К смеси добавляют 0,7 г (2,2 ммоль) 5,5-диметил-3-(5-фтор-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина. Полученную смесь перемешивают при 120-130°С в течение 5 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан - этилацетат), получают 0,63 г (выход 66,7%) 3-(5-(2-хлорфенокси)-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в виде желтого маслянистого вещества.
<Пример 22>
Получение 3-(5-(2-хлорфенокси)-1-метил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0014)
К раствору 0,63 г (1,5 ммоль) 3-(5-(2-хлорфенокси)-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в 20 мл хлороформа добавляют 1,0 г м-хлорнадбензойной кислоты (чистота 70%, 5,8 ммоль) при охлаждении льдом. Смесь перемешивают 1 час и затем при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия, водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученное твердое вещество промывают н-гексаном, получают 0,31 г (выход 45,7%) 3-(5-(2-хлорфенокси)-1-метил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина в виде белого порошка (температура плавления 67,0-70,0°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 7,50-6,91 (4Н, м), 4,45 (2Н, с), 3,71 (3Н, с), 3,03 (2Н, с), 1,47 (6Н, с).
<Пример 23>
Получение 3-(5-циклопентилокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0030)
К раствору 0,43 г (1,6 ммоль) трифенилфосфина в 10 мл бензола добавляют 0,14 г (1,6 ммоль) циклопентанола, 0,5 г (1,6 ммоль) 5,5-диметил-3-(5-гидрокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазола и 0,7 г (1,6 ммоль) диэтилазодикарбоксилата (40%-ный толуольный раствор). Смесь перемешивают при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан - этилацетат), получают 0,52 г (выход 85,2%) 3-(5-циклопентилокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в виде бесцветного прозрачного маслянистого вещества.
<Пример 24>
Получение 3-(5-циклопентилокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0015)
К раствору 0,52 г (1,4 ммоль) 3-(5-(циклопентилокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в 20 мл хлороформа добавляют 0,85 г м-хлорнадбензойной кислоты (чистота 70%, 4,9 ммоль) при охлаждении льдом. Смесь перемешивают 1 час и затем при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия, водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученное твердое вещество промывают н-гексаном, получают 0,2 г (выход 35,5%) 3-(5-(циклопентилокси-1-метил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина в виде белого порошка (температура плавления 113,0-114,0°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 5,03 (1Н, уш.), 4,60 (2Н, с), 3,73 (3Н, с), 3,05 (2Н, с), 1,88-1,70 (8Н, м), 1,50 (6Н, с).
<Пример 25>
Получение 3-(5-циано-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0031)
К раствору 0,5 г (1,6 ммоль) 5,5-диметил-3-(5-фтор-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-2-изоксазолина в 30 мл N,N-диметилформамида добавляют 0,2 г (4,0 ммоль) цианида натрия. Смесь перемешивают при 40°С в течение 1 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 0,9 г сырого 3-(5-циано-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в виде желтого маслянистого вещества.
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,30 (3Н, с), 4,08 (3Н, с), 2,81 (2Н, с), 1,43 (6Н, с).
<Пример 26>
Получение 3-(5-циано-1-метил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0016)
К раствору 0,9 г 3-(5-циано-1-метил-3-трифторметил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина (сырое соединение) в 50 мл хлороформа добавляют 2,1 г м-хлорнадбензойной кислоты (чистота 70%, 12,2 ммоль) при охлаждении льдом. Смесь перемешивают 1 час и затем при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия, водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученное твердое вещество промывают н-гексаном, получают 0,43 г (выход 76,4%) 3-(5-циано-1-метил-3-трифторметил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина в виде белого порошка (температура плавления 105,0-108,0°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,73 (2Н, с), 4,16 (3Н, с), 3,14 (2Н, с), 1,53 (6Н, с).
<Пример 27>
Получение 3-(3,5-дихлор-1-этил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0032)
К раствору 0,7 г (3,7 ммоль) 5,5-диметил-3-этилсульфонил-2-изоксазолина в 30 мл N,N-диметилформамида добавляют 0,6 г гидросульфида натрия (чистота 70%, 10,7 ммоль). Смесь перемешивают 1 час. К смеси добавляют 0,51 г (3,7 ммоль) безводного карбоната калия и 0,56 г (3,6 ммоль) ронгалита. Полученную смесь перемешивают 2 час. К смеси при охлаждении льдом добавляют 0,9 г (3,5 ммоль) 4-бромметил-3,5-дихлор-1-этил-1Н-пиразола. Полученную смесь перемешивают при комнатной температуре 2 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан - этилацетат), получают 0,8 г (выход 70,8%) 3-(3,5-дихлор-1-этил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в виде бесцветного прозрачного маслянистого вещества.
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,14 (2Н, с), 4,14 (2Н, кв), 2,81 (2Н, с), 1,43 (6Н, с), 1,42 (3Н, т).
<Пример 28>
Получение 3-(3,5-дихлор-1-этил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0017)
К раствору 0,8 г (2,6 ммоль) 3-(3,5-дихлор-1-этил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в 20 мл хлороформа добавляют 2,0 г м-хлорнадбензойной кислоты (чистота 70%, 11,6 ммоль) при охлаждении льдом. Смесь перемешивают 1 час и затем при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия, водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученное твердое вещество промывают н-гексаном, получают 0,41 г (выход 46,6%) 3-(3,5-дихлор-1-этил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина в виде белого порошка (температура плавления 105,0-107,0°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,48 (2Н, с), 4,19 (2Н, кв), 3,05 (2Н, с), 1,51 (6Н, с), 1,45 (3Н, т).
<Пример 29>
Получение 3-(5-хлор-3-дифторметил-1-метил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0020)
К раствору 1,9 г (10,0 ммоль) 5,5-диметил-3-этилсульфонил-2-изоксазолина в 30 мл N,N-диметилформамида добавляют 1,2 г гидрата гидросульфида натрия (чистота 70%, 15,0 ммоль). Смесь перемешивают 2 час. К смеси добавляют 2,1 г (15,0 ммоль) безводного карбоната калия, 2,3 г (15,0 ммоль) ронгалита и 2,6 г (10,0 ммоль) 4-бромметил-5-хлор-3-дифторметил-1-метил-1Н-пиразола. Полученную смесь перемешивают при комнатной температуре 15 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан - этилацетат), получают 2,1 г (выход 68,0%) 3-(5-хлор-3-дифторметил-1-метил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в виде бесцветной вязкой жидкости (n20 D = 1,5183).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 6,70 (1Н, т, J=54,2 Гц), 4,24 (2Н, с), 3,86 (3Н, с), 2,80 (2Н, с), 1,42 (6Н, с).
<Пример 30>
Получение 3-(5-хлор-3-дифторметил-1-метил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 3-0018)
К раствору 1,8 г (5,8 ммоль) 3-(5-хлор-3-дифторметил-1-метил-1Н-пиразол-4-илметилтио)-5,5-диметил-2-изоксазолина в 15 мл хлороформа добавляют 3,6 г м-хлорнадбензойной кислоты (чистота 70%, 14,5 ммоль) при охлаждении льдом. Смесь перемешивают при комнатной температуре 22 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученные кристаллы промывают гексаном, получают 1,7 г (выход 85,9%) 3-(5-хлор-3-дифторметил-1-метил-1Н-пиразол-4-илметилсульфонил)-5,5-диметил-2-изоксазолина в виде белых кристаллов (температура плавления 78-79°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 6,80 (1Н, т, J=54,8 Гц), 4,60 (2Н, с), 3,91 (3Н, с), 3,08 (2Н, с), 1,51 (6Н, с).
<Пример 31>
Получение 5,5-диметил-3-(5-метил-3-трифторметилизоксазол-4-илметилтио)-2-изоксазолина (соединение настоящего изобретения № 4-0003)
К раствору 0,4 г (2,3 ммоль) 5,5-диметил-3-метилсульфонил-2-изоксазолина в 10 мл N,N-диметилформамида добавляют 0,4 г гидрата гидросульфида натрия (чистота 70%, 4,6 ммоль). Смесь перемешивают 2 час. К смеси добавляют 0,3 г (2,3 ммоль) карбоната калия, 0,4 г (2,3 ммоль) ронгалита и 0,5 г (1,8 ммоль) 4-бромметил-5-метил-3-трифторметилизоксазола. Полученную смесь перемешивают при комнатной температуре 14 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан - этилацетат), получают 0,4 г (выход: 70,0%) 5,5-диметил-3-(5-метил-3-трифторметилизоксазол-4-илметилтио)-2-изоксазолина.
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,11 (2Н, с), 2,77 (2Н, с), 2,54 (3Н, с), 1,42 (6Н, с).
<Пример 32>
Получение 5,5-диметил-3-(5-метил-3-трифторметилизоксазол-4-илметилсульфонил)-2-изоксазолина (соединение настоящего изобретения № 4-0001)
К раствору 0,4 г (1,3 ммоль) 5,5-диметил-3-(5-метил-3-трифторметилизоксазол-4-илметилтио)-2-изоксазолина в 10 мл хлороформа добавляют 0,8 г м-хлорнадбензойной кислоты (чистота 70%, 3,2 ммоль) при охлаждении льдом. Смесь перемешивают при комнатной температуре 4 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученные кристаллы промывают гексаном, получают 0,4 г (выход 95,0%) 5,5-диметил-3-(5-метил-3-трифторметилизоксазол-4-илметилсульфонил)-2-изоксазолина в виде белых кристаллов (температура плавления 135-136°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,54 (2Н, с), 3,11 (2Н, с), 2,61 (3Н, с), 1,52 (6Н, с).
<Пример 33>
Получение [(5-хлор-3-метилизотиазол-4-ил)метилтио]-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 4-0004)
К раствору 0,89 г (5,00 ммоль) 5,5-диметил-3-метилсульфонил-2-изоксазолина в 10 мл N,N-диметилформамида добавляют при комнатной температуре 0,82 г гидросульфида натрия (чистота 70%, 10,00 ммоль). Смесь перемешивают 2 час. К смеси добавляют 0,70 г (5,00 ммоль) безводного карбоната калия, 0,78 г (5,00 ммоль) ронгалита и 0,91 г (5,00 ммоль) 5-хлор-4-хлорметил-3-метилизотиазола. Полученную смесь перемешивают при комнатной температуре в течение ночи для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле, получают 1,38 г (выход количественный) [(5-хлор-3-метилизотиазол-4-ил)метилтио]-5,5-диметил-2-изоксазолина.
<Пример 34>
Получение [(5-хлор-3-метилизотиазол-4-ил)метилсульфонил]-5,5-диметил-2-изоксазолина (соединение настоящего изобретения № 4-0002)
К раствору 1,38 г (5,00 ммоль) [(5-хлор-3-метилизотиазол-4-ил)метилтио]-5,5-диметил-2-изоксазолина в 20 мл хлороформа добавляют 2,96 г м-хлорнадбензойной кислоты (чистота 70%, 12,00 ммоль) при охлаждении льдом. Смесь перемешивают 1 час и затем при комнатной температуре в течение ночи для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученный остаток очищают колоночной хроматографией на силикагеле, получают 0,65 г (выход 47,0%) [(5-хлор-3-метилизотиазол-4-ил)метилсульфонил]-5,5-диметил-2-изоксазолина в виде желтого порошка (температура плавления 113-114°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 8,89 (1Н, с), 4,67 (2Н, с), 3,05 (2Н, с), 2,59 (3Н, с), 1,51 (6Н, с).
<Пример 35>
Получение 5,5-диметил-3-[2,5-диметил-4-(1-метоксииминоэтил)тиофен-3-илметилтио]-2-изоксазолина (соединение настоящего изобретения № 2-0002)
К раствору 1,0 г (3,4 ммоль) 3-(4-ацетил-2,5-диметилтиофен-3-илметилтио)-5,5-диметил-2-изоксазолина в 50 мл этанола добавляют 0,57 г (6,8 ммоль) гидрохлорида О-метилгидроксиламина и 0,56 г (6,8 ммоль) ацетата натрия. Полученную смесь перемешивают 5 час при кипении с обратным холодильником для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан - этилацетат), получают 0,4 г (выход 36,4%) 5,5-диметил-3-[2,5-диметил-4-(1-метоксииминоэтил)тиофен-3-илметилтио]-2-изоксазолина в виде желтого маслянистого вещества.
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,21 (2Н, с), 3,95 (3Н, с), 2,76 (2Н, с), 2,38 (3Н, с), 2,34 (3Н, с), 2,13 (3Н, с), 1,42 (6Н, с).
<Пример 36>
Получение 5,5-диметил-3-[2,5-диметил-4-(1-метоксииминоэтил)тиофен-3-илметилсульфонил]-2-изоксазолина (соединение настоящего изобретения № 2-0001)
К раствору 0,4 г (1,2 ммоль) 5,5-диметил-3-[2,5-диметил-4-(1-метоксииминоэтил)тиофен-3-илметилтио]-2-изоксазолина в 30 мл хлороформа добавляют 0,61 г м-хлорнадбензойной кислоты (чистота 70%, 3,5 ммоль) при охлаждении льдом. Смесь перемешивают 1 час и затем при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия, водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученный остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан - этилацетат), получают 0,35 г (выход: 80%) 5,5-диметил-3-[2,5-диметил-4-(1-метоксииминоэтил)тиофен-3-илметилсульфонил]-2-изоксазолина в виде белых кристаллов (температура плавления 95,0-96,0°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,79 (2Н, с), 3,95 (3Н, с), 2,93 (2Н, с), 2,42 (3Н, с), 2,37 (3Н, с), 2,17 (3Н, с), 1,47 (6Н, с).
<Пример 37>
Получение 5,5-диметил-3-(4-трифторметилпиридин-3-илметилтио)-2-изоксазолина (соединение настоящего изобретения № 7-0003)
К раствору 0,3 г (1,6 ммоль) 5,5-диметил-3-этилсульфонил-2-изоксазолина в 20 мл N,N-диметилформамида добавляют 0,26 г гидросульфида натрия (чистота 70%, 4,6 ммоль). Смесь перемешивают 1 час. К смеси добавляют 0,22 г (1,6 ммоль) безводного карбоната калия и 0,25 г (1,6 ммоль) ронгалита. Полученную смесь перемешивают 2 час. К смеси при охлаждении льдом добавляют 0,3 г (1,3 ммоль) 3-бромметил-4-трифторметилпиридина. Полученную смесь перемешивают при комнатной температуре 2 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан - этилацетат), получают 0,45 г (выход 98,9%) 5,5-диметил-3-(4-трифторметилпиридин-3-илметилтио)-2-изоксазолина в виде желтого маслянистого вещества.
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 8,98 (1Н, с), 8,70 (1Н, д), 7,51 (1Н, д), 4,47 (2Н, с), 2,79 (2Н, с), 1,43 (6Н, с).
<Пример 38>
Получение 5,5-диметил-3-(4-трифторметилпиридин-3-илметилсульфонил)-2-изоксазолина (соединение настоящего изобретения № 7-0001) и 5,5-диметил-3-(4-трифторметилпиридин-N-оксид-3-илметилсульфонил)-2-изоксазолина (соединение настоящего изобретения № 7-0002)
К раствору 0,45 г (1,6 ммоль) 5,5-диметил-3-(4-трифторметилпиридин-3-илметилтио)-2-изоксазолина в 20 мл хлороформа добавляют 0,77 г м-хлорнадбензойной кислоты (чистота 70%, 4,5 ммоль) при охлаждении льдом. Смесь перемешивают 1 час и затем при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия, водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученный остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 0,06 г (выход 12,0%) 5,5-диметил-3-(4-трифторметилпиридин-3-илметилсульфонил)-2-изоксазолина в виде светло-желтых кристаллов (температура плавления 77,0-80,0°С) и 0,12 г (выход 23,1%) 5,5-диметил-3-(4-трифторметилпиридин-N-оксид-3-илметилсульфонил)-2-изоксазолина в виде белых кристаллов (температура плавления 114,0-116,0°С).
Для 5,5-Диметил-3-(4-трифторметилпиридин-3-илметилсульфонил)-2-изоксазолина
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 8,98 (1Н, с), 8,84 (1Н, д), 7,64 (1Н, д), 4,92 (2Н, с), 3,09 (2Н, с), 1,52 (6Н, с).
Для 5,5-Диметил-3-(4-трифторметилпиридин-N-оксид-3-илметилсульфонил)-2-изоксазолина
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 8,50 (1Н, с), 8,25 (1Н, д), 7,59 (1Н, д), 4,81 (2Н, с), 3,12 (2Н, с), 1,53 (6Н, с).
<Пример 39>
Получение 5,5-диметил-[(4-метокси-6-трифторметилпиримидин-5-ил)метилтио]-2-изоксазолина (соединение настоящего изобретения № 8-0002)
К раствору 0,35 г (2,00 ммоль) 5,5-диметил-3-метилсульфонил-2-изоксазолина в 10 мл N,N-диметилформамида добавляют при комнатной температуре 0,32 г гидросульфида натрия (чистота 70%, 4,00 ммоль). Смесь перемешивают 2 час. К реакционной смеси добавляют 0,28 г (2,00 ммоль) безводного карбоната калия, 0,31 г (2,00 ммоль) ронгалита и 0,45 г (2,00 ммоль) 5-хлорметил-4-метокси-6-трифторметилпиримидина. Полученную смесь перемешивают при комнатной температуре 2 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле, получают 0,55 г (выход 85,9%) 5,5-диметил-[(4-метокси-6-трифторметилпиримидин-5-ил)метилтио]-2-изоксазолина.
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 8,81 (1Н, с), 4,44 (2Н, д), 4,12 (3Н, с), 2,81 (2Н, с), 1,45 (6Н, с).
<Пример 40>
Получение 5,5-диметил-[(4-метокси-6-трифторметилпиримидин-5-ил)метилсульфонил]-2-изоксазолина (соединение настоящего изобретения № 8-0001)
К раствору 0,55 г (1,71 ммоль) 5,5-диметил-[(4-метокси-6-трифторметилпиримидин-5-ил)метилтио]-2-изоксазолина в 20 мл хлороформа добавляют 1,05 г м-хлорнадбензойной кислоты (чистота 70%, 4,28 ммоль) при охлаждении льдом. Смесь перемешивают 1 час и затем при комнатной температуре 4 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученный остаток очищают колоночной хроматографией на силикагеле, получают 0,45 г (выход 75,0%) 5,5-диметил-[(4-метокси-6-трифторметилпиримидин-5-ил)метилсульфонил]-2-изоксазолина в виде белых, похожих на перья кристаллов (температура плавления 175-176°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 8,89 (1Н, с), 5,00 (2Н, д), 4,41 (3Н, с), 3,11 (2Н, с), 1,53 (6Н, с).
<Пример 41>
Получение 3-(5,5-диметил-2-изоксазолин-3-илтиометил)-2-трифторметил-6,7-дигидро-5Н-пиразоло[5,1-b][1,3]оксазина (соединение настоящего изобретения № 3-0033)
Раствор 0,82 г (2,3 ммоль) 3-[5-хлор-1-(3-гидроксипропил)-3-трифторметил-1Н-пиразол-4-илметилтио]-5,5-диметил-2-изоксазола в 5 мл N,N-диметилформамида добавляют по каплям к суспензии 0,11 г (2,8 ммоль) гидрида натрия в 15 мл N,N-диметилформамида. По окончании добавления полученную смесь перемешивают 30 мин при комнатной температуре, затем нагревают до 100°С и перемешивают 1 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водным раствором лимонной кислоты и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке, получают 0,77 г (выход 100%) 3-(5,5-диметил-2-изоксазолин-3-илтиометил)-2-трифторметил-6,7-дигидро-5Н-пиразоло[5,1-b][1,3]оксазина.
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,37 (2Н, т), 4,19 (2Н, т), 4,15 (2Н, с), 2,80 (2Н, с), 2,31 (2Н, м), 1,42 (6Н, с).
<Пример 42>
Получение 3-(5,5-диметил-2-изоксазолин-3-илсульфонилметил)-2-трифторметил-6,7-дигидро-5Н-пиразоло[5,1-b][1,3]оксазина (соединение настоящего изобретения № 3-0019)
К раствору 0,77 г (2,3 ммоль) 3-(6,7-дигидро-3-трифторметил-5Н-пиразоло[5,1-b][1,3]оксазин-4-илметилтио)-5,5-диметил-2-изоксазолина в 20 мл хлороформа добавляют 1,25 г м-хлорнадбензойной кислоты (чистота 70%, 5,1 ммоль) при охлаждении льдом. Смесь перемешивают 1 час и затем при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия, водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученный остаток очищают колоночной хроматографией на силикагеле, получают 0,36 г (выход 43%) 3-(5,5-диметил-2-изоксазолин-3-илсульфонилметил)-2-трифторметил-6,7-дигидро-5Н-пиразоло[5,1-b][1,3]оксазина в виде белого порошка (температура плавления 151,0-152,0°С).
1Н-ЯМР [СDCl3/TMS, δ (м.д.)]: 4,47 (2Н, с), 4,40 (2Н, т), 4,23 (2Н, т), 3,09 (2Н, с), 2,34 (2Н, м), 1,50 (6Н, с).
Номера соединений, представленные в таблицах 11-20, соответствуют номерам примеров.
Таблица 11
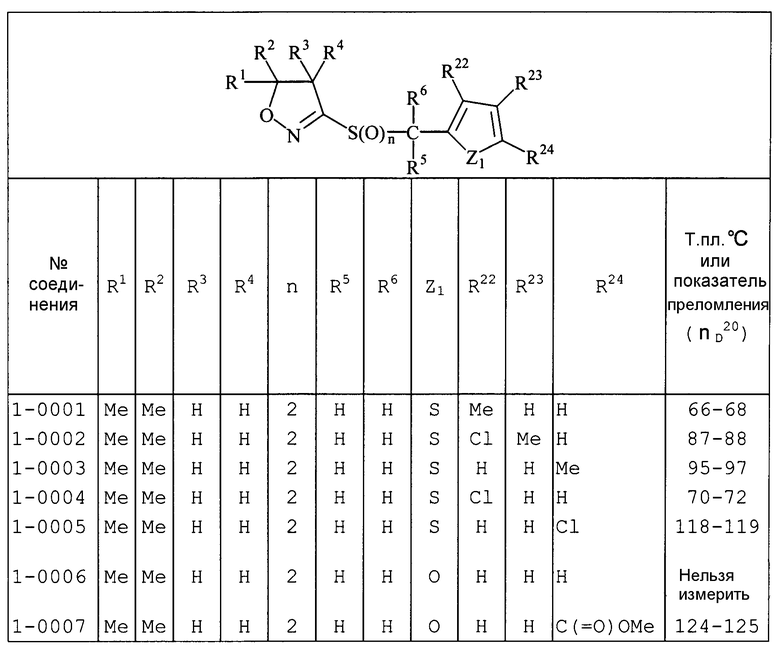
Таблица 12
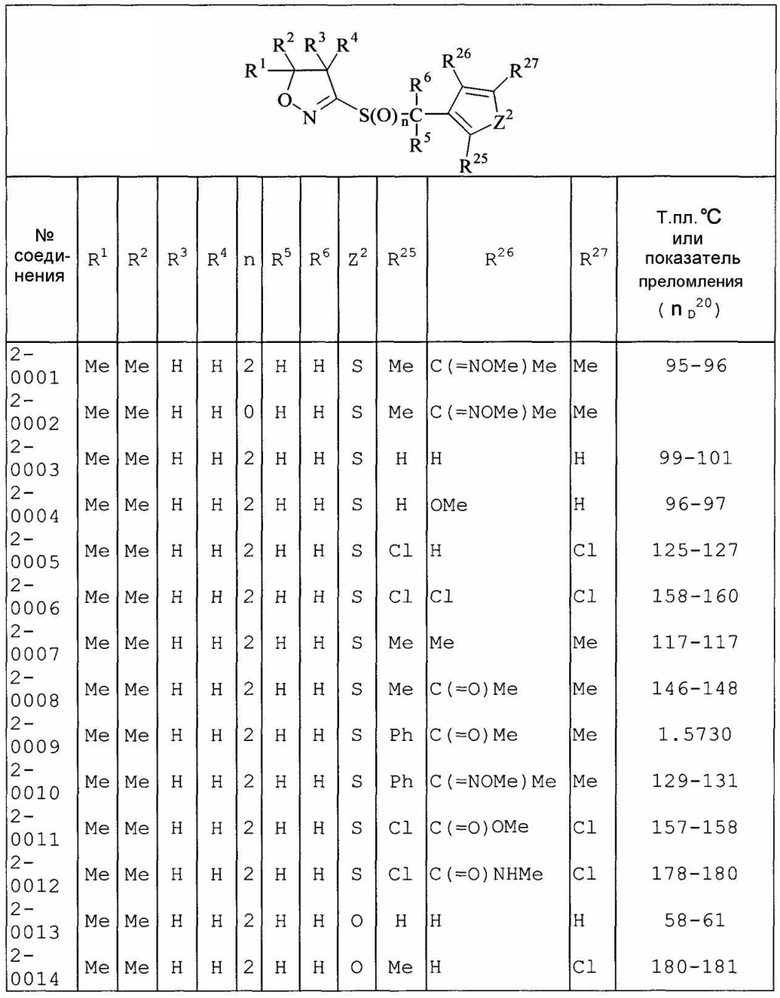
Таблица 13
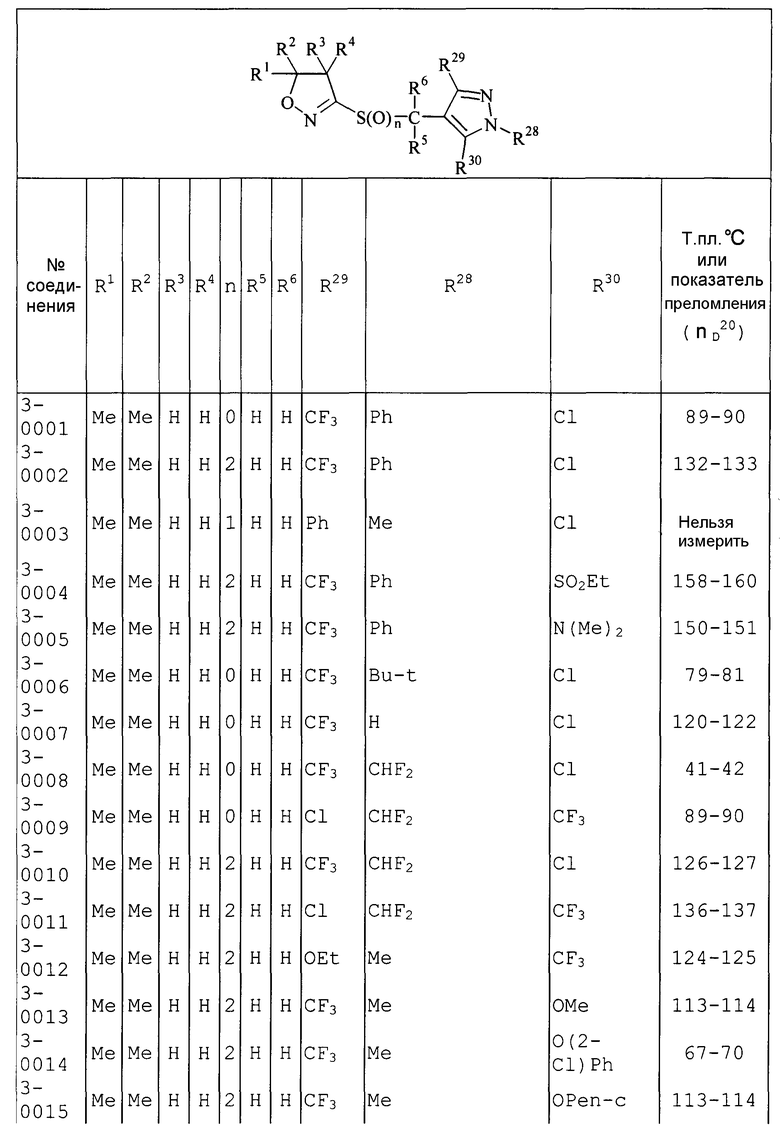
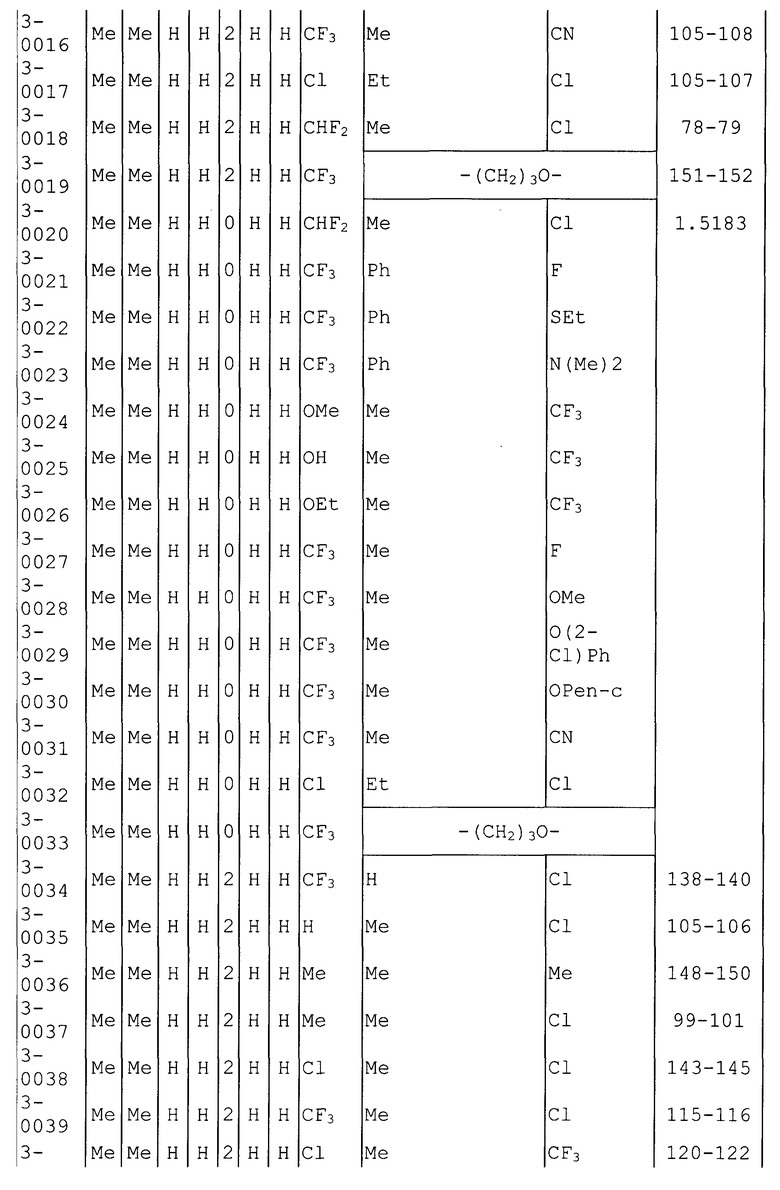
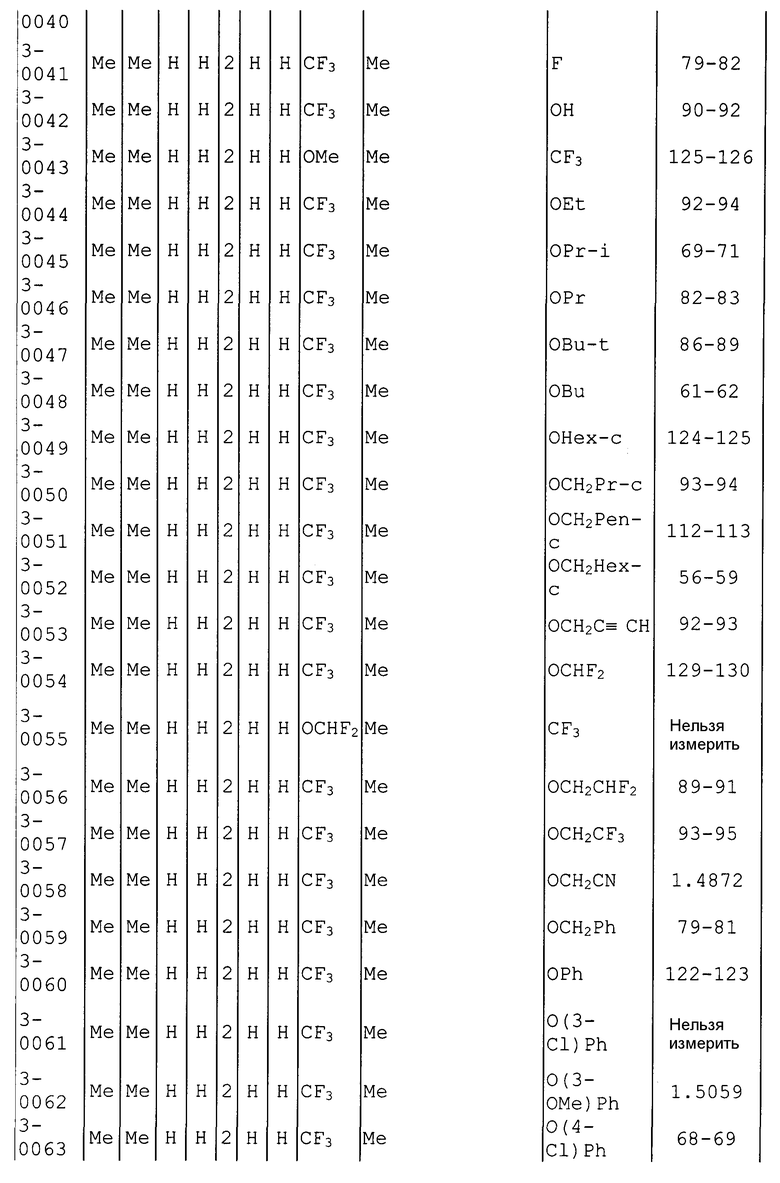
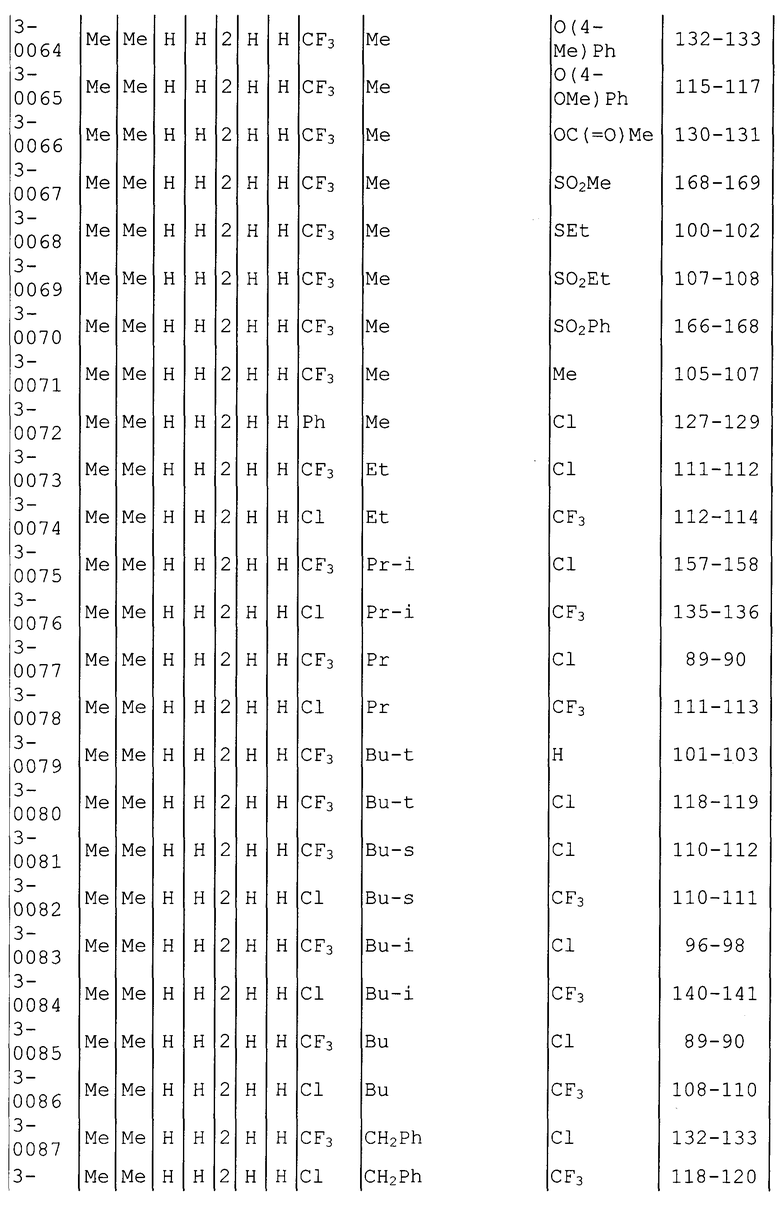
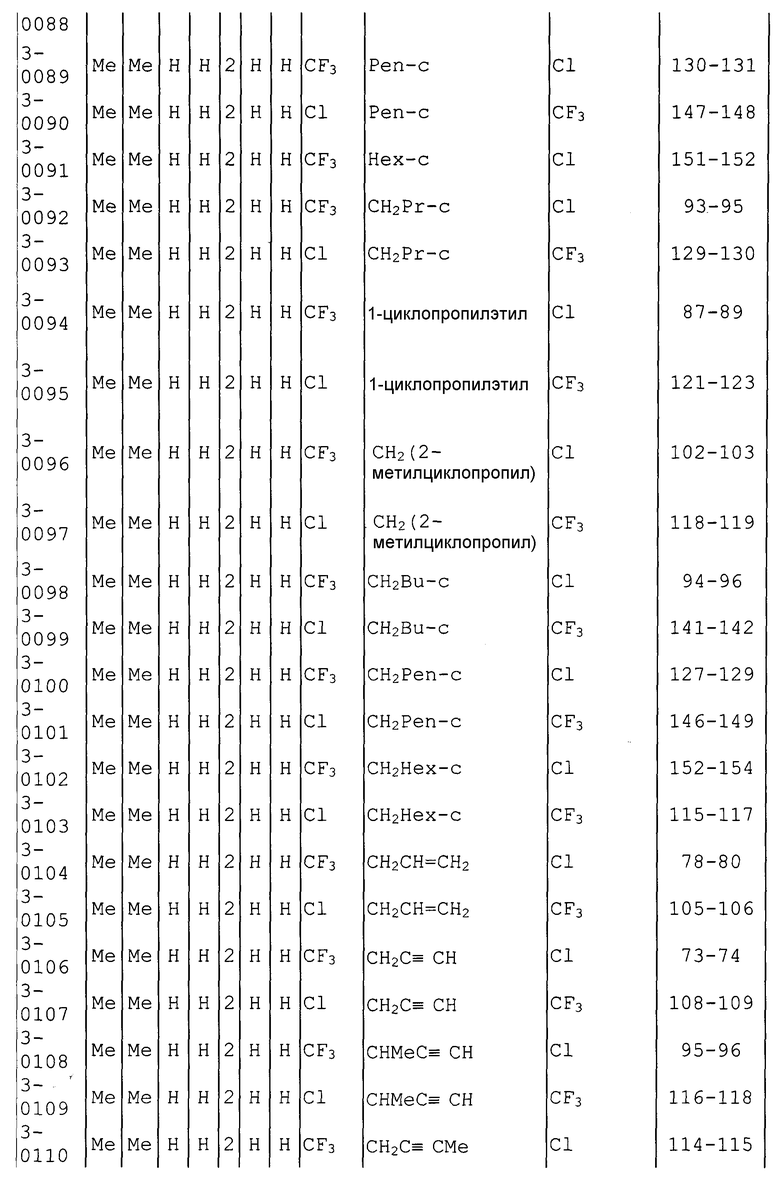
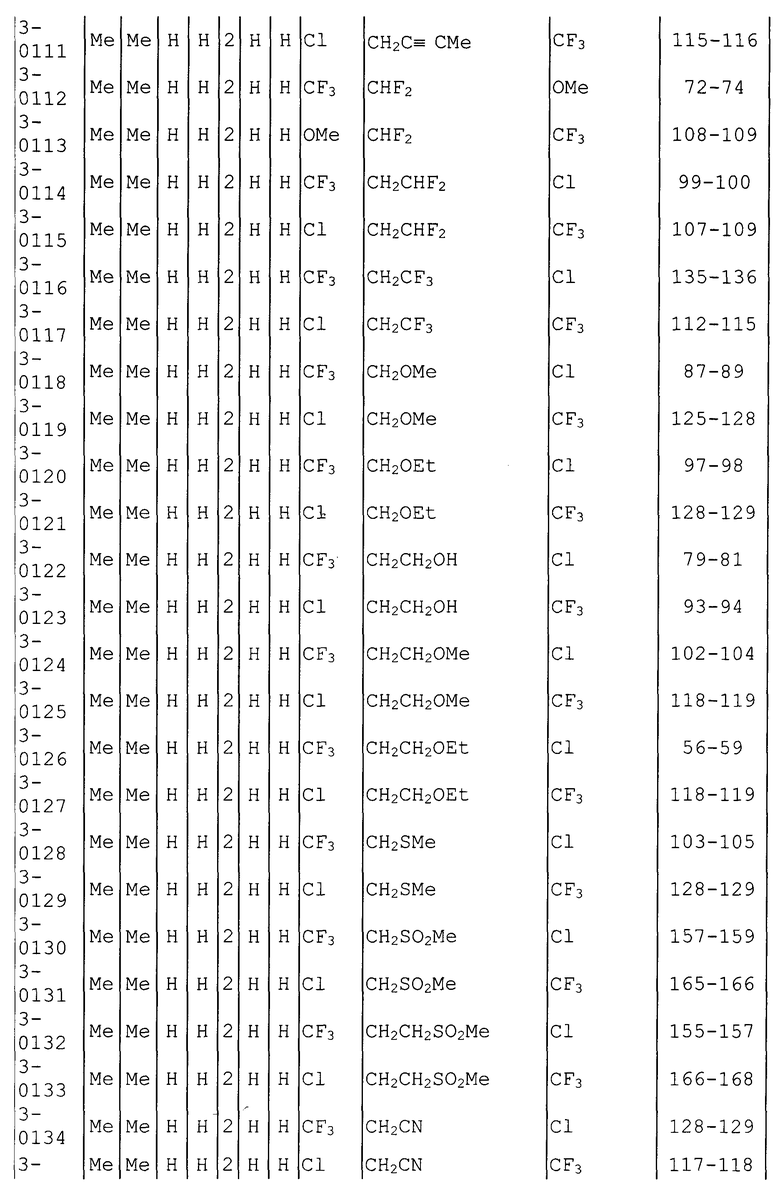
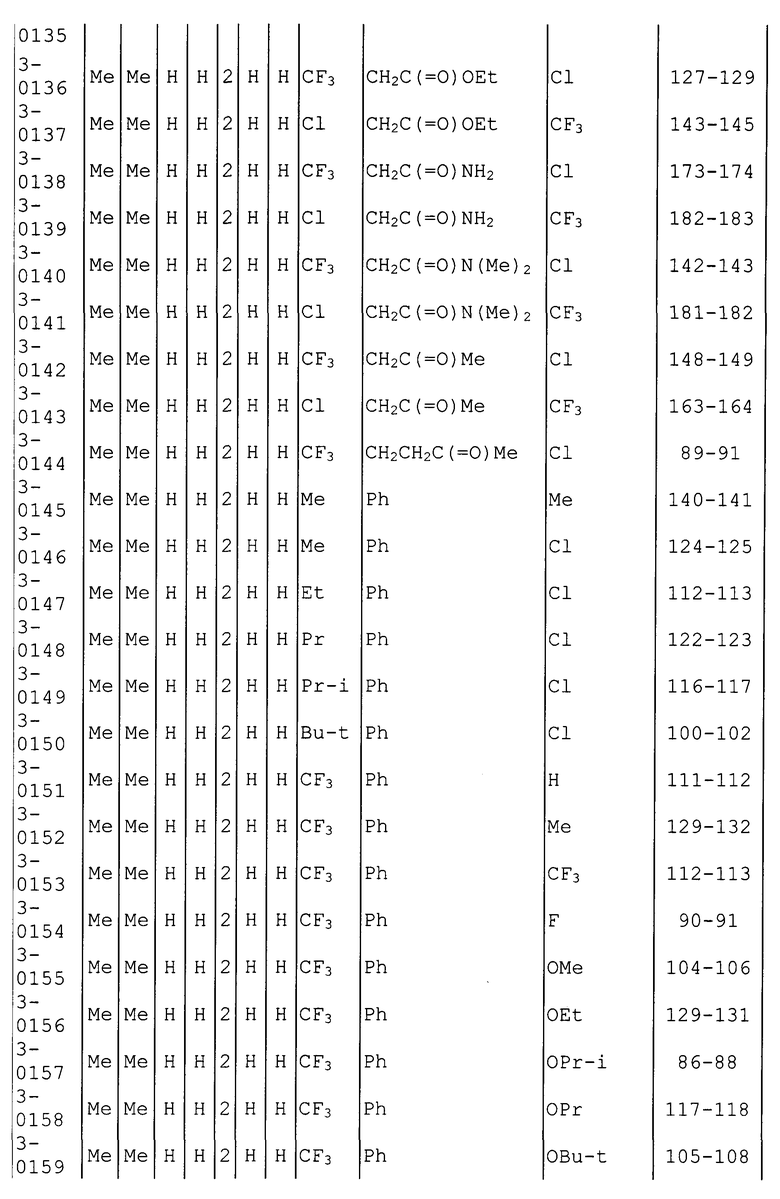
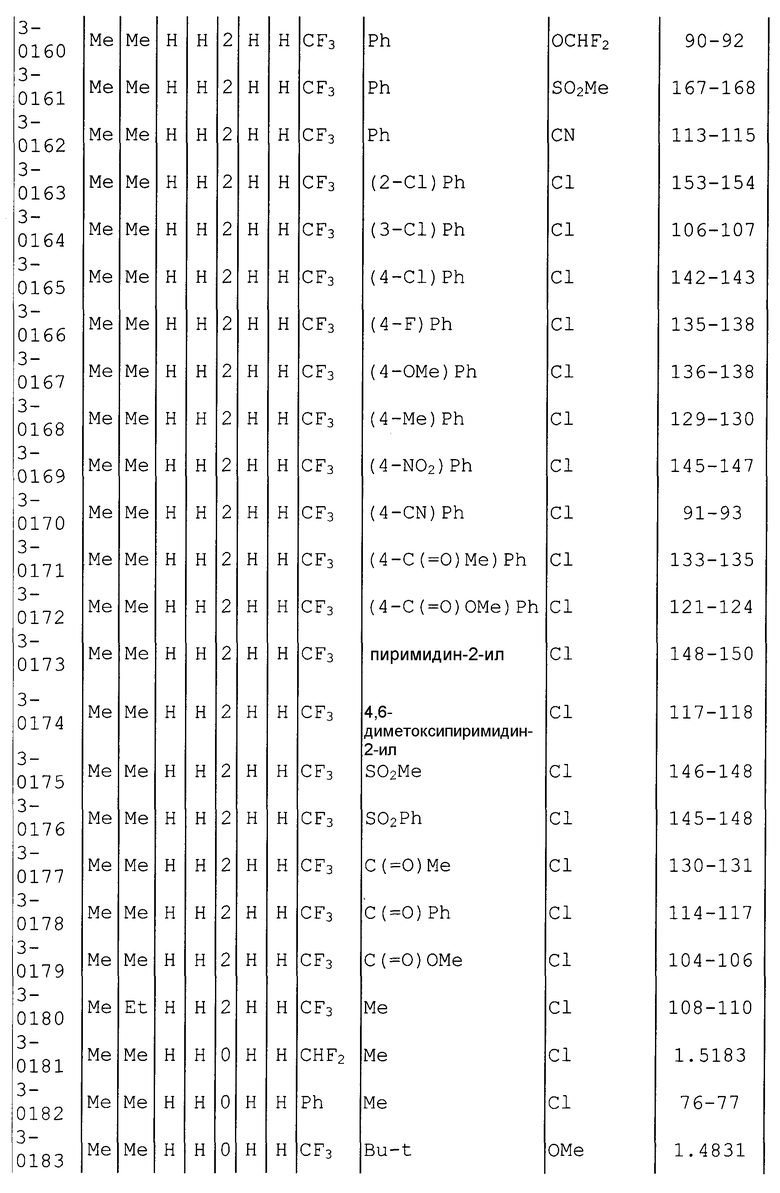
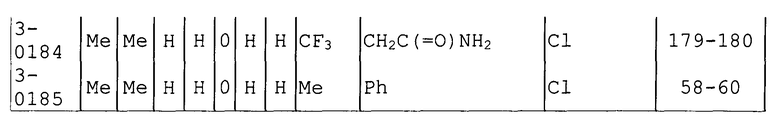
Таблица 14
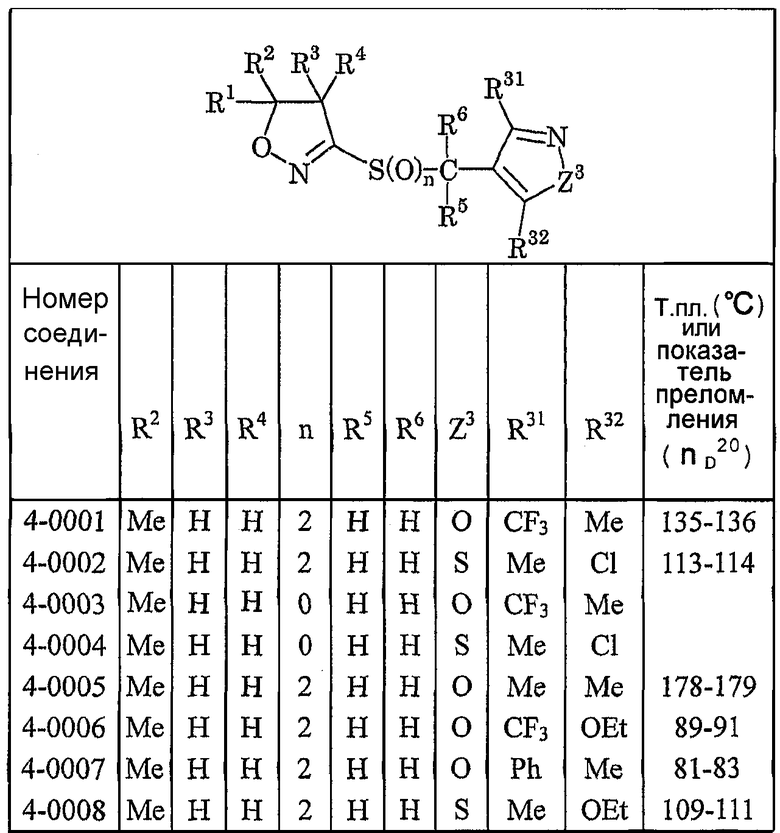
Таблица 15

Таблица 16
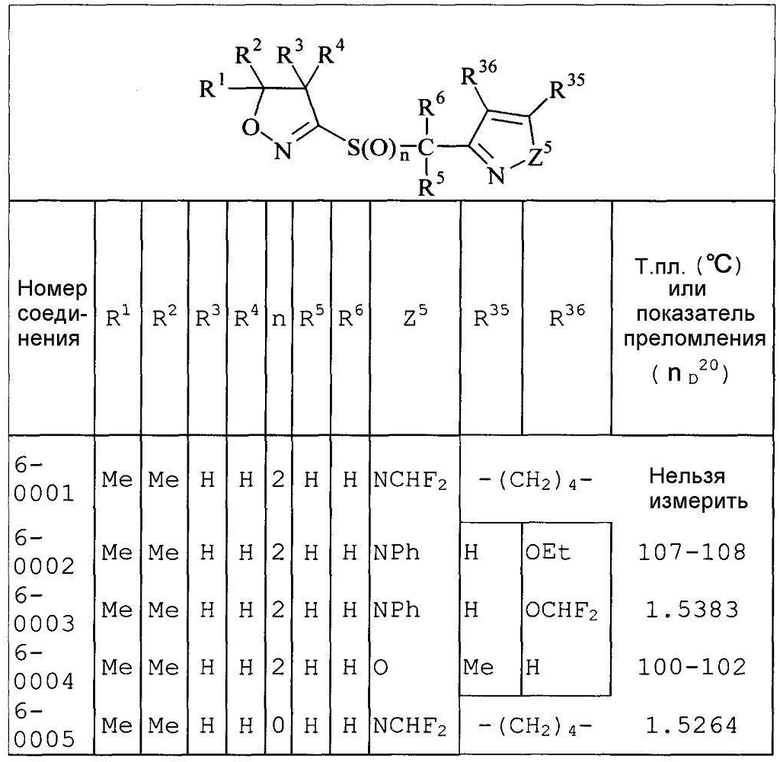
Таблица 17
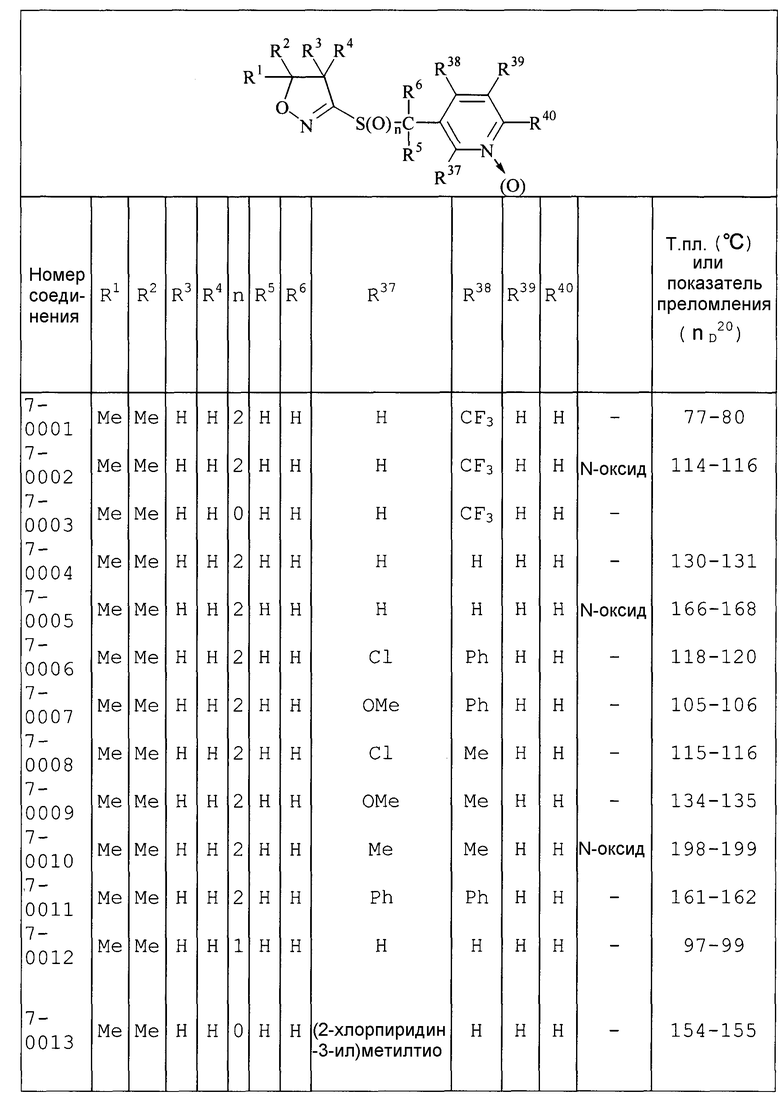
Таблица 18
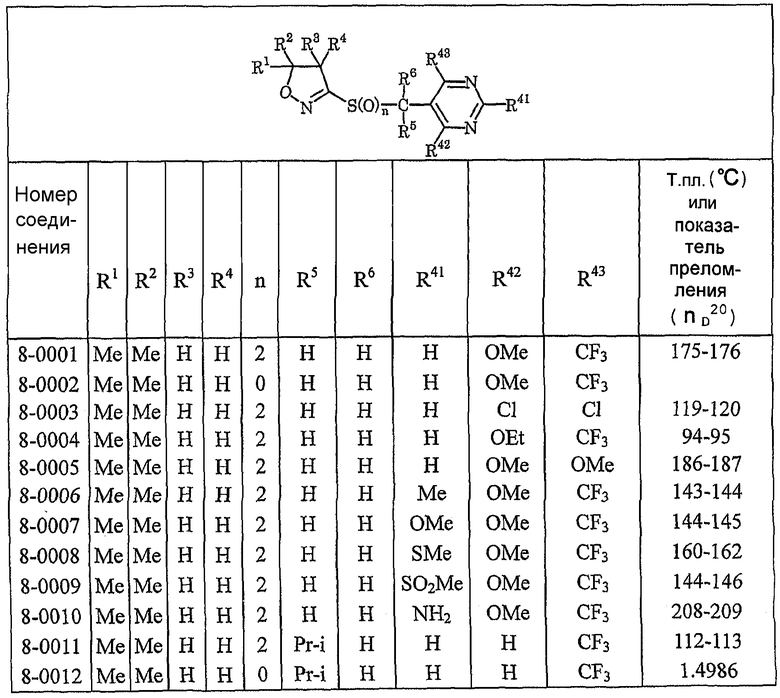
Таблица 19
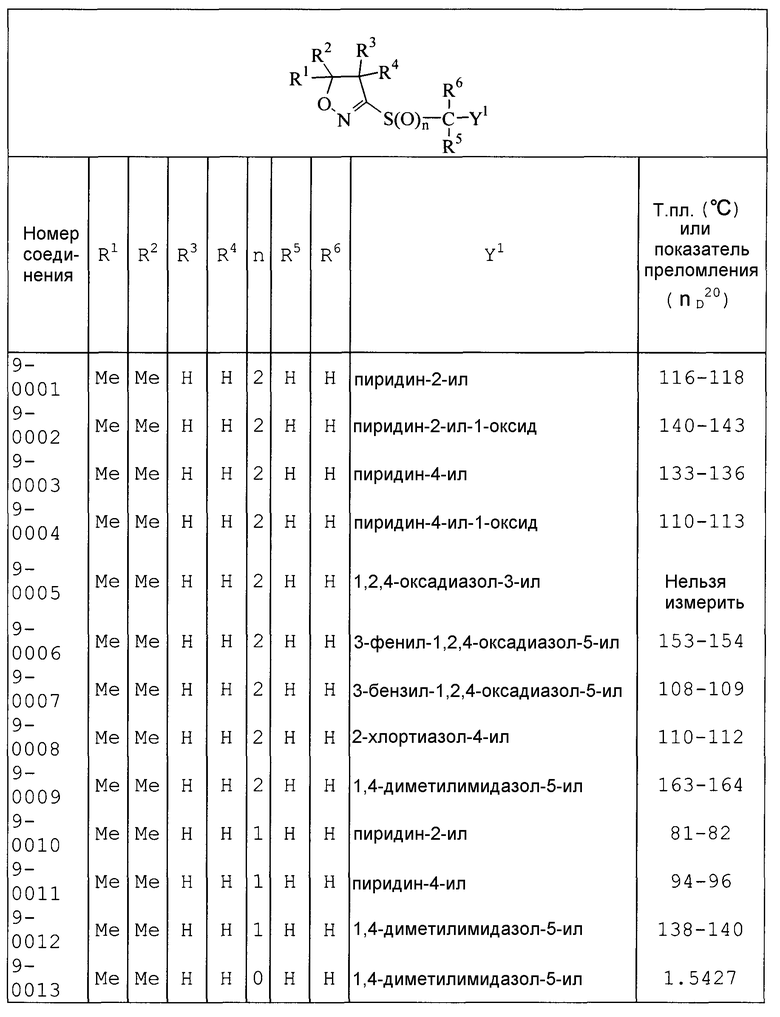
Таблица 20
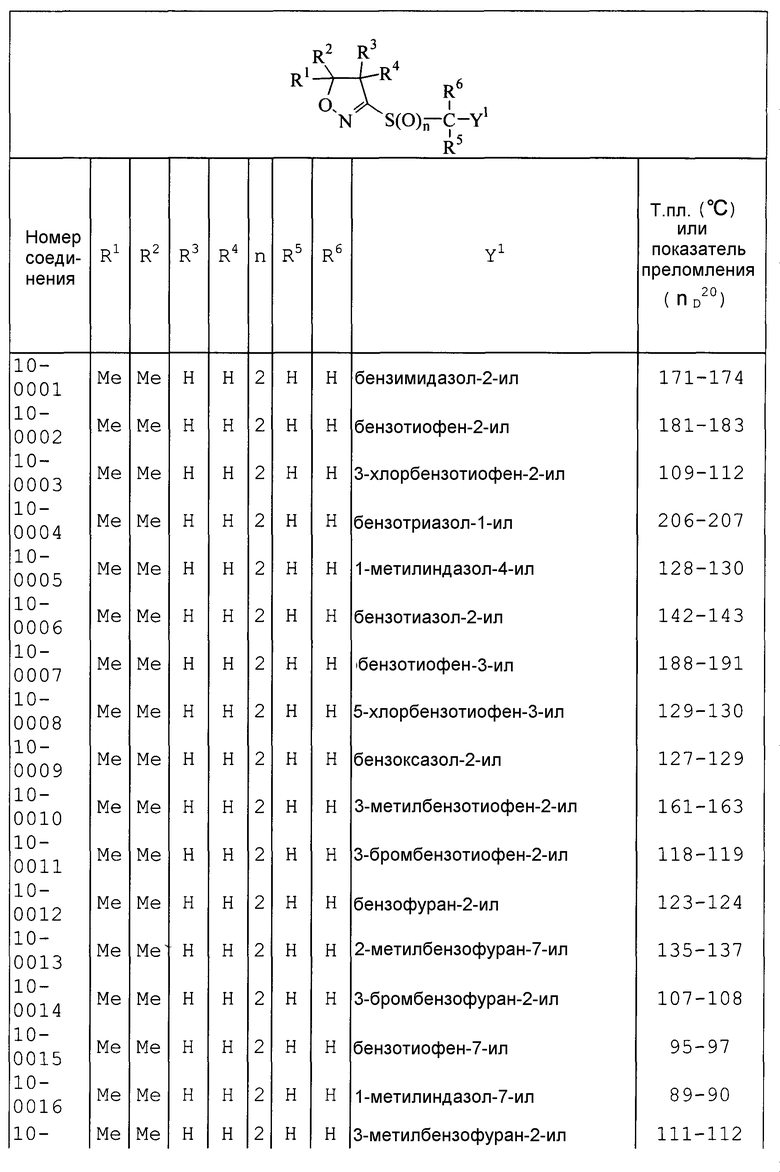
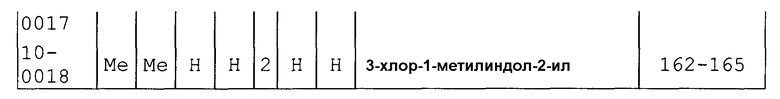
Примеры получения промежуточных соединений
<Справочный пример 1>
Получение 3-хлор-5,5-диметил-2-изоксазолина
К раствору 182,7 г (2,05 моль) альдоксима глиоксиловой кислоты в 2 л 1,2-диметоксиэтана постепенно добавляют при температуре 65-70°С 534,0 г (4,0 моль) N-хлорсукцинимида. Смесь кипятят с обратным холодильником 1 час. Затем к смеси при охлаждении льдом добавляют 1440,0 г (14,4 моль) гидрокарбоната калия и 10 мл воды. Затем добавляют 360,0 г (6,4 моль) 2-метилпропена. Полученную смесь перемешивают при комнатной температуре 24 час для протекания реакции. Реакционную смесь выливают в воду, затем экстрагируют диизопропиловым эфиром. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 107,7 г (выход 40,0%) 3-хлор-5,5-диметил-2-изоксазолина в виде желтой вязкой жидкости.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 2,93 (2Н, с), 1,47 (6Н, с).
<Справочный пример 2>
Получение 3-хлор-5-этил-5-метил-2-изоксазолина
К раствору 20,6 г (231,7 ммоль) альдоксима глиоксиловой кислоты в 500 мл 1,2-диметоксиэтана постепенно добавляют при температуре 60°С 61,9 г (463,4 ммоль) N-хлорсукцинимида. После добавления смесь кипятят с обратным холодильником 10 мин. Затем к смеси при охлаждении льдом добавляют 50 мл (463,4 ммоль) 2-метил-1-бутена, 98,9 г (1,622 ммоль) гидрокарбоната калия и 10 мл воды. Полученную смесь перемешивают 12 час для протекания реакции. Реакционную смесь выливают в воду, затем экстрагируют н-гексаном. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 13,9 г (выход 40,6%) 3-хлор-5-этил-5-метил-2-изоксазолина в виде желтой вязкой жидкости.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 2,91 (2Н, АВкв, J=17,0 Δ ν=46,1 Гц), 1,73 (2Н, кв), 1,42 (3Н, с), 0,96 (3Н, т).
<Справочный пример 3>
Получение 3-бензилтио-5,5-диметил-2-изоксазолина
К раствору 2,8 г (22,5 ммоль) бензилмеркаптана в 50 мл N,N-диметилформамида в атмосфере азота добавляют 3,2 г (23,2 ммоль) безводного карбоната калия и 3,0 г (22,5 ммоль) 3-хлор-5,5-диметил-2-изоксазолина. Смесь перемешивают при 100°С в течение 2 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле, получают 3,1 г (выход 62,0%) 3-бензилтио-5,5-диметил-2-изоксазолина в виде желтого маслянистого вещества (nD 20 = 1,5521).
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 7,24-7,39 (5Н, м), 4,26 (2Н, с), 2,77 (2Н, с), 1,40 (6Н, с).
<Справочный пример 4>
Получение 3-(2,6-дифторбензилсульфинил)-5-этил-5-метил-2-изоксазолина
К раствору 4,1 г (15,0 ммоль) 3-(2,6-дифторбензилтио)-5-этил-5-метил-2-изоксазолина в 50 мл хлороформа добавляют 4,6 г м-хлорнадбензойной кислоты (чистота 70%, 18,8 ммоль) при охлаждении льдом. Смесь перемешивают 1 час и затем при комнатной температуре 12 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия, водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученный остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 1,5 г (выход: 34,8%) 3-(2,6-дифторбензилсульфинил)-5-этил-5-метил-2-изоксазолина в виде белого порошка (температура плавления 30°С или ниже).
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 7,39-7,28 (1Н, м), 7,03-6,94 (2Н, м), 4,38 (2Н, с), 3,04 (1Н, АВкв, J=17,2 Δ ν=85,7 Гц), 3,12 (1Н, с), 1,75 (2Н, м), 1,44 (3Н, с), 1,41 (3Н, с), 0,97 (3Н, м).
<Справочный пример 5>
Получение 3-(2,6-дифторбензилсульфонил)-5-этил-5-метил-2-изоксазолина
К раствору 0,8 г (2,8 ммоль) 3-(2,6-дифторбензилсульфинил)-5-этил-5-метил-2-изоксазолина в 50 мл хлороформа добавляют 1,0 г м-хлорнадбензойной кислоты (чистота 70%, 4,1 ммоль) при охлаждении льдом. Смесь перемешивают 1 час и затем при комнатной температуре 12 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия, водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Полученный остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 0,6 г (выход 75,0%) 3-(2,6-дифторбензилсульфонил)-5-этил-5-метил-2-изоксазолина в виде белого порошка (температура плавления 64-65°С).
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 7,36-7,46 (1Н, м), 6,98-7,04 (2Н, м), 4,73 (2Н, с), 3,04 (1Н, АВкв, J=17,2 Δ ν=51,1 Гц), 1,77 (2Н, кв), 1,46 (3Н, с), 0,97 (3Н, т).
<Справочный пример 6>
Получение 5,5-диметил-3-метилсульфонил-2-изоксазолина
К раствору 143,0 г (1,07 моль) 3-хлор-5,5-диметил-2-изоксазолина в 500 мл N,N-диметилформамида добавляют по каплям при охлаждении льдом 1 кг водного раствора метантиолята натрия (содержание 15%, 2,14 ммоль). Смесь перемешивают при комнатной температуре 12 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 115,0 г (выход 74,1%) 5,5-диметил-3-метилтио-2-изоксазолина. Этот остаток (741,2 ммоль) растворяют в 1 л хлороформа. К раствору при охлаждении льдом добавляют 392,0 г м-хлорнадбензойной кислоты (чистота 70%, 1,59 моль). Полученную смесь перемешивают 1 час и затем при комнатной температуре 12 час для протекания реакции. По окончании реакции остаток м-хлорнадбензойной кислоты отфильтровывают. Полученный фильтрат промывают водным раствором гидросульфита натрия, водой, водным раствором гидрокарбоната натрия и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток промывают диизопропиловым эфиром, получают 77,6 г (выход 59,1%) 5,5-диметил-3-метилсульфонил-2-изоксазолина в виде белого порошка (температура плавления 82-84°С).
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 3,26 (3Н, с), 3,12 (2Н, с), 1,51 (6Н, с).
<Справочный пример 7>
Получение 5,5-диметил-3-этилтио-2-изоксазолина
К раствору, содержащему 3-хлор-5,5-диметил-2-изоксазолин, добавляют 1500 мл водного раствора, содержащего 560 г (9,0 моль) этилмеркаптана и 360,0 г (9,0 моль) гидроксида натрия. Смесь перемешивают при 60-70°С в течение 16 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 270,0 г сырого 5,5-диметил-3-этилтио-2-изоксазолина в виде темно-красного маслянистого вещества.
<Справочный пример 8>
Получение 5,5-диметил-3-этилсульфонил-2-изоксазолина
В 1 л хлороформа растворяют 270,0 г (1,7 моль) сырого маслянистого 5,5-диметил-3-этилтио-2-оксазолина. К раствору при охлаждении льдом добавляют 1050 г м-хлорнадбензойной кислоты (чистота 70%, 6,1 моль). Полученную смесь перемешивают 1 час и затем при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции остаток м-хлорнадбензойной кислоты отфильтровывают. Полученный фильтрат промывают водным раствором гидросульфита натрия, водным раствором гидрокарбоната натрия, водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток промывают н-гексаном, получают 133,6 г (выход 65,4%) 5,5-диметил-3-этилсульфонил-2-изоксазолина в виде белого порошка.
<Справочный пример 9>
Получение 1-фенил-3-трифторметил-1Н-пиразол-5-ол
К раствору 34,1 г (184,9 ммоль) этилтрифторацетоацетата в 500 мл этанола добавляют 20 г (184,9 ммоль) фенилгидразина и 4 мл концентрированной хлористоводородной кислоты. Смесь кипятят с обратным холодильником 1 час для протекания реакции. По окончании реакции реакционную смесь подвергают вакуумной перегонке для удаления большей части содержащегося в ней растворителя. Остаток смешивают с водой для осаждения кристаллов. Кристаллы отфильтровывают, промывают водой до тех пор, пока фильтрат не станет нейтральным, и сушат, получают 37,1 г (выход 87,9%) 1-фенил-3-трифторметил-1Н-пиразол-5-ол в виде коричневато-желтых кристаллов.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 7,68-7,41 (5Н, м), 5,86 (1Н, с), 3,71 (1Н, с).
<Справочный пример 10>
Получение 5-хлор-1-фенил-3-трифторметил-1Н-пиразол-4-карбальдегида
К 7,7 г (105,2 ммоль) N,N-диметилфорамида при охлаждении льдом добавляют 33,6 г (219,1 ммоль) оксихлорида фосфора. К смеси при комнатной температуре добавляют 20 г (87,7 ммоль) 1-фенил-3-трифторметил-1Н-пиразол-5-ола. Полученную смесь кипятят с обратным холодильником 1 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду при охлаждении льдом, затем экстрагируют хлороформом. Полученный органический слой промывают водным раствором гидрокарбоната натрия и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 19,1 г (выход 79,1%) 5-хлор-1-фенил-3-трифторметил-1Н-пиразол-4-карбальдегида в виде белых кристаллов.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 10,06 (1Н, с), 7,57 (5Н, с).
<Справочный пример 11>
Получение (5-хлор-1-фенил-3-трифторметил-1Н-пиразол-4-ил)метанола
Раствор 0,21 г (5,5 ммоль) литийалюминийгидрида в 70 мл ТГФ охлаждают до -30 оС. К раствору постепенно добавляют раствор 3 г (10,9 ммоль) 5-хлор-1-фенил-3-трифторметил-1Н-пиразол-4-карбальдегида в 30 мл тетрагидрофурана. Полученную смесь перемешивают при -30°С в течение 30 мин для протекания реакции. По окончании реакции добавляют этилацетат, после чего перемешивают. Затем добавляют воду, после чего перемешивают некоторое время. Реакционную смесь фильтруют в вакууме. Фильтрат экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 3,0 г (выход 99,9%) (5-хлор-1-фенил-3-трифторметил-1Н-пиразол-4-ил)метанола в виде белых кристаллов.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 7,54-7,51 (5Н, м), 4,71 (2Н, д), 1,79 (1Н, уш.).
<Справочный пример 12>
Получение 4-бромметил-5-хлор-1-фенил-3-трифторметил-1Н-пиразола
Раствор 3,0 г (10,9 ммоль) (5-хлор-1-фенил-3-трифторметил-1Н-пиразол-4-ил)метанола в 60 мл диэтилового эфира охлаждают до -10 оС. К раствору добавляют 1,0 г (3,8 ммоль) трибромида фосфора. Смесь перемешивают при комнатной температуре 1 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 3,6 г (выход 95,8%) 4-бромметил-5-хлор-1-фенил-3-трифторметил-1Н-пиразола в виде белых кристаллов.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 7,58-7,48 (5Н, м), 4,48 (2Н, с).
<Справочный пример 13>
Получение 5-фтор-1-фенил-3-трифторметил-1Н-пиразол-4-карбальдегида
К раствору 33,0 г (120,1 ммоль) 5-хлор-1-фенил-3-трифторметил-1Н-пиразол-4-карбальдегида в 500 мл диметилсульфоксида добавляют 10,5 г (180,2 ммоль) фторида калия. Смесь перемешивают при 100°С в течение 2 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 26,5 г (выход 85,0%) 5-фтор-1-фенил-3-трифторметил-1Н-пиразол-4-карбальдегида.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 9,96 (1Н, с), 7,68-7,51 (5Н, м).
<Справочный пример 14>
Получение (5-фтор-1-фенил-3-трифторметил-1Н-пиразол-4-ил)метанола
К раствору 1,6 г (41,0 ммоль) борогидрида натрия в 300 мл метанола при охлаждении льдом добавляют раствор 26,5 г (102,5 ммоль) 5-фтор-1-фенил-3-трифторметил-1Н-пиразол-4-карбальдегида в 200 мл метанола. Полученную смесь перемешивают при 0°С в течение 30 мин для протекания реакции. По окончании реакции смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 28,5 г (выход 100%) (5-фтор-1-фенил-3-трифторметил-1Н-пиразол-4-ил)метанола.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 7,65-7,41 (5Н, м), 4,68 (2Н, д), 1,73 (1Н, т).
<Справочный пример 15>
Получение 4-бромметил-5-фтор-1-фенил-3-трифторметил-1Н-пиразола
Раствор 27,5 г (105,7 ммоль) (5-фтор-1-фенил-3-трифторметил-1Н-пиразол-4-ил)метанола в 300 мл диэтилового эфира охлаждают до 0°С. К раствору добавляют 10,0 г (37,0 ммоль) трибромида фосфора. Смесь перемешивают при комнатной температуре 2 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют диэтиловым эфиром. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 30,3 г (выход 88,8%) 4-бромметил-5-фтор-1-фенил-3-трифторметил-1Н-пиразола.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 7,66-7,42 (5Н, м), 4,44 (2Н, с).
<Справочный пример 16>
Получение 1-трет-бутил-3-трифторметил-1Н-пиразол-5-ола
К раствору 552,3 г (3,0 моль) этилтрифторацетоацетата в 1500 мл этанола добавляют 373,8 г (3,0 моль) хлоргидрата трет-бутилгидразина и 50 мл концентрированной хлористоводородной кислоты. Смесь кипятят с обратным холодильником 2 дня для протекания реакции. По окончании реакции реакционную смесь подвергают вакуумной перегонке для удаления большей части содержащегося в ней растворителя. Остаток выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток промывают н-гексаном, получают 369,0 г (выход 59,1%) 1-трет-бутил-3-трифторметил-1Н-пиразол-5-ола в виде белого порошка.
<Справочный пример 17>
Получение 1-трет-бутил-5-хлор-3-трифторметил-1Н-пиразол-4-карбальдегида
К 87,7 г (1,2 моль) N,N-диметилфорамида при охлаждении льдом добавляют 462,0 г (3,0 моль) оксихлорида фосфора. К смеси при комнатной температуре добавляют 208,2 г (1,0 моль) 1-трет-бутил-3-трифторметил-1Н-пиразол-5-ола. Полученную смесь кипятят с обратным холодильником 10 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, затем экстрагируют хлороформом. Полученный органический слой промывают водой, 5%-ным водным раствором гидроксида натрия и водой в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 131,5 г (выход 21,7%) 1-трет-бутил-5-хлор-3-трифторметил-1Н-пиразол-4-карбальдегида в виде белых кристаллов.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 9,97 (1Н, д), 1,76 (9Н, с).
<Справочный пример 18>
Получение (1-трет-бутил-5-хлор-3-трифторметил-1Н-пиразол-4-ил)метанола
Раствор 39,9 г (156,9 ммоль) 1-трет-бутил-5-хлор-3-трифторметил-1Н-пиразол-4-карбальдегида в 300 мл метанола охлаждают до 0°С. К раствору постепенно добавляют 6,5 г (172,6 ммоль) борогидрида натрия. Полученную смесь перемешивают при комнатной температуре 3 час для протекания реакции. По окончании реакции смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 37,7 г (выход 93,6%) (1-трет-бутил-5-хлор-3-трифторметил-1Н-пиразол-4-ил)метанола.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 4,60 (2Н, д), 1,72 (9Н, с), 1,58 (1Н, т).
<Справочный пример 19>
Получение 4-бромметил-1-трет-бутил-5-хлор-3-трифторметил-1Н-пиразола
Раствор 9,2 г (35,7 ммоль) (1-трет-бутил-5-хлор-3-трифторметил-1Н-пиразол-4-ил)метанола в 100 мл диэтилового эфира охлаждают до -10°С. К раствору добавляют 11,6 г (42,9 ммоль) трибромида фосфора. Смесь перемешивают при комнатной температуре в течение ночи для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют диэтиловым эфиром. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 10,0 г (выход 87,3%) 4-бромметил-1-трет-бутил-5-хлор-3-трифторметил-1Н-пиразола.
<Справочный пример 20>
Получение (1-трет-бутил-5-хлор-3-трифторметил-1Н-пиразол-4-ил)метантиола
Добавляют 43,5 г (136,1 ммоль) 4-бромметил-1-трет-бутил-5-хлор-3-трифторметил-1Н-пиразола к раствору 21,8 г гидрата гидросульфида натрия (чистота 70%, 272,2 ммоль) в 300 мл N,N-диметилформамида. Смесь перемешивают при комнатной температуре в течение ночи для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют диэтиловым эфиром. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 32,3 г (выход 87,0%) (1-трет-бутил-5-хлор-3-трифторметил-1Н-пиразол-4-ил)метантиола.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 3,65 (2Н, д), 1,90 (1Н, т), 1,70 (9Н, с).
<Справочный пример 21>
Получение (1-трет-бутил-5-метокси-3-трифторметил-1Н-пиразола
К раствору 18,8 г (90,3 ммоль) 1-трет-бутил-3-трифторметил-1Н-пиразол-5-ола в 100 мл N,N-диметилформамида добавляют при комнатной температуре 15,0 г (108,4 ммоль) безводного карбоната калия и 19,3 г (135,5 ммоль) метилиодида. Смесь перемешивают 15 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, затем экстрагируют диэтиловым эфиром. Полученный органический слой промывают водой
и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 20,0 г (выход 99,8%) 1-трет-бутил-5-метокси-3-трифторметил-1Н-пиразола.
<Справочный пример 22>
Получение 1-трет-бутил-4-хлорметил-5-метокси-3-трифторметил-1Н-пиразола
К раствору 20,0 г (90,1 ммоль) 1-трет-бутил-5-метокси-3-трифторметил-1Н-пиразола в 90 мл уксусной кислоты добавляют 5,4 г параформа (180,2 ммоль из расчета на формальдегид) и 20 мл концентрированной хлористоводородной кислоты. Смесь перемешивают при 60°С в течение 30 мин для протекания реакции. По окончании реакции смесь выливают в воду, затем экстрагируют диизопропиловым эфиром. Полученный органический слой промывают водой и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 21,7 г (выход 89,0%) 1-трет-бутил-4-хлорметил-5-метокси-3-трифторметил-1Н-пиразола.
<Справочный пример 23>
Получение 3-метокси-1-метил-5-трифторметил-1Н-пиразола
К раствору 10,0 г (60,2 ммоль) 3-гидрокси-1-метил-5-трифторметил-1Н-пиразола в 50 мл N,N-диметилформамида добавляют при комнатной температуре 10,0 г (72,3 ммоль) безводного карбоната калия и 12,8 г (90,3 ммоль) метилиодида. Смесь перемешивают 15 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют диэтиловым эфиром. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 9,8 г (выход 90,7%) 3-метокси-1-метил-5-трифторметил-1Н-пиразола.
<Справочный пример 24>
Получение 4-хлорметил-3-метокси-1-метил-5-трифторметил-1Н-пиразола
К раствору 1,00 г (5,6 ммоль) 3-метокси-1-метил-5-трифторметил-1Н-пиразола в 25 мл уксусной кислоты добавляют 0,45 г параформа (15,0 ммоль из расчета на формальдегид) и 5 мл концентрированной хлористоводородной кислоты. Смесь перемешивают при 80°С в течение 2 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду и нейтрализуют карбонатом калия, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 0,83 г (выход 65,0%) 4-хлорметил-3-метокси-1-метил-5-трифторметил-1Н-пиразола.
<Справочный пример 25>
Получение 5-фтор-1-метил-3-трифторметил-1Н-пиразол-4-карбальдегида
К раствору 60,4 г (282,7 ммоль) 5-хлор-1-метил-3-трифторметил-1Н-пиразол-4-карбальдегида в 700 мл диметилсульфоксида добавляют 42,0 г (711,9 ммоль) фторида калия. Смесь перемешивают при температуре от 120 до 140°С в течение 5 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: гексан-этилацетат), получают 36,8 г (выход 66,0%) 5-фтор-1-метил-3-трифторметил-1Н-пиразол-4-карбальдегида.
<Справочный пример 26>
Получение (5-фтор-1-метил-3-трифторметил-1Н-пиразол-4-ил)метанола
К раствору 3,9 г (102,6 ммоль) борогидрида натрия в 500 мл метанола при охлаждении льдом добавляют раствор 36,8 г (187,6 ммоль) 5-фтор-1-метил-3-трифторметил-1Н-пиразол-4-карбальдегида в 200 мл метанола. Полученную смесь перемешивают при 0°С в течение 30 мин для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 35,4 г (выход 95,4%) (5-фтор-1-метил-3-трифторметил-1Н-пиразол-4-ил)метанола.
<Справочный пример 27>
Получение 4-бромметил-5-фтор-1-метил-3-трифторметил-1Н-пиразола
Раствор 35,4 г (178,7 ммоль) 5-фтор-1-метил-3-трифторметил-1Н-пиразол-4-метанола в 500 мл диэтилового эфира охлаждают до -30°С. К раствору добавляют 54,0 г (199,5 ммоль) трибромида фосфора. Смесь перемешивают при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют диэтиловым эфиром. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 31,4 г (выход 80,8%) 4-бромметил-5-фтор-1-метил-3-трифторметил-1Н-пиразола.
<Справочный пример 28>
Получение (этоксикарбонил)малондиальдегида
Несколько раз промывают 12,6 г гидрида натрия (чистота 60%, 525,0 ммоль) декантацией диэтиловым эфиром и затем готовят раствор в 500 мл диэтилового эфира. К раствору в токе азота при температуре от 0 до 10°С добавляют 194 г (2,6 ммоль) этилформиата и 50 г (262,0 ммоль) этил-3,3-диэтоксипропионата. Полученную смесь перемешивают при комнатной температуре 15 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего промывают диэтиловым эфиром. Полученный водный слой доводят до рН 1 с помощью хлористоводородной кислоты, после чего экстрагируют дихлорметаном. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 37,6 г (выход 100%) сырого (этоксикарбонил)малондиальдегида в виде темно-красного маслянистого вещества.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 9,09 (2Н, с), 5,26 (1Н, с), 4,27 (2Н, кв), 1,28 (3Н, т).
<Справочный пример 29>
Получение этил-1Н-пиразол-4-карбоксилата
К раствору 27,6 г (192 ммоль) (этоксикарбонил) малондиальдегида в 150 мл этанола при охлаждении льдом добавляют 6,2 г (193 ммоль) гидразина. Смесь перемешивают при комнатной температуре 17 час для протекания реакции. Реакционную смесь подвергают вакуумной перегонке для удаления содержащегося в нем этанола. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель дихлорметан-этилацетат), получают 19,4 г (выход 72,4%) этил-1Н-пиразол-4-карбоксилата в виде желтых кристаллов.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 8,08 (2Н, с), 5,30 (1Н, с), 4,31 (2Н, кв), 1,36 (3Н, т).
<Справочный пример 30>
Получение этил-1-этил-1Н-пиразол-4-карбоксилата
К раствору 1,5 г (10,7 ммоль) этил-1Н-пиразол-4-карбоксилата в 50 мл N,N-диметилформамида добавляют 3,7 г (26,8 ммоль) безводного карбоната калия и 4,2 г (26,6 ммоль) этилиодида. Смесь перемешивают при комнатной температуре 20 час для протекания реакции. По окончании реакции смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 1,6 г (выход 88,9%) этил-1-этил-1Н-пиразол-4-карбоксилата в виде желтого маслянистого вещества.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 7,90 (2Н, с), 4,28(2Н, кв), 4,18 (2Н, кв), 1,51 (3Н, т), 1,35 (3Н, т).
<Справочный пример 31>
Получение этил-3,5-дихлор-1-этил-1Н-пиразол-4-карбоксилата
В запаянную стеклянную трубку помещают 1,6 г (9,5 ммоль) этил-1-этил-1Н-пиразол-4-карбоксилата и 5,1 г (38,3 ммоль) N-хлорсукцинимида. Затем смеси дают возможность прореагировать при 160°С в течение 6 час. По окончании реакции реакционную смесь охлаждают до комнатной температуры, промывают тетрахлоридом углерода и хлороформом и фильтруют под вакуумом. Полученный фильтрат (органический слой) промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 1,0 г (выход 44,2%) этил-3,5-дихлор-1-этил-1Н-пиразол-4-карбоксилата в виде желтого маслянистого вещества.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 4,36 (2Н, кв), 4,21 (2Н, кв), 1,44 (3Н, т), 1,38 (3Н, т).
<Справочный пример 32>
Получение (3,5-дихлор-1-этил-1Н-пиразол-4-ил)метанола
Раствор 0,16 г (4,2 ммоль) литийалюминийгидрида в 70 мл ТГФ охлаждают до -50°С. К смеси постепенно добавляют раствор 1,0 г (4,2 ммоль) этил-3,5-дихлор-1-этил-1Н-пиразол-4-карбоксилата в 30 мл тетрагидрофурана. Полученную смесь перемешивают при -50°С в течение 3 час для протекания реакции. После подтверждения окончания реакции добавляют этилацетат, после чего перемешивают некоторое время. Добавляют воду и затем перемешивают некоторое время. Полученную смесь фильтруют под вакуумом. Фильтрат экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 0,82 г (выход 100%) (3,5-дихлор-1-этил-1Н-пиразол-4-ил)метанола в виде коричневого маслянистого вещества.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 4,52 (2Н, с), 4,16 (2Н, кв), 1,43 (3Н, т).
<Справочный пример 33>
Получение 4-бромметил-3,5-дихлор-1-этил-1Н-пиразола
Раствор 0,82 г (4,2 ммоль) (3,5-дихлор-1-этил-1Н-пиразол-4-ил)метанола в 50 мл диэтилового эфира охлаждают до -30°С. К раствору добавляют 1,3 г (4,8 ммоль) трибромида фосфора. Смесь перемешивают при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 0,9 г (выход 81,8%) 4-бромметил-3,5-дихлор-1-этил-1Н-пиразола в виде желтого маслянистого вещества.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 4,33 (2Н, с), 4,13 (2Н, кв), 1,43 (3Н, т).
<Справочный пример 34>
Получение 3-дифторметил-1-метил-1Н-пиразол-5-ола
К раствору 30,0 г (180,6 ммоль) этилдифторацетоацетата в 200 мл этанола добавляют 8,3 г (180,6 ммоль) метилгидразина и 5 мл концентрированной хлористоводородной кислоты. Смесь кипятят с обратным холодильником 2 дня для протекания реакции. По окончании реакции реакционную смесь подвергают вакуумной перегонке для удаления большей части содержащегося в ней растворителя. Остаток выливают в воду. Доводят рН смеси до 4 с использованием лимонной кислоты и экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 8,9 г (выход 33,3%) 3-дифторметил-1-метил-1Н-пиразол-5-ола.
<Справочный пример 35>
Получение 5-хлор-3-дифторметил-1-метил-1Н-пиразол-4-карбальдегида
К 7,9 г (108,0 ммоль) N,N-диметилфорамида при охлаждении льдом добавляют 41,6 г (270,1 ммоль) оксихлорида фосфора. К смеси при комнатной температуре добавляют 8,0 г (54,0 ммоль) 3-дифторметил-1-метил-1Н-пиразол-5-ола. Полученную смесь кипятят с обратным холодильником 4 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду при охлаждении льдом, затем экстрагируют хлороформом. Полученный органический слой промывают водой, 5%-ным водным раствором гидроксида натрия и водой в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 7,7 г (выход 73,3%) 5-хлор-3-дифторметил-1-метил-1Н-пиразол-4-карбальдегида в виде белых кристаллов.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 9,96 (1Н, с), 6,90 (1Н, т, J=53,3 Гц), 3,93 (3Н, с).
<Справочный пример 36>
Получение (5-хлор-3-дифторметил-1-метил-1Н-пиразол-4-ил)метанола
Раствор 7,2 г (37,0 ммоль) 5-хлор-3-дифторметил-1-метил-1Н-пиразол-4-карбальдегида в 100 мл метанола охлаждают до 0°С. К раствору постепенно добавляют 2,1 г (55,5 ммоль) борогидрида натрия. Полученную смесь перемешивают при комнатной температуре в течение 3 час для протекания реакции. По окончании реакции смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 3,8 г (выход 52,1%) (5-хлор-3-дифторметил-1-метил-1Н-пиразол-4-ил)метанола.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 6,70 (1Н, т, J=40,8 Гц), 4,63 (2Н, с), 3,86 (3Н, с), 1,79 (1Н, уш.).
<Справочный пример 37>
Получение 4-бромметил-5-хлор-3-дифторметил-1-метил-1Н-пиразола
Раствор 2,0 г (10,0 ммоль) (5-хлор-3-дифторметил-1-метил-1Н-пиразол-4-ил)метанола в 50 мл диэтилового эфира охлаждают до -10°С. К раствору добавляют 1,0 г (3,5 ммоль) трибромида фосфора. Смесь перемешивают при комнатной температуре в течение ночи для протекания реакции. По окончании реакции реакционную смесь выливают в воду при охлаждении льдом, после чего экстрагируют диэтиловым эфиром. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 2,6 г (выход 100%) 4-бромметил-5-хлор-3-дифторметил-1-метил-1Н-пиразола.
<Справочный пример 38>
Получение эфирата оксима трифторацетальдегида
К раствору 50,0 г (347,0 ммоль) полуэтилацеталя трифторуксусного альдегида в 80 мл метанола добавляют 24,1 г (347,0 ммоль) гидрохлорида гидроксиламина и 160 мл воды. К смеси по каплям при охлаждении льдом добавляют 80,0 г 50%-ного водного раствора гидроксида натрия (1,7 моль). По окончании добавления полученную смесь перемешивают при комнатной температуре 6 час для протекания реакции. По окончании реакции добавляют 10%-ную хлористоводородную кислоту для установления рН 6. Полученную смесь экстрагируют диэтиловым эфиром. Экстракт подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток подвергают перегонке, получают 24,7 г (выход 38,0%) эфирата оксима трифторацетальдегида.
<Справочный пример 39>
Получение эфирата трифторацетогидроксимоилбромида
Раствор 38,8 г (218,0 ммоль) N-бромсукцинимида в 125 мл N,N-диметилформамида при охлаждении льдом добавляют к раствору 24,7 г (131,7 ммоль) эфирата оксима трифторацетальдегида в 50 мл N,N-диметилформамида. Смесь перемешивают при комнатной температуре 3 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют диэтиловым эфиром. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток перегоняют, получают 33,3 г (выход 95,0%) эфирата трифторацетогидроксимоилбромида в виде коричневого маслянистого вещества.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 9,30 (1Н, с).
<Справочный пример 40>
Получение 4-этоксикарбонил-5-метил-3-трифторметилизоксазола
К раствору 6,7 г (51,3 ммоль) этилацетоацетата в 80 мл метанола добавляют 2,8 г (51,3 ммоль) метоксида натрия. К смеси при охлаждении льдом добавляют раствор 5,0 г (18,8 ммоль) эфирата трифторгидроксимоилбромида в 20 мл метанола. Полученную смесь перемешивают при комнатной температуре 3 час для протекания реакции. По окончании реакции реакционную смесь подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. К остатку добавляют воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан-этилацетат), получают 2,9 г (выход 69,0%) 4-этоксикарбонил-5-метил-3-трифторметилизоксазола в виде бесцветного маслянистого вещества.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 4,36 (2Н, кв), 2,77 (3Н, с), 1,37 (3Н, т).
<Справочный пример 41>
Получение (5-метил-3-трифторметилизоксазол-4-ил)метанола
Раствор 0,16 г (4,2 ммоль) литийалюминийгидрида в 15 мл ТГФ охлаждают до 0°С. К раствору постепенно добавляют раствор 0,93 г (4,2 ммоль) 4-этоксикарбонил-5-метил-3-трифторметилизоксазола в 15 мл ТГФ. Смесь перемешивают при 0°С в течение 1 час для протекания реакции. По окончании реакции добавляют этилацетат, после чего перемешивают некоторое время. Добавляют воду и перемешивают некоторое время. Полученную смесь фильтруют под вакуумом. Фильтрат экстрагируют диэтиловым эфиром. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 0,5 г (выход 60,0%) (5-метил-3-трифторметилизоксазол-4-ил)метанола.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 4,60 (2Н, д), 2,54 (3Н, с), 1,66 (1Н, уш.).
<Справочный пример 42>
Получение 4-бромметил-5-метил-3-трифторметилизоксазола
Раствор 0,45 г (2,5 ммоль) (5-метил-3-трифторметилизоксазол-4-ил)метанола в 10 мл диэтилового эфира охлаждают до 0°С. К раствору добавляют 0,2 г (8,9 ммоль) трибромида фосфора. Смесь перемешивают при комнатной температуре 1 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, после чего экстрагируют диэтиловым эфиром. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 0,5 г (выход 74,0%) 4-бромметил-5-метил-3-трифторметилизоксазола.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 4,31 (2Н, д), 2,51 (3Н, с).
<Справочный пример 43>
Получение (5-хлор-3-метилизотиазол-4-ил)метанола
Раствор 2,06 г (10,0 ммоль) этил-5-хлор-3-метилизотиазол-4-карбоксилата в 10 мл ТГФ при -30°С добавляют по каплям к раствору 0,42 г (11,0 ммоль) литийалюминийгидрида в 10 мл ТГФ. Смесь перемешивают при той же температуре 1 час для протекания реакции. После подтверждения окончания реакции к реакционной смеси добавляют этилацетат. Полученную смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле, получают 1,50 г (выход 91,5%) (5-хлор-3-метилизотиазол-4-ил)метанола.
<Справочный пример 44>
Получение 4-хлорметил-5-хлор-3-метилизотиазола
К раствору 1,50 г (9,15 ммоль) (5-хлор-3-метилизотиазол-4-ил)метанола в 10 мл хлороформа добавляют при комнатной температуре 3,26 г (27,44 ммоль) тионилхлорида. Смесь перемешивают 3 час для протекания реакции. После подтверждения окончания реакции реакционную смесь подвергают вакуумной перегонке для удаления содержащегося в ней растворителя, получают 1,67 г (выход количественный) 4-хлорметил-5-хлор-3-метилизотиазола.
<Справочный пример 45>
Получение метил-4-трифторметилникотината
К раствору 4,6 г (24,1 ммоль) 4-трифторметилникотиновой кислоты в 70 мл N,N-диметилформамида добавляют 6,7 г (48,6 ммоль) безводного карбоната калия и 6,9 г (48,6 ммоль) метилиодида. Смесь перемешивают при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан - этилацетат), получают 2,77 г (выход 56,1%) метил-4-трифторметилникотината в виде желтого маслянистого вещества.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 9,11 (1Н, с), 8,92 (1Н, д), 7,64 (1Н, д), 3,99 (3Н, с).
<Справочный пример 46>
Получение (4-трифторметилпиридин-3-ил)метанола
Раствор 0,37 г (9,7 ммоль) литийалюминийгидрида в 100 мл ТГФ охлаждают до -50°С. К раствору постепенно по каплям добавляют раствор 2,0 г (9,8 ммоль) 4-трифторметилникотината в 30 мл ТГФ. Смесь перемешивают при -50°С в течение 3 час для протекания реакции. После подтверждения окончания реакции добавляют этилацетат, после чего перемешивают некоторое время. Добавляют воду и перемешивают некоторое время. Реакционную смесь фильтруют под вакуумом. Фильтрат экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан - этилацетат), получают 0,6 г (выход 35,3%) (4-трифторметилпиридин-3-ил)метанола в виде желтого маслянистого вещества.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 9,00 (1Н, с), 8,73 (1Н, д), 7,51 (1Н, д), 4,95 (2Н, с).
<Справочный пример 47>
Получение 3-бромметил-4-трифторметилпиридина
Раствор 0,6 г (3,4 ммоль) (4-трифторметилпиридин-3-ил)метанола в 50 мл диэтилового эфира охлаждают до -30°С. К раствору добавляют 1,4 г (5,2 ммоль) трибромида фосфора. Смесь перемешивают при комнатной температуре 12 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 0,61 г (выход 75,3%) 3-бромметил-4-трифторметилпиридина в виде желтого маслянистого вещества.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 8,88 (1Н, с), 8,73 (1Н, д), 7,54 (1Н, д), 4,63 (2Н, с).
<Справочный пример 48>
Получение 5-бром-4-гидрокси-6-трифторметилпиримидина
К раствору 49,2 г (300,0 ммоль) 4-гидрокси-6-трифторметилпиримидина в 600 мл уксусной кислоты при комнатной температуре добавляют 77,5 г (945,0 ммоль) безводного ацетата натрия. К смеси при 45°С постепенно добавляют 50,3 г (315 ммоль) брома. Полученную смесь перемешивают при той же температуре 3 час для протекания реакции. После подтверждения окончания реакции реакционную смесь подвергают вакуумной перегонке для удаления содержащегося в ней растворителя. Остаток выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток промывают н-гексаном, получают 38,9 г (выход 53,4%) 5-бром-4-гидрокси-6-трифторметилпиримидина.
<Справочный пример 49>
Получение 5-бром-4-хлор-6-трифторметилпиримидина
В 18,5 г (120,0 ммоль) оксихлорида фосфора суспендируют 24,3 г (100,0 ммоль) 5-бром-4-гидрокси-6-трифторметилпиримидина. Смесь перемешивают при 100°С в течение 2 час для протекания реакции. После подтверждения окончания реакции реакционную смесь выливают постепенно в воду, затем экстрагируют хлороформом. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле, получают 21,5 г (выход 82,4%) 5-бром-4-хлор-6-трифторметилпиримидина.
<Справочный пример 50>
Получение 5-бром-4-метокси-6-трифторметилпиримидина
К раствору 21,5 г (82,2 ммоль) 5-бром-4-хлор-6-трифторметилпиримидина в 100 мл метанола добавляют при комнатной температуре 16,7 мл метоксида натрия (28%-ный метанольный раствор, 86,4 ммоль). Смесь перемешивают для протекания реакции. После подтверждения окончания реакции реакционную смесь подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток промывают н-гексаном, получают 19,2 г (выход 91,0%) 5-бром-4-метокси-6-трифторметилпиримидина.
<Справочный пример 51>
Получение 5-бром-4-этокси-6-трифторметилпиримидина
К раствору 3,00 г (11,48 ммоль) 5-бром-4-хлор-6-трифторметилпиримидина в 50 мл этанола добавляют при комнатной температуре 0,94 г (13,77 ммоль) этоксида натрия. Смесь перемешивают для протекания реакции. После подтверждения окончания реакции реакционную смесь подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток выливают в воду, после чего экстрагируют хлороформом. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле, получают 2,44 г (выход 82,9%) 5-бром-4-этокси-6-трифторметилпиримидина.
<Справочный пример 52>
Получение 4-метокси-6-трифторметилпиримидин-5-карбальдегида
К раствору 10,3 г (40,0 ммоль) 5-бром-4-метокси-6-трифторметилпиримидина в 100 мл тетрагидрофурана при температуре от -65 до -60°С постепенно добавляют 30,0 мл н-бутиллития (1,6 моль/л раствор в н-гексане, 48,0 ммоль). Смесь перемешивают 30 мин. К смеси при той же температуре добавляют 3,6 г (48,0 ммоль) этилформиата. Полученную смесь перемешивают при той же температуре 3 час для протекания реакции. Реакционную смесь выливают в воду, после чего экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле, получают 1,3 г (выход 15,8%) 4-метокси-6-трифторметилпиримидин-5-карбальдегида.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 10,41 (1Н, кв), 8,91 (1Н, с), 4,18 (3Н, с).
<Справочный пример 53>
Получение 4-этокси-6-трифторметилпиримидин-5-карбальдегида
Раствор 5,76 г (21,3 ммоль) 5-бром-4-этокси-6-трифторметилпиримидина в 250 мл ТГФ охлаждают до -78°С. К раствору постепенно по каплям добавляют 22,6 мл н-бутиллития (1,6 моль/л раствор в н-гексане, 36,1 ммоль). Смесь перемешивают 40 мин. К смеси добавляют 2,7 г (45,1 ммоль) метилформиата. Полученную смесь перемешивают 1,5 час для протекания реакции. По окончании реакции добавляют водный раствор хлорида аммония. Смесь экстрагируют диэтиловым эфиром. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан - этилацетат), получают 3,82 г (выход 81,6%) 4-этокси-6-трифторметилпиримидин-5-карбальдегида.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 10,41 (1Н, с), 8,95 (1Н, с), 4,63 (2Н, кв), 1,48 (3Н, т).
<Справочный пример 54>
Получение (4-метокси-6-трифторметилпиримидин-5-ил)метанола
К раствору 1,3 г (6,3 ммоль) 4-метокси-6-трифторметилпиримидин-5-карбальдегида в 30 мл метанола постепенно при комнатной температуре добавляют 0,24 г (6,3 ммоль) борогидрида натрия. Смесь перемешивают 3 час для протекания реакции. После подтверждения окончания реакции смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 0,42 г (выход 32,1%) (4-метокси-6-трифторметилпиримидин-5-ил)метанола.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 8,93 (1Н, с), 4,81 (2Н, с), 4,13 (3Н, с), 2,26 (1Н, уш.).
<Справочный пример 55>
Получение (4-этокси-6-трифторметилпиримидин-5-ил)метанола
Раствор 3,82 г (17,2 ммоль) 4-этокси-6-трифторметилпиримидин-5-карбальдегида в 50 мл метанола при охлаждении льдом добавляют к раствору 1,7 г (45,7 ммоль) борогидрида натрия в 50 мл метанола. Полученную смесь перемешивают при 0°С в течение 1 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 3,77 г (выход 97,8%) (4-этокси-6-трифторметилпиримидин-5-ил)метанола.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 8,80 (1Н, с), 4,81 (2Н, с), 4,59 (2Н, кв), 2,28 (1Н, уш.), 1,48 (3Н, т).
<Справочный пример 56>
Получение 5-хлорметил-4-метокси-6-трифторметилпиримидина
К раствору 0,42 г (2,02 ммоль) (4-метокси-6-трифторметилпиримидин-5-ил)метанола при комнатной температуре добавляют 1,19 г (10,1 ммоль) тионилхлорида. Смесь перемешивают 3 час для протекания реакции. После подтверждения окончания реакции реакционную смесь подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 0,45 г (выход количественный) 5-хлорметил-4-метокси-6-трифторметилпиримидина.
<Справочный пример 57>
Получение 5-бромметил-4-этокси-6-трифторметилпиримидина
Раствор 3,77 г (17,0 ммоль) (4-этокси-6-трифторметилпиримидин-5-ил)метанола в 50 мл диэтилового эфира охлаждают до 0°С. К раствору добавляют 2,0 г (7,2 ммоль) трибромида фосфора. Смесь перемешивают при комнатной температуре 1 час. Полученную соль растворяют с использованием метанола. Полученную смесь перемешивают 1 час для протекания реакции. Реакционную смесь выливают в воду, после чего экстрагируют диэтиловым эфиром. Полученный органический слой промывают водным раствором хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают сырой 5-бромметил-4-этокси-6-трифторметилпиримидин.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 8,79 (1Н, с), 4,61 (2Н, кв), 4,55 (2Н, с), 1,49 (3Н, т).
<Справочный пример 58>
Получение (2-хлор-4-метилпиридин-3-ил)метанола
Раствор 1,9 г (10,0 ммоль) метил-2-хлор-4-метилникотината в 5,0 мл ТГФ при температуре от -65 до -60°С постепенно добавляют к суспензии 0,4 г (10,0 ммоль) литийалюминийгидрида в 30 мл тетрагидрофурана. Смесь перемешивают в течение 30 мин и при -20°С в течение 1 час для протекания реакции. Реакционную смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле, получают 0,6 г (выход: 38,2%) (2-хлор-4-метилпиридин-3-ил)метанола.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 8,19 (1Н, д), 7,08 (1Н, д), 4,85 (2Н, с), 2,49 (3Н, с)
<Справочный пример 59>
Получение 3-ацетил-4-хлорметил-2,5-дихлортиофена
К раствору 5,0 г (32,4 ммоль) 3-ацетил-2,5-дихлортиофена в 26 мл (323,0 ммоль) хлорметилметилового эфира добавляют по каплям при 10°С при охлаждением льдом 33 мл тетрахлорида титана (2 моль/л, дихлорметановый раствор). Смесь перемешивают при комнатной температуре 2 час для протекания реакции. По окончании реакции реакционную смесь выливают в воду, затем экстрагируют хлороформом. Полученный органический слой промывают бикарбонатом натрия, водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан - этилацетат, 9/1), получают 2,6 г (выход 39,7%) 3-ацетил-4-хлорметил-2,5-дихлортиофена в виде желтых кристаллов.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 4,70 (2Н, с), 2,56 (3Н, с), 2,54 (3Н, с), 2,39 (3Н, с).
<Справочный пример 60>
Получение 3-бром-2-бромметилбензофурана
К раствору 2,8 г (13,3 ммоль) 3-бром-2-метилбензофурана в 30 мл монохлорбензола добавляют 2,7 г (15,3 ммоль) N-бромсукцинимида и 0,4 г (2,7 ммоль) азобисизобутиронитрила. Смесь перемешивают при 80°С в течение 30 мин для протекания реакции. После подтверждения превращения исходных веществ реакционную смесь охлаждают до комнатной температуры. Нерастворимые вещества отфильтровывают. Фильтрат подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя, получают 3,0 г (выход 79,0%) 3-бром-2-бромметилбензофурана.
<Справочный пример 61>
Получение этил-1-дифторметил-1Н-пиразол-4-карбоксилата
К раствору 3,0 г (21,4 ммоль) этил-1Н-пиразол-4-карбоксилата в 100 мл N,N-диметилформамида добавляют 6,0 г (43,5 ммоль) безводного карбоната калия. Через смесь барботируют хлордифторметан. Полученную смесь перемешивают при температуре от 130 до 140°С в течение 3 час для протекания реакции. После подтверждения окончания реакции смесь выливают в воду, затем экстрагируют этилацетатом. Полученный органический слой промывают водой и водным раствором хлорида натрия в указанном порядке и затем сушат над безводным сульфатом магния. Полученный раствор подвергают вакуумной перегонке для удаления содержащегося в нем растворителя. Остаток очищают колоночной хроматографией на силикагеле (проявляющий растворитель: смешанный растворитель гексан - этилацетат), получают 1,67 г (выход 41,0%) этил-1-дифторметил-1Н-пиразол-4-карбоксилата в виде бесцветного прозрачного маслянистого вещества.
1Н-ЯМР [CDCl3/TMS, δ (м.д.)]: 8,32 (1Н, с), 8,04 (1Н, с), 7,20 (1Н, т), 4,32 (2Н, кв), 1,37 (3Н, т).
Гербицид настоящего изобретения в качестве активного ингредиента содержит производное изоксазолина, представленное общей формулой [I], или его соль.
При использовании соединения настоящего изобретения в качестве гербицида настоящее соединение может быть использовано в чистом виде. Также оно может быть использовано в форме порошка, смачивающегося порошка, эмульгируемого концентрата, текучей формы, мелких гранул, гранул и т.д. при смешении с носителем, поверхностно-активным веществом, диспергатором, адъювантом и т.д., которые обычно используются в препарате.
В качестве носителя, используемого в препарате, можно назвать, например, твердые носители, такие как тальк, бентонит, глина, каолин, диатомовая земля, белая сажа, вермикулит, карбонат кальция, гашеная известь, силикатный песок, сульфат аммония, мочевина и т.д., и жидкие носители, такие как изопропиловый спирт, ксилол, циклогексан, метилнафталин и т.д.
В качестве поверхностно-активного вещества и диспергатора можно назвать, например, соли металлов и алкилбензолсульфоновой кислоты, соли металлов и динафтилметансульфоновой кислоты, соли сульфатов спиртов, соли алкиларилсульфоновых кислот, соли лигнинсульфоновой кислоты, полиоксиэтиленгликолевый эфир, полиоксиэтиленалкилариловые простые эфиры, моноалкилаты полиоксиэтиленсорбита и т.д. В качестве адъюванта можно привести, например, карбоксиметилцеллюлозу, полиэтиленгликоль и аравийскую камедь. При применении гербицид настоящего изобретения разбавляют до соответствующей концентрации и проводят опрыскивание или непосредственное нанесение.
Гербицид настоящего изобретения может быть использован путем опрыскивания листвы, внесения в почву, нанесения на водную поверхность и т.д. Количество используемого активного ингредиента определяется соответственно так, чтобы оно соответствовало цели применения. Содержание активного ингредиента определяют в соответствии с целью применения. Когда соединение настоящего изобретения приготовлено в форме порошка или гранул, его содержание находится в интервале от 0,01 до 10 мас.%, предпочтительно от 0,05 до 5 мас.%. Когда настоящее соединение приготовлено в виде эмульгируемого концентрата или смачивающегося порошка, его количество соответственно находится в интервале от 1 до 50 мас.%, от 5 до 30 мас.%. Когда настоящее соединение приготовлено в виде текучего препарата, его количество соответственно находится в интервале от 1 до 40 мас.%, предпочтительно от 5 до 30 мас.%.
Используемое количество гербицида настоящего изобретения меняется в зависимости от вида используемого соединения, уничтожаемого сорняка, тенденции к прорастанию сорняка, условий окружающей среды, типа применяемого гербицида и т.д. Когда настоящий гербицид используется в чистом виде в форме порошка или гранул, его количество соответственно выбирается в интервале от 1 г до 50 кг, предпочтительно от 10 г до 10 кг, на 1 гектар из расчета на активный ингредиент. Когда гербицид используется в жидкой форме, как в случае эмульгируемого концентрата, смачивающегося порошка или текучего препарата, количество соответственно выбирается в интервале от 0,1 до 50000 ч/млн, предпочтительно от 10 до 10000 ч/млн.
Соединение настоящего изобретения может быть смешано, если это необходимо, с инсектицидом, фунгицидом, другим гербицидом, регулятором роста растений, удобрением и т.д.
Ниже с помощью типичных примеров препаративной формы описана препаративная форма соединения настоящего изобретения. Типы соединений и добавок и их соотношения не ограничены приведенными ниже и могут меняться в широких пределах. В приведенном ниже описании "части" являются массовыми частями.
<Препаративная форма 1>
Смачивающийся порошок
Смешивают 10 частей соединения (3-0006) с 0,5 частями полиоксиэтиленоктилфенилового эфира, 0,5 частями конденсата натриевой соли β-нафталинсульфоновой кислоты и формалина, 20 частями диатомовой земли и 69 частями глины. Смесь перемешивают и распыляют, получают смачивающийся порошок.
<Препаративная форма 2>
Текучий препарат
В 69 частях воды диспергируют 20 частей грубо измельченного соединения (3-0006). К смеси добавляют 4 части сульфата полиоксиэтиленстирилфенилового эфира, 7 частей этиленгликоля и 200 ч/млн из расчета на полученный гербицид Silicone AF-118N (продукт фирмы Asahi Chemical Industry, Co. Ltd.). Полученную смесь перемешивают 30 мин с использованием высокоскоростного смесителя, а затем измельчают с использованием мельницы, получают текучий препарат.
<Препаративная форма 3>
Эмульсия
К 30 частям соединения (3-0006) добавляют 60 частей смеси равных объемов ксилола и изофорона и 10 частей смеси поверхностно-активных веществ алкилата полиоксиэтиленсорбита, полиоксиэтиленалкиларилового полимера и алкиларилсульфоната. Полученную смесь хорошо перемешивают, получают эмульгируемый концентрат.
<Препаративная форма 4>
Гранулы
Смешивают 10 частей соединения (3-0006), 80 частей наполнителя, который представляет собой смесь 1:3 талька и бентонита, 5 частей белой сажи и 5 частей смеси поверхностно-активных веществ алкилата полиоксиэтиленсорбита, полиоксиэтиленалкиларилового полимера и алкиларилсульфоната. К смеси добавляют 10 частей воды. Полученную смесь хорошо перемешивают до получения пасты. Пасту экструдируют через ячейки (диаметр 0,7 мм) сита. Экструдат сушат и нарезают длиной от 0,5 до 1 мм с получением гранул.
Далее описаны примеры применения соединения настоящего изобретения, чтобы показать эффективность соединения.
<Пример применения 1>
Испытания гербицидной активности при почвенной обработке затопляемых полей
Почвой затопляемого поля заполняют пластиковые горшки на 100 см2 и утрамбовывают. Затем высевают семена Echinochloa oryzicola Vasing и Monochoria vaginalis (Murm. F.) Presl var. plantaginea (Roxb.) Solms-Laub, и горшки заполняют слоем воды глубиной 3 см. На следующий день смачивающиеся порошки, полученные в соответствии с примером препаративной формы 1, разбавляют водой и наносят каплями на поверхность воды. Применяемое количество каждого смачивающегося порошка составляет 1000 г/га из расчета на активный ингредиент. Затем посадки вносят в теплицу и гербицидное действие каждого смачивающегося порошка оценивают на 21 день после обработки в соответствии со стандартом, приведенным в таблице 21. Полученные результаты представлены в таблице 22.
или фитотоксичность
менее чем 90%
менее чем 70%
менее чем 50%
менее чем 30%
менее чем 10%
Таблица 22
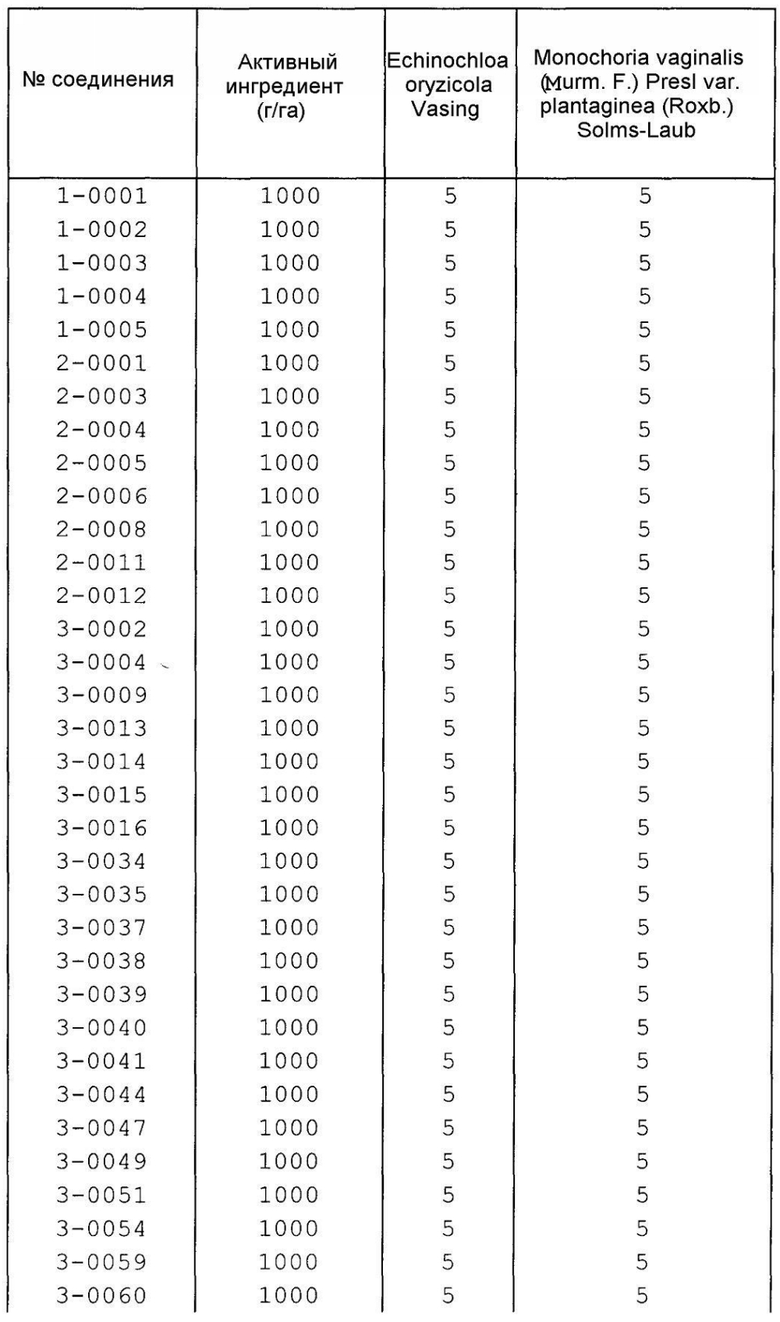
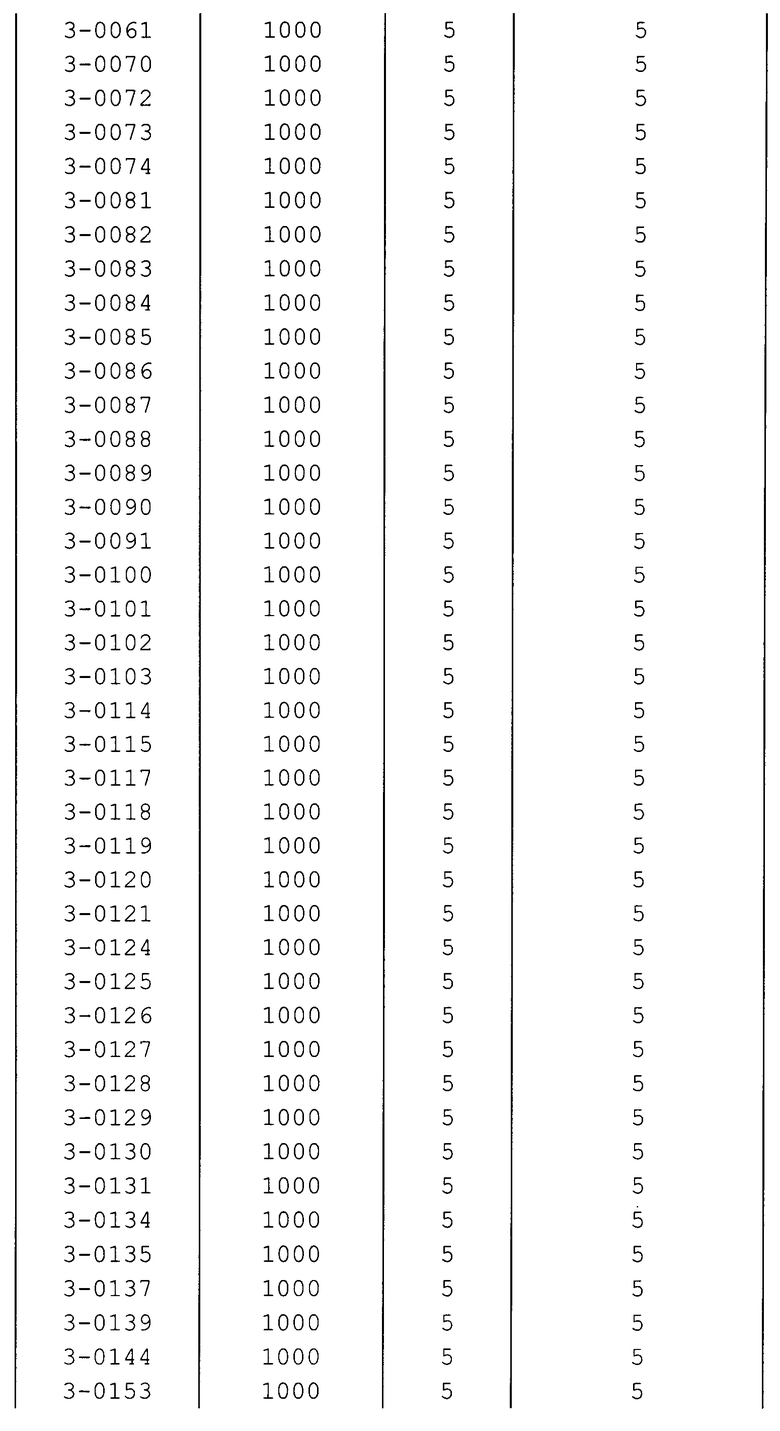
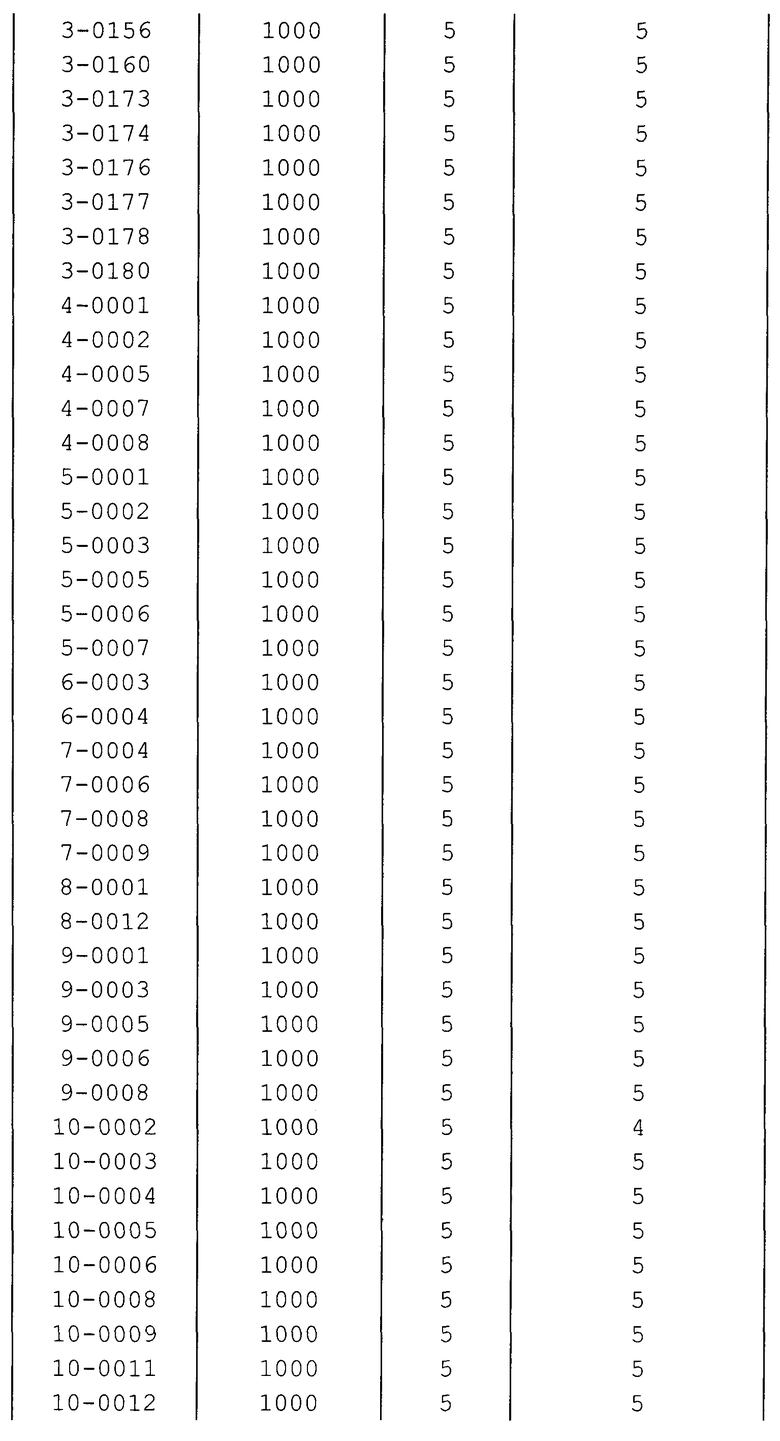
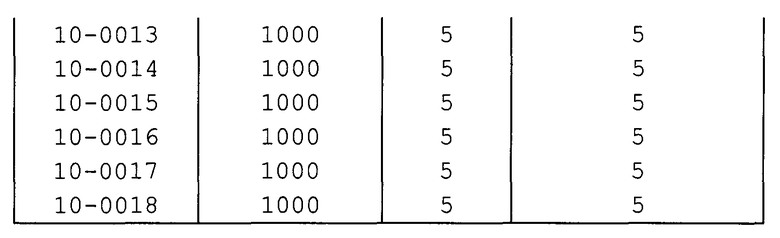
<Пример применения 2>
Испытания гербицидной активности при почвенной обработке суходольных полей
Почвой суходольного поля заполняют пластиковые горшки с поверхностью 80 см2. Затем высевают семена Echinochloa crus-galli (L) Beauv. var. crus-galli и Setaria viridis (L.) Beauv., после чего покрывают той же почвой. Смачивающиеся порошки, полученные в соответствии с примером препаративной формы 1, разбавляют водой и равномерно разбрызгивают на поверхность почвы с использованием небольшого опрыскивателя в количестве 1000 л/га, так что количество каждого активного ингредиента составляет 1000 г/га. Затем посадки вносят в теплицу и гербицидное действие каждого смачивающегося порошка оценивают на 21 день после обработки в соответствии со стандартом, приведенным в таблице 21. Полученные результаты представлены в таблице 23.
Таблица 23
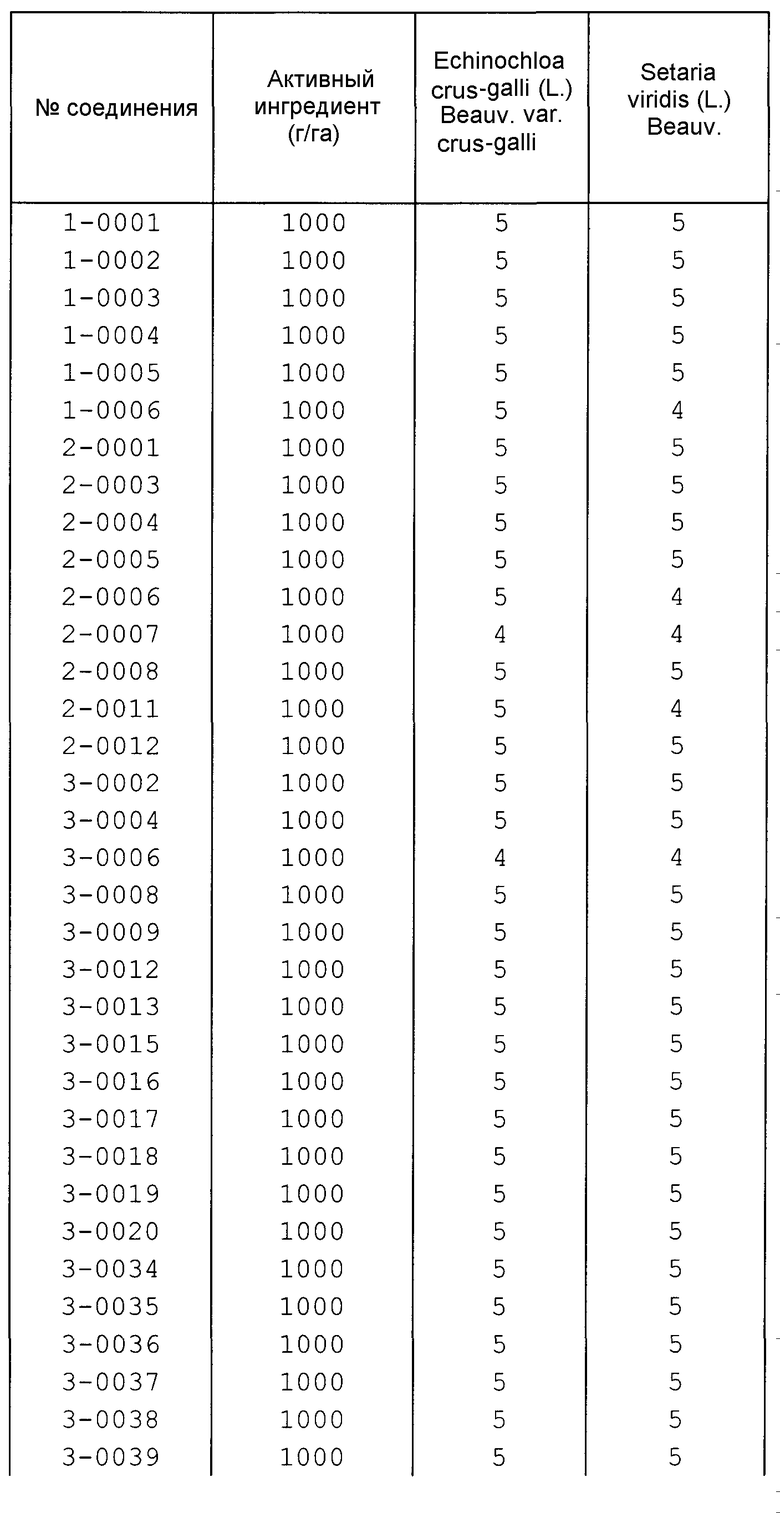
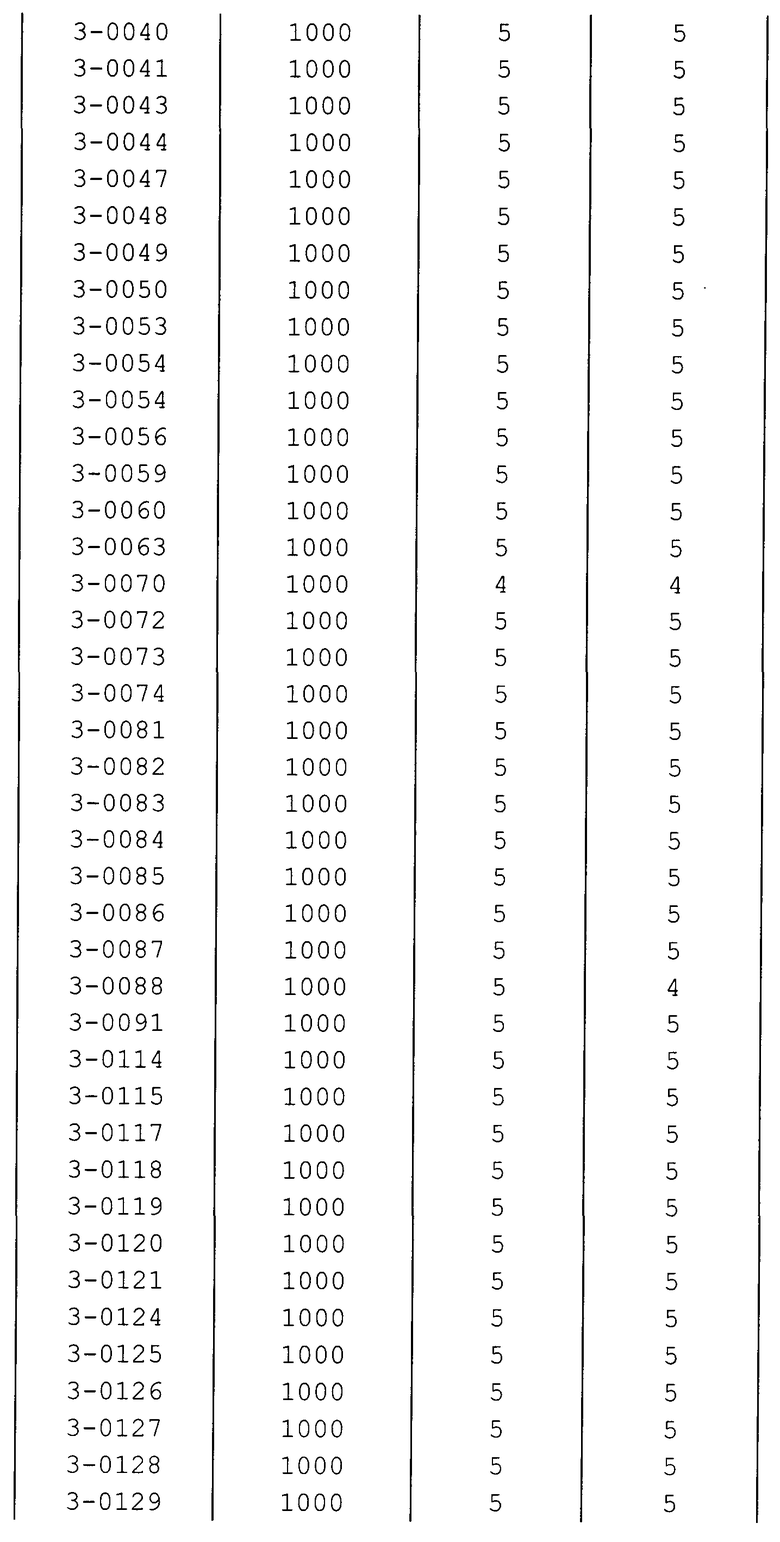
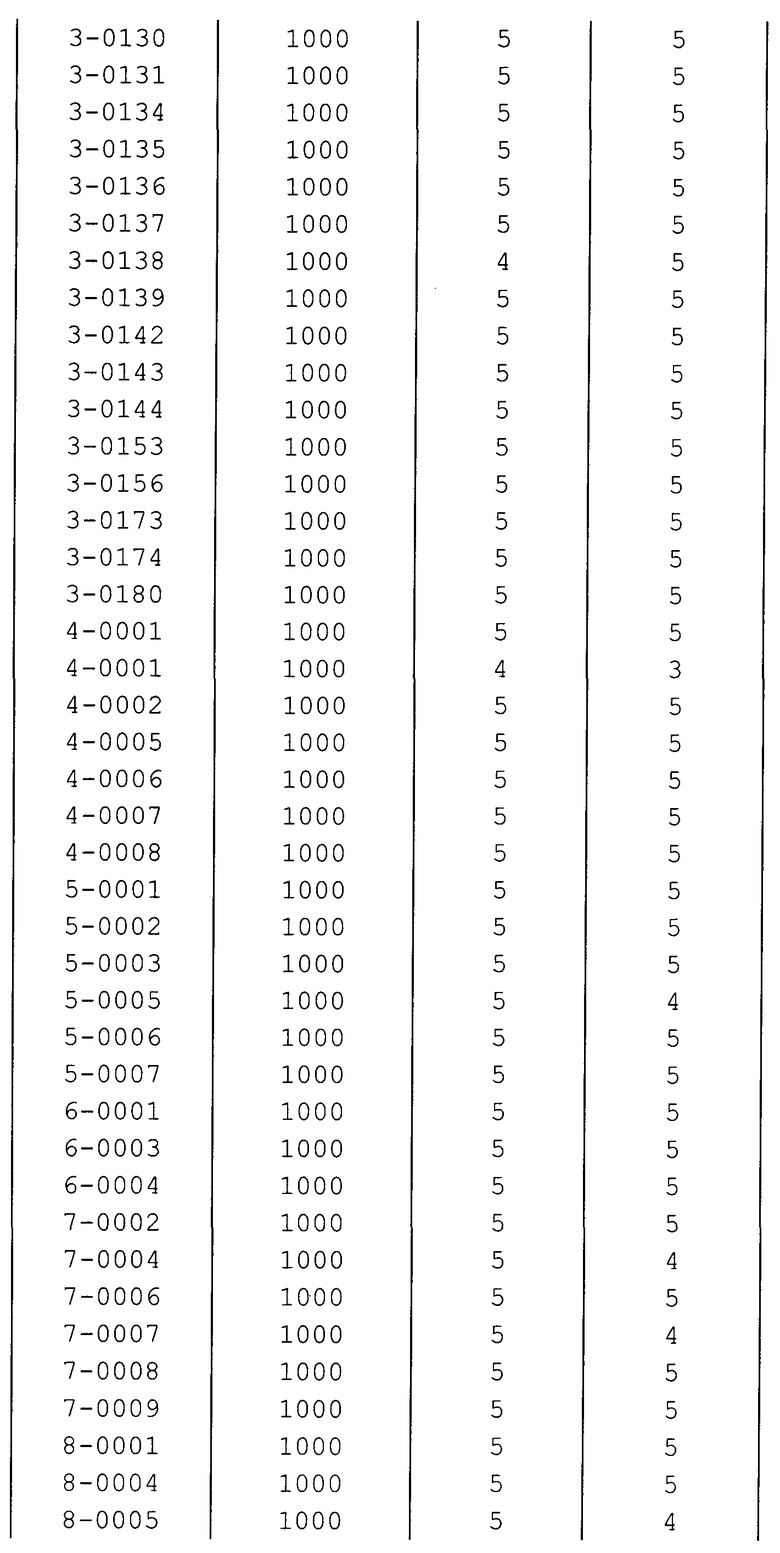
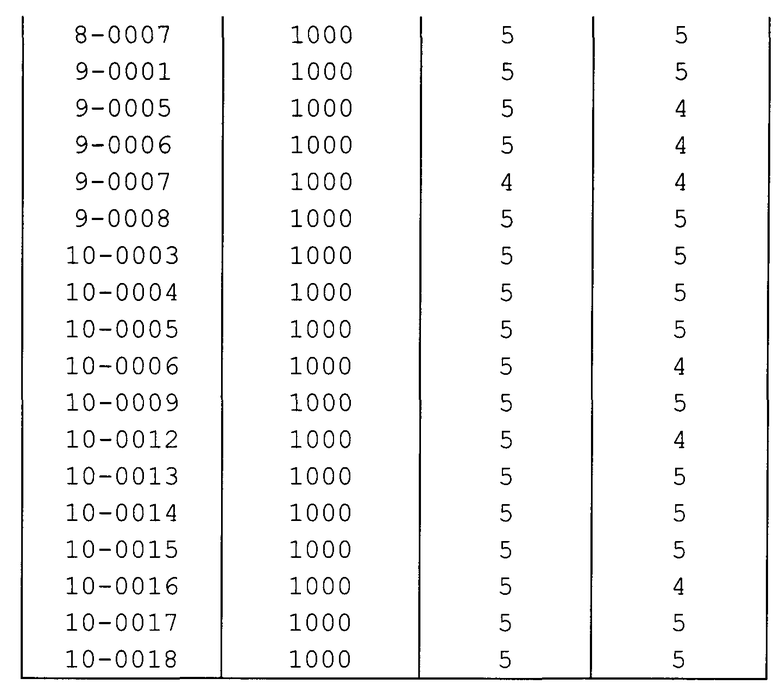
<Пример применения 3>
Испытания гербицидной активности при обработке листвы суходольных растений
Заполняют песком пластиковые горшки с поверхностью 80 см2. Высевают семена Echinochloa crus-galli (L.) Beauv. var. crus-galli и Setaria viridis (L.) Beauv. Посадки держат в теплице 2 недели. Смачивающиеся порошки, полученные в соответствии с примером препаративной формы 1, разбавляют водой и равномерно разбрызгивают на всю листву растений с использованием небольшого опрыскивателя в количестве 1000 л/га, так что количество каждого активного ингредиента составляет 1000 г на гектар. Затем посадки вносят в теплицу и гербицидное действие каждого смачивающегося порошка оценивают на 14 день после обработки в соответствии со стандартом, приведенным в таблице 21. Полученные результаты представлены в таблице 24.
Таблица 24
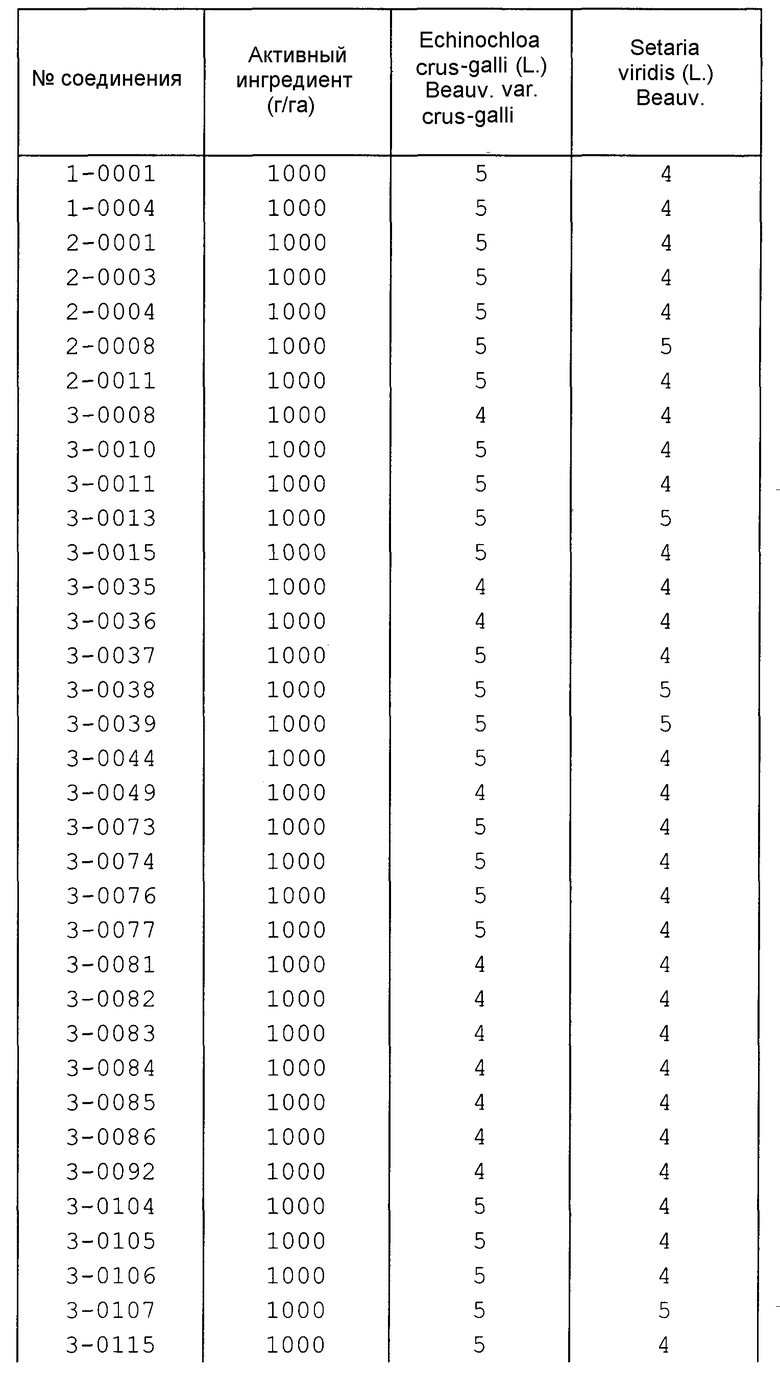
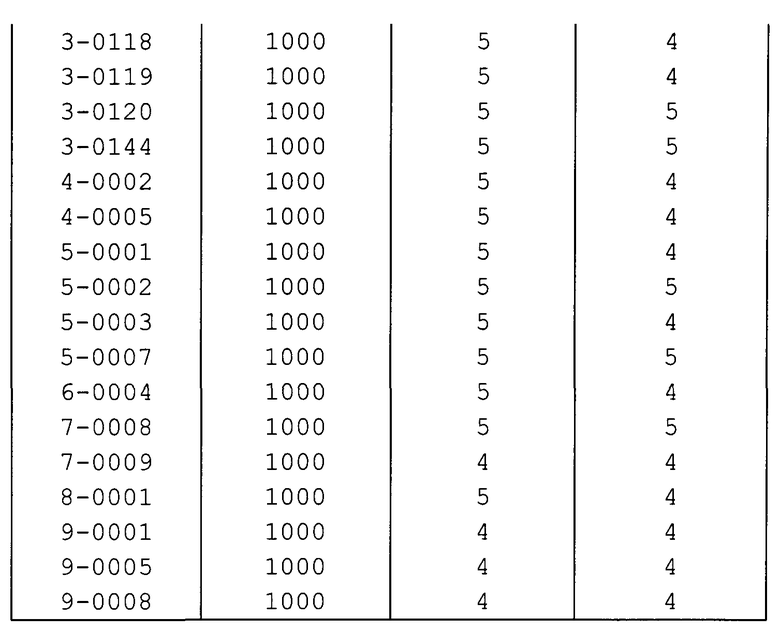
Промышленная применимость
Соединение, представленное формулой [I] в соответствии с настоящим изобретением, проявляет прекрасное гербицидное действие в течение широкого периода, начиная со времени до прорастания семян до активного роста, на различные сорняки, создающие проблемы на суходольных полях, например широколиственные сорняки [например, Polygonum lapathifolium L. subsp. nodosum (Pers.) Kitam., Amaranthus viridis L., Chenopodium album L., Stellaria media (L.) Villars, Abutilon theophrasti Medik., Sida spinosa, Sesbaria exaltata, Ipomea spp. и Xanthium strumarium L.], многолетние или однолетние осокоцветные сорняки [например, Cyperus rotundus L., Cyperus esculentus, Kyllinga brevifolia Rottb. subsp. leiolepis (Fraxch. et Savat.) T. Koyama, Cyperus microiria Steud. и Cyperus iria L.] и травянистые сорняки [например, Echinochloa crus-galli (L.) Beauv. var. crus-galli, Digitaris ciliaris (Retz) Koeler, Setaria viridis (L.) Beauv., Poa annua L., Sorghum halepense (L.) Pers., Alopecurus aequalis Sobol var. amurensis (Komar.) Ohwi и Avena fatua L.]. Кроме того, соединение настоящего изобретения также обладает гербицидным действием на сорняки, прорастающие на затопляемых полях, то есть однолетние сорняки [например, Echinochloa oryzicola Vasing., Cyperus difformis L., Monochoria vaginalis (Burm. F.) Presl var. plantaginea (Roxb.) Solms-Laub. и Lindernia procumbens] и многолетние сорняки [например, Sagittaria trifolia L., Sagittaria pygmaea Mig., Cyperus serotinus Rottb., Eleocharis kuroguwai Ohwi и Scirpus juncoides Roxb. subsp. hotarui (Ohwi) T. Koyama, Alisma canaliculatum].
Гербицид настоящего изобретения обладает высокой безопасностью для культур, в особенности для риса, пшеницы, ячменя, кукурузы, сорго, сои, хлопчатника, сахарной свеклы и т.д.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРАЗОЛА И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2003 |
|
RU2315758C2 |
| ИЗОКСАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ И ГЕРБИЦИДЫ, СОДЕРЖАЩИЕ ИХ В КАЧЕСТВЕ АКТИВНЫХ ИНГРЕДИЕНТОВ | 2000 |
|
RU2237664C2 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ГИДРОКСИ-4-ТИОМЕТИЛПИРАЗОЛЬНОГО СОЕДИНЕНИЯ | 2005 |
|
RU2386619C2 |
| ПРОИЗВОДНЫЕ КАРБАМАТА И ФУНГИЦИД СЕЛЬСКОГО ХОЗЯЙСТВА | 2000 |
|
RU2228328C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННОГО АНИЛИНОВОГО СОЕДИНЕНИЯ (ВАРИАНТЫ) И ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ | 2001 |
|
RU2292338C2 |
| СПОСОБ ПОЛУЧЕНИЯ СОЕДИНЕНИЯ 5-АЛКОКСИ-4-ГИДРОКСИМЕТИЛПИРАЗОЛА | 2007 |
|
RU2451677C2 |
| ПРОИЗВОДНОЕ БЕНЗИЛСУЛЬФИДА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПЕСТИЦИД | 1996 |
|
RU2170728C2 |
| ФТОРАЛКИЛИРУЮЩИЙ АГЕНТ | 2015 |
|
RU2716008C2 |
| ПРОИЗВОДНЫЕ АМИДА N-СУЛЬФОНИЛКАРБОНОВОЙ КИСЛОТЫ, ВКЛЮЧАЮЩИЕ N-СОДЕРЖАЩЕЕ 6-ЧЛЕННОЕ АРОМАТИЧЕСКОЕ КОЛЬЦО, ФУНГИЦИДНАЯ И ГЕРБИЦИДНАЯ КОМПОЗИЦИИ И СПОСОБЫ БОРЬБЫ С СОРНЯКАМИ И ФИТОПАТОГЕННЫМИ ГРИБКАМИ | 1993 |
|
RU2117662C1 |
| ПРОИЗВОДНЫЕ АМИДОВ АМИНОКИСЛОТ, СПОСОБ ПОЛУЧЕНИЯ, ФУНГИЦИДНАЯ КОМПОЗИЦИЯ ДЛЯ СЕЛЬСКОГО ХОЗЯЙСТВА И САДОВОДСТВА | 1994 |
|
RU2128186C1 |
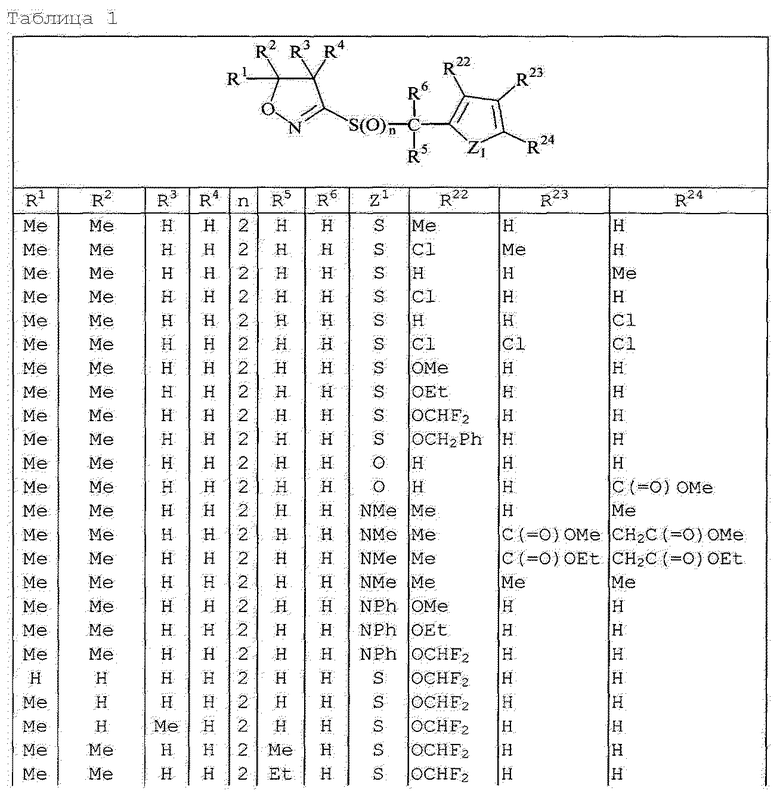
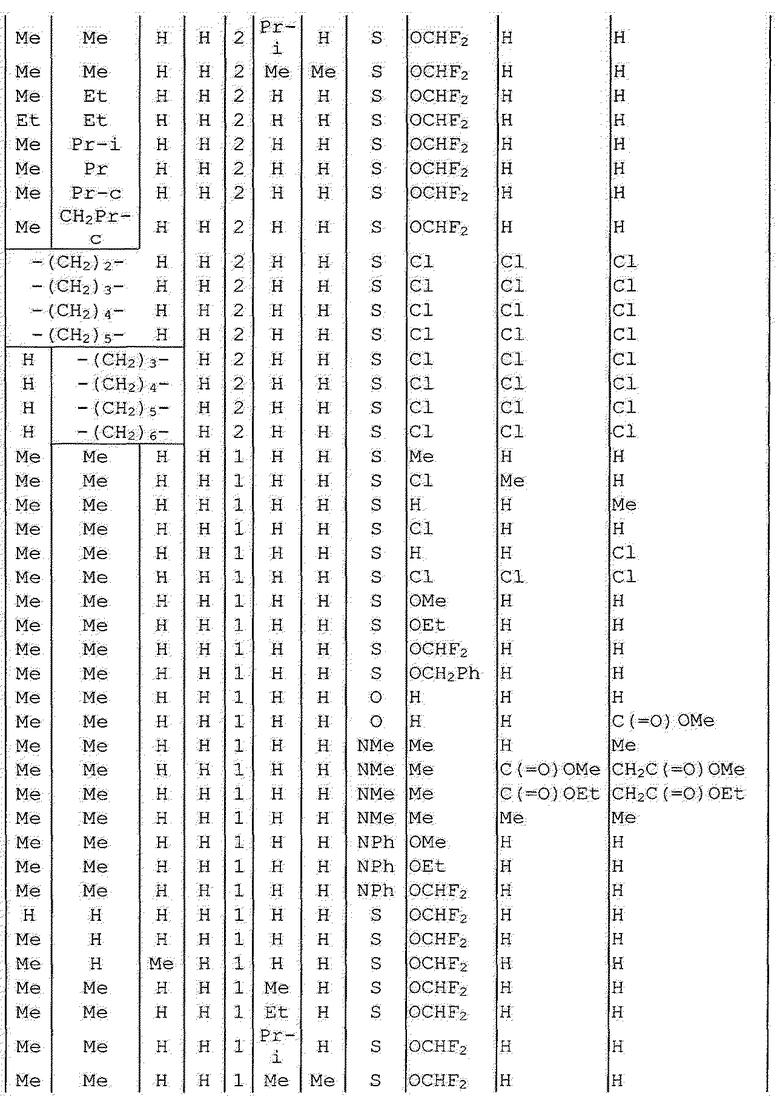
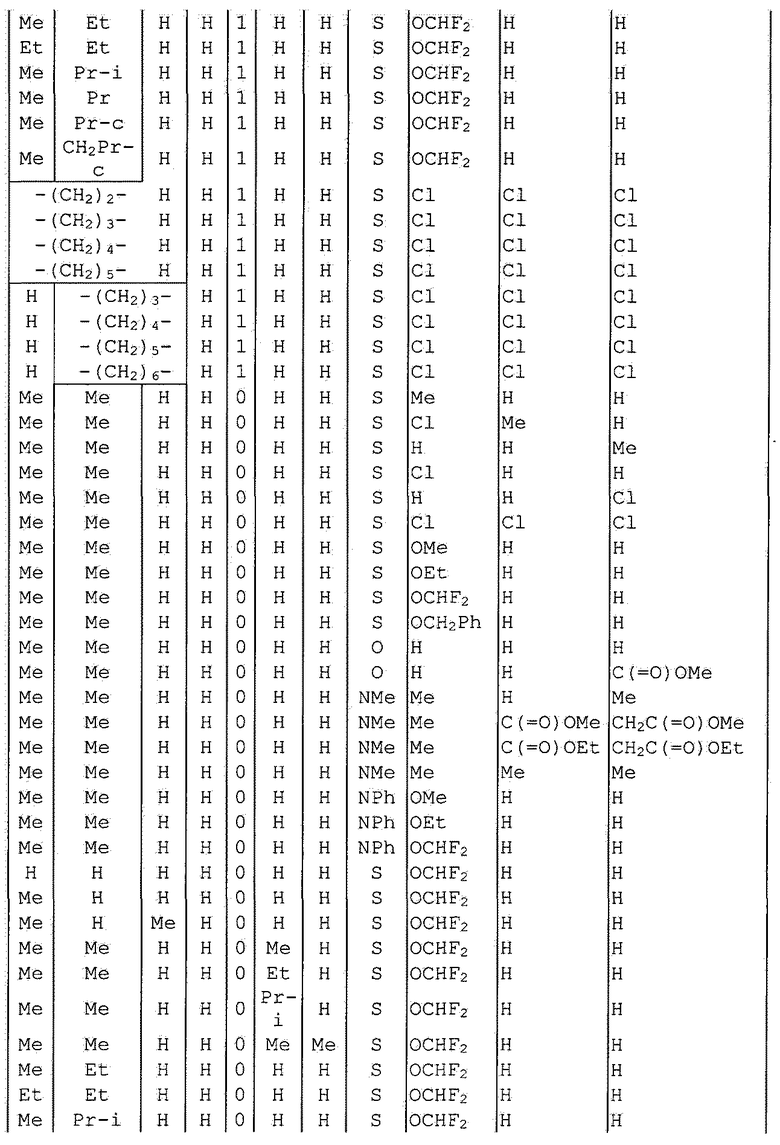
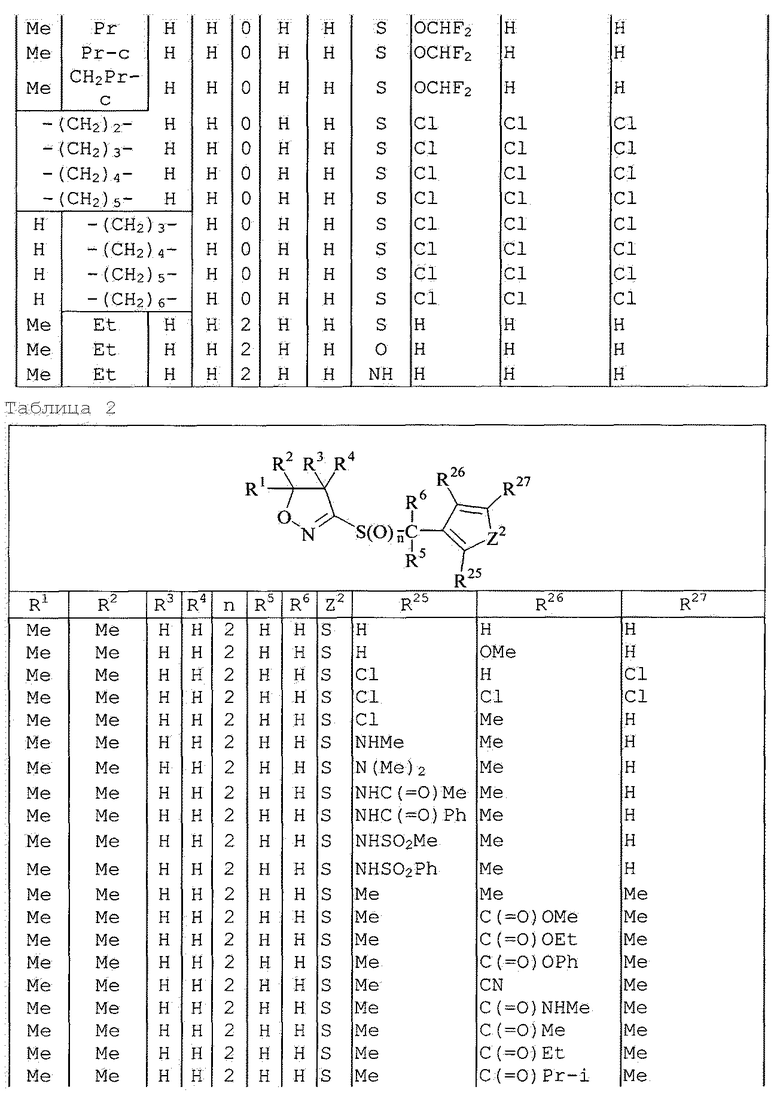
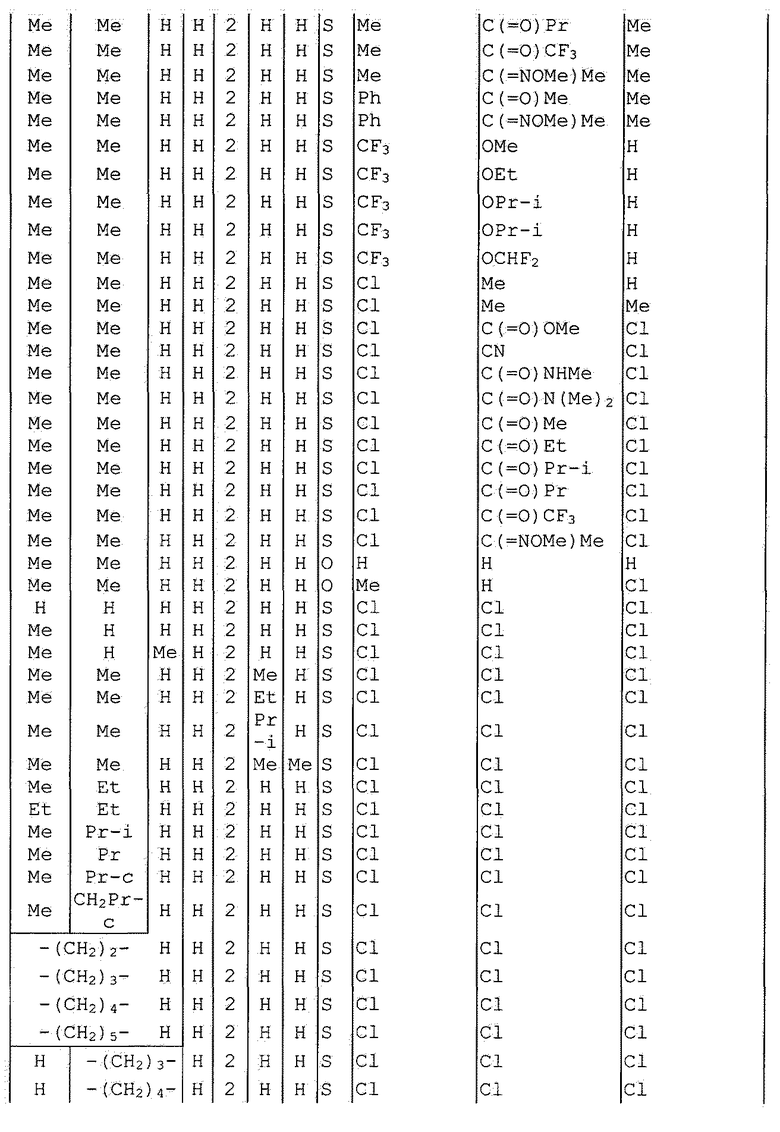
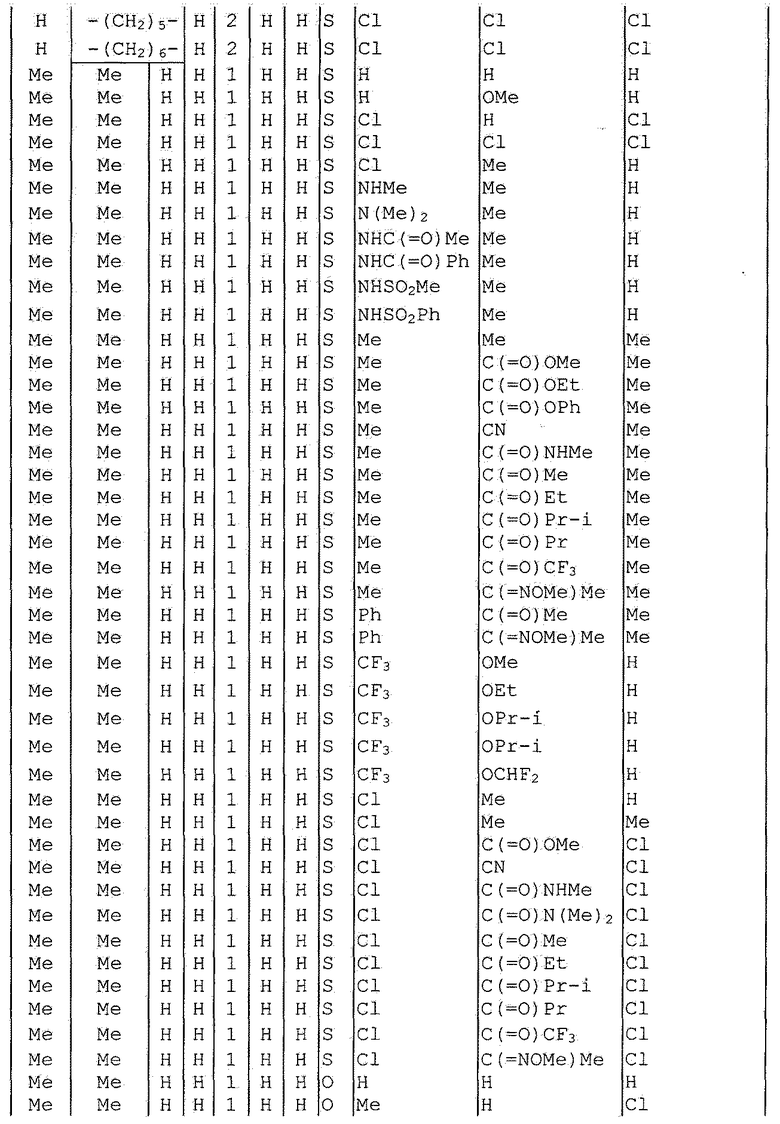
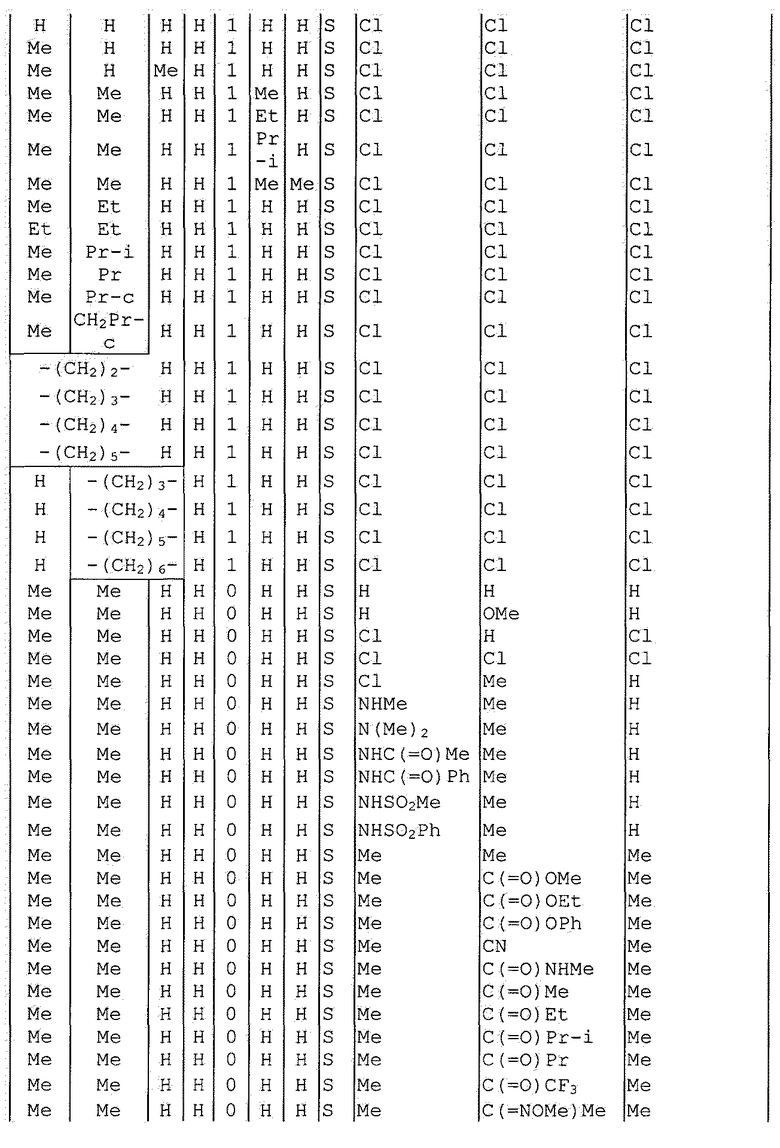
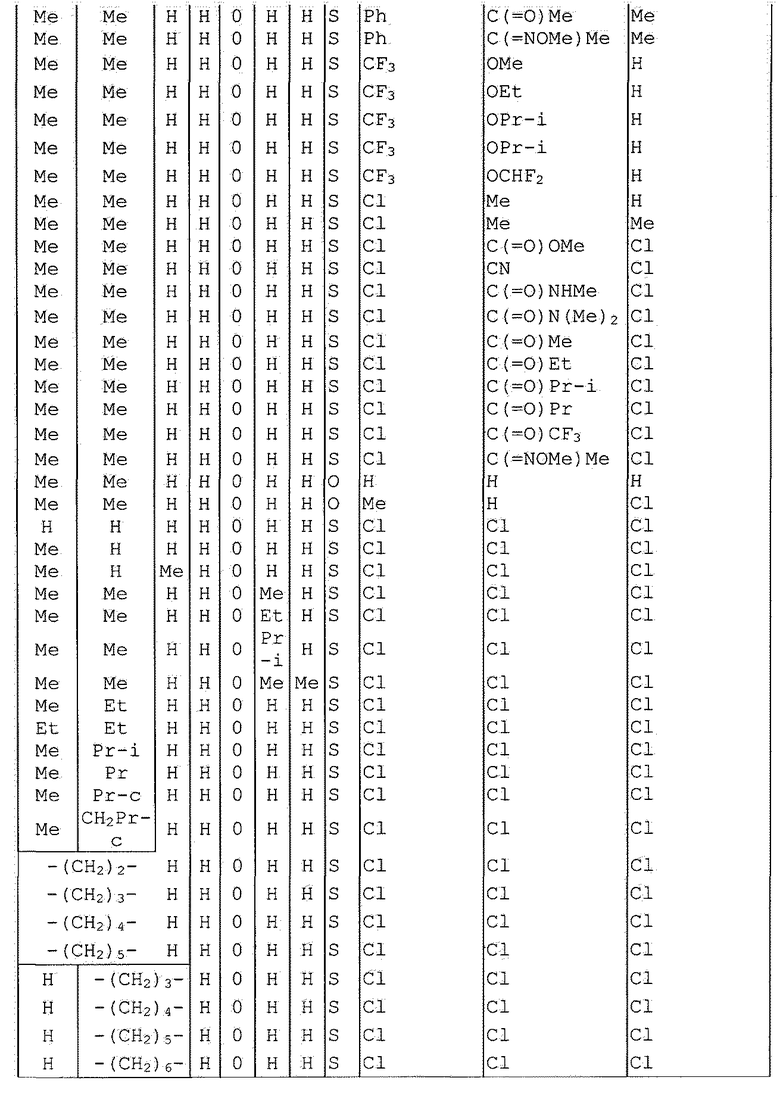
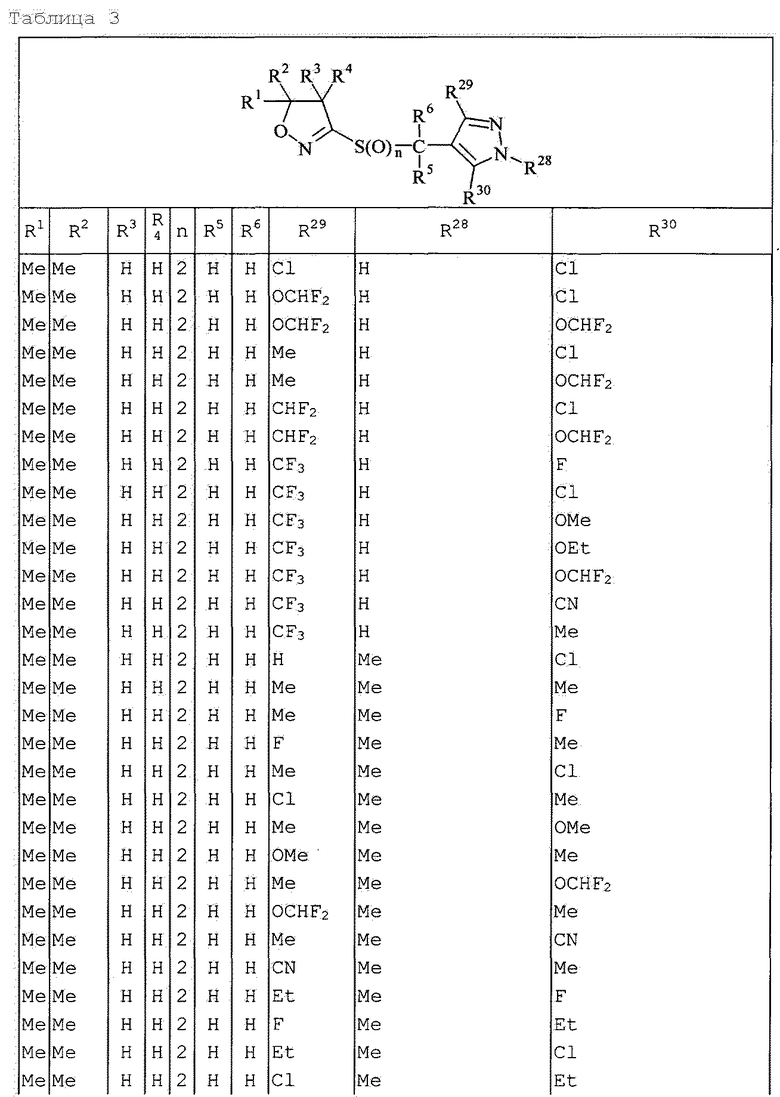
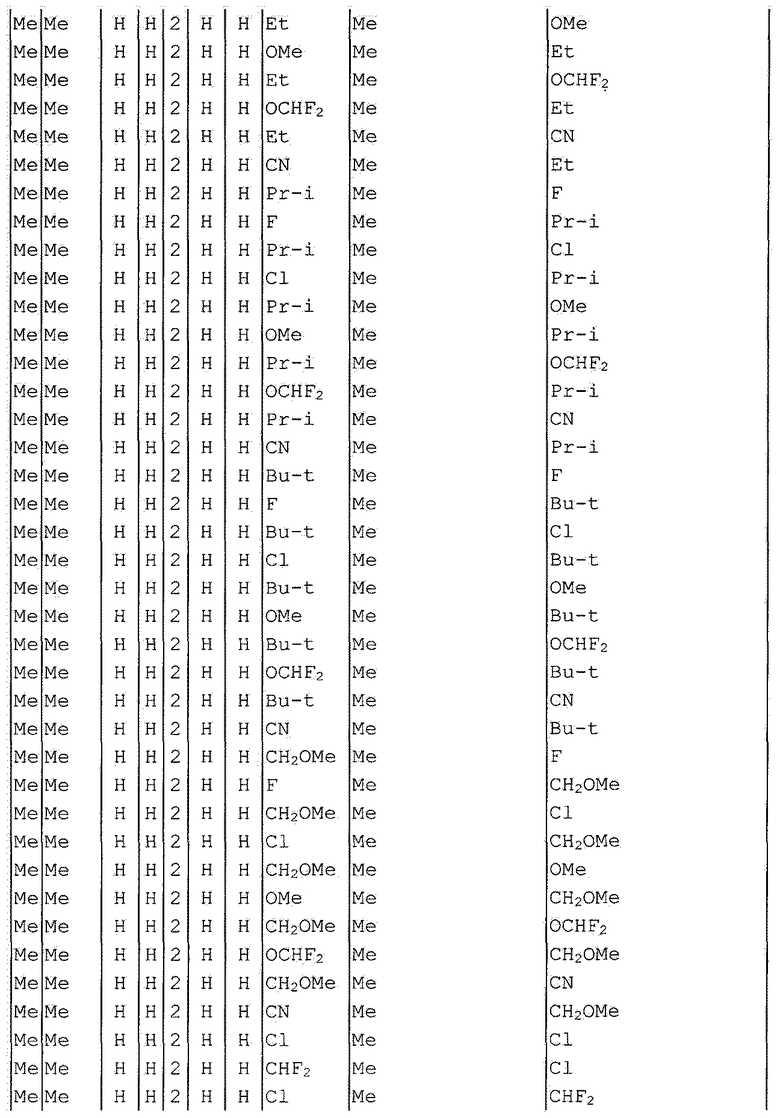
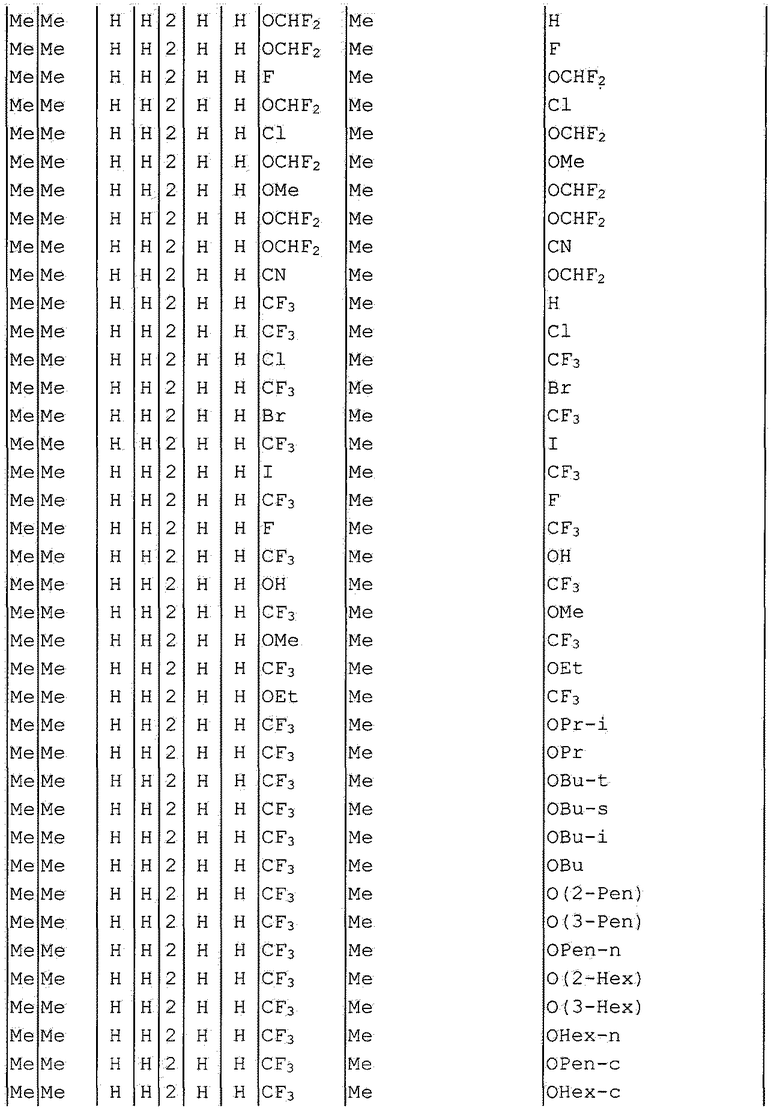
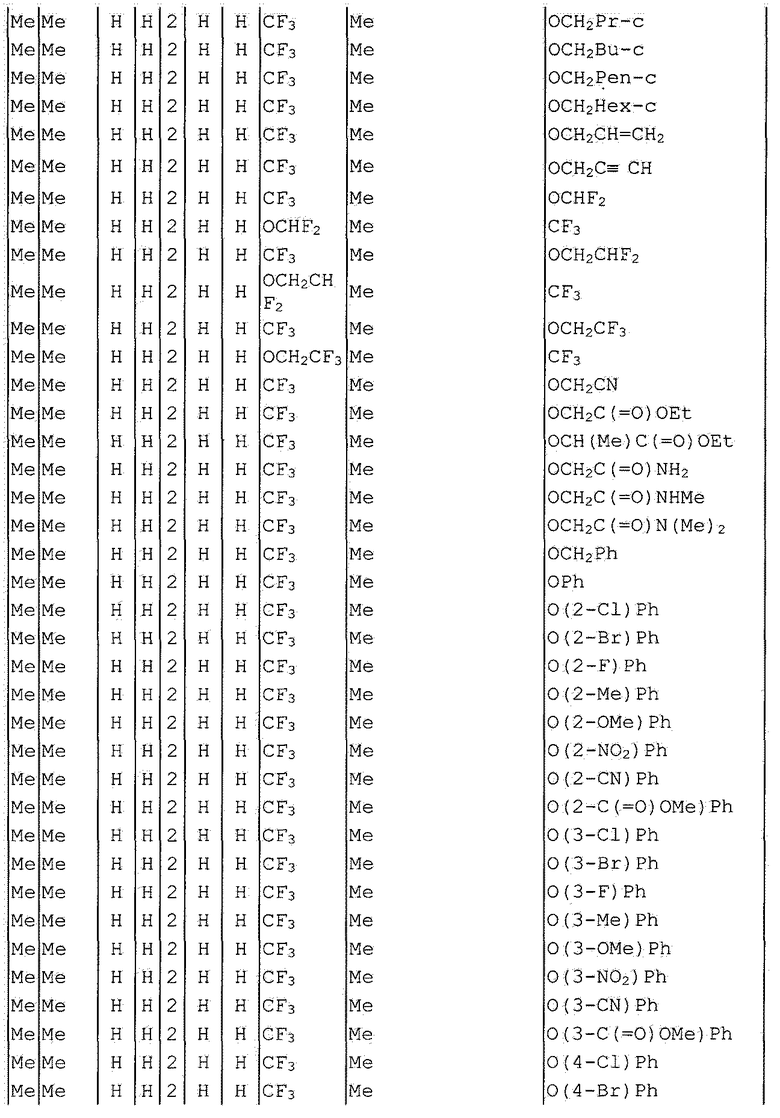
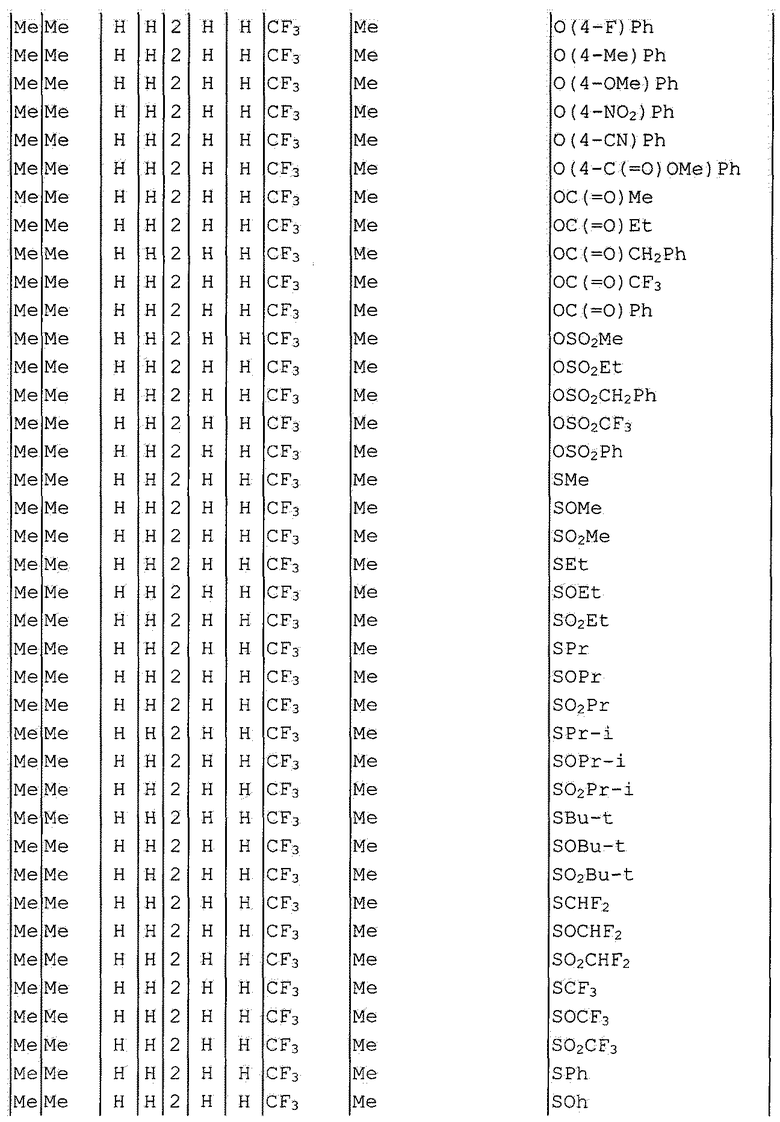
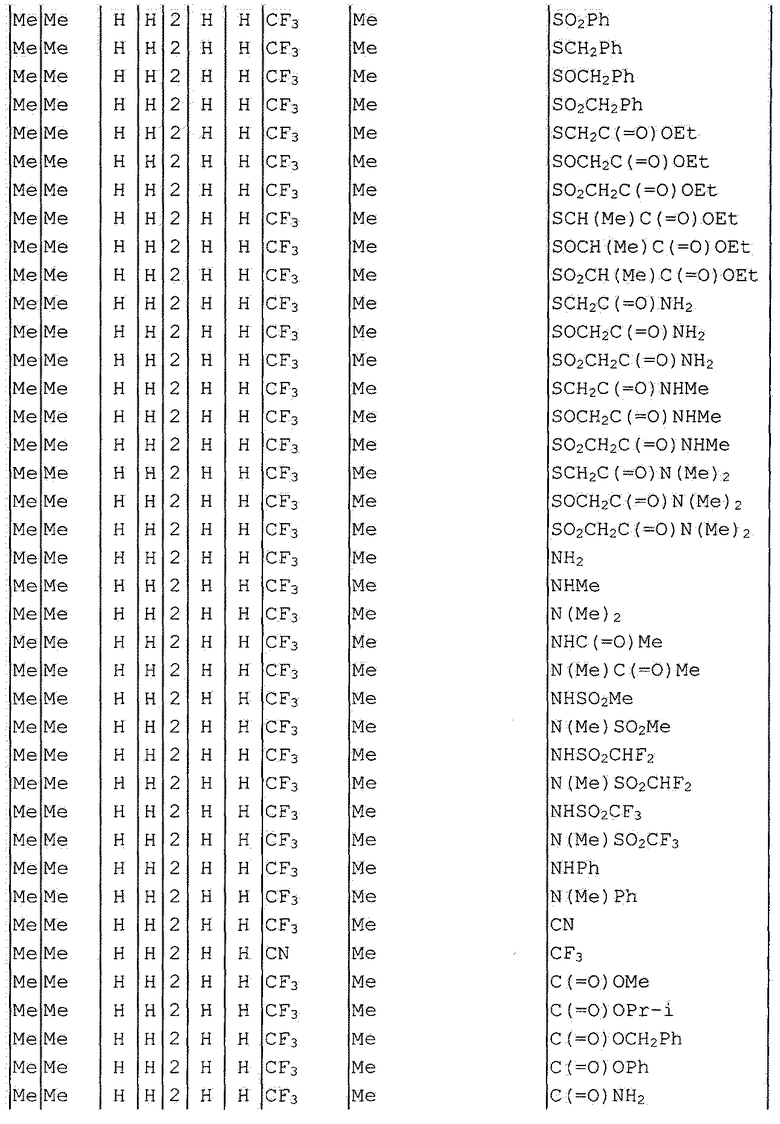

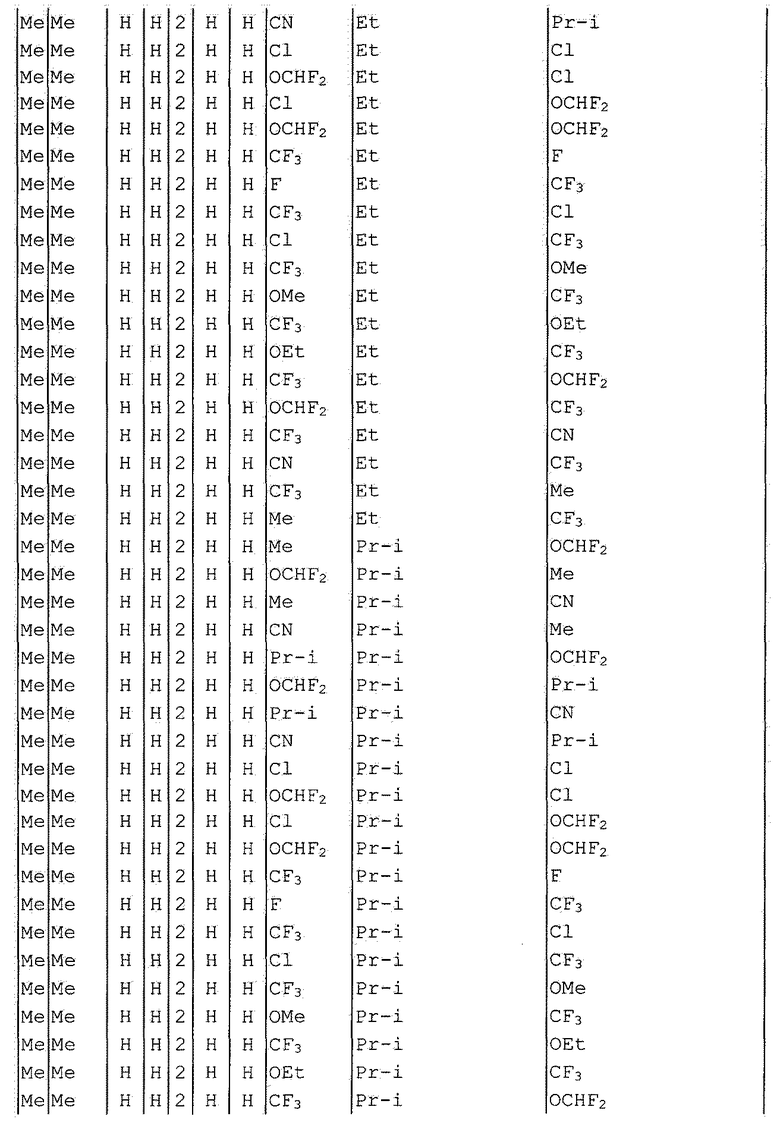
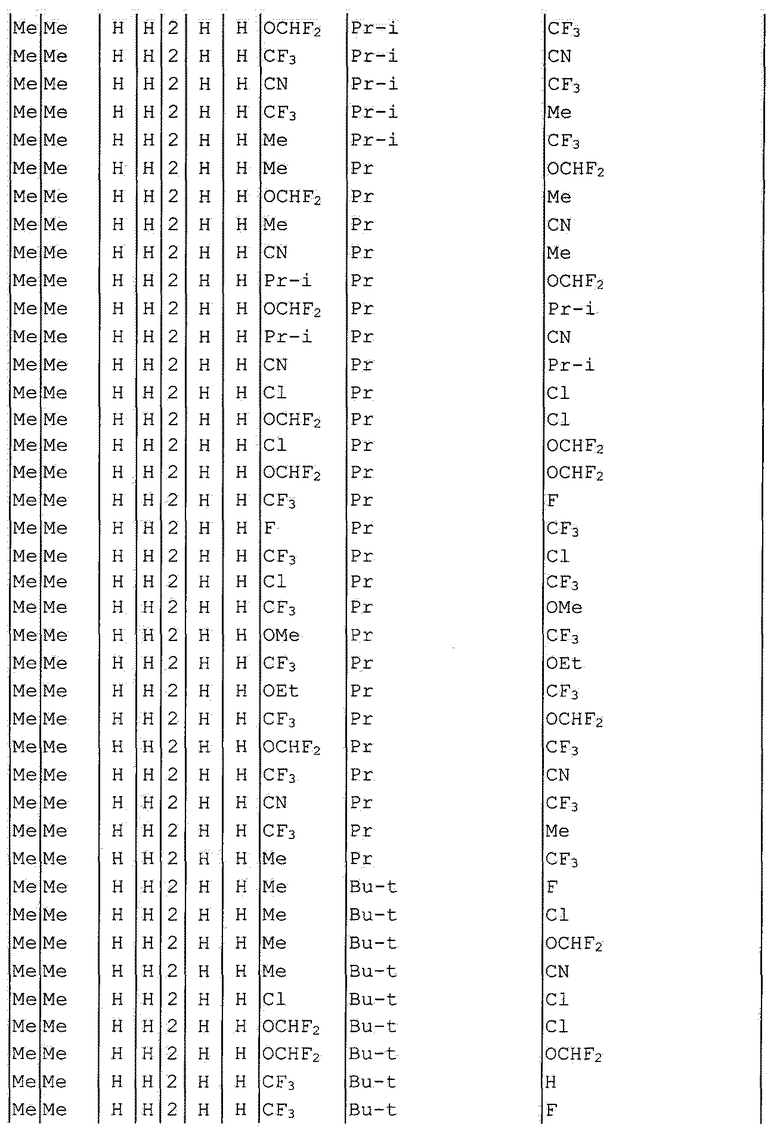
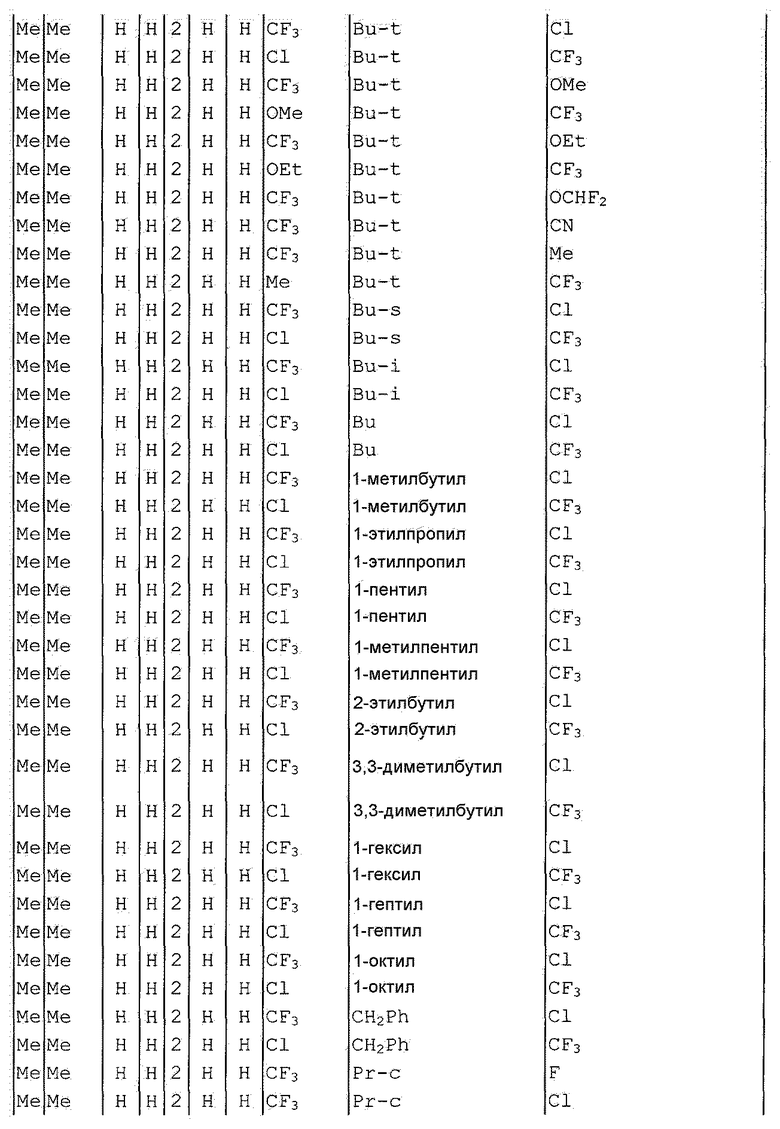
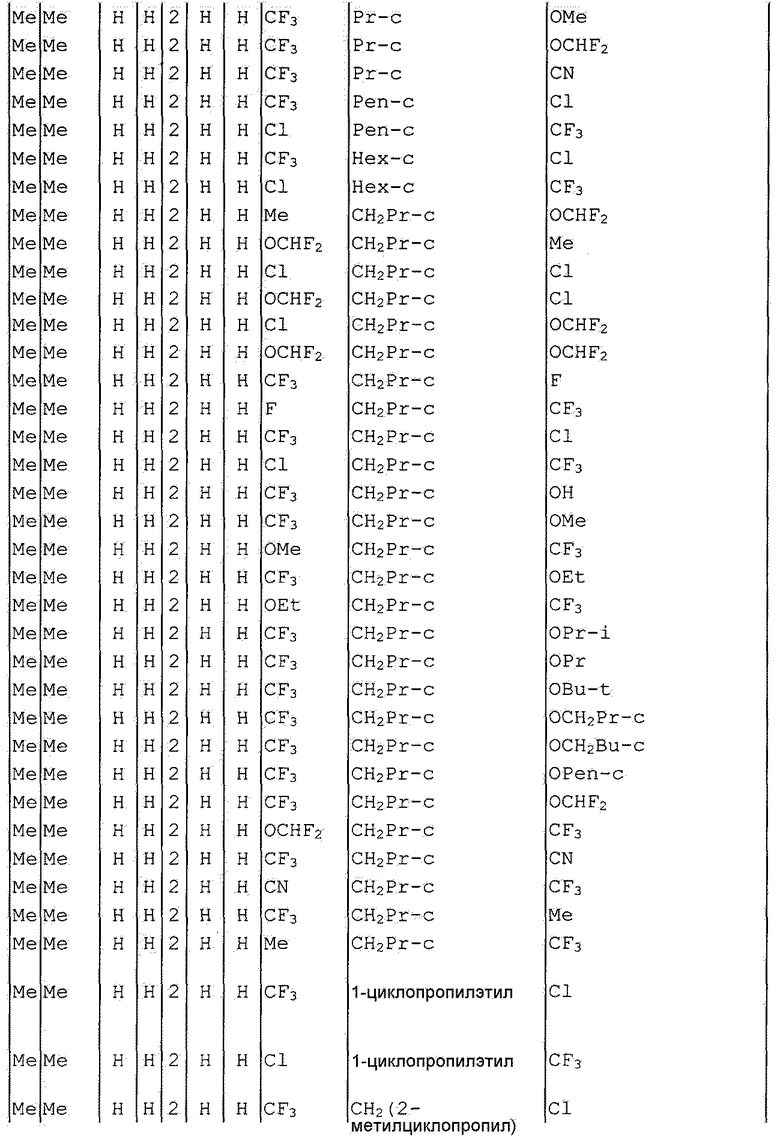
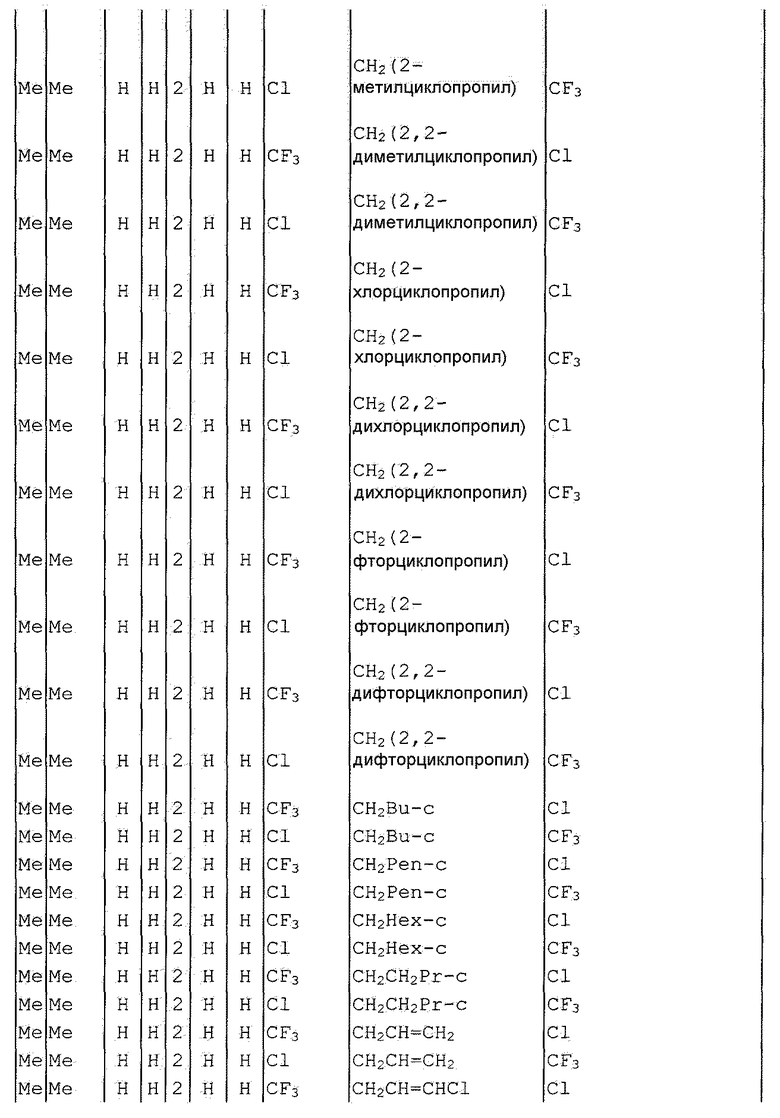
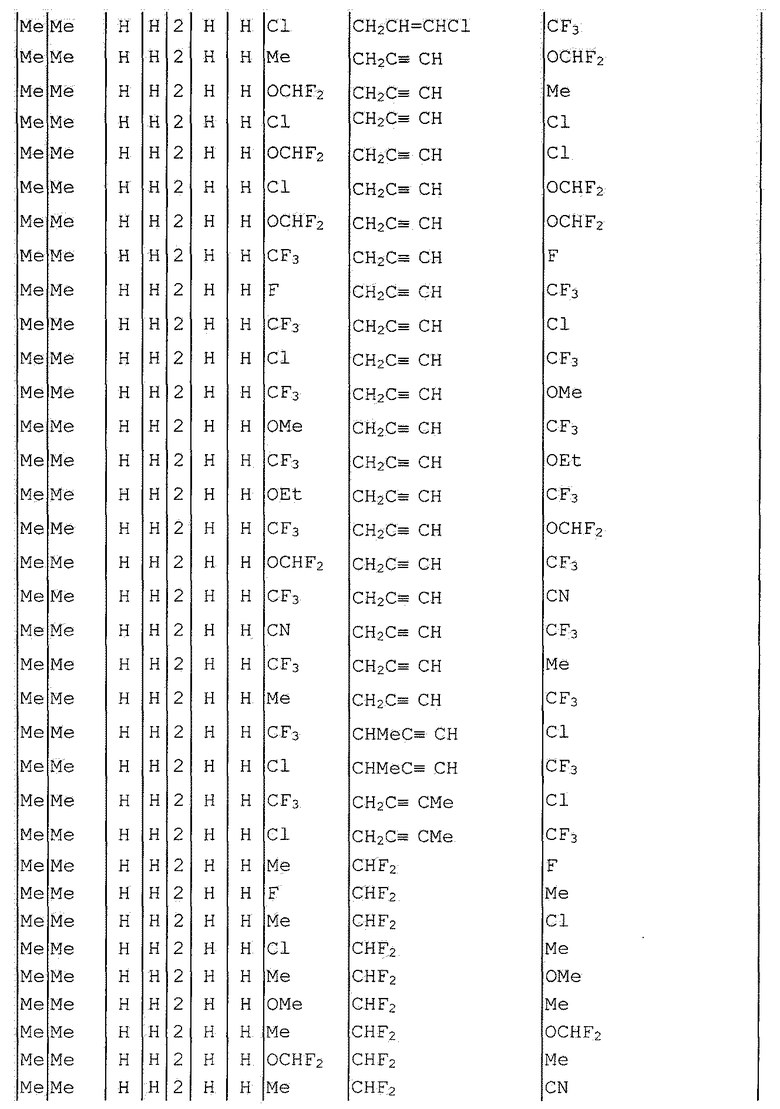
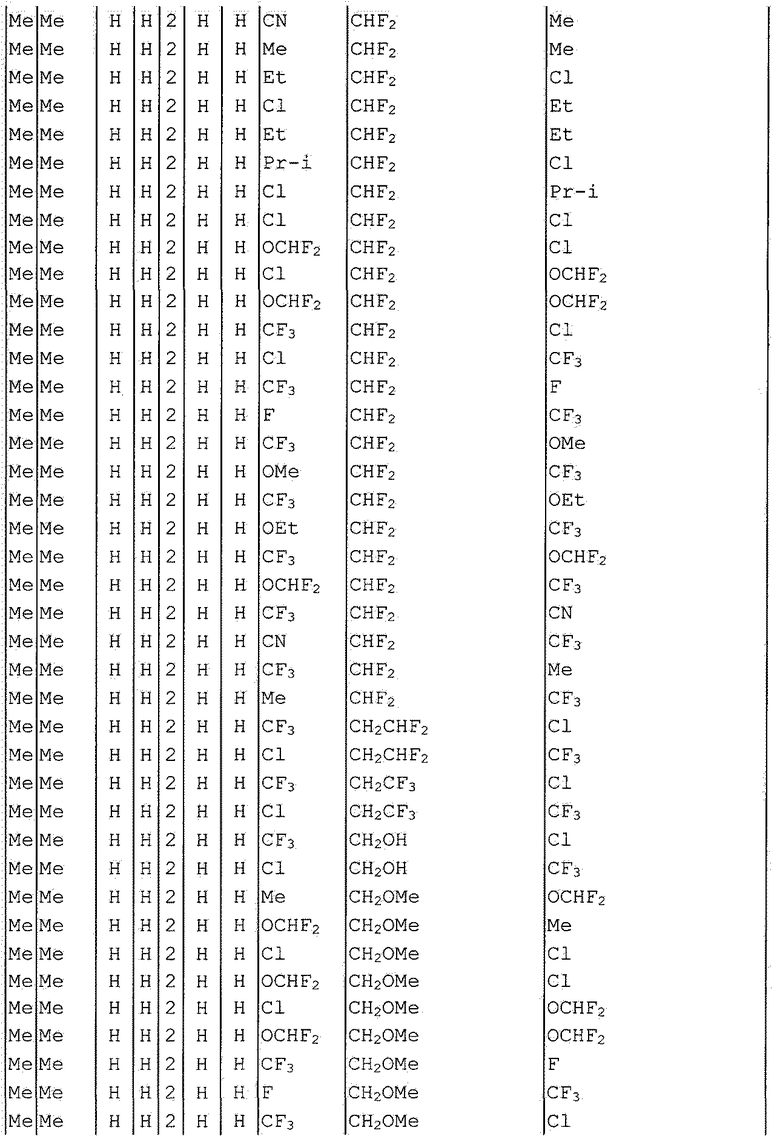
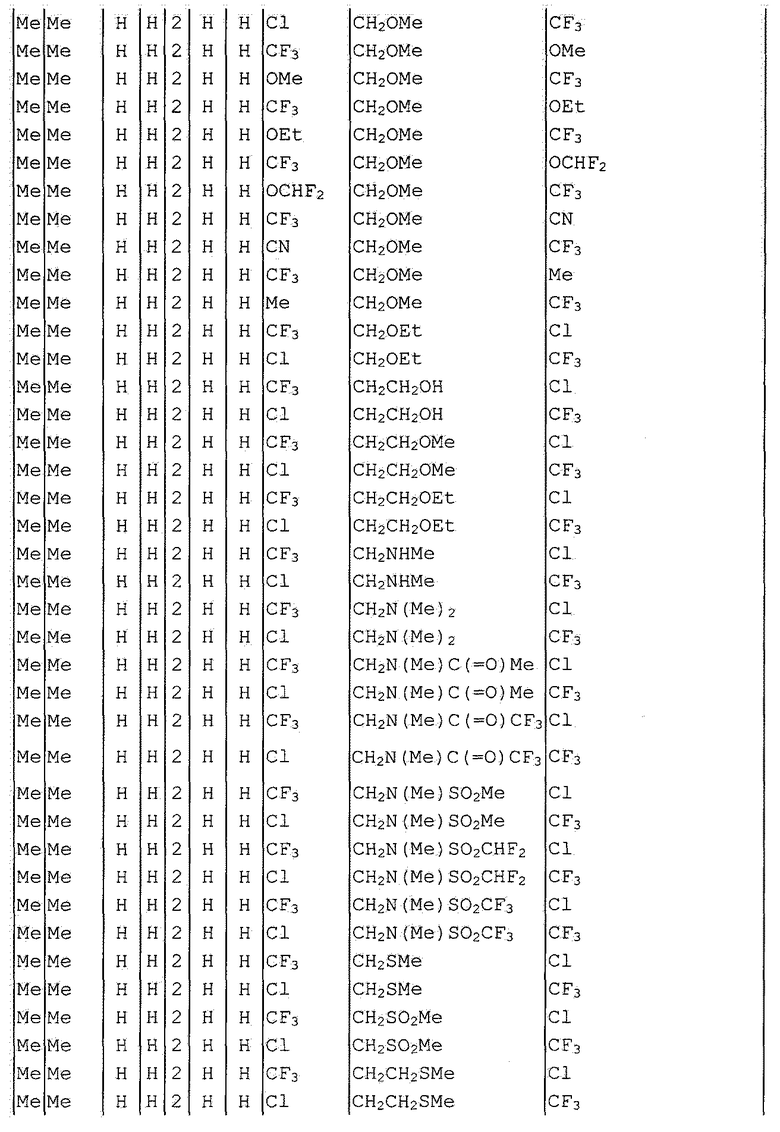
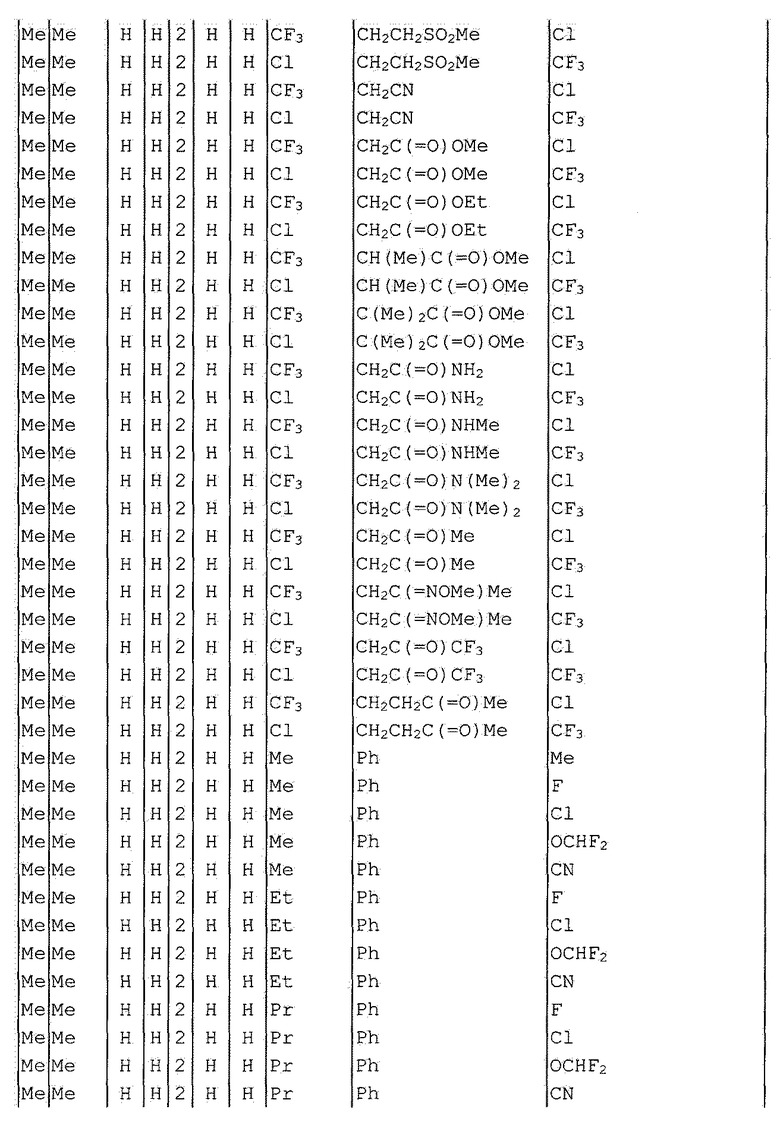
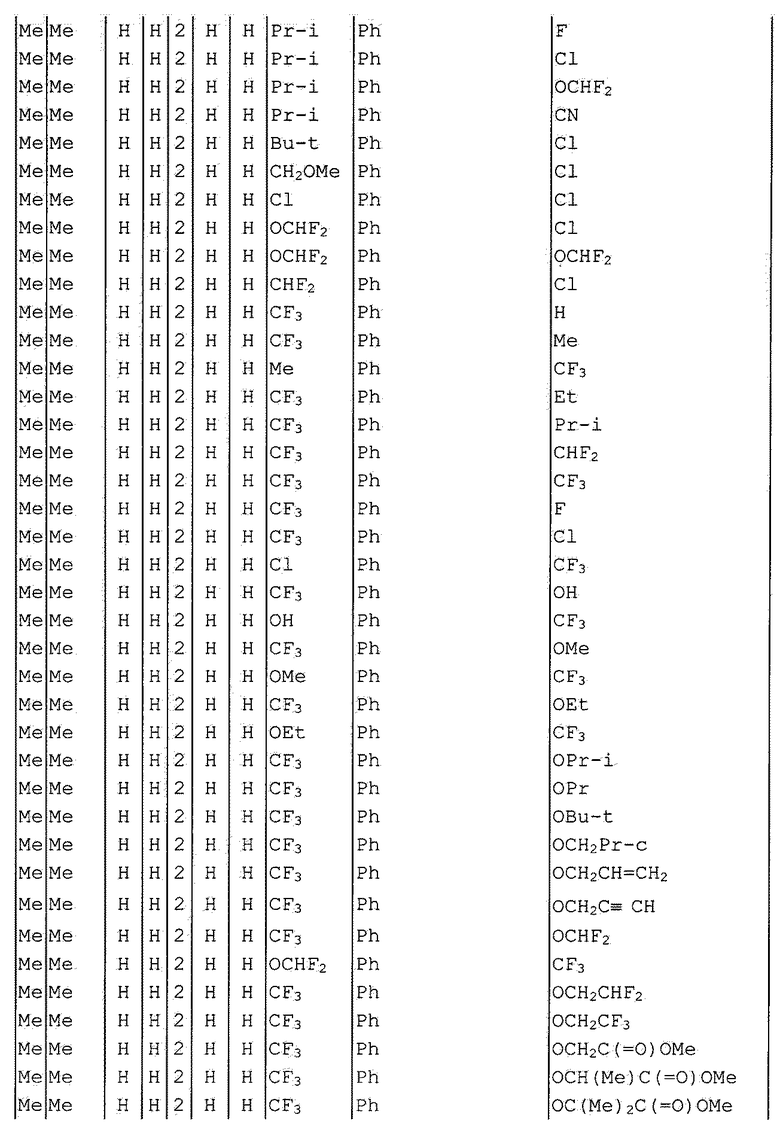
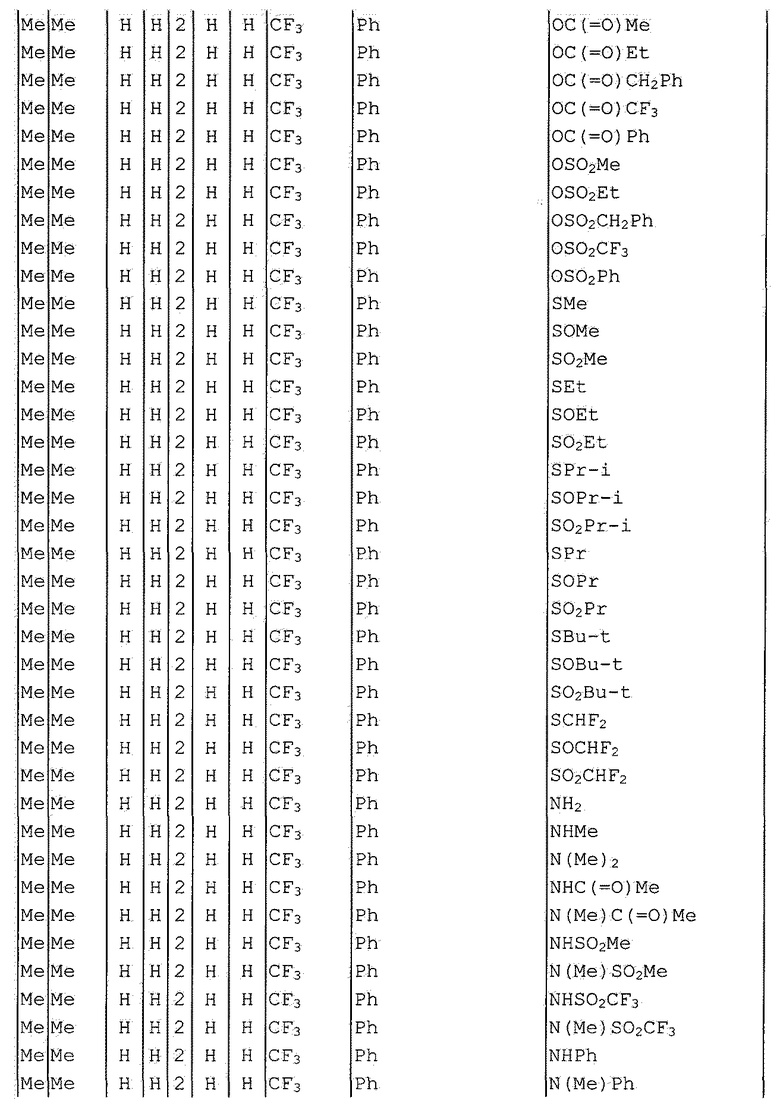
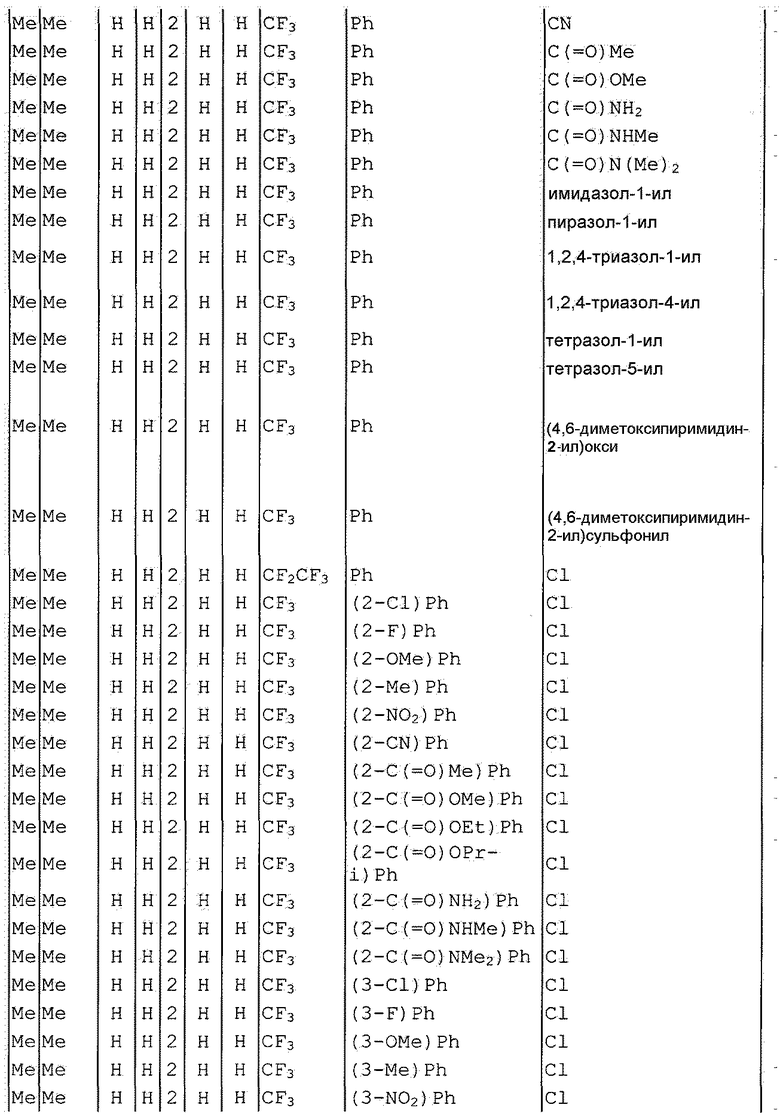
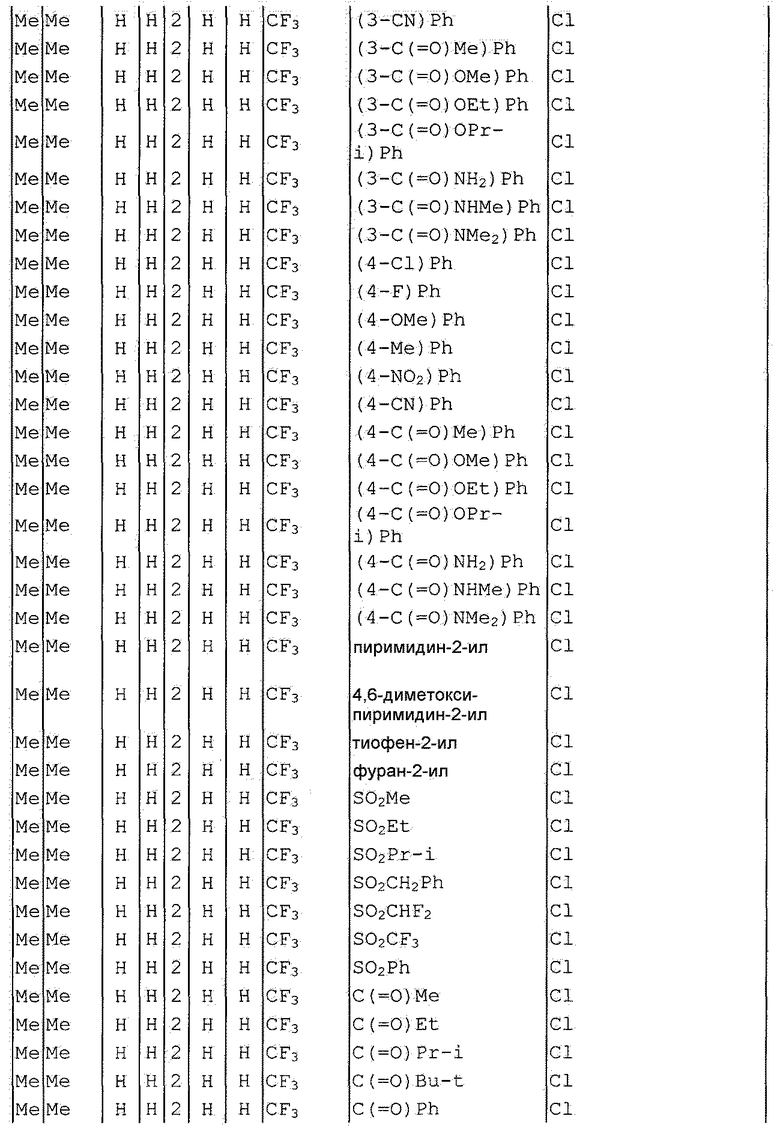
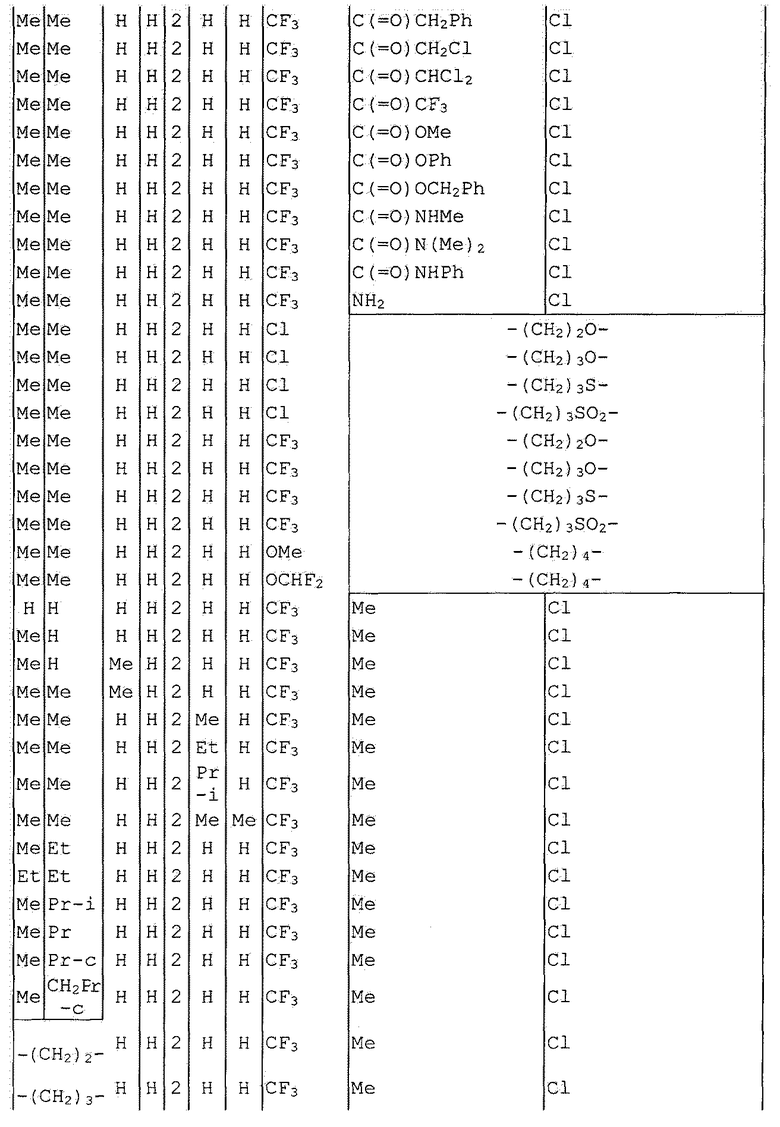
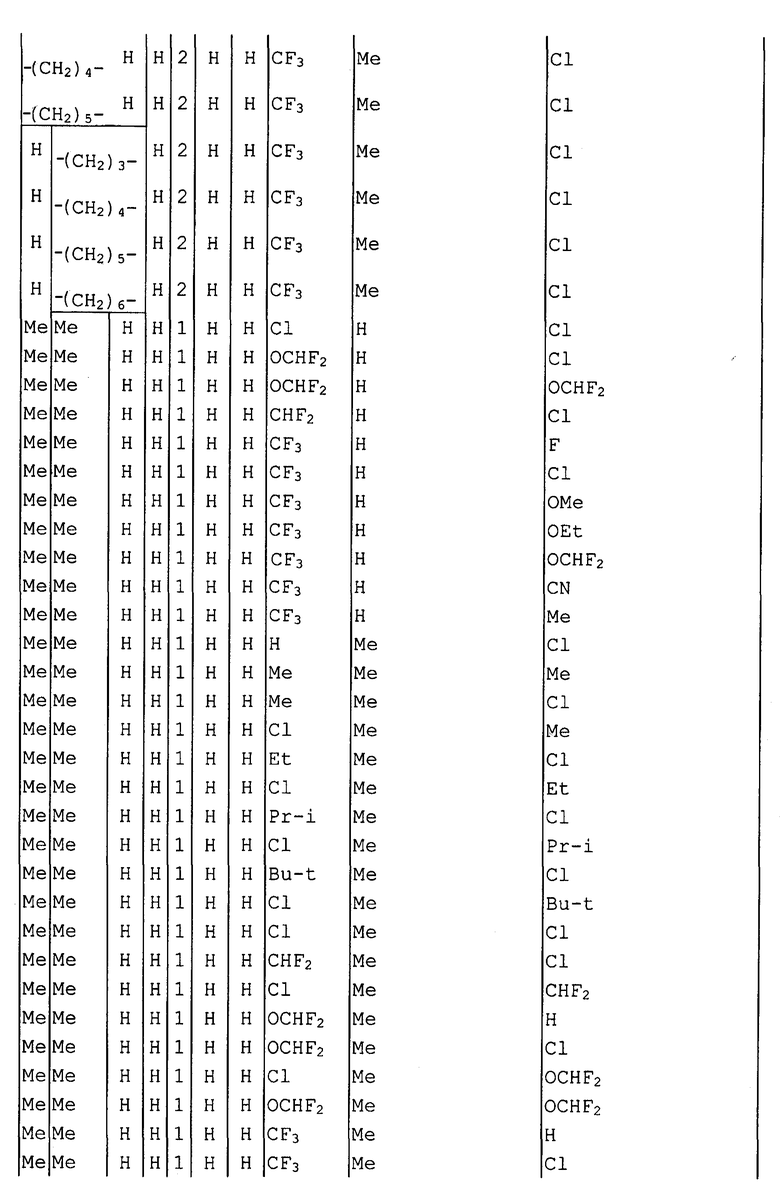
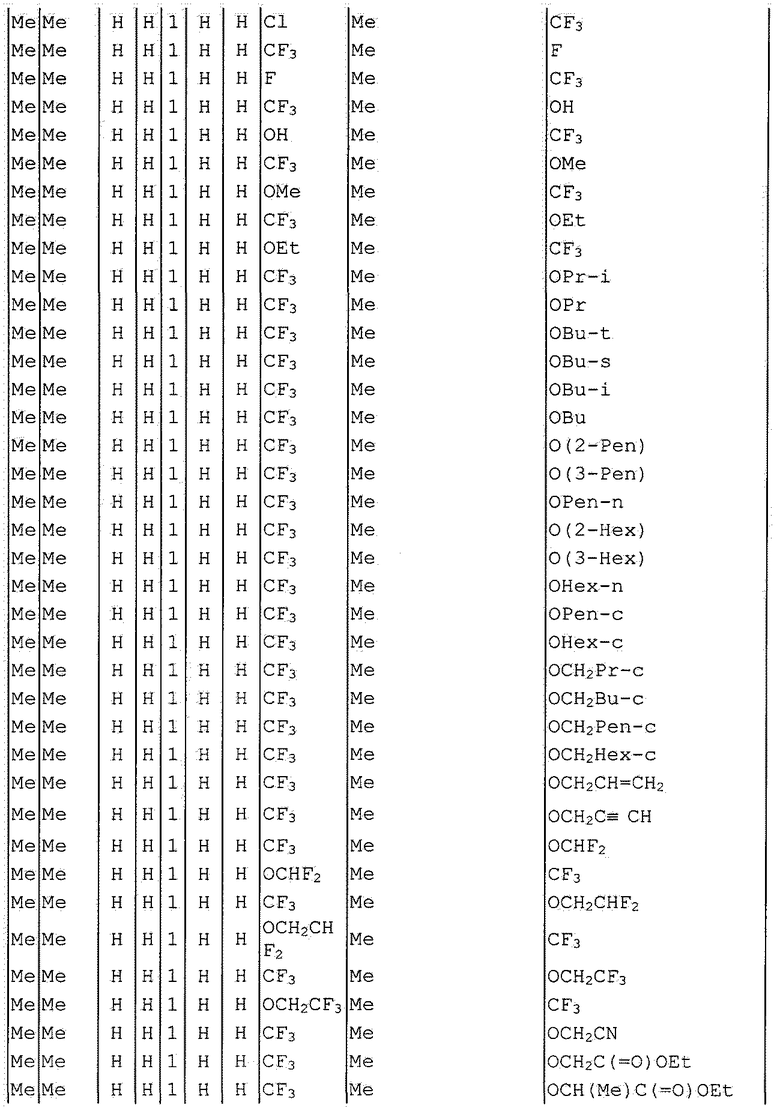
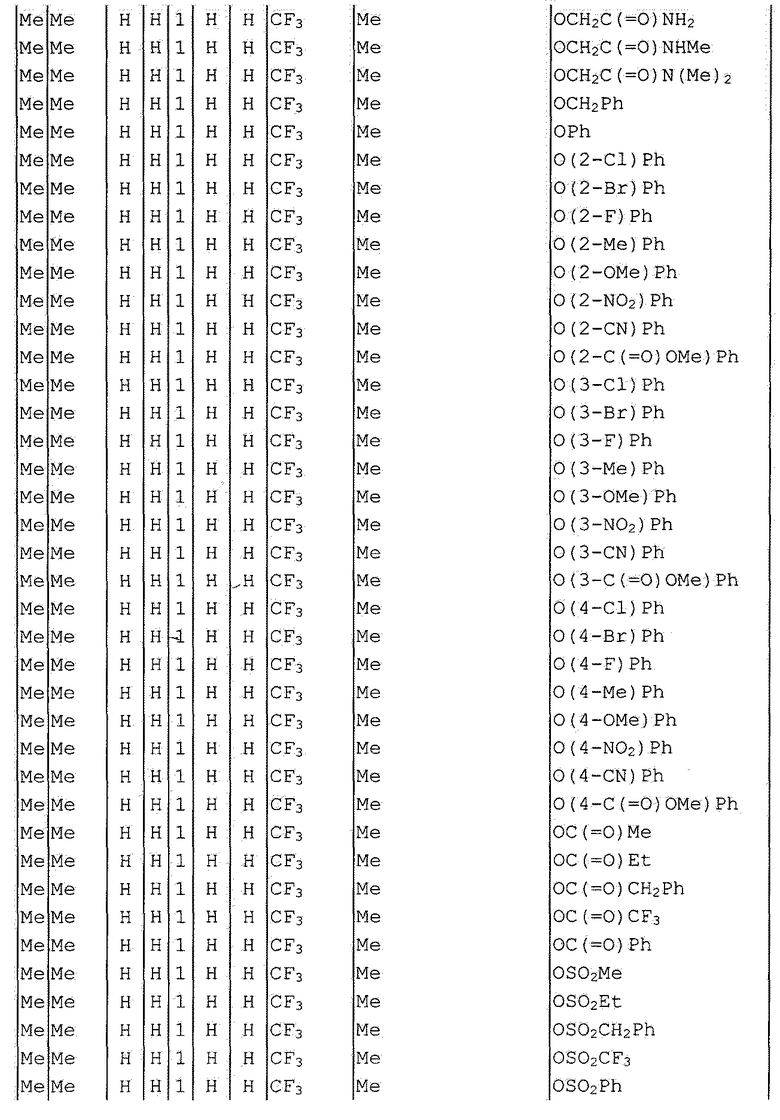
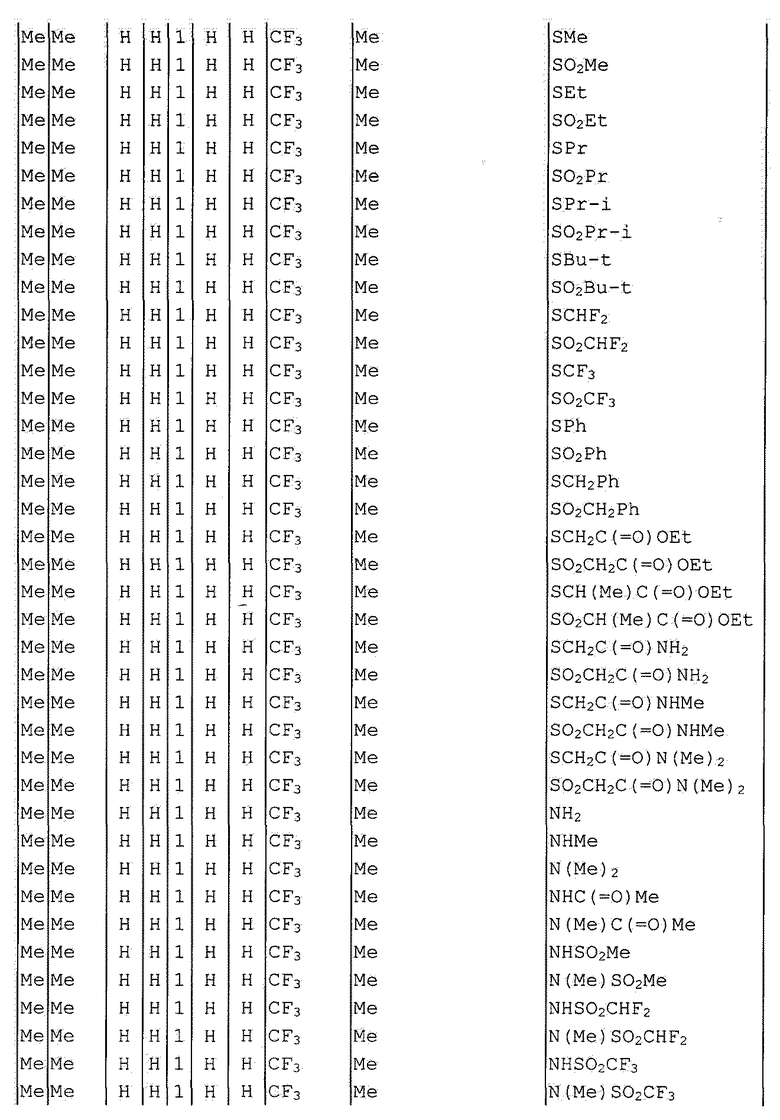
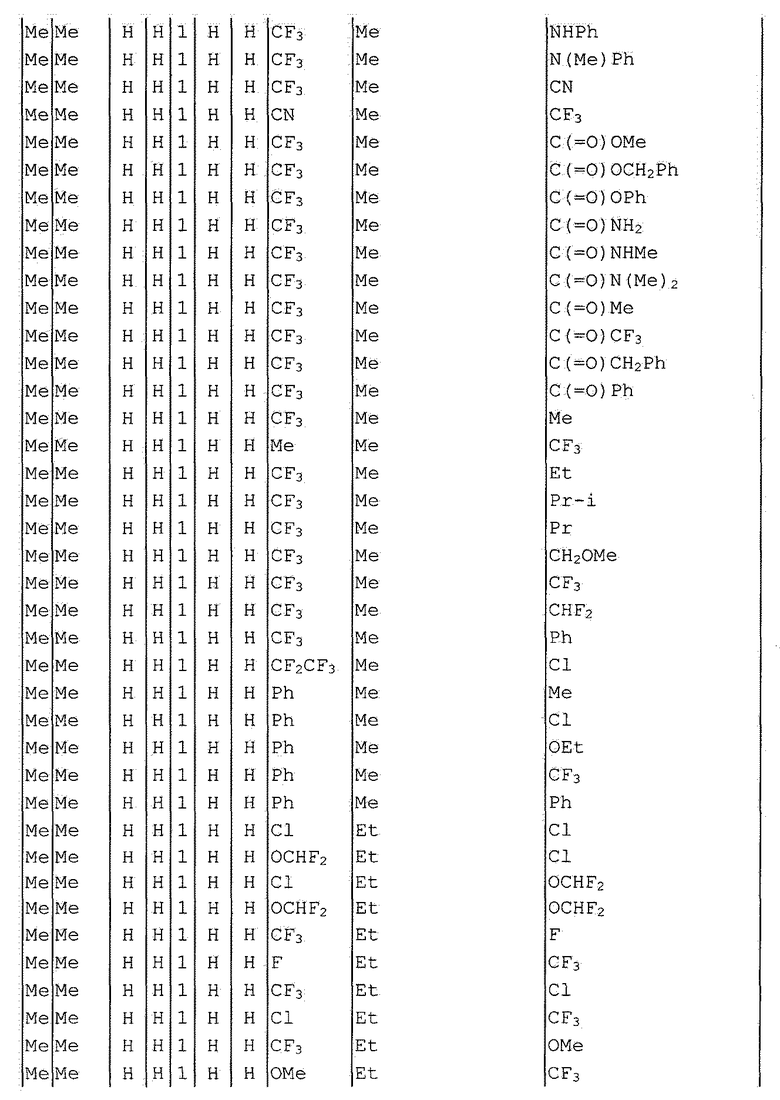
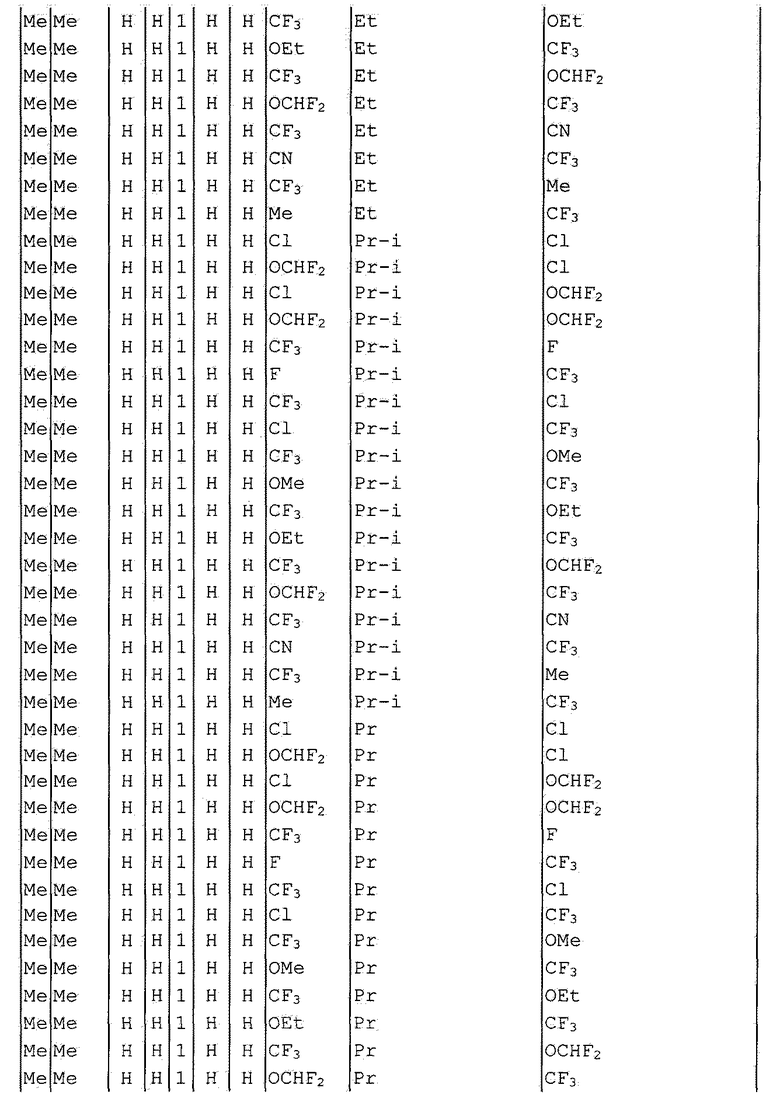
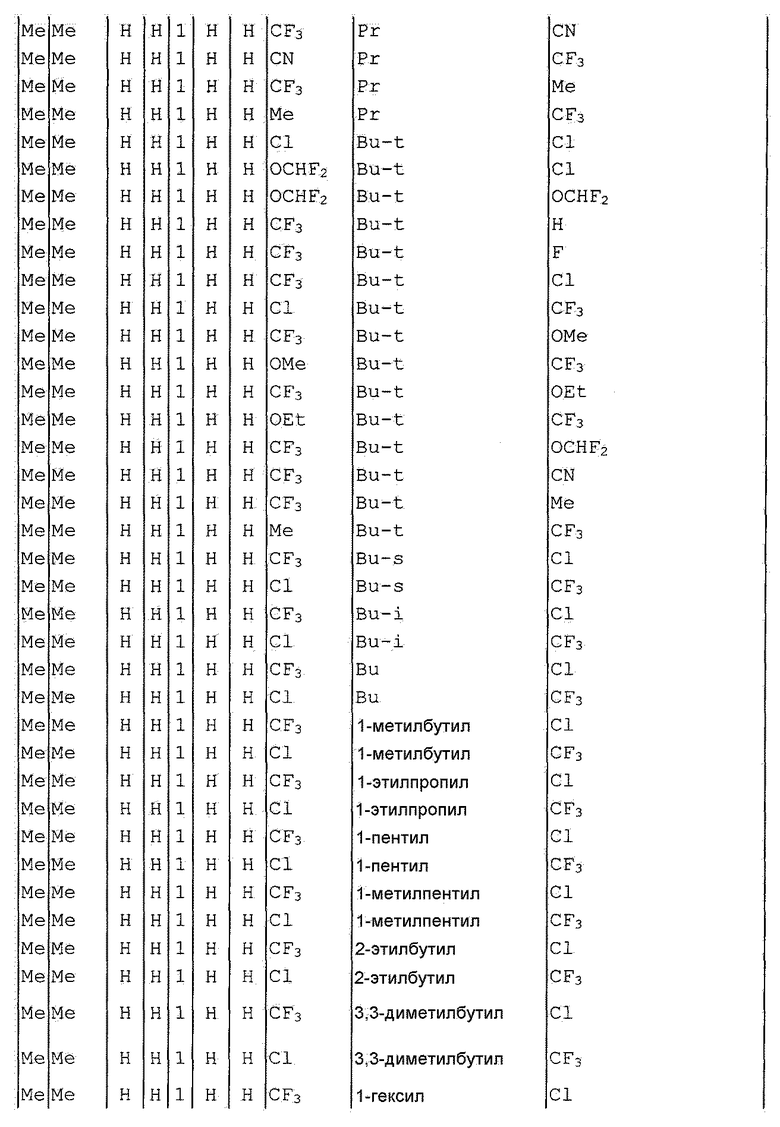
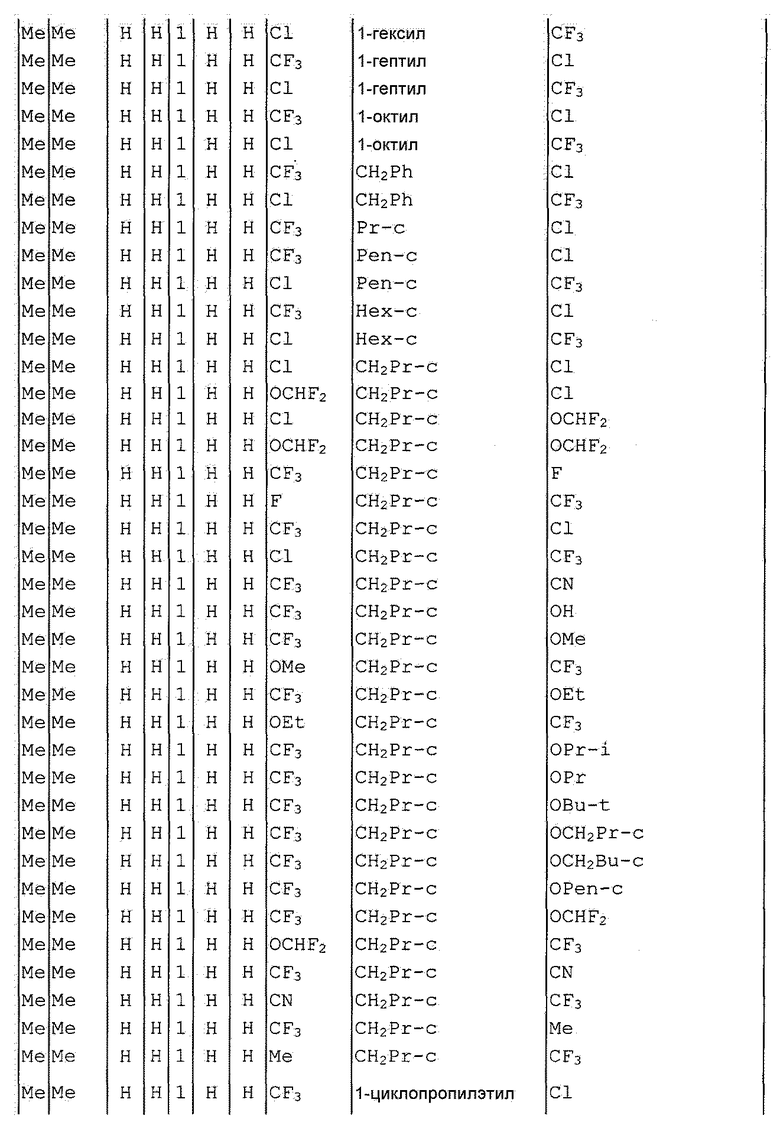
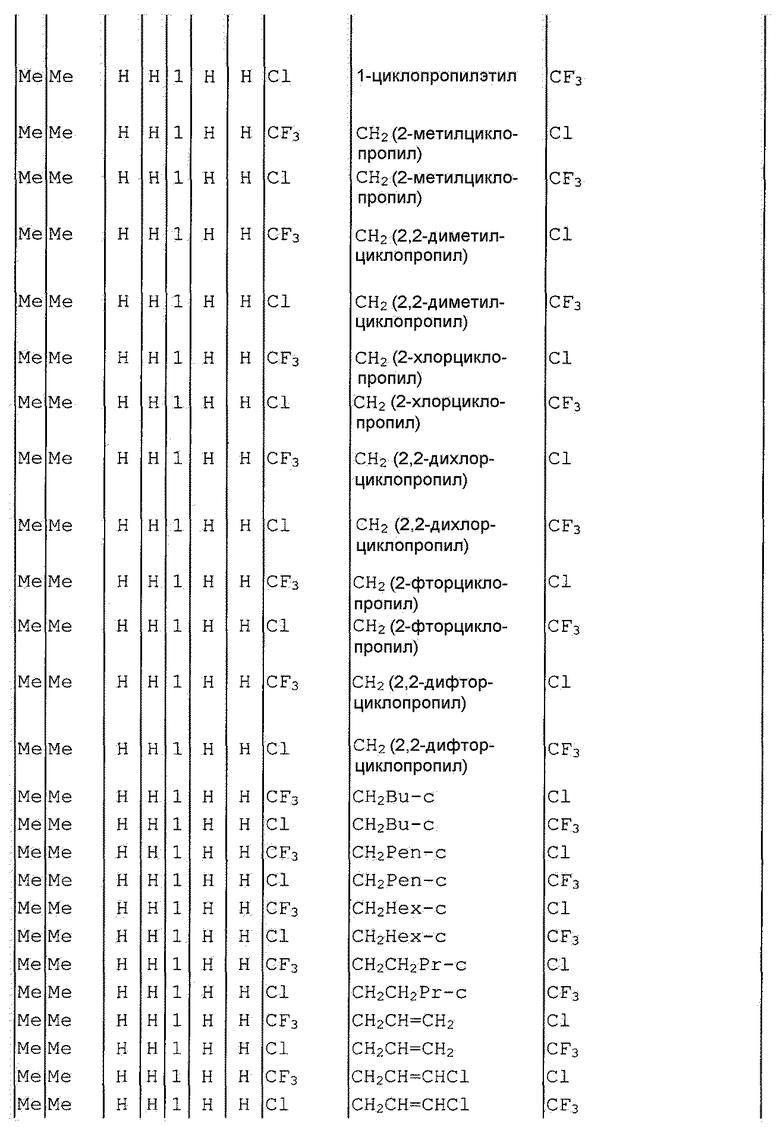
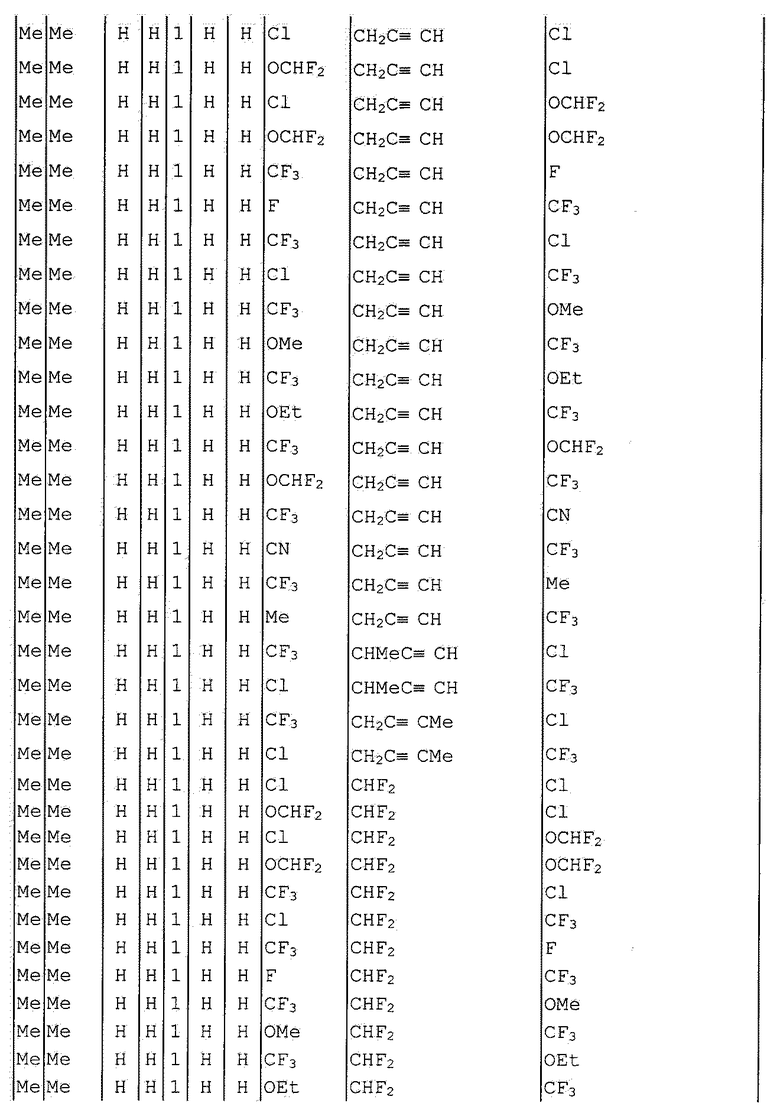
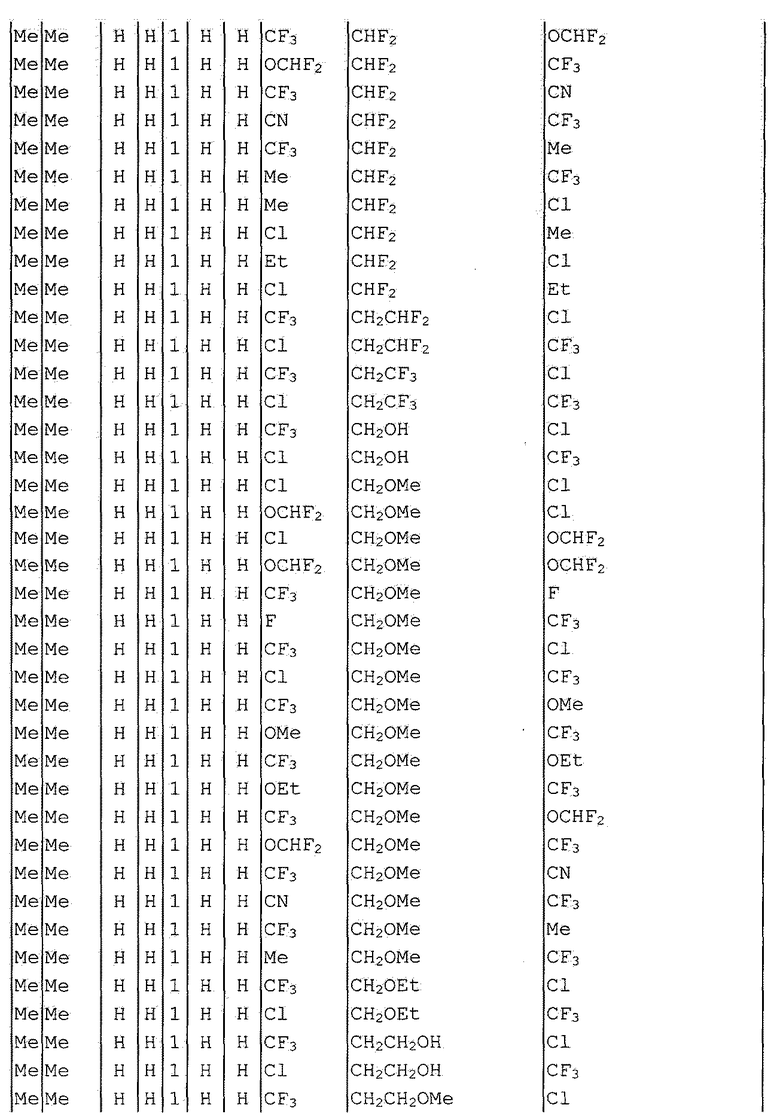
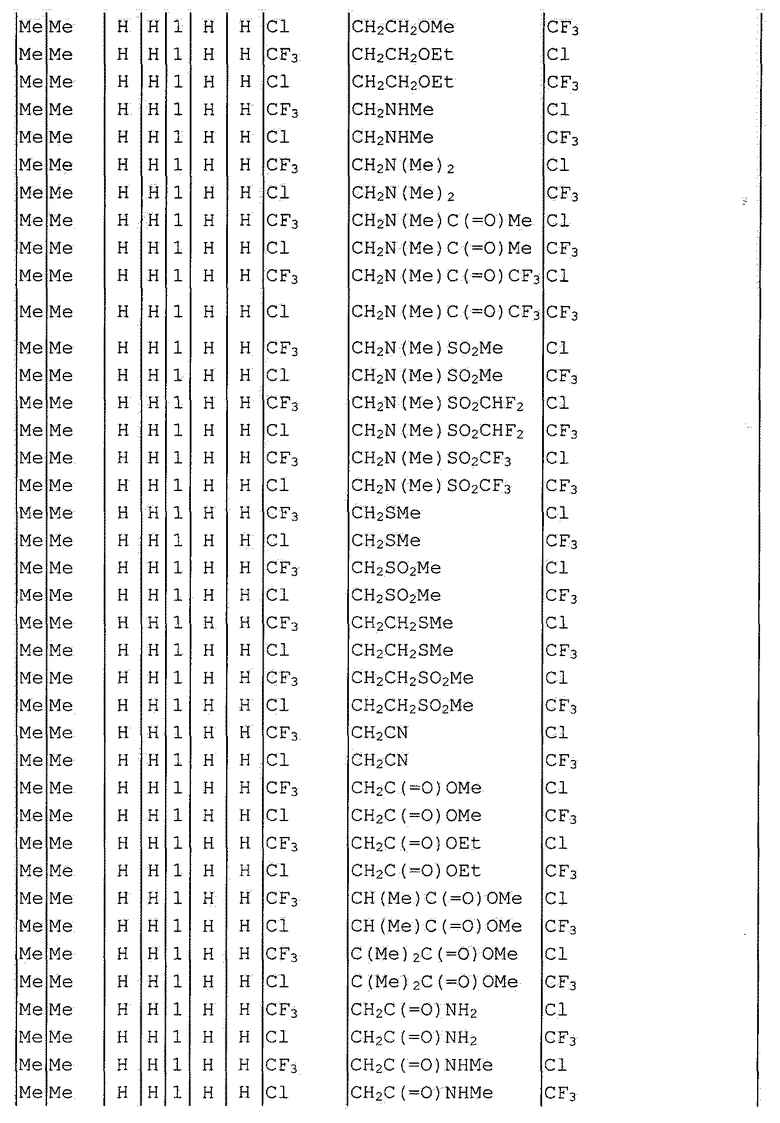
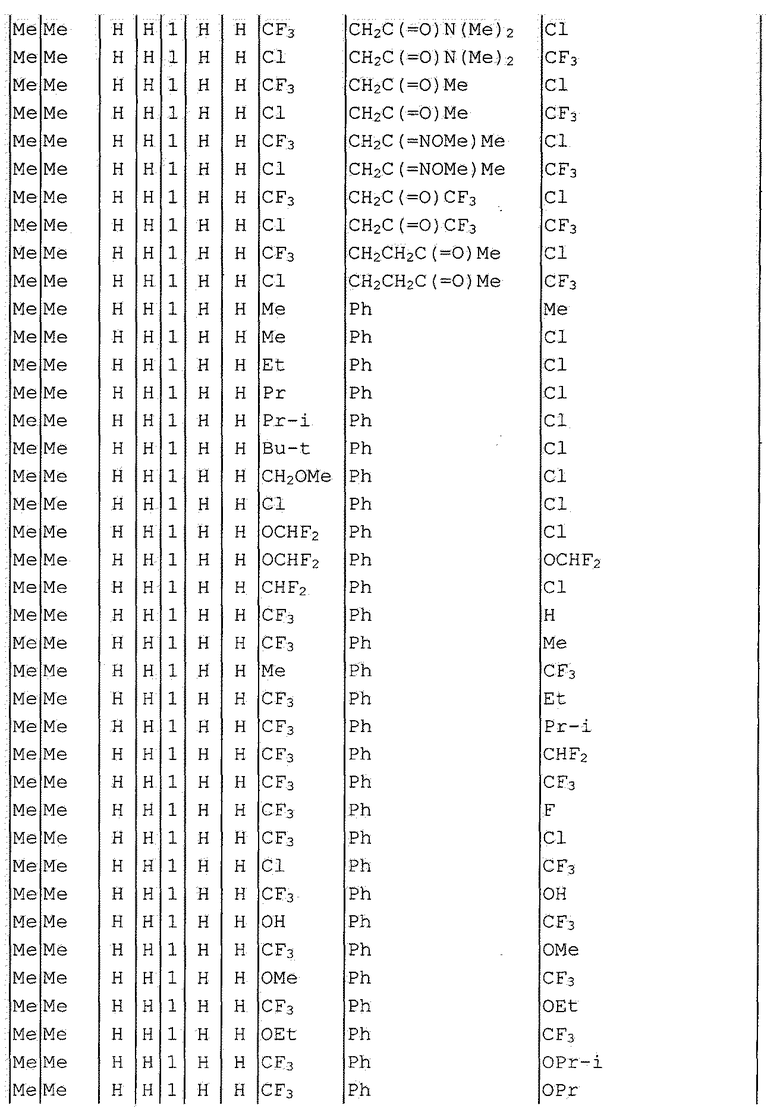
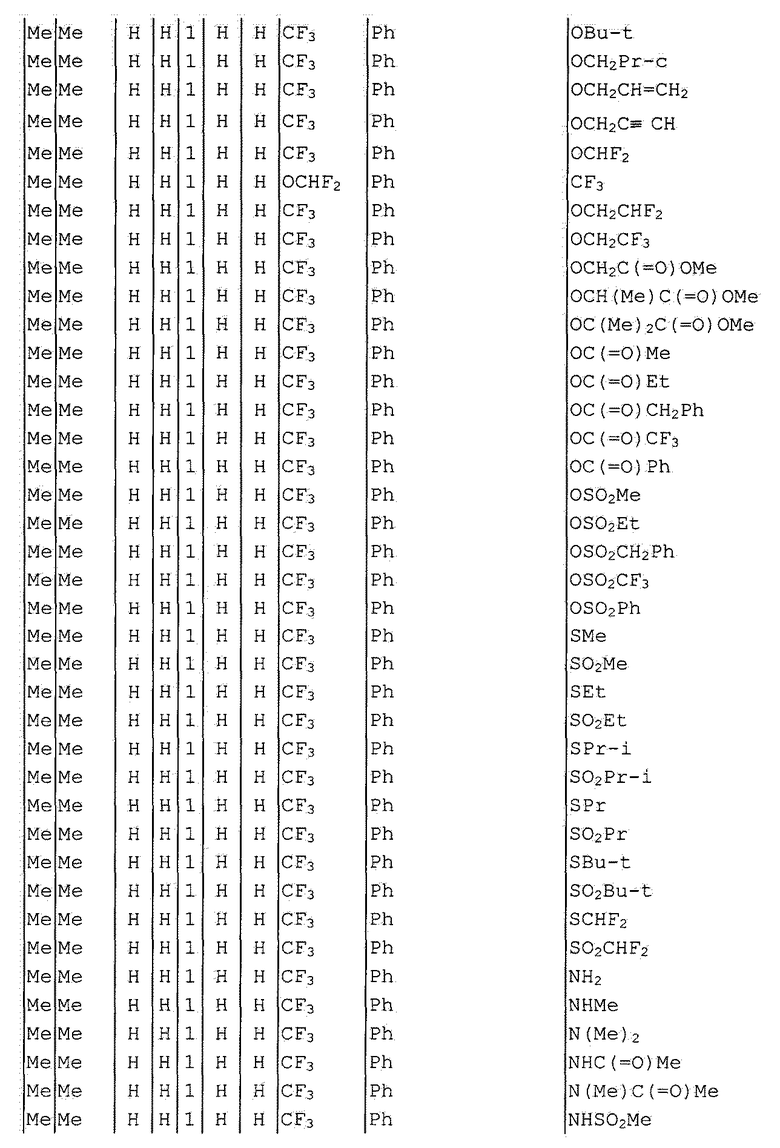
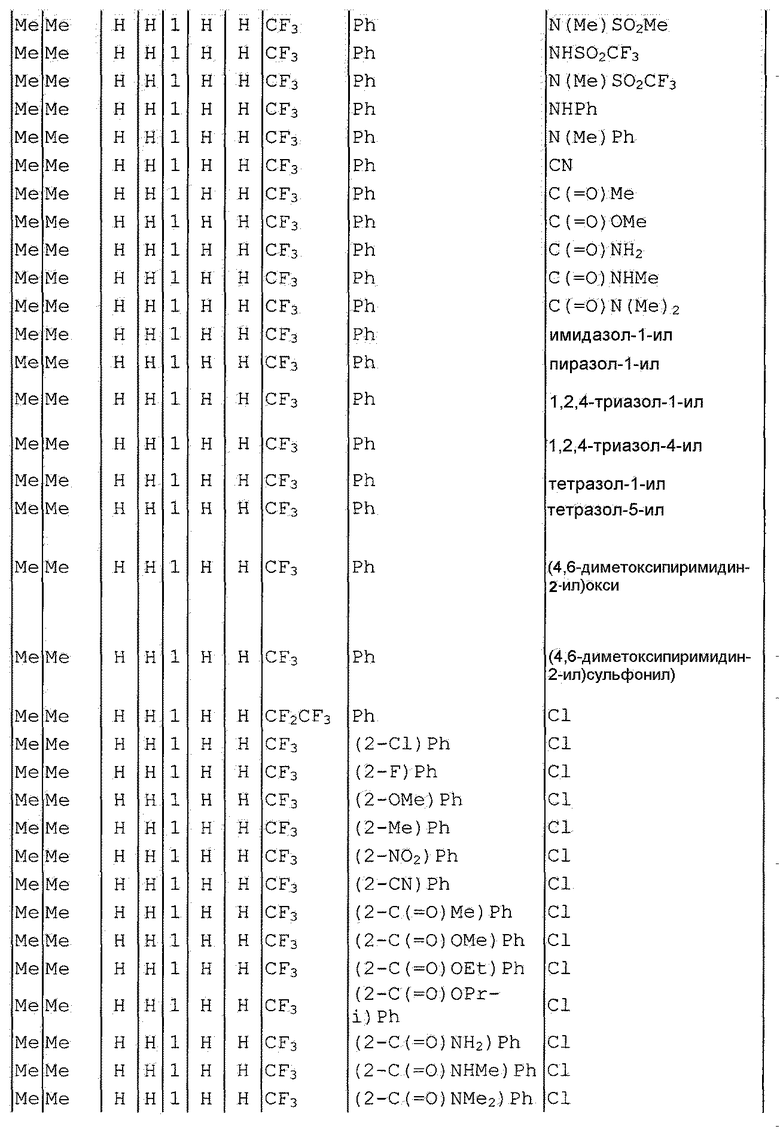
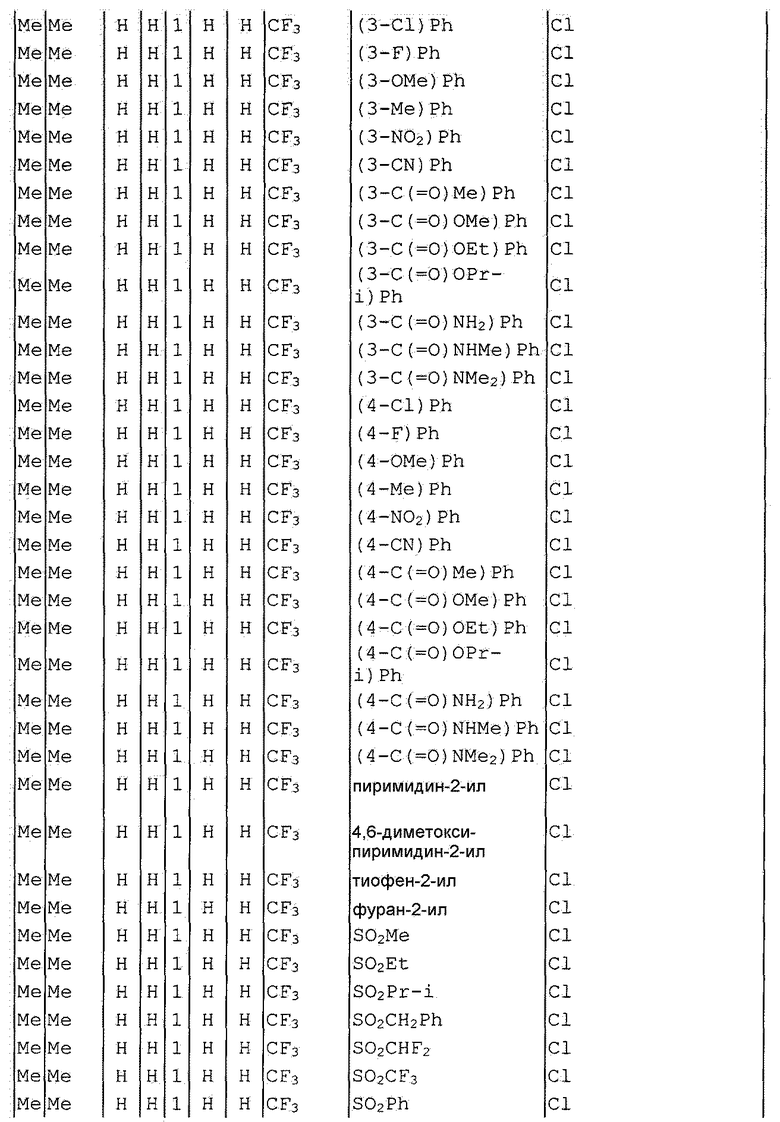
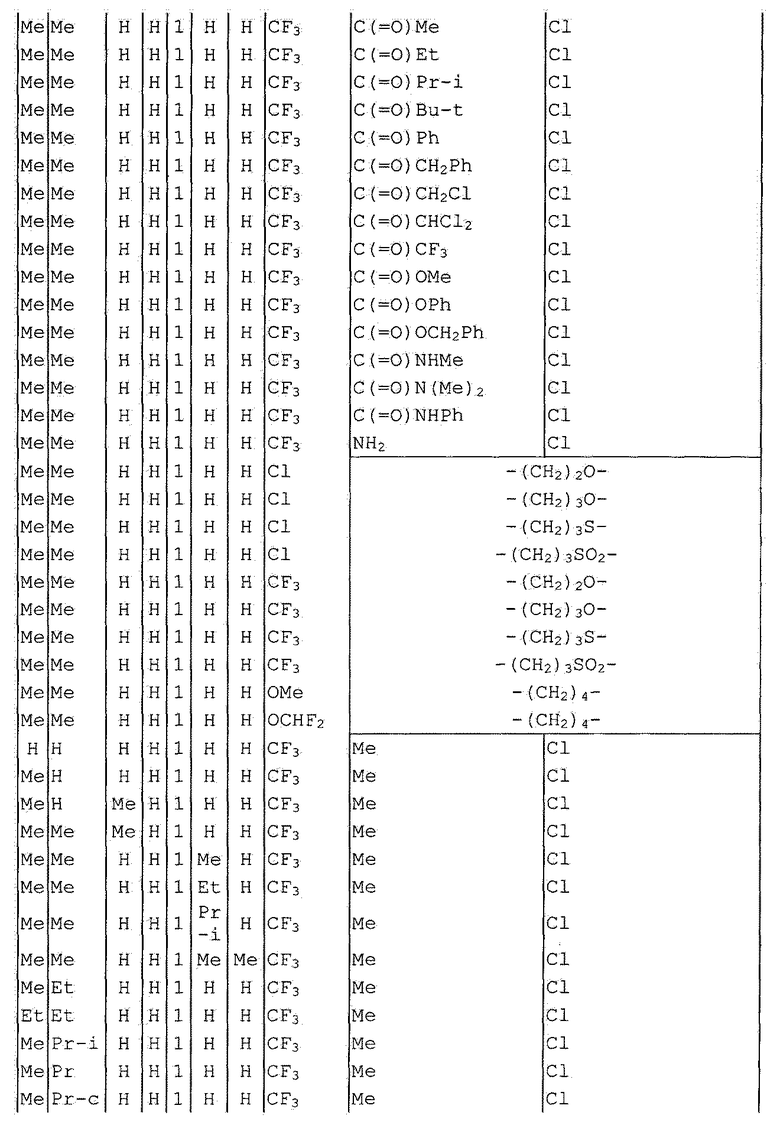
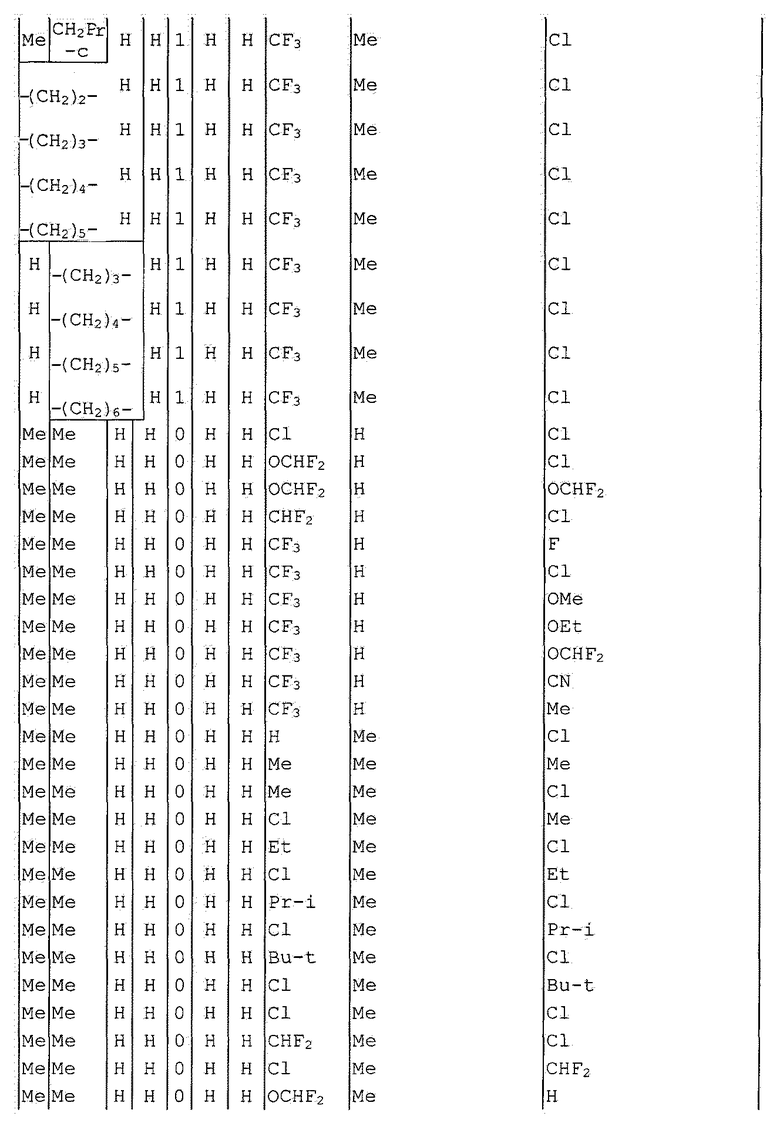
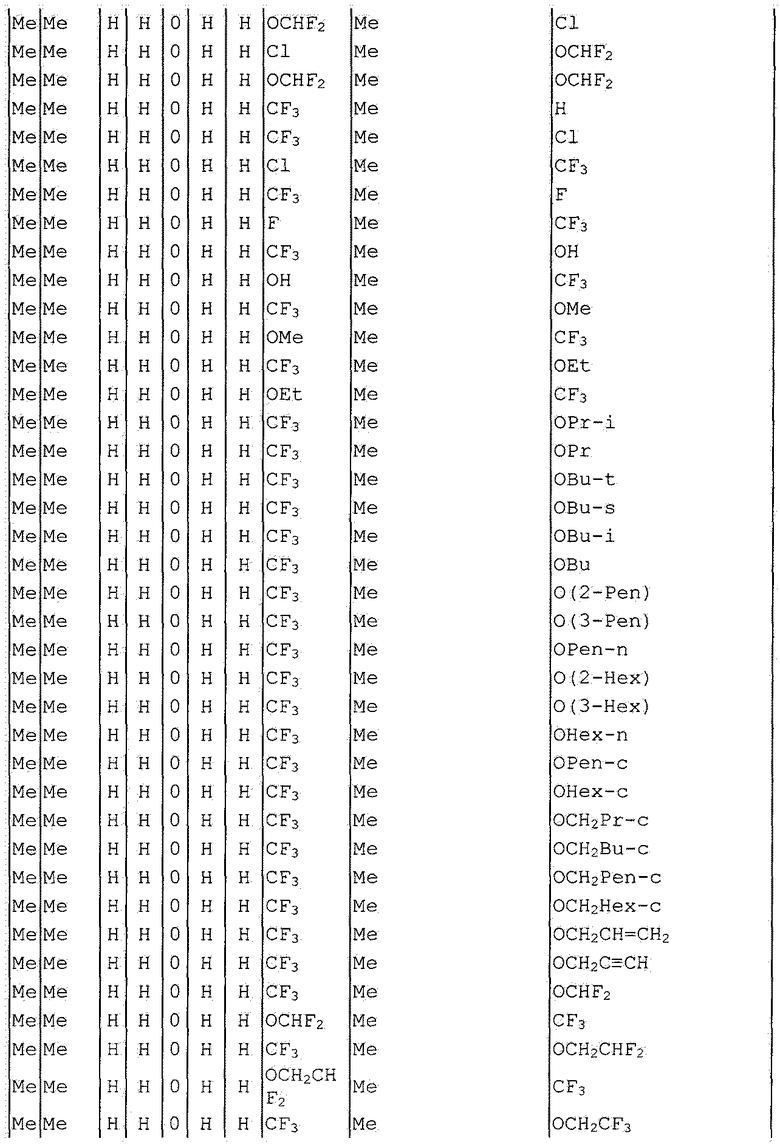
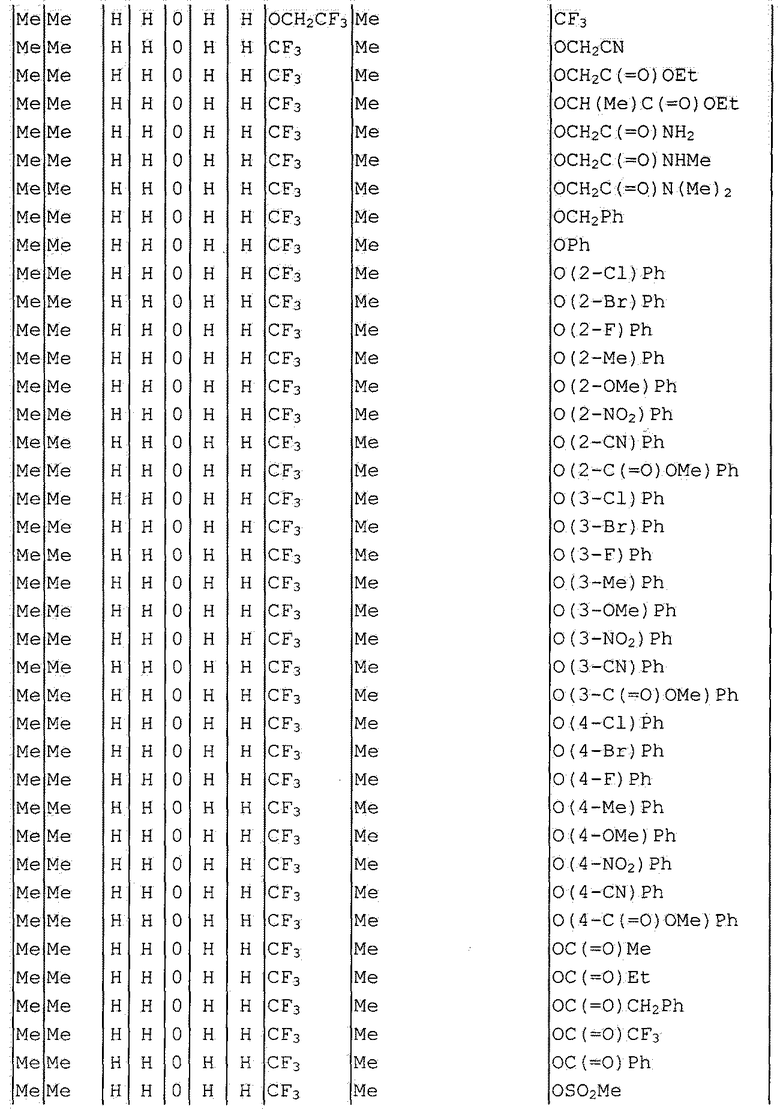
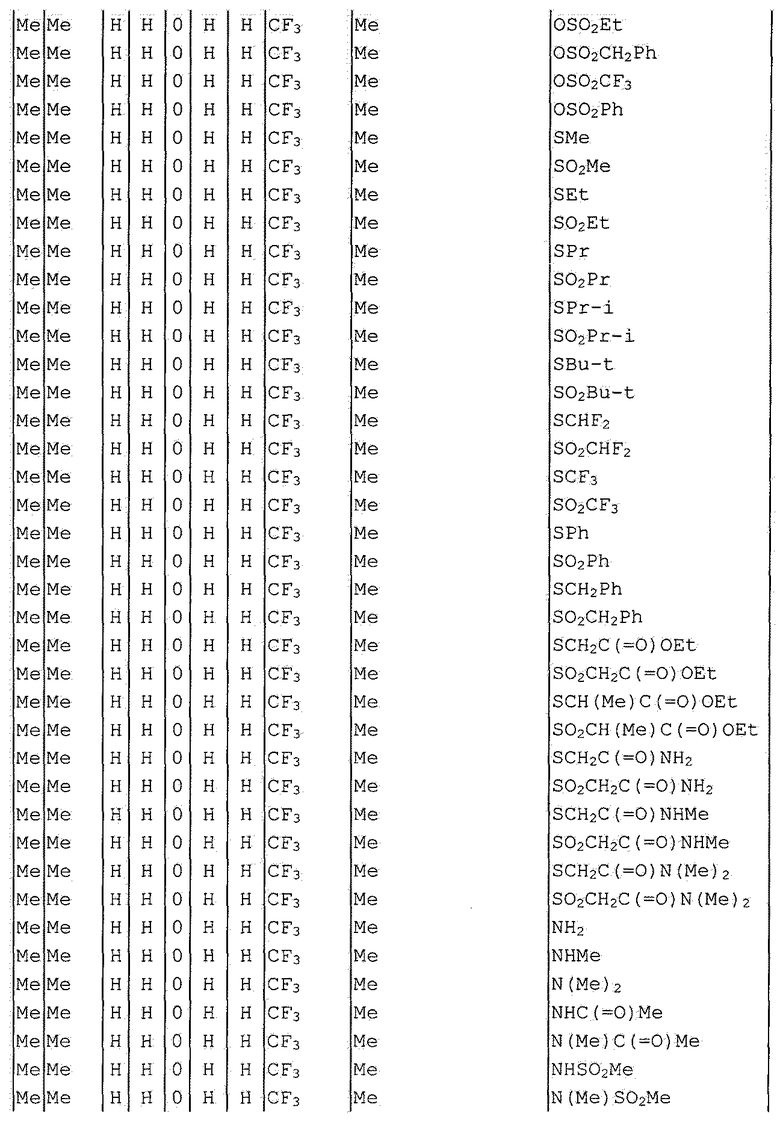
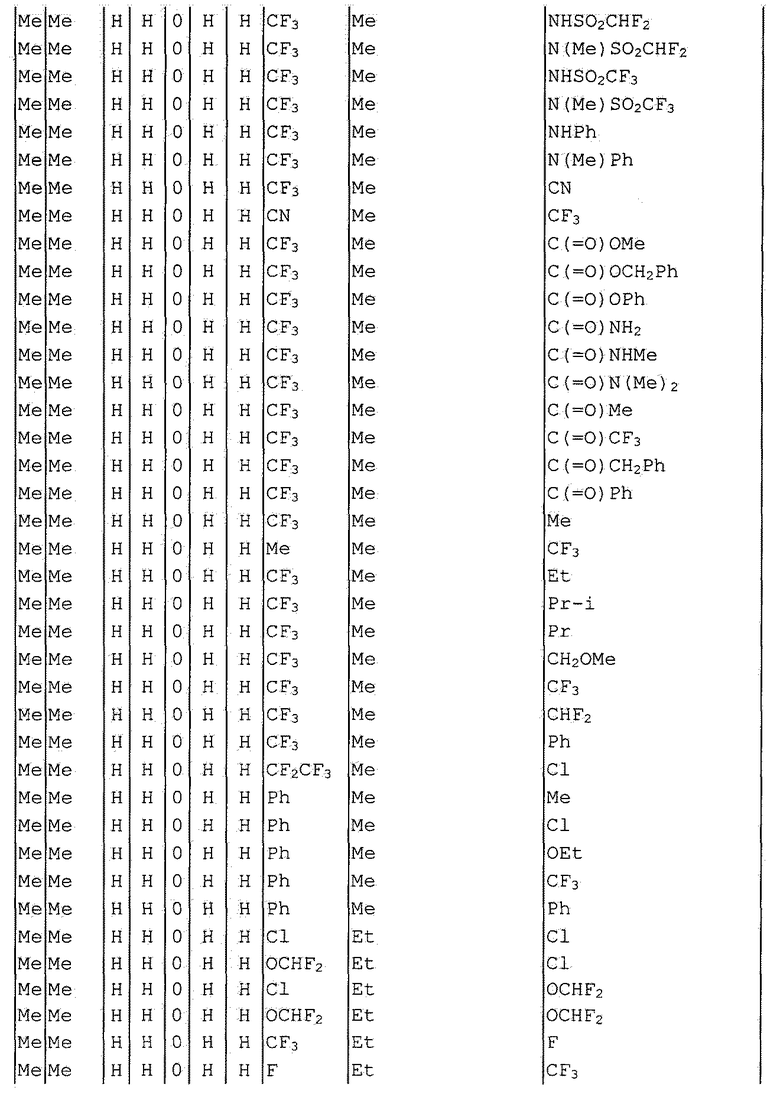
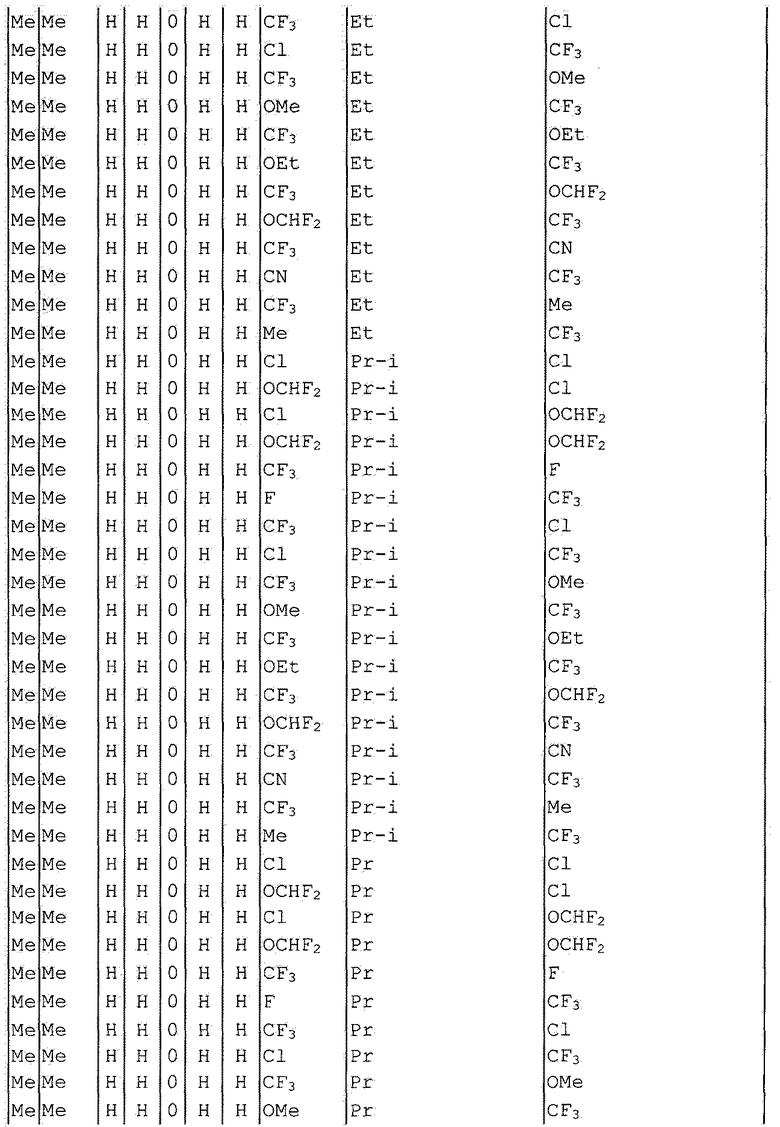
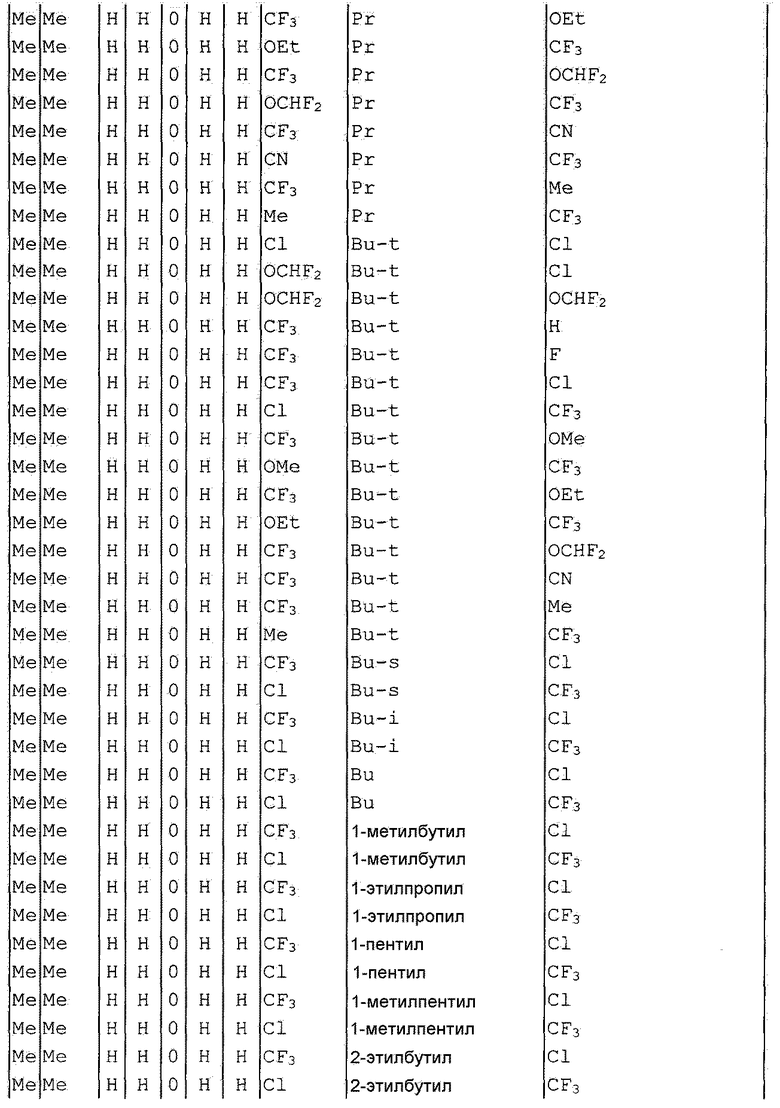
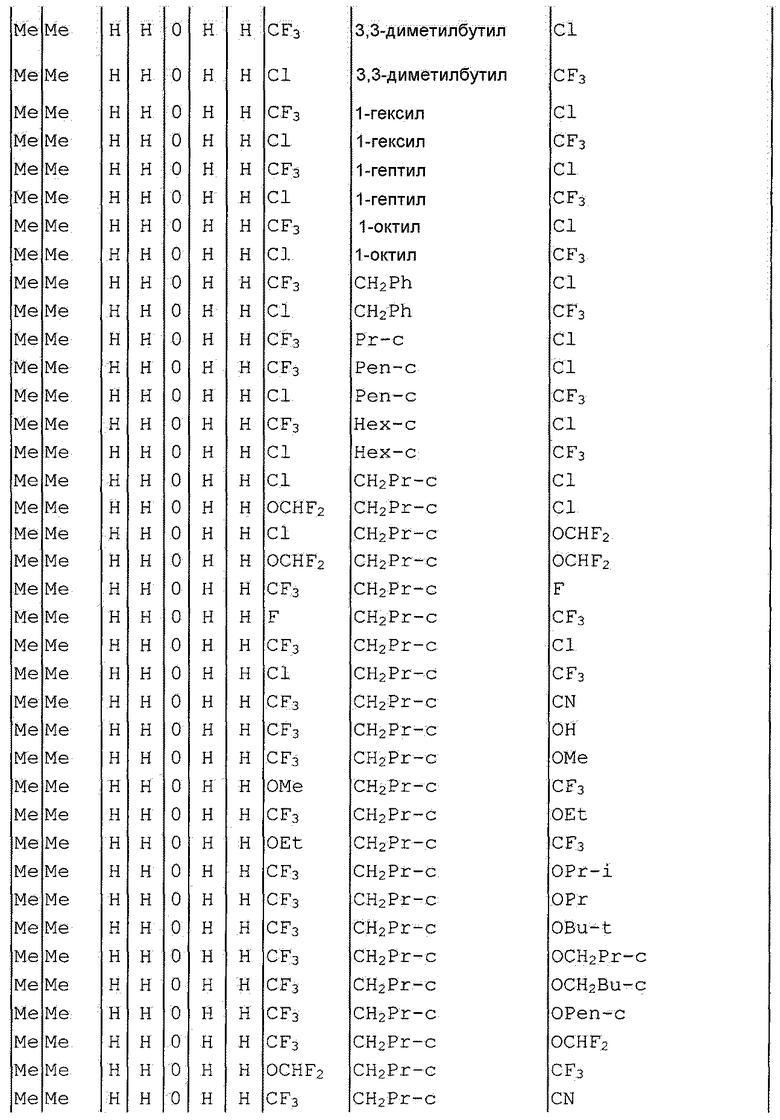
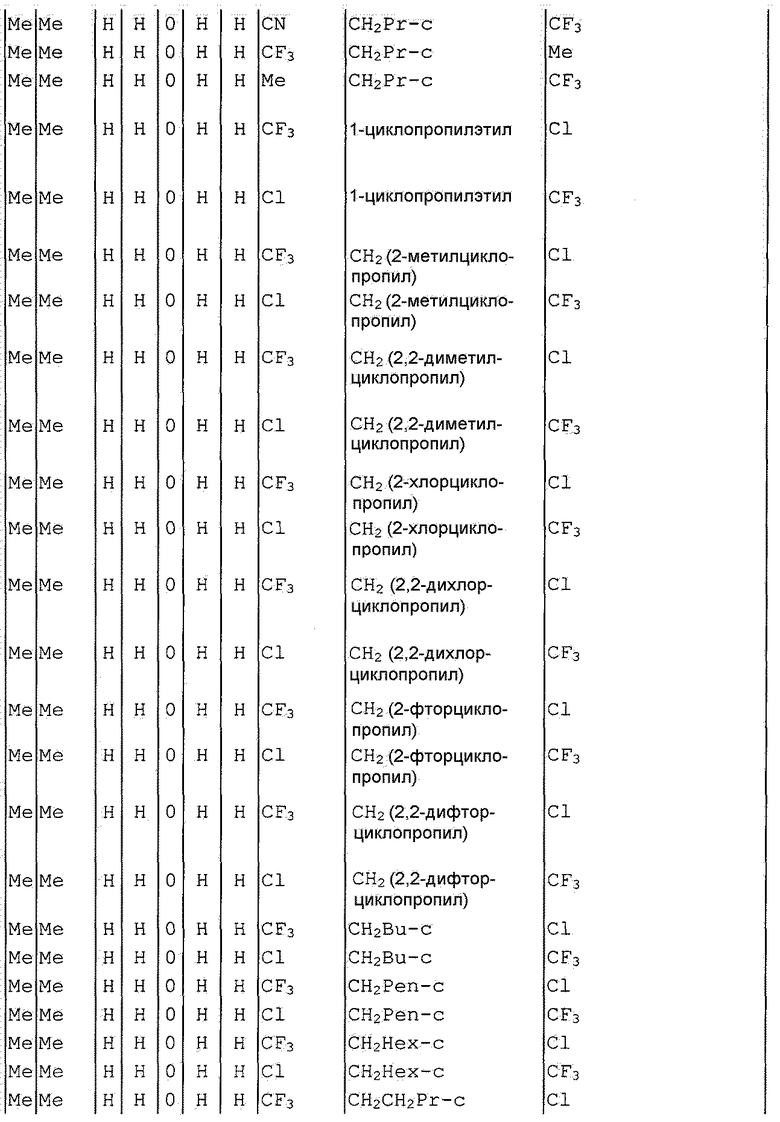
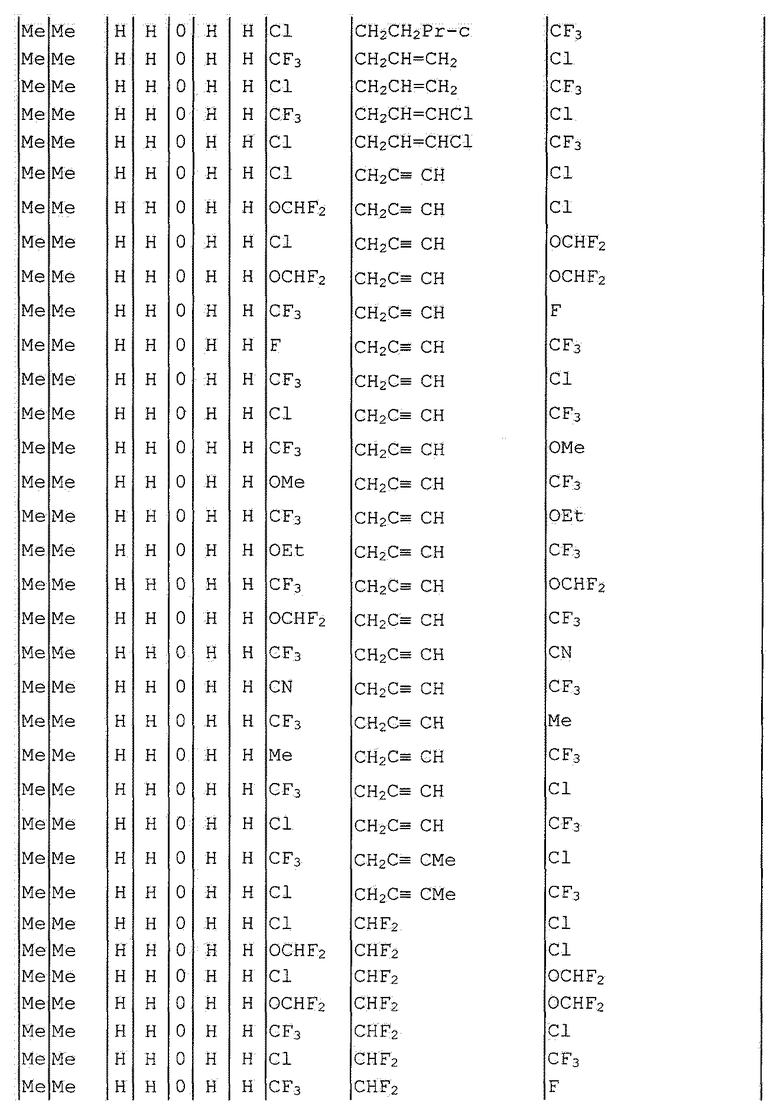
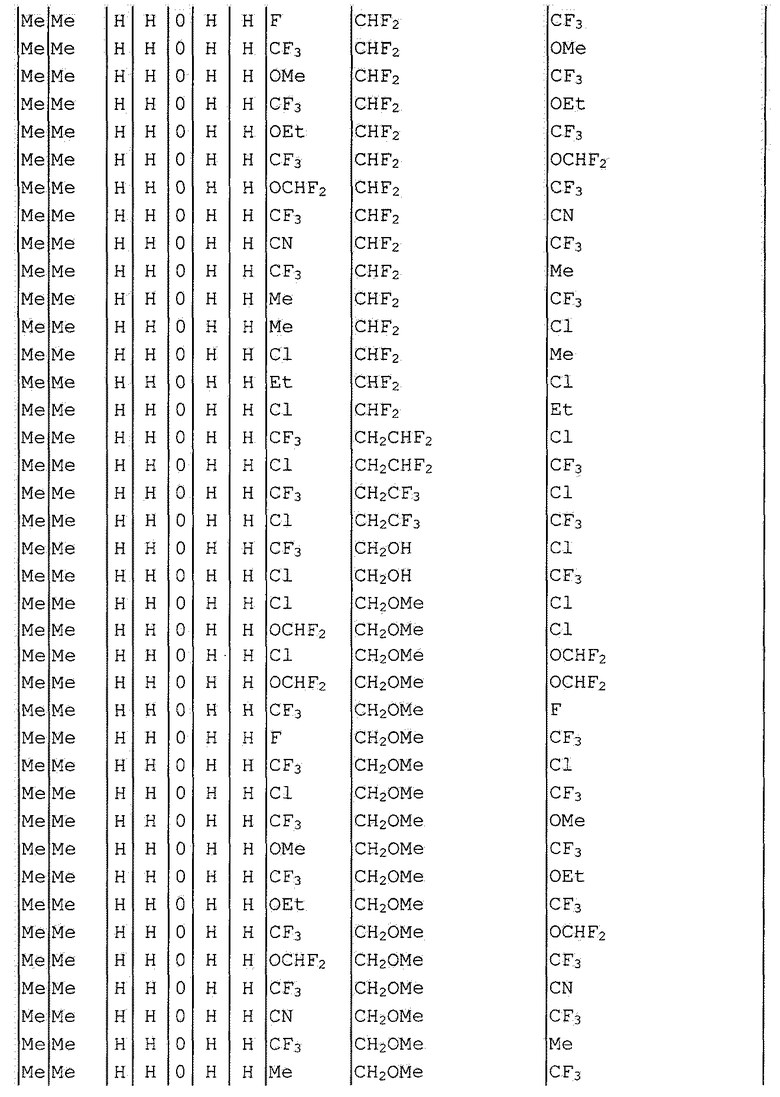
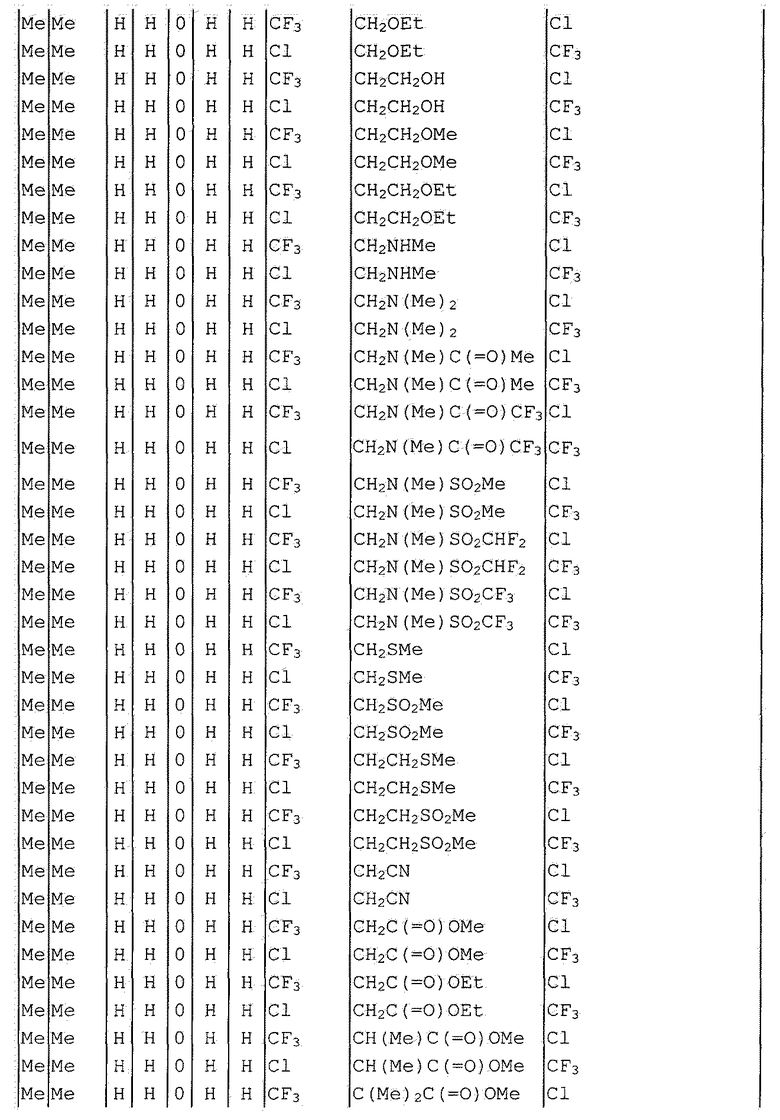
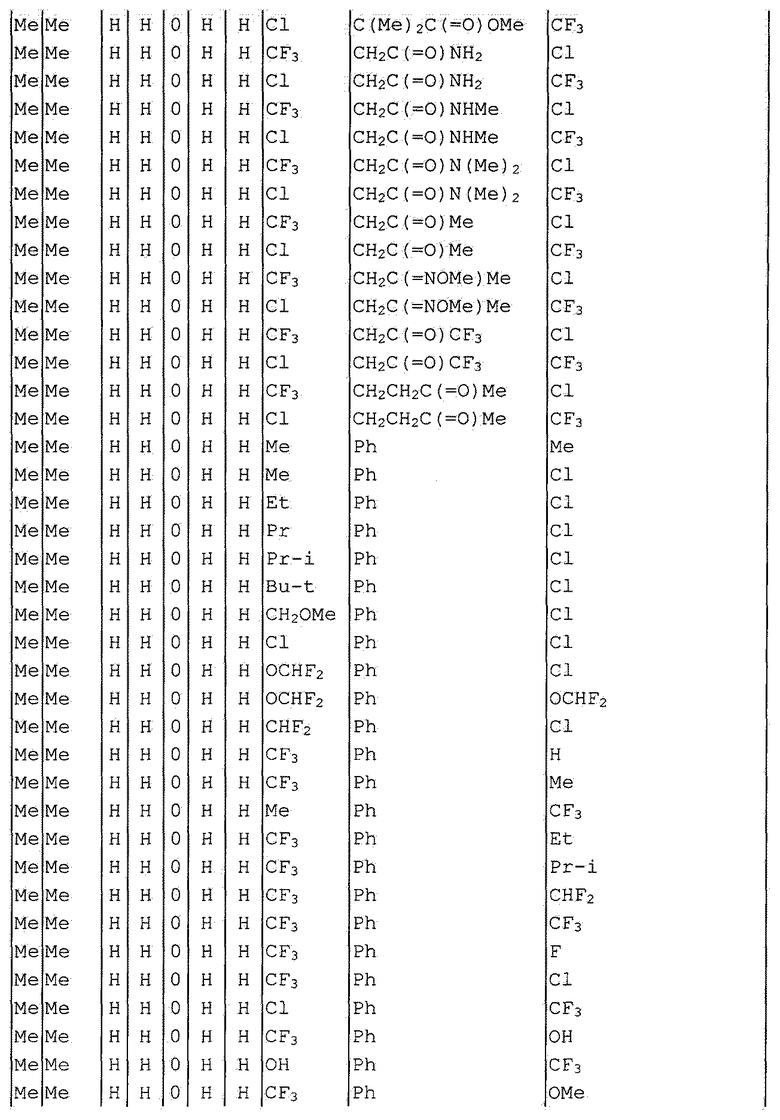
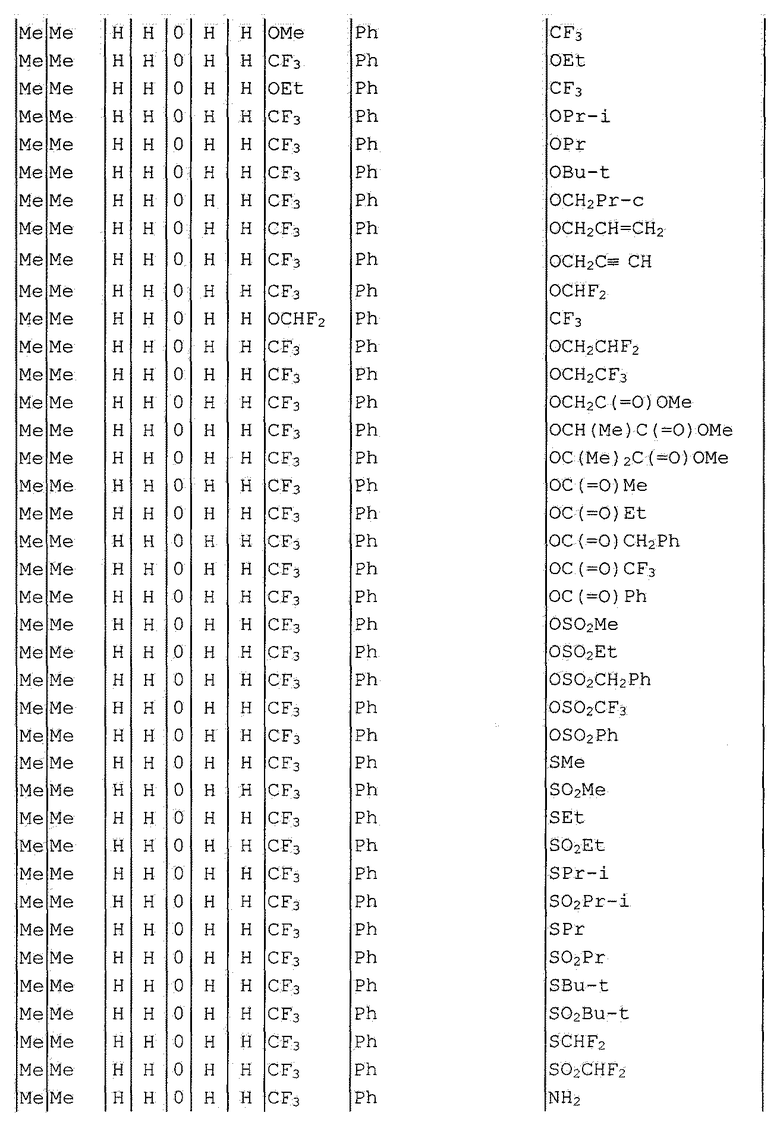
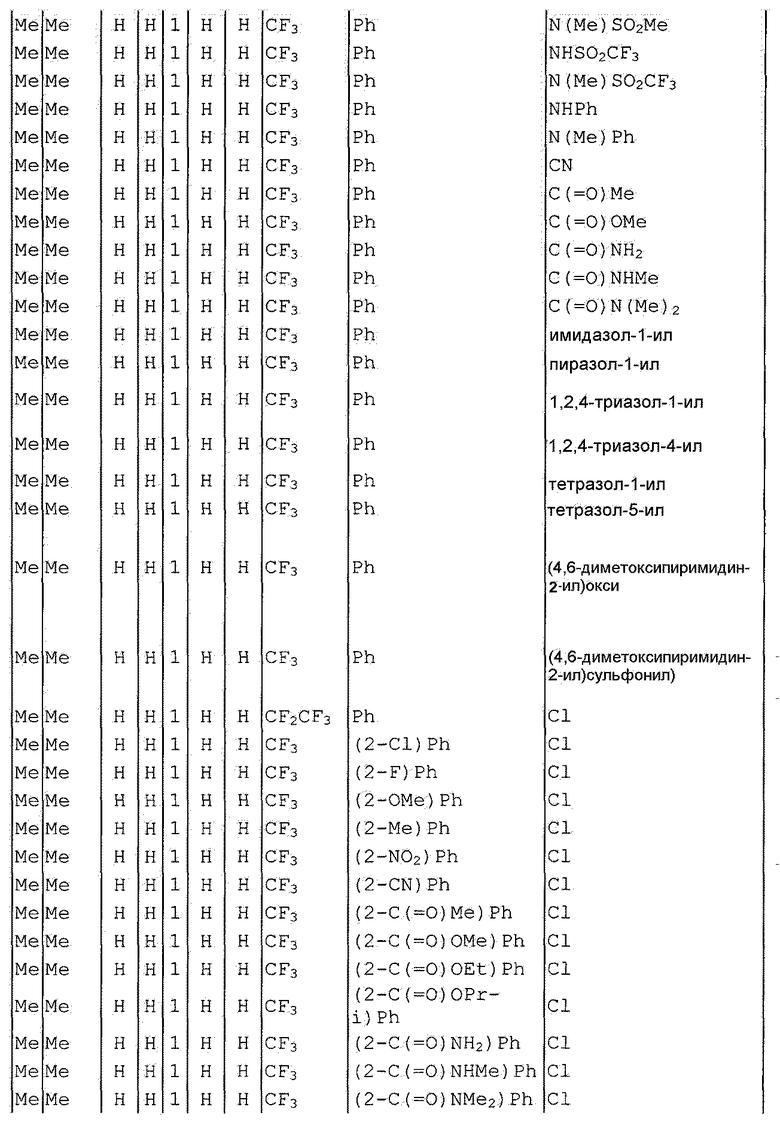

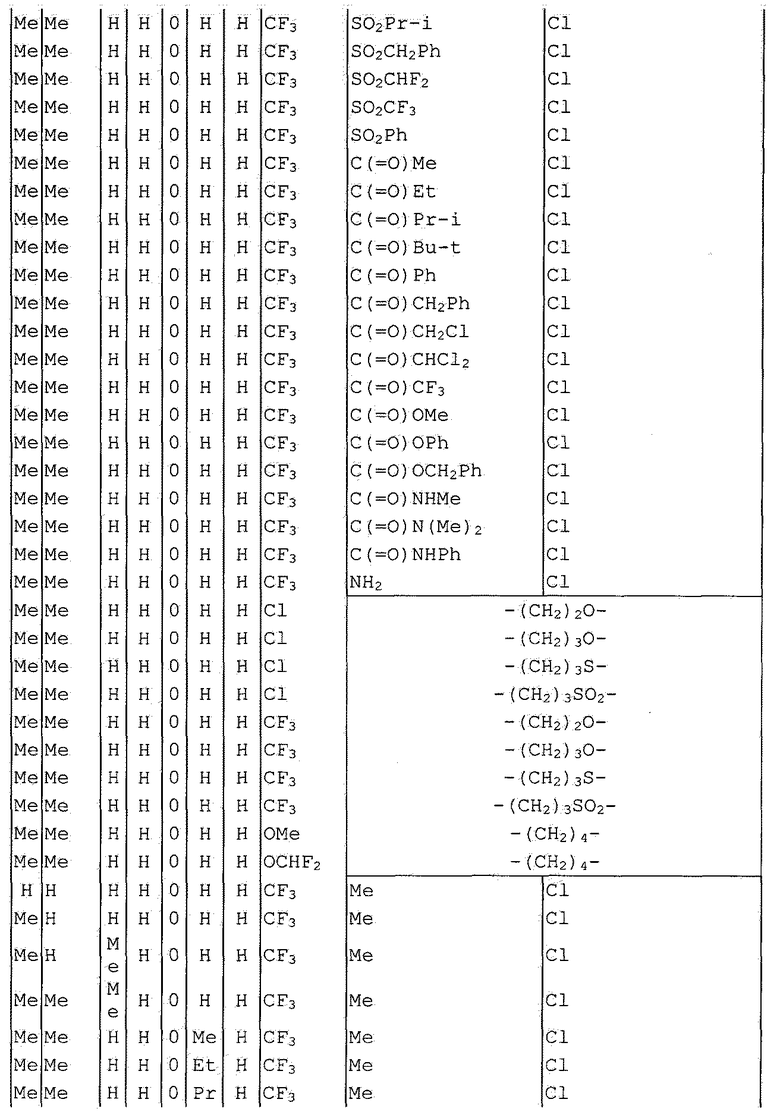
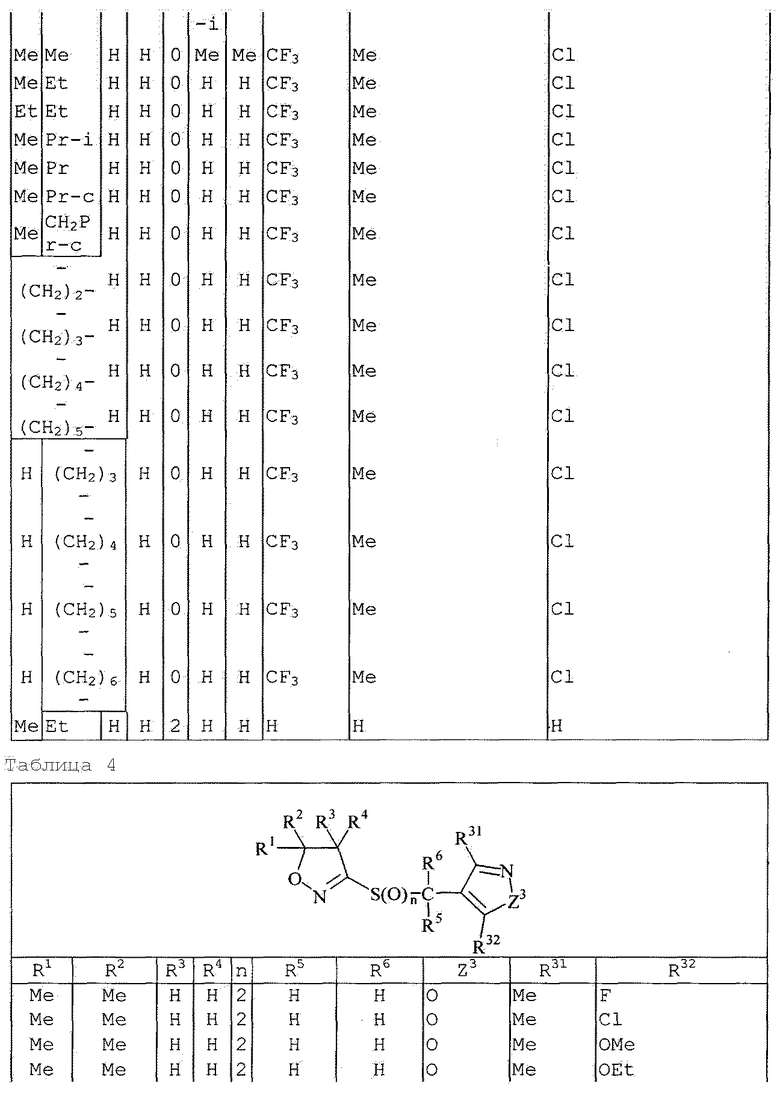
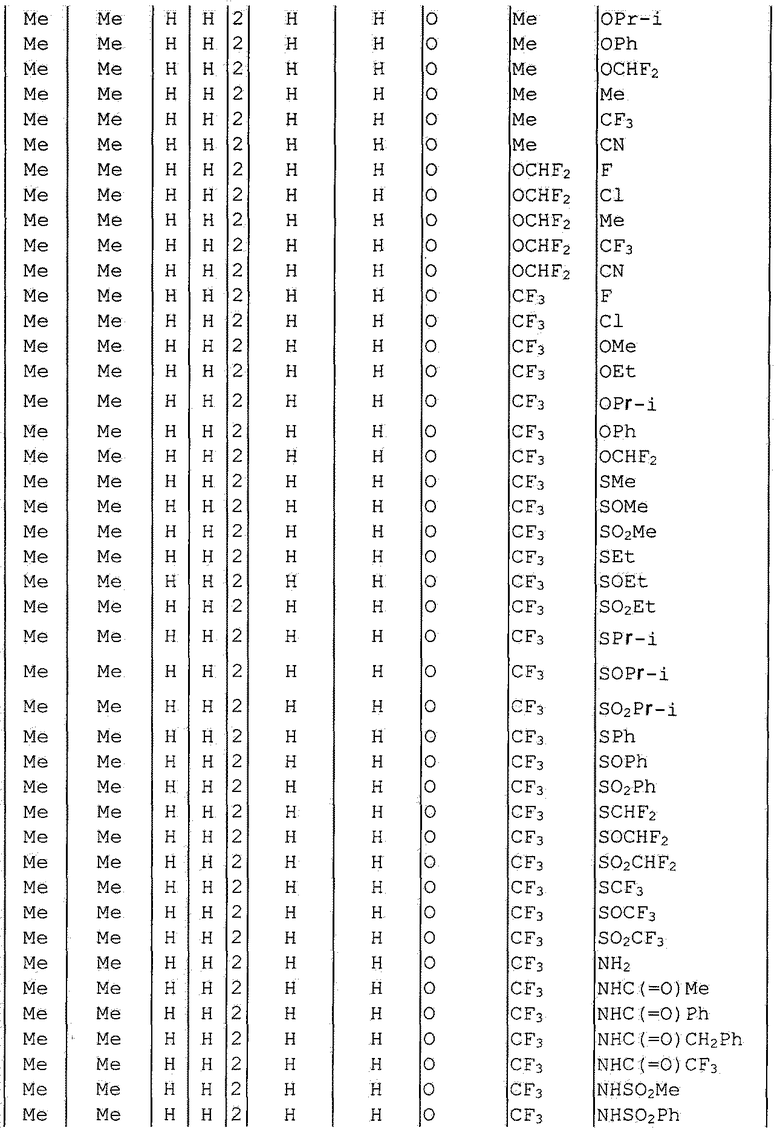
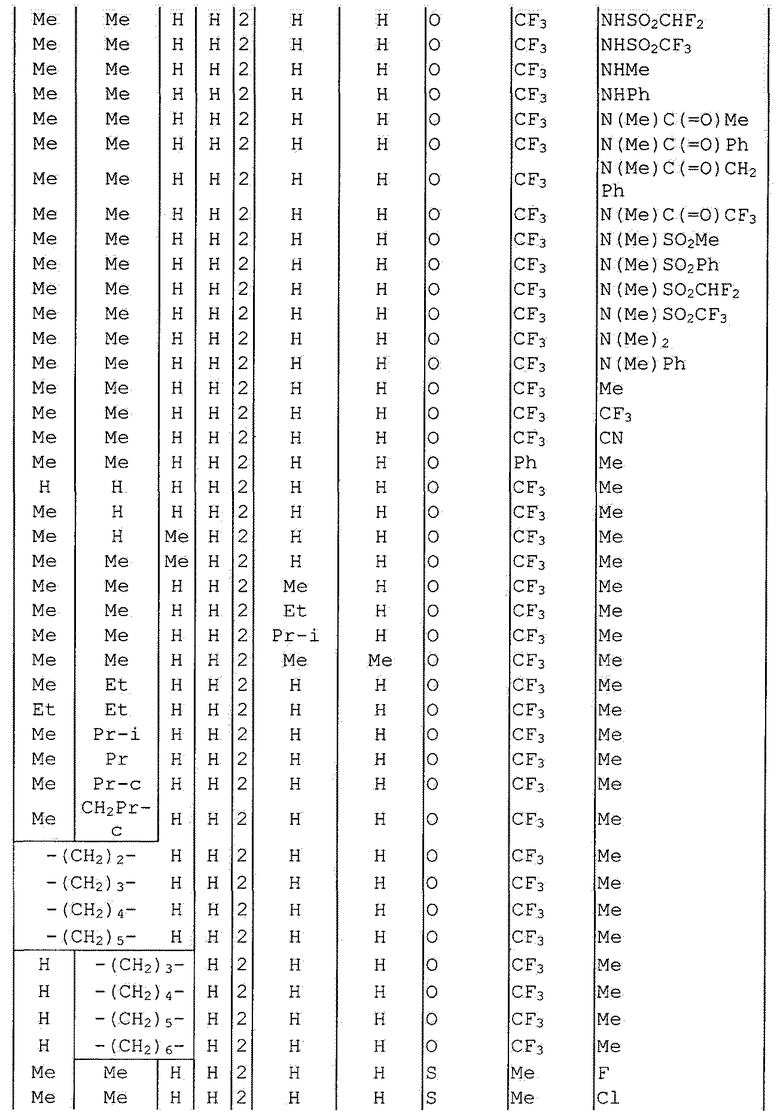
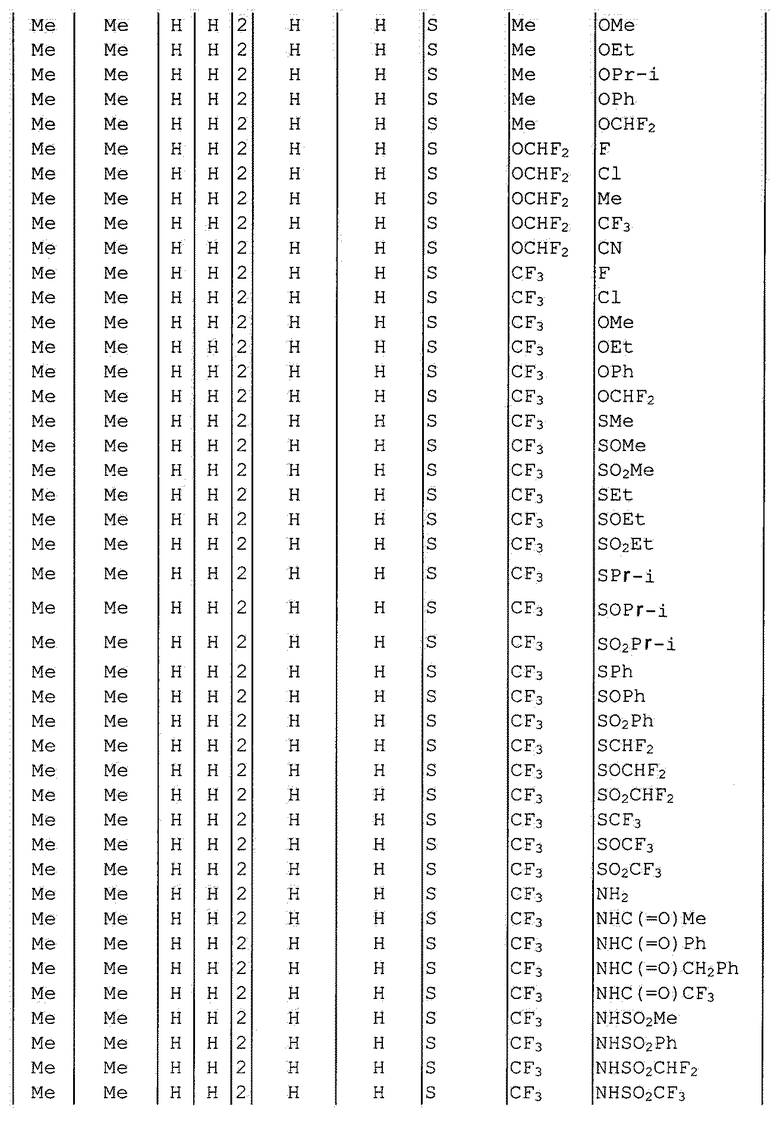
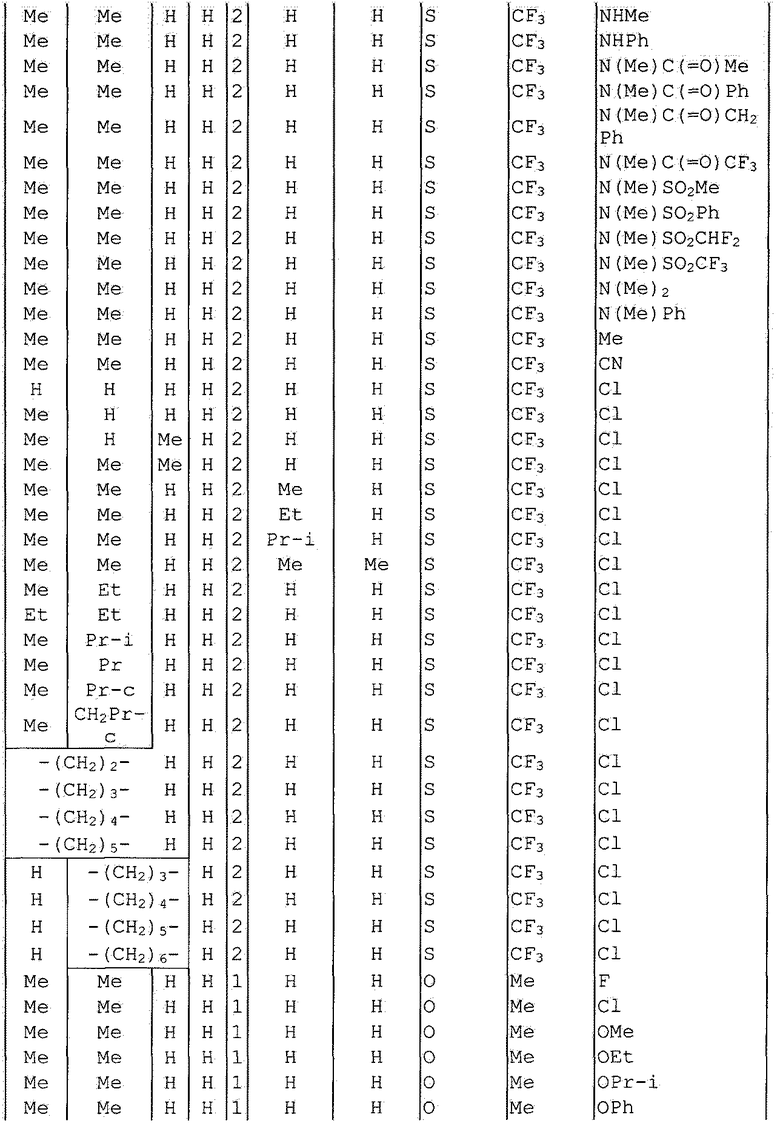
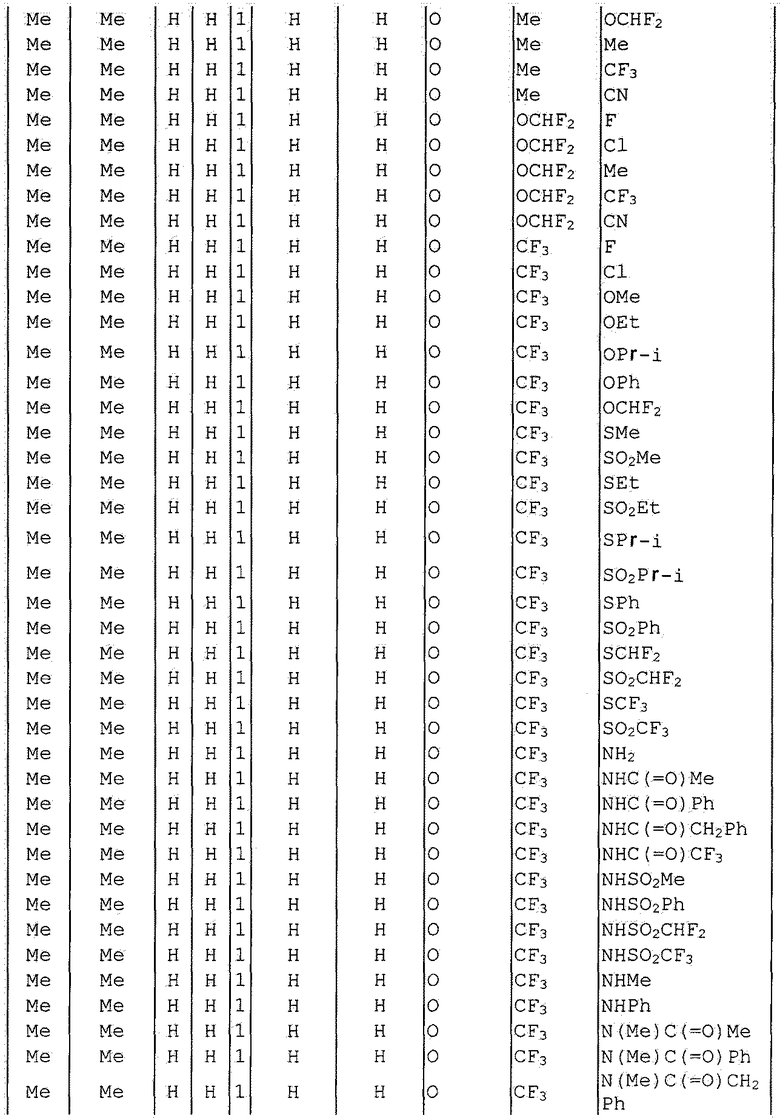
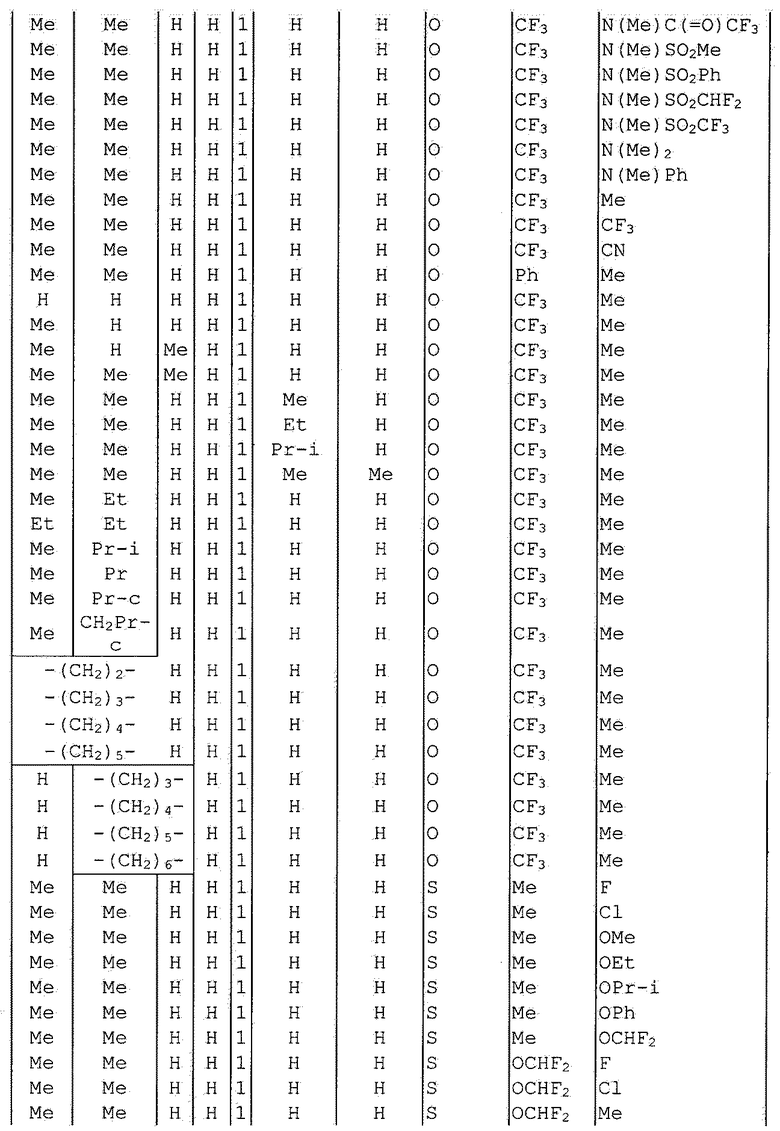
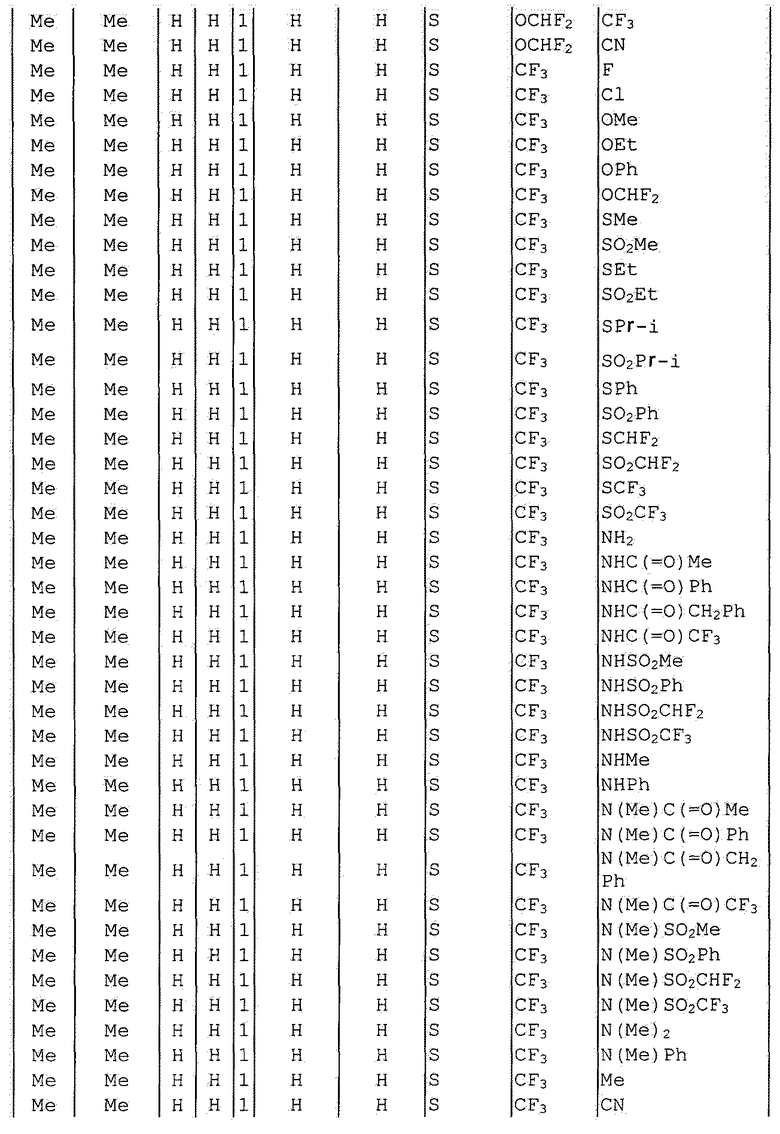
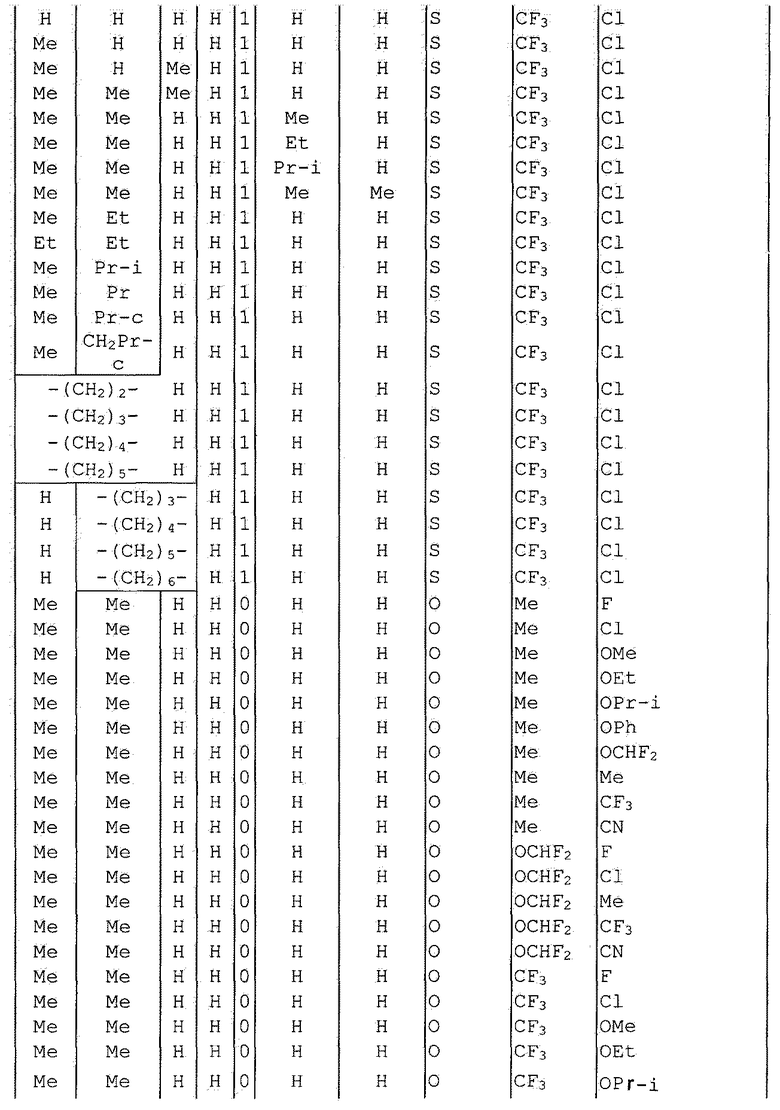

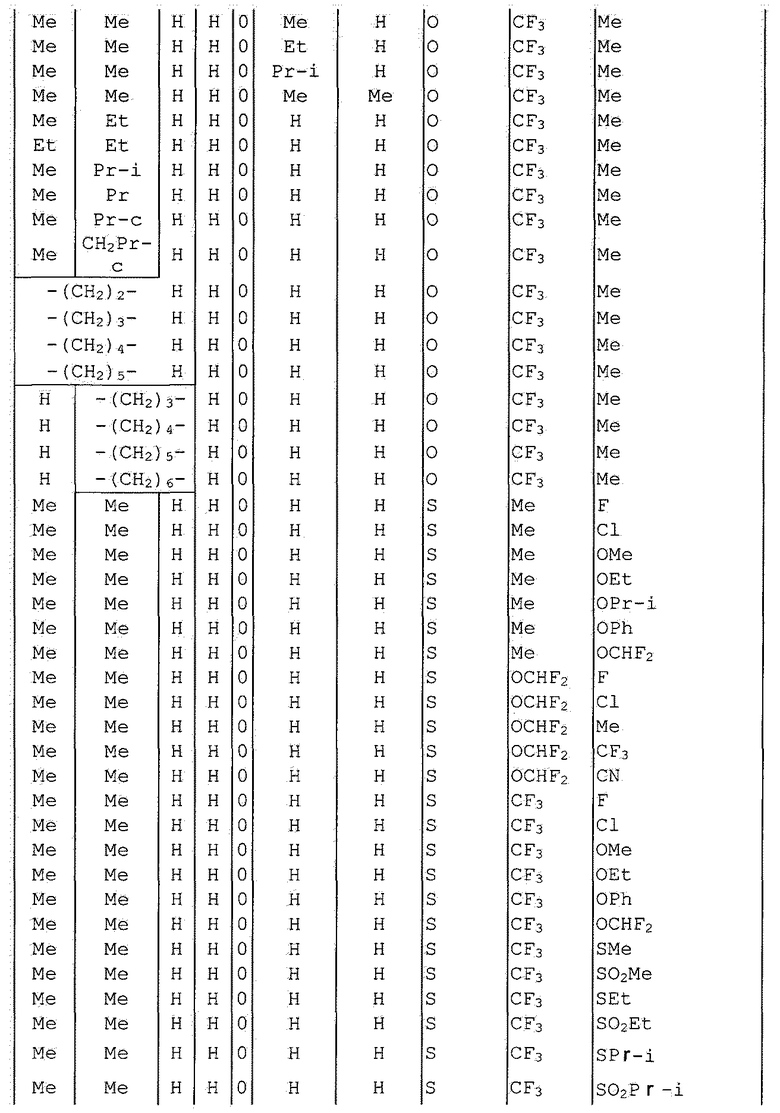
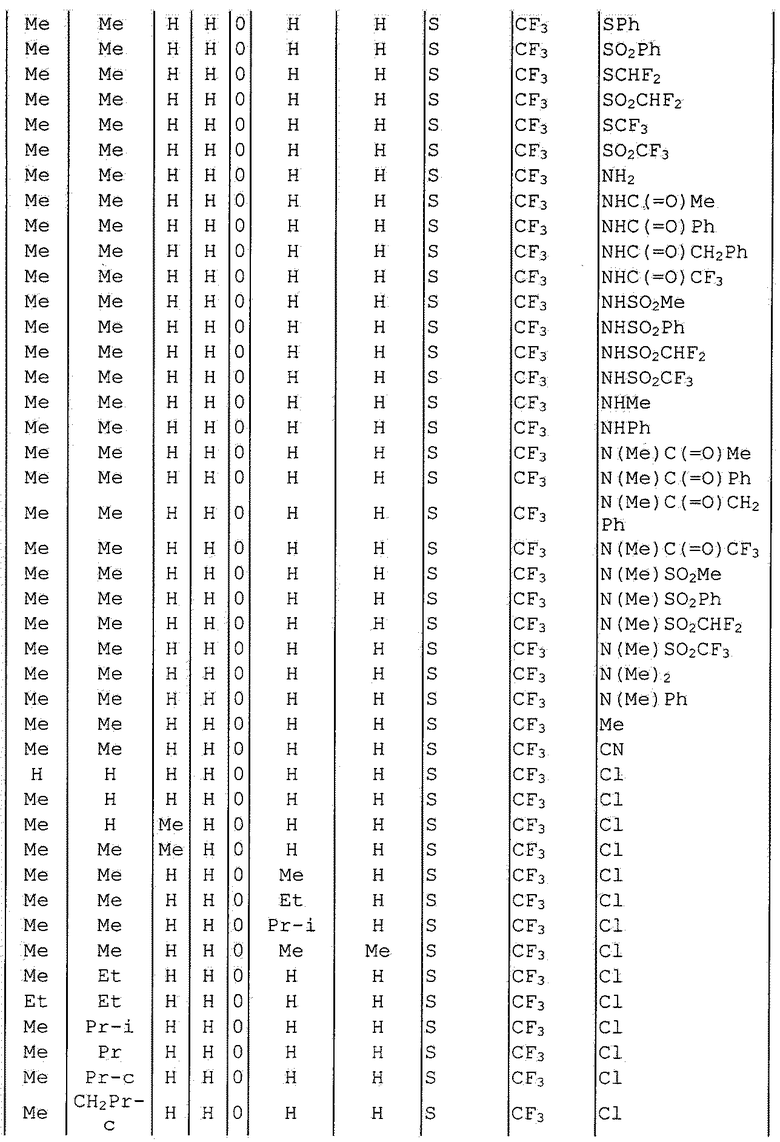
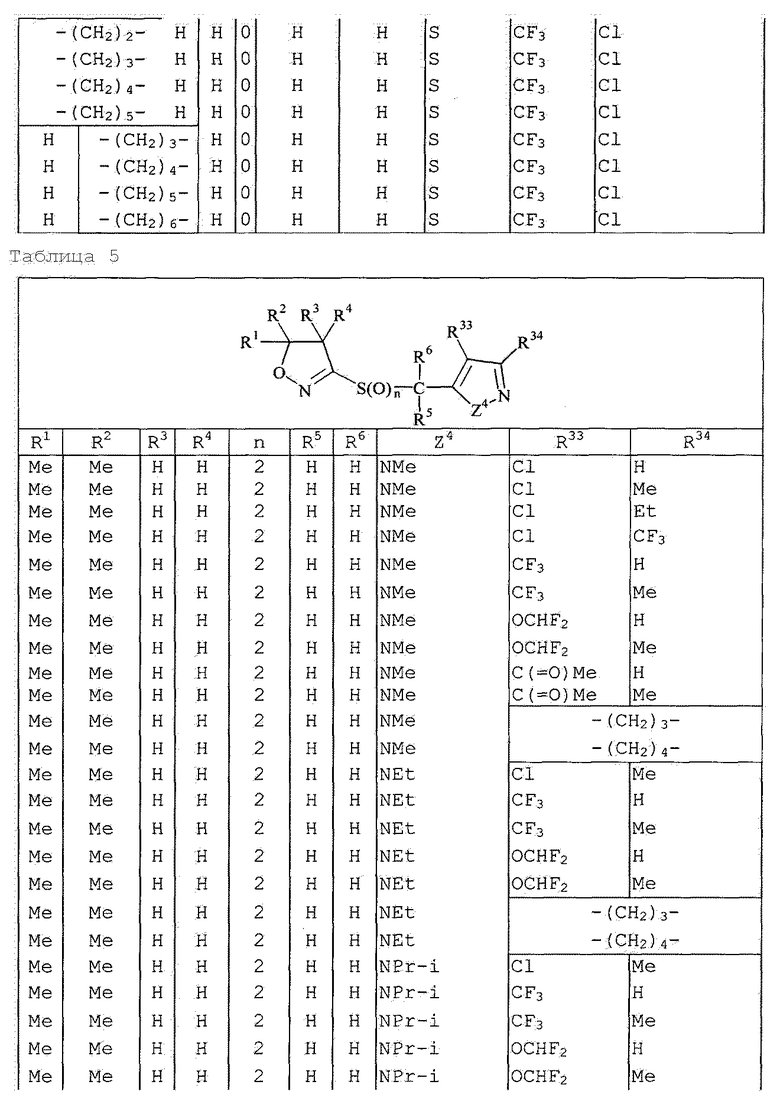
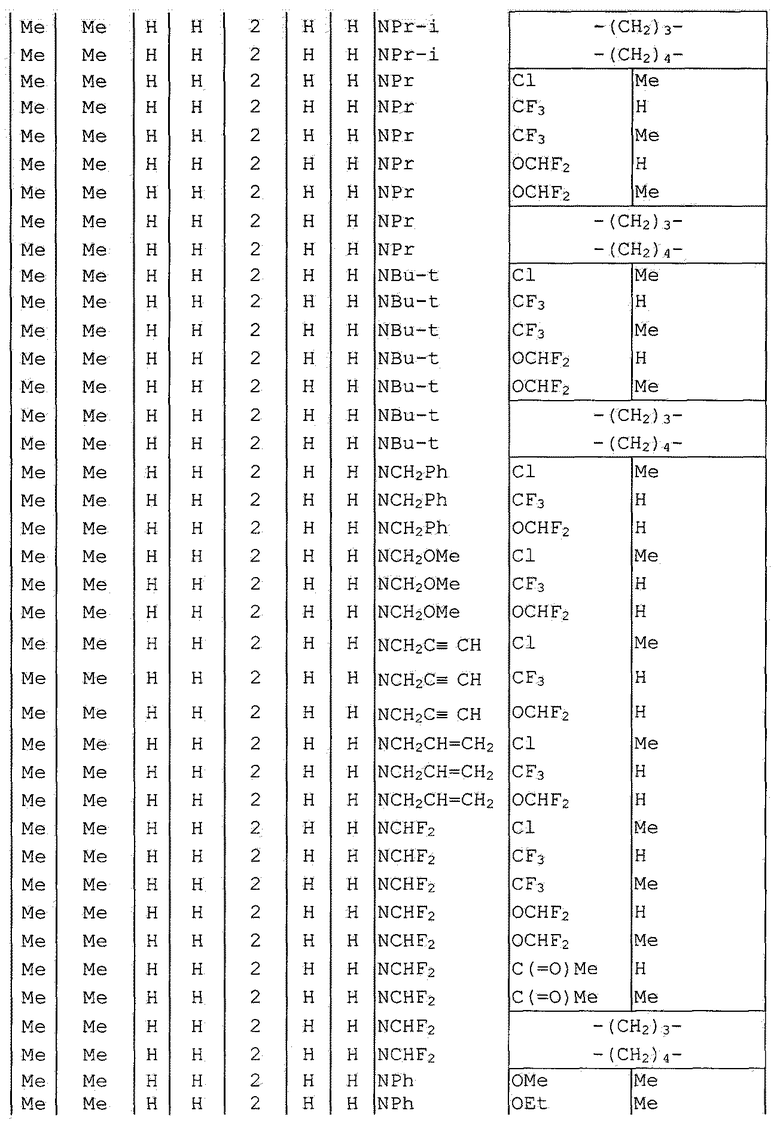
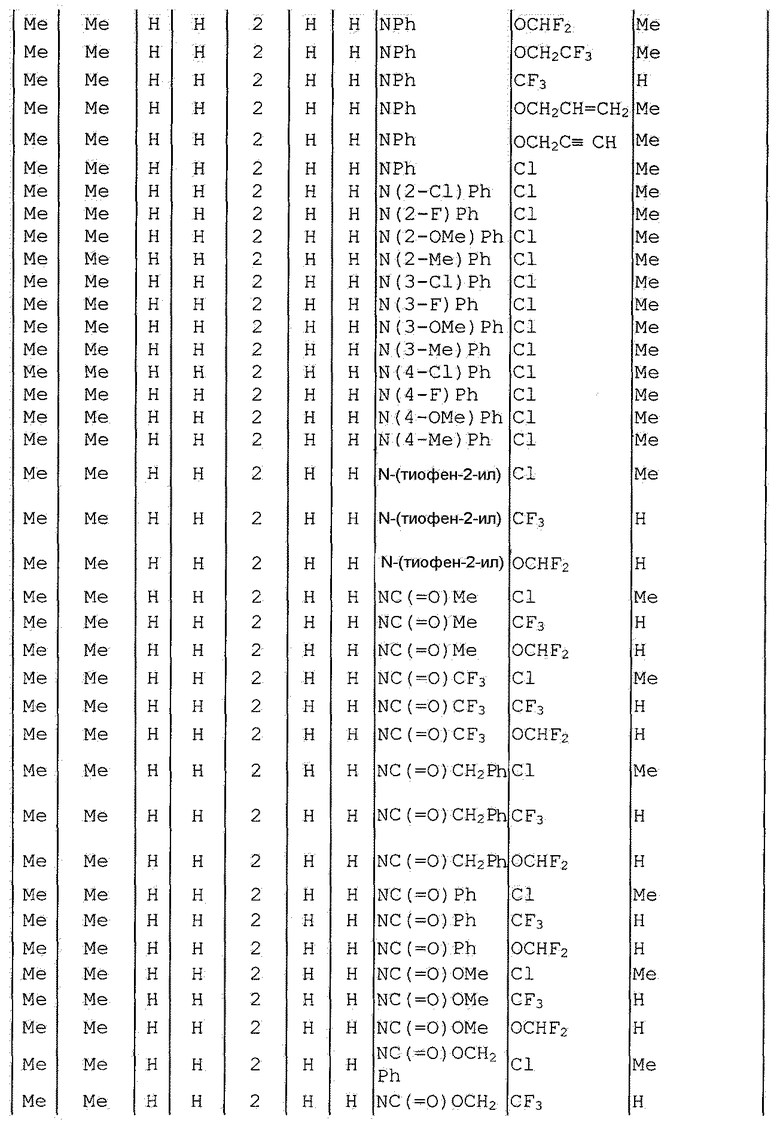
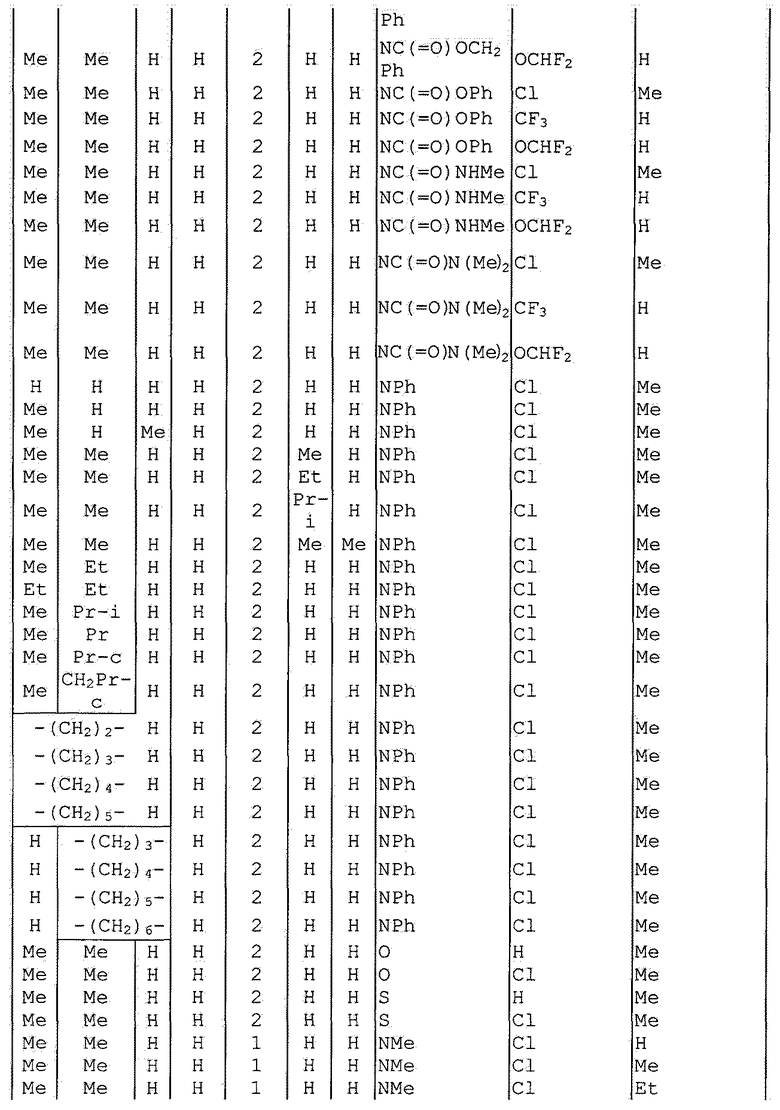
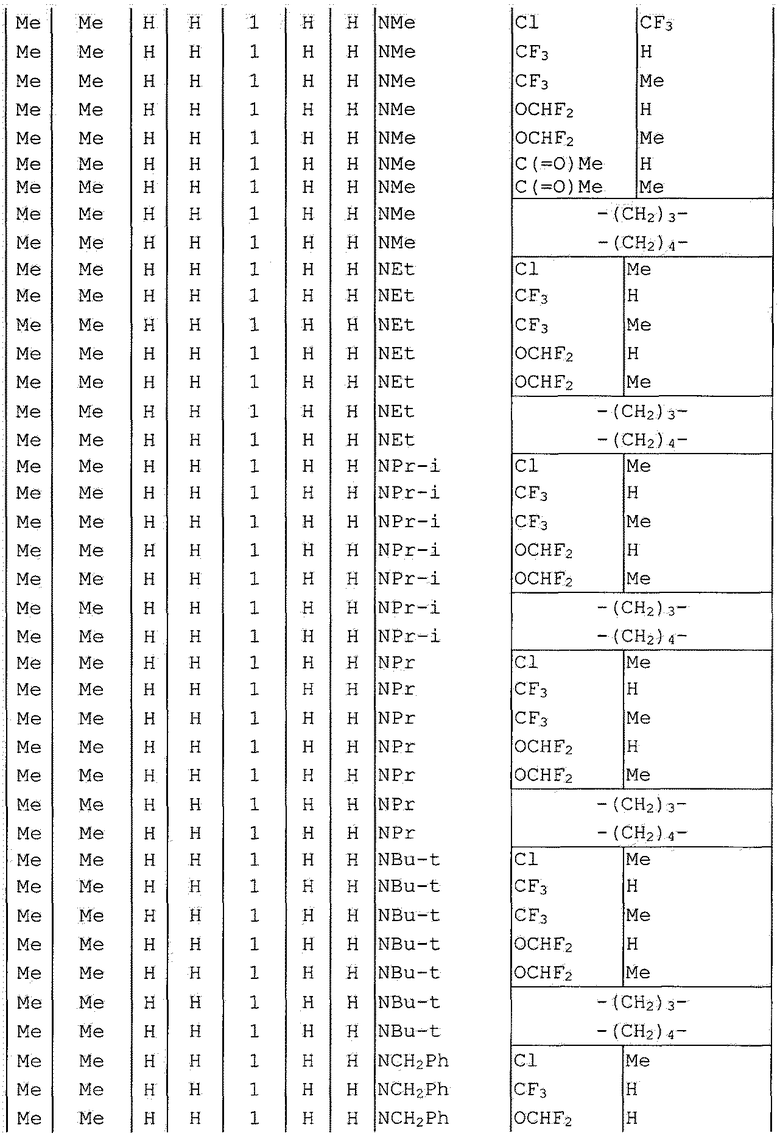
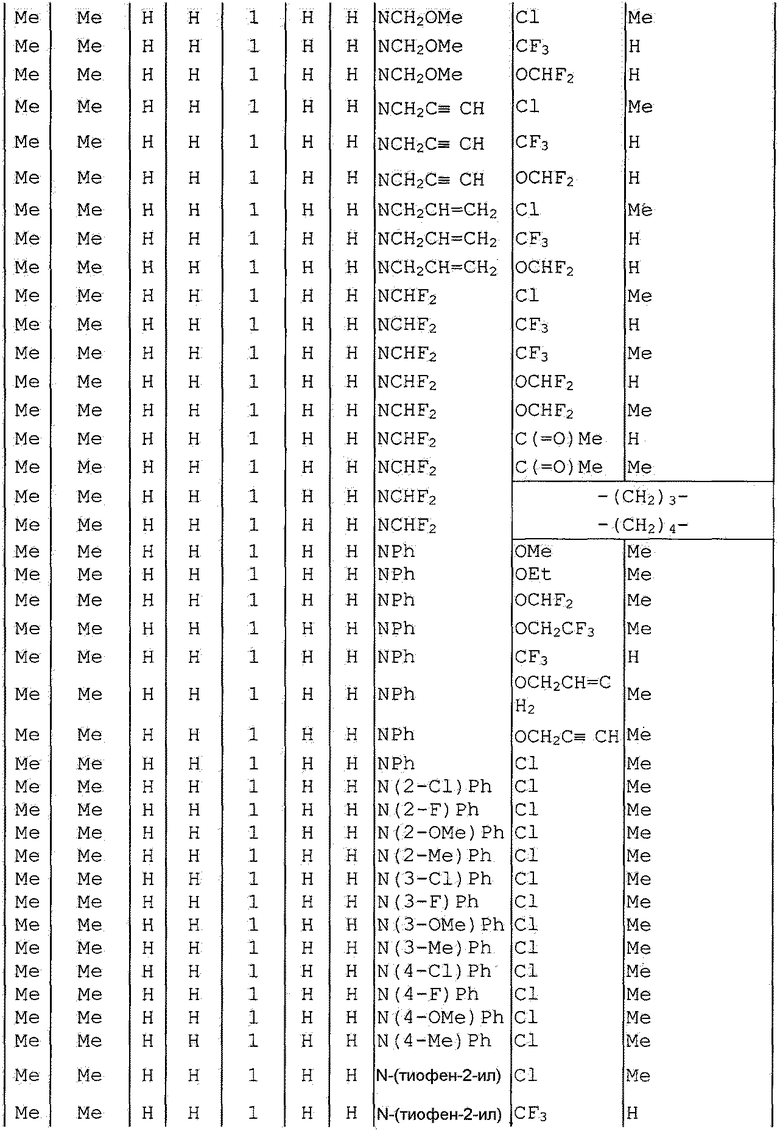
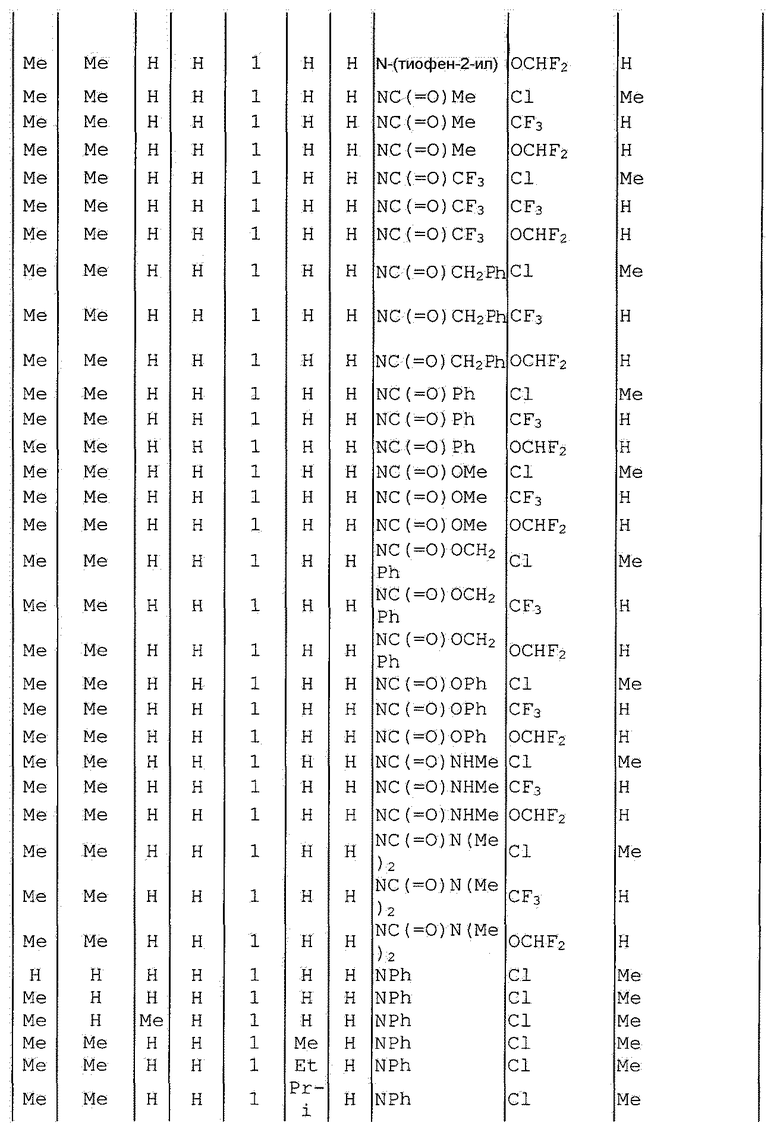
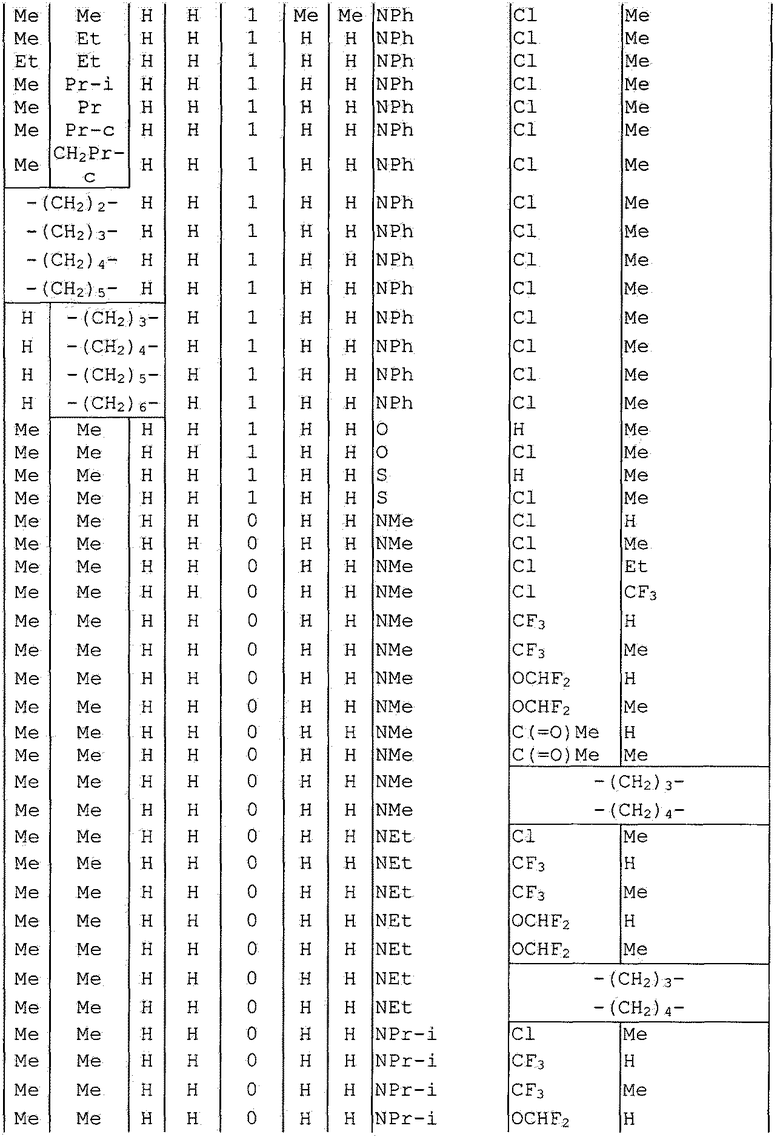
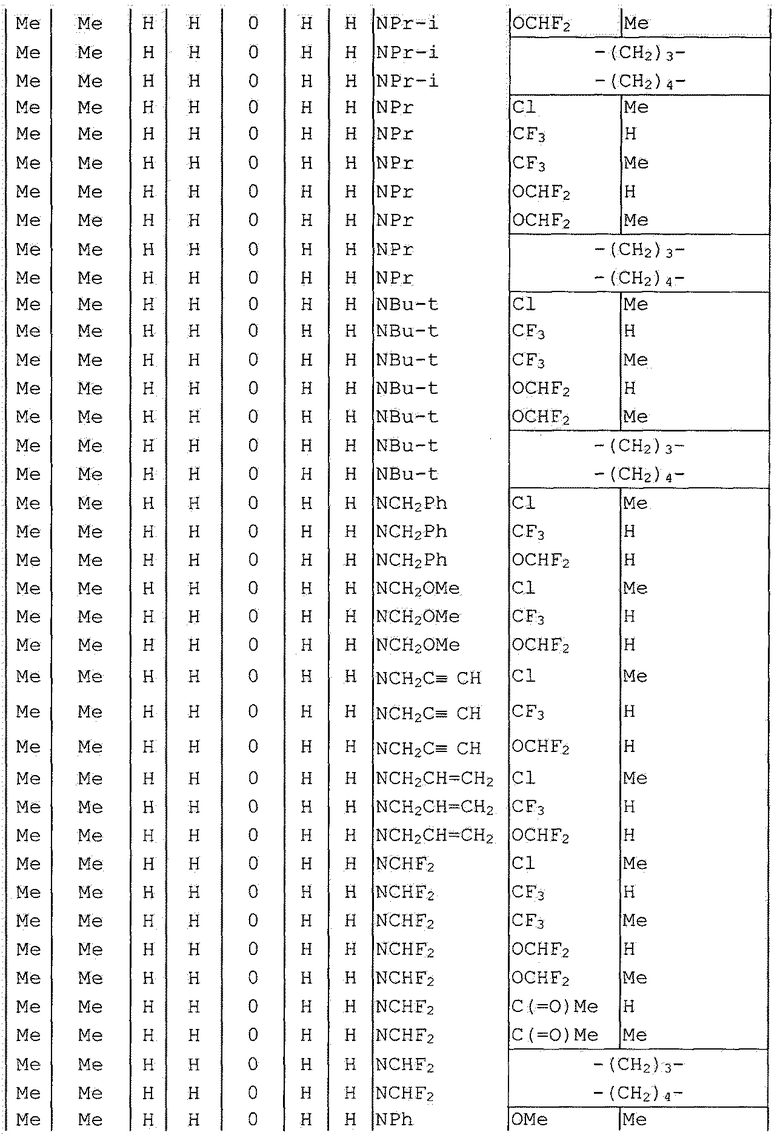
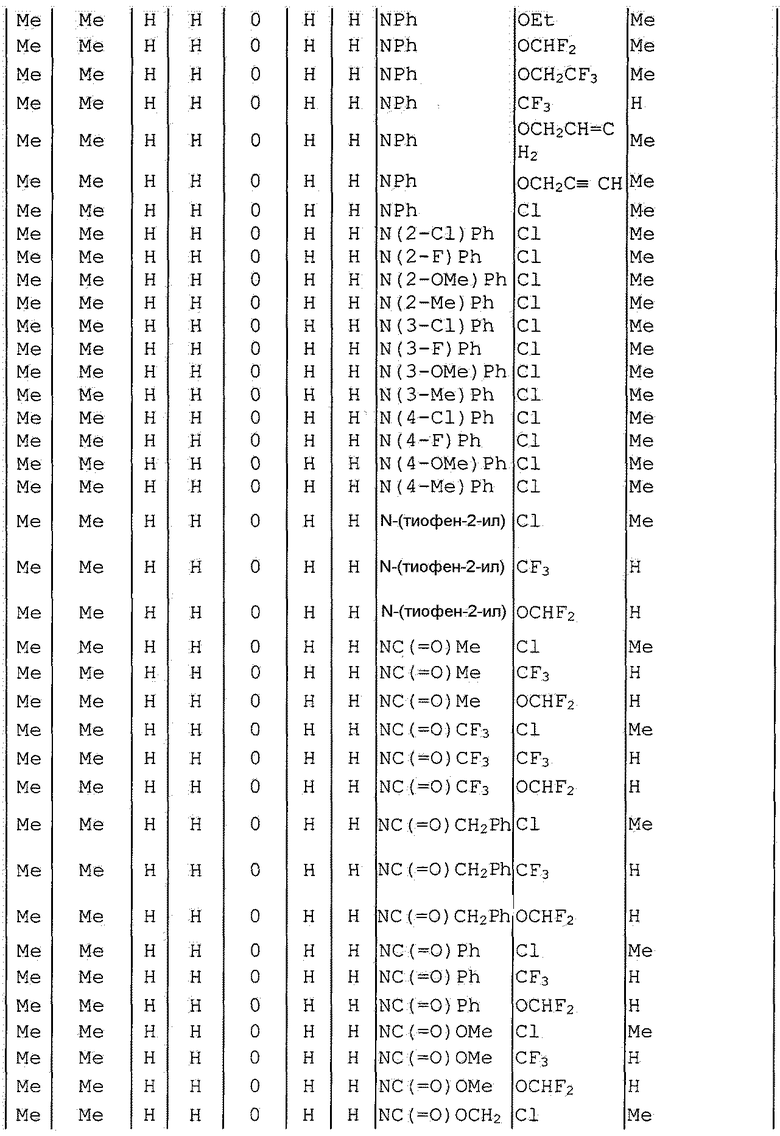
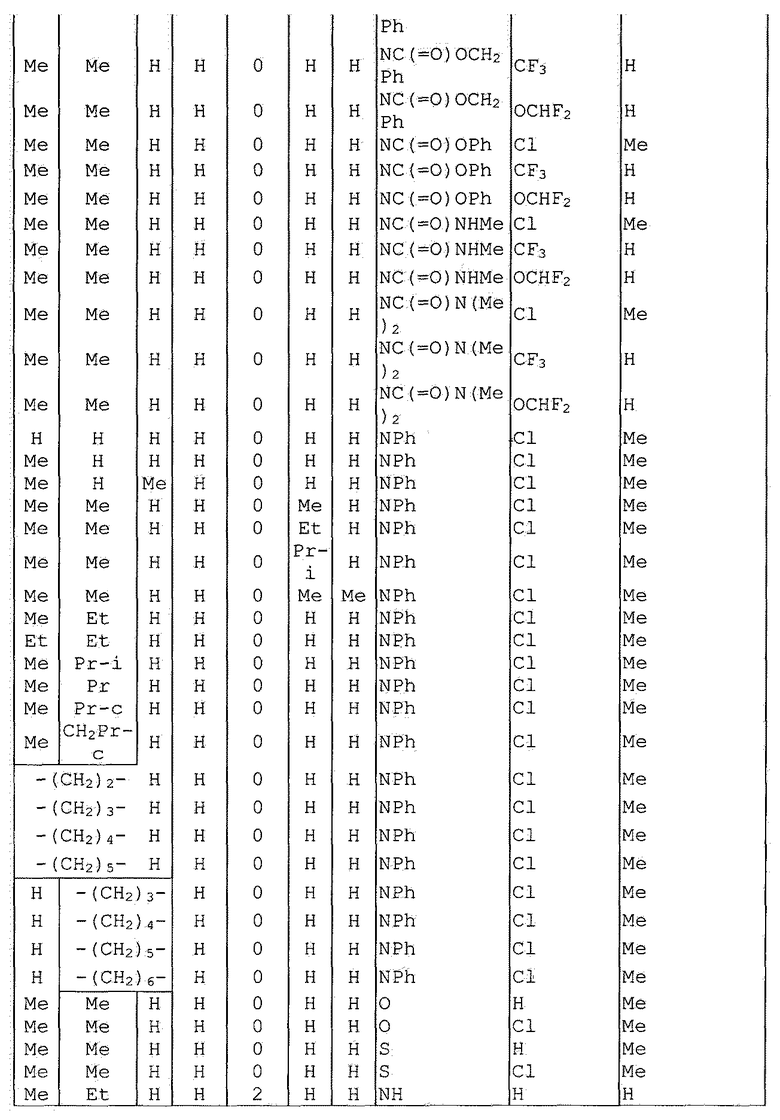
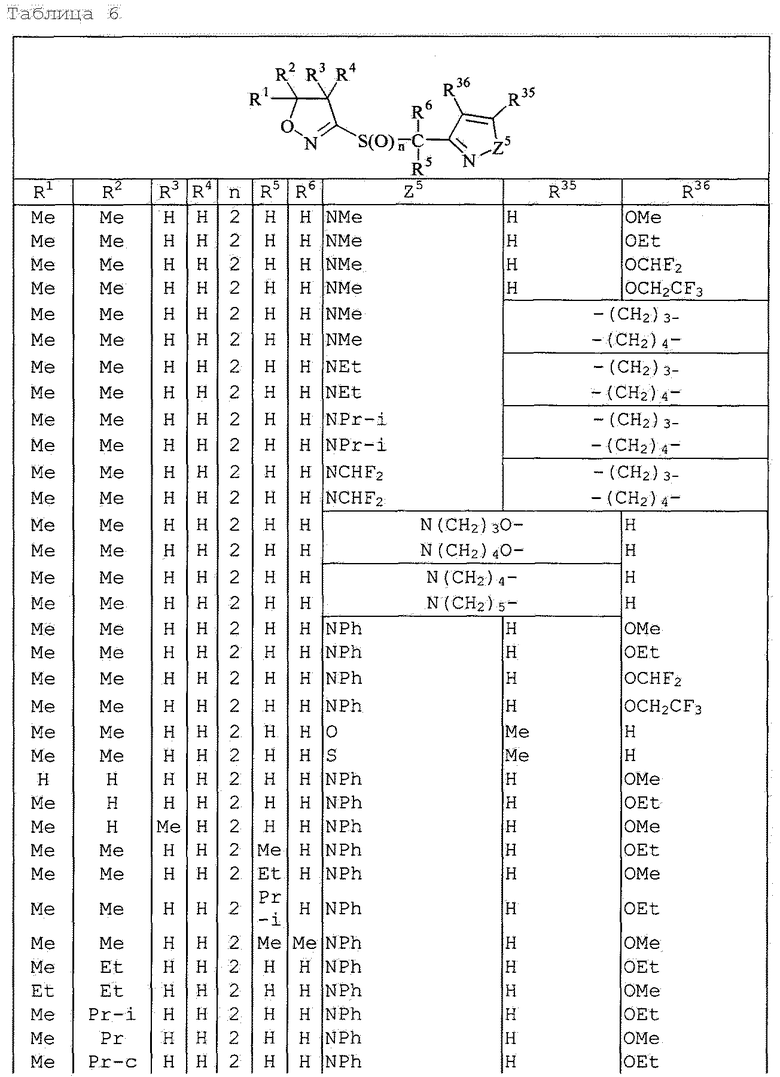
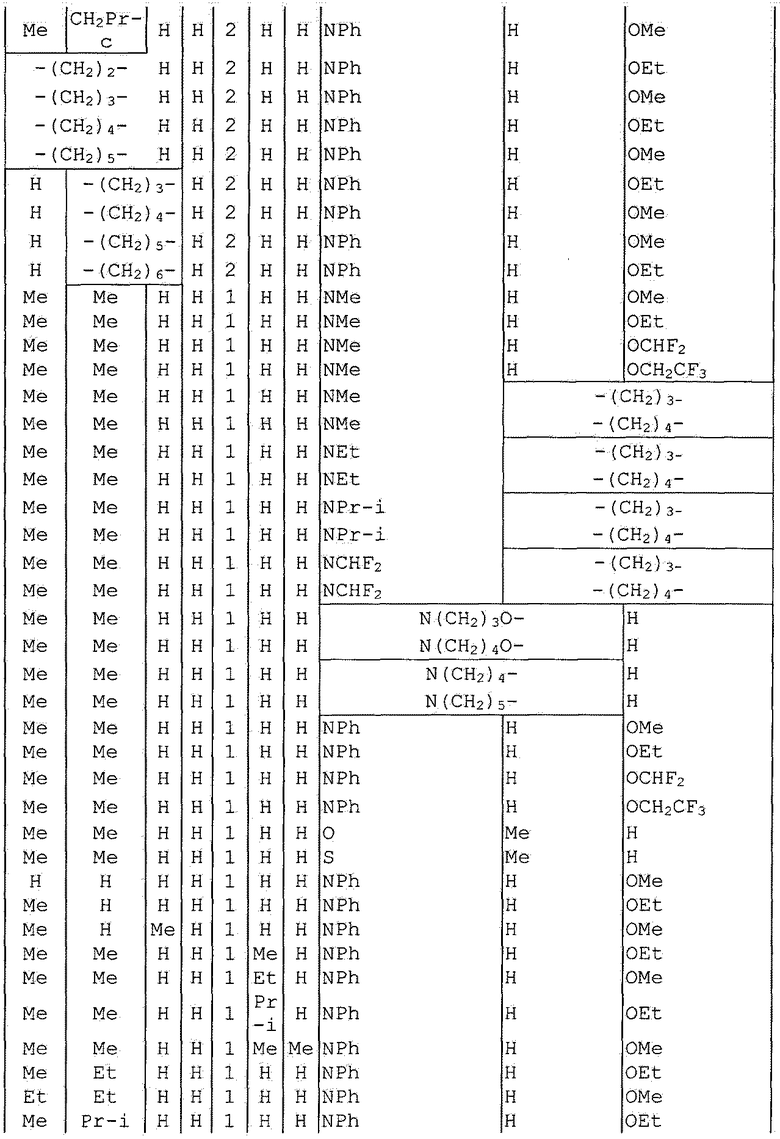
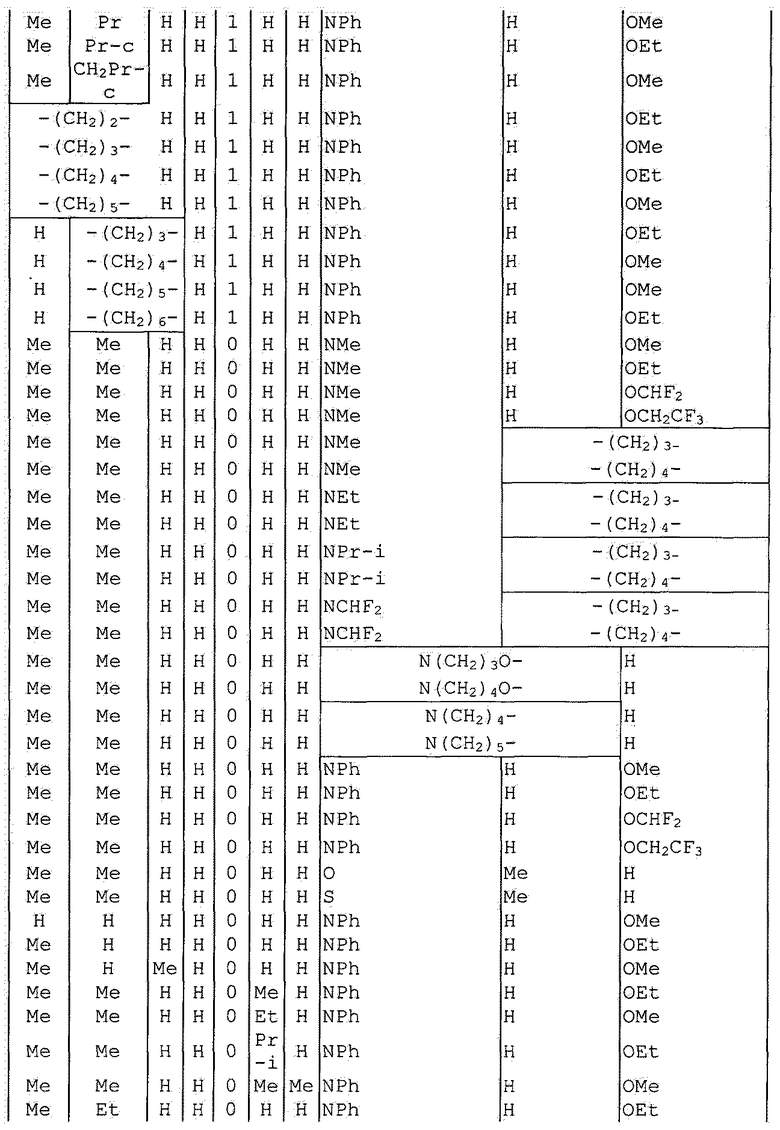
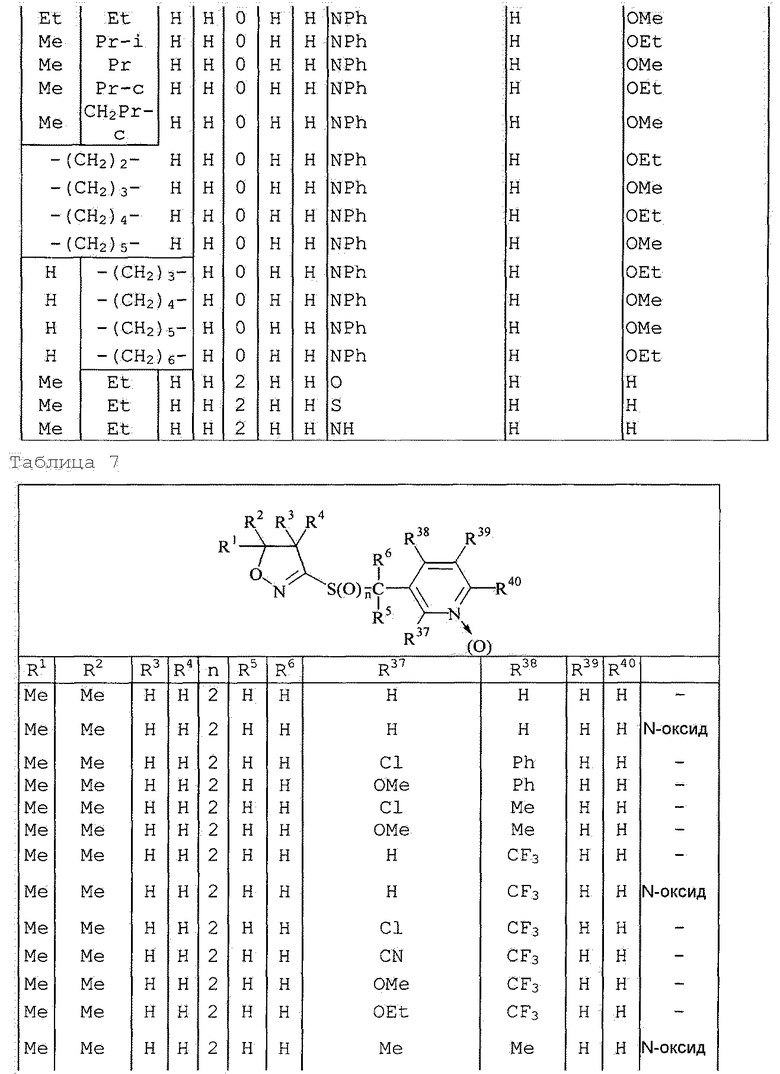
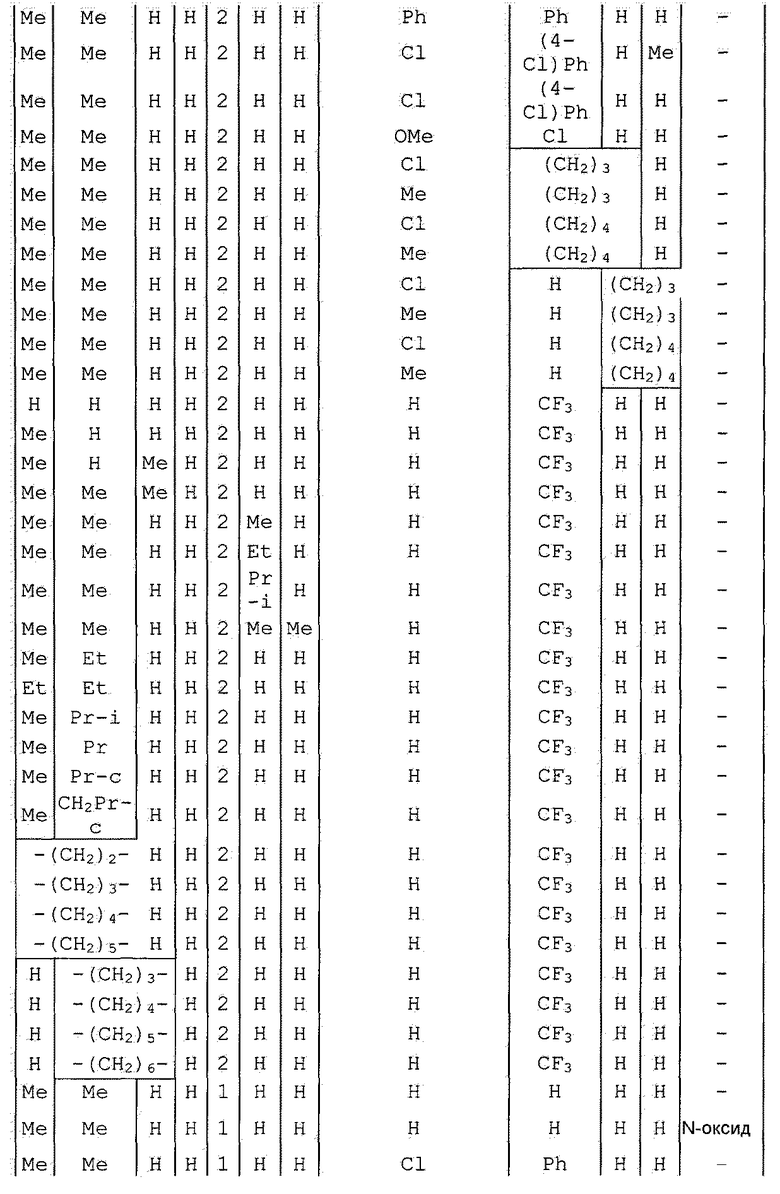

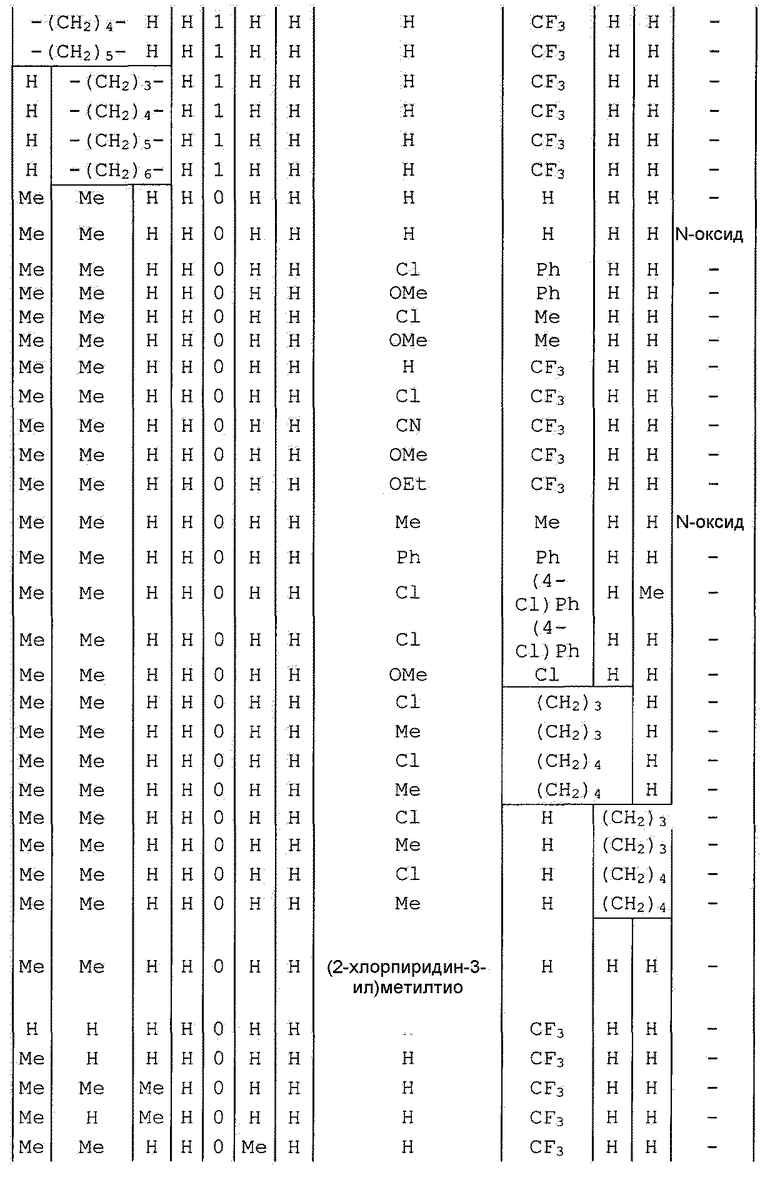
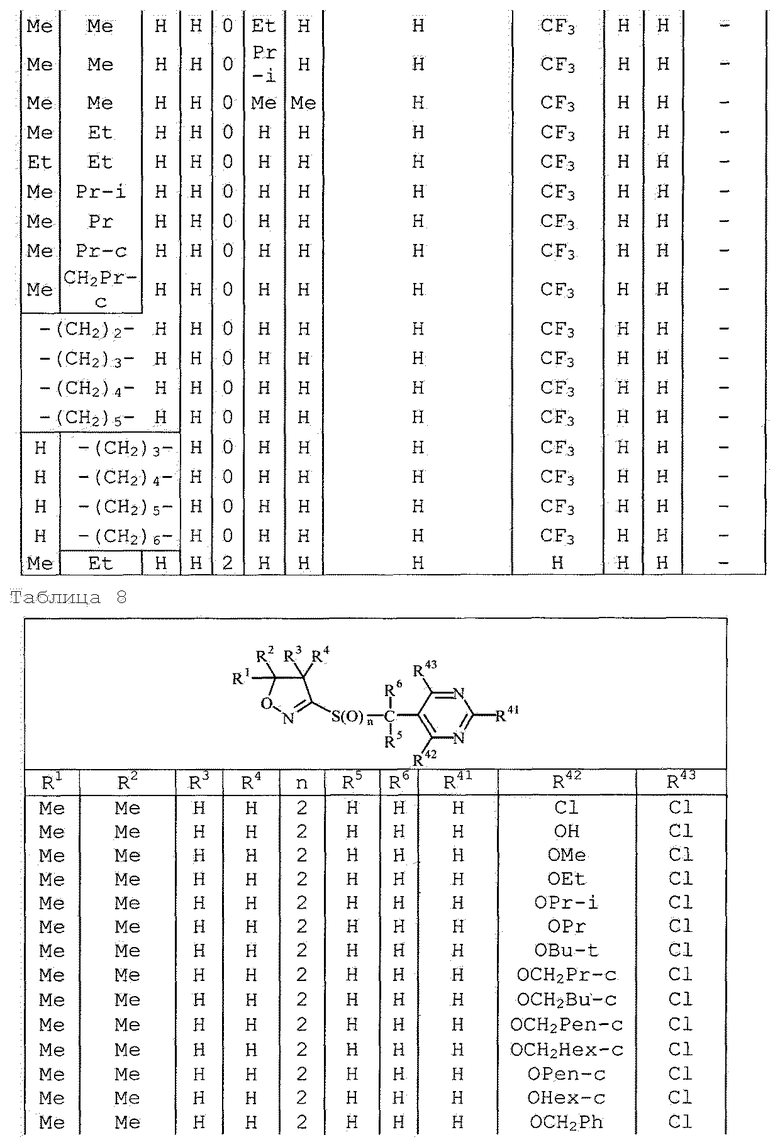
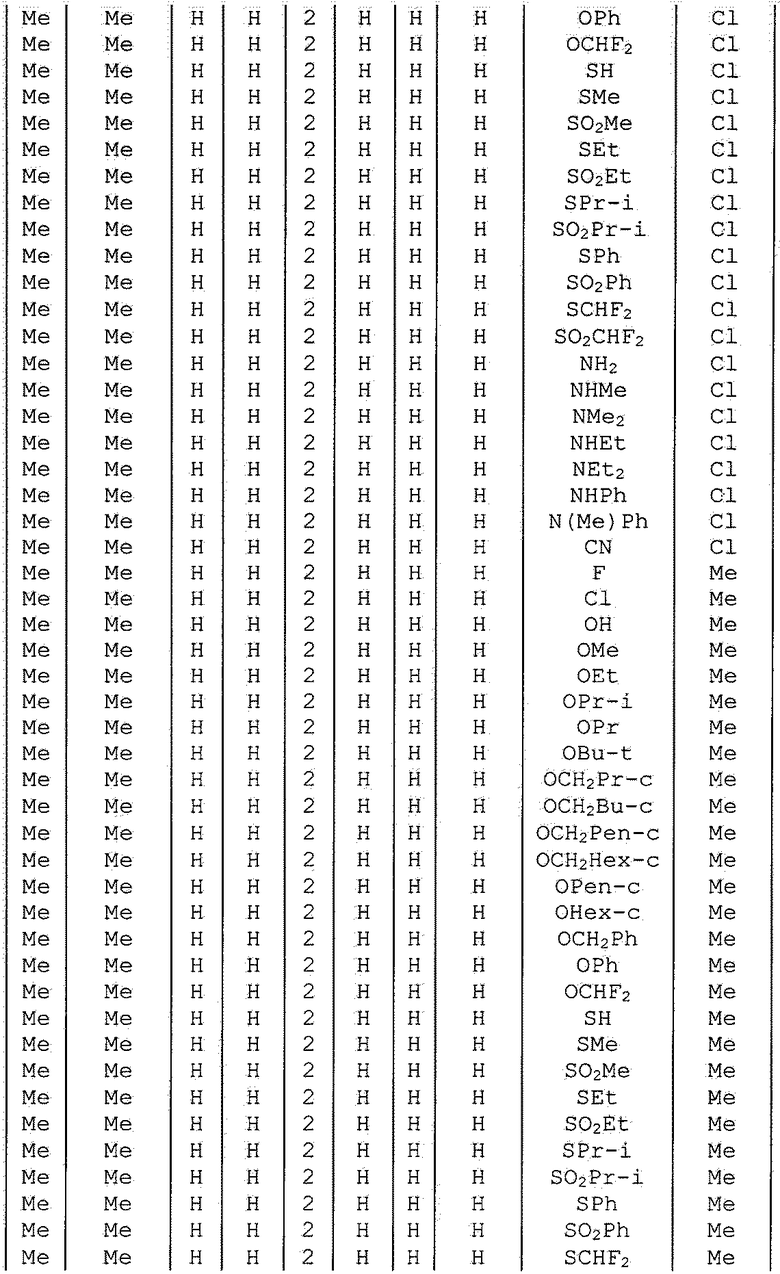
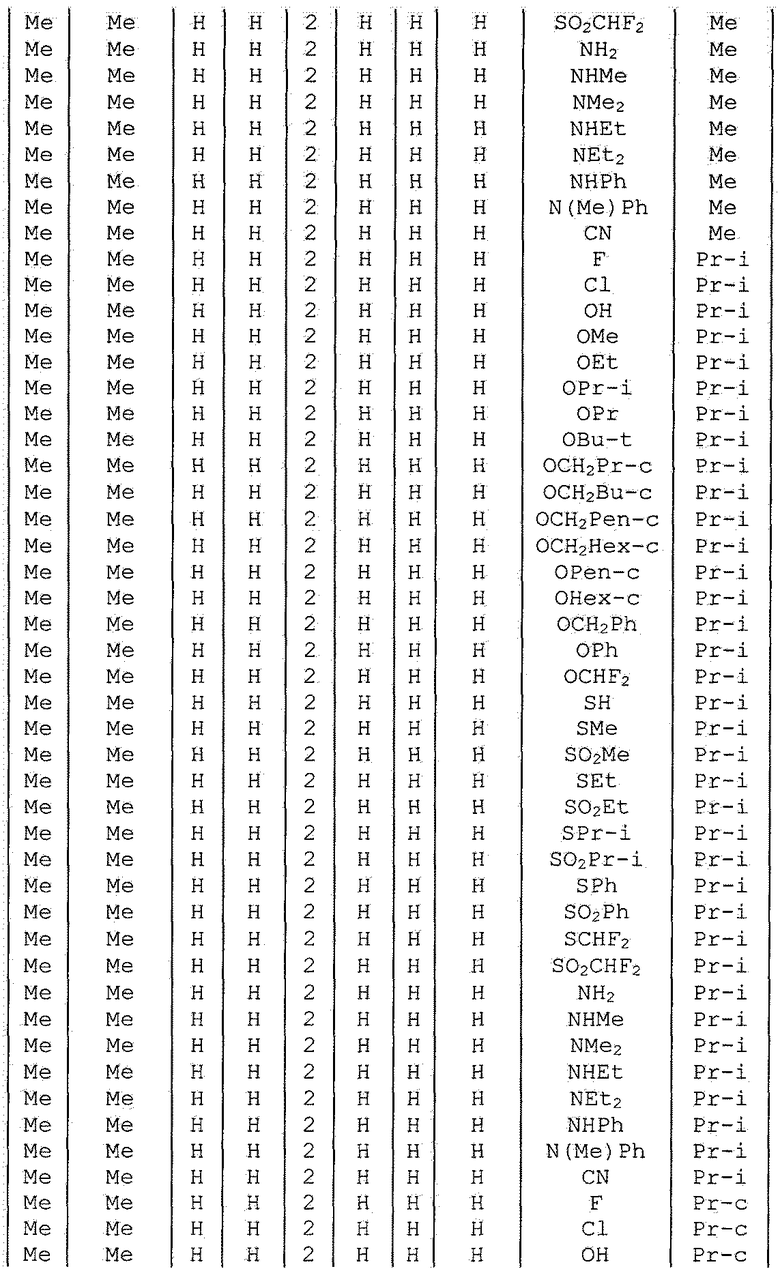
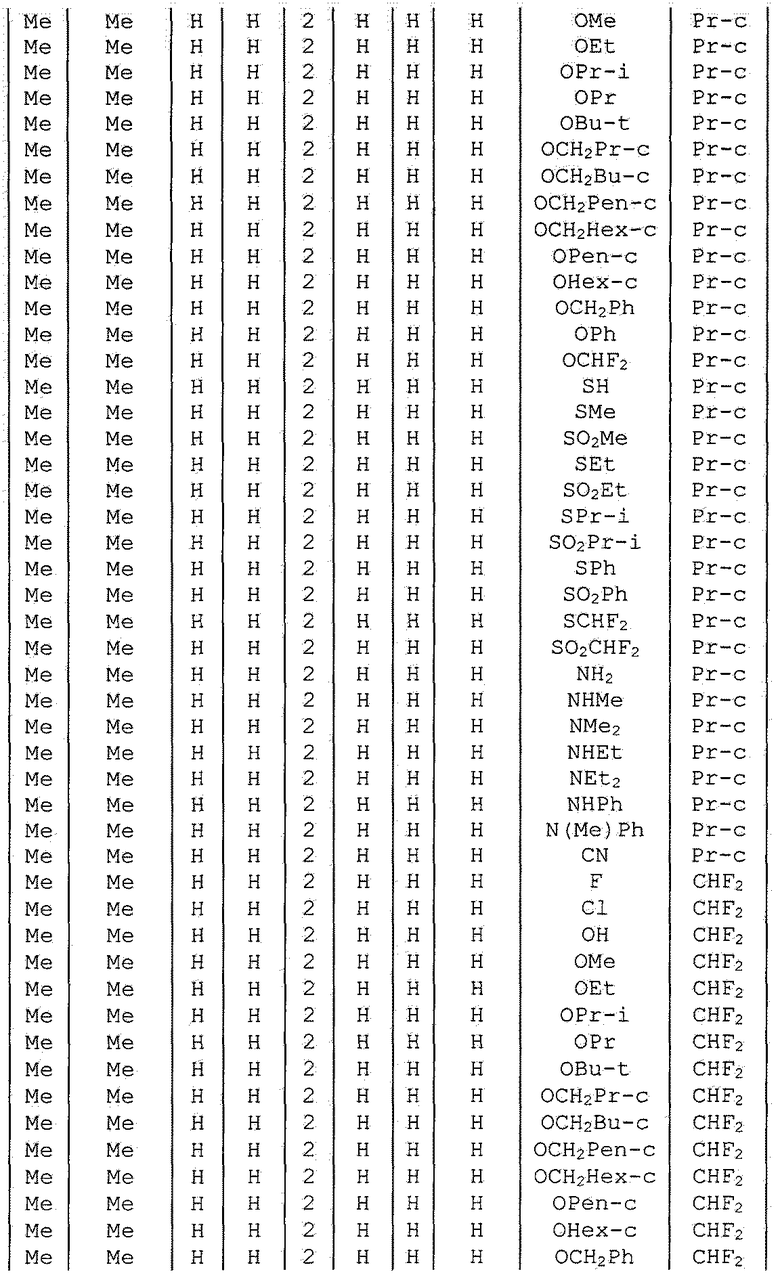
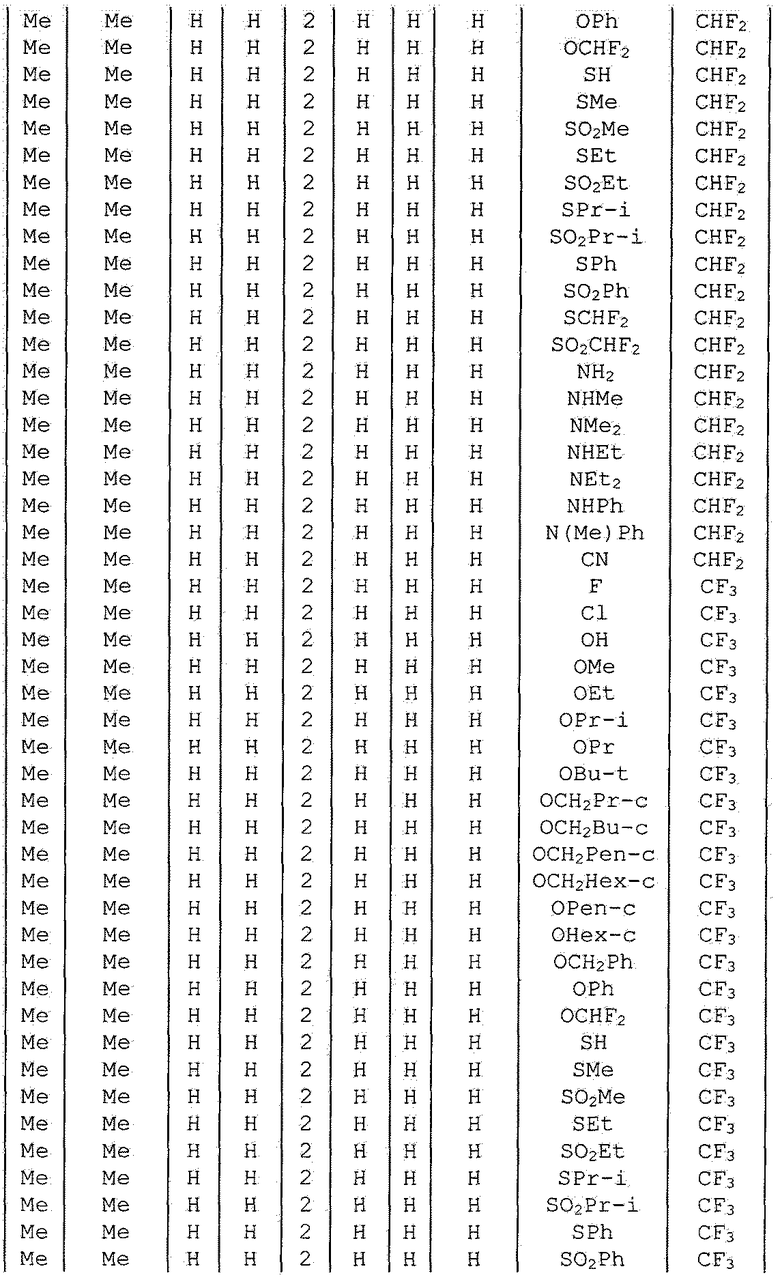
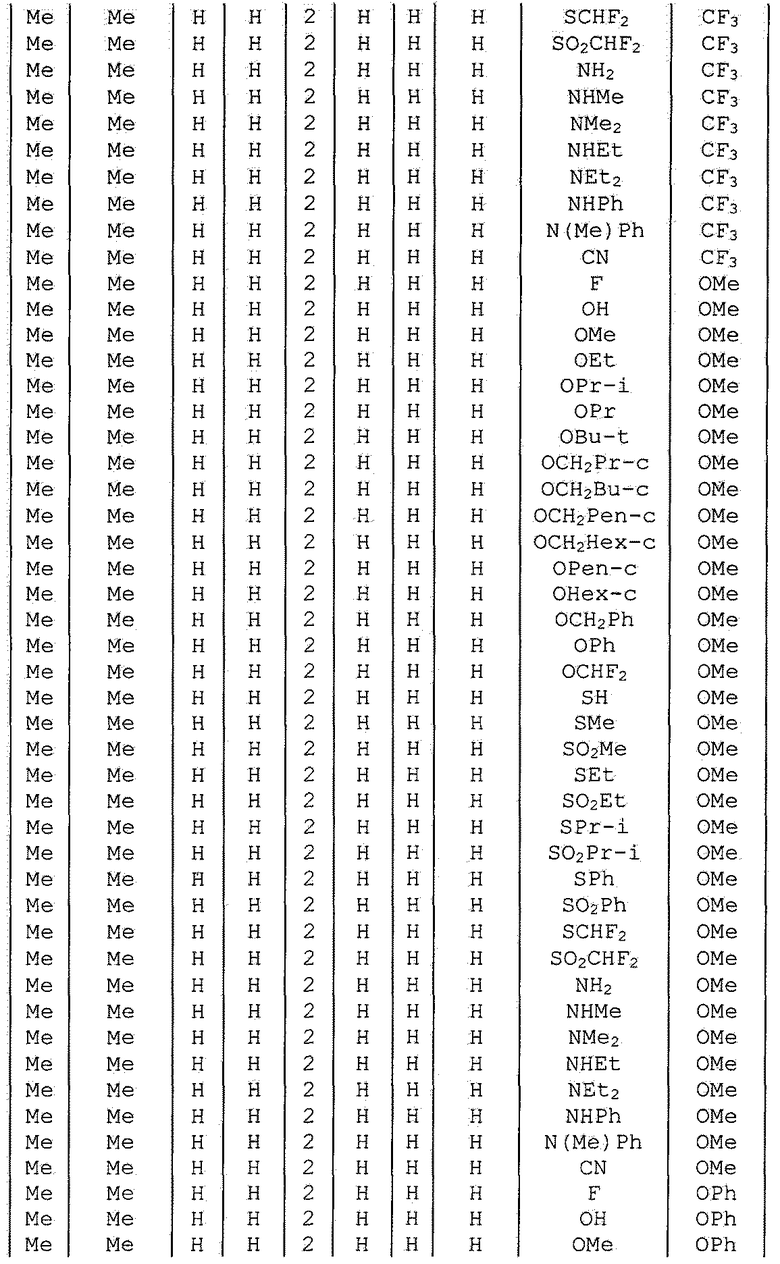
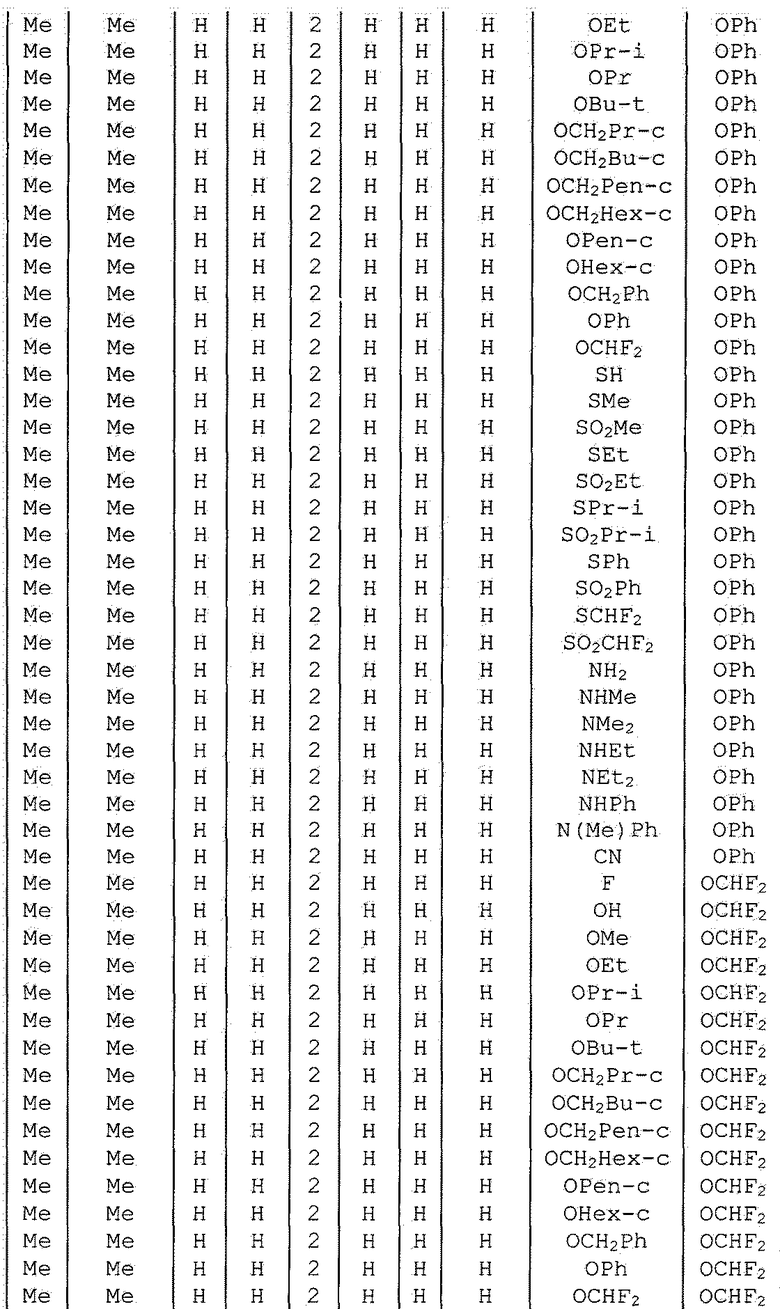
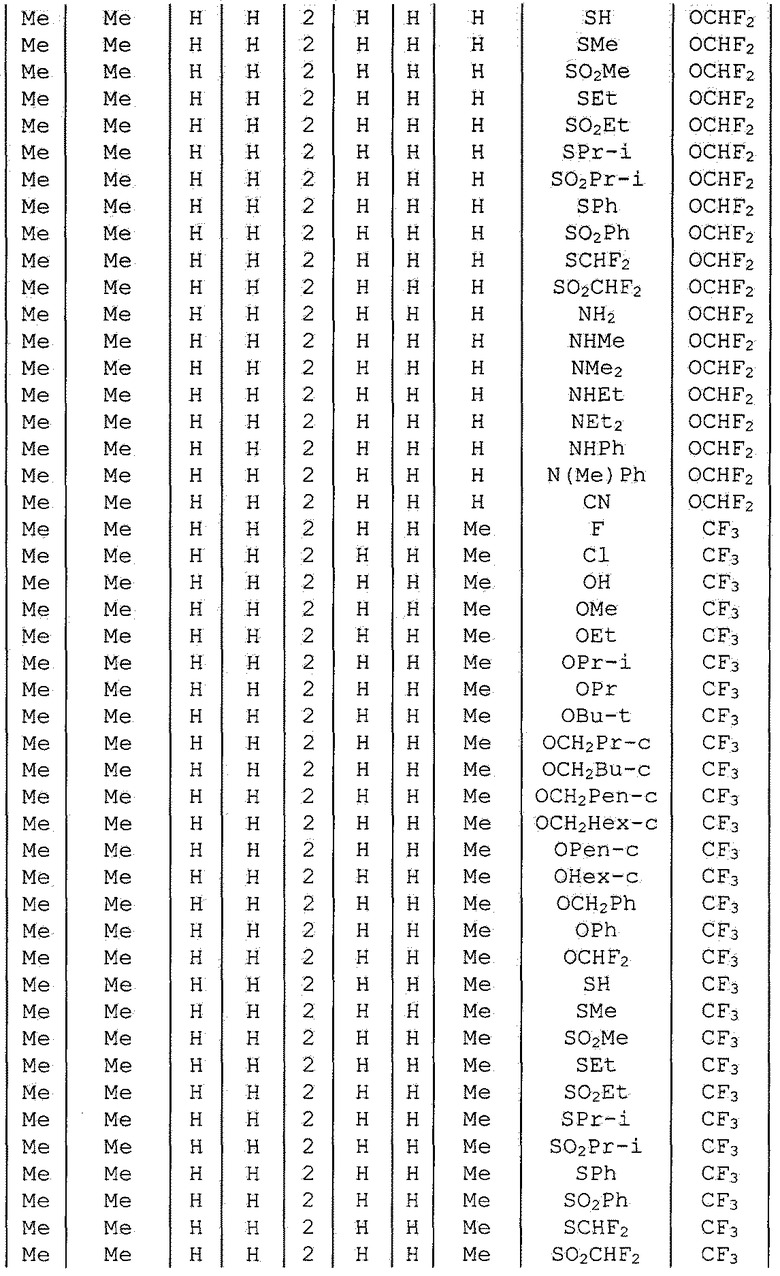
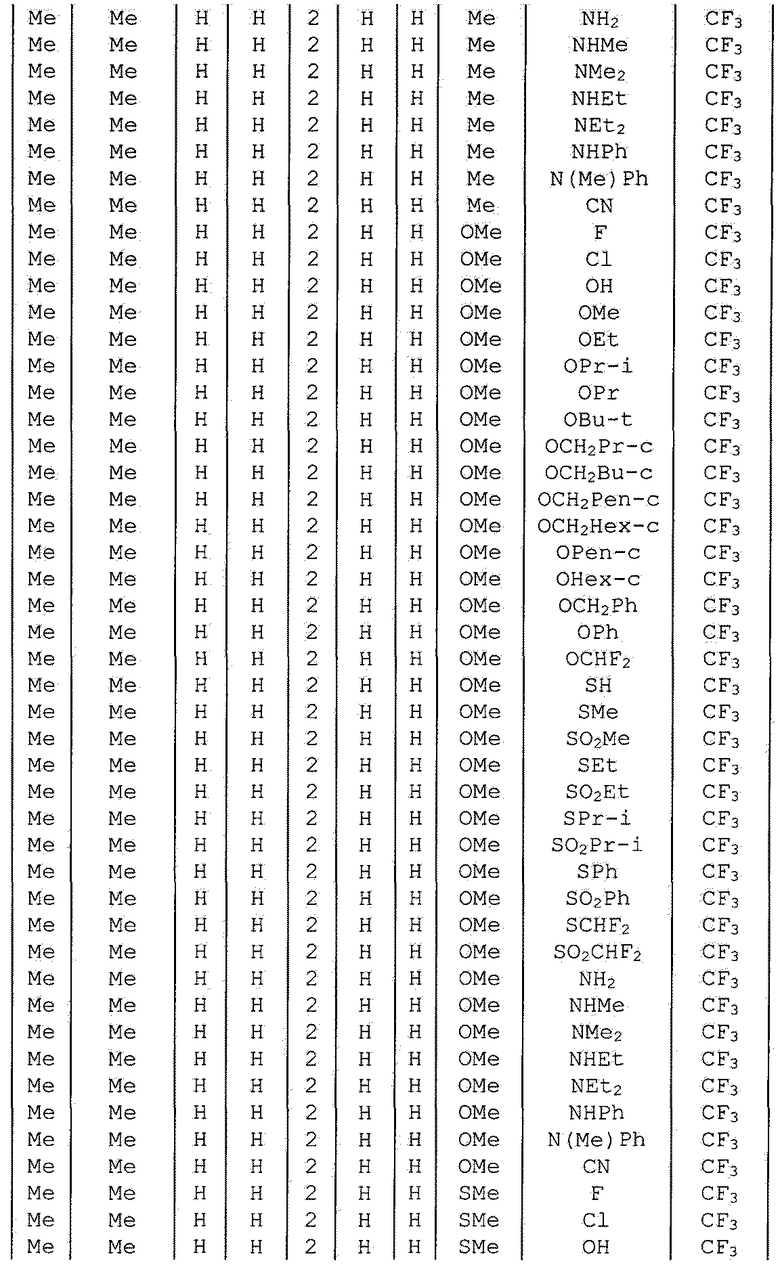
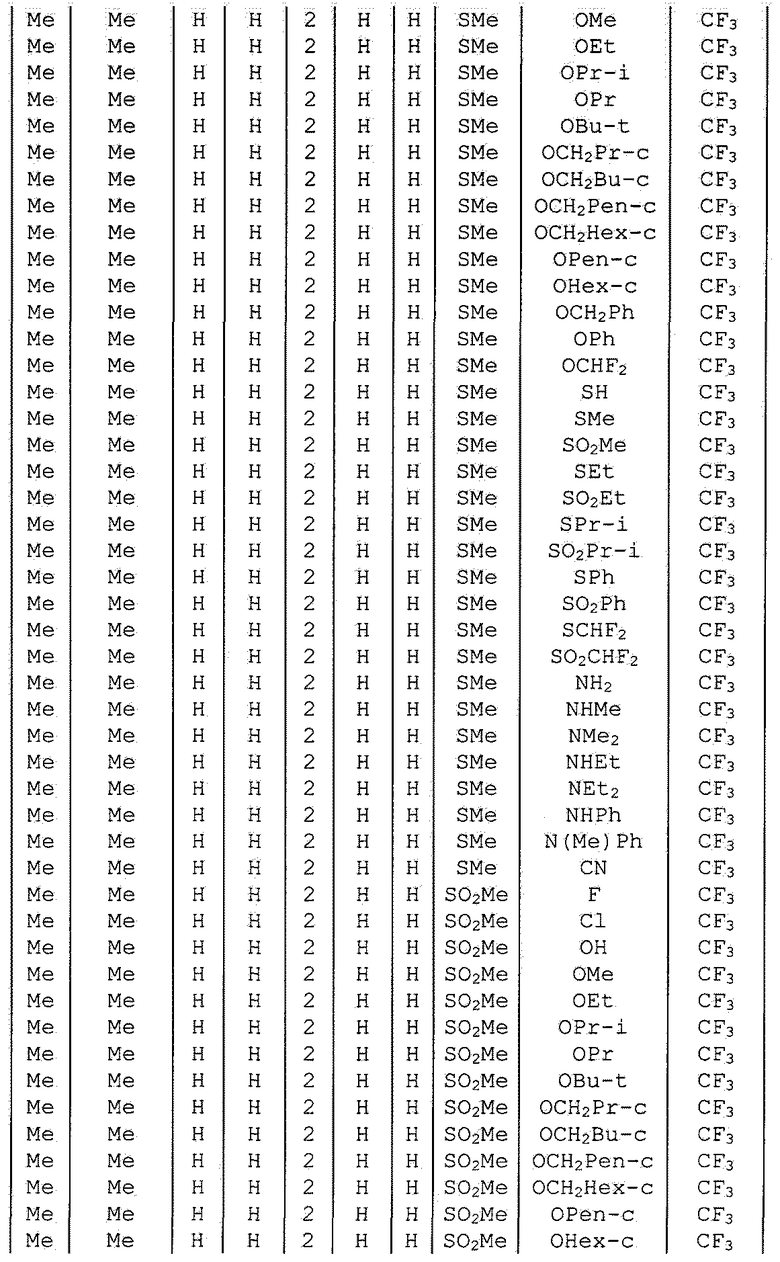
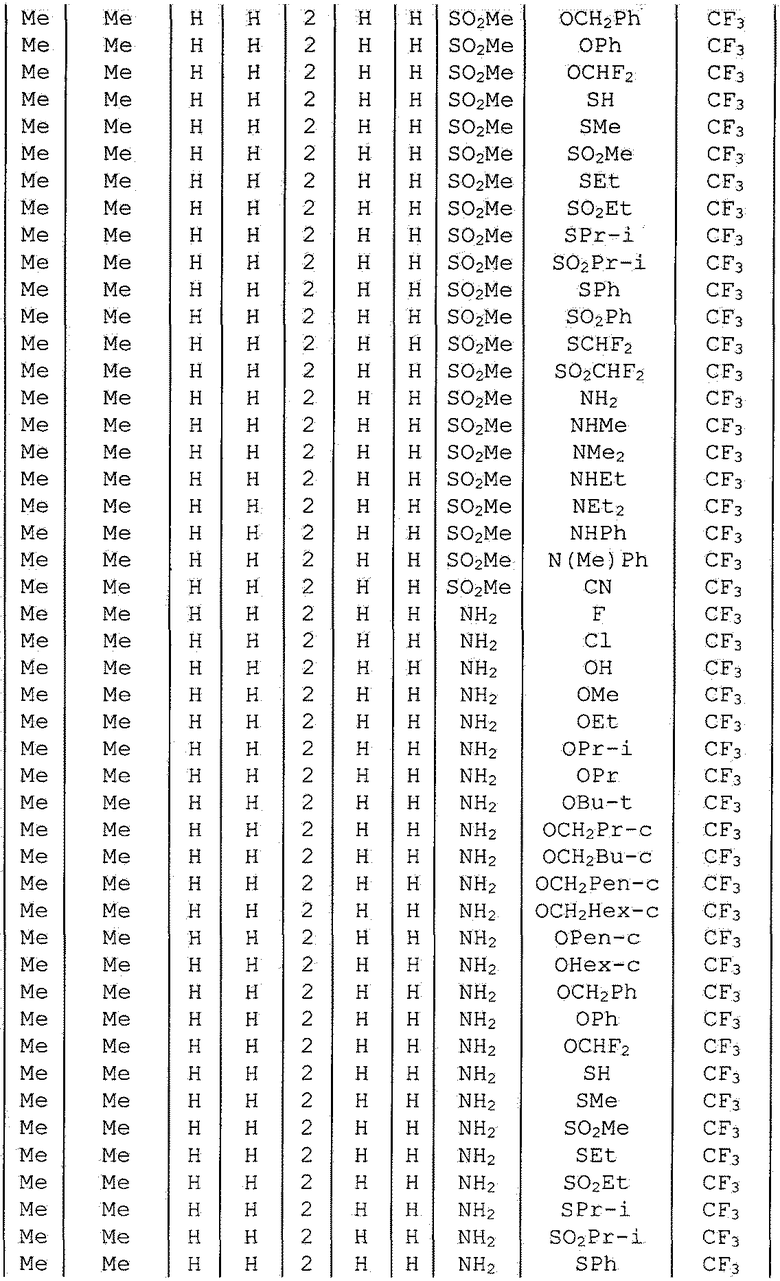
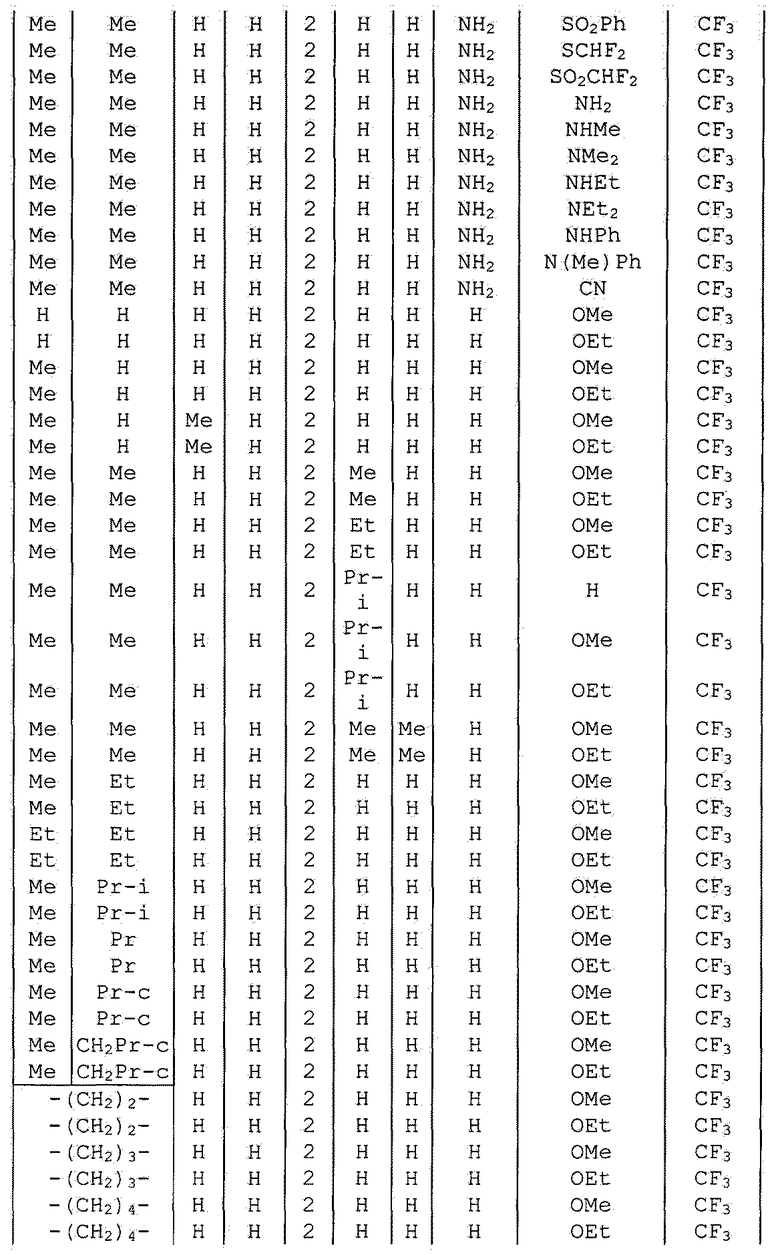
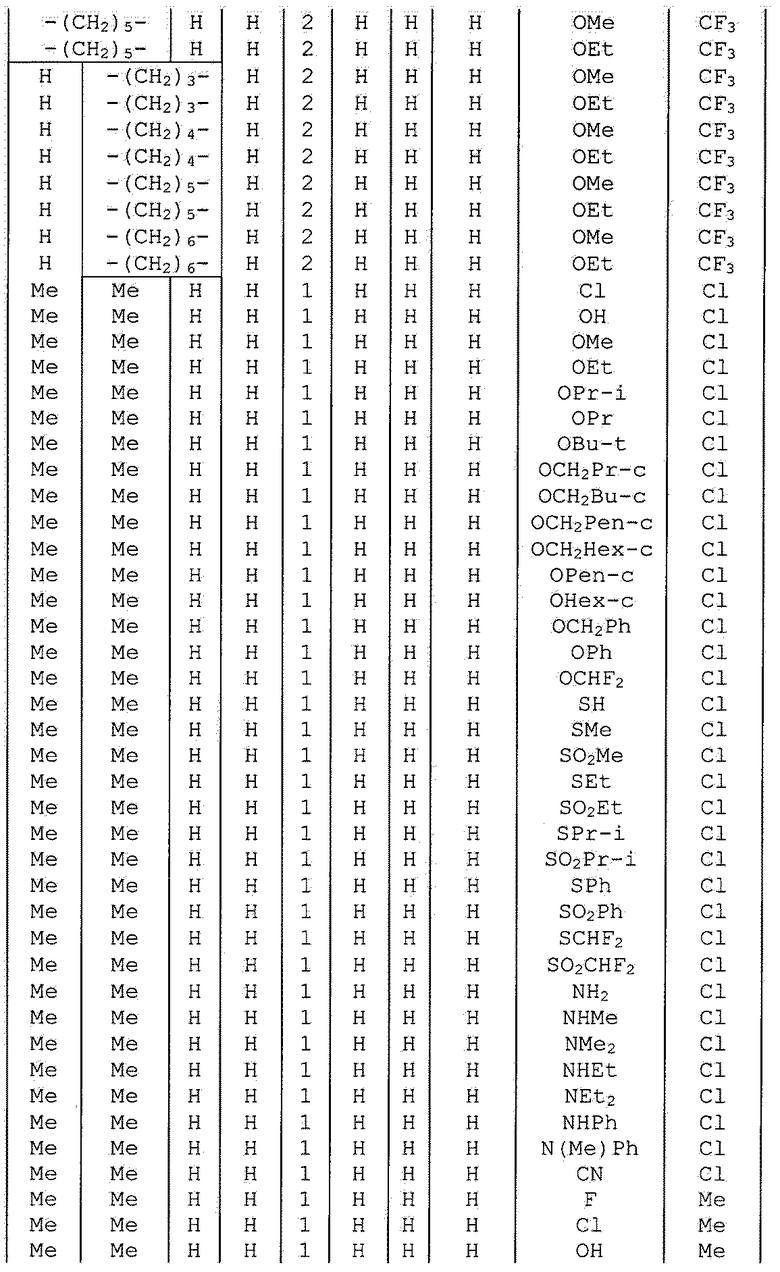
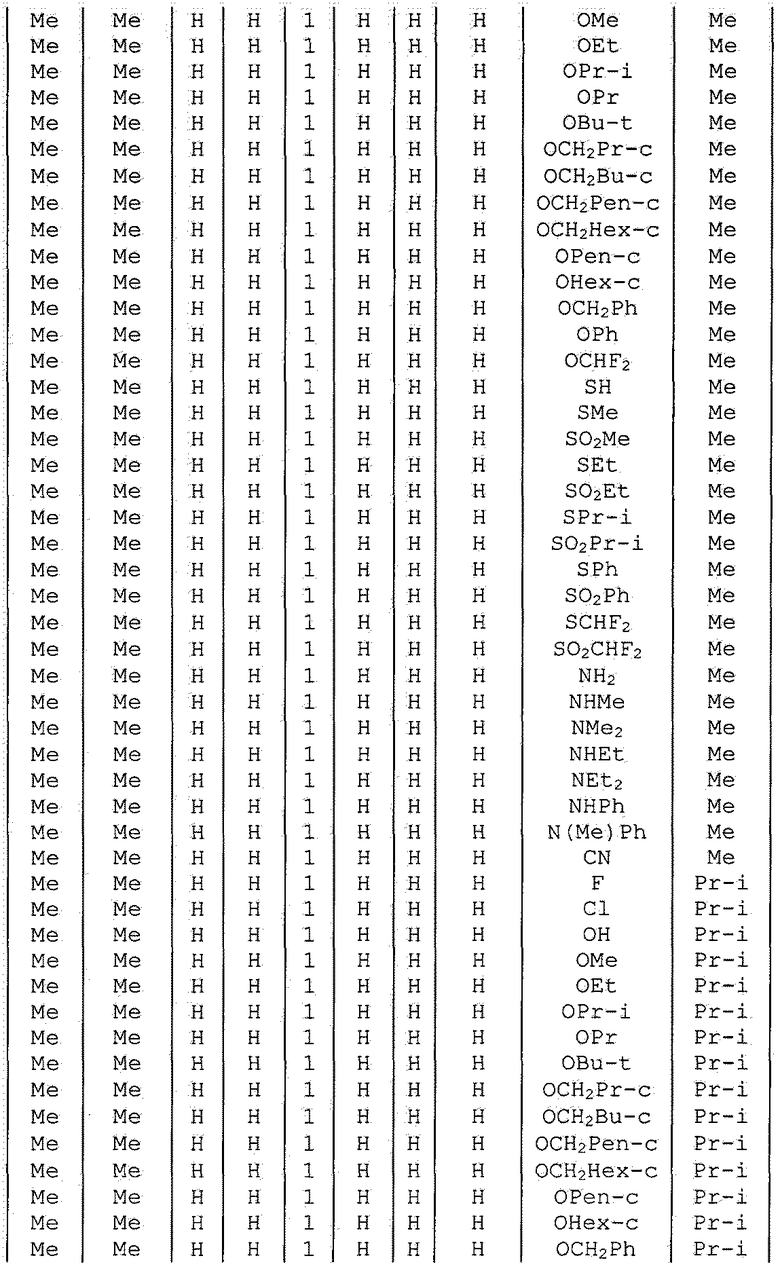
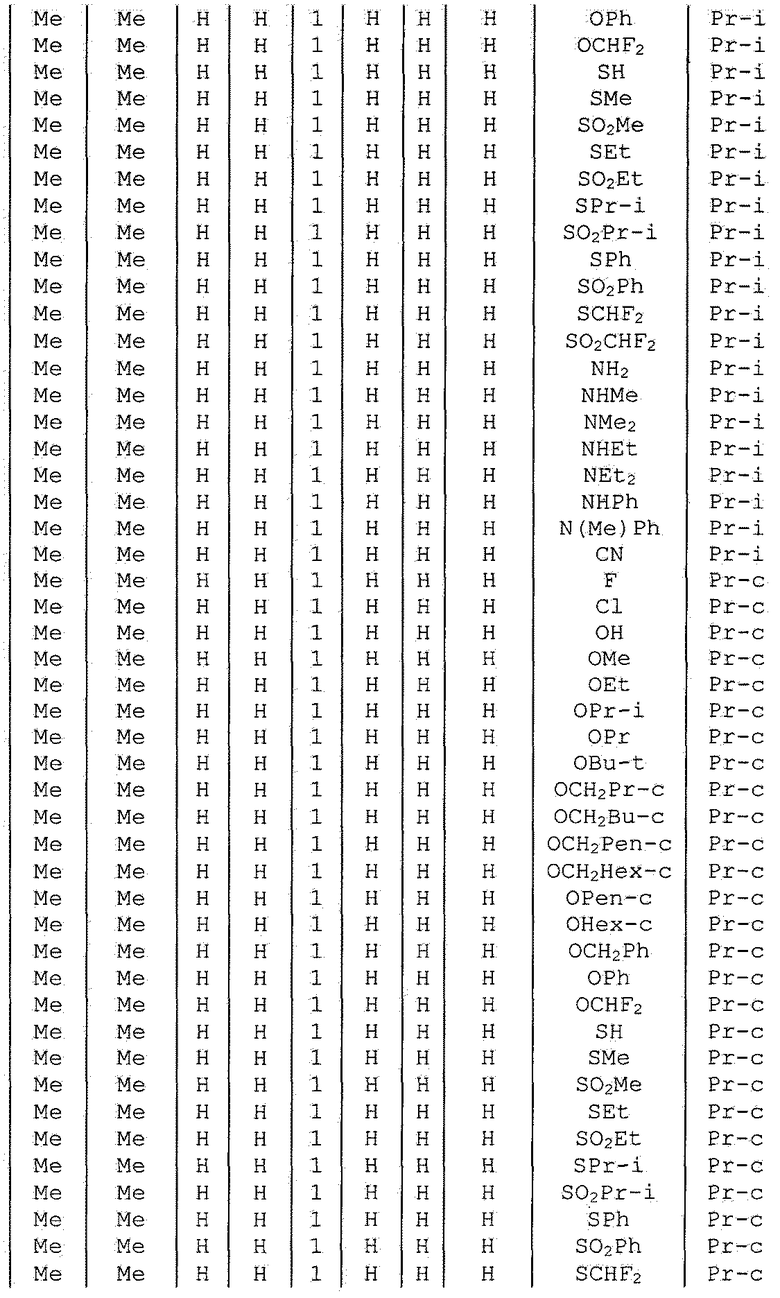
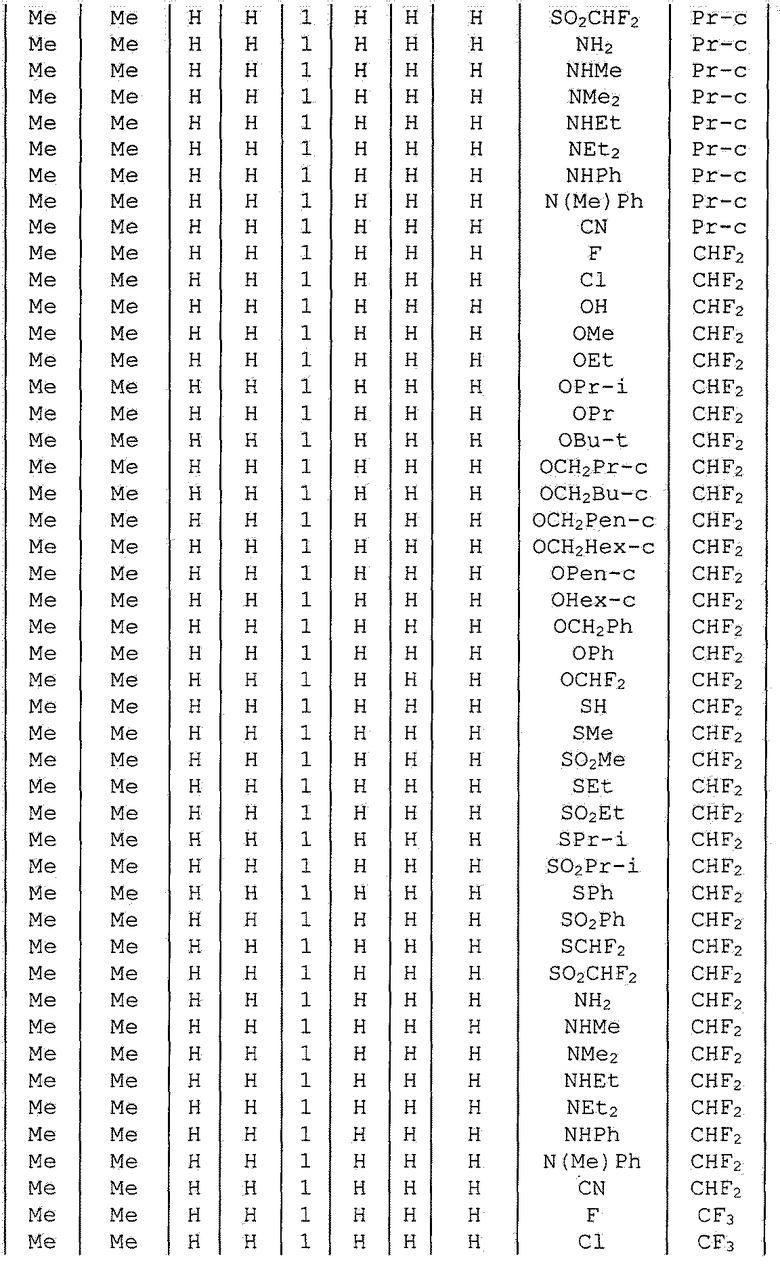
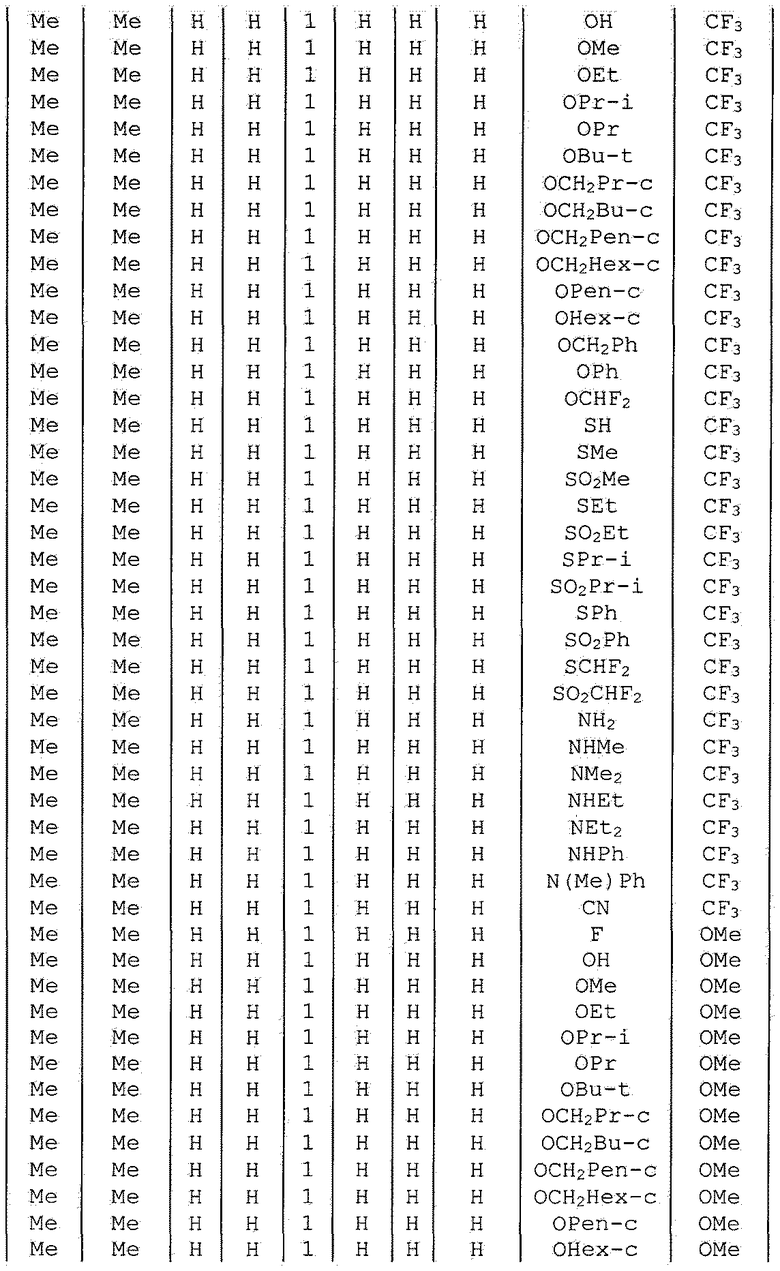
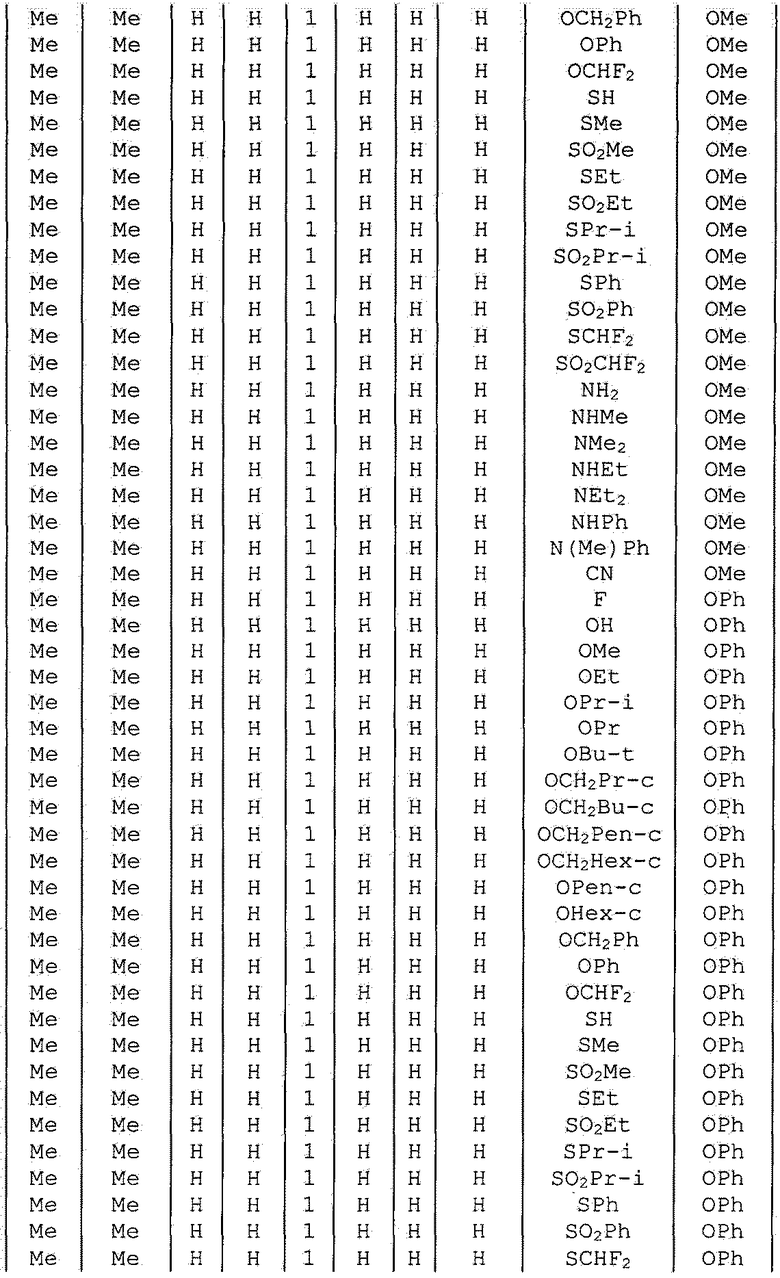
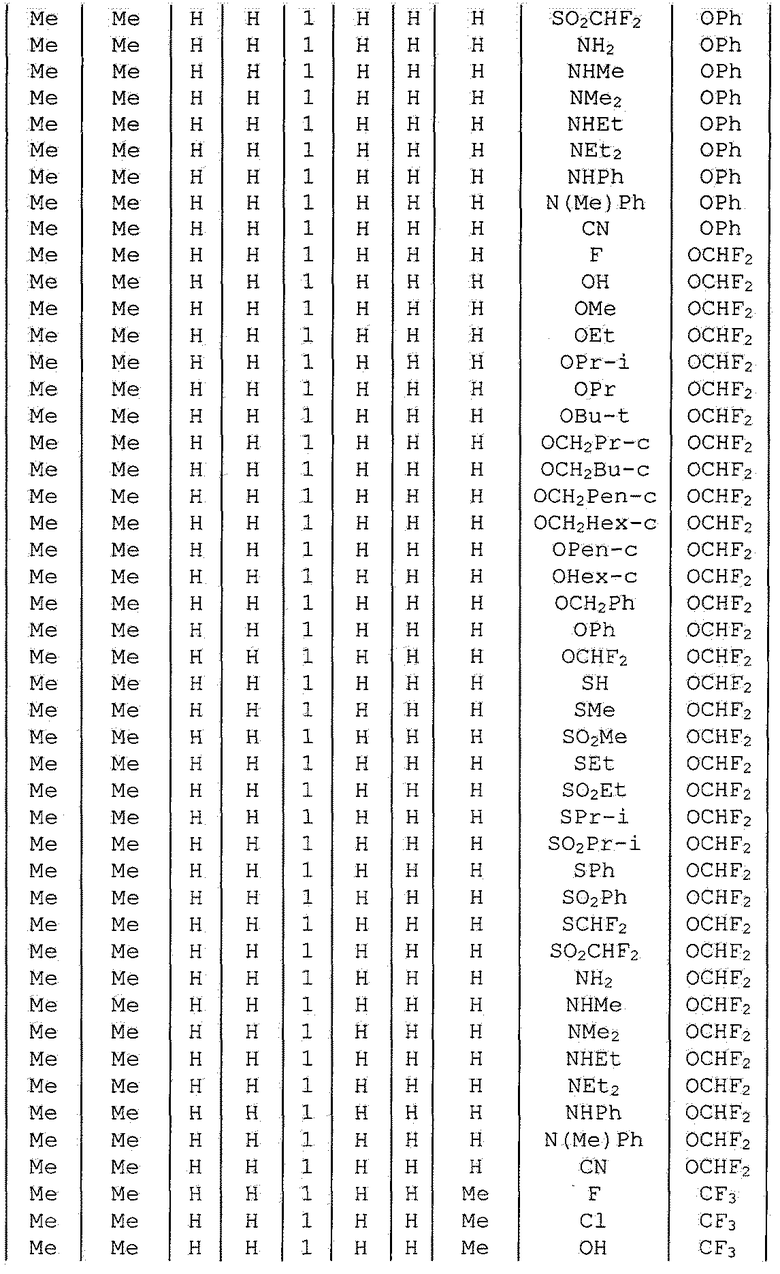
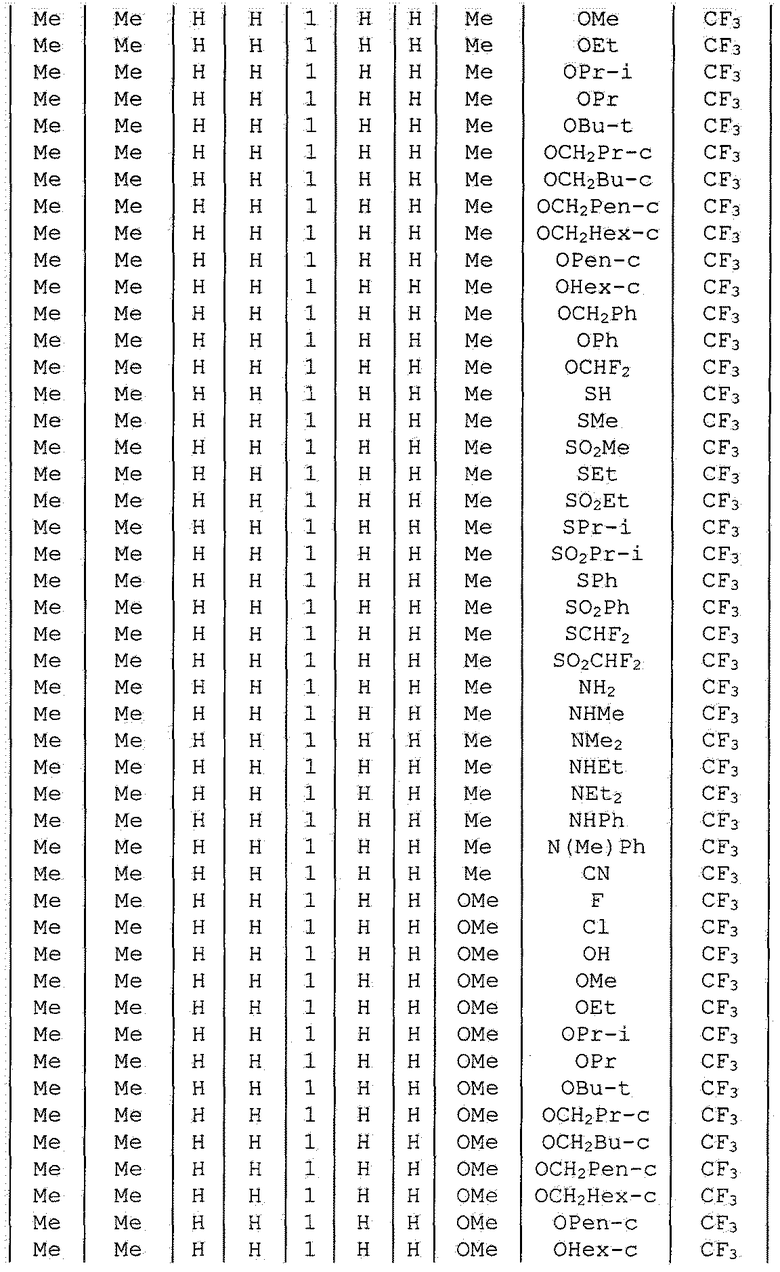
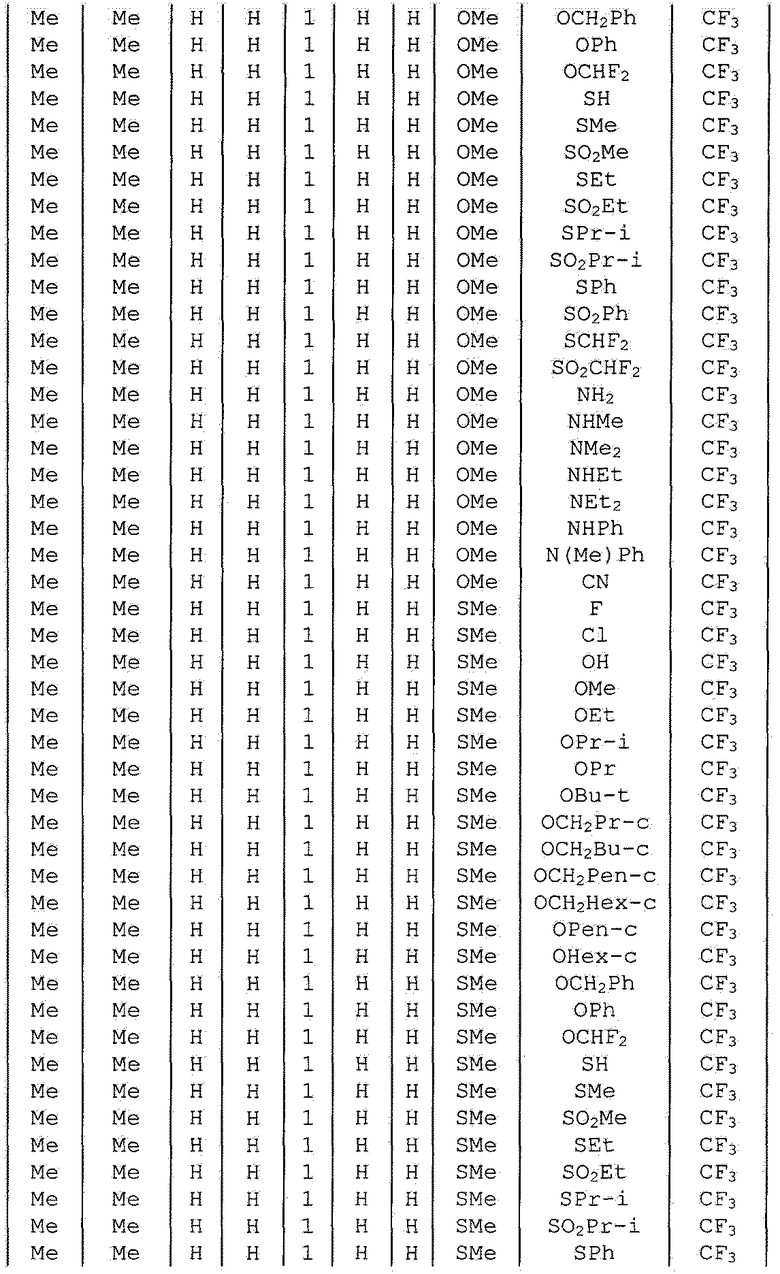
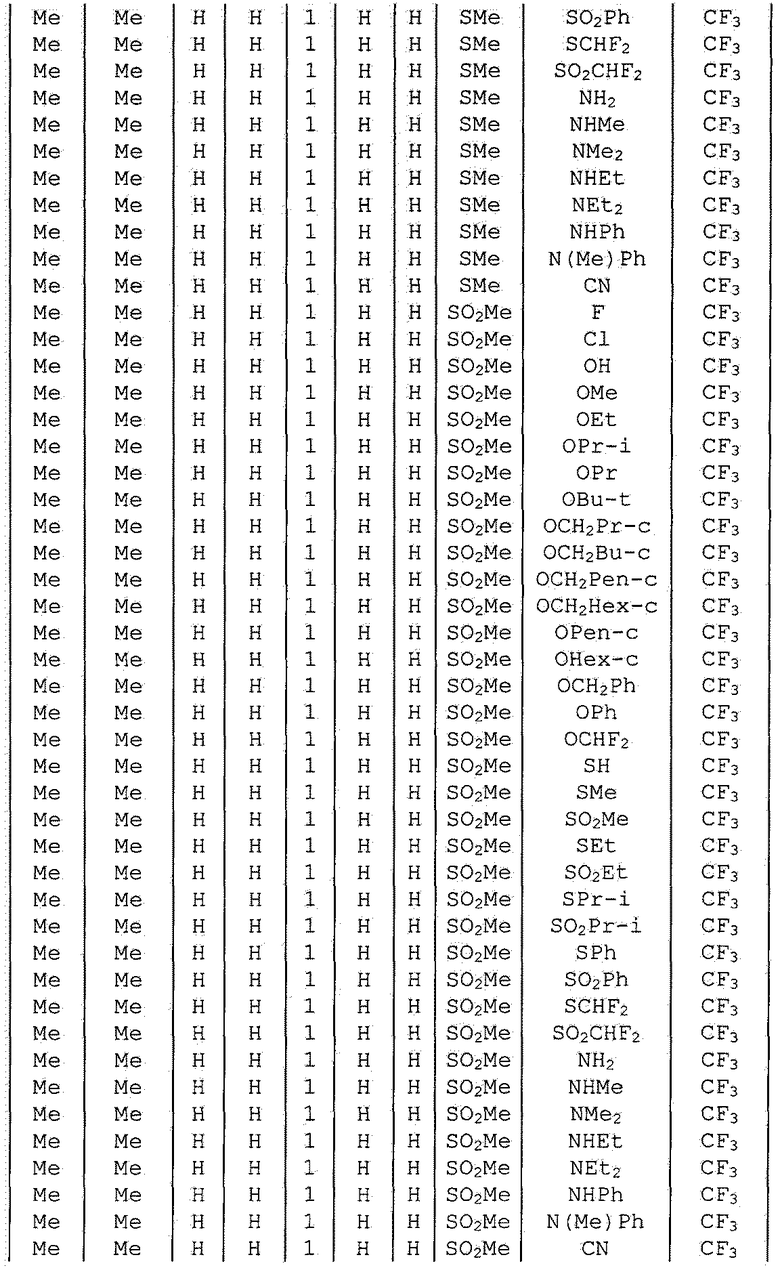
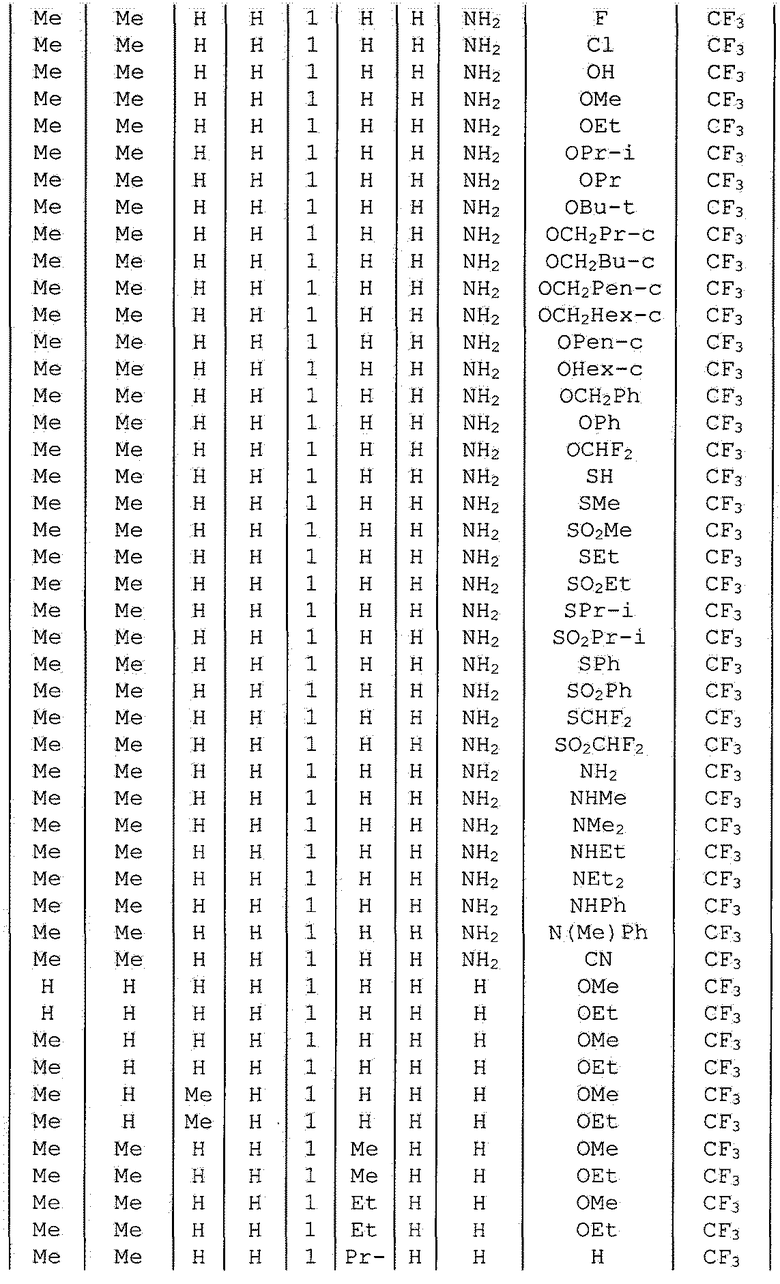
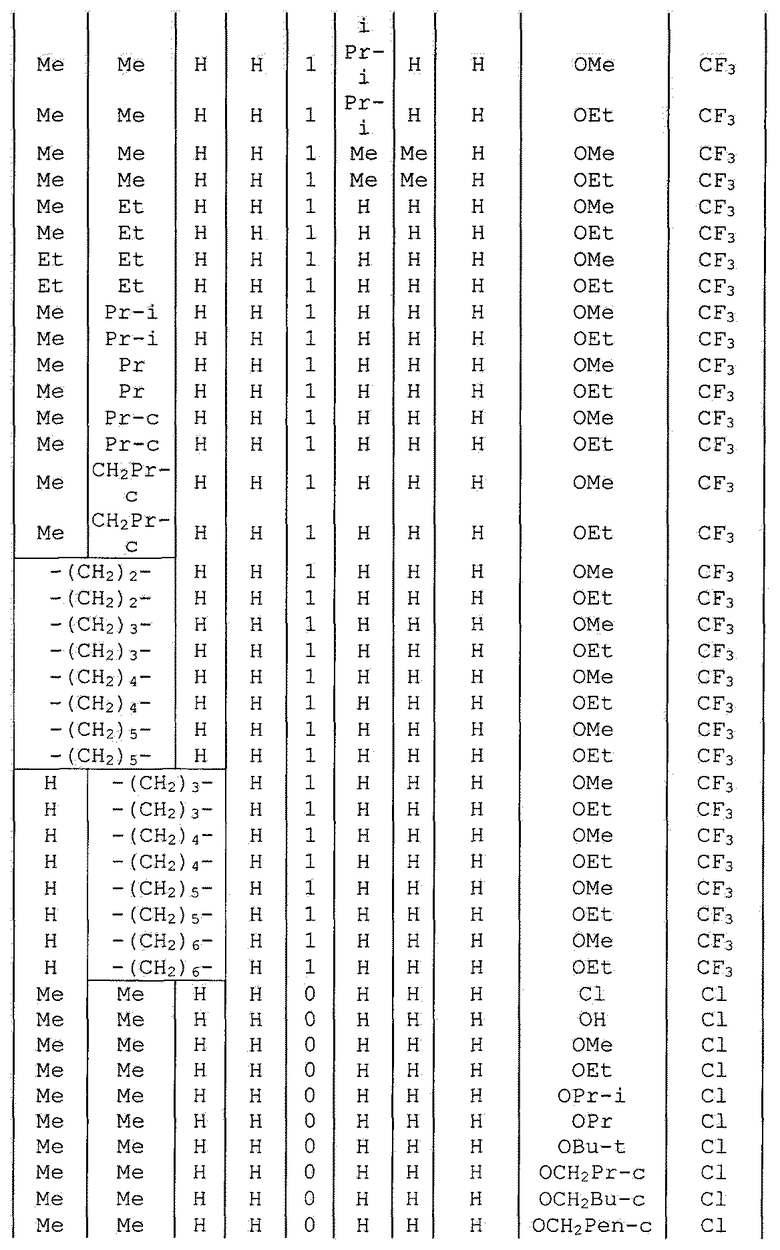
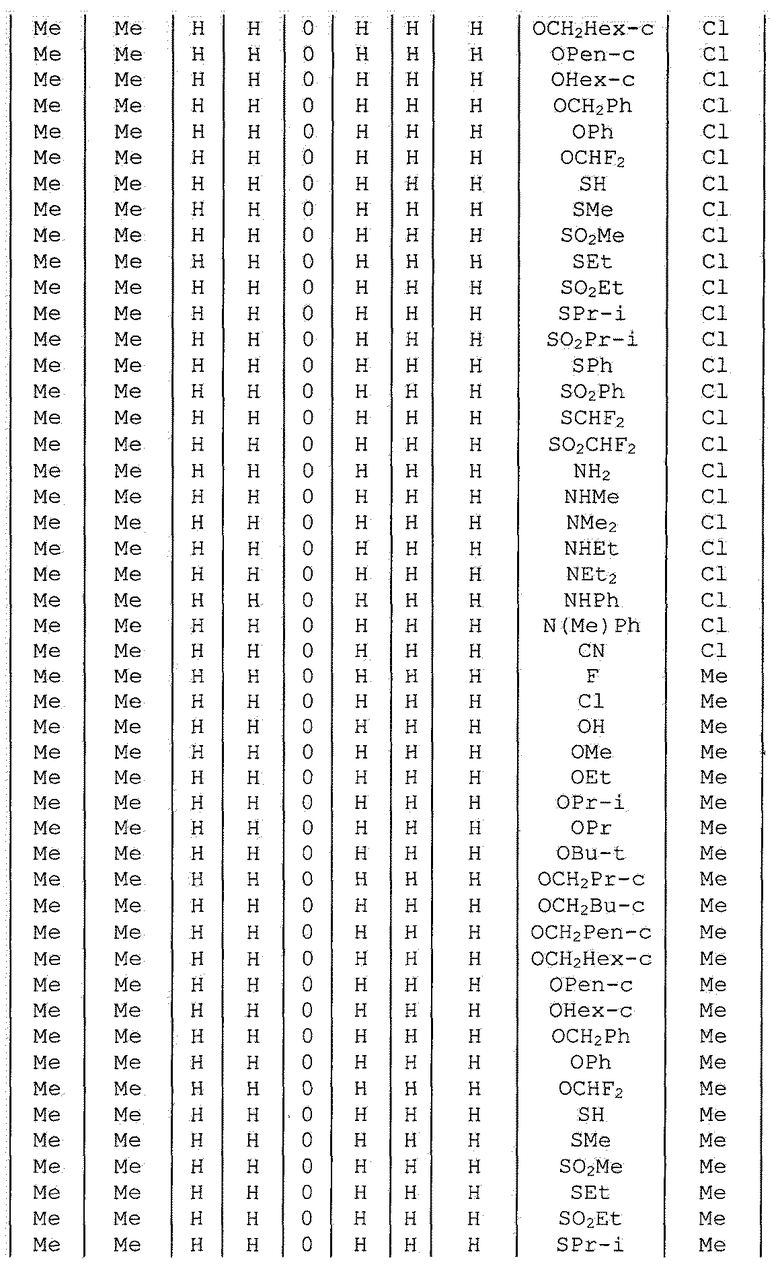
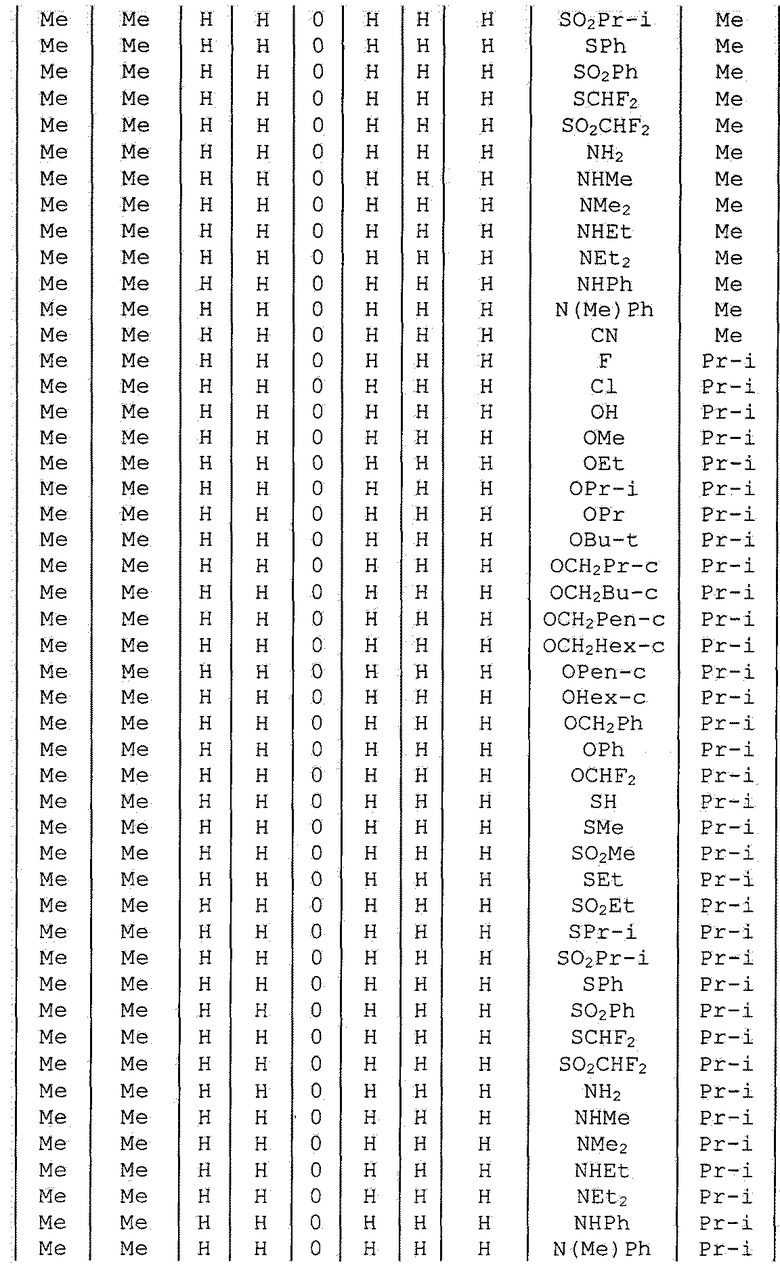
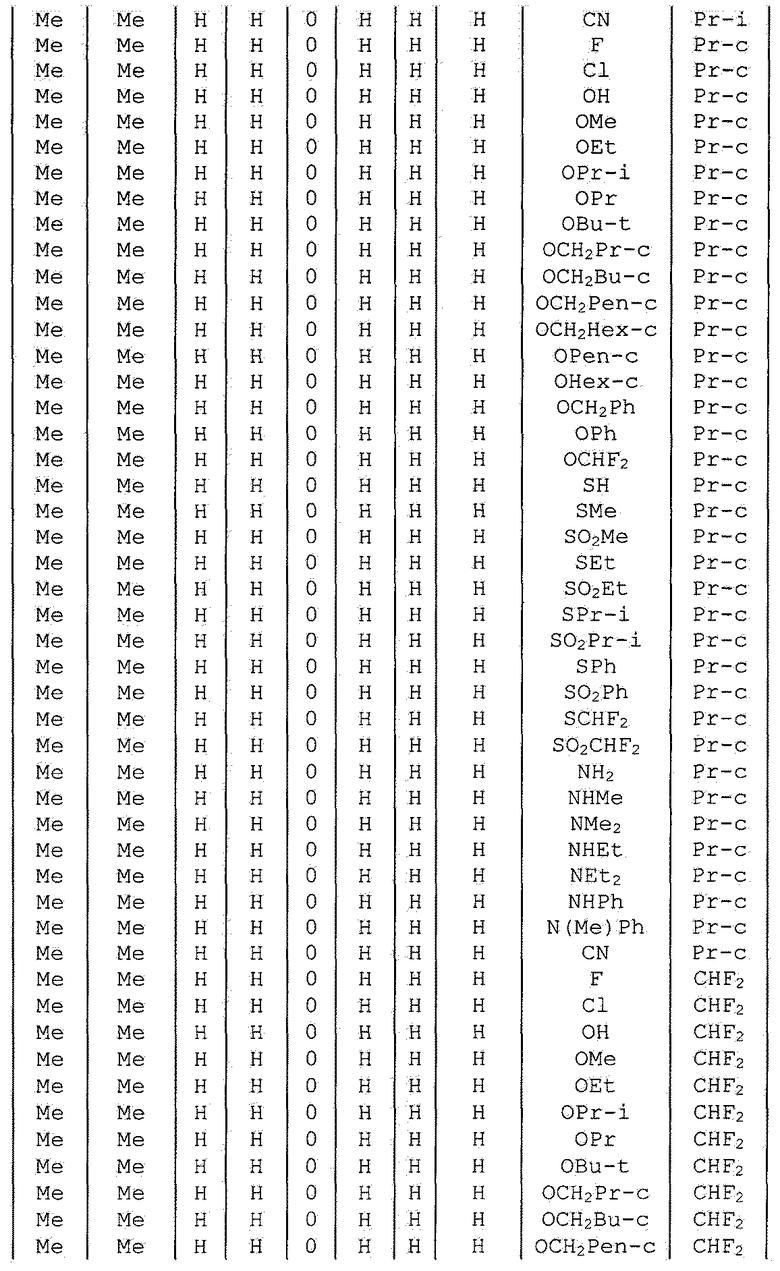
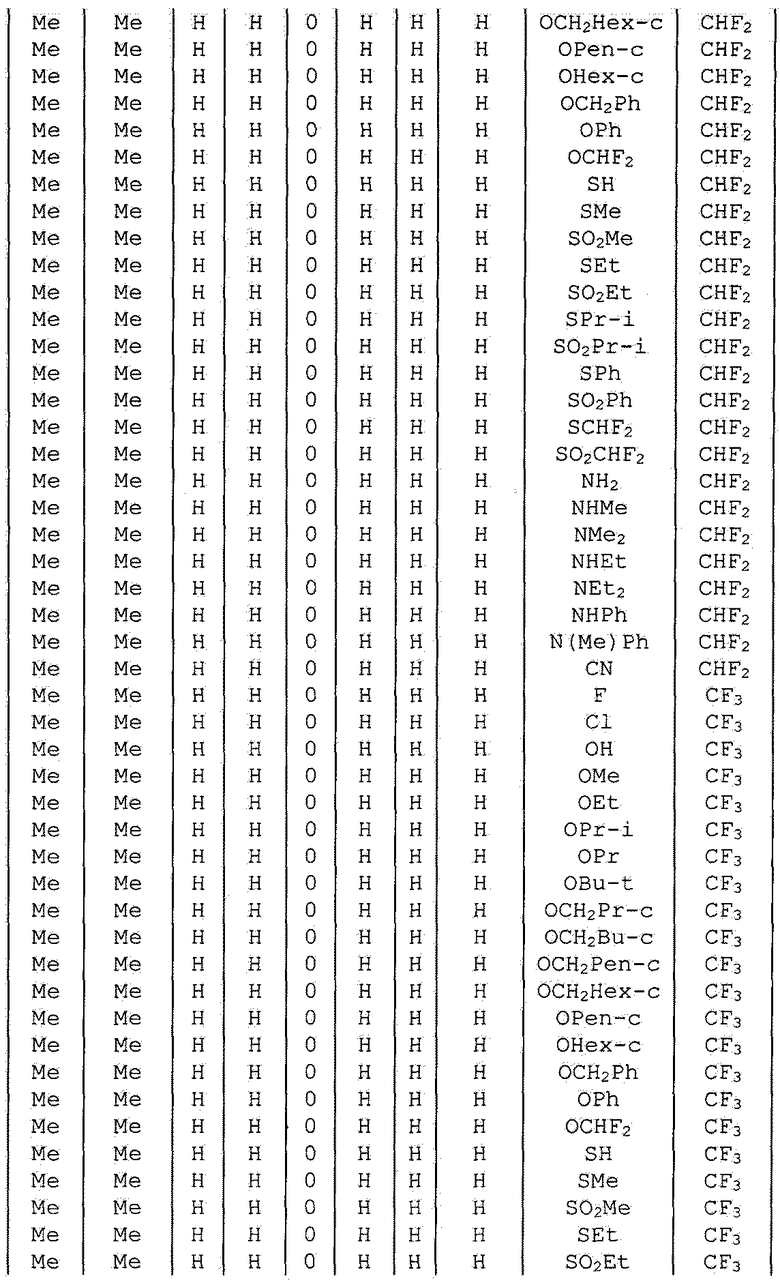
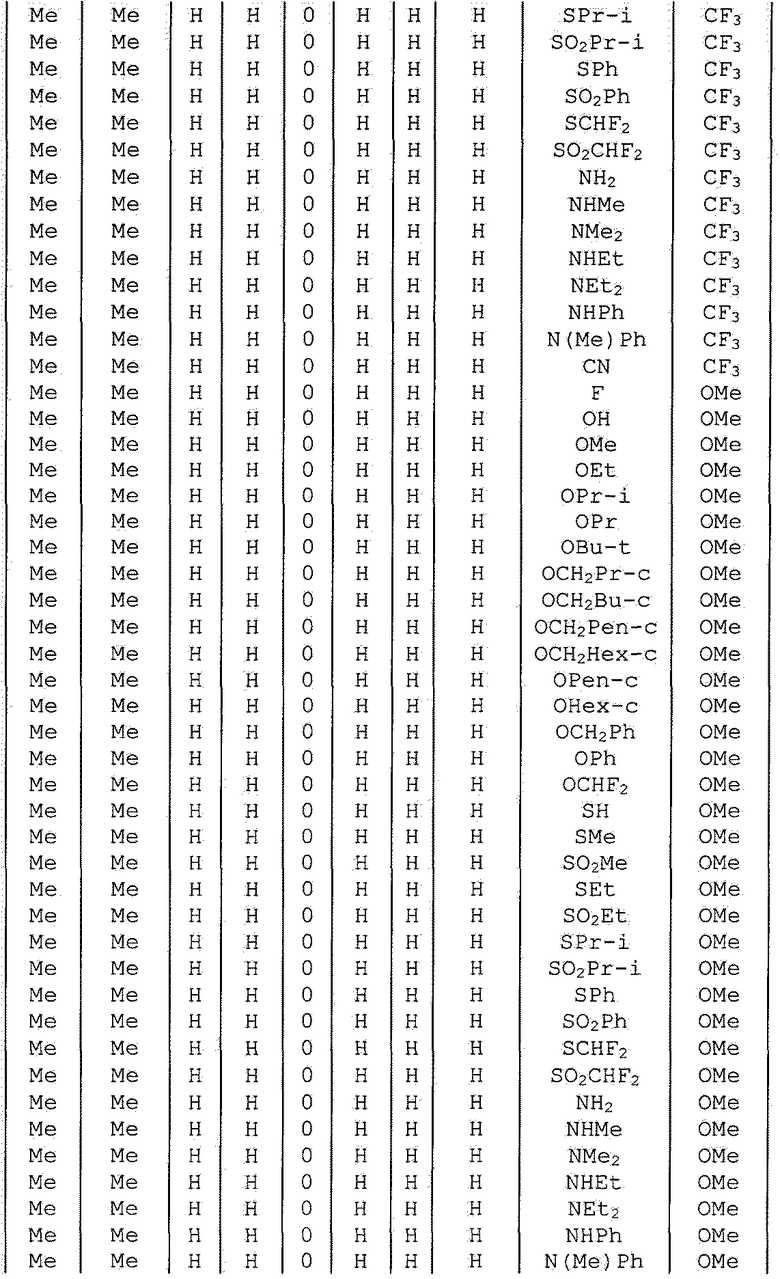
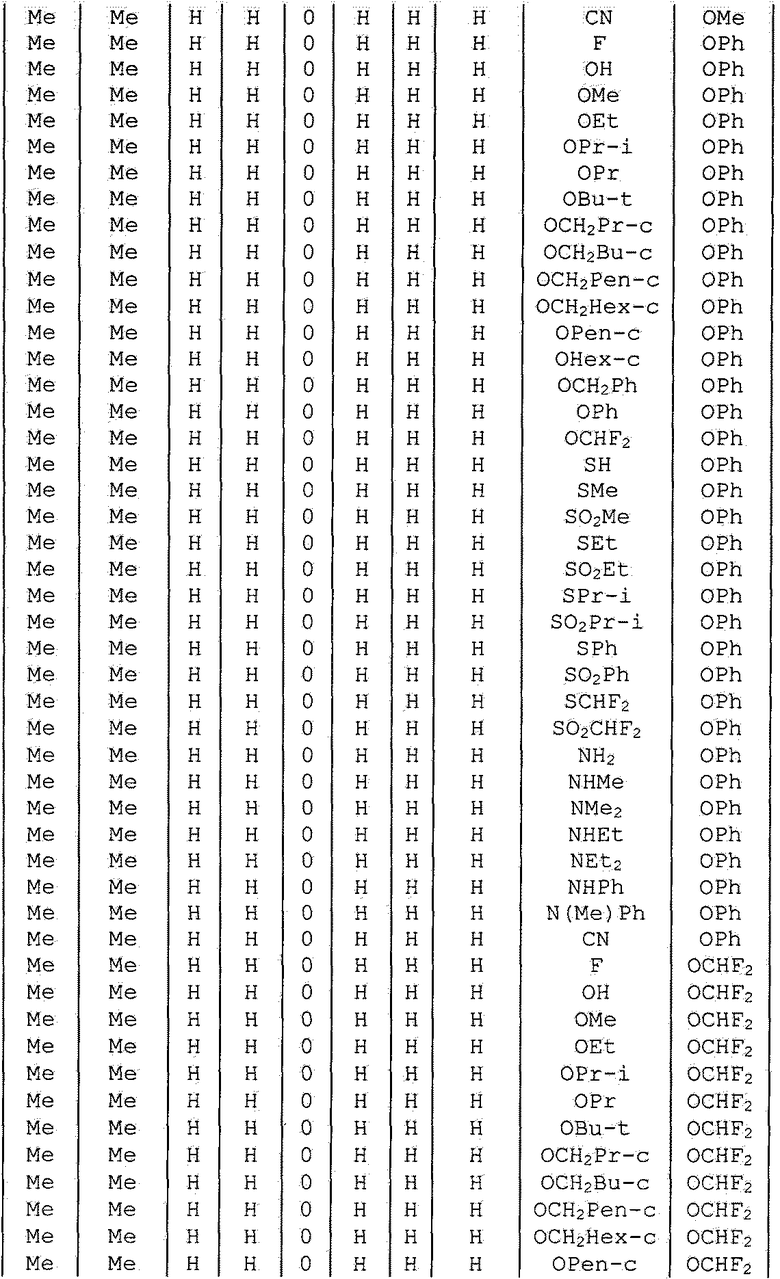
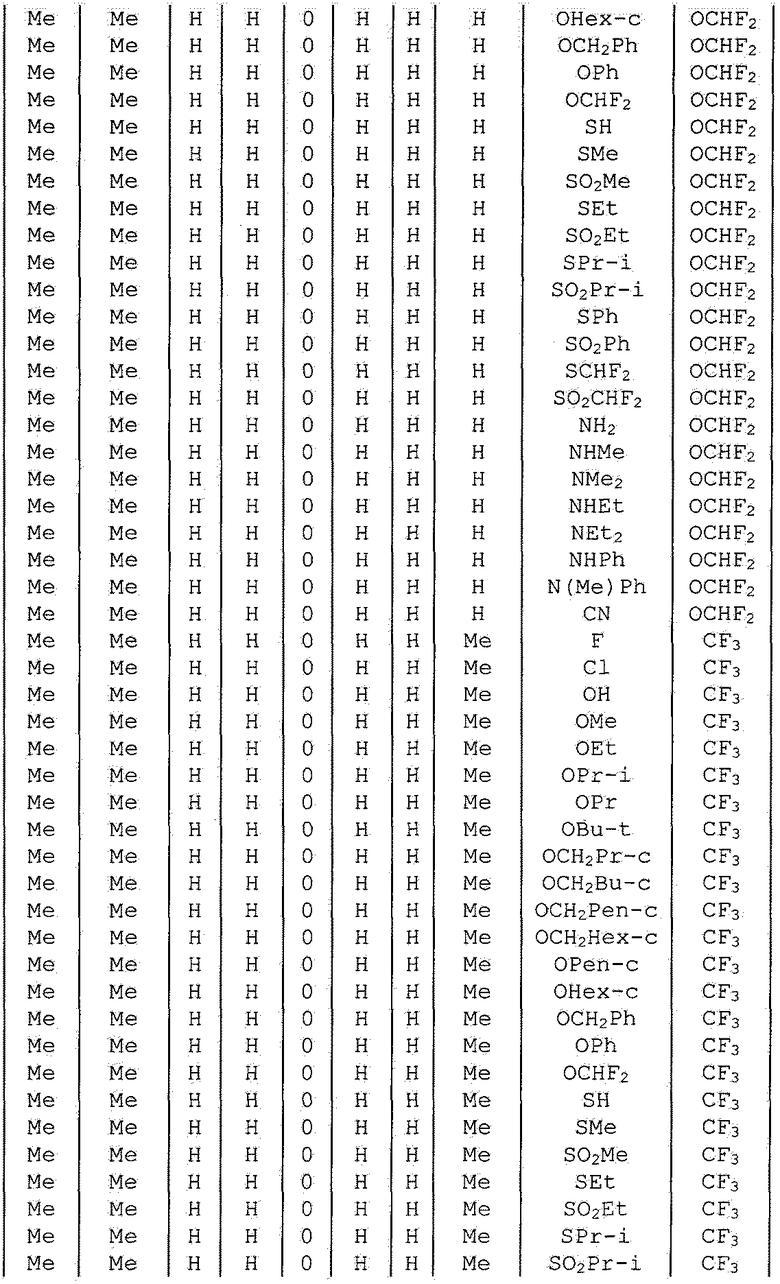
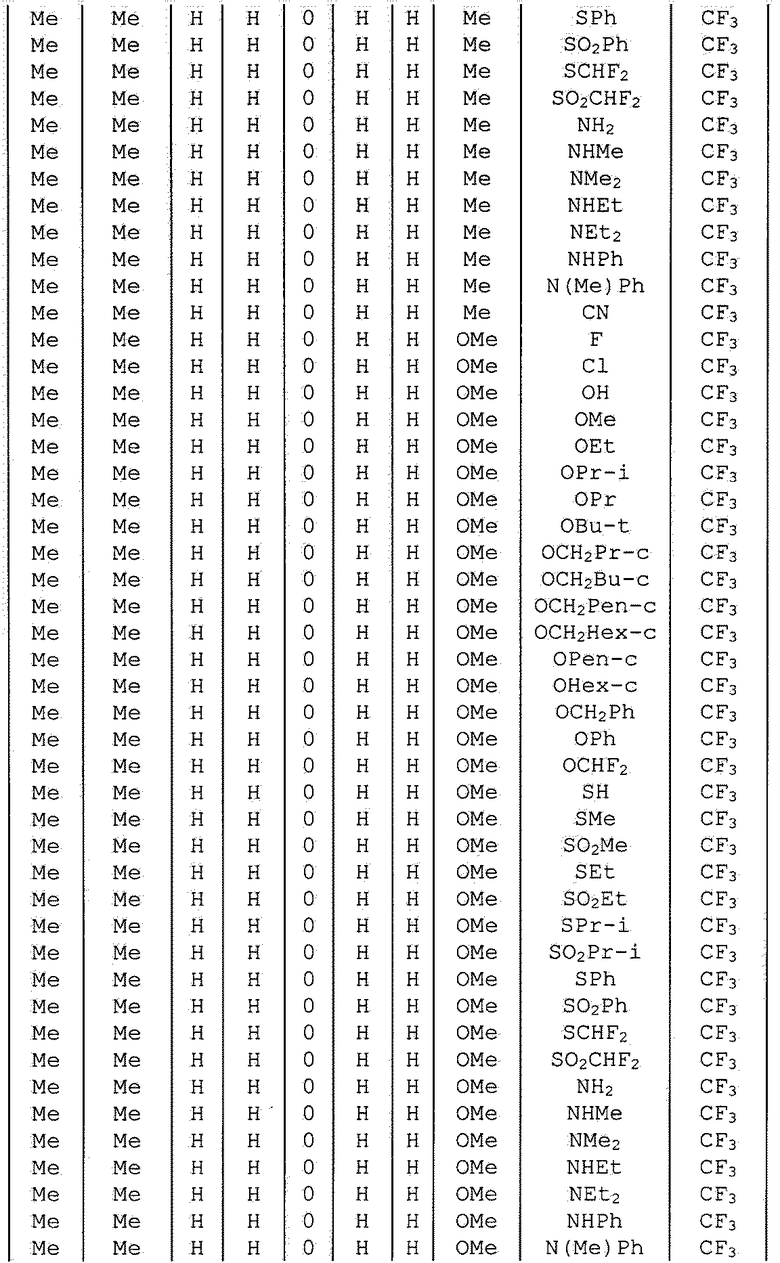
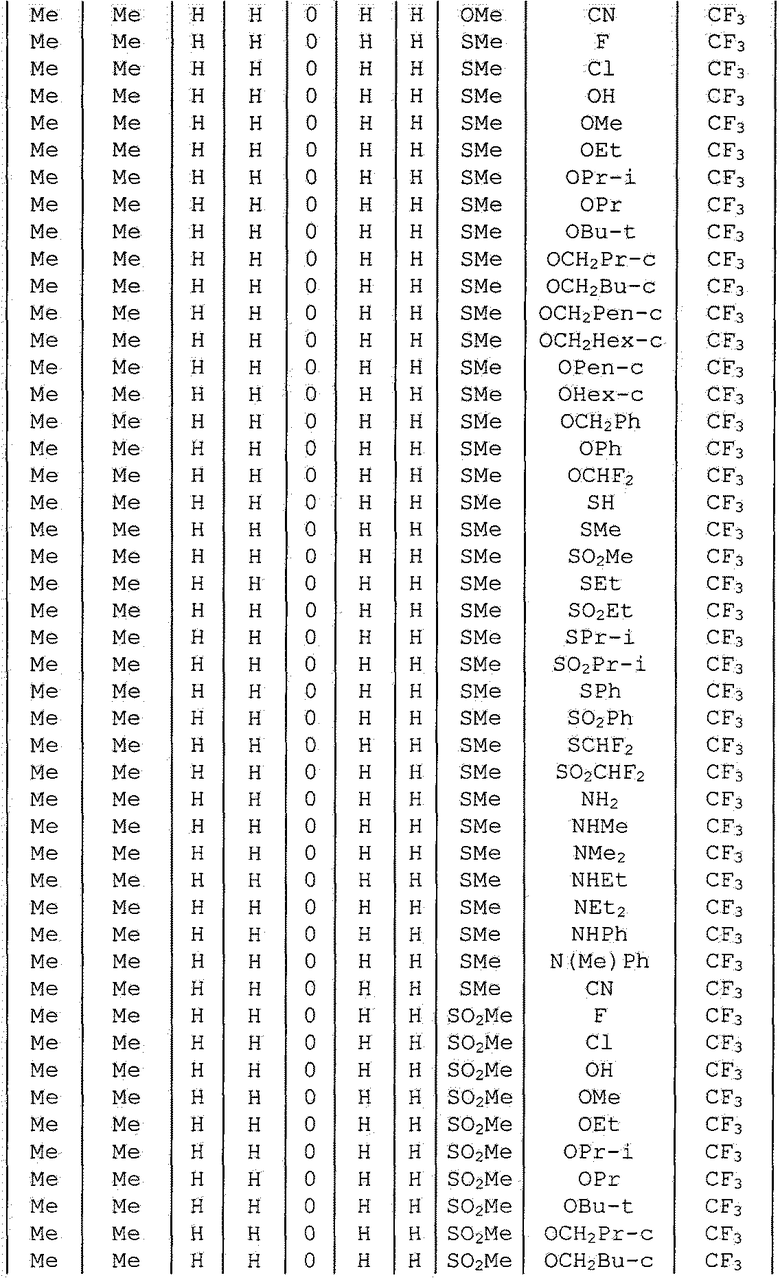
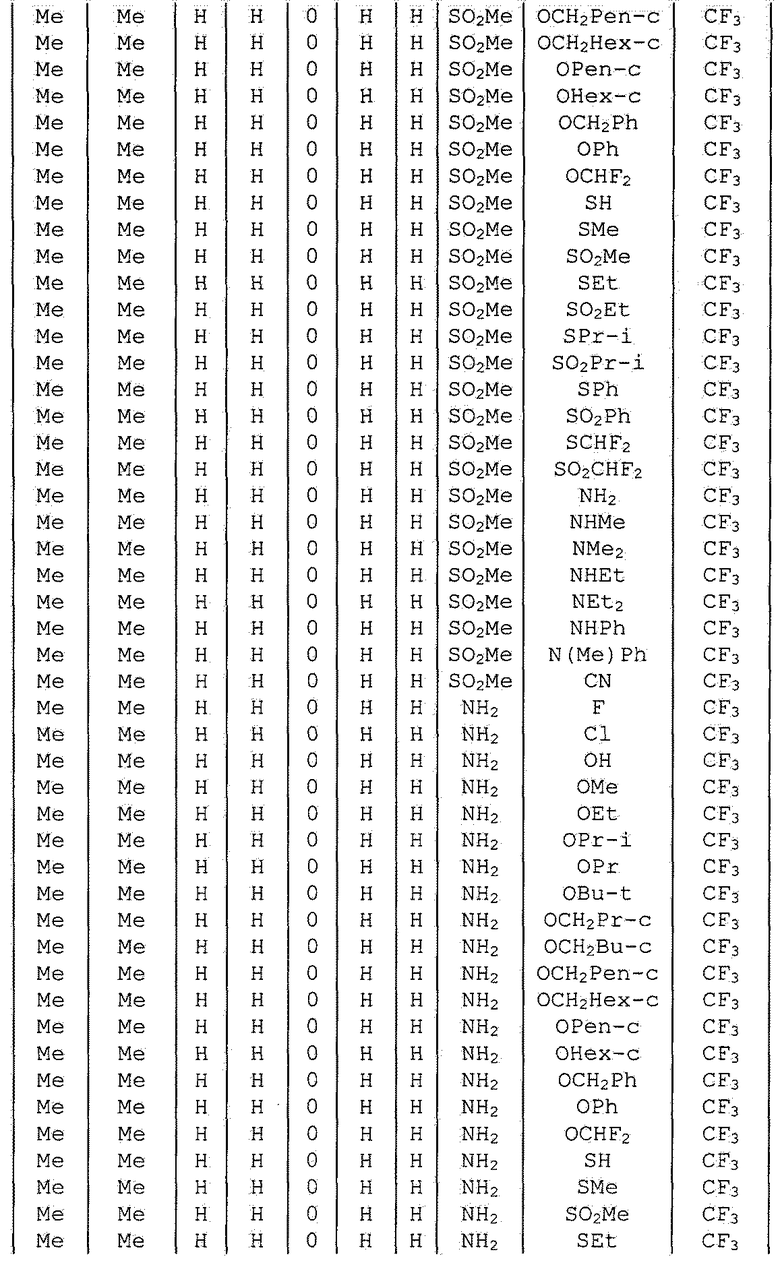
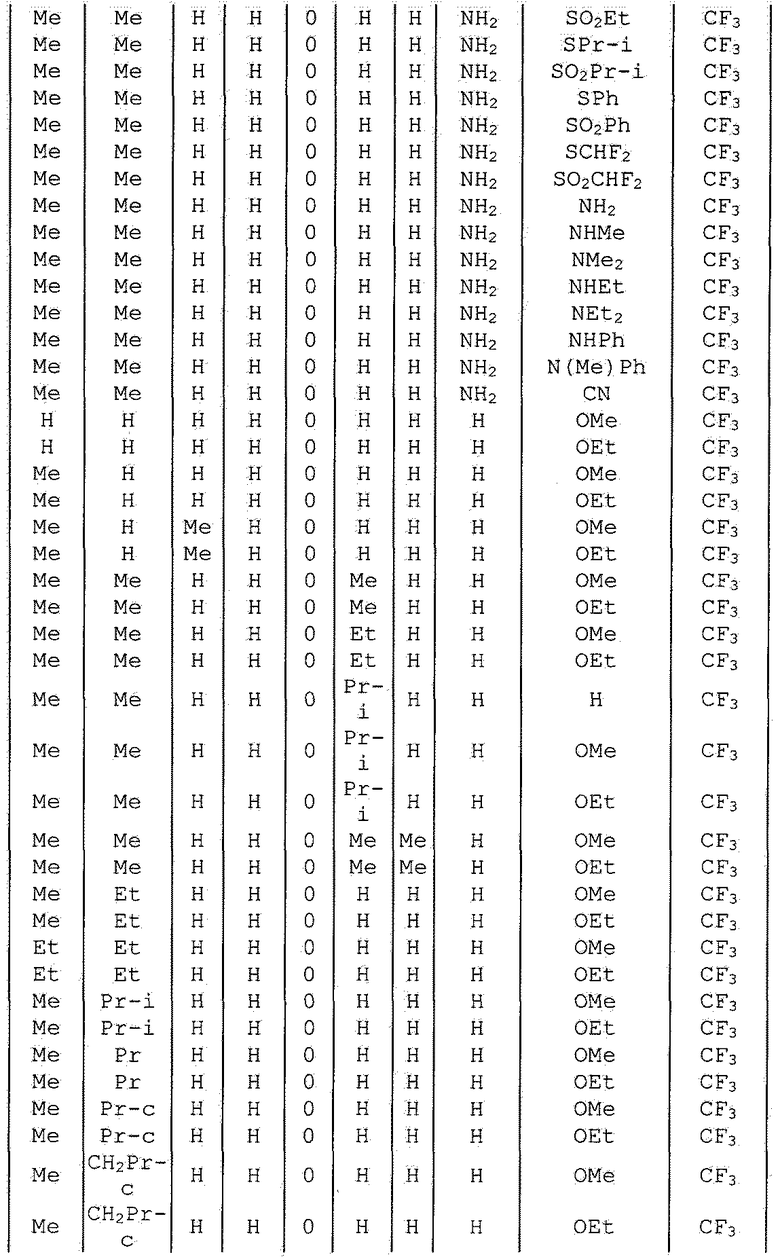
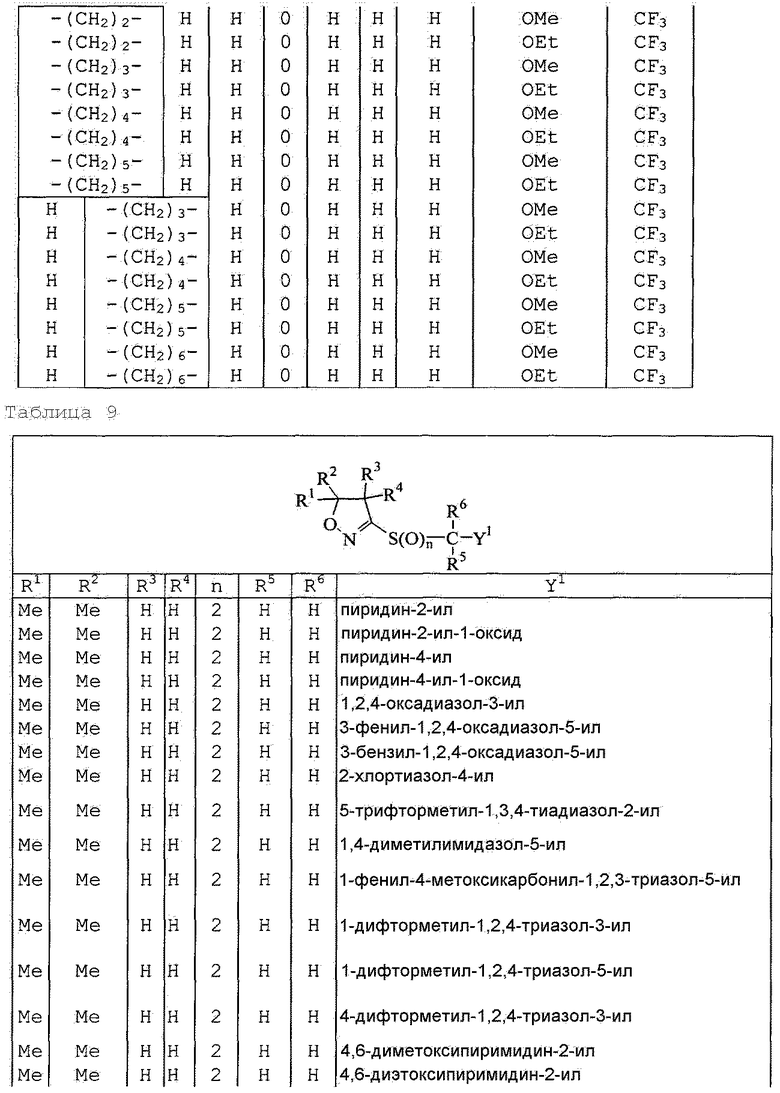
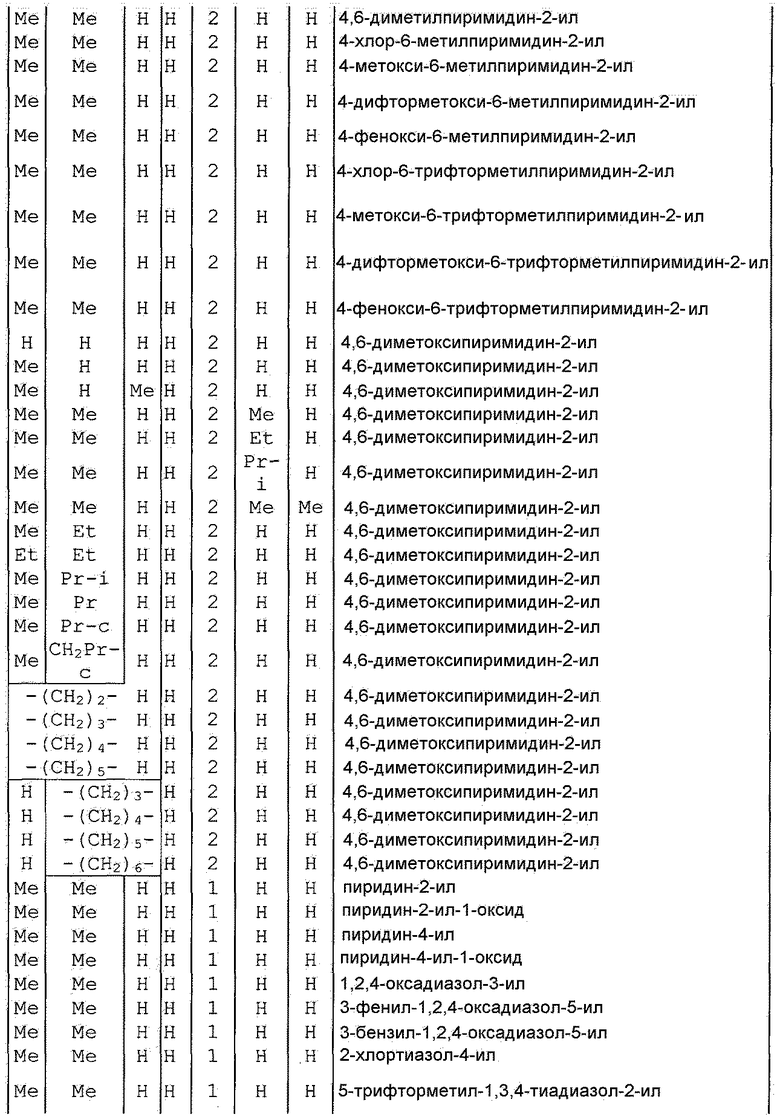
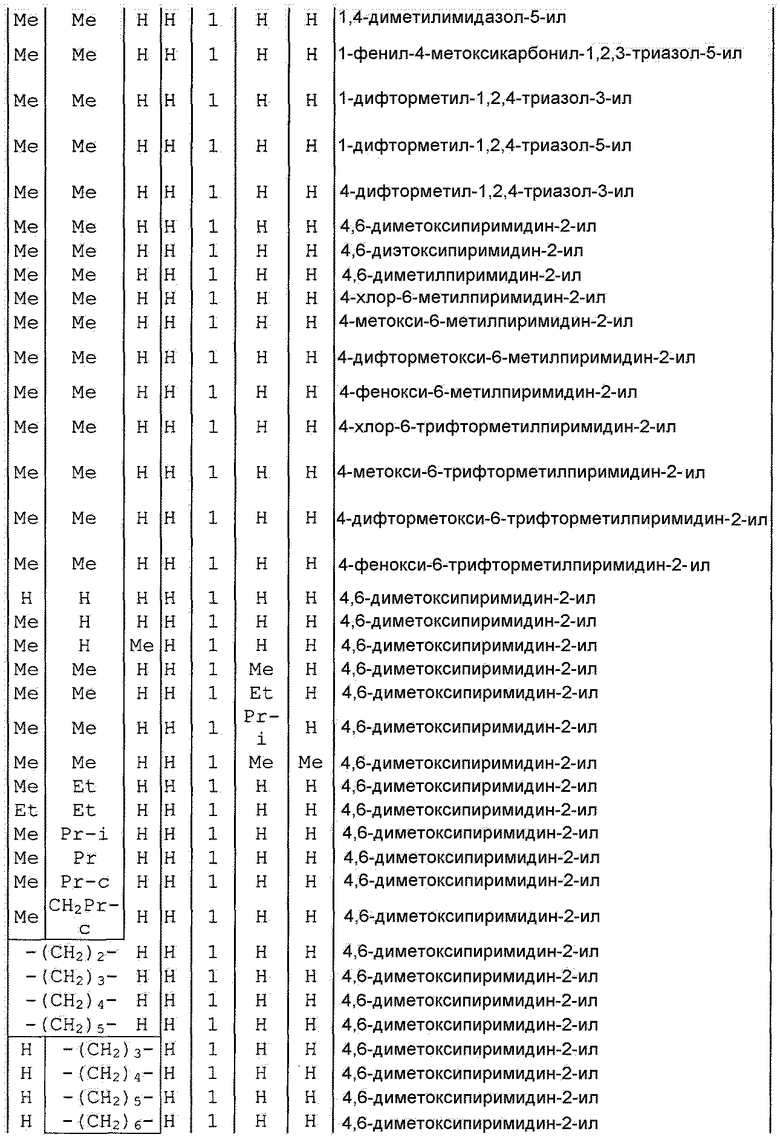
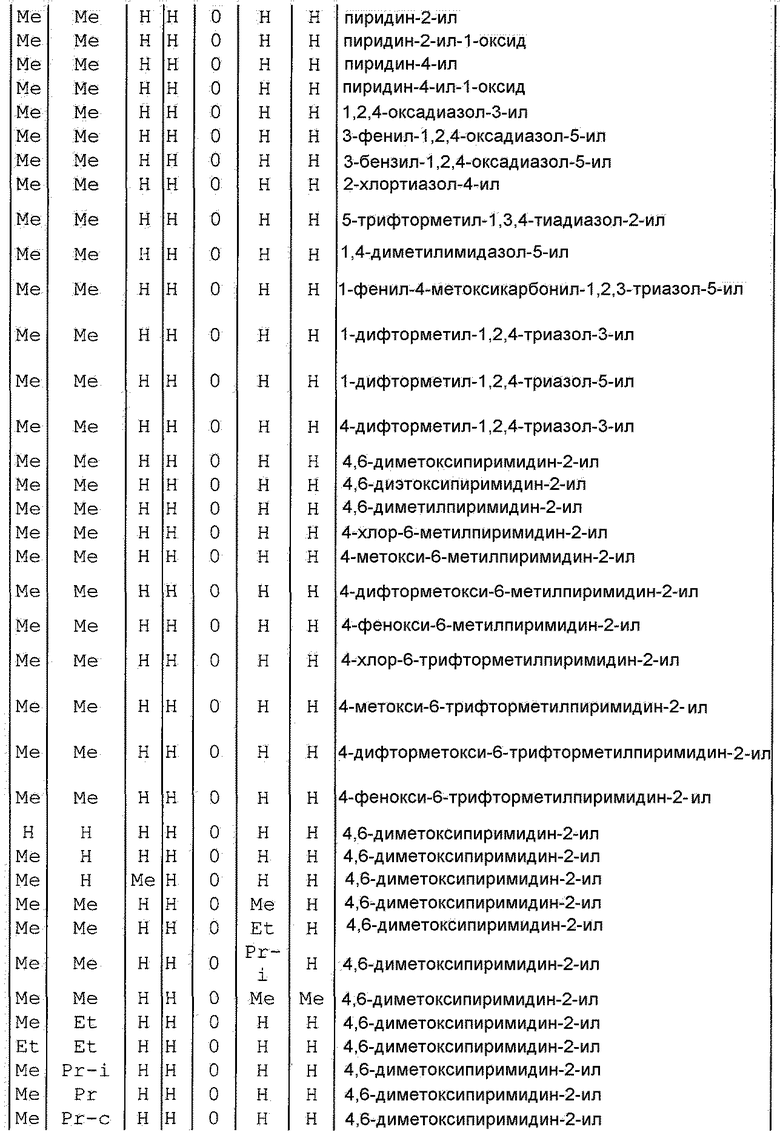
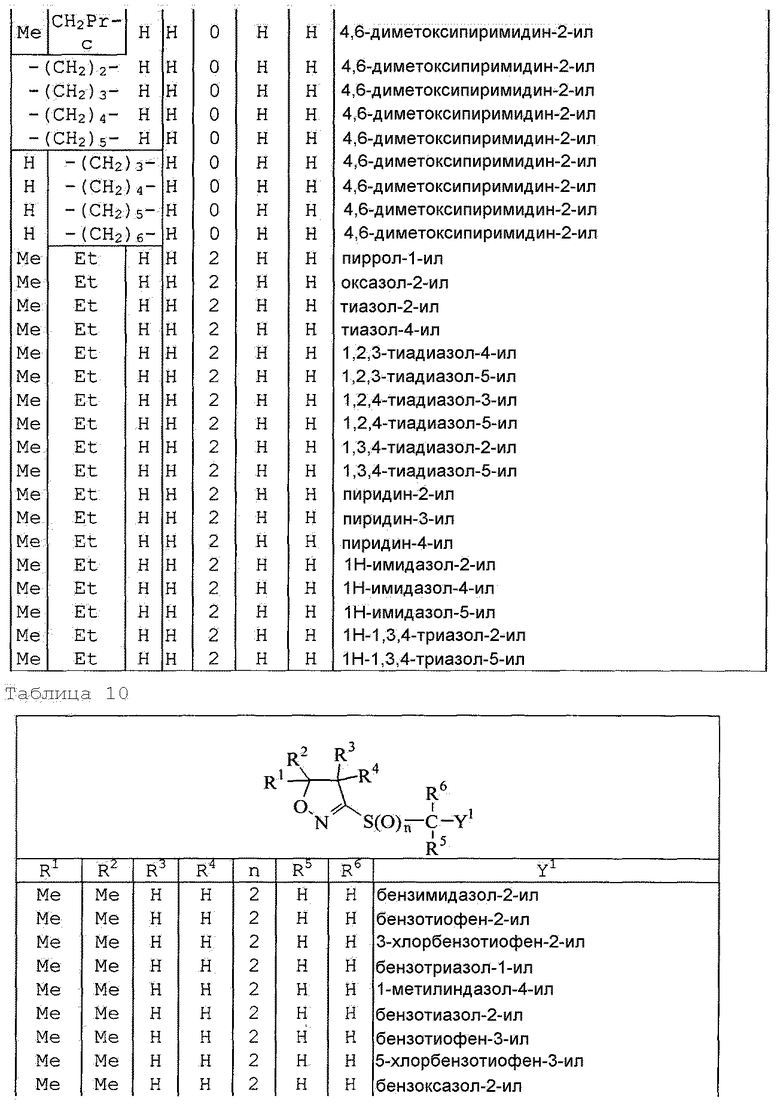

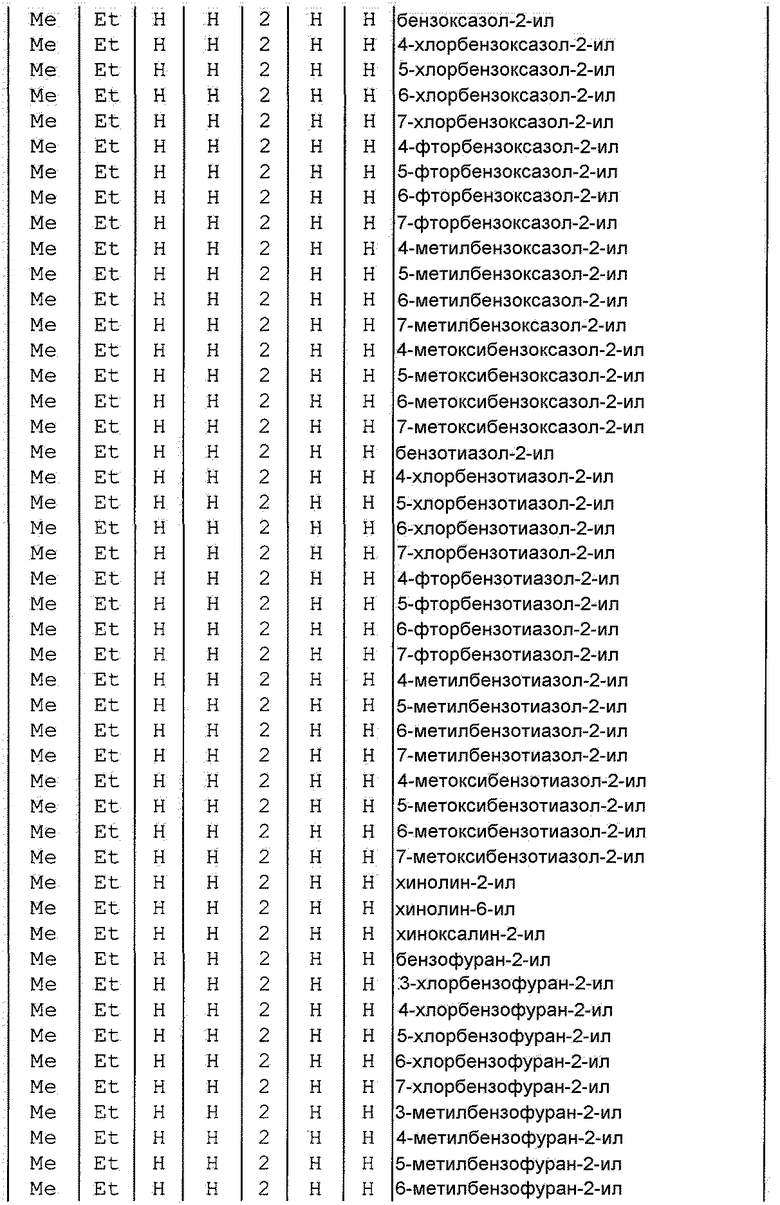
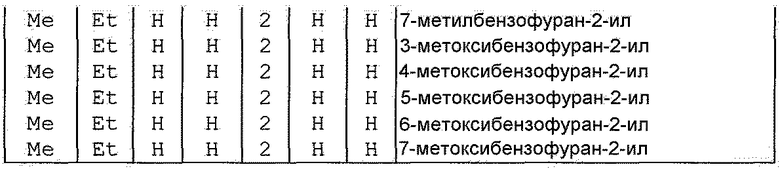
Изобретение относится к соединению общей формулы [1] или его фармацевтической приемлемой соли
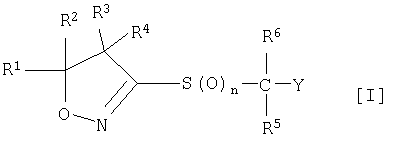
где R1 и R2 могут быть одинаковыми или разными и каждый из них представляет собой C1-С10-алкильную группу; R3 и R4 каждый представляет собой атом водорода; R5 и R6 могут быть одинаковыми или разными и каждый из них представляет собой атом водорода или C1-С10-алкильную группу; Y представляет собой 5-6-членную ароматическую гетероциклическую группу или конденсированную ароматическую гетероциклическую группу, содержащую один или несколько гетероатомов, выбранных из атома азота, атома кислорода и атома серы, причем гетероциклическая группа может быть замещена 0-6 одинаковыми или разными группами, выбранными из следующей группы заместителей α, и т.д.; n принимает целые значения от 0 до 2;
[группа заместителей α]: гидроксильная группа; атомы галогена; С1-С10-алкильные группы; C1-С10-алкильные группы, каждая из которых монозамещена группой, выбранной из следующей группы заместителей β; С1-С4-галогеналкильные группы; С3-С8-циклоалкильные группы; С1-С10-алкоксигруппы; C1-С10-алкоксигруппы, каждая из которых монозамещена группой, выбранной из следующей группы заместителей γ, и т.д. [группа заместителей β]: гидроксильная группа; С3-С8-циклоалкильные группы, которые могут быть замещены атомом галогена или алкильной группой; С1-С10-алкоксигруппы; С1-С10-алкилтиогруппы; С1-С10-алкилсульфонильные группы; C1-С10-алкоксикарбонильные группы; аминогруппа; карбамоильная группа (причем ее атом азота может быть замещен одинаковыми или разными C1-С10-алкильными группами); C1-С6-ацильные группы; С1-С10-алкоксииминогруппы; цианогруппа; необязательно замещенная фенильная группа; [группа заместителей γ]: необязательно замещенная фенильная группа; необязательно замещенные ароматические гетероциклические группы; цианогруппа. Также изобретение относится к гербициду, содержащему в качестве активного ингредиента производное изоксазолина формулы [I] или его фармацевтически приемлемую соль. Технический результат - производное изоксазолина, обладающее гербицидной активностью в отношении устойчивых сорняков, селективностью для культуры и сорняка, 2 н. и 16 з.п., 24 табл.
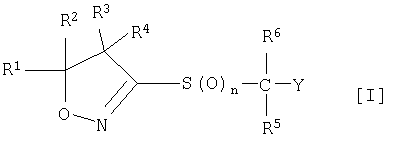
где R1 и R2 могут быть одинаковыми или разными и каждый из них представляет собой C1-С10-алкильную группу;
R3 и R4 каждый представляет собой атом водорода;
R5 и R6 могут быть одинаковыми или разными и каждый из них представляет собой атом водорода или C1-С10-алкильную группу;
Y представляет собой 5-6-членную ароматическую гетероциклическую группу или конденсированную ароматическую гетероциклическую группу, содержащую один или несколько гетероатомов, выбранных из атома азота, атома кислород и атома серы, причем гетероциклическая группа может быть замещена 0-6 одинаковыми или разными группами, выбранными из следующей группы заместителей α; когда гетероциклическая группа замещена в двух соседних положениях двумя алкильными группами, алкильной группой и алкоксигруппой, которые все выбраны из группы заместителей α, две группы могут образовывать вместе с атомами, с которыми они связаны, 5-8-членное кольцо, которое может быть замещено 1-4 атомами галогена; гетероатом гетероциклической группы, когда он представляет собой атом азота, может быть окислен до N-оксида;
n принимает целые значения от 0 до 2;
[группа заместителей α]:
гидроксильная группа; атомы галогена; C1-С10-алкильные группы; С1-С10-алкильные группы, каждая из которых монозамещена группой, выбранной из следующей группы заместителей β; С1-С4-галогеналкильные группы; С3-С8-циклоалкильные группы; C1-С10-алкоксигруппы; C1-С10-алкоксигруппы, каждая из которых монозамещена группой, выбранной из следующей группы заместителей γ; С1-С4-галогеналкоксигруппы; С3-С8-циклоалкилоксигруппы; С3-С8-циклоалкил-С1-С3-алкоксигруппы; C1-С10-алкилтиогруппы; С1-С10-алкилтиогруппы, каждая из которых монозамещена группой, выбранной из следующей группы заместителей у; С2-С6-алкенильные группы; С2-С6-алкенилоксигруппы; С2-С6-алкинильные группы; С2-С6-алкинилоксигруппы; С1-С10-алкилсульфонильные группы; необязательно замещенная фенильная группа; необязательно замещенная феноксигруппа; необязательно замещенные ароматические гетероциклические группы; необязательно замещенные фенилсульфонильные группы; ацильные группы; С1-С10-алкоксикарбонильные группы; цианогруппа; карбамоильная группа (причем ее атом азота может быть замещен одинаковыми или разными группами, выбранными из C1-С10-алкильных групп и необязательно замещенной фенильной группы); C1-С6-ацилоксигруппы; и аминогруппа (причем ее атом азота может быть замещен одинаковыми или разными группами, выбранными из С1-С10-алкильных групп);
[группа заместителей β]:
гидроксильная группа; С3-С8-циклоалкильные группы, которые могут быть замещены атомом галогена или алкильной группой; C1-С10-алкоксигруппы; С1-С10-алкилтиогруппы; C1-С10-алкилсульфонильные группы; С1-С10-алкоксикарбонильные группы; аминогруппа; карбамоильная группа (причем ее атом азота может быть замещен одинаковыми или разными C1-С10-алкильными группами); C1-С6-ацильные группы; C1-С10-алкоксииминогруппы; цианогруппа; необязательно замещенная фенильная группа;
[группа заместителей γ]:
необязательно замещенная фенильная группа; необязательно замещенные ароматические гетероциклические группы; цианогруппа.
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| ОРТОЗАМЕЩЕННЫЕ АМИДЫ 2-МЕТОКСИИМИНОФЕНИЛУКСУСНОЙ КИСЛОТЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СРЕДСТВО ДЛЯ БОРЬБЫ С ВРЕДОНОСНЫМИ ГРИБАМИ И ИНСЕКТОАКАРИЦИДНОЕ СРЕДСТВО | 1994 |
|
RU2130924C1 |
Авторы
Даты
2006-11-10—Публикация
2002-02-07—Подача