Область техники
Настоящее изобретение относится к способу получения соединения 5-алкокси-4-гидроксиметилпиразола, которое применимо в качестве промежуточного продукта для производства медицинского и сельскохозяйственного химического продукта, а также к новому соединению 5-алкокси-4-гидроксиметилпиразола, которое получают посредством указанного способа.
Уровень техники
Соединение 5-алкокси-4-гидроксиметилпиразола, получаемое посредством настоящего изобретения, применимо в качестве промежуточного продукта для производства медицинского и сельскохозяйственного химического продукта.
Неизвестны способы производства соединения 5-алкокси-4-гидроксиметилпиразола из соединения 5-гидроксипиразола в одну стадию.
Известен способ восстановления 5-алкокси-4-формилпиразола для получения соединения 5-алкокси-4-гидроксиметилпиразола (смотри патентную литературу 1). В данном способе, однако, поскольку для того, чтобы получить соединение 5-алкокси-4-гидроксиметилпиразола в качестве исходного материала применяют соединение 5-гидроксипиразола, требуются трехстадийные реакции; поэтому при производстве предполагаемого продукта производственный процесс и работа были сложными, требовалось длительное время, а общий выход предполагаемого продукта не был удовлетворительным.
Патентная литература 1: WO 2004-099157
Раскрытие настоящего изобретения
Задача, решаемая настоящим изобретением
Существует потребность в разработке способа получения соединения 5-алкокси-4-гидроксиметилпиразола, лишенного вышеупомянутых недостатков предшествующего уровня техники, с простыми производственным процессом и работой и выгодного по времени и выходу.
Способы решения задачи
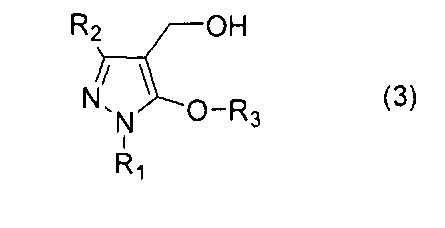
Принимая во внимание вышеуказанную ситуацию, настоящий изобретатель провел усиленное исследование способа производства соединения 5-алкокси-4-гидроксиметилпиразола. В результате было обнаружено, что соединение 5-алкокси-4-гидроксиметилпиразола, представленное общей формулой (3), показанной далее, образуется путем реакции соединения пиразола, представленного общей формулой (1), показанной далее, с соединением, представленным общей формулой (2), показанной далее, в присутствии основания и формальдегида. Данное открытие привело к доработке настоящего изобретения.
Эффект от настоящего изобретения
Способ настоящего изобретения делает возможным получение соединения 5-алкокси-4-гидроксиметилпиразола, представленного общей формулой (3), за одну стадию. Настоящий способ прост в производственном процессе и работе, выгоден по времени и выходу предполагаемого продукта при производстве в промышленном масштабе и чрезвычайно полезен в качестве промышленного способа производства соединения 5-алкокси-4-гидроксиметилпиразола.
Наилучший способ осуществления изобретения
Настоящее изобретение ниже описано подробно.
Настоящее изобретение решает вышеуказанную задачу путем предоставления изобретений с [1] по [21], показанных ниже.
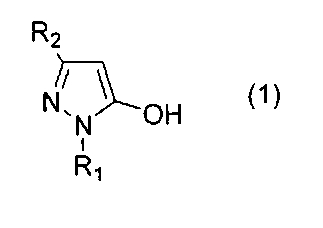
[1] Способ получения соединения 5-алкокси-4-гидроксиметилпиразола, представленного общей формулой (3)
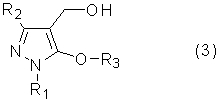
(где R1 представляет собой алкильную группу, арильную группу, которая может иметь заместитель, или гетероарильную группу, которая может иметь заместитель, R2 представляет собой электроноакцепторную группу, R3 представляет собой алкильную группу, которая может иметь заместитель, циклоалкильную группу, которая может иметь заместитель, циклоалкилалкильную группу, которая может иметь заместитель, алкенильную группу, которая может иметь заместитель, или алкинильную группу, которая может иметь заместитель), включающий реакцию соединения пиразола, представленного общей формулой (1)
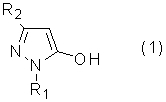
(где R1 и R2 определены выше), с соединением, представленным общей формулой (2)
L-R3 (2)
(где L представляет собой уходящую группу, а R3 определен выше), в присутствии основания и формальдегида.
[2] Способ получения соединения 5-алкокси-4-гидроксиметилпиразола в соответствии с [1], в котором уходящая группа, представленная L, представляет собой атом галогена, алкилсульфонилоксигруппу, галогеналкилсульфонилоксигруппу или бензолсульфонилоксигруппу, которая может иметь заместитель.
[3] Способ получения соединения 5-алкокси-4-гидроксиметилпиразола в соответствии с [1] или [2], в котором электроноакцепторная группа, представленная R2, представляет собой галогеналкильную группу, цианогруппу или алкоксикарбонильную группу.
[4] Способ получения соединения 5-алкокси-4-гидроксиметилпиразола в соответствии с [1] или [2], в котором электроноакцепторная группа, представленная R2, представляет собой (от моно- до трифтор)метильную группу.
[5] Способ получения соединения 5-алкокси-4-гидроксиметилпиразола в соответствии с [1] или [2], в котором электроноакцепторная группа, представленная R2, представляет собой трифторметильную группу.
[6] Способ получения соединения 5-алкокси-4-гидроксиметилпиразола в соответствии с [1] или [2], в котором электроноакцепторная группа, представленная R2, представляет собой цианогруппу.
[7] Способ получения соединения 5-алкокси-4-гидроксиметилпиразола в соответствии с [1] или [2], в котором электроноакцепторная группа, представленная R2, представляет собой (C1-C6алкокси)карбонильную группу.
[8] Способ получения соединения 5-алкокси-4-гидроксиметилпиразола в соответствии с [1] или [2], в котором электроноакцепторная группа, представленная R2, представляет собой этоксикарбонильную группу.
[9] Способ получения соединения 5-алкокси-4-гидроксиметилпиразола в соответствии с любым пунктом от [1] до [8], в котором уходящая группа, представленная L, представляет собой атом галогена.
[10] Способ получения соединения 5-алкокси-4-гидроксиметилпиразола в соответствии с любым пунктом от [1] до [9], в котором уходящая группа, представленная L, представляет собой атом галогена, а R3 представляет собой галогеналкильную группу.
[11] Способ получения соединения 5-алкокси-4-гидроксиметилпиразола в соответствии с любым пунктом от [1] до [8], в котором уходящая группа, представленная L, представляет собой атом хлора, а R3 представляет собой дифторметильную группу.
[12] Способ получения соединения 5-алкокси-4-гидроксиметилпиразола в соответствии с [1], в котором R1 представляет собой метильную группу, электроноакцепторная группа, представленная R2, представляет собой трифторметильную группу, а соединение, представленное общей формулой (2), представляет собой хлор(от моно- до тригалогензамещенный)метан.
[13] Способ получения соединения 5-алкокси-4-гидроксиметилпиразола в соответствии с [1], в котором R1 представляет собой метильную группу, электроноакцепторная группа, представленная R2, представляет собой трифторметильную группу, а соединение, представленное общей формулой (2), представляет собой хлордифторметан.
[14] Соединение 5-алкокси-4-гидроксиметилпиразола, представленное общей формулой (4)
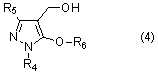
[где R4 представляет собой C1-C6 алкильную группу, арильную группу, которая может иметь заместитель, или гетероарильную группу, которая может иметь заместитель, R5 представляет собой C1-C6 галогеналкильную группу, цианогруппу или (C1-C6 алкокси)карбонильную группу, а R6 представляет собой C1-C6 алкильную группу, которая является незамещенной или замещенной галогеном, фенильной группой, цианогруппой или (C1-C6 алкокси)карбонильной группой, C3-C8 циклоалкильную группу, которая является незамещенной или замещенной галогеном, фенильной группой, цианогруппой или (C1-C6 алкокси)карбонильной группой, C2-C6 алкенильную группу, которая является незамещенной или замещенной галогеном, фенильной группой, цианогруппой или (C1-C6 алкокси)карбонильной группой, или C2-C6 алкинильную группу, которая является незамещенной или замещенной галогеном, фенильной группой, цианогруппой или (C1-C6 алкокси)карбонильной группой].
[15] Соединение 5-алкокси-4-гидроксиметилпиразола в соответствии с [14], где R5 представляет собой (от моно- до трифтор)метильную группу.
[16] Соединение 5-алкокси-4-гидроксиметилпиразола в соответствии с [14], где R5 представляет собой трифторметильную группу.
[17] Соединение 5-алкокси-4-гидроксиметилпиразола в соответствии с [14], где R5 представляет собой цианогруппу.
[18] Соединение 5-алкокси-4-гидроксиметилпиразола в соответствии с [14], где R5 представляет собой (C1-C6 алкокси)карбонильную группу.
[19] Соединение 5-алкокси-4-гидроксиметилпиразола в соответствии с [14], где R5 представляет собой этоксикарбонильную группу.
[20] Соединение 5-алкокси-4-гидроксиметилпиразола в соответствии с [14], где R4 представляет собой метильную группу, R5 представляет собой трифторметильную группу, а R6 представляет собой (от моно- до тригалогензамещенную)метильную группу.
[21] Соединение 5-алкокси-4-гидроксиметилпиразола в соответствии с [14], где R4 представляет собой метильную группу, R5 представляет собой трифторметильную группу, а R6 представляет собой дифторметильную группу.
Настоящие изобретения с [1] по [21] ниже описаны подробно.
Настоящее изобретение относится к способу получения соединения 5-алкокси-4-гидроксиметилпиразола, представленного общей формулой (3), который включает реакцию соединения пиразола, представленного общей формулой (1), с соединением, представленным общей формулой (2), в присутствии основания и формальдегида, а также к новому 5-алкокси-4-гидроксиметилпиразолу, который получают посредством указанного способа.
В первую очередь, описано соединение пиразола, представленное общей формулой (1), применяемое в настоящем изобретении в качестве исходного материала.
Соединение пиразола, представленное общей формулой (1), можно получить при помощи различных способов, описанных, например, в “Chemistry of Heterocyclic Compounds (written by Hiroshi Yamanaka and others)”, Chapter 5, 1988 (Kodansha Scientific); и “Handbook of Heterocyclic Chemistry, 2nd edition (written by J.A. Joule and K. Mills)”, Chapter 4.3.2.3, 2000 (Pergamon).
Известен, например, способ, который включает реакцию соответствующего соединения β-кетоэфира с соединением гидразина. Конкретно говоря, в Journal of Heterocyclic Chemistry, Vol. 27, p. 243 (1990) сообщалось, что посредством нагревания с обратным холодильником этил-4,4,4-трифторацетоацетата и метилгидразина в водном растворителе в течение 2 часов можно синтезировать 1-метил-5-гидрокси-3-трифторметилпиразол с выходом 49%.
Также описан, в JP-A-1998-287654, способ, который включает реакцию соединения диэфира щавелевоуксусной кислоты с соединением гидразина для получения соединения 3-(алкоксикарбонил)-5-гидроксипиразола и способ превращения алкоксикарбонильной группы соединения 3-(алкоксикарбонил)-5-гидроксипиразола, полученного при помощи вышеуказанного способа, в цианогруппу.
Также описан, в JP-B-1976-33556, способ, который включает реакцию соединения α-цианоянтарной кислоты с соединением соли диазония для получения соединения 3-циано-5-гидроксипиразола.
В качестве примера заместителя R1 общей формулы (1), представляющей соединение пиразола, применяемого в качестве исходного материала в настоящем изобретении, могут служить
алкильные группы, состоящие из 1-6 атомов углерода, с неразветвленной цепью или с разветвленной цепью (ниже атомы углерода, в случае, например, 1-6 атомов углерода, сокращенно обозначают как C1-C6), такие как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, втор-бутильная группа, трет-бутильная группа, н-пентильная группа, н-гексильная группа и тому подобные;
моноциклические или конденсированные арильные группы, такие как фенильная группа, нафтильная группа и тому подобные [арильные группы могут иметь, каждая, по меньшей мере один заместитель, выбранный из атомов галогенов (например, брома, хлора, фтора и йода), C1-C6 алкильных групп с неразветвленной цепью или с разветвленной цепью (например, метильной группы, этильной группы, н-пропильной группы, изопропильной группы, н-бутильной группы, втор-бутильной группы, трет-бутильной группы, н-пентильной группы и н-гексильной группы), гидроксильной группы, C1-C6 алкоксигрупп с неразветвленной цепью или с разветвленной цепью (например, метоксигруппы, этоксигруппы, н-пропоксигруппы и изопропоксигруппы), C1-C6 гидроксиалкильных групп с неразветвленной цепью или с разветвленной цепью (например, гидроксиметильной группы и 1-гидроксиэтильной группы), (с неразветвленной цепью или с разветвленной цепью C1-C6 алкокси)-(с неразветвленной цепью или с разветвленной цепью C1-C6 алкильных) групп (например, метоксиметильной группы, 1-метоксиэтильной группы и 1-этоксиэтильной группы), C1-C6 галогеналкильных групп с неразветвленной цепью или с разветвленной цепью (например, фторметильной группы, дифторметильной группы и трифторметильной группы), карбоксильной группы, солей металлов карбоксильной группы, типичными представителями которых являются соли щелочных металлов (например, соль натрия, соль калия и соль лития) или соли щелочноземельных металлов (например, соль кальция, соль бария и соль магния), (с неразветвленной цепью или с разветвленной цепью C1-C6 алкокси)карбонильных групп (например, метоксикарбонильной группы и этоксикарбонильной группы), нитрогруппы, аминогруппы, моно- или ди(C1-C6 алкил)аминогрупп с неразветвленной цепью или с разветвленной цепью (например, метиламиногруппы, диметиламиногруппы, этиламиногруппы и диэтиламиногруппы), (с неразветвленной цепью или с разветвленной цепью C1-C6 алкил)карбониламиногрупп (например, ацетиламиногруппы, пропиониламиногруппы и бутириламиногруппы), гидроксикарбонил(C1-C6 алкильных) групп с неразветвленной цепью или с разветвленной цепью (например, гидроксикарбонилметильной группы и 1-гидроксикарбонилэтильной группы), (с неразветвленной цепью или с разветвленной цепью C1-C6 алкокси)карбонил-(C1-C6 алкильных) групп (например, метоксикарбонилметильной группы, 1-метоксикарбонилэтильной группы и 1-этоксикарбонилэтильной группы), аминокарбонил-(C1-C6 алкильных) групп с неразветвленной цепью или с разветвленной цепью (например, аминокарбонилметильной группы и 1-аминокарбонилэтильной группы), (с неразветвленной цепью или с разветвленной цепью C1-C6 алкил)аминокарбонил-(с неразветвленной цепью или с разветвленной цепью C1-C6 алкильных) групп (например, метиламинокарбонилметильной группы, 1-метиламинокарбонилэтильной группы и 1-этиламинокарбонилэтильной группы), цианогруппы, и т.д.]; и
моноциклические или конденсированные гетероарильные группы, имеющие по меньшей мере один гетероатом, выбранный из атома азота, атома кислорода и атома серы, такие как пиридильная группа, тиенильная группа, оксазолильная группа, тиазолильная группа, изоксазолильная группа и тому подобные [гетероарильные группы могут иметь, каждая, по меньшей мере один заместитель, выбранный из C1-C6 алкильных групп с неразветвленной цепью или с разветвленной цепью (например, метильной группы, этильной группы, н-пропильной группы, изопропильной группы, н-бутильной группы, втор-бутильной группы, трет-бутильной группы, н-пентильной группы и н-гексильной группы), гидроксильной группы, C1-C6 алкоксигрупп с неразветвленной цепью или с разветвленной цепью (например, метоксигруппы, этоксигруппы, н-пропоксигруппы и изопропоксигруппы), C1-C6 гидроксиалкильных групп с неразветвленной цепью или с разветвленной цепью (например, гидроксиметильной группы и гидроксиэтильной группы), (с неразветвленной цепью или с разветвленной цепью C1-C6 алкокси)-(с неразветвленной цепью или с разветвленной цепью C1-C6 алкильных) групп (например, метоксиметильной группы, метоксиэтильной группы и этоксиэтильной группы), C1-C6 галогеналкильных групп с неразветвленной цепью или с разветвленной цепью (например, фторметильной группы, дифторметильной группы и трифторметильной группы), карбоксильной группы, солей металлов карбоксильной группы, типичными представителями которых являются соли щелочных металлов (например, соль натрия, соль калия и соль лития) или соли щелочноземельных металлов (например, соль кальция, соль бария и соль магния), (с неразветвленной цепью или с разветвленной цепью C1-C6 алкокси)карбонильных групп (например, метоксикарбонильной группы и этоксикарбонильной группы), атомов галогенов (например, брома, хлора, фтора и иода), нитрогруппы, аминогруппы, моно- или ди(C1-C6 алкил)аминогрупп с неразветвленной цепью или с разветвленной цепью (например, метиламиногруппы, диметиламиногруппы, этиламиногруппы и диэтиламиногруппы), (с неразветвленной цепью или с разветвленной цепью C1-C6 алкил)карбониламиногрупп (например, ацетиламиногруппы, пропиониламиногруппы и бутириламиногруппы), цианогруппы, формильной группы, (с неразветвленной цепью или с разветвленной цепью C1-C6 алкил)карбонильных групп (например, метилкарбонильной группы и этилкарбонильной группы), арилкарбонильных групп (например, бензоильной группы и нафтоильной группы), и т.д.]. В качестве примера заместителя R1 могут, кроме того, служить
арильные группы, имеющие по меньшей мере один заместитель, выбранный из (арил в вышеуказанном значении)-карбонильных групп (например, бензоильной группы и нафтоильной группы), (гетероарил в вышеуказанном значении)-карбонильных групп (например, пиридилкарбонильной группы, тиенилкарбонильной группы и фурилкарбонильной группы), и т.д.; и
гетероарильные группы, имеющие по меньшей мере один заместитель, выбранный из (гетероарил в вышеуказанном значении)-карбонильных групп (например, пиридилкарбонильной группы, тиенилкарбонильной группы и фурилкарбонильной группы), и т.д.
Под электроноакцепторной группой, представленной R2, общей формулы (1) имеется в виду группа (атомная группа), которая забирает электрон у другого атома или атомной группы реагента при помощи индуктивного эффекта, или арильная группа, замещенная атомной группой, которая забирает электрон у другого атома или атомной группы реагента при помощи индуктивного эффекта. В качестве конкретных примеров электроноакцепторной группы могут быть упомянуты C1-C6 галогеналкильные группы с неразветвленной цепью или с разветвленной цепью, такие как дифторметильная группа, трифторметильная группа и тому подобные; карбоксильная группа; соли металлов карбоксильной группы, типичными представителями которых являются соли щелочных металлов, такие как соль натрия, соль калия, соль лития и тому подобные, и соли щелочноземельных металлов, такие как соль кальция, соль бария, соль магния и тому подобные; (с неразветвленной цепью или с разветвленной цепью C1-C6 алкокси)карбонильные группы, такие как метоксикарбонильная группа, этоксикарбонильная группа и тому подобные; атомы галогенов, такие как бром, хлор, фтор, иод и тому подобные; нитрогруппа; формильная группа; (с неразветвленной цепью или с разветвленной цепью C1-C6 алкил)карбонильные группы, такие как метилкарбонильная группа, этилкарбонильная группа и тому подобные; арилкарбонильные группы, такие как бензоильная группа, нафтоильная группа и тому подобные; моноциклические или конденсированные гетероарилкарбонильные группы, имеющие от одного до четырех гетероатомов, выбранных из атома азота, атома кислорода и атома серы, такие как пиридилкарбонильная группа, тиенилкарбонильная группа, фурилкарбонильная группа и тому подобные; аминокарбонильная группа; моно- или ди(с неразветвленной цепью или с разветвленной цепью C1-C6 алкил)аминокарбонильные группы, такие как метиламинокарбонильная группа и диметиламинокарбонильная группа и тому подобные; и цианогруппа.
Поэтому в качестве конкретных примеров соединения пиразола, представленного общей формулой (1), могут быть упомянуты 5-гидрокси-1-метил-3-трифторметилпиразол, 3-этоксикарбонил-5-гидрокси-1-метилпиразол, 3-хлор-5-гидрокси-1-метилпиразол, 5-гидрокси-1-метил-3-нитропиразол, 5-гидрокси-1-метил-3-(2-тиофенкарбонил)пиразол, 5-гидрокси-1-метил-3-(3-пиридилкарбонил)пиразол, 3-диметиламинокарбонил-5-гидрокси-1-метилпиразол, 3-(4-диметиламинокарбонил)-5-гидрокси-1-метилфенилпиразол, 5-гидрокси-1-н-пропил-3-трифторметилпиразол, 3-циано-1-н-гексил-5-гидроксипиразол, 1-трет-бутил-5-гидрокси-3-трифторметилпиразол, 5-гидрокси-1-фенил-3-трифторметилпиразол, 3-циано-5-гидрокси-1-фенилпиразол, 1-(4-хлорфенил)-3-этоксикарбонил-5-гидроксипиразол, 3-этоксикарбонил-5-гидрокси-1-(2-метилфенил)пиразол, 3-этоксикарбонил-5-гидрокси-1-(2-метоксиметилфенил)пиразол, 1-(4-ацетилфенил)-3-этоксикарбонил-5-гидроксипиразол, 3-этоксикарбонил-5-гидрокси-1-(3-нитрофенил)пиразол, 5-гидрокси-1-(2-метоксифенил)-3-трифторметилпиразол, 5-гидрокси-3-трифторметил-1-(4-трифторметилфенил)пиразол, 1-(4-этоксикарбонилфенил)-5-гидрокси-3-трифторметилпиразол, 1-(4-диметиламинофенил)-5-гидрокси-3-трифторметилпиразол, 1-(4-ацетиламинофенил)-5-гидрокси-3-трифторметилпиразол, 1-(4-метоксикарбонилметилфенил)-5-гидрокси-3-трифторметилпиразол, 1-(4-диметиламинокарбонилметилфенил)-5-гидрокси-3-трифторметилпиразол, 1-(4-цианофенил)-5-гидрокси-3-трифторметилпиразол, 1-(2-нафтил)-5-гидрокси-3-трифторметилпиразол, 1-(2-бензотиазолил)-5-гидрокси-3-трифторметилпиразол, 5-гидрокси-1-(2-пиридил)-3-трифторметилпиразол, и 5-гидрокси-1-(2-пиримидил)-3-трифторметилпиразол.
Затем описано соединение, представленное общей формулой (2).
В качестве примера заместителя R3 общей формулы (2) могут служить
C1-C6 алкильные группы с неразветвленной цепью или с разветвленной цепью, такие как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, втор-бутильная группа, изобутил, трет-бутильная группа, н-пентильная группа, 1-метилбутильная группа, 2-метилбутильная группа, 3-метилбутильная группа, 1-этилпропильная группа, 1,1-диметилпропильная группа, 1,2-диметилпропильная группа, неопентильная группа, н-гексильная группа, 1-метилпентильная группа, 2-метилпентильная группа, 1-этилбутильная группа, 2-этилбутильная группа, 1,1-диметилбутильная группа, 1,2-диметилбутильная группа, 1,3-диметилбутильная группа, 2,2-диметилбутильная группа, 2,3-диметилбутильная группа, 3,3-диметилбутильная группа, 1,1,2-триметилпропильная группа, 1,2,2-триметилпропильная группа, 1-этил-1-метилпропильная группа, 1-этил-2-метилпропильная группа и тому подобные;
C3-C8 циклоалкильные группы, такие как циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа, циклогептильная группа, циклооктильная группа и тому подобные;
C4-C8 циклоалкилалкильные группы, такие как циклопропилметильная группа, 1-циклопропилэтильная группа, 2-циклопропилэтильная группа, 1-циклопропилпропильная группа, 2-циклопропилпропильная группа, 3-циклопропилпропильная группа, циклобутилметильная группа, циклопентилметильная группа, циклогексилметильная группа и тому подобные;
C2-C6 алкенильные группы с неразветвленной цепью или с разветвленной цепью, такие как винильная группа, 1-пропенильная группа, изопропенильная группа, 2-пропенильная группа, 1-бутенильная группа, 1-метил-1-пропенильная группа, 2-бутенильная группа, 1-метил-2-пропенильная группа, 3-бутенильная группа, 2-метил-1-пропенильная группа, 1,3-бутадиенильная группа, 1-пентенильная группа, 1-этил-2-пропенильная группа, 2-пентенильная группа, 1-метил-1-бутенильная группа, 3-пентенильная группа, 1-метил-2-бутенильная группа, 4-пентенильная группа, 1-метил-3-бутенильная группа, 3-метил-1-бутенильная группа, 1,2-диметил-2-пропенильная группа, 1,1-диметил-2-пропенильная группа, 2-метил-2-бутенильная группа, 3-метил-2-бутенильная группа, 1,2-диметил-1-пропенильная группа, 2-метил-3-бутенильная группа, 3-метил-3-бутенильная группа, 1,3-пентадиенильная группа, 1-винил-2-пропенильная группа, 1-гексенильная группа, 1-пропил-2-пропенильная группа, 2-гексенильная группа, 1-метил-1-пентенильная группа, 1-этил-2-бутенильная группа, 3-гексенильная группа, 4-гексенильная группа, 5-гексенильная группа, 1-метил-4-пентенильная группа, 1-этил-3-бутенильная группа, 1-(изобутил)винильная группа, 1-этил-1-метил-2-пропенильная группа, 1-этил-2-метил-2-пропенильная группа, 1-изопропил-2-пропенильная группа, 2-метил-2-пентенильная группа, 3-метил-3-пентенильная группа, 4-метил-3-пентенильная группа, 1,3-диметил-2-бутенильная группа, 1,1-диметил-2-бутенильная группа, 3-метил-4-пентенильная группа, 4-метил-4-пентенильная группа, 1,2-диметил-3-бутенильная группа, 1,3-диметил-3-бутенильная группа, 1,1,2-триметил-2-пропенильная группа, 1,5-гексадиенильная группа, 1-винил-3-бутенильная группа, 2,4-гексадиенильная группа и тому подобные; и
C2-C6 алкинильные группы с неразветвленной цепью или с разветвленной цепью, такие как этинильная группа, 1-пропинильная группа, 2-пропинильная группа, 1-бутинильная группа, 1-метил-2-пропинильная группа, 2-бутинильная группа, 3-бутинильная группа, 1-пентинильная группа, 1-этил-2-пропинильная группа, 2-пентинильная группа, 3-пентинильная группа, 1-метил-2-бутинильная группа, 4-пентинильная группа, 1-метил-3-бутинильная группа, 2-метил-3-бутинильная группа, 1-гексинильная группа, 1-(н-пропил)-2-пропинильная группа, 2-гексинильная группа, 1-этил-2-бутинильная группа, 3-гексинильная группа, 1-метил-2-пентинильная группа, 1-метил-3-пентинильная группа, 4-метил-1-пентинильная группа, 3-метил-1-пентинильная группа, 5-гексинильная группа, 1-этил-3-бутинильная группа, 1-этил-1-метил-2-пропинильная группа, 1,1-диметил-2-бутинильная группа, 2,2-диметил-3-бутинильная группа и тому подобные.
Каждая из вышеупомянутых C1-C6 алкильных групп с неразветвленной цепью или с разветвленной цепью, C3-C6 циклоалкильных групп, C4-C8 циклоалкилалкильных групп, C2-C6 алкенильных групп с неразветвленной цепью или с разветвленной цепью и C2-C6 алкинильных групп с неразветвленной цепью или с разветвленной цепью может иметь по меньшей мере один заместитель, выбранный из
атомов галогенов, таких как бром, хлор, фтор, иод и тому подобных;
C1-C6 алкоксигрупп с неразветвленной цепью или с разветвленной цепью, таких как метоксигруппа, этоксигруппа, н-пропоксигруппа, изопропоксигруппа, бутоксигруппа, пентилоксигруппа, гексилоксигруппа и тому подобные;
C1-C6 гидроксиалкильных групп с неразветвленной цепью или с разветвленной цепью, таких как гидроксиметильная группа, 1-гидроксиэтильная группа и тому подобные;
(с неразветвленной цепью или с разветвленной цепью C1-C6 алкокси)-(с неразветвленной цепью или с разветвленной цепью C1-C6 алкильных) групп, таких как метоксиметильная группа, этоксиэтильная группа, 1-метоксиэтильная группа, 1-метоксипропильная группа, 1-метоксибутильная группа, 1-этоксиэтильная группа, 1-этоксипропильная группа, 1-этоксибутильная группа, 1-метокси-2-метилпропильная группа и тому подобные;
C1-C6 галогеналкильных групп с неразветвленной цепью или с разветвленной цепью, таких как фторметильная группа, хлорметильная группа, бромметильная группа, дифторметильная группа, дихлорметильная группа, дибромметильная группа, трифторметильная группа, трихлорметильная группа, хлордифторметильная группа, бромдифторметильная группа, 2-фторэтильная группа, 1-хлорэтильная группа, 2-хлорэтильная группа, 1-бромэтильная группа, 2-бромэтильная группа, 2,2-дифторэтильная группа, 1,2-дихлорэтильная группа, 2,2-дихлорэтильная группа, 2,2,2-трифторэтильная группа, 2,2,2-трихлорэтильная группа, 1,1,2,2-тетрафторэтильная группа, пентафторэтильная группа, 2-бром-2-хлорэтильная группа, 2-хлор-1,1,2,2-тетрафторэтильная группа, 1-хлор-1,2,2,2-тетрафторэтильная группа, 1-хлорпропильная группа, 2-хлорпропильная группа, 3-хлорпропильная группа, 1-бромпропильная группа, 2-бромпропильная группа, 3-бромпропильная группа, 2-бром-1-метилэтильная группа, 3-иодпропильная группа, 2,3-дихлорпропильная группа, 2,3-дибромпропильная группа, 3,3,3-трифторпропильная группа, 3,3,3-трихлорпропильная группа, 3-бром-3,3-дифторпропильная группа, 3,3-дихлор-3-фторпропильная группа, 2,2,3,3-тетрафторпропильная группа, 1-бром-3,3,3-трифторпропильная группа, 2,2,3,3,3-пентафторпропильная группа, 2,2,2-трифтор-1-трифторметилэтильная группа, гептафторпропильная группа, 1,2,2,2-тетрафтор-1-трифторметилэтильная группа, 2,3-дихлор-1,1,2,3,3-пентафторпропильная группа, 2-хлорбутильная группа, 3-хлорбутильная группа, 4-хлорбутильная группа, 2-хлор-1,1-диметилэтильная группа, 4-бромбутильная группа, 3-бром-2-метилпропильная группа, 2-бром-1,1-диметилэтильная группа, 2,2-дихлор-1,1-диметилэтильная группа, 2-хлор-1-хлорметил-2-метилэтильная группа, 4,4,4-трифторбутильная группа, 3,3,3-трифтор-1-метилпропильная группа, 3,3,3-трифтор-2-метилпропильная группа, 2,3,4-трихлорбутильная группа, 2,2,2-трихлор-1,1-диметилэтильная группа, 4-хлор-4,4-дифторбутильная группа, 4,4-дихлор-4-фторбутильная группа, 4-бром-4,4-дифторбутильная группа, 2,4-дибром-4,4-дифторбутильная группа, 3,4-дихлор-3,4,4-трифторбутильная группа, 3,3-дихлор-4,4,4-трифторбутильная группа, 4-бром-3,3,4,4-тетрафторбутильная группа, 4-бром-3-хлор-3,4,4-трифторбутильная группа, 2,2,3,3,4,4-гексафторбутильная группа, 2,2,3,4,4,4-гексафторбутильная группа, 2,2,2-трифтор-1-метил-1-трифторметилэтильная группа, 3,3,3-трифтор-2-трифторметилпропильная группа, 2,2,3,3,4,4,4-гептафторбутильная группа, 2,3,3,3-тетрафтор-2-трифторметилпропильная группа, 1,1,2,2,3,3,4,4-октафторбутильная группа, нонафторбутильная группа, 4-хлор-1,1,2,2,3,3,4,4-октафторбутильная группа, 5-фторпентильная группа, 5-хлорпентильная группа, 5,5-дифторпентильная группа, 5,5-дихлорпентильная группа, 5,5,5-трифторпентильная группа, 6,6,6-трифторгексильная группа, 5,5,5,6,6,6-гексафторгексильная группа и тому подобные;
карбоксильной группы;
солей металлов карбоксильной группы, типичными представителями которых являются соли щелочных металлов, такие как соль натрия, соль калия, соль лития и тому подобные, или соли щелочноземельных металлов, такие как соль кальция, соль бария, соль магния и тому подобные;
(с неразветвленной цепью или с разветвленной цепью C1-C6 алкокси)карбонильных групп, таких как метоксикарбонильная группа, этоксикарбонильная группа, н-пропоксикарбонильная группа, изопропоксикарбонильная группа, трет-бутоксикарбонильная группа и тому подобные;
(с неразветвленной цепью или с разветвленной цепью C1-C6 алкил)карбонильных групп, таких как метилкарбонильная группа, этилкарбонильная группа, н-пропилкарбонильная группа, изопропилкарбонильная группа, трет-бутилкарбонильная группа и тому подобные;
моноциклических или конденсированных арильных групп, которые могут иметь заместитель, таких как фенильная группа, нафтильная группа и тому подобные;
моноциклических или конденсированных гетероарильных групп, которые могут иметь заместитель, имеющих от одного до четырех гетероатомов, выбранных из атома азота, атома кислорода и атома серы, типичными представителями которых являются пиридильная группа, тиенильная группа, оксазолильная группа, тиазолильная группа, изоксазолильная группа, и т.д.;
арилкарбонильных групп, таких как бензоильная группа, нафтоильная группа и тому подобные;
моноциклических или конденсированных гетероарилкарбонильных групп, имеющих от одного до четырех гетероатомов, выбранных из атома азота, атома кислорода и атома серы, таких как пиридилкарбонильная группа, тиенилкарбонильная группа, фурилкарбонильная группа и тому подобные;
и так далее.
L общей формулы (2) представляет собой уходящую группу и может представлять собой любой атом или атомную группу, если только он исполняет роль уходящей группы в настоящей реакции. В качестве ее конкретных примеров могут быть упомянуты
атомы галогенов, таких как хлор, бром, иод и тому подобные;
алкилсульфонилоксигруппы, такие как метансульфонилоксигруппа, этансульфонилоксигруппа и тому подобные;
галогеналкилсульфонилоксигруппы, такие как дифторметансульфонилоксигруппа, трифторметансульфонилоксигруппа и тому подобные; и
бензолсульфонилоксигруппы, которые могут иметь в качестве заместителя атом галогена или алкильную группу, такие как бензолсульфонилоксигруппа, 4-хлорбензолсульфонилоксигруппа, 4-метилбензолсульфонилоксигруппа и тому подобные.
Поэтому в качестве конкретных примеров соединения, представленного общей формулой (2), могут быть упомянуты метилхлорид, метилбромид, метилиодид, диметилсульфат, этилбромид, этилиодид, диэтилсульфат, н-пропилиодид, изопропилбромид, н-бутилбромид, втор-бутилиодид, изобутилиодид, трет-бутилиодид, 1-метилбутилбромид, 2-метилбутилиодид, 1-этилпропилбромид, 1,1-диметилпропилбромид, н-гексилиодид, 1-метилпентилиодид, 2-этилбутилиодид, 1,1-диметилбутилиодид, 1,2-диметилбутилиодид, 1,3-диметилбутилиодид, 3,3-диметилбутилиодид, 1,1,2-триметилпропилиодид, циклопропилметилиодид, 2-циклопропилпропилиодид, циклопентилметилбромид, циклопропилбромид, циклопентилбромид, циклогексилбромид, винилбромид, изопропенилбромид, 1-метил-1-пропенилбромид, 1-метил-3-бутенилбромид, 1-гексенилиодид, 1-этил-3-бутенилбромид, 1,1,2-триметил-2-пропенилбромид, этинилбромид, пропаргилбромид, 4-пентинилиодид, 2-гексинилиодид, 1-этил-2-бутенилбромид, 2-бромэтанол, 4-бром-н-бутанол, 1-бром-2-бутанол, хлорфторметан, хлордифторметан, 2,2,2-трифторбромэтан, 1,1,2,2-тетрафторбромэтан, 3,3,3-трифторпропилиодид, 3,3,3-трифторпропилбромид, 1,1,2,2,3,3,4,4,4-нонафторбутилбромид, 5,5,6,6,6-пентафторгексилбромид, метоксиметилбромид, этоксиметилбромид, изопропоксиметилиодид, хлоруксусная кислота, бромуксусная кислота, этилбромацетат, н-пропилбромацетат, изобутилбромацетат, бромацетон, иодацетон, α-хлорацетофенон, бензилбромид, 2-бромметилнафталин, 2-хлорметилпиридин, 2-бромметилфуран, п-толуолсульфонилметилпиран и 2-бромметилтиофен.
Затем описан способ производства соединения 5-алкокси-4-гидроксиметилпиразола, представленного общей формулой (3), который включает реакцию соединения пиразола, представленного общей формулой (1), с соединением, представленным общей формулой (2).
Формальдегид, используемый в реакции, может быть в любой форме. Однако для простого процесса предпочтительно использовать 35-50%-ный водный раствор формальдегида, типичным представителем которого является 35%-ный формалин (который свободно доступен как коммерческий продукт), или использовать параформальдегид (представляющий собой полимер формальдегида, при гидролизе образующий формальдегид в реакционной системе; поэтому его можно использовать в качестве эквивалента формальдегида).
Используемое количество формальдегида может представлять собой количество, по меньшей мере равное эквиваленту соединения пиразола, представленного общей формулой (1). Однако обыкновенно оно может составлять от 1,0 до 5,0 эквивалентов, предпочтительно от 1,0 до 3,0 эквивалентов по отношению к 1 молю соединения пиразола, представленного общей формулой (1).
Используемое количество соединения, представленного общей формулой (2), может представлять собой количество, по меньшей мере равное эквиваленту соединения пиразола, представленного общей формулой (1). Однако обыкновенно оно может составлять от 1,0 до 10,0 эквивалентов, предпочтительно от 1,0 до 3,0 эквивалентов по отношению к 1 молю соединения пиразола, представленного общей формулой (1).
В качестве основания, применяемого в настоящем изобретении, могут быть упомянуты неорганические основания, типичными представителями которых являются гидриды щелочных металлов (например, гидрид натрия, гидрид калия и гидрид лития), щелочные металлы (например, металлический натрий, металлический калий и металлический литий), гидроксиды щелочных металлов (например, гидроксид натрия, гидроксид калия и гидроксид лития), гидроксиды щелочноземельных металлов (например, гидроксид бария, гидроксид магния и гидроксид кальция), карбонаты щелочных металлов (например, карбонат натрия, карбонат калия, гидрокарбонат натрия и гидрокарбонат калия), оксиды щелочноземельных металлов (например, оксид бария, оксид магния и оксид кальция) и т.д.; и органические основания, типичными представителями которых являются алкоксиды металлов (например, метоксид натрия, этоксид натрия, метоксид калия, этоксид калия и трет-бутоксид калия), и алкилметалл, такой как н-бутиллитий и т.д. Однако предпочтительным является гидроксид щелочного металла или карбонат щелочного металла, и особенно предпочтительным является гидроксид натрия, гидроксид калия или карбонат калия.
Используемое количество основания может быть любым количеством, если только оно делает возможным удовлетворительное протекание настоящей реакции. Однако количество составляет, например, от 1,0 до 20 молей, предпочтительно от 3,0 до 10 молей на 1 моль соединения пиразола (исходное соединение), представленного общей формулой (1).
Растворитель, используемый в настоящей реакции, может представлять собой любой растворитель, если только он не мешает реакции. Могут быть упомянуты, например, вода; спирты, такие как метанол, этанол и тому подобные; ароматические углеводороды, такие как толуол, ксилол, хлорбензол и тому подобные; галогенированные алифатические углеводороды, такие как дихлорметан, хлороформ и тому подобные; апротонные полярные растворители, такие как диметилформамид (ДМФА), диметилацетамид, N-метилпирролидон, тетраметилмочевина, гексаметилфосфортриамид (ГМФА), пропиленкарбонат и тому подобные; эфирные растворители, такие как диэтиловый эфир, тетрагидрофуран, диоксан и тому подобные; и алифатические углеводороды, такие как пентан, н-гексан и тому подобные. Вода, спирт или апротонный полярный растворитель предпочтительны с точки зрения растворимости основания и реактивности, и вода или диметилформамид (ДМФА) особенно предпочтительны. Растворители можно применять по отдельности или в виде смешенного растворителя с любым соотношением компонентов.
Используемое количество растворителя может быть любым количеством, если только оно делает возможным удовлетворительное перемешивание реакционной системы. Однако оно обыкновенно составляет от 0,05 до 10 литров, предпочтительно от 0,5 до 2 литров на 1 моль соединения пиразола (исходное соединение), представленного общей формулой (1).
Температура реакции может составлять, например, от 0°C до температуры кипения используемого растворителя. Однако предпочтительно реакцию проводят при 20-50°C, а перемешивание при комнатной температуре особенно предпочтительно, поскольку оно является простым и дает хороший выход.
Что касается времени реакции, конкретные ограничения отсутствуют. Однако обыкновенно реакция завершается за 1-24 часа.
В настоящей реакции соединение 5-алкокси-4-гидроксиметилпиразола, представленное общей формулой (3), можно получать с хорошим выходом при простом процессе и мягких условиях. Полученное соединение 5-алкокси-4-гидроксиметилпиразола, представленное общей формулой (3), применимо в качестве промежуточного продукта для производства медицинского, сельскохозяйственного химического продукта, и т.д.
Затем описано настоящее соединение с [14] до [21].
Соединение настоящего изобретения представлено общей формулой (4)
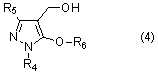
[где R4 представляет собой C1-C6 алкильную группу, арильную группу, которая может иметь заместитель, или гетероарильную группу, которая может иметь заместитель, R5 представляет собой C1-C6 галогеналкильную группу, цианогруппу или (C1-C6 алкокси)карбонильную группу, а R6 представляет собой C1-C6 алкильную группу, которая является незамещенной или замещенной галогеном, фенильной группой, цианогруппой или (C1-C6 алкокси)карбонильной группой, C3-C8 циклоалкильную группу, которая является незамещенной или замещенной галогеном, фенильной группой, цианогруппой или (C1-C6 алкокси)карбонильной группой, C2-C6 алкенильную группу, которая является незамещенной или замещенной галогеном, фенильной группой, цианогруппой или (C1-C6 алкокси)карбонильной группой, или C2-C6 алкинильную группу, которая является незамещенной или замещенной галогеном, фенильной группой, цианогруппой или (C1-C6 алкокси)карбонильной группой].
В качестве примера заместителя R4 общей формулы (4) могут служить
C1-C6 алкильные группы с неразветвленной цепью или с разветвленной цепью, такие как метильная группа, этильная группа, н-пропильная группа, изопропильная группа и тому подобные;
арильные группы, которые могут иметь заместитель, имеющий то же значение, что и заместитель R1; и
гетероарильные группы, которые могут иметь заместитель, имеющий то же значение, что и заместитель R1.
R5 общей формулы (4), в частности, включает
C1-C6 галогеналкильные группы с неразветвленной цепью или с разветвленной цепью, типичными представителями которых являются C1-C6 фторалкильные группы с неразветвленной цепью или с разветвленной цепью, такие как дифторметильная группа, трифторметильная группа, 1,2-дифторэтильная группа, 2,2-дифторэтильная группа, 2,2,2-трифторэтильная группа, 1,1,2,2-тетрафторэтильная группа, пентафторэтильная группа, 3,3,3-трифторпропильная группа, 2,2,3,3-тетрафторпропильная группа, 1,1,3,3,3-пентафторпропильная группа, 2,2,2-трифтор-1-трифторметилэтильная группа, гептафторпропильная группа и тому подобные;
цианогруппу; и
(с неразветвленной цепью или с разветвленной цепью C1-C6 алкокси)карбонильные группы, такие как метоксикарбонильная группа, этоксикарбонильная группа, н-пропоксикарбонильная группа, изопропоксикарбонильная группа, н-бутоксикарбонильная группа, 2-бутоксикарбонильная группа, изобутоксикарбонильная группа, н-пентилоксикарбонильная группа, неопентилоксикарбонильная группа, н-гексилоксикарбонильная группа, 2-метилпентилоксикарбонильная группа, 2-этилбутоксикарбонильная группа и тому подобные.
В качестве примера заместителя R6 могут служить
C1-C6 алкильные группы с неразветвленной цепью или с разветвленной цепью, такие как метильная группа, этильная группа, н-пропильная группа, изопропильная группа, н-бутильная группа, втор-бутильная группа, изобутильная группа, трет-бутильная группа, н-пентильная группа, 1-метилбутильная группа, 2-метилбутильная группа, 3-метилбутильная группа, 1-этилпропильная группа, 1,1-диметилпропильная группа, 1,2-диметилпропильная группа, неопентильная группа, н-гексильная группа, 1-метилпентильная группа, 2-метилпентильная группа, 1-этилбутильная группа, 2-этилбутильная группа, 1,1-диметилбутильная группа, 1,2-диметилбутильная группа, 1,3-диметилбутильная группа, 2,2-диметилбутильная группа, 2,3-диметилбутильная группа, 3,3-диметилбутильная группа, 1,1,2-триметилпропильная группа, 1,2,2-триметилпропильная группа, 1-этил-1-метилпропильная группа, 1-этил-2-метилпропильная группа и тому подобные;
C3-C8 циклоалкильные группы, такие как циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа, циклогептильная группа, циклооктильная группа и тому подобные;
C2-C6 алкенильные группы с неразветвленной цепью или с разветвленной цепью, такие как винильная группа, 1-пропенильная группа, изопропенильная группа, 2-пропенильная группа, 1-бутенильная группа, 1-метил-1-пропенильная группа, 2-бутенильная группа, 1-метил-2-пропенильная группа, 3-бутенильная группа, 2-метил-1-пропенильная группа, 1,3-бутадиенильная группа, 1-пентенильная группа, 1-этил-2-пропенильная группа, 2-пентенильная группа, 1-метил-1-бутенильная группа, 3-пентенильная группа, 1-метил-2-бутенильная группа, 4-пентенильная группа, 1-метил-3-бутенильная группа, 3-метил-1-бутенильная группа, 1,2-диметил-2-пропенильная группа, 1,1-диметил-2-пропенильная группа, 2-метил-2-бутенильная группа, 3-метил-2-бутенильная группа, 1,2-диметил-1-пропенильная группа, 2-метил-3-бутенильная группа, 3-метил-3-бутенильная группа, 1,3-пентадиенильная группа, 1-винил-2-пропенильная группа, 1-гексенильная группа, 1-пропил-2-пропенильная группа, 2-гексенильная группа, 1-метил-1-пентенильная группа, 1-этил-2-бутенильная группа, 3-гексенильная группа, 4-гексенильная группа, 5-гексенильная группа, 1-метил-4-пентенильная группа, 1-этил-3-бутенильная группа, 1-(изобутил)винильная группа, 1-этил-1-метил-2-пропенильная группа, 1-этил-2-метил-2-пропенильная группа, 1-изопропил-2-пропенильная группа, 2-метил-2-пентенильная группа, 3-метил-3-пентенильная группа, 4-метил-3-пентенильная группа, 1,3-диметил-2-бутенильная группа, 1,1-диметил-2-бутенильная группа, 3-метил-4-пентенильная группа, 4-метил-4-пентенильная группа, 1,2-диметил-3-бутенильная группа, 1,3-диметил-3-бутенильная группа, 1,1,2-триметил-2-пропенильная группа, 1,5-гексадиенильная группа, 1-винил-3-бутенильная группа, 2,4-гексадиенильная группа и тому подобные; и
C2-C6 алкинильные группы с неразветвленной цепью или с разветвленной цепью, такие как этинильная группа, 1-пропинильная группа, 2-пропинильная группа, 1-бутинильная группа, 1-метил-2-пропинильная группа, 2-бутинильная группа, 3-бутинильная группа, 1-пентинильная группа, 1-этил-2-пропинильная группа, 2-пентинильная группа, 3-пентинильная группа, 1-метил-2-бутинильная группа, 4-пентинильная группа, 1-метил-3-бутинильная группа, 2-метил-3-бутинильная группа, 1-гексинильная группа, 1-(н-пропил)-2-пропинильная группа, 2-гексинильная группа, 1-этил-2-бутинильная группа, 3-гексинильная группа, 1-метил-2-пентинильная группа, 1-метил-3-пентинильная группа, 4-метил-1-пентинильная группа, 3-метил-1-пентинильная группа, 5-гексинильная группа, 1-этил-3-бутинильная группа, 1-этил-1-метил-2-пропинильная группа, 1,1-диметил-2-бутинильная группа, 2,2-диметил-3-бутинильная группа и тому подобные.
Каждая из C1-C6 алкильных групп с неразветвленной цепью или с разветвленной цепью, C3-C8 циклоалкильных групп, C2-C6 алкенильных групп с неразветвленной цепью или с разветвленной цепью и C2-C6 алкинильных групп с неразветвленной цепью или с разветвленной цепью, представленных R6, может иметь по меньшей мере один заместитель, выбранный из атомов галогенов (например, брома, хлора, фтора и иода), фенильной группы, цианогруппы и (с неразветвленной цепью или с разветвленной цепью C1-C6 алкокси)карбонильных групп (например, метоксикарбонильной группы, этоксикарбонильной группы, н-пропоксикарбонильной группы, изопропоксикарбонильной группы, н-бутоксикарбонильной группы, 2-бутоксикарбонильной группы, изобутоксикарбонильной группы, н-пентилоксикарбонильной группы, неопентилоксикарбонильной группы, н-гексилоксикарбонильной группы, 2-метилпентилоксикарбонильной группы и 2-этилбутоксикарбонильной группы).
Типичные примеры соединения 5-алкокси-4-гидроксиметилпиразола, представленного общей формулой (4), настоящего изобретения показаны в таблице 1 и таблице 2. Однако соединение 5-алкокси-4-гидроксиметилпиразола, представленное общей формулой (4), настоящего изобретения не ограничено данными примерами. На номер каждого соединения даются ссылки в последующем описании.
В данном случае, сокращения, использованные в таблице 1 и таблице 2, имеют следующие значения.
Me: метильная группа
Et: этильная группа
n-Pr: н-пропильная группа
iPr: изопропильная группа
s-Bu: втор-бутильная группа
n-Pen: н-пентильная группа
c-Pen: циклопентильная группа
n-Hex: н-гексильная группа
Ph: фенильная группа
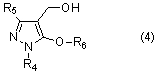
Примеры
Далее способ производства настоящего соединения конкретно описан при помощи примеров. Однако настоящее изобретение не ограничено данными примерами.
(Справочный пример 1)
Синтез 5-гидрокси-1-метил-3-трифторметилпиразола
92,1 г (0,5 моль) этил-4,4,4-трифторацетоацетата растворили в 60,1 г (1,0 моль) уксусной кислоты. Раствор охладили до 10°C или ниже при перемешивании. К нему по каплям добавили, за 1 час, 65,8 г (0,5 моль) 35%-ного водного раствора метилгидразина. После капельного добавления смесь перемешивали при комнатной температуре в течение 1 часа и затем при 80°C в течение 5 часов, чтобы вызвать реакцию. После реакции смесь охладили до комнатной температуры. К ней добавили 150 мл толуола, 600 мл воды и 48 г (1,2 моль) гидроксида натрия. После разделения фаз к водной фазе добавили 154 г (1,5 моль) 35%-ной соляной кислоты. Полученные кристаллы собрали при помощи фильтрации, промыли 50 мл воды дважды и высушили в сушилке с обогревом горячим воздухом, получив 71,8 г (выход 86,5%) названного соединения в виде светло-желтых кристаллов.
ЖХ-МС (ЭУ): m/z = 166 (M+)
Температура плавления: 179-180°C
(Справочный пример 2)
Синтез 5-гидрокси-1-фенил-3-трифторметилпиразола
18,4 г (0,1 моль) этил-4,4,4-трифторацетоацетата растворили в 12,0 г (0,2 моль) уксусной кислоты. Раствор охладили до 10°C или ниже при перемешивании. К нему по каплям добавили, за 0,5 часа, 11,8 г (0,11 моль) фенилгидразина. После капельного добавления смесь перемешивали при комнатной температуре в течение 1 часа и затем при 80°C в течение 5 часов, чтобы вызвать реакцию. После реакции смесь охладили до комнатной температуры. К ней добавили 100 мл воды. Полученные кристаллы собрали при помощи фильтрации, промыли 50 мл воды дважды и высушили в сушилке с обогревом горячим воздухом, получив 22,3 г (выход 98,0%) названного соединения в виде светло-желтых кристаллов.
ЖХ-МС (ЭУ): m/z = 228 (M+)
Температура плавления: 190-192°C
(Справочный пример 3)
Синтез 3-этоксикарбонил-5-гидрокси-1-метилпиразола
50,0 г (0,24 моль) соли диэтилоксалоацетата натрия суспендировали в 500 мл этанола. Туда же добавили 25 мл уксусной кислоты. Туда по каплям добавили при комнатной температуре за 0,5 часа при перемешивании 15 г (0,33 моль) 97%-ного метилгидразина. После капельного добавления смесь перемешивали при комнатной температуре в течение 2 часов и затем при температуре кипения в течение 5 часов. После охлаждения этанол отгоняли при пониженном давлении. К остатку добавили 200 мл этилацетата и 100 мл воды. После разделения фаз водный слой подвергли реэкстракции с помощью 50 мл этилацетата. Два этилацетатных слоя объединили и промыли 50 мл воды и 50 мл насыщенного водного раствора хлорида натрия в указанном порядке. Полученный слой этилацетата высушили над безводным сульфатом натрия и подвергли вакуумной перегонке, чтобы удалить растворитель. К полученным кристаллам добавили 100 мл воды. Кристаллы собрали при помощи фильтрации, промыли 10 мл воды и высушили в сушилке с обогревом горячим воздухом, получив 29,2 г (выход 71,8%) названного соединения в виде светло-желтых кристаллов.
ЖХ-МС (ЭУ): m/z = 170 (M+), 125 (основной)
Температура плавления: 151°C
(Справочный пример 4)
Синтез 3-циано-5-гидрокси-1-фенилпиразола
120 мл воды и 15 мл 35%-ной соляной кислоты добавили к 5,6 г (0,06 моль) анилина, чтобы получить раствор. Раствор охладили льдом до 0-5°C. К нему по каплям добавили, при перемешивании, 24 мл воды, в которой растворили 4,2 г (0,06 моль) нитрита натрия, после чего проводили перемешивание в течение 1 часа. Затем этот водный раствор соли диазония по каплям добавляли к 120 мл раствора пиридина, содержащего 10,2 г (0,06 моль) диэтил-α-цианосукцината, при перемешивании при охлаждении льдом. После капельного добавления смесь перемешивали в течение 1 часа при охлаждении льдом и затем в течение 1 часа при комнатной температуре, чтобы вызвать реакцию. После реакции добавили 240 мл 2%-ного водного раствора гидроксида натрия, затем следовало перемешивание в течение 2 часов. После этого реакционную смесь по каплям добавили к 240 мл 35%-ной соляной кислоты при охлаждении льдом. Полученные кристаллы собрали при помощи фильтрации, промыли 10 мл воды и высушили в сушилке с обогревом горячим воздухом, получив 8,4 г неочищенных красновато-коричневых кристаллов названного соединения. Неочищенные кристаллы перекристаллизовали из диэтилового эфира-петролейного эфира и высушили в сушилке с обогревом горячим воздухом, получив 5,7 г (выход 51,3%) названного соединения в виде светло-желтых кристаллов.
ЖХ-МС (ЭУ): m/z = 185 (M+), 125 (основной)
Температура плавления: 190°C
Пример 1
Синтез 5-дифторметокси-4-гидроксиметил-1-метил-3-трифторметилпиразола
16,6 г (0,10 моль) 5-гидрокси-1-метил-3-трифторметилпиразола, синтезированного в справочном примере 1, растворили в 35,0 г (0,15 моль) 24%-ного водного раствора гидроксида калия. К раствору, перемешиваемому при комнатной температуре, по каплям добавили 9,7 г (0,12 моль) 37%-ного раствора формалина, затем следовало перемешивание при той же температуре в течение 1 часа. После этого добавили 70,0 г (0,3 моль) 24%-ного водного раствора гидроксида калия и 100 мл ацетонитрила. Туда же вдули 17,3 г (0,20 моль) хлордифторметана при комнатной температуре за 2 часа, после чего следовало перемешивание при комнатной температуре в течение 2 часов, чтобы вызвать реакцию. После реакции органический слой, появившийся в результате разделения фаз, концентрировали при пониженном давлении, получая 26,5 г (чистота 82,0%, выход 88,2%) неочищенного раствора названного соединения. Неочищенный раствор подвергли вакуумной перегонке, получив названное соединение в виде бесцветного прозрачного раствора.
1H-ЯМР (300 МГц, ДМСО-d6): δ
7,23 (т, J=72 Гц, 1H), 5,29 (т, J=5,1 Гц, 1H),
4,36 (д, J=5,1 Гц, 2H), 3,77 (с, 3H) м.д.
ГХ-МС (ЭУ): m/z = 246 (M+), 177 (основной)
Температура кипения: 103-105°C/0,53 кПа
Пример 2
Синтез 4-гидроксиметил-5-метокси-1-метил-3-трифторметилпиразола
В 100 мл ДМФА суспендировали 16,6 г (0,10 моль) 5-гидрокси-1-метил-3-трифторметилпиразола, синтезированного в справочном примере 1, и 20,9 г (0,15 моль) карбоната калия. В эту суспензию, перемешиваемую при комнатной температуре, поместили 4,5 г (0,15 моль) параформальдегида, после чего следовало перемешивание при той же температуре в течение 1 часа. Затем добавили 41,8 г (0,30 моль) карбоната калия. Туда же по каплям добавили 42,6 г (0,30 моль) метилиодида, после чего следовало перемешивание при комнатной температуре в течение 2 часов, чтобы вызвать реакцию. После реакции добавили 200 мл этилацетата и 200 мл воды. Отделили органический слой, появившийся в результате разделения фаз. Водный слой подвергли реэкстракции с помощью 50 мл этилацетата. Два органических слоя объединили и промыли 50 мл воды, 30 мл насыщенного водного раствора хлорида аммония и 30 мл насыщенного водного раствора хлорида натрия в указанном порядке. Полученный органический слой высушивали над безводным сульфатом натрия и затем концентрировали при пониженном давлении, получая 24,9 г (чистота 67,5%, выход 79,0%) неочищенного раствора названного соединения. Неочищенный раствор подвергли вакуумной перегонке, получив названное соединение в виде светло-желтого прозрачного раствора.
1H-ЯМР (300 МГц, CDCl3): δ
4,60 (с, 2H), 4,13 (с, 3H), 3,69 (с, 3H), 2,02 (ушир., 1H) м.д.
ГХ-МС (ЭУ) m/z = 210 (M+), 193 (основной)
Температура кипения: 80-82°C/26,7 Па
Пример 3
Синтез 4-гидроксиметил-5-метокси-1-метил-3-трифторметилпиразола
В 100 мл ДМФА суспендировали 16,6 г (0,10 моль) 5-гидрокси-1-метил-3-трифторметилпиразола, синтезированного в справочном примере 1, и 20,9 г (0,15 моль) карбоната калия. В эту суспензию, перемешиваемую при комнатной температуре, поместили 4,5 г (0,15 моль) параформальдегида, после чего следовало перемешивание при той же температуре в течение 1 часа. Затем добавили 41,8 г (0,30 моль) карбоната калия. Туда же по каплям добавили 25,2 г (0,20 моль) диметилсульфата, затем следовало перемешивание при комнатной температуре в течение 2 часов, чтобы вызвать реакцию. После реакции добавили 200 мл этилацетата и 200 мл воды. Отделили органический слой, появившийся в результате разделения фаз. Водный слой подвергли реэкстракции с помощью 50 мл этилацетата. Два органических слоя объединили и промыли 50 мл воды, 30 мл насыщенного водного раствора хлорида аммония и 30 мл насыщенного водного раствора хлорида натрия в указанном порядке. Полученный органический слой высушивали над безводным сульфатом натрия и затем концентрировали при пониженном давлении, получая 23,5 г (чистота 75,4%, выход 84,3%) неочищенного раствора названного соединения. Неочищенный раствор подвергли вакуумной перегонке, получив названное соединение. Спектры данного соединения оказались идентичны приведенным в примере 2.
Пример 4
Синтез 5-этокси-4-гидроксиметил-1-метил-3-трифторметилпиразола
В 100 мл ДМФА суспендировали 16,6 г (0,10 моль) 5-гидрокси-1-метил-3-трифторметилпиразола, синтезированного в справочном примере 1, и 20,9 г (0,15 моль) карбоната калия. В эту суспензию, перемешиваемую при комнатной температуре, поместили 4,5 г (0,15 моль) параформальдегида, после чего следовало перемешивание при той же температуре в течение 1 часа. Затем добавили 41,8 г (0,30 моль) карбоната калия. Туда же по каплям добавили 21,8 г (0,20 моль) бромэтана. Реакционную смесь нагрели до 60°C и перемешивали в течение 8 часов, чтобы вызвать реакцию. После реакции добавили 200 мл этилацетата и 200 мл воды. Отделили органический слой, появившийся в результате разделения фаз. Водный слой подвергли реэкстракции с помощью 50 мл этилацетата. Два органических слоя объединили и промыли 50 мл воды, 30 мл насыщенного водного раствора хлорида аммония и 30 мл насыщенного водного раствора хлорида натрия в указанном порядке. Полученный органический слой высушивали над безводным сульфатом натрия и затем концентрировали при пониженном давлении, получая 22,5 г (чистота 82,7%, выход 83,0%) неочищенного раствора названного соединения. Неочищенный раствор подвергли вакуумной перегонке, получив названное соединение в виде бесцветного прозрачного раствора.
1H-ЯМР (300 МГц, CDCl3): δ
4,57 (с, 2H), 4,36 (кв, J=7,2 Гц, 2H), 3,71 (с, 3H),
1,73 (ушир., 1H), 1,43 (т, J=7,2 Гц, 3H) м.д.
ГХ-МС (ЭУ) m/z = 224 (M+), 177 (основной)
Температура кипения: 95-97°C/26,7 Па
Пример 5
Синтез 4-гидроксиметил-5-изопропилокси-1-метил-3-трифторметилпиразола
В 100 мл ДМФА суспендировали 16,6 г (0,10 моль) 5-гидрокси-1-метил-3-трифторметилпиразола, синтезированного в справочном примере 1, и 20,9 г (0,15 моль) карбоната калия. В эту суспензию, перемешиваемую при комнатной температуре, поместили 4,5 г (0,15 моль) параформальдегида, после чего следовало перемешивание при той же температуре в течение 1 часа. Затем добавили 41,8 г (0,30 моль) карбоната калия. Туда же по каплям добавили 36,9 г (0,30 моль) изопропилбромида. Реакционную смесь нагрели до 60°C и перемешивали в течение 12 часов, чтобы вызвать реакцию. После реакции добавили 200 мл этилацетата и 200 мл воды. Отделили органический слой, появившийся в результате разделения фаз. Водный слой подвергли реэкстракции с помощью 50 мл этилацетата. Два органических слоя объединили и промыли 50 мл воды, 30 мл насыщенного водного раствора хлорида аммония и 30 мл насыщенного водного раствора хлорида натрия в указанном порядке. Полученный органический слой высушивали над безводным сульфатом натрия и затем концентрировали при пониженном давлении, получая 21,7 г (чистота 59,4%, выход 53,5%) неочищенного раствора названного соединения. Неочищенный раствор подвергли вакуумной перегонке, получив названное соединение в виде светло-желтого прозрачного раствора.
1H-ЯМР (300 МГц, CDCl3): δ
4,7-4,6 (м, 1H), 4,53 (с, 2H), 3,71 (с, 3H),
1,85 (ушир., 1H), 1,38 (д, J=6,3 Гц, 6H) м.д.
ГХ-МС (ЭУ) m/z = 231 (M+), 178 (основной)
Температура кипения: 106-107°C/106,7 Па
Пример 6
Синтез 5-циклопентилокси-4-гидроксиметил-1-метил-3-трифторметилпиразола
В 100 мл ДМФА суспендировали 16,6 г (0,10 моль) 5-гидрокси-1-метил-3-трифторметилпиразола, синтезированного в справочном примере 1, и 20,9 г (0,15 моль) карбоната калия. В эту суспензию, перемешиваемую при комнатной температуре, поместили 4,5 г (0,15 моль) параформальдегида, после чего следовало перемешивание при той же температуре в течение 1 часа. Затем добавили 41,8 г (0,30 моль) карбоната калия. Туда же по каплям добавили 44,7 г (0,30 моль) циклопентилбромида. Реакционную смесь нагрели до 60°C, после чего следовало перемешивание в течение 12 часов, чтобы вызвать реакцию. После реакции добавили 200 мл этилацетата и 200 мл воды. Отделили органический слой, появившийся в результате разделения фаз. Водный слой подвергли реэкстракции с помощью 50 мл этилацетата. Два органических слоя объединили и промыли 50 мл воды, 30 мл насыщенного водного раствора хлорида аммония и 30 мл насыщенного водного раствора хлорида натрия в указанном порядке. Полученный органический слой высушивали над безводным сульфатом натрия и затем концентрировали при пониженном давлении, получая 41,9 г (чистота 42,2%, выход 67,0%) неочищенного раствора названного соединения. Неочищенный раствор подвергли вакуумной перегонке, получив названное соединение в виде светло-желтого прозрачного раствора.
1H-ЯМР (300 МГц, CDCl3): δ
5,0-5,1 (м, 1H), 4,56 (с, 2H), 3,68 (с, 3H),
2,19 (с, 1H), 1,9-1,6 (м, 8H) м.д.
ГХ-МС (ЭУ): m/z = 264 (M+), 178 (основной)
Температура кипения: 105-107°C/26,7 Па
Пример 7
Синтез 5-бензилокси-4-гидроксиметил-1-метил-3-трифторметилпиразола
16,6 г (0,10 моль) 5-гидрокси-1-метил-3-трифторметилпиразола, синтезированного в справочном примере 1, растворили в 35,0 г (0,15 моль) 24%-ного водного раствора гидроксида калия. К раствору, перемешиваемому при комнатной температуре, по каплям добавили 9,7 г (0,12 моль) 37%-ного раствора формалина, после чего следовало перемешивание при той же температуре в течение 1 часа. Затем добавили 70,0 г (0,3 моль) 24%-ного водного раствора гидроксида калия и 100 мл ацетонитрила. Туда же по каплям добавили 20,5 г (0,12 моль) бензилбромида при комнатной температуре за 1 час, после чего следовало перемешивание при комнатной температуре в течение 12 часов, чтобы вызвать реакцию. После реакции органический слой, появившийся в результате разделения фаз, концентрировали при пониженном давлении, получая 26,1 г (чистота 80,0%, выход 73,1%) неочищенного раствора названного соединения. Неочищенный раствор очистили посредством колоночной хроматографии с силикагелем (н-гексан:этилацетат = 5:1), получив названное соединение в виде светло-желтого прозрачного раствора.
1H-ЯМР (300 МГц, CDCl3): δ
7,4-7,3 (м, 5H), 5,28 (с, 2H), 4,56 (д, J=5,7 Гц, 2H),
3,51 (с, 3H), 1,74 (т, J=5,7 Гц, 1H) м.д.
ГХ-МС (ЭУ) m/z = 286 (M+), 91 (основной)
Пример 8
Синтез 5-этоксикарбонилметилокси-4-гидроксиметил-1-метил-3-трифторметилпиразола
В 100 мл ДМФА суспендировали 16,6 г (0,10 моль) 5-гидрокси-1-метил-3-трифторметилпиразола, синтезированного в справочном примере 1, и 20,9 г (0,15 моль) карбоната калия. В эту суспензию, перемешиваемую при комнатной температуре, поместили 4,5 г (0,15 моль) параформальдегида, после чего следовало перемешивание при той же температуре в течение 1 часа. Затем добавили 41,8 г (0,30 моль) карбоната калия. Туда же по каплям добавили 93,4 г (0,20 моль) этилбромацетата, после чего следовало перемешивание при комнатной температуре в течение 2 часов, чтобы вызвать реакцию. После реакции добавили 200 мл этилацетата и 200 мл воды. Отделили органический слой, появившийся в результате разделения фаз. Водный слой подвергли реэкстракции с помощью 50 мл этилацетата. Два органических слоя объединили и промыли 50 мл воды, 30 мл насыщенного водного раствора хлорида аммония и 30 мл насыщенного водного раствора хлорида натрия в указанном порядке. Полученный органический слой высушивали над безводным сульфатом натрия и затем концентрировали при пониженном давлении, получая 44,7 г (чистота 63,0%, выход 81,9%) неочищенного раствора названного соединения. Неочищенный раствор подвергли вакуумной перегонке, получив светло-желтый прозрачный раствор. К раствору добавили н-гексан. Полученные белые кристаллы собрали посредством фильтрования с отсасыванием, получив названное соединение в виде белых кристаллов.
1H-ЯМР (300 МГц, CDCl3): δ
5,18 (т, J=4,5 Гц, 1H), 5,06 (с, 2H),
4,19 (кв, J=7,2 Гц, 2H), 3,75 (с, 3H),
1,22 (т, J=7,2 Гц, 3H) м.д.
Температура кипения: 142°C/33,3 Па
Температура плавления: 57-59°C
Пример 9
Синтез 5-пропаргилокси-4-гидроксиметил-1-метил-3-трифторметилпиразола
В 100 мл ДМФА суспендировали 16,6 г (0,10 моль) 5-гидрокси-1-метил-3-трифторметилпиразола, синтезированного в справочном примере 1, и 20,9 г (0,15 моль) карбоната калия. В эту суспензию, перемешиваемую при комнатной температуре, поместили 4,5 г (0,15 моль) параформальдегида, после чего следовало перемешивание при той же температуре в течение 1 часа. Затем добавили 41,8 г (0,30 моль) карбоната калия. Туда же по каплям добавили 23,8 г (0,20 моль) пропаргилбромида. Реакционную смесь нагрели до 60°C и перемешивали в течение 2 часов, чтобы вызвать реакцию. После реакции добавили 200 мл этилацетата и 200 мл воды. Отделили органический слой, появившийся в результате разделения фаз. Водный слой подвергли реэкстракции с помощью 50 мл этилацетата. Два органических слоя объединили и промыли 50 мл воды, 30 мл насыщенного водного раствора хлорида аммония и 30 мл насыщенного водного раствора хлорида натрия в указанном порядке. Полученный органический слой высушивали над безводным сульфатом натрия и затем концентрировали при пониженном давлении, получая 31,2 г (чистота 36,9%, выход 49,2%) неочищенного раствора названного соединения. Неочищенный раствор подвергли вакуумной перегонке, получив названное соединение в виде светло-желтого прозрачного раствора.
1H-ЯМР (300 МГц, CDCl3): δ
4,95 (д, J=2,4 Гц, 2H), 4,61 (с, 2H),
3,77 (с, 3H), 2,63 (т, J=2,4 Гц, 1H), 1,78 (с, 1H) м.д.
ГХ-МС (ЭУ) m/z = 234 (M+), 203 (основной)
Температура кипения: 99-101°C/133,3 Па
Пример 10
Синтез 5-дифторметокси-4-гидроксиметил-1-фенил-3-трифторметилпиразола
22,8 г (0,10 моль) 5-гидрокси-1-фенил-3-трифторметилпиразола, синтезированного в справочном примере 2, растворили в 35,0 г (0,15 моль) 24%-ного водного раствора гидроксида калия. К раствору, перемешиваемому при комнатной температуре, по каплям добавили 9,7 г (0,12 моль) 37%-ного раствора формалина, после чего следовало перемешивание при той же температуре в течение 1 часа. Затем добавили 70,0 г (0,3 моль) 24%-ного водного раствора гидроксида калия и 100 мл ацетонитрила. Туда же вдули 17,3 г (0,20 моль) хлордифторметана при комнатной температуре за 2 часа, после чего следовало перемешивание при комнатной температуре в течение 2 часов, чтобы вызвать реакцию. После реакции органический слой, появившийся в результате разделения фаз, концентрировали при пониженном давлении, получая 28,0 г (чистота 93,6%, выход 84,9%) неочищенного раствора названного соединения. Неочищенный раствор очистили посредством колоночной хроматографии с силикагелем (н-гексан:этилацетат = 5:1), получив названное соединение в виде белых кристаллов.
1H-ЯМР (300 МГц, CDCl3): δ
7,6-7,4 (м, 5H), 6,67 (т, J=72 Гц, 1H),
4,68 (д, J=5,7 Гц, 2H), 1,91 (т, J=5,7 Гц, 1H) м.д.
ГХ-МС (ЭУ) m/z = 308 (M+), 77 (основной)
Температура плавления: 57-59°C
Пример 11
Синтез 3-этоксикарбонил-5-дифторметокси-4-гидроксиметил-1-метилпиразола
В 50 мл ДМФА суспендировали 8,5 г (0,05 моль) 3-этоксикарбонил-5-гидрокси-1-метилпиразола, синтезированного в справочном примере 3, и 10,5 г (0,08 моль) карбоната калия. В эту суспензию, перемешиваемую при комнатной температуре, поместили 2,3 г (0,08 моль) параформальдегида, после чего следовало перемешивание при той же температуре в течение 1 часа. Затем добавили 20,9 г (0,15 моль) карбоната калия. Туда же вдули 8,6 г (0,10 моль) хлордифторметана. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, чтобы вызвать реакцию. После реакции добавили 200 мл этилацетата и 200 мл воды. Отделили органический слой, появившийся в результате разделения фаз. Водный слой подвергли реэкстракции 50 мл этилацетата трижды. Органические слои объединили и промыли 50 мл воды, 30 мл насыщенного водного раствора хлорида аммония и 30 мл насыщенного водного раствора хлорида натрия в указанном порядке. Полученный органический слой высушивали над безводным сульфатом натрия и затем концентрировали при пониженном давлении, получая 24,3 г (чистота 42,2%, выход 82,0%) неочищенного раствора названного соединения. Неочищенный раствор очистили посредством колоночной хроматографии с силикагелем (н-гексан:этилацетат = 1:1), получив названное соединение в виде белых кристаллов.
1H-ЯМР (300 МГц, CDCl3): δ
6,61 (кв, J=71,7 Гц, 1H), 4,62 (д, J=6,9 Гц, 2H),
4,46 (т, J=7,2 Гц, 2H), 3,84 (с, 3H),
3,62 (т, J=6,9 Гц, 1H), 1,43 (т, J=7,2 Гц, 3H) м.д.
ГХ-МС (ЭУ) m/z = 250 (M+), 153 (основной)
Температура плавления: 90-91°C
Пример 12
Синтез 3-циано-5-дифторметокси-4-гидроксиметил-1-фенилпиразола
18,5 г (0,10 моль) 3-циано-5-гидрокси-1-фенилпиразола, синтезированного в справочном примере 4, растворили в 35,0 г (0,15 моль) 24%-ного водного раствора гидроксида калия. К раствору, перемешиваемому при комнатной температуре, по каплям добавили 9,7 г (0,12 моль) 37%-ного раствора формалина, после чего следовало перемешивание при той же температуре в течение 1 часа. Затем добавили 70,0 г (0,3 моль) 24%-ного водного раствора гидроксида калия и 100 мл ацетонитрила. Туда же вдули 17,3 г (0,20 моль) хлордифторметана при комнатной температуре за 2 часа, после чего следовало перемешивание при комнатной температуре в течение 2 часов, чтобы вызвать реакцию. После реакции органический слой, появившийся в результате разделения фаз, концентрировали при пониженном давлении, получая 24,6 г (чистота 70,6%, выход 65,5%) неочищенного раствора названного соединения. Неочищенный раствор очистили посредством колоночной хроматографии с силикагелем (н-гексан:этилацетат = 3:1), получив названное соединение в виде белых кристаллов.
1H-ЯМР (300 МГц, CDCl3): δ
7,6-7,4 (м, 5H), 4,72 (д, J=5,1 Гц, 2H),
2,10 (т, J=5,1 Гц, 1H) м.д.
ГХ-МС (ЭУ) m/z = 265 (M+), 77 (основной)
Температура плавления: 71-72°C
Промышленная применимость
Настоящее изобретение предлагает новый способ промышленного получения соединения 5-алкокси-4-гидроксиметилпиразола. В соответствии с настоящим способом соединение 5-алкокси-4-гидроксиметилпиразола образуется из соединения пиразола, представленного общей формулой (1), без применения специального реактора, или дорогостоящего катализатора, или переходного металла, за одну стадию при простом производственном процессе в мягких условиях с хорошим выходом. Более того, настоящий способ не образует вредных отходов от катализатора или переходного металла и имеет значительное промышленное значение.
Дополнительные экспериментальные данные
Ссылочный Пример А: Получение 4-хлорметил-5-дифторметокси-1-метил-3-трифторметилпиразол
116,6 г ацетонитрильного раствора 5-дифторметокси-4-гидроксиметил-1-метил-3-трифторметилпиразола (чистота: 84,4%, 0.40 моль) разбавляли путем добавления 320 мл ацетонитрила, в качестве растворителя. Затем при перемешивании в течение 1 часа добавляли по каплям 26,6 г (0,44 моль) тионилхлорида при охлаждении водой, таким образом, что температура реакционной смеси не повышалась выше 20°C. После добавления реакционную смесь дополнительно выдерживали в течение 30 минут при 25°C. После подтверждения завершения реакции реакционную смесь барботирировали азотом в течение 30 минут для удаления избытка тионилхлорида и кислотного компонента, образованного в течение реакции. Получали 336 г красновато-коричневого ацетонитрильного раствора соединения, указанного в заголовке.
Ссылочный Пример В: Получение 3-[(5-дифторметокси-1-метил-3-трифторметилпиразол-4-ил)метансульфонил]-5,5-диметил-4,5-дигидроизоксазола (известное соединение, раскрытое в документе WO 2004/013106 (Ссылочный Пример 3))
188 г ацетонитрильного раствора 4-хлорметил-5-дифторметокси-1-метил-3-трифторметилпиразола, полученного в Ссылочном Примере А (соответствующего 0,20 моль) охлаждали до 10°C или ниже путем перемешивания со льдом. После этого добавляют 183,3 г (чистота: 30%, 0,22 моль) водного раствора гидрохлорида [5,5-диметил-(4,5-дигидроизоксазол-3-ил)]тиокарбоксамидина, с последующим добавлением по каплям 83,3 г (1,0 моль) 48%-ного водного раствора гидроксида натрия в течение 30 минут, таким образом, что температура реакционной смеси не повышалась выше 10°C. После добавления реакционную смесь дополнительно выдерживали в течение 30 минут при 10°C, с последующим нагреванием до 25°C, и выдерживали в течение 4 часов. После завершения реакции, водный слой отделяли и удаляли с получением 181,8 г красновато-коричневого ацетонитрильного раствора соединения, указанного в заголовке (концентрация: 37,2%, анализированный методом ВЭЖХ, общий выход Ссылочного примера А и Ссылочного Примера В составил 94,1%).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНОГО ЭНДО-9-АЗАБИЦИКЛО[3.3.1]НОНАН-3-ОЛА | 2014 |
|
RU2639150C2 |
| БЛОКАТОР КАЛЬЦИЕВЫХ КАНАЛОВ Т-ТИПА | 2004 |
|
RU2326886C2 |
| ПИРИДАЗИНОВОЕ СОЕДИНЕНИЕ И ГЕРБИЦИД | 2020 |
|
RU2817020C2 |
| 7-ОКСА-3,4-ДИАЗАБИЦИКЛО[4.1.0]ГЕПТ-4-ЕН-2-ОНОВОЕ СОЕДИНЕНИЕ И ГЕРБИЦИД | 2020 |
|
RU2818255C2 |
| ИНСЕКТИЦИД, АКАРИЦИД И НЕМАТОЦИД, СОДЕРЖАЩИЕ В КАЧЕСТВЕ АКТИВНОГО КОМПОНЕНТА ПРОИЗВОДНОЕ 3-ТРИАЗОЛИЛФЕНИЛСУЛЬФИДА | 2005 |
|
RU2394819C2 |
| СОЕДИНЕНИЕ ФЕНОКСИМОЧЕВИНЫ И СРЕДСТВО ДЛЯ БОРЬБЫ С ВРЕДИТЕЛЯМИ | 2019 |
|
RU2753005C1 |
| (ГЕТЕРО)АРИЛИМИДАЗОЛЬНОЕ СОЕДИНЕНИЕ И СРЕДСТВО ДЛЯ БОРЬБЫ С ВРЕДНЫМИ ОРГАНИЗМАМИ | 2019 |
|
RU2813202C2 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ГИДРОКСИ-4-ТИОМЕТИЛПИРАЗОЛЬНОГО СОЕДИНЕНИЯ | 2005 |
|
RU2386619C2 |
| ПРОИЗВОДНОЕ ТЕТРАЗОЛИЛГИДРОКСИИМИНА, СПОСОБ ЕГО ОЧИСТКИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2013 |
|
RU2581828C2 |
| ПРОИЗВОДНОЕ БЕНЗИМИДАЗОЛА ИЛИ ЕГО СОЛЬ, СЕЛЬСКОХОЗЯЙСТВЕННОЕ И САДОВОДЧЕСКОЕ ИНСЕКТИЦИДНОЕ И АКАРИЦИДНОЕ СРЕДСТВО, СОДЕРЖАЩЕЕ УКАЗАННОЕ СОЕДИНЕНИЕ, И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 2019 |
|
RU2807181C2 |
Настоящее изобретение относится к способу получения соединения 5-алкокси-4-гидроксиметилпиразола, представленного общей формулой (3), где R1 представляет собой С1-С6 алкильную группу или фенильную группу, R2 представляет собой С1-С6 галогеналкильную группу, цианогруппу или (С1-С6 алкокси)карбонильную группу и R3 представляет собой С1-С6 алкильную группу, которая может быть незамещенной или замещенной галогеном, фенильной группой или (С1-С6 алкокси)карбонильной группой, С3-С8 циклоалкилалкильную группу, С2-С6 алкенильную группу или С2-С6 алкинильную группу. Предложенный способ включает реакцию соединения пиразола, представленного общей формулой (1), с соединением, представленным общей формулой (2), где L представляет собой уходящую группу, и формальдегидом в присутствии основания, где R1, R2 и R3 имеют значения, указанные выше. Изобретение также относится к новым соединениям 5-алкокси-4-гидроксиметилпиразола. Технический результат - предложенный способ позволяет простым образом и с высокой эффективностью получать соединения 5-алкокси-4-гидроксиметилпиразола, которые являются промежуточными соединениями для получения гербицидов. 2 н. и 18 з.п. ф-лы, 2 табл., 4 спр. пр., 12 пр.
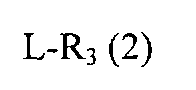
1. Способ получения соединения 5-алкокси-4-гидроксиметилпиразола, представленного общей формулой (3)
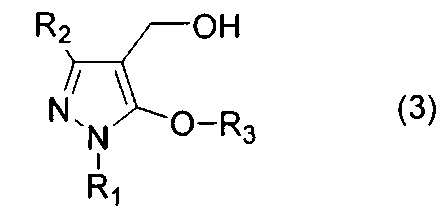
где R1 представляет собой С1-С6 алкильную группу или фенильную группу, R2 представляет собой С1-С6 галогеналкильную группу, цианогруппу или (С1-С6 алкокси)карбонильную группу, и R3 представляет собой С1-С6 алкильную группу, которая может быть незамещенной или замещенной галогеном, фенильной группой или (С1-С6 алкокси)карбонильной группой, С3-С8 циклоалкилалкильную группу, С2-С6 алкенильную группу или С2-С6 алкинильную группу, включающий реакцию соединения пиразола, представленного общей формулой (1)
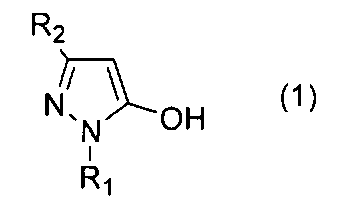
где R1 и R2 определены выше,
с соединением, представленным общей формулой (2)
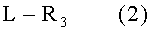
где L представляет собой уходящую группу, a R3 определен выше и формальдегидом в присутствии основания.
2. Способ получения соединения 5-алкокси-4-гидроксиметилпиразола по п.1, в котором L представляет собой атом галогена, алкилсульфонилоксигруппу, галогеналкилсульфонилоксигруппу или бензолсульфонилоксигруппу, которая может иметь заместитель.
3. Способ получения соединения 5-алкокси-4-гидроксиметилпиразола по п.1 или 2, в котором R2 представляет собой (от моно- до трифтор)метильную группу.
4. Способ получения соединения 5-алкокси-4-гидроксиметилпиразола по п.1 или 2, в котором R2 представляет собой трифторметильную группу.
5. Способ получения соединения 5-алкокси-4-гидроксиметилпиразола по п.1 или 2, в котором R2 представляет собой цианогруппу.
6. Способ получения соединения 5-алкокси-4-гидроксиметилпиразола по п.1 или 2, в котором R2 представляет собой (С1-С6 алкокси)карбонильную группу.
7. Способ получения соединения 5-алкокси-4-гидроксиметилпиразола по п.1 или 2, в котором R2 представляет собой этоксикарбонильную группу.
8. Способ получения соединения 5-алкокси-4-гидроксиметилпиразола по п.1, в котором L представляет собой атом галогена.
9. Способ получения соединения 5-алкокси-4-гидроксиметилпиразола по п.1, в котором L представляет собой атом галогена, a R3 представляет собой галогеналкильную группу.
10. Способ получения соединения 5-алкокси-4-гидроксиметилпиразола по п.9, в котором L представляет собой атом хлора, a R3 представляет собой дифторметильную группу.
11. Способ получения соединения 5-алкокси-4-гидроксиметилпиразола по п.1, в котором R1 представляет собой метильную группу, R2 представляет собой трифторметильную группу, а соединение, представленное общей формулой (2), представляет собой хлор(от моно- до тригалогензамещенный)метан.
12. Способ получения соединения 5-алкокси-4-гидроксиметилпиразола по п.1, в котором R1 представляет собой метильную группу, R2 представляет собой трифторметильную группу, а соединение, представленное общей формулой (2), представляет собой хлордифторметан.
13. Соединение 5-алкокси-4-гидроксиметилпиразола, представленное общей формулой (4)
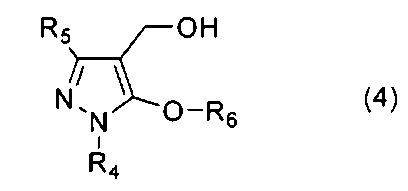
где R4 представляет собой С1-С6 алкильную группу или фенильную группу, R5 представляет собой С1-С6 галогеналкильную группу, цианогруппу или (С1-С6 алкокси)карбонильную группу, и R6 представляет собой С1-С6 алкильную группу, которая может быть незамещенной или замещенной галогеном, фенильной группой, или (С1-С6 алкокси)карбонильной группой, С3-С8 циклоалкильную группу, С2-С6 алкенильную группу или С2-С6 алкинильную группу.
14. Соединение 5-алкокси-4-гидроксиметилпиразола по п.13, где R5 представляет собой (от моно- до трифтор)метильную группу.
15. Соединение 5-алкокси-4-гидроксиметилпиразола по п.13, где R5 представляет собой трифторметильную группу.
16. Соединение 5-алкокси-4-гидроксиметилпиразола по п.13, где R5 представляет собой цианогруппу.
17. Соединение 5-алкокси-4-гидроксиметилпиразола по п.13, где R5 представляет собой (С1-С6 алкокси)карбонильную группу.
18. Соединение 5-алкокси-4-гидроксиметилпиразола по п.13, где R5 представляет собой этоксикарбонильную группу.
19. Соединение 5-алкокси-4-гидроксиметилпиразола по п.13, где R4 представляет собой метильную группу, R5 представляет собой трифторметильную группу, a R6 представляет собой (от моно- до тригалогензамещенную)метильную группу.
20. Соединение 5-алкокси-4-гидроксиметилпиразола по п.13, где R4 представляет собой метильную группу, R5 представляет собой трифторметильную группу, a R6 представляет собой дифторметильную группу.
| RU 2005105585 А, 27.08.2005 | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
Авторы
Даты
2012-05-27—Публикация
2007-02-08—Подача