Изобретение относится к области медицины и может быть использовано в оториноларингологии для лечения гнойного воспаления верхнечелюстной пазухи (гайморит) у взрослых и детей.
Фотодинамическое лечение относится к так называемой “фотодинамической терапии” (ФДТ). Фотосенсибилизаторы (ФС) находят применение при фотодинамической терапии в качестве терапевтических средств.
Известны способы лечения острого и обострения хронического гнойного гайморита, когда для освобождения пазухи от гнойного содержимого делают пункцию специальной иглой (игла Куликовского) и пазуху отмывают от гноя стерильным физиологическим раствором или раствором какого-либо антисептика (фурацилин) с последующим введением (инстилляция) в нее антибактериальных препаратов, или иных фармацевтических средств, способствующих ликвидации воспалительного процесса [1]. Однако такой способ лечения после однократного, а порой и многократного промывания пазухи с последующей инстилляцией лекарственного вещества достаточно часто не дает желаемого положительного эффекта, т.е. не приводит к излечению заболевания (гнойный гайморит), что заставляет врача вновь и вновь прибегать к пункциям верхнечелюстной пазухи и массированному антибактериальному лечению.
Известен также способ хирургического лечения (гайморотомия) гнойного гайморита, особенно часто применяемый при хронической форме данного заболевания, когда консервативное лечение с неоднократно повторяемыми пункциями приводит к непродолжительной ремиссии или вообще неэффективно. Положительный эффект от проведения данного способа лечения основан на том, что путем вскрытия верхнечелюстной пазухи из нее удаляют по возможности всю слизистую оболочку, что должно способствовать прекращению гнойного воспалительного процесса [2]. Однако и этот способ не гарантирует полного излечения, т.к. известны случаи рецидива гнойного воспаления и после радикальной операции на верхнечелюстной пазухе (по данным различных авторов до 30%).
К вышесказанному необходимо добавить, что на сегодня все известные способы лечения гнойного воспаления верхнечелюстной пазухи (гайморит) осуществляют с обязательным использованием антибиотиков, которые воздействуют не только строго локально в очаге воспаления, но и на весь организм в целом, нередко приводя к развитию аллергических реакций. Если же антибиотики применяют без учета чувствительности к ним микрофлоры очага воспаления, то это приводит к развитию привыкания и повышению резистентности со стороны патогенных микробов, что в свою очередь способствует хронизации воспалительного процесса.
Недостатки описанных способов лечения гайморита привели к необходимости поставить и решить задачу поиска эффективного, безопасного и быстрого терапевтического способа воздействия на измененную слизистую оболочку гайморовой пазухи.
Данная задача решена путем создания способа лечения острого и хронического гнойного гайморита путем воздействия на очаг воспаления фотодинамической реакции, при котором в целях полной санации гайморовой пазухи, сокращения сроков лечения и предотвращения рецидивов заболевания в верхнечелюстную (гайморову) пазуху вводят фотосенсибилизатор и проводят обработку слизистой оболочки фотосенсибилизатором (инкубация) с последующим облучением стенок пазухи лазерным излучением. В качестве фотосенсибилизатора используют порфирины хлоринового ряда и облучение ведут лазерным излучением длиной волны 654-670 нм, мощностью 0,10-0,35 Вт в течение 10-60 мин до достижения дозы облучения 10-1000 Дж/см2.
Предлагаемое изобретение принципиально отличается от всех известных, как по способу воздействия на очаг гнойного воспаления, так и по конечному результату от проводимого лечения. В основе предлагаемого способа лежит принцип взаимодействия двух компонентов, каждый из которых в отдельности малоэффективен или не эффективен вообще. В данном случае эффект от лечения наступает в результате фотохимической реакции, инициированной взаимодействием ФС, введенного в очаг воспаления, с лазерным излучением с длиной волны, совпадающей с длиной волны пика поглощения данного ФС. Данный метод успешно применяют для лечения опухолевых заболеваний, однако, в последнее время появились работы, указывающие на возможность успешного применения ФДТ при лечении гнойных ран [5, 6]. Однако не известно использование метода ФДТ для лечения гнойного гайморита.
Используемые в настоящем изобретении лазеры имеют длину волны излучения в диапазоне 654-670 нм (в каждом конкретном случае совпадающую с максимумом поглощения препарата ±3 нм, что важно для эффективной генерации активных частиц), характеризуются наличием полупроводниковых компонентов генерации излучения (повышенная надежность и стабильность длины волны излучения), малым весом и габаритными размерами (удобство эксплуатации).
В качестве фотосенсибилизатора может быть использован ФС “Радахлорин” [3] или ФС “Фотохлорин II” [4], время инкубации может составлять 2 ч, а в качестве лазерного излучения может использоваться излучение длиной волны 654-670 нм, мощностью 0,10-0,35 Вт в течение 10-60 мин однократно.
ФС “Радахлорин” характеризуется тем, что он включает щелочную соль-13-карбокси-17[2-карбоксиэтил]-15-карбоксиметил-17,18-транс-дигидро-3-винил-8-этил-2,7,12,18-тетраметилпорфирина (хлорина е6) формулы
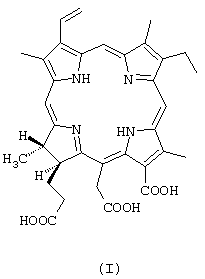
в количестве 80-90%; щелочную соль 13-карбокси-17-[2-карбоксиэтил]-15-формил-17,18-транс-дигидро-3-винил-8-этил-2,7,12,18-тетраметилпорфирина (пурпурина 5) формулы
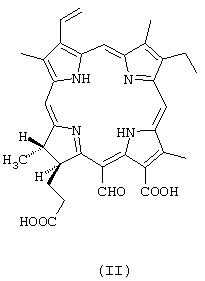
в количестве 5-20%; а также щелочную соль 13-карбокси-17-[2-карбоксиэтил]-15-карбокси-17,18-транс-дигидро-3-винил-8-этил-2,7,12,18-тетраметилпорфирина (хлорина р6) формулы
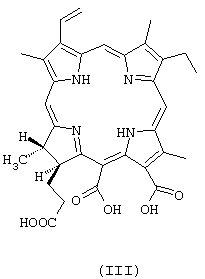
в количестве - остальное.
ФС “Фотохлорин II” характеризуется тем, что он включает щелочную соль 13-карбокси-17-[2-карбоксиэтил]-15-карбоксиметил-17,18-транс-дигидро-3-[1-этоксиэтил]-8-этил-2,7,12,18-тетраметилпорфирина (2-дезвинил-2-[1-этоксиэтил]хлорина е6) формулы
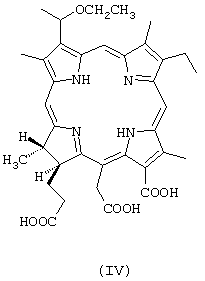
Эти ФС могут быть использованы в форме водного раствора.
В качестве щелочного металла может быть использован натрий или калий.
Физико-химические свойства ФС описаны в примерах 1, 2. Биологическую активность ФС оценивают in vitro и in vivo (примеры 3-7).
ФС “Радахлорин” и “Фотохлорин II” с точки зрения физической химии обладают способностью поглощать свет в видимой области, результатом чего является их фотоактивация и последующая релаксация возбужденного состояния с переносом энергии на растворенный в тканях молекулярный кислород и органические субстраты. Последнее приводит к окислительным и свободно-радикальным процессам в биологических тканях, способствуя их освобождению от патогенных микроорганизмов. Наиболее предпочтительной полосой возбуждения является длинноволновая полоса, т.к. с ростом длины волны растет проникающая способность света в биологические ткани.
Таким образом, ФС “Радахлорин” и “Фотохлорин II” способны разрушать микроорганизмы и асептически действовать на биологические ткани после возбуждения светом с длиной волны 654-670 нм на глубину до 10 мм. (см. табл.1).
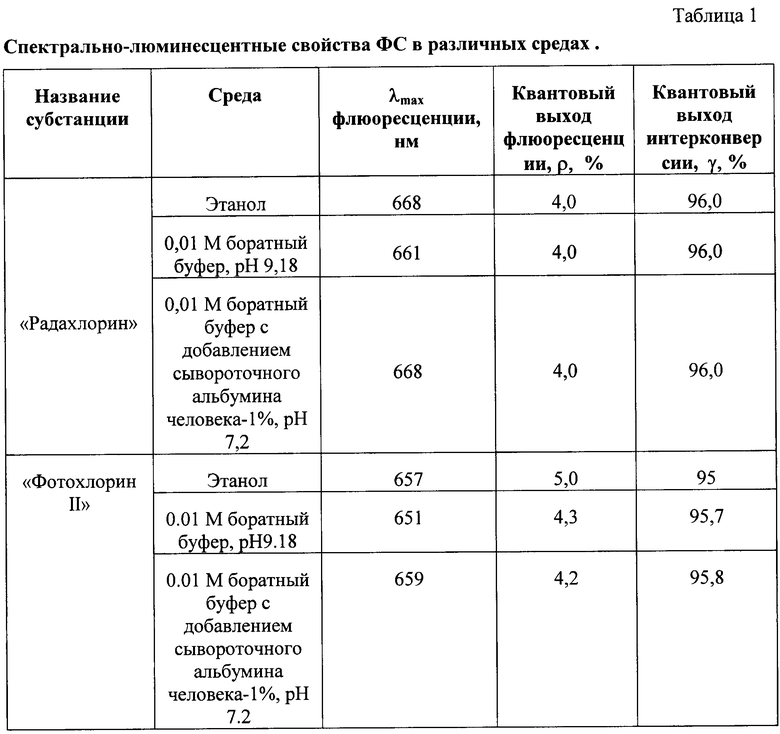
Сбалансированность ФС по амфифильности подтверждают стандартным экспериментом in vitro [7] (Таблица 2, Пример 2). Коэффициент распределения ФС в 1-октаноле/фосфатном буфере, рН 7,4 (Кр), равен 1,40 для “Радахлорина” и 2,40 для “Фотохлорина II”. Это означает, что заявляемые ФС одинаково хорошо растворимы как в водной, так и в липидной фазе, и доказывает липофильность ФС, которая позволяет им перераспределяться из воды в плазматические мембраны бактериальных клеток, быстро проникать в клетки и накапливаться в цитоплазматических внутриклеточных мембранах и микросомах, либо проникать в клетки путем диффузии через плазматическую мембрану этих клеток.
Таким образом, ФС “Радахлорин” и “Фотохлорин II” обладают способностью селективно накапливаться в инфицированных очагах, наряду с выраженной фотодинамической активностью.

Для исследования дозовозависимой цитофототоксической (после облучения лазером) и биологической "темновой" активности ФС используют МТТ-тест, который позволяет точно определить число живых клеток после их обработки ФС и облучения лазером для расчета цитотоксического и цитофототоксического индексов ФС. Этот же тест позволяет оценить дозовозависимую цитотоксическую и биологическую "темновую" активность ФС [8]. При длительном действии “Радахлорина” в концентрации 5 μМ на клетки в темноте выживало 96,5-86,2% PC-12. В этих же условиях синтез ДНК у клеток PC-12 практически не изменялся. В целом для ФС в отсутствие облучения более характерно проявление цитотоксической активности, чем индукция пролиферативной. После лазерного облучения клеток, обработанных ФС, наблюдается их гибель. Обнаружено дозозависимое цитофототоксическое действие препарата, что позволяет рассчитать EC50, т.е. определить концентрацию ФС, при которой погибает 50% клеток. Эти данные приведены в таблице 2. Следует отметить, что ФС, у которых ЕС50 меньше 20 μМ, считают эффективными для подавления бактериальных культур. Исследованная линия клеток высокочувствительна к действию лазерного облучения после их обработки ФС (данные МТТ-теста). При определении генофототоксичности после обработки клеток 5 μM ФС и облучения лазером получают резкое снижение синтеза ДНК (на 96,5% по сравнению с только облученным контролем) у клеток.
Таким образом, ФС являются высокоцитофототоксичными препаратами. В высоких концентрациях (>5 μМ) они являются умеренными ингибиторами клеточного роста и без облучения. Высокая генофототоксичность ФС позволяет считать их сильными ингибиторами бактериального роста при облучении [8-10].
Антибактериальную активность ФС подтверждали результатами, полученными в экспериментах in vitro.
Возбудителями острого и хронического гайморита являются грамположительные (стрептококки, стафилококки, пневмококки) и грамотрицательные (Hemophilus influenzae, Moraxella catarrhalis) бактерии, а также дрожжевые грибы рода Candida.
Поскольку грамотрицательные бактерии и дрожжевые грибы гораздо более устойчивы к фотодинамическим воздействиям по сравнению с грамположительными бактериями [12-14], определение эффективности фотосенсибилизатора и отработка режимов фотодинамического воздействия проводились на тест-системах грамотрицательных бактерий (Пример 3) и дрожжевых грибов рода Candida (Пример 4).
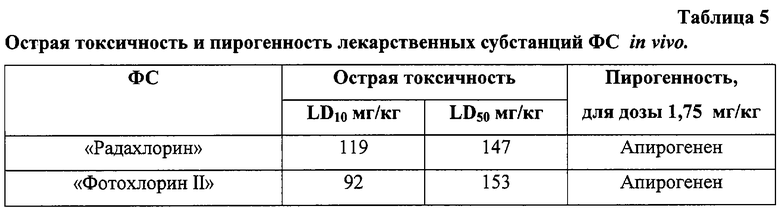
В экспериментах in vivo изучают токсические свойства ФС [8] (Пример 5). LD50 составляет в среднем, с учетом весового коэффициента, для “Радахлорина”, 147 мг/кг, а доза, вызывающая гибель 10% испытуемых животных (LD10), составляет 119 мг/кг. Проведенные исследования позволяют классифицировать оба ФС как “Малотоксичные вещества”.
Для активации ФС используют лазерный диодный модуль для фотодинамической терапии ML500-SP (“ЛАХТА”), разработанный фирмой ЗАО "МИЛОН ЛАЗЕР" (г. Санкт-Петербург) [11]. Этот модуль имеет мощность 2,5 Вт в волокне 250 мкм с апертурой 0,22 и максимум длины волны излучения 662±3 нм. Также может быть использован лазерный диодный модуль для фотодинамической и лазерной терапии “Санни 662/810”, разработанный ООО "СИГМ ПЛЮС" (г. Москва). Модуль имеет до трех каналов (мощностью 1,2 или 2,5 Вт каждый, в волокне 250 мкм, с апертурой 0,22) и максимумы длин волн излучения 656±3 нм, 662±3 нм, 808±3 нм. В целом, для активации ФС могут использоваться любые лазеры мощностью не менее 0,1 Вт с максимумом длины волны излучения 654-670 нм и оснащенные разъемом для подключения оптоволоконного световода, который может иметь на конце как прямой торец, так и цилиндрический диффузор различной длины.
Величину подаваемой энергии варьируют от 60 до 1260 Дж (0,10-0,35 Вт в течение 10-60 мин). При мощности лазерного излучения менее 0,10 Вт процедура ФДТ становится чрезмерно продолжительной. При световых дозах более 1250 Дж наблюдается значительное повреждение здоровой ткани, ведущее к увеличению периода ее регенерации.
Предлагаемый способ лечения осуществляется следующим образом. При наличии гнойного процесса (острого или хронического) в верхнечелюстной (гайморовой) пазухе, последнюю освобождают от содержимого (слизь и гной) путем проведения пункции стандартной методикой с последующим промыванием пазухи стерильным физиологическим раствором. После того, как промывная жидкость становится чистой (на глаз - ad oculus), пазуху с помощью шприца продувают воздухом, освобождая от жидкости, и вводят в нее 10 мл раствора ФС. Затем иглу Куликовского извлекают из пунктируемой пазухи и ватным тампоном туго тампонируют общий носовой ход в целях предотвращения вытекания раствора ФС, после чего больного укладывают на одноименный бок в кровать. Таким образом, находясь в горизонтальном положении больной проводит два часа, меняя попеременно позу (на боку - на спине), но не вставая и не ложась на живот и противоположный бок. Через два часа, когда ФС максимально проникает в поверхностные слои эпителия и оставшиеся в пазухе микробы, больного вновь пунктируют, но при этом в пазуху на игле Куликовского вводят дренаж, через который пазуху еще раз тщательно промывают физраствором и продувают. На завершающем этапе процедуры в пазуху через дренаж вводят кварц-полимерное волокно (световод), по которому транслируют лазерное излучение и облучают слизистую оболочку пазухи в течение того времени, которое требуется для достижения необходимой дозы, при которой начинается и идет фотохимическая реакция (10-1000 Дж/см2). Набор дозы облучения во времени может проходить поэтапно с небольшими (20-30 с) перерывами, во время которых пазуху продувают, освобождая последнюю от скапливающейся слизи. По окончании лазерного облучения световод извлекают, оставляя в пазухе дренажную трубку. Через эту дренажную трубку в последующие 3-5 дней после сеанса ФДТ ежедневно осуществляют промывание облученной пазухи стерильным физраствором, т.к. в эти сроки (дни) обычно наблюдается ответная на ФДТ реакция в виде обильного слизевыделения. Если же пазуху оставлять без дренажа и не пунктировать в указанные дни, у больного возможно развитие асептического воспаления с выраженным гипертензионным синдромом (отек и боль в области пазухи). При последнем промывании пазухи осуществляют бактериологический контроль.
Пример 1. Описание физико-химических свойств ФС.
ФС представляет собой жидкость черного цвета, в тонком слое приобретающую зеленый оттенок, с характерным запахом.
Раствор “Радахлорина” в этиловом спирте имеет желто-зеленый цвет, а “Фотохлорина II” - ярко-зеленый. При прохождении через слой раствора световых лучей от лампы медицинской синей марки МДС 220-75 (ТУ 16.535.376-79) в защищенном от света месте, раствор приобретает рубиново-красную окраску.
Для подтверждения подлинности к 10 мл раствора ФС прибавляют разбавленный раствор соляной кислоты до выпадения осадка ФС, который отфильтровывают, высушивают в вакууме над пятиокисью фосфора в течение 12 ч и снимают ПМР-, масс-спектры и спектр поглощения в диапазоне длин волн 360-720 нм.
Спектр ПМР ФС “Радахлорин”: (в ДМСО-D6, конц. раствор): 9,64, 9, 55, 9,52, 9,39, 8,90, 8,79 (с, мезо-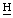 хлорина е6 и пурпурина 5), 8,09, 8,04, 7,97, 7,92 (2д, С
хлорина е6 и пурпурина 5), 8,09, 8,04, 7,97, 7,92 (2д, С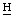 =СН2 хлорина е6 и пурпурина 5), 6,84 (с, γ-мезо-С
=СН2 хлорина е6 и пурпурина 5), 6,84 (с, γ-мезо-С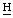 О пурпурина 5), 6,37, 6,32, 6,13, 6,10 (2д, СН=С
О пурпурина 5), 6,37, 6,32, 6,13, 6,10 (2д, СН=С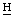 2), 5.43 (2s, γ-мезо–С
2), 5.43 (2s, γ-мезо–С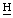 2СООН), 4,60 (м, 7-
2СООН), 4,60 (м, 7-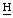 ), 4,45 (м, 8-
), 4,45 (м, 8-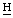 ), 3.80, 3,56 (кх2, 4-С
), 3.80, 3,56 (кх2, 4-С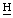 2СН3), 3.75, 3,64, 3,51, 3,46, 3,29, 3,23 (с, ядерные С
2СН3), 3.75, 3,64, 3,51, 3,46, 3,29, 3,23 (с, ядерные С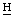 3 хлорина е6 и пурпурина 5), 2,38, 2,32 (2м, 7-С
3 хлорина е6 и пурпурина 5), 2,38, 2,32 (2м, 7-С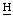 2СН2СООН), 2,71, 2,20 (2м, 7-С
2СН2СООН), 2,71, 2,20 (2м, 7-С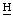 2СН2СООН), 1,76 (д, 8-С
2СН2СООН), 1,76 (д, 8-С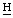 3), 1,72 (т, 4-СН2С
3), 1,72 (т, 4-СН2С 3), - 1,63, - 1,91 (2c, 2N
3), - 1,63, - 1,91 (2c, 2N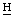 ) м.д.
) м.д.
Масс-спектр “Радахлорина”: e.i., M+ (%), 596 (16,0), 566 (9,4), 508 (100,0), 494 (7,3), 447 (9,4), 435 (50,6), 421 (12,8), 405 (6,9), 254 (7,4).
Спектр поглощения “Радахлорина” в видимой области: λ (ε) (этанол), 386 (22310), 406 (113040), 506 (14870), 536 (8925), 608 (7437), 662 (34220).
Согласно спектру ПМР, в субстанции содержится 80% хлорина е6, 15% пурпурина 5 и 5% хлорина р6 (минорные сигналы при 9,25, 9,10, 8,71, 7,84, 3,55, 3,32, 3,04 м.д.), что соответствует патентуемой композиции. Согласно масс-спектру, присутствуют пики молекулярных ионов 596 от хлорина е6 и 566 от пурпурина 5. В спектре поглощения имеется полоса 662 нм с величиной поглощения, хорошо соотносящейся с молекулярной экстинкцией эталона ФС (34230).
Следовательно, изученный образец является “Радахлорином”.
Пример 2. Коэффициент распределения н-октанол/фосфатный буфер, рН 7,4. Встряхивают в течение 20 с 300 мл н-октанола и 300 мл фосфатного буферного раствора, рН 7,4, и для расслаивания центрифугируют 10 мин при 10000 об/мин. В подготовленных таким образом буферном растворе (2 мл) и н-октаноле (8 мл) растворяют аликвоту ФС объемом 0,1 мл с концентрацией ФС 5 мг/мл и определяют максимум поглощения на длине волны 406 нм. Получают значения D°к и D
Кр определяют по формуле:
Кр = (D° V° D°к V°к)/(Dб Vб D
Получают значение 1,4±0,3 для “Радахлорина” и 2,4±0,4 для “Фотохлорина II”, что означает, что предлагаемые ФС - амфифильные вещества.
Пример 3
Для определения антибактериальной эффективности фотосенсибилизатора использовали тест-системы "Эколюм". Биосенсором служил стандартный материал лиофильно высушенных бактерий Е. coli TG1 (рХеп7), свечение которых обусловлено клонированным lux-опероном из светящихся почвенных энтомопатогенных бактерий Photorhabdus luminescens ZM1. Ранее была установлена прямая корреляция между фотодинамическим подавлением свечения и снижением колониеобразующей способности клеток бактерий в присутствии хлориновых ФС.
К регидратированным образцам бактерий (1 мл) Е. coli TG1 (рХеп7) добавляли 0,35% водный раствор радахлорина до конечной концентрации в пробе 10 мкМ и после 10-60 мин инкубации облучали лазерным светом 662 нм с мощностью 100 мВт (доза облучения 150 Дж/см2). Интенсивность свечения бактерий регистрировали с помощью люминометра "Биотокс-6". Результаты эксперимента приведены в таблице 3.
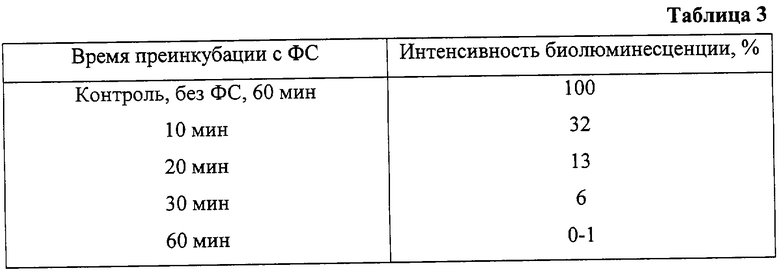
Таким образом, полное гашение биолюминесценции и, следовательно, потеря колониеобразующей способности (КОС) преинкубированных с радахлорином и облученных 662 нм культур бактерий Е. coli TG1 (рХеn7) свидетельствует о высокой антибактериальной активности этого ФС. Максимальный фотодинамический эффект достигался при времени преинкубации 60 мин.
Пример 4. Для отбора эффективных фотосенсибилизаторов с фунгицидной активностью использовали дрожжевые грибы Candida guilliermondi [3].
К суспензии дрожжевых грибов (1 мл) Candida guilliermondi добавляли 0,35% водный раствор радахлорина до конечной концентрации в пробе 10-20 мкМ и после 10 мин инкубации облучали лазерным светом 662 нм с мощностью 100 мВт. Результаты эксперимента приведены в таблице 4.

Из приведенных данных видно, что полная потеря колониеобразующей способности преинкубированных 10 мин с радахлорином и облученных 662 нм культур дрожжевых грибов Candida guilliermondi достигается при концентрации ФС 10 мкМ и дозе облучения 150 Дж/см2 или 20 мкМ и дозе облучения 75 Дж/см2.
Таким образом, полная инактивация дрожжевых грибов наступает при параметрах воздействий (концентрация ФС и доза облучения), меньших или равных таковым для грамотрицательных бактерий.
Пример 5. Изучение токсических свойств ФС in vivo.
Токсичность изучают при внутривенном введении ФС лабораторным белым мышам массой тела 19-21 г (питомник РАМН, отделение Крюково). Животных содержат в стандартных условиях вивария и кормление проводят в соответствии с Приказом Минздрава СССР № 1179 от 10.10.83 года “Об утверждении нормативов затрат кормов для лабораторных животных в учреждениях здравоохранения”.
Токсичность определяют по гибели животных, после расчета среднесмертельной дозы – LD50. Расчет проводят статистическими методами, рекомендованными Государственной Фармакопеей XI издания (1, 3). На основании LD50 определяют принадлежность исследуемого вещества к определенному классу токсичности по Hodge и Sterner. Также проводят учет реакций интоксикации в ходе эксперимента.
В опыт отбирают мышей в количестве 12 особей (6 самцов и 6 самок) на каждую испытуемую дозу ФС. Для определения LD50 ФС исследуют следующие дозы: 5, 10, 15, 20, 30, 40, 50, 75, 100, 125, 150, 175, 200, 225, 250, 275 мг/кг. Раствор с концентрацией 5 мг/мл ФС вводят мышам внутривенно, варьируя дозу объёмом введенного ФС.
Получают значение LD50 “Радахлорина”, равное 147 мг/кг, LD50, равное 119 мг/кг, а для “Фотохлорина II”, соответственно, 153 мг/кг и 92 мг/кг, что означает, что предлагаемые ФС являются малотоксичными соединениями (табл.5).
Пример 6. Больной К., 1957 г.р. (и.б. №6809/01), поступил в ЛОР клинику МОНИКИ с жалобами на гнойные выделения из правой половины носа, заложенность и затруднение дыхания носом справа, головную боль, локализованную преимущественно в лобной области.
Из анамнеза: болен в течение 7 месяцев до госпитализации. Лечился по месту жительства антибактериальными препаратами, физиопроцедурами, за последние 2 месяца было выполнено около 30 пункций правой верхнечелюстной пазухи. Каждый раз при промывании пазухи получали гнойное отделяемое.
При поступлении: общее состояние удовлетворительное, по внутренним органам без видимых патологических изменений. Status localis: дыхание затруднено больше через правую половину носа, перегородка носа по средней линии, слизистая оболочка и нижние носовые раковины отечны, в среднем носовом ходе справа после анемизации - слизисто-гнойное отделяемое. Общеклинические анализы крови и мочи - в пределах нормы. Рентгенологически: тотальное затемнение правой верхнечелюстной пазухи. При пункции получено около 4,0 мл гнойного отделяемого с неприятным запахом. При микробиологическом исследовании отделяемого выделены бактерии рода Haemophilus<103.
Учитывая неэффективность проводимого ранее лечения с выполнением большого числа пункций верхнечелюстной пазухи, пациенту был проведен сеанс ФДТ в режиме 0,35 Вт с экспозицией 10 мин (ФС “Радахлорин раствор для внутривенного введения, 0,35% 10 мл”). За время проведения сеанса активно жалоб не предъявлял, однако отмечал умеренное "покалывание" в области проекции облучаемой лазером пазухи. После сеанса ФДТ проводили ежедневные сеансы промывания облученной гайморовой пазухи стерильным изотоническим раствором через дренажную трубку. Дренаж был удален из пазухи на 5-е сутки после очередного промывания и контрольного исследования промывной жидкости на наличие микрофлоры (посев роста не дал). На 7-е сутки после сеанса ФДТ в общем анализе крови было отмечено повышение содержания лейкоцитов (8,1×109/л) по сравнению с данными, полученными при поступлении (4,0×109/л). Остальные показатели в пределах нормы. При контрольном посеве промывных вод правой верхнечелюстной пазухи при ее пункции на 11 сутки после сеанса ФДТ - роста нет. По результатам диагностической микрогайморотомии на 12 день после сеанса ФДТ гистологически определялось, что слизистая оболочка пазухи покрыта респираторным эпителием, в субэпителиальной основе которого отек, гиперемия сосудов, полиморфно-клеточная воспалительная инфильтрация с высоким содержанием эозинофилов.
Пациент выписан на 20 сутки после сеанса ФДТ в удовлетворительном состоянии, общеклинические анализы крови и мочи - в пределах нормы, дыхание через нос не затруднено, в носовых ходах отделяемого нет.
При последующих осмотрах через 3 и 6 месяцев после выписки из стационара дыхание через нос у этого больного свободное, отделяемого нет, жалоб на головную боль не предъявлял.
Пример 7. Больная Д., 1957 г.р. (и.б. №19058), поступила в ЛОР клинику МОНИКИ с жалобами на гнойные выделения из правой половины носа, частую головную боль.
Считает себя больной в течение последних 2 лет. Лечилась по месту жительства пункциями правой верхнечелюстной пазухи, антибактериальными и фито-препаратами, физиопроцедурами с непродолжительным положительным эффектом. Настоящее обострение в течение месяца, выполнено 12 пункций пазухи, при которых каждый раз получали гнойное отделяемое.
При поступлении: общее состояние удовлетворительное, по внутренним органам: хронический сальпингоофорит. Status localis: дыхание не затруднено, перегородка носа умеренно искривлена вправо, слизистая оболочка полости носа отечна, с цианотичным оттенком, отделяемого в носовых ходах нет. При задней риноскопии: в своде носоглотки справа определяется слизисто-гнойное отделяемое. Общеклинические анализы крови и мочи в пределах нормы. Рентгенологически: правая верхнечелюстная пазуха интенсивно гомогенно затемнена, завуалированность клеток решетчатого лабиринта справа. При пункции получено скудное гнойное отделяемое без запаха. При микробиологическом исследовании отделяемого выделены Е. coli 106.
Пациентке проводилось промывание правой верхнечелюстной пазухи через установленный дренаж с введением антисептических растворов на фоне антибактериальной и противовоспалительной терапии, промывание придаточных пазух носа методом перемещения без видимого положительного эффекта. На 10 день лечения пациентке выполнен сеанс ФДТ в режиме 0,10 Вт, с экспозицией 60 мин (ФС “Фотохлорин II раствор для внутривенного введения, 0,5% 10 мл”). Во время проведения сеанса активно предъявляла жалобы на "покалывание" в проекции правой верхнечелюстной пазухи, незначительные болезненные ощущения в ней, слезотечение, боль в правой глазнице и дискомфорт в области проекции правой лобной пазухи. В последующие за ФДТ 5 суток ежедневно через дренаж пазуху промывали стерильным физраствором. На 7 сутки после сеанса ФДТ в общеклинических анализах крови и мочи динамики не отмечалось. Контрольный посев промывных вод правой верхнечелюстной пазухи при ее пункции на 10 сутки после ФДТ роста микрофлоры не дал. Пациентка выписана на 14 сутки после сеанса ФДТ в удовлетворительном состоянии, общеклинические анализы крови и мочи в пределах нормы, дыхание через нос не затруднено, в носовых ходах отделяемого нет, при задней риноскопии определяли слизистое отделяемое в своде носоглотки справа.
По данным катамнеза через 3 и 5 месяцев после выписки из стационара дыхание через нос у пациентки свободное, в полости носа небольшое количество слизи, жалоб на головную боль нет.
Источники информации
1. А.И.Фельдман, С.И.Вульфсон “Болезни уха и верхних дыхательных путей в детском возрасте”. М. - “Медгиз”. - 1950. - с.264-265.
2. B.C.Погосов “Атлас оперативной оториноларингологии. М. - “Медицина”. - 1983. - с.227.
3. Решетников А.В., Залевский И.Д., Кемов Ю.В., Иванов А.В., Карменян А.В., Градюшко А.Т., Лаптев В.П., Неугодова Н.П., Абакумова О.Ю., Привалов В.А., Лаппа А.В., Романов В.А. Фотосенсибилизатор и способ его получения. // Патент РФ №2183956, выдан 27 июня 2002 г. Положительное решение от 21 декабря 2001 г. по заявке №2001108397 от 30 марта 2001 г.
4. А.В.Решетников, А.В.Иванов, О.Ю.Абакумова, А.Т.Градюшко, И.Д.Залевский, А.В.Карменян, В.П.Лаптев, Н.П.Неугодова. Оценка биологических свойств новых фотосенсибилизаторов хлоринового ряда. В сб. “Использование лазеров для диагностики и лечения заболеваний. Научно-информационный сборник” (приложение к бюллетеню “Лазер-информ”), вып.3, 34-40 (2001).
5. П.И.Толстых с соавт. “Фотодинамическая терапия в комплексной методике лечения гнойных ран у больных сахарным диабетом” в Сборнике трудов междун. конф. “Лазерные и информационные технологии в медицине XXI века”. СПб, 2001. - с.449-450.
6. А.Б.Шехтер с соавт. “Экспериментальное обоснование применения фотодинамической терапии для лечения гнойных ран”. Там же - с.457-458.
7. Kessel D. Biochemistry. 1977. V. 16. р.3443-3449.
8. A.V.Reshetnickov, et. al. In Optical Methods for Tumor Treatment and Detection: Mechanisms and Techniques in Photodynamic Therapy IX. - T.J.Dougherty, ed., 2000, Vol. 3909, p.124-129.
9. A.E.Medvedev et al., Biomed. Science, 1990, V.1, p.261.
10. O.Yu. Abakumova, et. al., J. Neural. Transm. Suppl. 3, 1998, V. 52, p.87.
11. Сертификат МИНЗДРАВА РФ - Протокол №4 от 13.06.1996, регистрационный № 29/10-679-96.
12. Фомичев А.Ю., Зорин В.П., Зорина Т.Е., Черенкевич С.Н. Фотоповреждение грамположительных и грамотрицательных бактериальных клеток в присутствии производных хлорина е6. Микробиология, 1991, т.60, вып.3, 507-511.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФОТОСЕНСИБИЛИЗАТОР И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2183956C1 |
| СПОСОБ ЛЕЧЕНИЯ НОЗОКОМИАЛЬНОГО СИНУСИТА У ПАЦИЕНТОВ В ОТДЕЛЕНИЯХ РЕАНИМАЦИИ И ИНТЕНСИВНОЙ ТЕРАПИИ | 2012 |
|
RU2503471C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ПЕРЕВИВНОЙ ОПУХОЛИ КАРЦИНОМА ЭРЛИХА МЫШЕЙ С ФОТОСЕНСИБИЛИЗАТОРОМ ХЛОРИНОВОГО РЯДА | 2022 |
|
RU2788766C2 |
| СПОСОБ ЛАЗЕРНОГО ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ТОНЗИЛЛИТА С ПРИМЕНЕНИЕМ ФОТОСЕНСИБИЛИЗАТОРА | 2007 |
|
RU2379073C2 |
| СПОСОБ ФОТОИММУНОТЕРАПИИ ФОТОСЕНСИБИЛИЗАТОРОМ, АКТИВИРУЕМЫМ ВОЛНОВОЙ ЭНЕРГИЕЙ ВНЕ ОРГАНИЗМА ЧЕЛОВЕКА | 2006 |
|
RU2345803C2 |
| СПОСОБ СНИЖЕНИЯ ПОВЕРХНОСТНОЙ ДОЗЫ ОФТАЛЬМОАППЛИКАТОРА ПРИ ПРОВЕДЕНИИ БРАХИТЕРАПИИ ВНУТРИГЛАЗНЫХ НОВООБРАЗОВАНИЙ | 2005 |
|
RU2303966C2 |
| ФОТОСЕНСИБИЛИЗАТОР ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2017 |
|
RU2646477C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ВНУТРИГЛАЗНЫХ НОВООБРАЗОВАНИЙ | 2005 |
|
RU2290150C2 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ И ЭЛЕКТРОХИМИЧЕСКОЙ ДЕСТРУКЦИИ МЕЛАНОМЫ ХОРИОИДЕИ | 2006 |
|
RU2303964C1 |
| СПОСОБ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ЛОР-ОРГАНОВ | 2014 |
|
RU2572159C1 |
Изобретение относится к медицине и предназначено для лечения острого и хронического гайморита. Гайморову пазуху освобождают от содержимого, вводят в нее фотосенсибилизатор (ФС). При этом в качестве ФС используют порфирины хлоринового ряда. Проводят облучение стенок пазухи лазерным излучением с длиной волны, совпадающей с длиной волны пика поглощения используемого ФС в течение 10-60 мин и с мощностью 0,10-0,35 Вт. Облучение проводят лазерным излучением длиной волны 654-670 нм и с дозой облучения 10-1000 Дж/см2. Облучение стенок пазухи проводят через 2 ч после введения ФС. Набор дозы облучения проводят поэтапно, с перерывами 20-30 с, во время которых пазуху продувают, освобождая от скапливающейся слизи. Гайморову пазуху перед и через 2 ч после введения в нее ФС промывают физиологическим раствором. В последующие после лечения 3-5 дней осуществляют промывание гайморовой пазухи физиологическим раствором. Способ обеспечивает полную санацию гайморовой пазухи, сокращает сроки лечения и предотвращает рецидивы. 5 з.п. ф-лы, 5 табл.
| ОВЧИННИКОВ Ю.М | |||
| Оториноларингология | |||
| - М., 1995, с.132-139 | |||
| ФОТОСЕНСИБИЛИЗАТОР И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2001 |
|
RU2183956C1 |
| RU 2051618 C1, 10.01.1996 | |||
| КАРАНДАШОВ В.И | |||
| и др | |||
| Фототерапия | |||
| - М., 2001, с.307-308 | |||
| ПАЛЬЧУН В.Т | |||
| Болезни уха, горла, носа | |||
| - М., 2000, с.96-99. | |||
Авторы
Даты
2004-05-20—Публикация
2002-10-01—Подача