Изобретение относится к микробиологии, биотехнологии и, в частности, к производству средств бактериального происхождения для борьбы с болезнями растений и животных.
В настоящее время в качестве средств борьбы с возбудителями болезней растений в основном используются химические фунгициды. Несмотря на высокую эффективность, ряд недостатков химических средств защиты растений (возникновение устойчивости у возбудителей, отсутствие селективного эффекта, токсичность для теплокровных) диктуют необходимость поиска новых соединений. В качестве альтернативных средств защиты растений могут быть использованы бактериальные фунгицидные препараты, в состав которых входят штаммы микроорганизмов, проявляющих антагонистическую активность по отношению к различным биологическим объектам.
Широкое применение так называемых “классических” антибиотиков привело к возникновению резистентных форм болезнетворных микроорганизмов, что создает серьезные социальные и медицинские проблемы. Одним из способов решения данной проблемы является поиск антибиотиков нового поколения, к которым относятся пептидные антибиотики. Интерес к ним обусловлен механизмом их действия, вызывающего физические нарушения клеточных мембран микроорганизмов. Предполагается, что такой механизм действия в определенной степени обеспечивает снижение вероятности возникновения устойчивости болезнетворных бактерий.
В настоящее время известен ряд бациллярных штаммов, способных продуцировать пептидные антибиотики, обладающие антибактериальной и/или фунгицидной активностью. Характерными особенностями бациллярных пептидных антибиотиков и фунгицидов является их нерибосомальный синтез и содержание необычных (орнитин и др.) и D-аминокислот. Так, описаны штаммы Bacillus licheniformis, синтезирующие низкомолекулярные (мол. масса 1400-3200) полипептиды и липопептиды, обладающие широким спектром антагонистического действия (1, 2). Штаммы Bacillus subtilis продуцируют ряд антимикробных факторов. Микобациллин - анионный 13-членный циклический полипептид с мол. массой ~1800, обладает широким спектром действия против бактерий, простейших и грибков (3). Новый класс липопептидных фунгицидов объединяет активные пептиды семейств итурина, сурфактина и фенгицина (4). Итурины (4) и бацилломицины (5) - нейтральные или анионные циклогептапептиды с мол. массой ~1000, соединенные с жирной кислотой либо сложноэфирной связью с образованием лактонного цикла (итурины), либо пептидной связью в цикле (бацилломицины) (6). Итурины и бацилломицины имеют ограниченную антибактериальную активность и широкий спектр активности против грибов и дрожжей. Сурфактин - циклический липопептид, содержащий семь гидрофобных аминокислотных остатков, соединенных с β-гидроксижирной кислотой (7). Это мощное поверхностно активное соединение, известное также как антибактериальный и фунгицидный агент. Фенгицин (8) и плипастатин (9) - липопептиды, содержащие десять аминокислот и липидную часть, расположенную на N-конце молекулы. Они отличаются от итурина и сурфактина присутствием таких необычных аминокислот, как орнитин и allo-треонин. Известна группа циклодекапептидов (грамицидин S и тироцидины), продуцируемая штаммами Bacillus brevis, обладающая антибактериальной и слабой фунгицидной активностью (10). Имеются сведения о штаммах Bacillus laterosporus, ингибирующих рост бактерий и грибов (11, 19, 20). Из штамма Bacillus laterosporus MK-PNG-276A выделены лолоатины А, В, С, Д - группа циклических декапептидов тироцидинового семейства, проявляющих антагонистическую активность в отношении грамположительных бактерий Staphylococcus aureus, Staphylococcus ssp., Streptococcus ssp., Enterococcus faecicum и дрожжеподобных грибов Candida albicans, но не активных по отношению к грамоотрицательным бактериям Pseudomonas mendocina и Pseudomonas marginata (12, 13). Сведения об антагонистической активности этих веществ в отношении простейших, цианобактерий, дрожжей Saccharomyces cerevisiae и фитопатогенных грибов отсутствуют. Штамм - продуцент лолоатинов Bacillus laterosporus MK-PNG-276A выбран в качестве ближайшего аналога заявляемого штамма с широким спектром антагонистического действия.
Поставлена задача: расширить арсенал средств на основе циклических декапептидов, используемых для борьбы с возбудителями болезней растений и животных.
Задача решена путем:
- выделения циклодекапептидного антибиотика широкого спектра антагонистического действия латероцидина;
- получения штамма бактерий Brevibacillus laterosporus ВКПМ В-8287, продуцирующего антибиотик латероцидин и обладающего широким спектром антагонистического действия, обусловленного в том числе и антибиотиком латероцидином.
Заявляемый циклодекапептидиый антибиотик, названный нами латероцидин, не известен из источников информации. Латероцидин обладает антагонистическим действием против бактерий, цианобактерий, фитопатогенных грибов и простейших (таблица 1). Латероцидин представляет собой белое аморфное твердое вещество, имеющее формулу [cyclo-(L-Val-L-Orn-L-Leu-D-Tyr-L-Pro-L-Phe-D-Phe-L-Asn-L-Asp-L-Leu)] и молекулярную массу 1224,4. Латероцидин растворяется в метаноле, этаноле, других низших спиртах, не растворяется в воде.
Заявляемый штамм выделен нами в результате многоступенчатой селекции из природного штамма Brevibacillus laterosporus. Он депонирован во Всероссийской коллекции промышленных микроорганизмов под номером ВКПМ В-8287.
Штамм Brevibacillus laterosporus ВКПМ В-8287 заявляется
- как продуцент антибиотика латероцидина и
- как штамм, обладающий широким спектром антагонистического действия.
Заявляемый штамм Brevibacillus laterosporus ВКПМ В-8287 имеет следующие характеристики:
1. Культурально-морфологические признаки.
Аэробные грамположительные подвижные палочки размером 0,5-0,7×2,5-5,0 мкм капсулу не образуют. Вегетативные клетки - палочки со жгутиками, перитрихи. Споры овальные, с каноэвидными включениями, прикрепленными к одной стороне споры. Размер спор равен 0,9-1,2×1,5-1,7 мкм. Через 24 часа роста на богатых агаризованных средах [NBY г/л: питательный бульон (nutrient broth)-8; дрожжевой экстракт (yeast extract) - 3, агар-агар - 20; ДПС г/л: дрожжи эприновые - 30, кукурузная мука - 15, агар-агар - 20; ГД г/л: гидролизные дрожжи - 45, агар-агар 20] штамм образует округлые колонии 3-4 мм в диаметре с гладкой поверхностью кремового цвета и неровным краем.
2. Культивирование штамма.
При выращивании в жидкой питательной среде [NBY (г/л): питательный бульон (nutrient broth) - 8; дрожжевой экстракт (yeast extract) - 3] при 28-30°С со встряхиванием (250 об/мин) равномерный рост культуры наблюдается по всему объему. К 96 часам культивирования наблюдается преимущественно 90-95% спор и 5-10% вегетативных клеток. Титр культуры после 96 часов культивирования составляет ~3,0×109 мл.
3. Физиолого-биохимические признаки.
Штамм сбраживает глюкозу, мальтозу, фруктозу. Не сбраживает сахарозу и лактозу. Образует лецитиназу; не гидролизует крахмал; гидролизует казеин и желатину. Мочевину не расщепляет. Образует твин-эстеразу.
На основании морфологических (наличие каноэвидной структуры, прикрепленной к споре) и физиолого-биохимических признаков выделенный штамм ВКПМ В-8287 отнесен к Bacillus laterosporus (14). По новой классификации - к Brevibacillus laterosporus (15).
4. Антагонистическая активность.
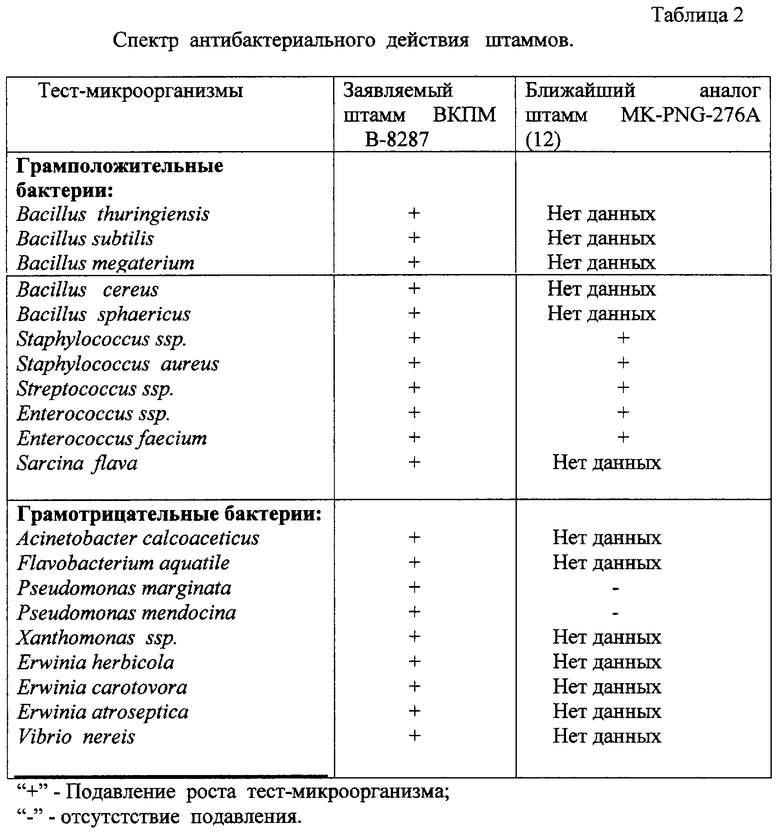
Штамм синтезирует антибиотик латероцидин и проявляет антагонистическую активность по отношению к грамположительным бактериям: Bacillus thuringiensis, Bacillus subtilis, Bacillus megaterium, Bacillus cereus, Bacillus sphaericus, Staphylococcus ssp., Staphylococcus aureus, Streptococcus ssp., Enterococcus ssp., Enterococcus faecium, Sarcina flava (таблица 2);
грамотрициательным бактериям: Acinetobacter calcoaceticus, Flavobacterium aquatile, Pseudomonas marginata, Pseudomonas mendocina, Xanthomonas ssp., Erwinia herbicola, Erwinia carotovora, Erwinia atroseptica. Vibrio nereis (таблица 2);
цианобактериям: Nostoc ssp. 29411 и Anabaena ssp. 5781 (таблица 3);
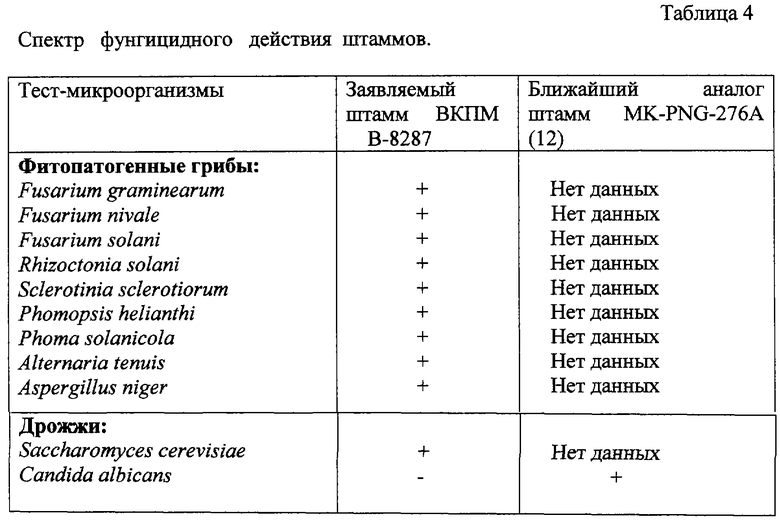
фитопатогенным грибам: Fusarium graminearum, Fusarium nivale, Fusarium solani, Rhizoctonia solani, Sclerotinia sclerotiorum, Phomopsis helianthi, Phoma solanicola, Alternaria tenuis, Aspergillus niger (таблица 4);
дрожжам: Saccharomyces cerevisiae (таблица 4);
простейшим: Tetrahymena pyriformis u Entamoeba moshkovskii (пример 8).
Изобретение иллюстрируется следующими примерами
Пример 1.
Микробиологический синтез латероцидина штаммом Brevibacillus laterosporus ВКПМ В-8287, выделение и очистка латероцидина.
Штамм Brevibacillus laterosporus ВКПМ В-8287 культивировали в жидкой питательной среде NBY 72 часа при 30°С на круговой качалке (250 об/мин). Культуральную жидкость центрифугировали при 10000 g 15 мин, полученную надосадочную жидкость отбрасывали, а к трижды отмытому водой при центрифугировании осадку добавляли абсолютный этанол. Спиртовую экстракцию продолжали в течение 20 часов при комнатной температуре. Полученный спиртовой экстракт отделяли центрифугированием (15 мин при 10000g), полученный раствор выпаривали при 56°С до получения кристаллов желто-бурого цвета. Спиртовой раствор кристаллов фракционировали с помощью ВЭЖХ (HPLC) на обращенно-фазовой колонке Delta Pak C-18, 300  , 20 мкм (19×300 мм. Waters) при скорости потока 2 мл/мин в линейном градиенте (от 0 до 100%) раствора Б (метанол - ацетонитрил - вода, 75:22,5:2,5) в растворе А (метанол - ацетонитрил - вода, 60:5:35) за 100 мин и затем в растворе Б в течение 20 мин. На колонку наносили по 10 мкл раствора. Полученные фракции, проявляющие антагонистическую активность, объединяли, упаривали досуха и растворяли в этаноле. Далее раствор (по 10 мкл) наносили на обращенно-фазовую колонку Vydac С-18, 300
, 20 мкм (19×300 мм. Waters) при скорости потока 2 мл/мин в линейном градиенте (от 0 до 100%) раствора Б (метанол - ацетонитрил - вода, 75:22,5:2,5) в растворе А (метанол - ацетонитрил - вода, 60:5:35) за 100 мин и затем в растворе Б в течение 20 мин. На колонку наносили по 10 мкл раствора. Полученные фракции, проявляющие антагонистическую активность, объединяли, упаривали досуха и растворяли в этаноле. Далее раствор (по 10 мкл) наносили на обращенно-фазовую колонку Vydac С-18, 300  , 5 мкм (4,6×250 мм, Vydac). Элюцию осуществляли при скорости потока 0,5 мл/мин в линейном градиенте (от 10 до 100%) раствора Б в растворе А за 60 мин и затем в растворе Б в течение 20 мин. Фракции, проявляющие антибактериальную активность, объединяли и упаривали досуха. Полученный гомогенный антибиотик представлял собой аморфное вещество белого цвета.
, 5 мкм (4,6×250 мм, Vydac). Элюцию осуществляли при скорости потока 0,5 мл/мин в линейном градиенте (от 10 до 100%) раствора Б в растворе А за 60 мин и затем в растворе Б в течение 20 мин. Фракции, проявляющие антибактериальную активность, объединяли и упаривали досуха. Полученный гомогенный антибиотик представлял собой аморфное вещество белого цвета.
Пример 2.
Определение первичной структуры латероцидина.
Для определения структуры выделенного антибиотика применяли ЯМР-спектроскопию. 1H-ЯМР спектр пептидного антибиотика, растворенного в метаноле (1,7 мг/600 мкл, рН=8,4; 30°С), получен на спектрометре Varian Unity 600 с рабочей частотой 600 МГц. На основании анализа ЯМР-спектра COSY, TOCSY и ROESY при помощи стандартной процедуры (17) проведено полное отнесение сигналов протонов исследуемого образца, которое соответствует аминокислотной последовательности [cyclo-(L-Val-L-Orn-L-Leu-D-Tyr-L-Pro-L-Phe-D-Phe-L-Asn-L-Asp-L-Leu)]. После анализа базы данных SRS выявлено, что пептид с вышеуказанной последовательностью не имеет аналогов. Данный пептид, названный нами латероцидином, относится к семейству тироцидиновых антибиотиков.
Пример 3.
Определение молекулярной массы латероцидина.
Для определения молекулярной массы латероцидина использовали масс-спектрометрический анализ.
MALDI (matrix-assisted lazer desorption ionization) масс-спектометрический анализ пептида проводили на масс-спектрометре VISION 2000 (ThermoBioAnalysis, OK). В качестве матрицы использовали 0,15 М 2,5-дигидроксибензойную кислоту (DHB) в смеси, содержащей 25% метанол и 0,1% трифторуксусную кислоту. Образец облучали УФ-лазером с длиной волны 337 нм и максимальной энергией 250 мкДж в импульсном режиме с частотой 3 нс. При масс-спектрометрическом исследовании пептида (мощность лазера - 57%, число лазерных ударов - 20) был получен пик с m/z 1224,4; соответствующий молекулярному иону нового антибиотика латероцидина.
Пример 4.
Определение минимальной ингибирующей концентрации латероцидина.
Количественную оценку антагонистического действия латероцидина проводили путем определения его минимальной ингибирующей концентрации (МИК). Для этого полученный латероцидин растворяли в минимальном объеме абсолютного этанола и готовили исходный раствор, содержащий 200 мкг/мл 5%-ного этанола. Минимальную ингибирующую концентрацию латероцидина определяли стандартным методом серийных двухкратных разведении исходного раствора антибиотика (18) против каждого тест-микроорганизма (таблица 1).
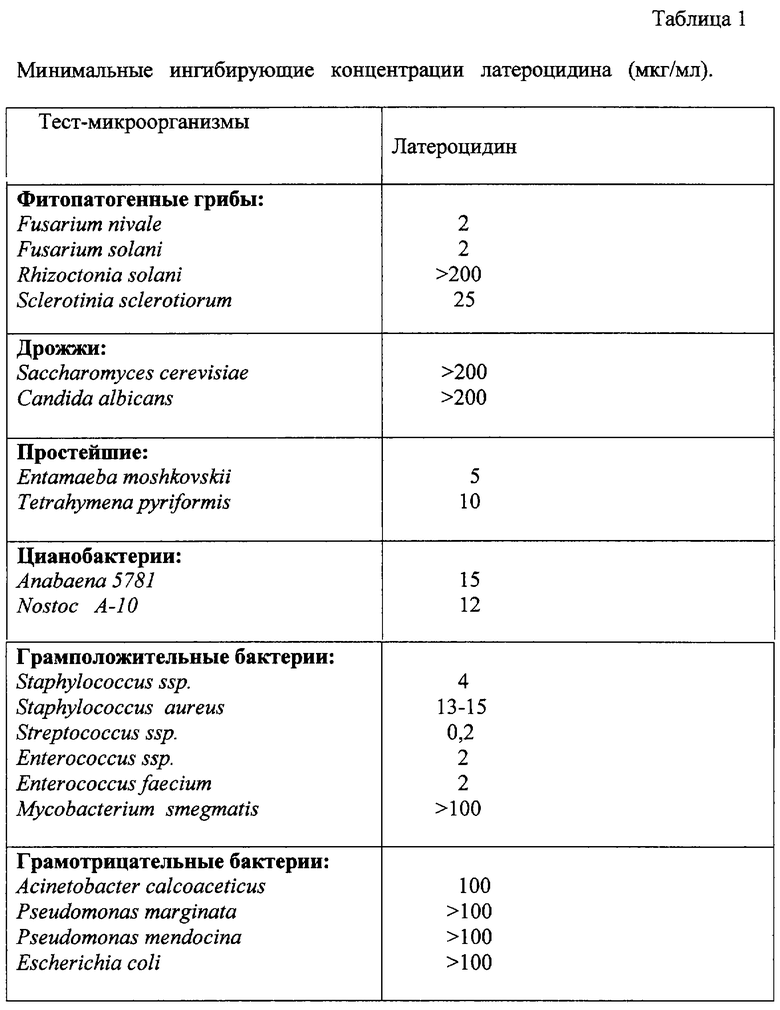
Из данных, приведенных в таблице 1, следует, что латероцидин обладает широким спектром антагонистического действия, наиболее высокий уровень антагонистической активности он проявляет по отношению к фитопатогенным грибам рода Fusarium, простейшим, цианобактериям, патогенным бактериям групп стрептококков, стафиллококков и энтерококков.
Пример 5.
Определение спектра антибактериального действия штамма ВКПМ В-8287 и его сравнение с ближайшим аналогом.
Антибактериальное действие культуры штамма выявляли методом лунок. В 25 мл агаризованной среды NBY добавляли 1 мл 4-х часовой культуры тест- бактерии, в вырезанные лунки диаметром 8 мм вносили по 50 мкл 72-часовой КЖ штамма В-8287. Чашки Петри выдерживали 2 часа при +5°С и далее инкубировали при 30°С. Антагонистическое действие штамма фиксировали через 24 часа по измерению зон ингибирования роста тест-микроорганизмов. Результаты приведены в таблице 2.
Пример 6.
Определение цианолитической активности штамма ВКПМ В-8287.
Цианолитическую активность штамма выявляли при смешанном культивировании. Культуральную жидкость 72-часовой культуры ВКПМ В-8287 вносили в суспензию 14-суточной культуры цианобактерий Nostoc ssp. 29411 или Anabaena ssp. 5781 (16). Измеряли оптическую плотность (при длине волны 590 нм) смеси в нулевой момент времени и после инкубации при 25°С и круглосуточном освещении. Цианолитическую активность оценивали по падению оптической плотности через 24 часа инкубации. Штамм ВКПМ В-8287 вызывал падение оптической плотности в 3-4 раза, что свидетельствовало о его литическом действии на цианобактерии (таблица 3). Лизис клеток цианобактерий выявлялся также при оптической микроскопии.

Сведений о цианолитической активности штамма - ближайшего аналога в источниках информации не обнаружено.
Пример 7.
Определение фунгицидной активности штамма Brevibacillus laterosporus ВКПМ В-8287.
Для выявления фунгицидной активности штамма против грибов и дрожжей использовали метод лунок. Культуру тест-микроорганизма помещали в центр чашки Петри с картофельным агаром (бакто-агар - 20 г, глюкоза - 15 г, картофельный отвар - до 1 л). В лунки вносили культуральную жидкость 72-часовой культуры В-8287. Чашки инкубировали в темноте при комнатной температуре. Через 48 часов оценивали наличие или отсутствие зон подавления роста грибов.
Заявляемый штамм подавлял рост мицелия следующих микроорганизмов: Fusarium graminearum, Fusarium nivale, Fusarium solani, Rhizoctonia solani, Sclerotinia sclerotiorum, Phomopsis helianthi, Phoma solanicola, Alternaria tenuis, Aspergillus niger и Saccharomyces cerevisiae, но не был активен против Candida albicans (таблица 4), в отличие от ближайшего аналога.
Пример 8.
Определение активности штамма ВКПМ В-8287 против простейших.
Активность штамма ВКПМ В-8287 против простейших определяли при смешанном культивировании штамма и простейших. 72-часовую культуральную жидкость штамма вносили в суспензию клеток простейших. Использовали 4-дневную культуру инфузорий Tetrahymena pyriformis (15-20×10, количество инфузорий подсчитывали микроскопически) или 7-дневную культуру амеб Entamoeba moshkovskii (5-8×103, количество амеб подсчитывали микроскопически). После 24 часов инкубации гибель простейших составляла 100%.
Сведения об антагонистической активности ближайшего аналога против простейших отсутствуют.
Таким образом, нами получен штамм бактерий Brevibacillus laterosporus ВКПМ В-8287 с широким спектром антагонистического действия, проявляющий антибиотическую активность по отношению к ряду грамположительных и грамотрицательных бактерий, цианобактерий, фитопатогенных грибов, дрожжей и простейших. Он является продуцентом впервые выделенного циклодекапептидного антибиотика, названного нами латероцидином, который также обладает широким, но несколько отличающимся от такового у штамма-продуцента, спектром антагонистического действия. Оба этих объекта могут найти независимое применение в качестве антибактериальных, фунгицидных и антипротозойных средств для борьбы с возбудителями болезней у растений и животных.
Список литературы
1. De Lucca A.J., Walsh T.J. 1999. Antifungal peptides: novel therapeutic compouds against emerging pathogens. Antimicrobial Agents and Chemotherapy. 43:1-11.
2. Galvez A.M., Maqueda M., Martinez-Bueno M., Lebbadi M., Valdivia E. 1993. Isolation and physico-chemical characterization of an antifungal and antibacterial peptide produced by Bacillus licheniformis A 12. Appl. Microbiol. Biotechnol. 38:438-442.
3. Егоров Н.С. 1994. Основы учения об антибиотиках. Издательство МГУ. 422-423.
4. Klich M.A., Lax A.R., Bland J.M. 1991. Inhibition of some mycotoxigenic fungi by iturin A, a peptidolipid produced by Bacillus subtilis. Mycopathology. 116:77-80.
5. Mhammedi A.F., Peypoux F., Besson F., Michel G. 1982. Bacillomycin F, a new antibiotic of iturin group. Isolation and characterization. J. Antibiot. 35: 306-311.
6. Moyne A.L., Cleveland Т.Е., Tuzun S. Small peptides with antipathogenic activity, treated and methods for treating same. U.S. Patent No. 6183736.
7. Volpon L., Besson F., Lancelin J. 1999. NMR structure of active and inactive forms of the sterol-dependent antifungal antibiotic bacillomycin L. Eur. J. Biochem. 263:1-12.
8. Ahimou F., Jacques P., Deleu M. 2000. Surfactin and iturin A effect on Bacillus subtilis surface hydrophobility. Enzyme Microb. Technol. 27:749-754.
9. Volpon L., Besson F., Lancelin J. 2000. NMR structure of antibiotics plipastatins A and В from Bacillus subtilis inhibitors of phospholipase A2. FEMS Lett. 485:76-80.
10. Hancock R.E.W., Lehrer R. 1998. Cationic peptides as a new source of antibiotics. Trends Biotechnol. 16:82-88.
11. O'Donnell В. J. Method of inhibiting fungi by Bacillus laterosporus. 1995. U.S. Patent № 5455028.
12. Kelly M.T. Loloatin derivates and analogs. 1999. U.S. Patent № 5962407.
13. Gerald J.M., Haden P., Kelly M.T., Andersen R.J. 1999. Loloatins A-D, cyclic decapeptide antibiotics produced in culture by a tropical marine bacterium. J. Nat. Prod., 62:80-85.
14. Определитель бактерий Берджи. 1997. Москва, “Мир”, т.2, стр. 567.
15. Shida O., Takagi H., Kadowaki К., Komagata К. 1996. Proposal for new genera, Brevibaciillus gen.nov. and Aneurinibacillus gen.nov. Int. J. Sysyt. Bacteriol., 45:939-946.
16. Stanier R.Y., Kunisava R., Mandel M., Cohen-Basire G. 1971. Purification and properties of unicellular blue-green algae (order Chroococcales). Bacteriological Reviews. 35:171-205.
17. Wuthrich К. NMR of Proteins and Nucleic Acids. New York: John Wiley Sons, 1986.
18. Woods, G. L. and Washington, J. A, "Antibacterial susceptibility tests: dilution and disk diffusion methods. Manual of Clinical Microbiology (6. sup. th Ed.), Murray, Baron, Pfaller, Tenover and Yolken (Eds.), ASM Press, Washington DC, 1995, pp. 1327-1341.
19. O’Donnell В.J. Treatment of soil and plants with a composition containing Bacillus laterosporus. 1997. U.S. Patent № 5702701.
20. Yasunaka К. Antibiotic KSY-5 and production thereof. 1991. JP Patent № 3206099.
Изобретение относится к области биотехнологии, в частности к производству нового антибиотика латероцидина. Латероцидин обладает антагонистическим действием против бактерий, цианобактерий, фитопатогенных грибов и простейших. Латероцидин является циклодекапептидным антибиотиком и представляют собой белое аморфное твердое вещество, имеющее формулу [cyclo-(L-Val-L-Orn-L-Leu-D-Tyr-L-Pro-L-Phe-D-Phe-L-Asn-L-Asp-L-Leu)] и молекулярную массу 1224,4 Da. Продуцентом латероцидина является штамм бактерий Brevibacillus laterasporus, который получен из природного штамма того же вида в результате многоступенчатой селекции и депонирован под номером ВКПЕМ В-8287. Штамм активен против ряда Гр+ и Гр- бактерий, фитопатогенных грибов и простейших микроорганизмов. Использование штамма и латероцидина позволяет расширить ассортимент антагонистов широкого спектра действия. 2 с.п. ф-лы, 4 табл.
| US 5455028 А, 03.10.1995 | |||
| US 5702701 А, 30.12.1997 | |||
| JP 3206099 А, 09.09.1991 | |||
| ЕГОРОВ Н.С | |||
| Основы учения об антибиотиках | |||
| - М.: Высшая школа, 1986, с.167-194. |
Авторы
Даты
2004-05-27—Публикация
2002-11-05—Подача