Изобретение относится к микробиологии, биотехнологии и сельскому хозяйству, в частности к производству и применению биологических средств защиты растений на основе бактериальных штаммов для подавления развития фитопатогенных грибов. Одной из серьезных проблем сельского хозяйства является сохранение сельскохозяйственных культур: овощей, фруктов и злаков. Заражение растений фитопатогенными грибами вызывает серьезные экономические и социальные проблемы. Растительные патогены - возбудителей грибных инфекции поражают растения на разных стадиях развития. Большой ущерб наносится овощным растениям и на стадии хранения. В разных странах мира на хранение закладывается до 25-50% урожая. Потери во время хранения составляют до 20-30% урожая [1-3]. Болезни, вызываемые фитопатогенными грибами, снижают качество продовольственного и семенного материала сельскохозяйственных растений. Зараженный посадочный материал становится источником различных болезней в период вегетативного роста растений. Химические фунгициды используют для защиты от фитопатогенов. Дезактивацию проводят при закладке урожая на хранение, что значительно снижает инфицирование фитопатогенными грибами. В качестве химических фунгицидов для обработки клубней, корнеплодов и плодов овощных растений используют большое количество химикатов. Химические фунгициды имеют ряд недостатков. Основными негативными факторами являются - специфичность действия, загрязнение окружающей среды, накопление пестицидов в окружающей среде и возникновение резистентности возбудителей. Химические фунгициды представляют особую опасность при обработке сельскохозяйственной продукции, поскольку известно отрицательное влияние химических веществ на человека и животных. В конечных продуктах, получаемых из сельскохозяйственных растений, часто выявляют, вызывающие мутагенные, тератогенные и летальные последствия примеси химических пестицидов, накопленные за период вегетативного роста растений.
Наиболее эффективными биологическими средствами защиты растений являются биофунгициды на основе спорообразующих бактерий рода Bacillus. Альтернативой для химических фунгицидов при подавлении фитопатогенных грибов является применение биологических средств на основе этих бактерий и их метаболитов, обладающих фунгицидными свойствами. К несомненным преимуществам биологических фунгицидов относится их высокая эффективность, разнообразие механизмов проявления фунгицидной активности, индукция системной резистентности, способность образовывать биологические пленки (биопленки), которые затем блокируют фитопатогенным грибам доступ к источникам питания и возможности распространения. Спорообразующие бактерии, по сравнению с другими производителями биологически активных соединений, имеют ряд биотехнологических преимуществ:
- в процессе культивирования,
- в процессе отбора целевых продуктов,
- в процессе применения [4-18].
В качестве ближайшего штамма-аналога заявляемого штамма рассмотрен штамм Bacillus amyloliquefaciens CGMCC №4777 [19].
Согласно патенту [19] штамм Bacillus amyloliquefaciens CGMCC №4777 имеет следующие особенности: палочковидные бактерии, имеющие жгутики. Штамм спорообразующий. Грамположительный. Штамм образует колонии округлой формы, обычно имеющие глянцевую и морщинистую поверхность с неровными краями. Колонии молочно-белого цвета, непрозрачные, седиментированные, с адгезивными свойствами. Колонии молодой культуры бесцветные прозрачные с блестящей поверхностью, в конце культивирования, колонии становятся белыми непрозрачными, более темными. При световой микроскопии вегетативные клетки представлены в виде палочек, состоящих из одной или двух клеток, имеют жгутики, образуют овальные споры. Антибиотики, синтезируемые этим штаммом, имеют мощный бактериостатический эффект с широким бактерицидным спектром. Подавляют рост фитопатогенных грибов, вызывающих такие заболевания, как серая гниль томатов, фитофтороз, фузариоз и 10 видов различных гнилей яблок. Штамм Bacillus amyloliquefaciens CGMCC №4777 устойчив к стрессам, имеет высокую резистентность к кислотам и щелочам.
Задача заявляемого изобретения:
- расширить арсенал штаммов бактерий Bacillus amyloliquefaciens, обладающих фунгицидным действием против фитопатогенных грибов, вызывающих заболевания овощных растений,
- разработать на его основе биологический препарат для защиты овощных растений от грибных заболеваний.
Задача решена путем:
- получения штамма спорообразующих бактерий Bacillus amyloliquefaciens ВКПМ В-11443, обладающего фунгицидным действием, против фитопатогенных грибов, поражающих овощные растения.
- разработки биологического препарата для защиты овощных растений от заболеваний, вызываемых фитопатогенными грибами, включающего в качестве активного начала культуральную жидкость штамма, иммобилизованную на носителе в виде гранул микрокаолина или микродиатомита в соотношении по объему от 1:3 до 1:5.
1. Выделение заявляемого штамма
Заявляемый штамм получен в результате многоступенчатой селекции из природного штамма 16-1841, выделенного из природных источников.
2. Культивирование заявляемого штамма
Спорообразующий штамм ВКПМ В-11443 культивируют в следующих питательных средах.
Состав среды NBY, мас. %: nutrient broth "Difco" (питательный бульон) - 0,8; yeast extract "Difco" (дрожжевой экстракт) - 0,3; вода - остальное, рН 6,8-7,2
Состав среды YM, мас. %: гидролизные дрожжи - 4,5; вода - остальное, рН 6,8-7,2
Состав среды СМ-1, мас. %: гидролизные дрожжи - 0,30; кукурузная мука - 0,15; NaCl-0,1; MgSO4×7H2O-0,03; СаСО3-0,3, вода - остальное, рН 6,8-7,2
Для приготовления агаризованных питательных сред в жидкие среды дополнительно добавляют агар-агар (мас. % - 2,0).
Процедура приготовления биопрепарата Биологический препарат получают следующим образом:
заявляемый штамм высевают на твердую среду NBY и помещают в термостат при температуре 30°С, культивируют в течение 2 дней; получают вегетативную культуру заявляемого штамма, которую затем инокулируют в жидкую среду, выращивают при 30°С на качалке при 250 об/мин в течение 24 часов для получения посевной культуры.
Полученную посевную культуру затем вносят в ферментационную среду, содержащую мас. %: порошка дрожжевого экстракта 1-2, мелассы 2-3, муки кукурузного глютена1, дигидрофосфата калия 0,05; сульфата магния 0,05; карбоната кальция 0,3; хлорида натрия 0,03, при непрерывном добавлении порошка дрожжей (2%), порошка соевого белка (4%), аммиачной воды рН 7,0 в соотношении 3,0% по объему, остальное - вода. Штамм выращивают при 130°С, в течение 72 часов. В качестве носителя для иммобилизации активного начала - культуральной жидкости бактерий, выбран субстрат, состоящей из микрокаолина или микродиатомита [20]. Биопрепарат состоит из: культуральной жидкости заявляемого штамма, включающей комплекс спор, вегетативных клеток (с титром КОЕ/мл до 8,0×109) и продуктов метаболизма, а также гранулы носителя в виде микрокаолина или микродиатомита при следующем соотношении компонентов от 1:3 до 1:5, на которых этот комплекс иммобилизован, с последующим высушиванием полученной биомассы при температуре 56-60°С в течение 72-х часов.
Преимуществом заявляемого биопрепарата является то, что он хорошо хранится, удобен для транспортировки, дает стабильный объем, не слеживается, и сохраняет фунгицидные свойства.
3. Морфологические и физиологические характеристики заявляемого штамма
Заявляемый штамм образует на агаризованной среде NBY колонии с плоской поверхностью светло-серого цвета с ровными краями, диаметром 4-5 мм. Вегетативные клетки имеют длинные прямые палочки с закругленными краями, часто образующие цепочки из 3-4; свободные споры имеют форму эллипса, не превышающую размер клетки, одиночные, имеют жгутики. Грамположительный. Заявляемый штамм обладает широким спектром фунгицидной активности и ингибирует рост следующих фитопатогенных грибов: Alternaria tenuis, Botrytis cinerea, Cercospora zeae-maydis, Fusarium oxysporum, Magnaporthe grisea, Sclerotinia sclerotiorum, Phytophthora drechsleri Tucker, Alternaria solani Soraue.
Источниками углерода для аэробного роста являются: глюкоза, сахароза, маннит, мальтоза и лактоза. При использовании глюкозы, арабинозы, ксилозы и маннита выделяются кислота и ацетон. Газ не образует. Штамм гидролизует крахмал и казеин. На основании культуральных, морфологических, физиологических и биохимических признаков, а также по результатам проведенного анализа секвенсов вариабельных участков генов, кодирующих 16S rRNK, заявляемый штамм депонирован во Всероссийской коллекции промышленных микроорганизмов как Bacillus
amyloliquefaciens ВКПМ В-11443. Ген gyrB амплифицирован с использованием тотальной ДНК заявляемого штамма в качестве матрицы. По гену gyrB сравнивают и относят штамм также к Bacillus amyloliquefaciens.
4. Культивирование патогенных грибов
Для выращивания патогенных грибов Magnaporthe grisea использован картофельно-сахарозный агар (PSA), следующего состава (мас. %): сахароза - 2.0; агар-агар - 2.0; картофельный отвар - остальное; рН до 6.0-6.5. Для приготовления картофельного отвара берут 200 г очищенного картофеля, отваривают в 1 л водопроводной воды. Затем картофельный отвар используют для приготовления среды, а картофель выбрасывают. Фитопатогенные грибы: Alternaria tenuis, Botrytis cinerea, Fusarium oxysporum, Sclerotinia sclerotiorum, Cercospora zeae-maydis культивируют на среде Чапека (CzM), следующего состава (мас. %): сахароза - 3.0; NaNO3 - 0.3; КН2РО4 - 0.1; MgSO4 × 7H2O - 0.05; KCl - 0.05; FeSO4 - 0,001; агар-агар - 2.0; водопроводная вода - остальное. рН от 6,5 до 7,0.
В качестве тест-грибов используют фитопатогенные грибы китайского происхождения Alternaria tenuis, Botrytis cinerea, Fusarium oxysporum, Sclerotinia sclerotiorum получены из различных провинций Китая; грибы Cercospora zeae-maydis, Magnaporthe grisea, Phytophthora drechsleri Tucker, Alternaria solani Soraue получены из коллекции микроорганизмов Сычуаньского университета (КНР).
5. Определение фунгицидной активности заявляемого штамма
Метод лунок. Для выявления фунгицидной активности используют культуральную жидкость заявляемого штамма. Для этого тестируемые фитопатогенные грибы высевают в центр чашки Петри с картофельным агаром (мас. %: агар - 2,0; глюкоза - 1,5; картофельный отвар - до 1 л, рН - при 25°С - 7,2). В вырезанные в агаре лунки диаметром 10 мм вносят по 150 мкл 72-часовой культуральной жидкости штамма. Чашки инкубируют в темноте при комнатной температуре. Через 48 часов оценивают наличие или отсутствие зон подавления роста тест-грибов. Эффективность фунгицидного действия определяют в мм по размеру зоны ингибирования роста грибов от края лунки.
Метод линейного роста. В чашки Петри (диаметр 8,7 см) наливают по 20 мл расплавленного агара Чапека (CzM) или PSA при +50°С, в который вносят культуральную жидкость заявляемого штамма (в конечной концентрации 0.01 или 0.05%). В центр чашки Петри помещают вырезанный агаризованный блок (диаметр 7 мм) с выращенным тест-грибом. Экспериментальные чашки Петри инкубируют в течение 24-48 часов при 24°С. Рост определяют относительно тест-гриба, растущего на агаре от центра до края чашки Петри. Рост тест-гриба по всей поверхности контрольной чашки Петри (без бактерий) принимают за 100%. Результаты эксперимента учитывают после 5 или 15 дней инкубирования (в зависимости от роста грибов). Фунгицидную активность штамма рассчитывают, как % по отношению к контролю (100%) при совместной инкубации тестируемых грибов и штамма бактерий.
Изобретение иллюстрируется следующими фигурами:
Фиг. 1. Ингибирующий эффект биопрепарата на основе заявляемого штамма Bacillus amyloliquefaciens ВКПМ В-11443 против Botrytis cinerea.
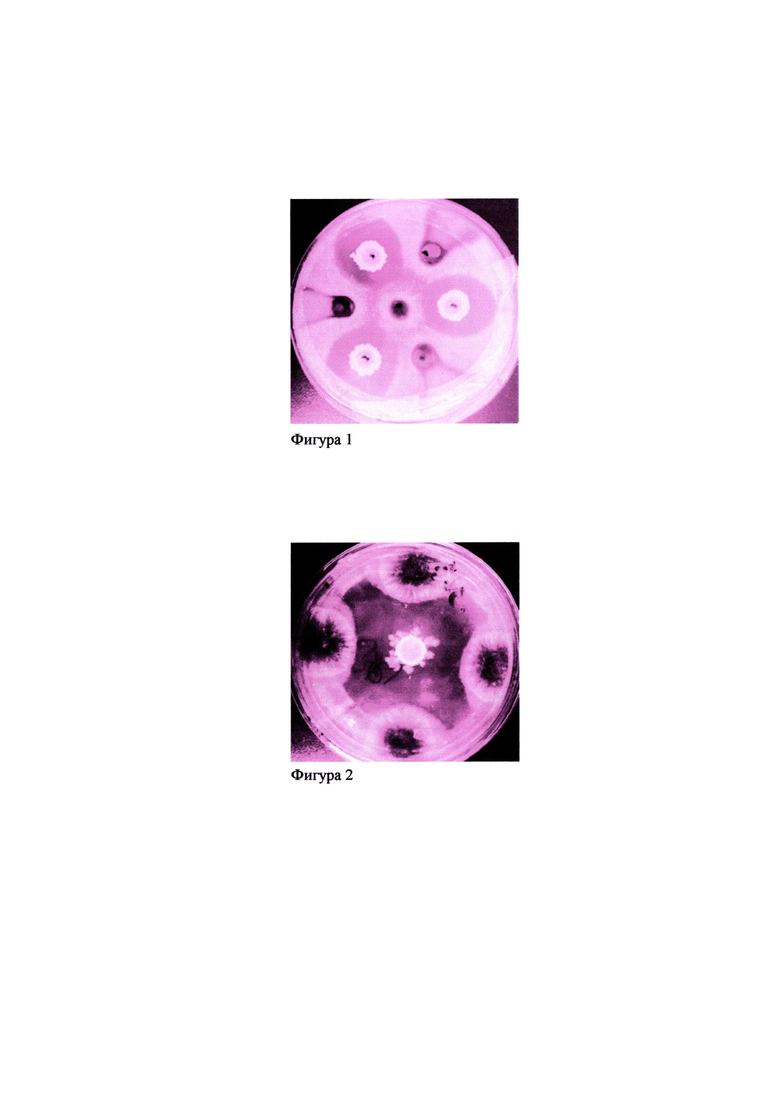
Фиг. 2. Ингибирующий эффект биопрепарата на основе заявляемого штамма Bacillus amyloliquefaciens ВКПМ В-11443 против Alternaria solani Soraue.
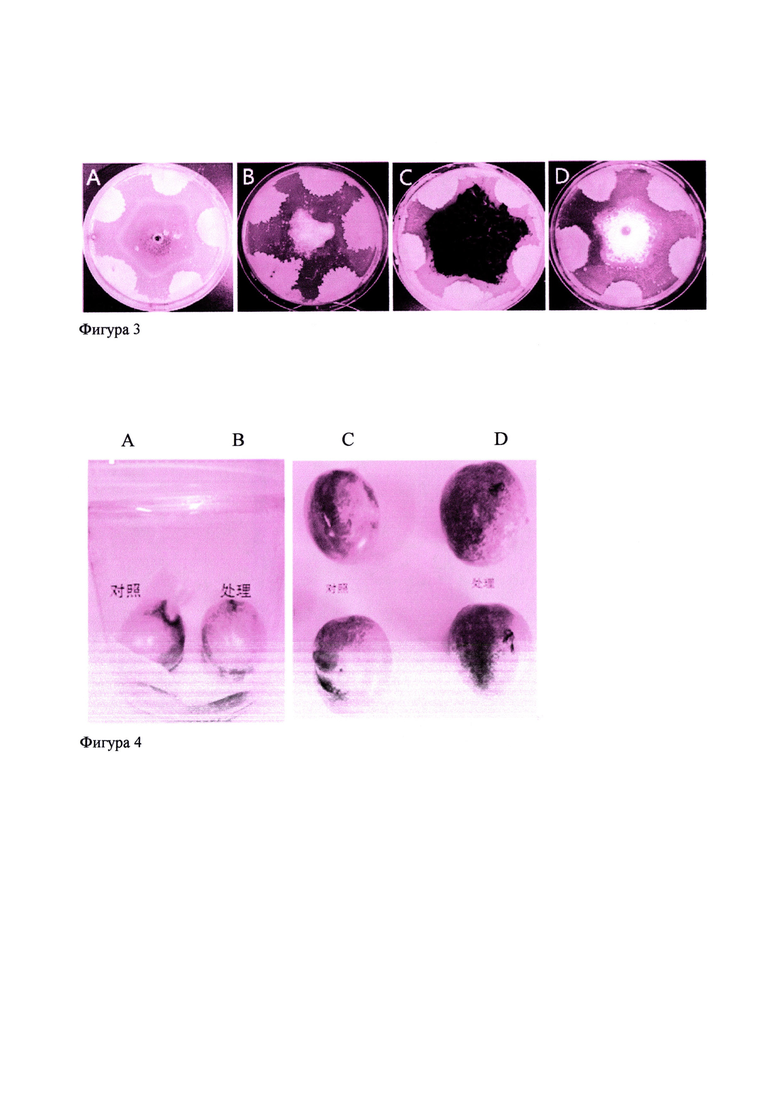
Фиг. 3. Ингибирующий эффект биопрепарата на основе заявляемого штамма Bacillus amyloliquefaciens ВКПМ В-11443 против фитопатогенных грибов: А - Fusarium graminearum; В - Pnytophthora drechsleri Tucker; C - Alternaria solani Sorauer; D - Sclerotinia sclerotiorum.
Фиг. 4. Предотвращение и контроль развития серой гнили томатов, вызванных Botrytis cinerea, биопрепаратом на основе заявляемого штамма Bacillus amyloliquefaciens ВКПМ В-11443: А - плоды томата, пораженные серой гнилью; В - плоды томата, предварительно обработанные биопрепаратом на основе заявляемого штамма; С - плоды томата, пораженные серой гнилью; D - плоды томата, обработанные биопрепаратом на основе заявляемого штамма, одновременно с контролем.
Изобретение иллюстрируется следующими примерами:
Пример 1.
Культивирование заявляемого штамма Bacillus amyloliquefaciens ВКПМ В-11443
Для культивирования заявляемого штамма используют стандартные стеклянные конические плоскодонные колбы Эрленмейера объемом 750 см3, которые заполняют 50 мл жидкой среды NBY или YM или СМ-1. Доводят рН среды до 7,0. После стерилизации колбы со средой охлаждают до +20°С. В 50 мл стерильной среды добавляют 5 мл посевного материала, выращенного в среде NBY на качалке (250 об/мин) при температуре 30°С в течение 16 часов. Бактериальную культуру штамма для получения биомассы выращивают в тех же условиях, что и посевной материал в течение 72 часов. Каждые сутки (после 24 часов роста) отбирают пробы для микробиологического контроля, который включает проверку состояния культуры. Отсутствие посторонней микрофлоры подтверждают микроскопически. К 72 часам культивирования титр культуры заявляемого штамма достигает 109КОЕ/мл. В таблице 1 представлена продуктивность заявляемого штамма по сравнению со штаммом-аналогом после культивирования в течение 72 часов в среде YM.

Из представленных в таблице 1 данных следует, что, заявляемый штамм по продуктивности несколько превышает контрольный штамм, в качестве которого использован штамм - ближайший аналог.
Пример 2.
Определение фунгицидной активности заявляемого штамма методом лунок Оценку фунгицидной активности производят методом лунок, как описано выше.
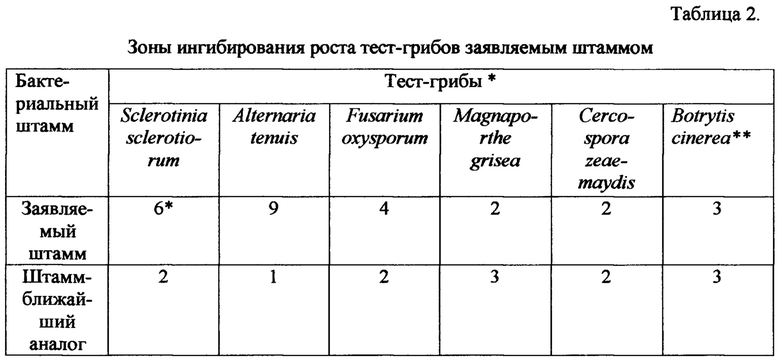
* Примечание: Зоны ингибирования роста грибов (мм) при применении культурный жидкости (разведение 1:500).
** Зоны ингибирования роста грибов Botrytis cinerea (мм) при применении культурный жидкости (без разведения).
Из представленных в таблице 2 данных следует, что заявляемый штамм по отношению к фитопатогенным грибам Sclerotinia sclerotiorum, Alternaria tenuis, Fusarium oxysporum превосходит по активности штамм-ближайший аналог, а по отношению к грибам Magnaporthe grisea, Cercospora zeae-maydis, Botrytis cinerea соответствует его уровню.
Пример 3.
Оценка фунгицидной активности разведений культурный жидкости заявляемого штамма методом лунок
Оценку фунгицидной активности проводят методом лунок, как описано выше.
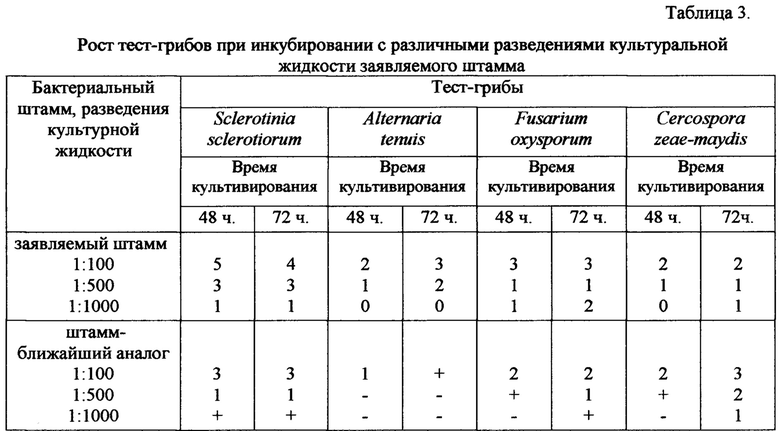
Из представленных в таблице 3 данных следует, что заявляемый штамм в условиях совместного инкубирования превосходит по фунгицидной активности контрольный штамм-ближайший аналог, на грибах Sclerotinia sclerotiorum, Alternaria tenuis, Fusarium oxysporum, а на грибах Cercospora zeae-maydis соответствует его уровню.
Пример 4.
Оценка фунгицидной активности заявляемого штамма методом линейного роста на тест-грибах Fusarium oxysporum после 15 дней совместного инкубирования
Оценку фунгицидной активности осуществляют методом линейного роста грибов, как описано выше.
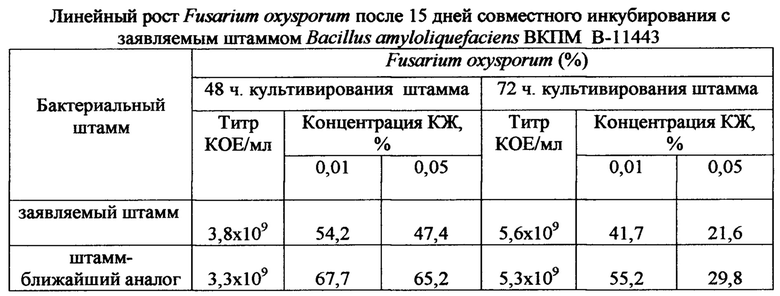
Из представленных в таблице 4 данных следует, что заявляемый штамм как после 48-часового, так и после 72-часового совместного инкубирования более активно подавляет линейный рост Fusarium oxysporum в концентрации как 0,01%, так и 0,05%, чем контрольный штамм - ближайший аналог.
Пример 5.
Оценка фунгицидной активности заявляемого штамма методом линейного роста тест-гриба Cercospora zeae-maydis
Оценку фунгицидной активности осуществляют методом линейного роста грибов, как описано выше.
Из представленных в таблице 5 данных следует, что заявляемый штамм после 72-часового совместного инкубирования лишь незначительно лучше подавляет линейный рост Cercospora zeae-maydis в концентрациях как 0,01%, так и 0,05%, по сравнению с контрольным штаммом-ближайшим аналогом.
Пример 6.
Оценка фунгицидной активности заявляемого штамма методом линейного роста тест-гриба Alternaria tenuis
Оценка фунгицидной активности осуществляют методом линейного роста грибов, как описано выше.
Из представленных в таблице 6 данных следует, что заявленный штамм после 72-часового совместного инкубирования более активно подавляет линейный рост Alternaria tenuis в концентрациях как 0,01%, так и 0,05%, чем контрольный штамм-ближайший аналог.
Пример 7.
Оценка фунгицидной активности заявляемого штамма методом линейного роста тест-гриба Sclerotinia sclerotiorum
Оценку фунгицидной активности осуществляют методом линейного роста грибов, как описано выше.

Из представленных в таблице 7 данных следует, что заявляемый штамм после 72-часового совместного инкубирования более активно подавляет линейный рост Sclerotinia sclerotiorum в концентрациях как 0,01%, так и 0,05%, чем контрольный штамм-ближайший аналог.Итак, заявляемый штамм спорообразующих бактерий Bacillus amyloliquefaciens ВКПМ В-11443 имеет более широкий спектр фунгицидной активности и подавляет рост фитопатогенных тест-грибов: Alternaria tenuis, Botrytis cinerea, Cercospora zeae-maydis, Fusarium oxysporum, Magnaporthe grisea, Sclerotinia sclerotiorum. Заявляемый штамм превосходит штамм-ближайший аналог Bacillus amyloliquefaciens CGMCC №4777 по своим фунгицидным свойствам.
Пример 8.
Оценка фунгицидной активности заявляемого биологического препарата по действию на фитопатогенные грибы Botrytis cinerea, Fusarium graminearum; Phvtophthora drechsleri Tucker, Alternaria solani Sorauer; Sclerotinia sclerotiorum в лабораторных условиях
Для определения фунгицидной активности методом лунок заявляемый биопрепарат высушивают в течение 72 часов при температуре 56-60°С для сохранения биологической активности. Из сухого порошка готовят исходный раствор из расчета: 100 мг сухого порошка разводят в 1,2 мл воды. Раствор порошка оставляют при комнатной температуре на 30 минут, затем методом последовательных разведений готовят рабочие растворы: 1:100; 1:500; 1:1000, как в примере 3. Оценку фунгицидной активности проводят методом лунок, как описано выше. В качестве положительного контроля используют аналогичные разведения исходной культуральной жидкости заявляемого штамма, а в качестве отрицательного контроля - стерильную дистиллированную воду. Результаты представлены на фигурах 1, 2 и 3. Заявляемый биопрепарат значительно ингибирует рост фитопатогенных тест-грибов. Зоны ингибирования составляют около 11-18 мм, а уровень ингибирования составляет 45-68%.
Пример 9.
Предотвращение и контроль развития серой гнили томатов, вызванной Botrytis cinerea, заявляемым биопрепаратом Биопрепарат готовят, как в примере 8.
Свежесобранные плоды томатов подвергают поверхностной стерилизации 70% этанолом в течение 30 секунд, затем промывают стерильной водой. Маленький скальпель используют для надрезания небольшого участка на плодах томата. Контрольную группу томатов опрыскивают 50 мкл стерильной воды и инокулируют
небольшим количеством серой гнили (Botrytis cinerea). Экспериментальную группу плодов томатов надрезают и распыляют 50 (мкл) по их поверхности биологический препарат, приготовленный, как в примере 8, затем инокулируют такое же количество серой гнили (Botrytis cinerea), как и в контрольном образце. Обработанные томаты помещают в стерилизованный контейнер. Контейнер с плодами - в термостат при +22°С. Статистическую обработку результатов опыта проводят через неделю.
В результате, как показано на фигуре 4, все плоды томатов в контрольной группе покрываются плесенью серой гнили, а плоды томатов, защищенные заявляемым биопрепаратом, сохраняются свежими и неповрежденными.
Из результатов, продемонстрированных в приведенных выше примерах, следует, что заявляемый штамм и биологический препарат на его основе обладают фунгицидной активностью широкого спектра действия и ингибируют рост следующих фитопатогенных грибов: Alternaria tenuis, Botrytis cinerea, Cercospora zeae-maydis, Fusarium oxysporum, Magnaporthe grisea, Fusarium graminearum, Sclerotinia sclerotiorum, Phytophthora drechsleri Tucker, Alternaria solani Soraue.
Фунгицидное действие заявляемого штамма и биопрепарата на его основе превосходит контрольный штамм-ближайший аналог Bacillus amyloliquefaciens CGMCC 4777.
Список литературы
1. Azizbekyan R. The Fungicidal Activity of Spore-Forming Bacteria. // In Bacterial Spore Formers. Probiotics and Emerging Applications, Horizon Bioscience, Norfolk UK, ds. E. Ricca, A. Henrigues, S. Cutting, 2004, 229-237.
2. Павлюшин B.A., Тютерев С.Л., Попова Э.В., Новикова И.И., Быкова Г.А., Домнина Н.С. Новые комплексные биопрепараты для защиты овощных культур от грибных и бактериальных болезней. Биотехнология, 2010 №4, 69-80.
3. Маслиенко Л.В., Шипиевская Е.Ю. Захарченко Н.С, Бурьянов Я.И., Шевелуха B.C. Выделение штаммов-продуцентов, содержащих белковые факторы подавления роста фитопатогенных грибов Sclerotinia sclerotiorum и Phomopsis helianth. Биотехнология, 2010, №3, 50-56.
4. Maldonado М.С., Corona J., Gordillo M.A., Navarro A.R. Isolation and partial characterization of antifungal metabolites produced by Bacillus sp. IBA 33. Curr. Microbiol., 2009, 59(60), 646-650.
5. Sharifi-Tehrani A, Saberi-Riseh R, Heidarian R. Antagonistic effects of several bacteria on Fusarium oxysporum, the causal agent of root and crown rot of onion under field conditions. Commun. Agric. Appl. Biol. Sci. 2004, 69(4), 657-61.
6. Lee J.P., Lee S.W., Kim, C.S., Son J.H., Song J.H., Lee K.Y., Kim H.J., Jung S.J., Moon B.J. Evaluation of formulations of Bacillus licheniformis for the biological control of tomato gray mold caused by Botrytis cinerea. Biol. Control, 2006, 37, 329-337.
7. Choi Gyung L,A., Jin-Cheol HEOL Kim, K young Soo Jang, Dong- Hyun Lee. Antifungal Activities of Bacillus thuringiensis Isolates on Barley and Cucumber Powdery Mildews. J. Microbiol. Biotechnol., 2007, 17(12), 2071-2075
8. Tendulkar S.R., Saikumari Y.K., Patel V., Raghotama S., Munshi Т.K., Balaram P., Chattoo B.B. Isolation, purification and characterization of an antifungal molecule produced by Bacillus licheniformis BC98, and its effect on phytopathogen Magnaporthe grisea. J. Appl. Microbiol., 2007, 103, 2331-2339.
9. Ongena M., Jacques P. Bacillus lipopeptides: versatile weapons for plant diseases biocontrol. Trends Microbiol., 2008, 16, 115-125.
10. Jourdan E., G. Henry G, Duby F., Dommes J., Barthelemy J., Thonart P., Ongena M., Insights into the defense-related events occurring in plant cells following perception of surfactin-type lipopeptide from Bacillus subtilis. Mol. Plant Microbe Interact. 2009, 22, 456-468.
11. Choudhary D., Johri B. Interactions of Bacillus spp. and plants - With special reference to induced stemic resistance (ISR). Microbiological Research. 2009,164, №5, 493-513.
12. Arrebola E, Jacobs R, Korsten L. Iturin A is the principal inhibitor in the biocontrol activity of Bacillus amyloliquefaciens PPCB004 against postharvest fungal pathogens. J. Appl. Microbiol. 2010, 108(2), 386-395.\
13. Alvarez F, Castro M, Principe A, Borioli G, Fischer S, Mori G, 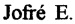 The plant-associated Bacillus amyloliquefaciens strains MEP2 18 and ARP2 3 capable of producing the cyclic lipopeptides iturin or surfactin and fengycin are effective in biocontrol of sclerotinia stem rot disease. J. Appl. Microbiol., 2012, 112(1), 159-174.
The plant-associated Bacillus amyloliquefaciens strains MEP2 18 and ARP2 3 capable of producing the cyclic lipopeptides iturin or surfactin and fengycin are effective in biocontrol of sclerotinia stem rot disease. J. Appl. Microbiol., 2012, 112(1), 159-174.
14 Кузин А.И., Кузнецова Н.И., Николаенко М.А., Азизбекян P.P. Штамм Bacillus amyloliquefaciens 16-K11, обладающий фунгицидной активностью против возбудителей фузариоза зерновых культур. Биотехнология, 2013, №5, 31-39.
15. Новикова И.И., Бойкова И.В., Павлюшин В.А., Зейрук В.Н., Васильева С.В, Азизбекян P.P., Кузнецова Н.И. Перспективы использования биопрепаратов на основе микробов-антагонистов для защиты картофеля при хранении. Вестник защиты растений. 2013, 4. 12-21.
16. Азизбекян P.P. Использование спорообразующих бактерий в качестве биологических средств защиты растений. Биотехнология, 2013, 1, 69-77.
17. Гагкаева Т.Ю., Гаврилова О.П., Кузин А.И., Кузнецова Н.И., Николаенко М.А., Азизбекян P.P. Влияние бактерий Bacillus amyloliquefaciens на рост и токсинообразование гриба Fusarium sporotrichioides. Биотехнология, 2014, 1, 32-37.
18. Morikawa М. Beneficial biofilm formation by industrial bacteria Bacillus subtilis and related species J. Bioscience and Bioengineering, 2006, 101, 1-8.
19. CN 102604864 A.
20. ТУ 9692-0003-59266087-05 "Материалы сорбционные и фильтрующие"
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ БАКТЕРИЙ BACILLUS AMYLOLIQUEFACIENS, ОБЛАДАЮЩИЙ ФУНГИЦИДНЫМ И БАКТЕРИЦИДНЫМ ДЕЙСТВИЕМ, И БИОЛОГИЧЕСКИЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ЗАЩИТЫ ОВОЩНЫХ РАСТЕНИЙ ОТ ГРИБНЫХ И БАКТЕРИАЛЬНЫХ БОЛЕЗНЕЙ | 2023 |
|
RU2808722C1 |
| СПОСОБ КОНТРОЛЯ ГРИБОВ | 2021 |
|
RU2837648C1 |
| Композиция с противогрибковой активностью | 2023 |
|
RU2827161C1 |
| ШТАММ БАКТЕРИЙ BACILLUS AMYLOLIQUEFACIENS, ОБЛАДАЮЩИЙ ФУНГИЦИДНЫМ И БАКТЕРИЦИДНЫМ ДЕЙСТВИЕМ, И БИОЛОГИЧЕСКИЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ЗАЩИТЫ ЗЕРНОВЫХ РАСТЕНИЙ ОТ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ ФИТОПАТОГЕННЫМИ ГРИБАМИ | 2013 |
|
RU2528058C1 |
| Штамм гриба Trichoderma asperellum для получения биопрепарата комплексного действия для растениеводства | 2016 |
|
RU2634415C1 |
| БИОПРЕПАРАТ ДЛЯ СТИМУЛЯЦИИ РОСТА И ЗАЩИТЫ РАСТЕНИЙ ОТ БОЛЕЗНЕЙ, ПОВЫШЕНИЯ УРОЖАЙНОСТИ И ПОЧВЕННОГО ПЛОДОРОДИЯ | 2011 |
|
RU2478290C2 |
| ШТАММ PENICILLIUM CHRYSOGENUM ВКМ F-4876D ДЛЯ ПОЛУЧЕНИЯ БИОПРЕПАРАТА ДЛЯ ЗАЩИТЫ СЕЛЬСКОХОЗЯЙСТВЕННЫХ РАСТЕНИЙ ОТ ФИТОПАТОГЕННЫХ МИКРООРГАНИЗМОВ, СПОСОБ ПРОИЗВОДСТВА ПРЕПАРАТА | 2021 |
|
RU2780228C1 |
| ПРИМЕНЕНИЕ АЦИКЛИЧЕСКОГО ПИКОЛИНАМИДНОГО СОЕДИНЕНИЯ В КАЧЕСТВЕ ФУНГИЦИДА ДЛЯ КОНТРОЛЯ ФИТОПАТОГЕННЫХ ГРИБОВ В ОВОЩНЫХ КУЛЬТУРАХ | 2018 |
|
RU2769764C2 |
| ПРИМЕНЕНИЕ АМФИДИНОЛА С ФУНГИЦИДНОЙ И(ИЛИ) БАКТЕРИЦИДНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ГРИБОВ, ООМИЦЕТОВ И(ИЛИ) ПАТОГЕННЫХ БАКТЕРИЙ РАСТЕНИЙ И СЕМЯН | 2018 |
|
RU2790051C2 |
| БИОФУНГИЦИД ДЛЯ ЗАЩИТЫ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР ОТ БОЛЕЗНЕЙ И ПОВЫШЕНИЯ УРОЖАЙНОСТИ | 2015 |
|
RU2621356C1 |
Группа изобретений относится к биотехнологии и производству биологических средств защиты растений. Группа изобретений включает спорообразующий штамм бактерий Bacillus amyloliquefaciens ВКПМ В-11443 и биопрепарат на его основе. Указанный штамм обладает фунгицидным действием против фитопатогенных грибов, вызывающих заболевания овощных растений. Препарат на основе данного штамма включает культуральную жидкость как комплекс спор, вегетативных клеток и продуктов метаболизма и носитель в виде гранул микрокаолина или микродиатомита в соотношении по объему от 1:3 до 1:5. Описываемый штамм и биологический препарат на его основе обладают высокой фунгицидной активностью широкого спектра действия. 2 н.п. ф-лы, 4 ил., 9 пр.
1. Штамм спорообразующих бактерий Bacillus amyloliquefaciens ВКПМ В-11443, обладающий фунгицидным действием против фитопатогенных грибов, вызывающих заболевания овощных растений.
2. Биологический препарат, включающий в качестве активного начала культуральную жидкость штамма по п. 1 и носитель в виде гранул микрокаолина или микродиатомита в соотношении по объему от 1:3 до 1:5.
| ШТАММ БАКТЕРИЙ BACILLUS AMYLOLIQUEFACIENS, ОБЛАДАЮЩИЙ ФУНГИЦИДНЫМ И БАКТЕРИЦИДНЫМ ДЕЙСТВИЕМ, И БИОЛОГИЧЕСКИЙ ПРЕПАРАТ НА ЕГО ОСНОВЕ ДЛЯ ЗАЩИТЫ ЗЕРНОВЫХ РАСТЕНИЙ ОТ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ ФИТОПАТОГЕННЫМИ ГРИБАМИ | 2013 |
|
RU2528058C1 |
| ШТАММ БАКТЕРИЙ Bacillus amyloliquefaciens subsp. plantarum BS89 В КАЧЕСТВЕ СРЕДСТВА ПОВЫШЕНИЯ ПРОДУКТИВНОСТИ РАСТЕНИЙ И ИХ ЗАЩИТЫ ОТ БОЛЕЗНЕЙ | 2015 |
|
RU2599416C1 |
| Штамм бактерий Bacillus amyloliquefaciens OPS-32 для получения биопрепарата комплексного действия для защиты сельскохозяйственных растений от фитопатогенных грибов, стимуляции их роста и повышения урожайности | 2016 |
|
RU2625977C1 |
| CN 102604864 A | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
Авторы
Даты
2019-09-26—Публикация
2018-09-28—Подача