Настоящее изобретение главным образом имеет отношение к созданию способов лечения реципиента за счет имплантации реципиенту генетически не связанных клеток. Более конкретно, в соответствии с настоящим изобретением предлагаются иммортализованные нейропроизводные клеточные линии эмбриона человека и способы лечения реципиента за счет имплантации реципиенту или пациенту этих клеточных линий.
Трансплантация органов стала успешным и широко практикуемым средством лечения различных заболеваний. Трансплантаты сердца, почек и даже легких стали обычным средством лечения во многих медицинских центрах. В несчастью, заболевания многих органов человека не могут быть устранены полной заменой всего органа на трансплантат. Например, поражения центральной нервной системы не могут быть устранены заменой пораженной ткани на трансплантат всего органа.
Так как замена пораженной ткани при помощи трансплантационной терапии всего органа невозможна, в случае многих заболеваний или даже для всех пациентов, имеющих определенные заболевания, были предприняты попытки развить способы трансплантации клеток. [Сан и др., Biomat., Art. Cells. Art. Org., 15:483-496 (1987)]. Паренхиматозные поражения, которые приводят к дефициту биологически активного соединения, могут быть подвергнуты лечению при помощи трансплантации изолированных клеток или групп клеток, которые выделяют биологически активное соединение. Например, животные с заболеванием диабетом были успешно вылечены при помощи имплантации островков Лангерганса, выделенных из поджелудочной железы донора. [Ноэль и др., Metabolism, 31:184 (1982)].
Клеточная трансплантационная терапия особенно привлекательна для лечения неврологических заболеваний. Трансплантация цельных тканей не годится для лечения неврологических заболеваний по многим причинам. Хирургическая операция с открытием мозга, что требуется для трансплантации цельной ткани, может вызвать невосстановимое повреждение путей нервной системы, приводящее к клиническим неврологическим расстройствам. Более того, неврологическая функция часто зависит от комплексных межклеточных связей, которые не могут быть восстановлены хирургически. Кроме того, клетки центральной нервной системы чрезвычайно чувствительны к гипоксии и недостатку питания. Быстрая васкуляризация трансплантатов цельных тканей является критичной, так как клетки внутри трансплантата цельной ткани часто не имеют достаточной перфузии для поддержания жизнеспособности. [Стеневи и др., Brain Res., 114:1-20 (1976)].
Известный неврологический синдром, паркинсонизм, уже являлся объектом попыток применения клеточной трансплантационной терапии. [Бьерклунд и др., Brain Res., 177: 555-560 (1979); Линдвалл и др., Science. 247:574-577 (1990); Фрид, Restor. Neurol. Neurosci., 3:109-134 (1991)]. Паркинсонизм вызывается потерей допамин-производящих нейронов в substantia nigra (в черном веществе) базальных ядер. [Бернс и др., N. Engl. J. Med., 312:1418-1421 (1985); Вольф и др., Neurobiology, 86:9011-9014 (1989)]. Паркинсонизм представляет собой заболевание неизвестной этиологии, которое характеризуется определенными клиническими проявлениями и вызывается идиопатической деструкцией указанных допамин-производящих нейронов. Паркинсонизм может быть вызван различными лекарственными средствами, например, антипсихотическими или химическими веществами, такими как 1-метил-4-фенил-1, 2, 3, 6 тетрагидропиридин. [Бернс и др., Proc. Natl. Acad. Sci. USA, 80:4546-4550 (1983) и Банкиевич и др., Life Sci., 39:7-16 (1985)].
Были предприняты попытки реверсировать клинические проявления экспериментально вызванного паркинсонизма при помощи трансплантации допаминергических клеток в стриатум (полосатое тело) пораженных животных. Генетически модифицированные фибропласты (трансфекция которых производилась вместе с ДНК, кодирующей тирозин гидроксилазу) были успешно трансплантированы животным, имеющим поражения допаминергических путей. В результате имплантации производящих допамин фибропластов улучшилась моторная функция и поведение животных. [Вольф и др., Proc. Natl. Acad. Sci. USA, 86:9011-9014 (1989); Фишер и др., Neuron, 6:371-380 (1991)]. Срок жизнеспособности трансплантата может быть увеличен, и даже могут быть продлены клинические улучшения при применении трансплантации эмбриональной ткани, если сравнивать с трансплантацией клеток, полученных после рождения. [Гейдж и Фишер, Neuron, 6:1-12(1991)]. Производилась пересадка свежих эмбриональных допаминергических нейронов в каудальное ядро обезьяны вслед за химическим повреждением нигростриарной допаминной системы. В результате трансплантации вызванные повреждением поведенческие расстройства улучшались. [Банкиевич и др., J.Neurosurg., 72:231-244 (1990) и Тейлор и др., Prog. Brain Res., 82:543-539 (1990)].
Пациенты (люди), страдающие паркинсонизмом, подвергались лечению при помощи стриарной имплантации допаминергических нейронов. [Линдвалл и др., Arch. Neurol, 46:615-631(1989); Уиднер и др., New Engl. J. Med., 327:1556-1563 (1992)]. Трансплантированные клетки были получены при абортах. До аборта производился скрининг женщин на антитела различных заболеваний, вызываемых вирусами. После имплантационной хирургии пациенты чувствовали улучшение неврологической функции. Однако они должны были пройти курс иммуно-депрессивной терапии.
Проведенные недавно исследования показывают, что трофические факторы, которые выделяются поддерживающими клетками центральной нервной системы (например, астроциты и олигодендроциты), являются критичными к сроку жизнеспособности нейронов в клеточной культуре. [О - Малли и др., Exp. Neurol., 112:40-48 (1991)]. Было показано, что имплантированные фибропласты, которые были генетически изменены для проявления (экспрессии) фактора роста нерва, увеличивают срок жизнеспособности холинергических нейронов базального переднего мозга после повреждения края - свода головного мозга, которое вызывает гибель ацетилхолиновых нейронов в базальном переднем мозге, что проявляется при болезни Альцгеймера. [Розенберг и др., Science, 242:1575-1577 (1988)].
Несмотря на то, что предыдущие попытки клеточной трансплантационной терапии неврологических нарушений дали обнадеживающие результаты, все еще остается множество существенных проблем. Поставка эмбриональной ткани для клеточных трансплантатов крайне ограничена. Для обеспечения максимальной жизнеспособности отбор свежих эмбриональных клеток должен производиться непосредственно перед проведением трансплантации. Это требует согласования процедуры имплантации с определенными абортами. Даже и в этом случае в США нет широкого предложения эмбриональной ткани. Кроме того, гестационный возраст эмбриона, от которого получают клетки, влияет на срок жизнеспособности трансплантата. [Гейдж и Фишер, см. выше]. Требование получения эмбриональной ткани только определенных гестационных возрастов добавляет определенные ограничения на наличие эмбриональных клеток для трансплантации. Кроме того, этические соображения побуждают некоторых потенциальных реципиентов трансплантатов с неохотой идти на процедуру, в которой имплантируются свежие эмбриональные клетки.
Так как эмбриональная ткань получена от свежих абортов, то существует значительный риск инфекционного заражения. Несмотря на то, что женщины, подвергающиеся абортам, которые будут давать эмбриональную ткань, проходят скрининг на множество инфекций, некоторые инфекции, такие как ВИЧ-инфекция, не могут быть обнаружены в клинике и поэтому не идентифицируются в процессе скрининга. В результате, если их широко использовать, то трансплантаты свежих эмбриональных клеток вероятно могут служить причиной многих инфекционных осложнений.
Использование иммортализованных клеточных линий позволяет преодолеть многие из указанных трудностей, связанных с необходимым количеством (трансплантатов) и инфекциями. Сообщение об иммортализованных нейропроизводных клеточных линиях эмбриона человека сделано Майером и др., Proc. Natl. Acad. Sci. USA. 82:1257-1262 (1985), а также в патенте США No. 4707448. Следует иметь в виду, что иммортализованные клеточные линии, по самой их природе предрасположены к образованию опухоли вслед за трансплантацией in vivo. В результате, терапевтические интрацеребральные трансплантации иммортализованных клеток обладают высоким риском возникновения внутричерепных опухолей, причем даже опухоли с доброкачественной гистологией имеют плохой прогноз при их наличии в своде черепа.
В дополнение к риску возникновения опухоли, трансплантаты генетически не связанных клеток также обладают риском иммунологического отторжения трансплантата и интрацеребрального воспаления. [Уиднер и Брандин, Brain Res. Rev., 13:287-324 (1988). Все трансплантаты генетически не связанных клеток обладают этим риском. В результате, пациенты, которые прошли курс лечения при помощи интрацеребрального клеточного трансплантата, должны подвергаться курсу долговременной поддерживающей иммунодепрессии, которая даже при отсутствии трансплантированных иммортализованных клеток обладает высоким риском инфекций и злокачественных осложнений.
Трансплантация иммортализованных клеток только увеличивает риск таких осложнений.
Поэтому срочно необходимы способы терапевтической имплантации иммортализованных клеток эмбриона человека, а также клеточные линии, пригодные для такого использования. В идеальном случае такие способы не должны приводить к образованию опухоли или вызывать сильное воспаление после трансплантации. Желательно, чтобы в таких способах могли быть использованы клетки, производные от клеточных линий, так чтобы был сведен к минимуму риск инфекционного заражения и ограниченной доступности клеток. Удивительным образом настоящее изобретение позволяет удовлетворить указанные и другие связанные с ними потребности.
В соответствии с настоящим изобретением предлагаются способы лечения реципиента, при которых предусматривается имплантация реципиенту клеток иммортализованной нейропроизводной клеточной линии эмбриона человека. Обычно клеточная линия является производной от астроцитов эмбриона человека, например, представляет собой SVG клеточную линию. Клетки часто подлежат имплантации в центральную нервную систему реципиента. Клетки могут быть капсулированы при помощи мембран, которые проницаемы для антител реципиента.
В соответствии с некоторыми вариантами настоящего изобретения, трансфекция клеток может быть произведена с последовательностью нуклеиновой кислоты, кодирующей пептид. Пептиды обычно являются ферментами, такими как тирозин гидроксилаза, или факторами роста, такими как фактор роста нерва. Пептид также может быть связанным с заболеванием антигеном. Имплантация клеток может производиться для лечения или для профилактики. В некоторых случаях клетки могут быть удалены после имплантации.
В соответствии с дополнительными вариантами настоящего изобретения, в нем предлагается иммортализованная нейропроизводная клеточная линия эмбриона человека, которая содержит ксеногенную последовательность нуклеиновой кислоты, причем клеточная линия способна проявлять (экспрессировать) ксеногенную последовательность нуклеиновой кислоты. Особенно предпочтительные клеточные линии способны проявлять нуклеиновую кислоту, которая кодирует тирозин гидроксилазу. В более предпочтительных аспектах, клеточные линии в соответствии с настоящим изобретением способны проявлять серотонин.
В соответствии со связанным вариантом настоящего изобретения, в нем предлагается состав трансплантата, который содержит клеточные линии в соответствии с настоящим изобретением, а также фармацевтически приемлемый носитель.
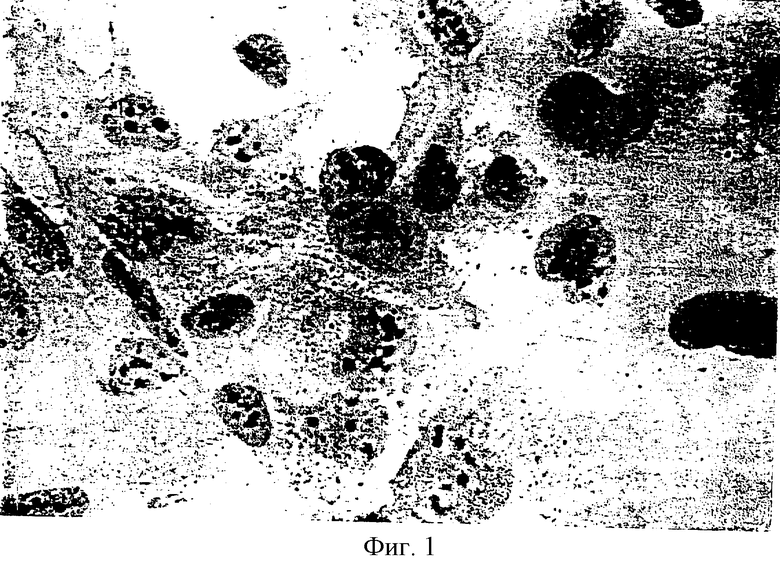
На фиг.1 показана морфология клеток SVG in vitro.
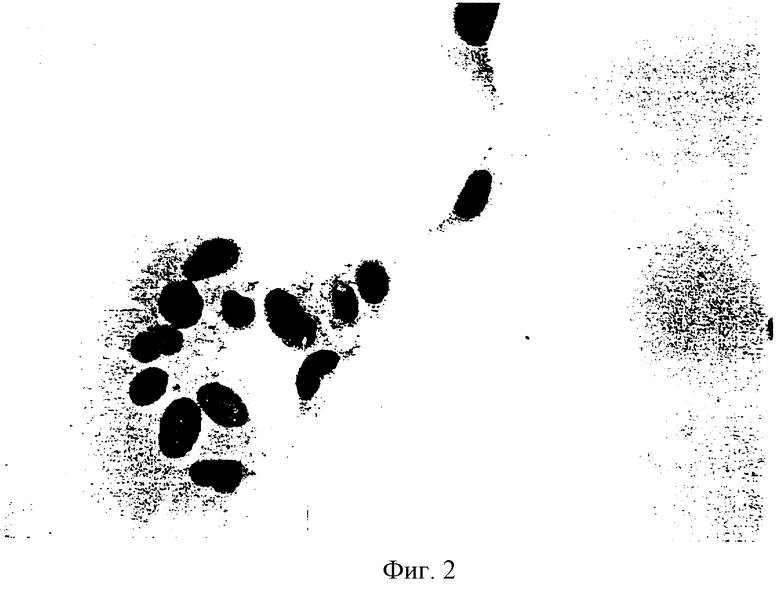
На фиг.2 показано окрашивание иммунопероксидазы антитела протеина SV40 Т в SVG клетках.
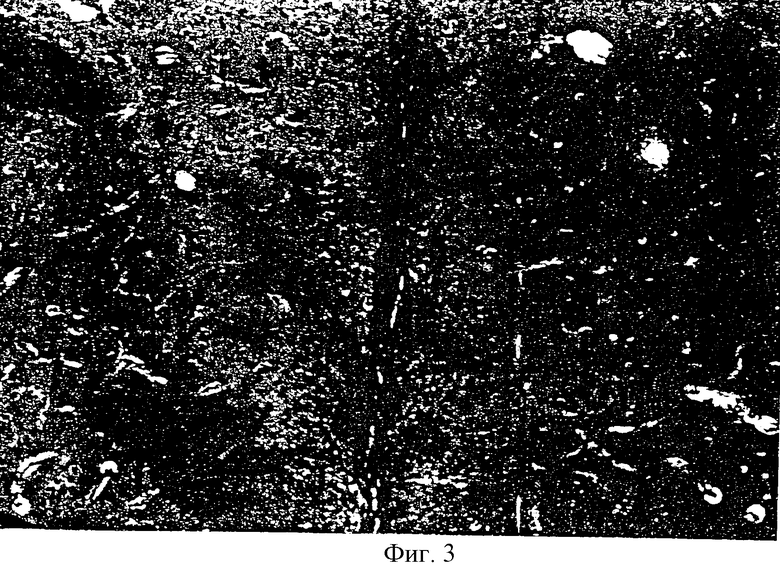
На фиг.3 показан след иглы в базальных ядрах при низком увеличении.
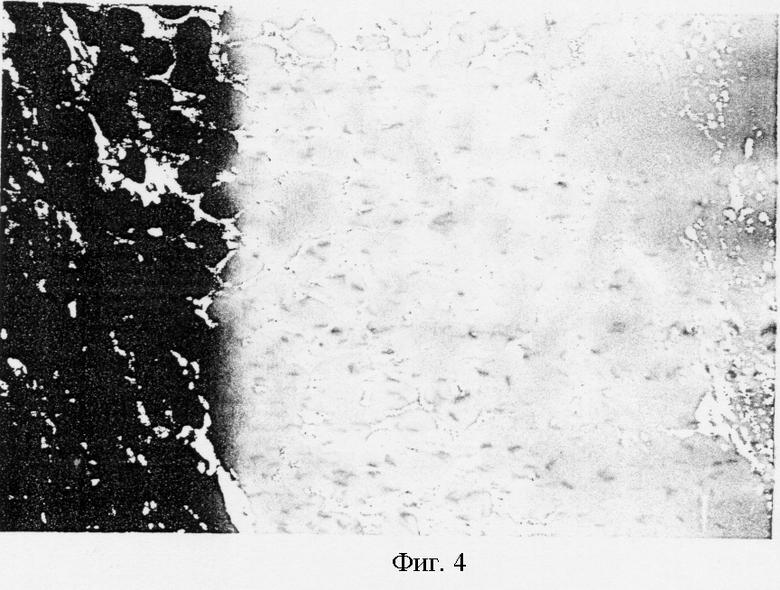
На фиг.4 показан след иглы в базальных ядрах при высоком увеличении.
На фиг.5 показан другой вид следа иглы в базальных ядрах при высоком увеличении.
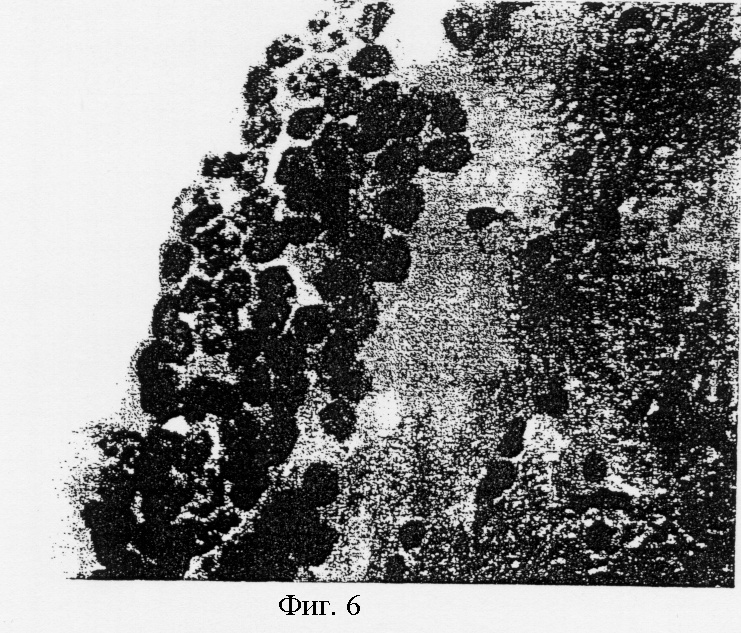
На фиг.6 показано гнездо SVG клеток на стенке бокового желудочка.
На фиг.7 показаны имплантированные SVG клетки на стенке бокового желудочка, окрашенные антителом глиального фибриллярного кислотного протеина.
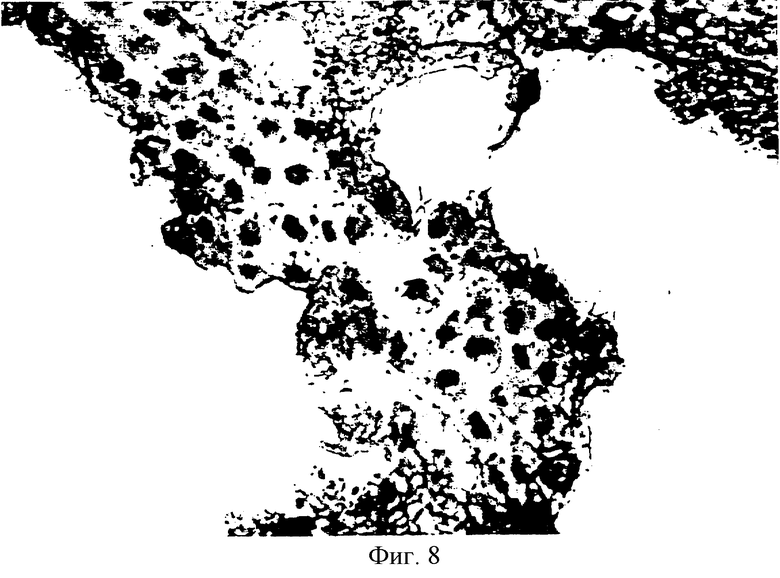
На фиг.8 показано сечение in vivo имплантированных SVG клеток, окрашенных антителом анти-Т-протеина.
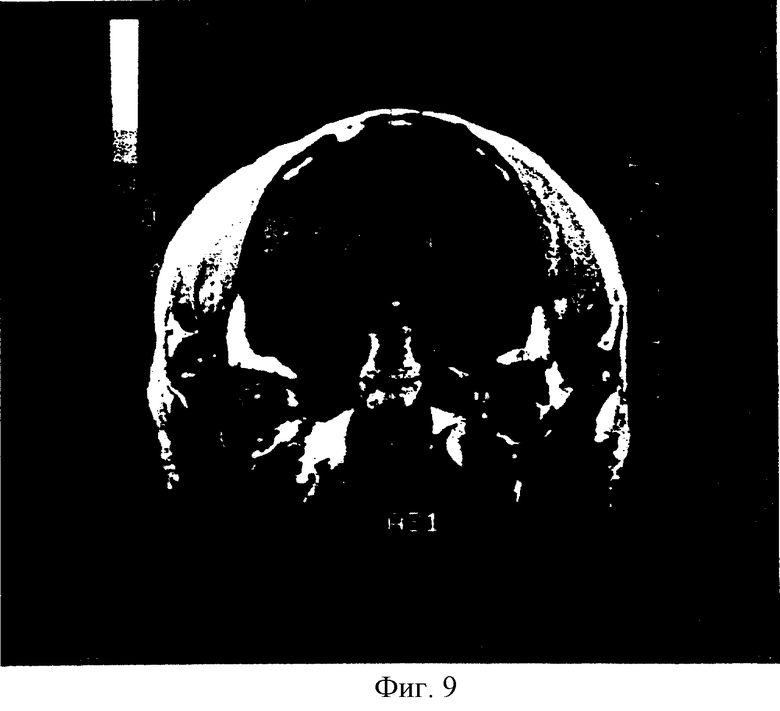
На фиг.9 показан T1 взвешенный MRI (с усилением гадолиния) мозг обезьяны через 6 месяцев после имплантации.
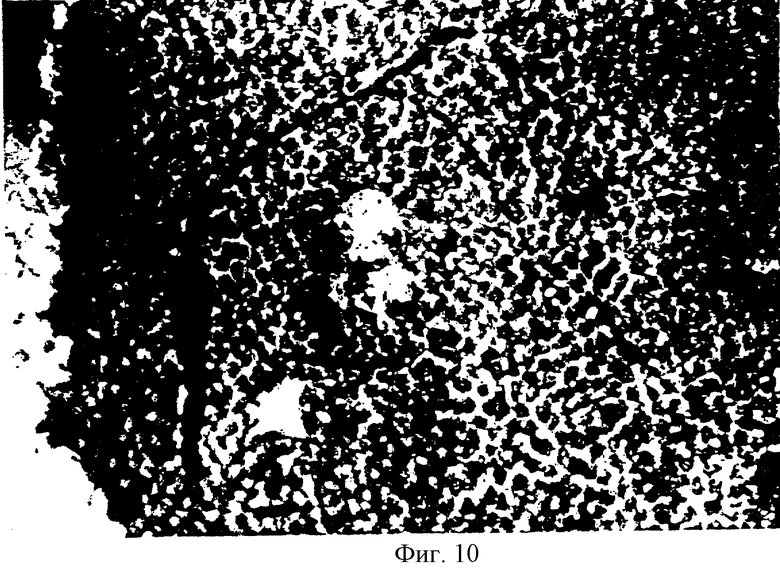
На фиг.10 показан рост нейрона тирозин гидроксилазы на слое имплантированных SVG клеток in vivo.
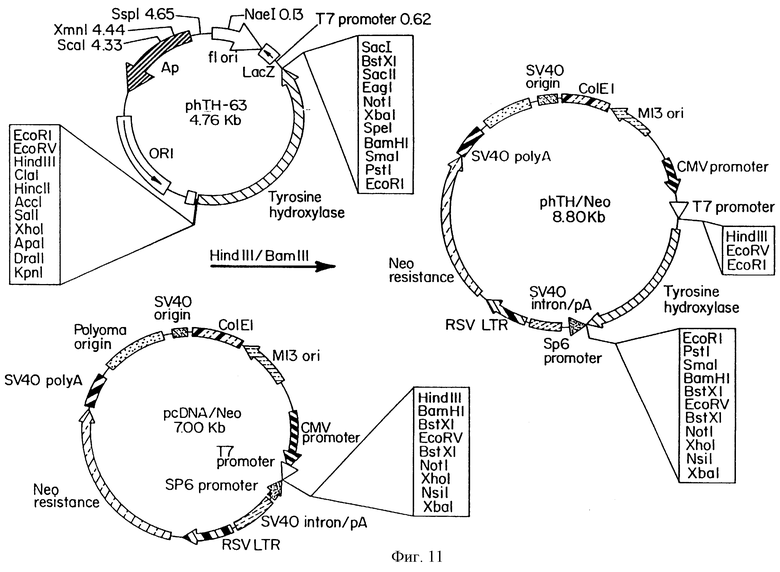
На фиг.11 схематично показано образование плазмида, использованного при образовании SVG-ТН клеточных линий.
На фиг.12 показано иммуногистохимическое окрашивание тирозин гидроксилазой стабильного phTH/Neo трансфектанта.
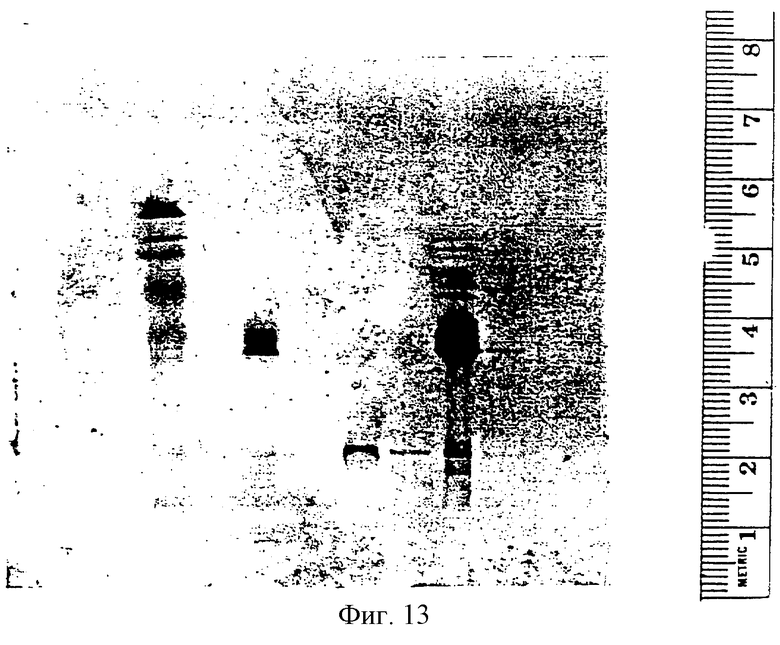
На фиг.13 показан вестерн-блоттинг одного ТН положительного клона (1В1В), который подтверждает иммуногистохимию, показанную на фиг.12.
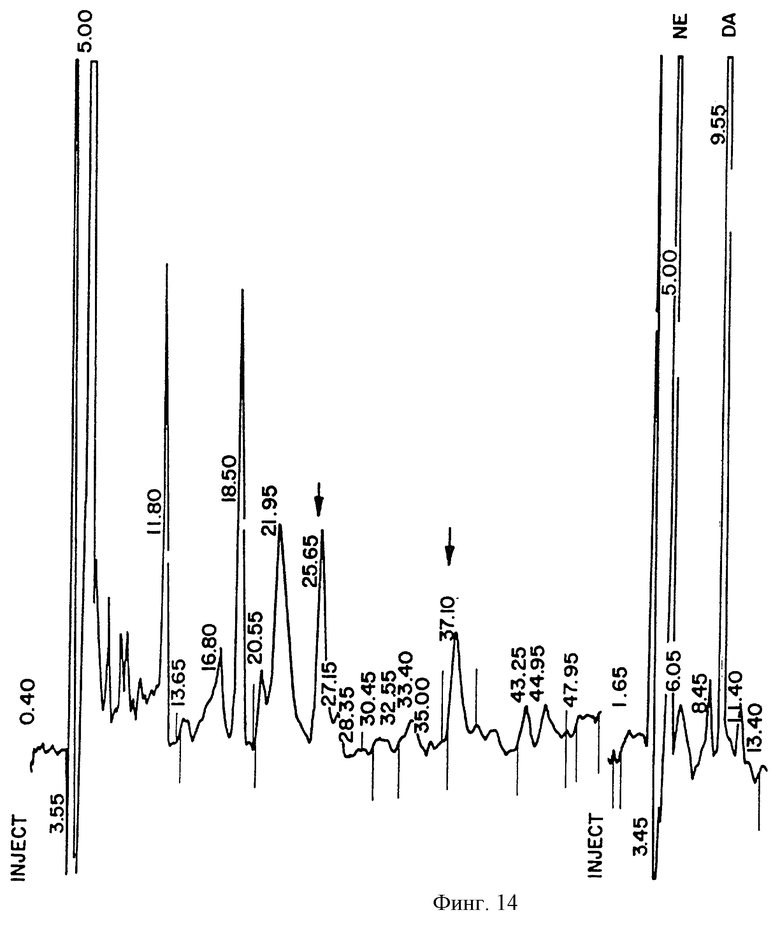
На фиг.14 показана хроматограмма, полученная при анализе HPLC (ВЭЖХ) супернатанта клеточной культуры SVG-TH. Два пика, с временами удерживания 25, 65 и 37, 1 минуты, соответствуют временам удерживания для серотонина и 5-гидроксииндолеуксусной кислоты, продукта распада серотонина. Это было подтверждено иммуногистохимическим окрашиванием SVG-TH клеток для серотонина.
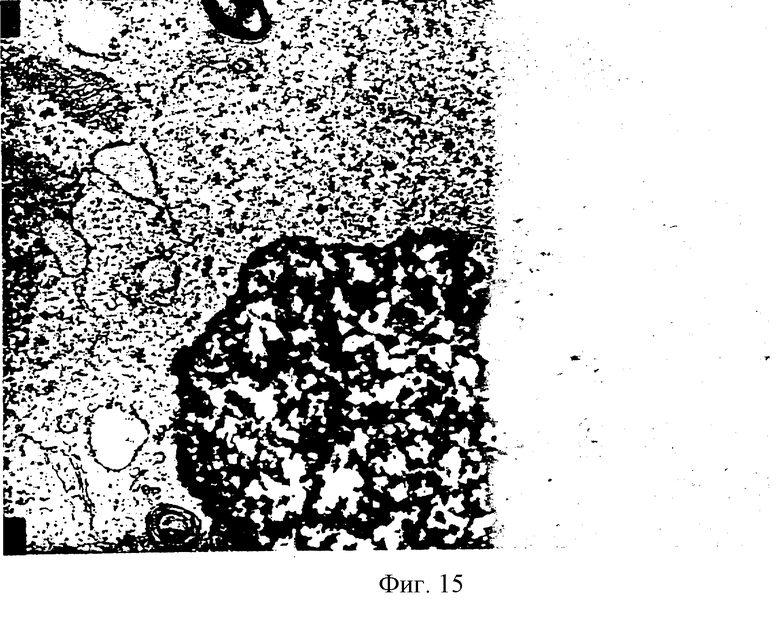
На фиг.15 показана электронная микрофотография SVG-TH клеток.
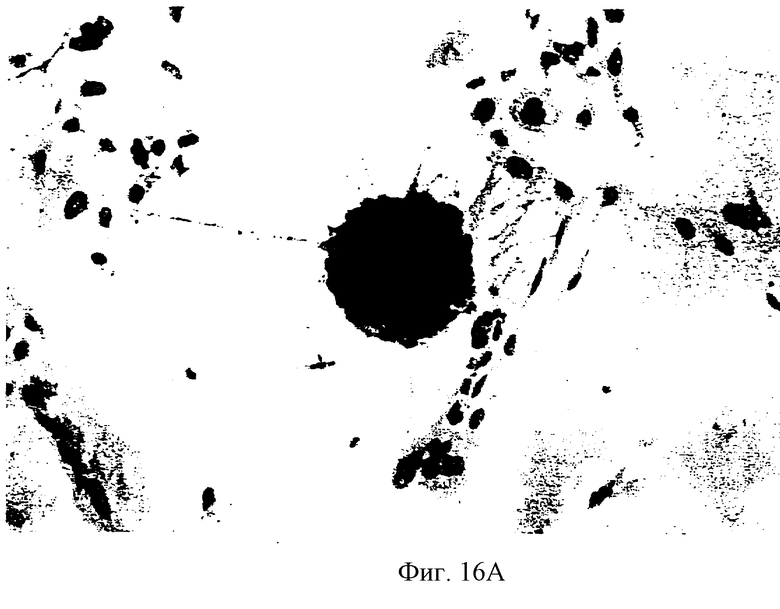
На фиг.16А показано иммуногистохимическое окрашивание клеток из сокультивации hNT/SVG-TH, по истечении ориентировочно 72 часов. Небольшие плоские клетки представляют собой SVG-TH клетки. На фиг.16В показано иммуногистохимическое окрашивание клеток из сокультивации PC12/SVG-TH, по истечении ориентировочно 72 часов. Клетка PC 12 показана вблизи от центра фотографии, с нейронными отростками, идущими от нее в окрестность SVG-TH клеток. Аналогичные результаты были получены для SVG клеток.
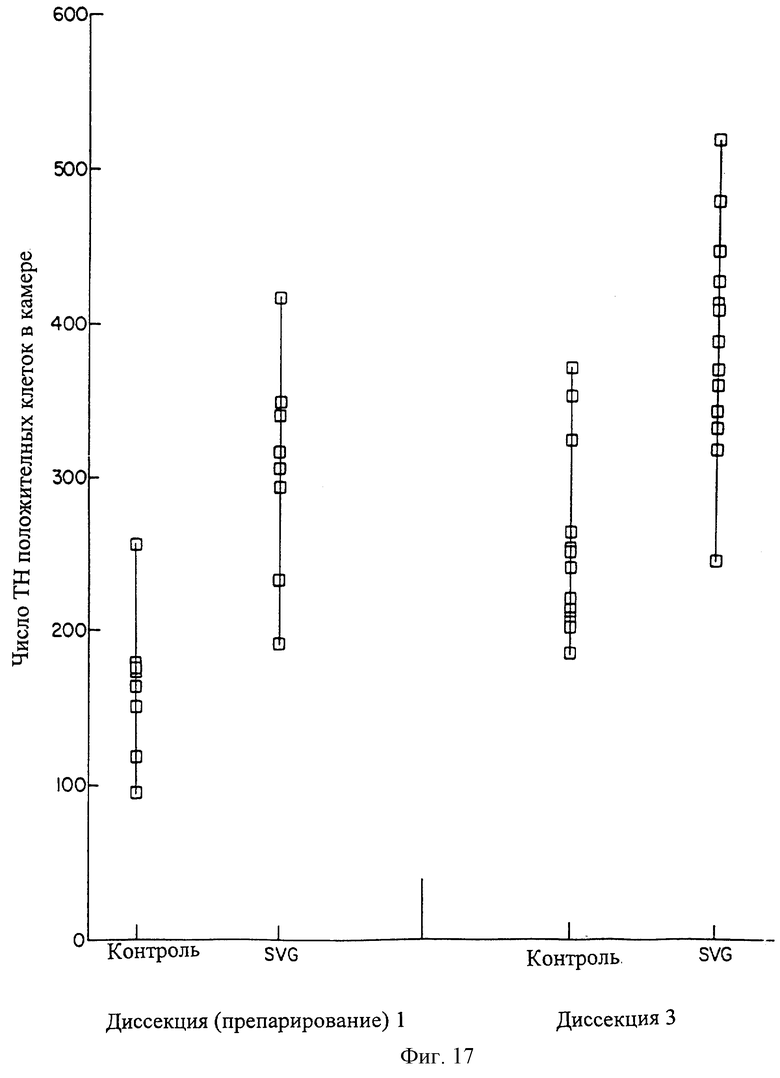
На фиг.17 показан график распределения числа ТН положительных клеток для допаминергичных клеток, посеянных в количестве 100.000 клеток в камере с лунками переноса (transwell), с наличием SVG сокультуры и без нее. Показано число ТН положительных клеток среднего мозга крысы, остающихся в камере трансвелла (по оси Y), когда эти клетки были культивированы в течение 96 часов при наличии SVG клеток и при их отсутствии. Сокультура с SVG-TH клетками дает аналогичные результаты.
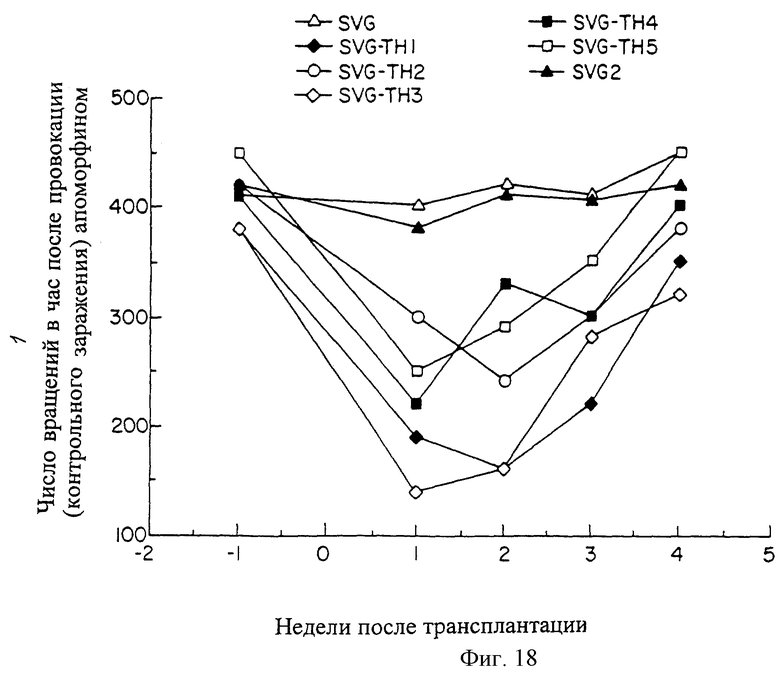
На фиг.18 показан эффект SVG-TH трансплантации для паркинсонизма моделей крыс. Функциональное нарушение указано числом вращений в час моделей крыс. Показано число вращений в час после того, как крысе был провокационно введен апоморфин (контрольное заражение), раньше и по истечении 4 недель вслед за имплантацией SVG-TH клеток в пораженный стриатум крыс (результаты показаны зачерненными квадратиками, зачерненными алмазиками, светлыми квадратиками и светлыми алмазиками). Также показаны результаты двух SVG трансплантаций (зачерненными треугольниками и светлыми квадратиками).
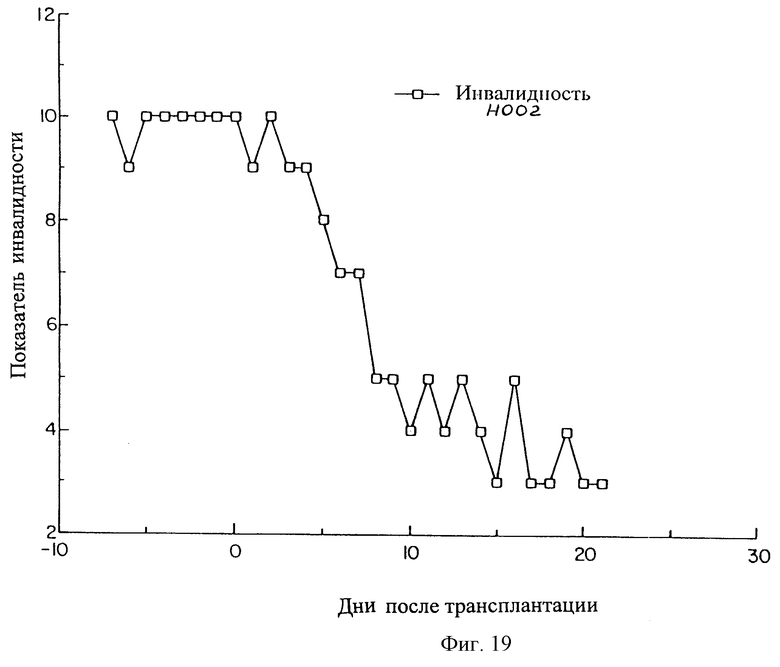
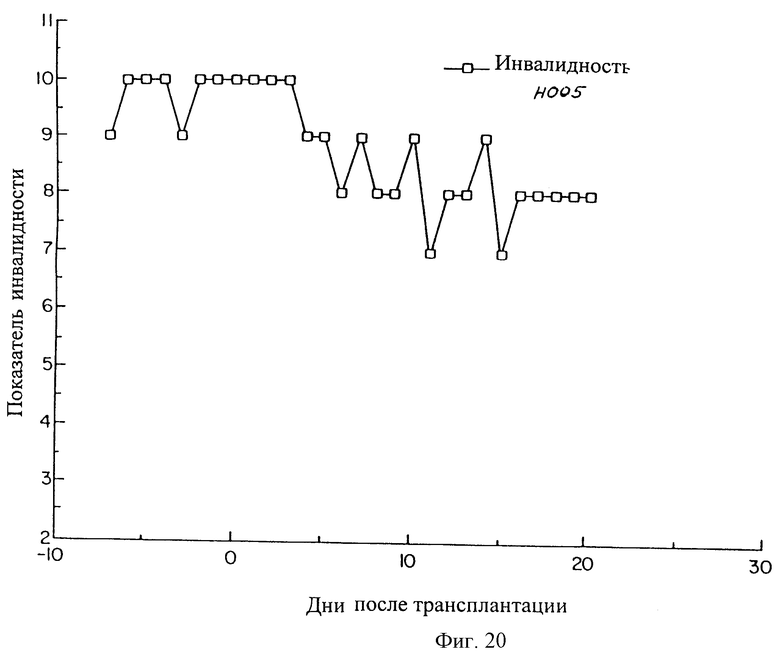
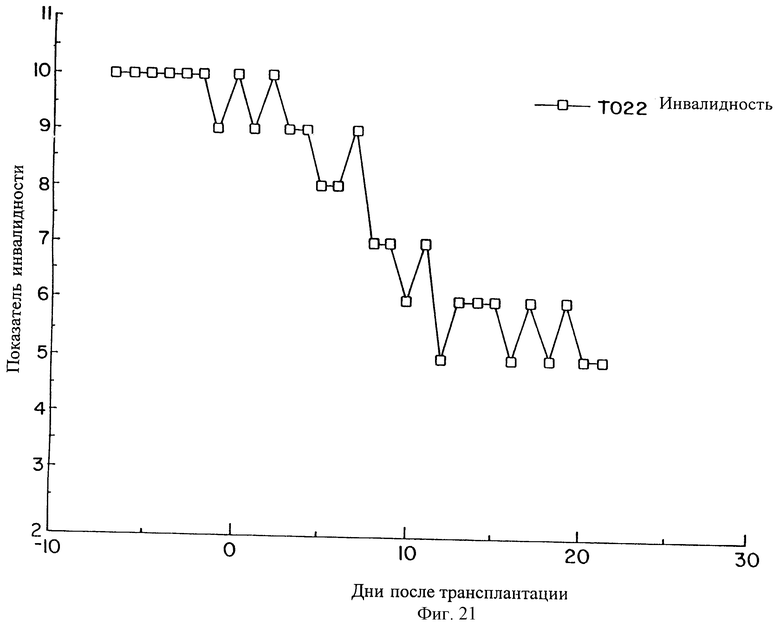
На фиг.19, 20 и 21 показано время улучшения при лечении паркинсонизма в результате приживления SVG-TH клеток в хвостатые ядра и в путамен трех макак резус (Н002, Н005 и Т022), которые получали МРТР для создания симптомов болезни Паркинсона.
Настоящее изобретение главным образом имеет отношение к иммортализованным клеточным линиям эмбриона человека, производным от клеток центральной нервной системы, и к способам использования указанных клеточных линий при лечении расстройств центральной нервной системы. В частности, клеточные линии и способы в соответствии с настоящим изобретением могут быть использованы при лечении расстройств, вызванных поражениями центральной нервной системы, такими как паркинсонизм.
I. Способы лечения
В соответствии с первым вариантом настоящего изобретения, в нем предложены способы лечения реципиента, страдающего расстройством центральной нервной системы, или способы облегчения симптомов такого расстройства, за счет имплантации иммортализованных клеточных линий эмбриона человека, производных от клеток центральной нервной системы. После имплантации таких клеток в центральную нервную систему не было проявления таких явлений, как отторжение трансплантата, интенсивное интрацеребральное воспаление и образование опухоли. Кроме того, клетки показали способность вызывать миграцию нейрона и экстензию неврита. Это свидетельствует о том, что при функционировании клеток вырабатываются трофические факторы, которые стимулируют нейронные ответы (реакции).
Имплантация иммортализованных эмбриональных клеток человека, производных от клеток центральной нервной системы, позволяет лечить многие заболевания. Например, может быть проведен курс лечения болезни Паркинсона за счет имплантации таких клеток в базальные ядра пораженного реципиента. Трофические факторы, выделяемые имплантированными клетками, могут затормозить гибель допаминергического нейрона и даже вызвать регенерацию допаминергического нейрона. Увеличенная популяция допаминергических нейронов может привести к клиническому улучшению состояния пациентов, страдающих паркинсонизмом.
В соответствии с дополнительными вариантами осуществления настоящего изобретения, может быть произведена трансфекция имплантированных клеток с нуклеиновой кислотой, которая кодирует неврологически подходящий полипептид. Термин "неврологически подходящий полипептид" в общем относится к пептиду или протеину, который катализирует реакцию с тканями центральной нервной системы. Такими пептидами могут быть природные нейронные пептиды, протеины или ферменты, а также фрагменты пептида или протеина, которые имеют терапевтическую активность внутри центральной нервной системы. Среди примеров можно указать нейронные факторы роста, а также ферменты, используемые для катализа выработки важных нейрохимикатов или их посредников. В соответствии с особенно предпочтительными аспектами настоящего изобретения, трансфекция клеток производится с нуклеиновой кислотой, которая кодирует тирозин гидроксилазу. Тирозин гидроксилаза представляет собой фермент, который преобразует тирозин в L-DOPA, который также является ограничителем скорости выработки допамина. В результате, проявление (экспрессия) тирозин гидроксилазы при помощи имплантированных клеток позволяет этим клеткам вырабатывать и секретировать допамин. Таким образом, в дополнение к усилению регенерации нейронов, имплантированные клетки могут увеличивать концентрацию допамина в черном веществе, а также ограничивать или реверсировать эффект потери допаминергического нейрона.
Способы в соответствии с настоящим изобретением могут быть также использованы для лечения других неврологических нарушений, таких как хорея Хантингтона, болезнь Альцгеймера или множественные склерозы. Иммортализованные нейропроизводные эмбриональные клетки человека являются совместимыми с центральной нервной системой (ЦНС); трансфекция этих клеток может быть произведена с последовательностями ДНК, кодирующими физиологически активные пептиды, для имплантации в ЦНС для осуществления лечения различных расстройств. Например, в случае хореи Хантингтона и амиотрофических боковых склерозов, пептид может блокировать возбудительные нейропередатчики, такие как глутамин. В случае применения для лечения, например, множественных склерозов, пептид обычно является трофическим стимулятором миелинизации, таким как производный от тромбоцита фактор роста или цилиарный трофический фактор, который может блокировать гибель олигодендроцита. Так как такие заболевания являются более общими, чем локальные поражения, желательно применение альтернативных способов имплантации. Например, клетки могут быть имплантированы на поверхность, на которую воздействует цереброспинальная жидкость. После проявления (экспрессии) и секреции пептид смывается со всей поверхности мозга за счет естественной циркуляции цереброспинальной жидкости. Желательными местоположениями для имплантации являются боковые желудочки, область поясничной оболочки и т.п. В случае болезни Альцгеймера может быть произведена трансфекция клеток для выработки фактора роста нерва для поддержания нейронов базального переднего мозга, как это описано Розенбергом и др. в публикации: Science, 242:1575-1578 (1988), которая включена в описание заявки в качестве ссылки.
Способы в соответствии с настоящим изобретением могут быть также использованы для лечения реципиентов при помощи имплантации клеток в экстранервные местоположения. Такой вариант осуществления настоящего изобретения особенно полезен для профилактического лечения реципиента. Трансфекция иммортализованных нейропроизводных эмбриональных клеток человека может быть произведена с ДНК, кодирующей связанный с заболеванием антиген, например, HIV (ВИЧ) gp120 полипептиды, которые окружают основную нейтрализующую область HIV (ВИЧ), как это описано, например, в патенте США Nо 5166050. Клетки могут затем проявлять и секретировать антиген, кодированный при помощи трансфекции ДНК. Антиген может быть непрерывно секретирован имплантированными клетками и может выявлять мощный иммунный ответ. По истечении адекватного временного интервала для полной иммунизации реципиента, клетки могут быть удалены.
Использованный в настоящем описании термин "лечение реципиента" включает в себя профилактику, паллиативное и куративное вмешательство в процесс заболевания. Использованный в настоящем описании термин "лечение" обычно относится к терапевтическим методам ослабления или устранения симптомов определенного заболевания, для которого предназначено лечение. В настоящем описании термин "реципиент" относится к любому теплокровному млекопитающему, такому как человек, приматы, грызуны и т. д., которые получают определенное лечение. Обычно использованный здесь термин "реципиент" или "пациент" относится к человеку.
Способы в соответствии с настоящим изобретением могут быть использованы для лечения самых разнообразных заболеваний и симптомов. Обычно заболеванием является неврологическое расстройство, такое как паркинсонизм (в том числе и болезнь Паркинсона), болезнь Альцгеймера, хорея Хантингтона, множественные склерозы, амиотрофические боковые склерозы, болезнь Гоше, болезнь Тея-Сакса, невропатии, мозговые опухоли и т.п. Способы в соответствии с настоящим изобретением могут быть также использованы и для лечения не неврологических заболеваний. Например, способы в соответствии с настоящим изобретением могут быть использованы для иммунизации реципиентов против инфекционных заболеваний, таких как вызванные вирусами, бактериями, протозойными, как это описано выше. Трансфекция иммортализованных нейропроизводных эмбриональных клеток человека может быть произведена с ДНК, кодирующей физиологически активные пептиды или пептиды, которые содержат иммунологические эпитопы. Способы в соответствии с настоящим изобретением могут быть использованы для имплантации пептидов, вырабатывающих клетки и непрерывно поставляющих реципиенту in vivo другие типы пептидов, таких как гормон роста.
II. Клеточные линии
Для внедрения в практику описанных выше способов лечения в настоящем изобретении также предлагаются клеточные линии, подходящие для трансплантации реципиенту или пациенту.
Обычно клетками, которые имплантированы при помощи способов в соответствии с настоящим изобретением, являются иммортализованные нейро-производные эмбриональные клетки человека. Термин "нейропроизводные" означает, что перед иммортализацией клетки имели фенотип неврологической клетки или представляли собой эмбриональную клетку, подвергнутую дифференциации для получения клетки неврологического типа. Типы неврологических клеток включают в себя астроциты, эпителиальные клетки нервного сплетения (choroid plexus), олигодендроциты, и т. п.
Приготовление иммортализованных эмбриональных клеточных линий обычно может быть осуществлено в соответствии со следующими процедурами. Отбор эмбриональных клеток может быть произведен после выборочного аборта. Женщины, от которых после аборта получают эмбрионы, должны подвергаться серологическому скринингу на различные инфекционные заболевания, в том числе на вирус иммунодефицита человека, вирус гепатита В, вирус гепатита С, цитомегаловирус и вирусы герпеса Тип 1 и 2. Гестационный возраст эмбрионов обычно равен 9-11 недель (7-9 недель после зачатия). Возраст эмбрионов может быть подтвержден ультразвуковым обследованием. Экстракция эмбрионов может быть произведена с ультразвуковой локацией для сведения к минимуму риска травмы мозга эмбриона.
После экстракции производится идентификация и диссекция (отделение) мозга эмбриона, полученного от аборта. Клетки могут быть приготовлены следующим образом. Мозговая ткань всасывается через иглу 19 калибра и дважды промывается минимальным основным средством Игла (Е-МЕМ, Gibco, New York, N.Y.). Клетки высевают на чашки Петри с обработкой поли-В-лизином (0, 1 мг/мл в течение 5 минут). Клетки растут на Е-МЕМ с добавкой 20% эмбриональной говяжей сыворотки, 75 мкг/мл стрептомицина, 75 единиц/мл пенициллина, 1% декстрозы и 2 мкг/мл фунгизона (Gibco). Перед иммортализацией клетки инкубируют при температуре 37°С во влажной среде 5% СО2. Специалисты легко поймут, что могут быть также использованы и другие способы приготовления клеток.
Клетки, которые должны быть имплантированы при помощи способов в соответствии с настоящим изобретением, могут быть иммортализованы при помощи различных видов техники. Обычно производят иммортализацию клеток следующим образом. Клеточные культуры обычно вырабатывают клетки-предшественники нейронных и глиальных клеток, а также нейроны, как это описано Мейером и Вейкантом в публикации: J.Neuropath, and Exp. Neurol, 48:425-436 (1989), которая включена в настоящее описание в качестве ссылки. При регулярной подпитке мозговые клетки имеют срок жизнеспособности несколько месяцев, но обладают малой клеточной пролиферацией. Преобразование клеток производится трансфекцией с мутантом с делецией SV40. Мутант ДНК не имеет начала репликации (ori-) и не может размножаться. Однако трансфекция ДНК придает клеткам неограниченный потенциал роста, как это описано Глузманом в публикации: Cell, 23:175-182 (1981). После роста эмбриональных клеточных культур в течение 3 недель, может быть произведена транфекция клеток с 100 мкг/на пробирку плазмида ДНК (рМК16), содержащего SV40 ori-мутант, с использованием техники осаждения фосфата кальция, как это описано Грэхемом и др., Virol, 52:456-467 (1973). Альтернативно, трансфекция клеток может быть произведена при помощи электропорации или при помощи других хорошо известных техник, как это описано Сембруком и др. в публикации: Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Press (1988), которая включена в настоящее описание в качестве ссылки. После трансфекции рост культур осуществляется при еженедельной подкормке. По истечении нескольких недель пролиферация глиальных клеток в отдельных областях чашек Петри становится очевидной. После этого производится перенос клеток при помощи трипсинизации (0,025%) в новые культуры. Трансформированные клетки могут быть идентифицированы флюоресцентным анализом антител, при котором обнаруживают SV40 Т-протеин, который проявлен трансформированными клетками (фиг.2). Пассажи клеток осуществляют каждые 10 дней, пока не будет обнаружено увеличение числа положительных клеток Т-протеин.
Трансформированные клетки проявляют фенотип непрерывной клеточной линии. В частности, клетки растут до высокой плотности насыщения с временем генерации 18 часов. Однако клетки не проявляют трансформированный фенотип или независимый от якорной подложки рост, что является характеристическим для немутантных SV40 трансформированных клеток. Морфология клеток также не изменяется в ходе установления клеточной линии. Фокусы (центры) клеток обычно не обнаруживаются. Особенно полезными клетками являются клетки от SVG клеточной линии, внесенной в Американскую коллекцию типов культур, Роквилл MD, (А. Т. С. С. CRL 8621), которая описана в патенте США No 4707448, включенном в настоящее описание в качестве ссылки (фиг.1). В дальнейшем изложении термины "клетки SVG" или "клеточная линия SVG" означают клетки или клеточную линию А. Т. С. С. CRL 8621. Под производными подразумевают субклон, реплику или генетически измененный мутант клеточной линии А. Т. С. С. CRL 8621.
Альтернативно, клетки могут быть иммортализованы при помощи других видов техники, которые хорошо известны сами по себе. Например, может быть использована иммортализация при помощи вируса Эпштейна-Барра, как это описано в патенте США No 4464465, включенном в настоящее описание в качестве ссылки. Особенно полезны мутанты вируса Эпштейна-Барра, в которых отсутствуют начала репликации OriP и OriLyt. Другим полезным способом иммортализации является сверхэкспрессия клеточного гена для контроля роста, такого как с-myc, как это описано Бартлеттом и др. в публикации: Proc. Natl. Acad. Sci. USA. 85:3255-3259 (1988), включенной в настоящее описание в качестве ссылки. Обычно подходящие для имплантации трансформированные клетки являются зависящими от якорной подложки, не растут в мягком агаре и не образуют фокусы (центры).
Затем может быть определено гистологическое происхождение трансформированных клеток. Характеристически, астроглиальные клетки могут быть опознаны по наличию промежуточного филамента, образованного глиальным фибриллярным кислотным протеином (GFAP). С другой стороны, олигодендроглиальные клетки представляют собой клетки, вырабатывающие миелин; они могут быть опознаны по их синтезу галактоцереброзида (gal С), который является компонентом миелина.
После трансформации клетки готовят для имплантации. Клетки суспендируют в физиологически совместимом носителе, таком как среда клеточной культуры (например, минимальная основная среда Игла) или в с фосфатно-солевом буферном растворе. Плотность клеток обычно составляет ориентировочно от 104 до 107 клеток/мл. Перед имплантацией клеточную суспензию осторожно перемешивают (покачивают). Объем имплантированной клеточной суспензии зависит от местоположения имплантации, целей лечения и плотности клеток в суспензии. Обычно количество трансплантированных пациенту или реципиенту клеток представляет собой "терапевтически эффективное количество". Использованный здесь термин терапевтически эффективное количество означает число трансплантированных клеток, которое требуется для эффективного лечения определенного заболевания, для которого предусмотрено лечение. Например, при лечении паркинсонизма, трансплантация терапевтически эффективного количества клеток обычно приводит к снижению количества и/или тяжести симптомов, связанных с этим заболеванием, например, ригидности, акинезии и нарушений походки. При лечении паркинсонизма при каждой инъекции обычно вводят от 5 до 60 мкл клеточной суспензии, чтобы получить указанное эффективное количество. Каждому реципиенту могут быть произведены различные инъекции. Специалисты знают, как определять надлежащие клеточные дозировки.
В соответствии с альтернативными предпочтительными вариантами осуществления настоящего изобретения, трансфекция клеток, которые пригодны для трансплантации, может производиться с ксеногенной последовательностью нуклеиновой кислоты (с возможностью ее экспрессии), которая кодирует неврологически подходящий пептид. Термин "ксеногенной", использованный здесь для описания нуклеиновых кислот, относится в основном к последовательности, которая как целое естественно не встречается в той клеточной линии, трансфекция которой произведена с этой последовательностью. Таким образом, ксеногенная последовательность может содержать фрагмент, который является совершенно инородным для клеточной линии, или альтернативно, может содержать врожденный сегмент, который встроен в клеточную линию не свойственным образом, например, имеет связь с не свойственной последовательностью промотера/усилителя, имеет связь с врожденным промотером, который обычно не объединен с сегментом, или ксеногенная последовательность снабжена множеством копий, в то время как клеточная линия обычно дает одну копию или не дает их вообще.
Обычно последовательность нуклеиновой кислоты операбельно связывают с промотором транскрипции и терминатором транскрипции. Сегмент ДНК операбельно связан, когда он помещен в состояние функциональной связи с другим сегментом ДНК. Например, промотор или усилитель операбельно связан с последовательностью кодирования, если он стимулирует транскрипцию последовательности; ДНК для сигнальной последовательности операбельно связана с кодирующей полипептид ДНК, если она проявлена как препротеин, который участвует в секреции полипептида. Обычно операбельно связанные последовательности ДНК являются смежными, а в случае сигнальной последовательности являются смежными и находятся в фазе считывания. Однако усилители не обязательно должны быть смежными с кодирующей последовательностью, транскрипцией которой они управляют. Сцепление осуществляется при помощи перевязки (лигирования) в нужных ограниченных местоположениях или у адаптеров или линкеров, введенных вместо них. Последовательность ДНК может быть также связана с усилителем транскрипции. Проявление ДНК в имплантированных клетках может быть образующим или вынужденным. Для трансфекции клеток ДНК может переносить различные, имеющие указанные характеристики векторы проявления, такие как векторы плазмида рТК2, pHyg и pRSVneo, векторы обезьянего вируса 40, векторы бычьего папилломавируса или векторы вируса Эпштейна-Барра, как это описано Сембруком и др. в публикации: Molecular Cloning. A Laboratory Manual, Cold Spring Harbor Press (1988), которая была включена ранее в настоящее описание в качестве ссылки. Векторы могут быть введены в клетки при помощи стандартных методов, например, таких как электропорация, трансфекция посредством фосфата кальция, трансфекция полибрена (polybrene) и т.п.
Пептид, кодированный нуклеиновой кислотой, обычно может быть непосредственно терапевтическим соединением, таким как ингибитор движения при лечении хореи Хантингтона. Альтернативно, пептид, кодированный нуклеиновой кислотой, может быть выбран для добавления или замены дефицитной выработки пептида эндогенными тканями реципиента, причем указанный дефицит является причиной симптомов определенного заболевания. В этом случае клеточные линии действуют как искусственный источник пептида. Альтернативно, пептид может быть ферментом, который катализирует выработку терапевтически или неврологически уместных соединений. И в этом случае такие соединения могут быть экзогенными относительно системы реципиента или могут быть эндогенными, пути синтеза которых нарушены. В этом последнем случае выработка пептида внутри ЦНС реципиента обеспечивает дополнительные пути выработки соединения. Например, в соответствии с предпочтительным вариантом настоящего изобретения, производится трансфекция иммортализованных нейропроизводных эмбриональных клеточных линий человека с нуклеиновой кислотой, которая кодирует фермент тирозин гидроксилазы. Тирозин гидроксилаза катализирует синтез допамина из тирозина. Допамин показал свою эффективность при лечении паркинсонизма.
В соответствии с особенно предпочтительными вариантами осуществления настоящего изобретения, иммортализованными нейропроизводными эмбриональными клеточными линиями, трансфекция которых была произведена с тирозин гидроксилазой, является SVG клеточная линия, например, полученная от SVG клеточной линии, внесенной в Американскую коллекцию типов культур, Роквилл MD, (А.Т.С.С. CRL 8621), которая описана в патенте США No 4707448, включенном в настоящее описание в качестве ссылки (фиг.1). Такие клеточные линии именуются здесь SVG-TH клеточными линиями. В соответствии с еще более предпочтительными аспектами настоящего изобретения, трансфекция SVG клеточной линии производится с phTH/Neo плазмидом.
Нуклиновая кислота может также кодировать трофический фактор, такой как фактор роста нерва, ингибиторный фактор роста или цитокин, используемый при лечении мозговых опухолей.
В результате своей способности усиливать регенерацию нервов и вырабатывать и секретировать допамин, клеточные линии в соответствии с настоящим изобретением особенно полезны при лечении расстройств центральной нервной системы, которые связаны с потерей допаминергичных клеток в ЦНС реципиента, таких как паркинсонизм. Удивительным образом было также обнаружено, что клеточные линии в соответствии с настоящим изобретением также способны вырабатывать дополнительные нейропередатчики. В соответствии с особенно предпочтительным вариантом настоящего изобретения, например, клеточные линии в соответствии с настоящим изобретением также способны к экспрессии (проявлению) серотонина. Серотонин задействован в случаях клинической депрессии пациентов. В частности, было обнаружено, что повышенные уровни серотонина в тканях центральной нервной системы приводят к облегчению симптомов депрессии, причем серотонин служат основой для изготовления ряда антидепрессантов, например, таких как Prozac™. Поэтому клеточные линии в соответствии с настоящим изобретением могут быть также особенно полезны в способах лечения расстройств, связанных с пониженными уровнями серотонина в ЦНС, таких как депрессия. Обычно эти способы аналогичны или в основном аналогичны способам, которые описаны здесь для лечения других расстройств центральной нервной системы.
В случае паркинсонизма клеточные линии в соответствии с настоящим изобретением имеют двойной эффект облегчения симптомов расстройства за счет секреции допамина и регенерации нервов, а также лечения депрессии, связанной с расстройством, за счет секреции серотонина.
III. Имплантация клеточных линий
Обычно клетки от клеточных линий в соответствии с настоящим изобретением могут быть имплантированы внутрь паренхимы мозга, в пространство, содержащее цереброспинальную жидкость, такое как пространство субпаутинной оболочки или желудочек, или же экстраневрально. Используемый здесь термин "экстраневрально" предназначен для обозначения областей реципиента, которые не находятся внутри центральной нервной системы или периферической нервной ткани, таких как чревный ганглий или седалищный нерв. "Экстраневральные" области могут содержать периферические нервы. Термин "центральная нервная система" предназначен для обозначения всех структур внутри dura mater (твердой мозговой оболочки).
При имплантировании клеток в мозг обычно используют стереотаксические способы, как это описано в публикации Лекселла и Джернберга, Acta Neurochir., 52:1-7(1980), и в публикации Лекселла и др., J.Neurosurg., 66:626-629 (1987), которые включены в настоящее описание в качестве ссылки. Локализация районов мишени обычно предусматривает предварительную имплантацию MRI, как это описано в публикации Лекселла и др., J.Neurol. Neurosurg. Psychiatry. 48:14-18 (1985), которая включена в настоящее описание в качестве ссылки. Координаты мишени определяют при помощи предварительно имплантированного MRI.
До проведения имплантации производят оценку жизнеспособности клеток, как это описано в публикации Брандина и др., Brain Res., 331:251-259 (1985), которая включена в настоящее описание в качестве ссылки. Вкратце, аликвотные пробы суспензии клеток (1-4 мкл) перемешивают на стеклянном слайде с 10 мкл смеси акридинового оранжевого пигмента и бромида этида (3,4 мг/ мл каждого компонента в 0,9% физиологическом растворе; Sigma). Суспензию переносят в гемоцитометр и производят визуальный подсчет жизнеспособных и не жизнеспособных клеток с использованием флуоресцентного микроскопа с эпи- освещением при 390 нм в сочетании с транс-освещением белым светом для визуализации сетки камеры подсчета. Акридиновый оранжевый пигмент окрашивает в зеленый цвет живые ядра клеток, в то время как бромид этида проникает в мертвые клетки и вызывает их оранжево-красную флуоресценцию.
Клеточные суспензии должны обычно содержать ориентировочно более 98% жизнеспособных клеток.
Инъекции обычно производят с помощью стерилизованных шприцов Гамильтона 10 мкл, имеющих иглы калибра 23-27. Шприц, наполненный клетками, устанавливают непосредственно над головой стереотаксической рамы. Иглу инъекции опускают до заданных координат через малые трепанационные отверстия в черепе и вводят 40-50 мкл суспензии при скорости около 1-2 мкл/мин, а затем ожидают дополнительно 2-5 мин до осуществления диффузии перед медленным извлечением иглы. Часто производят два раздельных ввода суспензии с промежутком 1-3 мм при одном и том же проникновении иглы, причем в одной и той же операции могут быть произведены до 5 вводов суспензии, распределенных по зоне мишени. Инъекция может быть произведена вручную или при помощи инфузионного насоса. После извлечения иглы по завершении хирургической операции реципиент извлекается из рамы и рана зашивается. При необходимости могут быть введены профилактические антибиотики или проведена иммунодепрессивная терапия.
Для лечения неврологических расстройств более общего характера, может быть произведена трансфекция клеток для экспрессии (проявления) терапевтического соединения, причем имплантация клеток производится в желудочки или в поясничную оболочку. Так как секреция терапевтического соединения осуществляется клетками, то естественная циркуляция цереброспинальной жидкости промывает терапевтическое соединение по всей центральной нервной системе, обеспечивает таким образом общее лечение. Имплантация в желудочки может быть произведена при помощи открытой процедуры, как это описано в публикации Мадразо и др., New Engl. J. Med., 316:831-834 (1987) или в публикации Пенна и др., Neurosurgerv. 22:999-1004 (1988), которые включены в настоящее описание в качестве ссылки. Имплантация клеток в поясничную оболочку может быть наиболее удобно проведена с использованием стандартных процедур, аналогичных установке радиографического контрастного средства или введению противоопухолевого лекарственного средства при помощи пункции оболочки.
В некоторых случаях в соответствии с настоящим изобретением желательно имплантировать клетки экстраневрально. Клетки могут быть имплантированы с введением через кожу при помощи иглы или эндоскопа, а также при помощи открытой процедуры. Специалисты легко найдут наиболее подходящий способ имплантации клеток для определенного применения.
Перед имплантацией клетки могут быть капсулированы при помощи мембран. Капсулирование создает барьер иммунной системе реципиента, тормозит отторжение трансплантата и предотвращает воспаление. Могут быть использованы различные способы капсулирования. В некоторых случаях применяют индивидуальное капсулирование клеток. В других случаях множество клеток капсулируют в одну и ту же мембрану. В случае последующего удаления клеток после имплантации, относительно большой размер капсулы для множества клеток удобен для возвращения имплантированных клеток. Хорошо известны различные способы капсулирования клеток, например, такие как описанные в Европейской заявке на патент No 301777 или в патентах США No 4353888, 4744933, 4749620, 4814274, 5084350 и 5089274, которые включены в настоящее описание в качестве ссылки.
Один из способов капсулирования осуществляют следующим образом. Трансформированные клетки перемешивают с альгинатом натрия (полианионным экстрактом морских водорослей) и экструдируют в раствор двухвалентных катионов, например хлорида кальция, который образует комплексы с альгинатом натрия в виде геля, что приводит к образованию гранул или капелек геля, в которых заключены клетки. Гранулы геля инкубируют полиаминовой кислотой с высоким молекулярным весом (MW 60-500×103) и с высокой концентрацией (0,03-0,1% w/v (весовых процентов в объеме)), такой как поли-Е-лизин, в течение короткого промежутка времени (3-20 мин) для образования мембраны. Внутренность образованной капсулы очищается за счет обработки цитратом натрия. Единичная мембрана вокруг клеток является высоко проницаемой (MW среза 200-400×103). Содержащая клетку единичная мембрана инкубируется в физиологическом растворе в течение 1-3 часов для вывода диффузией из капсулы захваченного альгината натрия и придания капсуле состояния равновесия. Полученная обедненная альгинатом капсула вводится в реакцию с полиаминовой кислотой с низким молекулярным весом (MW 10-30×103), такой как поли-L-лизин (PLL), или с хитозаном (деацетилированным хитином; MW 240×103), для получения интерактивной мало проницаемой мембраны (MW среза 40-80×103). После этого производят культивирование клеток, капсулированных в двойной мембране, в среде Е-МЕМ в течение двух-трех недель, как это было описано ранее.
Несмотря на то, что была сделана специальная ссылка на капсулы из альгината натрия, специалисты легко поймут, что может быть использовано любое другое не токсичное растворимое в воде вещество, которое может образовывать гель в виде удерживающей форму массы при изменении условий среды, в которую оно помещено. Такие образующие гель материалы обычно содержат несколько химических составляющих, которые легко ионизируются с образованием анионных или катионных групп, так что поверхностные слои могут иметь перекрестное сшивание с образованием постоянной мембраны при взаимодействии с противоположно заряженными полимерами. Многие полисахаридные резиновые смеси, как натуральные, так и синтетические, могут иметь перекрестное сшивание при помощи полимеров, содержащих положительно заряженные реактивные группы, такие как аминогруппы. Обладающие возможностью перекрестного сшивания биосовместимые полимеры, которые могут вступать в реакцию с резиновой смесью альгината натрия, включают в себя полилизин и другие полиаминовые кислоты. Степень проницаемости образованной мембраны может управляться правильным выбором полиаминовой кислоты, имеющей желательный молекулярный вес. Предпочтительным полимерным материалом является поли-L-лизин (PLL), но также могут быть использованы хитозан и полиакрилат. Молекулярные веса обычно лежат в диапазоне от 104 до 106.
Далее настоящее изобретение иллюстируется примерами. Эти примеры имеют только иллюстративный характер и не ограничивают настоящее изобретение.
Пример 1. Приготовление SVG клеток
В этом примере описано приготовление SVG клеток (А. Т. С. С. CRL 8621), для имплантации макакам резус. Производился скрининг на инфекции микоплазмы, HIV-1, вирус гепатита В, обезьяний вирус 40, симплекс вирус герпеса и JC вирус.
Рост SVG клеток продолжался до слияния. Рост клеток является зависящим от якорной подложки. Образование фокусов (центров) не происходит и морфология клетки является гомогенной. Клетки снимают с чашек тканевой культуры при помощи ферментации 0,05% трипсином в 0,01 М EDTA (буфер Версена) в сбалансированном солевом растворе Ханка. Сбор клеток производится при помощи центрифугирования, с промывкой 3 раза и с повторным суспендированием в фосфатно-солевом буферном растворе. Конечная плотность клеток составила 106 клеток/мл. Клеточная суспензия хранится до трансплантации при температуре 4°С.
Пример 2. Имплантация SVG клеток
В этом примере описана имплантация SVG клеток в базальные ядра шести макак резус. Имплантации были осуществлены стереотаксическим методом без хирургических осложнений.
Животные были первоначально анестезированы кетамином и поддерживались в состоянии анестезии при помощи газа изофтора в течение хирургической операции. Животные были помещены в стереотаксическую раму (Kopf) и ориентиры для имплантации были найдены при помощи стереотаксических координат. Верхний сагиттальный синус был открыт для нахождения средней линии. На череп были нанесены метки над хвостатыми ядрами и путаменом с обеих сторон. Координаты были следующие: АР был +24 мм напротив 0. Боковые координаты были 5 мм от средней линии для ядра хвостатых ядер (caudate) и 10 мм от средней линии для путамена.
Были сделаны 5 трепанационных отверстий. Одно было сделано над верхним сагиттальным синусом, два других над хвостатыми ядрами и два над путаменами. Были использованы две различные техники имплантации.
1. Были использованы шприцы Гамильтона 10 мкл с иглами калибра 26 или шприцы Гамильтона 50 мкл с иглами калибра 23. SVG клетки были трансплантированы с правой стороны мозга. При помощи шприцов в путамен были осуществлены два ввода. Один ввод был произведен в боковой путамен, а другой - в средний. Иглы от кортекса были опущены на 18 мм, а затем было введено 10 мкл суспензии с использованием микроинъектора Копфа. После первой имплантации игла выводилась со скоростью 1 мм в минуту на 3 мм, а затем проводилась вторая инъекция 10 мкл клеточной суспензии. После второй имплантации игла выводилась со скоростью 1 мм в минуту. Вторая имплантация проводилась в противоположный путамен с такими же координатами и с использованием такой же техники.
После осуществления инъекции в путамен, производилась имплантация той же самой клеточной суспензии в хвостатое ядро. Были произведены две инъекции в хвостатые ядра, в боковом и срединном аспекте. Глубина инъекции составила 15 мм, при вводе 10 мкл. Игла выводилась со скоростью 1 мм в минуту на 3 мм, а затем проводилась вторая инъекция 10 мкл клеточной суспензии. В путамен трансплантировались SVG клетки без трансфекции, а в хвостатые ядра трансплантировались SVG клетки с трансфекцией геном тирозин гидроксилазы. Концентрация клеток составляла 2×106 клеток на 1 мл.
2. В дополнение к имплантации при помощи шприцов с иглами были сконструированы канюли с синими заборными трубками и иглами калибра 22. Трубки были соединены с туберкулиновыми шприцами емкостью 1 см при помощи соединителей с нулевым мертвым объемом. После введения в мишень игла до начала инфузии выдерживалась 15 минут. После этого включался инфузионный насос Гарварда, содержащий клеточную суспензию, с расходом 0,2 мкл/мин. После проведения инфузии в течение 15 минут с расходом 0,2 мкл/мин было произведено увеличение расхода до 0,4 мкл/мин и инфузия продолжалась 100 минут. По завершении инфузии иглы выдерживались на месте 30 минут до их извлечения. Затем иглы очень медленно выводились из мозга.
Рана промывалась и затем закрывалась анатомическими слоями. Животные пробуждались от анестезии и переводились в родные клетки через 20 минут после хирургической операции.
Пример 3. Приживление SVG клеток у обезьян
В этом примере демонстрируется успешное приживление имплантированных SVG клеток у двух обезьян, которые были умерщвлены через месяц после имплантации. Трансплантированные клетки были гистологически здоровыми. Следов воспаления или образования опухоли не было.
Мозговая ткань в области имплантации исследовалась следующим образом:
Для проведения гистопаталогических исследований животные были умерщвлены сверхдозой пентобарбитала (460 мг внутривенно), с перфузией через поднимающуюся аорту 15 мл фосфатно-солевого буферного раствора (PBS), а затем 10% формалина. Мозг был извлечен очень быстро, разрезан на 6 мм венечные слои и подвергался вторичной фиксации в течение 30 минут в том же самом фиксаторе. Ткань слоев промывалась в течение 48 часов в 30%-ном растворе сахарозы в фосфатно-солевом буферном растворе (PBS), а затем быстро замораживалась при температуре -70°С. Ткань разрезалась на 40 мкм венечные срезы в замораживающем микротоме; серии срезов хранились в фосфатно-солевом буферном растворе (PBS). Производилась иммуногистохимическая обработка срезов антителами против тирозин гидроксилазы, глиального фибриллярного кислотного протеина и Т-протеина. Срезы, смежные к тем, которые исследовались на TH-IR, были окрашены гемотоксилином и эозином. Некоторые блоки ткани, которые содержали имплант, были обработаны в 5 мкм парафиновых срезах и были окрашены, как это указано выше.
На фиг.3 показан след иглы в базальных ядрах одной из обезьян при низком увеличении. На фиг.4 и 5 показаны следы иглы в базальных ядрах при высоком увеличении; в следе можно видеть жизнеспособные SVG клетки. Клетки могут быть легко идентифицированы за счет большого ядра, содержащего множество ядрышек в SVG клетках in vitro. Морфология клеток импланта удивительным образом отличается от морфологии окружающих клеток. Воспалительные клетки или признаки образование опухоли обнаружены не были.
Аналогичные тесты были проведены на обезьянах, умерщвленных через 9 месяцев после трансплантации. Был идентифицирован трансплантат, причем воспалительные клетки или признаки образования опухоли обнаружены не были, что свидетельствует о приживлении клеток и отсутствии их отторжения реципиентом.
Пример 4. MRI оценка приживления SVG клеток
В этом примере описана церебральная MRI оценка, проведенная через 1 месяц после имплантации для четырех остальных обезьян. Ни у одной из обезьян не наблюдалось признаков образования опухоли.
После введения анестезии обезьяны помещались в стандартную MRI раму. Были сделаны взвешенные изображения T1 и Т2 без контраста и T1 взвешенные изображения с гадолинием с использованием магнита 1,5 Тесла (Signa). В результатах сканирования не выявлены следы образования опухоли или узелков (фиг.9).
Пример 5
В этом примере показано функционирование трансплантированных SVG клеток внутри центральной нервной системы. Нейроны реципиента мигрировали в направлении имплантированных клеток, нейронных допаминергичных тел, а допаминергичные отростки реципиента были распространены на имплантированные клетки.
Две оставшиеся живыми обезьяны, которые получили SVG клетки в соответствии с Примером 2, были умерщвлены в соответствии с описанным. Мозг был извлечен не поврежденным в соответствии с описанным и разделен на срезы.
Каждый срез был помещен на покрытие желатином слайды. Представительные срезы были окрашены гематоксилином и эозином для выявления анатомии (фиг.6). Имплантированные клетки обладают характеристической SVG морфологией с большими ядрами, имеющими множество ядрышек. Смежные срезы были окрашены моноклональным антителом к глиальному фибриллярному кислотному протеину (GFAP), SV40 Т-протеину или тирозин гидроксилазе. После этого срезы получили контрастирующее окрашивание только при помощи гематоксилина. На фиг.7 показан смежный срез, окрашенный антителом к GFAP, который представляет собой цитоплазменный протеин астроцитной родословной. Астроцитное происхождение демонстрируется плотным цитоплазменным окрашиванием. Начало клеток также показано на фиг.8, где ясно видны имплантированные клетки, окрашенные антителом анти-Т-протеина.
Клетки трансплантата в хвостатых ядрах и путамене были жизнеспособными и легко идентифицируемыми при помощи окрашивания антителом анти-Т-протеина, как это описано выше. SVG клетки были также идентифицированы на стенках боковых желудочков всех обезьян. Допаминергичные нейроны имеют нейронные отростки в направлении имплантированных клеток. (На фиг.10 показан нейрон тирозин гидроксилазы, окрашенный антителом антитирозин гидроксилазы в слое SVG клеток in vivo). Допаминергичные нейронные тела также присутствовали в области имплантированных SVG клеток. Усиление неврита и наличие нейронных тел показывают, что SVG клетки вырабатывают нейротропные факторы, которые вызывают миграцию нейрона и распространение нейронных отростков.
Ни в одном из срезов не было обнаружено признаков воспаления, отторжения трансплантата или образования опухоли или узелка.
Пример 6. Капсуляция SVG клеток
В этом примере описана индивидуальная капсуляция SVG клеток и подготовка клеток к имплантации. Капсуляция клеток производилась в осадке центрифугирования альгината натрия.
SVG клетки растут до слияния на чашках Петри. Съем клеток с чашек Петри осуществлялся при помощи 0,05% трипсина и 1 мM EDTA в фосфатно-солевом буферном растворе Dulbecco (PBS). Была образована суспензия клеток в PBS с добавкой MgCl2, СаСl2, 0,1% глюкозы и 5% эмбриональной говяжей сыворотки. Клетки накапливались центрифугированием, промывались 2 раза в растворе суспензии, как это описано ранее, и центрифугировались до получения осадка.
Клеточный осадок на дне пробирки центрифуги вновь переводился в суспензию в 5 мл 1,5% (w/v) раствора альгината натрия (Keltone LV®, Keico Ltd, Чикаго, штат Иллинойс). Альгинатная клеточная суспензия была экструдирована в 50 мл 1,5% (w/v) раствора CaCl2. Сферические капельки суспензии были образованы при помощи генератора капелек с воздушным струйно-шприцевым насосом. Затем при помощи этого устройства суспензия клетки - альгинат натрия была экструдирована через иглу 22 калибра, расположенную внутри защитной трубки (внутренний диаметр 3 мм), через которую протекал воздух с управляемым расходом (9 л/мин). При выдавливании капелек жидкости на конце иглы при помощи шприцевого насоса (с расходом 20 см3/час), капельки отрываются за счет усилий среза, создаваемых быстро протекающим воздушным потоком. Кончик иглы удерживается на расстоянии 8 см над поверхностью раствора CaCl2, при этом образуются однородные сферические капли геля диаметром около 300-1000 мкм.
Размер и форма пробы с гелированными микрогранулами исследуется при помощи препаровальной лупы (Модель М8 Wild Heerbrugg), снабженной калиброванным окуляром. После переноса гранул геля альгината кальция, содержащего иммобилизованные клетки, в 50 мл пластиковую пробирку центрифуги с коническим дном, гранулы промываются 30 мл растворов 0,1% (w/v) CHES и 1,1% CaCl2. Объем супернатанта уменьшался после каждой промывки при помощи вакуумного аспиратора. Полупроницаемая капсульная мембрана была образована при помощи реакции капель геля с водным 0,05% (w/v) PLL раствором (M/v PLL=22.000) в течение 8 минут. После добавления PLL раствора пробирка для центрифугирования закрывалась колпачком и вручную переворачивалась с одного конца на другой в ходе реакции, чтобы капсулы не слипались друг с другом. Полученные микрокапсулы диаметром около 300-1000 мкм были промыты 30 мл растворов 0,1% (w/v) CHES и 1,1% (w/v) CaCl2 и 30 мл аликватов изотонического раствора. Капсулированные клетки были введены в контакт с 30 мл 0,03% (w/v) раствора альгината натрия в течение 4 минут, образующего внешний слой на капсулах. Внутренность микрокапсул очищается за счет обработки 30 мл 0,05 М цитрата натрия в течение 6 минут. Полученные микрокапсулы диаметром 400-1400 мкм промываются несколько раз в солевом растворе для удаления остатков цитрата, а затем подразделяются на пять 1 мл аликватов. Каждый аликват инкубируется в 10 мл среды DMEM в 25 см3 колбе с культурой при температуре 37°С в инкубаторе серии isotemp 400 СО2 (модель 413D, Fisher Scientific Co., Nepean, Ontario).
Пример 7. Генная инженерия SVG клеток для экспрессии тирозин гидроксилазы
В этом примере описана трансфекция SVG клеток с нуклеиновой кислотой, кодирующей тирозин гидроксилазу. SVG клетки, которые осуществляют экспрессию тирозин гидроксилазы, были идентифицированы в культуре после трансфекции.
Была произведена трансфекция SVG клеточных линий с нуклеиновой кислотой, кодирующей фермент тирозин гидроксилазы (ТН). Плазмид phTH-63 имеет тип 2 cDNA для тирозин гидроксилазы, клонированной в сайт EcoRl вектора KS Блускрипта. ТН cDNA был клонирован в два различных эукариотных вектора экспрессии, pcDNA/Neo и pRSV/ Neo (которые могут быть закуплены в Invitrogen Corp., Сан Диего, Калифорния). Hindin/BamHl фрагмент phTH-63, который содержит ТН cDNA, был клонирован в HindIII/Hind 1 сайт pcDNA/Neo, что приводит к получению плазмида phTH/Neol Аналогично, HindIII/Spel фрагмент phTH 63, который содержит ТН cDNA, был клонирован в HindIII/Spel сайт pRc/RSV, что приводит к получению плазмида pRSV-hTH/Neo. Как это показано на фиг.11, phTH/Neo состоит из ближайшего раннего CMV промотора выше от ТН cDNA, на плазмиде, который сообщает устойчивость к неомицину. Конструкция pRSV-hTH/Neo состоит из RSV LTR выше от ТН cDNA, на плазмиде, который сообщает устойчивость к неомицину.
Были созданы отдельные культуры SVG клеток, трансфекция каждой из которых производилась с phTH/Neo или с pRSV-hTH/Neo. После трансфекции клетки росли в среде, которая содержит 500 мкг/мл генетицина, в течение двух месяцев. При phTH/Neo трансфекции были получены 7 клонов, которые стабильно устойчивы к генетицину. Оба трансфектанта были способны вырабатывать ТН, однако при использовании конструкции pRSV-hTH/Neo были получены не имеющие долговременной стабильности клоны, по причине слабой экспрессии маркера устойчивости неомицина в этом плазмиде. Иммуногистохимическое окрашивание тирозин гидроксилазой одного из стабильных трансфектантов phTH/Neo можно видеть на фиг.12. Клоны находятся в диапазоне от 30 до 60% положительного ТН. Была проведена клональная экспансия одного из клонов (1В 1В), который был 40-60 ТН-положительным; для подтверждения иммуногистохимии был произведен его вестерн-блоттинг. Как это показано на фиг.13, при зондировании вестерн-блота поликлональным антителом на ТН, была обнаружена миграция полосы ориентировочно на 60 Kd, совпадающая с размером типа 2 ТН. В последующем клон 1В 1В был обозначен как SVG-TH.
Для определения наличия биологически активного ТН в SVG-TH клетках и для определения наличия секреции L-допа в клетках, был проведен анализ клеточной культуры супернатанта при помощи ВЭЖХ. До отбора клеточной культуры супернатанта для ВЭЖХ клетки были инкубированы в 1 мM биоптерина (BH4); биоптерин представляет собой софактор, необходимый для функции ТН. Контрольные пробы содержали супернатант SVG-TH клеточной культуры, инкубированный в отсутствии биоптерина, а также супернатант от культур родительской SVG клеточной линии, инкубированный с биоптерином или без него. Результаты приведены в табл.1.

Как это показано в табл.1, L-допа не обнаружена в родительской SVG клеточной культуре, как с биоптерином, так и без него, а также не обнаружена в SVG-TH клеточной культуре без биоптерина. Однако в том случае, когда SVG-TH клетки инкубированы с биоптерином, то в супернатанте клеточной культуры вырабатывается ориентировочно 4-6 пг/мл/мин L-допа. Это подтверждает, что ТН, который виден при иммуногистохимии и вестерн-блоттинге, является биологически активным.
Совершенно неожиданно два других больших пика были обнаружены при анализе хроматограмм ВЭЖХ супернатанта SVG-TH клеточной культуры (фиг.14), независимо от добавки биоптерина в среду. Эти два пика не видны в родительской SVG клеточной линии. При помощи ряда стандартов было определено, что один из двух пиков отображает серотонин, а другой пик отображает 5-гидроксииндолеуксусную кислоту (HIАА), продукт распада серотонина.
Для подтверждения наличия серотонина в этих клетках была проведена иммуногистохимия SVG-TH клеток с использованием поликлонального антитела к серотонину. SVG-TH клетки были положительными на серотонин как при иммуноокрашивании, так и при проведении ВЭЖХ. Выработка серотонина этими клеточными линиями является уникальной для клеток глиального происхождения, так как отсутствуют сообщения о том, что они могут вырабатывать серотонин.
SVG-TH клетки были проанализированы при помощи иммуногистохимических способов, с использованием той же панели антител, которые были использованы для анализа SVG клеток. Сравнительные результаты приведены в табл.2.

При исследовании в электронном микроскопе (ЕМ) SVG-TH клетки обнаруживают выраженное расширение гранулярной ER, что не видно в родительской SVG клеточной линии (фиг.15). Опять были легко опознаны окаймленные ямки, митохондрии и рибосомы.
Пример 8. Усиление неврита при помощи SVG-ТН клеток
Как и в рассмотренном выше случае SVG клеток, SVG-TH клетки были также проверены на их способность усиления неврита и жизнеспособность как первичных нейронов, так и нейронных клеточных линий.
А. Сокультивация hNT клеточной линии
Как это описано ранее, в экспериментах сокультивации с SVG и SVG-TH клетками была использована клеточная линия, производная от тератокарциномы человека. Эта клеточная линия получена от родительской клеточной линии тератокарциномы при помощи обработки родительской клеточной линии ретиноевой кислотой и комбинацией антимитотических веществ. После обработки родительская клеточная линия дифференцируется в пост митотические нейроны. [Андрюс П.У., Вызванная ретиноевой кислотой нейронная дифференциация клонированной эмбриональной клеточной линии карциномы человека In Vitro, Dev.BioL, 103:285-293 (1984)]. Указанные клетки, заканчивающиеся hNT нейронами, которые были использованы для проведения описанных здесь экспериментов сокультивации, сохраняют многие фенотипические качества нейронов, в том числе экспрессию нейрофиламента и секрецию нейропередатчиков. Для сохранения этих клеток они должны быть помещены в чашку Петри на ламинин или матригель и должны питаться кондиционированной средой.
В трех изолированных экспериментах клетки SVG, SVG-TH и Cos высевались в 6 чашек с лунками, которые совсем не были покрыты экстраклеточной матрицей (1×105 клеток на лунку). Через 48 часов после высева клеток SVG, SVG-TH и Cos, они были слиты на 30% и в те же лунки были посеяны 1×105 hNT клеток. Клетки hNT высевались также в четвертую лунку, которая не содержала ни одной из указанных клеточных линий и которая не была покрыта экстраклеточной матрицей. Культуры питались только D-MEM с 2% эмбриональной говяжей сыворотки. Через 48 часов после высева некоторые из hNT клеток прикрепились к зонам, свободным от SVG и SVG-TH клеток, а также прикрепились непосредственно к этим клеткам. Было обнаружено, что число hNT клеток приблизительно равно числу SVG или SVG-TH клеток. Различные небольшие отростки наблюдались в hNT клетках, сокультивированных с SVG или SVG-ТН клетками. В сокультивации hNT/Cos, клетки hNT были непосредственно прикреплены к Cos клеткам, однако не были обнаружены в зонах, свободных от Cos клеток. Дополнительно, только около 1% Cos клеток имеют прикрепленные к ним hNT клетки, причем на hNT клетках не наблюдалось никаких отростков. В контрольной чашке Петри, в случае высева только hNT клеток на необработанную поверхность, можно было видеть только редкие прикрепленные клетки. За 72 часа hNT клетки поднялись из Cos клеток и в контрольной чашке Петри hNT клетки обнаружены не были. В отличие от этого, hNT клетки в обеих сокультивациях SVG и SVG-TH остались прикрепленными и имеют длинные отростки, которые теперь вступают в контакт с окружающими SVG/SVG-TH клетками (фиг.16А). Была произведена фиксация в ацетоне/метаноле некоторых культур и осуществлена иммуногистохимия на Т-протеин для четкого различения двух клеточных популяций (фиг.16А). Эти культуры оставались жизнеспособными в течение двух недель, после чего клетки SVG и SVG-TH слились. Сокультуры были перенесены на новые чашки Петри и тот же феномен наблюдался еще раз. После двух дополнительных недель эксперименты были закончены.
В. Сокультивация PC12
В этом наборе экспериментов была произведена сокультивация клеток PC12 с клетками SVG, SVG-TH или Cos; клетки PC12 высевались также изолированно. В hNT эксперименте клетки SVG, SVG-TH или Cos высевались в 6 чашек с лунками (1×105 клеток на лунку) в необработанную пластиковую посуду. Через 48 часов клетки PC12 высевались на все три клеточные линии, а также изолированно в необработанную пластиковую посуду. Через 48 часов после осуществления сокультивации с клетками SVG или SVG-TH, клетки PC12 прикрепились к зонам, свободным от SVG и SVG-TH, а также непосредственно к клеткам SVG и SVG-TH. Клетки PC12 выпустили нейритные отростки, которые за 92 часа вступили в контакт с окружающими клетками SVG и SVG-TH. Некоторые из культур были зафиксированы в ацетоне и метаноле и была осуществлена иммуногистохимия на Т-протеин, чтобы разделить две клеточные популяции (фиг.16В). По истечении 17 дней культуры стали переросшими и эксперимент был закончен. В отличие от указанного, клетки PC12, которые были сокультивированы с клетками Cos или изолированно, совсем не выпускали отростков.
В отдельном наборе экспериментов клетки PC12 высевались изолированно на чашки Петри с покрытием поли-В-лизином, а затем питались не кондиционированной средой или средой, кондиционированной от культур клеток SVG или SVG-TH. По истечении 72 часов клетки PC12, которые питались кондиционированной средой, выпустили нейритные отростки, в то время как клетки PC12, которые питались некондиционированной средой, не изменили свою морфологию.
С. Первичные культуры эмбриональных среднемозговых нейронов крысы
Для определения способности поддержания клетками SVG и/или SVG-TH жизнеспособности первичных нейронов была произведена диссекция среднего мозга эмбрионов крыс Е13, его отделение и высев в трех наборах в 6 чашках Петри. Через 48 часов в лунках была установлена камера с лунками переноса Costar, и было произведено пассирование SVG или SVG-TH клеток в камеру с лунками переноса (1×105 клеток). Один комплект культур среднего мозга совсем не подвергался сокультивации ни с какими клетками и использовался как отрицательный контроль. Через 7 дней камера с лунками переноса с клетками была снята и культуры среднего мозга в лунках были фиксированы в ацетоне и метаноле, а также были окрашены за счет иммуногистохимии на тирозин гидроксилазу, чтобы определить число жизнеспособных (выживших) нейронов среднего мозга. Как это показано на фиг.17, те культуры среднего мозга, которые подвергались сокультивации с SVG клетками, имеют в 2-3 раза больше выживших нейронов тирозин гидроксилазы, чем в контрольном высеве. Аналогичные результаты получены для SVG-TH клеток. Не наблюдалось разницы в морфологии положительных нейронов тирозин гидроксилазы между контрольным высевом и высевом с сокультивацией.
Пример 9. Трансплантация и идентификация SVG и SVG-TH клеток в стриатуме грызунов
Для определения возможности трансплантации SVG или SVG-TH клеток в стриатум (полосатое тело) грызунов и последующей недвусмысленной идентификации результатов трансплантации, производилась трансплантация 5×105 клеток SVG или SVG-TH в стриатум крыс Sprague Dawley, с использованием стереотаксической рамы. Десяти животным были пересажены клетки SVG, а десяти другим - клетки SVG-TH. Через 3 или 7 дней после пересадки животные были умерщвлены и их мозг обработан для проведения иммуногистохимии. Пяти животным из двух групп была произведена систематическая перфузия 4% параформальдегида при умерщвлении. Срезы мозга фиксированных параформальдегидом животных были использованы для иммуногистохимического окрашивания поликлональными антителами, в то время как нефиксированные мозговые срезы были использованы для иммуногистохимического окрашивания моноклональными антителами. Недвусмысленная дифференциация пересаженных SVG или SVG-TH клеток от окружающей паренхимы может быть осуществлена на основании окрашивания SV40 Т-протеина, который был обнаружен только в пересаженных клетках. Более того, пересаженные клетки имели экспрессию тех же самых антигенов in vivo, что и in vitro, как это подтверждается иммуногистохимическим окрашиванием. Указанные антигены включают в себя виментин, серотонин, МНС человека класс I, Т-протеин и ТН. Аналогична наблюдаемой in vitro ситуация in vivo, где только 40% SVG-TH клеток были ТН-положительными. Окружающая паренхима реципиента также была иммуноокрашена на виментин и ТН. SVG-TH клетки остаются GFAP-, в то время как окружающая паренхима реципиента была четко GFAP+ астроцитами. Есть окрашивание для крысы МНС класс I окружающих паренхимальных кровяных сосудов и случайных сосудов реципиента в трансплантате, однако окрашивания пересаженных клеток нет, как это и ожидалось. При изучении под электронным микроскопом SVG-TH пересаженных клеток было обнаружено, что пересаженные клетки сохранили характеристику расширенной гранулированной эндоплазматической сети и окаймленные пузырьки, как это показано на фиг.15. Аналогичные результаты были получены для SVG клеток, за тем исключением, что SVG клетки были GFAP положительными и ТН отрицательными.
Пример 10. Трансплантация SVG и SVG-TH клеток в поврежденный 6-гидроксидопамином стриатум крыс Sprague Dawley
После подтверждения возможности идентификации SVG и SVG-TH клеток в стриатуме, следующей задачей было подтверждение возможности коррекции этими клетками функционального дефицита в модели животного с болезнью Паркинсона.
Семь крыс Sprague Dawley подвергались одностороннему химическому повреждению черного вещества при помощи 6-гидроксидопамина, с использованием стереотаксической рамы для направления лекарственного средства в соответствующее анатомическое местоположение (сайт). Через 5 недель после повреждения животные получили провокационно апоморфин для оценки степени денервации. Как это показано на фиг.18, все 7 животных имели основные скорости вращения 400 оборотов/час или более. Через 6 недель после повреждения пяти животным в пораженный стриатум были трансплантированы SVG-ТН клетки (ориентировочно 5×105 клеток). Двум животным в пораженный стриатум были трансплантированы SVG клетки. С недельным интервалом после трансплантации, всего в течение 4 недель, животным был провокационно введен апоморфин (контрольное заражение) для определения изменения их основной активности. Как это показано на фиг.18, через 1 неделю после трансплантации наблюдалось существенное снижение объема вращательного поведения у пяти животных, которым были пересажены SVG-TH клетки. В отличие от этого, животные, которым были пересажены SVG клетки, имели незначительные изменения, что и можно было ожидать, учитывая, что эти крысы были полностью денервированы и лишены возможности давать отростки допаминергичных нейронов, а SVG клетки были неспособны секретировать допамин. Однако в течение трех последующих недель животные с пересаженными SVG-TH клетками постепенно вернулись к предтрансплантационному вращательному поведению, как это показано на фиг.18.
Пример 11. Характеризация пересаженных клеток через месяц после трансплантации
Семь крыс Sprague Dawley с повреждением при помощи 6-гидроксидопамина, описанных в Примере 10, были умерщвлены через 1 месяц после трансплантации. Трем животным с SVG-TH пересаженными клетками и одному животному с SVG пересаженными клетками произведена систематическая перфузия 4% параформальдегида при умерщвлении. Трем другим животным при умерщвлении не была произведена фиксация перфузией. Срезы мозга фиксированных параформальдегидом животных были использованы для иммуногистохимического окрашивания поликлональными антителами, в то время как нефиксированные мозговые срезы были использованы для иммуногистохимического окрашивания моноклональными антителами.
Пересаженные клетки через месяц после трансплантации могут быть идентифицированы иммуногистохимическим окрашиванием SV40 Т-протеина, виментина, серотонина и ТН. Однако трансплантат был существенно меньше трансплантатов, которые наблюдались через 3 и 7 дней после трансплантации. Наблюдалось иммуногистохимическое окрашивание в трансплантате больших объемов Т протеина, серотонина и виментина; однако иммуноокрашивание ТН могло наблюдаться как в трансплантате, так и в окружающем денервированном стриатуме. Трансплантат может быть дополнительно идентифицирован по отсутствию окрашивания для крысы Thy 1.1, причем антиген имеет сильную экспрессию в окружающей паренхиме реципиента. В паренхиме реципиента наблюдаются маркированные астроциты вокруг трансплантата. При окрашивании срезов для крыс CD4 и CD8 множество положительных клеток было идентифицировано в трансплантате и вокруг него, что свидетельствует об иммунологическом отторжении трансплантата. Приведенные выше данные указывают, что клетки представляют собой ксенотрансплантат в ЦНС грызунов, в то время как выживание клеток в ЦНС приматов до девяти месяцев отражает тот факт, что эти клетки представляют собой аллотрансплантат в этой системе.
Пример 12. Влияния пересаженных SVG-TH клеток на показатель инвалидности при болезни Паркинсона
Были созданы экспериментальные условия, которые очень напоминают симптомы болезни Паркинсона у человека, путем введения макакам резус 1-метил-4-фенил-1, 2, 3, 6 тетрагидропиридина (МРТР). На фиг.19, 20 и 21 показаны эффекты трансплантации SVG-TH клеток в хвостатые ядра и в путамен трех макак резус, которые получали МРТР для создания симптомов болезни Паркинсона. До трансплантации макаки получали инъекции МРТР до достижения значения 10 показателя инвалидности при болезни Паркинсона (самый высокий уровень), который поддерживался в течение нескольких месяцев после проведения инъекций.
При осуществлении процедуры пересадки 750000 клеток в объеме 10 мкл были помещены в каждый из четырех сайтов в хвостатых ядрах и в путамене каждого животного. Строился график показателя инвалидности при болезни Паркинсона относительно времени после операции (в днях). В течение одной недели все три макаки показали улучшение, что отражается снижением показателя инвалидности (табл.3).

Макака Н002 (результаты 21 дня для которой показаны на фиг.19) в течение 90 дней после операции совсем не получала стандартного лекарственного средства от болезни Паркинсона (препарат Sinemet).
Текущий показатель инвалидности 2-3 для этого животного аналогичен уровням, которые можно ожидать у пациентов с болезнью Паркинсона при обычном медикаментозном лечении, и отражает улучшение относительно лечения животного препаратом Sinemet. В отличие от его состояния перед операцией животное способно само кормиться, является достаточно активным и мобильным, хорошо реагирует на окружающую обстановку и набирает вес.
Как это показано на фиг.20 и 21, макаки Н005 и Т022 также показали улучшение их показателей инвалидности, и продолжают его улучшать, хотя они и не наблюдались в течение такого длительного периода времени.
Таким образом, трансплантация SVG-TH клеток приводит к существенному улучшению состояния при болезни Паркинсона, вызванной МРТР повреждением.
Все упомянутые в настоящем описании публикации, патенты и заявки на патенты включены в него в качестве ссылок в таком объеме, который соответствует тому, который существовал бы, если бы каждая индивидуальная публикация, патент или заявка на патент была индивидуально включена в качестве ссылки.
Несмотря на то, что для ясности понимания сущности настоящего изобретения был детально описан предпочтительный вариант осуществления изобретения, совершенно ясно, что в него специалистами в данной области могут быть внесены изменения и дополнения, которые не выходят однако за рамки приведенной далее формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРАНСПЛАНТАЦИЯ НЕРВНЫХ КЛЕТОК ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ СОСТОЯНИЙ | 2005 |
|
RU2434636C2 |
| ПОЛУЧЕНИЕ ТЕРМИНАЛЬНО ДИФФЕРЕНЦИРОВАННЫХ ДОФАМИНЕРГИЧЕСКИХ НЕЙРОНОВ ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2004 |
|
RU2345133C2 |
| НЕЙРОТРАНСПЛАНТАЦИЯ С ИСПОЛЬЗОВАНИЕМ ПЛЮРИПОТЕНТНЫХ НЕЙРОЭПИТЕЛИАЛЬНЫХ КЛЕТОК | 1996 |
|
RU2185833C2 |
| ПРИМЕНЕНИЕ ПРОГРАММЫ ПРОТИВОПОЛОЖНОЙ ДИФФЕРЕНЦИРОВКИ КЛЕТОК (ППДК) ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРИРОВАВШИХ ОРГАНОВ В ПАТОЛОГИЧЕСКОМ СОСТОЯНИИ | 2008 |
|
RU2528084C2 |
| СПОСОБ ЛЕЧЕНИЯ ДЕФЕКТОВ РОГОВИЦЫ | 2004 |
|
RU2279887C2 |
| СПОСОБ ТКАНЕВОЙ ИНЖЕНЕРИИ СПИННОГО МОЗГА ПОСЛЕ ЕГО АНАТОМИЧЕСКОГО РАЗРЫВА | 2012 |
|
RU2489176C1 |
| ТРАНСПЛАНТАЦИЯ ГЕМОПОЭТИЧЕСКИХ КЛЕТОК | 2000 |
|
RU2216336C2 |
| СПОСОБ ЛЕЧЕНИЯ ДЕМИЕЛИНИЗИРУЮЩИХ РАССТРОЙСТВ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ | 1998 |
|
RU2136299C1 |
| СПОСОБ ЛЕЧЕНИЯ ТРАВМАТИЧЕСКИХ ПОВРЕЖДЕНИЙ СПИННОГО МОЗГА | 2000 |
|
RU2195941C2 |
| ДИФФЕРЕНЦИРОВКА СТРОМАЛЬНЫХ КЛЕТОК, ПОЛУЧЕННЫХ ИЗ ЖИРОВОЙ ТКАНИ, В ЭНДОКРИННЫЕ КЛЕТКИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ И ИХ ИСПОЛЬЗОВАНИЕ | 2002 |
|
RU2351648C2 |




Изобретение относится к медицине, в частности к трансплантологии. Заявлена иммортализованная нейропроизводная клеточная линия эмбриона человека, в которой SVG клетки трансфектированы плазмидой phTH/Neo, при этом указанная клеточная линия способна к экспрессии последовательности нуклеиновой кислоты, которая кодирует тирозингидроксилазу, и способна к производству и секреции допамина. Заявлена также трансплантабельная композиция, включающая клетки из клеточной линии, которые инкапсулированы при помощи мембраны из геля альгината, непроницаемой для антител. Изобретение позволяет получить материал для трансплантологии, не вызывающий побочных эффектов. 2 с.п. ф-лы, 3 табл., 21 ил.
| US 4707448 А, 17.11.1987 | |||
| US 5082670 A1, 21.01.1992 | |||
| WO 9423754 A1, 27.10.1994 | |||
| СПОСОБ ТРАНСФОРМАЦИИ ГЕНОМА ПТИЦЫ | 1988 |
|
RU2022014C1 |
Авторы
Даты
2004-08-20—Публикация
1996-06-06—Подача