Изобретение относится к физике взаимодействия ускоренных частиц с поверхностью вещества и может быть использовано при создании масс-спектрометров для проведения исследований в области молекулярной биологии.
Масса биомолекул (белков, углеводов, липидов, нуклеиновых кислот и т.д.) - одна из важнейших характеристик, знание которой необходимо для расшифровки их структуры. Известно, что при измерении масс объектов на атомно-молекулярном уровне самыми точными являются масс-спектрометрические методы. Однако их применение требует получения ионизированных молекул вещества в свободном состоянии. Трудность состоит в том, что биомолекулы как органические вещества термически неустойчивы, и к ним не применимы тепловые методы перевода исследуемого вещества в газовую фазу.
Существует несколько десорбционных методов, которые исключают макронагрев исследуемого биообразца и в то же время позволяют получать биомолекулярные ионы в свободном состоянии. К этим методам относятся плазменно-десорбционная масс-спектрометрия [1], лазерная абляция [2] и электроспрей-ионизация [3]. Перечисленные методы объединяет то, что в их основе лежит возбуждение электронной подсистемы, обусловленное неупругими потерями энергии, вводимой в биовещество.
Однако в настоящее время верхний предел измеряемых масс, достигнутый с использованием этих методов, (3-5)· 105 атомных единиц масс (а.е.м.). В то же время, например, массовый диапазон белковых молекул простирается до 5· 107 а.е.м., а молекулярная масса макромолекул дезоксирибонуклеиновой кислоты (ДНК) достигает 109 а.е.м.
Наиболее близким по технической сущности к предлагаемому способу является метод плазменно-десорбционной масс-спектрометрии. В этом методе получение биомолекулярных ионов происходит путем бомбардировки слоя биовещества атомарными (например, осколками деления 252Cf) или полиатомными (например, Aun (n=1-5)) ионами МэВ-ных энергий. Десорбция/ионизация биомолекул происходит за счет электронных потерь энергии налетающими ионами. Составляющая ядерных потерь энергии ионами, используемыми в этом методе при скоростях ~109 см/с, пренебрежимо мала.
Недостатком прототипа является то, что верхний предел масс биомолекул, измеряемых с помощью этого метода, не превышает (4-5)· 104 а.е.м.
Задачей изобретения является повышение выхода и верхнего предела масс измеряемых биомолекул. Для решения поставленной задачи предлагается способ получения биомолекулярных ионов в свободном состоянии путем бомбардировки слоя исследуемого вещества, нанесенного на подложку ускоренными металлическими нанокластерными ионами (НКИ). В этом процессе кинетическая энергия НКИ в силу их большой массы (105-109) а.е.м. и малых скоростей (104-105) см/с высвобождается исключительно в результате упругих соударений налетающих частиц с молекулами исследуемого вещества и атомами подложки. Десорбированные биомолекулярные ионы регистрируются времяпролетным масс-спектрометром. Развитие этого метода может повысить верхний предел измеряемых масс биомолекул, т.к. при ускорении НКИ могут приобретать значительную кинетическую энергию (до десятков МэВ), при этом выделение этой энергии будет происходить в самых поверхностных слоях вещества.
Предлагаемый способ получения биомолекулярных ионов осуществляют в следующей последовательности. Каплю водного раствора исследуемого вещества осаждают на отполированную металлическую подложку и высушивают в вакууме. Средняя толщина осажденного слоя составляет несколько мкг/см2, что достигается подбором концентрации биовещества в капле. Бомбардирующие частицы - отрицательно заряженные НКИ золота - десорбируют многозарядными атомарными ионами, например осколками деления от изотопного источника на основе 252Cf, из нанодисперсных слоев золота на тонких металлических подложках. Затем они ускоряются, фокусируются и направляются на биомишень. Десорбированные под действием НКИ ионизированные молекулы биовещества вытягиваются электрическим полем и ускоряются в направлении детектора - микроканальной пластины. Масса молекул определяется времяпролетным масс-спектрометром.
Преимущества предлагаемого метода состоят:
- в возможности расширения массового диапазона анализируемых биомолекул при увеличении размеров бомбардирующих нанокластеров и их энергий,
- в упрощении технологии приготовления биомишеней, поскольку нет необходимости заключать биовещество в матрицу;
- в повышении чувствительности вследствие более высокого выхода,
- в уменьшении повреждения поверхности по сравнению с облучением мишеней лазером.
Пример.
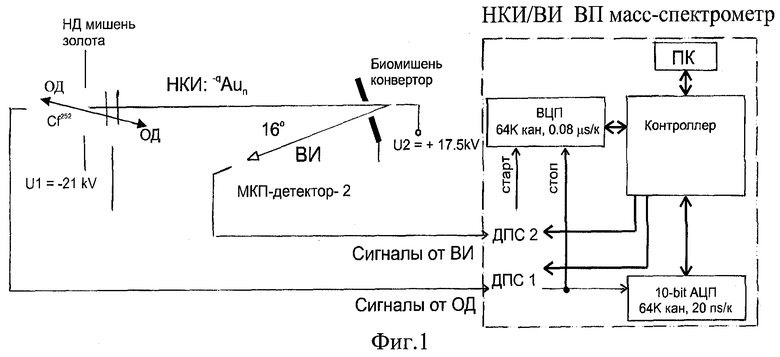
Прибор, в котором создавали и ускоряли нанокластерные ионы, облучали биомишени и измеряли времяпролетные спектры, схематически представлен на фиг.1 (подробно описан в [4]). Прибор состоит из источника нанокластерных ионов (НКИ), тракта транспортировки НКИ, конвертора (биомишени) и времяпролетного масс-спектрометра, позволяющего измерять спектры масс как НКИ, так и вторичных ионов (ВИ), эжектируемых этими НКИ из конвертора.
Отрицательно заряженные НКИ золота десорбировали из нанодисперсных слоев золота на тонких металлических подложках осколками деления от изотопного источника на основе 252Cf, описанного в патенте РФ [5].
Для создания двух различных потоков нанокластерных ионов золота со средними размерами 4, 5 нм и 12 нм использовали две нанодисперсных мишени с соответствующими распределениями островков-зерен золота по размерам. Характеристики нанокластеров, полученные с использованием известных методов [6, 7], представлены в Таблице.
Исследовали три вида биообразцов: пептид Р (Sigma chemicals, 1345 а.е.м.), бацитрацин (SERVA, Germany, 1422 а.е.м.) и апротинин (SERVA, Germany, 6500 а.е.м.). Капли водных растворов этих веществ (~0,05 мкг /мл) осаждали на подложки из золота толщиной 0,2 мм и высушивали в вакууме при давлении ~1 Торр. Средняя расчетная толщина слоев составляла 15-25 нм.
Стартовый сигнал создавался парным осколком деления. Десорбированные НКИ вначале ускоряли потенциалом 21 кВ, затем после прохождения ими первого времяпролетного промежутка дополнительно ускоряли потенциалом 17,5 кВ, приложенным к биомишени. В результате НКИ бомбардировали мишень, имея полную энергию 38,5 кВ· q, где q - заряд, средняя величина которого определяется размером НКИ (см. Таблицу).
Положительно заряженные вторичные ионы (ВИ), эжектированные из биомишени нанокластерами, выталкивались потенциалом мишени во второе времяпролетное плечо, пролетали его и детектировались стоповым микроканальным детектором. Угол между направлением первичных и вторичных ионов составлял 16 градусов. Мультистоповая система регистрации позволяла записывать времяпролетные спектры как бомбардирующих НКИ, так и ВИ.
Поскольку при данных ускоряющих потенциалах скорости НКИ слишком малы (сотни м/с), чтобы эмиттировать вторичные электроны для создания стартового сигнала для времяпролетных измерений вторичных ионов, спектры ВИ записывались в режиме самосовпадений, т.е. сигналы, создаваемые ВИ, являлись и стартовьми, и стоповыми.
Спектр самосовпадений является суммой множества единичных спектров и состоит из интенсивной линии в начале временной шкалы и широкого распределения ВИ, которые приходят на детектор после стартового иона и которые эжектируются из мишени в том же акте удара НКИ о мишень, что и ион, стартовый для данного единичного спектра. Этот режим предполагает регистрацию крупных биомолекулярных ионов в совпадении с более легкими (в пределах 1-50 а.е.м.), которые всегда присутствуют в спектре масс вторичных ионов [8].
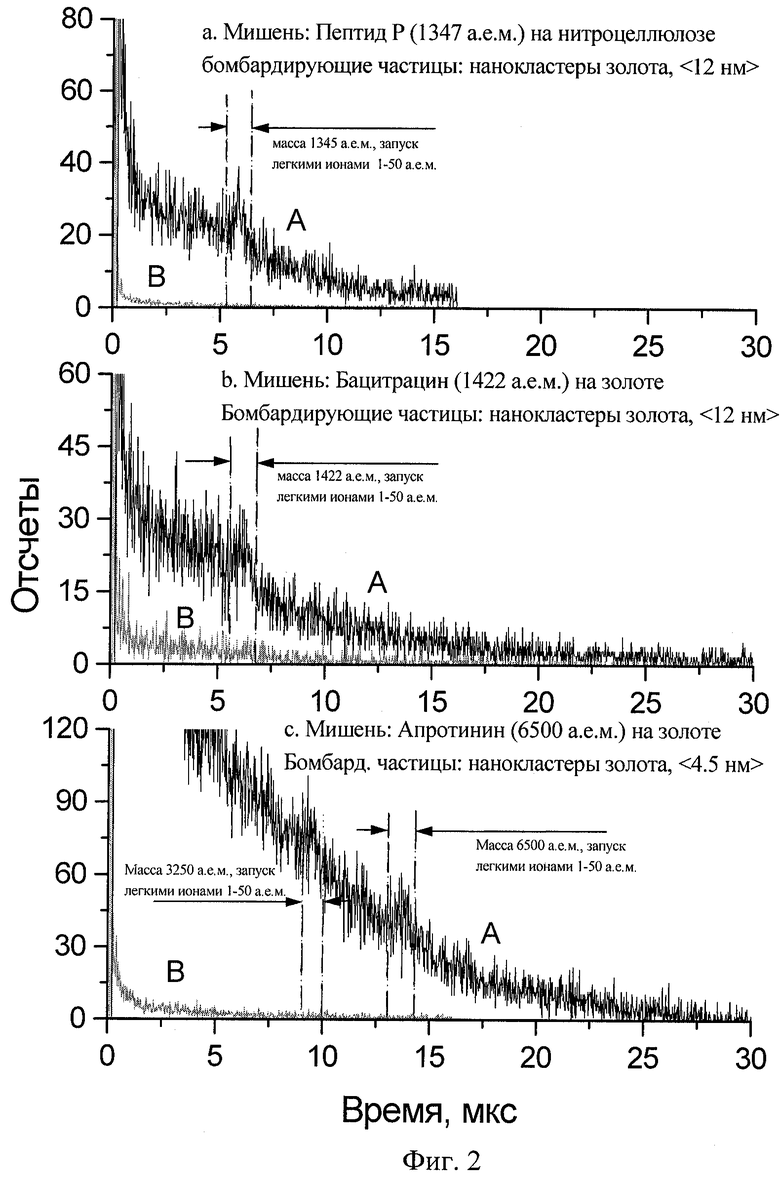
Спектры самосовпадений вторичных ионов, эжектированных из слоев пептида Р (а), бацитроцина (b) и апротинина (с) под действием нанокластеров золота, представлены на фиг.2 (спектры А). Для сравнения представлены также спектры самосовпадений вторичных ионов, эжектированных из материалов соответствующих подложек под действием тех же самых нанокластеров (спектры В). Спектры А и В приведены к одному времени измерений. На оси времени отмечены временные окна, соответствующие расчетным разностям во временах пролета для молекулярных ионов данного вещества в зависимости от масс стартующих легких ионов в диапазоне 1-50 а.е.м. Видно, что в каждом спектре широкие пики молекулярных ионов удовлетворительно совпадают с этими временными окнами. Ширина пиков наиболее вероятно определяется распределением масс легких ионов, которые в режиме самосовпадений задают старты для набора единичных спектров.
Полученные временные спектры показывают, что нанокластерные ионы в режиме упругого торможения способны десорбировать биомолекулярные ионы с массами в несколько тысяч а.е.м.
Кроме того, для мишени бацитрацина оценены выходы молекулярных ионов, эжектированных под действием обоих типов бомбардирующих нанокластерных ионов (средние размеры 4,5 нм и 12 нм соответственно). Выход оценивался как отношение
(Nпик·α)/(Nсс·β),
где Nпик - число отсчетов в пике молекулярного иона после вычета фона, β - геометрический фактор, учитывающий прозрачность сеточных электродов, размещенных на пути вторичных ионов (2 сетки с прозрачностью 90%), и геометрическую эффективность микроканального детектора, Ncc - число отсчетов в линии самосовпадений, поправленное на величину α - эффективность регистрации нанокластеров [9], дает полное число нанокластеров, упавших на мишень. Значения оцененных величин выходов молекулярных ионов бацитрацина при бомбардировке нанокластерами со средними размерами 4,5 нм и 12 нм приведены в Таблице.
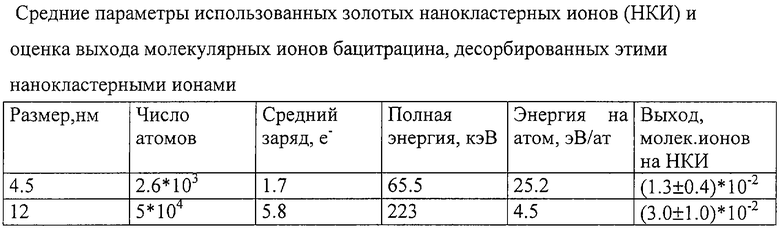
Выход молекулярных ионов с массой 1422 а.е.м. (бацитроцин) при бомбардировке НКИ составил (1-3)· 10-2 на нанокластер, что примерно на три порядка больше, чем при десорбции атомарными ионами [10].
Сравнение величин выходов, полученных при бомбардировке НКИ со средними размерами 4,5 нм и 12 нм, показывает, что выход молекулярных ионов растет с увеличением размера нанокластеров и их энергии. Наличие такой тенденции позволяет рассчитывать в дальнейшем на расширение диапазона анализируемых масс биомолекул, десорбируемых предлагаемым методом.
Следует отметить, что область взаимодействия отдельного нанокластера с поверхностью мишени имеет порядок сотен нм2, в то время как при облучении мишеней лазером площадь пятна при каждом “выстреле” составляет ~10 нм.
Источники информации
1. B.Sundqvist, A.Hedin,  , I.Kamensky, M.Salehpur and
, I.Kamensky, M.Salehpur and  G. Plasma desorption mass spectrometry (PDMS). Limitations and possibilities. Int. J. of Mass Spectrom. and Ion Proc. 65 (1985) 69.
G. Plasma desorption mass spectrometry (PDMS). Limitations and possibilities. Int. J. of Mass Spectrom. and Ion Proc. 65 (1985) 69.
2. Tanaka, K., Waki, H., Ido, Y., Akita, S., Yoshida, Y. and Yoshida, T. Protein and polymer analysis up to m/z 100,000 by laser ionization time-of-flight mass spectrometry. Rapid Commun. Mass Spectrom. 2 (1988) 151.
3. J.В.Fenn, M.Mann, С.К.Meng, S.F.Wong and C.M.Whitehouse. Electrospray Ionization for Mass Spectrometry of Large Biomolecules. Science. 246 (1989) 64.
4. Технический отчет по проекту МНТЦ # 902-98 “Изучение кластерного макроэффекта от одиночных многозарядных ионов и разработка нового метода получения пучков супертяжелых кластерных ионов” (руководитель И. Баранов). С.Петербург, 2001.
5. Патент РФ №2207639 (бюлл. №18 от 27.06.2003)" Герметичный изотопный источник осколков деления на основе калифорния-252 и способ его изготовления". Авторы: И.Баранов, Т.Кузьмина, В.Обнорский и С.Ярмийчук.
6. I.Baranov, S.Jarmiychuk, S.Kirillov, A.Novikov, V.Obnorskii, A.Pchelintsev, C.T.Reimann and K.Wien, Macrocluster effect caused by single MCI:charges of gold clusters (2-20 nm) desorbed due to electronic processes induced by fission fragment bombardment in nanodispersed gold targets. Nucl. Instr. and Meth. В 157 (1999) 167.
7. I.Baranov,  , S.Kirillov, J.Kopniczky, A.Novikov, V.Obnorskii, A.Pchelintsev, A.P.Quist, G.Torzo, S.Yarmiychuk and L.Zennaro. Desorption of nanoclusters (2-40 nm) from nanodispersed metal and semiconductor layers by swist heavy ions. Nucl. Instr. and Meth. В 193 (2002) 798.
, S.Kirillov, J.Kopniczky, A.Novikov, V.Obnorskii, A.Pchelintsev, A.P.Quist, G.Torzo, S.Yarmiychuk and L.Zennaro. Desorption of nanoclusters (2-40 nm) from nanodispersed metal and semiconductor layers by swist heavy ions. Nucl. Instr. and Meth. В 193 (2002) 798.
8. J.Martens, W.Ens, K.G.Standing and A.Verentchikov. Secondary-ion and electron production from surfaces bombarded by large polyatomic ions. Rapid Commun. Mass Spectrom., 6 (1992) 1463.
9. Van-Tan Nguyen, K.Wien, I.Baranov, A.Novikov and V.Obnorskii. Detection of large cluster ions by ion-to-ion conversion. Rapid Commun. Mass Spectrom. 10 (1996) 1463.
10. R.D.Harris, M.J.Van Stipdonk, E.A.Schweikert, Kiloelectron volt cluster impacts: prospects for cluster-SIMS. Int. J. of Mass Spectrom. and Ion Proc. 174 (1998) 167.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МЕТАЛЛИЧЕСКИХ НАНОКЛАСТЕРОВ В СВОБОДНОМ СОСТОЯНИИ | 2007 |
|
RU2341845C2 |
| УСТРОЙСТВО ДЛЯ ПОЛУЧЕНИЯ ПУЧКОВ ЖИДКОМЕТАЛЛИЧЕСКИХ НАНОКЛАСТЕРНЫХ ИОНОВ | 2001 |
|
RU2210135C2 |
| УСТРОЙСТВО ДЛЯ ПОЛУЧЕНИЯ ПУЧКОВ УСКОРЕННЫХ НАНОКЛАСТЕРНЫХ ИОНОВ | 2010 |
|
RU2423753C1 |
| СПОСОБ ДЕСОРБЦИИ-ИОНИЗАЦИИ ХИМИЧЕСКИХ СОЕДИНЕНИЙ | 2005 |
|
RU2285253C1 |
| Биомолекулярный сенсор с микроэлектронным генератором электромагнитной волны | 2020 |
|
RU2749698C1 |
| Способ вторично-ионной масс-спектрометрии твердого тела | 1978 |
|
SU708794A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МЕТАЛЛОВ И КОМПЛЕКСНЫХ СОЕДИНЕНИЙ МЕТАЛЛОВ | 2013 |
|
RU2531762C1 |
| СПОСОБ УПРАВЛЕНИЯ СООТНОШЕНИЕМ РАЗРЕШАЮЩЕЙ СПОСОБНОСТИ ПО МАССЕ И ЧУВСТВИТЕЛЬНОСТИ В МНОГООТРАЖАТЕЛЬНЫХ ВРЕМЯПРОЛЕТНЫХ МАСС-СПЕКТРОМЕТРАХ | 2015 |
|
RU2660655C2 |
| СПОСОБ АНАЛИЗА СМЕСЕЙ ХИМИЧЕСКИХ СОЕДИНЕНИЙ НА ОСНОВЕ РАЗДЕЛЕНИЯ ИОНОВ ЭТИХ СОЕДИНЕНИЙ В ЛИНЕЙНОЙ РАДИОЧАСТОТНОЙ ЛОВУШКЕ | 2012 |
|
RU2502152C2 |
| Способ идентификации сероваров бактерий рода Leptospira методом MALDI-TOF масс-спектрометрии | 2017 |
|
RU2661108C1 |
Изобретение относится к физике взаимодействия ускоренных частиц с поверхностью вещества и может быть использовано при создании масс-спектрометров для проведения исследований в области молекулярной биологии. Предлагается способ получения биомолекулярных ионов в свободном состоянии путем бомбардировки слоя исследуемого вещества, нанесенного на подложку, ускоренными металлическими нанокластерными ионами. В этом случае кинетическая энергия бомбардирующих частиц, которую можно изменять в широких пределах, высвобождается исключительно в результате упругих соударений с молекулами исследуемого вещества и атомами подложки. Десорбированные биомолекулярные ионы регистрируются времяпролетным масс-спектрометром. Времяпролетные масс-спектры, полученные в режиме самосовпадений, показывают, что нанокластерные ионы массой 107 а.е.м. с энергией 220 кэВ способны десорбировать биомолекулярные ионы с массами в несколько тысяч а.е.м. Технический результат - повышения верхнего предела масс измеряемых биомолекул, повышение чувствительности вследствие более высокого выхода биомолекул. 1 табл., 2 ил.
Способ получения биомолекулярных ионов в свободном состоянии, включающий нанесение биовещества на подложку, облучение подложки ускоренными ионами и регистрацию десорбированных биомолекулярных ионов, отличающийся тем, что облучение подложки ведут металлическими нанокластерными ионами в режиме упругого торможения.
| B.Sundqvist and oth | |||
| Plasma desorption mass spectrometry (PDMS) | |||
| Limitation and possibilities | |||
| Int | |||
| J | |||
| of Mass Spectrom | |||
| and Ion Proc | |||
| Разборное приспособление для накатки на рельсы сошедших с них колес подвижного состава | 1920 |
|
SU65A1 |
Авторы
Даты
2004-10-20—Публикация
2003-07-14—Подача