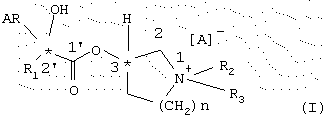
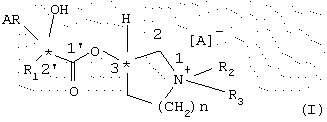
Предметом данного изобретения являются энантиомерно чистые сложные эфиры, а именно имеющие (3R,2’R)-, (3S,2’R)-,(3R,2’S) и (3S,2’S)-конфигурацию энантиомеры общей формулы I
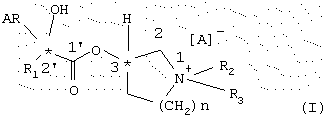
где R1 обозначает моно-, би- или трициклический С3-С9-циклоалкильный остаток, при необходимости, замещенный одним или несколькими остатками C1-С6-алкил, С2-С6-алкенил и/или С2-С6-алкинил и/или одним или несколькими атомами галогена, такими как фтор, хлор, бром или иод;
R2 обозначает C1-C6-алкил, С2-С6-алкенил или С2-С6-алкинил, которые, при необходимости, могут быть замещены одним или несколькими атомами галогена, такими как фтор, хлор, бром или иод;
R3 обозначает C1-С6-алкил, С2-С6-алкенил или C2-C6-алкинил, который, при необходимости, может быть замещен одним или несколькими атомами галогена, такими как фтор, хлор, бром или иод;
AR обозначает С6-С10-ароматический остаток или гетероаромагический остаток, содержащий азот, серу или кислород в качестве гетероатома;
n обозначает целое число 1, 2 или 3;
А обозначает анион фармакологически приемлемой соли,
способ их получения и их применение в качестве лекарственных средств.
Предпочтительными являются соединения общей формулы I, в которой
R1 обозначает моноили бициклический С5-С7-циклоалкильный остаток, при необходимости, замещенный одним или несколькими остатками C1-С3-алкил, С2-С6-алкенил или С2-С6-алкинил и/или одним или несколькими атомами галогена, такими как фтор, хлор, бром или иод;
R2 обозначает C1-С3-алкил, С2-С4-алкенил или С2-С4-алкинил, который, при необходимости, может быть замещен одним или несколькими атомами галогена, такими как фтор, хлор, бром или иод;
R3 обозначает C1-С3-алкил, С2-С4-алкенил или C2-C4-алкинил, который, при необходимости, может быть замещен одним или несколькими атомами галогена, такими как фтор, хлор, бром или иод;
AR обозначает С6-С10-ароматический или гетероаромагический остаток, содержащий серу в качестве гетероатома;
n обозначает целое число 1 или 2;
А обозначает анион фармакологически приемлемой минеральной кислоты или карбоновой кислоты.
Особенно предпочтительны соединения общей формулы I, в которых
R1 обозначает циклопентил, циклогексил или норборнил;
R2 обозначает метил;
R3 обозначает метил;
AR обозначает фенил;
n обозначает целое число 1 или 2;
А обозначает фторид, хлорид, бромид или иодид и в которых ОН, AR и R1 размещены по ходу часовой стрелки относительно карбоксильной группы.
Данное изобретение относится далее к способу получения соединений согласно изобретению, а также к их применению в качестве лекарственных средств.
C1-С6-алкил, если не указано иное, обозначает разветвленный или неразветвленный алкильный остаток с 1-6 атомами углерода, который, при необходимости, может быть замещен одним или несколькими атомами галогена. В объеме данного изобретения в качестве C1-C6-алкильных остатков имеют в виду следующие заместители: метил, этил, пропил, 1-метилэтил (изо-пропил), бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил, гексил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2-метилпропил.
Если не указано иное, под алкильными заместителями, содержащими 1-3 атомов углерода, предпочтительно понимают, например, следующие низшие алкильные остатки: метил, этил, н-пропил или изо-пропил.
С2-С6-алкенил, если не указано иное, обозначает разветвленный или неразветвленный алкильный остаток с 2-6 атомами углерода, который содержит одну или, при необходимости, две двойные связи и, при необходимости может быть замещен одним или несколькими атомами галогена. В объеме данного изобретения в качестве С2-С6-алкенильных остатков имеют в виду следующие заместители:
винил, 2-пропенил (аллил), 2-бутенил, 3-бутенил, 1-метил-2-пропенил, 2-метил-2-пропенил, 2-пентенил, 3 пентенил, 4-пентенил, 1-метил-2-бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 3-метил-3-бутенил, 1,1-диметил-2-пропенил, 1,2-диметил-2-пропенил, 1-этил-2-пропенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-метил-2-пентенил, 4-метил-2-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 3-метил-3-пентенил, 4-метил-3-пентенил, 1-метил-4-пентенил, 3-метил-4-пентенил, 4-метил-4-пентенил, 1,1-диметил-2-бутенил, 1,1-диметил-3-бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-3-бутенил, 1,3-диметил-2-бутенил, 1,3-диметил-3-бутенил, 2,2-диметил-3-бутенил, 2,3-диметил-2-бутенил, 2,3-диметил-3-бутенил, 1-этил-2-бутенил, 1-этил-3-бутенил, 2-этил-1-бутенил, 2-этил-2-бутенил, 2-этил-3-бутенил, 1,1,2-триметил-2-пропенил, 1-этил-1-метил-2-пропенил и 1-этил-2-метил-2-пропенил, среди которых предпочтительным является аллильный остаток.
С2-С6-алкинил, если не указано иное, обозначает разветвленный или неразветвленный алкильный остаток с 2-6 атомами углерода, который может содержать одну или, при необходимости, две тройные связи или одну тройную связь и одну двойную связь и, при необходимости, может быть замещен одним или несколькими атомами галогена. Согласно данному изобретению в качестве С2-С6-алкинильных остатков следует иметь в виду, например, такие заместители:
2-пропинил (пропаргил), 2-бутинил, 3-бутинил, 1-метил-2-пропинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-метил-2-бутинил, 1-метил-3-бутинил, 2-метил-3-бутинил, 1,1-диметил-2-пропинил, 1-этил-2-пропинил, 2-гексинил, 3-гексинил, 4-гексинил, 5-гексинил, 1-метил-2-пентинил, 4-метил-2-пентинил, 1-метил-3-пентинил, 2-метил-3-пентинил, 1-метил-4-пентинил, 3-метил-4-пентинил, 1,1-диметил-2-бутинил, 1,1-диметил-3-бутинил, 1,2-диметил-3-бутинил, 2,2-диметил-3-бутинил, 1-этил-2-бутинил, 1-этил-3-бутинил, 2-этил-3-бутинил или 1-этил-1-метил-2-пропинил, среди которых предпочтительным является пропаргильный остаток.
Циклоалкил обозначает в общем насыщенный или ненасыщенный циклический углеводородный остаток с 3-9 атомами углерода, который может быть, при необходимости, замещен одним атомом галогена или несколькими атомами галогена, предпочтительно фтора, которые могут быть одинаковыми или различными. Предпочтительными являются циклические углеводороды с 5 или 6 атомами углерода. В качестве примеров можно было бы назвать циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил, циклогептенил, циклогептадиенил, циклооктил, циклооктенил, циклооктадиенил и циклононинил.
Арил обозначает в общем ароматический остаток с 6-10 атомами углерода - также смесь, причем ароматический остаток может быть замещен одной или несколькими группами низшего алкила с 1-3 атомами углерода, трифторметильной группой (группами), цианогруппой (группами), алкоксигруппой (группами), нитрогруппой (группами), аминогруппой (группами) или одним или несколькими атомами галогена - одинаковыми или различными; предпочтительным арильным остатком является, при необходимости, замещенный фенильный остаток, причем в качестве заместителей предпочтительными являются галоген, такой как фтор, хлор или бром, циано, а также гидроксил.
Гетероарил согласно вышеупомянутому обозначает в общем 5-6-членное кольцо, которое может содержать в качестве гетероатомов кислород, серу и/или азот и с которым может быть сконденсировано дополнительное ароматическое кольцо.
Предпочтительными являются 5- и 6-членные ароматические кольца, которые содержат кислород, серу и/или до двух атомов азота и которые, при необходимости, могут быть бензоконденсированными.
В качестве конкретных гетероциклических систем можно назвать акридинил, акридонил, алкилпиридинил, антрахинонил, аскорбил, азаазуленил, азабензантраценил, азабензантренил, азахризенил, азациклазинил, азаиндолил, азанафтаценил, азанафталенил, азапренил, азатрифениленил, азепинил, азиноиндолил, азинопирролил, бензакридинил, бензазапинил, бензофурил, бензонафтиридинил, бензопиранонил, бензопиранил, бензопиронил, бензохинолинил, бензохинолизинил, бензотиепинил, бензотиофенил, бензилизохинолинил, бипиридинил, бутиролактонил, капролактамил, карбазолил, карболинил, катехинил, хроменопиронил, хромонопиранил, кумаринил, кумаронил, декагидрохинолинил, декагидрохинолонил, диазаантраценил, диазафенантренил, дибензазапинил, дибензофуранил, дибензотифенил, дихромиленил, дигидрофуранил, дигидроизокумаринил, дигидроизохинолинил, дигидропиранил, дигидропиридинил, дигидропиридонил, дигидропиронил, дигидротиопиранил, диприленил, диоксантиленил, энантолактамил, флаванил, флавонил, флуранил, флуоресцеинил, фурандионил, фуранохроманил, фуранонил, фуранохинолинил, фуранил, фуропиранил, фуропиронил, гетероазуленил, гексагидропиразиноизохинолинил, гидрофуранил, гидрофуранонил, гидроиндолил, гидропиранил, гидропиридинил, гидропирролил, гидрохинолинил, гидротиохроменил, гидротиофенил, индолизидинил, индолизинил, индолонил, изатинил, изатогенил, изобензофурандионил, изобензфуранил, изохроманил, изофлавонил, изоиндолинил, изоиндолобензазапинил, изоиндолил, изохинолинил, изохинуклидинил, лактамил, лактонил, малеимидил, моноазабензонафтенил, нафталенил, нафтимидазопиридиндионил, нафтиндолизиндионил, нафтодигидропиранил, нафтофуранил, нафтиридинил, окзепинил, оксиндолил, оксоленил, пергидроазолопиридинил, пергидроиндолил, фенантрахинонил, фталидизохинолинил, фталимидил, фталонил, пиперидинил, пиперидонил, пролинил, пиразинил, пираноазинил, пираноазолил, пиранопитзандионил, пиранопиридинил, пиранохинолинил, пиранопиразинил, пиранил, пиразолопиридинил, пиридинтионил, пиридинонафталенил, пиридинопиридинил, пиридинил, пиридоколинил, пиридоиндолил, пиридопиридинил, пиридопиримидинил, пиридопирролил, пиридохинолинил, пиронил, пирроколинил, пирролидинил, пирролизидинил, пирролизинил, пирролодиоазинил, пирролонил, пирролопиримидинил, пирролохинолонил, пирролил, хинакридонил, хинолинил, хинолизидинил, хинолизинил, хинолонил, хинуклидинил, родаминил, спирокумаринил, сукцинимидил, фульфоланил, сульфоленил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидропиранил, тетрагидропиридинил, тетрагидротиапиранил, тетрагидротиофенил, тетрагидротипиранонил, тетрагидротипиранил, тетронил, тиафенил, тиахроманил, тиадекалинил, тианафтенил, тиапиранил, тиапиронил, тиазолопиридинил, тиенопиридинил, тиенопирролил, тиенотиофенил, тиепинил, тиохроменил, тиокумаринил, тиопиранил, тиазаантраценил, триазиноиндолил, триазолопиридинил, тропанил, ксантенил, ксантонил, ксангидролил, аденинил, аллоксанил, аллоксазинил, антранилил, азабензантренил, азабензонафтенил, азанафтаценил, азафеноксазинил, азапуринил, азинил, азолоазинил, азолил, барбитуровая кислота, бензазинил, бензимидазолтионил, бензимидазолонил, бензизотиазолил, бензизоксазолил, бензоциннолинил, бензодиазоцинил, бензодиоксоланил, бензодиоксолил, бензхопиридазинил, бензотиазепинил, бензотиазинил, бензотиазолил, бензоксазинил, бензоксазолинонил, бензоксазолил, циннолинил, депсидинил, диаэафенантренил, диазейинил, диазинил, дибензоксазепинил, дигидробензимидазолил, дигидробензотиазинил, дигидрооксазолил, дигидропиридазинил, дигидропиримидинил, дигидротиазинил, диоксанил, диоксенил, диоксепинил, диоксинонил, диоксоланил, диоксолонил, диоксопиперазинил, дипиримидопиразинил, дитиоланил, дитиоленил, дитиолил, флавинил, фуропиримидинил, гликоциамидинил, гуанинил, гексагидропиразиноизохинолинил, гексагидропиридазинил, гидантоинил, гидроимидазолил, гидропараэинил, гидропиразолил, гидропиридазинил, гидропиримидинил, имидазолинил, имидазолил, имидазохиназолинил, имидазотиазолил, индазолбензопиразолил, индоксазенил, инозинил, изоаллоксазинил, изотиазолил, изоксазолидинил, изоксазолинонил, изоксазолинил, иэоксазолонил, изоксахолил, лумазинил, метилтиминил, метилурацил, морфолинил, нафтимидазолил, оротицил, оксатианил, оксатиоланил, оксазинонил, оксазодидинонил, оксазолидинил, оксазолидонил, оксазолинонил, оксазолинил, оксазолонил, оксазалопиримидинил, оксазолил, пергидроциннолинил, пергидропирролоазинил, пергидропирролотиазинил, пергидротиазинонил, перимидинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, феноксазонил, фталазинил, пиперазиндионил, пиперазинодионил, полихиноксалинил, птеридинил, птеринил, пуринил, пиразинил, пиразолидинил, пиразолидонил, пиразолинолил, паразолинил, пиразолобензодиазепинил, пиразолонил, пиразолопиримидинил, пиразолотриазинил, пиразолил, пиридазинил, пиридазонил, пиридопиразинил, пиридопиримидинил, пиримидинтионил, пиримидинил, пиримидионил, пирмидоазепинил, пиримидоптеринил, пирролобенздиазепинил, пирролодиазинил, пирролопиримидинил, хиназолидинил, хиназолиздонил, хиназолинил, хиноксалинил, сультамил, сультинил, сультонил, тетрагидрооксазолил, тетрагидропиразинил, тетрагидропиридазинил, тетрагидрохиноксалинил, тетрагидротиазолил, тиазепинил, тиазинил, тиазолидинонил, тиазолидинил, тиазолинонил, тиазолинил, тиазолобензимидазол, тиазолил, тиенопиримидинил, тиазолидинонил, тиминил, триазолопиримидинил, урацилил, ксантинил, ксилитолил, азабензонафтенил, бензофуроксанил, бензотиадиазинил, бензотриазепинонил, бензотриазолил, бензоксадиазинил, диоксадиазинил, дитиадазолил, дитиазолил, фуразанил, фуроксанил, гидротриазолил, гидрокситризинил, оксадиазинил, оксадиазолил, оксатиазинонил, оксатриазолил, пентазинил, пентазолил, петразинил, полиоксадиазолил, сидонил, тетраоксанил, тетразепинил, тетразинил, тетразолил, тиадиазинил, тиадиазолинил, тиадиазолинил, тиадиазолил, тиадиоксазинил, тиатриазинил, тиатриазолил, триазепинил, триазиноиндолил, триазинил, триазолиндионил, триазолинил, триазолил, триоксанил, трифенодиоксазинил, трифенодитиазинил, тритиадиазепинил, тритианил или триоксоланил.
В качестве фармацевтически пригодной соли имеют в виду соль фармакологически приемлемой соли.
Другим предметом данного изобретения является способ получения этих соединений, при котором компонент, предпочтительно третичный аминоспирт в энантиомерно чистой форме, и кислоту в энантиомерно чистой или предпочтительно рацемической форме подвергают взаимодействию до сложного эфира и непосредственно после этого проводят кватернизацию с применением подходящего алкилирующего средства, предпочтительно алкилгалогенида. В предпочтительных вариантах способа после превращения рацемической кислоты в эфир проводят разделение образующихся диастереомеров путем кристаллизации. Следующим предметом данного изобретения является применение энантиомерно чистых сложных эфиров общей формулы I в лекарственных средствах.
Энантиомерно чистые соединения согласно данному изобретению общей формулы I могут быть получены способами, которые сами по себе известны из существующего уровня техники. В частности, существенные стадии способа получения состоят в том, что энантиомерно чистую α-гидроксикарбоновую кислоту (R- или S-энантиомер) общей формулы II
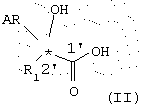
где R1 и AR имеют указанное выше значение,
или их эфиры, предпочтительно C1-С3-алкиловый эфир, или активированное производное кислоты подвергают взаимодействию с энантиомерно чистым спиртом общей формулы III (R- или S-энантиомером)
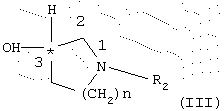
где R2 и n имеют указанное выше значение,
и полученный таким образом энантиомерно чистый сложный эфир общей формулы IV
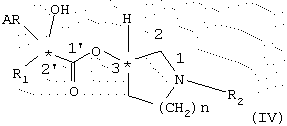
подвергают взаимодействию с алкилирующим средством общей формулы V
R3-X (V),
в которой Х обозначает удаляемую группу, замещающую третичную аминогруппу,
и полученную соль выделяют или переводят в другую соль.
В предпочтительном способе кислоту общей формулы II в рацемической форме подвергают взаимодействию с энантиомерно чистым аминоспиртовым компонентом общей формулы III и полученную смесь диастереомеров разделяют согласно известному из уровня техники способу, в частности, с применением кристаллизации, предпочтительно с использованием энантиомерно чистой вспомогательной кислоты.
Эфиры арил-циклоалкил-гидроксикислот и циклических спиртов, в которых присутствует кватернизованный азот и которые описываются общей формулой I
состоящие из гидроксикарбоновой кислоты, в которой AR обозначает ароматическое кольцо и в которой R1 обозначает циклоалифатическое кольцо, и состоящие из спиртового компонента, в котором находится гидроксильная группа в диметилпирролидиновом кольце (n=1) или диметилпиперидиновом кольце (n=2), в котором R2=R3 обозначает низший алкил, и в которой А обозначает галогенид, были описаны в некоторых случаях как спазмолитические средства. Если оба остатка R2 и R3 одинаковы, то соединения общей формулы I обладают двумя хиральными центрами. Один центр находится в кислотной части и относится к положению, обозначенному 2’, второй хиральный центр находится в циклической системе, в положении, обозначенном цифрой 3. Так как соединения этой структуры обладают тем самым двумя хиральными центрами, в принципе возможны четыре стереомера(3R, 2’R; 3S, 2’R; 3R, 2’S и 3S, 2’S). До сих пор чистые стереоизомеры общей формулы I не были ни выделены, ни получены синтетическим путем и, что является важным для объекта данной заявки, - не исследовались фармакологически. Важнейшим, также применяемым в терапии представителем общей формулы I является гликопирронийбромид (AR = фенил, R1 = циклопентил, R2=R3 = метил, n=1, А=Br). С международным тривиальным названием гликопирронийбромид описана рацемическая смесь диастереомеров, в которой содержатся все четыре стереоизомера.
Известные до настоящего времени публикации и патенты описывают либо существующий в виде смеси стереоизомеров активный компонент гликопирронийбромид (CAS 596-51-0) с эритро-(RN 59677-73-5) или трео-(RN 59677-70-2) конфигурациями рацематов третичных аминоэфиров (CRN 131118-11-1), которые могут рассматриваться только в качестве предшественников в синтезе соединений формулы I, либо смесь стереоизомеров аналогичного циклогексильного производного (R1 = циклогексил) общей формулы I (n=1) (RN 101564-29-8). В публикациях Chemical Abstracts Zitaten 80:53209h и 80:53214f описаны результаты анализов кристаллической структуры, существующих в виде смеси стереоизомеров соединений гликопирронийбромида и гексапирронийбромида. Публикации Chemical Abstracts Zitaten 80:66587е, 80:66588f и 89:191258 описывают результаты фармакологических исследований смеси стереоизомеров соединения гликопирронийбромида или комбинаторных препаратов этого вещества с неостигмином и пиридостигмином. Публикации Abstracts 84:43164h и 85:32832u описывают частичное разделение смеси стереоизомеров способом кристаллизации с помощью 5-нитроизофталевой кислоты и ЯМР-исследование уже упомянутых выше рацематов треоили эритро-конфигураций рацематов. Авторам удалось исходя из смеси стереоизомеров (CRN 131118-11-1) разделить диастереомеры только на два рацемата, но не удалось получить энантиомерно чистые соединения. Публикации в Chemical Abstracts Zitaten 96:29498m, 105:48928x, 113:158782t, 89:19158k, а также Европейский патент № ЕР 128886 А2 описывают результаты хроматографического анализа смеси стереоизомеров соединений гликопирронийбромида или приготовление применяемых стационарных фаз. Ни в одной из приведенных публикаций не сообщается ни о разделении энантиомеров, ни о выделении отдельных стереоизомеров общей формулы I. Хроматографическое разделение (ВЭЖХ) удалось во всех указанных случаях только на стадии диастереомеров. Получение предлагаемых согласно данному изобретению энантиомерно чистых соединений общей формулы I еще не известно из уровня техники.
Фармакологическая активность лекарственных средств общей формулы I основана на их взаимодействии с мускариновыми рецепторами ацетилхолина (мускариновыми рецепторами). Поэтому их называют антагонистами м-холиноцептора или парасимпатолитическими средствами или из-за их расслабляющего действия на гладкую мускулатуру - нейротропными спазмолитическими средствами. Многосторонняя активность парасимпатолитических средств включают в себя: ускорение частоты сердечных сокращений, снижение секреции слез, слюны и пота, а также секреции желез пищеварительного тракта, расслабление гладкой мускулатуры бронхов, желудочно-кишечного тракта, желчных путей, матки и мочевого пузыря, расширение зрачков и нарушение аккомодации. Кватернизованные спазмолитические средства, к которым принадлежат также соединения общей формулы I, не преодолевают гематоэнцефалический барьер и поэтому не действуют на центральную нервную систему. В зависимости от вида применения желательные и нежелательные действия парасимпатолитических средств являются различными. Если эти вещества используют в качестве спазмолитических средств, то, например, уменьшенную секрецию слюны или расширение зрачков считают побочным, нежелательным действием. На основании исследований последних лет известно, что мускариновые рецепторы не обладают однородной структурой, фармакологическая активность сводится к взаимодействиям по меньшей мере с четырьмя различными подтипами мускариновых рецепторов. Эти подтипы, с одной стороны, по-разному распределяются в различных органах, с другой стороны, различные подтипы мускариновых рецепторов с различными функциями участвуют во многих нейронных каскадах передачи (трансдукции) сигналов. Побочные действия могут объясняться взаимодействиями с различными подтипами рецепторов, так что высокая специфичность в отношении подтипа является целью при разработке современных спазмолитических средств. гликопирронийбромид является давно установленным активным веществом, которое не соответствует требованиям "современных" терапевтических средств этого типа. Но гликопирронийбромид является не только рацематом, но, кроме того, смесью диастереомеров, в которой в зависимости от процесса получения соотношение отдельных изомеров в продукте может даже колебаться. Таким образом, в случае таких изомерных смесей активных веществ можно получить случайные подтипы, вследствие чего целенаправленное применение затрудняется и провоцируется появление нежелательных побочных действий.
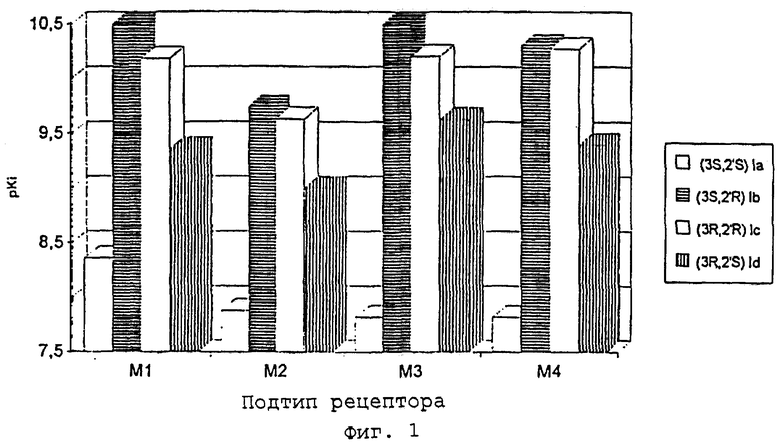
Часто фармакологическое действие при разделении рацемата лекарственного средства на энантиомеры обнаруживается исключительно у одного из энантиомеров. Из Примера 9, прежде всего из графика, построенного в логарифмической шкале, Фиг.1, можно сделать вывод, что все изомеры соединений данного изобретения в принципе могут обнаруживать сродство к рецептору. Однако отдельные энантиомеры, во первых, обнаруживают явные различия в аффинности, во-вторых, имеются также отчетливые отклонения в специфичности M1-M4 подтипов, причем различия в аффинности достигают максимально фактора около 1000. Именно высокая аффинность в отношении подтипа М3-рецепторов при относительно более низкой аффинности в отношении подтипа М2-рецепторов делает обсуждаемые как предпочтительные более высокоаффинные энантиомеры (в случае примера 9: 1б и 1в) особенно пригодными биологически активными веществами для терапии спазмов гладкой мускулатуры желудочно-кишечного тракта и мочеполового тракта, а также для лечения обструктивных заболеваний дыхательных путей. Благодаря особенно благоприятному профилю подтипов и благодаря их обусловленной высокой аффинностью возможности применения в особенно низких дозах они обеспечивают более эффективный терапевтический успех при явно пониженном потенциале побочных действий.
Следующий особенно важный фактор при терапевтическом применении энантиомеров общей формулы I состоит в кинетической селективности подтипа. Как можно заметить в Примере 10 или на Фиг.2, полупериоды диссоциации отдельных энантиомеров 1а-1d соединения общей формулы I (AR = фенил, R1 циклопентил, R2=R3 = метил, n=1, А=I) в случае подтипа М3-рецепторов в пределах между 1 минутой и 120 минутами, в то время как полупериоды диссоциации в случае подтипов M1, M2 и М4 находятся в пределах нескольких минут. Именно соединения с особенно длительными полупериодами диссоциации делают возможными особенно низкие дозировки при длительно сохраняющемся терапевтическом эффекте. Возможность посредством целенаправленного выбора энантиомера с определенным полупериодом диссоциации направленно влиять на длительность фармакологического действия является дополнительным важным достоинством соединений данного изобретения в противоположность известному уровню техники. Описанные свойства невозможно было предвидеть заранее и в литературе также отсутствовали указания на это.
Таким образом, удалось установить, что энантиомерно чистые сложные эфиры общей формулы I, в противоположность известному уровню техники, отличаются своей фармакодинамической селективностью. Они обладают в предпочтительной конфигурации явно более высокой аффинностью в отношении мускариновых М3-рецепторов, чем в отношении М2-рецепторов, и проявляют вследствие этого кинетическую селективность в отношении М3-рецепторов, т.е. они только медленно диффундируют от этого типа рецепторов. На основе этих свойств они особенно пригодны для терапии спазмов гладкой мускулатуры желудочно-пищеварительного тракта и мочеполового тракта, а также для лечения обструктивных заболеваний дыхательных путей, таких как бронхиальная астма и хронический бронхит. В сравнении с применяемыми до сих пор неселективными парасимпатолитическими средствами они проявляют благодаря их определенной селективности подтипа четкое различие в фармакологических свойствах. В сравнении с известными смесями стереоизомеров или рацематами эти соединения могут к тому же применяться в особенно низких дозировках (вследствие исключения энантиомерного балласта!). На основании этих причин следует ожидать с уверенностью явно более низкий объем побочных действий.
В соответствии с этим применение энантиомерно чистых эфиров(3R,2’R, 3S,2’R, 3R,2’S и 3S,2’S-энантиомеры) общей формулы I в лекарственных средствах для терапии спазмов гладкой мускулатуры желудочно-кишечного тракта и мочеполового тракта, а также для лечения обструктивных заболеваний дыхательных путей (бронхиальной астмы, хронического бронхита) является предпочтительным предметом данного изобретения.
Особенно предпочтительно применение энантиомеров общей формулы I с высокой селективностью подтипа М3 (pKi более 10) и высокими полупериодами диссоциации на М3-рецепторе в лекарственных средствах для лечения обструктивных заболеваний дыхательных путей, предпочтительно бронхиальной астмы и хронического бронхита.
Описанное изобретение поясняется далее следующими примерами. Разнообразные другие формы выполнения являются очевидными для специалиста. Однако особенно обращается внимание на то, что примеры и описание предназначены только для пояснения, но не для ограничения данного изобретения.
Примеры
Пример 1
Получение (3S,2’S)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидинийиодида 1а (общей формулы I, Аr = фенил, R1 = циклопентил, R2=R3 метил, n=1, А=I).
В сухой реакционной аппаратуре помещают 20 ммоль (3S)-1-метил-З-пирролидинола и 24 ммоль метилового эфира 2-циклопентил-2-гидроксифенилуксусной кислоты в 500 мл н-гептана (абс.). После этого 200 мл гептана перегоняют для удаления всех следов влаги и пропускают через водоотделитель. После охлаждения добавляют 2 ммоль NaH или NaOMe (10 мол.%) и опять нагревают до кипения. Температуру выбирают таким образом, что н-гептан перегоняется лишь медленно. Используемое количество заменяют непрерывно на протяжении 5-6 часов из капельной воронки до полного превращения гидроксиэфира. После водной обработки реакционной смеси и экстракции простым эфиром неочищенный продукт сушат над Nа2SО4/К2СО3 2:1. После отсасывания сиккатива предварительно охлаждают в бане со льдом и при охлаждении льдом добавляют до насыщения смесь HCl/2-бутанон в эфире. При этом продукт выпадает сначала в виде масла. Путем добавления 2-бутанона или отгонкой эфира получают прозрачный раствор, из которого при охлаждении льдом кристаллизуется гидрохлорид смеси диастереомеров (3S,2’R/S)-3-[(циклопентилгидроксифенилацетил)окси]-1-метилпирролидина (общей формулы IV Аr = фенил, R1 = циклопентил, R2 = метил, n=1). Выход 15,7 ммоль. Т.пл. 176°С.
Получение гидротартрата (кислого тартрата)
Разделение диастереомеров фракционирующей кристаллизацией
Для получения гидротартрата 15 ммоль вышеописанного гидрохлорида переносят с помощью NаНСО3/К2СО3-буфера рН 10 в делительную воронку и экстрагируют водную фазу трижды по 150 мл диэтилового эфира. Объединенные эфирные фазы соединяют с 100 мл этилацетата и сушат над Nа2SО4/К2СО3 2:1. После отсасывания сиккатива объем уменьшают на роторном испарителе до ~100 мл. Раствор нагревают до ~60°С и соединяют с раствором 1,2 экв (18 ммоль) энантиомерно чистой винной кислоты в этилацетате. Гидротартрат кристаллизуется в течение ночи в холодильнике. При помощи многократной перекристаллизации диастереомеры могут быть разделены до de (диастереомерной чистоты) 99%. Выход 8,3 ммоль.
(3S,2’S)-3-[(циклопентилгидроксифенилацетил)окси]-1-метилпирролидин, D-(-)-гидротартрат общей формулы IV (AR = фенил, R1 = циклопентил, R2 = метил, n=1): Т.пл. 178-179°С. 1H-ЯМР-спектр (300 МГц CD4O): δ (м.д.) 1,3-1,7 (М, 8Н, циклопентил-СН2), 2,05-2,1 (М, 1Н, С4), 2,39-2,46 (М, 1Н, С4), 2,77 (С, 3Н, Н-метил), 2,97-3,0 (М, 1Н, циклопентил С1), 3,18-3,25 (дд, 1Н, С2, 2J=12,8 Гц, 3J=0-1 Гц), 3,31-3,5 (М, 2Н, С5), 3,6-3,7 (дд, 1Н, 3J=5,2 Гц, 2J=13 Гц, С2), 4,42 (С, 2Н, тартрат), 5,34-5,39 (М, 1Н, С3), 7,2-7,8 (М, 5Н). Отнесение на основе H,H-COSY-NMR.
Кватернизация
После высвобождения оснований экстракцией эфиром относительно бикарбонатного буфера рН 10 и высушивания над Na2SO4/K2CO3 2:1 проводят кватернизацию добавлением 3 экв (20 ммоль) метилиодида и образованный кристаллический продукт (3S,2’S)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидинийиодид 1а (общей формулы I, Аr = фенил, R1 = циклопентил, R2=R3= метил, n=1, А=I) отсасывают. (Определение диастереомерного избытка можно проводить способами ВЭЖХ на фазах циклодекстрина и "Whelck" или оценкой ЯМР-спектров вышеописанного гидротартрата).
(3S,2’S)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидинийиодид 1a (общей формулы I, Аr = фенил, R1 = циклопентил, R2=R3= метил, n=1, A=I). Т.пл. 165°С. 1H-ЯМР-спектр (300 МГц CD4O): δ (м.д.) (1,15-1,4 (М, 2Н), 1,5-1,7 (М, 6Н), циклопентил-метилен), 2,2 (М, 1Н, С4), 2,63 (М, 1Н, С4), 2,9 (С, 3Н, N-метил), 2,93-2,99 (M, 1H, циклопентил-метин), 3,1 (С, 3Н, N-метил), 3,43-3,47 (дд, 1Н, С2, 2J=14 Гц, 3J=0 Гц) 3,5-3,7 (М, 2Н, С5), 3,75 (дд, 1Н, С2, 2J=13,7 Гц, 3J=6,05 Гц), 5,38 (М, 1Н, С3), 7,15-7,4 (M, 3Н), 7,5-7,65 (М, 2Н).
13С-ЯМР (52 МГц CD4O) δ (м.д.) (24,4-25,4) (4т, циклопентил-метилен), 28,5 (т, С4), 47,4 (т, циклопентил-метин), 51,3 (к, N-метил), 51,8 (к, N-метил), 63,6 (т, С5), 68,9 (т, С2), 72,0 (д, С3), 78,4 (с, гидроксиэфир С2), 124,5 (д), 126,1 (д), 126,7 (д), 140,5 (с), 172 (с).
Определение диастереомерной чистоты (de) проводили сравнением интегралов N-метил-протонов диастереомерного гидротартрата в 1Н-ЯМР-спектрах (300 МГц, CD4O) или аналитической ВЭЖХ на β-циклодекстриновых фазах (Cyclobond β-CD-OH, 50*0,4 см, буфер: 85% H2O, 15% СН3СN, 0,2% СН3СООН об/об, 0,35 мл/мин, изократический, УФ-детектирование: 236 нм).
Пример 2
Получение (3S,2’R)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидинийиодида 1b (общей формулы I, Аr = фенил, R1 = циклопентил, R2=R3= метил, n=1, А=I).
Из маточного раствора, описанного в примере 1 разделения диастереомеров, при добавлении эфира кристаллизуется D-(-)-гидротартрат соединения (3S, 2’R)-конфигурации. Многократная перекристаллизация дает de>98%. D-(-)-гидротартрат (3S,2’R)-3-[(циклопентилгидроксифенилацетил)окси]-1-метилпирролидина (общей формулы IV AR = фенил, R1 = циклопентил, R2 = метил, n=1). Т.пл. 158-160°С, 1H-ЯМР-спектр (300 МГц CD4O): δ (м.д.) 1,3-1,7 (М, 8Н, циклопентил-СН2), 2,0-2,1 (М, 1Н, С4), 2,39-2,46 (М, 1Н, С4), 2,81 (С, 3Н, М-метил), 2,93-3,05 (М, 1Н, циклопентил С1), 3,24-3,4 (М, 3Н, С2, С5), 3,63-3,7 (дд, 1Н, 3J=5,2 Гц, 2J=13 Гц, С2), 4,42 (С, 2Н, тартрат), 5,38 (М, 1Н, С3), 7,2-7,7 (М, 5Н). Отнесение на основе H, H-COSY-NMR.
Проводили кватернизацию, как описано выше, и получали выпадающий в виде кристаллов продукт (3S,2’R)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидинийиодид 1b (общей формулы I, Аr = фенил, R1 = циклопентил, R2=R3= метил, n=1, A=I). Т.пл. 108-109°С. 1H-ЯМР-спектр (300 МГц CD4O): δ (м.д.) (1,15-1,4 (М, 2Н), 1,5-1,7 (М, 6Н), циклопентил-метилен), 2,2 (М, 1Н, С4), 2,65-2,85 (М, 1Н, С4), 3,01 (М, 1Н, циклопентил-метин), 3,06 (С, 3Н, N-метил), 3,1 (С, 3Н, N-метил), 3,55-3,8 (М, 3Н, С2, С5), 4,07 (дд, 1Н, C2, 2J=13,8 Гц, 3J=6,2 Гц), 5,48 (М, 1Н, С3), 7,26-7,4 (М, 3Н), 7,5-7,65 (М, 2Н).
13С-ЯМР (50 МГц CD4O)/DEPT и СН-корреляция): δ (м.д.) (27,0 (т), 27,4 (т), 28,06 (т), циклопентил-метилен), 31,26 (т, С4), 46,6 (т, циклопентил-метин), 53,8 (к, N-метил), 54,3 (к, N-метил), 66,2 (т, С5), 71,5 (т, С2), 74,5 (д, С3), 81,2 (с, гидроксиэфир С2), 127 (д), 128,8 (д), 129,35 (д), 143,2 (с), 175,0 (с).
Определение диастереомерной чистоты проводили, как описано в Примере 1.
Пример 3
Получение(3R,2’R)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидинийиодида 1с (общей формулы I, Аr = фенил, R1 = циклопентил, R1=R3= метил, n=1, А=I).
Получение проводили, как описано в Примере 1, из(3R)-1-метил-3-пирролидинола с использованием L (+)-винной кислоты для разделения диастереомеров. Описанный в Примере 1 способ обеспечивает(3R,2’R)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидинийиодид 1с (общей формулы I, Аr = фенил, R1= циклопентил, R2=R3= метил, n=1, А=I). Аналитические данные [1Н]- и [13С]-ЯМР согласуются с данными приведенного в примере 1 соединения 1а с (3S,2’S)-конфигурацией. Т.пл. 165-166°С.
Определение диастереомерной чистоты проводили, как описано в Примере 1.
Пример 4
Получение(3R,2’S)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидинийиодида 1d (общей формулы I, Аr = фенил, R1 = циклопентил, R2=R3= метил, n=1, А=I).
Из маточного раствора, описанного в Примере 1 разделения диастереомеров, соединений 3R-конфигурации, при добавлении эфира кристаллизуется L-(+)-гидротартрат соединения(3R,2’S)-конфигурации. Многократная перекристаллизация дает de>98%. Также проводят кватернизацию, как описано в Примере 1, и получают выпадающий в виде кристаллов продукт(3R,2’S)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидинийиодид 1d (общей формулы I, Аr = фенил, R1 = циклопентил, R2=R3= метил, n=1, А=I).
Аналитические данные [1H]- и [13H]-ЯМР согласуются с данными приведенного в Примере 2 соединения 1b с (3S,2’R)-конфигурацией. Т.пл. 107-108°С.
Определение диастереомерной чистоты проводили, как описано в Примере 1.
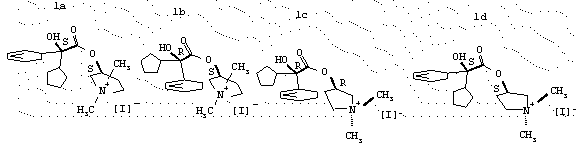
Формулы энантиомеров 1a-1d Примеров 1-4
Пример 5
Получение (3S,2’S)-3-[(циклогексилгидроксифенилацетил)окси]-1,1-диметилпирролидинийбромида 2а (общей формулы I, Аr = фенил, R1 = циклогексил, R2 = R3 = метил, n=1, А=Br).
Получение представленного в Примере 5 соединения проводят из (3S)-1-метил-3-пирролидинола, метилового эфира 2-циклогексил-2-гидроксифенилуксусной кислоты и NaOMe согласно описанному в Примере 1 способу. Переэтерификацию и разделение диастереомеров L (+)-гидротартрата 3S-конфигурации выполняют аналогичным образом.
L(+)-гидротартрат (3S,2’S)-3-(циклогексилгидроксифенилацетил)окси]-1-метилпирролидина общей формулы IV (Аr = фенил, R1 = циклопентил, R2 = метил, n=1). 1H-ЯМР-спектр (300 МГц CD4O): δ (м.д.) 1,12-1,2 (М, 4Н, циклогексил-СН2), 1,2-1,64 (М, 3Н, циклогексил-СН2), 1,64-1,67 (М, 2Н, циклогексил-СН2), 1,75-1,85 (М, 1Н, циклогексил-СН2), 2,03-2,1 (М, 1Н, С4), 2,25-2,4 (М, 1Н, циклогексил-метин), 2,40-2,55 (М, 1Н, С4), 2,78 (С, 3Н, N-метил), 3,22 (дд, 1Н, С2, 2J=13,3 Гц, 3J=0-1 Гц), 3,27-3,51 (М, 2Н, С5), 3,65 (дд, 1Н, 3J=5,42 Гц, 2J=13,2 Гц, C2), 4,42 (С, 2Н, тартрат), 5,37 (М, 1Н, С3), 7,2-7,61 (М, 5Н). Отнесение проводили на основе Н,H-COSY-NMR-спектров. 13С-ЯМР (50 МГц CD4O/DEPT): δ (м.д.) (26,71 (т), 27,35 (т), 27,47 (т), 28,71 (т), циклогексил-метилен), 31,8 (т, С4), 42,5 (к, n-метил), 46,92 (д, циклогексил-метин), 55,35 (т, С5), 61,24 (т, С2), 74,2 (д, тартрат-метин), 75,2 (д, С3), 82,7 (с, гидроксиэфир С2’), 126,9 (д), 128,7 (д), 129,2 (д), 142,1 (с), 175,0 (с, тартрат-карбоксил), 177,2 (с, гидроксиэфир-карбоксил).
Для кватернизации применяют в отличие от описанной в Примере 1 процедуры метилбромид в трет-бутилметиловом эфире.
(3S,2’S)-3-[(циклогексилгидроксифенилацетил)окси]-1,1-диметилпирролидинийбромид 2а: 1H-ЯМР-спектр (300 МГц CD4O): δ (м.д.) (1,1-2,0 (М, 10Н), циклогексил-метилен), 2,1-2,3-(М, 1Н, циклогексил-метин), 2,35-2,45 (М, 1Н, С4), 2,65-2,85 (М, 1Н, С4), 3,07 (С, 3Н, М-метил), 3,21 (С, 3Н, N-метил), 3,55-3, 8 (М, 3Н, С2, С5), 3,85 (дд, 1Н, С2, 2J=13,8 Гц, 3J=6,1 Гц), 5,47 (М, С3), 7,25-7,4 (М, 3Н), 7,55-7,65 (М, 2Н).
Определение диастереомерной чистоты (de) проводили сравнением интегралов N-метил-протонов диастереомерного гидротартрата при 2,78 м.д. и 2,82 м.д. в 1H-ЯМР-спектрах (300 МГц, CD4O).
Пример 6
Получение (3S,2’R)-3-[(циклогексилгидроксифенилацетил)окси]-1,1-диметилпирролидинийбромида 2b (общей формулы I, Аr = фенил, R1 = циклогексил, R2=R3= метил, n=1, А=Br).
Из маточного раствора, описанного в Примере 1 разделения диастереомеров, для получения (3S,2’S)-3-[(циклогексилгидроксифенилацетил)окси]-1,1-диметилпирролидинийбромида (Пример 5) после высвобождения третичных сложных аминоэфиров кристаллизуется диастереомерное соединение D(-)-гидротартрат (3S,2’R)-3-[(циклогексилгидроксифенилацетил)окси]-1-метилпирролидина.
D(-)-гидротартрат (33,2’R)-3-[(циклогексилгидроксифенилацетил)окси]-1-метилпирролидина: lH-ЯMP-cпeктp (300 МГц CD4O): δ (м.д.) 1,12-1,2 (М, 4Н, циклогексил-СН2), 1,2-1,64 (М, 3Н, циклогексил-СН2), 1,64-1,67 (М, 2Н, циклогексил-СН2), 1,75-1,85 (М, 1Н, циклогексил-СН2), 2,03-2,08 (М, 1Н, С4), 2,25-2,4 (М, 1Н, циклогексил-метин), 2,40-2,55 (М, 1Н, С4), 2,82 (С, 3Н, М-метил), 3,27-3,34 (М, 2Н, С5, С2), 3,44 (М, 1Н, С5), 3,73 (дд, 1Н, 3J=5,45 Гц, 2J=13,3 Гц, С2), 4,42 (С, 2Н, тартрат), 5,37 (М, 1Н, С3), 7,2-7,61 (М, 5Н). Отнесение на основе H,H-COSY-NMR. 13С-ЯМР (62,5 МГц, CD4O): δ (м.д.) (25,31 (т), 26 (т), 26,1 (т), 27,32 (т), циклогексил-метилен), 30,57 (т, С4), 41,1 (к, N-метил), 45,6 (д, циклогексил-метин), 53,93 (т, С5), 59,7 (т, С2), 72,8 (д, тартрат-метин), 73,82 (д, С3), 81,3 (с, гидроксиэфир С2), 125,54 (д), 127,2 (д), 127,8 (д), 140,85 (с), 173,64 (с,тартрат-карбоксил) 175,8 (с,гидроксиэфир-карбоксил).
После кватернизации с метилбромидом в трет-бутилметиловом эфире получают (3S,2’R)-3-[(циклогексилгидроксифенилацетил)окси]-1,1-диметилпирролидинийбромид. 1H-ЯМР-спектр (300 МГц CD4O): δ (м.д.) (1,1-1,8 (М, 10Н), циклогексил-метилен), 2,2-2,4-(М,2Н.С4 & циклогексил-метин), 2,65-2,85 (М, 1Н, С4), 3,03 (C, 3H, N-метил), 3,21 (С, 3Н, М-метил), 3,55-3,8 (М, 3Н, С2, С5), 3,86 (дд, 1Н, С2, 2J=13,8 Гц, 3J=6,1 Гц), 5,48 (М, 1Н, С3), 7,25-7,4 (М, 3Н), 7,57-7,65 (М, 2Н). Определение диастереомерной чистоты (de) проводили, как описано в Примере 5.
Пример 7
Получение(3R,2’R)-3-[(циклогексилгидроксифенилацетил)окси]-1,1-диметилпирролидинийбромида 2с (общей формулы I, Аr = фенил, R1 = циклогексил, R2=R3= метил, n=1, A=Br).
Получение представленного в Примере 5 соединения проводят из(3R)-1-метил-3-пирролидинола, метилового эфира 2-циклогексил-2-гидроксифенилуксусной кислоты и NaOMe согласно описанному в Примере 1 способу. Переэтерификацию и разделение диастереомеров L (+)-гидротартратa 3R-конфигурации выполняют аналогичном образом. Для кватернизации аналогично используют представленный в Примере 5 метилбромид в трет-бутилметиловом эфире. Аналитические данные [1Н]- и [13С]-АМР идентичны данным приведенного в Примере 5 соединения с (3S,2’S)-конфигурацией. Определение диастереомерной чистоты (de) проводили, как описано в Примере 5.
Пример 8
Получение(3R,2’S)3-[(циклогексилгидроксифенилацетил)окси]-1,1-диметилпирролидинийбромида 2d (общей формулы I, Аr = фенил, R1 = циклогексил, R2=R3= метил, n=1, А=Вr).
Из маточного раствора разделения диастереомеров для получения(3R,2’R)-3-[(циклогексилгидроксифенилацетил)окси]-1,1-диметилпирролидинийбромида (Пример 7) кристаллизуется диастереомерное соединение L(+)-гидротартрат(3R,2’S)-3-[(циклогексилгидроксифенилацетил)окси]-1-метилпирролидина. После кватернизации с метилбромидом в трет-бутилметиловом эфире получают(3R,2’S)-3-[(циклогексилгидроксифенилацетил)окси]-1,1-диметилпирролидинийбромид. Аналитические данные [1Н]- и [13C]-ЯMP соответствуют данным приведенного в Примере 6 соединения с (3S,2’R)-конфигурацией. Определение диастереомерной чистоты (de) проводили, как описано в Примере 5.
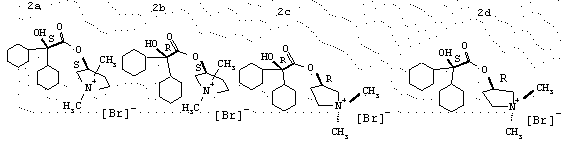
Формулы энантиомеров 2a-2d Примеров 5-8
Пример 9
Получение(3R,2’S)-3-[(2’-циклопентил-2’-гидрокси-2’-(2’-тиенил)ацетил)окси]-1,1-диметилпирролидинийбромид (общая формула 1, AR = 2-тиенил, R1 = циклопентил, R2=R3= метил, n=1, А=Вr).
В сухой реакционный аппарат помещают 5 ммоль(3R)-1-метил-3-пирролидинола и 5 ммоль метилового эфира (2R)-2-циклопентил-2-гидрокси-2-(2’-тиенил) уксусной кислоты в 150 мл н-гептана (абс.). Затем 100 мл гептана удаляют путем дистилляции для удаления всех следов влаги и пропускают через водоотделитель. После охлаждения добавляют 0,5 ммоль NaOMe (10 мол.%) и опять нагревают до кипения. Используемое количество растворителя заменяют непрерывно на протяжении 5-6 часов посредством капельной воронки. После водной обработки реакционной смеси и экстракции простым эфиром органическую фазу сушат над смесью Nа2SO4 К2СО3 при соотношении 2:1. После отделения осушающего средства и растворителя получают свободное основание.
Кватернизация
Кватернизацию свободного основания проводят путем добавления 3 экв. метилбромида, растворенного в простом трет-бутилметиловом эфире, и образовавшийся кристаллический продукт отсасывают.
1H-ЯМР (300 МГц, D2О): δ = 7,33 (d, 3J=4,98 Гц, 1Н, тиенил-5’’-Н); 7, 13 (d, 3J=3,45 Гц, 1Н, тиенил-3’’-Н); 6,96 (dd, 3J=4,86 или 3,78 Гц, 1Н, тиенил-4’’-Н); 5,50-5,42 (m, 1Н, 3-СН); 4,67 (s, Н2О); 3,78-3,62 (т, 2Н, 2-СНН и 5-СНН); 3,58-3,47 (m, 2Н, 2-СНН и 5-СНН); 3,08 (s, 3Н, N-СН3,(3R, 2’S)); 3,01-2,83 (m, 4Н, N-СН3,(3R, 2’S) и циклопентил-метин)); 2,76-2,62 (m, 1H, 4-СНН); 2,37-2,22 m, 1H, 4-CHH(3R, 2’S)); 1,65-1,20 (т, 8Н, циклопентил-метилен).
Диастереомерные соединения различаются в основном сдвигами следующих сигналов: 3,11 (s, NСН3); 3,04 (s, NСН3); 2,15-2,03 (m, 4-CHH).
13С-ЯМР (50 МГц, D2O): δ = 176,2 (s, 1’-СОО); 147,7 (s, тиенил, 1’’-С); 130,1 (d, тиенил, 4’’-С); 128,8 (d, тиенил, 5’’-С); 128,4 (d, тиенил, 3’’-С); 82,2 (s, 2’-С); 76,9 (d, 3-С); 72,9 (t, 2-С); 67,7 (t, 5-C); 56,4 (q, NСН3); 55,8 (q, NСН3); 49,4 (d, циклопентил-метин); 32,5 (t, 4-C); 29,2/29,0/28,7/28,4 (t, циклопентил-метилен),
Суммарная формула/масса катиона: (C17H26NO3S)+ (Br) / 324,47
(ESI+)-масс-спектр: 324,4 = M+.
Определение абсолютной конфигурации проводили посредством рентгеноструктурного анализа.
Пример 10
(3R,2’S)-3-[(2’-циклoпeнтил-2’-гидpoкcи-2’-(2’’-тиенил)ацетил)окси]-1,1-диметилпирролидинийбромид (общая формула 1, AR=2-тиенил, R1 = циклопентил, R2=R3= метил, n=2, А=Вr).
Получение осуществляют согласно примеру 9.
1H-ЯМР (300 МГц, CDCl3): δ = 7,27 (СНСl3); 7,24 (dd, 3J=5,18 Гц, 4J=1,02 Гц, 1Н, тиенил, 5’’-Н); 7,12 (dd, 3J=3,45 Гц, 4J=1,01 Гц, 1Н, тиенил, 3’’-Н); 6,97 (dd, 3J=5,0 Гц или 3,65 Гц, 1Н, тиенил, 4’’-Н); 5,26-5,20 (m, 1Н, 3-СН); 4,40 (dd, 2J=13,8 Гц, 3J=2,48 Гц, 1Н, 2-СНН); 4,25-4,12 (m, 1Н, 6-СНН); 3,86-3,76 (m, 1H, 6-СНН); 3,61-3,52 (m, 1Н, 2-CHH); 3,51 (s, 3H, N-СН3); 3,0 (s, 3H, N-СН3); 2,88-2,74 (m, 1H, циклопентил-метин); 2,38-2,23 (m, 1H, 4-СНН); 2,11-1,90 (m, 3H, 4-СНН и 5-СН2); 1,76-1,40 (m, 8H, циклопентил-метилен).
13С-ЯМР (50 МГц, CDCl3): δ = 173,3 (s, 1’-СОО); 145,6 (s, тиенил-С); 127,2 (d, тиенил, 4’’-С); 125,4 (d, тиенил, 5’’-С); 125,0 (d, тиенил, 3’’-С); 78,6 (s, 2’-С); 68,4 (d, 3-С); 62,7 (t, 2-С); 61,5 (t, 6-C); 56,3 (q, NСН3); 51,4 (q, NCH3); 47,5 (d, циклопентил-метин); 26,9/26,7/26,4/26,0 (t, циклопентил-метилен); 25,0 (t, 4-C); 16,7 (t, 5-C).
Суммарная формула/масса катиона: (C18H28NO3S)+ (Br)/338,49
(ESI+)-масс-спектр: 337,9 = M+.
Элементный анализ:
теор. С 51,67 Н 6,75 N 3,35
практ. С 51,44 Н 6,92 N 3,10
Пример 11
(3R,2’R)-3-[(2’-циклопентил-2’-гидрокси-2’-фенилацетил)окси]-1,1-диметилпирролидинийбромид (общая формула 1, AR = фенил, R1 = циклопентил, R2=R3= метил, n=2, А=Вr).
Получение осуществляют согласно примеру 9.
1H-ЯМР (300 МГц, CDCl3): δ = 7,57 (d, 3J=7,43 Гц, 2Н, фенил, 2’’ и 6’’-Н); 7,36 (dd, каждый 3J=7,49 Гц, 2Н, фенил, 3’’ и 5’’-Н); 7,30-7,23 (m, 1H, фенил, 4’’-Н и СНСl3[7,27]); 5,22-5,16 (m, 1H, 3-СН); 4,32 (dd, 2J=13,7 Гц, 3J=2,5 Гц, 1H, 2-СНН); 4,18-4,05 (m, 1H, 6-СНН); 3,75-3,64 (m, 1H, 6-СНН); 3,58-3,47 (m, 1H, 2-СНН); 3,43 (s, 3Н, NСН3,(3R, 2’R)); 3,0-2,85 (m, 1H, циклопентил-метин); 2,80 (s, 3Н, NСН3,(3R, 2’R)); 2,31-2,18 (m, 1H, 4-СНН); 1,99-1,82 (m, 3Н, 4-СНН и 5-СН2); 1,75-1,32 (m, 8H, циклопентил-метилен).
Диастереомерные соединения различаются в основном сдвигами следующих сигналов: 3,49 (s, NСН3); 3,27 (s, NСН3),
13С-ЯМР (50 МГц, СDСl3): δ = 174,0 (3, 1’-СОО); 140,9 (s, фенил, 1’’-С); 128,4 (d, фенил, 3’’ и 6’’-С); 127,8 (d, фенил, 4’’-С); 125,9 (d, фенил, 2’’ и 6’’-С); 79,4 (s, 2’-С); 67,7 (d, 3-C); 62,6 (t, 2-C); 61,4 (t, 6-C); 56,1 (q, NСН3); 51,3 (q, NСН3); 45,8 (d, циклопентил-метин); 26,9/26,5/26,3/25,9 (t, циклопентил-метилен); 24,8 (t, 4-C); 16,6 (t, 5-C).
Суммарная формула/масса катиона: (C20H30NO3)+ (Br)/332,47
(ESI+)-масс-спектр: 331,9 = М+.
Элементный анализ:
теор. С 58,25 Н 7,33 N 3,40
практ. С 58,03 Н 7,21 N 3,33
Пример 12
(3R,2’R)-3-[(2’-циклопентил-2’-гидрокси-2’-(п-фторфенил)ацетил)окси]-1,1-диметилпирролидинийбромид (общая формула 1, AR = пара-фторфенил, R1 = циклопентил, R2=R3= метил, n=1, А=Br).
Получение осуществляют согласно примеру 9.
1H-ЯМР (300 МГц, D2O): δ = 7,53 (dd, 3Jн,н=8,61 Гц, 4Jн,F=5,37 Гц, 2Н, фенил, 2’’ и 6’’-Н); 7,06 (dd, 3Jн,н=8,8 Гц, 3Jн,F=8,8 Гц, 2Н, фенил, 3’’ и 5’’-Н); 5,47-5,35 (m, 1Н, 3-СН); 4,68 (s, Н2O); 3,73-3,59 (m, 2Н, 2-СНН и 5-СНН); 3,57-3,39 (m, 2Н, 2-СНН и 5-СНН); 3,10-2,97 (m, 4Н, циклопентил-метин и N-СН3[при 3,06]); 2,81 (s, 3Н, N-СН3); 2,76-2,62 (m, 1H, 4-CHH); 2,33-2,20 (m, 1H, 4-CHH); 1,65-1,32 (m, 7H, циклопентил-метилен); 1,21-1,06 (m, 1H, циклопентил-метилен).
13С-ЯМР (50 МГц, D2O): δ = 176,9 (s, 1’-СОО); 164,9 (d, 1JC,F =243 Гц, фенил, 4’’-С); 139,2 (d, 4JC,F=3,1 Гц, фенил, 1’’-С); 130,9 (dd, 3JC,F =8,25 Гц, фенил, 2’’ и 6’’-С); 118,0 (dd, 2JC,F=21,5 Гц, фенил, 3’’ и 5’’-С); 82,8 (s, 2’-C); 76,7 (d, 3-C); 72,9 (t, 2-C); 67,7 (t, 5-C); 56 (q, NСН3); 55,7 (q, NСН3); 47,8 (d, циклопентил-метин); 32,5 (t, 4-C); 29,2/28,8/28,7/28,4 (t, циклопентил-метилен).
Суммарная формула/масса катиона: (C19H27NO3S)+ (Br)/336,43
(ESI+)-масс-спектр: 336,3 = M+.
Элементный анализ:
теор. С 54,64 Н 6,54 N 3,36
практ. С 54,64 Н 6,49 N 3,27
Пример 13
(3R,2’R)-3-[(2’-циклопентил-2’-гидрокси-2’-(п-фторфенил)ацетил)окси]-1,1-диметилпиперидинийбромид (общая формула 1, AR = фенил, R1 = циклопентил, R2=R3= метил, n=2, А=Br).
Получение осуществляют согласно примеру 9.
13Н-ЯМР (300 МГц, CDCl3): δ = 7,58 (dd, 3JН,Н=8,79 Гц, 4Jн,F=5,3 Гц, 2Н, фенил, 2’’ и 6’’-Н); 7,27 (СНСl3); 7,07 (dd, 3JH,H=8,64 Гц, 3JH,F = 8,64 Гц, 2Н, фенил, 3’’ и 5’’-Н); 5,25-5,16 (m, 1H, 3-CH); 4,28 (dd, 2J=13,58 Гц, 3J=2,27 Гц, 1H, 2-СНН); 4,12-3,99 (m, 1H, 6-СНН); 3,82-3,67 (m, 2Н, 2-СНН и 6-СНН); 3,48 (s, 3Н, N-СН3); 3,10 (s, 3Н, N-СН3); 2,92-2,79 (m, 1H, циклопентил-метин); 2,28-2,12 (m, 1H, 4-СНН); 2,00-1,85 (m, 3Н, 4-СНН и 5-CH2); 1,74-1,31 (m, 8Н, циклопентил-метилен).
13С-ЯМР (50 МГц, СDСl3): δ = 173,9 (s, 1’-СОО); 162,11 (d, lJC,F=245 Гц, фенил, 4’’-С); 136,8 (d, 4JC,F=3,1 Гц, фенил, 1’’-С); 127,8 (dd, 3JC,F=8,0 Гц, фенил, 2’’ и 6’’-С); 115,3 (dd, 2JC,F = 21,2 Гц, фенил, 3’’ и 5’’-С); 79,2 (s, 2’-С); 77,2 (d, 3-C); 62,7 (t, 2С); 61, 6 (t, 6-C); 55,8 (q, NСН3); 51,8 (q, НСН3); 46,5 (d, циклопентил-метин); 27,0/26,5/26,3/25,9 (t, циклопентил-метилен); 25,0 (t, 4-С); 16,8 (t, 5-C).
Суммарная формула/масса катиона: (C20H29NO3S)+ (Br)/350,46
(ESI+)-масс-спектр: 350,1 = М+.
Элементный анализ:
теор. С 55,82 Н 6,79 N 3,25
практ. С 55,94 Н 6,71 N 3,10
Пример 14
(3R,2’R)-3-[(циклопентилгидроксифенилацетил)окси]-1-аллил-1-метилпирролидинийбромид (общая формула 1, AR = фенил, R1 = циклопентил, R2 = метил, R3 = аллил, n=1, А=Вr).
Получение осуществляют из свободного основания(3R.2R)-гликопирролата. Для кватернизации использовался аллилбромид.
1H-ЯМР (300 МГц, DMSO-d6): δ (ppm) 7,62-7,56 (m, 2H, фенил, 2’’ и 6’’-Н); 7,39-7,31 (m, 2H, фенил, 3’’ и 5’’-Н); 7,29-7,22 (m, 1H, фенил, 4’’-Н); 6,14-5,91 (m, 1H, алкен-СН); 5,82 (s, 1H, ОН); 5,69-5,50 (m, 2H, алкен-СН2); 5,38 (m, 1H, 3-СН); 4,10 и 3,98 (d, 2J=6,9 Гц, 2H, N+-CH2, два диастереомера); 3,94-3,84 (m, 1H, 2-СНН); 3,75-3,48 (m, 3H, 2-СНН и 5-СН2); 3,07 и 3,00 (s, 3H, N+-метил, два диастереомера); 2,95-2,83 (m, 1H, циклопентил-метин); 2,74-2,59 (m, 1H, 4-СНН); 2,50 (DMSO) 2,19-2,01 (m, 1H, 4-СНН); 1,68-1,13 (m, 8H, циклопентил-метилен).
13С-ЯМР (50 МГц, DMSO-d6): δ (ppm) 173,3 (s, 1’-COO); 142,1 (3, фенил, 1’’-С); 127,9 (d, фенил, 3’’ и 5’’-С); 127,5 и 127,3 (t, алкен, два диастереомера); 127,2 (d, фенил, 4’’-С); 126,5 и 126,3 (d, алкен, два диастереомера); 125,6 (d, фенил, 2’’ и 6’’-С); 79,2 (s, 2’-С); 72,6 и 72,4 (d, 3-С, два диастереомера); 67,2 (t, 2-C); 66,0 и 65,4 (t, N+-CH2-, два диастереомера); 61,8 (t, 5-C); 49,7 и 49,4 (q, N+-метил, два диастереомера); 46,6 (t, циклопентил-метин); 29,4 и 29,2 (t, 4-C, два диастереомера); 26,5/26,0/25,9/25,5 (4t, циклопентил-метилен).
Смесь находится в виде двух диастереомеров, которые различаются конфигурациями четвертичного атома азота. Их соотношение составляет 2,3:1, измеренное по N-метил-протоновым сигналам около 3,07 и 3,0 ppm.
Пример 15
(3R,2’R)-3-[(циклопентилгидроксифенилацетил)окси]-1-метил-пропаргилпирролидинийбромид (общая формула 1, AR = фенил, R1 = циклопентил, R2 = метил, R3 = аллил, n=1, А=Вr).
Получение осуществляют из свободного основания(3R.2R)-гликопирролата. Для кватернизации использовался пропаргилбромид.
1H-ЯMP (300 МГц, DMSO-d6): δ (ppm) 7,62-7,56 (m, 2H, фенил, 2’’ и 6’’-Н); 7,38-7,30 (m, 2H, фенил, 3’’ и 5’’-Н); 7,29-7,23 (m, 1Н, фенил, 4’’-Н); 5,82 и 5,81 (s, 1Н, ОН, два диастереомера); 5,41 (m, 1H, 3-СН); 4,50 и 4,42 (d, 2J=3,0 Гц, 2H, N+-CH2-, два диастереомера); 4,09-4,05 (m, 1H, алкин-Н); 4,03-3,93 (m, 1H, 2-СНН); 3,84-3,56 (m, 3H, 2-СНН и 5-СН2); 3,32 (Н2O), 3,22 и 3,14 (s, 3H, Н+-метил, два диастереомера); 2,98-2,83 (m, 1H, циклопентил-метин); 2,76-2,62 (m, 1H, 4-СHН); 2,50 (DMSO) 2,21-2,06 (m, 1H, 4-СНН); 1,64-1,12 (m, 8Н, циклопентил-метилен).
13С-ЯМР (50 МГц, DMSO-d6): δ (ppm) 173,2 (s, 1’-СОО); 142,0 (s, фенил, 1’’-С); 127,9 (d, фенил, 3’’ и 5’’-С); 127,2 (d, фенил, 4’’-С); 125,6 (d, фенил, 2’’ и 6’’-С); 82,4 (s, алкин-C); 79,2 (s, 2’-С); 72,7 и 72,5 (d, 3-С, два диастереомера); 67,5 (d, алкин-С); 67,3 (t, 2-C); 62,2 (t, 5-C); 53,7 и 53,4 (t, N+-CH2-, два диастереомера); 50,2 (q, Н+-метил); 46,8 и 46,6 (t, циклопентил-метин, два диастереомера); 29,7 и 29,4 (t, 4-C, два диастереомера); 26,6/26,5/25,9/25,5 (4t, циклопентил-метилен).
Смесь находится в виде двух диастереомеров, которые различаются конфигурациями четвертичного атома азота. Их соотношение составляет 2,3:1, измеренное по N-метил-протоновым сигналам около 3,07 и 3,0 ppm.
Пример 16
Фармакологические данные соединений общей структурной формулы I с AR = фенил, R1 = циклопентил, n=1, R2=R3= метил, А = иодид (см. таблицу 1).
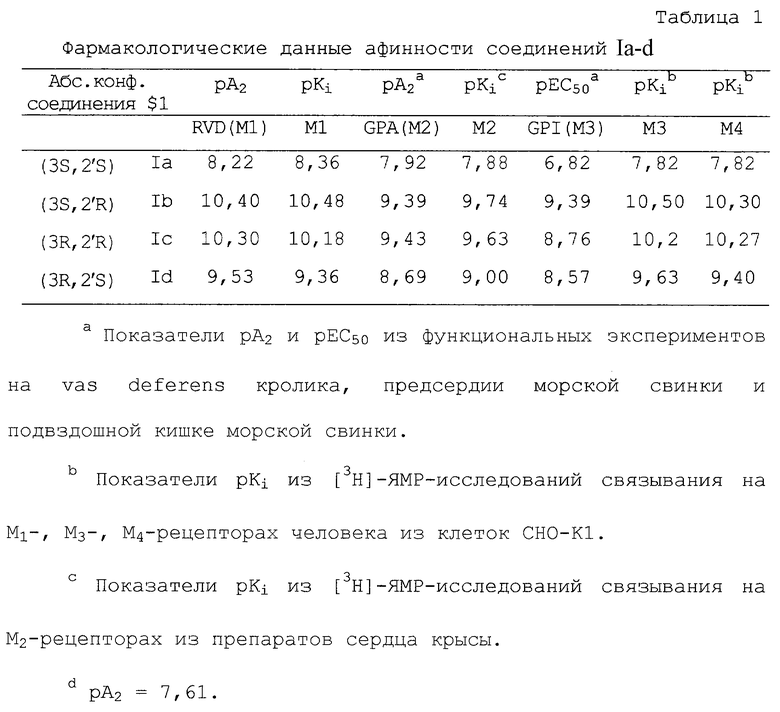
Фиг.1 показывает показатели pKi из [3H]-ЯМР-исследований связывания. Соединения Ia-d в соответствии с Таблицей 1.
Пример 17
Кинетические данные на подтипе М3-рецепторов соединений общей структурной формулы I с AR = фенил, R1 = циклопентил, R2=R3= метил, n=1, А = иодид (см. таблицу 2).
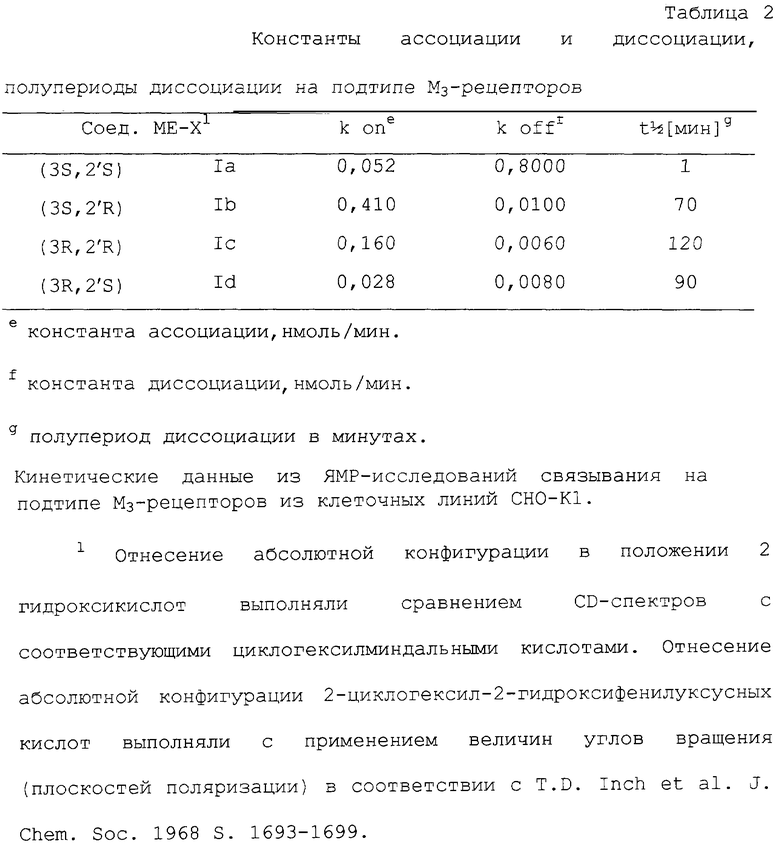
Фиг.2 показывает полупериоды диссоциации на подтипе М3-рецепторов из [3Н]-ЯМР-исследований связывания. Соединения Ia-d в соответствии с Таблицей 2.
Пример 18
Данные in vitro по афинности к рецепторам
Фармакологические данные, полученные с бромидной солью(3R,2’R)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметил-пирролидиния в сравнении со смесью(3R,2’S)- и (3S,2’R)-гликопиррония представлены в таблице 3.
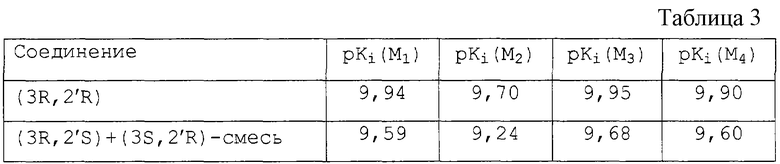
Как видно из таблицы 3, (3R,2’R)-3-[(циклопентил-гидроксифенилацетил)окси]-1,1-диметилпирролидиний проявляет несколько большую аффинность по отношению к рецепторам M1-M4, при этом аффинность в отношении рецепторов М3-типа является наиболее ярко выраженной.
2. Данные in vivo
Определяли влияние гликопирролата и(3R,2’R)-энантиомера на сжатие бронхов, индуцированное метахолином, через 18 часов после введения разовой дозы анестезированным морским свинкам (6 животных в группе) (см. таблицу 4).

Как видно из полученных данных,(3R,2’R)-энантиомеры согласно изобретению, по меньшей мере, в три раза более активны, чем рацемический гликопирролат, который представляет собой смесь (33,2’R)- и(3R,2’S)-изомеров при соотношении 1:1.
Пример 19 (фармакологические данные) (см таблицу 5).
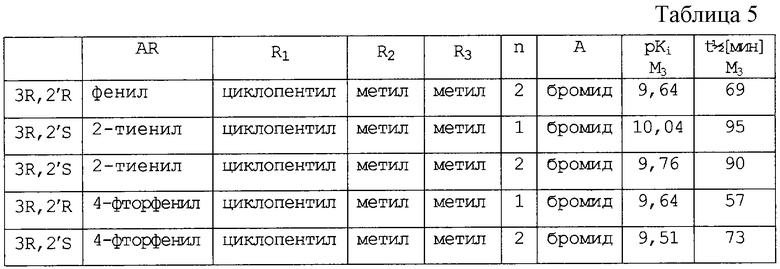
Показатели pKi и кинетические данные, полученные [3Н]-ЯМР-исследованиями стадии связывания на рецепторах человека М3-типа из клеток СНО-К1. Время 50%-ной диссоциации в минутах.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2679914C9 |
| ПРОИЗВОДНЫЕ ХИНУКЛИДИНАМИДА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, КОМБИНИРОВАННЫЙ ПРОДУКТ И СПОСОБ ИНГИБИРОВАНИЯ МУСКАРИНОВЫХ РЕЦЕПТОРОВ | 2003 |
|
RU2314306C2 |
| СПОСОБ ПОЛУЧЕНИЯ СТЕРЕОИЗОМЕРА ГЛИКОПИРРОНИЯ R,R (ИЛИ S,S)-КОНФИГУРАЦИИ | 2003 |
|
RU2337096C2 |
| СПОСОБ ПОЛУЧЕНИЯ СОЛЕЙ ПИРРОЛИДИНИЯ | 2010 |
|
RU2554878C2 |
| КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ПИРАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2686117C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ МЕВАЛОНОВОЙ КИСЛОТЫ, ИНГИБИРУЮЩИХ ГМГ-СОА РЕДУКТАЗУ | 2003 |
|
RU2335500C2 |
| ПРОИЗВОДНЫЕ 4-АМИНОПИПЕРИДИНА | 2005 |
|
RU2396257C2 |
| ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ ДЛЯ ПОЛУЧЕНИЯ ИНГИБИТОРОВ НЕЙТРАЛЬНОЙ ЭНДОПЕПТИДАЗЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2564024C2 |
| ИЗОИНДОЛИНОНОВЫЕ ИНГИБИТОРЫ ВЗАИМОДЕЙСТВИЯ MDM2-P53, ОБЛАДАЮЩИЕ ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2794333C1 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ БЕНЗОПИПЕРАЗИН, В КАЧЕСТВЕ ИНГИБИТОРОВ БРОМОДОМЕНОВ ВЕТ | 2014 |
|
RU2720237C2 |
Данное изобретение относится к энантиомерно чистым сложным эфирам, а именно к имеющим (3R,2’R)-, (3S,2’R)-, (3R,2’S)- и (3S,2’S)-конфигурацию энантиомерам общей формулы I,
где R1 обозначает моноциклический насыщенный С5-С7-циклоалкильный остаток, при необходимости замещенный одним или несколькими С1-С3-алкильными остатками или одним или несколькими атомами галогена, такими, как фтор, хлор, бром или иод; R2 обозначает С1-С6-алкильный, С2-С6-алкенильный или C2-C6-алкинильный остаток, который при необходимости может быть замещен одним или несколькими атомами галогена, такими, как фтор, хлор, бром или иод; R3 обозначает С1-С3-алкильный остаток; n обозначает целое число 1 или 2; AR обозначает фенильный остаток или 5-членное кольцо, содержащее в качестве гетероатома серу, которые могут быть замещены одной или несколькими алкильными С1-С3-алкильными группами, группами CF3, CN, NH2, NO2, алкоксигруппами и/или одним или несколькими одинаковыми или различными атомами галогена; А обозначает анион фармакологически приемлемой кислоты и в которых ОН, AR и R1 расположены в направлении по часовой стрелке от центра четвертичного атома углерода к карбоксильной группе. Соединения формулы I могут быть использованы в качестве лекарственного средства для лечения обструктивных заболеваний дыхательных путей, в частности бронхиальной астмы и хронического бронхита. Описан способ получения соединения I. 4 с. и 7 з.п.ф-лы, 5 табл., 2 ил.
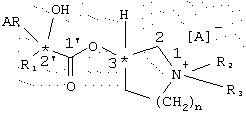
где R1 обозначает моноциклический насыщенный С5-С7-циклоалкильный остаток, при необходимости замещенный одним или несколькими C1-С3-алкильными остатками или одним или несколькими атомами галогена, такими, как фтор, хлор, бром или иод;
R2 обозначает C1-С6-алкильный, С2-С6-алкенильный или С2-С6-алкинильный остаток, который при необходимости может быть замещен одним или несколькими атомами галогена, такими, как фтор, хлор, бром или иод;
R3 обозначает C1-С3-алкильный остаток;
n = 1 или 2,
AR обозначает фенильный остаток или 5-членное кольцо, содержащее в качестве гетероатома серу, которые могут быть замещены одной или несколькими алкильными группами с 1-3 атомами углерода, трифторметильными группами, цианогруппами, алкоксигруппами, нитрогруппами, аминогруппами и/или одним или несколькими одинаковыми или различными атомами галогена;
А обозначает анион фармакологически приемлемой кислоты,
и в которых ОН, AR и R1 размещены в направлении по часовой стрелке от центра четвертичного атома углерода к карбоксильной группе.
ОН, AR и R1 размещены в направлении по часовой стрелке относительно карбоксильной группы.
соль (3R,2'R)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидиния,
соль (3S,2'R)-3-[(циклопентилгидроксифенилацетил)окси]-1,1-диметилпирролидиния,
соль (3R,2'S)-3-[(циклопентилгидрокситиенилацетил)окси]-1,1-диметилпирролидиния,
соль (3S,2'S)-3-[(циклопентилгидрокситиенилацетил)окси]-1,1-диметилпирролидиния,
соль (3R,2'S)-[(циклопентилгидрокситиенилацетил)окси]-1,1-диметилпиперидиния,
соль (3S,2'S)-3-[(циклопентилгидрокситиенилацетил)окси]-1,1-диметилпиперидиния,
соль (3R,2'R)-3-[(циклогексилгидроксифенилацетил)окси]-1,1-диметилпирролидиния,
соль (3S,2'R)-3-[(циклогексилгидроксифенилацетил)окси]-1,1-диметилпирролидиния.
где R1 обозначает моноциклический насыщенный С5-С7-циклоалкильный остаток, при необходимости замещенный одним или несколькими C1-С3-алкильными остатками или одним или несколькими атомами галогена, такими, как фтор, хлор, бром или йод;
AR обозначает фенильный или тиенильный остаток, которые могут быть замещены одной или несколькими алкильными группами с 1-3 атомами углерода, трифторметильными группами, цианогруппами, алкоксигруппами, нитрогруппами, аминогруппами и/или одним или несколькими одинаковыми или различными атомами галогена;
ОН, AR и R1 расположены по часовой стрелке относительно направления от центра четвертичного атома углерода к карбоксильной группе,
или их эфиры, предпочтительно C1-С3-алкиловый эфир, или активированное производное кислоты подвергают взаимодействию с энантиомерно-чистым аминоспиртом общей формулы III (R- или S-энантиомером)
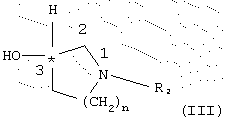
где R2 обозначает C1-С6-алкильный, С2-С6-алкенильный или С2-С6-алкинильный остаток, который при необходимости может быть замещен одним или несколькими атомами галогена такими, как фтор, хлор, бром или иод;
n = 1 или 2,
и полученный таким образом энантиомерно-чистый сложный эфир общей формулы IV
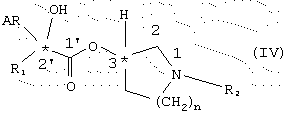
подвергают взаимодействию с алкилирующим средством общей формулы V
R3-X, (V)
в которой Х обозначает А анион фармакологически приемлемой кислоты,
и полученную соль выделяют или переводят в другую соль.
| Стойка сновального валика шлихтовальной машины | 1987 |
|
SU1420084A1 |
Авторы
Даты
2004-10-27—Публикация
1997-11-11—Подача