Настоящее изобретение относится к новым производным липоевой кислоты, обладающим ингибирующей активностью в отношении ферментов NO-синтаз, продуцирующих монооксид азота NO и/или являющимся агентами, позволяющими регенерировать антиоксиданты или ловушки для реактивных форм кислорода (ROS=reactive oxygen species) и, в более общем случае, влияющие на окислительно-восстановительные характеристики тиоловых групп. Эти антиоксиданты или ловушки для реактивных форм кислорода могут иметь природное происхождение, например витамин Е или глутатион, или синтетическое происхождение, например некоторые соединения, являющиеся ловушками для ROS, или соединения, обладающие одновременно ингибирующей активностью в отношении ферментов NO-синтаз и способностью захватывать ROS. Примеры таких соединений, имеющих синтетическое происхождение, могут быть, в частности, найдены в патентных заявках РСТ WO 96/09653, WO 98/42696 и WO 98/58934.
Изобретение, таким образом, относится, в частности, к производным, соответствующим определенной ниже общей формуле I, способам их получения, содержащим их фармацевтическим препаратам и, в частности, к их использованию в качестве ингибиторов NO-синтаз и/или агентов, позволяющих регенерировать антиоксиданты или ловушки для ROS и, в более общем случае, влияющих на окислительно-восстановительные характеристики тиоловых групп.
С учетом потенциальной роли в патофизиологии NO, ROS и метаболизма глутатиона описанные новые производные, отвечающие общей формуле I, могут оказывать благотворное или благоприятное влияние при лечении патологий, в которых задействован монооксид азота и метаболизм глутатиона, а также окислительно-восстановительные характеристики тиоловых групп. В частности, речь идет о следующих патологиях:
сердечно-сосудистые и цереброваскулярные нарушения, включающие, например, атеросклероз, мигрень, артериальную гипертонию, септический шок, кардио- и церебральные инфаркты ишемического или геморрагического происхождения, ишемии и тромбозы;
нарушения центральной или периферической нервной системы, такие, например, как нейродегенеративные болезни, из которых можно, в частности, назвать церебральные инфаркты, геморрагию под паутинной оболочкой мозга, старение, проявления старческого слабоумия, включая болезнь Альцгеймера, хорею Хантингтона, болезнь Паркинсона, болезнь Крейтцфельда-Якоба и прионные болезни, амиотрофический латеральный склероз, а также боль, травмы головного или спинного мозга, привыкание к наркотикам, к спирту и к веществам, способствующим привыканию, нарушения эрекции и репродуктивной функции, умственные нарушения, энцефалопатии вирусного или токсического происхождения, депрессия, ощущение тревоги, шизофрения, эпилепсия, нарушения сна, алиментарные нарушения (анорексия, булимия...);
болезни скелетных мышц и нейромышечных связок (миопатия, миозит), а также кожные болезни;
пролиферативные и воспалительные болезни, такие, например, как атеросклероз, легочная гипертония, дыхательная недостаточность, гломерулонефрит, катаракта, портальная гипертензия, псориаз, ревматоидный артроз и артрит, фиброзы, амилоидозы, воспаления желудочно-кишечной системы (колит, болезнь Крона) или легочной системы и воздушных путей (астма, синуситы, риниты), а также контактная сверхчувствительность или заторможенная реакция; пересадки органов;
аутоиммунные и вирусные болезни, такие, например, как волчанка, СПИД, паразитарные и вирусные инфекции, диабет и его осложнения, включающие ретинопатии, нефропатии, полинейропатии, рассеянный склероз, миопатии;
рак;
аутосомные генетические болезни, такие как болезнь Унферрихта-Люнборга;
неврологические болезни, обусловленные интоксикациями (отравление кадмием, вдыхание н-гексана, пестицида, гербицида), лечебными процедурами (радиотерапия) или генетическими расстройствами (болезнь Вильсона);
половое бессилие, обусловленное диабетом;
все патологии, характеризующиеся продуцированием или дисфункцией монооксида азота и/или метаболизма глутатиона и окислительно-восстановительных свойств тиоловых групп.
В отношении совокупности этих патологий существуют экспериментальные свидетельства, доказывающие участие в них монооксида азота или дисфункции метаболизма глутатиона (Kerwin et al., Nitric oxide: a new paradigm for second messengers, J. Med. Chem. 38, 4343-4362, 1995; Packer et al., Alpha-lipoic acid as biological antioxidant. Free Radical Biology & Medicine 19, 227-250, 1995). Изобретение иллюстрирует, в частности, пример, связанный с болезнью Паркинсона (Beal MF, Excitotoxicity and nitric oxide in Parkinson's disease pathogenesis, Ann. Neurol. 44 [Supplemented by I], S110-S114, 1998; Donato A et al., Gluthathion in Parkinson's disease: a link between oxidative stress and mitochondrial damage, Ann. Neurol. 32, S111-S115, 1992). В этом контексте медикаменты, способные ингибировать образование монооксида азота или восстанавливать биологическое функционирование тиоловых групп или глутатиона, могут оказать благотворное влияние.
Наряду с этим, авторами данного изобретения были описаны в более ранних патентах ингибиторы NO-синтаз и их применение (патенты US 5081148, US 5360925), а также ассоциации этих ингибиторов с продуктами, обладающими антиоксидантными и антирадикальными свойствами (заявка на патент РСТ WO 98/09653). Ими также описаны производные амидинов в заявках на патент РСТ WO 98/42696 и WO 98/58934 и производные аминопиридинов в заявке на патент РСТ WO 00/02860. Эти производные амидинов и аминопиридинов характеризуются тем, что они являются одновременно ингибиторами МО-синтаз и ингибиторами ROS.
Объектом настоящего изобретения являются новые производные липоевой кислоты, способ их получения и их применение в качестве терапевтических средств.
Изобретение, в частности, относится к соединению общей формулы (I);
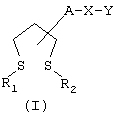
в которых R1 и R2 независимо обозначают атом водорода или нормальный или разветвленный алкильный радикал с 1-6 атомами углерода или могут образовывать простую связь;
А обозначает радикалы - (СН2)m-NR3-СО(СН2)n-, -(СН2)m-СО-NR3-(СН2)n-, -(СН2)m-NR3-(СН2)n-, - (СН2)m-СО-НR3-(CH2)p-NR4-(СН2)n-, -(CH2)m-NR3-CO-NR4-(CH2)n- или -(СН2)m-,
где m и n обозначают целые числа от 0 до 6, а
р обозначает целое число от 2 до 6;
R3 и R4 независимо обозначают атом водорода или нормальный или разветвленный алкильный радикал с 1-6 атомами углерода;
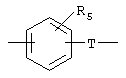
Х обозначает радикал
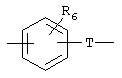
в котором группа Т, соединенная с группой Y, обозначает радикал -(CH2)i-, в котором i обозначает целое число от 0 до 6, a R5 обозначает атом водорода, нормальный или разветвленный алкильный радикал с 1-6 атомами углерода или радикал -(CH2)m-Q, в котором Q обозначает атом галогена, радикал гидрокси, циано, амино, алкокси, алкилтио, алкиламино или диалкиламино, или же R5 может также обозначать 5- или 6-членный гетероцикл, в котором гетероциклические звенья выбраны из радикалов -О-, -N(R6)- и -S-, где R6 обозначает атом водорода, нормальный или разветвленный алкильный радикал с 1-6 атомами углерода или связь радикала Х с фенильным циклом;
либо Х обозначает радикал -(CH2)q-, в котором q обозначает целое число от 0 до 6;
и, наконец, Y обозначает один из радикалов

в которых В обозначает нормальный или разветвленный алкильный радикал с 1-6 атомами углерода, 5- или 6-членный карбоциклический или гетероциклический арил, содержащий от 1 до 4 гетероатомов, выбранных из O, S, N и, в частности, радикалы тиофен, фуран, пиррол или тиазол, причем радикал арил может быть замещен одной или несколькими группами, выбранными из нормальных или разветвленных радикалов алкил, алкенил или алкокси, имеющих от 1 до 6 атомов углерода, или В обозначает NR8R9, в котором R8 и R9 независимо обозначают атом водорода или нормальный или разветвленный алкильный радикал с 1-6 атомами углерода или один из R8 и R9 обозначает радикал нитро, а другой атом водорода или нормальный или разветвленный алкильный радикал с 1-6 атомами углерода или же R8 и R9 вместе с атомом азота образуют пяти- или шестичленный неароматический гетероцикл, элементы звена которого выбраны из группы, в которую входят -СН2-, -NH-, -O- или -S-;
или В может также обозначать радикал SR10, в котором R10 обозначает атом водорода или нормальный или разветвленный алкильный радикал с 1-6 атомами углерода;
и R7 обозначает атом водорода или нормальный или разветвленный алкильный радикал с 1-6 атомами углерода;
или соль соединения общей формулы I.
Предпочтительно, когда R5 обозначает 5- или 6-членный гетероцикл, то R5 преимущественно обозначает один из следующих гетероциклов: пиррол, имидазол, пиразол, триазол, тиазолидин, пирролидин, пиперидин, пиперазин, N-алкилпиперазин, тиоморфолин, морфолин, азетидин.
Изобретение касается, в частности, соединений определенной выше общей формулы I, в которых независимо друг от друга имеются следующие характеристики:
А обозначает один из радикалов - (СН2)m-NR3-СО-(CH2)n-,
-(CH2)m-CO-NR3-(CH2)n- или - (CH2)m-NR3-CO-NR4- (CH2) n,
m обозначает целое число от 0 до 4, a n целое число от 0 до 6,
и R3 и R4 независимо обозначают атом водорода или нормальный или разветвленный алкильный радикал с 1-6 атомами углерода;
Х обозначает радикал
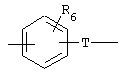
в котором группа Т, соединенная с группой Y, обозначает радикал -(СН2)i-, в котором i равно 0 или 1. и Rs обозначает атом водорода, нормальный или разветвленный алкильный радикал с 1-6 атомами углерода или радикал -(СН2)m-Q, в котором Q обозначает атом галогена, радикал гидрокси, циано, амино, алкокси, алкиламино или диалкиламино, или же R5 обозначает 5- или 6-членный гетероцикл, в котором гетероциклические звенья выбраны из радикалов -О-, -N(R6)- и -S-, где R6 обозначает атом водорода, нормальный или разветвленный алкильный радикал с 1-6 атомами углерода или связь с фенильным циклом радикала X; или
Y обозначает радикал
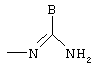
в котором В обозначает нормальный или разветвленный алкильный радикал с 1-6 атомами углерода, 5- или 6-членный карбоциклический или гетероциклический арил, содержащий от 1 до 4 гетероатомов, выбранных из О, S, N и, в частности, радикалы тиофен, фуран, пиррол или тиазол, причем радикал арил может быть замещен одной или несколькими группами, выбранными из нормальных или разветвленных радикалов алкил, алкенил или алкокси, имеющих от 1 до 6 атомов углерода.
Соединения формулы (I), в которой R1 и R2 образуют простую связь, представлены формулой (Iа)
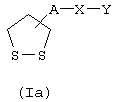
где А, Х и У имеют указанные выше значения.
Соединения формулы (I), в которой R1 и R2 имеют значения, указанные выше, за исключением значения простой связи, обозначены формулой (Ib)
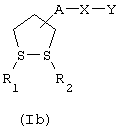
где А, X и У имеют указанные выше значения.
Более конкретно, изобретение относится к следующим описанным в примерах соединениям (иногда в форме солей):
- N-{4-[[(2-тиенил)(имино)метил]амино]фенил}-1,2-дитиолан-3-пентанамид;
- N-{2-{4-[[(2-тиенил)(имино)метил]амино]фенил}этил}-1,2-дитиолан-3-пентанамид;
- N-{2-{4-[[(2-тиенил)(имино)метил]амино]фенил}этил}-1,2-дитиолан-3-ацетамид;
- N-[4-(6-амино-4-метил-2-пиридинил)бутил]-1,2-дитиолан-З-пентанамид;
- N-[4-(6-амино-4-метил-2-пиридинил)бутил]-1,2-дитиолан-З-ацетамид;
- N-(4-{[амино(2-тиенил)метилиден]амино}фенил)-2-(1,2-дитиолан-3-ил)ацетамид;
- N-(4-{[амино(2-тиенил)метилиден]амино}бензил)-5-(1,2-дитиолан-3-ил)пентанамид;
- N-(5-{[амино(2-тиенил)метилиден]амино}-2-метоксифенил)-5-(1,2-дитиолан-З-ил)пентанамид;
- N-[5-{[амино(2-тиенил)метилиден]амино}-2-(диметилами-но)бензил]-5-(1,2-дитиолан-3-ил)пентанамид;
- N-[5-{[амино(2-тиенил)метилиден]амино}-2-(1Н-пиррол-1-ил)бензил]-5-(1,2-дитиолан-3-ил)пентанамид;
и соли этих соединений.
Изобретение, кроме того, предлагает несколько способов для получения описанных выше продуктов общей формулы I, предпочтительные условия которых описаны ниже.
Изобретение касается, в частности, способа получения амидина определенной выше общей формулы I, заключающегося в том, что промежуточное соединение общей формулы II
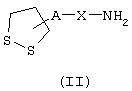
в которой А и Х имеют значения, указанные выше,
вводят во взаимодействие с промежуточным соединением общей
формулы (I.i)
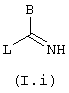
в которой В имеет определенные выше значения, a L обозначает удаляемую группу, например радикал алкокси, алкилтио, остаток сульфоновой кислоты, галоген, остаток арилового спирта или тозильную группу.
Изобретение касается также способа получения соединений общей формулы I, в которой А обозначает определенный выше радикал - (CH2)m-CO-NR3-(CH2)n-, заключающегося в том, что промежуточное соединение общей формулы (VII)a
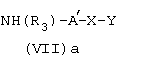
где R3, Х и Y имеют определенное выше значение, а А′ обозначает радикал -(СН2)n-, в котором n определен выше, вводят во взаимодействие с соединением общей формулы (I.vi)
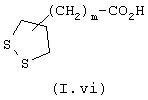
где m определено выше.
Изобретение касается также способа получения соединений общей формулы I, в которой А обозначает определенный выше радикал - (CH2)m-NR3-CO-NR4- (СН2)n-, заключающегося в том, что промежуточное соединение общей формулы (VII)b
HN(R4)-A′ -X-Y
(VII)b
где R4, X и Y определены выше, а А′ обозначает радикал -(СН2)n-, в котором n определен выше, вводят во взаимодействие с соединением общей формулы (I.vi)

где m определен выше, и с дифенилфосфорилазидом в присутствии основания такого, например, как триэтиламин.
Изобретение относится также к способу получения соединений общей формулы I, в которой В обозначает амин, заключающемуся в том, что промежуточное соединение общей формулы II

в которой А и Х определены выше,
вводят во взаимодействие
а) с промежуточным соединением общей формулы (I.ii)
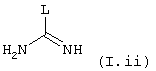
в которой L обозначает удаляемую группу, например радикал алкокси, алкилтио, остаток сульфоновой кислоты, галоген, остаток арилового спирта или тозил,
b) или с промежуточным соединением общей формулы (I.iii)
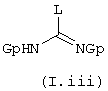
в которой L обозначает удаляемую группу, например радикал алкокси, алкилтио, остаток сульфоновой кислоты, галоген, остаток арилового спирта или тозил, a Gp обозначает защитную группу карбаматного типа, например трет-бутоксикарбонильную группу,
причем в том случае, когда осуществляют взаимодействие с соединением общей формулы (I.iii), за этой реакцией следует гидролиз в присутствии сильной кислоты, например, трифтор-уксусной кислоты;
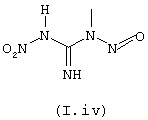
c) или с производным формулы (I.iv) (N-метил-N′ -нитро-N-нитрозогуанидин)
d) или с производным формулы (I.v), в котором Gp обозначает защитную группу
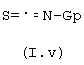
В некоторых случаях соединения согласно изобретению могут содержать асимметрические атомы углерода и, следовательно, обладать двумя возможными энантиомерными формами, т.е. конфигурациями R и S. Настоящее изобретение включает две энантиомерные формы и все комбинации этих форм, включая рацемические смеси RS. С целью простоты, если в структурных формулах не указывается никакая специфическая конфигурация, следует считать, что представлены две энантиомерные формы и их смеси.
С другой стороны, если не дано других уточнений, под алкилом подразумевается нормальный или разветвленный алкильный радикал с 1-6 атомами углерода. Под алкенилом, если не дано других уточнений, подразумевается нормальный или разветвленный алкильный радикал с 1-6 атомами углерода, имеющий по меньшей мере одну ненасыщенность (двойную связь).
Под радикалами алкилтио, алкокси, алкиламино, диалкиламино и алкенил подразумеваются, соответственно, радикалы алкилтио, алкокси, алкиламино, диалкиламино и алкенил, где алкильный радикал имеет указанные выше значения.
Под нормальным или разветвленным алкильным радикалом с 1-6 атомами углерода подразумевают, в частности, радикалы метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил, пентил, неопентил, изопентил, гексил, изогексил. Под галогеном подразумеваются атомы фтора, хлора, брома или йода.
Объектом изобретения являются также описанные выше соединения или их фармацевтически приемлемые соли в качестве лекарственных средств. Изобретение касается также фармацевтических композиций, содержащих эти соединения или их фармацевтически приемлемые соли, и применение этих соединений или их фармацевтически приемлемых солей для приготовления лекарственных средств, предназначенных для ингибирования нейрональной NО-синтазы или индуцируемой NO-синтазы, для регенерирования антиоксидантов (которые могут быть природными или синтетическими) или для обеспечения двойной функции: ингибирования NO-синтазы и регенерирования антиоксидантов.
Под фармацевтически приемлемыми солями подразумеваются, в частности, аддитивные соли с неорганическими кислотами, такие как гидрохлорид, гидробромид, гидроиодид, сульфат, фосфат, дифосфат и нитрат, или с органическими кислотами, такие как ацетат, малеат, фумарат, тартрат, сукцинат, цитрат, лактат, метансульфонат, п-толуолсульфонат, памоат, оксалат и стеарат. В рамки настоящего изобретения входят также, когда они пригодны для использования, соли, образуемые основаниями, такими как гидроксид натрия или калия. В отношении других примеров фармацевтически приемлемых солей можно сослаться на "Pharmaceutical salts", J. Pharm. Sci. 66:1 (1977).
Объектом изобретения является также применение продуктов общей формулы I или фармацевтически приемлемых солей этих продуктов для приготовления лекарственных средств, предназначенных для лечения патологий, в которых задействованы монооксид азота и/или окислительно-восстановительные характеристики тиоловых групп; таких патологий как расстройства центральной или периферической нервной системы, примером которых прежде всего является болезнь Паркинсона, цереброваскулярные нарушения, пролиферативные и воспалительные болезни, рвоты, септический шок, патологии, обусловленные радиоактивным облучением, солнечным облучением или пересадками органов, аутоиммунные и аутосомальные болезни, рак и все патологии, характеризующиеся продуцированном или дисфункцией, в которых играют роль монооксид азота и/или окислительно-восстановительные характеристики тиоловых групп.
Объектом изобретения является также применение продуктов общей формулы I или фармацевтически приемлемых солей этих продуктов для приготовления лекарственных средств, предназначенных для лечения цереброваскулярных нарушений, таких как мигрень, церебральные инфаркты ишемического или геморрагического происхождения, ишемии и тромбозы.
Наконец, объектом изобретения является также применение продуктов общей формулы I или фармацевтически приемлемых солей этих продуктов для приготовления лекарственных средств, предназначенных для лечения нарушений центральной или периферической нервной системы, таких как нейродегенеративные болезни, боль, травмы головного или спинного мозга, привыкание к наркотикам, спирту и веществам, способствующим привыканию, нарушения эрекции и репродуктивной функции, умственные нарушения, энцефалопатии, депрессия, ощущение тревоги, шизофрения, эпилепсия, нарушения сна и алиментарные нарушения.
Фармацевтические композиции могут быть в твердой форме, например в виде порошков, гранул, таблеток, желатиновых капсул, липосом или свечей. Подходящими твердыми носителями могут быть, например, фосфат кальция, стеарат магния, тальк, сахара, лактоза, декстрин, крахмал, желатин, целлюлоза, метилцеллюлоза, натриевая карбоксиметилцеллюлоза, поливинил-пирролидин и воск.
Фармацевтические композиции, содержащие соединения изобретения, могут быть также в жидкой форме, например в виде растворов, эмульсий, суспензий или сиропов. Подходящими жидкими носителями могут быть, например, вода, органические растворители, такие как глицерин или гликоли, а также их смеси в воде в различных соотношениях.
Введение лекарственных средств согласно изобретению может осуществляться местно, перорально, парентерально, в виде внутримышечных инъекций и т.д.
Предполагаемая вводимая доза лекарственных средств согласно изобретению составляет от 0,1 мг до 10 г, в зависимости от типа используемого активного соединения.
Согласно изобретению, соединения общей формулы I могут быть получены с помощью приведенных ниже способов.
Получение соединений общей формулы I
А) Получение соединений общей формулы I, в которых Y обозначает
Первый вариант
Соединения общей формулы I могут быть получены из промежуточных продуктов общих формул II, III и IV по схеме 1, где А, В, Х и Y имеют значения, указанные выше, a Gp является защитной группой карбаматного типа.
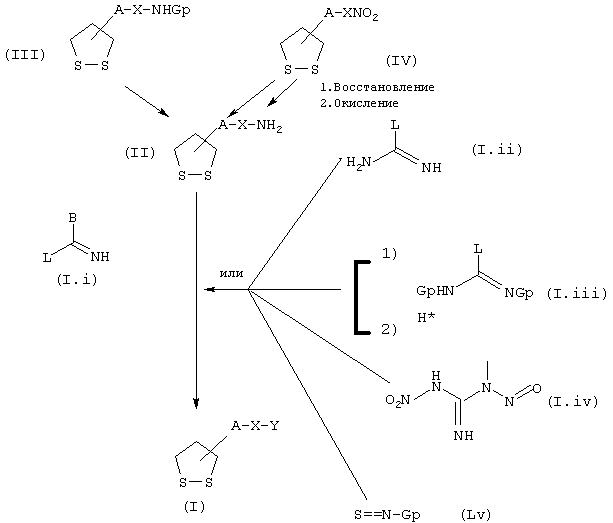
СХЕМА 1
Производные анилина и аминов общей формулы (II) подвергают реакции конденсации с соединениями общей формулы (I.i), в которых L является удаляемой группой (в частности, группой алкокси, алкилтио, сульфоновой кислотой, ариловым спиртом или тозилом) с целью получения целевых замещенных соединений общей формулы I амидинового типа (см. схему 1). В частности, если В = тиофен, производные общей формулы II можно конденсировать с гидройодидом 3-метилтиофентиокарбоксамида, полученным по описанному в литературе способу (Ann. Chim. (1962), 7, 303-337). Конденсация может быть осуществлена нагреванием в спирте (например метиловом или изопропиловом), возможно в присутствии ДМФ, при температуре преимущественно от 50 до 100°С обычно в течение нескольких часов или в течение ночи.
В случае, когда B=SR10, например S-СН3, эти соединения могут быть получены конденсацией аминов или анилинов общей формулы II с изотиоцианатом (I.v), в котором Gp является защитной группой, такой, например, как бензоильная группа. Последующее снятие защиты осуществляют отщеплением защитной группы в подходящих условиях, а образовавшуюся тиомочевину обрабатывают, например, галогеналканом с получением конечных соединений общей формулы I.
В случае, когда B=NR8R9, конечные соединения общей формулы I представляют собой гуанидины. Последние могут быть получены, например, конденсацией аминов или анилинов общей формулы II с производными общей формулы (I.ii) или (I.iii). Соединения общей формулы (I.ii), в которых L представляет собой, например, пиразольный цикл, конденсируют с аминами общей формулы II в описанных в литературе условиях (J. Org. Chem. (1992), 2497-2502). То же самое относится к соединениям общей формулы (I.iii), в которых L представляет собой, например, пиразольный цикл, а Gp группу tBuOCO {Tetrahedron Lett. (1993) 34 (21), 3389-3392), или же L является группой -N-SO2-СF3, а Gp группой tBuOCO (J. Org. Chem. (1998) 63, 3804-3805). На последней стадии синтеза деблокирование гуанидиновой функции осуществляют в присутствии сильной кислоты, например трифторуксусной кислоты.
В случае, когда B=-NHNO2, конечные соединения общей формулы I могут быть получены, например, конденсацией аминов или анилинов общей формулы II с реагентом формулы (I.iv) (N-метил-N’-нитро-N-нитрозогуанидином) в условиях, описанных в литературе (J. Amer. Chem. Soc. (1947), 69, 3028-3030).
Соединения общей формулы (I)b получают из соединений общей формулы (I)а, где А, Х и Y определены выше. Превращение липоевых соединений общей формулы (I)а в дигидролипоевые производные общей формулы (I)b, в которых R1=R2=H, осуществляют в спиртовом растворителе, таком, например, как метанол, в присутствии восстанавливающего агента, такого, например, как NaBH4, NаВН3СN или LiAlH4. Соединения общей формулы (I)b, в которых R1 и R2 не являются водородом, получают взаимодействием соединений общей формулы (I)b, в которых R1= R2=Н, с соединением формулы R1-Hal и/или R2-Hal (На1=галоген), где R1 и R2 являются такими, как определены выше, а атом галогена является удаляемой группой. Реакцию проводят, например, в каком-либо подходящем растворителе, таком как ТГФ, ацетон или этилацетат в присутствии основания, такого как КзСОз или триэтиламин, получая промежуточные продукты общей формулы (1)b.
Получение соединений общей формулы II
Промежуточные продукты общей формулы II получают отщеплением защитной группы Gp или восстановлением нитрогруппы.
Промежуточные продукты общей формулы II, у которых А и Х такие, как определены выше, могут быть получены из промежуточных продуктов общей формулы III или IV, схема 1, которые представляют собой соединения, содержащие, соответственно, защищенный амин или анилин (NHGp) в форме, например, карбамата или нитрогруппы. В частном случае БОК-групп последние удаляют классическим путем с помощью трифторуксусной кислоты или НС1, получая в конечном итоге первичные амины и анилины общей формулы II. Восстановление нитрофункции промежуточных продуктов общей формулы IV, схема 1, в которых А и Х такие, как определены выше, осуществляют, например, нагреванием продукта в соответствующем растворителе, таком как этилацетат с небольшим количеством этанола, в присутствии SnCl2 (J. Heterocyclic Chem. (1987), 24, 927-930;
Tetrahedron betters (1984), 25 (8), 839-842), в присутствии SnCl2/Zn (Synthesis (1996), 9, 1076-1078), или с помощью NaBH4-BiCl3 (Synth. Corn. (1995) 25 (23), 3799-3803) в растворителе, таком как этанол или с использованием Ni Ренея с добавкой гидразингидрата (Monatshefte fur Chemie, (1995), 126, 725-732), или же с помощью индия в кипящей смеси этанола с хлоридом аммония (Synlett (1998), 9, 1028). Далее продукт двойного восстановления повторно окисляют в присутствии хлорида железа (III) (FеСl3) (Synlett (1991), 10, 717-718) или йода (Tetrahedron Letters (1997), 38 (33), 5785-5788), получая в конечном итоге амины и анилины, вновь содержащие дитиолан общей формулы II.
Получение соединений общих формул III и IV
Синтез карбоксамидов общих формул III и IV
Карбоксамиды общих формул III и IV, схема 2, у которых А, X, R3 и m такие, как определены выше, получают конденсацией кислот общей формулы (1.vi) с монезащищенными аминами или анилинами общей формулы V или с нитропроизводными общей формулы VI, у которых А′ является радикалом -(СН2)n-. Радикал Rx в схемах синтезов настоящей заявки обозначает R3 или R4. Карбоксамидные связи образуются в классических условиях пептидного синтеза (M.Bodanszky и A.Bodanszky, The Practice of Peptide Synthesis, 145 (Springer-Verlag, 1984) в ТГФ, дихлорметане или ДМФ в присутствии сочетающего реагента, такого как дициклогексилкарбодиимид (ДЦК), 1,Г-карбонилдиимидазол (КДИ) (J. Med. Chem. (1992), 35 (23), 4464-4472) или гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (ХДЭК или WSCI) (John Jones, The chemical synthesis of peptides, 54 (Clarendon Press, Oxford, 1991)) или в присутствии изобутилхлорформиата и М-метилморфолина (Org. Prep. Proced. Int. (1975), 35, 215). Синтезы карбоновых кислот общей формулы (I.vi) и аминов/анилинов общих формул V и VI (не продажных) описаны ниже.

СХЕМА 2
Второй вариант
Соединения общей формулы I могут быть получены из промежуточных продуктов общих формул VII, VIII, IX и Х по схеме 3, где А, В, X и Y являются такими, как определены выше, А′ является радикалом -(CH2)n-, Rx обозначает R3 или R4 и Gp является защитной группой, например защитной группой карбаматного типа.

СХЕМА 3
Синтез карбоксамидов общей формулы I
Карбоксамиды общей формулы I, схема 4, у которых A′ , X, К3, Y и m являются такими, как определены выше, получают конденсацией кислот общей формулы (I.vi) с аминами/анилинами общей формулы VII. Карбоксамидные связи образуются в классических условиях пептидного синтеза (M.Bodanszky и A.Bodanszky, The Practice of Peptide Synthesis, 145 (Springer-Verlag, 1984) в ТГФ, дихлорметане или ДМФ в присутствии сочетающего реагента, такого как дициклогексилкарбодиимид (ДЦК), 1,1′ -карбонилдиимидазол (КДИ) (J. Med. Chem. (1992), 35 (23), 4464-4472) или гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида (ХДЭК или WSCI) (John Jones, The chemical synthesis of peptides, 54 (Clarendon Press, Oxford, 1991)) или в присутствии изобутилхлорформиата и N-метилморфолина (Огд. Prep. Proced. Int., (1975), 35, 215). Синтезы непродажных карбоновых кислот общей формулы (1.vi) описаны ниже.
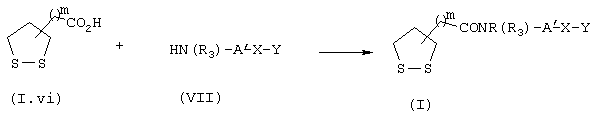
Синтез мочевин общей формулы I
Мочевины общей формулы I, схема 5, у которых А′ , R4, Х и Y являются такими, как определены выше, получают конденсацией кислот общей формулы (I.vi) с аминами/анилинами общей формулы VII в растворителе, таком как толуол в присутствии дифенилфосфорилазида (ДФФА) и основания, такого, например, как триэтиламин, преимущественно в течение 2-3 час и при нагревании преимущественно до температуры от 40 до 110° С, например при температуре 80° С.
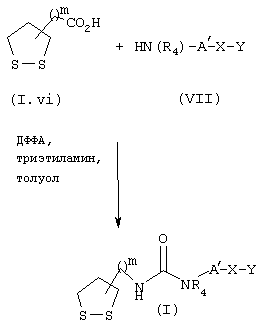
СХЕМА 5
Получение соединений общих формул VII, VIII, IX и Х
Соединения общей формулы VII получают путем отщепления защитной группы. Соединения общей формулы VII, у которых Rx, А′ , Х и Y являются такими, как определены выше, могут быть получены из соединений общей формулы VIII, схема 3, которые являются соединениями, содержащими защищенный амин (NGp) в форме, например, карбамата. В конкретном случае БОК-групп последние удаляют обычным способом с помощью трифторуксусной кислоты (ТФК) или НСl, получая в конечном итоге амины общей формулы VII.
Соединения общей формулы VIII могут быть получены из промежуточных продуктов общих формул IX и Х по схеме 3, где В, А', X, Y и Rx такие, как определены выше, a Gp является защитной группой, например карбонатного типа.
Производные анилина/аминов общей формулы IX могут быть сконденсированы с соединениями общих формул (1.i), (1.ii) и (I.iii), в которых L является удаляемой группой, или с соединениями общих формул (1.iv) и (1.v), как было ранее описано для соединений общей формулы I в схеме 1, с образованием в конечном итоге соединений общей формулы VIII, схема 3. В тех случаях, когда R3 обозначает радикал 2-гидрокси-4,6-диметоксибензил, a Gp обозначает трет-бутокси-карбонил (БОК), условия реакции приводят к N-дебензилированию in situ с непосредственным образованием соединений общей формулы VIII, схема 6.
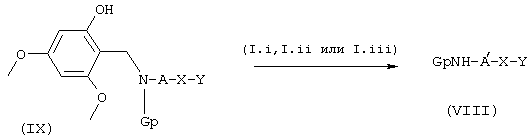
СХЕМА 6
Соединения общей формулы IX получают восстановлением нитрогруппы соединений общей формулы X. Восстановление нитрофункции соединений общей формулы X, схема 3, у которых Rx, A′ и Х являются такими, как определены выше, осуществляют, например, нагреванием продукта в каком-либо подходящем растворителе, таком как этилацетат с небольшим количеством этанола, в присутствии SnCl2 (J. Heterocyclic Chem. (1987), 24, 927-930; Tetrahedron Letters (1984), 25 (8), 839-842), в присутствии SnCl2/Zn (Synthesis (1996), 9, 1076-1078), или с помощью NaBH4-BiCl3 (Synth. Corn. (1995) 25 (23), 3799-3803) в растворителе, таком как этанол или с использованием Ni Ренея с добавкой гидразингидрата {Monatshefte fur Chemie (1995), 126, 725-732), или же с помощью индия в кипящей смеси этанола с хлоридом аммония (Synlett (1998), 9, 1028), получая в конечном итоге первичные амины и анилины общей формулы IX.
Получение непродажных соединений общей формулы Х описано ниже.
В) Получение соединений общей формулы I, в которых Y обозначает
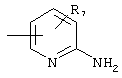
Соединения общей формулы I, в которых А, X, Y и R7 такие, как определены выше, могут быть получены из промежуточных продуктов общей формулы II по реакции, проиллюстрированной на схеме 7.
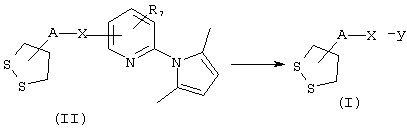
СХЕМА 7
Конечные молекулы общей формулы I получают после отщепления 2,5-диметилпиррольной защитной группы от соединений общей формулы II при нагревании в присутствии гидроксиламингидрохлорида при температуре от 60 до 100° С в растворителе, таком, например, как этанол, согласно экспериментальному протоколу, описанному в J. Chem. Perkin Trans. (1984), 12, 2801-2807.
Получение соединений общей формулы II
Соединения общей формулы II могут быть получены в соответствии со следующими схемами синтеза:
1) Способы получения замещенных 2-(2,5-диметилпиррол-1-ил)пиридинов общей формулы (II.x)
1.1) Синтетические предшественники, приводящие к промежуточным продуктам общей формулы II, получают, схема 8, из соединений общей формулы (II.1), таких, например, как 2-(2,5-диметилпиррол-1-ил)-4,6-диметилпиридин. Последний получают из продажного 6-амино-2,4-лютидина по экспериментальной прописи, приведенной в J. Chem. Soc. Perkin Trans. (1984), 12, 2801-2807. Обработка соединений общей формулы (II.1) сильным основанием, таким, например, как n-BuLi, при температуре от -50 до -30° С в безводном растворителе, таком как диэтиловый эфир в инертной атмосфере и, возможно, в присутствии N,N,N′ ,N′ -тетраметилэтилендиамина позволяет получить литиевое производное (промежуточный продукт (II.2)), которое в присутствии электрофила Е+ дает аддукты общей формулы (II.x).

СХЕМА 8
1.2) Среди электрофилов Е+, которые могут реагировать с литированным соединением общей формулы (II.2), имеются, например, защищенные галогенамины. Амины общей формулы (II.3) получают из промежуточного продукта (II.2), который конденсирован, например, с защищенными галогенаминами (например в виде силилированных производных или фталимидов) в описанных выше условиях. Амины общей формулы (II.4) получают в конечном итоге после удаления защиты в условиях, которые описаны в литературе (T.W.Greene и P.G.M.Wuts, Protective Groups in Organic Synthesis, Second edition (Wiley-Interscience, 1991)).
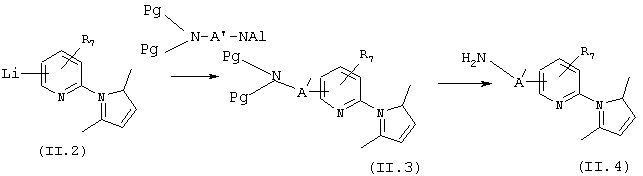 СХЕМА 9
СХЕМА 9
2) Способы получения соединений общей формулы II
Получение карбоксамидов общей формулы II
Карбоксамиды общей формулы II, у которых m, R3, А′ и R7 такие, как определены выше, могут быть также получены, схема 10, конденсацией карбоновых кислот общей формулы (I.vi) с аминами общей формулы (II.4) в описанных выше условиях. Синтез непродажных карбоновых кислот общей формулы (I.vi) описан ниже.
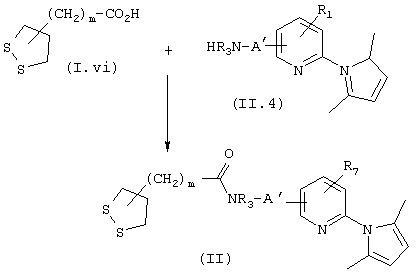
СХЕМА 10
3) Получение некоторых непродажных промежуточных продутов синтеза
Непродажные кислоты общей формулы (I.vi), у которых m такой, как определен выше, могут быть получены с использованием литературных методов. Например, трис-норлипоевую кислоту получают в 5 стадий в соответствии с экспериментальной прописью (Tetrahedron letters (1997), 38 (33), 5785-5788).
Когда Х обозначает радикал -(CH2)q-, селективно монозащищенные первичные амины общей формулы V и IX, у которых R3 обозначает Н, могут быть получены по описанным в литературе методам (например: Synthesis (1984), 12, 1032-1033; Synth. Соmmun.(1990), 20 (16), 2559-2564; J. Amer. Chem. Soc. (1993), 115 (9), 3548-3557; J. Med. Chem. (1989), 32 (2), 391-396; J. Amer. Chem. Soc. (1995), 117 (11), 3308-3309). Первичные нитроамины общей формулы VI, у которых R3 обозначает Н, могут быть получены по описанным в литературе методам (например: J. Chem. Soc. (1947), (1487).
Когда Х обозначает радикал фенилен, а n и R5 такие, как описаны выше, амины/анилины общей формулы V, у которых R3 обозначает Н, могут быть получены по методам, проиллюстрированным на приведенной ниже схеме 2.1.
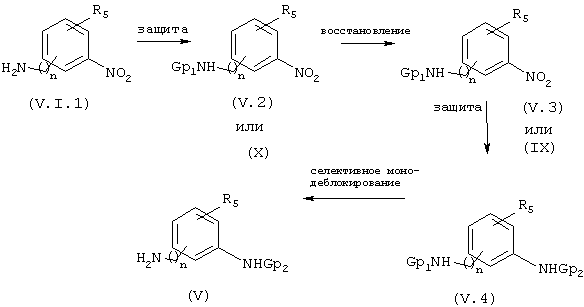
СХЕМА 2.1
Соединения общей формулы V, схема 2.1, получают из нитроаминов или нитроанилинов общей формулы (VI.1). Защиту аминной или анилиновой функции осуществляют, например, в каком-либо подходящем растворителе, таком как диоксан, дихлорметан или ацетонитрил в присутствии Fmoc-Cl (Tetrahedron Letters (1989), 30 (11), 1401-1404) или (БОК)2, или предшественников других известных специалистам защитных групп (Gp), в результате чего получают соединения общей формулы (V.2) (или соединения общей формулы X). Восстановление нитрофункции в промежуточных продуктах общей формулы (V.2) обычно осуществляют путем каталитического гидрирования в этаноле в присутствии 10% Pd/C или с помощью других ранее описанных методов, получая анилины (V.3) (или соединения общей формулы IX). Защиту анилиновой функции общей формулы (V.3) осуществляют, например, в присутствии Fmoc-Cl или (БОК)2, или предшественников других известных специалистам защитных групп (Gp), при условии, что Ср1≠Ср2, схема 2.1. Последняя стадия синтеза состоит в регенерировании первичного амина путем монодеблокирования. Когда, например, Gp1=Fmoc, деблокирование может быть, например, осуществлено в каком-либо подходящем растворителе, таком как ДМФ или диоксан в присутствии основания такого как пиперидин, морфолин, 4-диметиламинопиридин или диизопропилэтиламин (Tetrahedron Letters (1989), 30 (11), 1401-1404). Когда Gp2=БOK, деблокирование осуществляют традиционным способом с помощью трифторуксусной кислоты или НС1, получая в конечном итоге монезащищенные анилины общей формулы V. Соединения общих формул IX и X, у которых R3 является радикалом 2-гидрокси-4,6-диметоксифенолом, Gp представляет собой группу БОК, а n и R5 такие, как описаны выше, получают из нитроаминов или нитроанилинов общей формулы (VI.1), схема 6.1.
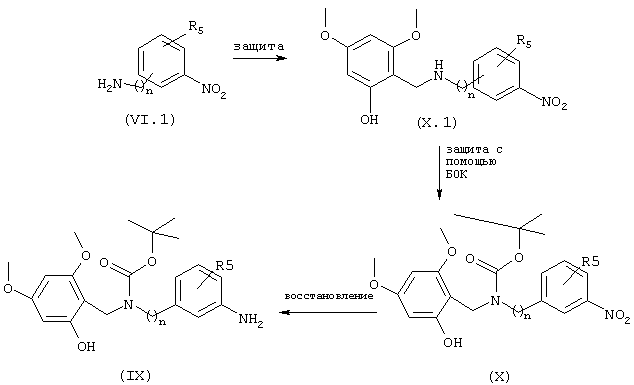 СХЕМА 6.1
СХЕМА 6.1
Соединения общих формул IX и Х получают, схема 6.1, конденсацией 2-гидрокси-4,6-диметоксибензальдегида с амином/анилином общей формулы (VI.1) в восстановительной среде. Реакция протекает в спиртовом растворителе, таком, например, как метанол, в присутствии восстанавливающего агента, такого, например, как NaBH4 или NаВН3СN. Защиту образовавшегося вторичного амина осуществляют после этого стандартным способом с помощью (БОК)2 в дихлорметане, получая соединения общей формулы X. Восстановление нитрофункции соединений общей формулы Х осуществляют каталитическим гидрированием в этаноле в присутствии 10% Pd/C, получая анилины IX.
Когда Х обозначает радикал фенилен, a Rs обозначает 5- или 6-членный гетероцикл, содержащий один гетероатом азота или группу, содержащую гетероатом W (группа, обозначаемая Wα β , в которой W=0, N или S, α обозначает алкил и β отсутствует, когда W=0 или S, или β обозначает Н или алкил, когда W=N), схемы 3.1 и 3.2, непродажные амины/анилины общей формулы X, у которых R3 является водородом, получают с использованием методов, описанных в литературе (например: J. Med. Chem. (1980), 23, 973-975; J. Med. Chem. (1990), 33, 633-641; Chem. Heterocycl. Compd. (EN), (1969), 5, 683-687; J. Org. Chem. USSR (EN) (1989), 3, 599-600; J. Med. Chem. (1994), 37, 467-475; J. Med. Chem. (1999), 42, 4362-4379). Соединения общей формулы X, могут быть, например, получены с помощью способов, проиллюстрированных на схеме 3.1.
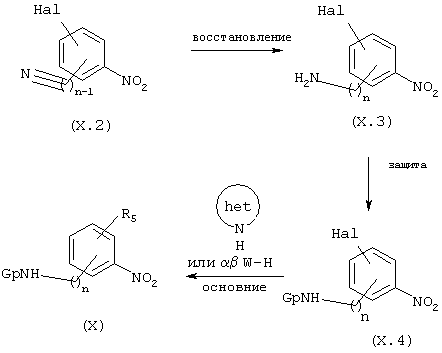
СХЕМА 3.1
Соединения общей формулы X, схема 3.1, у которых n, Het и Woβ являются такими, как определены выше, получают из галогеннитробензонитрилов общей формулы (Х.2). Восстановление нитрильной функции промежуточных продуктов общей формулы (Х.2), схема 3.1, осуществляют, например, в каком-либо подходящем растворителе, таком как эфир или ТГФ, в присутствии диборана или LAH. После этого образовавшиеся галогеннитроанилины/амины (Х.З) защищают в форме БОК (Х.4) или с помощью других известных специалистам защитных групп (Gp), после чего соединения общей формулы (Х.4) подвергают нуклеофильному замещению гетероциклической группой (het) в растворителе, таком как ДМСО или ДМФ в присутствии основания, такого как К2СО3, КОН или NaOH с получением промежуточных продуктов общей формулы X.
Соединения общей формулы Х такие, как определены выше, могут быть также получены с использованием способа, аналогичного способу, представленному на приведенной ниже схеме 3.2:
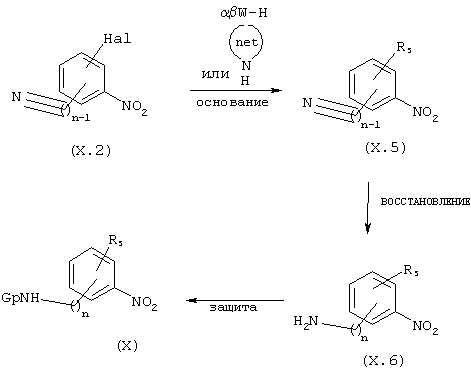
СХЕМА 3.2
Соединения общей формулы X, схема 3.2, у которых R5 обозначает 5- или 6-членный гетероцикл, содержащий гетероатом азота или группу, содержащую гетероатом W (определенный выше Wα β ), получают из галоген-нитробензонитрилов общей формулы (Х.2). Соединения общей формулы (Х.2) подвергают нуклеофильному замещению соответствующим реагентом в каком-либо растворителе, таком как ДМСО или ДМФ, в присутствии основания, такого как К2СО3, КОН или NaOH с получением промежуточных продуктов общей формулы (Х.5).
Восстановление нитрильной функции промежуточных продуктов общей формулы (Х.5), схема 3.2, осуществляют, например, в каком-либо подходящем растворителе, таком как эфир или ТГФ, в присутствии диборана или LAH. После этого образовавшиеся галогеннитроанилины/амины (Х.6) защищают в форме БОК или с помощью других известных специалистам защитных групп (Gp) с тем, чтобы получить в конечном итоге промежуточные продукты общей формулы X, схема 3.2.
Следующие примеры представлены для того, чтобы проиллюстрировать приведенные ниже процедуры и ни в коей мере не должны рассматриваться как ограничение объема изобретения.
ПРИМЕРЫ
Пример 1
Гидрохлорид N-{4-[[(2-тиенил)(имино)метил]амино]фенил}-1,2-дитиолан-3-пентанамид
1.1) N-{4-[{1,1-Диметилэтокси)карбониламино]фенил}-1,2-дитиолан-3-пентанамид
К раствору 2 г (9,694 ммоль) DL-липоевой кислоты в 40 мл дихлорметана последовательно добавляют 1,84 г (8,81 ммоль) N-БОК-1,4-фенилендиамина, 1,6 мл триэтиламина, 1,7 г (12,6 ммоль) гидроксибензотриазола, 4,82 г (25,2 ммоль) гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида и 1,6 мл триэтиламина. После перемешивания реакционной смеси в течение ночи при 25° С смесь разбавляют 100 мл воды и продолжают перемешивание в течение еще 30 мин. Продукт трижды экстрагируют 100 мл дихлорметана. Органический раствор высушивают на сульфате магния, фильтруют и упаривают в вакууме. Полученный рыжеватого цвета осадок суспендируют в эфире (100 мл), отфильтровывают и промывают в таком же объеме эфира, получая бледно-розовый с оранжевым отливом порошок с выходом 80,5%, т.пл.190-195° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,39 (м, 2Н, СН2); 1,57 (с, 9Н, БОК); 1,61 (м, 4Н, СН2); 1,88 (м, 1Н, CH2); 2,27 (м, 2Н, CH2); 2,50 (м, 1Н, СН2); 3,15 (м, 2Н, СН3); 3,63 (м, 1Н, -S- -); 7,34 (д, 2Н, аром., J=8,70 Гц); 7,45 (д, 2Н, аром., J=9,00 Гц); 9,24 (с, 1Н, CONH), 9,77 (с, 1Н, CONH-БОК).
-); 7,34 (д, 2Н, аром., J=8,70 Гц); 7,45 (д, 2Н, аром., J=9,00 Гц); 9,24 (с, 1Н, CONH), 9,77 (с, 1Н, CONH-БОК).
1.2) N-(4-Аминофенил)-1,2-дитиолан-3-пентанамид
Через раствор промежуточного продукта 1.1 (6,5 г; 16,4 ммоль) в смеси (200 мл) эфир/этанол/ацетон/дихлорметан (1/1/1/1) пропускают путем барботирования газообразного НС1 при 0° С. Температуру поднимают до комнатной температуры в течение ночи, пропускают через реакционный поток аргона и досуха упаривают растворители. После этого остаток упаривания вливают в 100 мл холодного насыщенного раствора NаНСО3 и трижды экстрагируют 100 мл дихлорметана. Органическую фазу высушивают на сульфате магния, фильтруют и упаривают в вакууме. После этого производят очистку на колонке с силикагелем (элюент: гептан с 50% этилацетата и затем дихлорметан с 5% этанола), получая твердое вещество бежевого цвета с выходом 29%, т.пл. 55-60° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,38 (м, 2Н, СН2); 1,57 (м, 4Н, СН2); 1,87 (м, 1Н, СН2); 2,22 (м, 2Н, СН2); 2,40 (м, 1Н, СН2); 3,18 (м, 2Н, СН2); 3,62 (м, 1Н, -S- -); 4,78 (с, 2Н, NH2); 6,48 (д, 2Н, аром., J=8,64 Гц); 7,20 (д, 2Н, аром., J=8,64 Гц); 9,39 (с, 1 Н,
-); 4,78 (с, 2Н, NH2); 6,48 (д, 2Н, аром., J=8,64 Гц); 7,20 (д, 2Н, аром., J=8,64 Гц); 9,39 (с, 1 Н, 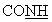 ).
).
1.3) Гидрохлорид N-14-[[(2-тиенил) (имино)метил]амино]фенил} -1,2-дитиолан-З-пентанамида
Промежуточный продукт 1.2 (0,703 г; 2,37 ммоль) растворяют в 2-пропаноле (15 мл) и добавляют 1,014 г гидройодида S-метил-2-тиофентиокарбоксимида (3,56 ммоль) (Ann. Chim. (1962), 7, 303-353). После нагревания в течение 15 час при 60° С реакционную смесь досуха упаривают в вакууме. Остаток поглощают дихлорметаном и насыщенным водным раствором NаНСОз. После разделения слоев органическую фазу последовательно промывают 50 мл насыщенного водного раствора NаНСО3, водой и рассолом. Органический раствор высушивают на сульфате магния, фильтруют и упаривают при пониженном давлении. После этого свободное основание растворяют в 30 мл дихлорметана, охлаждают раствор на ледяной бане и прибавляют по каплям 6,3 мл 1н раствора НСl в безводном диэтиловом эфире. После перемешивания в течение 15 час при 25° С полученные кристаллы отфильтровывают и промывают диэтиловым эфиром, получая после сушки 1,6 г твердого продукта светло-бежевого цвета с выходом 77%, т.пл. 258,7-258,9° С.
ЯМР 1Н (ДМСО-d6, 400 МГц, δ ): 1,43 (м, 2Н, СН2); 1,62 (м, 4Н, СН2); 1,88 (м, 1Н, CH2); 2,38 (м, 3Н, СН2); 3,18 (м, 2Н, СН2); 3,63 (м, 1Н, -S-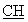 -); 7,20-8,20 (м, 7Н, аром.); 8,79 (с ушир., 1Н, NH+); 9,78 (с ушир., 1Н, NН+ ); 10,36 (с, 1Н,
-); 7,20-8,20 (м, 7Н, аром.); 8,79 (с ушир., 1Н, NH+); 9,78 (с ушир., 1Н, NН+ ); 10,36 (с, 1Н, 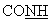 ); 11,49 (с ушир., 1Н, NH+).
); 11,49 (с ушир., 1Н, NH+).
ИК: vc=N (амидин): 1580 см-1; Vc=o (амид): 1659 см-1.
Пример 2
N-{2-{4-[[(2-тиенил)(имино)метил]амино]фенил}этил}-1,2-дитиолан-3-пентанамид
2.А. Первый вариант способа
Использована та же последовательность операций, которая описана для соединения 1. Желтый твердый продукт с т.пл. 146-148° С.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,32 (м, 2Н, СН2); 1,60 (м, 4Н, СН2); 1,88 (м, 1Н, СН2); 2/07 (т, 2Н, CH2, J=7,36 Гц); 2,41 (м, 1Н, СН2); 2,65 (м, 2Н, СН2); 3,10-3,30 (м, 4Н, СН2); 3,60 (м, 1 Н, -S- -); 6,33 (с ушир., 2Н, NH, амидин); 6,78 (д, 2Н, аром., J=8,04 Гц); 7,08 (м, 1Н, тиофен); 7,12 (д, 2Н аром., J=8,16 Гц); 7,60-7,80 (м, 2Н, тиофен); 7,81 (т, 1Н,
-); 6,33 (с ушир., 2Н, NH, амидин); 6,78 (д, 2Н, аром., J=8,04 Гц); 7,08 (м, 1Н, тиофен); 7,12 (д, 2Н аром., J=8,16 Гц); 7,60-7,80 (м, 2Н, тиофен); 7,81 (т, 1Н, 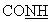 , J=5,56 Гц).
, J=5,56 Гц).
ИК: vC=N (амидин): 1590 см-1; Vс=o (амид): 1629 см-1.
2.В. Второй вариант способа
Синтез соединения примера 2 может быть также осуществлен по методу, проиллюстрированному на схемах 3 (с Gp=БOK и R3=2-гидрокси-4,6-диметоксибензил) и 6.
2.B.1) 3,5-Диметокси-2-({[2-(4-нитрофенил)этил]амино}метил) фенол
В колбу с 200 мл безводного метанола в инертной атмосфере последовательно добавляют 9,0 г (49,4 ммоль) 4,6-диметоксисалицилальдегида, 11,6 г (54,3 ммоль) гидрохлорида 4-нитрофенетиламина и 7,5 мл триэтиламина. Реакционную смесь интенсивно перемешивают в течение 15 мин, после чего порциями добавляют 2,1 г (55,5 ммоль) NaBH4. Перемешивание продолжают еще 10 час и добавляют 10 мл воды. Через четверть часа реакционную смесь дважды экстрагируют 100 мл СН2Сl2. Органическую фазу последовательно промывают 50 мл воды и 50 мл рассола, высушивают на сульфате натрия, фильтруют и упаривают в вакууме. Остаток после этого очищают на колонке с силикагелем (элюент: CH2Cl2/EtOH, 20/1), получая оранжевое масло с выходом 58%.
2.В.2) Трет-бутиловый эфир 2-гидрокси-4, 6-диметокси-бензил{2-(4-нитрофенил)этил]карбаминовой кислоты
Использована та же последовательность операций, которая описана для промежуточного продукта 7.B.1, с заменой пнитробензиламина на промежуточный продукт 2.В.1. Получают белое твердое вещество с выходом 60%, т.пл.133,5-134,4° С.
2.В.3) Трет-бутиловый эфир 2-(4-аминофенил)этил(2-гидрокси-4, 6-диметоксибензил)карбаминовой кислоты
Использована та же последовательность операций, которая описана для промежуточного продукта 7.В.2, с заменой промежуточного продукта 7.1 на промежуточный продукт 2.В.2. Получают прозрачное желтое масло с выходом 90%.
2.В.4) Трет-бутиловый эфир 2-(4-{[амино (2-тиенил) метили-ден]амино}фенил)этилкарбаминовой кислоты
Использована та же последовательность операций, которая описана для промежуточного продукта 1.3, с заменой промежуточного продукта 1.2 на промежуточный продукт 2.В.3. В этих условиях протекает N-дебензилирование с образованием первичного амина, монозащищенного группой БОК. Получают желтое твердое вещество с выходом 79%, т.пл. 144° С.
2.В.5) N′ -[4-(2-аминоэтил)фенил]-2-тиофенкарбоксимидамид
Использована та же последовательность операций, которая описана для промежуточного продукта 1.2, с заменой промежуточного продукта 1.1 на промежуточный продукт 2.В.4.
Получают белое твердое вещество с выходом 79%, т.пл. 169,2-170,5° С.
2.В.6) N-{2-{4-[[2-Тиенил) (имино)метил]амино]фенил}этил}-1,2-дитиолан-3-пентанамид
Использована та же последовательность операций, которая описана для промежуточного продукта 1.1, с заменой М-БОК-1,4-фенилендиамина на промежуточный продукт 2.В.5. Получают желтое твердое вещество с выходом 79%, т.пл. 146-148° С.
ЯМР 1Н (ДМСО-d6, 400 МГц, δ ): 1,32 (м, 2Н, CH2); 1,60 (м, 4Н, СН2); 1,88 (м, 1Н, CH2); 2,07 (т, 2Н, CH2, J=7,36 Гц); 2,41 (м, 1Н, CH2); 2,65 (м, 2Н, CH2); 3,10-3,30 (м, 4Н, CH2); 3,60 (м, 1Н, -S-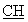 -); 6,33 (с ушир., 2Н, NH2, амидин); 6,78 (д, 2Н, аром., J=8,04 Гц); 7,08 (м, 1Н, тиофен); 7,12 (д, 2Н, аром., J=8,16 Гц); 7,60-7,80 (м, 2Н, тиофен); 7,81 (т, 1Н,
-); 6,33 (с ушир., 2Н, NH2, амидин); 6,78 (д, 2Н, аром., J=8,04 Гц); 7,08 (м, 1Н, тиофен); 7,12 (д, 2Н, аром., J=8,16 Гц); 7,60-7,80 (м, 2Н, тиофен); 7,81 (т, 1Н, 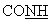 , J=5,56 Гц).
, J=5,56 Гц).
ИК: vC=N (амидин): 1590 см-1; vC=O (амид): 1629 см-1.
2.С. Еще один метод по второму варианту
Может быть также использован еще один синтез, проиллюстрированный на схеме 3, где Gp=БOK. Последовательность операций в этом случае аналогична описанной ниже для способа 7.
В с заменой п-нитробензиламина на 4-нитрофенетиламин.
Пример 3
Гидрохлорид N-{2-{4-[[(2-тиенил)(имино)метил]амино]
фенил}этил}-1,2-дитиолан-3-ацетамида 3.А. Первый вариант способа
Использована та же последовательность операций, которая описана для соединения 1, с заменой липоевой кислоты на трис-норлипоевую кислоту [2-(1,2-дитиолан-3-ил)уксусная кислота] (полученную по методу Tetrahedron Letters, (1997), 38, 33, 5785). Желтое твердое вещество.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 1,91 (м, 1Н, СН2); 2,30-2,60 (м, 3Н, СН2); 2,70-2,90 (м, 2Н, СН2); 3,17 (м, 2Н, СН2); 3,40 (м, 2Н, СН2); 3,93 (м, 1Н, -S- -); 7,30-7,50 (м, 5Н, аром.); 8,10-8,30 (м, 3Н, аром. +
-); 7,30-7,50 (м, 5Н, аром.); 8,10-8,30 (м, 3Н, аром. + 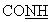 ; 8,86 (с ушир., 1H,NH+); 9,80(с ушир., 1Н, NH+); 11,50 (с ушир., 1Н, NH+). MS:MH+=392,1.
; 8,86 (с ушир., 1H,NH+); 9,80(с ушир., 1Н, NH+); 11,50 (с ушир., 1Н, NH+). MS:MH+=392,1.
3.В. Второй вариант способа
Синтез соединения примера 3 может быть также осуществлен по методу, проиллюстрированному на схемах 3 (с Gp=БOK и R3=2-гидрокси-4,6-диметоксибензил) и 6. Использованная последовательность операций та же, что и последовательность операций, описанная для способа 2.В, с заменой липоевой кислоты на трис-норлипоевую кислоту [2-(1,2-дитиолан-3-ил)уксусная кислота] (полученную по методу Tetrahedron Letters (1997), 38, 33, 5785). Желтое твердое вещество.
3.С. Еще один метод по второму варианту
Может быть также использован еще один синтез, проиллюстрированный на схеме 3, где Gр=БОК. Последовательность операций в этом случае аналогична описанной ниже для способа 7. В с заменой п-нитробензиламина на нитрофенетиламин и липоевой кислоты на трис-норлипоевую кислоту [2-(1,2-дитиолан-3-ил)уксусная кислота] (полученную по методу Tetrahedron Letters (1997), 38, 33, 5785)).
Пример 4
N-[4-(6-Амино-4-метил-2-пиридинил)бутил]-1,2-дитиолан-3-пентанамид
4.1) 6-(2,5-Диметил-1Н-пиррол-1-ил)-4-метил-2-пиридинбутанамин
Растворяют в атмосфере аргона 1 г (5 ммоль) 2-(2, 5-диметил-1Н-пиррол-1-ил)-4,6-диметилпиридина (полученного из 6-амино-2,4-лютидина по методу J. Chem. Soc., Perkin Trans., 1984, 12, 2801) в 10 мл безводного диэтилового эфира с 1,132 мл (7,5 ммоль) N,N,N,N-тетраметилэтилендиамина (ТМЭДА). Охлаждают реакционную смесь до -20° С и прибавляют по каплям 2,4 мл (6 ммоль) 2,5 М раствора BuLi в гексане. Реакционную смесь выдерживают 5 час при -20° С, охлаждают до -45° С, добавляют 1,68 г (6 ммоль) 1-(3-бромпропил)-2,2,5,5-тетраметил-1-аза-2,5-дисилациклопентана, после чего оставляют смесь на ночь для самопроизвольного подъема температуры до комнатной. Добавляют 50 мл насыщенного раствора хлорида аммония и перемешивают смесь 2 часа при 25° С. Органическую фазу отделяют и промывают последовательно 40 мл воды и 40 мл рассола, высушивают на сульфате магния, фильтруют и упаривают в вакууме. Полученный остаток очищают на колонке с силикагелем (элюент: дихлорметан с 5% этанола), получая желтое масло с выходом 62%.
ЯМР 1H (СDСl3, 400 МГЦ, δ ): 1,52 (м, 2H, СН2); 1,78 (м, 2Н, СН2); 2,11 (с, 6Н, 2× СН3 пиррол); 2,39 (с, 3Н, СН3, пиридин); 2,72 (т, 2Н, СН2, J=7,02 Гц); 2,79 (t, 2H, СН2, J=7,62 Гц); 5,87 (с, 2H, пиррол); 6,85 (с, 1Н, пиридин); 6,98 (с, 1Н, пиридин).
4.2) N-{4-[6- (2,5-диметил-1Н-пиррол-1-ил)-4-метил-2-пиридинил]бутил}-1, 2-дитиолан-3-пентанамид
Использованная последовательность операций та же, что и описанная для промежуточного продукта 1.1 с заменой N-БOK-1,4-фенилендиамин на промежуточный продукт 4.1. Получают желтое масло.
ЯМР 1H (CDCl3, 400 МГц, δ ): 1,30-2,00 (м, 11Н, CH2); 2,07 (м, 2Н, CH2); 2,11 (с, 6Н, 2× СН3 пиррол); 2,40 (с, 3Н, СН3 пиридин); 2,45 (м, 1Н, CH2); 2,82 (м, 2Н, CH2); 3,10-3,30 (м, 4Н, CH2); 3,57 (м, 1Н, -S- -); 5,87 (с, 2Н, пиррол); 5,94 (s ушир., 1Н,
-); 5,87 (с, 2Н, пиррол); 5,94 (s ушир., 1Н, 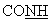 ); 6,87 (с, 1Н, пиридин); 6,99 (с, 1 Н, пиридин). MS:MH+ = 446,2
); 6,87 (с, 1Н, пиридин); 6,99 (с, 1 Н, пиридин). MS:MH+ = 446,2
4.3) N- [4-[6-амино-4-метил-2-пиридинил)бутил]-1,2-дитиолан-3-пентанамид
Растворяют промежуточный продукт 4.2 (1,53 г; 3,43 ммоль) в 55 мл этанола с добавкой 18 мл воды и добавляют 1,2 г (17,2 ммоль) гидроксиламина-гидрохлорида. Реакционную смесь кипятят в течение 24 час. После падения температуры до 25° С смесь разбавляют 20 мл насыщенного раствора бикарбоната натрия и экстрагируют продукт 100 мл дихлорметана. После разделения фаз органический раствор промывают последовательно 40 мл насыщенного раствора бикарбоната натрия и 40 мл рассола, высушивают на сульфате магния, фильтруют и упаривают в вакууме. Остаток упаривания очищают на колонке с силикагелем (элюент: дихлорметан с 2,5% этанола), получая желтое масло с выходом 76%.
ЯМР 1H (CDCl3, 400 МГц, δ ): 1,30-1,80 (м, 10Н, СН2); 1,89 (м, 1Н, СН2); 2,16 (м, 2Н, CH2); 2,19 (с, 3Н, СН3 пиридин); 2,40 (м, 1Н, СН2); 2,58 (м, 2Н, СН2); 3,05-3,30 (м, 4Н, CH2); 3,56 (м, 1Н, -S-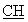 -); 4,35 (с ушир., 2Н, NH2); 5,80 (с ушир., 1Н,
-); 4,35 (с ушир., 2Н, NH2); 5,80 (с ушир., 1Н, 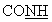 ); 6,17 (с, 1Н, пиридин); 6,35 (с, 1Н, пиридин). ИК: Vc=0 (амид): 1637 см-1.
); 6,17 (с, 1Н, пиридин); 6,35 (с, 1Н, пиридин). ИК: Vc=0 (амид): 1637 см-1.
Пример 5
Фумарат N-[4-(6-амино-4-метил-2-пиридинид)бутил]-1,2-дитиолан-3-ацетамида
Использованная последовательность операций та же, что и последовательность операций, описанная для соединения 4, с заменой липоевой кислоты на трис-норлипоевую кислоту [2-(1,2-дитиолан-3-ил)уксусная кислота] (полученную по методу Tetrahedron Letters (1997), 38, 33, 5785). Свободное основание после этого превращают в соль с помощью фумаровой кислоты в смеси растворителей ацетон/метилэтилкетон (50/50). Получают фумарат в виде кремового цвета порошка с выходом 14,8%.
ЯМР 1Н (ДМСО-d6, 400 МГц, δ ): 1,40 (м, 2Н, СН2); 1,57 (м, 2Н, CH2); 1,92 (м, 1Н, CH2); 2,15 (с, 3Н, СН3 пиридин); 2,30-2,70 (м, 5Н, CH2); 3,03-3,18 (м, 4Н, CH2); 3,94 (м, 1Н, -S-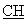 -); 6,17 (с, 1Н, пиридин); 6,26 (с, 1Н, пиридин); 6,00-6,60 (с ушир., 2Н, -CO2H фумаровая кислота); 6,60 (с, 2Н,
-); 6,17 (с, 1Н, пиридин); 6,26 (с, 1Н, пиридин); 6,00-6,60 (с ушир., 2Н, -CO2H фумаровая кислота); 6,60 (с, 2Н, 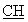 =
=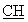 , фумаровая кислота); 7,90 (с ушир., 1Н,
, фумаровая кислота); 7,90 (с ушир., 1Н, 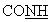 ). ИК: Vc=0 (амид): 1649 см-1. MS: ME+ = 326,2.
). ИК: Vc=0 (амид): 1649 см-1. MS: ME+ = 326,2.
Пример 6
N-[4-{[Амино(2-тиенил)метилиден]амино}фенил]-2-(1,2-дитиолан-3-ил)ацетамид
Использованная последовательность операций та же, что и последовательность операций, описанная для соединения 1, с заменой липоевой кислоты на трис-норлипоевую кислоту [2-(1,2-дитиолан-3-ил)уксусная кислота] (полученную по методу Tetrahedron Letters, (1997), 38, 33, 5785). Желтая пена.
ЯМР 1H (ДМСО-d6, 400 МГц, δ ): 2,00 (м, 1Н, CH2); 2,40-2,80 (м, 3Н, СН2); 3,00-3,30 (м, 2Н, CH2); 4,10(м, 1Н, -S-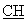 -); 6,50-6,80 (с ушир., 2Н, NH+); 6,80-7,10 (м, 3Н, аром.); 7,50-7,80 (м, 4Н, аром.); 9,93 (с, 1Н,
-); 6,50-6,80 (с ушир., 2Н, NH+); 6,80-7,10 (м, 3Н, аром.); 7,50-7,80 (м, 4Н, аром.); 9,93 (с, 1Н, 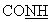 ). NH+ = 364,1.
). NH+ = 364,1.
Пример 7
N-[4-{[Амино(2-тиенил)метилиден]амино}бензил)-5-(1,2-дитиолан-3-ил)пентанамид
7.А. Первый вариант способа
Использованная последовательность операций та же, что и последовательность операций, описанная для соединения 1, с заменой N-БOK-1,4-фенилендиамина на трет-бутиловый эфир 4-(аминометил)фенилкарбаминовой кислоты. Твердое вещество, т.пл.151,9-152,1° С.
7.В. Второй вариант способа
7.В.1) Трет-бутил-4-нитробензилкарбамат
Растворяют 5,66 г (30,0 ммоль) гидрохлорида п-нитробензиламина в смеси 100 мл дихлорметана с 9,2 мл триэтиламина. Реакционную смесь охлаждают на ледяной бане и добавляют несколькими порциями 7,2 г (33,0 ммоль) (БОК)20, перемешивают 12 час при 23° С и вливают в смесь воды со льдом. Органическую фазу отделяют, промывают последовательно 20 мл воды и 20 мл рассола. После высушивания на сульфате магния, фильтрации, упаривания в вакууме и растирания в диизопропиловом эфире получают белое твердое вещество с выходом 67,4%, т.пл. 107,8° С.
7.В.2) Трет-бутил-4-аминобензилкарбамат
В автоклав из нержавеющей стали с магнитным бруском загружают раствор промежуточного продукта 7.B.I (5,1 г; 20,2 ммоль) в 66 мл смеси дихлорметана, этилацетата и ТГФ (1 мл/60 мл/5 мл), а также 1,0 г 10% Pd/C. Реакционную смесь перемешивают под давлением водорода (1,5 бар) в течение 12 час при температуре 20° С. После этого Pd/C удаляют фильтрацией, а фильтрат упаривают в вакууме. Остаток упаривания очищают растиранием с диизопролиловым эфиром, получая серовато-белый порошок с выходом 42%, т.пл.74,4° С.
7.В.3) Трет-бутиловый эфир 4-{[амино(2-тиенил)метили-ден]амино}бензилкарбаминовой кислоты
Использованная последовательность операций та же, что и последовательность операций, описанная для промежуточного продукта 1.3, с заменой промежуточного продукта 1.2 промежуточным продуктом 7.В.2. Получают оранжевое масло с выходом 99%.
ЯМР 1H (AMCO-d6, 400 МГц, δ ): 1,40 (с, 9Н, 3хСН3); 4,19 (д, 2Н, CH2, J=6,00 Гц); 7,30-7,40 (м, 5Н, аром.); 7,46 (т, 1Н, CONH, J=6,00 Гц); 8,10-8,20 (м, 2Н, тиофен); 9,00-10,00 (с ушир., 2Н, NH, амидин); 11, 10-11,40 (с ушир., 1Н, HI). МН+ = 332,2.
7.8.4) N′ -[4-(аминометил)фенил]-2-тиофенкарбоксимидамид
Использованная последовательность операций та же, что и последовательность операций, описанная для промежуточного продукта 1.2, с заменой промежуточного продукта 1.1 промежуточным продуктом 7.В.3. Получают белое твердое вещество с выходом 92%, т.пл. 241,1-241,6° С.
7.8.5) N-(4-{[Амино(2-тиенил)метилиден]амино}бензил)-5-(1,2-дитиолан-3-ил)пентанамид
Использованная последовательность операций та же, что и последовательность операций, описанная для промежуточного продукта 1.1, с заменой N-БОК-1,4-фенилендиамина промежуточным продуктом 7.В.4. Получают белое твердое вещество с выходом 40%, т.пл. 151,9-152,1° С.
Пример 8
N-(5-{[Амино(2-тиенил)метилиден]амино}-2-метоксифенил)-5-(1,2 дитиолан-3-ил)пентанамид
(полученный по второму варианту способа)
8.1. 5-(1,2-Дитиолан-3-ил)-N-(2-метокси-5-нитрофенил)пентанамид
К раствору 4,12 г (21,0 ммоль) DL-липоевой кислоты в 50 мл ДМФ добавляют последовательно 3,36 г (21,0 ммоль) 2-метокси-5-нитроанилина, триэтиламин (6,0 мл), 3,0 г (22,0 ммоль) гидроксибензотриазола и 4,21 (22,0 ммоль) гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида. После перемешивания в течение 18 час при 80° С реакционную смесь разбавляют 400 мл воды и продолжают перемешивание в течение дополнительных 30 мин. Продукт трижды экстрагируют 200 мл дихлорметана. Органический раствор высушивают на сульфате магния, фильтруют и упаривают в вакууме. Полученное твердое вещество отфильтровывают и промывают диэтиловым эфиром, получая после сушки 2,6 г желтого твердого продукта (выход 37%), т.пл 116,7-117,1° С.
8.2. N-(5-Амино-2-метоксифенил)-5-(1,2-дитиолан-3-ил)пентанамид
К раствору 2,6 г (13,20 ммоль) промежуточного продукта 8.1 в 40 мл этанола добавляют последовательно 10 мл насыщенного водного раствора хлорида аммония и 12,0 г (0,183 моль) порошка индия. После этого реакционную смесь кипятят в течение 4,5 час (Synlett (1998), 9, 1028), охлаждают до комнатной температуры и фильтруют на целите. Фильтрат подщелачивают 50%-ным раствором гидроксида натрия до рН 10. Восстановленный продукт 4 раза экстрагируют 150 мл дихлорметана. Органический раствор высушивают на сульфате магния, фильтруют и упаривают в вакууме, получая масло каштанового цвета. Масло растворяют в 50 мл этилацетата и охлаждают смесь до 0° С на ледяной бане. После этого прибавляют по каплям 10%-ный раствор бикарбоната калия в воде, перемешивают смесь приблизительно 10 мин при 0° C и прибавляют по каплям раствор йода (0,8 г в 10 мл этилацетата) до устойчивой йодной окраски. Продукт экстрагируют 4 раза 100 мл этилацетата, после чего органический раствор высушивают на сульфате магния, фильтруют и упаривают в вакууме. Далее проводят очистку на колонке с силикагелем (элюент: 5% этанол в дихлорметане), получая масло каштанового цвета (1,0 г, выход 63%). MH+ = 327,20.
8.3. N-(5-{[Амино(2-тиенил)метилиден]амино}-2-метоксифенил)-5-(1, 2-дитиолан-З-ил)пентанамид МН+=436,10.
Пример 9
N-[5-{[Амино(2-тиенил)метилиден]амино}-2-(диметиламино)бензил]-5-(1,2 дитиолан-3-ил)пентанамид
(полученный по второму варианту способа)
9.1. 2-(Диметиламино)-5-нитробензонитрил
Растворяют в атмосфере аргона 1,66 г (10,0 ммоль) 2-фтор-5-нитробензонитрила, 1,22 г (15,1 ммоль) гидрохлорида диметиламина и 3,46 г (25,1 ммоль) бикарбоната калия в ДМФ (30 мл), после чего реакционную среду нагревают в течение 18 час при 80° С, охлаждают до 0° C, добавляют ледяную воду и экстрагируют этилацетатом. Органическую фазу промывают последовательно 50 мл воды и 50 мл рассола, высушивают на сульфате магния, фильтруют и упаривают в вакууме. Остаток упаривания очищают растиранием с диизопропиловым эфиром. Полученное твердое вещество отфильтровывают и промывают изопентаном, получая после сушки 2,0 г желтого твердого продукта (выход 100%), т.пл. 109-110,5° С.
9.2. 2-(Аминометил)-N,N-диметил-4-нитроанилин
Промежуточный продукт 9.1 (1,5 г; 7,85 ммоль) растворяют в атмосфере аргона в ТГФ (40 мл) и добавляют раствор диборана (16 мл, 1 М в ТГФ). После этого реакционную смесь кипятят в течение 6 час, добавляют метанол (30 мл) и затем в течение 15 мин барботируют через смесь газообразный НСl. Реакционную среду досуха упаривают, поглощают раствором бикарбоната натрия и экстрагируют дихлорметаном. Органическую фазу промывают последовательно 50 мл воды и 50 мл рассола, высушивают на сульфате магния, фильтруют и упаривают в вакууме. Остаток упаривания очищают кристаллизацией из смеси диизопропиловый эфир-дихлорметан, получая желтый твердый продукт с выходом 82%, т.пл. 196-200° С.
9.3. Трет-бутиловый эфир 2-(диметиламино)-5-нитробензил-карбаминовой кислоты
Использованная последовательность операций та же, что и последовательность операций, описанная для стадии 7. B.1 примера 7, с заменой гидрохлорида п-нитробензиламина на промежуточный продукт 9.2. Получают желтое твердое вещество с выходом 100%, т.пл. 101-102° С.
9.4. Трет-бутиловый эфир 5-амино-2-(диметиламино)бензилкарбаминовой кислоты
Использованная последовательность операций та же, что и последовательность операций, описанная для стадии 7. В. 2 примера 1, с заменой промежуточного продукта 7.В.1 на промежуточный продукт 9.3. Получают масло каштанового цвета с выходом 15%. MH+ = 266,20.
9.5. Трет-бутиловый эфир 5-{[амино(2-тиенил)метилиден]амино}-2-(диметиламино)бензилкарбаминовой кислоты
Использованная последовательность операций та же, что и последовательность операций, описанная для стадии 1.3 примера 1, с заменой промежуточного продукта 1.2 на промежуточный продукт 9.4. Получают желтое твердое вещество с выходом 64%, т.пл. 175,8-177,0° С.
9.6. N′ -[3-(аминометил)-4-(диметиламино)фенил]-2-тиофенкарбоксимидамид
Использованная последовательность операций та же, что и последовательность операций, описанная для стадии 1.2 примера 1, с заменой промежуточного продукта 1.1 на промежуточный продукт 9.5. Получают желтое твердое вещество с выходом 66%, т.пл. 169,0-170,0° С.
9.7. N-[5-{[Амино(2-тиенил)метилиден]амино}-2-(диметиламино)бензил]-5-(1, 2-дитиолан-З-ил)пентанамид
Использованная последовательность операций та же, что и последовательность операций, описанная для стадии 1.1 примера 1, с заменой N-БОК-1,4-фенилендиамина на промежуточный продукт 9.6. Получают белое твердое вещество с выходом 67%, т.пл. 183,5-185,0° С.
Пример 10
N-[5-{[амино(2-тиенил)метилиден]амино}-2-(1Н-пиррол-1-ил)бензил]-5-(1,2 дитиолан-3-ил)пентанамид
Использованная последовательность операций та же, что и последовательность операций, описанная для соединения примера 9, с заменой в первой стадии гидрохлорида диметиламина на пиррол. Получают белое твердое вещество с выходом 72%, т.пл. 156,1-157, 6° С.
Фармакологические исследования соединений согласно изобретению
Изучение влияния на конституционную нейрональную NO-синтазу мозжечка крысы
Ингибиторную активность продуктов изобретения определяют путем измерения их влияния на превращение с помощью МО-синтазы [3Н]L-аргинина в [3H-цитруллин с использованием модифицированного метода Bredt и Snyder (Proc. Nat. Acad. Sci. USA, (1990) 87: 682-685). Мозжечки крыс породы Sprague-Dawley (300 г Charles River) быстро отбирают, препарируют при 4° С и гомогенизируют в определенном объеме экстракционного буфера (HEPES 50 мМ, EDTA 1 мМ, рН 7,4, pepstatin A 10 мг/мл, leupeptine 1 - мг/мл). Гомогенаты затем центрифугируют при 21000 г в течение 15 мин при 4° С. Измерение производят в стеклянных пробирках, в которых распределены 100 мкл инкубационного буфера, содержащего 100 мМ HEPES (рН 7,4), 2 мМ 3DTA, 2,5 мМ CaCl2, 2 мМ дитиотреитола, 2 мМ восстановленного НАДФ и 10 мкг/мл кальмодулина. Добавляют 25 мкл раствора, содержащего 100 нМ [3Н]L-аргинина (удельная активность 56,4 Кюри/ммоль, Amersham) и 40 мкМ нерадиоактивного L-аргинина. Реакцию инициируют добавлением 50 мкл гомогената, в результате чего конечный объем составляет 200 мкл (недостающие 25 мкл представляют собой либо воду, либо тестируемый продукт). Через 15 мин реакцию останавливают с помощью 2 мл останавливающего буфера (20 мМ HEPES, рН 5,5, 2 мМ ЭDTA). После пропускания образцов через колонку с 1 мл смолы DOWEX количественно измеряют радиоактивность на жидкостном сцинцилляционном спектрометре.
Описанные выше соединения примеров 1, 2, 3, 4, 5 показывают значения CI50 ниже 4,5 мкМ.
Изучение влияния на окислительный стресс, вызванный глутаматом в культуре клеток (НТ-22)
Ингибирующую активность соединений согласно изобретению определяют путем измерения их способности защищать клетки гиппокампальной линии мышей (НТ-22) от окислительного стресса, вызываемого глутаматом. Биосинтез глутатиона - незаменимого элемента для детоксификации клеток в отношении свободных радикалов требует активного внутриклеточного транспорта цистина. Глутамат, препятствуя прониканию цистина, вызывает понижение уровня глутатиона, что приводит к смерти клетки от окислительного стресса (Davis, J.B. and Maher, P., Brain Res. (1994), 652: 169-173; Murphy, Т.Н. et al.. Neuron (1989) 2: 1547-1558). Клетки культивируют при 37° С в среде DMEM, к которой добавлено 10% плодной сыворотки теленка. Испытания проводятся на планшетах с 96 лунками, в каждой из которых содержится по 5000 клеток. Глутамат (5 мМ) добавляют к среде, содержащей или не содержащей испытуемые продукты. Выживаемость клеток тестируют через 24 часа по методу МТТ (Hansen, M.B. et al., J. Immunol. Methods (1989), 119, 203-210). Способность соединений защищать клетки от токсического действия глутамата оценивают в виде величины CE50, рассчитываемой по отношению к выживаемости клеток, не подвергшихся действию глутамата, выживаемость которых принимают за 100%.
Описанные выше соединения примеров 1, 2, 3, 5 показывают значения СЕ50 ниже 30 мкМ.
Настоящее изобретение относится к новым производным липоевой кислоты формулы Iа
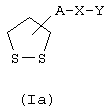
в которой А обозначает радикалы -(CH2)m-CO-NR3-(CH2)n- или -(СН2)m-, R3 - водород или алкильный радикал C1-C6, Х обозначает радикал
Т вместе с Y обозначает радикал -(CH2)i-, R5 - алкильный радикал, алкокси, диалкиламино, 5-членный гетероцикл. Соединения обладают ингибирующей активностью в отношении ферментов NO-синтаз, продуцирующих монооксид азота NO, и/или являются агентами, позволяющими регенерировать антиоксиданты. Предметом изобретения являются также способы получения этих соединений, содержащие их фармацевтические препараты, и их использование в терапевтических целях. 5 н.з. и 3 з.п. ф-лы.
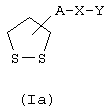
в которой А обозначает радикалы -(CH2)m-CO-NR3-(CH2)n- или
-(СН2)m-, где m и n обозначают целые числа 0-6,
R3 обозначает атом водорода или нормальный или разветвленный алкильный радикал с 1-6 атомами углерода;
Х обозначает радикал

в котором группа Т, соединенная с группой Y, обозначает радикал -(CH2)i-, в котором i обозначает целое число 0-6, a R5 обозначает атом водорода, нормальный или разветвленный алкильный радикал с 1-6 атомами углерода или радикал алкокси или диалкиламино, содержащий 1-6 атомов углерода, или же R5 может также обозначать 5-членный гетероцикл, в котором гетероциклические звенья выбраны из радикалов -O-,-NH- и -S-; либо Х обозначает радикал -(CH2)q-, в котором q обозначает целое число 0-6;
Y обозначает один из радикалов:
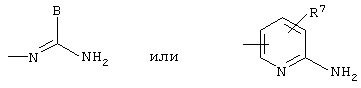
в которых В обозначает нормальный или разветвленный алкильный радикал с 1-6 атомами углерода, 5- или 6-членный карбоциклический или гетероциклический арил, содержащий 1-4 гетероатомов, выбранных из О, S, N, в частности, радикалы тиофен, фуран, пиррол или тиазол, причем радикал арил может быть замещен одной или несколькими группами, выбранными из нормальных или разветвленных радикалов алкил или алкокси;
R7 обозначает атом водорода или нормальный или разветвленный алкильный радикал с 1-6 атомами углерода.
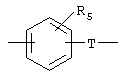
в котором группа Т, соединенная с группой Y, обозначает радикал -(СН2)i-, в котором i обозначает целое число 0-6,
R5 обозначает радикал пиррол, имидазол, пиразол, триазол, тиазолидин, пирролидин, пиперидин, пиперазин, N-алкилпиперазин, тиоморфолин, морфолин или азетидин.
-N-{4-[[(2-тиенил)(имино)метил]амино]фенил}-1,2-дитиолан-3-пентанамид;
-N-{2-{4-[[(2-тиенил)(имино)метил]амино]фенил}этил}-1,2-дитиолан-3-пентанамид;
-N-{2-{4-[[(2-тиенил)(имино)метил]амино]фенил}этил}-1,2-дитиолан-3-ацетамид;
-N-[4-(6-амино-4-метил-2-пиридинил)бутил]-1,2-дитиолан-3-пентанамид;
-N-[4-(6-амино-4-метил-2-пиридинил)бутил]-1,2-дитиолан-3-ацетамид;
-N-(4-{[амино(2-тиенил)метилиден]амино}фенил)-2-(1,2-дитиолан-3-ил)ацетамид;
-N-(4-{[амино(2-тиенил)метилиден]амино}бензил)-5-(1,2-дитиолан-3-ил)пентанамид;
-N-(5-{[амино(2-тиенил)метилиден]амино}-2-метоксифенил)-5-(1,2-дитиолан-3-ил)пентанамид;
-N-[5-{[амино(2-тиенил)метилиден]амино}-2-(диметиламино)бензил]-5-(1,2-дитиолан-3-ил)пентанамид;
-N-[5-{[амино(2-тиенил)метилиден]амино}-2-(1Н-пиррол-1-ил)бензил]-5-(1,2-дитиолан-3-ил)пентанамид;
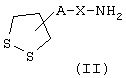
в которой А обозначает радикалы -(CH2)m-CONH-(CH2)n- или -(СН2)m-, где m и n обозначают целые числа 0-6,
Х обозначает радикал фенилен или -(CH2)q-, где q обозначает целое число 0-6,
вводят в реакцию с промежуточным соединением общей формулы (I.i):
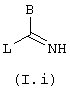
в которой В обозначает нормальный или разветвленный алкильный радикал с 1-6 атомами углерода, 5- или 6-членный карбоциклический или гетероциклический арил, содержащий 1-4 гетероатомов, выбранных из О, S, N, в частности, радикалы тиофен, фуран, пиррол или тиазол, причем радикал арил может быть замещен одной или несколькими группами, выбранными из нормальных или разветвленных радикалов алкил или алкокси, имеющих 1-6 атомов углерода,
L обозначает удаляемую группу, например радикал алкокси, алкилтио, остаток сульфоновой кислоты, галоген, остаток арилового спирта или тозил.
HN(R3)-A’-X-Y
(VII) a
где R3 такой, как определен выше;
Х и Y такие, как определены в п. 1;
А’ обозначает радикал -(СН2)n-, в котором n является целым числом 0-6,
вводят во взаимодействие с соединением общей формулы (I.vi):
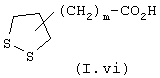
где m является целым числом 0-6.
Приоритет по пунктам:
| Способ получения производных 1,2-дитиол-3-она или их хлористоводородных солей | 1984 |
|
SU1480769A3 |
| EP 869126 A, 07.10.1998 | |||
| Способ изготовления образца для измерения когезионной прочности рабочего слоя носителя магнитной записи | 1982 |
|
SU1014020A1 |
Авторы
Даты
2004-08-10—Публикация
2000-03-31—Подача