Изобретение относится к новому классу соединений, а именно, производным аминобензофенона, к фармацевтическим препаратам, содержащим указанные соединения, к стандартным дозированным формам таких препаратов, к методам лечения пациентов, включающим введение указанных соединений, и к применению указанных соединений в получении фармацевтических препаратов.
Уровень техники
Ранее был описан ряд близко родственных аминобензофенонов (например, 4-(2-амино-4-нитрофениламино)бензофенон) (Hussein, F.A. et al, Iraqi J. Sci., 22, 54-66 (1981)). Однако нет описания их применения. В WO 98/32730, WO 01/05744, WO01/05746, WO 01/05749, WO 01/05751, WO 01/05745 и WO 01/42189 описаны аминобензофеноновые ингибиторы секреции Интерлейкина 1b (ИЛ-1b) и фактора некроза опухоли a (ФНО-a) in vitro, где указанные соединения являлись потенциально полезными для лечения воспалительных заболеваний, в которых вырабатывание цитокинов вовлечено в патогенез, например, астмы, ревматоидного артрита, псориаза, контактного дерматита и атопического дерматита. Более того, соединения, описанные в указанных выше заявках на патенты, были тестированы in vivo на противовоспалительные свойства в мышиной модели хронического воспаления кожи, вызванного 12-О-тетрадеканоилфорбол-13-ацетатом (ТФА), (De Young, L.M. et al., Agents Action, 26, 335-341 (1989); Carlson, R.P. et al., Agents Action, 17, 197-204 (1985); Alford, J.G. et al., Agents Action, 37, (1992); Stanley, P.L. et al., Skin Pharmacol, 4, 262-271 (1991)). В данной модели хронического воспаления кожи соединения имели эффективность, подобную таковой у сравнительного соединения гидрокортизона.
Получение структурно родственных аминобензофенонов, применяемых в качестве красителей для текстиля, описано в Man-Made Text. India (1987), 30(6), 275-6, Man-Made Text. India (1986), 29(5), 224-30 и Man-Made Text. India (1985), 28(11), 425, 427-9, 431; и структурно родственные аминобензофеноны описаны в JP 81-61259 в качестве реагента для получения предшественников красителя флуорана.
Целью данного изобретения является получение других фармакологически активных производных бензофенона с превосходными физико-химическими свойствами, в частности, с улучшенной биодоступностью.
Краткое описание изобретения
Неожиданно было обнаружено, что новые производные аминобензофенона общей формулы I являются мощными ингибиторами секреции Интерлейкина 1b (ИЛ-1b) и фактора некроза опухоли α (ФНО-α) in vitro, что делает их потенциально полезными для лечения воспалительных заболеваний, в которых секреция и регуляция цитокинов, или более конкретно, Интерлейкина 1b (ИЛ-1b) и фактора некроза опухоли a (ФНО-a) вовлечены в патогенез. Ингибирование или ослабление регуляции цитокинов возможно благодаря ингибированию МАП киназ.
Следовательно, данное изобретение относится к соединениям общей формулы I
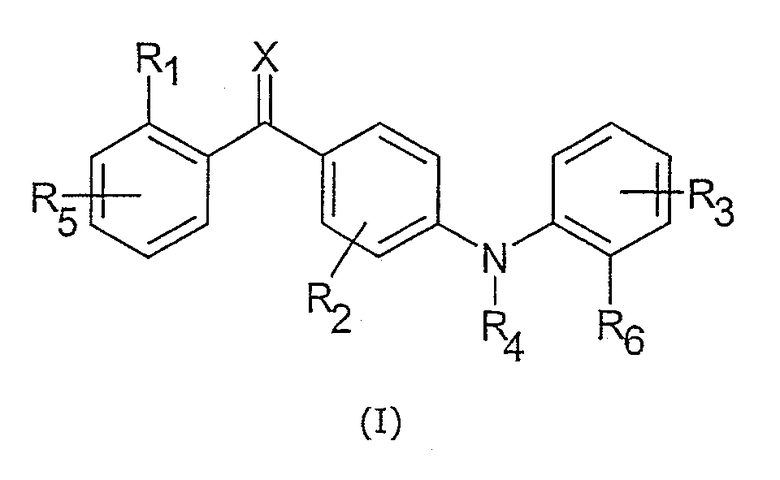
где
Х является кислородом, серой или N-ORс;
R1 является заместителем, выбранным из группы, включающей галоген, гидрокси, меркапто, трифторметил, амино, (С1-С3)алкил, (С2-С3)олефиновую группу, (С1-С3)алкокси, (С1-С3)алкилтио, (С1-С6)алкиламино, (С1-С3)алкоксикарбонил, циано, -CONH2, фенил и нитро;
R2 является одним или более, одинаковыми или разными заместителями, выбранными из группы, включающей водород, галоген, гидрокси, меркапто, трифторметил, амино, (С1-С3)алкил, (С2-С3)олефиновую группу, (С1-С3)алкокси, (С1-С3)алкилтио, (С1-С6)алкиламино, (С1-С3)алкоксикарбонил, циано, -CONH2, фенил и нитро;
R3 является одним или более, одинаковыми или разными заместителями, выбранными из группы, включающей водород, галоген, гидрокси, меркапто, трифторметил, циано, карбокси, карбамоил, нитро, (С1-С10)алкил, (С2-С10)олефиновую группу, (С3-С12)циклическую углеводородную группу, (С1-С10)алкокси, (С1-С10)алкилтио, (С1-С10)алкоксикарбонил и фенил;
R4 является водородом, (С1-С6)алкилом, (С2-С6)олефиновой группой, (С3-С6)циклической углеводородной группой или -C(O)O-C(Rd)(Re)(-O-C(O)-R14); где группа R14 необязательно замещена одним или более одинаковыми или разными заместителями, представленными R8;
R5 является одним или более одинаковыми или разными заместителями, выбранными из группы, включающей водород и R1;
R6 является (С1-С10)алкил-гетероциклилом, (С1-С10)алкил-(С3-С12)циклической углеводородной группой, (С1-С10)алкилом, (С2-С10)олефиновой группой, (С3-С12)циклической углеводородной группой, гетероциклилом, (С2-С10)алкинилом, Y1R21, Y2R22 или Y4R24; где (С1-С10)алкил, (С2-С10)олефиновая группа и (С3-С12)циклическая углеводородная группа замещены одним или более одинаковыми или разными заместителями, представленными R7 и где (С1-С10)алкил-гетероциклил, (С1-С10)алкил-(С3-С12)циклическая углеводородная группа, гетероциклил и (С2-С10)алкинил необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R7;
R7 является R12, Y-H или Y-R14; где R12 и Y-R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R8;
R8 является R12, Y-H, Y-R14 или R14; где R12, Y-R14 и R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R9;
R9 является R12, Y-H, Y-R14 или R14; где R12, Y-R14 и R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R10;
R10 является R12, Y-H, Y-R14 или R14; где R12, Y-R14 и R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R11;
R11 является R12 или R14; где R12 и R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R12;
R12 является галогеном, гидрокси, меркапто, трифторметилом, амино, (С1-С3)алкокси, (С1-С3)алкилтио, (С1-С6)алкиламино, (С1-С3)алкоксикарбонилом, (С1-С9)триалкиламмонием в сочетании с анионом, (С2-С10)диалкилфосфиноилом, (С1-С5)алкил(гидрокси)фосфиноилом, (С2-С10)диалкилфосфиноилокси, (С1-С5)алкил(гидрокси)фосфиноилокси, дигидроксифосфиноилом, дигидроксифосфиноилокси, циано, азидо, нитро, -СНО, -СООН, -CONH2, -CONHR' или -CONRR', где R и R' являются (С1-С3)алкилом;
Y является -O-, -S-, -S(O)-, -S(O)2-, -NRa-, -NRaC(Z)NRb-,
-NRaC(Z)-, -C(Z)NRa-, -C(O)-, -C(S)-, -C(Z)O-, -C(O)Z-, -C(S)S-, -OC(Z)-, -NRaC(Z)O-, -OC(Z)NRa-, -S(O)2O-, -OS(O)2-, -S(O)2NRa-, -NRaS(O)2-, -OC(Z)O-, -OC(Z)Z-, -OP(O)(ORa)O-, -P(O)(ORa)O-, -C(NRa)-, -C(NORa)-, -N=C(Ra)-, -N=C(ORa)-, -N(ORa)-, -ON(Ra)-, -N(Ra)O-, -N(Ra)C(=NRb)NRc-, -C(=NRa)NRb- или -N(Ra)C(=NRb)-;
Z является кислородом или серой;
R14 является (С1-С6)алкилом, (С2-С6)олефиновой группой, (С3-С12)циклической углеводородной группой, гетероциклилом или (С2-С6)алкинилом;
Y1 является -NRaC(S)NRb-, -C(O)-, -С(S)-, -C(S)O-, -C(O)S-, -C(S)S-, -OC(S)-, -OC(O)-, -NRaC(S)O-, -OC(Z)NRa-, -S(O)2O-, -OS(O)2-, -S(O)2NRa-, -NRaS(O)2-, -OC(Z)O-, -OC(Z)Z-, -OP(O)(ORa)O-, -P(O)(ORa)O-, -C(NRa)-, -C(NORa)-, -N=C(Ra)-, -N=C(ORa)-, -N(ORa)-, -ON(Ra)-, -N(Ra)O-, -N(Ra)C(=NRb)NRc-, -C(=NRa)NRb- или -N(Ra)C(=NRb)-;
R21 является (С1-С10)алкил-гетероциклилом, (С1-С10)алкил-(С3-С12)циклической углеводородной группой, (С1-С10)алкилом, (С2-С10)олефиновой группой, (С3-С12)циклической углеводородной группой, гетероциклилом или (С2-С10)алкинилом; любой из которых необязательно замещен одним или более одинаковыми или разными заместителями, представленными R7;
Y2 является -O-, -S-, -C(O)O- или -C(O)NRa-;
R22 является (С1-С10)алкил-гетероциклилом, (С1-С10)алкил-(С3-С12)циклической углеводородной группой, гетероциклилом, (С2-С10)алкинилом, (С1-С10)алкилом, (С2-С10)олефиновой группой или (С3-С12)моноциклической углеводородной группой; где (С1-С10)алкил замещен одним или более, одинаковыми или разными заместителями, представленными R7 и где (С1-С10)алкил-гетероциклил, (С1-С10)алкил-(С3-С12)циклическая углеводородная группа, гетероциклил, (С2-С10)алкинил, (С2-С10)олефиновая группа и (С3-С12)моноциклическая углеводородная группа необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R7;
Y4 является -NRaC(O)NRbCH(Rc)-, -NRaC(O)NRbS(O)2-, -NRa-, -NRaC(Z)-, -NRaC(O)OCH(Rc)-, -NRaC(O)NRbC(Rd)(Re)-OC(O)- или -NRaC(O)OC(Rd)(Re)-OC(O)-;
R24 является (С1-С10)алкил-гетероциклилом, (С1-С10)алкил-(С3-С12)циклической углеводородной группой, гетероциклилом, (С2-С10)алкинилом, (С1-С10)алкилом, (С2-С10)олефиновой группой или (С3-С12)циклической углеводородной группой; где (С1-С10)алкил, (С2-С10)олефиновая группа и (С3-С12)циклическая углеводородная группа замещены одним или более, одинаковыми или разными заместителями, представленными R15 и где (С1-С10)алкил, (С2-С10)олефиновая группа, (С3-С12)циклическая углеводородная группа, (С1-С10)алкил-гетероциклил, (С1-С10)алкил-(С3-С12)циклическая углеводородная группа, гетероциклил и (С2-С10)алкинил необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R7;
R15 является R12a, R12b или R12c; где R12a, R12b и R12c необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R7;
R12a является (С1-С3)алкокси, (С1-С3)алкилтио, (С1-С6)алкиламино, (С1-С3)алкоксикарбонилом, -CONHR' или -CONRR', где R и R' являются (С1-С3)алкилом; любой из которых замещен одним или более, одинаковыми или разными заместителями, представленными R42; при условии, что если R12a или R15, включая их заместители R42, являются группами формул -(Q-O)n-Q или -CH2(Q-O)n-Q, где Q является (С1-С3)алкилом и n является целым числом больше 1, то указанные группы включают непрерывную линейную последовательность атомов, состоящую, по меньшей мере, из 16 атомов;
R12b является (С4-С10)алкокси, (С4-С10)алкилтио, (С7-С12)алкиламино, (С4-С10)алкоксикарбонилом, -CONHR' или -CONRR', где R и R' являются (С4-С10)алкилом; любая из которых замещена одним или более, одинаковыми или разными заместителями, представленными R7;
R12c является -Y5(С1-С10)алкилом, -Y-арилом, -Y-гетероциклилом, -Y-(С3-С12)циклической углеводородной группой и -Y-(С2-С10)олефиновой группой; любой из которых замещен одним или более, одинаковыми или разными заместителями, представленными R7;
Y5 является -S(O)-, -S(O)2-, -NRaC(Z)-, -NRaC(Z)NRb-, -C(S)NRa-, -C(O)-, -C(S)-, -C(S)O-, -C(O)S-, -C(S)S-, -OC(Z)-, -NRaC(Z)O-, -OC(Z)NRa-, -S(O)2O-, -OS(O)2-, -S(O)2NRa-, -NRaS(O)2-, -OC(Z)O-, -OC(Z)Z-, -OP(O)(ORa)O-, -P(O)(ORa)O-, -C(NRa)-, -C(NORa)-, -N=C(Ra)-, -N=C(ORa)-, -N(ORa)-, -ON(Ra)-, -N(Ra)O-, -N(Ra)C(=NRb)NRc-, -C(=NRa)NRb- или -N(Ra)C(=NRb)-;
R42 является -Y-H, -Y-R14, R52, галогеном, трифторметилом, циано, азидо или нитро; где R52 и -Y-R14 необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R8;
R52 является (С6-С10)алкилом, (С2-С6)олефиновой группой, (С3-С12)циклической углеводородной группой, гетероциклилом, (С2-С6)алкинилом или гетероарилом;
Ra, Rb и Rc независимо являются водородом, (С1-С6)алкилом, (С2-С6)олефиновой группой, (С3-С12)циклической углеводородной группой, арилом, гетероциклилом или (С2-С6)алкинилом; любой из которых замещен одним или более, одинаковыми или разными заместителями, представленными R12;
Rd и Re независимо являются водородом, (С1-С6)алкилом, (С2-С6)олефиновой группой и (С3-С12)циклической углеводородной группой; любой из которых замещен одним или более, одинаковыми или разными заместителями, представленными R12;
и их фармацевтически приемлемые соли, сольваты, например, их гидрат.
В другом аспекте, данное изобретение относится к фармацевтическим препаратам, содержащим соединение формулы I или его фармацевтически приемлемую соль, необязательно вместе с фармацевтически приемлемым наполнителем или носителем.
В еще одном аспекте данное изобретение относится к способу лечения воспалений у пациентов, который включает введение указанным пациентам эффективного количества соединения формулы I.
В еще одном аспекте данное изобретение относится к применению соединения формулы I, необязательно вместе с фармацевтически приемлемым наполнителем или носителем, в получении лекарственного средства для лечения воспаления.
Подробное описание изобретения
Хорошо известно и подтверждено на практике, что во многих, если не в большинстве, исследованиях лекарственных средств кандидаты, которые кажутся многообещающими в исследовании in vitro, не оказывают никакого терапевтического действия при тестировании in vivo. Этому явлению может быть несколько объяснений, например, быстрый метаболизм лекарственного средства или недостаточная стабильность плазмы, но очень часто причиной является недостаточная биодоступность. Биодоступность лекарственного средства контролируется несколькими факторами, широко известными как физико-химические характеристики. Физико-химическими характеристиками, являющимися основными для биодоступности, являются, например, растворимость в воде и log P, определяемый как log (растворимость в октане/растворимость в воде). Значение log P от 1 до 5 показывают оптимальную биодоступность для большинства лекарственных средств. Следовательно, любая программа получения лекарственного средства будет успешной, если определить одну или более групп в молекуле, которые можно заменить, не меняя при этом биологической активности, для того, чтобы изменить физико-химические характеристики и, таким образом, биодоступность. Авторы данного изобретения неожиданно обнаружили, что заместитель, представленный R6, может быть изменен, при этом в основном сохраняя биологическую активность соединений формулы I, для того, чтобы контролировать физико-химические характеристики указанных соединений.
Соответственно, предпочтительными соединениями в соответствии с данным изобретением являются те, в которых R1 является заместителем, выбранным из группы, включающей галоген, гидрокси, трифторметил, амино, (С1-С3)алкил, (С2-С3)олефиновую группу, (С1-С3)алкокси и циано.
В другом предпочтительном варианте R2 является одним или более заместителями, независимо выбранными из группы, включающей водород, галоген, гидрокси, трифторметил, (С1-С3)алкил, (С2-С3)олефиновую группу и (С1-С3)алкокси.
В другом предпочтительном варианте R3 является одним или более заместителями, независимо выбранными из группы, включающей водород, галоген, гидрокси, трифторметил, циано, нитро, (С1-С6)алкил, (С2-С6)олефиновую группу, (С3-С6)моноциклическую углеводородную группу, (С1-С6)алкокси и (С1-С6)алкоксикарбонил.
В другом предпочтительном варианте R4 является водородом, (С1-С6)алкилом или (С2-С6)олефиновой группой.
В другом предпочтительном варианте R5 является одним или более заместителями, независимо выбранными из группы, включающей водород и галоген, гидрокси, трифторметил, амино, (С1-С3)алкил, (С2-С3)олефиновую группу, (С1-С3)алкокси, (С1-С3)алкоксикарбонил и циано.
В другом предпочтительном варианте Х является О или N-ORc.
В другом предпочтительном варианте R6 является (С1-С6)алкил-гетероциклилом, (С1-С6)алкил-(С3-С9)циклической углеводородной группой, (С1-С6)алкилом, (С2-С6)олефиновой группой, (С3-С6)циклической углеводородной группой, гетероциклилом, (С2-С6)алкинилом, Y1R21, Y2R22 или Y4R24; где (С1-С6)алкил, (С2-С6)олефиновая группа и (С3-С6)циклическая углеводородная группа замещены одним или более одинаковыми или разными заместителями, представленными R7, и где (С1-С6)алкил-гетероциклил, (С1-С6)алкил-(С3-С9)циклическая углеводородная группа, гетероциклил и (С2-С6)алкинил необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R7;
R7 является R12, Y-H или Y-R14; где R12 и Y-R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R8;
R8 является R12, Y-H, Y-R14 или R14; где R12, Y-R14 и R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R9;
R9 является R12, Y-H, Y-R14 или R14; где R12, Y-R14 и R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R10;
R10 является R12 или R14; где R12, Y-R14 и R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R12;
R12 является галогеном, гидрокси, меркапто, трифторметилом, амино, (С1-С3)алкокси, (С1-С3)алкилтио, (С1-С6)алкиламино, (С1-С3)алкоксикарбонилом, (С1-С6)триалкиламмонием в сочетании с анионом, (С2-С6)диалкилфосфиноилом, (С1-С3)алкил(гидрокси)фосфиноилом, (С2-С6)диалкилфосфиноилокси, (С1-С3)алкил(гидрокси)фосфиноилокси, дигидроксифосфиноилом, дигидроксифосфиноилокси, циано, азидо, нитро, -СНО, -СООН, -CONH2, -CONHR' или -CONRR', где R и R' являются (С1-С3)алкилом;
Y является -O-, -S-, -S(O)-, -S(O)2-, -NRa-, -NRaC(Z)NRb-,
-NRaC(Z)-, -C(Z)NRa-, -C(O)-, -C(Z)O-, -OC(Z)-, -NRaC(Z)O-, -OC(Z)NRa-, -S(O)2O-, -OS(O)2-, -S(O)2NRa-, -NRaS(O)2-, -OC(Z)Z-, -OP(O)(ORa)O-, -P(O)(ORa)O-, -C(NORa)-, -N(ORa)-, -ON(Ra)-, -N(Ra)O-, -N(Ra)C(=NRb)NRc-, -C(=NRa)NRb- или -N(Ra)C(=NRb)-;
Z является кислородом;
R14 является (С1-С6)алкилом, (С2-С6)олефиновой группой, (С3-С9)циклической углеводородной группой, гетероциклилом или (С2-С6)алкинилом;
Y1 является -NRaC(S)NRb-, -C(O)-, -OC(O)-, -NRaC(S)O-, -OC(Z)NRa-, -S(O)2NRa-, -NRaS(O)2-, -OC(Z)O-, -C(NRa)-, -C(NORa)-, -N(ORa)-, -ON(Ra)-, -N(Ra)O-, -N(Ra)C(=NRb)NRc-, -C(=NRa)NRb- или -N(Ra)C(=NRb)-;
R21 является (С1-С6)алкил-гетероциклилом, (С1-С6)алкил-(С3-С9)циклической углеводородной группой, (С1-С6)алкилом, (С2-С6)олефиновой группой, (С3-С9)циклической углеводородной группой, гетероциклилом или (С2-С6)алкинилом; любой из которых необязательно замещен одним или более одинаковыми или разными заместителями, представленными R7;
Y2 является -O-, -S-, -C(O)O- или -C(O)NRa-;
R22 является (С1-С6)алкил-гетероциклилом, (С1-С6)алкил-(С3-С9)циклической углеводородной группой, гетероциклилом, (С2-С6)алкинилом, (С1-С6)алкилом, (С2-С6)олефиновой группой или (С3-С9)моноциклической углеводородной группой; где (С1-С6)алкил замещен одним или более, одинаковыми или разными заместителями, представленными R7, и где (С1-С6)алкил-гетероциклил, (С1-С6)алкил-(С3-С9)циклическая углеводородная группа, гетероциклил, (С2-С6)алкинил, (С2-С6)олефиновая группа и (С3-С9)моноциклическая углеводородная группа необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R7;
Y4 является -NRaC(O)NRbCH(Rc)-, -NRaC(O)NRbS(O)2-, -NRa-, -NRaC(Z)-, -NRaC(O)OCH(Rc)-, -NRaC(O)NRbC(Rd)(Re)-OC(O)- или -NRaC(O)OC(Rd)(Re)-OC(O)-;
R24 является (С1-С6)алкил-гетероциклилом, (С1-С6)алкил-(С3-С9)циклической углеводородной группой, гетероциклилом, (С2-С6)алкинилом, (С1-С6)алкилом, (С2-С6)олефиновой группой или (С3-С9)циклической углеводородной группой; где (С1-С6)алкил, (С2-С6)олефиновая группа и (С3-С9)циклическая углеводородная группа замещены одним или более, одинаковыми или разными заместителями, представленными R15, и где (С1-С6)алкил, (С2-С6)олефиновая группа, (С3-С9)циклическая углеводородная группа, (С1-С6)алкил-гетероциклил, (С1-С6)алкил-(С3-С9)циклическая углеводородная группа, гетероциклил и (С2-С6)алкинил, необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R7;
R15 является R12a, R12b или R12c; где R12a, R12b и R12c необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R7;
R12a является (С1-С3)алкокси, (С1-С3)алкилтио, (С1-С6)алкиламино, (С1-С3)алкоксикарбонилом, -CONHR' или -CONRR', где R и R' являются (С1-С3)алкилом; любой из которых замещен одним или более, одинаковыми или разными заместителями, представленными R42; при условии, что если R12a или R15, включая их заместители R42, являются группой формул -(Q-O)n-Q или -CH2(Q-O)n-Q, где Q является (С1-С3)алкилом и n является целым числом больше 1, то указанные группы включают непрерывную линейную последовательность атомов, состоящую, по крайней мере, из 16 атомов;
R12b является (С4-С6)алкокси, (С4-С6)алкилтио, (С7-С12)алкиламино, (С4-С8)алкоксикарбонилом, -CONHR' или -CONRR', где R и R' являются (С4-С8)алкилом; любой из которых замещен одним или более, одинаковыми или разными заместителями, представленными R7;
R12c является -Y5(С1-С6)алкилом, -Y-арилом, -Y-гетероциклилом, -Y-(С3-С9)циклической углеводородной группой и -Y-(С2-С6)олефиновой группой; любой из которых замещен одним или более, одинаковыми или разными заместителями, представленными R7;
Y5 является -S(O)-, -S(O)2-, -NRaC(Z)-, -NRaC(Z)NRb-, -C(O)-, -OC(Z)-, -NRaC(Z)O-, -OC(Z)NRa-, -S(O)2NRa-, -NRaS(O)2-, -OC(Z)O-, -OP(O)(ORa)O-, -P(O)(ORa)O-, -C(NRa)-, -C(NORa)-, -N(ORa)-, -ON(Ra)-, -N(Ra)O-, -N(Ra)C(=NRb)NRc-, -C(=NRa)NRb- или -N(Ra)C(=NRb)-;
R42 является -Y-H, -Y-R14, R52, галогеном, трифторметилом, циано, азидо или нитро; где R52 и -Y-R14 необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R8;
R52 является (С6-С8)алкилом, (С2-С4)олефиновой группой, (С3-С6)циклической углеводородной группой, гетероциклилом, (С2-С4)алкинилом или гетероарилом;
Ra, Rb и Rc независимо являются водородом, (С1-С4)алкилом, (С2-С4)олефиновой группой, (С3-С9)циклической углеводородной группой, арилом, гетероциклилом или (С2-С4)алкинилом; любой из которых замещен одним или более, одинаковыми или разными заместителями, представленными R12;
Rd и Re независимо являются водородом, (С1-С4)алкилом, (С2-С4)олефиновой группой и (С3-С9)циклической углеводородной группой; любой из которых замещен одним или более, одинаковыми или разными заместителями, представленными R12.
В еще одном предпочтительном варианте R1 является заместителем, выбранным из группы, включающей галоген, гидрокси, трифторметил, амино, (С1-С3)алкил, (С2-С3)олефиновую группу, (С1-С3)алкокси и циано;
R2 является одним или более заместителями, независимо выбранными из группы, включающей водород, галоген, гидрокси, трифторметил, (С1-С3)алкил, (С2-С3)олефиновую группу и (С1-С3)алкокси;
R3 является одним или более заместителями, независимо выбранными из группы, включающей водород, галоген, гидрокси, трифторметил, циано, нитро, (С1-С6)алкил, (С2-С6)олефиновую группу, (С3-С6) циклическую углеводородную группу, (С1-С6)алкокси и (С1-С6)алкоксикарбонил;
R4 является водородом, (С1-С6)алкилом или (С2-С6)олефиновой группой;
и R5 является одним или более заместителями, независимо выбранными из группы, включающей водород и галоген, гидрокси, трифторметил, амино, (С1-С3)алкил, (С2-С3)олефиновую группу, (С1-С3)алкокси, (С1-С3)алкоксикарбонил и циано.
В более предпочтительном варианте R1 является заместителем, выбранным из группы, включающей галоген, циано, метил и метокси.
В более предпочтительном варианте R2 является одним или более заместителями, независимо выбранными из группы, включающей водород, галоген, циано, метил и метокси.
В более предпочтительном варианте R3 является одним или более заместителями, независимо выбранными из группы, включающей водород, галоген, гидрокси, метил, метокси и циано.
В более предпочтительном варианте R4 является водородом, метилом или этилом.
В более предпочтительном варианте R5 является одним или более заместителями, независимо выбранными из группы, включающей водород, галоген, гидрокси, трифторметил, метил, этил и метокси.
В более предпочтительном варианте Х является О.
В более предпочтительном варианте R6 является (С1-С4)алкил-гетероциклилом, (С1-С4)алкил-(С3-С6)циклической углеводородной группой, (С1-С6)алкилом, (С2-С4)олефиновой группой, гетероциклилом, (С2-С4)алкинилом, Y1R21, Y2R22 или Y4R24; где (С1-С6)алкил и (С2-С4)олефиновая группа замещены одним или более одинаковыми или разными заместителями, представленными R7, и где (С1-С4)алкил-гетероциклил, (С1-С4)алкил-(С3-С6)циклическая углеводородная группа, гетероциклил и (С2-С4)алкинил необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R7;
R7 является R12, Y-H или Y-R14; где R12 и Y-R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R8;
R8 является R12, Y-H, Y-R14 или R14; где R12, Y-R14 и R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R9;
R9 является R12, Y-H, Y-R14 или R14; где R12, Y-R14 и R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R12;
R12 является галогеном, гидрокси, трифторметилом, амино, (С1-С3)алкокси, (С1-С3)алкилтио, (С1-С6)алкиламино, (С1-С3)алкоксикарбонилом, (С1-С6)триалкиламмонием в сочетании с анионом, (С2-С6)диалкилфосфиноилом, (С2-С6)диалкилфосфиноилокси, дигидроксифосфиноилом, дигидроксифосфиноилокси, циано, -СООН, -CONH2, -CONHR' или -CONRR', где R и R' являются (С1-С3)алкилом;
Y является -O-, -S-, -S(O)-, -S(O)2-, -NRa-, -NRaC(Z)NRb-,
-NRaC(Z)-, -C(Z)NRa-, -C(O)-, -C(Z)O-, -OC(Z)-, -NRaC(Z)O-, OC(Z)NRa-, -S(O)2O-, -OS(O)2-, -S(O)2NRa-, -NRaS(O)2-, -OC(Z)Z-, -N(Ra)C(=NRb)NRc-, -C(=NRa)NRb- или -N(Ra)C(=NRb)-;
Z является кислородом;
R14 является (С1-С4)алкилом, (С2-С4)олефиновой группой, (С3-С6)циклической углеводородной группой, гетероциклилом или (С2-С3)алкинилом;
Y1 является -NRaC(S)NRb-, -C(O)-, -OC(O)-, -NRaC(S)O-, -OC(Z)NRa-, -S(O)2NRa-, -NRaS(O)2- и -OC(Z)O-;
R21 является (С1-С4)алкил-гетероциклилом, (С1-С4)алкил-(С3-С6)циклической углеводородной группой, (С1-С6)алкилом, (С2-С4)олефиновой группой, (С3-С6)циклической углеводородной группой, гетероциклилом или (С2-С6)алкинилом; любой из которых необязательно замещен одним или более одинаковыми или разными заместителями, представленными R7;
Y2 является -O-, -S-, -C(O)O- или -C(O)NRa-;
R22 является (С1-С4)алкил-гетероциклилом, (С1-С4)алкил-(С3-С6)циклической углеводородной группой, гетероциклилом, (С2-С4)алкинилом, (С1-С6)алкилом, (С2-С4)олефиновой группой или (С3-С6)моноциклической углеводородной группой; где (С1-С6)алкил замещен одним или более, одинаковыми или разными заместителями, представленными R7, и где (С1-С4)алкил-гетероциклил, (С1-С4)алкил-(С3-С6)циклическая углеводородная группа, гетероциклил, (С2-С4)алкинил, (С2-С4)олефиновая группа и (С3-С6)моноциклическая углеводородная группа необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R7;
Y4 является -NRaC(O)NRbCH(Rc)-, -NRaC(O)NRbS(O)2-, -NRa-, -NRaC(Z)-, -NRaC(O)OCH(Rc)-, -NRaC(O)NRbC(Rd)(Re)-OC(O)- или -NRaC(O)OC(Rd)(Re)-OC(O)-;
R24 является (С1-С4)алкил-гетероциклилом, (С1-С4)алкил-(С3-С6)циклической углеводородной группой, гетероциклилом, (С2-С4)алкинилом, (С1-С6)алкилом, (С2-С4)олефиновой группой или (С3-С9)циклической углеводородной группой; где (С1-С6)алкил, (С2-С4)олефиновая группа и (С3-С9)циклическая углеводородная группа замещены одним или более, одинаковыми или разными заместителями, представленными R15, и где (С1-С6)алкил, (С2-С4)олефиновая группа, (С3-С9)циклическая углеводородная группа, (С1-С4)алкил-гетероциклил, (С1-С4)алкил-(С3-С6)циклическая углеводородная группа, гетероциклил и (С2-С4)алкинил необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R7;
R15 является R12a, R12b или R12c; где R12a, R12b и R12c необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R7;
R12a является (С1-С3)алкокси, (С1-С3)алкилтио, (С1-С6)алкиламино, (С1-С3)алкоксикарбонилом, -CONHR' или -CONRR', где R и R' являются (С1-С3)алкилом; любой из которых замещен одним или более, одинаковыми или разными заместителями, представленными R42; при условии, что если R12a или R15, включая их заместители R42, являются группой формул -(Q-O)n-Q или -CH2(Q-O)n-Q, где Q является (С1-С3)алкилом и n является целым числом больше 1, то указанные группы включают непрерывную линейную последовательность атомов, состоящую, по крайней мере, из 16 атомов;
R12b является (С4-С6)алкокси, (С4-С6)алкилтио, (С7-С12)алкиламино, (С4-С8)алкоксикарбонилом, -CONHR' или -CONRR', где R и R' являются (С4-С8)алкилом; любой из которых замещен одним или более, одинаковыми или разными заместителями, представленными R7;
R12c является -Y5(С1-С6)алкилом, -Y-арилом, -Y-гетероциклилом, -Y-(С3-С9)циклической углеводородной группой и -Y-(С2-С6)олефиновой группой; любой из которых замещен одним или более, одинаковыми или разными заместителями, представленными R7;
Y5 является -S(O)-, -S(O)2-, -NRaC(Z)-, -NRaC(Z)NRb-, -C(O)-, -OC(Z)-, -NRaC(Z)O-, -OC(Z)NRa-, -S(O)2NRa-, -NRaS(O)2- или -OC(Z)O-;
R42 является -Y-H, -Y-R14, R52, галогеном, трифторметилом, циано, азидо или нитро; где R52 и -Y-R14 необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R8;
R52 является (С6-С8)алкилом, (С2-С4)олефиновой группой, (С3-С6)циклической углеводородной группой, гетероциклилом, (С2-С4)алкинилом или гетероарилом;
Ra, Rb и Rc независимо являются водородом, (С1-С2)алкилом, (С2-С3)олефиновой группой или (С2-С3)алкинилом; любой из которых замещен одним или более, одинаковыми или разными заместителями, представленными R12;
Rd и Re независимо являются водородом или (С1-С2)алкилом.
В более предпочтительном варианте R1 является заместителем, выбранным из группы, включающей галоген, циано, метил и метокси;
R2 является одним или более заместителями, независимо выбранными из группы, включающей водород, галоген, циано, метил и метокси;
R3 является одним или более заместителями, независимо выбранными из группы, включающей водород, галоген, гидрокси, метил, метокси и циано;
R4 является водородом, метилом или этилом;
R5 является одним или более заместителями, независимо выбранными из группы, включающей водород, галоген, гидрокси, трифторметил, метил, этил и метокси;
Х является О.
В особенно предпочтительном варианте Х является О; R1 является метилом; R2 является 2-Cl; R3 является водородом или 4-Br и R4 и R5 являются водородом.
Биодоступность лекарственных средств обычно обратно пропорциональна молекулярному весу указанного лекарственного средства. Другими словами, это значит, что любая биологически активная структура имеет верхний предел веса, свыше которого она перестает быть активной из-за множества факторов, таких как недостаточная растворимость, неспособность проникать через мембраны, стерические препятствия взаимодействия лекарство-рецептор и т.д. Следовательно, в предпочтительном варианте данное изобретение относится к соединениям формулы I с молекулярным весом ниже 1500 Да или около 1500 Да, более предпочтительно, ниже 1200 Да или около 1200 Да, и даже более предпочтительно, ниже 800 Да или около 800 Да.
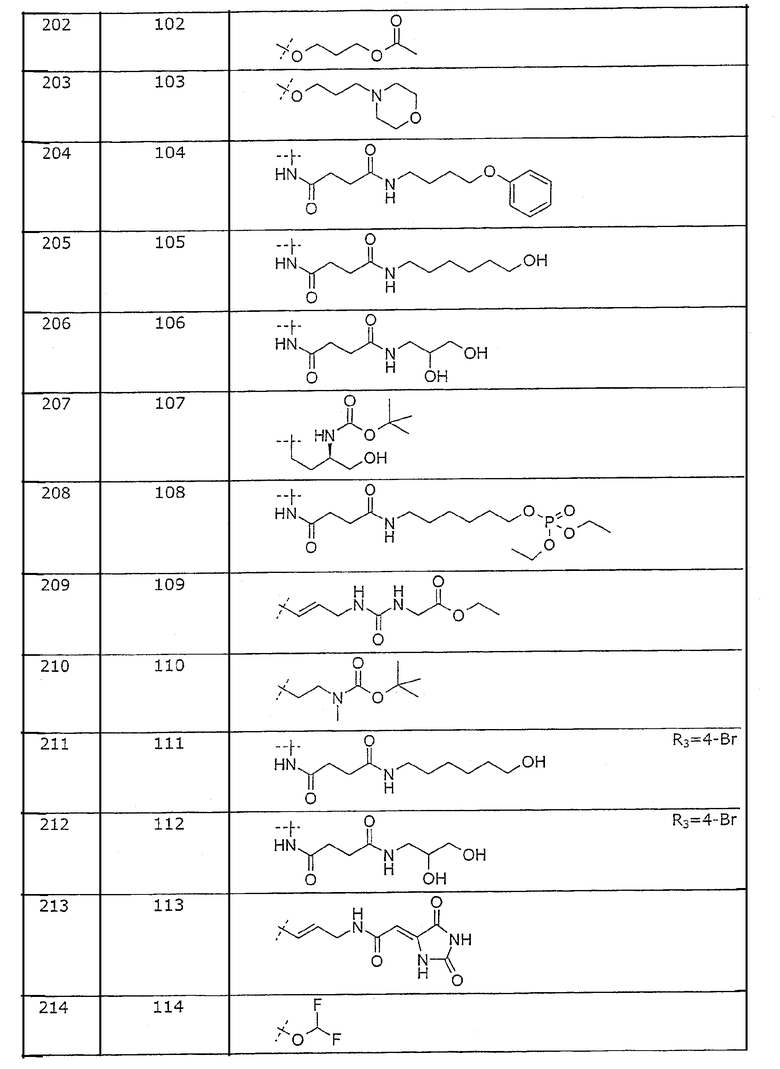
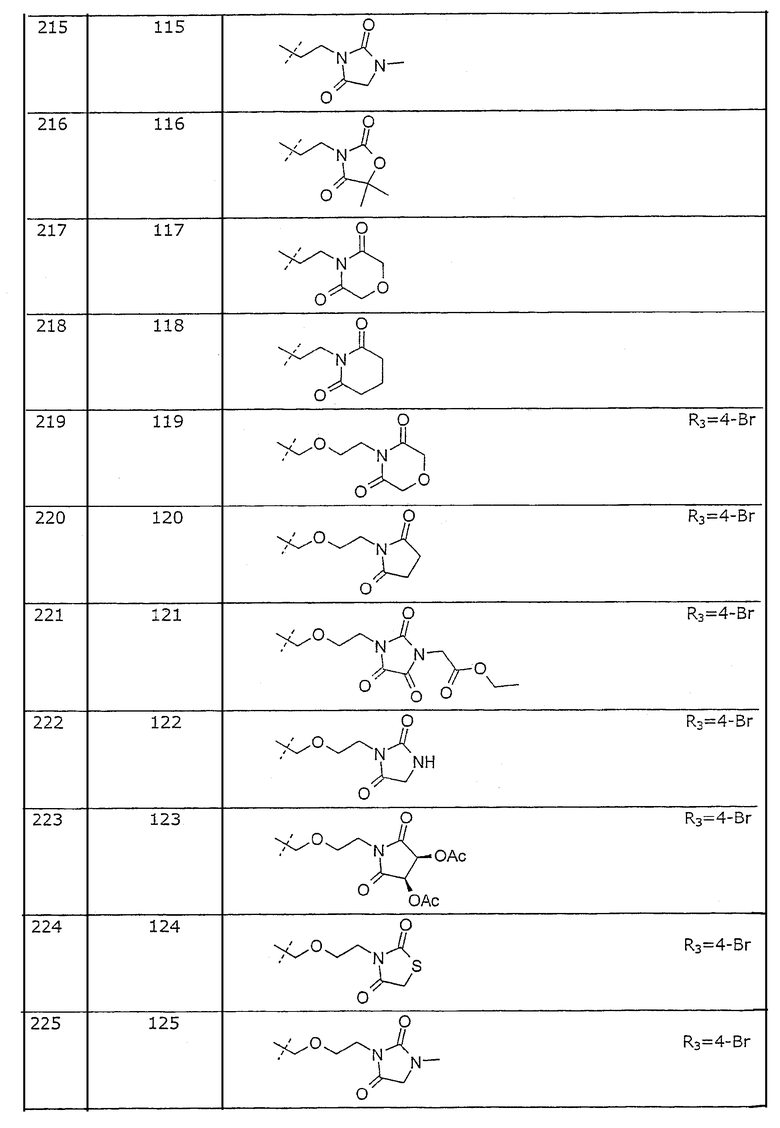
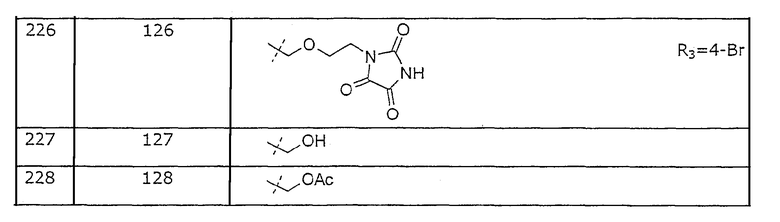
В еще более предпочтительном варианте, соединения формулы I выбирают из группы, включающей:
[2-Хлор-4-({2-[2-(тетрагидро-2Н-пиран-2-илокси)этил]фенил}амино)фенил](2-метилфенил)метанон;
(2-Хлор-4-{[2-(2-гидроксиэтил)фенил]амино}фенил)(2-метилфенил)метанон;
2-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}фенил)этил-ацетат;
4-(2-{2-[(3-Хлор-4-(2-метилбензоил)фенил)амино]фенил}-этокси)-4-оксобутановая кислота;
2-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}фенил)этил-гексаноат;
2-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}фенил)-1-метилэтилацетат;
(2-Хлор-4-{[2-(2-гидроксипропил)фенил]амино}фенил)-(2-метилфенил)метанон;
[2-Хлор-4-({2-[(1Е)-3-гидроксипроп-1-енил]фенил}амино)-фенил](2-метилфенил)метанон;
(2-Хлор-4-{[2-(3-гидроксипропил)фенил]амино}-фенил)(2-метилфенил)метанон;
[2-Хлор-4-({2-[(1Е)-4-гидроксибут-1-енил]фенил}амино)-фенил](2-метилфенил)метанон;
[4-({2-[(1Е)-3-аминопроп-1-енил]фенил}амино)-2-хлорфенил](2-метилфенил)метанон;
Диэтил (2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)проп-2-енилфосфонат;
[2-Хлор-4-({2-[(1Е)-3-гидрокси-3-метилбут-1-енил]фенил}-амино)фенил](2-метилфенил)метанон;
Этил (2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)акрилат;
(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-акриловая кислота;
{2-Хлор-4-[(2-{(1Е)-3-[(2,2-диметил-1,3-диоксолан-4-ил)-метокси]проп-1-енил}фенил)амино]фенил}(2-метилфенил)метанон;
[2-Хлор-4-({2-[(1Е)-3-(2,3-дигидроксипропокси)проп-1-енил]фенил}амино)фенил](2-метилфенил)метанон;
Трет-бутил (2R)-3-{[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)-фенил]амино}фенил)проп-2-енил]амино}-1-(гидроксиметил)-2-оксоэтилилкарбамат;
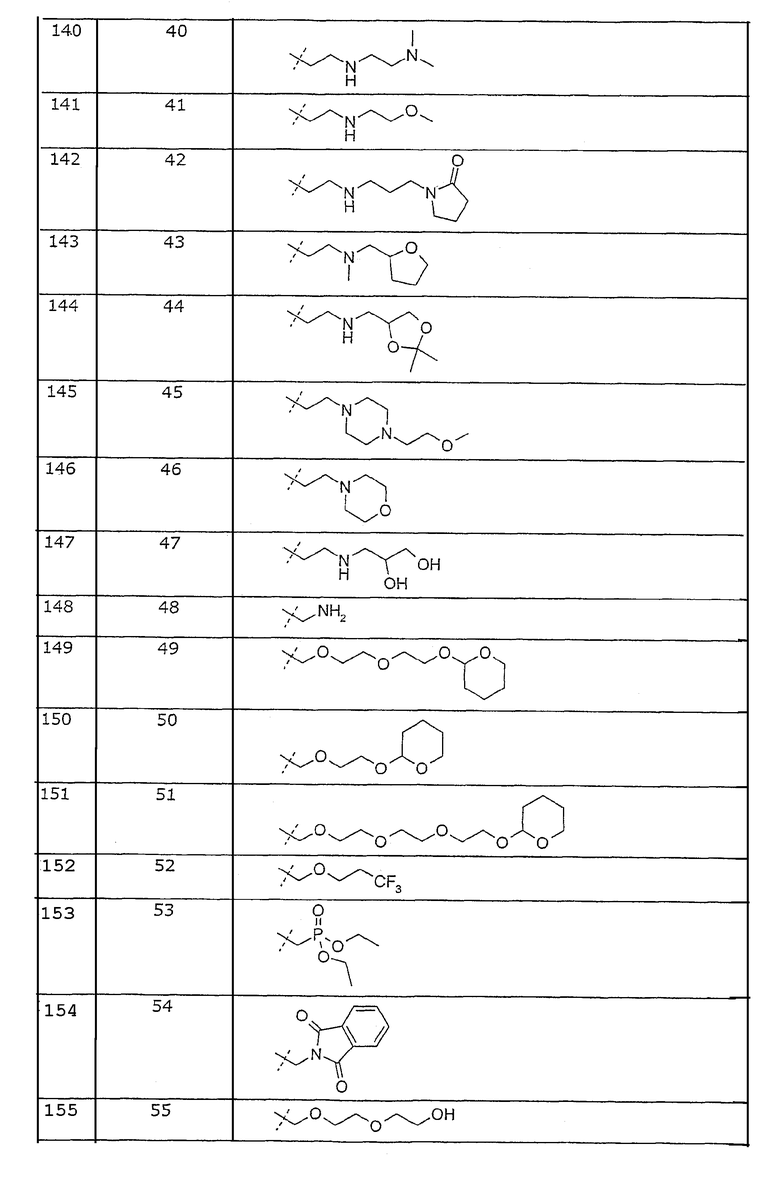
Метил О-(трет-бутил)-N-({[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)проп-2-енил]амино}карбонил)-L-серинат;
N-(трет-бутил)-N'-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)-фенил]амино}фенил)проп-2-енил]тиомочевина;
N-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)проп-2-енил]-4-оксопентанамид;
N-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)проп-2-енил]-N'-этилмочевина;
Этил 4-{[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)проп-2-енил]амино}-4-оксобутаноат;
N-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)проп-2-енил]-N'-циклогексилмочевина;
N'-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-
фенил)проп-2-енил]-N,N-диметилсукцинамид;
Диметил [(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]- амино}фенил)проп-2-енил]малонат;
[2-Хлор-4-({2-[(1Е)-3-морфолин-4-илпроп-1-енил]фенил}-амино)фенил](2-метилфенил)метанон;
6-О-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)проп-2-енил]-1,2:3,4-ди-О-(1-метилэтилиден)-a-D-галактопираноза;
Метил 5-О-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)проп-2-енил]-2,3-О-(1-метилэтилиден)-b-D-рибофуранозид;
Метил 5-О-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)проп-2-енил]-b-D-рибофуранозид;
Метил (4Е)-5-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)-2-(метилсульфонил)пент-4-еноат;
Этил {[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)проп-2-енил]тио}ацетат;
[2-Хлор-4-{[2-((1Е)-3-{бис[2-(ацетилокси)этил]амино}проп-1-енил)фенил]амино}фенил](2-метилфенил)метанон;
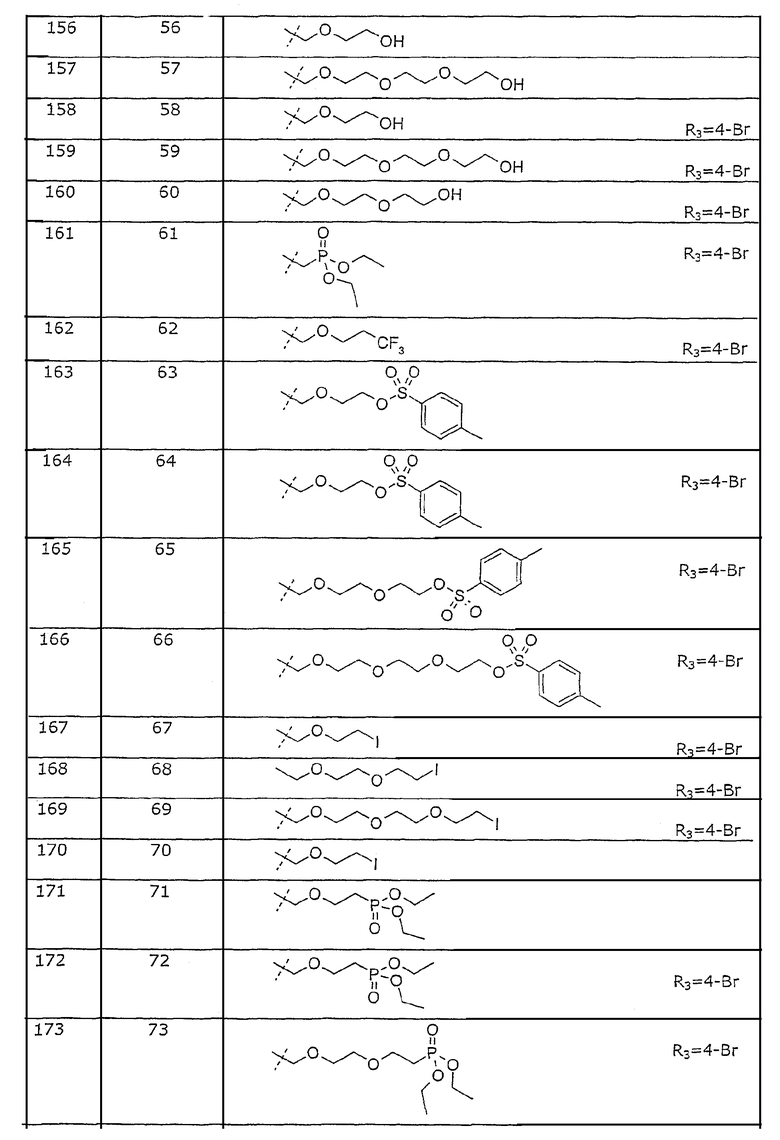
[2-Хлор-4-{[2-((1Е)-3-{бис[2-(гидрокси)этил]амино}проп-1-енил)фенил]амино}фенил](2-метилфенил)метанон;
(2-Хлор-4-{[2-((1Е)-3-{4-[2-(ацетилокси)этил]пиперидин-1-ил}проп-1-енил)фенил]амино}фенил)(2-метилфенил)метанон;
{2-Хлор-4-[(2-{(1Е)-3-[4-(2-гидроксиэтил)пиперидин-1-ил]-проп-1-енил}фенил)амино]фенил}(2-метилфенил)метанон;
{2-Хлор-4-[(2-{2-[(тетрагидрофуран-2-илметил)амино]этил}-фенил)амино]фенил}(2-метилфенил)метанон;
[2-Хлор-4-({2-[2-(4-метилпиперазин-1-ил)этил]фенил}амино)-фенил](2-метилфенил)метанон;
{2-Хлор-4-[(2-{2-[(3-морфолин-4-илпропил)амино]этил}фенил)-амино]фенил}(2-метилфенил)метанон;
(2-Хлор-4-{[2-(2-{[2-(диметиламино)этил]амино}этил)фенил]-амино}фенил)(2-метилфенил)метанон;
{2-Хлор-4-[(2-{2-[(2-метоксиэтил)амино]этил}фенил)амино]-фенил}(2-метилфенил)метанон;
1-[3-({2-[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)фенил]этил}амино)пропил]пирролидин-2-он;
{2-Хлор-4-[(2-{2-[метил(тетрагидрофуран-2-илметил)амино]-этил}фенил)амино]фенил}(2-метилфенил)метанон;
(2-Хлор-4-{[2-(2-{[(2,2-диметил-1,3-диоксолан-4-ил)метил]амино}этил)фенил]амино}фенил)(2-метилфенил)метанон;
{2-Хлор-4-[(2-{2-[4-(2-метоксиэтил)пиперазин-1-ил]этил}-фенил)амино]фенил}(2-метилфенил)метанон;
(2-Хлор-4-{[2-(2-морфолин-4-илэтил)фенил]амино}фенил)-(2-метилфенил)метанон;
{2-Хлор-4-[(2-{2-[(2,3-дигидроксипропил)амино]этил}фенил)-амино]фенил}(2-метилфенил)метанон;
(4-{[2-(Аминометил)фенил]амино}-2-хлорфенил)(2-метилфенил)-метанон;
(2-Хлор-4-{[2-({2-[2-(тетрагидро-2Н-пиран-2-илокси)этокси]-этокси}метил)фенил]амино}фенил)(2-метилфенил)метанон;
{2-Хлор-4-[(2-{[(тетрагидро-2Н-пиран-2-илокси)этокси]-
метил}фенил)амино]фенил}(2-метилфенил)метанон;
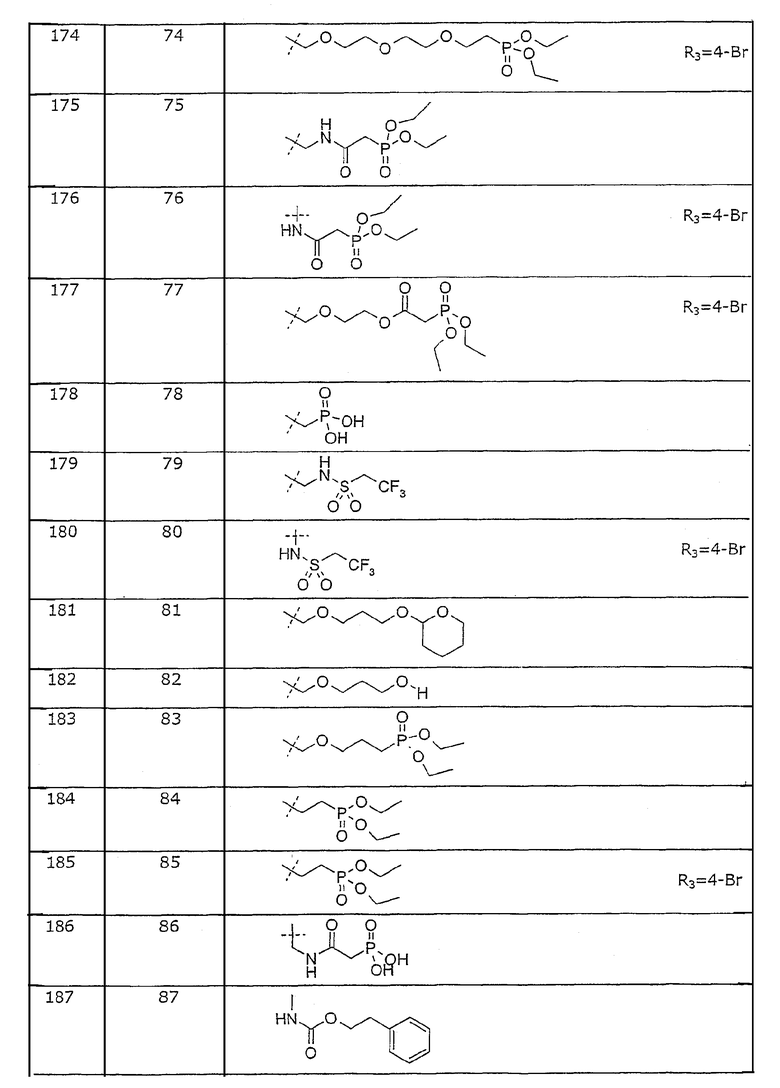
[2-Хлор-4-({2-[(2-{2-[2-(тетрагидро-2Н-пиран-2-илокси)-этокси]этокси}этокси)метил]фенил}амино)фенил](2-метилфенил)-метанон;
[2-Хлор-4-({2-[(3,3,3-трифторпропокси)метил]фенил}амино)-фенил](2-метилфенил)метанон;
Диэтил 2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензилфосфонат;
2-[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]-1Н-изоиндол-1,3(2Н)-дион;
{2-Хлор-4-[(2-{[2-(2-гидроксиэтокси)этокси]метил}фенил)-амино]фенил}(2-метилфенил)метанон;
[2-Хлор-4-({2-[(гидроксиэтокси)метил]фенил}амино)фенил]-(2-метилфенил)метанон;
(2-Хлор-4-{[2-({2-[2-(2-гидроксиэтокси)этокси]этокси}-метил)фенил]амино}фенил)(2-метилфенил)метанон;
[4-({4-Бром-2-[(2-гидроксиэтокси)метил]фенил}амино)-2-хлорфенил](2-метилфенил)метанон;
(4-{[4-Бром-2-({2-[2-(2-гидроксиэтокси)этокси]этокси}-метил)фенил]амино}-2-хлорфенил)(2-метилфенил)метанон;
{4-[(4-Бром-2-{[2-(2-гидроксиэтокси)этокси]метил}фенил)-амино]-2-хлорфенил}(2-метилфенил)метанон;
Диэтил 5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензилфосфонат;
[4-({4-Бром-2-[(3,3,3-трифторпропокси)метил]фенил}амино)-2-хлорфенил](2-метилфенил)метанон;
2-{[2-({3-Хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил-4-метилбензолсульфонат;
2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}этил-4-метилбензолсульфонат;
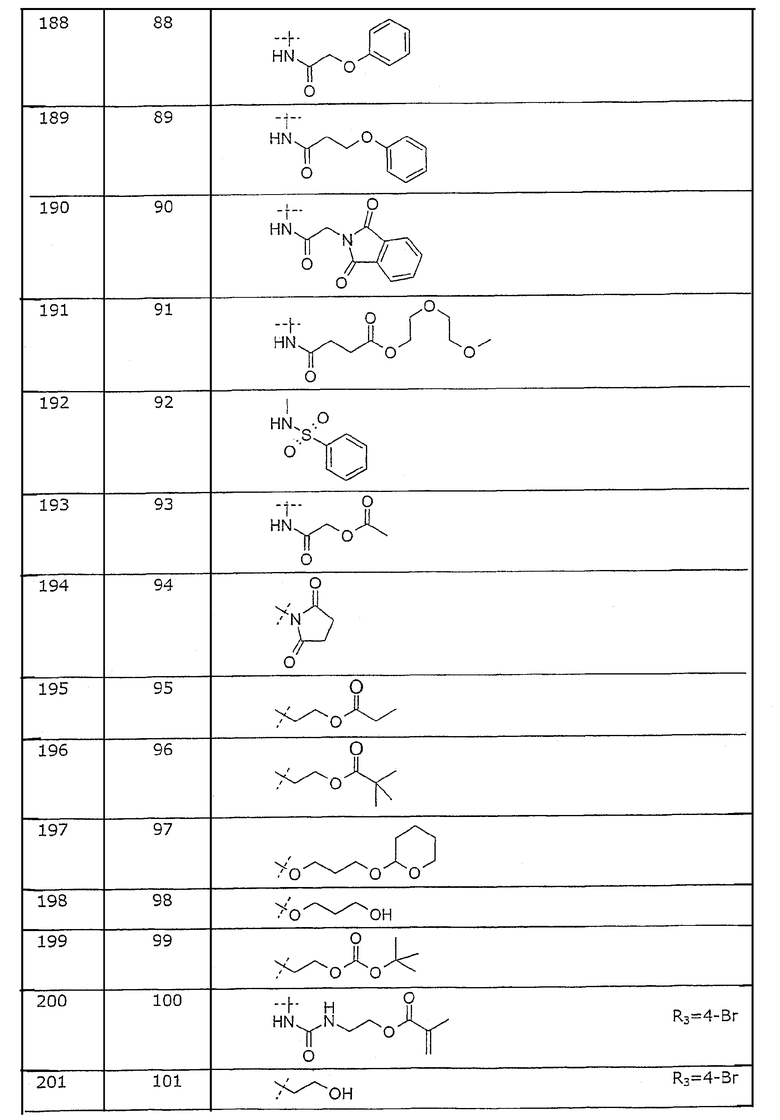
2-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}этокси)этил-4-метилбензолсульфонат;
2-[2-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]-фенил}амино)бензил]окси}этокси)этокси]этил-4-метилбензолсульфонат;
[4-({4-Бром-2-[(2-йодэтокси)метил]фенил}амино)-2-хлорфенил](2-метилфенил)метанон;
{4-[(4-Бром-2-{[2-(2-йодэтокси)этокси]метил}фенил)амино]-2-хлорфенил}(2-метилфенил)метанон;
(4-{[4-Бром-2-({2-[2-(2-йодэтокси)этокси]этокси}метил)-фенил]амино}-2-хлорфенил)(2-метилфенил)метанон;
[2-Хлор-4-({2-[(2-йодэтокси)метил]фенил}амино)фенил](2-метилфенил)метанон;
Диэтил 2-{[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}этилфосфонат;
Диэтил 2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]-фенил}амино)бензил]окси}этилфосфонат;
Диэтил 2-({[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]-фенил}амино)бензил]окси}этокси)этилфосфонат;
Диэтил 2-[2-(2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)-карбонил]фенил}амино)бензил]окси}этокси)этокси]этилфосфонат;
Диэтил 2-{[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]амино}-2-оксоэтилфосфонат;
Диэтил 2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]-фенил}амино)бензил]амино}-2-оксоэтилфосфонат;
{[2-({5-Бром-3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}этил(диэтоксифосфорил)ацетат;
2-({3-Хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензилфосфоновая кислота;
N-[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]-2,2,2-трифторэтансульфонамид;
N-[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)фенил]-2,2,2-трифторэтансульфонамид;
{2-Хлор-4-[(2-{[(тетрагидро-2Н-пиран-2-илокси)пропокси]-метил}фенил)амино]фенил}(2-метилфенил)метанон;
[2-Хлор-4-({2-[(гидроксипропокси)метил]фенил}амино)фенил]-(2-метилфенил)метанон;
Диэтил 3-{[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}пропилфосфонат;
Диэтил 2-[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}- амино)фенил]этилфосфонат;
Диэтил 2-[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]-фенил}амино)фенил]этилфосфонат;
2-{[2-({3-Хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]амино}-2-оксиэтилфосфоновая кислота;
Фенетиловый эфир (2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)карбаминовой кислоты;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-2-феноксиацетамид;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-3-феноксипропионамид;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетамид;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-сукцинамовой кислоты 2-(2-метоксиэтокси)этиловый эфир;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-бензолсульфонамид;
Уксусной кислоты (2-{[3-хлор-4-(2-метилбензоил)фенил]- амино}фенилкарбамоил)метиловый эфир;
1-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}фенил)-пирролидин-2,5-дион;
2-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}фенил)-этилпропионат;
2,2-Диметилпропионовой кислоты (2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)этиловый эфир;
[2-Хлор-4-({2-[3-(тетрагидро-2Н-пиран-2-илокси)пропокси]-фенил}амино)фенил](2-метилфенил)метанон;
{2-Хлор-4-{[2-(3-гидроксипропокси)фенил]амино}-фенил)(2-метилфенил)метанон;
трет-Бутил 2-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}-фенил)этилкарбонат;
2-({[(5-Бром-2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)амино]карбонил}амино)этил 2-метилакрилат;
(4-{[4-Бром-2-(2-гидроксиэтил)фенил]амино}(2-хлорфенил)(2-метилфенил)метанон;
3-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}фенокси)-пропилацетат;
[2-Хлор-4-({2-[3-(морфолин-4-ил)пропокси]фенил}амино)-фенил](2-метилфенил)метанон;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-(4-феноксибутил)сукцинамид;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-(6-гидроксигексил)сукцинамид;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-(2,3-дигидроксипропил)сукцинамид;
трет-Бутил (1R)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)-1-(гидроксиметил)пропилкарбамат;
Диэтил 6-[3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенилкарбамоил)пропиониламино]гексил фосфат;
Этил N-({[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)проп-2-енил]амино}карбонил)глицинат;
трет-Бутил 2-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)этил(метил)карбамат;
N-(5-Бром-2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-(6-гидроксигексил)сукцинамид;
N-(5-Бром-2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-(2,3-дигидроксипропил)сукцинамид;
(2Z)-N-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)проп-2-енил]-2-(2,5-диоксиимидазолидин-4-илиден)ацетамид;
(2-Хлор-4-{[2-(дифторметил)фенил]амино}фенил)-(2-метилфенил)метанон;
3-{[2-({3-Хлор-4-[(2-метилфенил)карбонил]фенил}амино)-фенил]этил}-1-метилимидазолидин-2,4-дион;
3-{[2-({3-Хлор-4-[(2-метилфенил)карбонил]фенил}амино)-фенил]этил}-5,5-диметилоксазолин-2,4-дион;
4-{[2-({3-Хлор-4-[(2-метилфенил)карбонил]фенил}амино)-фенил]этил}морфолин-3,5-дион;
1-{[2-({3-Хлор-4-[(2-метилфенил)карбонил]фенил}амино)-фенил]этил}пиперидин-2,6-дион;
4-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил)морфолин-3,5-дион;
1-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил)пирролидин-2,5-дион;
Этил 2-[3-(2-{5-Бром-[2-({3-хлор-4-[(2-метилфенил)-карбонил]фенил}амино)бензилокси}этил)-2,4,5-триоксоимидазолидин-1-ил]ацетат;
3-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил)имидазолин-2,4-дион;
1-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил)-3,4-цис-диацетоксипирролидин-2,5-дион;
3-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил) карбонил]фенил}амино)-бензил]окси}этил)тиазолин-2,4-дион;
3-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил) карбонил]фенил}амино)-бензил]окси}этил)-1-метилимидазолидин-2,4-дион;
1-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил) карбонил]фенил}амино)-бензил]окси}этил)имидазолидин-2,4,5-трион;
(2-Хлор-4-{[2-(гидроксиметил)фенил]амино}фенил)-(2-метилфенил)метанон;
2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}бензилацетат;
и их фармацевтически приемлемые соли и сольваты, например, их гидраты.
Соединения формулы I могут содержать двойные связи, кольцевые системы и асимметричные атомы углерода, которые позволяют получать изомерные формы. Понятно, что данное изобретение относится ко всем таким изомерным формам, представленным общей формулой I, в чистом виде или в виде смесей.
Термин «фармацевтически приемлемая соль» означает соль, полученную взаимодействием соединения формулы I с подходящей органической или неорганической кислотой, например, хлористоводородной, бромистоводородной, йодистоводородной, серной, азотной, уксусной, фосфорной, молочной, яблочной, фталевой, лимонной, пропионовой, бензойной, глутаровой, глюконовой, метансульфоновой, салициловой, янтарной, винной, толуолсульфоновой, сульфамовой или фумаровой кислотой. Фармацевтически приемлемые соли соединений формулы I также могут быть получены взаимодействием с подходящим основанием, таким как гидроксид натрия, гидроксид калия, аммиак и подобные.
Термин «сольват» относится к соединениям, полученным взаимодействием между соединением, например, соединением формулы I, и растворителем, например, спиртом, глицерином и водой, где указанные соединения находятся в твердой форме. Если растворителем является вода, указанные соединения называются гидратами.
Термин «непрерывная линейная последовательность атомов» означает ряд атомов, в котором нет ни одного атома водорода. Таким образом, диэтиловый эфир и ди-1-пропилкетон являются непрерывными линейными последовательностями атомов с 5 и 7 атомами, соответственно.
Термин «галоген» означает членов седьмой основной группы Периодической таблицы, т.е. фтор, хлор, бром и йод.
Термин «алкил» означает одновалентную группу, полученную из прямого или разветвленного алкана удалением атома водорода из любого атома углерода, и он включает подклассы первичных, вторичных и третичных алкильных групп, включая, например, (С1-С3)алкил, (С1-С10)алкил, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, деканил и т.д.
Термин «олефиновая группа» означает прямой или разветвленный ациклический углеводород, имеющий одну или более двойную связь углерод-углерод, при Е или Z стереохимии, если возможно. Термин включает, например, (С2-С10)олефиновую группу, (С2-С3)олефиновую группу, винил, аллил, 1-бутенил, 2-бутенил и 2-метил-2-пропенил, 2,4-пентендиенил и т.д.
Термин «алкокси» означает радикал формулы -OR, где R является алкилом, таким как определен выше, например, (С1-С10)алкокси, (С1-С3)алкокси, метокси, этокси, н-пропокси, трет-бутокси и т.д.
Термин «алкилтио» означает радикал формулы -SR, где R является алкилом, таким как определен выше, например, (С1-С10)алкилтио, (С1-С3)алкилтио, метилтио, этилтио, н-пропилтио, 2-пропилтио и т.д.
Термин «алкиламино» означает радикал формулы -NHR или -NR2, где R является алкилом, таким как определен выше, и включает, например, метиламино, диметиламино, ди-(н-пропил)амино, н-бутил(этил)амино и т.д.
Термин «алкоксикарбонил» означает радикал формулы -COOR, где R является алкилом, таким как определен выше, и включает метоксикарбонил, этоксикарбонил, н-пропоксикарбонил, изо-пропоксикарбонил и т.д.
Термин «циклическая углеводородная группа» включает насыщенные и ненасыщенные, необязательно сконденсированные бициклические углеводородные кольца, такие как (С3-С12)циклоалкил, циклопропил, циклопентил, циклогексил и циклооктил, (С3-С12)циклоалкеновую группу, такую как циклопроп-2-енил, циклобут-2-енил, циклопент-2-енил, циклогекс-3-енил, циклоокта-4-енил, циклогекс-3,5-диенил, инданил, инденил, 1,4-дигидронафтил, фенил и нафтил. Термин «циклическая углеводородная группа» также включает соединения, такие как определены выше, в которых один или более -СН2- фрагментов кольца замещены -С(О)- фрагментом и/или экзо-циклической двойной связью углерод-углерод, такие как оксоциклогексил, оксоциклопентил, 4-оксо-1,2,3,4-тетрагидронафталин-1-ил, 1-оксо-1,2,3,4-тетрагидронафталин-1-ил, 2-оксоциклогекс-3-ен-1-ил и 2-оксоциклогекс-1-ен-1-ил, и
Термин «алкинил» включает одновалентную группу, полученную из прямого или разветвленного алкина удалением атома водорода из любого атома углерода, и включает подклассы первичных, вторичных и третичных алкильных групп, соответственно, и имеет определенное количество атомов углерода, например, (С1-С10)алкинил, этинил, пропинил, 1,1-диметил-3-бутинил, и т.д.
Термин «гетероциклил» включает насыщенные или ненасыщенные, необязательно сконденсированные карбоциклические кольца, содержащие один или более гетероатомов, выбранных из группы, включающей О, N и S, такие как пирролил, фуранил, тиофенил, имидазолил, оксазолил, тиазолил, пиразолил, пирролидинил, пиридинил, пиримидинил, тетрагидротиофенил, тетрагидрофуранил, тетрагидропиранил, пиперидинил, путинил, хинолинил, изохинолинил, 1,2-дигидрохинолинил и т.д. Термин «гетероциклил» также включает соединения, такие как определены выше, в которых один или более -СН2- фрагментов кольца замещены -С(О)-фрагментом и/или экзо-циклической двойной связью углерод-углерод, такие как диоксопиперинидил, 1-оксо-3,4-дигидроизохинолин-2(1Н)-ил и
Соединения в соответствии с данным изобретением полезны в медицине и ветеринарии в качестве системных или местных терапевтических агентов для профилактики, лечения и/или уменьшения тяжести заболевания, симптомов заболевания и/или периодичности рецидивов заболеваний, связанных с дисфункцией противовоспалительной или регулирующей цитокины системах. Эти заболевания или состояния включают акне, астму, аллергию, артрит, включая ревматоидный артрит и спондилоартрит, подагру, атеросклероз, хроническое воспалительное заболевание кишечника (болезнь Крона), пролиферативные и воспалительные заболевания кожи, такие как псориаз, атопический дерматит, увеит, септический шок, СПИД и остеопороз.
В другом аспекте, данное изобретение относится к фармацевтическим композициям соединения формулы I. Композиции в соответствии с данным изобретением, как для ветеринарии, так и для медицины, включают активные ингредиенты, необязательно в сочетании с фармацевтически приемлемыми носителями, и, необязательно, другие терапевтические ингредиенты. Носители могут быть «приемлемыми» с точки зрения совместимости с другими ингредиентами композиции и безопасности по отношению к пациенту.
Обычно, активный ингредиент составляет 0,1-100 мас.% композиции. Соответственно, стандартная лекарственная форма содержит от 0,07 мг до 1 г соединения формулы I.
Под термином «стандартная (дозированная) лекарственная форма» понимают унифицированную, т.е. разовую дозу, которая может быть введена пациенту и которая может быть легко получена и упакована, оставаясь физически и химически устойчивой стандартной лекарственной формой, содержащей либо активный материал как таковой, либо его смесь с твердым или жидким фармацевтическим разбавителем или носителем.
Композиции включают, например, формы, подходящие для перорального (включая замедленное или отсроченное, регулируемое выделение), ректального, парентерального (включая подкожное, внутрибрюшинное, внутримышечное, внутрисуставное и внутривенное), чрескожное, глазное, местное, назальное или буккальное введение.
Композиции могут быть представлены в стандартных лекарственных формах и могут быть получены любыми методами, хорошо известными в области фармацевтики, например, как описано у Remington, The Science and Practice of Pharmacy, 20th ed., 2000. Все методы включают стадию соединения активного ингредиента с носителем, который состоит из одного или более вспомогательных ингредиентов. В общем, композиции получают с помощью однородного и тщательного соединения активного ингредиента с жидким носителем или тонкоизмельченным твердым носителем или с обоими и затем, при необходимости, формования желаемой композиции.
Композиции в соответствии с данным изобретением, подходящие для перорального применения, могут быть в виде дискретных (отдельных) единиц, таких как капсулы, саше, таблетки или пастилки, где каждая содержит предварительно определенное количество активного ингредиента; в виде порошков или гранул; в виде растворов или суспензий в водных жидкостях или не водных жидкостях, таких как этанол или глицерин; или в виде эмульсии «масло в воде» или эмульсии «вода в масле». Такими маслами могут быть пищевые масла, такие как, например, хлопковое масло, конопляное масло, кокосовое масло, арахисовое масло. Подходящие диспергирующие или суспендирующие агенты для водных суспензий включают синтетические или природные смолы, такие как трагакант, альгинат, акация, декстран, натрий карбоксиметилцеллюлоза, желатин, метилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, карбомеры и поливинилпирролидон. Активные ингредиенты также могут вводиться в виде болюсов, электуара или пасты.
Таблетки могут быть получены прессованием или формованием активного ингредиента необязательно с одним или более вспомогательными ингредиентами. Прессованные таблетки могут быть получены прессованием в подходящей машине активного ингредиента(ов) в свободнотекучей форме, такой как порошки или гранулы, необязательно смешанного со связующим агентом, таким как лактоза, глюкоза, крахмал, желатин, аравийская камедь, трагакант, альгинат натрия, карбоксиметилцеллюлоза, метилцеллюлоза, гидроксипропилметилцеллюлоза, полиэтиленгликоль, воски или подобные; смазывающим агентом, таким как, например, олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетата натрия, хлорид натрия и подобные; разрыхлителем, таким как, например, крахмал, метилцеллюлоза, агар, бентонит, натрий кроскармеллоза, натрий гликолят крахмала, кросповидон или подобные, или диспергирующим агентом, таким как полисорбат 80. Формованные таблетки могут быть получены формованием в подходящей машине смеси порошкообразного активного ингредиента и подходящего носителя, увлажненного инертным жидким разбавителем.
Композиции для ректального введения могут быть в виде суппозиториев, в которых соединение в соответствии с данным изобретением смешано с растворимыми или нерастворимыми в воде твердыми веществами с низкой температурой плавления, такими как кокосовое масло, гидрированные растительные масла, полиэтиленгликоль или сложные эфиры жирных кислот полиэтиленгликолей, а эликсиры могут быть получены с применением миристил пальмитата.
Композиции, подходящие для парентерального введения, содержат стерильные масляные или водные препараты активного ингредиента, которые предпочтительно являются изотоническими в крови пациента, например, изотонический физиологический раствор, изотонический раствор глюкозы или буферный раствор. Композиции могут быть соответствующим образом стерилизованы, например, фильтрацией через улавливающий бактерии фильтр, добавлением стерилизующего агента к композиции, облучением композиции или нагреванием композиции. Липосомные композиции, такие как описаны в Encyclopedia of Pharmaceutical Technology, том 9, 1994, также подходят для парентерального введения.
Альтернативно, соединение формулы I может быть представлено в виде стерильной твердой лекарственной формы, например, высушенного вымораживанием порошка, который легко растворяется в стерильном растворителе непосредственно перед применением.
Чрескожные композиции могут быть в виде пластырей или пэтчей (наклеек).
Композиции, подходящие для глазного введения, могут быть в виде стерильной водной лекарственной формы активного ингредиента, который может быть в микрокристаллической форме, например, в виде формы водной микрокристаллической суспензии. Липосомные композиции или биоразлагаемые полимерные системы, например, такие как описаны в Encyclopedia of Pharmaceutical Technology, том 2, 1989, также могут применяться для глазного введения активного ингредиента.
Композиции, подходящие для местного введения, включают жидкие или полужидкие композиции, такие как мази, лосьоны, гели, аппликанты, эмульсии «масло в воде» или «вода в масле», такие как кремы, мази или пасты; или растворы или суспензии, такие как капли.
Композиции, подходящие для назального или буккального введения, включают порошки, самодиспергирующиеся и распыляемые композиции, такие как аэрозоли и распылители.
Пролекарства в соответствии с данным изобретением также могут вводиться с помощью моноклональных антител в качестве индивидуальных носителей, к которым присоединены молекулы соединения.
В добавление к указанным выше ингредиентам, композиции соединения формулы I могут включать один или более дополнительных ингредиентов, таких как разбавители, буферы, вкусовые добавки, красители, поверхностно-активные вещества, загустители, консерванты, например, метилгидроксибензоат (включая антиоксиданты), эмульгирующие агенты и подобные.
При системном лечении с помощью данного изобретения вводят ежедневную дозу от 0,001 до 500 мг на килограмм массы тела, предпочтительно от 0,002 до 100 мг/кг массы тела млекопитающего, например, 0,003-20 мг/кг соединения формулы I, что обычно соответствует ежедневной дозе для взрослого человека 0,01-37000 мг. При местном лечении дерматологических расстройств, наносят мази, кремы или лосьоны, содержащие от 0,1 до 750 мг/г, предпочтительно от 0,1 до 500 мг/г, например, 0,1-200 мг/г соединения формулы I. Для местного введения вносят офтальмологические мази, капли или гели, содержащие 0,1-750 мг/г, предпочтительно 0,1-500 мг/г, например, 0,1-200 мг/г соединения формулы I. Пероральные композиции получают в виде таблеток, капсул или капель, содержащих от 0,07-1000 мг, предпочтительно 0,1-500 мг соединения формулы I на стандартную лекарственную форму.
Данное изобретение также включает введение других фармацевтически активных ингредиентов, обычно применяемых при лечении болезненных состояний, указанных выше, в композиции в соответствии с данным изобретением. Без ограничений, такие другие фармацевтические активные ингредиенты включают глюкокортикоиды, аналоги витамина D, антигистамины, антагонисты фактора активации тромбоцитов (ФАТ), антихолергенные агенты, метилксантины, b-адренергические агенты, ингибиторы СОХ-2, салицилаты, индометацин, флуфенамат, напроксен, тимегадин, соли золота, пеницилламин, агенты, снижающие уровень холестерина в сыворотке, ретиноиды, соли цинка и салицилазосульфапиридин.
Авторы данного изобретения также обнаружили, что определенный ряд соединений хорошо подходит для получения композиций соединений формулы I. Следовательно, данное изобретение представляет соединения, выбранные из группы, включающей:
2-(2-бромфенил)-1-метилэтилацетат (соединение 402);
(3Е)-2-метил-4-(трибутилстаннил)бут-3-ен-2-ол (соединение 403);
Трибутил{((1Е)-3-[(2,2-диметил-1,3-диоксолан-4-ил)метокси]проп-1-енил}станнан (соединение 404);
Диметил [(2Е)-3-(трибутилстаннил)проп-1-енил]малонат (соединение 405);
4-[(2Е)-3-(трибутилстаннил)проп-2-енил]морфолин (соединение 406);
1,2:3,4-ди-О-(1-метилэтилиден)-6-О-[(2Е)-3-(трибутилстаннил)проп-2-енил]-a-D-галактопиранозу (соединение 407);
Метил 2,3-О-(1-метилэтилиден)-5-О-[(2Е)-3-(трибутилстаннил)проп-2-енил]-a-D-рибофуранозид (соединение 408);
Метил (4Е)-2-(метилсульфонил)-5-(трибутилстаннил)пент-4-еноат (соединение 409);
Этил {[(2Е)-3-(трибутилстаннил)проп-2-енил]тио}ацетат (соединение 410);
Трибутил {(1Е)-3-[бис(2-гидроксиэтил)амино]проп-1-енил}станнан (соединение 411);
Трибутил ((1Е)-3-{бис[2-(ацетилокси)этил]амино}проп-1-енил)станнан (соединение 412);
Трибутил {(1Е)-3-[4-(2-гидроксиэтил)пиперидин-1-ил]проп-1-енил}станнан (соединение 413);
Трибутил ((1Е)-3-{4-[2-(ацетилокси)этил]пиперидин-1-ил}проп-1-енил)станнан (соединение 414);
2-(2-{(2-бромбензил)окси}этокси)этанол (соединение 415);
2-(2-{2-[(2-бромбензил)окси]этокси}этокси)этанол (соединение 416);
2-бромбензил 3,3,3-трифторпропиловый эфир (соединение 419);
2-(2-{2-[(2-бромбензил)окси]этокси}этокси)тетрагидро-2Н-пиран (соединение 420);
2-[2-(2-{2-[(2-бромбензил)окси]этокси}этокси)этокси]- тетрагидро-2Н-пиран (соединение 421);
2-{2-[(2-бромбензил)окси]этокси}тетрагидро-2Н-пиран (соединение 422);
2-{3-[(2-бромбензил)окси]пропокси}тетрагидро-2Н-пиран (соединение 425);
3-[(2-бромбензил)окси]пропил 4-метилбензолсульфонат (соединение 426);
1-бром-2-(3-йодпропоксиметил)бензол (соединение 427);
Диэтил 3-[(2-бромбензил)окси]пропилфосфонат (соединение 428);
Диэтил 2-(2-бромфенил)этилфосфонат (соединение 431);
(2-хлор-4-йодфенил)(2-метилфенил)метанон (соединение 432);
трет-бутил (4R)-4-[2-(2-аминофенил)этил]-2,2-диметил-1,3-оксазолидин-3-карбоксилат (соединение 433);
трет-бутил (4R)-4-[2-(2-{[3-хлор-4-(2-метилбензоил)фенил]- амино}фенил)этил]-2,2-диметилоксазолидин-3-карбоксилат (соединение 434);
трет-бутил [2-(2-бромфенил)этил](метил)карбамат (соединение 435);
3-[2-(2-бромфенил)этил]-1-метилимидазолидин-2,4-дион (соединение 436);
3-[2-(2-бромфенил)этил]-5,5-диметилоксазолидин-2,4-дион (соединение 437);
4-[2-(2-бромфенил)этил]морфолин-3,5-дион (соединение 438);
1-[2-(2-бромфенил)этил]пиперидин-2,6-дион (соединение 439);
2-бромбензил (триизопропил)силиловый эфир (соединение 440);
{2-хлор-4-[(2-{[(триизопропил)силокси]метил}фенил)амино]- фенил}(2-метилфенил)метанон (соединение 441).
Способы получения
Соединения в соответствии с данным изобретением могут быть получены множеством методов, хорошо известных специалистам в области органической химии. Соединения в соответствии с данным изобретением могут быть синтезированы с помощью описанных ниже методов, а также методами, известными в области органической химии, или их вариациями, понятными специалистам в данной области техники. Предпочтительные методы включают, но не ограничены ими, описанные ниже.
Соединения формулы I могут быть получены с применением реакций и методов, описанных в данном разделе. Реакции проводят в растворителях, которые подходят для применяемых реагентов и материалов и которые подходят для проводимых превращений. Также, в отношении описанных ниже методов синтеза должно быть понятно, что все предложенные условия реакций, включая выбор растворителя, атмосферы реакции, температуры реакции, продолжительности эксперимента и методик обработки, являются стандартными условиями для данного вида реакций, которые должны быть легко узнаваемы специалистом в данной области техники. Специалисту в области органической химии должно быть понятно, что функциональность, присутствующая в разных частях выбранной молекулы, должна быть совместима с реагентами и предложенными реакциями. Не все соединения формулы I, попадающие в данный класс, могут быть совместимы с некоторыми условиями реакций, требуемыми в некоторых описанных методах. Такие ограничения заместителей, которые совместимы с условиями реакций, легко понятны специалистам в данной области техники, которые могут применять альтернативные методы.
Соединения в соответствии с данным изобретением могут быть получены способом, включающим сочетание амина формулы III с бромидом, йодидом, фторидом, хлоридом или трифлатом формулы II, как показано на схеме 1, или альтернативно, способом, включающим сочетание амина формулы IIa с, например, йодидом формулы IIIa, как показано на схеме 1, где R1, R2, R3, R4, R5, R6 и Х такие, как определены выше, за исключением того, что заместители или функциональные группы, которые потенциально реакционноспособны в реакции сочетания, могут быть защищены перед проведением реакции сочетания и далее удалены.
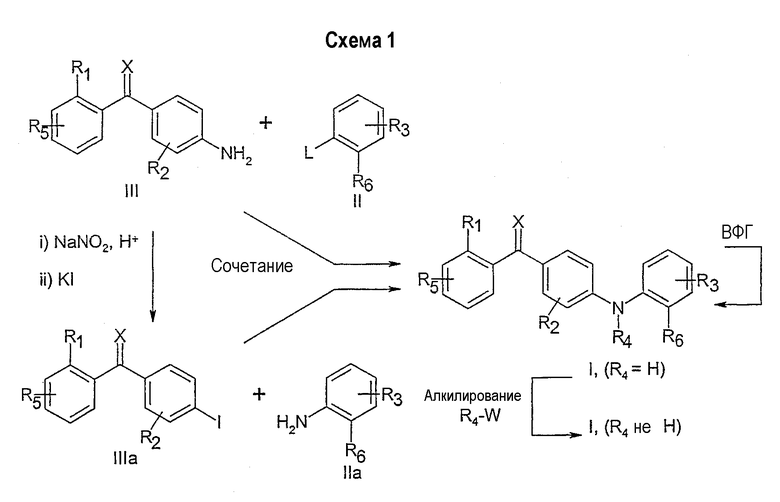
L: BR, I, OSO2CF3 или F и Cl (в особых случаях)
W: Cl, Br, I, OSO2CF3 или OTs
ВФГ: взаимопревращение функциональных групп
Реакцию сочетания проводят с применением любых методов получения дифениламинов, известных специалисту в области органической химии. Предпочтительным методом является катализируемое палладием аминирование, которое включает сочетание амина с арилгалогенидом (или арилтрифлатом) в присутствии основания, подходящего источника Pd и подходящего фосфинового лиганда в инертном растворителе. В способе могут применяться различные соединения палладия, не ограничивающими примерами которых являются ацетат палладия(II), хлорид палладия(II), бромид палладия(II), дихлорбис(трифенилфосфин)палладий(II), тетракис(трифенилфосфин)палладий(0), трис(дибензилиденацетон)дипалладий(0). Предпочтительные фосфиновые лиганды включают, но не ограничены ими, рацемические или не рацемические 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (далее обозначенный как BINAP), три-о-толилфосфин, три-трет-бутилфосфин, 1,1'-бис(дифенилфосфино)ферроцен, бис[(2-дифенилфосфино)фенил]эфир (DPEphos), 2-дициклогексилфосфанил-2'-диметиламинобифенил, 2-(ди-трет-бутилфосфино)бифенил и 9,9-диметил-4,6-бис(дифенилфосфино)ксантен (Xantphos). Количество палладия и лиганда, применяемое в данном способе, обычно составляет от 0,1 до 10% моль по отношению к применяемому количеству ароматического галогенида (или трифлата). Особенно предпочтительными основаниями для данного способа оказались трет-бутоксид натрия (NaOt-Bu) и карбонат цезия (Cs2CO3), но также могут применяться другие основания.
Реакцию обычно проводят при повышенных температурах (80-120°С) в инертном растворителе, таком как 1,4-диоксан, толуол, бензол и тетрагидрофуран в инертной атмосфере, например, аргона или азота.
Соединения в соответствии с данным изобретением, в которых R4 не является водородом, могут быть получены способом, включающим сочетание амина формулы I (R4=Н) с алкилирующим агентом, как показано на схеме 1, где R1, R2, R3, R5, R6 и Х такие, как определены в общей формуле I, за исключением того, что любые заместители или функциональные группы, которые потенциально реакционноспособны в реакции сочетания, могут быть защищены перед проведением реакции сочетания и далее удалены. Обычно алкилирующие агенты для общей формулы R4-W включают, но не ограничены ими, йодиды (W=I), бромиды (W=Br), хлориды (W=Cl) и сульфонаты (L=OSO2R', где R' является метилом, трифторметилом или 4-метилфенилом).
Соединения в соответствии с данным изобретением в особых случаях могут быть получены простым взаимопревращением функциональных групп (ВФГ), что означает стандартный способ, известный специалистам в области органической химии, где функциональная группа в соединениях общей формулы I превращается в другую функциональную группу в одну или более синтетических стадий, что дает новое соединение общей формулы I. Примеры таких способов включают, но не ограничены ими, гидролиз сложного эфира с получением кислоты в щелочных условиях, снятие защиты с метилового эфира с получением фенола обработкой, например, трибромидом бора (BBr3), и каталитическое гидрирование олефина с получением насыщенного углеводорода.
Соединения в соответствии с данным изобретением общей формулы I, в которых Х=S, могут быть получены из кетона (общей формулы I, Х=О) методом, таким как ВФГ с применением многих тиокарбонилирующих реагентов, известных специалистам в области органического синтеза. Примеры таких тиокарбонилирующих реагентов включают, но не ограничиваются ими, пентасульфид фосфора (P4S10), реагент Лавессона (2,4-бис(4-метоксифенил)-1,3,2,4-дитиафосфетан-2,4-дисульфид) и подобные.
Соединения в соответствии с данным изобретением общей формулы I, в которых Х=N-ORc могут быть получены из кетона (общей формулы I, Х=О) обработкой H2N-ORc или его защищенным производным с последующим снятием защиты, в подходящем растворителе, таком как, например, пиридин или метанол.
Соединения в соответствии с данным изобретением формулы III могут быть получены несколькими методами, известными специалистам в области органического синтеза. Одна из применяемых реакций показана на схеме 2. Ключевая стадия включает сочетание бромида (или йодида) общей формулы VI с хлоридом кислоты общей формулы V с получением бензофенона общей формулы IV. Это соединение IV может быть восстановлено до соответствующего амина общей формулы III обработкой стандартными восстанавливающими агентами. Примеры таких восстанавливающих агентов включают, но не ограничены ими, дигидрат хлорида двухвалентного олова; водород, формиат аммония или гидразингидрат и каталитическое количество палладия на угле. Реакцию сочетания проводят превращением бромида (VI) в реакционноспособное металлорганическое промежуточное соединение, например, обработкой бутиллитием с получением производного лития, или обработкой магнием с получением производного магния.
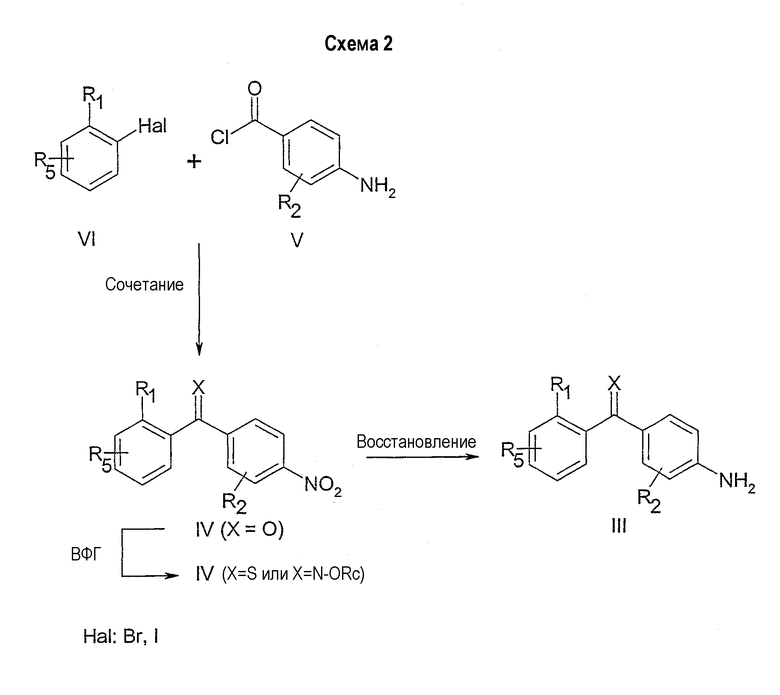
Реакционноспособность данного промежуточного соединения затем изменяют переметаллированием, например, на цинк обработкой ZnCl2, ZnBr2 или ZnI2. Данное цинкорганическое соединение затем сочетают с хлоридом кислоты общей формулы V в присутствии каталитического количества палладиевого(0) комплекса. Примеры таких катализаторов включают, но не ограничены ими, тетракис(трифенилфосфин)палладий(0), тетракис(трифениларсин)палладий(0), дихлорбис(трифенилфосфин)палладий(II) или бензилхлорбис(трифенилфосфин)палладий(II).
Как показано на схеме 2, соединения общей формулы IV (Х=О) могут быть превращены методом ВФГ с получением соединений общей формулы IV (Х=S или Х=N-ORc), как описано выше. Данный пример только иллюстрирует гибкость синтеза и в общем, описываемая последовательность процессов является только одной из множества возможных стратегий синтеза соединений в соответствии с данным изобретением. То есть в некоторых случаях может быть более предпочтительным изменять последовательность процессов, описанную выше. Описанная последовательность процессов не должна считаться ограничивающей для способов получения соединений в соответствии с данным изобретением общей формулы I, и изменение последовательности реакций может быть очевидной альтернативой для специалиста в области органического синтеза.
Указанный аспект данного изобретения может быть особенно подходящим для синтеза соединений с различными заместителями на R6 группе. Легкодоступные промежуточные соединения могут служить исходными соединениями для синтеза различных видов соединений, охватываемых общей формулой I. Примеры таких соединений показаны на схемах 3 и 4 с примерами синтеза соединений (Ia-Ie), охватываемых общей формулой I. Легкодоступные промежуточные соединения, например, VIIa, VIIb и VIId сами могут попадать под определение формулы I.
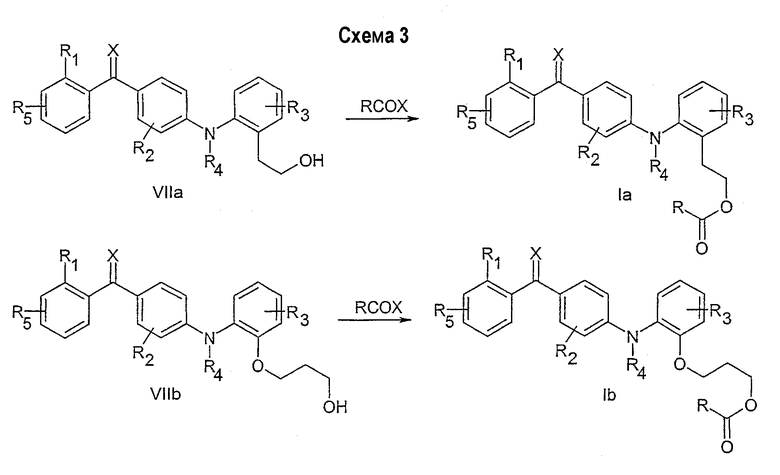
Соединения со свободной гидроксигруппой (общая формула VIIa, VIIb) могут сочетаться с карбоновой кислотой (R-COOH) или ее активированным производным методом, известным специалистам в области органического синтеза, с получением сложного эфира общей формулы Ia и Ib.
Соединения со свободной аминогруппой (общая формула VIIc, VIId) могут сочетаться с карбоновой кислотой (R-COOH) или ее активированным производным методом, хорошо известным специалистам в области органического синтеза, с получением амида общей формулы Ic и Id.
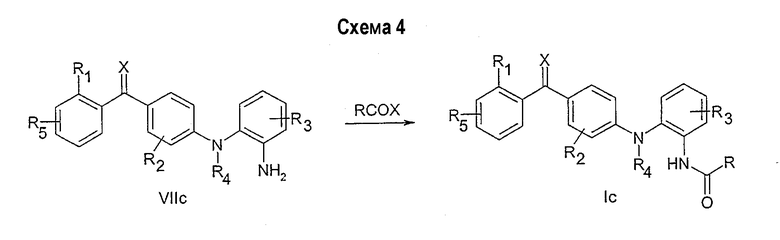
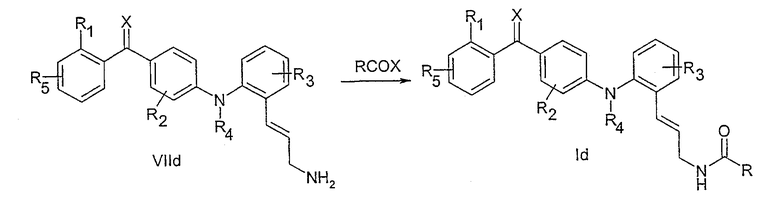
Соединения со свободной группой карбоновой кислоты (общая формула VIIе) могут сочетаться с амином (R-NH2), как описано выше методом, хорошо известным специалистам в области органического синтеза, с получением амида общей формулы Iе.
Подходящим реакционноспособным производным карбоновой кислоты является, например, ацилхлорид, смешанный ангидрид или активный сложный эфир. Реакции обычно проводят в инертном растворителе, таком как диэтиловый эфир, тетрагидрофуран или дихлорметан, в присутствии подходящего основания, такого как триэтиламин, карбонат калия или пиридин.
Необходимые исходные соединения, такие как соединения общих формул II, IIa, R-NH2 и R-COOH могут быть получены методами, известными в литературе, или стандартными методами органической химии. Получение таких исходных материалов описано в соответствующих примерах получения.
Общие методики, примеры получения и примеры
Представленные в примерах соединения перечислены в таблице 1.
Все температуры плавления не скорректированы. Для 1Н спектра ядерного магнитного резонанса (ЯМР) (300 МГц) и 13С ЯМР (75,6 МГц) значения химических сдвигов (d) (в м.д.) даны, если не указано иначе, для раствора в дейтериохлороформе, соответствующих внутреннему стандарту тетраметилсилана (d=0,00) или хлороформа (d=7,25) или дейтериохлороформа (d=76,81 для 13С ЯМР). Значение мультиплета, либо определенного (дублет (д), триплет (т), квартет (кв)) либо нет (м), даны для приблизительной средней точки, если не указан промежуток. Применяемые органические растворители являются безводными. Хроматографию проводят на колонке с силикагелем с применением флэш-методики.
Применяются следующие аббревиатуры:
ВОС - трет-бутоксикарбонил
дба - дибензилиденацетон
ДХМ -дихлорметан
ДМФ - N,N-диметилформамид
DMTMM - хлорид 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния
МС - масс - спектроскопия
NMM - N-метилморфолин
ЯМР - ядерный магнитный резонанс
рац-BINAP - рацемический 2,2'-бис(дифенилфосфино)-1,1'-бинафтил
КТ - комнатная температура
ТФК - трифторуксусная кислота
ТГФ - тетрагидрофуран
ТГП - тетрагидропиран
Нумерация в таблице 1 означает нумерацию в представленной ниже формуле
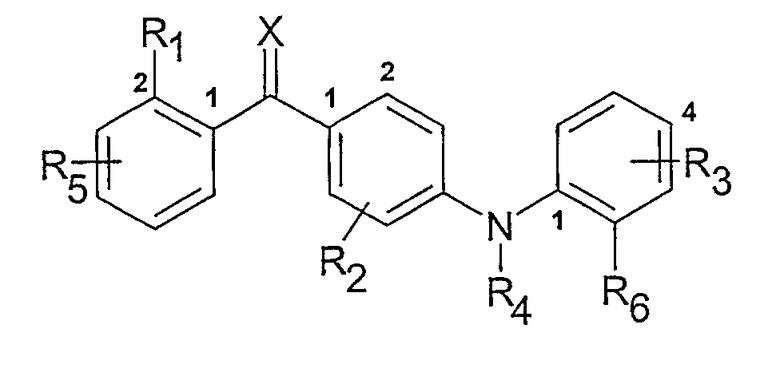
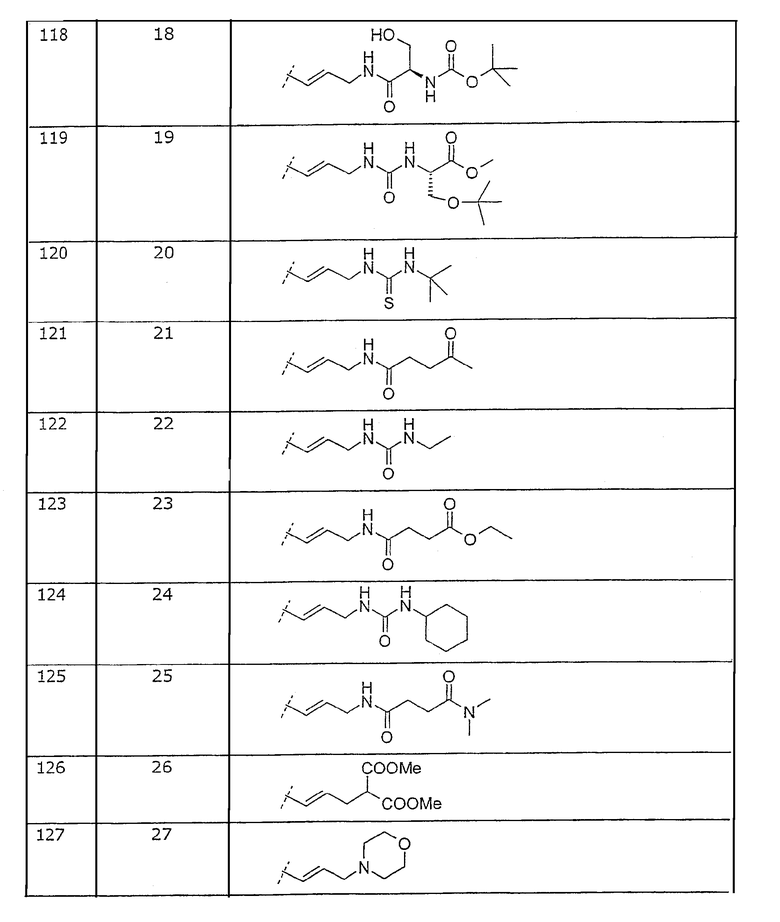
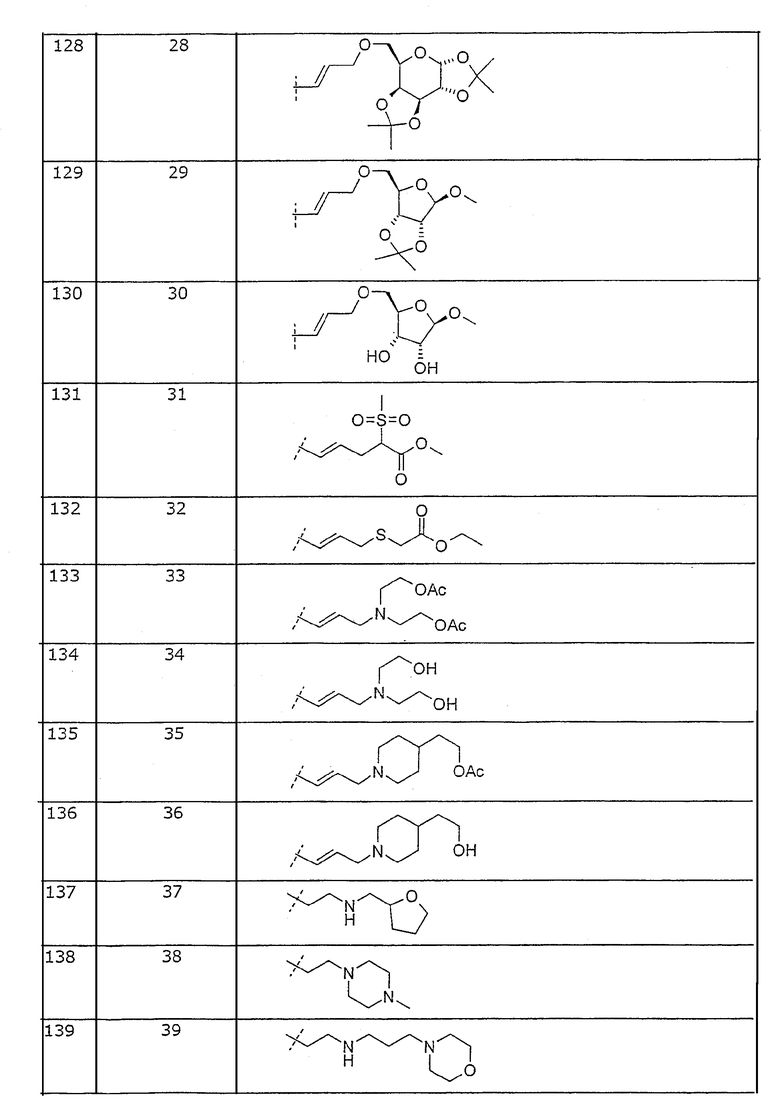
Таблица 1. Представленные в примерах соединения общей формулы I (Х=О; R1=метил; R2=2-Cl; R3, R4 и R5=Н, если не указано иначе).

Пример получения 1
2-[2-(2-бромфенил)этокси]тетрагидро-2Н-пиран (соединение 401)
Раствор 2-бромфенетилового спирта (9,88 г), 3,4-дигидро-2Н-пирана (4,45 мл) и 4-толуолсульфокислоты (0,20 г) в ТГФ (20 мл) перемешивают в течение 2 часов при температуре 50°С и затем при комнатной температуре в течение ночи. Реакционную смесь выливают в смесь лед-вода и EtOAc. Водную фазу экстрагируют EtOAc (х2). Объединенные органические фазы промывают насыщенным NaHCO3, солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают хроматографией, элюируя петролейным эфиром/Et2O 4:1 с получением указанного в заголовке соединения в виде бесцветного масла.
Пример получения 2
2-(2-бромфенил)-1-метилэтилацетат (соединение 402)
Ангидрид уксусной кислоты (1,2 мл) добавляют к раствору 1-(2-бромфенил)-2-пропанола (529 мг) в пиридине (1,0 мл) при температуре 20°С при перемешивании. Реакционную смесь перемешивают в течение ночи, затем выливают в смесь воды и EtOAc. Водную фазу экстрагируют EtOAc (х2). Объединенные органические фазы промывают водой (х3), сушат (MgSO4), фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения в виде сиропа.
Пример получения 3
(3Е)-2-метил-4-(трибутилстаннил)бут-3-ен-2-ол (соединение 403)
Смесь 2-метилбут-3-ин-2-ол (2,00 г), гидрида трибутилолова (10,5 г) и aa'-азобисизобутиронитрила (190 мг) нагревают (чистым) до температуры 80°С при перемешивании. Через 4 часа реакционную смесь охлаждают до комнатной температуры. Неочищенный продукт очищают хроматографией, элюируя петролейным эфиром/Et2O 7:1 с получением указанного в заголовке соединения в виде жидкости.
Пример получения 4
Трибутил {(1Е)-3-[(2,2-диметил-1,3-диоксолан-4-ил)метокси]проп-1-енил}станнан (соединение 404)
Гидрид натрия (215 мг) добавляют к раствору (2,2-диметил-1,3-диоксолан-4-ил)метанола (644 мг) в сухом ДМФ (25 мл) при температуре 0°С. Через 10 минут к реакционной смеси добавляют [(1Е)-3-бромпроп-1-енил](трибутил)станнан (1,00 г). Реакционную смесь перемешивают в течение 20 ч при температуре 20°С и затем гасят насыщенным NH4Cl (водн.). Экстрагирование EtOAc и сушка (Na2SO4) органической фазы дает, после концентрирования в вакууме, неочищенный продукт. Очистку проводят хроматографией, элюируя петролейным эфиром/EtOAc 10:1 с получением указанного в заголовке соединения в виде жидкости.
Пример получения 5
Диметил [(2Е)-3-(трибутилстаннил)проп-1-енил]малонат
(соединение 405)
Гидрид натрия (75 мг) добавляют к раствору диметилмалоната (387 мг) в сухом ДМФ (5 мл) при температуре 0°С. Через 10 минут к реакционной смеси добавляют [(1Е)-3-бромпроп-1-енил](трибутил)станнан (600 мг). Реакционную смесь перемешивают в течение 3 ч при температуре 20°С и затем гасят насыщенным NH4Cl (водн.). Экстрагирование EtOAc и сушка (MgSO4) органической фазы дает, после концентрирования в вакууме, неочищенный продукт. Очистку проводят хроматографией, элюируя петролейным эфиром/Et2O 12:1 с получением указанного в заголовке соединения в виде жидкости.
Пример получения 6
4-[(2Е)-3-(трибутилстаннил)проп-2-енил]морфолин (соединение 406)
Раствор морфолина (637 мг) и [(1Е)-3-бромпроп-1-енил](трибутил)станнана (1,00 г) в сухом ДМФ (8,0 мл) перемешивают в течение 24 ч при температуре 20°С. Реакционную смесь гасят насыщенным NH4Cl (водн.). Экстрагирование Et2O и сушка (MgSO4) органической фазы дает, после концентрирования в вакууме, неочищенный продукт. Очистку проводят хроматографией, элюируя петролейным эфиром/EtOAc 10:1 с получением указанного в заголовке соединения в виде жидкости.
Пример получения 7
1,2:3,4-ди-О-(1-метилэтилиден)-6-О-[(2Е)-3-(трибутилстаннил)проп-2-енил]-a-D-галактопиранозу
(соединение 407)
Гидрид натрия (62 мг) добавляют к раствору 1,2:3,4-ди-О-(1-метилэтилиден)-a-D-галактопиранозы (635 мг) в сухом ТГФ (8 мл) при температуре 0°С. Через 10 минут к реакционной смеси добавляют [(1Е)-3-бромпроп-1-енил](трибутил)станнан (500 мг). Реакционную смесь перемешивают в течение 20 ч при температуре 20°С и затем гасят насыщенным NaHCO3 (водн.). Экстрагирование Et2O и сушка (Na2SO4) органической фазы дает, после концентрирования в вакууме, неочищенный продукт. Очистку проводят хроматографией, элюируя петролейным эфиром/Et2O 9:1 с получением указанного в заголовке соединения в виде жидкости.
Пример получения 8
Метил 2,3-О-(1-метилэтилиден)-5-О-[(2Е)-3-(трибутилстаннил)проп-2-енил]-a-D-рибофуранозид (соединение 408)
Реакцию проводят по методике примера получения соединения 407, применяя 2,3-О-(1-метилэтилиден)-b-D-рибофуранозу (598 мг) в качестве спирта. Очистку проводят флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 30:1 с получением указанного в заголовке соединения в виде жидкости.
Пример получения 9
Метил (4Е)-2-(метилсульфонил)-5-(трибутилстаннил)пент-4-еноат (соединение 409)
Реакцию проводят по методике примера получения соединения 407, применяя метил (метилсульфонил)ацетат (446 мг) в качестве нуклеофильного компонента. Очистку проводят флэш-хроматографией, элюируя смесью петролейного эфира/Et2O 5:1 с получением указанного в заголовке соединения в виде жидкости.
Пример получения 10
Этил {[(2Е)-3-(трибутилстаннил)проп-2-енил]тио}ацетат (соединение 410)
Реакцию проводят по методике примера получения соединения 407, применяя этил меркаптоацетат (550 мг) в качестве нуклеофильного компонента. Очистку проводят флэш-хроматографией, элюируя смесью петролейного эфира/Et2O 100:1 с получением указанного в заголовке соединения в виде жидкости.
Пример получения 11
Трибутил {(1Е)-3-[бис(2-гидроксиэтил)амино]проп-1-енил}станнан (соединение 411)
N-Этил-N,N-диизопропиламин (315 мг) добавляют к раствору диэтаноламина (256 мг) в сухом ДМФ (5 мл) при температуре 0°С. Через 10 минут к реакционной смеси добавляют [(1Е)-3-бромпроп-1-енил](трибутил)станнан (600 мг). Реакционную смесь перемешивают в течение 15 ч при температуре 20°С и затем гасят насыщенным NH3Cl (водн.). Экстрагирование Et2O и сушка (MgSO4) органической фазы дает, после концентрирования в вакууме, неочищенный продукт. Очистку проводят хроматографией, элюируя Et2O/МеОН 100:4 с получением указанного в заголовке соединения в виде жидкости.
Пример получения 12
Трибутил ((1Е)-3-{бис[2-(ацетилокси)этил]амино}проп-1-енил)станнан (соединение 412)
Реакцию проводят по методике примера получения соединения 402, применяя соединение 411 (575 мг) в качестве спирта. Очистку проводят флэш-хроматографией, элюируя смесью петролейного эфира/Et2O 4:1 с получением указанного в заголовке соединения.
Пример получения 13
Трибутил {(1Е)-3-[4-(2-гидроксиэтил)пиперидин-1-ил]проп-1-енил}станнан (соединение 413)
Реакцию проводят по методике примера получения соединения 411, применяя соединение 2-пиперидин-4-илэтанол (504 мг) в качестве амина. Очистку проводят флэш-хроматографией, элюируя смесью Et2O/МеОН 92:8 с получением указанного в заголовке соединения.
Пример получения 14
Трибутил ((1Е)-3-{4-[2-(ацетилокси)этил]пиперидин-1-ил}проп-1-енил)станнан (соединение 414)
Реакцию проводят по методике примера получения соединения 402, применяя соединение 413 (510 мг) в качестве спирта. Очистку проводят флэш-хроматографией, элюируя смесью петролейного эфира/Et2O 1:2 с получением указанного в заголовке соединения в виде жидкости.
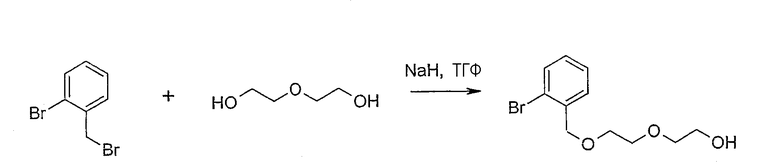
Пример получения 15
2-(2-{(2-бромбензил)окси}этокси)этанол (соединение 415)
NaH (0,53 г, 60% в масле, 13 ммоль) суспендируют в сухом ТГФ (80 мл) в сухой пробирке Шленка в атмосфере аргона. Медленно добавляют диэтиленгликоль (11,4 мл, 120 ммоль) при перемешивании. Суспензию перемешивают при КТ в течение 30 минут. Добавляют 2-бромбензилбромид (5,0 г, 20 ммоль), растворенный в 5 мл сухого ТГФ, с последующим добавлением йодида тетрабутиламмония (74 мг, 0,2 ммоль). Реакционную смесь нагревают при кипении с обратным холодильником в течение 18 часов, после чего добавляют Н2О (50 мл). Водную фазу экстрагируют дважды EtOAc, и объединенные органические фазы промывают водой и солевым раствором, сушат (MgSO4), фильтруют и выпаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией, элюируя ДХМ/ацетоном 3:1. Это дает указанное в заголовке соединение в виде желтого масла.
Пример получения 16
2-(2-{2-[(2-бромбензил)окси]этокси}этокси)этанол
(соединение 416)
Реакцию проводят по методике примера получения соединения 415, применяя триэтиленгликоль (16,0 мл, 120 ммоль) вместо диэтиленгликоля. Неочищенный продукт очищают флэш-хроматографией с применением ДХМ/ацетона 6:1-3:1 в качестве элюента с получением указанного в заголовке соединения в виде бледно-желтого масла.
Пример получения 17
2-((2-бромбензил)окси)этанол (соединение 417)
Реакцию проводят по методике примера получения соединения 415. Исходными материалами являются NaH (60% в масле, 1,8 г, 44 ммоль) в ТГФ (160 мл), этиленгликоль (13,4 мл, 240 ммоль), 2-бромбензилбромид (10 г, 40 ммоль), растворенный в 5 мл сухого ТГФ, и йодид тетрабутиламмония (0,15 г, 0,4 ммоль). Неочищенный продукт очищают флэш-хроматографией с применением ДХМ/ацетона 30:1 в качестве элюента с получением указанного в заголовке соединения в виде бледно-желтого масла.
Пример получения 18
Диэтил 2-бромбензилфосфонат (соединение 418)
Диэтил фосфит (0,77 мл, 6,0 ммоль) растворяют в сухом ТГФ (10 мл) в сухой колбе Шленка в атмосфере аргона. Раствор охлаждают на ледяной бане и добавляют NaH (0,24 г, 60% в масле, 6,0 ммоль) и перемешивают в течение 5 минут. Добавляют 2-бромбензилбромид (1,0 г, 4,0 ммоль), растворенный в 2 мл сухого ТГФ, и реакционную смесь нагревают при кипении с обратным холодильником в течение ночи. Добавляют Н2О (20 мл) и водную фазу экстрагируют EtOAc (3×10 мл). Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и выпаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией с применением EtOAc в качестве элюента с получением указанного в заголовке соединения в виде бесцветного масла.
Пример получения 19
2-бромбензил 3,3,3-трифторпропиловый эфир (соединение 419)
Реакцию проводят по методике примера получения соединения 415. Исходными материалами являются NaH (60% в масле, 0,08 г, 2 ммоль) в сухом ТГФ (10 мл), 3,3,3-трифторпропан-1-ол (0,23 г, 2 ммоль), 2-бромбензилбромид (0,50 г, 2 ммоль) и йодид тетрабутиламмония (0,74 г, 0,2 ммоль). Неочищенный продукт очищают флэш-хроматографией с применением EtOAc/петролейного эфира 1:35 в качестве элюента с получением указанного в заголовке соединения в виде бледно-желтого масла.

Пример получения 20
2-(2-{2-[(2-бромбензил)окси]этокси}этокси)тетрагидро-2Н-пиран (соединение 420)
Соединение 415 (2,78 г, 10,0 ммоль) растворяют в сухом ТГФ (6 мл) в атмосфере аргона. Добавляют 3,4-дигидро-2Н-пиран (1,03 мл, 11,3 ммоль) с последующим добавлением п-толуолсульфокислоты (43 мг, 0,23 ммоль). Реакционную смесь нагревают до температуры 50°С в течение 2 часов, затем добавляют водный NaHCO3 (5%, 30 мл). Водную фазу экстрагируют EtOAc (3×15 мл) и объединенные органические фазы промывают водой, сушат (Na2SO4), фильтруют и выпаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией, элюируя EtOAc/петролейным эфиром 1:3. Это дает указанное в заголовке соединение в виде желтого масла.
Пример получения 21
2-[2-(2-{2-[(2-бромбензил)окси]этокси}этокси)этокси]тетрагидро-2Н-пиран (соединение 421)
Реакцию проводят по методике примера получения соединения 420. Исходными материалами являются соединение 416 (2,82 г, 8,9 ммоль) в 6 мл сухого ТГФ, 3,4-дигидро-2Н-пиран (0,89 мл, 9,8 ммоль) и п-толуолсульфокислота (37 мг, 0,19 ммоль). Неочищенный продукт очищают флэш-хроматографией с применением EtOAc/петролейного эфира 1:3 в качестве элюента с получением указанного в заголовке соединения в виде бледно-желтого масла.
Пример получения 22
2-{2-[(2-бромбензил)окси]этокси}тетрагидро-2Н-пиран
(соединение 422)
Реакцию и обработку проводят по методике примера получения соединения 420. Исходными материалами являются соединение 417 (8,0 г, 34,9 ммоль) в 20 мл сухого ТГФ, 3,4-дигидро-2Н-пиран (3,2 мл, 34,9 ммоль) и п-толуолсульфокислота (0,14 г, 0,76 ммоль) и время реакции составляет 4 часа. Неочищенный продукт очищают флэш-хроматографией с применением EtOAc/петролейного эфира 1:2 в качестве элюента с получением указанного в заголовке соединения в виде бесцветного масла.
Пример получения 23
2-(2-бромбензил)-1Н-изоиндол-1,3(2Н)-дион (соединение 423)
2-Бромбензилбромид (5,25 г, 21,0 ммоль) растворяют в сухом ДМФ (200 мл) и добавляют фталимид калия (3,89 г, 21,0 ммоль). Суспензию перемешивают при температуре 70°С в течение 5 ч. Смесь охлаждают до комнатной температуры и выливают в ледяную воду (200 мл). Через 30 минут смесь фильтруют и кристаллическое вещество сушат в течение ночи. Перекристаллизация из ДХМ/петролейного эфира дает указанное в заголовке соединение в виде бесцветных кристаллов.
Пример получения 24
3-[(2-бромбензил)окси]пропанол (соединение 424)
Реакцию и обработку проводят по методике примера получения соединения 415. Исходными материалами являются NaH (60% в масле, 0,86 г, 22 ммоль) в ТГФ (80 мл), 1,3-пропандиол (8,67 мл, 120 ммоль), 2-бромбензилбромид (5,0 г, 20 ммоль), растворенный в 4 мл сухого ТГФ, и йодид тетрабутиламмония (0,07 г, 0,2 ммоль). Неочищенный продукт очищают флэш-хроматографией с применением EtOAc/петролейного эфира 1:1-2:1 в качестве элюента с получением указанного в заголовке соединения в виде бледно-желтого масла.
Пример получения 25
2-{3-[(2-бромбензил)окси]пропокси}тетрагидро-2Н-пиран (соединение 425)
Реакцию и обработку проводят по методике примера получения соединения 420. Исходными материалами являются соединение 424 (2,41 г, 9,8 ммоль) в 7 мл сухого ТГФ, 3,4-дигидро-2Н-пиран (0,99 мл, 10,8 ммоль) и п-толуолсульфокислота (37 мг, 0,19 ммоль). Неочищенный продукт очищают флэш-хроматографией с применением EtOAc/петролейного эфира 1:4 в качестве элюента с получением указанного в заголовке соединения в виде бледно-желтого масла.
Пример получения 26
3-[(2-бромбензил)окси]пропил 4-метилбензолсульфонат
(соединение 426)
Реакцию и обработку проводят по методике примера получения соединения 163, используя соединение 424 (2,50 г, 10,2 ммоль) в пиридине (3 мл) и п-толуолсульфонилхлорид (2,14 г, 11,2 ммоль). Неочищенный продукт очищают флэш-хроматографией, элюируя EtOAc/петролейным эфиром 1:3. Это дает указанное в заголовке соединение в виде бесцветного кристаллического твердого вещества.
Пример получения 27
1-бром-2-(3-йодпропоксиметил)бензол (соединение 427)
Реакцию и обработку проводят по методике примера получения соединения 167, используя соединение 426 (3,04 г, 7,6 ммоль) в 8 мл ацетона и NaI (2,28 г, 15,2 ммоль). Неочищенный продукт очищают флэш-хроматографией, элюируя EtOAc/петролейным эфиром 1:2. Это дает указанное в заголовке соединение в виде бесцветного масла.
Пример получения 28
Диэтил 3-[(2-бромбензил)окси]пропилфосфонат (соединение 428)
Реакцию проводят по методике примера получения соединения 171, применяя NaH (0,036 г, 60% в масле, 0,9 ммоль) в сухом ТГФ (2 мл) и диэтилфосфит (0,12 мл, 0,9 ммоль). Добавление соединения 427 (0,20 г, 0,6 ммоль), растворенного в сухом ТГФ (1 мл), перемешивание при комнатной температуре в течение 48 ч и обработку проводят по методике примера получения соединения 171. Неочищенный продукт очищают флэш-хроматографией с применением EtOAc в качестве элюента с получением указанного в заголовке соединения в виде бесцветного масла.
Пример получения 29
2-(2-бромфенил)этил-4-метилбензолсульфонат (соединение 429)
Реакцию и обработку проводят по методике примера получения соединения 163, используя 2-бромфенетиловый спирт (5 г, 25 ммоль) в пиридине (12 мл) и п-толуолсульфонилхлорид (5,2 г, 27,5 ммоль). Неочищенный продукт очищают флэш-хроматографией, элюируя EtOAc/петролейным эфиром 1:4. Это дает указанное в заголовке соединение в виде бесцветного кристаллического твердого вещества.
Пример получения 30
1-бром-2-(2-йодэтил)бензол (соединение 430)
Реакцию и обработку проводят по методике примера получения соединения 167, используя соединение 429 (7,98 г, 22,5 ммоль) в 22 мл ацетона и NaI (6,7 г, 44,9 ммоль). Флэш-хроматография неочищенного продукта с применением петролейного эфира в качестве элюента дает указанное в заголовке соединение в виде бесцветного масла.
Пример получения 31
Диэтил 2-(2-бромфенил)этилфосфонат (соединение 431)
Реакцию проводят по методике примера получения соединения 171, применяя NaH (0,19 г, 60% в масле, 4,8 ммоль) в сухом ТГФ (10 мл) и диэтилфосфит (0,62 мл, 4,8 ммоль). Добавляют соединение 430 (1,0 г, 3,2 ммоль) и перемешивают при комнатной температуре в течение 18 ч. Обработку проводят по методике примера получения соединения 171. Неочищенный продукт очищают флэш-хроматографией с применением EtOAc/петролейного эфира 0:1-1:0 в качестве элюента с получением указанного в заголовке соединения в виде бесцветного масла.
Пример получения 32
(2-хлор-4-йодфенил)(2-метилфенил)метанон (соединение 432)
К перемешиваемой суспензии (4-амино-2-хлорфенил)(2-метилфенил)метанона (9,83 г, 40 ммоль) (описано в WO 01/42189 А1) в HCl (37%, 150 мл) при температуре 0°С добавляют раствор NaNO2 (5,52 г, 80 ммоль) в воде (40 мл) в течение 20 минут. Реакционную смесь перемешивают в течение 15 минут и добавляют раствор KI (36 г, 240 ммоль) в воде (100 мл) при перемешивании. Через 2 часа при комнатной температуре водную фазу дважды экстрагируют диэтиловым эфиром. Объединенные органические фазы промывают Na2CO3 (10%), NaHSO3 (40%), сушат над Na2SO4 и концентрируют в вакууме. Остаток очищают флэш-хроматографией с применением петролейного эфира/EtOAc 40:1 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества.
Пример получения 33
трет-бутил (4R)-4-[2-(2-аминофенил)этил]-2,2-диметил-1,3-оксазолидин-3-карбоксилат (соединение 433)
трет-Бутоксид калия (498 мг, 4,44 ммоль) добавляют к раствору хлорида (2-нитробензил)трифенилфосфония (2,04 г, 4,89 ммоль) в 1,4-диоксане (10 мл) в атмосфере аргона. Смесь перемешивают в течение 30 мин при комнатной температуре и затем при температуре 80°С в течение 40 мин. Через шприц добавляют раствор трет-бутил (4S)-4-формил-2,2-диметилоксазолидин-3-карбоксилата (510 мг, 2,22 ммоль) в 1,4-диоксане (3,0 мл). Полученную смесь нагревают при кипении с обратным холодильником в течение 4 ч и затем охлаждают до комнатной температуры в течение ночи. Реакционную смесь выливают в воду и экстрагируют EtOAc (х3). Органические фазы объединяют и промывают солевым раствором и сушат с MgSO4. Неочищенный продукт очищают флэш-хроматографией, элюируя петролейным эфиром/EtOAc 9:1 с получением (Z)/(E) смеси трет-бутил (4R)-2,2-диметил-4-[2-(2-нитрофенил)винил]-1,3-оксазолидин-3-карбоксилата в виде желтого масла. 288 мг полученного продукта растворяют в EtOAc (10 мл), добавляют Pd/C (40 мг, 10%) и затем перемешивают в атмосфере водорода (1 атм) в течение 4 ч. Реакционную смесь фильтруют через слой декалита и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, элюируя петролейным эфиром/EtOAc 2:1 с получением указанного в заголовке соединения в виде белого твердого вещества.
Пример получения 34
трет-бутил (4R)-4-[2-(2-{[3-хлор-4-(2-метилбензоил)фенил]- амино}фенил)этил]-2,2-диметилоксазолидин-3-карбоксилат (соединение 434)
Реакцию и обработку проводят по методике примера получения соединения 101, используя соединение 432 (378 мг, 1,06 ммоль) и соединение 433 (340 мг, 1,06 ммоль). Очистку проводят флэш-хроматографией, элюируя петролейным эфиром/EtOAc 9:1 с получением указанного в заголовке соединения в виде пены.
Пример получения 35
трет-бутил [2-(2-бромфенил)этил](метил)карбамат (соединение 435)
Раствор трет-бутил [2-(2-бромфенил)этил]карбамата (810 мг, 2,7 ммоль) в сухом ТГФ (2,0 мл) переносят в колбу с суспензией гидрида натрия (65 мг, 2,7 ммоль) в сухом ТГФ (2,0 мл) в атмосфере аргона. Смесь перемешивают в течение 15 мин при комнатной температуре и в течение 10 мин при температуре 60°С. Через шприц добавляют йодметан (0,19 мл, 2,97 ммоль). Через 4 часа реакционную смесь выливают в воду и экстрагируют EtOAc (х3). Органические фазы объединяют и промывают солевым раствором и сушат с MgSO4. Неочищенный продукт очищают флэш-хроматографией, элюируя петролейным эфиром/EtOAc 10:1 с получением указанного в заголовке соединения в виде бесцветного масла.
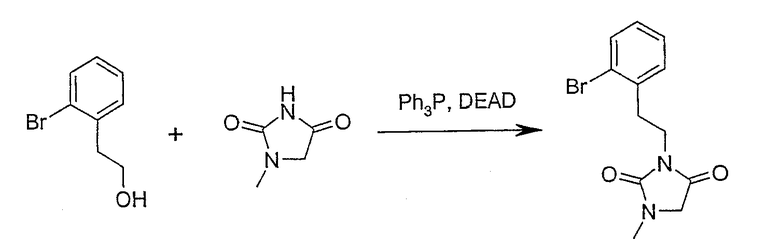
Пример получения 36
3-[2-(2-бромфенил)этил]-1-метилимидазолидин-2,4-дион
(соединение 436)
К раствору 2-бромфенетилового спирта (402 мг, 2,0 ммоль), 1-метилгидантоина (320 мг, 2,8 ммоль) и трифенилфосфина (734 мг, 2,8 ммоль) в ТГФ (20 мл) добавляют раствор диэтил азодикарбоксилата (40% в толуоле, 1,22 мл, 2,8 ммоль) при КТ. Реакционный раствор перемешивают при той же температуре в течение 3 ч и концентрируют в вакууме. Остаток очищают хроматографией (петролейный эфир/этилацетат 1:1) с получением указанного в заголовке соединения в виде бесцветного твердого вещества.
13С ЯМР (СDCl3): δ 169,6, 156,7, 137,6, 132,9, 130,9, 128,5, 127,6, 124,6, 51,6, 38,6, 34,4, 29,6.
Пример получения 37
3-[2-(2-бромфенил)этил]-5,5-диметилоксазолидин-2,4-дион (соединение 437)
2-Бромфенетиловый спирт (402 мг, 2 ммоль) и 5,5-диметилоксазолидин-2,4-дион (361 мг, 2,8 ммоль) обрабатывают по методике примера получения соединения 436. Очистку проводят флэш-хроматографией (петролейный эфир/этилацетат 4:1) с получением указанного в заголовке соединения в виде бесцветного твердого вещества.
13С ЯМР (СDCl3): δ 175,7, 154,4, 136,6, 133,1, 131,1, 128,8, 127,5, 124,7, 83,6, 39,2, 33,7, 23,5.
Пример получения 38
4-[2-(2-бромфенил)этил]морфолин-3,5-дион (соединение 438)
2-Бромфенетиловый спирт (402 мг, 2 ммоль) и морфолин-3,5-дион (322 мг, 2,8 ммоль) обрабатывают по методике примера получения соединения 436. Очистку проводят флэш-хроматографией (петролейный эфир/этилацетат 4:1) с получением указанного в заголовке соединения в виде бесцветного твердого вещества.
13С ЯМР (СDCl3): δ 168,9, 137,7, 132,9, 131,0, 128,5, 127,5, 124,7, 67,7, 38,2, 34,0.
Пример получения 39
1-[2-(2-бромфенил)этил]пиперидин-2,6-дион (соединение 439)
2-Бромфенетиловый спирт (402 мг, 2 ммоль) и глутаримид (317 мг, 2,8 ммоль) обрабатывают по методике примера получения соединения 436. Очистку проводят флэш-хроматографией (петролейный эфир/этилацетат 2:1) с получением указанного в заголовке соединения в виде бесцветного твердого вещества.
13С ЯМР (СDCl3): δ 172,3, 138,3, 132,7, 131,0, 128,2, 127,4, 124,7, 39,0, 34,1, 32,8, 17,1.
Пример получения 40
2-бромбензил (триизопропил)силиловый эфир (соединение 440)
К раствору о-бромбензилового спирта (2,55 г, 13,6 ммоль) и имидазола (1,36 г, 20 ммоль) в CH2Cl2 (20 мл) добавляют триизопропилсилил хлорид (2,6 мл, 12 ммоль) при КТ. Полученную смесь перемешивают при той же температуре в течение 1 ч и затем помещают в Н2О. После разделения фаз водную фазу дважды экстрагируют петролейным эфиром. Объединенные органические фазы сушат над MgSO4 и концентрируют в вакууме. Остаток очищают фильтрацией через короткую колонку силикагеля с получением указанного в заголовке соединения в виде бесцветной жидкости.
13С ЯМР (СDCl3): δ 140,3, 131,7, 127,8, 127,2, 127,1, 120,6, 64,6, 17,9, 11,8.
Пример получения 41
{2-хлор-4-[(2-{[(триизопропил)силокси]метил}фенил)амино] фенил}(2-метилфенил)метанон (соединение 441)
Смесь (4-амино-2-хлорфенил)(2-метилфенил)метанона (2,15 г, 8,74 ммоль) (описан в WO 01/42189 А1) и соединения 440 (3,0 г, 8,74 ммоль) обрабатывают по методике примера получения соединения 215. Очистку проводят флэш-хроматографией (петролейный эфир/этилацетат 20:1) с получением указанного в заголовке соединения в виде красноватого масла.
13С ЯМР (СDCl3): δ 196,2, 147,3, 140,3, 139,1, 137,6, 134,9, 133,4, 131,0, 130,6, 130,6, 129,4, 128,9, 128,7, 128,5, 125,2, 122,4, 119,1, 116,5, 113,2, 65,2, 20,2, 17,8, 17,5.
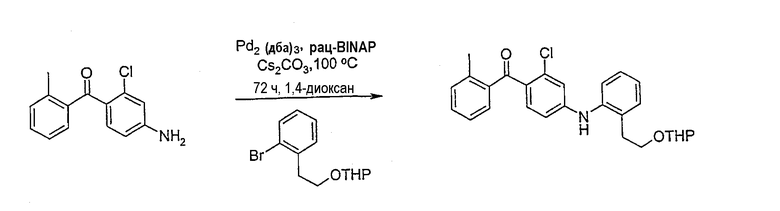
Пример 1
[2-Хлор-4-({2-[2-(тетрагидро-2Н-пиран-2-илокси) этил]фенил}амино)фенил](2-метилфенил)метанон (соединение 101)
В колбу Шленка загружают (4-амино-2-хлорфенил)(2-метилфенил)метанон (9,42 г) (описан в WO 01/42189 А1) в 1,4-диоксане (60 мл), соединение 401 (12,0 г), Cs2CO3 (17,5 г), Pd2(дба)3 (440 мг) и рац-BINAP (900 мг). Колбу закрывают резиновой мембраной, промывают аргоном в течение 5 мин и затем перемешивают при температуре 100°С в течение 72 ч. Реакционную смесь охлаждают до комнатной температуры, затем выливают в смесь воды и EtOAc. Водную фазу экстрагируют EtOAc (х2). Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают хроматографией, элюируя петролейным эфиром/простым эфиром 2:1 с получением указанного в заголовке соединения в виде оранжевого полутвердого вещества.
13С ЯМР (СDCl3): δ 196,3, 149,0, 139,6, 139,5, 137,6, 135,3, 133,9, 133,5, 131,1, 130,6, 129,4, 127,8, 127,4, 125,3, 124,4, 122,3, 115,8, 112,1, 99,3, 70,2, 62,3, 32,8, 30,6, 25,2, 20,3, 19,6.
Пример 2
(2-хлор-4-{[2-(2-гидроксиэтил)фенил]амино}фенил)-(2-метилфенил)метанон (соединение 102)
Раствор соединения 101 (4,00 г) и 4-толуолсульфокислоты (2,54 г) в метаноле (25 мл) перемешивают в течение 2 часов при КТ. Реакционную смесь выливают в смесь 1 н. NaOH и EtOAc. Водную фазу экстрагируют EtOAc (х2). Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают хроматографией, элюируя петролейным эфиром/простым эфиром 2:1, далее 4:1, с получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (CDCl3): δ 196,6, 149,0, 139,5, 137,6, 135,3, 133,8, 133,4, 131,2, 131,2, 130,6, 129,5, 127,8, 127,5, 125,3, 124,6, 122,7, 115,9, 112,2, 65,0, 34,6, 20,3.
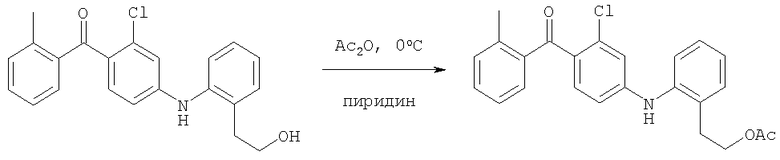
Пример 3
2-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}фенил)этилацетат (соединение 103)
Ангидрид уксусной кислоты (0,12 мл) добавляют к раствору соединения 102 (306 мг) в пиридине (3,0 мл) при температуре 0°С при перемешивании. Реакционную смесь доводят до комнатной температуры в течение ночи, затем выливают в смесь воды и EtOAc. Водную фазу экстрагируют EtOAc (х2). Объединенные органические фазы промывают солевым раствором, сушат (МgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают хроматографией, элюируя петролейным эфиром/Et2O 1:1 с получением указанного в заголовке соединения в виде сиропа.
13С ЯМР (СDСl3): δ 196,4, 171,4, 148,8, 139,3, 138,9, 137,8, 135,1, 133,6, 131,2, 131,1, 130,7, 129,6, 128,7, 128,1, 125,3, 124,8, 123,1, 116,1, 112,7, 64,6, 31,2, 21,0, 20,4.
Пример 4
4-(2-{2-[(3-хлор-4-(2-метилбензоил)фенил)амино]фенил}этокси)-4-оксобутановая кислота (соединение 104)
Реакцию проводят по методике, описанной для получения соединения 103, применяя соединение 102 (1,37 г) в качестве спирта и янтарный ангидрид (0,56 г). Очищают флэш-хроматографией, элюируя петролейным эфиром/EtOAc 4:1 и 5% уксусной кислотой с получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (СDCl3): δ 196,6, 176,3, 172,7, 149,0, 148,6, 139,3, 138,8, 137,8, 135,1, 133,6, 131,2, 131,0, 130,7, 129,6, 128,4, 128,1, 125,3, 125,1, 123,8, 115,9, 112,5, 64,8, 31,0, 29,0, 28,8, 20,4.
Пример 5
2-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)этилгексаноат (соединение 105)
Реакцию проводят по методике, описанной для получения соединения 103, применяя соединение 102 (0,42 г) в качестве спирта и гексановый ангидрид (0,40 мл). Объединенные органические фазы также промывают 0,5 н. NaOH. Очищают флэш-хроматографией, последовательно элюируя петролейным эфиром/EtOAc 9:1 и петролейным эфиром/EtOAc 4:1 с получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (СDCl3): δ 196,4, 174,3, 148,8, 139,3, 138,9, 137,8, 135,2, 133,6, 131,2, 131,1, 130,8, 130,7, 129,6, 128,6, 128,0, 125,3, 124,8, 123,2, 116,1, 112,6, 64,4, 34,3, 31,3, 24,6, 24,4, 22,3, 20,4, 13,9.
Пример 6
2-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-1-метилэтилацетат (соединение 106)
Реакцию проводят по методике, описанной для получения соединения 101, применяя соединение 402 (304 мг) в качестве бромида. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 4:1 с получением указанного в заголовке соединения в виде оранжевого сиропа.
13С ЯМР (СDCl3): δ 196,5, 171,7, 148,5, 139,4, 139,3, 137,8, 135,1, 133,6, 131,7, 131,2, 130,7, 129,6, 129,0, 128,8, 127,9, 125,3, 123,7, 121,5, 116,4, 113,2, 71,6, 39,0, 21,4, 20,4, 19,1.
Пример 7
(2-хлор-4-{[2-(2-гидроксипропил)фенил]амино}фенил)-
(2-метилфенил)метанон (соединение 107)
Раствор соединения 106 (49 мг) в ТГФ (1,0 мл) добавляют к раствору метоксида натрия в метаноле (3,0 мл, 0,33М) и затем перемешивают в течение 45 мин при температуре 20°С. Реакционную смесь выливают в смесь воды и EtOAc. Водную фазу экстрагируют EtOAc (х2). Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (СDCl3): δ 196,5, 148,9, 139,7, 139,6, 137,6, 135,3, 133,9, 132,0, 132,0, 131,1, 130,6, 129,4, 127,7, 127,5, 125,3, 124,1, 122,3, 116,0, 112,3, 70,6, 40,6, 23,8, 20,3.
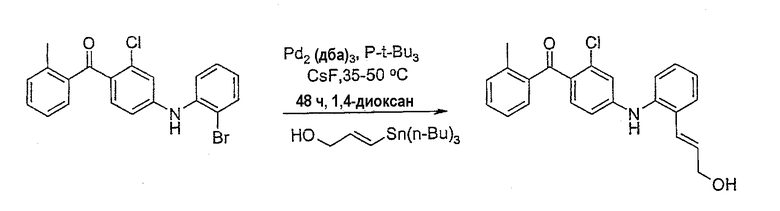
Пример 8
[2-Хлор-4-({2-[(1Е)-3-гидроксипроп-1-енил]фенил}амино)фенил]
(2-метилфенил)метанон (соединение 108)
В атмосфере аргона раствор {2-хлор-4-[(2-бромфенил)амино]фенил}(2-метилфенил)метанона (300 мг) (описан в WO 01/42189) в диоксане (1,5 мл) и раствор Р-т-Bu3 (18 мл) в диоксане (1,0 мл) добавляют по очереди в колбу Шленка, в которую загружен Pd2(дба)3 (21 мг) и CsF (152 мг). Затем через шприц добавляют (2Е)-3-(трибутилстаннил)проп-2-ен-1-ол (273 мг) и колбу Шленка герметично закрывают, помещают в масляную баню при температуре 35-50°С и перемешивают в течение 48 ч. Затем реакционную смесь охлаждают до комнатной температуры, разбавляют ацетонитрилом и фильтруют через слой целита. Целит промывают ацетонитрилом и объединенные органические фазы затем тщательно промывают петролейным эфиром и концентрируют в вакууме. Продукт очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 4:1 с получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (СDCl3): δ 196,8, 149,0, 139,2, 137,7, 137,2, 135,1, 133,6, 131,9, 131,5, 131,2, 130,8, 129,6, 128,6, 128,4, 127,4, 126,0, 125,4, 125,4, 124,0, 116,1, 112,5, 63,4, 20,4.
Пример 9
(2-Хлор-4-{[2-(3-гидроксипропил)фенил]амино}фенил)
(2-метилфенил)метанон (соединение 109)
Смесь соединения 108 (50 мг) и 10% Pd/C (7 мг) в этаноле (1,0 мл) перемешивают в атмосфере водорода при комнатной температуре в течение 8 ч. Реакционную смесь концентрируют в вакууме и очищают флэш-хроматографией, элюируя смесью ДХМ/МеОН 97:3 с получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (СDCl3): δ 196,5, 149,4, 139,5, 138,7, 137,7, 135,2, 134,7, 133,8, 131,2, 130,7, 130,6, 129,5, 128,0, 127,1, 125,3, 124,9, 123,1, 115,8, 112,2, 60,9, 32,8, 26,6, 20,4.
Пример 10
[2-Хлор-4-({2-[(1Е)-4-гидроксибут-1-енил]- фенил}амино)фенил](2-метилфенил)метанон (пример 110)
Реакцию проводят по методике, описанной для получения соединения 108, применяя (2Е)-4-(трибутилстаннил)бут-3-ен-1-ол (304 мг) в качестве станнана. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 8:1 с последующим 1:1 получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (СDCl3): δ 196,5, 149,0, 139,3, 137,8, 136,8, 135,1, 133,6, 131,2, 130,8, 129,8, 129,6, 128,3, 127,9, 127,3, 125,5, 125,3, 124,2, 116,0, 112,4, 61,9, 36,6, 20,4.
Пример 11
[4-({2-[(1Е)-3-аминопроп-1-енил]фенил}амино)-2-хлорфенил](2-метилфенил)метанон (соединение 111)
Реакцию проводят по методике, описанной для получения соединения 108, применяя (2Е)-3-(трибутилстаннил)проп-2-ен-1-амин (273 мг) в качестве станнана. Очищают флэш-хроматографией, элюируя смесью ДХМ/МеОН/Et3N 90:5:5 с получением указанного в заголовке соединения в виде желтой пены.
13С ЯМР (СDCl3): δ 196,5, 149,0, 139,3, 137,8, 137,1, 135,1, 133,6, 132,2, 131,2, 130,8, 129,6, 128,5, 128,4, 127,4, 125,4, 125,3, 125,2, 123,9, 116,2, 112,5, 44,2, 20,4.
Пример 12
Диэтил (2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)- фенил]амино}фенил)проп-2-енилфосфонат (соединение 112)
Реакцию проводят по методике, описанной для получения соединения 108, применяя диэтил (2Е)-3-(трибутилстаннил)проп-2-енилфосфонат (219 мг) в качестве станнана. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 1:1 с получением указанного в заголовке соединения.
13С ЯМР (СDCl3): δ 196,4, 148,9, 139,3, 137,8, 137,1, 135,1, 133,6, 132,0, 131,2, 130,8, 130,3, 130,1, 129,6, 128,7, 127,4, 125,3, 123,9, 122,2, 122,0, 116,1, 112,5, 62,1, 31,3, 20,4, 16,5.
Пример 13
[2-хлор-4-({2-[(1Е)-3-гидрокси-3-метилбут-1-енил]фенил}амино)фенил](2-метилфенил)метанон (соединение 113)
Реакцию проводят по методике, описанной для получения соединения 108, применяя соединение 403 (295 мг) в качестве станнана. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 2:1 с получением указанного в заголовке соединения в виде сиропа.
13С ЯМР (СDCl3): δ 196,5, 148,8, 140,5, 139,3, 137,8, 137,2, 135,0, 133,5, 132,1, 131,2, 130,8, 129,6, 128,7, 128,5, 127,4, 125,5, 125,3, 124,1, 121,8, 116,2, 112,7, 71,2, 30,0, 20,4.
Пример 14
Этил (2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}- фенил)акрилат (соединение 114)
Реакцию проводят по методике, описанной для получения соединения 108, применяя диэтил (2Е)-3-(трибутилстаннил)акрилат (295 мг) в качестве станнана. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 6:1 с получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (СDCl3): δ 196,5, 167,2, 148,2, 139,7, 139,3, 139,0, 138,0, 135,0, 133,4, 131,3, 130,9, 129,8, 129,6, 129,0, 128,0, 125,4, 125,3, 123,9, 119,9, 116,8, 113,3, 51,8, 20,5.
Пример 15
(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)акриловая кислота (соединение 115)
Раствор соединения 114 (190 мг) в ТГФ (2,0 мл) добавляют к раствору гидроксида лития (22 мг) в смеси МеОН/Н2О (3:4, 3,5 мл) и затем перемешивают в течение 72 ч при температуре 20°С. Реакционную смесь выливают в смесь 1 н. HCl (водн.) и ДХМ. Водную фазу экстрагируют ДХМ (х3). Объединенные органические фазы промывают солевым раствором, сушат (Na2SO4), фильтруют и концентрируют в вакууме с получением неочищенного продукта в виде твердого вещества. Кристаллизация из EtOAc дает указанное в заголовке соединение в виде желтых кристаллов.
13C ЯМР (ДМСО-d6): δ 195,2, 167,5, 149,8, 139,3, 139,2, 139,1, 136,5, 133,5, 131,2, 131,0, 130,7, 128,9, 128,9, 127,7, 126,7, 125,6, 125,2, 124,8, 120,0, 115,1, 112,1, 19,7.
Пример 16
{2-хлор-4-[(2-{(1Е)-3-[(2,2-диметил-1,3-диоксолан-4-ил)метокси]проп-1-енил}фенил)амино]фенил}(2-метилфенил)метанон (соединение 116)
Реакцию проводят по методике, описанной для получения соединения 108, применяя соединение 404 (351 мг) в качестве станнана. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 2:1 с получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (СDCl3): δ 196,4, 148,8, 139,3, 137,9, 137,2, 135,1, 133,5, 131,9, 131,3, 130,8, 129,6, 128,9, 128,8, 127,5, 125,5, 125,4, 124,1, 116,2, 112,6, 109,5, 74,8, 72,1, 71,4, 66,7, 26,8, 25,4, 20,4.
Пример 17
[2-хлор-4-({2-[(1Е)-3-(2,3-дигидроксипропокси)проп-1-енил]фенил}амино)фенил](2-метилфенил)метанон (соединение 117)
Раствор соединения 116 (70 мг) в смеси ТГФ (1,0 мл) и водный HCl (1,0 мл, 1 н.) перемешивают при температуре 20°С в течение 24 ч. Реакционную смесь выливают в смесь воды и EtOAc. Органическую фазу сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают хроматографией, элюируя смесью ДХМ/МеОН 95:5 с получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (СDCl3): δ 196,9, 149,2, 139,1, 137,9, 137,3, 135,0, 133,5, 131,9, 131,3, 130,9, 129,7, 128,8, 128,4, 128,1, 127,9, 127,3, 125,6, 125,4, 124,5, 116,0, 112,4, 71,8, 71,7, 70,7, 63,9, 20,4.

Пример 18
трет-бутил (1R)-2-{[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)проп-2-енил]амино}-1-(гидроксиметил)-2-оксоэтилкарбамат (соединение 118)
Смесь N-(трет-бутоксикарбонил)-L-серина (30 мг) и соединения 111 (50 мг) в ТГФ (1,0 мл) перемешивают при температуре 20°С в течение 10 мин. К смеси добавляют DMTMM (40 мг) и перемешивают в течение 20 ч при температуре 20°С. Реакционную смесь выливают в воду и экстрагируют EtOAc (х3). Органическую фазу объединяют и промывают солевым раствором и сушат с MgSO4. Неочищенный продукт очищают хроматографией, элюируя EtOAc/трифторуксусной кислотой 99:1 с получением указанного в заголовке соединения в виде желтой пены.
13С ЯМР (СDCl3): δ 196,8, 171,4, 156,2, 149,0, 139,2, 137,9, 137,3, 135,0, 133,5, 131,3, 131,2, 130,9, 129,7, 128,7, 128,4, 127,6, 127,2, 126,8, 125,4, 125,1, 123,7, 116,2, 112,6, 80,7, 62,8, 55,5, 41,5, 28,3, 20,4.
Пример 19
Метил О-(трет-бутил)-N-({[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)проп-2-енил]амино}карбонил)-L-серинат (соединение 119)
Смесь метил О-(трет-бутил)-N-(оксометилен)-L-серината (40 мг) и соединения 111 (50 мг) в ДХМ (3,0 мл) перемешивают при температуре 20°С в течение 1 ч. Концентрирование в вакууме с последующей хроматографией с элюированием петролейным эфиром/EtOAc 2:1 дает указанное в заголовке соединение в виде желтой пены.
13С ЯМР (СDCl3): δ 196,5, 172,9, 158,1, 149,3, 139,5, 137,7, 137,6, 134,9, 133,6, 131,2, 131,1, 130,6, 129,5, 129,0, 128,3, 127,9, 127,2, 126,3, 125,3, 124,5, 123,0, 116,6, 112,7, 73,5, 62,4, 54,0, 52,4, 46,1, 27,3, 20,4.
Пример 20
N-(трет-бутил)-N'-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил) фенил]амино}фенил)проп-2-енил]тиомочевина (соединение 120)
Смесь трет-бутил изотиоцианата (19 мг) и соединения 111 (50 мг) в ДХМ (3,0 мл) перемешивают при температуре 20оС в течение 1,5 ч. Добавляют этиламин (20 мг) и реакционную смесь перемешивают в течение 24 ч. Концентрирование в вакууме с последующей хроматографией с элюированием петролейным эфиром/EtOAc 3:1 дает указанное в заголовке соединение.
13С ЯМР (СDCl3): δ 196,6, 181,4, 149,0, 139,2, 137,8, 137,2, 135,0, 133,6, 131,9, 131,3, 130,8, 129,6, 128,8, 128,5, 127,9, 127,8, 127,4, 125,5, 125,4, 124,0, 116,1, 112,5, 53,0, 47,5, 29,5, 20,4.
Пример 21
N-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)проп-2-енил]-4-оксопентанамид (соединение 121)
Реакцию проводят по методике, описанной для получения соединения 118, применяя 4-оксопентановую кислоту (25 мг) в качестве карбоновой кислоты. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 2:3 с получением указанного в заголовке соединения.
13С ЯМР (СDCl3): δ 208,5, 196,5, 172,0, 149,1, 139,4, 137,8, 137,3, 135,0, 133,6, 131,2, 131,0, 130,7, 129,6, 128,4, 128,4, 128,2, 127,1, 125,7, 125,3, 124,9, 123,4, 116,5, 112,6, 41,3, 38,6, 29,9, 20,4.
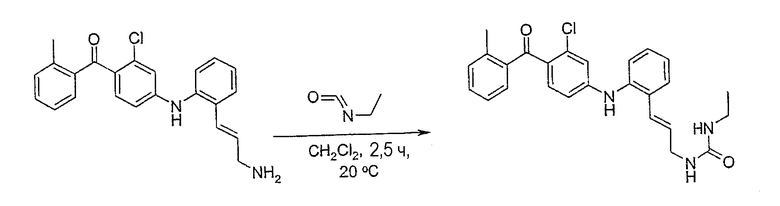
Пример 22
N-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)проп-2-енил]-N'-этилмочевина (соединение 122)
Смесь этилизоцианата (28 мг) и соединения 111 (100 мг) в ДХМ (1,0 мл) перемешивают при температуре 20оС в течение 2,5 ч. Реакционную смесь выливают в воду и экстрагируют ДХМ (х3). Органическую фазу объединяют и промывают солевым раствором и сушат с MgSO4. Неочищенный продукт очищают хроматографией, элюируя петролейным эфиром/EtOAc 2:3 с получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (СDCl3): δ 197,0, 158,7, 149,5, 139,2, 137,7, 137,1, 134,9, 133,6, 132,1, 131,3, 130,9, 129,9, 129,6, 128,4, 127,8, 127,3, 126,5, 125,4, 125,4, 124,2, 116,2, 112,3, 42,5, 35,2, 20,4, 15,5.
Пример 23
Этил 4-{[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)-фенил]амино}фенил)проп-2-енил]амино}-4-оксобутаноат
(соединение 123)
Реакцию проводят по методике, описанной для получения соединения 118, применяя этил гидросукцинат (32 мг) в качестве карбоновой кислоты. Очищают флэш-хроматографией, элюируя смесью ДХМ/МеОН 95:5 с получением указанного в заголовке соединения в виде сиропа.
13С ЯМР (СDCl3): δ 196,6, 173,3, 171,7, 149,2, 139,3, 137,7, 137,3, 135,0, 133,6, 131,4, 131,2, 130,8, 129,6, 128,5, 128,3, 128,2, 127,2, 126,5, 125,4, 125,2, 123,8, 116,2, 112,5, 60,9, 41,6, 30,9, 29,5, 20,4, 14,1.
Пример 24
N-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)проп-2-енил]-N'-циклогексилмочевина (соединение 124)
Реакцию проводят по методике, описанной для получения соединения 122, применяя циклогексилизоцианат (40 мг). Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 1:1 с получением указанного в заголовке соединения в виде сиропа.
13С ЯМР (СDCl3): δ 196,8, 157,8, 149,2, 139,2, 137,8, 137,1, 134,9, 133,5, 132,0, 131,3, 130,9, 130,0, 129,7, 128,5, 128,1, 127,4, 126,7, 125,4, 125,3, 124,0, 116,3, 112,5, 49,1, 42,6, 33,9, 25,6, 25,0, 20,4.
Пример 25
N'-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)проп-2-енил]-N,N-диметилсукцинамид (соединение 125)
Реакцию проводят по методике, описанной для получения соединения 118, применяя N,N-диметилсукцинамовую кислоту (32 мг) в качестве карбоновой кислоты. Очищают флэш-хроматографией, элюируя смесью EtOAc/МеОН 95:5 с получением указанного в заголовке соединения в виде сиропа.
13С ЯМР (СDCl3): δ 196,5, 172,7, 172,1, 149,6, 139,6, 137,6, 137,5, 135,1, 133,7, 131,1, 130,6, 129,4, 128,2, 127,8, 126,9, 125,6, 125,3, 124,7, 123,5, 116,1, 112,3, 41,4, 37,1, 35,7, 31,2, 28,6, 20,3.
Пример 26
Диметил [(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)-фенил]амино}фенил)проп-2-енил]малонат (соединение 126)
Реакцию проводят по методике, описанной для получения соединения 108, применяя соединение 405 (300 мг) в качестве станнана. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 6:1 с получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (СDCl3): δ 196,4, 169,2, 148,6, 139,3, 137,8, 137,1, 135,1, 133,6, 131,8, 131,2, 130,8, 129,6, 129,0, 128,7, 128,5, 127,7, 125,3, 125,0, 123,1, 116,2, 112,6, 52,6, 51,6, 32,4, 20,4.
Пример 27
[2-хлор-4-({2-[(1Е)-3-морфолин-4-илпроп-1-енил]фенил}амино)фенил](2-метилфенил)метанон (соединение 127)
Реакцию проводят по методике, описанной для получения соединения 108, применяя соединение 406 (466 мг) в качестве станнана. Очищают флэш-хроматографией, элюируя EtOAc с получением указанного в заголовке соединения в виде желтой пены.
13С ЯМР (СDCl3): δ 196,4, 149,0, 139,3, 137,8, 136,9, 135,1, 133,5, 132,4, 131,3, 130,8, 129,6, 128,9, 128,7, 128,7, 127,3, 125,8, 125,4, 124,6, 115,9, 112,5, 66,9, 61,5, 53,7, 20,4.
Пример 28
6-О-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)проп-2-енил]-1,2:3,4-ди-О-(1-метилэтилиден)-a-D-галактопираноза (соединение 128)
Реакцию проводят по методике, описанной для получения соединения 108, применяя соединение 407 (400 мг) в качестве станнана. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 5:1 с получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (СDCl3): δ 196,4, 148,7, 139,3, 137,8, 137,3, 135,1, 133,6, 131,6, 131,2, 130,7, 129,6, 129,3, 128,7, 128,6, 127,6, 127,3, 125,3, 125,1, 123,5, 116,3, 112,6, 109,4, 108,6, 96,4, 71,8, 71,3, 70,7, 70,5, 69,4, 67,1, 26,1, 26,0, 24,9, 24,5, 20,4.
Пример 29
Метил 5-О-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)- фенил]амино}фенил)проп-2-енил]-2,3-О-(1-метилэтилиден)-b-D-рибофуранозид (соединение 129)
Реакцию проводят по методике, описанной для получения соединения 108, применяя соединение 408 (427 мг) в качестве станнана. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 6:1 с получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (СDCl3): δ 196,4, 148,8, 139,3, 137,8, 137,2, 135,1, 133,6, 131,7, 131,2, 130,8, 129,6, 129,0, 128,8, 127,5, 127,4, 125,4, 125,3, 123,9, 116,2, 112,6, 112,5, 109,4, 85,2, 82,1, 71,8, 71,5, 54,9, 26,5, 25,0, 20,4.
Пример 30
Метил 5-О-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)проп-2-енил]-b-D-рибофуранозид (соединение 130)
Соединение 129 (50 мг) растворяют в 80% водной уксусной кислоте (1,0 мл) и смесь перемешивают в течение 7 дней при температуре 50°С. Реакционную смесь выливают в насыщенный водный Na2CO3 (10 мл) и водную фазу экстрагируют EtOAc (3×10 мл). Объединенные органические фазы сушат (Na2SO4), фильтруют и выпаривают в вакууме. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 1:4 с получением указанного в заголовке соединения в виде желтой пены.
13С ЯМР (СDCl3): δ 197,4, 149,2, 138,8, 138,2, 137,0, 134,9, 133,3, 132,4, 131,4, 131,1, 130,1, 128,8, 128,7, 127,4, 127,3, 125,9, 125,4, 124,8, 116,0, 112,4, 108,4, 81,7, 75,1, 72,4, 71,9, 71,7, 55,3, 20,6.
Пример 31
Метил (4Е)-5-(2-{[3-хлор-4-(2-метилбензоил) фенил]амино}фенил)-2-(метилсульфонил)пент-4-еноат
(соединение 131)
Реакцию проводят по методике, описанной для получения соединения 108, применяя соединение 409 (250 мг) в качестве станнана. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 3:1 с получением указанного в заголовке соединения в виде сиропа.
13С ЯМР (СDCl3): δ 196,4, 166,5, 148,6, 139,2, 137,9, 137,3, 135,0, 133,5, 131,5, 131,3, 130,8, 130,2, 129,7, 128,9, 128,9, 127,6, 126,1, 125,4, 125,3, 123,8, 116,1, 112,6, 68,8, 53,5, 39,4, 30,4, 20,4.
Пример 32
Этил {[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)-фенил]амино}фенил)проп-2-енил]тио}ацетат (соединение 132)
Реакцию проводят по методике, описанной для получения соединения 108, применяя соединение 410 (300 мг) в качестве станнана. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 10:1 с получением указанного в заголовке соединения в виде сиропа.
13С ЯМР (СDCl3): δ 196,4, 171,0, 148,6, 139,3, 137,8, 137,5, 135,1, 133,6, 131,2, 131,0, 130,7, 129,6, 129,3, 128,7, 127,5, 127,0, 125,3, 124,8, 122,9, 116,4, 112,6, 61,6, 35,2, 32,4, 20,4, 14,1.
Пример 33
[2-хлор-4-{[2-((1Е)-3-{бис[2-(ацетилокси)этил]амино}проп-1-енил)фенил]амино}фенил](2-метилфенил)метанон (соединение 133)
Реакцию проводят по методике, описанной для получения соединения 108, применяя соединение 412 (454 мг) в качестве станнана. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 1:2 с получением указанного в заголовке соединения в виде пены.
13С ЯМР (СDCl3): δ 196,4, 171,2, 149,0, 139,4, 137,8, 137,4, 135,1, 133,6, 131,9, 131,2, 130,7, 129,7, 129,6, 128,5, 128,3, 127,5, 125,3, 125,1, 123,5, 116,4, 112,6, 62,4, 57,6, 52,8, 21,0, 20,4.
Пример 34
[2-хлор-4-{[2-((1Е)-3-{бис[2-(гидрокси)этил]амино}проп-1-енил)фенил]амино}фенил](2-метилфенил)метанон (соединение 134)
Реакцию проводят по методике, описанной для получения соединения 107, применяя соединение 133 (172 мг) в качестве сложного эфира. Очищают флэш-хроматографией, элюируя смесью ДХМ/МеОН 10:1 с получением указанного в заголовке соединения в виде желтого сиропа.
13С ЯМР (СDCl3): δ 196,6, 149,1, 139,2, 137,9, 137,1, 135,0, 133,5, 132,0, 131,3, 130,8, 129,7, 129,2, 128,6, 128,6, 128,5, 127,4, 125,4, 125,3, 124,0, 116,1, 112,6, 59,6, 57,0, 56,0, 20,4.
Пример 35
(2-хлор-4-{[2-((1Е)-3-{4-[2-(ацетилокси)этил]пиперидин-1-ил}проп-1-енил)фенил]амино}фенил)(2-метилфенил)метанон (соединение 135)
Реакцию проводят по методике, описанной для получения соединения 108, применяя соединение 413 (280 мг) в качестве станнана. Очищают флэш-хроматографией, элюируя EtOAc с получением указанного в заголовке соединения в виде пены.
13С ЯМР (СDCl3): δ 196,5, 171,1, 149,0, 139,3, 137,8, 137,0, 135,1, 133,5, 132,3, 131,2, 130,8, 129,6, 129,1, 128,7, 128,6, 127,3, 125,6, 125,3, 124,4, 116,0, 112,5, 62,4, 61,3, 53,8, 35,1, 32,5, 31,9, 21,0, 20,4.
Пример 36
{2-хлор-4-[(2-{(1Е)-3-[4-(2-гидроксиэтил)пиперидин-1-ил]проп-1-енил}фенил)амино]фенил}(2-метилфенил)метанон (соединение 136)
Реакцию проводят по методике, описанной для получения соединения 107, применяя соединение 135 (170 мг) в качестве сложного эфира. Очищают флэш-хроматографией, элюируя смесью ДХМ/МеОН 17:3 с получением указанного в заголовке соединения в виде желтого твердого вещества.
13С ЯМР (СDCl3): δ 196,6, 149,0, 139,3, 137,8, 137,5, 135,0, 133,5, 131,4, 131,2, 130,8, 129,6, 128,9, 128,5, 127,3, 125,3, 125,2, 123,9, 116,1, 112,7, 60,6, 60,1, 53,5, 38,8, 31,7, 31,1, 20,4.
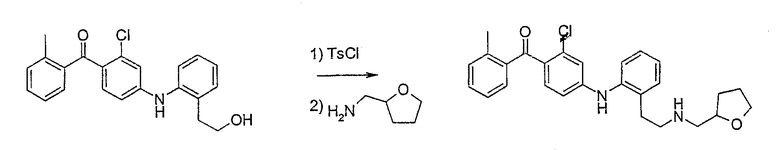
Пример 37
{2-хлор-4-[(2-{2-[(тетрагидрофуран-2-илметил)амино]этил}фенил)амино]фенил}(2-метилфенил)метанон (соединение 137)
Соединение 102 (0,15 г, 0,41 ммоль) растворяют в пиридине (0,2 мл) при температуре 0°С и добавляют п-толуолсульфонилхлорид (0,086 г, 0,45 ммоль). Суспензию перемешивают в течение 45 мин при температуре 0°С, после чего добавляют амин (тетрагидрофурфуриламин, 0,127 мг, 1,23 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Добавляют Н2О (10 мл) и водную фазу экстрагируют EtOAc (5×10 мл). Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и выпаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией, применяя смесь EtOAc/МеОН/Et3N 10:1:0,1 в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 149,3, 139,9, 137,5, 135,3, 134,4, 134,0, 131,2, 131,1, 130,4, 129,3, 127,3, 127,2, 125,3, 123,8, 121,8, 116,2, 112,1, 78,0, 68,0, 54,6, 51,7, 33,5, 29,4, 25,7, 20,3.
Пример 38
[2-хлор-4-({2-[2-(4-метилпиперазин-1-ил)этил]фенил}амино)фенил](2-метилфенил)метанон (пример 138)
Реакцию проводят по методике, описанной для получения соединения 137, применяя 1-метилпиперазин (0,137 мл, 1,23 ммоль) в качестве амина. Обработку проводят по методике, описанной для получения примера 137, и неочищенный продукт очищают флэш-хроматографией, элюируя смесью EtOAc/EtOH/Et3N 7:1:0,5. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,3, 149,1, 139,8, 139,6, 137,7, 135,3, 134,7, 133,8, 131,2, 130,6, 129,4, 128,0, 127,2, 125,3, 123,8, 121,4, 116,8, 112,8, 60,8, 55,2, 54,0, 46,1, 30,9, 20,4.
Пример 39
{2-хлор-4-[(2-{2-[(3-морфолин-4-илпропил)амино]этил}фенил)амино]фенил}(2-метилфенил)метанон (соединение 139)
Реакцию проводят по методике, описанной для получения соединения 137, применяя 1-морфолино-3-аминопропан (0,18 мл, 1,23 ммоль) в качестве амина. Обработку проводят по методике, описанной для получения примера 137, и неочищенный продукт очищают флэш-хроматографией, элюируя смесью EtOAc/EtOH/Et3N 5:1:0,5. Это дает указанное в заголовке соединение в виде оранжевого масла.
13С ЯМР (СDCl3): δ 196,7, 149,6, 140,2, 140,0, 137,9, 135,7, 134,3, 133,9, 131,5, 131,4, 130,9, 129,8, 127,9 127,8, 125,7, 124,4, 122,6, 116,4, 112,6, 67,2, 57,9, 54,2, 51,4, 49,5, 33,0, 26,1, 20,7.
Пример 40
(2-хлор-4-{[2-(2-{[2-(диметиламино)этил]амино}этил)- фенил]амино}фенил)(2-метилфенил)метанон (соединение 140)
Реакцию проводят по методике, описанной для получения соединения 137, применяя 2-диметиламиноэтиламин (0,13 мл, 1,23 ммоль) в качестве амина. Обработку проводят по методике, описанной для получения примера 137, и неочищенный продукт очищают флэш-хроматографией, элюируя смесью EtOAc/EtOH/Et3N 4:1:0,5. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 149,4, 139,8, 139,8, 137,5, 135,3, 133,9, 131,1, 131,1, 130,5, 129,4, 127,4, 125,3, 123,9, 121,9, 116,2, 112,1, 58,2, 51,2, 47,0, 45,3, 33,0, 20,3.
Пример 41
{2-хлор-4-[(2-{2-[(2-метоксиэтил)амино]этил}-фенил)амино]фенил}(2-метилфенил)метанон (соединение 141)
Реакцию проводят по методике, описанной для получения соединения 137, применяя 2-метоксиэтиламин (0,11 мл, 1,23 ммоль) в качестве амина. Обработку проводят по методике, описанной для получения примера 137, и неочищенный продукт очищают флэш-хроматографией, элюируя смесью EtOAc/МеОН/Et3N 4:1:0,5. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4 149,2, 139,8, 139,8, 137,5, 135,3, 134,2, 133,9, 131,2, 131,1, 130,5, 129,4, 127,4, 127,3, 125,3, 123,8, 121,7, 116,2, 112,1, 71,5, 58,9, 51,4, 49,4, 33,3, 20,3.
Пример 42
1-[3-({2-[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)фенил]этил}амино)пропил]пирролидин-2-он (соединение 142)
Соединение 102 (0,15 г, 0,41 ммоль) растворяют в пиридине (0,2 мл) при температуре 3°С и добавляют п-толуолсульфонилхлорид (0,086 г, 0,45 ммоль). Суспензию перемешивают в течение 45 мин при температуре 3°С, после чего добавляют амин (1-(3-аминопропил)-2-пирролидинон, 0,18 мл, 1,23 ммоль). Реакционную смесь перемешивают при температуре 3°С в течение 3 дней. Обработку проводят по методике, описанной для получения примера 137, и неочищенный продукт очищают флэш-хроматографией, элюируя смесью EtOAc/EtOH/Et3N 4:1:0,5. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 175,5, 149,3, 139,7, 139,6, 137,5, 135,2, 134,0, 134,0, 131,2, 131,1, 130,5, 129,4, 127,4, 127,3, 125,3, 124,0, 122,0, 116,0, 112,2, 51,0, 47,2, 46,6, 39,9, 33,0, 30,9, 27,0, 20,3, 17,9.
Пример 43
{2-хлор-4-[(2-{2-[метил(тетрагидрофуран-2-илметил)амино]этил}фенил)амино]фенил}(2-метилфенил)метанон (соединение 143)
Реакцию проводят по методике, описанной для получения соединения 142, применяя N-метилтетрагидрофурфуриламин (0,14 мл, 1,23 ммоль) в качестве амина. Обработку проводят по методике, описанной для получения примера 137, и неочищенный продукт очищают флэш-хроматографией, элюируя смесью EtOAc/МеОН/Et3N 20:1:0,1. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 155,8, 149,5, 140,0, 139,9, 137,5, 135,3, 134,7, 134,0, 131,2, 131,1, 130,4, 129,3, 127,1, 125,3, 123,6, 121,4, 116,4, 112,3, 76,8, 67,9, 63,2, 60,9, 42,9, 31,5, 30,2, 25,3, 20,3.
Пример 44
(2-хлор-4-{[2-(2-{[(2,2-диметил-1,3-диоксолан-4-ил)метил]амино}этил)фенил]амино}фенил)(2-метилфенил)метанон (соединение 144)
Реакцию проводят по методике, описанной для получения соединения 142, применяя 2,2-диметил-1,3-диоксолан-4-метанамин (0,16 мл, 1,23 ммоль) в качестве амина. Обработку проводят по методике, описанной для получения примера 137, и неочищенный продукт очищают флэш-хроматографией, элюируя смесью EtOAc/EtOH/Et3N 15:1:0,1. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 149,2, 139,7, 137,6, 135,3, 134,4, 133,9, 131,2, 131,1, 130,5, 129,4, 127,5, 127,3, 125,3, 124,1, 122,1, 116,1, 112,1, 109,5, 75,0, 67,3, 53,1, 51,8, 33,6, 26,9, 25,2, 20,3.
Пример 45
{2-хлор-4-[(2-{2-[4-(2-метоксиэтил)пиперазин-1-ил]этил}-фенил)амино]фенил}(2-метилфенил)метанон (соединение 145)
Реакцию проводят по методике, описанной для получения соединения 142, применяя 1-(2-метоксиэтил)пиперазин (0,18 мл, 1,23 ммоль) в качестве амина. Обработку проводят по методике, описанной для получения примера 137, и неочищенный продукт очищают флэш-хроматографией, элюируя смесью EtOAc/EtOH/Et3N 15:1:0,1. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,3, 149,1, 139,8, 139,6, 137,6, 135,3, 134,7, 133,8, 131,2, 130,6, 129,4, 127,9, 127,2, 125,3, 123,7, 121,3, 116,8, 112,8, 70,0, 60,9, 58,9, 57,9, 54,0, 53,6, 30,9, 20,3.
Пример 46
(2-хлор-4-{[2-(2-морфолин-4-илэтил)фенил]амино}фенил)-(2-метилфенил)метанон (соединение 146)
Реакцию проводят по методике, описанной для получения соединения 142. Исходными материалами являются соединение 102 (2,0 г, 5,45 ммоль) в пиридине (2,7 мл), п-толуолсульфонилхлорид (1,15 г, 6,0 ммоль) и морфолин (1,43 мл, 16,4 ммоль) в качестве амина. Обработку проводят по методике, описанной для получения примера 137, и неочищенный продукт очищают флэш-хроматографией, элюируя EtOAc/петролейным эфиром 1:2-1:0. Это дает указанное в заголовке соединение в виде желтого кристаллического соединения.
13С ЯМР (СDCl3): δ 196,3, 149,1, 139,5, 139,5, 137,7, 135,3, 134,7, 133,8, 131,2, 131,1, 130,6, 129,5, 128,1, 127,4, 125,3, 124,1, 122,0, 116,3, 112,7, 67,1, 61,3, 54,4, 30,4, 20,4.
Пример 47
{2-хлор-4-[(2-{2-[(2,3-дигидроксипропил)амино]-этил}фенил)амино]фенил}(2-метилфенил)метанон (соединение 147)
Соединение 144 растворяют в 1М HCl/ТГФ 1:1 (1,2 мл) и смесь перемешивают в течение 18 ч при КТ. Реакционную смесь выливают в 10% водный NaHCO3 (10 мл) и водную фазу экстрагируют EtOAc (3×10 мл). Объединенные органические фазы сушат (MgSO4), фильтруют и выпаривают в вакууме. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,7, 149,6, 139,4, 139,0, 137,7, 135,2, 134,2, 133,8, 131,2, 131,0, 130,7, 129,5, 127,8, 127,6, 125,3, 125,1, 123,8, 115,8, 112,1, 70,1, 65,3, 52,1, 50,7, 32,3, 20,4.
Пример 48
(4-{[2-(аминометил)фенил]амино}-2-хлорфенил)(2-метилфенил)-метанон (соединение 148)
Соединение 154 (2,17 г, 4,51 ммоль) растворяют в ДХМ (50 мл) и EtOH (10 мл). Добавляют гидразингидрат (0,44 мл, 9,0 ммоль) и реакционную смесь перемешивают при комнатной температуре в течение 4 дней. Суспензию фильтруют и фильтрат концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/МеOH/Et3N 10:1:0,1 в качестве элюента. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 147,8, 141,1, 139,5, 137,7, 135,1, 133,7, 131,2, 130,7, 130,0, 129,5, 128,4, 128,4, 125,3, 122,4, 119,2, 116,8, 113,1, 45,4, 20,4.
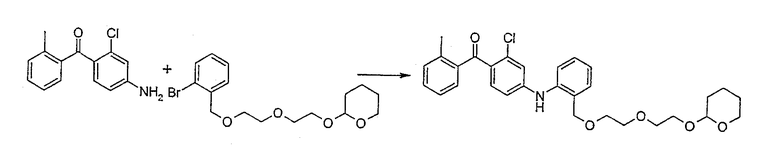
Пример 49
(2-хлор-4-{[2-({2-[2-(тетрагидро-2Н-пиран-2-илокси)этокси]-этокси}метил)фенил]амино}фенил)(2-метилфенил)метанон
(соединение 149)
Соединение 420 (3,39 г, 10,3 ммоль) растворяют в 15 мл сухого 1,4-диоксана в колбе Шленка в атмосфере аргона. Добавляют (4-амино-2-хлорфенил)(2-метилфенил)метанон (описан в WO 01/42189) и растворяют в растворителе. Добавляют рац-BINAP (0,26 г, 0,42 ммоль), Pd2(дба)3 (0,19 г, 0,20 ммоль) и Cs2CO3 (4,7 г, 14,4 ммоль) и реакционную смесь перемешивают в атмосфере аргона при температуре 100°С в течение 18 ч. Реакционную смесь разбавляют Н2О и EtOAc и водную фазу дважды экстрагируют EtOAc. Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и выпаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией, применяя ДХМ/ацетон 100:1 в качестве элюента с получением указанного в заголовке соединения в виде масла.
13С ЯМР (СDCl3): δ 196,4, 147,9, 140,9, 139,4, 137,8, 135,0, 133,6, 131,2, 130,7, 130,4, 129,6, 129,3, 128,7, 128,5, 125,3, 122,8, 120,1, 116,9, 113,3, 99,1, 72,3, 70,6, 70,3, 69,4, 66,6, 62,3, 30,6, 25,4, 20,4, 19,5.
Пример 50
{2-хлор-4-[(2-{[(тетрагидро-2Н-пиран-2-илокси)этокси]-метил}фенил)амино]фенил}(2-метилфенил)метанон
(соединение 150)
Реакцию проводят по методике, описанной для получения соединения 149. Исходными материалами являются соединение 422 (8,3 г, 26,3 ммоль) в 38 мл сухого 1,4-диоксана, (4-амино-2-хлорфенил)(2-метилфенил)метанон (6,47 г, 26,3 ммоль) (описан в WO 01/42189), рац-BINAP (0,67 г, 1,07 ммоль), Pd2(дба)3 (0,48 г, 0,52 ммоль) и Cs2CO3 (11,98 г, 36,8 ммоль). Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:2 в качестве элюента с получением указанного в заголовке соединения в виде масла.
13С ЯМР (СDCl3): δ 196,4, 147,7, 140,9, 139,3, 137,8, 135,0, 133,5, 131,2, 130,7, 130,5, 129,6, 129,2, 128,9, 128,3, 125,3, 122,7, 119,8, 117,1, 113,2, 99,4, 72,3, 69,4, 66,6, 62,7, 30,7, 25,3, 20,4, 19,8.
Пример 51
[2-хлор-4-({2-[(2-{2-[2-(тетрагидро-2Н-пиран-2-илокси)этокси]-этокси}этокси)метил]фенил}амино)фенил](2-метилфенил)метанон (соединение 151)
Реакцию проводят по методике, описанной для получения соединения 149. Исходными материалами являются соединение 421 (3,12 г, 7,74 ммоль) в 15 мл сухого 1,4-диоксана, (4-амино-2-хлорфенил)(2-метилфенил)метанон (2,06 г, 8,37 ммоль) (описан в WO 01/42189), рац-BINAP (0,21 г, 0,34 ммоль), Pd2(дба)3 (0,15 г, 0,17 ммоль) и Cs2CO3 (3,8 г, 11,7 ммоль). Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:2-1:1-1:0 в качестве элюента с получением указанного в заголовке соединения в виде масла.
13С ЯМР (СDCl3): δ 196,4, 147,9, 140,8, 139,4, 137,8, 135,0, 133,6, 131,2, 130,7, 130,5, 129,6, 129,3, 128,7, 128,5, 125,3, 122,8, 120,1, 117,0, 113,2, 99,0, 72,2, 70,6, 70,6, 70,4, 69,4, 66,6, 62,2, 30,6, 25,4, 20,4, 19,5.
Пример 52
[2-хлор-4-({2-[(3,3,3-трифторпропокси)метил]-фенил}амино)фенил](2-метилфенил)метанон (соединение 152)
Реакцию проводят по методике, описанной для получения соединения 149. Исходными материалами являются соединение 419 (0,22 г, 0,79 ммоль) и (4-амино-2-хлорфенил)(2-метилфенил)метанон (0,19 г, 0,79 ммоль) (описан в WO 01/42189 А1) в 4 мл сухого 1,4-диоксана, рац-BINAP (20,0 мг, 0,03 ммоль), Pd2(дба)3 (14 мг, 0,016 ммоль) и Cs2CO3 (0,36 г, 1,1 ммоль). Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:2 в качестве элюента с получением указанного в заголовке соединения в виде масла.
13С ЯМР (СDCl3): δ 196,4, 147,3, 140,6, 139,2, 137,9, 135,0, 133,5, 131,3, 130,8, 130,6, 129,7, 129,6, 129,4, 127,6, 126,3, 125,4, 122,9, 120,0, 117,0, 113,6, 72,3, 63,0, 34,4, 20,5.
Пример 53
Диэтил 2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензилфосфонат (соединение 153)
Реакцию проводят по методике, описанной для получения соединения 149. Исходными материалами являются соединение 418 (0,55 г, 1,79 ммоль) и (4-амино-2-хлорфенил)(2-метилфенил)метанон (0,44 г, 1,79 ммоль) (описан в WO 01/42189 А1) в 15 мл сухого 1,4-диоксана, рац-BINAP (44 мг, 0,07 ммоль), Pd2(дба)3 (33 мг, 0,04 ммоль) и Cs2CO3 (0,82 г, 2,51 ммоль). Через 16 ч при температуре 100оС добавляют еще рац-BINAP (44 мг, 0,07 ммоль) и Pd2(дба)3 (33 мг, 0,04 ммоль) и перемешивание продолжают при температуре 100°С в течение еще 7 ч. Обработку проводят по методике получения соединения 149. Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:1 в качестве элюента с получением указанного в заголовке соединения в виде коричневого масла.
13С ЯМР (СDCl3): δ 195,7, 148,0, 139,4, 138,8, 137,0, 134,5, 133,0, 131,4, 130,5, 129,9, 128,8, 127,6, 127,4, 124,6, 124,0, 123,7, 122,3, 115,6, 112,1, 62,1, 30,4, 19,7, 15,7.
Пример 54
2-[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)бензил]-1Н-изоиндол-1,3(2Н)-дион (соединение 154)
Реакцию проводят по методике, описанной для получения соединения 149. Исходными материалами являются соединение 423 (4,0 г, 12,65 ммоль) и (4-амино-2-хлорфенил)(2-метилфенил)метанон (3,1 г, 12,7 ммоль) (описан в WO 01/42189 А1) в 125 мл сухого толуола, рац-BINAP (0,47 г, 0,76 ммоль), Pd2(дба)3 (0,35 г, 0,38 ммоль) и Cs2CO3 (5,77 г, 17,7 ммоль). Через 18 ч при температуре 100°С добавляют еще рац-BINAP (0,24 г, 0,38 ммоль) и Pd2(дба)3 (0,17 г, 0,19 ммоль) и перемешивание продолжают при температуре 100°С в течение еще 8 ч. Добавляют еще рац-BINAP (0,24 г, 0,38 ммоль) и Pd2(дба)3 (0,17 г, 0,19 ммоль) и перемешивание продолжают при температуре 100°С в течение еще 18 ч. Обработку проводят по методике получения соединения 149. Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:3 в качестве элюента с получением указанного в заголовке соединения в виде желтого кристаллического соединения.
13С ЯМР (СDCl3): δ 196,4, 168,9, 148,4, 139,4, 137,8, 135,2, 134,4, 133,6, 132,7, 131,9, 131,2, 130,7, 129,6, 129,5, 128,7, 128,2, 125,3, 124,2, 123,6, 122,2, 116,5, 112,9, 37,9, 20,4.

Пример 55
{2-хлор-4-[(2-{[2-(2-гидроксиэтокси)этокси]метил}-фенил)амино]фенил}(2-метилфенил)метанон (соединение 155)
Соединение 149 (5,68 г, 10,8 ммоль) растворяют в МеОН (100 мл) и добавляют п-толуолсульфокислоту (3,09 г, 16,3 ммоль). Раствор перемешивают при комнатной температуре в течение 2 ч. Добавляют водный NaHCO3 (5%, 100 мл) и водную фазу экстрагируют EtOAc (3×50 мл). Объединенные органические фазы промывают солевым раствором (50 мл), сушат (MgSO4) и выпаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:1-3:2 в качестве элюента с получением указанного в заголовке соединения в виде оранжевого масла.
13С ЯМР (СDCl3): δ 196,4, 147,7, 140,7, 139,3, 137,9, 135,0, 133,5, 131,2, 130,8, 130,5, 129,7, 129,4, 129,0, 128,3, 125,4, 122,9, 120,1, 117,0, 113,3, 72,5, 72,2, 70,3, 69,2, 61,8, 20,4.
Пример 56
[2-хлор-4-({2-[(гидроксиэтокси)метил]фенил}амино)фенил](2-метилфенил)метанон (соединение 156)
Реакцию и обработку проводят по методике, описанной для получения соединения 155. Исходными материалами являются соединение 150 (13 г, 27 ммоль) в 290 мл МеОН и п-толуолсульфокислота (7,6 г, 40,4 ммоль). Неочищенный продукт очищают флэш-хроматографией, используя EtOAc/петролейный эфир 1:2-1:1 в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,6, 147,7, 140,7, 139,3, 137,8, 135,0, 133,5, 131,2, 130,8, 130,5, 129,6, 129,4, 128,9, 128,3, 125,4, 122,9, 120,0, 117,0, 113,4, 72,1, 71,3, 61,7, 20,4.
Пример 57
(2-хлор-4-{[2-({2-[2-(2-гидроксиэтокси)этокси]этокси}-метил)фенил]амино}фенил)(2-метилфенил)метанон (соединение 157)
Реакцию и обработку проводят по методике, описанной для получения соединения 155. Исходными материалами являются соединение 151 (4,4 г, 7,75 ммоль) в 100 мл МеОН и п-толуолсульфокислота (2,2 г, 11,6 ммоль). Неочищенный продукт очищают флэш-хроматографией, используя EtOAc/петролейный эфир 3:1 в качестве элюента с получением указанного в заголовке соединения в виде оранжевого масла.
13С ЯМР (СDCl3): δ 196,4, 148,1, 140,7, 139,4, 137,8, 135,0, 133,6, 131,2, 130,7, 130,7, 129,6, 129,4, 128,8, 128,6, 125,3, 123,1, 120,7, 116,9, 113,0, 72,5, 72,1, 70,5, 70,3, 70,3, 69,3, 61,7, 20,4.

Пример 58
[4-({4-бром-2-[(2-гидроксиэтокси)метил]фенил}амино)-2-хлорфенил](2-метилфенил)метанон (соединение 158)
Соединение 156 (3,8 г, 9,6 ммоль) растворяют в ДМСО (115 мл). Раствор охлаждают на ледяной бане и медленно добавляют 48% водный HBr (32 мл, 258 ммоль). Раствор перемешивают в закрытом сосуде при комнатной температуре в течение 5 дней. Реакционную смесь охлаждают на ледяной бане и добавляют 27% водный NaOH (30 мл) с получением щелочного раствора. Водную фазу три раза экстрагируют EtOAc, объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и выпаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:1 в качестве элюента с получением указанного в заголовке соединения в виде слегка окрашенного кристаллического соединения.
13С ЯМР (СDCl3): δ 196,5, 147,0, 140,0, 139,0, 138,0, 134,9, 133,3, 133,1, 132,1, 131,3, 130,9, 130,1, 129,8, 129,6, 125,4, 121,1, 117,4, 114,8, 113,8, 71,5, 71,4, 61,7, 20,5.
Пример 59
(4-{[4-бром-2-({2-[2-(2-гидроксиэтокси)этокси]этокси}-метил)фенил]амино}-2-хлорфенил)(2-метилфенил)метанон
(соединение 159)
Реакцию и обработку проводят по методике, описанной для получения соединения 158. Исходными материалами являются соединение 157 (2,14 г, 2,56 ммоль) в 36 мл ДМСО и 48% HBr (8,6 мл, 78,8 ммоль). Время реакции составляет 8 дней. Неочищенный продукт очищают флэш-хроматографией, элюируя EtOAc/петролейным эфиром 3:1 с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 7,48 (1Н, шир.с), 7,24-7,45 (7H, м), 7,20 (1H, т), 7,04 (1H, д) 6,90 (1H, дд), 4,51 (2H, c), 3,55-3,75 (12H, м), 2,45 (3H, c).
Пример 60
{4-[(4-бром-2-{[2-(2-гидроксиэтокси)этокси]метил}фенил)амино]-2-хлорфенил}(2-метилфенил)метанон (соединение 160)
Реакцию и обработку проводят по методике, описанной для получения соединения 158. Исходными материалами являются соединение 155 (1,19 г, 2,70 ммоль) в 36 мл ДМСО и 48% HBr (9,1 мл, 81,1 ммоль). Время реакции составляет 8 дней. Неочищенный продукт очищают флэш-хроматографией, элюируя EtOAc/петролейным эфиром 3:1 с получением указанного в заголовке соединения в виде оранжевого масла.
13С ЯМР (СDCl3): δ 196,4, 147,0, 140,0, 139,0, 138,0, 134,9, 133,4, 133,2, 132,2, 131,3, 130,9, 130,1, 129,8, 129,7, 125,4, 121,2, 117,4, 114,8, 113,6, 72,5, 71,6, 70,2, 69,3, 61,8, 20,5.
Пример 61
Диэтил 5-бром-2-({3-хлор-4-[(2-метилфенил)-карбонил]фенил}амино)бензилфосфонат (соединение 161)
Реакцию и обработку проводят по методике, описанной для получения соединения 158, используя соединение 153 (0,11 г, 0,23 ммоль) в ДМСО (3 мл) и 48% водный HBr (0,77 мл, 6,9 ммоль). Время реакции составляет 11 дней. Реакцию гасят водным NaHCO3 (10%, 10 мл). Водную фазу три раза экстрагируют EtOAc и объединенные органические фазы промывают Н2О и солевым раствором, сушат (MgSO4), фильтруют и выпаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией, элюируя EtOAc/петролейным эфиром 1:1 с получением указанного в заголовке соединения в виде слегка окрашенного масла.
13С ЯМР (СDCl3): δ 196,4, 148,0, 139,4, 139,3, 137,8, 135,1, 134,6, 133,5, 131,2, 130,8, 129,6, 128,8, 126,7, 125,3, 124,0, 124,0, 116,6, 116,4, 113,1, 63,0, 30,9, 20,4, 16,4.
Пример 62
[4-({4-бром-2-[(3,3,3-трифторпропокси)метил]фенил}амино)-2-хлорфенил](2-метилфенил)метанон (соединение 162)
Реакцию и обработку проводят по методике, описанной для получения соединения 158, используя соединение 152 (0,10 г, 0,22 ммоль) в ДМСО (2,65 мл) и 48% водный HBr (0,75 мл, 6,70 ммоль). Время реакции составляет 6 дней. Неочищенный продукт очищают флэш-хроматографией, используя EtOAc/петролейный эфир 1:4 в качестве элюента. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 7,5-7,25 (7H, м), 7,20 (1H, т), 7,00 (1H, д), 6,92 (1H, шир.c), 6,84 (1H, дд), 4,51 (2H, c), 3,71 (2H, т), 2,55-2,35 (2H, м), 2,46 (3H, c).

Пример 63
2-{[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил-4-метилбензолсульфонат (соединение 163)
Соединение 156 (1,0 г, 2,55 ммоль) растворяют в пиридине (1,3 мл) в атмосфере аргона. Раствор охлаждают на ледяной бане и добавляют п-толуолсульфонилхлорид (0,56 г, 2,9 ммоль). Суспензию перемешивают в течение 3 ч при комнатной температуре. Реакцию гасят водой и водную фазу дважды экстрагируют EtOAc. Объединенные органические фазы промывают солевым раствором, сушат (Na2SO4), фильтруют и выпаривают в вакууме. Неочищенный продукт очищают флэш-хроматографией, элюируя EtOAc/петролейным эфиром 1:2. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 147,4, 145,1, 140,7, 139,2, 137,9, 134,9, 133,5, 132,9, 131,3, 130,8, 130,6, 129,9, 129,7, 129,6, 129,2, 127,9, 127,6, 125,4, 122,8, 120,0, 117,0, 113,8, 72,2, 68,9, 67,5, 21,6, 20,5.
Пример 64
2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}этил-4-метилбензолсульфонат (соединение 164)
Реакцию и обработку проводят по методике, описанной для получения соединения 163, используя соединение 158 (1,99 г, 4,19 ммоль) в пиридине (4 мл) и п-толуолсульфонилхлорид (0,92 мл, 4,19 ммоль). Неочищенный продукт очищают флэш-хроматографией, элюируя EtOAc/петролейным эфиром 1:2. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 146,7, 145,2, 140,0, 139,0, 138,1, 134,8, 133,3, 133,2, 132,8, 132,3, 131,3, 131,0, 130,0, 129,8, 129,5, 127,9, 125,4, 121,3, 117,4, 114,8, 114,2, 71,5, 68,8, 67,6, 21,7, 20,5.
Пример 65
2-(2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}этокси)этил-4-метилбензолсульфонат
(соединение 165)
Реакцию и обработку проводят по методике, описанной для получения соединения 163, используя соединение 160 (1,10 г, 2,12 ммоль) в пиридине (2 мл) и п-толуолсульфонилхлорид (0,47 мл, 2,44 ммоль). Неочищенный продукт очищают флэш-хроматографией, элюируя EtOAc/петролейным эфиром 1:2. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 146,9, 144,9, 140,0, 139,0, 138,0, 134,8, 133,4, 133,1, 132,9, 132,1, 131,3, 130,9, 130,1, 129,9, 129,8, 129,6, 127,9, 125,4, 121,0, 117,3, 114,7, 113,7, 71,5, 70,5, 69,2, 69,0, 68,8, 21,6, 20,5.
Пример 66
2-[2-(2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}этокси)этокси]этил-4-метилбензолсульфонат (соединение 166)
Реакцию и обработку проводят по методике, описанной для получения соединения 163, используя соединение 159 (1,15 г, 2,04 ммоль) в пиридине (2 мл) и п-толуолсульфонилхлорид (0,45 мл, 2,35 ммоль). Неочищенный продукт очищают флэш-хроматографией, элюируя EtOAc/петролейным эфиром 2:3. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 149,5, 147,1, 144,8, 140,0, 139,1, 138,0, 134,8, 133,4, 133,1, 132,0, 131,3, 130,9, 130,3, 129,8, 129,7, 129,5, 127,9, 125,4, 121,2, 117,4, 114,8, 113,4, 71,5, 70,8, 70,4, 70,4, 69,4, 69,2, 68,7, 21,6, 20,5.
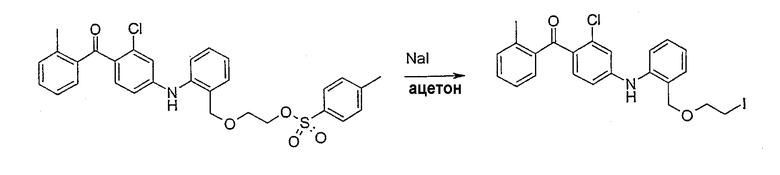
Пример 67
[4-({4-бром-2-[(2-йодэтокси)метил]фенил}амино)-2-хлорфенил](2-метилфенил)метанон (соединение 167)
Соединение 164 (1,72 г, 2,73 ммоль) растворяют в сухом ацетоне (2,7 мл) и добавляют сухой NaI (0,82 г, 5,47 ммоль). Суспензию перемешивают в защищенной от света колбе при комнатной температуре в течение 20 ч, после чего реакционную смесь разбавляют водой, и водную фазу три раза экстрагируют EtOAc. Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и выпаривают в вакууме. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,8, 147,1, 140,4, 139,3, 138,5, 135,2, 133,7, 132,8, 131,7, 131,4, 130,4, 130,2, 130,0, 125,8, 121,6, 118,0, 115,2, 114,6, 71,6, 70,8, 20,9, 4,1.
Пример 68
{4-[(4-бром-2-{[2-(2-йодэтокси)этокси]метил}фенил)амино]-2-хлорфенил}(2-метилфенил)метанон (соединение 168)
Реакцию и обработку проводят по методике, описанной для получения соединения 167, используя соединение 165 (0,87 г, 1,29 ммоль) в 1,3 мл ацетона и NaI (0,39 г, 2,59 ммоль). Обработка дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 146,9, 140,1, 139,0, 138,0, 134,9, 133,4, 133,1, 132,1, 131,3, 130,9, 130,0, 129,8, 129,7, 125,4, 121,0, 117,5, 114,7, 113,7, 72,0, 71,7, 69,9, 69,3, 20,5, 2,4.
Пример 69
(4-{[4-бром-2-({2-[2-(2-йодэтокси)этокси]этокси}метил)- фенил]амино}-2-хлорфенил)(2-метилфенил)метанон (соединение 169)
Реакцию и обработку проводят по методике, описанной для получения соединения 167, используя соединение 166 (1,07 г, 1,49 ммоль) в 1,5 мл ацетона и NaI (0,45 г, 2,98 ммоль). Обработка дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 147,1, 140,1, 139,1, 138,0, 134,9, 133,4, 133,1, 132,0, 131,3, 130,9, 130,2, 129,7, 129,5, 125,4, 121,1, 117,4, 114,7, 113,5, 71,9, 71,6, 70,5, 70,4, 70,2, 69,4, 20,5, 2,7.
Пример 70
[2-хлор-4-({2-[(2-йодэтокси)метил]фенил}амино)фенил](2-метилфенил)метанон (соединение 170)
Реакцию и обработку проводят по методике, описанной для получения соединения 167, используя соединение 163 (0,26 г, 0,48 ммоль) в 1,5 мл ацетона и NaI (0,14 г, 0,96 ммоль). Неочищенный продукт очищают флэш-хроматографией, элюируя EtOAc/петролейным эфиром 1:2 с получением указанного в заголовке соединения в виде бледно-желтого масла.
13С ЯМР (СDCl3): δ 196,4, 147,4, 140,7, 139,2, 137,9, 135,0, 133,4, 131,3, 130,8, 130,7, 129,7, 129,6, 129,3, 127,8, 125,4, 122,9, 120,0, 117,2, 113,8, 71,9, 70,3, 20,5, 3,9.
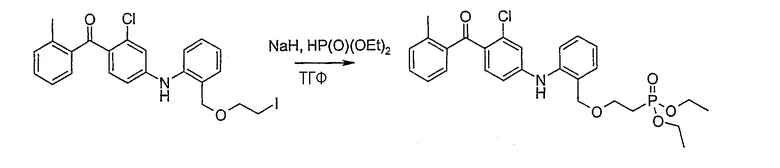
Пример 71
Диэтил 2-{[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}этилфосфонат (соединение 171)
В сухой колбе Шленка в атмосфере аргона NaH (0,01 г, 60% в масле, 0,24 ммоль) суспендируют в сухом ТГФ (0,2 мл) и добавляют диэтилфосфит (0,031 мл, 0,24 ммоль). Через 10 мин добавляют соединение 170 (0,10 г, 0,20 ммоль), растворенное в сухом ТГФ (0,3 мл), и реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 15 ч. Реакционную смесь разбавляют Н2О и водную фазу дважды экстрагируют EtOAc. Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:2 в качестве элюента с получением указанного в заголовке соединения в виде слегка окрашенного масла.
13С ЯМР (СDCl3): δ 196,3, 148,7, 140,7, 139,4, 137,4, 134,8, 133,4, 130,9, 130,7, 130,3, 129,3, 129,2, 129,1, 127,9, 125,1, 123,1, 121,6, 116,5, 112,8, 71,6, 63,9, 61,6, 26,5, 20,1, 16,1.
Пример 72
Диэтил 2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)-карбонил]фенил}амино)бензил]окси}этилфосфонат (соединение 172)
Реакцию проводят по методике получения соединения 171 с применением NaH (0,036 г, 60% в масле, 0,9 ммоль) в сухом ТГФ (0,5 мл) и диэтилфосфита (0,13 мл, 1,0 ммоль). Добавляют соединение 167 (0,48 г, 0,82 ммоль), растворенное в сухом ТГФ (0,8 мл), и нагревают при кипении с обратным холодильником в течение 18 ч. Обработку проводят по методике получения соединения 171. Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:2-4:1 в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 148,4, 140,2, 139,4, 137,8, 134,9, 133,6, 133,5, 132,2, 131,3, 131,2, 130,7, 129,6, 128,7, 125,3, 123,2, 117,1, 115,3, 113,3, 71,1, 64,3, 61,8, 26,6, 20,4, 16,4.
Пример 73
Диэтил 2-({[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]-фенил}амино)бензил]окси}этокси)этилфосфонат (соединение 173)
Реакцию проводят по методике получения соединения 171 с применением NaH (0,023 г, 60% в масле, 0,6 ммоль) в сухом ТГФ (0,3 мл) и диэтилфосфита (0,078 мл, 0,6 ммоль). Добавляют соединение 168 (0,34 г, 0,55 ммоль), растворенное в сухом ТГФ (1,0 мл), и нагревают при кипении с обратным холодильником в течение 18 ч. Обработку проводят по методике получения соединения 171. Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:2-1:0 в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,3, 147,2, 139,8, 139,1, 137,9, 134,9, 133,4, 132,9, 131,9, 131,3, 130,9, 130,4, 129,7, 129,5, 125,4, 121,2, 117,4, 114,9, 113,4, 71,4, 70,0, 69,3, 65,3, 61,7, 27,0, 20,5, 16,4.
Пример 74
Диэтил 2-[2-(2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]-фенил}амино)бензил]окси}этокси)этокси]этилфосфонат
(соединение 174)
Реакцию проводят по методике получения соединения 171 с применением NaH (0,03 г, 60% в масле, 0,76 ммоль) в сухом ТГФ (0,3 мл) и диэтилфосфита (0,098 мл, 0,76 ммоль). Добавляют соединение 169 (0,47 г, 0,69 ммоль), растворенное в сухом ТГФ (1,0 мл), и нагревают при кипении с обратным холодильником в течение 18 ч. Обработку проводят по методике получения соединения 171. Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:1-EtOAc/МеОН 20:1 в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,3, 147,3, 139,9, 139,1, 137,9, 134,9, 133,4, 133,0, 132,0, 131,3, 130,9, 130,6, 129,7, 129,3, 125,4, 121,5, 117,3, 114,9, 113,4, 71,4, 70,4, 70,3, 70,1, 69,4, 65,1, 61,6, 27,0, 20,4, 16,4.
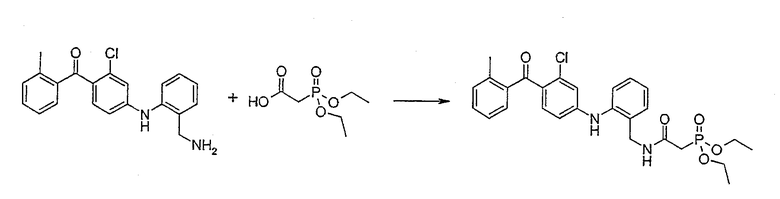
Пример 75
Диэтил 2-{[2-({3-хлор-4-[(2-метилфенил)карбонил]-фенил}амино)бензил]амино}-2-оксоэтилфосфонат (соединение 175)
Соединение 148 (0,20 г, 0,56 ммоль) растворяют в сухом ДХМ (1 мл) в высушенной в печи стеклянной посуде в атмосфере аргона. Добавляют диэтилфосфоноуксусную кислоту (0,09 мл, 0,56 ммоль) с последующим добавлением по каплям дициклогексилкарбодиимида (0,13 г, 0,61 ммоль, растворенный в 1 мл сухого ДХМ). Суспензию перемешивают при комнатной температуре в течение 7 ч, после чего ее фильтруют. Фильтрат разбавляют 5 мл ДХМ и промывают 10% водным NaHCO3, Н2О и солевым раствором. Органическую фазу сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc в качестве элюента с получением указанного в заголовке соединения в виде слегка окрашенного масла.
13C ЯМР (ДМСО-d6): δ 195,1, 164,5, 149,8, 139,3, 137,8, 136,4, 133,6, 132,8, 131,0, 130,6, 129,0, 128,7, 128,0, 126,3, 125,5, 124,6, 123,5, 114,9, 111,7, 61,6, 54,8, 34,5, 19,7, 16,1.
Пример 76
Диэтил 2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил} амино)фенил]амино}-2-оксоэтилфосфонат (соединение 176)
Реакцию проводят в атмосфере аргона, применяя высушенную в печи стеклянную посуду. Диэтилфосфоноуксусную кислоту (0,085 мл, 0,53 ммоль) растворяют в сухом толуоле (1 мл) и добавляют тионилхлорид (0,044 мл, 0,61 ммоль). Реакционную смесь нагревают при кипении с обратным холодильником в течение 1 ч и затем концентрируют в вакууме. {4-[(2-Амино-4-бромфенил)амино]-2-хлорфенил}(2-метилфенил)метанон (0,28 г, 0,48 ммоль) (описан в WO 01/05744) растворяют в сухом ДХМ (1 мл) и добавляют N,N-диизопропилэтиламин (0,16 мл, 0,96 ммоль) с последующим добавлением по каплям полученного выше хлорангидрида, растворенного в сухом ДХМ (2,5 мл). Реакционную смесь перемешивают при комнатной температуре в течение 22 ч, после чего ее разбавляют ДХМ. Органическую фазу промывают 10% водным NaHCO3, Н2О и солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 3:1 в качестве элюента с получением указанного в заголовке соединения в виде масла.
13С ЯМР (СDCl3): δ 196,5, 163,2, 148,0, 139,0, 138,0, 134,9, 133,3, 131,9, 131,8, 131,3, 130,9, 129,7, 129,4, 129,2, 126,9, 125,4, 124,5, 117,2, 116,6, 113,0, 63,4, 36,1, 20,5, 16,3.
Пример 77
{[2-({5-бром-3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}этил(диэтоксифосфорил)ацетат (соединение 177)
Реакцию проводят в атмосфере аргона, применяя высушенную в печи стеклянную посуду. Диэтилфосфоноуксусную кислоту (0,053 мл, 0,33 ммоль) растворяют в сухом толуоле (2 мл) и добавляют тионилхлорид (0,065 мл, 0,9 ммоль). Реакционную смесь нагревают при кипении с обратным холодильником в течение 2 ч и затем концентрируют в вакууме. Соединение 158 (0,14 г, 0,3 ммоль) растворяют в сухом ТГФ (1,5 мл). Добавляют 4-N,N-диметиламинопиридин (0,073 г, 0,6 ммоль) с последующим добавлением по каплям полученного выше хлорангидрида, растворенного в ТГФ (1,5 мл). Реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 20 ч. Реакционную смесь разбавляют EtOAc и водным NaHCO3, и органическую фазу промывают Н2О и солевым раствором, и объединенные водные фазы экстрагируют EtOAc. Объединенные органические фазы сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 2:1 в качестве элюента с получением указанного в заголовке соединения в виде слегка окрашенного масла.
13С ЯМР (СDCl3): δ 196,4, 165,7, 147,5, 139,4, 139,1, 138,0, 134,9, 133,4, 133,0, 132,0, 131,3, 130,9, 129,7, 129,5, 125,4, 122,1, 117,3, 115,5, 113,4, 70,9, 68,1, 64,8, 62,9, 34,4, 20,5, 16,3.
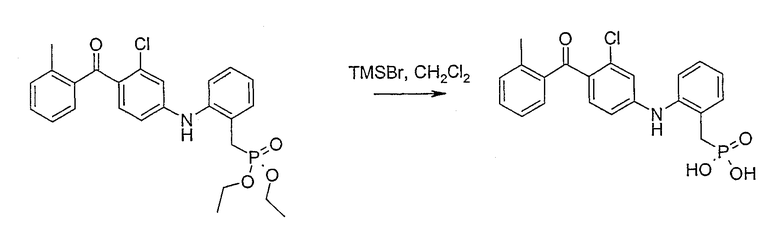
Пример 78
2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензилфосфоновая кислота (соединение 178)
Соединение 153 (0,27 г, 0,56 ммоль) растворяют в сухом ДХМ (5 мл) в атмосфере аргона. Добавляют триметилсилилбромид (0,37 мл, 2,8 ммоль) и раствор перемешивают при комнатной температуре в течение 20 ч. Раствор концентрируют в вакууме и затем повторно концентрируют с МеОН три раза. Неочищенный продукт растворяют в МеОН и обрабатывает активированным углем, фильтруют и концентрируют в вакууме с получением указанного в заголовке соединения в виде оранжевого масла.
13C ЯМР (ДМСО-d6): δ 195,0, 149,2, 139,3, 138,9, 136,3, 133,8, 133,7, 132,0, 130,9, 130,6, 128,7, 127,8, 127,2, 126,2, 125,5, 124,3, 122,6, 114,7, 111,9, 32,3, 19,7.

Пример 79
N-[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)бензил]-2,2,2-трифторэтансульфонамид (соединение 179)
Соединение 148 (0,18 г, 0,71 ммоль) растворяют в сухом пиридине (0,9 мл) и добавляют 2,2,2-трифторэтансульфонилхлорид (0,12 мл, 1,1 ммоль). Раствор перемешивают при комнатной температуре в течение 1 ч, после чего его концентрируют в вакууме. Масло разбавляют Н2О и водную фазу три раза экстрагируют EtOAc. Объединенные органические фазы промывают 10% водным NaHCO3, сушат (MgSO4) и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:2 в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,8, 148,1, 139,3, 139,0, 137,9, 135,0, 133,5, 131,3, 131,0, 130,1, 129,8, 129,3, 128,5, 125,4, 124,8, 123,2, 121,5, 116,5, 113,2, 54,6, 44,5, 20,4.
Пример 80
N-[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)- фенил]-2,2,2-трифторэтансульфонамид (соединение 180)
Реакцию проводят по методике получения соединения 179, применяя {4-[(2-амино-4-бромфенил)амино]-2-хлорфенил}(2-метилфенил)метанон (0,15 г, 0,35 ммоль) (описан в WO 01/05744) в пиридине (0,47 мл) и трифторэтансульфонилхлорид (0,059 мл, 0,53 моль). Время реакции составляет 4 ч. Обработка, проводимая по методике получения соединения 179, дает указанное в заголовке соединение в виде коричневых кристаллов.
13С ЯМР (СDCl3): δ 196,8, 149,2, 147,3, 138,5, 138,3, 134,9, 134,0, 133,2, 131,5, 131,3, 131,0, 130,2, 130,0, 127,1, 125,7, 125,5, 121,3, 118,0, 117,1, 113,7, 53,1, 20,6.
Пример 81
{2-хлор-4-[(2-{[(тетрагидро-2Н-пиран-2-илокси)пропокси]-метил}фенил)амино]фенил}(2-метилфенил)метанон (соединение 181)
Реакцию и обработку проводят по методике, описанной для получения соединения 149. Исходными материалами являются соединение 425 (2,6 г, 7,9 ммоль) в 15 мл сухого 1,4-диоксана, (4-амино-2-хлорфенил)(2-метилфенил)метанон (2,14 г, 8,7 ммоль) (описан в WO 01/42189 А1), рац-BINAP (0,22 мг, 0,35 ммоль), Pd2(дба)3 (0,16 г, 0,17 ммоль) и Cs2CO3 (3,9 г, 12,0 ммоль). Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:3 в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 147,5, 140,6, 139,3, 137,9, 135,0, 133,5, 131,3, 130,8, 130,5, 129,7, 129,2, 129,1, 128,5, 125,4, 122,8, 119,7, 117,0, 113,4, 99,1, 72,0, 67,4, 64,3, 62,6, 30,7, 30,0, 25,4, 20,4, 19,8.
Пример 82
[2-хлор-4-({2-[(гидроксипропокси)метил]фенил}амино)фенил](2-метилфенил)метанон (соединение 182)
Реакцию и обработку проводят по методике, описанной для получения соединения 155. Исходными материалами являются соединение 181 (3,89 г, 7,9 ммоль) в 100 мл МеОН и п-толуолсульфокислота (2,25 г, 11,82 ммоль). Неочищенный продукт очищают флэш-хроматографией, используя EtOAc/петролейный эфир 1:1 в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 147,6, 140,5, 139,2, 137,9, 135,0, 133,5, 131,3, 130,8, 130,6, 129,7, 129,3, 129,1, 128,4, 125,4, 123,0, 120,1, 116,9, 113,4, 72,0, 68,5, 61,1, 32,2, 20,4.
Пример 83
Диэтил 3-{[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}пропилфосфонат (соединение 183)
Реакцию и обработку проводят по методике, описанной для получения соединения 149. Исходными материалами являются соединение 428 (0,14 г, 0,4 ммоль) в 3 мл сухого 1,4-диоксана, (4-амино-2-хлорфенил)(2-метилфенил)метанон (0,098 г, 0,4 ммоль) (описан в WO 01/42189 А1), рац-BINAP (0,01 мг, 0,016 ммоль), Pd2(дба)3 (0,008 г, 0,009 ммоль) и Cs2CO3 (0,18 г, 0,56 ммоль). Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:2-4:1 в качестве элюента с получением указанного в заголовке соединения в виде бледно-желтого масла.
13С ЯМР (СDCl3): δ 196,4, 147,6, 140,5, 139,3, 137,9, 135,0, 133,5, 131,3, 130,8, 130,7, 129,7, 129,3, 129,1, 128,4, 125,4, 122,9, 120,0, 117,1, 113,5, 171,8, 69,6, 61,6, 23,4, 23,0, 20,4, 16,5.
Пример 84
Диэтил 2-[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)фенил]этилфосфонат (соединение 184)
Реакцию проводят по методике, описанной для получения соединения 149. Исходными материалами являются соединение 431 (0,73 г, 2,3 ммоль) в 19 мл сухого 1,4-диоксана, (4-амино-2-хлорфенил)(2-метилфенил)метанон (0,55 г, 2,3 ммоль) (описан в WO 01/42189 А1), рац-BINAP (0,06 мг, 0,08 ммоль), Pd2(дба)3 (0,046 г, 0,05 ммоль) и Cs2CO3 (1,04 г, 3,18 ммоль). Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 149,7, 139,7, 138,5, 137,6, 135,3, 134,9, 134,7, 133,8, 131,1, 130,6, 130,5, 129,4, 127,6, 125,3, 125,2, 124,4, 115,6, 112,2, 61,7, 26,6, 23,9, 20,3, 16,3.
Пример 85
Диэтил 2-[5-бром-2-({3-хлор-4-[(2-метилфенил)-карбонил]фенил}амино)фенил]этилфосфонат (соединение 185)
Реакцию и обработку проводят по методике, описанной для получения соединения 158. Исходными материалами являются соединение 184 (0,37 г, 0,8 ммоль) в 11 мл ДМСО и 48% водном HBr (2,6 мл, 23 ммоль). Время реакции составляет 5 дней. Неочищенный продукт очищают флэш-хроматографией, элюируя EtOAc/петролейным эфиром 1:2-1:0 с получением указанного в заголовке соединения в виде бесцветного кристаллического соединения.
13С ЯМР (СDCl3): δ 196,4, 149,0, 139,4, 138,0, 137,8, 136,7, 136,6, 135,2, 133,7, 133,4, 131,2, 130,7, 129,5, 128,3, 125,5, 125,3, 117,4, 115,9, 112,5, 61,9, 26,4, 23,7, 20,4, 16,3.
Пример 86
2-{[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)бензил]-амино}-2-оксиэтилфосфоновая кислота (соединение 186)
Соединение 175 (0,04 г, 0,075 ммоль) растворяют в сухом CH2Cl2 (0,5 мл) в атмосфере аргона. Добавляют триметилсилилбромид (0,1 мл, 0,75 ммоль) и раствор хранят при комнатной температуре в течение 45 ч. Раствор концентрируют в вакууме и затем повторно три раза концентрируют в МеОН. Это дает указанное в заголовке соединение в виде оранжевого масла.
13C ЯМР (ДМСО-d6): δ 195,6, 166,3, 150,3, 139,7, 138,2, 136,7, 134,1, 133,9,, 133,6, 131,4, 131,0, 129,6, 129,1, 128,3, 126,5, 126,0, 125,1, 124,0, 115,2, 112,1, 37,5, 20,1.
Пример 87
Фенетиловый эфир (2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)карбаминовой кислоты (соединение 187)
Реакции проводят в атмосфере аргона. Раствор 2-фенилэтанола (0,108 мл) в ДХМ (2,5 мл, 0,90 ммоль) охлаждают до температуры 0°С. Медленно добавляют смесь бис(трихлорметил) карбоната (0,097, 0,33 ммоль) и пиридина (0,07 мл, 0,90 ммоль) в ДХМ (2,5 мл) при перемешивании. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре и затем фильтруют и концентрируют в вакууме. Остаток растворяют в ДХМ (2,5 мл) и добавляют {2-хлор-4-[(2-аминофенил)амино]фенил}(2-метилфенил)метанон (0,150 г, 0,45 ммоль) (описан в WO 98/32730) и карбонат калия (0,25 г, 1,78 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 48 ч, после чего ее выливают в смесь воды и Et2O. Водную фазу экстрагируют Et2O. Объединенные органические фазы промывают водой, солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, используя EtOAc/петролейный эфир 1:3 в качестве элюента с получением указанного в заголовке соединения.
13С ЯМР (СDCl3): δ 196,6, 154,0, 149,1, 139,1, 137,9, 137,5, 135,0, 133,5, 133,1, 131,3, 130,9, 130,6, 129,7, 129,0, 128,9, 128,6, 126,8, 126,7, 125,8, 125,4, 125,0, 121,9, 116,1, 112,4, 66,1, 35,3, 20,4.
Пример 88
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-2-феноксиацетамид (соединение 188)
Раствор 2-феноксиуксусной кислоты (75 мг, 0,49 ммоль), тионилхлорида (72 мкл, 1,0 ммоль) и одной капли ДМФ в толуоле (2,0 мл) нагревают при кипении с обратным холодильником в течение 30 мин. Реакционную смесь концентрируют в вакууме и полученный неочищенный хлорангидрид растворяют в сухом ДХМ (2,0 мл). Раствор медленно добавляют к охлажденному (0°С) раствору {2-хлор-4-[(2-аминофенил)амино]фенил}(2-метилфенил)метанона (0,150 г, 0,45 ммоль) (описан в WO 98/32730) и триэтиламина (135 мг, 1,33 ммоль) в сухом ДХМ (5,0 мл). Раствор охлаждают до комнатной температуры. Реакционную смесь перемешивают в течение 3 ч, затем выливают в смесь NaHCO3 (водн.) и EtOAc. Водную фазу экстрагируют EtOAc (х2). Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, используя ДХМ в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): 196,5, 166,9, 156,7, 148,8, 139,0, 137,8, 135,1, 133,6, 131,8, 131,4, 131,2, 130,8, 129,9, 129,6, 128,9, 126,6, 126,3, 125,7, 125,3, 122,9, 122,4, 116,0, 114,5, 112,1, 67,3, 20,4.
Пример 89
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-3-феноксипропионамид (соединение 189)
Реакцию и обработку проводят по методике получения соединения 188, применяя 3-феноксипропионовую кислоту (81 мг, 0,49 ммоль) в качестве карбоновой кислоты. Очищают флэш-хроматографией, элюируя смесью петролейного эфира/EtOAc 1:1 с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): 196,7, 170,0, 157,9, 148,8, 139,2, 137,7, 134,9, 133,5, 132,4, 132,0, 131,2, 130,8, 129,6, 129,5, 128,5, 126,1, 125,9, 125,4, 124,9, 123,8, 121,5, 116,2, 114,5, 112,4, 63,9, 37,2, 20,4.
Пример 90
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетамид (соединение 190)
Реакцию и обработку проводят по методике получения соединения 188, применяя (1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетилхлорид (219 мг, 0,98 ммоль) в качестве хлорангидрида. Очищают флэш-хроматографией, элюируя смесью ДХМ/EtOAc 10:1 с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 167,8, 165,2, 148,9, 139,1, 137,9, 134,9, 134,6, 133,5, 132,1, 131,7, 131,3, 130,9, 129,7, 128,9, 126,4, 126,2, 125,4, 123,8, 123,0, 116,1, 112,3, 41,6, 20,5.
Пример 91
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)сукцинамовой кислоты 2-(2-метоксиэтокси)этиловый эфир (соединение 191)
Раствор диэтилазодикарбоксилата (40% в толуоле, 229 мкл, 0,5 ммоль) медленно добавляют к смеси N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-сукцинамовой кислоты (200 мг, 0,46 ммоль) (описана в WO 01/05746), трифенилфосфина (132 мг, 0,50 ммоль) и 2-(2-метоксиэтокси)этанола (55 мг, 0,46 ммоль) в сухом толуоле (2,5 мл). Реакционную смесь перемешивают в течение 48 ч и затем выливают в смесь воды и EtOAc. Водную фазу экстрагируют EtOAc (х2). Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, используя EtOAc в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,6, 173,0, 171,1, 148,7, 139,3, 137,7, 135,0, 133,6, 133,4, 131,2, 130,9, 130,8, 129,5, 128,4, 126,4, 125,4, 125,1, 124,7, 123,7, 116,4, 112,5, 71,8, 70,4, 68,9, 63,9, 59,0, 31,7, 29,7, 20,4.
Пример 92
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)- бензолсульфонамид (соединение 192)
К холодному (лед/вода) раствору {2-хлор-4-[(2-аминофенил)амино]фенил}(2-метилфенил)метанона (0,67 г, 2,0 ммоль) (описан в WO 98/32730) в пиридине (10 мл) добавляют бензолсульфонилхлорид (0,32 мл, 2,5 ммоль). Реакционную смесь нагревают до комнатной температуры. После перемешивания в течение 48 ч реакционную смесь выливают в ледяную воду. Осадок отфильтровывают, промывают водой и диэтиловым эфиром с получением неочищенного продукта. Кристаллизация из уксусной кислоты дает указанное в заголовке соединение в виде твердого вещества. Т.пл. 211-215°С.
13C ЯМР (ДМСО-d6): δ 195,2, 148,6, 139,4, 139,2, 136,4, 134,0, 133,2, 133,2, 132,3, 131,0, 130,6, 129,7, 128,7, 126,7, 126,6, 126,4, 126,2, 125,6, 124,6, 123,8, 114,6, 112,1, 19,7.
Пример 93
Уксусной кислоты (2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенилкарбамоил)метиловый эфир (соединение 193)
Реакцию и обработку проводят по методике получения соединения 188, применяя ацетоксиацетилхлорид (62 мкл, 0,58 ммоль) в качестве хлорангидрида. Очищают флэш-хроматографией, элюируя смесью петролейный эфир/EtOAc 1:1 с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 169,3, 165,8, 148,6, 138,9, 138,0, 135,0, 133,5, 131,7, 131,6, 131,4, 131,0, 129,7, 129,3, 126,6, 125,6, 125,4, 123,2, 116,0, 112,4, 63,2, 20,5.
Пример 94
1-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)пирролидин-2,5-дион (соединение 194)
Изо-бутилхлорформиат (60 мкл, 0,46 ммоль) добавляют к перемешиваемому раствору N-(2-{[3-хлор-4-(2-метилбензоил)фенил] амино}фенил)-сукцинамовой кислоты (200 мг, 0,46 ммоль) (описана в WO 01/05746) и 4-метилморфолина (51 мкл, 0,46 ммоль) в ТГФ (5,0 мл) при температуре -15°С. Через 5 мин при температуре 0°С реакционную смесь охлаждают до температуры -15°С и добавляют раствор этилдиизопропиламина (65 мкл, 0,46 ммоль) в ТГФ (5,0 мл). Полученную реакционную смесь хранят при температуре 0°С в течение 1 ч. Реакционную смесь перемешивают в течение 16 ч при КТ и затем выливают в смесь 1М HCl (водн.) и EtOAc. Органическую фазу промывают HCl (водн.) (х2). Органическую фазу промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, используя петролейный эфир/EtOAc 1:2 в качестве элюента с получением указанного в заголовке соединения в виде масла.
13С ЯМР (СDCl3): δ 196,5, 176,2, 147,8, 138,9, 138,0, 137,0, 134,8, 133,3, 131,3, 131,0, 130,3, 129,7, 129,5, 129,1, 126,3, 125,6, 125,4, 125,2, 116,9, 113,1, 28,6, 20,5.
Пример 95
2-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)этилпропионат (соединение 195)
Реакцию и обработку проводят по методике получения соединения 188, применяя пропионилхлорид (63 мг, 0,68 ммоль) в качестве хлорангидрида. Очищают флэш-хроматографией, элюируя ДХМ с получением указанного в заголовке соединения в виде масла.
13С ЯМР (СDCl3): δ 196,4, 174,8, 148,8, 139,3, 138,9, 137,8, 135,1, 133,7, 131,2, 131,1, 130,9, 130,7, 129,6, 128,6, 128,0, 125,3, 124,8, 123,2, 116,0, 112,7, 64,5, 31,2, 27,6, 20,4, 9,0.
Пример 96
2,2-диметилпропионовой кислоты (2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)этиловый эфир (соединение 196)
Реакцию и обработку проводят по методике получения соединения 188, применяя пивалоилхлорид (32 мг, 0,27 ммоль) в качестве хлорангидрида. Очищают флэш-хроматографией, элюируя смесью петролейный эфир/EtOAc 10:1 с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 179,2, 148,9, 139,4, 138,8, 137,8, 135,2, 133,6, 131,2, 131,1, 130,8, 130,7, 129,6, 128,6, 128,0, 125,3, 124,8, 123,3, 116,0, 112,6, 64,1, 38,8, 31,2, 27,2, 20,4.
Пример 97
[2-хлор-4-({2-[3-(тетрагидро-2Н-пиран-2-илокси)пропокси]-фенил}амино)фенил](2-метилфенил)метанон (соединение 197)
Реакцию и обработку проводят по методике получения соединения 101, применяя 2-[3-(2-бромфенокси)пропокси]тетрагидро-2Н-пиран (4,10 г) в качестве бромида. Очищают флэш-хроматографией, элюируя петролейным эфиром/EtOAc 4:1 с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 149,2, 147,4, 139,2, 137,9, 134,9, 133,4, 131,3, 130,8, 130,1, 129,7, 129,3, 125,4, 123,0, 120,9, 118,6, 117,1, 113,5, 112,4, 99,1, 65,8, 64,0, 62,6, 30,7, 29,6, 25,4, 20,4, 19,7.
Пример 98
{2-хлор-4-{[2-(3-гидроксипропокси)фенил]амино}фенил)(2-метилфенил)метанон (соединение 198)
Реакцию и обработку проводят по методике получения соединения 102. Исходными соединениями являются соединение 197 (2,56 г) в МеОН (5,0 мл) и 4-толуолсульфокислота (1,52 г). Очищают флэш-хроматографией, элюируя смесью петролейный эфир/EtOAc 4:1 с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 149,5, 147,4, 139,2, 137,9, 134,9, 133,4, 131,3, 130,8, 130,1, 129,7, 129,3, 125,4, 123,3, 121,2, 119,1, 117,0, 113,5, 112,8, 66,4, 60,1, 32,0, 20,5.
Пример 99
трет-бутил 2-(2-{[3-хлор-4-(2-метилбензоил)-фенил]амино}фенил)этилкарбонат (соединение 199)
Соединение 102 (200 мг) растворяют в сухом триэтиламине (3,0 мл) и добавляют {[(трет-бутоксикарбонил)окси]амино}- (фенил)ацетонитрил (148 мг). Раствор перемешивают при температуре 70°С в течение 5 ч. Реакционную смесь охлаждают до комнатной температуры и затем выливают в смесь воды и EtOAc. Водную фазу экстрагируют EtOAc (х2). Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, используя петролейный эфир/диэтиловый эфир 8:1 в качестве элюента с получением указанного в заголовке соединения.
13С ЯМР (СDCl3): δ 196,5, 153,5, 148,8, 139,4, 139,2, 137,8, 135,2, 133,7, 131,3, 131,2, 130,8, 130,7, 129,6, 128,5, 128,0, 125,3, 124,6, 122,6, 116,4, 112,6, 82,9, 67,5, 31,7, 27,8, 20,4.
Пример 100
2-({[(5-бром-2-{[3-хлор-4-(2-метилбензоил)фенил]амино}- фенил)амино]карбонил}амино)этил 2-метилакрилат (соединение 200)
2-Изоцианатоэтил 2-метилакрилат (0,31 г, 2,2 ммоль) медленно добавляют к раствору {4-[(2-амино-4-бромфенил)амино]-2-хлорфенил}(2-метилфенил)метанона (0,60 г, 1,44 ммоль) (описан в WO 01/05744) в сухом пиридине (3,00 мл). Раствор перемешивают при комнатной температуре в течение 6 ч, после чего его выливают в смесь воды и EtOAc. Водную фазу экстрагируют EtOAc (х2). Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, используя петролейный эфир/EtOAc 4:1 в качестве элюента с получением указанного в заголовке соединения в виде светло-коричневого твердого вещества.
13С ЯМР (СDCl3): δ 197,4, 167,6, 155,7, 149,0, 138,8, 137,8, 135,8, 135,0, 134,8, 133,6, 131,4, 131,2, 130,1, 129,8, 128,5, 127,3, 126,3, 126,1, 125,5, 125,4, 118,7, 116,3, 112,5, 63,7, 39,6, 20,5, 18,3.
Пример 101
(4-{[4-бром-2-(2-гидроксиэтил)фенил]амино}2-хлорфенил)(2-метилфенил)метанон (соединение 201)
Реакцию и обработку проводят по методике, описанной для получения соединения 158, применяя соединение 102 (0,10 г, 0,22 ммоль) в ДМСО (3,0 мл) и 48% водном HBr (0,4 мл, 6,70 ммоль). Время реакции составляет 2 дня. Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc/петролейный эфир 1:4 в качестве элюента. Это дает указанное в заголовке соединение в виде желтого масла.
13С ЯМР (СDCl3): δ 196,6, 148,3, 139,3, 139,0, 137,8, 135,5, 135,2, 133,9, 133,7, 131,2, 130,8, 130,4, 129,6, 128,4, 125,3, 123,7, 116,7, 116,2, 112,5, 64,9, 34,4, 20,4.
Пример 102
3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенокси)пропилацетат (соединение 202)
Ангидрид уксусной кислоты (72 мкл, 0,77 ммоль) добавляют к раствору соединения 198 (121 мг, 0,31 ммоль) в 100% уксусной кислоты (1,0 мл) при температуре 20°С при перемешивании. Реакционную смесь перемешивают в течение ночи при температуре 80°С и затем выливают в смесь воды и EtOAc. Водную фазу экстрагируют EtOAc (х2). Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, используя петролейный эфир/EtOAc 4:1 в качестве элюента с получением указанного в заголовке соединения.
13С ЯМР (СDCl3): δ 196,8, 171,5, 149,5, 147,8, 139,6, 138,3, 135,3, 133,8, 131,7, 131,2, 130,5, 130,1, 129,6, 125,8, 123,5, 121,5, 119,3, 117,5, 114,0, 112,8, 65,4, 61,4, 29,0, 21,4, 20,8.
Пример 103
[2-хлор-4-({2-[3-(морфолин-4-ил)пропокси]фенил}амино)фенил](2-метилфенил)метанон (соединение 203)
Соединение 198 (100 мг, 0,25 ммоль) растворяют в сухом пиридине (130 мкл) в атмосфере аргона. Раствор охлаждают на ледяной бане и добавляют 4-толуолсульфонилхлорид (48 мг, 0,25 ммоль). Реакционную смесь гасят водой через 45 мин при комнатной температуре. Водную фазу дважды экстрагируют EtOAc. Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, используя петролейный эфир/EtOAc 4:1 в качестве элюента. Тозилат растворяют в сухом ДМФ (2,0 мл) и добавляют морфолин (17 мкл, 0,19 ммоль). Реакционную смесь перемешивают в течение 48 ч при комнатной температуре и затем выливают в смесь воды и EtOAc. Водную фазу экстрагируют EtOAc (х2). Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, используя ДХМ/МеОН 100:4 в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 149,4, 147,4, 139,2, 137,9, 134,9, 133,4, 131,3, 130,8, 129,9, 129,7, 129,3, 125,4, 123,2, 120,9, 119,0, 117,1, 113,6, 112,3, 66,9, 66,9, 55,5, 53,8, 26,4, 20,5.
Пример 104
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-(4-феноксибутил)сукцинамид (соединение 204)
4-(4,6-Диметокси-1,3,5-триазин-2-ил)-4-метилморфолин-4-иум хлорид (DMT-MM) (69 мг, 0,25 ммоль) добавляют к раствору N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-сукцинамовой кислоты (100 мг, 0,23 ммоль) (описана в WO 01/05746) и 4-феноксибутиламина (30 мг, 0,25 ммоль) в метаноле (2,0 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь выливают в 1 н. HCl (водн.) и экстрагируют EtOAc (х2). Объединенные органические фазы промывают водой, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, используя ДХМ/МеОН/NH3 (водн.) 95:5:0,5 в качестве элюента с получением указанного в заголовке соединения в виде желтого твердого вещества.
13С ЯМР (СDCl3): δ 196,6, 172,4, 171,8, 158,8, 148,6, 139,2, 137,8, 134,9, 133,5, 133,4, 131,2, 130,8, 130,6, 129,7, 129,5, 128,6, 126,3, 125,4, 124,9, 124,7, 123,2, 120,8, 116,6, 114,5, 112,4, 67,2, 39,5, 32,4, 31,5, 26,7, 26,3, 20,4.
Пример 105
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-(6-гидроксигексил)сукцинамид (соединение 205)
4-(4,6-Диметокси-1,3,5-триазин-2-ил)-4-метилморфолин-4-иум хлорид (DMT-MM) (138 мг, 0,50 ммоль) добавляют к раствору N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-сукцинамовой кислоты (200 мг, 0,46 ммоль) (описана в WO 01/05746) и 6-аминогексанола (60 мг, 0,51 ммоль) в ТГФ (4,0 мл). Реакционную смесь перемешивают при комнатной температуре в течение 18 ч. Реакционную смесь выливают в 1 н. HCl (водн.) и экстрагируют EtOAc (х2). Объединенные органические фазы промывают водой, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, используя ДХМ/МеОН/NH3 (водн.) 95:5:0,5 в качестве элюента с получением указанного в заголовке соединения в виде желтого твердого вещества.
13С ЯМР (СDCl3): δ 196,7, 172,5, 171,8, 148,6, 139,2, 137,8, 134,9, 133,5, 133,4, 131,3, 130,8, 130,5, 129,7, 128,6, 126,2, 125,4, 124,9, 124,7, 123,0, 116,6, 112,5, 62,4, 39,6, 32,5, 32,3, 31,5, 29,4, 26,2, 25,1, 20,4.
Пример 106
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-(2,3-дигидроксипропил)сукцинамид (соединение 206)
Реакцию и обработку проводят по методике получения соединения 204. Исходными соединениями являются N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-сукцинамовая кислота (100 мг, 0,46 ммоль) (описана в WO 01/05746) и 3-аминопропан-1,2-диол (23 мг, 0,25 ммоль). Неочищенный продукт очищают флэш-хроматографией, используя ДХМ/МеОН/NH3 (водн.) 90:10:0,5 в качестве элюента с получением указанного в заголовке соединения в виде желтого твердого вещества.
13С ЯМР (СDCl3): δ 197,1, 173,8, 172,2, 148,8, 138,9, 137,9, 134,7, 133,4, 133,3, 131,3, 131,1, 130,7, 129,8, 128,4, 126,4, 125,4, 124,9, 123,5, 70,9, 63,9, 42,3, 32,0, 31,0, 20,5.
Пример 107
трет-бутил (1R)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)-1-(гидроксиметил)пропилкарбамат (соединение 207)
Трифторуксусную кислоту (78 мкл, 0,78 ммоль) добавляют к раствору соединения 434 (213 мг, 0,39 ммоль) во влажном МеОН (2,50 мл). Реакционную смесь нагревают при кипении с обратным холодильником в течение 10 ч, затем выливают в смесь насыщенного NaHCO3 и EtOAc. Органическую фазу промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, используя петролейный эфир/EtOAc 2:1 в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 156,7, 149,8, 139,5, 138,2, 137,7, 136,0, 135,2, 133,8, 131,2, 130,6, 130,5, 129,5, 127,9, 127,3, 125,5, 125,3, 124,6, 115,9, 112,1, 80,1, 65,4, 52,2, 32,6, 28,4, 27,5, 20,4.
Пример 108
Диэтил 6-[3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенилкарбамоил)пропиониламино]гексилфосфат (соединение 208)
Йодин (53 мг, 0,21 ммоль) добавляют при температуре 0°С к раствору триэтилфосфита (36 мкл, 0,21 ммоль) в безводном ДХМ (0,50 мл). После перемешивания в течение 15 мин при температуре 0°С и в течение 5 мин при комнатной температуре, этот раствор добавляют, через канюлю, к раствору соединения 205 (101 мг, 0,19 ммоль) в безводном пиридине (61 мкл, 0,75 ммоль). После перемешивания в течение 90 мин при температуре 0°С и в течение еще 90 мин при комнатной температуре реакционную смесь выливают в воду и ДХМ. Органическую фазу промывают водой, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, используя ДХМ/МеОН 97:3 в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,6, 172,5, 171,9, 148,7, 139,3, 137,8, 134,9, 133,5, 133,4, 131,2, 130,8, 129,6, 128,5, 126,1, 125,4, 124,9, 124,6, 123,1, 116,6, 112,4, 67,3, 63,8, 39,3, 32,7, 31,6, 29,9, 29,2, 25,9, 24,7, 20,4, 16,1.
Пример 109
Этил N-({[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)проп-2-енил]амино}карбонил)глицинат (соединение 209)
Этил изоцианатоацетат (45 мг, 0,35 ммоль) добавляют к раствору соединения 111 (100 мг, 0,27 ммоль) в сухом ДХМ (1,0 мл). Этот раствор перемешивают при комнатной температуре в течение 5 ч, после чего его выливают в смесь воды и ДХМ. Водную фазу экстрагируют ДХМ (х2). Объединенные органические фазы промывают солевым раствором, сушат (MgSO4), фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией, используя петролейный эфир/EtOAc 4:1 в качестве элюента с получением указанного в заголовке соединения.
13С ЯМР (СDCl3): δ 196,8, 172,0, 158,6, 149,4, 139,4, 137,6, 137,5, 135,0, 133,6, 131,3, 131,2, 130,8, 129,5, 129,2, 128,4, 127,8, 127,2, 126,1, 125,4, 124,9, 123,4, 116,5, 112,5, 61,5, 42,6, 42,2, 20,4, 14,1.
Пример 110
трет-бутил 2-(2-{[3-хлор-4-(2-метилбензоил)-фенил]амино}фенил)этил(метил)карбамат (соединение 210)
Реакцию и обработку проводят по методике получения соединения 101. Исходными соединениями являются (4-амино-2-хлорфенил)(2-метилфенил)метанон (211 мг, 0,86 ммоль) (описан в WO 01/42189 А1) и соединение 435 (324 мг, 1,03 ммоль). Неочищенный продукт очищают флэш-хроматографией, применяя петролейный эфир/EtOAc 6:1 в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 149,3, 139,7, 139,4, 137,7, 135,2, 133,7, 131,1, 130,5, 129,5, 127,5, 125,3, 123,5, 122,0, 116,4, 112,2, 80,4, 50,0, 35,1, 31,1, 28,5, 20,3.
Пример 111
N-(5-бром-2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-
(6-гидроксигексил)сукцинамид (соединение 211)
Реакцию и обработку проводят по методике получения соединения 205. Исходными соединениями являются N-(5-бром-2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-сукцинамовая кислота (600 мг, 1,16 ммоль) (получают по методике, описанной в WO 01/05746) и 6-аминогексанол (151 мг, 1,28 ммоль). Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc в качестве элюента с получением указанного в заголовке соединения в виде желтого твердого вещества.
13С ЯМР (СDCl3): δ 196,7, 172,6, 171,8, 148,2, 139,0, 138,0, 134,9, 133,3, 132,1, 131,4, 131,0, 129,8, 129,2, 128,9, 127,2, 125,4, 124,3, 117,0, 116,8, 112,7, 62,4, 39,7, 32,5, 32,3, 31,4, 29,4, 26,3, 25,1, 20,5.
Пример 112
N-(5-бром-2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-(2,3-дигидроксипропил)сукцинамид (соединение 212)
Реакцию и обработку проводят по методике получения соединения 211. Исходными соединениями являются N-(5-бром-2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-сукцинамовая кислота (600 мг, 1,16 ммоль) (получают по методике, описанной в WO 01/05746) и 3-амино-1,2-пропандиол (117 мг, 1,28 ммоль). Неочищенный продукт очищают флэш-хроматографией, применяя EtOAc, затем EtOAc/МеОН 95:5 в качестве элюента с получением указанного в заголовке соединения в виде твердого вещества.
13С ЯМР (СDCl3): δ 197,2, 173,9, 172,2, 148,4, 138,7, 138,1, 134,6, 133,3, 132,3, 132,0, 131,4, 131,3, 130,0, 129,0, 127,2, 125,5, 124,9, 117,3, 116,8, 112,7, 70,9, 64,0, 42,4, 32,1, 31,6, 20,6.
Пример 113
(2Z)-N-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)проп-2-енил]-2-(2,5-диоксиимидазолидин-4-илиден)ацетамид (соединение 213)
Смесь (2Z)-(2,5-диоксоимидазолидин-4-илиден)уксусной кислоты (35 мг, 0,22 ммоль) и соединения 111 (75 мг, 0,20) в ТГФ (1,5 мл) перемешивают при температуре 20°С в течение 10 мин. К смеси добавляют DMTMM (40 мг) и перемешивают в течение 20 ч при температуре 20°С. Реакционную смесь выливают в воду и экстрагируют EtOAc (х3). Органические фазы объединяют и промывают солевым раствором и сушат с MgSO4. Неочищенный продукт очищают флэш-хроматографией, элюируя петролейным эфиром/EtOAc 2:3, затем EtOAc с получением указанного в заголовке соединения в виде желтой пены.
13С ЯМР (СDCl3): δ 195,1, 164,7, 164,4, 154,6, 150,4, 139,3, 137,3, 137,1, 136,3, 133,6, 131,8, 130,9, 130,5, 128,7, 128,5, 127,9, 126,5, 126,2, 125,9, 125,5, 125,4, 125,1, 114,7, 111,5, 97,6, 40,8, 19,7.
Пример 114
(2-хлор-4-{[2-(дифторметил)фенил]амино}фенил)
(2-метилфенил)метанон (соединение 214)
Реакцию и обработку проводят по методике получения соединения 101. Исходными соединениями являются (4-амино-2-хлорфенил)(2-метилфенил)метанон (270 мг, 1,10 ммоль) (описан в WO 01/42189 А1) и соединение 1-бром-2-(дифторметокси)бензол (324 мг, 1,03 ммоль). Неочищенный продукт очищают флэш-хроматографией, применяя петролейный эфир/EtOAc 9:1 в качестве элюента с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 146,2, 141,6, 138,8, 138,2, 134,8, 133,1, 132,9, 131,4, 131,1, 130,7, 130,0, 126,3, 125,4, 123,1, 120,3, 119,7, 117,8, 116,3, 114,4, 20,6.

Пример 115
3-{[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-фенил]этил}-1-метилимидазолидин-2,4-дион (соединение 215)
Смесь (4-амино-2-хлорфенил)(2-метилфенил)метанона (61 мг, 0,25 ммоль) (описан в WO 01/42189 А1), соединения 436 (89 мг, 0,30 ммоль), BINAP (5 мг), Pd2(дба)3 (5 мг) и Cs2CO3 (114 мг, 0,35 ммоль) в 1,4-диоксане (5 мл) нагревают до температуры 120°С при перемешивании в течение 3 дней. Реакционную смесь фильтруют. Полученный раствор концентрируют в вакууме. Остаток очищают хроматографией (петролейный эфир/этилацетат 1:1) с получением желаемого продукта, который не является чистым. Неочищенный продукт очищают препаративной ТСХ (петролейный эфир/этилацетат 2:1) с получением чистого указанного в заголовке соединения в виде коричневатого масла.
13С ЯМР (СDCl3): δ 7,53 (д, 1H), 7,4-7,0 (м, 9H), 6,95 (шир.c, 1H), 6,89 (дд, 1H), 3,80 (c, 2H), 3,79 (м, 2H), 3,08 (м, 2H), 2,91 (c, 3H), 2,44 (c, 3H).
Пример 116
3-{[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)- фенил]этил}-5,5-диметилоксазолин-2,4-дион (соединение 216)
Смесь (4-амино-2-хлорфенил)(2-метилфенил)метанона (31 мг, 0,13 ммоль) (описан в WO 01/42189 А1) и соединения 437 (47 мг, 0,15 ммоль) обрабатывают по методике примера получения соединения 215. Очистку проводят флэш-хроматографией (петролейный эфир/этилацетат 4:1) с получением указанного в заголовке соединения в виде коричневатого масла.
13С ЯМР (СDCl3): δ 196,5, 176,1, 154,6, 149,0, 139,3, 139,0, 137,9, 135,1, 133,6, 131,4, 131,2, 131,0, 130,7, 129,6, 128,8, 128,6, 125,4, 125,3, 124,7, 116,0, 112,6, 84,0, 39,0, 29,8, 23,4, 20,4.
Пример 117
4-{[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-фенил]этил}морфолин-3,5-дион (соединение 217)
Смесь (4-амино-2-хлорфенил)(2-метилфенил)метанона (61 мг, 0,25 ммоль) (описан в WO 01/42189 А1) и соединения 438 (89 мг, 0,30 ммоль) обрабатывают по методике примера получения соединения 215. Очистку проводят флэш-хроматографией (петролейный эфир/этилацетат 4:1) с получением указанного в заголовке соединения в виде коричневатого масла.
13С ЯМР (СDCl3): δ 196,5, 169,5, 148,5, 139,3, 139,0, 137,8, 135,1, 133,6, 131,2, 131,2, 130,7, 129,8, 129,6, 128,8, 128,2, 125,3, 124,1, 122,2, 116,3, 113,0, 77,2, 67,6, 38,6, 30,3, 20,4.
Пример 118
1-{[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-фенил]этил}пиперидин-2,6-дион (соединение 218)
Смесь (4-амино-2-хлорфенил)(2-метилфенил)метанона (61 мг, 0,25 ммоль) (описан в WO 01/42189 А1) и соединения 439 (89 мг, 0,30 ммоль) обрабатывают по методике примера получения соединения 215. Очистку проводят флэш-хроматографией (петролейный эфир/этилацетат 2:1) с получением указанного в заголовке соединения в виде коричневатого масла.
13С ЯМР (СDCl3): δ 196,5, 172,9, 148,6, 139,4, 139,1, 137,8, 135,0, 133,6, 131,2, 130,7, 130,2, 129,7, 129,6, 128,5, 127,9, 125,3, 123,6, 121,4, 116,4, 113,1, 39,6, 32,7, 30,6, 20,4, 17,1.
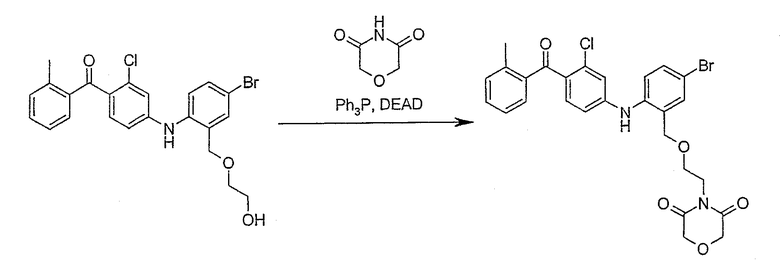
Пример 119
4-(2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил)морфолин-3,5-дион (соединение 219)
К раствору соединения 158 (47 мг, 0,1 ммоль), морфолин-3,5-диона (16 мг, 0.14 ммоль) и трифенилфосфина (37 мг, 0,14 ммоль) в ТГФ (5 мл) добавляют раствор диэтилазодикарбоксилата (40% в толуоле, 0,1 мл, 0,23 ммоль) при КТ. Реакционный раствор перемешивают при той же температуре в течение 18 ч и концентрируют в вакууме. Остаток очищают хроматографией (петролейный эфир/этилацетат 1:1) с получением указанного в заголовке соединения, которое не является чистым. Продукт очищают препаративной ТСХ (петролейный эфир/этилацетат 1:1) с получением чистого указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 169,4, 147,0, 140,0, 139,1, 138,0, 134,9, 133,4, 132,2, 131,3, 130,9, 129,9, 129,8, 125,4, 121,4, 117,4, 114,8, 113,9, 71,1, 67,7, 66,8, 38,1, 20,5.
Пример 120
1-(2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}этил)пирролидин-2,5-дион (соединение 220)
Соединение 158 (47 мг, 0,1 ммоль), сукцинимид (14 мг, 0,14 ммоль) обрабатывают по методике получения соединения 219. Очистку проводят флэш-хроматографией (петролейный эфир/этилацетат 1:1) с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 177,4, 147,2, 139,9, 139,0, 138,0, 134,9, 133,5, 133,4, 132,2, 131,3, 130,9, 130,0, 129,8, 129,6, 125,4, 121,7, 117,3, 114,9, 113,8, 70,8, 66,6, 38,5, 28,2, 20,5.
Пример 121
Этил 2-[3-(2-{5-бром-[2-({3-хлор-4-[(2-метилфенил)карбонил]-фенил}амино)бензилокси}этил)-2,4,5-триоксоимидазолидин-1-ил]ацетат (соединение 221)
Соединение 158 (47 мг, 0,1 ммоль) и этил 2,4,5-триоксоимидазолидин-1-ацетат (28 мг, 0,14 ммоль) обрабатывают по методике получения соединения 219. Очистку проводят флэш-хроматографией (петролейный эфир/этилацетат 1:1) с получением указанного в заголовке соединения, которое не является чистым. Продукт очищают хроматографией (CH2Cl2/этилацетат 15:1) с получением указанного в заголовке соединения в виде желтой пены.
13С ЯМР (СDCl3): δ 165,8, 153,1, 146,9, 139,9, 139,0, 138,1, 134,8, 133,4, 133,3, 132,4, 131,4, 131,0, 130,0, 129,8, 129,7, 125,4, 121,7, 117,4, 115,0, 114,0, 71,1, 66,1, 62,6, 39,8, 39,3, 20,5, 14,0.
Пример 122
3-(2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)бензил]-окси}этил)имидазолин-2,4-дион (соединение 222)
Соединение 158 (47 мг, 0,1 ммоль), гидантоин (14 мг, 0,14 ммоль) обрабатывают по методике получения соединения 219. Очистку проводят флэш-хроматографией (петролейный эфир/этилацетат 1:1) с получением указанного в заголовке соединения, которое не является чистым. Продукт очищают препаративной ТСХ (петролейный эфир/этилацетат 1:1) с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 171,3, 157,8, 147,4, 139,9, 139,1, 138,0, 134,9, 133,5, 133,4, 132,2, 131,3, 130,9, 130,2, 129,8, 129,5, 125,4, 121,9, 117,3, 115,0, 113,7, 70,9, 66,9, 46,4, 38,5, 20,5.
Пример 123
1-(2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)бензил]-окси}этил)-3,4-цис-диацетоксипирролидин-2,5-дион
(соединение 223)
Соединение 158 (67 мг, 0,1 ммоль) и 2,3-цис-диацетоксисукцинимид (30 мг, 0,14 ммоль) обрабатывают по методике получения соединения 219. Очистку проводят флэш-хроматографией (CH2Cl2/этилацетат 1:20) с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 169,9, 169,5, 147,1, 139,9, 139,0, 138,0, 134,8, 133,5, 133,3, 132,3, 131,3, 130,9, 130,0, 129,8, 125,4, 121,7, 117,5, 115,0, 113,9, 72,7, 71,0, 66,1, 39,2, 20,5, 20,3.
Пример 124
3-(2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил)тиазолин-2,4-дион (соединение 224)
Соединение 158 (47 мг, 0,1 ммоль) и 2,4-тиазолидинон (16 мг, 0,14 ммоль) обрабатывают по методике получения соединения 219. Очистку проводят флэш-хроматографией (петролейный эфир/этилацетат 3:1) с получением указанного в заголовке соединения, которое не является чистым. Продукт очищают препаративной ТСХ (петролейный эфир/этилацетат 3:1) с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 172,0, 171,6, 147,0, 139,9, 139,0, 138,0, 134,9, 133,4, 133,4, 132,3, 131,3, 130,9, 129,8, 125,4, 121,6, 117,4, 114,9, 114,0, 71,0, 66,3, 41,5, 33,8, 20,5.
Пример 125
3-(2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)бензил]окси}этил)-1-метилимидазолидин-2,4-дион (соединение 225)
Соединение 158 (47 мг, 0,1 ммоль) и метилгидантоин (16 мг, 0,14 ммоль) обрабатывают по методике получения соединения 219. Очистку проводят флэш-хроматографией (петролейный эфир/этилацетат 1:1) с получением указанного в заголовке соединения, которое не является чистым. Продукт очищают препаративной ТСХ (петролейный эфир/этилацетат 1:1) с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,5, 170,0, 156,7, 147,4, 140,0, 139,1, 137,9, 134,9, 133,6, 133,4, 132,2, 131,3, 130,9, 130,3, 129,7, 129,5, 125,4, 121,9, 117,4, 115,0, 113,7, 70,8, 67,2, 51,7, 38,7, 29,7, 20,5.
Пример 126
1-(2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил)имидазолидин-2,4,5-трион (соединение 226)
Соединение 158 (47 мг, 0,1 ммоль) и парабановая кислота (16 мг, 0,14 ммоль) обрабатывают по методике получения соединения 219. Очистку проводят флэш-хроматографией (CH2Cl2/этилацетат 4:1) с получением указанного в заголовке соединения, которое не является чистым. Продукт очищают препаративной ТСХ (CH2Cl2/этилацетат 20:1) с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 156,4, 153,8, 146,8, 139,7, 138,9, 138,1, 134,8, 133,3, 132,4, 131,4, 131,0, 130,0, 129,9, 129,8, 125,4, 121,8, 117,4, 115,1, 113,9, 70,9, 66,1, 39,2, 20,5.
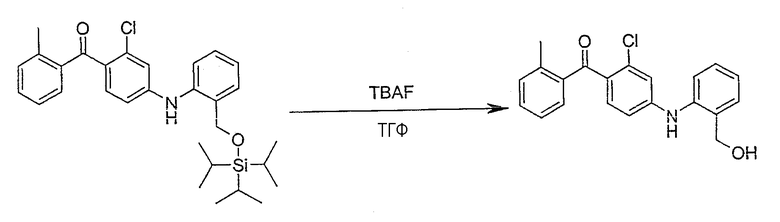
Пример 127
(2-хлор-4-{[2-(гидроксиметил)фенил]амино}фенил)
(2-метилфенил)метанон (соединение 227)
Соединение 441 (3,21 г, 6,32 ммоль) и TBAF·3H2O (2,99 г, 6,32 ммоль) растворяют в ТГФ (20 мл). Полученный реакционный раствор перемешивают при КТ в течение 0,5 ч. После реакции раствор концентрируют в вакууме. Остаток повторно растворяют в CH2Cl2 и промывают Н2О. Водную фазу дважды экстрагируют CH2Cl2. Объединенные органические фазы сушат над MgSO4 и концентрируют в вакууме. Неочищенный продукт очищают хроматографией (петролейный эфир/этилацетат 2:1) с получением указанного в заголовке соединения в виде красноватой пены.
13С ЯМР (СDCl3): δ 196,7, 147,5, 140,4, 139,1, 137,9, 135,0, 133,5, 131,3, 130,9, 130,8, 129,7, 129,7, 129,2, 129,0, 125,4, 123,1, 120,1, 117,0, 113,4, 64,3, 20,4.
Пример 128
2-{[3-хлор-4-(2-метилбензоил)фенил]амино}бензилацетат
(соединение 228)
К раствору соединения 227 (50 мг, 0,14 ммоль), Et3N (0,1 мл) и ДМАП (3 мг) добавляют Ac2O (0,05 мл) при КТ. Реакционный раствор перемешивают при той же температуре в течение 1 ч. После реакции раствор концентрируют в вакууме. Остаток повторно растворяют в CH2Cl2 и промывают насыщенным водным раствором бикарбоната натрия. Водную фазу дважды экстрагируют CH2Cl2. Объединенные органические фазы сушат над MgSO4 и концентрируют в вакууме. Остаток фильтруют через короткую колонку силикагеля (этилацетат/петролейный эфир 1:2) с получением указанного в заголовке соединения в виде желтого масла.
13С ЯМР (СDCl3): δ 196,4, 171,8, 148,1, 139,7, 139,2, 137,8, 135,1, 133,5, 132,3, 131,2, 130,8, 130,1, 129,6, 128,9, 128,0, 125,3, 124,2, 122,1 116,5, 113,0, 63,6, 21,0, 20,4.
Соединения по изобретению испытывали следующим образом:
Растворимость (фосфатный буфер с рН 7)
Протокол эксперимента по определению растворимости:
Испытываемое соединение встряхивали в фосфатном буфере, имеющем рН 7, в течение одного часа при комнатной температуре. Затем смесь фильтровали или центрифугировали и фильтрат анализировали методом ВЭЖХ. Затем рассчитывали концентрацию соединения путем сравнения площадей на хроматограммах со стандартными растворами известных концентраций этого же соединения после детекции при помощи УФ или фотодиодного детектора.
Модель in vivo скрининга ЛПС-индуцированного TNF-α ответа у мышей, при этом такой ответ отражает биодоступность этих соединений
Протокол эксперимента модели in vivo скрининга ЛПС-индуцированного TNF-α (ФНО-α) ответа у мышей:
Группы из 6 мышей (С3Н/HeN, самки в возрасте 8 недель (20 г) Bomholygaard) получали дозу испытываемых соединений, суспендированных в носителе, за 1 час до введения ЛПС (ЛПС из E.coli 055:85, L-4005, Sigma). На момент времени 0 мышам интраперитонеально вводили 1,0 мг ЛПС/кг. После анестезии Hypnorm/Dormicum у мышей отбирали кровь из сплетения венозных сосудов вокруг глазницы через 80-90 минут после введения ЛПС. Образцы крови помещали в EDTA-стабилизированные пробирки и центрифугировали при 4000 об/мин в течение 10 минут при 4°С.
Уровень содержания TNF-α в плазме анализировали при помощи ELISA. В качестве сравнительного соединения использовали соединение 181, описанное в WO 98/32730.
Уровень содержания TNF-α в плазме определяли с использованием сэндвич-метода ELISA. Микротитровальные планшеты покрывали моноклональными антителами против мышиного TNF-α, промывали и блокировали казеиновым буфером. В лунки микротитровальных планшетов добавляли образцы стандартных рекомбинантных мышиных TNF-α и осуществляли инкубацию. Все стандартные образцы испытывали в трех повторах, все образцы плазмы испытывали один раз. После инкубации образца и стандарта планшеты промывали и инкубировали с биотинилированным поликлональным вторичным антителом против мышиного TNF-α и промывали. Во все лунки добавляли ферментный конъюгат и инкубировали. Добавляли субстрат и реакцию фермент/субстрат останавливали через 15 минут при комнатной температуре при помощи 1М Н2SO4. Проявление цвета (ОП) измеряли при 450 нм на считывающем устройстве для ELISA и вычитали фоновую ОП при 620 нм.
Эксперименты считались достоверными, если группа, обработанная сравнительным соединением, показывала существенное ингибирование (р<0,05) TNF-α ответа в сравнении с ЛПС-обработанной контрольной группой. Результаты испытываемых соединений представлены в виде процента ингибирования в сравнении с ЛПС-обработанной контрольной группой. Соединения испытывали в дозе 10 мг/кг. Для сравнения групп, обработанных лекарственным средством, с ЛПС-обработанной контрольной группой использовали критерий Mann-Whitney (p<0,05). Результаты представлены в Таблице 2.
D1 - WO 01/42189; D2 - WO 01/05749; D3 - WO01/05746; D4 - WO98/32730; D5 - WO 01/05751
Из представленных данных очевидно, что соединения в соответствии с настоящим изобретением показывают значительную биологическую активность in vivo в отношении ингибирования ЛПС-индуцированной продукции TNF-α на мышиной модели и/или улучшение растворимости в сравнении с ближайшими аналогами.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИАЗОЛЗАМЕЩЕННЫЕ АМИНОБЕНЗОФЕНОНОВЫЕ СОЕДИНЕНИЯ | 2005 |
|
RU2394818C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ АМИНОБЕНЗОФЕНОНА | 2004 |
|
RU2396250C2 |
| АМИНОБЕНЗОФЕНОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ИНТЕРЛЕЙКИНА IL-1БЕТА И ФАКТОРА НЕКРОЗА ОПУХОЛЕЙ TNF-АЛЬФА | 2000 |
|
RU2240995C2 |
| АМИНОБЕНЗОФЕНОНЫ КАК ИНГИБИТОРЫ IL-1β И TNF-α | 2000 |
|
RU2239628C2 |
| АМИНОБЕНЗОФЕНОНЫ КАК ИНГИБИТОРЫ IL-1 БЕТА И TNF-АЛЬФА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2000 |
|
RU2247719C2 |
| АНТАГОНИСТЫ РЕЦЕПТОРА ВАЗОПРЕССИНА V | 2005 |
|
RU2370497C2 |
| ПРОИЗВОДНЫЕ ИЗОКСАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ 11-БЕТА-ГИДРОКСИСТЕРОИДДЕГИДРОГЕНАЗЫ 1 ТИПА | 2009 |
|
RU2480467C2 |
| АМИНОБЕНЗОФЕНОНЫ КАК ИНГИБИТОРЫ ИЛ-β И ТНФ-α | 2000 |
|
RU2260422C2 |
| МАКРОЦИКЛИЧЕСКИЕ АНТИБИОТИКИ ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ | 2020 |
|
RU2834484C2 |
| КАТАЛИТИЧЕСКИЕ КОМПЛЕКСЫ С КАРБЕНОВЫМ ЛИГАНДОМ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В РЕАКЦИИ МЕТАТЕЗИСА | 2014 |
|
RU2644556C2 |
Изобретение относится к новым производным аминобензофенонов общей формулы I, обладающих свойствами ингибитора интерлейкина-1β(IL-1β) и фактора некроза опухоли(ТМР-α). Соединения могут найти применение для получения лекарственного средства для лечения и профилактики заболеваний, связанных с регулирующей системой цитокинов, таких как воспалительные заболевания. Изобретение также относится к фармацевтическим композициям и применению. В общей формуле I
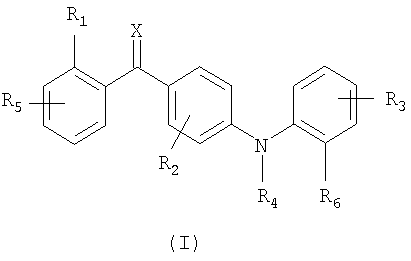
Х является кислородом; R1 является (C1-C3)алкилом, R2 является одним или более, одинаковыми или разными заместителями, выбранными из группы, включающей водород и галоген; R3 является одним или более, одинаковыми или разными заместителями, выбранными из группы, включающей водород и галоген, R4 является водородом, R5 является водородом, R6 является (C1-C10)алкил-гетероциклилом, (C1-C10)алкилом, (C2-C10)олефиновой группой, гетероциклилом, Y1R21, Y2R22 или Y4R24; где (C1-C10)алкил, (C2-C10)олефиновая группа замещены одним или более одинаковыми или разными заместителями, представленными R7 и где (C1-C10)алкил-гетероциклил, гетероциклил необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R7; при этом гетероциклил сам по себе и в (C1-C10)алкил-гетероциклиле означает 5-6-членный насыщенный или частично ненасыщенный гетероциклил, возможно конденсированный с бензольным кольцом и содержащий 1-2 гетероатома, выбираемых из азота, кислорода и серы. Другие значения радикалов указаны в формуле изобретения. 4 н. и 9 з.п. ф-лы, 3 табл.
1. Соединение общей формулы I

где Х является кислородом;
R1 является (C1-C3)алкилом,
R2 является одним или более, одинаковыми или разными заместителями, выбранными из группы, включающей водород и галоген;
R3 является одним или более, одинаковыми или разными заместителями, выбранными из группы, включающей водород и галоген,
R4 является водородом,
R5 является водородом,
R6 является (C1-C10)алкил-гетероциклилом, (C1-C10)алкилом, (C2-C10)олефиновой группой, гетероциклилом, Y1R21, Y2R22 или Y4R24; где (C1-C10)алкил, (C2-C10)олефиновая группа замещены одним или более одинаковыми или разными заместителями, представленными R7, и где (C1-C10)алкил-гетероциклил, гетероциклил необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R7; при этом гетероциклил сам по себе и в (C1-C10)алкил-гетероциклиле означает 5-6-членный насыщенный или частично ненасыщенный гетероциклил, возможно конденсированный с бензольным кольцом и содержащий 1-2 гетероатома, выбираемых из азота, кислорода и серы, и где необязательно один, два или три -CH2-фрагмента кольца замещены фрагментом -C=O;
R7 является R12, Y-H или Y-R14; где R12 и Y-R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R8;
R8 является R12, Y-H, Y-R14 или R14; где R12, Y-R14 и R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R9;
R9 является R12, Y-H, Y-R14 или R14, где R12, Y-R14 и R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R10;
R10 является R12, Y-H, Y-R14 или R14; где R12, Y-R14 и R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R11;
R11 является R12 или R14; где R12 и R14 группы необязательно замещены одним или более, одинаковыми или разными заместителями, представленными R12;
R12 является галогеном, гидрокси, трифторметилом, амино, (C1-C3)алкокси, (C1-C6)алкиламино, (C1-C3)алкоксикарбонилом, (C2-C10)диалкилфосфиноилом, (C1-C5)алкил(гидрокси)фосфиноилом, (C2-C10)диалкилфосфиноилокси, (C1-C5)алкил(гидрокси)фосфиноилокси, дигидроксифосфиноилом, дигидроксифосфиноилокси, циано, -СООН, -CONH2, -CONHR' или -CONRR', где R и R' являются (C1-C3)алкилом;
Y является -O-, -S-, -S(O)2-, -NRa-, -NRaC(Z)NRb-, -NRaC(Z)-, -C(Z)NRa-, -C(O)-, -C(Z)O-, -C(O)Z-, -OC(Z)-, -NRaC(Z)O-, -OC(Z)NRa -, -S(O)2O-, -OS(O)2-, -, -NRaS(O)2-, -OC(Z)O-, -OP(O)(ORa)O-, -P(O)(ORa)O-;
Z является кислородом или серой;
R14 является (C1-C6)алкилом, (C2-C6)олефиновой группой, (C3-C12)циклической углеводородной группой, гетероциклилом, имеющим вышеуказанное значение; или 5-6-членным насыщенным гетероциклом, конденсированным с одним или двумя 5-членными насыщенными гетероциклами, где каждый гетероцикл включает 1-2 гетероатома, выбранного из О, или группой  , Y1 является -NHS(O)2-,
, Y1 является -NHS(O)2-,
R21 является (C3-C12)циклической углеводородной группой или (C1-C10)алкилом, любой из которых необязательно замещен одним или более одинаковыми или разными заместителями, представленными галогеном или трифторметилом; Y2 является -O-,
R22 является (C1-C10)алкил-гетероциклилом или (C1-C10)алкилом, где (C1-C10)алкил замещен одним или более заместителями, представленными галогеном, и где (C1-C10)алкил-гетероциклил необязательно замещен одним или более одинаковыми или разными заместителями, представленными R7, где гетероцикл определен выше;
Y4 является -NRaC(O)NRbCH(Rc)-, -NRa -, -NRaC(Z)- или -NRaC(O)OCH(Rc)-,
R24 является (C1-C10)алкил-гетероциклилом, (C1-C10)алкил-(C3-C12)циклической углеводородной группой или (C1-C10)алкилом или (C2-C10)олефиновой группой; где (C1-C10)алкил, (C2-C10)олефиновая группа замещены одним или более одинаковыми или разными заместителями, представленными R15;
при этом остаток гетероциклила имеет значения, указанные выше;
R15 является R12a, R12b или R12c;
R12a является (C1-C3)алкоксикарбонилом или -CONHR', где R' является (C1-C3)алкилом; любой из которых замещен одним или более одинаковыми или разными заместителями, представленными R42; при условии, что если R12a или R15, включая их заместители R42, являются группами формул -(Q-O)n-Q или -CН2(Q-O)n-Q, где Q является (C1-C3)алкилом и n является целым числом больше 1, то указанные группы включают непрерывную линейную последовательность атомов, состоящую, по меньшей мере, из 16 атомов;
R12b является CONHR', где R' являются (C4-C10)алкилом; любой из которых замещен одним или более одинаковыми или разными заместителями, представленными R7;
R12c является -Y5(C1-C10)алкилом, -Y-арилом - и -Y-(C2-C10)олефиновой группой; где Y-(C2-C10)олефиновая группа необязательно замещена одним или более одинаковыми или разными заместителями, представленными R7; Y5 является -C(O)-, -OC(Z)-, -OP(O)(ORa)O-;
R42 является -YH или -Y-R14, где -Y-R14 необязательно замещен одним или более заместителями, представленными OCH3; Ra, Rb и Rc независимо являются водородом или (C1-C6)алкилом; при условии, что соединение общей формулы I не может быть 2-хлор-4-(2-[1,1,1-трифторметил]фениламино-2'-метилбензофеноном;
и их фармацевтически приемлемые соли, сольваты и гидраты.
2. Соединение по п.1, в котором R6 является (C1-C6)алкил-гетероциклилом, (C1-C6)алкилом, (C2-C6)олефиновой группой, гетероциклилом, Y1R21, Y2R22 или Y4R24; где (C1-C6)алкил и (C2-C6)олефиновая группа замещены одним или более одинаковыми или разными заместителями, представленными R7, и где (C1-C6)алкил-гетероциклил, гетероциклил необязательно замещены одним или более одинаковыми или разными заместителями, представленными R7;
R7 является R12, Y-H или Y-R14; где R12 и Y-R14 группы необязательно замещены одним или более одинаковыми или разными заместителями, представленными R8;
R8 является R12, Y-H, Y-R14 или R14; где R12, Y-R14 и R14 группы необязательно замещены одним или более одинаковыми или разными заместителями, представленными R9;
R9 является R12, Y-H, Y-R14 или R14; где R12, Y-R14 и R14 группы необязательно замещены одним или более одинаковыми или разными заместителями, представленными R10;
R10 является R12 или R14; где R12 и R14 группы необязательно замещены одним или более одинаковыми или разными заместителями, представленными R12;
R12 является галогеном, гидрокси, трифторметилом, амино, (C2-C6)диалкилфосфиноилом, (С1-C3)алкил(гидрокси)фосфиноилом, (C2-C6)диалкилфосфиноилокси, (C1-C3)алкил(гидрокси)фосфиноилокси, дигидроксифосфиноилом, дигидроксифосфиноилокси, -COOH;
Y является -O-, -S-, -S(O)2-, -NRa-, -NRaC(Z)NRb-, -NRaC(Z)-, -C(Z)NRa-, -C(O)-, -C(Z)O-, -OC(Z)-, -NRaC(Z)O-, -OC(Z)NRa-, -OS(O)2-, -NRaS(O)2-, -OC(Z)Z-, -OP(O)(ORa)O-, -P(O)(ORa)O-;
Z является кислородом;
R14 является (C1-C6)алкилом, (C2-C6)олефиновой группой, (C3-C9)циклической углеводородной группой, гетероциклилом;
Y1 является -NRaS(O)2-;
R21 является (C3-C9)циклической углеводородной группой или (С1-C6)алкилом; любой из которых необязательно замещен одним или более одинаковыми или разными заместителями, представленными галогеном или трифторметилом;
Y2 является -O-;
R22 является (C1-C6)алкил-гетероциклилом или (C1-C6)алкилом; где (C1-C6)алкил замещен одним или более заместителями, представленными галогеном, и где (C1-C6)алкил-гетероциклил, необязательно замещен одним или более одинаковыми или разными заместителями, представленными R7;
Y4 является -NRaC(O)NRbCH(Rc)-, -NRa-, -NRaC(Z)-, -NRaC(O)OCH(Rc)-;
R24 является (C1-C6)алкил-гетероциклилом, (C1-C6)алкил-(C3-C9)циклической углеводородной группой, (C1-C6)алкилом, (C2-C6)олефиновой группой; где (C1-C6)алкил, (C2-C6)олефиновая группа замещены одним или более одинаковыми или разными заместителями, представленными R15;
R15 является R12a, R12b или R12c;
R12а является (C1-C3)алкоксикарбонилом, -CONHR', где R' является (С1-С3)алкилом; любой из которых замещен одним или более одинаковыми или разными заместителями, представленными R42; при условии, что если R12a или R15, включая их заместители R42, являются группой формул -(Q-O)n-Q или -CH2(Q-O)n-Q, где Q является (С1-С3)алкилом и n является целым числом больше 1, то указанные группы включают непрерывную линейную последовательность атомов, состоящую, по крайней мере, из 16 атомов;
R12b является -CONHR', где R' является (С4-С8)алкилом; любой из которых замещен одним или более одинаковьми или разными заместителями, представленными R7;
R12c является -Y5(C1-C6)алкилом, -Y-арилом, -Y-(C2-C6)олефиновой группой; где -Y-(C2-C6)олефиновая группа необязательно замещена одним или более одинаковыми или разными заместителями, представленными R7;
Y5 является -C(O)-, -OC(Z)-, -OP(O)(ORa)O-;
R42 является -Y-H, -Y-R14, где -Y-R14 необязательно замещены одним или более заместителями, представленными OСН3;
Ra, Rb и Rc независимо являются водородом или (С1-С4)алкилом.
3. Соединение по п.1, в котором R6 является (C1-C4)алкил-гетероциклилом, (С1-С6)алкилом, (C2-C4)олефиновой группой, гетероциклилом, Y1R21, Y2R22 или Y4R24; где (C1-C6)алкил и (C2-C4)олефиновая группа замещены одним или более одинаковьми или разными заместителями, представленными R7, и где (C1-C4)алкил-гетероциклил, гетероциклил необязательно замещен одним или более одинаковыми или разными заместителями, представленными R7;
R7 является R12, Y-H или Y-R14; где R12 и Y-R14 группы необязательно замещены одним или более одинаковыми или разными заместителями, представленными R8;
R8 является R12, Y-H или Y-R14; где R12 и Y-R14 группы необязательно замещены одним или более одинаковыми или разными заместителями, представленными R9;
R9 является R12, Y-H, Y-R14 или R14; где R12, Y-R14 и R14 группы необязательно замещены одним или более одинаковыми или разными заместителями, представленными R12;
R12 является галогеном, гидрокси, трифторметилом, амино, (С1-С3)алкокси, (C1-C3)алкилтио, (C1-C3)алкиламино, (C1-C3)алкоксикарбонилом, (C2-C6)диалкилфосфиноилом, (C2-C6)диалкилфосфиноилокси, дигидроксифосфиноилом, дигидроксифосфиноилокси, циано, -CОOН, -CONH2, -CONHR' или -CONRR', где R и R' являются (C1-C3)алкилом;
Y является -O-, -S-, -S(O)2-, -NRa-, -NRaC(Z)NRb-,
-NRaC(Z)-, -C(Z)NRa-, -C(O)-, -C(Z)O-, -OC(Z)-, -NRaC(Z)O-, -OC(Z)NRa-, -OS(O)2-, -NRaS(O)2-;
Z является кислородом;
R14 является (C1-C4)алкилом, (C2-C4)олефиновой группой, (C3-C6)циклической углеводородной группой, гетероциклилом;
Y1 является -NRaS(O)2-;
R21 является (C3-C6)циклической углеводородной группой, (C1-C6)алкилом; любой из которых необязательно замещен одним или более одинаковыми или разными заместителями, представленными галогеном или трифторметилом;
Y2 является -O-;
R22 является (C1-C4)алкил-гетероциклилом или (C1-C6)алкилом; где (C1-C6)алкил замещен одним или более одинаковыми или разными заместителями, представленными галогенами, где (C1-C4)алкил-гетероциклил необязательно замещен одним или более одинаковыми или разными заместителями, представленными R7;
Y4 является -NRaC(O)NRbCH(Rc)-, -NRa-, -NRaC(Z)-, -NRaC(O)OCH(Rc)-;
R24 является (C1-C4)алкил-гетероциклилом, (C1-C4)алкил-(C3-C6)циклической углеводородной группой, (C1-C6)алкилом или (C2-C4)олефиновой группой; где (C1-C6)алкил, (C2-C4)олефиновая группа замещены одним или более одинаковыми или разными заместителями, представленными R15;
R15 является R12a, R12b или R12c;
R12a является (C1-C3)алкоксикарбонилом или -CONHR', где R' является (C1-C3)алкилом; любой из которых замещен одним или более одинаковыми или разными заместителями, представленными R42; при условии, что если R12a или R15, включая их заместители R42, являются группой формул -(Q-O)n-Q или -CH2(Q-O)n-Q, где Q является (C1-C3)алкилом и n является целым числом больше 1, то указанные группы включают непрерывную линейную последовательность атомов, состоящую, по крайней мере, из 16 атомов;
R12b является -CONHR', где R' является (C4-C8)алкилом; любой из которых замещен одним или более одинаковыми или разными заместителями, представленными R7;
R12c является -Y5(C1-C6)алкилом, -Y-арилом и -Y-(C2-C6)олефиновой группой; где -Y-(C2-C6)олефиновая группа замещена одним или более одинаковыми или разными заместителями, представленными R7;
Y5 является -C(O)-, -OC(Z)-;
R42 является -Y-H, -Y-R14; где -Y-R14 необязательно замещен одним или более заместителями, представленными OCН3;
Ra, Rb и Rc независимо являются водородом или (C1-C2)алкилом.
4. Соединение по п.1, в котором R1 является метилом;
R2 является одним или более заместителями, независимо выбранными из группы, включающей водород или галоген;
R3 является одним или более заместителями, независимо выбранными из группы, включающей водород или галоген;
R4 является водородом;
R5 является водородом.
5. Соединение по п.1, где молекулярная масса указанного соединения ниже 1500 Да.
6. Соединение по п.1, где молекулярная масса указанного соединения ниже 1200 Да.
7. Соединение по п.1, где молекулярная масса указанного соединения ниже 800 Да.
8. Соединение по п.1, выбранное из группы, включающей
[2-Хлор-4-({2-[2-(тетрагидро-2Н-пиран-2-илокси)этил]фенил}-амино)фенил](2-метилфенил)метанон;
(2-Хлор-4-{[2-(2-гидроксиэтил)фенил]амино}фенил)(2-метилфенил)метанон;
2-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}фенил)этил-ацетат;
4-(2-{2-[(3-Хлор-4-(2-метилбензоил)фенил)амино]фенил}-этокси)-4-оксобутановая кислота;
2-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}фенил)этил-гексаноат;
2-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}фенил)-1-метилэтилацетат;
(2-Хлор-4-{[2-(2-гидроксипропил)фенил]амино}фенил)(2-метилфенил)метанон;
[2-Хлор-4-({2-[(1E)-3-гидроксипроп-1-енил]фенил}амино)-фенил](2-метилфенил)метанон;
(2-Хлор-4-{[2-(3-гидроксипропил)фенил]амино}фенил)(2-метилфенил)метанон;
[2-Хлор-4-({2-[(1Е)-4-гидроксибут-1-енил]фенил}амино)-фенил](2-метилфенил)метанон;
[4-({2-[(1Е)-3-аминопроп-1-енил]фенил}амино)-2-хлорфенил](2-метилфенил)метанон;
Диэтил (2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)проп-2-енилфосфонат;
[2-Хлор-4-({2-[(1Е)-3-гидрокси-3-метилбут-1-енил]фенил}-амино)фенил](2-метилфенил)метанон;
Этил (2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)акрилат;
(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-акриловая кислота;
{2-Хлор-4-[(2-{(1Е)-3-[(2,2-диметил-1,3-диоксолан-4-ил)метокси]проп-1-енил}фенил)амино]фенил}(2-метилфенил)метанон;
[2-Хлор-4-({2-[(1Е)-3-(2,3-дигидроксипропокси)проп-1-енил]фенил}амино)фенил](2-метилфенил)метанон;
Трет-бутил (2R)-3-{[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)-фенил]амино}фенил)проп-2-енил]амино}-1-(гидроксиметил)-2-оксоэтилилкарбамат;
Метил O-(трет-бутил)-N-({[(2E)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)проп-2-енил]амино}карбонил)-L-серинат;
N-(трет-бутил)-N'-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)-фенил]амино}фенил)проп-2-енил]тиомочевина;
N-[(2E)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)проп-2-енил]-4-оксопентанамид;
N-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-проп-2-енил]-N'-этилмочевина;
Этил 4-{[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)проп-2-енил]амино}-4-оксобутаноат;
N-[(2E)-3-(2-{[3-xлop-4-(2-мeтилбeнзoил)фeнил]aминo}-фeнил)пpoп-2-eнил]-N'-циклогексилмочевина;
N'-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)проп-2-енил]-N,N-диметилсукцинамид;
Диметил [(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)проп-2-енил]малонат;
[2-Хлор-4-({2-[(1Е)-3-морфолин-4-илпроп-1-енил]фенил}-амино)фенил](2-метилфенил)метанон;
6-O-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)проп-2-енил]-1,2:4,3-ди-O-(1-метилэтилиден)-а-D-галактопираноза;
Метил 5-O-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)проп-2-енил]-2,3-O-(1-метилэтилиден)-b-D-рибофуранозид;
Метил 5-O-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)проп-2-енил]-b-D-рибофуранозид;
Метил (4Е)-5-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)-2-(метилсульфонил)пент-4-еноат;
Этил {[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)проп-2-енил]тио}ацетат;
[2-Хлор-4-{[2-((1Е)-3-{бис[2-(ацетилокси)этил]амино}проп-1-енил)фенил]амино}фенил](2-метилфенил)
метанон;
[2-Хлор-4-{[2-((1Е)-3-{бис[2-(гидрокси)этил]амино}проп-1-енил)фенил]амино}фенил](2-метилфенил)метанон;
(2-Хлор-4-{[2-((1Е)-3-{4-[2-(ацетилокси)этил]пиперидин-1-ил}проп-1-енил)фенил]амино}фенил)(2-метилфенил)
метанон;
{2-Хлор-4-[(2-{(1Е)-3-[4-(2-гидроксиэтил)пиперидин-1-ил]проп-1-енил}фенил)амино]фенил}(2-метилфенил)
метанон;
{2-Хлор-4-[(2-{2-[(тетрагидрофуран-2-илметил)амино]этил}-фенил)амино]фенил}(2-метилфенил)метанон;
[2-Хлор-4-({2-[2-(4-метилпиперазин-1-ил)этил]фенил}амино)-фенил](2-метилфенил)
метанон;
{2-Хлор-4-[(2-{2-[(3-морфолин-4-илпропил)амино]этил}фенил)-амино]фенил}(2-метилфенил)метанон;
(2-Хлор-4-{[2-(2-{[2-(диметиламино)этил]амино}этил)фенил]-амино}фенил)(2-метилфенил)метанон;
{2-Хлор-4-[(2-{2-[(2-метоксиэтил)амино]этил}фенил)амино]-фенил}(2-метилфенил)метанон;
1-[3-({2-[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)фенил]этил}амино)пропил]пирролидин-2-он;
{2-Хлор-4-[(2-{2-[метил(тетрагидрофуран-2-илметил)амино]-этил}фенил)амино]фенил}(2-
метилфенил)метанон;
(2-Хлор-4-{[2-(2-{[(2,2-диметил-1,3-диоксолан-4-ил)метил]амино}этил)фенил]амино}фенил)(2-
метилфенил)метанон;
{2-Хлор-4-[(2-{2-[4-(2-метоксиэтил)пиперазин-1-ил]этил)-фенил)амино]фенил}(2-метилфенил)метанон;
(2-Хлор-4-{[2-(2-морфолин-4-илэтил)фенил]амино}фенил)(2-метилфенил)метанон;
{2-Хлор-4-[(2-{2-[(2,3-дигидроксипропил)амино]этил}фенил)-амино]фенил}(2-метилфенил)метанон;
(4-{[2-(Аминометил)фенил]амино}-2-хлорфенил)(2-метилфенил)метанон;
(2-Хлор-4-{[2-({2-[2-(тетрагидро-2Н-пиран-2-илокси)этокси]-этокси}метил)фенил]амино}фенил)(2-метилфенил)
метанон;
{2-Хлор-4-[(2-{[(тетрагидро-2Н-пиран-2-илокси)этокси]-метил}фенил)амино]фенил}(2-метилфенил)метанон;
[2-Хлор-4-({2-[(2-{2-[2-(тетрагидро-2Н-пиран-2-илокси)-этокси]этокси}этокси)метил]фенил}амино)фенил](2-метилфенил)метанон;
[2-Хлор-4-({2-[(3,3,3-трифторпропокси)метил]фенил}амино)-фенил](2-метилфенил)метанон;
Диэтил 2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензилфосфонат;
2-[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]-1Н-изоиндол-1,3(2Н)-дион;
{2-Хлор-4-[(2-{[2-(2-гидроксиэтокси)этокси]метил}фенил)-амино]фенил}(2-метилфенил)метанон;
[2-Хлор-4-({2-[(гидроксиэтокси)метил]фенил}амино)фенил](2-метилфенил)метанон;
(2-Хлор-4-{[2-({2-[2-(2-гидроксиэтокси)этокси]этокси}-метил)фенил]амино}фенил)(2-метилфенил)метанон;
[4-({4-Бром-2-[(2-гидроксиэтокси)метил]фенил}амино)-2-хлорфенил](2-метилфенил)метанон;
(4-{[4-Бром-2-({2-[2-(2-гидроксиэтокси)этокси]этокси}-метил)фенил]амино}-2-хлорфенил)(2-метилфенил)метанон;
{4-[(4-Бром-2-{[2-(2-гидроксиэтокси)этокси]метил}фенил)-амино]-2-хлорфенил}(2-метилфенил)метанон;
Диэтил 5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензилфосфонат;
[4-({4-Бром-2-[(3,3,3-трифторпропокси)метил]фенил}амино)-2-хлорфенил](2-метилфенил)метанон;
2-{[2-({3-Хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил-4-метилбензолсульфонат;
2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}этил-4-метилбензолсульфонат;
2-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}этокси)этил-4-метилбензолсульфонат;
2-[2-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]-фенил}амино)бензил]окси}этокси)этокси]этил-4-
метилбензолсульфонат;
[4-({4-Бром-2-[(2-йодэтокси)метил]фенил}амино)-2-хлорфенил](2-метилфенил)метанон;
{4-[(4-Бром-2-{[2-(2-йодэтокси)этокси]метил}фенил)амино]-2-хлорфенил}(2-метилфенил)метанон;
(4-{[4-Бром-2-({2-[2-(2-йодэтокси)этокси]этокси}метил)-фенил]амино}-2-хлорфенил)(2-метилфенил)метанон;
[2-Хлор-4-({2-[(2-йодэтокси)метил]фенил}амино)фенил](2-метилфенил)метанон;
Диэтил 2-{[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}этилфосфонат;
Диэтил 2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]-фенил}амино)бензил]окси}этилфосфонат;
Диэтил 2-({[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]-фенил}амино)бензил]окси}этокси)этилфосфонат;
Диэтил 2-[2-(2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)-карбонил]фенил}амино)бензил]окси}этокси)этокси]этилфосфонат;
Диэтил 2-{[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]амино}-2-оксоэтилфосфонат;
Диэтил 2-{[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]-фенил}амино)бензил]амино}-2-оксоэтилфосфонат;
{[2-({5-Бром-3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}этил(диэтоксифосфорил)ацетат;
2-({3-Хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензилфосфоновая кислота;
N-[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]-2,2,2-трифторэтансульфонамид;
N-[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)фенил]-2,2,2-трифторэтансульфонамид;
{2-Хлор-4-[(2-{[(тетрагидро-2Н-пиран-2-илокси)пропокси]метил}фенил)амино]фенил}(2-метилфенил)метанон;
[2-Хлор-4-({2-[(гидроксипропокси)метил]фенил}амино)фенил]-(2-метилфенил)метанон;
Диэтил 3-{[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)бензил]окси}пропилфосфонат;
Диэтил 2-[2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}-амино)фенил]этилфосфонат;
Диэтил 2-[5-бром-2-({3-хлор-4-[(2-метилфенил)карбонил]-фенил}амино)фенил]этилфосфонат;
2-{[2-({3-Хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]амино}-2-оксиэтилфосфоновая кислота;
фенетиловый эфир (2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)карбаминовой кислоты;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-2-феноксиацетамид;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-3-феноксипропионамид;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-2-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)ацетамид;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-сукцинамовой кислоты 2-(2-метоксиэтокси)этиловый эфир;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-бензолсульфонамид;
Уксусной кислоты (2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенилкарбамоил)метиловый эфир;
1-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}фенил)-пирролидин-2,5-дион;
2-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}фенил)-этилпропионат;
2,2-Диметилпропионовой кислоты (2-{[3-хлор-4-(2-метилбензоил)фенил]амино }фенил)этиловый эфир;
[2-Хлор-4-({2-[3-(тетрагидро-2Н-пиран-2-илокси)пропокси]фенил}амино)фенил](2-метилфенил)
метанон;
{2-Хлор-4-{[2-(3-гидроксипропокси)фенил]амино}фенил)(2-метилфенил)метанон;
трет-Бутил 2-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}фенил)этилкарбонат;
2-({[(5-Бром-2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)амино]карбонил}амино)этил 2-метилакрилат;
(4-{[4-Бром-2-(2-гидроксиэтил)фенил]амино}2-хлорфенил)(2-метилфенил)метанон;
3-(2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}фенокси)-пропилацетат;
[2-Хлор-4-({2-[3-(морфолин-4-ил)пропокси]фенил}амино)-фенил](2-метилфенил)метанон;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-(4-феноксибутил)сукцинамид;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-(6-гидроксигексил)сукцинамид;
N-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-(2,3-дигидроксипропил)сукцинамид;
трет-Бутил (1R)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)-1-(гидроксиметил)пропилкарбамат;
Диэтил 6-[3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенилкарбамоил)пропиониламино]гексил фосфат;
Этил N-({[(2E)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]-амино}фенил)проп-2-енил]амино}карбонил)глицинат;
трет-Бутил 2-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)этил(метил)карбамат;
N-(5-Бром-2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-(6-гидроксигексил)сукцинамид;
N-(5-Бром-2-{[3-хлор-4-(2-метилбензоил)фенил]амино}фенил)-N'-(2,3-дигидроксипропил)сукцинамид;
(2Z)-N-[(2Е)-3-(2-{[3-хлор-4-(2-метилбензоил)фенил]амино}-фенил)проп-2-енил]-2-(2,5-диоксиимидазолидин-4-илиден)ацетамид;
(2-Хлор-4-{[2-(дифторметил)фенил]амино}фенил)(2-метилфенил)метанон;
3-{[2-({3-Хлор-4-[(2-метилфенил)карбонил]фенил}амино)-фенил]этил}-1-метилимидазолидин-2,4-дион;
3-{[2-({3-Хлор-4-[(2-метилфенил)карбонил]фенил}амино)-фенил]этил}-5,5-диметилоксазолин-2,4-дион;
4-{[2-({3-Хлор-4-[(2-метилфенил)карбонил]фенил}амино)-фенил]этил}морфолин-3,5-дион;
1-{[2-({3-Хлор-4-[(2-метилфенил)карбонил]фенил}амино)-фенил]этил}пиперидин-2,6-дион;
4-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил)морфолин-3,5-дион;
1-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил)пирролидин-2,5-дион;
Этил 2-[3-(2-{5-бром-[2-({3-хлор-4-[(2-метилфенил)-карбонил]фенил}амино)бензилокси}этил)-2,4,5-триоксоимидазолидин-1-ил]ацетат;
3-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил)имидазолин-2,4-дион;
1-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил)-3,4-цис-диацетоксипирролидин-2,5-дион;
3-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил)тиазолин-2,4-дион;
3-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил)-1-метилимидазолидин-2,4-дион;
1-(2-{[5-Бром-2-({3-хлор-4-[(2-метилфенил)карбонил]фенил}амино)-бензил]окси}этил)имидазолидин-2,4,5-трион;
(2-Хлор-4-{[2-(гидроксиметил)фенил]амино}фенил)(2-метилфенил)метанон;
2-{[3-Хлор-4-(2-метилбензоил)фенил]амино}бензилацетат;
и их фармацевтически приемлемые соли и сольваты, например их гидраты.
9. Фармацевтическая композиция, обладающая свойствами ингибитора интерлейкина -1β (IL-1β) и фактора некроза опухоли (ТNF-α), содержащая соединение формулы I по любому из пп.1-8 вместе с фармацевтически приемлемым носителем.
10. Фармацевтическая композиция по п.9, где указанная композиция содержит от 0,1 до 100% соединения формулы I.
11. Фармацевтическая композиция по п.9 в стандартной дозированной лекарственной форме, содержащей от 0,07 мг до 1 г соединения формулы I.
12. Способ ингибирования фактора некроза опухоли (TNF-α), включающий введение эффективного количества соединения по п.1, необязательно вместе с фармацевтически приемлемым наполнителем.
13. Применение соединения по любому из пп.1-19 для получения лекарственного средства для лечения или профилактики заболеваний, связанных с регулирующей системой цитокинов.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| BHAVSAR MADHURY D | |||
| et al | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| IV "Man-Made Textiles in India (English), 1986, 29(5), 224-30 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2009-07-20—Публикация
2002-08-26—Подача