Изобретение относится к новым биологически активным производным 5’-фосфата 3’-азидо-3’-дезокситимидина и 2’,3’-дидезокси-2’,3’-дидегидротимидина и может быть использовано в качестве противовирусных средств, в первую очередь против вируса иммунодефицита человека (ВИЧ).
Известно, что ингибировать репродукцию вируса иммунодефицита можно на разных стадиях его жизненного цикла, но очевидно, что целесообразно использовать ингибиторы наиболее ранних процессов. Именно поэтому обратная транскриптаза ВИЧ, первый по времени функционирования фермент в цикле репликации вируса, является наиболее привлекательной мишенью для подавления размножения вируса.
В настоящее время известны различные соединения, подавляющие репродукцию вируса иммунодефицита человека. Наиболее эффективными из известных соединений являются 3’-азидо-3’-дезокситимидин (азидотимидин или AZT, зидовудин, “Ретровир”, “Тимазид”), находящий применение в медицинской практике (Mitsuya, Н.; Broder, S. Inhivition of the in vitro infectivity and cytiopathic effect of human T-lymphotropic virus type III/lymphoadenopathy-associated virus/HTLV-III(LAV) by 2’,3’-dideoxynucleosides. Proc. Nat. Acad. Sci. USA, 1986, 83, 1911-1915), а также 2’,3’-дидезоксицитидин (ddC, зальцитабин, “Гивид”), 2’,3’-дидезоксиинозин (ddI, диданозин, “Видекс”), 3’-дезокси-2’,3’-дидегидротимидин (d4T, ставудин, “Зерит”) и 3’-тиоцитидин (3ТС, ламивудин, “Эпивир”).
Молекулярный механизм действия указанного соединения включает диффузию его внутрь клетки, инфицированной ВИЧ. Далее он подвергается трифосфорилированию и специфично блокирует синтез ДНК, катализируемый обратной транскриптазой ВИЧ. Аналогичным образом действуют другие противовирусные нуклеозиды, применяемые в медицинской практике для лечения СПИД: 2’,3’-дидезоксицитидин и, 2’,3’-дидезоксиинозин (Mitsuya, Н.; Broder, S. Inhibition of the in vitro infectivity and cytopatic effect of human T-lymphotropic virustype III/lymphoadenopathy-assosiated virus (HTLV-III/LAV) by 2’,3’-dideoxynucleosides. Proc. Nat. Acad. Sci. USA, 1986, 82, 1911-1915), 2’,31-дидезокси-2′,3’-дидегидротимин (Herdewijn, P.; Balzarini, J.; DeClercq, E.; et al., 3’-Substituted 2’,3’-dideoxynucleoside analogues as potential anti-HIV (HTLV/LAV) agents. J. Med. Chem., 1987, 30, 1270-1278) и 2’,3’-дидeзoкcи-3’-тиoтимидин (Soudeyns, H.; Yao, Q.; et al., Anti-human immunodeficiency virus type 1 activity and in vitro toxicity of 2’-deoxy-3’-thiacytidine (BCH-189), a novel heterocyclic nucleoside agents. Antimicrob. Agents Chemother., 1991, 35, 1386-1390).
Однако фосфорилирование модифицированных нуклеозидов клеточными ферментами происходит значительно менее эффективно, чем природных нуклеозидов. Процесс превращения нуклеозида в организме человека в соответствующий 5’-трифосфат занимает около 1,5-2 часов. За это время проникший в клетки вирус успевает в форме провирусной ДНК интегрировать в геном человека. Использование в качестве лекарственных препаратов нуклеозид-5’-трифосфатов с немодифицированной трифосфатной частью невозможно из-за их низкой стабильности к действию ферментов гидролиза и вследствие этого низкой способности проникать внутрь клетки. Таким образом, применяемые препараты, даже если они приняты в момент инфицирования, не могут предохранить от заражения ВИЧ.
Наиболее близким техническим решением (прототипом) является использование в качестве противовирусного препарата производные 3’-азидо-3’-дезокситимидина, содержащие модифицированную фосфатную группу в 5’-положении, а именно Н-фосфонат AZT (Патент США №5043437, МПК С 07 Н 19/00, опубл. 27.08.1991), а также: Н.Б.Тарусова, А.А.Хорлин, А.А.Краевский, и др., Ингибирование вируса иммунодефицита человека в культуре клеток 5’-фосфонатами 3’-азидо-2’,3’-дидезоксинуклеозвдов, Мол. Биол, 1989, 23, N6, 1716-1724). В настоящее время он используется в качестве лекарственного средства под названием “Никавир” для лечения СПИД (ВИЧ-инфекций).
Однако было показано, что в организме это соединение в основном подвергается дефосфорилированию, превращаясь в AZT (Кузнецова Е.В., Куханова М.К., и др. Реакция 5’-Н-фосфонатов, 5’-фторфосфатов и 5’-фосфатов модифицированных тимидинов в плазме крови. - Мол. Биол, 1995, 29, N2, 415-420).
Техническим результатом настоящего изобретения является создание и использование новых соединений, которые устойчивы к действию ферментов дефосфорилирования, способны проникать внутрь клетки и обладают избирательной активностью в подавлении биосинтеза ДНК, катализируемого обратной транскриптазой ВИЧ.
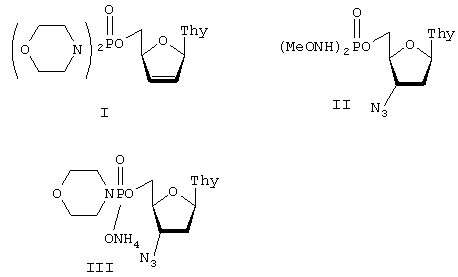
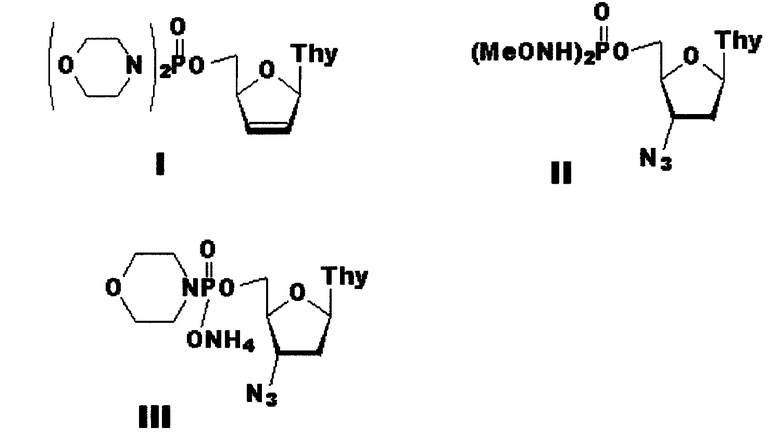
Указанный технический результат достигается тем, что согласно изобретению, заявляются новые соединения: фосфорамидаты нуклеозидных аналогов, включающие 5’-фосфодиморфолидат 2’,3’-дидезокси-2’,3’-дидегидротимидина (формула I) и фосфорамидаты 3’-азидо-3’-дезокситимидина (формулы II и III), ингибирующие активность репродукции вируса иммунодефицита человека и имеющие следующие формулы:
Для получения соединений формул I-III был использован единый синтетический подход, заключающийся в реакции нуклеозида с хлорокисью фосфора в триэтилфосфате, с последующей обработкой полученного фосфодихлоридата различными аминами. Полученные фосфорамидаты I-III могут быть выделены и очищены стандартными способами, например, экстракцией, осаждением, хроматографией и т.д.
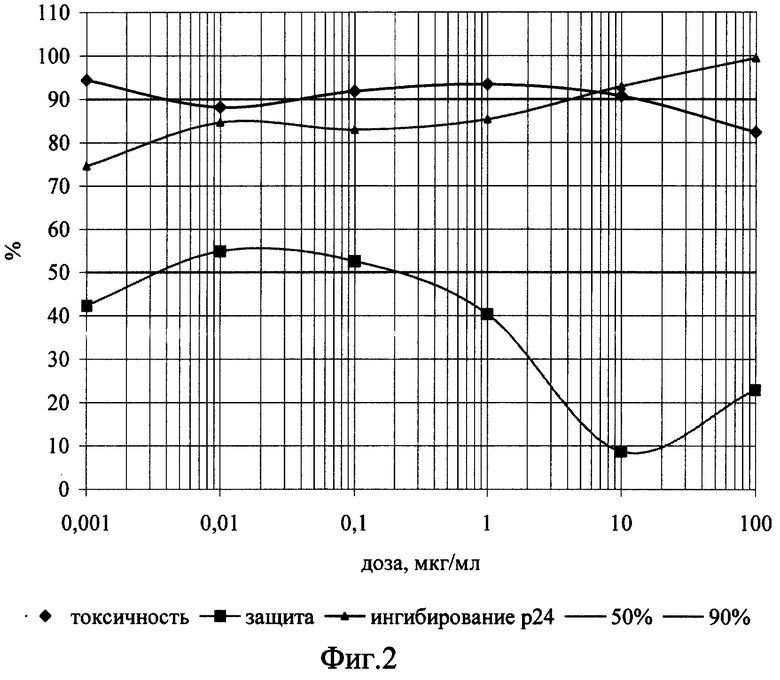
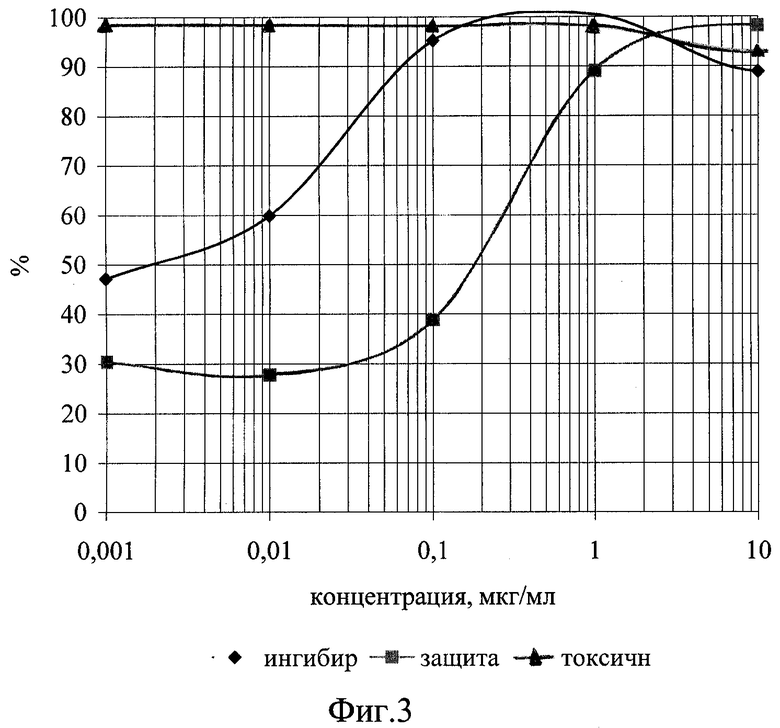
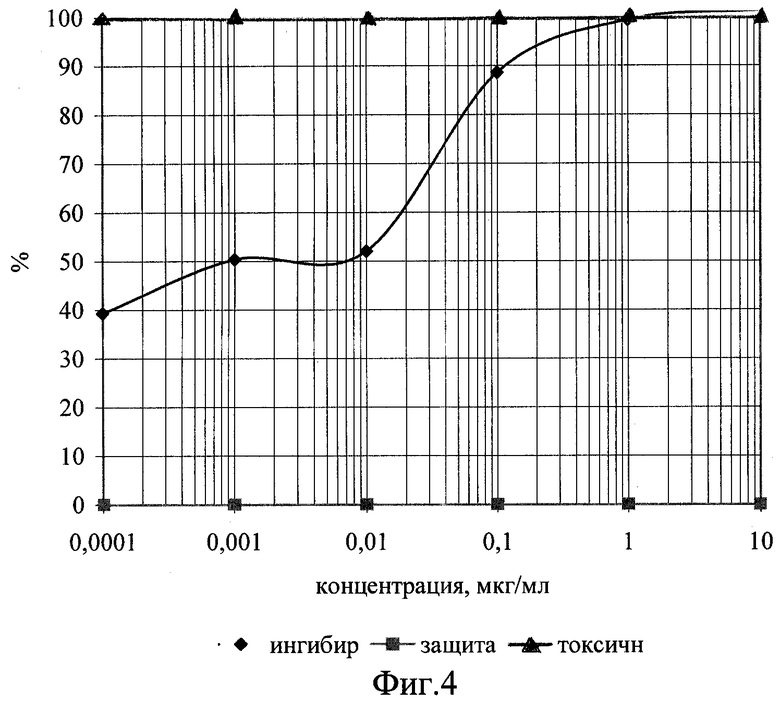
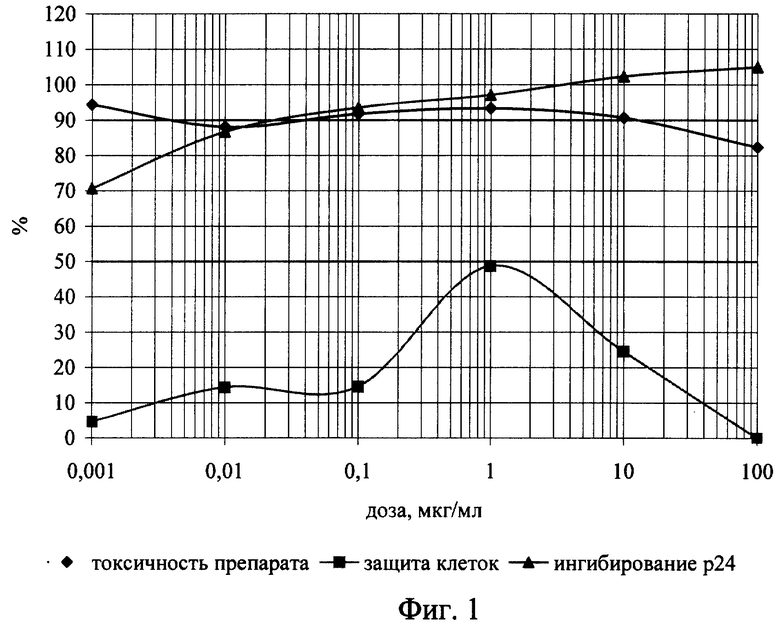
Изобретение иллюстрируется следующими графическими материалами. На фиг.1 приведены сравнительные графики анти-ВИЧ действия соединения формулы I в отношении ВИЧ-1 ГКВ 4046 при одновременном внесении с вирусом. На фиг.2 приведены сравнительные графики анти-ВИЧ действия соединения формулы I при внесении его после адсорбции вируса. На фиг.3 - то же, анти-ВИЧ действие соединения формулы II при одновременном с вирусом внесении. На фиг.4 - то же, анти-ВИЧ действие соединения формулы III при одновременном с вирусом внесении
Настоящее изобретение проиллюстрировано нижеследующими примерами получения данных соединений и результатами биохимических испытаний.
Пример 1. Получение 5’-фосфодиморфолидат 2’,3’-Дидезокси-2’,3’-дидегидротимидин 5’-фосфодиморфолидат (формула I)
К раствору 2’,3’-дидезокси-2’,3’-дидегидротимидина (235 мг, 1,05 ммоль) в триэтилфосфате (3 мл), при rt, при встряхивании, прибавили трет-бутанол (8.5 мг, 0.12 ммоль) и хлорокись фосфора (0.35 г, 2.24 ммоль). Реакционную смесь выдержали 16 ч при rt, охладили до 4°С, после чего прибавили раствор морфолин (1.3 г, 15 ммоль) в метаноле (5 мл). Затем реакционную смесь (суспензию) разбавили этилацетатом (10 мл) и выдержали 18 ч при 4°С. Выпавший осадок (хлорида морфолиния) отфильтровали, маточник упарили и остаток разделяли колоночной хроматографией на силикагеле (10 г Silasorb в хлороформе), элюируя градиентом (0-5%) метанола в хлороформе. Выход титульного соединения 0.87 ммоль (82%, по УФ), продукт содержал около 2 моль триэтилфосфата на моль диморфолидата. Для повторной очистки была взята половина этого количества. Очистку проводили на силикагеле (5 г Silasorb в хлороформе), элюируя 3% метанолом в хлороформе. Было получено 117 мг целевого соединения (0.264 ммоль, 50%).
1Н-ЯМР (D2O): 7.49 с (1Н, Н-6); 6.93 уш.с. (1Н, Н-1’); 6.54д. (J=6.2 Hz, 1H, H-3’); 6.10д (J=6.2 Hz, 1H, H-2’); 5.18 уш.с. (1H, H-4’); 4.22 и 4.07 2м (2Н, Н-5’); 3.67 м (4Н, СН2O-морфолина); 3.13 м (4Н, СH2N-морфолина); 1.94с (3Н, Me тимина).
31Р-ЯМР (D2O): 16.38с.
Пример 2. Получение 3’-Азидо-2’,3’-дидезокситимидин 5’-фосфобис (метоксиамид) (формула II)
К раствору 3’-азидо-3’-дезокситимидина (82 мг, 0.31 ммоль) в триэтилфосфате (1.7 г) при перемешивании, при rt, прибавили трет-бутанол (5 мг, 0.06 ммоль) и хлорокись фосфора (86 мг, 0.56 ммоль). Реакционную смесь выдержали 1 ч при rt, а затем 20 ч при 4°С, после чего к охлажденному раствору прибавили метоксиамид хлорогидрат (309 мг, 3.7 ммоль) и триэтиламин (0.51 г, 5.05 ммоль) в метаноле (5 мл). Выпавший осадок отфильтровали, маточник упарили и разбавили этилацетатом (10 мл). Вновь отфильтровали осадок, упарили маточник и выделяли продукт аналогично ранее описанному. Выход целевого соединения - 58 мг (0.143 ммоль, 46%)
1Н-ЯМР (D2O): 7.49с (1H, Н-6); 6.19т (J=6.4 Гц, 1H, Н-1’); 4.49к (J=6.7 Гц, 1H, H-3’); 4.28-4.15m (3Н, 2Н-5’+Н-4’); 3.62 д (J=17 Гц, 6Н, 2 CH3ON); 2.43т (J=6.7 Гц, 2Н, 2Н-2’); 1.86с (3Н, Me тимина).
31Р-ЯМР (D2O): 18.73с.
Пример 3. Получение 3’-Азидо-2’,3’-дидезокситимидин 5’-фосфоморфолидат (формула III)
К раствору 3’-азидо-3’-дезокситимидина (178 мг, 0.67 ммоль) в триэтилфосфате (2.6 г) при перемешивании, при rt, прибавили трет-бутанол (7 мг, 0.09 ммоль) и хлорокись фосфора (170 мг, 1.09 ммоль). Реакционную смесь выдержали 1 ч при rt, а затем 20 ч при 4°С, после чего к охлажденному раствору прибавили воду (55 мг, 3.06 ммоль), выдержали 40 мин при 4°С, прибавили морфолин (0.33 г, 3.8 ммоль) в метаноле (3 мл). Реакционную смесь упарили и разбавили этилацетатом (10 мл). Отфильтровали осадок, упарили маточник и выделяли продукт аналогично ранее описанному, используя для элюции систему хлороформ-метанол-25% водный аммиак (60:35:5). Выход целевого соединения - 182 мг (0.420 ммоль, 63%)
1Н-ЯМР (D2O): 7.49с (1Н, Н-6); 6.16т (J=6.4 Гц, 1Н, Н-1’); 4.48к (J=6.7 Гц, 1Н, Н-3’); 4.25-4.14м (3Н, 2Н-5’+Н-4’); 3.72м (2Н, СН2О-морфолина); 3.01м (2Н, CH2N-мopфoлинa); 2.31т (J=6.7 Гц, 2Н, 2Н-2’); 1.88с (3Н, Me тимина).
31Р-ЯМР (D2O): 7.81с.
Далее приведены исследования ингибирования репродукции ВИЧ.
Исследование ингибирования репродукции ВИЧ включает культивирование первично инфицированных лимфоидных клеток линии МТ-4 в присутствии исследуемых соединений, конечные концентрации которых в культуральной среде составляют 0,0001-100 мкг/мл, на протяжении одного пассажа - в течение 4 суток.
Об ингибировании репродукции ВИЧ в культуре чувствительных клеток судят по снижению накопления вирусспецифического белка р24 (по данным иммуноферментного анализа), а также по увеличению жизнеспособности клеток в присутствии препарата по сравнению с контролем, определяемому на 4-е сутки культивирования при окрашивании 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT).
Пример 4. Оценка цитотоксичности соединений
Цитотоксичность препарата оценивают путем добавления его разведении в бессывороточной среде RPMI-1640 к клеточной суспензии МТ-4, помещенной в лунки 96-луночного планшета ("Orange"), до конечных концентраций 0,001-100 мкг/мл (по три лунки на каждую дозу) с последующим культивированием при 37°С в течение 4 суток. Посевная концентрация составляет 0,5×106 клеточных частиц в миллилитре. Контролем служат клетки без добавления препарата, вместо которого вносят такое же количество бессывороточной среды. Жизнеспособность клеток подсчитывают на 4 сутки культивирования, пользуясь формазановым методом (прижизненным окрашиванием клеток 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) [Leslie R.Bisset, Hans Lutz, Jurg Boni, Regina Hoffinann-Lehmann, Ruedi Luthy, Jorg Schupbach. Combined effect of zidovudine (ZDV), lamivudine (3TC) and abacavir (ABC) antiretroviral therapy in suppressing in vitro FIV replication. Antiviral Research 53 (2002) 35-45].
Токсичность различных доз препарата определяют по жизнеспособности клеток относительно контроля, по полученным результатам строят дозозависимую кривую и определяют концентрацию, на 50% снижающую жизнеспособность клеток (СD50). Следует отметить, что исследуемые соединения не оказывают токсического действия на клетки МТ-4 в эффективных концентрациях: 50% токсичные дозы на 5-6 порядков превышают эффективные в отношении ВИЧ-1 дозы (таблица).
Количественные характеристики анти-ВИЧ действия соединений
PD50
PD50
2,4
23,8
(IMB-43)
0,0022
0,22
18,7
18,7
(IMB-94)
0,37
(IMB-101)
-
Пример 5. Изучение влияния заявляемых соединений на репродукцию ВИЧ-1 в культуре клеток МТ-4.
Исследование противовирусной активности соединений в отношении ВИЧ-1 проводят на перевиваемой линии чувствительных клеток МТ-4. Для заражения используют супернатант инфицированных клеток, хранящийся в жидком азоте, множественность заражения составляет 0,2-0,5 инфекционных единиц на клетку. Суспензию клеток МТ-4 с концентрацией 2,0×106 клеточных частиц в миллилитре и жизнеспособностью не менее 90% помещают в лунки 96-луночного планшета непосредственно после внесения вируссодержащего материала и сразу же добавляют исследуемые соединения, разведенные в среде RPMI-1640 без сыворотки, до конечных концентраций 0,0001-100 мкг/мл (по три лунки на каждую дозу). Контролями служат инфицированные ВИЧ-1 клетки МТ-4 без добавления препарата (вместо препарата вносят такое же количество среды RPMI-1640 без добавок) и неинфицированные клетки.
Планшет инкубируют в течение часа при 37°С для адсорбции вируса, затем клетки разводят до посевной концентрации (0,5х10 в миллилитре) питательной средой RPMI-1640 с добавлением 10% фетальной сыворотки КРС, предварительно инактивированной прогреванием при 56°С в течение 30 минут, 300 мг/мл L-глютамина и 100 мкг/мл гентамицина. Затем планшет помещают в термостат на 37°С в атмосфере 5% СО2. На 4 сутки культивирования подсчитывают концентрацию и жизнеспособность клеток формазановым методом. По полученным данным строят графики зависимости прироста жизнеспособности клеток относительно контроля под действием возрастающих доз препаратов, т.е. определяют способность препаратов защищать инфицированные клетки от цитопатогенного действия вируса. Оценку анти-ВИЧ активности соединений проводят с использованием количественного определения вирусспецифического белка р24 методом прямого иммуноферментного анализа, как описано в [Leslie R.Bisset, Hans Lutz, Jurg Boni, Regina Hoffmann-Lehmann, Ruedi Luthy, Jorg Schupbach. Combined effect of zidovudine (ZDV), lamivudine (3TC) and abacavir (ABC) antiretroviral therapy in suppressing in vitro FIV replication. Antiviral Research 53 (2002) 35-451], и строят дозозависимые кривые (фиг.1-4), по которым рассчитывают концентрации, на 50 и 90% подавляющие прирост вирусного антигена (ID50 и ID90). Терапевтический индекс, или индекс селективности (IS) считают как отношение 50%-ной токсической концентрации соединения к его 50%-ной эффективной дозе. Соединение I (2’,3’-Дидезокси-2’,3’-дидегидротимидин 5’-фосфодиморфолидат) при внесении в культуру чувствительных клеток одновременно с ВИЧ по своей эффективности на порядок и более превосходит исходный препарат d4T по ID50 и на два порядка по ID90, при внесении после адсорбции вируса - на два порядка превосходит исходный препарат по ID50 при почти одинаковом уровне 90%-го ингибирования. Соединения II (3’-Азидо-2’,3’-дидезокситимидин 5’-фосфобис (метоксиамид)) и III (3’-Азидо-2’,3’-дидезокситимидин 5’-фосфоморфолидат) проявили активность, сравнимую с активностью исходного азидотимидина, примерно одинаковую при добавлении одновременно с ВИЧ и при добавлении в постадсорбционных условиях. На основании этих количественных показателей ингибирования можно судить об эффективности противовирусного действия новых соединений, заключающейся в высокой степени подавления репликации ВИЧ-1 в культуре клеток МТ-4 и превышающей эффективность исходных d4T и AZT.
| название | год | авторы | номер документа |
|---|---|---|---|
| 5`-АМИНОКАРБОНИЛФОСФОНАТЫ D4Т - ИНГИБИТОРЫ РЕПРОДУКЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2003 |
|
RU2247124C1 |
| 2',3'-ДИДЕГИДРО-2',3'-ДИДЕЗОКСИТИМИДИН-5'[(ЭТОКСИКАРБОНИЛ)(ЭТИЛ)ФОСФОНАТ]- ИНГИБИТОР РЕПРОДУКЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2000 |
|
RU2188203C2 |
| МОДИФИЦИРОВАННЫЕ 5'-ФОСФОНАТЫ АЗТ В КАЧЕСТВЕ АКТИВНЫХ КОМПОНЕНТОВ ДЛЯ ПОТЕНЦИАЛЬНЫХ ПРОТИВОВИРУСНЫХ ПРЕПАРАТОВ | 2004 |
|
RU2322450C2 |
| МОДИФИЦИРОВАННЫЕ НУКЛЕОЗИД-5'-ТРИФОСФАТЫ КАК АНТИВИРУСНЫЕ АГЕНТЫ | 1996 |
|
RU2183213C2 |
| 5'-ФОСФОРСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ 2',3'-ДИДЕЗОКСИ-3'-ТИАЦИТИДИНА НОВЫЕ ПРОТИВОВИРУСНЫЕ АГЕНТЫ | 2007 |
|
RU2373218C2 |
| 5`-ХОЛИНФОСФАТ 3`-АЗИДО-3`-ДЕЗОКСИТИМИДИНА КАК АНТИВИРУСНЫЙ АГЕНТ | 2002 |
|
RU2293739C2 |
| УРЕТАНОВЫЕ ПРОИЗВОДНЫЕ АЗТ - ПОТЕНЦИАЛЬНЫЕ ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ | 2009 |
|
RU2430103C1 |
| НОВЫЕ ДЕПО-ФОРМЫ ЗИДОВУДИНА И ЛАМИВУДИНА НА ОСНОВЕ ПРОИЗВОДНЫХ ФОСФОНОВЫХ КИСЛОТ | 2009 |
|
RU2430104C1 |
| ПРОИЗВОДНЫЕ 5'-H-ФОСФОНАТА 3'-АЗИДО-3'-ДЕЗОКСИТИМИДИНА И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2001 |
|
RU2187509C1 |
| СОЛИ 5'-АМИНОКАРБОНИЛФОСФОНАТА 3'-АЗИДО-3'-ДЕЗОКСИТИМИДИНА, ЯВЛЯЮЩИЕСЯ СЕЛЕКТИВНЫМИ ИНГИБИТОРАМИ ПРОДУКЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА ВИЧ-1 | 2010 |
|
RU2441016C1 |
Изобретение относится к фосфорамидатам нуклеозидных аналогов, включающим 5'-фосфодиморфолидат 2',3'-дидезокси-2',3'-дидегидротимидина (формула I) и фосфорамидаты 3'-азидо-3'-дезокситимидина (формулы II и III), ингибирующим активность репродукции вируса иммунодефицита человека. Соединения по изобретению устойчивы к действию ферментов дефосфорилирования, способны проникать внутрь клетки и обладают избирательной активностью в подавлении биосинтеза ДНК, катализируемого обратной транскриптазой ВИЧ. 4 фиг., 1 табл.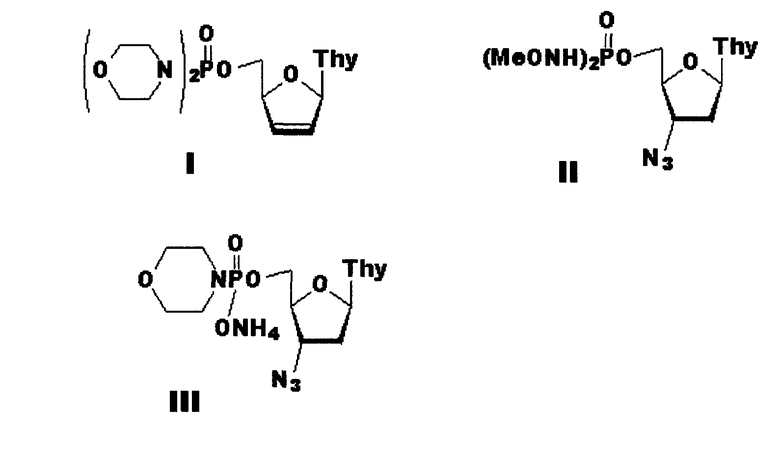
Фосфорамидаты нуклеозидных аналогов, представляющие собой 5'-фосфодиморфолидат 2',3'-дидезокси-2',3'-дидегидротимидина (формула I) или фосфорамидаты 3'-азидо-3'-дезокситимидина (формулы II и III), ингибирующие активность репродукции вируса иммунодефицита человека и имеющие следующие формулы:
| RU 2000123650, 27.08.2002, БИ № 24, с | |||
| Способ получения нерастворимых лаков основных красителей в субстанции и на волокнах | 1923 |
|
SU132A1 |
Авторы
Даты
2005-01-10—Публикация
2003-06-26—Подача