Изобретения относятся к медицине и могут использоваться при контроле за состоянием больных с нарушением мозгового кровообращения и для дифференциальной диагностики эпилепсии и эпилептиформных проявлений.
Пароксизмальные состояния нервной системы относятся к нервньм заболеваниям, которые широко распространены, особенно в развитых странах, и имеют тенденцию к увеличению. Диагностика этих заболеваний производится, как правило, по данным тщательного клинического обследования пациентов, включающего применение электрофизиологических методов, ангиографии, рентгеноскопии, метода ядерного магнитного резонанса, позитронно-эмиссионной томографии и других инструментальных подходов. Для уточнения диагноза нередко используют клинико-биохимический анализ крови и других биологических жидкостей на содержание возбуждающих и тормозных нейромедиаторов и нейропептидов или продуктов их метаболизма: глютамата, ГАМК, серотонина, дофамина, моноаминооксидазы, эндорфина и др. (см., например, патент Российской Федерации №2112243, МПК7 G 01 N 33/53, C 12 Q 1/04, А 61 К 39/00) Однако использование всех этих методов для оценки функционального состояния мозга и организма не позволяет однозначно определить степень вовлеченности определенных обменных и регуляторных систем в патогенез заболевания, что очень важно для определения тактики лечения, требует больших временных и экономических затрат на выполнение исследований, не обладает достаточным уровнем специфичности для каждой нозологической формы, практически не дает возможности выявлять предрасположенность (группу риска), проводить диагностику заболеваний на ранних стадиях.
Известен способ определения биоэлектрической активности мозга, включающий наложение на голову пациента измерительных электродов над мозгом и нулевого электрода на определенном расстоянии от мозга, усиление сигналов с измерительных электродов в два этапа: на первом этапе биопотенциал с каждого измерительного электрода поступает на один вход соответствующего дифференциального усилителя, на второй вход которого подается биопотенциал с нулевого электрода, на втором этапе выходной сигнал каждого дифференциального усилителя сравнивается с усредненным выходным сигналом дифференциальных усилителей соседних измерительных электродов (см. заявку Великобритании № 1501803, МПК3 А61В 5/04, НКИ G1N, A3R, публ. 1979 г.). Этот способ из-за отсутствия возможности измерения подэлектродных сопротивлений не обладает достаточной точностью регистрации сверхмедленной (менее 1 Гц) биоэлектрической активности мозга, по которой оценивается величина церебральных энергозатрат. Поэтому такое исследование функционального состояния мозга мало информативно для дифференциальной диагностики эпилепсии и эпилептиформных проявлений.
В патенте Российской Федерации № 2007116, МПК5 А 61 В 5/04, публ. 1994 г., описан способ регистрации сдвига уровня постоянного электрического потенциала головного мозга, используемый при оценке стабильности функционального состояния, при диагностике неврозов и психических заболеваний. Способ осуществляется следующим образом. На голове испытуемого устанавливают пару регистрирующих электродов над заданным участком мозга. Электроды подсоединяют к усилителю электрических напряжений, с выхода которого считывают в начале и конце сдвига, вызванного внешним воздействием, значения постоянного электрического потенциала и сравнивают их между собой. Для исключения влияния нестабильности межэлектродного кожного потенциала вход усилителя кратковременно шунтируют эталонным сопротивлением и осуществляют сравнение между снижением сопротивления, возникающего при кратковременном шунтировании входа усилителя в начале и конце сдвига. Если снижение усиления одинаково, то полагают, что влияние кожного потенциала не сказывается, и результат регистрируется. Если же снижение усиления в начале и конце сдвига разное, то считается, что результаты искажены нестабильностью кожного потенциала, и регистрация не осуществляется. Недостаток такого способа оценки функционального состояния мозга - ограниченная применимость, отсутствие возможности дифференциальной диагностики мозгового кровообращения, малая информативность и низкая точность из-за нестабильности и различия подэлектродного сопротивления.
Патентом Российской Федерации № 2187958, МПК7 А 61 В 5/04, публ. 2002 г., защищен способ исследования состояния сосудов головного мозга, включающий локальное холодовое воздействие и реоэнцефалографию, отличающийся тем, что локальное холодовое воздействие осуществляют в проекции бассейна сосудов внутренней сонной артерии теплообменником с температурой t° =10±2° С в течение 10 мин, причем реоэнцефалография проводится до, сразу и через 10 и 20 мин после холодового воздействия. Этот способ имеет ограниченное применение и непригоден для дифференциальной диагностики эпилепсии и эпилепиформных проявлений.
Из описания к патенту Российской Федерации № 2189776, МПК7 А 61 В 5/0476, публ. 2002 г., известен способ диагностики и прогнозирования развития эпилепсии у пациентов с доклинической стадией болезни. Регистрируют электроэнцефалограмму в состоянии пациента пассивного бодрствования. Методом кросскорреляционного анализа обрабатывают фрагменты ЭЭГ длительностью не более одной минуты, которые не содержат пароксизмальной активности. Получают коэффициенты кросскорреляций (ККр) альфа-активности между отведениями левой лобной и левой затылочной областей. Полученные значения ККр в пределах от –1,00 до -0,35 свидетельствуют о здоровье пациента, при значениях ККр от -0,34 до 0,00 диагностируют доклиническую стадию эпилепсии, а при значениях ККр от 0,01 до 1,00 - клиническую стадию эпилепсии. Способ позволяет повысить точность диагностики развития эпилепсии. Недостаток - способ имеет ограниченное применение и не позволяет из-за малой информативности осуществлять дифференциальную диагностику нарушений мозгового кровообращения.
Известен способ определения нарушения кровоснабжения головы (см. патент Российской Федерации № 2159075, МПК7 А 61 В 5/05, публ. 2000 г.), в соответствии с которым регистрируют дифференциальные реограммы с области шеи, груди, рук. Измеряют их амплитудно-временные характеристики. Рассчитывают объем притока крови к голове как разность объемов кровотока на участках грудь - шея и грудь - руки. Регистрируют огибающую реограмму на участке грудь - шея и измеряют амплитуды ее венозной систолической и основной волн. Рассчитывают их соотношение. Регистрируют ультразвуковую доплерограмму потока крови через правое атриовентрикулярное отверстие сердца. Измеряют по ней средние скорости потока крови во время раннего наполнения правого желудочка сердца и систолы правого предсердия. Рассчитывают их соотношение. Нарушение кровоснабжения головы определяют по рассчитанным величинам. Недостаток этого способа - он позволяет выявить патологические нарушения только при их клинической выраженности и мало эффективен в донозологической диагностике.
Из описания к патенту Российской Федерации № 2188575, МПК7 А 61 В 5/0476, G 01 N 33/53, публ. 2002 г., известен способ диагностики и прогнозирования развития эпилепсии у пациентов с доклинической стадией болезни, включающий ЭЭГ-мониторинг, обработку полученной ЭЭГ методом фрактального анализа и получение значений фрактальной размерности (ФР), расчет значений теста параксимальной активности (ПАТ) по содержанию в крови пациента аутоантител к квисквалатсвязывающему мембранному белку, расчет индекса эпилепсии (ИЭ) по формуле ИЭ=ПАТ × ФР и диагностирование клинической стадии эпилепсии при значениях ИЭ=132,5±5,32, отсутствие признаков эпилепсии при значениях ИЭ=45,05±3,31 и доклинической стадии эпилепсии при промежуточных значениях ИЭ. Этот способ позволяет выявить доклиническую стадию эпилепсии, но мало информативен для дифференциальной диагностики эпилепсии и эпилептиформных проявлений.
Из патента Российской Федерации № 2103912, МПК6 А 61 В 5/0476, публ. 1998 г., известен способ исследования мозга, согласно которому снимают электроэнцефалограмму до и после предъявления стимула, вычисляют спектр мощности ЭЭГ или коэффициент синхронности электрических процессов в каждой точке расположения электрода по отношению к соседним. Определяют изменение величины полученных значений после стимула и представляют результаты вычислений в виде топографической карты. Дополнительно в точках расположения электродов измеряют температуру, рассчитывают ее разность и вносят в карту. Этот способ позволяет одновременно с измерением и исследованием электрических процессов, измерять и исследовать тепловое поле головы. Недостаток этого способа - отсутствие возможности дифференциальной диагностики нарушений мозгового кровообращения, отсутствие возможности различения эпилепсии и эпилептиформных проявлений.
Известен способ диагностики степени психофизиологической дезадаптации у больных с начальными формами хронической цереброваскулярной патологии (см. патент Российской Федерации № 2154979, МПК7 А 61 В 5/04, 5/0476, публ. 2000 г.). Этот способ осуществляется следующим образом. Больному, находящемуся в состоянии расслабленного бодрствования с закрытыми глазами, производят многоканальную запись ЭЭГ по стандартной методике, располагая 19 или более электродов для отслеживания артефактов. Одновременно осуществляют компьютерный спектральный анализ лишенных артефактов фрагментов ЭЭГ с оценкой мощности спектрограммы в полосах частот альфа-(8... 12 Гц), бета-(12 Гц и выше), тета-(4... 8 Гц) и дельта-(0...4 Гц) активности. При значении абсолютной мощности альфа-активности более 10 мкВ2, или более 80 мкВ2, и/или при значениях мощности альфа-активности более 50% диагностируют значительную степень психофизиологической дезадаптации. Описанный способ позволяет объектизировать у больных с начальными формами сосудистых заболеваний головного мозга значительную психофизиологическую дезадаптацию, являющуюся важным патогенетическим фактором развития патологии. Недостаток такого способа - низкая эффективность при установлении причин нарушения мозгового кровообращения и при дифференциальной диагностике эпилепсии и эпилептиформных проявлений.
Наиболее близким к заявляемому способу исследования функционального состояния головного мозга по большинству совпадающих признаков является способ исследования индивидуальных особенностей регуляции физиологических функций организма человека, защищенный патентом Российской Федерации № 2185088, МПК7 А 61 В 5/00, 5/04, публ. 2002 г. Способ исследования индивидуальных особенностей регуляции физиологических функций включает запись электроэнцефалограммы (ЭЭГ), электрокардиограммы (ЭКГ) пневмограммы, измерение артериального давления (АД) и проведение семи функциональных дыхательных проб. Особенности регуляции физиологических функций определяют по показателям внешнего дыхания и газообмена, РАСО2, РАО2, пневмограммы, характеру и скорости появления изменений ЭКГ, АД, ЭЭГ, латентного периода двигательной реакции, скорости выработки не дыхательных условных рефлексов. Первую пробу, 1-2-минутную не дозированную по интенсивности гипервентиляцию, проводят с учетом ощущений, обусловленных изменениями мозгового кровообращения, головокружения, легкой головной боли, пелены перед глазами, изменениями в деятельности ЦНС, проявляющимися в форме сенсорных или двигательных расстройств, в виде парестезии, онемения, скованности, напряженности, дрожи, а также вегетативными сдвигами в виде ощущения тепла, учащения сердцебиений, потливости, сухости во рту, позволяющими выявить физиологические функции: сердечно-сосудистые, дыхательные, нервной системы, участвующие в развитии гипервентиляционного синдрома. Вторую пробу - жесткую гипервентиляцию осуществляют на протяжении 2,5-3,5 минут, во время которой испытуемому дают команды для поддержания уровня вентиляции, проводят с целью выявления людей, чувствительных к гипервентиляции, регистрируя скорость появления ощущений и их характер. Третью пробу - изокапническую гипервентиляцию, обеспечивающую поддержание у обследуемых стабильного уровня РСО2, проводят для выявления испытуемых с преобладанием нейрогенного фактора в регуляции функций. Четвертая проба - задержка дыхания на уровне спокойного вдоха. Пятая проба - задержка дыхания на уровне обычного выдоха. Шестая проба - задержка дыхания на вдохе после произвольной гипервентиляции. Во всех трех пробах с задержкой дыхания определяют время от начала задержки дыхания до первого побуждения к дыханию (1-я фаза) и до возобновления дыхания (2-я фаза), а также общее время задержки дыхания. По первой фазе оценивают индивидуальную чувствительность испытуемых к совокупности гуморальных СО2 и O2 и нейрогенных факторов, по второй фазе оценивают способность к волевым усилиям. Седьмая проба - гиповентиляция - режим дыхания, при котором обследуемый дышит не менее 10 минут в ритме два дыхания в минуту без ограничения глубины, после предварительной дыхательной тренировки, срок которой индивидуально обусловлен. Перечисленные семь проб позволяют выявить индивидуальную чувствительность обследуемых к гуморальным и нейрогенным факторам, причем первая и вторая пробы с гипервентиляцией - к степени падения РАСО2 и выраженным в разной степени нейрогенным сдвигам, третья проба с гипервентиляцией - только к нейрогенным факторам, четвертая и пятая пробы с задержкой дыхания - к накоплению СO2, снижению РАО2 и нейрогенньм факторам, шестая проба с задержкой дыхания - к снижению РАО2, седьмая - к снижению РАО2, накоплению РАСО2, нейрогенньм факторам, тренируемости дыхания и способности к установлению нового, более эффективного стереотипа дыхания. Достигаемый результат заключается в возможности получения наиболее полной информации о формировании физиологических реакций организма на произвольное управление дыханием и его адаптивных возможностях, целенаправленного влияния на функциональное состояние организма, повышении умственной и физической работоспособности здоровых людей, увеличении эффективности адаптации к изменяемым условиям окружающей среды, тренировки и установления нового эффективного стереотипа дыхания. Недостаток способа прототипа - он применим для исследования индивидуальных особенностей здоровых людей и неэффективен при установлении причин нарушения мозгового кровообращения, при дифференциальной диагностике эпилепсии и эпилептиформных проявлений, при выявлении начальных проявлений цереброваскулярных нарушений и прогнозе их развития.
Задача, решаемая изобретением, - повышение эффективности при установлении причин нарушения мозгового кровообращения и при дифференциальной диагностике эпилепсии и эпилептиформных проявлений, выявлении начальных проявлений цереброваскулярных нарушений и прогнозе их развития.
Решение указанной задачи достигается тем, что в способе исследования функционального состояния головного мозга, включающем многоканальную запись электроэнцефалограммы (ЭЭГ), электрокардиограммы (ЭКГ), проведение функциональной пробы и компьютерный анализ электрофизиологических сигналов, дополнительно, синхронно с многоканальной записью ЭЭГ и ЭКГ в реальном масштабе времени, осуществляют регистрацию сверхмедленной активности мозга, запись реоэлектроэнцефалограммы (РЭГ) в бассейнах сонных и позвоночных артерий и фотоплетизмограммы (ФПГ) пальцев рук и/или ног и измерение подэлектродных сопротивлений электродов для снятия биоэлектрической активности головного мозга, при этом в едином покардиоцикловом временном масштабе, т.е. в привязке к каждому из автоматически распознаваемых кардиоциклов, осуществляют вычисление и визуализацию физиологических показателей биоэлектрической активности мозга - абсолютные и относительные значения мощности альфа-активности, патологической медленно-волновой активности в диапазоне дельта- и тета-волн, показатель динамики уровня метаболической активности головного мозга по постоянной составляющей ЭЭГ, частоту сердечных сокращений по ЭКГ, показатели пульсового кровенаполнения сосудов мозга по реографическим индексам РЭГ, показатель периферического сопротивления мозговых сосудов (ППСС), показатель тонуса периферических сосудов в виде амплитуды пульсации периферической ФПГ, показатель тонуса магистральных сосудов по времени распространения пульсовой волны от зубца Q сигнала ЭКГ до начала систолической волны периферической ФПГ, показатель тонуса посткапиллярно-венулярных сосудов по постоянной составляющей ФПГ, а дифференциальную диагностику эпилепсии и эпилептиформных проявлений производят по динамике изменений физиологических показателей до, во время и после проведения функциональной пробы. Для определения функционального состояния мозга проводят функциональную пробу на гипервентиляцию и, если после начала проведения пробы наблюдается снижение реографического индекса РЭГ более чем на 20%, а затем наблюдаются пароксизмальные проявления на ЭЭГ в виде резкого повышения отношения патологических медленно-волновых волн в дельта- и тета-диапазонах к альфа-активности, то потенциально возможной причиной пароксимальных проявлений на ЭЭГ формулируют сосудистые нарушения головного мозга. Если снижение реографического индекса РЭГ и появление пароксимальных проявлений на ЭЭГ сопровождается смещением уровня постоянного потенциала сверхмедленной активности мозга, то делается вывод о наличии влияния сосудистого фактора на пароксимальные проявления, сопровождающегося метаболическими изменениями. Если снижение реографического индекса РЭГ и появление пароксимальных проявлений на ЭЭГ не сопровождается значимым снижением периферического кровотока по ФПГ, то потенциально возможной причиной сосудистых нарушений головного мозга формулируют недостаточность регуляторных процессов по компенсаторному снижению периферического кровотока и перераспределению общего кровотока в жизненно важные органы. Если снижение реографического индекса РЭГ и появления пароксимальных проявлений на ЭЭГ совпадают, то дополнительно делается вывод о наличии фокуса патологической активноста, определяющего неадекватность регионарного мозгового кровотока. Если до проведения функциональной пробы на гипервентиляцию наблюдались дезорганизация ЭЭГ, снижение пульсового кровенаполнения и повышение тонуса по РЭГ, а в процессе проведения пробы наблюдалась нормализация показателей мозгового кровотока, выражающаяся в повышении пульсового кровенаполнения, снижении показателя периферического сопротивления мозговых сосудов, и нормализация ЭЭГ, выражающаяся в повышении уровня альфа-активнсти с сохранением зональных различий по лобно-затылочным областям, снижении отношения патологических медленно-волновых волн в дельта- и тета-диапазонах к альфа-активности, то формулируют предположение о наличии цереброваскулярных нарушений, связанных с нарушением газового состава крови в исходном фоновом состоянии. Если проводят функциональную пробу на гипервентиляцию и в процессе проведения пробы на сигнале ЭКГ наблюдаются экстрасистолы и им предшествуют пароксизмы на синхронно регистрируемых сигналах ЭЭГ, то делают вывод о цереброгенном характере нарушений сердечного ритма, если отсутствует причинно-временная связь между пароксизмами на ЭЭГ и экстрасистолами на ЭКГ, то делается вывод о кардиогенном характере нарушений сердечного ритма. Проводят длительную пассивную ортостатическую пробу и, если в процессе проведения пробы у пациента фиксируется синокопальное состояние, то при резко выраженной брадикардии или асистолии по ЭКГ до наступления синокопального состояния и снижении показателей мозгового кровотока по РЭГ диагностируют кардиоингибиторную причину синкопального состояния, при предшествующих синокопальному состоянию выраженных признаках депонирования крови в конечностях по ФПГ и снижении показателей мозгового кровотока по РЭГ и отсутствии значимого уменьшения частоты сердечных сокращений по ЭКГ диагностируют вазодепресивную причину синкопального состояния, а при предшествующих синкопальному состоянию пароксизмах на ЭЭГ и отсутствии значимого уменьшения частоты сердечных сокращений по ЭКГ и выраженных признаков депонирования крови в конечностях по ФПГ диагностируют судорожный тип обморока.
Устройство для исследования функционального состояния головного мозга является самостоятельньм объектом изобретения.
Известен электроэнцефалограф, защищенный патентом СССР N 880241, МПК3. А61В 5/04 (заявка ФРГ N 2727583 от 20.06.77 г.), содержащий измерительные электроды, накладываемые на голову пациента, селектор отведений, выполненный в виде изображения головы с размещенными на нем переключателями с индикаторньми лампочками, и сигнальные усилители, входы которых через селектор отведений подключается к измерительным электродам, а выходные сигналы управляют самописцами. В этом электроэнцефалографе обеспечивается наглядность подключения измерительных электродов ко входам усилителей, чем снижается вероятность их ошибочного подсоединения. К недостаткам такого электроэнцефалографа следует отнести отсутствие возможности оперативного анализа электроэнцефалограмм, невозможность выявления нарушений мозгового кровотока.
Известно устройство для оценки патологических изменений в системной деятельности мозга человека, включающее набор датчиков, налагаемых на голову человека и/или подключаемых к глубинным электродам, многоканальный усилитель сигналов датчиков с числом каналов, соответствующим числу датчиков, блок одновременного преобразования сигналов из непрерывной формы в дискретную, блок статистической обработки полученных данных и блок объемного воспроизведения (см. патент США № 4736751, МПК5 А 61 В 5/04, публ. 1988 г.). Такое устройство не обеспечивает выявление причин нарушения мозгового кровообращения и недостаточно эффективно при дифференциальной диагностике эпилепсии и элептиформных проявлений.
Из патента Российской Федерации № 2177716, МПК7 А 61 В 5/0476, публ. 2002 г., известно устройство для оценки патологических изменений в системной деятельности мозга, которое включает набор датчиков, налагаемых на голову человека, и/или подключаемых к глубинным электродам, и/или располагаемых на некотором расстоянии от головы, многоканальный усилитель сигналов датчиков, например электроэнцефалограф, с числом каналов, соответствующим числу датчиков, блок преобразования сигналов, например преобразования из непрерывной формы в дискретную, блок измерения статистической взаимосвязи между процессами, блок измерения размерности пространства отображаемых процессов, соответствующей совокупным статистическим свойствам взаимосвязей между измеряемыми процессами, блок вычисления координат и/или величин радиус-векторов отображаемых процессов, блок визуализации пространственного распределения радиус-векторов отображаемых процессов, например графопостроитель или графический дисплей, запоминающее устройство, блок измерения отличий параметров пространственных распределений радиус-векторов отображаемых процессов, блок визуализации отличий в интегративной деятельности мозга пациента, блок предъявления тестов и блок синхронизации. Устройство позволяет достоверно выявить степень и характер устойчивых патологических отклонений в системной деятельности мозга человека, определять их локализацию и характер нарушений, количественно оценивать степень патологических отклонений, связанных с выполнением тестов или с любыми переменами функционального состояния мозга. Недостаток этого устройства для оценки патологических изменений в системной деятельности мозга - сравнительно низкая эффективность при дифференциальной диагностике эпилепсии и элептиформных проявлений, отсутствие возможности диагностировать причину нарушения мозгового кровообращения.
Устройство для съема, регистрации и анализа электрофизиологических сигналов, защищенное патентом Российской Федерации № 2102004, МПК6 А 61 В 5/04, публ. 1998 г., содержит последовательно соединенные блок электродов, селективный многоканальный усилитель, мультиплексор, аналого-цифровой преобразователь, устройство управления и первичной обработки, блок гальванического разделения, интерфейсный блок и персональную ЭВМ. Цепи питания многоканального усилителя соединены с выходными шинами блока защиты от аварийных токов, первая группа входов которого подключена к электродам, а вторая к выходным шинам источника питания. Это устройство не эффективно при дифференциальной диагностике эпилепсии и элептиформных проявлений из-за отсутствия возможности измерения импеданса головного мозга синхронно со съемом сигналов биоэлектрической активности мозга и контроля подэлектродных сопротивлений.
Наиболее близким к заявляемому устройству для исследования функционального состояния головного мозга является устройство для исследования биологической активности мозга, содержащее блок отводящих электродов, датчик электрокардиосигнала, коммутационную панель, выполненную в виде изображения головы с гнездами для подключения отводящих электродов, многоканальный предварительный усилитель, входы которого соединены с соответствующими гнездами подключения коммутационной панели, а выходы с соответствующими информационными выходами селектора отведений, усилитель электрокардиосигнала, выходы которого соединены с соответствующими гнездами подключения коммутационной панели, блок контроля импеданса электродов, многоканальный селективный усилитель, аналого-цифровой преобразователь, генератор звуковых стимулов, генератор зрительных стимулов и ЭВМ с подключенными к ней накопителем на магнитных дисках, дисплеем и печатающим устройством, дополнительно включены блок измерительных электродов, блок измерения внутричерепного импеданса, блок контроля работоспособности с соединительной колодкой, четырехканальный дифференциальный усилитель, многоканальный аналоговый коммутатор, усилитель с регулируемыми напряжением смещения и коэффициентом усиления, блок памяти, микропроцессор, блоки обмена информацией и сопряжения и четырехканальный аналоговый переключатель (см. патент Российской Федерации № 2076625, МПК6 А 61 В 5/04, публ. 1997 г). Это устройство позволяет в течение одного сеанса обследования снимать и анализировать сигналы электроэнцефалографии, электрографии и реоэлектроэнцефалографии, контролировать параметры усилителей и импеданс электродов, что особенно важно при исследованиях с проведением функциональных проб.
Устройство для исследования биологической активности мозга по патенту Российской Федерации № 2076625 принято в качестве прототипа. Общими признаками заявляемого устройства с прототипом являются следующие:
- назначение - оба устройства предназначены для исследования функционального состояния головного мозга;
- оба устройства включают аналогичные по назначению функциональные узлы - блок электродов для съема сигналов биоэлектрической активности головного мозга (в прототипе это блок отводящих электродов), блок датчиков электрофизиологических сигналов (в прототипе - датчик электрокардиосигналов), блок токовых и потенциальных электродов для осуществления записи реосигналов (в прототипе - блок измерительных электродов), многоканальный усилитель сигналов биоэлектрической активности головного мозга (в прототипе - многоканальный предварительный усилитель), многоканальный усилитель реосигналов (в прототипе - многоканальный селективный усилитель), многоканальный аналого-цифровой преобразователь (в прототипе - многоканальный аналоговый переключатель и аналого-цифровой преобразователь), усилитель электрофизиологических сигналов (в прототипе - усилитель электрокардиосигнала), микроЭВМ (в прототипе - микропроцессор), ПЭВМ стандартной конфигурации (в прототипе - ЭВМ с дисплеем и печатающим устройством), генератор токовых реосигналов и синхронный детектор реосигналов (в прототипе - блок измерения внутричерепного импеданса);
- соединения блоков и узлов - блок электродов для съема сигналов биоэлектрической активности головного мозга и блок датчиков электрофизиологических сигналов соединены соответственно с многоканальным усилителем сигналов биоэлектрической активности головного мозга и усилителем электрофизиологических сигналов (в прототипе они соединены через коммутационную панель), многоканальный аналого-цифровой преобразователь, микроЭВМ и ПЭВМ стандартной конфигурации соединены последовательно (в прототипе через шину данных и устройство сопряжения соответственно).
Недостатки прототипа - отсутствие возможности синхронного съема сигналов электроэнцефалографии и реоэлектроэнцефалографии, что снижает возможность их взаимной корреляции, низкая точность измерения подэлектродного сопротивления, что снижает точность регистрации сверхмедленной биоэлектрической активности головного мозга. Эти недостатки существенно затрудняют дифференциальную диагностику эпилепсии и эпилептиформных проявлений и выявление начальных проявлений нарушений регуляторного характера.
Задача, решаемая изобретением, - повышение эффективности дифференциальной диагностики эпилепсии и эпилептиформных проявлений, выявление начальных проявлений нарушений регуляторного характера.
Решение указанной задачи достигается тем, что устройство для исследования функционального состояния головного мозга, содержащее последовательно соединенные многоканальный аналого-цифровой преобразователь, микроЭВМ с гальванически развязанными портами ввода-вывода и ПЭВМ стандартной конфигурации, блок электродов для съема сигналов биоэлектрической активности головного мозга, подключенный к многоканальному усилителю сигналов биоэлектрической активности головного мозга, блок датчиков электрофизиологических сигналов, соединенный с усилителем электрофизиологических сигналов, блок токовых и потенциальных электродов для осуществления записи реосигналов, многоканальный усилитель реосигналов, генератор токовых реосигналов и синхронный детектор реосигналов, дополнительно содержит двухчастотный прецизионный генератор тока, задающий вход которого подключен к микроЭВМ, первая группа выходов соединена с рабочими электродами, а вторая - с референтньми электродами блока электродов для съема сигналов биоэлектрической активности головного мозга, коммутатор отведений, первая группа входов которого соединена с потенциальными электродами блока токовых и потенциальных электродов для осуществления записи реосигналов, вторая группа входов - с выходами генератора токовых реосигналов, первая группа выходов - с токовыми электродами блока токовых и потенциальных электродов для осуществления записи реосигналов, вторая группа выходов - с входами синхронного детектора реосигналов, демультиплексор, вход которого соединен с выходом синхронного детектора реосигналов, а выходы с входами многоканального усилителя реосигналов, выходы многоканального усилителя сигналов биоэлектрической активности головного мозга, многоканального усилителя реосигналов и усилителя электрофизиологических сигналов соединены с соответствующими входами многоканального аналого-цифрового преобразователя, выходы микроЭВМ соединены с входом управления коммутатора отведений, входом управления демультиплексора, входом управления многоканального аналого-цифрового преобразователя и входами синхронизации генератора токовых реосигналов и синхронного детектора реосигналов. Блок датчиков электрофизиологических сигналов содержит электроды для съема электрической активности сердца, электрических сигналов двигательной активности мышц, фотодатчик пульсовой волны и датчик дыхательной волны. Генератор токовых реосигналов содержит источник постоянного напряжения, полюсы которого через управляемый переключатель и узкополосный усилитель напряжения соединен с входом линейного преобразователя напряжение - ток, выход которого является выходом генератора. Синхронный детектор реосигналов содержит последовательно соединенные дифференциальный усилитель, полосовой фильтр и инвертор, а также управляемый переключатель, переключаемые входы соединены с входом и выходом инвертора, входами синхронного детектора являются входы дифференциального усилителя и управляющий вход управляемого переключателя, выходом - выход управляемого переключателя. Двухчастотный прецизионный генератор тока содержит два частотных делителя, входы которых объединены и являются задающим входом генератора, а выходы через конденсаторы емкостью 10... 20 pF соединены: первого с выходами для подключения рабочих электродов, второго - для подключения референтных электродов. Усилительный канал многоканального усилителя сигналов биоэлектрической активности головного мозга содержит последовательно соединенные дифференциальный усилитель, неинвертирующий вход которого соединен с входом для подключения соответствующего рабочего электрода, а инвертирующий - через согласующий каскад с входом для подключения референтного электрода, усилитель с коэффициентом усиления по постоянному току, равном единице, и усилением в рабочей полосе частот, равном номинальному, и фильтр нижних частот.
Способ измерения подэлектродных сопротивлений является самостоятельньм объектом изобретения.
Известен способ измерения электрокожного сопротивления, защищенный авторским свидетельством СССР № 1821195, МПК5 А 61 Н 39/00, А 61 В 5/05, публ. 1993 г., по которому на кожу накладывают измерительные электроды, пропускают между ними знакопостоянные стабилизированные импульсы электрического тока длительностью 200... 380 мксек при плотности тока 7,1... 36,2 мкА, многократно измеряют сопротивление в конце каждого импульса, вычисляют значение поправки к измеряемому сопротивлению как разность между значением сопротивления при первом измерении и значением сопротивления при втором через 42 сек после первого измерения, а значение сопротивления при каждом последующем измерении определяют с учетом этой поправки. Этот способ неприменим для синхронного измерения подэлектродного сопротивления при регистрации биопотенциалов головного мозга и/или электрических сигналов, генерируемых сердцем и/или электрических сигналов мышечных движений.
По способу двухэлектродного измерения электрического сопротивления биообъектов, защищенному авторским свидетельством СССР №1204182, МПК4 А 61 В 5/05, G 01 R 27/02, публ. 1986 г., на исследуемом объекте размещают электроды, через которые пропускают измерительный ток и измеряют межэлектродное сопротивление R1, затем изменяют величину измерительного тока и площадь электродов в k раз при условии неизменности внешних габаритов электродов и измеряют новое значение межэлектродного сопротивления R2, а величину сопротивления ткани биообъекта и подэлектродного сопротивления R3 вычисляют по формулам. Этот способ также неприемлем для синхронного измерения подэлектродных сопротивлений при регистрации биопотенциалов головного мозга и/или электрических сигналов, генерируемых сердцем и/или электрических сигналов мышечных движений.
Технический результат от использования изобретения - обеспечение возможности синхронного измерения подэлектродных сопротивлений при регистрации биопотенциалов головного мозга и/или электрических сигналов, генерируемых сердцем и/или электрических сигналов мышечных движений.
Указанный результат достигается тем, что в способе измерения подэлектродного сопротивления при регистрации биопотенциалов головного мозга и/или электрических сигналов, генерируемых сердцем, и/или электрических сигналов мышечных движений с использованием дифференциальных усилителей этих сигналов, на каждый рабочий электрод подают сигнал от узкополосного генератора тока с частотой f1, превышающей верхнюю частоту регистрируемых сигналов fвepx, а на референтный электрод подают сигнал от узкополосного генератора тока с частотой f2≠f1>fвepx, узкополосной фильтрацией выделяют и измеряют на выходе каждого усилителя напряжения с частотами f1 и f2 - Uf1 и uf2, а подэлектродное сопротивление каждого из электродов определяют с учетом значений токов узкополосных генераторов тока с частотами f1 и f2 - Jf1, Jf2 и измеренных напряжений с частотами f1 и f2 - Uf1, Uf2. Подэлектродное сопротивление каждого рабочего электрода определяют по формуле Zj=Ujf1:(Jf1×Kj), где Zj - подэлектродное сопротивление j-го электрода, Ujf1 - напряжение на выходе j-го усилителя с частотой f1, Jf1 - ток узкополосного генератора тока с частотой f1, Kj - коэффициент усиления j-го усилителя, а подэлектродное сопротивление референтного электрода определяют по формуле: ZA=Ujf2:(Jf1×Kj), где ZA - подэлектродное сопротивление референтного электрода А, сопричастного j-му усилителю, Ujf2 - напряжение на выходе j-го усилителя с частотой f2, jf2 - ток узкополосного генератора тока с частотой f2.
Заявителем не выявлены источники, содержащие информацию о технических решениях, идентичных настоящим изобретениям, что позволяет сделать вывод об их соответствии критерию "новизна".
Заявителю не известны какие-либо публикации, которые содержали бы сведения о влиянии отличительных признаков изобретений на достигаемый технический результат. В связи с этим, по мнению заявителя, можно сделать вывод о соответствии заявляемых технических решениях критерию "изобретательский уровень".
Изобретения поясняются чертежами. На фиг.1 приведена структурная схема устройства для исследования функционального состояния головного мозга, на фиг.2 - функциональная схема усилительного канала усилителя сигналов биоэлектрической активности головного мозга, на фиг.3 - функциональная схема генератора токовых реосигналов, на фиг.4 - функциональная схема синхронного детектора реосигналов, на фиг.5 - функциональная схема двухчастотного прецизионного генератора тока, на фиг.6 и 8 представлены примеры записи значений физиологических сигналов: слева исходное фоновое состояние, справа - с трехминутой гипервентиляцей, на фиг.7 и 9 - покардиоцикловая динамика физиологических показателей для этих примеров, на фиг.10 изображена функциональная схема, поясняющая способ измерения подэлектродных сопротивлений.
Перечень позиций на фиг.1 - фиг.5:
1 - блок электродов для съема сигналов биоэлектрической активности головного мозга;
2 - блок датчиков электрофизиологических сигналов;
3 - блок токовых и потенциальных электродов для осуществления записи реосигналов;
4 - коммутатор отведений;
5 - генератор токовых реосигналов;
6 - синхронный детектор реосигналов;
7 - многоканальный усилитель сигналов биоэлектрической активности головного мозга;
8 - усилители электрофизиологических сигналов;
9 - демультиплексор;
10 - многоканальный усилитель реосигналов;
11 - многоканальный аналого-цифровой преобразователь (МАЦП);
12 - микроЭВМ с гальванически развязанным портом ввода-вывода;
13 - двухчастотный прецизионный генератор тока;
14 - ПЭВМ стандартной конфигурации;
15 - управляемый переключатель;
16 - фильтр нижних частот;
17 - полосовой фильтр;
18 - управляемый переключатель;
19 - частотный делитель с частотой f1;
20 - частотный делитель с частотой f2.
Заявленный способ исследования функционального состояния головного мозга реализуется следующим образом. На голову пациента накладывают электроды для съема биоэлектрической активности головного мозга и для регистрации реографических сигналов в бассейнах сонных и позвоночных артерий, на груди закрепляют электроды для съема электрокардиографических сигналов, датчик кожно-гальванической реакции, датчик дыхательной волны (при необходимости), на пальцы руки - датчики пульсовой волны (кровенаполнения). Электроды и датчики подключены каждый к отдельному входу многоканального усилителя, соединенного с многоканальным аналого-цифровым преобразователем, выход которого соединен с гальванически развязанным портом ввода-вывода микроЭВМ. Это позволяет осуществлять синхронно в реальном масштабе времени многоканальную запись электроэнцефалограммы (ЭЭГ), запись реоэлектроэнцефалограммы (РЭГ) в бассейнах сонных и позвоночных артерий, запись электрокардиограммы (ЭКГ), фотоплетизмограммы (ФПГ) и пневмограммы и производить их компьютерный анализ. Одновременно с многоканальной записью электроэнцефалограммы, реоэлектроэнцефалограммы и электрокардиограммы измеряют подэлектродные сопротивления, что обеспечивает не только контроль надежности контактов электродов с кожей, но и более высокую точность определения показателей электроэнцефалограммы, а также регистрацию сверхмедленной активности мозга (СМА) в течение проведения функциональных проб. Компьютерный анализ и обработка электрофизиологических сигналов в ПЭВМ позволяют в едином покардиоцикловом временном масштабе, т.е. в привязке к каждому из автоматически распознаваемых кардиоциклов, осуществлять вычисление и визуализацию физиологических показателей биоэлектрической активности мозга - абсолютные и относительные значения мощности альфа-активности, патологической медленно-волновой активности в диапазоне дельта- и тета-волн, показатель динамики уровня метаболической активности головного мозга по постоянной составляющей ЭЭГ, частоту сердечных сокращений по ЭКГ, показатели пульсового кровенаполнения сосудов мозга по реографическим индексам РЭГ, показатель периферического сопротивления мозговых сосудов (ППСС), показатель тонуса периферических сосудов в виде амплитуды пульсации периферической ФПГ, показатель тонуса магистральных сосудов по времени распространения пульсовой волны от зубца Q сигнала ЭКГ до начала систолической волны периферической ФПГ, показатель тонуса посткапиллярно-венулярных сосудов по постоянной составляющей ФПГ, спектральный анализ лишенных артефактов фрагментов ЭЭГ с оценкой мощности спектрограмм в стандартных частотных диапазонах. Определение всех этих показателей производится по известным формулам. После включения и проверки работы аппаратуры проводят функциональную пробу на гипервентиляцию в типовом режиме. Пациенту предлагают глубоко ритмично дышать в течение 3 минут. Глубина вдоха и полнота выдоха должны быть максимальными, частота дыхания в пределах 16... 20 в минуту. Параметры дыхания контролируются с помощью датчика дыхательной волны. Запись и регистрацию электрофизиологических показателей необходимо производить как минимум за 3 минуты до пробы и не менее 5 минут после ее окончания. При констатации в процессе проведения пробы наличия снижения реографического индекса и пароксизмаксимальных проявлений на ЭЭГ в виде резкого повышения отношения патологических медленно-волновых волн в дельта- и тета-диапазонах к альфа-активности различают потенциально возможные причины пароксизмальных проявлений на ЭЭГ. Дифференциальная диагностика эпилепсии и эпилептиформных проявлений заключается в следующем. Если вначале наблюдалось снижение реографического индекса более чем на 20%, а затем наблюдаются пароксизмальные проявления, то причиной следует считать с большой вероятностью сосудистые нарушения головного мозга. Если снижение реографического индекса РЭГ и появление пароксимальных проявлений на ЭЭГ сопровождается смещением уровня постоянного потенциала, то делается вывод о наличии влияния сосудистого фактора на пароксимальные проявления, сопровождающегося метаболическими изменениями. Если снижение реографического индекса РЭГ и появление пароксимальных проявлений на ЭЭГ не сопровождается значимым снижением периферического кровотока по ФПГ, то потенциально возможной причиной сосудистых нарушений головного мозга может быть недостаточность регуляторных процессов по компенсаторному снижению периферического кровотока и перераспределению общего кровотока в жизненно важные органы. Если снижение реографического индекса РЭГ и появления пароксимальных проявлений на ЭЭГ совпадают, то дополнительно делается вывод о наличии фокуса патологической активности, определяющего неадекватность регионарного мозгового кровотока. Если до проведения функциональной пробы на гипервентиляцию наблюдались дезорганизация ЭЭГ, снижение пульсового кровенаполнения и повышение тонуса по РЭГ, а в процессе проведения пробы наблюдалась нормализация показателей мозгового кровотока, выражающаяся в повышении пульсового кровенаполнения, снижении показателя периферического сопротивления мозговых сосудов, и нормализация ЭЭГ, выражающаяся в повышении уровня альфа-активности с сохранением зональных различий по лобно-затылочным областям, снижении отношения патологических медленно-волновых волн в дельта- и тета-диапазонах к альфа-активности, то предполагают наличие цереброваскулярных нарушений, связанных с нарушением газового состава крови в исходном фоновом состоянии. Если проводят функциональную пробу на гипервентиляцию и в процессе проведения пробы на сигнале ЭКГ наблюдаются экстрасистолы и им предшествуют пароксизмы на синхронно регистрируемых сигналах ЭЭГ, то делают вывод о цереброгенном характере нарушений сердечного ритма. Если отсутствует причинно-временная связь между пароксизмами на ЭЭГ и экстрасистолами на ЭКГ, то делается вывод о кардиогенном характере нарушений сердечного ритма. Для выявления причин синокопальных состояний проводят длительную пассивную ортостатическую пробу и, если в процессе проведения пробы у пациента фиксируется синокопальное состояние, то при резко выраженной брадикардии или асистолии по ЭКГ до наступления синокопального состояния и снижении показателей мозгового кровотока по РЭГ диагностируют кардиоингибиторную причину синкопального состояния, при предшествующих синокопальному состоянию выраженных признаках депонирования крови в конечностях по ФПГ и снижении показателей мозгового кровотока по РЭГ, и отсутствии значимого уменьшения частоты сердечных сокращений по ЭКГ диагностируют вазодепресивную причину синкопального состояния, а при предшествующих синкопальному состоянию пароксизмах на ЭЭГ и отсутствии значимого уменьшения частоты сердечных сокращений по ЭКГ и выраженных признаков депонирования крови в конечностях по ФПГ диагностируют судорожный тип обморока.
Синхронная регистрация ЭЭГ, РЭГ, СМА и других сигналов с возможностью сжатого представления в едином временном масштабе трендов физиологических показателей позволяет расширить диагностические возможности при исследовании различных заболеваний и нарушений. Она позволяет контролировать корректность проведения исследований (в частности, провоцирующих проб на гипервентиляцию), учитывать возможное влияние сосудистого фактора при эпилепсии, выявлять пациентов с неправильно сформированным дыхательным паттерном, приводящим к цереброваскулярньм нарушениям, давать полезную информацию при дифференциальной диагностике синкопальных состояний, исследовать характер взаимодействий между системами организма при различных нарушениях, обеспечивать более обоснованный выбор лечебных мероприятий и оценку их эффективности.
В связи с важностью совокупных исследований, позволяющих одновременно контролировать изменения ЭЭГ и РЭГ в процессе проведения различных функциональных проб, по результатам которых может быть установлена достоверная зависимость между патологическими ритмами ЭЭГ и динамикой изменений мозгового кровотока - амплитуды РЭГ, тонуса артериол и венозного оттока. Достижение указанного выше технического результата поясняется следующими примерами При начальных проявлениях недостаточности кровообращения мозга (НПНКМ) часто встречаются ЭЭГ с высокой степенью синхронизации (преимущественно в альфа-диапазоне). Это связано с активизацией интегративных структур мезэнцефального уровня, возникающей в ответ на ухудшение кровоснабжения мозга. При дисциркуляторных расстройствах в вертебробазилярном русле могут наблюдаться явления десинхронизации и уплощения ЭЭГ, при тромбозах и стенозах с соответствующими клиническими проявлениями (парезы, перемежающаяся слепота и афазия) изменения на ЭЭГ проявляются медленными волнами дельта- и тета-диапазона. Выявлена тесная корреляция между объемом кровотока в бассейне пораженного сосуда и средней частотой ритмической активности в этой области, что позволяет судить по данным ЭЭГ о возможностях компенсации и реабилитации при ишемических нарушениях мозгового кровообращения. На этом же основании ЭЭГ используют для контроля мозговых функций во время операций каротидной эндартерэктомии.
При ишемических нарушениях мозгового кровообращения ЭЭГ-данные могут до определенной степени служить дифференциально-диагностическим целям. Так, при каротидном стенозе патологические ЭЭГ встречаются у 50% больных, при тромбозе сонной артерии - у 70%, а при тромбозе сильвиевой артерии - у 95%. Определенное значение имеет электроэнцефалография в дифференциальной диагностике сосудистого инсульта. При геморрагических инсультах изменения на ЭЭГ значительно более грубые и стойкие, сопровождаются более выраженными общемозговыми изменениями, что соответствует более тяжелой клинической картине. Синхронная регистрация перечисленных электрофизиологических сигналов делает возможным выявление влияния сосудистого фактора при пароксизмальных состояниях и эпилепсии путем сопоставления изменений параметров мозгового кровотока, предшествующих проявлениям эпилептиформной активности. Например, неадекватно сильное ухудшение параметров мозгового кровотока (чаще всего это выражается в снижении пульсового кровенаполнения, повышении тонуса сосудов, нарастании нестабильности показателей тонуса и пр.) на проводимые функциональные пробы может спровоцировать возникновение эпилептиформной активности на ЭЭГ. Сопоставляя степень изменения параметров мозгового кровотока по РЭГ с соответствующими изменениями ЭЭГ, а также временные соотношения этих изменений, может быть принято решение о преимущественном акценте в лечении сосудистых нарушений или о совместном приеме препаратов, улучшающих мозговую гемодинамику и противосудорожных препаратов. Одновременная регистрация дыхательной кривой с помощью респираторного пояса помогает контролировать корректность выполнения проб с гипервентиляцией и задержкой дыхания. Такой контроль весьма желателен для корректной содержательной интерпретации, поскольку поверхностное учащенное или, наоборот, замедленное дыхание при проведении гипервентиляции может привести к обратному физиологическому эффекту (гиперкапнии вместо гипокапнии).
Если моменту появления эпилептиформных вспышек и разрядов предшествуют значимые изменения параметров церебрального кровотока, то это может свидетельствовать о первичном влиянии нарушений именно мозгового кровотока. Например, перед трехминутной гипервентиляцией в исходном состоянии наблюдалась несколько дезорганизованная альфа-активность высокой амплитуды, нерегулярная по частоте. Реоэнцефалограмма в исходном состоянии была относительно нормальной формы со слегка повышенным тонусом. На третьей минуте гипервентиляции начали проявляться вспышки полиморфной, преимущественно медленно-волновой (тета-диапазона и частично дельта), эпилептиформной активности. Перед началом вспышек на РЭГ наблюдается существенная нестабильность пульсового кровенаполнения и тонуса сосудов различного калибра, даже в соседних кардиоциклах амплитуда пульсаций РЭГ отличается в полтора и более раз, форма реоволны меняется от гипотонической до гипертонической. Наблюдаются некоторые изменения и по периферической фотоплетизмограмме (ФПГ), в частности повышение тонуса резистивных сосудов (снижение амплитуды пульсации ФПГ).
Низким значениям тонуса артериол мозговых сосудов соответствуют минимальные, в сравнении с другими группами пациентов, изменения ЭЭГ. Прирост патологических элементов ЭЭГ увеличивается пропорционально нарастанию явлений внутричерепной гипертензии. С прогностической точки зрения низкие исходные значения показателей тонуса являются свидетельством сохранности центральных механизмов сосудодвигательной регуляции, а высокие значения тонуса коррелируют с выпадением центральных механизмов сосудодвигательной регуляции и начальными проявлениями ишемической болезни мозга.
В качестве иллюстрации рассмотрим несколько примеров исследований.
Пример 1. В первом исследовании (фиг.6 и 8) у пациента было выявлено снижение порога судорожной готовности на гипервентиляцию. Во втором исследовании (фиг.7 и 9) у пациента была зафиксирована нормализация показателей ЭЭГ и РЭГ на гипервентиляцию.
Изображения на фиг.7 и 8 иллюстрируют динамику трендов в исходном состоянии и при проведении провоцирующей 3-минутной пробы на гипервентиляцию следующих физиологических показателей: частоты сердечных сокращений (ЧСС), амплитуды систолической волны ФПГ (АСВ ФПГ), времени распространения пульсовой волны (ВРПВ, ФПГ), альфа-индекса ЭЭГ по левому затылочному отведению соотношение мощности медленно-волновых составляющих ЭЭГ (сумма поддиалазонов дельта- и тета-волн) к альфа-мощности левого лобного ЭЭГ-отведения (D+T/A, F3-A1), реографического индекса по левому фронто-мастоидальному отведению РЭГ (РИ, FM_L), постоянной составляющей (СМА) в левом лобном ЭЭГ-отведении (ПС, F3-A1).
На фиг.7 заметны следующие характерные моменты. Провоцирующая проба на гипервентиляцию приводит к сочетанным изменениям практически всех физиологических сигналов, в частности резкое возрастание ЧСС (с 84 до 106 уд/мин), резкое повышение тонуса периферических резистивных сосудов (АСВ ФПГ в фоне составляла порядка 4 pm, а при ГВ достигала значений 0,47 pm, т.е. амплитуда пульсации резистивных сосудов уменьшилась в несколько раз), существенное снижение альфа-индекса на 3-й минуте гипервентиляции (в фоне около 70%, на 3-й минуте - около 20%), резкое возрастание преобладания патологических медленно-волновых составляющих (дельта и тета) над нормальной альфа-активностью - более чем в 10 раз, резкое уменьшение пульсового кровенаполнения по РЭГ-РИ уменьшился с 1,2-1,35 до 0,7-0,8 Ом, возрастание уровня постоянного потенциала в процессе гипервентиляции (почти на 2 мВ). Завершение провоцирующей пробы привело к постепенной нормализации большинства физиологических показателей: ЧСС снизилось почти до исходных значений (87 уд/мин). ВРПВ возрос даже выше исходных значений, что свидетельствует о существенном снижении тонуса магистральных артерий. Альфа-индекс затылочных отведений ЭЭГ восстановился. Соотношение медленно-волновых и быстро-волновых компонентов ЭЭГ нормализовалось.
На фиг.6 представлены физиологические сигналы (ЭЭГ, РЭГ, ЭКГ, ФПГ). Слева - исходное фоновое состояние, справа - 3-я минута гипервентиляции. Заметно выраженное ухудшение сигналов ЭЭГ и РЭГ на провоцирующее воздействие, в частности, снижение пульсового кровенаполнения мозговых сосудов (РИ РЭГ) и появление пароксизмальных вспышек медленно-волновой активности на ЭЭГ.
Пример 2. На фиг.8 и 9 показана сравнительная диаграмма динамики средних показателей ЭЭГ, РЭГ, ЭКГ, ФПГ на провоцирующие воздействия при втором исследовании, когда у пациента была зафиксирована нормализация показателей ЭЭГ и РЭГ на гипервентиляцию. Исходное состояние характеризуется низкоамплитудной десинхронизированной ЭЭГ (алфа-волн почти не заметно), повышенным тонусом мозговых сосудов (вторая систолическая волна выше по амплитуде, чем первая, ППСС 100%), сниженным пульсовым кровенаполнением (РИ на уровне 0,08... 0,09 Ом). При провоцирующем воздействии в виде гипервентиляции наблюдаются следующие изменения: альфа-ритм существенно более выражен с сохранением нормальных зональных различий, тонус мозговых сосудов нормализовался (вторая систолическая волна стала ниже первой по амплитуде, ППСС на уровне 70%), пульсовое кровенаполнение мозговых сосудов нормализовалось (РИ на уровне 0,12 Ом).
Сравнение отклонений физиологических показателей по двум пациентам позволяет сделать следующие выводы. По 1-му пациенту с выявленным повышением порога судорожной готовности при гипервентиляции следует отметить, что ухудшение показателей ЭЭГ (снижение альфа-активности на 40%, возрастание отношения медленно-волновой дельта и тета-активности к альфе в 4,7 раза) сопровождается ухудшением показателей пульсового кровенаполнения мозговых сосудов (снижение реографического индекса на 30%). Сначала происходит существенное ухудшение показателей мозгового кровотока (наблюдается с 1-й минуты гипервентиляции), а затем возникновение пароксизмальных проявлений патологической активности (на 3-й минуте гипервентиляции). При гипервентиляции происходит снижение амплитуды пульсаций периферической ФПГ (на 46%).
По пациенту с нормализацией показателей ЭЭГ при гипервентиляции наблюдается другая картина. Проба на гипервентиляцию приводит к нормализации ЭЭГ (повышение альфа-индекса на 64%, снижение отношения медленно-волновой дельта и тета-активности к альфе на 35%) сопровождается улучшением показателей пульсового кровенаполнения мозговых сосудов (повышение реографического индекса почти на 30%). Нормализация ЭЭГ и РЭГ начинается одновременно уже через 30 секунд после начала гипервентиляции. Проба на гипервентиляцию приводит к значительно большему возрастанию тонуса периферических сосудов (уменьшение амплитуды пульсаций пальцевой ФПГ в 5,5 раза, тогда как у первого пациента уменьшение ФПГ было всего в 2 раза).
Можно предположить, что у второго пациента в исходном состоянии было недостаточное содержание кислорода в крови, из-за чего исходные показатели ЭЭГ и РЭГ были несколько нарушены. Гипервентиляция привела к повышению содержания кислорода в крови, что привело к нормализации показателей мозгового кровотока и показателей ЭЭГ. Кроме того, у второго пациента, видимо, более развиты адаптационные возможности, т.к. при провоцирующем воздействии сработали адаптационные механизмы по повышению тонуса периферических сосудов, а значит, улучшилось соотношение по перераспределению общего кровотока в пользу мозгового за счет периферического. У первого пациента тонус периферических сосудов повысился незначительно, соответствующего перераспределения кровотока не произошло, мозговой кровоток существенно уменьшился, что и могло привести к ухудшению ЭЭГ.
Следует отметить, что резкие изменения показателей ЭЭГ, РЭГ, СМА наблюдаются во многих случаях и при выполнении умственных нагрузок. На фиг.10 показаны тренды физиологических показателей по ЭЭГ, РЭГ, ЭКГ, СМА - постоянной составляющей электрокардиограммы (ПС ЭЭГ) при проведении арифметической и лингвистической пробы. Заметны резкие изменения по альфа-индексу и ПС ЭЭГ. После умственной нагрузки наблюдается компенсаторное повышение РИ РЭГ. Метод совокупного анализа ЭЭГ, РЭГ и СМА также может быть с успехом использован для проведения исследований у различных групп больных с психическими и психоневрологическими отклонениями для исследования механизмов памяти и пр.
Устройство для исследования функционального состояния головного мозга, с использованием которого реализуется заявленный способ, содержит (фиг.1) блок 1 электродов для съема сигналов биоэлектрической активности мозга, блок 2 датчиков электрофизиологических сигналов, блок 3 токовых и потенциальных электродов для осуществления записи реосигналов, коммутатор отведений 4, генератор 5 токовых реосигналов, синхронный детектор 6 реосигналов, многоканальный усилитель 7 сигналов биоэлектрической активности головного мозга, усилитель 8 электрофизиологических сигналов, демультиплексор 9, многоканальный усилитель реосигналов 10, многоканальный аналого-цифровой преобразователь (МАЦП) 11, микроЭВМ 12 с гальванически развязанным портом ввода-вывода, двухчастотный прецизионный генератор тока 13 и ПЭВМ 14 стандартной конфигурации. Блок 1, включающий устройство для закрепления электродов, рабочие (сигнальные), референтные и нулевой электроды, соединительные проводники и разъем для подключения к многоканальному усилителю 7, может быть выполнен в виде эластичной шапочки и предназначен для удобного и комфортного закрепления электродов на голове пациента. Блок 2 включает как минимум электрокардиографические электроды и датчики фотоплетизмографический и окулограммы и элементы закрепления электродов и датчиков на теле пациента. При необходимости контроля продолжительности и глубины дыхания во время проведения функциональной пробы на гиперентиляцию блок 2 может дополнительно содержать датчик дыхательной волны (например, респираторный пояс). Блок 3 включает токовые электроды для подачи токовых импульсных сигналов и потенциальные электроды для съема падения напряжений от токовых импульсных сигналов и может быть совмещен с блоком 1, т.е. токовые и потенциальные электроды могут быть закреплены на той же эластичной шапочке, при этом в элементах крепления электроды блока 3 группируются попарно - токовый электрод б1 и соответствующий ему потенциальный электрод Б1. Коммутатор 4 предназначен для временного разделения реосигналов и включает два демультиплексора, один из которых подключает к выходу генератора 5 токовые электроды блока 3 и к входу синхронного детектора 6 потенциальные электроды блока 3 с четными номерами, другой - с нечетными. Генератор 5 (фиг.3) содержит источник постоянного напряжения Е, полюсы которого через управляемый переключатель 15, узкополосный усилитель, включающий С3, R7, У3, и фильтр нижних частот 16 подключены к входу линейного преобразователя напряжение - ток (У4, Tp1, R8). На выходе генератора 6 частота синусоидального тока равна частоте переключения управляемого переключателя 15. Синхронный детектор 6 (фиг.4) содержит дифференциальный усилитель У5 с полосовым фильтром 17 на выходе и управляемый переключатель 18, один вход которого соединен с полосовым фильтром непосредственно, а второй через инвертор. На входы управления переключателей 15 и 18 подаются синхронные сигналы от микроЭВМ 12. Многоканальный усилитель 7 предназначен для усиления сигналов биоэлектрической активности мозга, снимаемых с помощью рабочих электродов блока 1. Каждый канал усиления этого усилителя содержит (фиг.2) последовательно соединенные дифференциальный усилитель (У1, R1, R2), усилитель с коэффициентом по постоянному току, равном единице, и усилением в рабочей полосе частот (У2, R3, R4, R5, С1), и фильтр нижних частот. Неинвертирующий вход дифференциального усилителя соединен с соответствующим рабочим электродом блока 1 и одним из выходов двухчастотного прецизионного генератора 13, а инвертирующий через согласующий каскад с соответствующим референтным электродом А. Двухчастотный прецизионный генератор 13 тока с синхронизацией от микроЭВМ 12 может быть реализован в виде двух делителей эталонной частоты с различными коэффициентами деления (фиг.5). Частота f1 на выходе частотного делителя 19 больше в 1,5... 2,0 раза верхней fвepx частоты анализируемых сигналов, частота f2 на выходе частотного делителя 20 больше частоты f1, например, если верхняя частота анализируемых электроэнцефалографичесих сигналов 300 Гц, то частота на выходе частотного делителя 19 устанавливается в пределах 450... 500 Гц. Частота частотного делителя 20 устанавливается отличной от частоты частотного делителя 19 на 50... 100 Гц. Узкополосной фильтрацией цифровыми методами сигналы этих генераторов выделяются из выходных напряжений многоканального усилителя 7 и используются при вычислении подэлектродных сопротивлений. Режим генератора тока обеспечивается тем, что выход делителя соединен с каждым электродом блока 1 через высокодобротный конденсатор малой емкости (10... 20 pF). Выход частотного делителя 19 соединен с рабочими электродами блока 1, выход частотного делителя 20 соединен с референтными электродами. Усилитель 8 содержит усилительный каскад для каждого из электрофизиологических сигналов. Схемы электрические этих каскадов выполнены без каких либо особенностей, их описание приводится в учебниках. Выход синхронного детектора 6 подключен к входу мультиплексора 9, выходы которого соединены с входами многоканального усилителя 10. Подключение выходов мультиплексора 9 осуществляется от микроЭВМ 12 синхронно с переключением электродов блока 3 коммутатором отведений 4. Выходы многоканальных усилителей 7 и 10 и усилителя 8 подключены к соответствующим входам многоканального аналого-цифрового преобразователя 11, назначение которого - преобразование аналоговых сигналов в дискретную форму с пространственным разделением каналов. МикроЭВМ предназначена для обеспечения съема в реальном масштабе времени всех сигналов, предварительная их обработка (цифровая фильтрация), контроль за функционированием блока 1 и многоканального усилителя 7 и управление работой коммутатора 4, генератора 5, синхронного детектора 6, мультиплексора 9, двухчастотного прецизионного генератора 13 и многоканального аналого-цифрового преобразователя 11. МикроЭВМ 12 каналом обмена соединена с ПЭВМ 14. Назначение ПЭВМ 14 - статистическая обработка записанных синхронно в реальном масштабе времени значений электрофизиологических сигналов (ЭЭГ, ЭКГ, РЭГ, СМА, ФПГ), вычисление в едином покардиоцикловом временном масштабе, т.е. в привязке к каждому из автоматически распознаваемых кардиоциклов, физиологических показателей: биоэлектрической активности мозга - абсолютные и относительные значения мощности альфа-активности, патологической медленно-волновой активности в диапазоне дельта- и тета-волн, динамики уровня метаболической активности головного мозга по постоянной составляющей ЭЭГ, частоты сердечных сокращений по ЭКГ, пульсового кровенаполнения сосудов мозга по реографическим индексам РЭГ, периферического сопротивления мозговых сосудов (ППСС), тонуса периферических в виде амплитуды пульсации периферической ФПГ, тонуса магистральных сосудов по времени распространения пульсовой волны от зубца Q сигнала ЭКГ до начала систолической волны периферической ФПГ, тонуса посткаппиллярно-венулярных сосудов по постоянной составляющей ФПГ, отображение этих показателей на экране дисплея в объеме и в виде для обеспечения возможности дифференциальной диагностики эпилепсии и эпилептиформных проявлений.
Заявленное устройство работает следующим образом. Электроды для съема электроэнцефалограммы и реограммы закрепляются на голове с использованием эластичного шлема (специальной электродной эластичной шапочки), электроды для съема электрокардиограммы и датчики кожно-гальванической реакции, пульсометрии (ФПГ) и миографии закрепляются на пациенте с помощью электропроводящего клея или лейкопластыря, датчик дыхательной волны - с помощью респираторного пояса. При длительном мониторинге, когда канал обмена микроЭВМ 12 с ПЭВМ 14 организован по радиоканалу, на пациенте дополнительно могут быть закреплены акселерометры, по сигналам от которых устанавливается двигательная активность пациента. Осуществление связи ПЭВМ 14 с микроЭВМ 12 по радиоканалу не только позволяет пациенту находиться в комфортных условиях, но и одновременно осуществлять мониторинг нескольких пациентов. После установки электродов и датчиков блока 1...3 и включения питания проверяется работоспособность и надежность подключения электродов и датчиков. Измеряются подэлектродные сопротивления и, если подэлектродное сопротивление какого либо электрода превысит пороговое значение, то проверяется его исправность и надежность установки, неисправный электрод заменяется, исправный устанавливается заново. Затем включается микроЭВМ 12 в режим съема физиологических сигналов. Электрические сигналы, подаваемые на входы, усиливаются, преобразуются в МАЦП 3 из аналоговой формы в дискретную, очищаются от артефактов в микроЭВМ 4 и в кодовом виде запоминаются в накопителе 10. Быстродействие микроЭВМ 4 и емкость накопителя 10 позволяют в реальном масштабе времени синхронно записать и сохранить данные суточного мониторинга: ЭЭГ-сигналов по нужному количеству отведений (до 32 цифровых отведений); реографических сигналов (до 6 каналов); физиологических сигналов по каналам: ЭКГ, ЭОГ, ПГ, ЭМГ; сигналов о положении тела от гироскопических датчиков; значений подэлектродных сопротивлений; маркеров различного типа; отражающих те или иные события; функциональных проб, намеченных программой или проводимых врачом в процессе ЭЭГ-видеомониторинга; результатов предварительной обработки по выявлению аномалий ЭЭГ и ЭКГ. Записанная информация из микроЭВМ 12 передается в ПЭВМ 14 подключении ее к порту ПЭВМ 14, либо по радиоканалу. В ПЭВМ 14 производится обработка необходимых фрагментов электрофизиологических сигналов и, в зависимости от цели исследования, отображение в едином временном интервале необходимых для визуальной оценки врачом происходящих процессов.
Обработка производится с использованием всех возможностей математической обработки. Так, например, обработка электроэнцефалограммы производится с использованием всех возможностей компьютизированного электроэнцефалографа, таких как референтная реконструкция, вертикальный “сплит”, автоматический поиск артефактов и эпилептиформной активности, двух- и трехмерный топоскоп, спектральный, автокросскорреляционный анализ и функция когерентности с топографическим картированием, анализ функциональной асимметрии, а также автоматическое формирование описания и классификация ЭЭГ с возможностью редактирования, трехмерная локализация источников патологической электрической активности мозга и т.п.
Длительный мониторинг электроэнцефалограммы и синхронно снимаемых с ней других физиологических параметров является важным диагностическим методом, позволяющим дифференцировать псевдоэпилептические и истинные эпилептические пароксизмы. ЭЭГ-видеомониторинг применяют при необходимости подтверждения правильности предварительного диагноза “эпилепсия”, особенно в сложных случаях, когда точная дифференциальная диагностика является принципиально важной для выбора наилучшей тактики лечения и прогноза течения заболевания. Диагноз “эпилепсия” очевиден при обнаружении эпилептических ЭЭГ-паттернов на межприступной/приступной ЭЭГ. Отсутствие аномалий ЭЭГ в межприступном/приступном периоде не исключает полностью эпилепсию. Известно, что значительное число простых парциальных пароксизмов, сопровождающихся вегетативными или соматосенсорными симптомами, нередко характеризуется отсутствием изменений на ЭЭГ при поверхностном наложении электродов. Наличие эпилептических ЭЭГ-паттернов в момент приступа также не является абсолютным доказательством эпилепсии. У больных с ритмическими повторными моторными феноменами на ЭЭГ в ряде случаев имеются артефакты, напоминающие эпилептические ЭЭГ-паттерны и способные ввести в заблуждение неопытного электроэнцефалографиста. Во избежание ошибок необходимо сопоставление синхронных изменений ЭЭГ и РЭГ исследований. При подготовке пациента целесообразно использовать комбинированную электродную систему, содержащую отведения ЭЭГ и РЭГ каналов.
Для получения комплексной информации при обследовании конкретного пациента используется одновременная совокупная регистрация электрической активности мозга и параметров мозгового кровообращения. Подобный подход обеспечивает не только экономию времени проведения исследований за счет однократного выполнения записи в исходном (фоновом) состоянии и при проведении функциональных проб в рамках одновременного ЭЭГ-РЭГ-исследования. Получение комплексной информации при сопоставлении динамики синхронного изменения показателей ЭЭГ, РЭГ и ЭКГ в процессе выполнения одновременного исследования, что в свою очередь позволяет:
- оценить возможное влияние сосудистого фактора на пароксизмальные проявления (в случае их наличия);
- выявить возможные цереброваскулярные причины изменения биоэлектрической активности головного мозга;
- сопоставить пароксизмальные проявления на ЭЭГ и признаки нарушения сердечного ритма и проводимости на ЭКГ (в случае их наличия) с целью выявления типа нарушений (кардиогенный или цереброгенный);
- проанализировать взаимодействие ЦНС, ВНС и мозгового кровообращения на основе сопоставления динамики сигналов ЭЭГ, РЭГ и ЭКГ, а также физиологических показателей, рассчитываемых на основе этих сигналов.
По данным, полученным с помощью заявленного устройства, для больных с исходно низкими показателями объемного мозгового кровотока характерно значительное увеличение числа диффузных патологических тета-включений, эквивалентных процессам демиелинизации, атеросклероза и диффузной ишемии мозга. У больных с избыточным полнокровием мозговых сосудов (РИ=0,3 Ом), умеренно сниженным тонусом и замедленным венозным оттоком также наблюдаются признаки билатерально синхронной ритмики, отражающей явления дисфункции срединных образований мозга. То есть и в том, и в другом случае значительные отклонения гемодинамических компонентов мозга свидетельствуют о нарушении центральных механизмов регуляции сосудодвигательного контроля. Замедление венозного оттока, специфичное для явлений повышенного кровенаполнения мозга и высокого тонуса артериол свидетельствует о нарастании внутричерепной гипертензии с потерей отрицательной обратной связи между центром и основньми компонентами мозгового кровотока, с чем коррелируют ЭЭГ-проявления ирритативных и диффузных изменений функционального состояния мозгового ствола. Низким значениям тонуса артериол соответствовали минимальные, в сравнении с другими группами пациентов, изменения ЭЭГ. Прирост патологических элементов ЭЭГ увеличивался пропорционально нарастанию явлений внутричерепной гипертензии. С прогностической точки зрения низкие исходные значения показателей тонуса являются свидетельством сохранности центральных механизмов сосудодвигательной регуляции, а высокие значения тонуса коррелируют с выпадением центральных механизмов сосудодвигательной регуляции и начальными проявлениями ишемической болезни мозга.
Важное значение имеет сопоставление ЭЭГ и РЭГ с точки зрения выявления провоцирующих факторов элементов эпилептиформной активности. Если моменту появления эпилептиформных вспышек и разрядов предшествуют значимые изменения параметров церебрального кровотока, то это может свидетельствовать о первичном влиянии нарушений именно мозгового кровотока.
Однако этим не ограничивается возможная область применения синхронной записи ЭЭГ и полиграфических сигналов, отражающих деятельность церебрального, центрального и периферического кровотока. Учитывая зависимость функционального состояния головного мозга от состояния сердечно-сосудистой системы, учет изменений регистрируемых показателей сосудистой системы может помочь в интерпретации возникающих феноменов на ЭЭГ. Это может относиться и к выявлению провоцирующих факторов эпилептических приступов (анализ изменений церебрального кровотока, предшествовавших началу приступа), и для дифференциальной диагностики эпилептических и неэпилептических приступов (например, вьмвление синкопальных состояний, связанных с нарушением сердечного ритма или вазодепрессорной реакцией), к выявлению нарушений ЭЭГ церебральноваскулярного характера (по факту нормализации ЭЭГ и РЭГ при проведении каких-либо проб, например гипервентиляции), и к подтверждению наличия регуляторных нарушений, проявляемых на ЭЭГ, РЭГ и вариабельности сердечного ритма. В рамках отдельно проводимых исследований ЭЭГ, РЭГ, кардиоинтервалографии, показателей центральной гемодинамики часто используются одни и те же функциональные пробы. Синхронная регистрация этих данных позволяет не только уменьшить суммарное время исследования, но и получить уникальную возможность сопоставления показателей, получаемых по разным типам сигналов с целью более достоверной интерпретации данных. Сопоставление этих данных позволяет уточнить характер основного сосудистого заболевания и региональность цереброваскулярных расстройств. Кроме РЭГ и ЭКГ целесообразно использовать и другие физиологические сигналы. К ним могут относиться периферическая фотоплетизмограмма (ФПГ, для контроля реактивности резистивных сосудов, тонуса магистральных артерий, состояния посткапиллярно-венулярного русла), кожно-гальваническая реакция (КГР, для контроля психоэмоционального напряжения, особенно при проведении психологических проб), пневмограмма (ПГ, для оценки частоты и глубины дыхания, контроля корректности выполнения различных дыхательных проб) и другие сигналы.
Анализ сверхмедленной активности мозга является практически единственным электрофизиологическим методом, позволяющим оценивать величину церебральных энергозатрат. Нарушения метаболизма играют важную роль в развитии сосудистых и атрофических заболеваний мозга, эпилепсии и влияют на течение невротических расстройств. Регистрация СМА с необходимой точностью обеспечивается лишь с измерением подэлектродных сопротивлений и учетом их изменения в течение мониторинга.
Способ измерения подэлектродных сопротивлений поясняется схемой, изображенной на фиг.10. На фиг.10 обозначены: 1д, 2д - электроды, подключенные к входам дифференциального усилителя, 1... к - рабочие электроды, а - референтные электроды, Jf1 - генератор тока с частотой f1, Jf2 - генератор тока с частотой f2, Zд1, Zд2, Za, Z1... Zк - подэлектродные сопротивления электродов 1д, 2д, а, 1...к соответственно, Уд, Уа, У1... Ук - дифференциальный, референтный и рабочие усилители соответственно, f1, f2 - полосовые фильтры, Uf1, uf2 - напряжения на выходе усилителей Уд, Уа, У1... Ук.
Заявленный способ измерения подэлектродного сопротивления при регистрации с использованием входных усилителей биопотенциалов головного мозга и/или электрических сигналов, генерируемых сердцем, и/или электрических сигналов мышечных движений реализуется следующим образом. На каждый рабочий электрод подают сигнал от узкополосного генератора тока Jf1 с частотой f1, превышающей верхнюю частоту регистрируемых сигналов fвepx, а на референтный электрод подают сигнал от узкополосного генератора тока Jf2 с частотой f2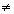 f1>fвepx. Узкополосной фильтрацией выделяют из выходного напряжения каждого рабочего усилителя У1... Ук и измеряют напряжение с частотой f1-Uf1 и напряжение с частотой f2 - Uf2, подэлектродное сопротивление рабочего электрода определяют по формуле Zj=Ujf1 : (J1×Kj), где Zj - подэлектродное сопротивление j-го рабочего электрода, Ujf1 - напряжение на выходе j-го рабочего усилителя с частотой f1, Jf1 - ток узкополосного генератора тока с частотой f1, Кj - коэффициент усиления j-го рабочего усилителя, подэлектродное сопротивление референтного электрода определяют по формуле Za=Ujf2 : (Jf2×Kj), где Zа - подэлектродное сопротивление референтного электрода, сопричастного j-му рабочему усилителю, Ujf2 - напряжение на выходе j-го рабочего усилителя с частотой f2, Jf2 - ток узкополосного генератора тока с частотой f2. Коэффициенты усиления усилителей измеряются перед установкой электродов, например, как отношение напряжения на выходе усилителя к калиброванному напряжению на входе. Так же предварительно могут быть откалиброваны генераторы тока Jf1, и Jf2. Частоты f1 и f2 выбираются из условия исключения влияния на результаты измерения анализируемых сигналов. Так как на изменение подэлектродных сопротивлений влияют вялотекущие процессы, работа генераторов Jf1, и Jf2 может быть разнесена во времени. Тогда отпадает необходимость борьбы с комбинационными частотами.
f1>fвepx. Узкополосной фильтрацией выделяют из выходного напряжения каждого рабочего усилителя У1... Ук и измеряют напряжение с частотой f1-Uf1 и напряжение с частотой f2 - Uf2, подэлектродное сопротивление рабочего электрода определяют по формуле Zj=Ujf1 : (J1×Kj), где Zj - подэлектродное сопротивление j-го рабочего электрода, Ujf1 - напряжение на выходе j-го рабочего усилителя с частотой f1, Jf1 - ток узкополосного генератора тока с частотой f1, Кj - коэффициент усиления j-го рабочего усилителя, подэлектродное сопротивление референтного электрода определяют по формуле Za=Ujf2 : (Jf2×Kj), где Zа - подэлектродное сопротивление референтного электрода, сопричастного j-му рабочему усилителю, Ujf2 - напряжение на выходе j-го рабочего усилителя с частотой f2, Jf2 - ток узкополосного генератора тока с частотой f2. Коэффициенты усиления усилителей измеряются перед установкой электродов, например, как отношение напряжения на выходе усилителя к калиброванному напряжению на входе. Так же предварительно могут быть откалиброваны генераторы тока Jf1, и Jf2. Частоты f1 и f2 выбираются из условия исключения влияния на результаты измерения анализируемых сигналов. Так как на изменение подэлектродных сопротивлений влияют вялотекущие процессы, работа генераторов Jf1, и Jf2 может быть разнесена во времени. Тогда отпадает необходимость борьбы с комбинационными частотами.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ИССЛЕДОВАНИЯ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ГОЛОВНОГО МОЗГА И УСТРОЙСТВО ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2003 |
|
RU2248745C1 |
| СПОСОБ ЛЕЧЕНИЯ ЭПИЛЕПСИИ | 2007 |
|
RU2353411C2 |
| УСТРОЙСТВО ДЛЯ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ МОЗГА | 1993 |
|
RU2076625C1 |
| СПОСОБ ЛЕЧЕНИЯ ТРАВМАТИЧЕСКОЙ БОЛЕЗНИ ГОЛОВНОГО МОЗГА | 2003 |
|
RU2263521C2 |
| НЕМЕДИКАМЕНТОЗНЫЙ СПОСОБ ПРОФИЛАКТИКИ ГИПОКСИЧЕСКОГО СОСТОЯНИЯ МОЗГА | 2011 |
|
RU2465820C1 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ ХРОНИЧЕСКИХ НАРУШЕНИЙ МОЗГОВОГО КРОВООБРАЩЕНИЯ, ОБУСЛОВЛЕННЫХ АРТЕРИАЛЬНОЙ ГИПОТЕНЗИЕЙ | 2010 |
|
RU2462182C2 |
| Способ лечения начальных проявлений недостаточности кровоснабжения мозга | 1990 |
|
SU1813463A1 |
| СПОСОБ ПРОВЕДЕНИЯ ОБСЛЕДОВАНИЯ ПРИ СИНДРОМЕ ГОЛОВНОЙ БОЛИ У ДЕТЕЙ | 2010 |
|
RU2427313C1 |
| СПОСОБ ОЦЕНКИ ВЕГЕТАТИВНЫХ ТОНУСА И РЕАКТИВНОСТИ СОСУДОВ ГОЛОВНОГО МОЗГА | 2004 |
|
RU2292844C2 |
| СПОСОБ РЕОКАРОТИДНОЙ ЦЕРЕБРОГРАФИИ | 2008 |
|
RU2376931C1 |
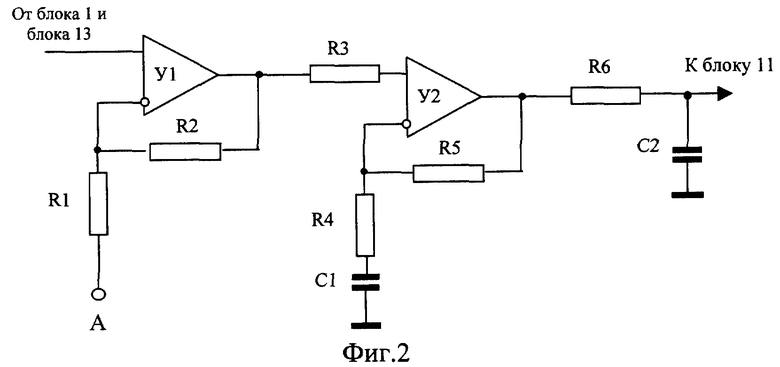
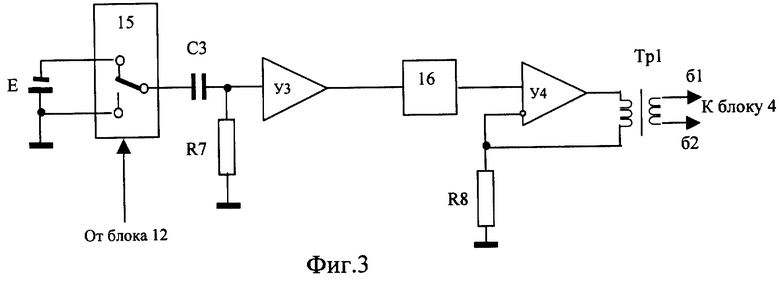
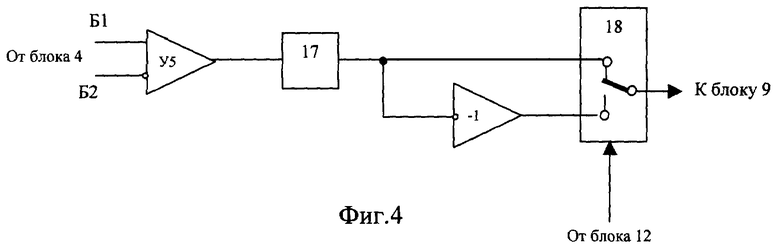
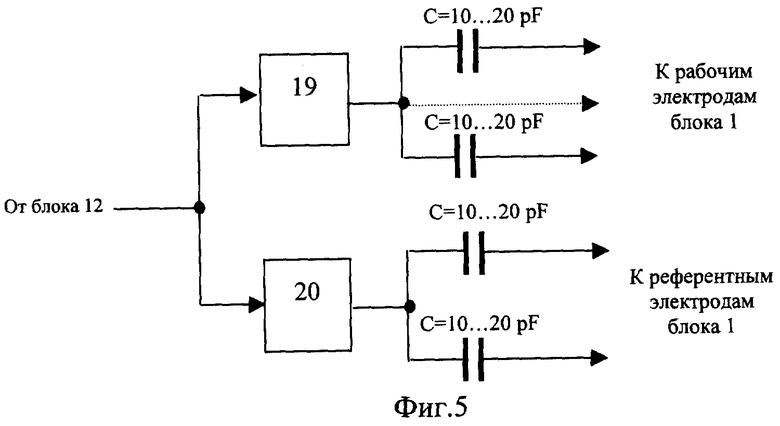
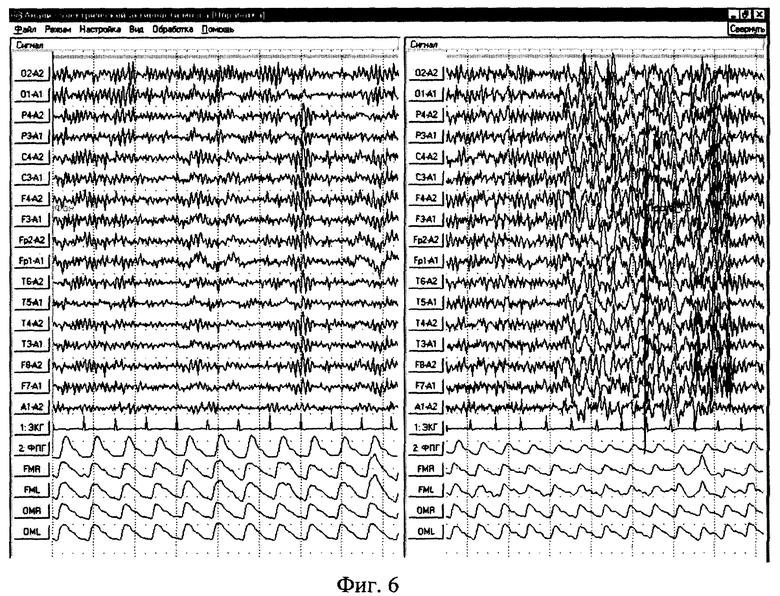
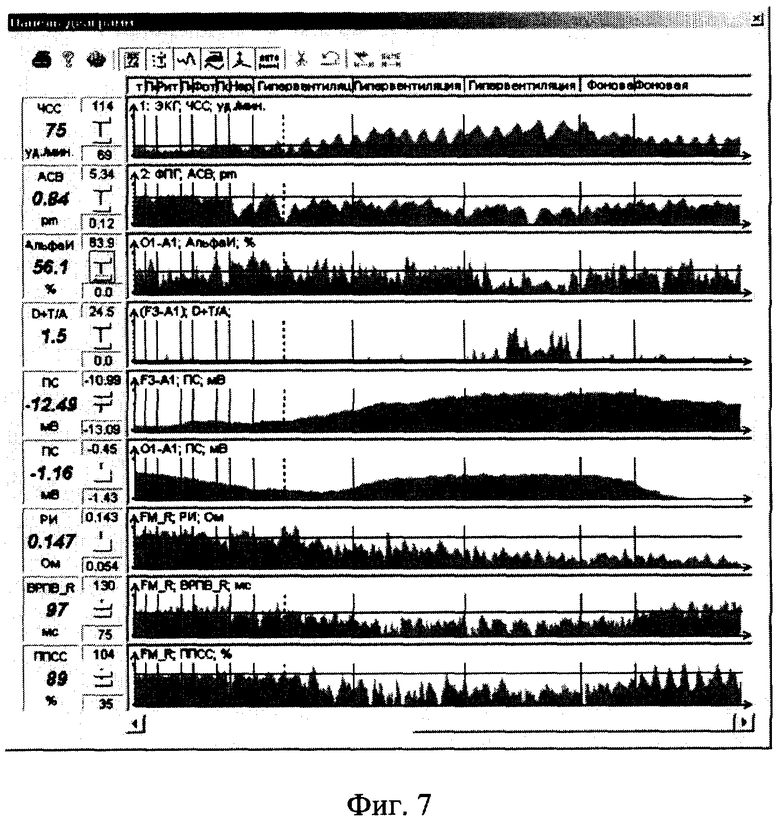
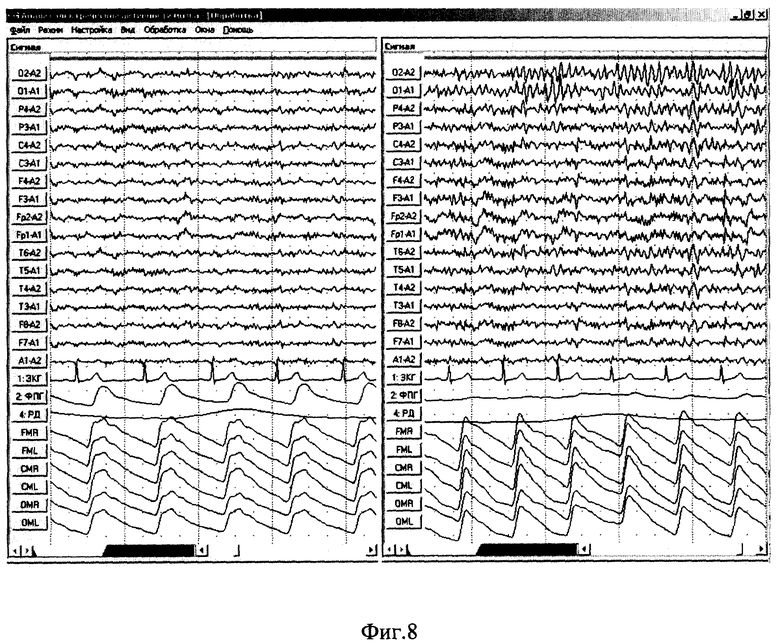
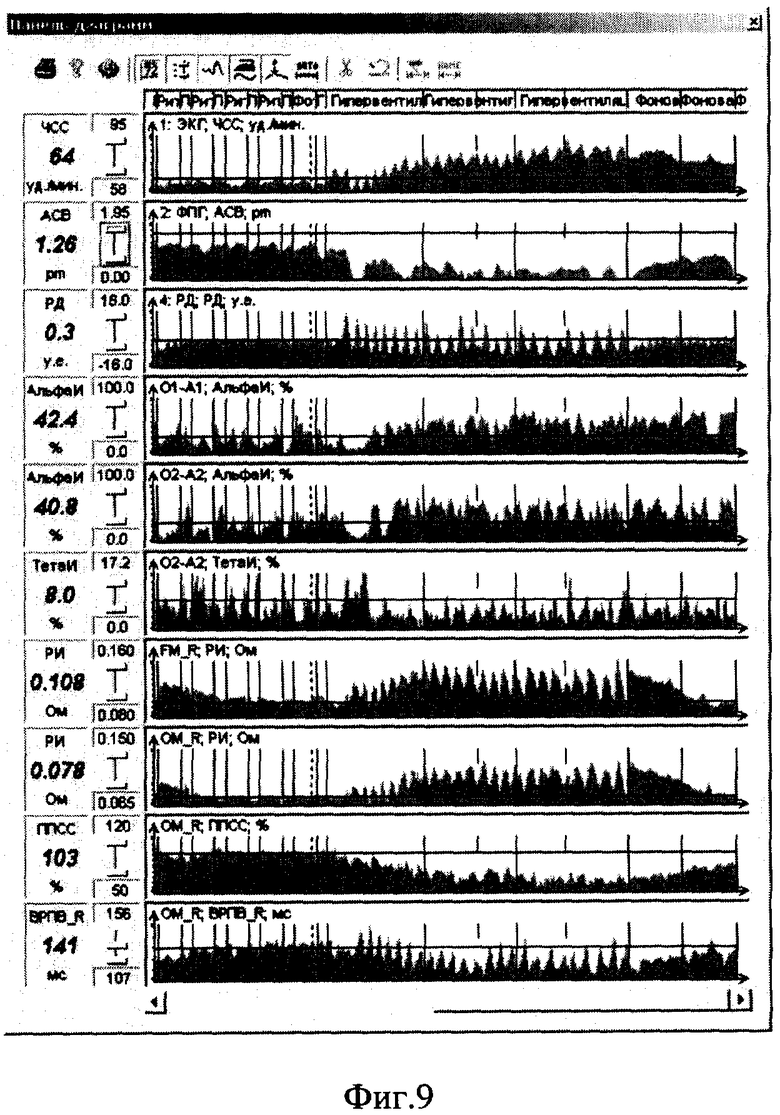
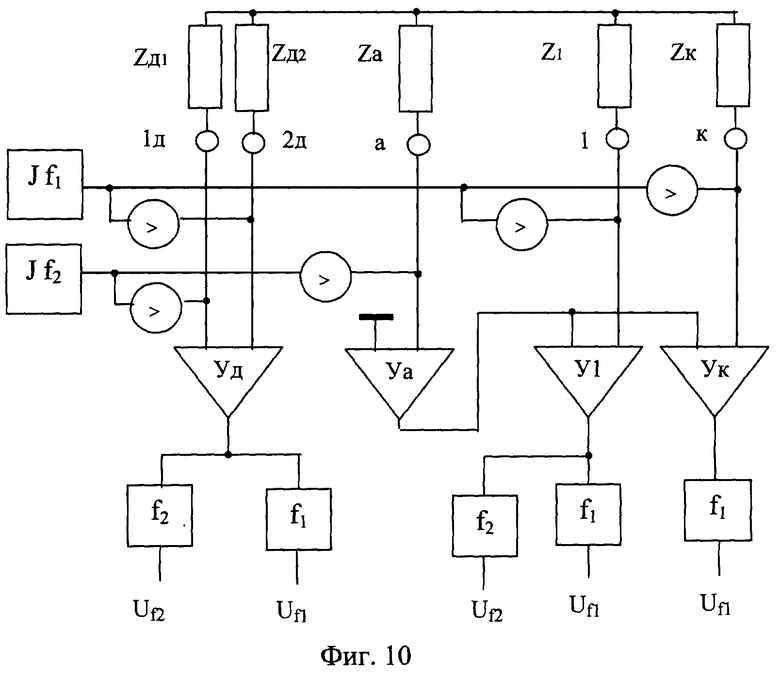
Изобретения относятся к медицине и могут использоваться при контроле за состоянием больных. Способ исследования функционального состояния головного мозга: осуществляют многоканальную запись электроэнцефалограммы (ЭЭГ), электрокардиограммы (ЭКГ), проводят функциональную пробу и компьютерный анализ электрофизиологических сигналов, синхронно с многоканальной записью ЭЭГ и ЭКГ в реальном масштабе времени. Проводят регистрацию сверхмедленной активности мозга, запись реоэлектроэнцефалограммы (РЭГ) в бассейнах сонных и позвоночных артерий и фотоплетизмограммы (ФПГ) пальцев рук и/или ног и измерение подэлектродных сопротивлений электродов для снятия биоэлектрической активности головного мозга. При этом в едином покардиоцикловом временном масштабе осуществляют вычисление и визуализацию физиологических показателей биоэлектрической активности мозга - абсолютные и относительные значения мощности альфа-активности, патологической медленно-волновой активности в диапазоне дельта- и тета-волн, показатель динамики уровня метаболической активности головного мозга по уровню постоянного потенциала, частоту сердечных сокращений по ЭКГ, показатели пульсового кровенаполнения сосудов мозга по реографическим индексам РЭГ, показатель периферического сопротивления мозговых сосудов (ППСС), показатель тонуса периферических сосудов в виде амплитуды пульсации периферической ФПГ, показатель тонуса магистральных сосудов по времени распространения пульсовой волны от зубца Q сигнала ЭКГ до начала систолической волны периферической ФПГ, показатель тонуса посткапиллярно-венулярных сосудов по постоянной составляющей ФПГ, а оценку функционального состояния головного мозга производят по динамике изменений физиологических показателей до, во время и после проведения функциональной пробы. Устройство для исследования функционального состояния головного мозга содержит последовательно соединенные многоканальный аналого-цифровой преобразователь, микроЭВМ с гальванически развязанными портами ввода-вывода и ПЭВМ стандартной конфигурации, блок электродов для съема сигналов биоэлектрической активности головного мозга, подключенный к многоканальному усилителю сигналов биоэлектрической активности головного мозга, блок датчиков электрофизиологических сигналов, соединенный с усилителем электрофизиологических сигналов, блок токовых и потенциальных электродов для осуществления записи реосигналов, многоканальный усилитель реосигналов, генератор токовых реосигналов и синхронный детектор реосигналов, также устройство дополнительно содержит двухчастотный прецизионный генератор тока, задающий вход которого подключен к микроЭВМ, первая группа выходов соединена с рабочими электродами, а вторая - с референтными электродами блока электродов для съема сигналов биоэлектрической активности головного мозга, коммутатор отведений, первая группа входов которого соединена с потенциальными электродами блока токовых и потенциальных электродов для осуществления записи реосигналов, вторая группа входов - с выходами генератора токовых реосигналов. Первая группа выходов - с токовыми электродами блока токовых и потенциальных электродов для осуществления записи реосигналов, вторая группа выходов - с входами синхронного детектора реосигналов, демультиплексор, вход которого соединен с выходом синхронного детектора реосигналов, а выходы - с входами многоканального усилителя реосигналов. Выходы многоканального усилителя сигналов биоэлектрической активности головного мозга, многоканального усилителя реосигналов и усилителя электрофизиологических сигналов соединены с соответствующими входами многоканального аналого-цифрового преобразователя, выходы микроЭВМ соединены с входом управления коммутатора отведений, входом управления демультиплексора, входом управления многоканального аналого-цифрового преобразователя и входами синхронизации генератора токовых реосигналов и синхронного детектора реосигналов. Для измерения подэлектродного сопротивления на каждый рабочий электрод подают сигнал от узкополосного генератора тока с частотой f1, превышающей верхнюю частоту регистрируемых сигналов fверх, а на референтный электрод подают сигнал от узкополосного генератора тока с частотой f2≠f1>fверх, узкополосной фильтрацией выделяют и измеряют на выходе каждого усилителя напряжения с частотами f1 и f2 - Uf1 и uf2. При этом подэлектродное сопротивление каждого рабочего электрода определяют по формуле Zj=Ujf1: (Jf1×Kj), где Zj – подэлектродное сопротивление j-го электрода, Ujf1 - напряжение на выходе j-го усилителя с частотой f1, Jf1 - ток узкополосного генератора тока с частотой f1, Кj - коэффициент усиления j-го усилителя, а подэлектродное сопротивление референтного электрода определяют по формуле ZA=ujf2: (Jf2×Kj), где zA - подэлектродное сопротивление референтного электрода А, сопричастного j-му усилителю, Ujf2 - напряжение на выходе j-го усилителя с частотой f2, Jf2 - ток узкополосного генератора тока с частотой f2. Изобретение позволяет расширить арсенал диагностических средств. 10 ил. 3 н. и 12 з.п. ф-лы.
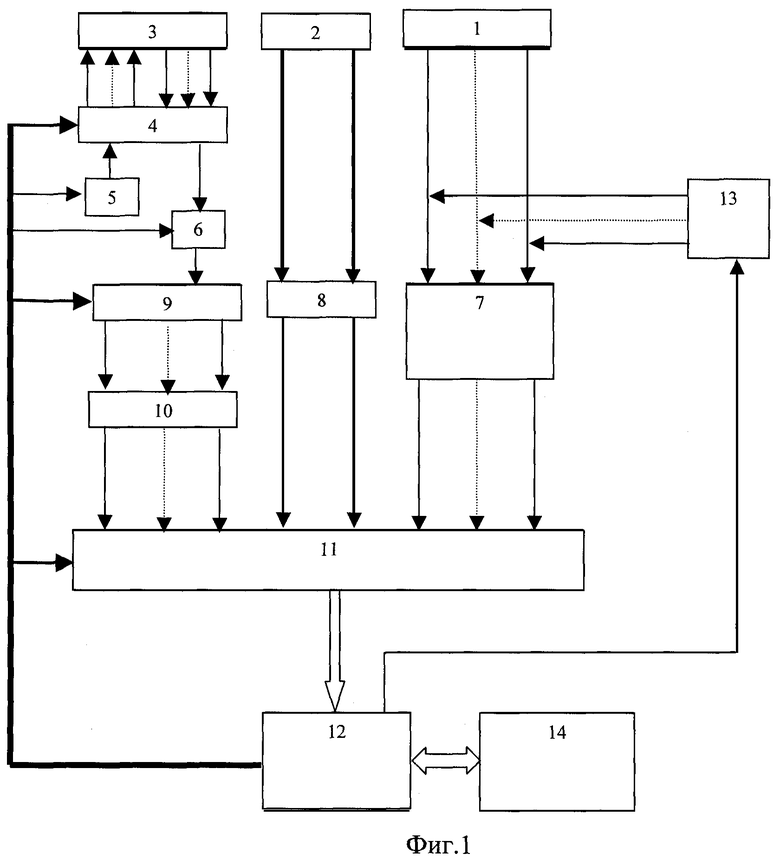
| УСТРОЙСТВО ДЛЯ ИССЛЕДОВАНИЯ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ МОЗГА | 1993 |
|
RU2076625C1 |
| СПОСОБ ОЦЕНКИ ЭНЕРГЕТИЧЕСКОГО СОСТОЯНИЯ ГОЛОВНОГО МОЗГА | 1998 |
|
RU2135077C1 |
| СПОСОБ ВЕЛИКАНОВА И.И. ЛЕЧЕНИЯ ВЕРТЕБРОГЕННОЙ НЕДОСТАТОЧНОСТИ МОЗГОВОГО КРОВООБРАЩЕНИЯ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2000 |
|
RU2194485C2 |
| УСТРОЙСТВО ДЛЯ СЪЕМА, РЕГИСТРАЦИИ И АНАЛИЗА ЭЛЕКТРОФИЗИОЛОГИЧЕСКИХ СИГНАЛОВ И БЛОК ЗАЩИТЫ ОТ АВАРИЙНЫХ ТОКОВ ПАЦИЕНТА | 1995 |
|
RU2102004C1 |
| Инструментальные методы исследования сердечно-сосудистой системы под ред | |||
| Т.С.ВИНОГРАДОВОЙ, М., Медицина, 1986, с.308-311, 332-333, 340-363, 372-373 | |||
| КОНСТАНТИНОВ Б.А | |||
| и др | |||
| "Оценка производительности и анализ поцикловой работы сердца", | |||
Авторы
Даты
2005-05-27—Публикация
2003-07-25—Подача