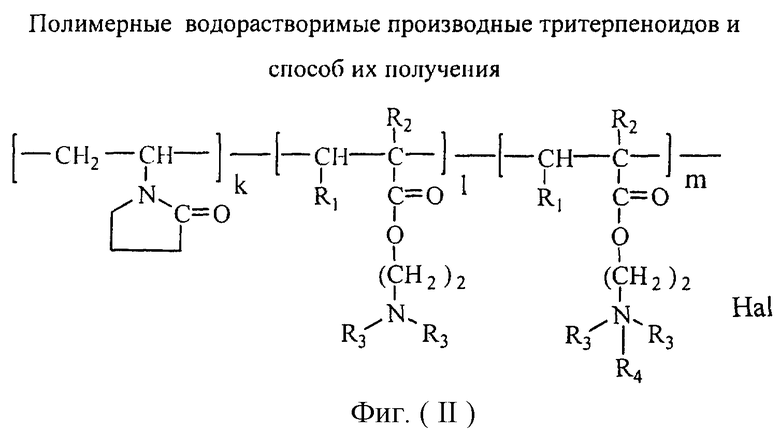
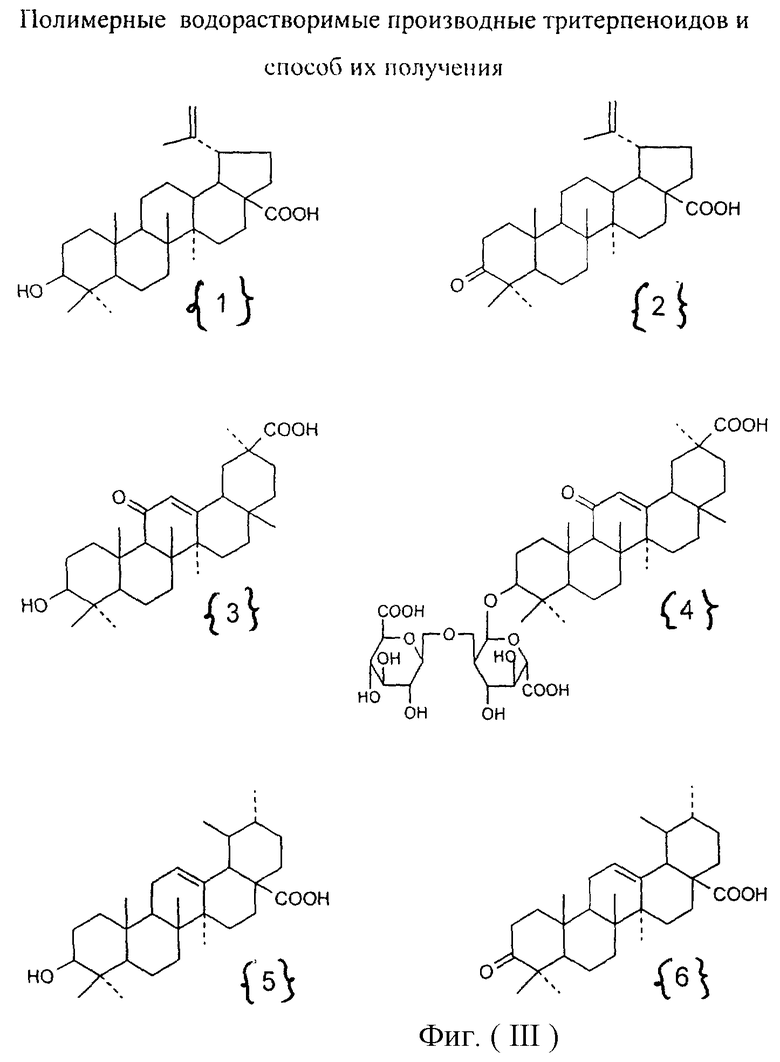
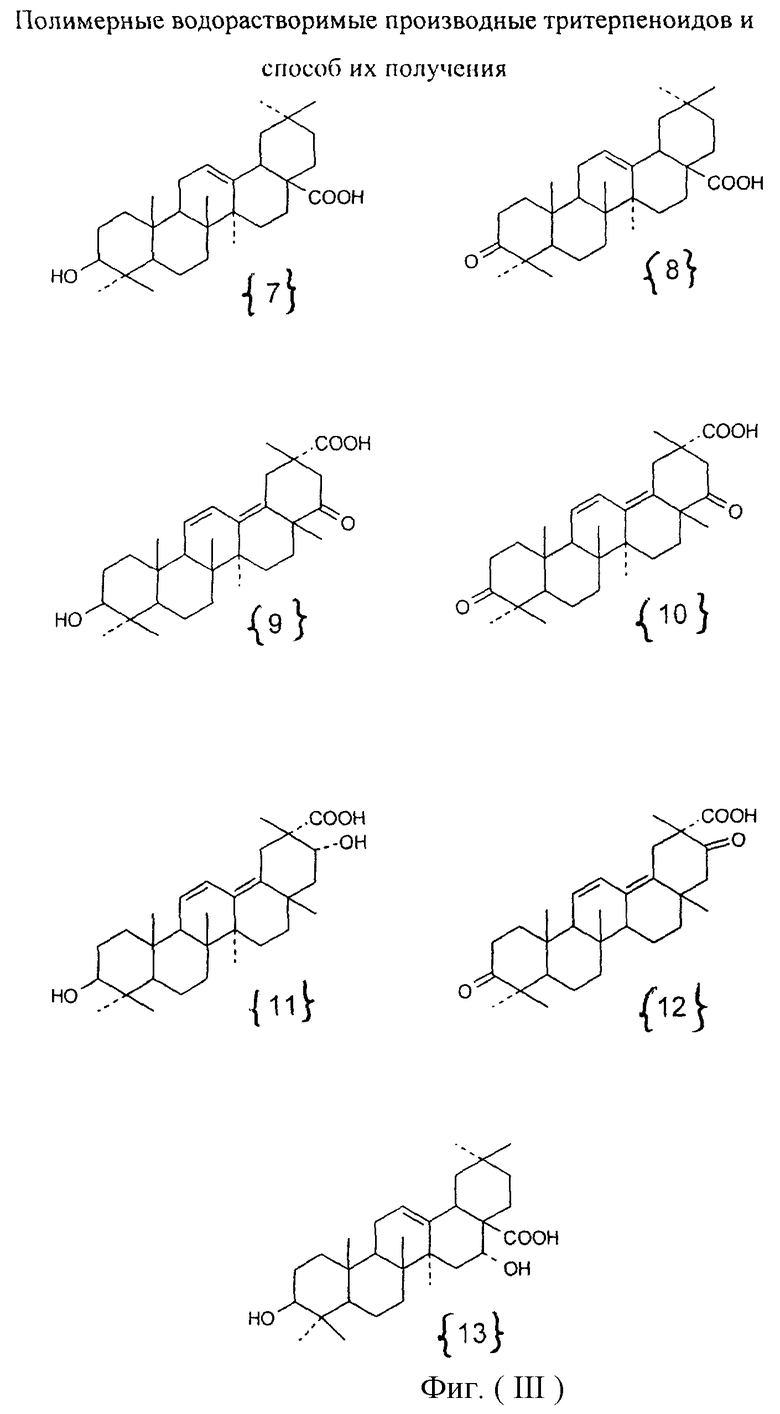
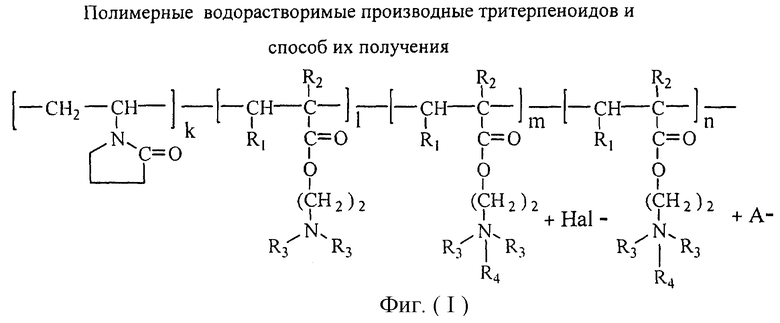
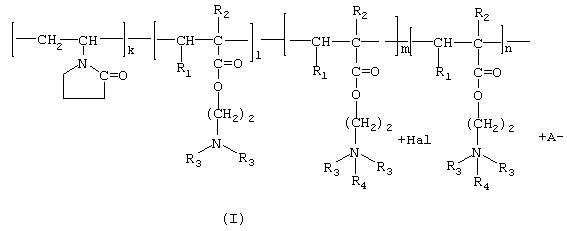
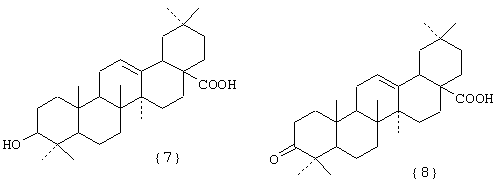
Изобретение относится к химии высокомолекулярных соединений, более точно к полимерным водорастворимым производным тритерпеноидов общей формулы I [фиг.I], где в качестве полимера-носителя берут водорастворимые сополимеры N-винилпирролидона с алкиловыми эфирами α,β-(метил)акриловых кислот и их четвертичными аммониевыми солями общей формулы II [фиг.II], при этом А - остаток тритерпеноида из ряда, содержащего бетулиновую {1}, бетулоновую {2}, глицирретовую {3}, глицирризиновую {4}, урсоловую {5}, урсоновую {6} [фиг.III], олеаноловую {7}, олеаноновую {8}, меристотроповую {9}, дикетомеристотроповую {10}, мацедониковую {11}, дикетомацедониковую {12}, эхиноцистовую {13} кислоты [фиг.III] или другой карбоксилсодержащий тритерпеноид или смесь карбоксилсодержащих тритерпеноидов; при этом - R1-Н, СН3; R2-Н, СН3; R3-СН3, С2Н5; R4 - алкил из ряда С6Н13-С16Н33; Hal-J, Br или Сl; k=65-95 мол.%; l=0,1-34 мол.%, m=0,1-33,9 мол.%, n=0,5-5,4 мол.%; молекулярная масса (ММ)=(7-100).103D.
Изобретение относится также к способу получения полимерных водорастворимых производных тритерпеноидов указанного строения. Изобретение может найти широкое использование в качестве веществ с повышенной антивирусной активностью, которые в медицине и ветеринарии могли бы стать основой для создания лекарственных средств.
Многие широко используемые средства обладают антимикробным действием, но не активны в отношении вирусов.
Известно, что природные тритерпеноиды и их низкомолекулярные производные обладают противовирусной активностью по отношению к широкому спектру вирусов различной природы: гриппа, герпеса, Эпштейна-Барр, ВИЧ. Они характеризуются также высоким уровнем противовоспалительной активности, ингибируют или подавляют рост таких широко распространенных злокачественных новообразований, как лейкемия, лимфома, меланома, опухоли легких, простаты, яичников и др. (1. Платонов В.Г., Зорина А.Д., Гордон М.А. и др./ Исследование противогриппозной активности тритерпеноидов//Химико-фармац. журн. 1995. №2. С.35-42; 2. Walker M.A./Anti-HIV activity of betulinic acid analogue YKFH3 12//Drug Discov. Today. 2001. V. 262. №2. Р.154-169; 3. Kashiwada Y., Nagao Т.. Hashimoto A. et al./Anti-AIDS agents. 38. Anti-HIV activity of 3-О-acyl ursolic acid derivatives//J. Nat. Prod. 2000. V. 48. №9. Р.1387-1390; 4. Ohigashi H., Takamura H., Koshimizu К. et al./Search for possible antitumour promoters by inhibition of 12-О-tetradecanoyl-13-acetate, induced Epstein-Barr virus activation; ursolic acid and oleanolic acid from an anti-inflammatory Chinese medicinical plant, Glechoma Hederaceae L.//Cancer Lett. 1986. V. 30. P.143-151; 5. Recio M.C., Giner R.M., Manez S. et al./Investigations on the steroidal anti-inflammatory activity of triterpenoids from Diospyros leucomelas// Planta Med. 1995. V. 61. №1. Р.9-12; 6. Zuco V., Supino R., Rignetti S.C. et al./Selective cytotoxicity of betulinic acid on tumor cell lines, but not on normal cells//Cancer Lett. 2001. V. 45. №4. Р.1225-1230; 7. Ramadoss S., Jaggi M., Siddiqui M.J.A./Use of betulinic acid and its derivatives for inhibiting cancer growth and a method of monitoring this//US Patent №6.048.847, приоритет от 18.03.1998 г., выдан 11.04.2000 г.).
При этом в отличие от многих известных синтетических химиотерапевтических средств природные соединения, тритерпеноиды и их производные, малотоксичны для организма человека, хотя могут вызывать при введении нежелательные эффекты, например, глицирретовая кислота и ее производные влияют на водно-солевой баланс и их длительный прием приводит к повышению артериального давления, которое быстро нормализуется после прекращения приема средства (8. Shibata S., Takahashi К., Yano S et al./ Chemical modification of glycyrrhetinic acid in relation to the biological activities//Chem. Pharm. Bull. 1987. V. 35. №5. P.1910-1918.).
Основными недостатками известных природных тритерпеноидов являются, во-первых, необходимость создания в организме большой концентрации дорогостоящего препарата, поскольку низкомолекулярные вещества быстро выводятся из организма, во-вторых, природные тритерпеноиды практически нерастворимы в воде, поэтому возникают сложности при их введении.
Задачей заявленного изобретения являлось придание тритерпеноидам водорастворимости при сохранении высокого уровня биологической активности и увеличение времени циркуляции при снижение концентрации вводимых в организм средств.
Эта задача решалась, во-первых, полимерными производными тритерпеноидов общей формулы [фиг.I], где в качестве полимера-носителя берут водорастворимые сополимеры N-винилпирролидона с аминоалкиловыми эфирами α,β-(метил)акриловых кислот и их четвертичными аммониевыми солями [фиг.II], при этом А - остаток тритерпеноида из ряда, содержащего бетулиновую {1}, бетулоновую {2), глицирретовую {3}, глицирризиновую {4}, урсоловую {5}, урсоновую {6} [фиг.III], олеаноловую {7}, олеаноновую {8}, меристотроповую {9}, дикетомеристотроповую {10}, мацедониковую {11}, дикетомацедониковую {12}, эхиноцистовую {13} кислоты [фиг.III], или другой карбоксилсодержащий тритерпеноид или смесь карбоксилсодержащих тритерпеноидов; при этом R1-Н, СН3; R2-Н, СН3; R3-СН3, С2Н5; R4 - алкил из ряда С6Н13-С16Н33; Hal-J, Br или Сl; k=65-95 мол.%; l=0,1-34 мол.%, m=0,1-33,9 мол.%, n=0,5-5,4 мол.%: молекулярная масса (ММ=(7-100).103 дальтон.
Во-вторых, задача решалась способом получения полимерных производных тритерпеноидов заявленного строения, который реализовался следующей совокупностью существенных признаков:
1. Проводят взаимодействие тройного сополимера со структурой II [фиг.II], где k=65-95 мол.%; l=0,1-34 мол.%; х=1,0-34,9 мол.%: R1-H, СН3; R2-H, СН3; R3-СН3, C2H5; R4 - алкил из ряда С6H13-С16Н33; Hal=J, Br, Cl; MM=(7100)103 D с тритерпеноидом с получением целевого продукта со структурой I [фиг.I], где А - остаток тритерпеноида из ряда, содержащего бетулиновую {1}, бетулоновую {2}, глицирретовую {3}, глицирризиновую {4}, урсоловую [5], урсоновую {6} [фиг.III], олеаноловую {7}, олеаноновую {8}, меристотроповую {9}, дикетомеристотроповую {10}, мацедониковую {11}, дикето-мацедониковую {12}, эхиноцистовую {13} кислоты [фиг.III] или другой карбоксилсодержащий тритерпеноид или смесь карбоксилсодержащих тритерпеноидов; при этом R1-Н, СН3; R2-Н, СН3; R3-СН3, С2Н5; R4 - алкил из ряда С6Н13-С16Н33; Hal-J, Br или Сl; k=65-95 мол.%; l=0,1-34 мол.%, m=0,1-33,9 мол.%, n=1-5,4 мол.%; молекулярная масса (ММ)=(7-100)·103 дальтон.
2. Взаимодействие с тритерпеноидом проводят в органическом растворителе при концентрации тройного сополимера 1-30 мас.%, концентрации тритерпеноида 0,05-3,4 мас.%; молярном отношении звена, содержащего четвертичный азот, к тритерпеноиду от 1 до 10.
3. Целевые полимерные водорастворимые производные тритерпеноидов выделяют удалением растворителя. Гомогенность полученных полимерных производных тритерпеноидов установлена методом гель-хроматографии. Состав полученных производных определен методом ПМР-спектроскопии по соотношению интенсивностей сигналов протонов при двойных связях в молекулах тритерпеноидов (в области 4,6-4,8 м.д.) и сигналов протонов в кольце N-винилпирролидона в α-положении к атому азота (в области 3,2 м.д.) [см. фиг.IV-VI].
Водорастворимые сополимеры N-винилпирролидона с аминоалкиловыми эфирами α,β-(метил)акриловых кислот и их четвертичными аммониевыми солями синтезируют известным способом (9. Панарин Е.Ф., Гаврилова И.И./Сополимеры винилпирролидона с диметил- и диэтиламиноэтилметакрилатом) и полиэлектролиты на их основе//Высокомолек. соед. 1977. - том 19(Б) - №4. - С.251-254).
Полученные в соответствии с настоящим изобретением полимерные производные тритерпеноидов приобрели водорастворимость, при этом сохранили специфическую биологическую активность мономерных исходных тритерпеноидов можно ожидать, что их действие в организме будет характеризоваться значительной пролонгацией.
Анализ известного уровня науки и техники в отношении заявленных полимерных водорастворимых производных тритерпеноидов не позволил обнаружить известное решение, совпадающее с заявленным по всей совокупности существенных признаков. Более того, анализ известных публикаций как научных, так и патентных не позволил обнаружить каких-либо сведений о полимерных производных тритерпеноидов. Авторами настоящего изобретения у полученных полимерных тритерпеноидов заявленной структуры in vitro найдено неожиданное свойство - повышение удельной активности в расчете на действующее начало. Это подтверждено примерами конкретного выполнения. Таким образом, можно утверждать не только о соответствии заявленных полимерных водорастворимых производных тритерпеноидов такому условию патентоспособности, как новизна, но такому условию патентоспособности, как изобретательский уровень - неочевидность.
Анализ известного уровня науки и техники относительно способа получения полимерных водорастворимых производных тритерпеноидов также не позволил обнаружить какого-либо известного способа, совпадающего с заявленным по всей совокупности существенных признаков. Таким образом, заявленное решение в отношении независимого пункта формулы, относящегося к способу, соответствует такому условию патентоспособности, как новизна. Наиболее близким по совокупности существенных признаков решением является способ получения полимерных производных антибиотика леворина на основе сополимеров N-винилпирролидона с аминоакрилатами или аминами (10. Авторское свид. СССР №527442, МПК: 2 С 08 F 8/30; С 08 F 226/08; заявлено 18.06.1975; опубликовано 05.09.1976 ), который реализуется следующей совокупностью существенных признаков:
1. Сополимеры N-винилпирролидона с аммониевыми солями аминоалкиловых эфиров метакриловой кислоты, имеющих заместители у атома азота, предпочтительно C12-C16, растворяют в органическом растворителе.
2. К раствору добавляют суспензию леворина в том же растворителе и перемешивают при комнатной температуре.
3. Непрореагировавший леворин отделяют центрифугированием.
4. Из фильтрата удаляют растворитель.
Отличительным признаком заявленного способа является используемое для модификации биологически активное вещество. В известном способе - это антибиотик леворин. В заявленном - тритерпеноиды.
Неожиданным эффектом заявленного способа оказалось существенное увеличение удельной противовирусной активности полученных этим способом полимерных водорастворимых производных тритерпеноидов по сравнению с исходными низкомолекулярными тритерпеноидами. Этого не было найдено в известном способе. Впервые обнаруженная функция заявленного способа подтверждает соответствие решения такому условию патентоспособности, как "изобретательский уровень".
Описание фигур.
Фигура I. Структура заявленного целевого продукта.
Фигура II. Структура полимера-носителя
Фигура III. Структурные формулы тритерпеноидов: бетулиновая {1}, бетулоновая {2}, глицирретовая {3}, глицирризиновая {4}, урсоловая {5}, урсоновая {6} кислоты, олеаноловая {7}, олеаноновая {8}, меристотроповая {9}, дикетомеристотроповая {10}, мацедониковая {11}, дикетомацедониковая {12}, эхиноцистовая {13} кислоты.
Фигура IV. Спектр ПМР бетулиновой кислоты в CDCl3 на осях – х-химический сдвиг (м.д.); у - интенсивность сигнала.
Фигура V. Спектр ПМР исходного сополимера N- винилпирролидона с диметиламиноэтилметакрилатом и димегиллаурилмегакрилоилоксиэтиламмоний иодидом в CDCl3. на осях х-химический сдвиг (м.д.); у интенсивность сигнала.
Фигура VI. Спектр ПМР полимерного производного бетулиновой кислоты на основе сополимера N-винилпирролидона с диметиламиноэтилметакрилатом и диметиллаурилметакрилоилоксиэтиламмоний иодидом в CDCl3 нa осях х - химический сдвиг (м.д.); у - интенсивность сигнала.
Для подтверждения соответствия заявленного решения условию патентоспособности "промышленная применимость" и для лучшего понимания сущности изобретения приводим примеры конкретной реализации изобретения, которые не могут исчерпать сущности предложенного решения.
Пример 1. 3,5 г сополимера N-винилпирролидона (ВП) с диметиламиноэтилметакрилатом (ДМАЭМ) и диметиллаурилметакрилоилоксиэтиламмоний иодидом (ДМАЭМ·C12H25J) (состав тройного сополимера ВП:ДМАЭМ:ДМАЭМ·C12H25J=90,2:6,3:3,5 мол.%, М.М.=18000 Д) растворяют в 300 мл метанола и добавляют 0,44 г бетулиновой кислоты. Смесь перемешивают 1 час. Из фильтрата удаляют растворитель. Получают 3,8 г (выход=96%) полимера, содержащего по данным ПМР 3,5 мол.% бетулиновой кислоты (11,5 маc.%).
Примеры 2-15 выполнены в условиях примера 1, все данные представлены в Таблице 1. Использованы сокращения: ДЭАМА - диэтиламиноэтилмеиакрилат, ДМАЭА - диметиламиноэтилакрилат, ДЭАМК - диметиламиноэтилкротонат. Взаимодействие ведут при 15-30°С в течение 0,5-2 часов.

Противовирусную активность препаратов in vitro в отношении вирусов гриппа А и В (штаммы А/Йоханнесбург В/Йоханнесбург соответственно) исследовали на переживающих фрагментах хорионаллантоисной оболочки куриного эмбриона (ХАО) по методу Fasecas de St. Groth S. (11. Методы испытания и оценки противовирусной активности новых препаратов в отношении вируса гриппа. Ленинград. 1973. 36 с.). Для этого готовили ряд разведений испытуемого препарата на среде, которую разливали в лунки панелей, куда вносили подготовленные кусочки ХАО. Через 1 час контакта при комнатной температуре в эту же среду добавляли по 0,2 мл рабочего (ранее определенного) разведения вируса. Через 48 часов инкубации (при 33-34°С) отмечали количество живых и погибших кусочков. Лунки с погибшими ХАО из опытов исключают. В лунки с живыми кусочками ХАО добавляют 0,1 мл 5% эритроцитов курицы. Контролями при постановке опыта являлись обработанные таким же образом кусочки ХАО, но без добавления препарата. По результатам экспериментов рассчитывали индекс защиты (ИЗ): ИЗ=(КЗ-1)/КЗ×100, где КЗ - коэффициент защиты, определяемый как отношение процента образцов с вирусом в контроле к проценту образцов с вирусом в условиях введения препарата. При этом чем выше значение ИЗ, тем более активно исследуемое вещество. Противовирусную активность in vitro в отношении вируса простого герпеса (12. Вирусология. Методы. / под. Ред. Б. Мейха. М.: “Мир”. 1988. 420 с.) проводили в культуре клеток Vero при заражающей дозе вируса 100 ЦПД 50/мл. Вируссодержащую жидкость вносили в лунки после 30-минутной инкубации клеток с растворами исследуемых веществ. Результаты оценивали через 48 часов культивирования зараженных клеток. Данные по противовирусной активности приведены в Таблице 2. Анализ данных Таблицы 2 подтверждает, что достигнута заявленная задача как в отношении полученных новых полимерных водорастворимых производных, так и в отношении способа их получения.
150
75
150
75
100
70
50
25
72
10
150
75
150
75
100
70
100
80
н.о.
0
150
75
150
75
75
50
0
0
300
0
0
0
300
150
0
20
0
0
0
200
100
22
11
100
100
100
87
100
45
150
75
17
8
100
33
100
37
100 100
300
150
33
17
74
37
100
0
80
н.о.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРНОГО ВОДОРАСТВОРИМОГО ПРОИЗВОДНОГО БЕТУЛОНОВОЙ КИСЛОТЫ | 2009 |
|
RU2393174C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАТРИЕВОЙ СОЛИ 3-СУЛЬФАТА АЛЛОБЕТУЛИНА | 2012 |
|
RU2482125C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАТРИЕВОЙ СОЛИ 3-СУЛЬФАТА АЛЛОБЕТУЛИНА | 2012 |
|
RU2482126C1 |
| КОНЪЮГАТЫ ТРИТЕРПЕНОВЫХ КИСЛОТ И (Е)-4-(1Н-ИНДОЛ-3-ИЛВИНИЛ)-ПИРИДИНИЙ БРОМИДА С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2020 |
|
RU2786134C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИНКАПСУЛИРОВАННУЮ ТРИТЕРПЕНОВУЮ КИСЛОТУ ИЛИ ЕЕ ПРОИЗВОДНЫЕ | 2012 |
|
RU2516952C1 |
| Композиция для лечения заболеваний кожи и косметического использования | 2019 |
|
RU2724342C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АЦЕТАТА-28-СУЛЬФАТА БЕТУЛИНА | 2012 |
|
RU2477285C1 |
| МАЗЬ, СОДЕРЖАЩАЯ ИНКАПСУЛИРОВАННУЮ ТРИТЕРПЕНОВУЮ КИСЛОТУ ИЛИ ЕЕ ПРОИЗВОДНЫЕ | 2012 |
|
RU2519133C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАТРИЕВОЙ СОЛИ 3-АЦЕТАТА-28-СУЛЬФАТА БЕТУЛИНА | 2012 |
|
RU2482124C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО, ОБЛАДАЮЩЕЕ ГИПОХОЛЕСТЕРИНЕМИЧЕСКИМ, ГИПОЛИПИДЕМИЧЕСКИМ ДЕЙСТВИЕМ | 2014 |
|
RU2582297C1 |


Описаны полимерные производные тритерпеноидов общей формулы I
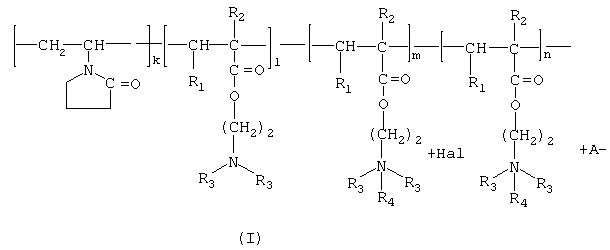
где в качестве полимера-носителя берут водорастворимые сополимеры N-винилпирролидона с алкиловыми эфирами α,β-(метил)акриловых кислот и их четвертичными аммониевыми солями общей формулы II

при этом А - остаток тритерпеноида из ряда, содержащего бетулиновую {1}, бетулоновую {2}, глицирретовую {3}, глицирризиновую {4}, урсоловую {5}, урсоновую {6}, олеаноловую {7}, олеаноновую {8}, меристотроповую {9}, дикетомеристотроповую {10}, мацедониковую {11}, дикетомацедониковую {12}, эхиноцистовую {13} кислоты, или смесь вышеуказанных карбоксилсодержащих тритерпеноидов; при этом – R1 - Н, СН3; R2 - Н, СН3; R3 – СН3, С2Н5; R4 - алкил из ряда С6Н13-С16Н33; Hal - J, Br или Cl; k=65-95 мол. %; l=0,1-34 мол.%, m=0,1-33,9 мол. %, n=0,5-5,4 мол.%; молекулярная масса (ММ)=(7-100)·103 дальтон. Способ получения полимерных производных тритерпеноидов заявленного строения реализуют взаимодействием тройного сополимера со структурой II, где k=65-95 мол.%; l=0,1-34 мол.%; х=1,0-34,9 мол.%; R1 - Н, СН3; R2 - Н, СН3; R3 – СН3, С2Н5; R4 - алкил из ряда С6Н13-С16Н33; Hal=J, Br, Cl; MM=(7-100)·103 дальтон с тритерпеноидом с получением целевого продукта. Взаимодействие с тритерпеноидом проводят в органическом растворителе при концентрации тройного сополимера 1-30 мас.%, концентрации тритерпеноида 0,05-3,4 мас. %; молярном отношении звена, содержащего четвертичный азот, к тритерпеноиду от 1 до 10; целевые полимерные водорастворимые производные тритерпеноидов выделяют удалением растворителя. 1 н.п. ф-лы, 2 табл., 6 ил.
где в качестве полимера-носителя берут водорастворимые сополимеры N-винилпирролидона с алкиловыми эфирами α,β-(метил)акриловых кислот и их четвертичными аммониевыми солями общей формулы (II)

при этом А - остаток тритерпеноида из ряда, содержащего бетулиновую {1}, бетулоновую {2}, глицирретовую {3}, глицирризиновую {4}, урсоловую {5}, урсоновую {6}, олеаноловую {7}, олеаноновую {8}, меристотроповую {9}, дикетомеристотроповую {10}, мацедониковую {11), дикетомацедониковую {12}, эхиноцистовую {13} кислоты или смесь вышеуказанных карбоксилсодержащих тритерпеноидов






R1 - H, СН3; R2 - H, СН3; R3 – СН3, С2Н5;
R4 - алкил из ряда С6Н13-С16Н33; Hal - J, Br или Cl; k=65-95 мол.%; 1=0,1-34 мол.%, m=0,1-33,9 мол.%, n=0,5-5,4 мол.%; молекулярная масса (ММ)=(7-100)·103 дальтон.
| US 6048847 А, 11.04.2000 | |||
| Способ получения водорастворимых биологически активных полимеров | 1975 |
|
SU527442A1 |
| Платонов В.Г | |||
| и др | |||
| Исследование противогриппозной активности терпеноидов | |||
| Химико-фармац | |||
| Журнал, 1995, №2, с.35-42. | |||
Авторы
Даты
2005-06-10—Публикация
2002-07-08—Подача