Изобретение относится к микробиологической промышленности и представляет собой нематофаговый штамм гриба Duddingtonia flagrans, который может быть использован в качестве продуцента для получения биопрепаратов для борьбы с паразитическими нематодами растений и животных.
Известны штаммы нематофаговых грибов: Arthrobotrys oligospora BKMF-2461D (Авторское свидетельство СССР, МПК С 12 N 1/14, №1264393, опубл. 1986), Arthrobotrys oligospora (патент США №4975105, МПК С 05 F 11/08, опубл. 1990), проявляющие высокий нематофаговый эффект. Препаративные формы для борьбы с галловыми нематодами получали на разных органических субстратах. Действующее начало - конидии и мицелий гриба.
Однако такие штаммы характеризуются нестабильностью морфологических признаков нематофаговых свойств. Это проявляется в появлении секторов и пятен в колониях культур на агаризованных питательных средах. Цитокариологическим анализом обнаружены анастомозы между гифами, а также различие ядер по форме и величине в многоядерных базальных клетках конидиеносцев. Препарат на основе конидий может храниться не более 1 года.
Известен другой аналог штамм Arthrobotrys oligospora 3062D (Авторское свидетельство СССР №1688818, МПК А 01 N 63/00, опубл. 1991), проявляющий по сравнению с вышеприведенным штаммом более высокий нематофаговый эффект и стабильность свойств. Действующим началом также являются конидии и мицелий. Данный штамм является основой разработанного биопрепарата “нематофагин-БЛ”, утвержденного в 1990 году Комиссией по микробиологическим средствам защиты ВАСХНИЛ, Союзсельхозхимией, и рекомендован для внедрения. “Нематофагин-БЛ” включен в список биопрепаратов, разрешенных к применению на территории России.
Однако штаммы рода Arthrobotrys образуют в условиях поверхностной культуры конидии и мицелий, которые не приспособлены для длительного хранения, для применения против гельминтозов животных и нуждаются в дополнительных средствах для зашиты конидий от воздействия пищеварительных процессов животных [Прядко Э.И., Осипов П.П.Пленкообразующие вещества в качестве защиты конидий хищных грибов от воздействия пищеварительных процессов животных. Грибы-гифомицеты - регуляторы численности паразитических нематод. - Алма-Ата: Наука, 1990. - С.97-112], а при внесении в почву против фитопаразитических нематод необходимо длительное время (2-3 недели) для осуществления процесса адаптации и формирования хламидоспор и ловушек, которые обеспечивают хищным грибам существование в этой экологической нише.
Более детальное изучение поведения нематофаговых грибов в условиях почвы позволило установить, что конидии не являются формой существования гриба в почве. При помощи прямого микроскопирования и метода мембранных камер установлено, что хищные грибы рода Arthrobotrys существуют в почве в виде хламидоспор.
Часть конидий и мицелия, внесенной в почву, подвергается лизису, а часть клеток трансформируется в хламидоспоры. Они имеют мощную меланизированную оболочку, характеризуются повышенной активностью по отношению к нематодам, так как при прорастании сразу формируют улавливающие приспособления.
Наиболее близким аналогом (прототипом) является штамм Duddmgtonia flagrans CI 3 DSM 6703 (Патент США №5643568, МПК А 01 N 63/00, опубл. 1997), обладающий нематофаговыми свойствами и используемый для борьбы с паразитирующими на животных нематодами.
Однако данный штамм не исследовался на активность в отношении галловых нематод растений и не обладает свойством стимулировать рост растений, что сужает область его использования.
Техническим результатом настоящего изобретения является получение нового штамма нематофагового гриба, обладающего высокой эффективностью в уничтожении галловых немагод растений, возбудителей гельминтозов животных, способностью сохранять жизнеспособность без потери свойств, как при прохождении через желудочно-кишечный тракт животных, так и в услових почвы, а также обладающего свойством стимулировать рост и развитие растений.
Указанный результат достигается тем, что в качестве продуцента для получения биопрепаратов для борьбы с паразитическими нематодами растений и животных предлагается использовать штамм Duddingtonia flagrans T-89, зарегистрированный в коллекции культур микроорганизмов ГНЦ ВБ “Вектор” под номером F-S82 (справка о депонировании штамма прилагается).
Заявляемый штамм характеризуется:
- образованием в поверхностной культуре на различных твердых (агаризованных и сыпучих) средах спороношения преимущественно в виде хламидоспор, имеющих толстую оболочку;
- хламидоспоры хранятся в сухом состоянии без потери исходных свойств гриба и жизнеспособности не менее двух лет, легко восстанавливаются даже после 10-летнего хранения при помещении культуры в суспензию нематод, которые стимулируют прорастание хламидоспор;
- обладает высокой эффективностью по отношению к разным нематодам, проявляет длительность действия;
сравнительная характеристика методом геномной дактилоскопии показала значительные различия данного штамма от прототипа.
Штамм гриба Duddmgtonia flagrans T-89 выделен из почвы тепличного комбината “Кировец” г. Новосибирска в 1989 г. и депонирован в коллекции микроорганизмов НИИ коллекции культур микроорганизмов ГНЦ ВБ “Вектор” (пос. Кольцово, Новосибирская область) под номером F-882.
Штамм имеет следующие культурально-морфологические и физиолого-биохимические признаки.
На сусло-агаре и пептонно-кукурузном агаре образует колонии, имеющие пушистый мицелий коричневатого оттенка. На конидиеносцах образуются немногочисленные конидии, двухклеточные, прямые или слегка изогнутые. На вершине конидиеносцев образуется от 4 до 12 конидий, средний размер которых составляет 40×10 мкм. На мицелии обильно образуются круглые хламидоспоры, диаметр которых составляет от 25 до 55 мкм. Они имеют темно-коричневую окраску и толстую грубобородавчатую оболочку. В присутствии нематод гриб образует клейкие петли и их сплетения, участвующие в акте хищничества.
Гриб усваивает различные источники углерода и азота. Хорошо растет на средах, содержащих сусло, мелассу, кукурузный экстракт.
Оптимальная температура роста +(25-26)°С, нижний предел +(5-6)°С, верхний +(29-30)°С.
Хранится штамм на агаризованной среде - пептонно-кукурузном агаре (ПКА) в пробирках при температуре +(4-5)°С в течение 2-х лет. Для длительного хранения могут быть использованы лиофилизация, криоконсервация, а также хранение в стерильной почве.
Штамм F-882 маркерных признаков не имеет. Имеется характеристика ДНК штамма, полученная методом ПЦР-геномной дактилоскопии.
Штаммы Duddingtonia flagrans широко применяются в различных странах (США, Дания, Аргентина и др.) в экспериментах на животных (лошади, овцы и др.) для борьбы с распространенными и опасными заболеваниями с.-х. и домашних животных - гельминтозами.
В собственных экспериментах по исследованию заявляемого штамма на мышах токсичности не обнаружено. Имеется заключение Научно-исследовательского института медицины труда и экологии человека Российской академии медицинских наук (Сибирское отделение - Восточно-Сибирский научный центр), аккредитованного как испытательный центр в Системе сертификации ГОСТ Р (РОСС RU. 0001.510164) о не вирулентности, не токсичности, не токсигенности штамма.
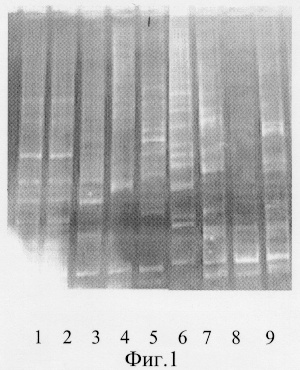
На фиг.1 приведена электрофореграмма RAPD-ПЦР анализ геномных ДНК грибов с праймером Ш-19. Штаммы: дорожка 1 - Phoma exigua 13, 2 - Phoma exigua 3; 3 - Pleurotus ostreatus A, 4 - Rhizoctonia solani var. faviata S, 5 - Rhizoctonia solani var. faviata SC, 6 - Rhizoctonia solani var. faviata P; 7 - Arthrobotrys sp. V-02, 8 - Duddingtonia flagrans T-89, 9 - Arthrobotrys oligospora BKMF-3062D.
Характеризация штаммов грибов по методу ПП-ПЦР-геномной дактилоскопии
Для изучения геномного полиморфизма особый интерес представляют гипервариабельные минисателлитные последовательности. Метод ПП-ПЦР-дактилоскопии (RAPD-PCR analysis) [Шагинян И.А., Гинцбург А.Л. ПЦР-генетическое типирование патогенных микроорганизмов // Генетика 1995, том 31, №5, с.600-610] с использованием произвольных праймеров длиной 6-20 нуклеотидов позволяет получать ряд ампликонов различной длины с молекулярными массами от 200 до 1500 пар нуклеотидов, при этом спектр ампликонов меняется для каждой комбинации праймер-ДНК-мишень, но характерен для каждой из комбинаций. При регистрации продуктов амплификации с помощью электрофореза в полиакриламидном или агарозном гелях каждый спектр разрешается в виде профилей амплификации, или дактилоскопии.
Ниже приведен сравнительный анализ геномных ДНК гельминтофаговых грибов рода Arthrobotrys и Duddingtonia flagrans методом ПП-ПЦР-геномной дактилоскопии с применением произвольных праймеров.
Геномные ДНК грибов выделяли из биомассы по методике Ahman и др. [Ahman J., Ek В., Rask L., Tunlid A. Sequence analysis and regulation of a gene encoding a cuticle-degrading serine protease from the nematophagouse fungus Arthrobotrys oligospora. // Microbiol. 1996. V.142, N7. P.1605-1616] с применением протеиназы К и с последующей очисткой ДНК фенолом и хлороформом. Качество ДНК оценивали методом электрофореза в 1%-ном агарозном геле ( Маниатис Р.А., Фрич Э., Сэмбрук Д. Методы генетической инженерии. Молекулярное клонирование. // М,: Мир, 1984. С.479).
Полимеразную цепную реакцию с произвольными праймерами проводили следующим образом. Реакционная смесь (объем 25 мкл) содержала: 1.2 мкл смеси 2тМ дезокси-нуклеозидтрифосфатов, 2.5 мкл буфера MPCR (0.5M трис-НСl рН 8.8, 160тМ (NH4)2SO4, 20mM MgCl2, 0,5тМ твин-20), 0.5 мкл Taq-полимеразы, 2.5 мкл 0.02М MgCl2, 1 мкл олигонуклеотидного праймера, 1 нг геномной ДНК. Условия амплификации (30 циклов): 94°С - 1 мин (этап денатурации); 42°С - 1 мин (этап отжига); 72°С - 1,5 мин (этап достройки цепи); 72°С - 8 мин (этап завершающего синтеза).
Анализ продуктов амплификации проводили с помощью электрофореза в 4%-ном полиакриламидном геле с последующим окрашиванием бромистым этидием. Наиболее важным этапом при использовании ПЦР-дактилоскопии в генетическом типировании микроорганизмов является экспериментальный поиск и подбор праймера или их комбинации для наиболее эффективной дифференциации близкородственных представителей того или иного вида организмов.
Для этой цели были испытаны несколько “случайных” праймеров длиной 10-20 нуклеотидов (таблица 1) на ДНК грибов Arthrobotrys oligospora (BKMF-3062D) и Duddingtonia flagrans T-89. В качестве отрицательных контролей были взяты ДНК микобактерии Mycobacterium bovis и ДНК бациллы Bacillus subtilis 652. Наиболее специфичными и информативными праймерами для дифференциации штаммов оказались олигонуклеотиды GDI8 и Ш-19, с которыми далее был проведен анализ вновь выделенных хромосомных ДНК грибов.
Для анализа помимо грибов рода Arthrobotrys (Arthrobotrys oligospora BKMF-3062D, Duddingtonia flagrans T-89 и Arthrobotrys sp. V-02) были взяты дополнительно еще 6 контрольных препаратов грибов других различных родов: Phoma exigua 3 и Phoma exigua 13; Rhizoctonia solani var. faviata S, Rhizoctonia solani var. faviata P и Rhizoctonia solani var. faviata SC; Pleurotus ostreatus А. После выделения хромосомных ДНК грибов провели их характеризацию методом ПП-ПЦР-генотипирования с использованием одного из подобранных праймеров Ш-19 (табл.1).
Были получены следующие результаты (Фиг.1): все картины геномных фингерпринтов контрольных ДНК отличались от таковых для рода Arthrobotrys. Для грибов Arthrobotrys похожими были картины полос у штаммов Arthrobotrys oligospora BKMF-3062D и Arthrobotrys sp. V-02 (дорожки 7 и 9). Вероятно, они оба относятся к виду Arthrobotrys oligospora. Штамм Duddingtonia flagrans T-89 (дорожка 8) существенно отличался от них, в частности, на электрофореграмме в диапазоне длин от 400 до 1300 пар нуклеотидов (пн) полосы совершенно не совпадают с таковыми на дорожках 7 и 9, а в диапазоне 300-340 пн вместо двойных полос на дорожке 8 присутствует лишь одна, т.к. Duddingtonia flagrans T-89 является представителем другого рода грибов, на что указывают и данные морфологических исследований этого штамма.
Пример 1. Сравнительный нематофаговый эффект Duddingtonia flagrans и Arthrobotrys oligospora BKMF-3062D в суспензии нематоды сапрозойной Panagrellus rediviras. (табл.2).
Duddingtonia flagrans, как и Arthrobotrys oligospora проявляет хороший аттрактивный эффект, который обнаруживается по числу скопившихся нематод в блоках из культур грибов, выросших на пептонно-кукурузном агаре. Как и многие покоящиеся структуры, имеющие толстые оболочки, хламидоспоры Duddingtonia flagrans требуют для прорастания чуть больше времени, чем прототип, культура которого представлена конидиями и мицелием.
Пример 2. Большое количество хламидоспор, требующих адаптации к почвенным условиям, позволяет осуществлять применение Duddingtonia flagrans F-882 не только за 2-3 недели до высадки рассады растений, поражаемых паразитическими нематодами, но и одновременно с растениями. В опыте, где биопрепарат на основе штамма D. flagrans F-882 был внесен в лунку вместе с рассадой огурца, наблюдалось его пролонгированное действие, что сказалось на галловых немагодах и на урожайности следующего оборота томата (табл.3).
Пример 3. Скармливание в течение 7 суток зернового биопрепарата на основе штаммов D. flagrans F-882 в дозе 3 г в день в течение 7 суток лабораторной линии белых мышей, пораженных гельминтами (сифации, аспикулюрусы), показало, что гриб, проходя через пищеварительную систему животных, сохраняет свою жизнеспособность и нематофаговую эффективность. Экскременты опытных и контрольных линий помещали в чашки Петри на голодный агар (ГА) и осуществляли их прямое микроскопирование. Установлено наличие ловчих петель и хламидоспор гриба на экскрементах во всех пробах с хищным грибом, начиная с 2-х суток. Было также отмечено уменьшение колоний грибов рода Aspergillium, Penicillium и актиномицетов, как на поверхности агара, так и на самих экскрементах опытного варианта после употребления препарата в течение 3-х суток. После окончания опыта гельминтологический анализ показал полное отсутствие нематод в экскрементах мышей в опыте с грибом-нематофагом, в то время как в контрольном варианте их число в 1 г составляло в среднем 8 штук.
Пример 4. Опыт поставлен с использованием фекалий лошадей, спонтанно инвазированных стронгилятами желудочно-кишечного тракта. Предварительные исследования методом овоскопии по Котельникову-Хренову показали высокую зараженность животных. Интенсивность инвазии составила 35-50 яиц в одной капле. Из этой пробы сделаны навески навоза массой 36 г. и 50 г. и равномерно распределены по чашкам Петри. В одну чашку с пробой фекалий массой 50 г. было добавлено 78 зерен ржи, на которой был выращен гриб Duddingtonia flagrans. Пробы были поставлены в термостат при температуре 26.7°С. Через 13 суток личинок нематод выделяли по методу Бермана-Орлова. Результаты представлены в табл.4.
Анализ полученных данных показал, что на 13 сутки после взятия проб в опытной пробе (D. flagrans) численность личинок паразитических нематод была в 11.5 раз меньше, чем в контрольной пробе.
Пример 5. Данные о заявляемом штамме, обеспечивающем стимулирование роста и развития растений.
Испытания гриба Duddingtonia flagrans в опытах на разных культурах позволили установить стимулирующий эффект на рост и развитие растений. Это отмечено на сеянцах сосны, на цикламенах, на огурцах и томатах.
Внесение биомассы глубинной культуры Duddingtonia flagrans в горшочки под рассаду огурца при ее пикировке в дозе 1% к массе субстрата, состоящего из опилок, торфа и почвы, привело к значительному опережению растений в росте, формировании листьев. Через 4 недели вегетации был проведен анализ огурца сорта “Кристалл”, результаты представлены в табл.5.
Пример 6.
В декабре 2002 года в тепличном комбинате КГУП “Индустриальный” г. Барнаула под огурцы сорта “Сапфир” в теплице №36 был внесен препарат на основе D. flagrans в дозе по 45 г в лунку под рассаду (450 растений). Учеты, проведенные через 5 недель, показали, что средняя высота опытных растений составляла 180 см, на растениях было много завязей и плодов массой до 100 г. На контрольной площади, где не вносился препарат, растения имели среднюю высоту 150 см, а завязи только начали развиваться.
Эксперименты на разных видах нематод, проведенные в лабораторных и полевых испытаниях, свидетельствуют о проявлении хищным грибом Duddingtonia flagrans нематофаговых свойств по отношению к сапрозойной нематоде Panagrellus redivivus, фитопаразитическим нематодам из рода Meloidogyne (M. hapla, M. incognita, M. javanica, M. arenaria), энтомопатогенным нематодам Steinernema carpocasae и S. feltiae, а также стронгилятам желудочно-кишечного тракта лошади - Trichonema, Strongylus, Alfortia, Delafondia и личинкам Elaphostrongylus sp. - возбудителю гельминтоза головного мозга маралов.
Пример 7. Для оценки стимулирующего влияния гриба Duddingtonia flagrans T-89 (номер F-882) на рост и развитие растений и одновременное проявление нематофаговой эффективности был проведен лабораторный опыт, в котором использовали культуры хищных грибов D. flagrans T-89 и Arthrobotrys oligospora BKMF-3062D (рабочее название Т-82). На основе этих культур предварительно был получен биопрепарат путем выращивания грибов на зернах ржи.
В качестве тест-объекта использовали огурцы сорта Зозуля. Опыт проводили в пластмассовых стаканчиках, а в качестве субстрата использовали прокаленный речной песок. Для создания инфекционного фона использовали измельченные корневые галлы огурца из тепличного комбината “Индустриальный” (Барнаул).
Биопрепарат вносили одновременно с посевом проросших семян огурцов в дозе 1% к массе субстрата в стаканчике, которая составляла 225г. В каждом варианте было по 5 растений. Полив растений осуществляли из расчета 20 мл на 1 растение через 2-3 дня по мере подсыхания почвы. Один раз в 10 дней растения поливали раствором “Золото Флоры”. Контроль был представлен сосудами, в которые биопрепарат не вносили. Продолжительность опыта составила 4 недели.
Результаты проведенного опыта позволили установить различия в росте, развитии растений, а также проявлении нематофаговой эффективности в зависимости от штамма хищного гриба.
Лучшие показатели отмечены в варианте с Duddingtonia flagrans T-89 (заявляемый штамм). К окончанию опыта ни одно растение в этом варианте не погибло.
В варианте с A. oligospora (Т-82) 2 растения погибли, 2 имели желтые засохшие семядольные листья, у 5 растений отмечен хлороз листьев. Кроме различий в высоте растений, длине корневой системы, количестве листьев, варианты различались по количеству галлов на одно растение. Как видно из таблицы 6, наилучшие показатели роста, развития растений и проявления нематофагового эффекта были в варианте со штаммом Duddingtonia flagrans (см. фиг.2)
Промышленная применимость. Изобретение может быть использовано в микробиологической промышленности и сельском хозяйстве как продуцент для производства биопрепаратов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм нематофагового гриба Arthrobotrys oligospora, поражающий яйца и личинки цистообразующей золотистой картофельной нематоды Globodera rostochiensis в цистах | 2016 |
|
RU2634390C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА ХИЩНЫХ ГРИБОВ ДЛЯ ЗАЩИТЫ РАСТЕНИЙ И ЖИВОТНЫХ ОТ ПАРАЗИТИЧЕСКИХ НЕМАТОД | 1993 |
|
RU2106092C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА НА ОСНОВЕ ХЛАМИДОСПОР МИКРОСКОПИЧЕСКОГО ГРИБА ДЛЯ БОРЬБЫ С ПАРАЗИТИЧЕСКИМИ НЕМАТОДАМИ РАСТЕНИЙ И ЖИВОТНЫХ | 2008 |
|
RU2366178C1 |
| Штамм гриба АRтнRовотRYS DIGoSpoRa FReS. для получения препарата против галловых нематод | 1988 |
|
SU1688818A1 |
| ПРОТИВОВИРУСНОЕ СРЕДСТВО НА ОСНОВЕ ШТАММА НЕМАТОФАГОВОГО ГРИБА Duddingtonia flagrans F-882 | 2011 |
|
RU2475531C2 |
| ШТАММ БАКТЕРИЙ Bacillus amyloliquefaciens, ОБЛАДАЮЩИЙ НЕМАТИЦИДНОЙ АКТИВНОСТЬЮ ПРОТИВ ГАЛЛОВЫХ НЕМАТОД | 2020 |
|
RU2745156C1 |
| СПОСОБ ВОСПРОИЗВОДСТВА МИКРОГЕЛЬМИНТОВ | 2018 |
|
RU2683874C1 |
| СПОСОБ ОБРАБОТКИ РАСТЕНИЙ ТОМАТА ПРОТИВ ГАЛЛОВОЙ НЕМАТОДЫ (Meloidogyne ssp) | 2014 |
|
RU2556901C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОПЕСТИЦИДНОГО ПРЕПАРАТА | 2016 |
|
RU2651487C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКОГО СРЕДСТВА ДЛЯ ЗАЩИТЫ РАСТЕНИЙ ОТ ФИТОПАТОГЕНОВ И НЕМАТОД НА ОСНОВЕ ШТАММА ГРИБА РОДА TRICHODERMA И БИОЛОГИЧЕСКОЕ СРЕДСТВО, ПОЛУЧЕННОЕ СПОСОБОМ | 2012 |
|
RU2534213C2 |

Изобретение относится к биотехнологии и представляет собой нематофаговый штамм гриба Duddingtonia flagrans, который может быть использован в качестве основы для получения биопрепаратов. Штамм Duddingtonia flagrans Т-89, зарегистрированный в Коллекции культур микроорганизмов ГНЦ ВБ “Вектор” под номером F-882, проявляющий свойства против галловых нематод растений и паразитических нематод животных и стимулирующий рост и развитие растений. Штамм обладает высокими показателями стимуляции роста, развития растений и проявлением нематофагового эффекта. 6 табл., 2 ил.
Штамм Duddingtonia flagrans Т-89, зарегистрированный в Коллекции культур микроорганизмов ГНЦ ВБ “Вектор” под номером F-882, проявляющий свойства против галловых нематод растений и паразитических нематод животных и стимулирующий рост и развитие растений.
| US 5643568, 01.07.1997 | |||
| Штамм гриба продуцент аттрактанта овсяной нематоды | 1978 |
|
SU683701A1 |
| ШТАММ БАКТЕРИЙ PSEUDOMONAS LEMOIGNEI ДЛЯ ПОЛУЧЕНИЯ ПРЕПАРАТА, ИСПОЛЬЗУЕМОГО ДЛЯ СТИМУЛЯЦИИ РОСТА И ЗАЩИТЫ РАСТЕНИЙ ОТ ГРИБНЫХ ФИТОПАТОГЕНОВ В ПРОЦЕССЕ ВЕГЕТАЦИИ И ПРИ ХРАНЕНИИ УРОЖАЯ | 1997 |
|
RU2121271C1 |
| Штамм гриба АRтнRовотRYS DIGoSpoRa FReS. для получения препарата против галловых нематод | 1988 |
|
SU1688818A1 |
| ЕР 0623284, 09.11.1994. | |||
Авторы
Даты
2005-06-10—Публикация
2003-05-13—Подача