Статус родственных заявок
Настоящее изобретение относится к серийной патентной заявке № 60/236077, поданной 28 сентября 2000 г. Указанная заявка полностью включена в настоящее описание в качестве ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится к фармацевтическим композициям. В частности, изобретение относится к микрочастицам с адсорбирующими поверхностями, способам получения таких микрочастиц и к их использованию. Кроме того, изобретение относится к композициям, содержащим биоразлагаемые микрочастицы, где на поверхности таких микрочастиц адсорбированы биологически активные вещества, такие как терапевтически полезные полинуклеотиды, полипептиды, антигены и адъюванты.
Предпосылки создания изобретения
Для достижения контролируемой парентеральной доставки терапевтических соединений используют носители в виде частиц. Такие носители разрабатывают с целью удержания активного вещества в системе доставки в течение длительного периода времени. Примеры носителей в виде частиц включают такие носители, которые получены из полиметилметакрилатных полимеров, а также на основе микрочастиц, полученных из поли(лактидов) (см., например, патент США № 3773919), поли(лактидкогликолидов), известных как ПЛГ (PLG) (см., например, патент США № 4767628) и из полиэтиленгликоля, известного как ПЭГ (см., например, патент США № 5648095). Полиметилметакрилатные полимеры относятся к недеградируемым веществам, тогда как частицы ПЛГ разлагаются при ненаправленном неэнзиматическом гидролизе сложноэфирных связей на молочную и гликолевую кислоты, которые выделяются обычными метаболическими путями.
Так, например, в патенте США № 5648095 описывается использование микросфер с инкапсулированными в их состав фармацевтическими агентами в качестве систем доставки лекарственных средств для назальной, пероральной, легочной и оральной доставки. Были также описаны композиции с медленным высвобождением, содержащие различные полипептидные факторы роста. См., например, международную публикацию № WO 94/12158, патент США № 5134122 и международную публикацию № WO 96/37216.
Fattal et al., Journal of Controlled Release 53:137-143 (1998) описывает наночастицы, полученные из полиалкилцианоакрилатов (ПАЦА), включающие адсорбированные олигонуклеотиды.
Носители в виде частиц с адсорбированными на них или захваченными в их состав антигенами также используются с целью достижения адекватных иммунных реакций. Такие носители презентируют иммунной системе множественные копии выбранного антигена и способствуют захвату и удерживанию антигенов в локальных лимфатических узлах. Частицы могут быть подвергнуты фагоцитозу за счет действия макрофагов, и они могут усилить презентирование антигена за счет высвобождения цитокина. Так, например, в одновременно рассматриваемой заявке совместного владения № 09/015652, поданной 29 января 1998 г., описывается использование микрочастиц с адсорбированным антигеном и инкапсулированным антигеном для стимуляции клетко-опосредованных иммунологических реакций, а также способы изготовления таких микрочастиц.
Так, например, в одновременно рассматриваемой серийной заявке совместного владения № 09/015652, поданной 29 января 1998 г., раскрывается способ образования микрочастиц, который включает объединение полимера с органическим растворителем, при последующих добавке стабилизатора эмульсии, такого как поверхностно-активное вещество поливиниловый спирт (ПВС), и выпаривании органического растворителя с образованием при этом микрочастиц. Поверхность микрочастиц включает полимер и стабилизатор. На указанных поверхностях могут быть также адсорбированы макромолекулы, такие как ДНК, полипептиды и антигены.
В патентах США №№ 5814482 и 6015686 раскрываются эукариотические слоистые векторные системы инициации (ELVIS векторы), в особенности те, которые получены и сконструированы на основе геномов альфа-вирусов (таких как Синдбис вирус), для использования в стимуляции иммунной реакции на антиген, в процессах ингибирования патогенных агентов и при доставке гетерологичных нуклеотидных последовательностей в эукариотические клетки и, в числе других, в клетки животных.
В международной патентной заявке совместного владения РСТ/US99/17308 и в совместно рассматриваемой серийной заявке на патент США № 09/715902 раскрываются способы получения микрочастиц, содержащих адсорбированные макромолекулы, такие как фармацевтический агент, полинуклеотид, полипептид, белок, гормон, фермент, медиатор транскрипции или трансляции, интермедиат метаболического пути, иммуномодулятор, антиген, адъювант или их сочетания и др. Микрочастицы включают, например, полимер, такой как поли(альфа-гидроксикислота) (например, ПЛГ), полигидроксимасляная кислота, поликапролактон, полиортоэфир, полиангидрид и др., которые получают с использованием, например, катионных, анионных или неионных детергентов.
Несмотря на то, что ПЛГ микрочастицы с адсорбированным антигеном обеспечивают значительные преимущества в сравнении с другими более токсичными системами, тем не менее адсорбция биологически активных агентов на поверхности микрочастиц может быть улучшена. Так, например, зачастую бывает трудно или невозможно осуществить адсорбцию заряженных или объемных биологически активных веществ, таких как полинуклеотиды, крупные полипептиды и др., на поверхности микрочастиц. Таким образом, существует постоянная потребность в гибких системах доставки для таких веществ и в особенности для лекарственных средств, которые характеризуются высокой чувствительностью и сложностями при составлении на их основе композиции.
Краткое описание сущности изобретения
Авторами настоящего изобретении было обнаружено, что адсорбция макромолекул на микрочастицах может быть улучшена за счет обеспечения доступности детергента в образовании комплекса с макромолекулами при адсорбции. Такая доступность может быть достигнута, например, посредством отдельного добавления некоторого количества детергента при адсорбции макромолекулы или за счет обеспечения того, что процесс образования микрочастиц приведет к получению продукта, содержащего существенное количество несвязанного детергента. Указанный подход противоречит методикам известного уровня техники, согласно которым микрочастицы тщательно промывают для удаления остаточных количеств детергента перед проведением адсорбции макромолекул. Так, в частности, в цитированном выше документе РСТ/US99/17308 приведены примеры, согласно которым микрочастицы промывают много раз водой (т.е. их промывают водой четыре раза с последующим центрифугированием) перед введением интересующей макромолекулы. Такие стадии промывки удаляют, по существу, весь несвязанный детергент, в результате чего в готовом продукте более 99% оставшегося детергента связано с частицами.
Таким образом, в соответствии с первым аспектом настоящего изобретения предлагается композиция микрочастиц, которая содержит (1) микрочастицы, которые дополнительно включают полимер и первую часть детергента, которая связана с полимером, и (2) комплекс биологически активной макромолекулы со второй частью детергента, причем указанный комплекс адсорбирован на поверхности микрочастиц. Первая часть детергента и вторая часть детергента могут содержать один и тот же детергент или разные детергенты.
Предпочтительные биологически активные макромолекулы выбирают из группы, состоящей из полипептида, полинуклеотида, полинуклеозида, антигена, фармацевтического агента, гормона, фермента, медиатора транскрипции или трансляции, интермедиата метаболического пути, иммуномодулятора и адъюванта.
Предпочтительные полимеры представляют собой поли(α-гидроксикислоты), более предпочтительно, те из них, которые выбирают из группы, состоящей из поли(L-лактида), поли(D,L-лактида) и поли(D,L-лактидкогликолида). Более предпочтительными являются поли(D,L-лактидкогликолидные) полимеры. Предпочтительные поли(D,L-лактидкогликолидные) полимеры представляют собой такие полимеры, которые характеризуются молярным соотношением лактид/гликолид в диапазоне от 30:70 до 70:30, более предпочтительно, от 40:60 до 60:40 и имеют молекулярную массу, варьирующую от 10000 до 100000 дальтон, более предпочтительно, от 30000 дальтон до 70000 дальтон. Более предпочтительные биологически активные макромолекулы включают бактериальные и вирусные антигены (например, ВИЧ антигены, такие как gp120, gp140, p24gag и p55gag, антигены менингита В, антигены стрептококка В и антигены гемагглютинина гриппа А), а также полинуклеотиды, которые кодируют антигены. Биологически активные макромолекулы могут находиться, например, в виде плазмиды, ELVIS вектора или конструкции на основе РНК-вектора. Особенно предпочтительной биологически активной макромолекулой является pCMV-p55gag.
В некоторых вариантах осуществления изобретения предлагается композиция микрочастиц с дополнительной биологически активной макромолекулой, которая может находиться в связанном или несвязанном виде и может быть даже захвачена полимером. Так, например, может быть получена композиция микрочастиц с адъювантом, в частности, с Th1-стимулирующим адъювантом. Предпочтительные адъюванты включают CpG олигонуклеотиды, LTK63, LTR72, MPL и соли алюминия, включая фосфат алюминия.
В некоторых вариантах осуществления изобретения первая часть детергента и вторая часть детергента содержат один и тот же детергент. Предпочтительными для данной цели детергентами являются катионные детергенты, например ЦТАБ. В таких вариантах осуществления изобретения первая часть детергента (которая связана с полимером), предпочтительно, составляет примерно 5-95% от общего количества детергента в композиции, более предпочтительно, примерно 10-90%, еще более предпочтительно, примерно 10-60% и, наиболее предпочтительно, примерно 25-40%.
В других вариантах осуществления изобретения первая часть детергента и вторая часть детергента содержат разные детергенты. Так, например, первая часть детергента может включать неионный детергент (например, ПВС), и вторая часть детергента может включать катионный детергент (например, ЦТАБ).
В соответствии с другим аспектом настоящего изобретения к указанным выше композициям микрочастиц добавляют фармацевтически приемлемый эксципиент.
Другой аспект настоящего изобретения относится к доставке макромолекулы позвоночному субъекту, которая включает введение позвоночному субъекту указанной выше композиции микрочастиц.
В дополнительном аспекте изобретение относится к способу проявления клеточной и/или гуморальной иммунной реакции у позвоночного субъекта, который включает введение позвоночному субъекту терапевтически эффективного количества композиции микрочастиц, определенной выше.
Другой аспект настоящего изобретения относится к способу иммунизации, который включает введение позвоночному субъекту терапевтически эффективного количества композиции микрочастиц, определенной выше.
В других аспектах настоящего изобретения указанные выше композиции микрочастиц используют при диагностике заболеваний, при лечении заболеваний, в составе вакцин и/или для усиления иммунитета.
Еще другие аспекты настоящего изобретения относятся к способам получения композиций микрочастиц. В целом, указанные способы включают: (а) получение эмульсии, содержащей (i) полимер, выбранный из группы, состоящей из поли(α-гидроксикислоты), полигидроксимасляной кислоты, поликапролактона, полиортоэфира, полиангидрида и полицианоакрилата, (ii) органический растворитель, (iii) детергент и (iv) воду; и последующее (b) удаление органического растворителя. В указанном варианте осуществления изобретения примерно 10-90% всего детергента в полученной композиции, предпочтительно, связано с микрочастицами, более предпочтительно, примерно 10-60% и, наиболее предпочтительно, примерно 25-40%. В целом, указанные композиции микрочастиц далее инкубируют с биологически активной макромолекулой, такой как указано выше, с образованием биологически активной композиции.
Предпочтительно, эмульсия представляет собой эмульсию вода–в–масле–в–воде, которая образуется посредством способа, включающего: (а) эмульгирование органической фазы, содержащей полимер и органический растворитель, с первой водной фазой,
содержащей воду, с образованием эмульсии вода–в–масле; и (b) эмульгирование второй водной фазы, содержащей катионный детергент и воду, с эмульсией, образованной на стадии (а), с получением эмульсии вода – в – масле – в – воде.
В некоторых предпочтительных вариантах осуществления изобретения детергент представляет собой катионный детергент, который обеспечивается в виде эмульсии при массовом соотношении детергента к полимеру от примерно 0,05:1 до примерно 0,5:1. В указанных вариантах осуществления изобретения способ, предпочтительно, дополнительно включает фильтрование частиц в поперечном потоке после стадии удаления растворителя. В конкретном варианте осуществления изобретения полимер представляет собой поли(D,L-лактидкогликолид), катионный детергент представляет собой ЦТАБ и катионный детергент обеспечивается в виде эмульсии при массовом соотношении детергента к полимеру от примерно 0,1:1 до примерно 0,5:1.
В других предпочтительных вариантах осуществления изобретения детергент представляет собой катионный детергент, который обеспечивается в виде эмульсии при массовом соотношении детергента к полимеру, от примерно 0,001:1 до примерно 0,05:1. При указанных низких уровнях обычно отсутствует необходимость в стадии фильтрования или промывания для удаления избытка детергента. В конкретном варианте осуществления изобретения катионный детергент представляет собой ЦТАБ, полимер представляет собой поли(D,L-лактидкогликолид), катионный детергент обеспечивается в виде эмульсии при массовом соотношении детергента к полимеру от примерно 0,002:1 до
примерно 0,04:1, и микрочастицы не подвергают стадии удаления ЦТАБ из композиции.
Другие аспекты настоящего изобретения относятся к способам получения композиций микрочастиц, при этом указанные способы включают: (1) получение микрочастиц в процессе эмульгирования, причем указанные микрочастицы включают полимер и первую часть детергента, который связывается с микрочастицами; и (2) адсорбирование комплекса биологически активной макромолекулы и второй части детергента на поверхности микрочастицы. Первая часть детергента и вторая часть детергента могут включать один и тот же детергент или разные детергенты. Полимер, предпочтительно, выбирают из группы, состоящей из поли(α-гидроксикислоты), полигидроксимасляной кислоты, поликапролактона, полиортоэфира, полиангидрида и полицианоакрилата.
В некоторых вариантах осуществления изобретения первая и вторая части детергента включают один и тот же детергент. Указанный детергент, предпочтительно, представляет собой катионный детергент, например, ЦТАБ. В таких вариантах осуществления изобретения примерно 10-90%, более предпочтительно, примерно 10-60% и, наиболее предпочтительно, 25-40% от всего количества детергента в композиции микрочастиц присутствует в виде первой части детергента, который связан с микрочастицами. В типичном случае весь детергент добавляют в ходе процесса эмульгирования.
В других вариантах осуществления изобретения первая часть детергента включает первый детергент, а вторая часть детергента
включает второй детергент, отличающийся от первого детергента. В типичном случае первый детергент добавляют в ходе процесса эмульгирования, а второй детергент добавляют после процесса эмульгирования, предпочтительно, одновременно с добавлением биологически активной макромолекулы. Предпочтительно, первая часть детергента включает неионный детергент, такой как ПВС, а вторая часть детергента включает катионный детергент, такой как ЦТАБ.
Эти и другие варианты осуществления настоящего изобретения будут понятны специалистам в данной области из приведенного ниже раскрытия.
На чертеже представлена схематическая диаграмма аппарата, подходящего для получения микрочастиц согласно настоящему изобретению.
Подробное описание изобретения
Практическое осуществление настоящего изобретения включает, если особо не оговорено иное, традиционные методы химии, химии полимеров, биохимии, молекулярной биологии, иммунологии и фармакологии, все из которых доступны специалистам в данной области. Такие методики хорошо представлены в литературе. См., например, Remington's Pharmaceutical Sciences, 18th Edition (Easton, Pennsylvania: Mack Publishing Company, 1990); Methods In Enzymology (S. Colowick and N. Kaplan, eds., Academic Press, Inc.); Handbook of Experimental Immunology, Vols. I-IV (D.M. Weir and C.C. Blackwell, eds., 1986, Blackwell Scientific Publications); Sambrook et al., Molecular Cloning: A Laboratory Manual (2nd Edition, 1989); Handbook of Surface and Colloidal Chemistry (Birdi, K.S., ed. CRC Press, 1997) и Seymour/Carraher's Polymer Chemistry (4th edition, Marcel Dekker Inc., 1996).
Все публикации, патенты и заявки на патенты, процитированные в настоящем описании ранее или далее, включены в настоящее описание в качестве ссылки.
В контексте настоящего описания и предлагаемой формулы изобретения термин "микрочастица" (в единственном числе) относится к одной или более микрочастицам и т.д.
А. Определения
В ходе описания настоящего изобретения будут использоваться следующие термины и их следует понимать как указано ниже.
Если особо не оговорено иное, все проценты и соотношения даются на основе массовых частей.
Термин "микрочастица" в контексте настоящего описания относится к частице с диаметром от примерно 10 нм до примерно 150 мкм, более предпочтительно, с диаметром от примерно 200 нм до примерно 30 мкм и, наиболее предпочтительно, с диаметром от примерно 500 нм до примерно 10 мкм. Предпочтительно, микрочастицы имеют диаметр, который позволяет осуществлять парентеральное введение или введение через слизистую без закупорки игл и капилляров. Размер микрочастицы может быть легко определен известными в данной области техники способами, такими как фотонно-корреляционная спектроскопия, лазерная дифрактометрия и/или электронная сканирующая микроскопия. Термин "частица" может также использоваться для обозначения микрочастицы, определенной в настоящем описании.
Полимерные микрочастицы для использования согласно настоящему описанию получают из материалов, которые могут подвергаться стерилизации, являются нетоксичными и биоразлагаемыми. Такие материалы включают, не ограничиваясь этим, поли(α-гидроксикислоту), полигидроксимасляную кислоту, поликапролактон, полиортоэфир, полиангидрид, ПАЦА и полицианоакрилат. Предпочтительно, микрочастицы, используемые согласно настоящему изобретению, представляют собой микрочастицы полимера, полученного из поли(α-гидроксикислоты), в частности, из поли(лактида) ("ПЛА") или из сополимера D,L-лактида и гликолида или гликолевой кислоты, такого как поли(D,L-лактидкогликолид) ("ПЛГ" или "ПЛГА"), или сополимера D,L-лактида и капролактона. Микрочастицы полимера могут быть получены из любого из множества исходных полимерных материалов, характеризующихся различными молекулярными массами, и в случае сополимеров, таких как ПЛГ, характеризующихся различными соотношениями лактид:гликолид, выбор которых определяется, главным образом, конкретной ситуацией, зависящей, в частности, от природы совместно вводимой макромолекулы. Указанные параметры более подробно обсуждаются ниже.
Термин "детергент" в контексте настоящего описания включает поверхностно-активные вещества, диспергирующие агенты, суспендирующие агенты и стабилизаторы эмульсий. Анионные детергенты включают, не ограничиваясь этим, ДСН (додецилсульфат натрия), ЛСН (лаурилсульфат натрия), ДСС (дисульфосукцинат), сульфатированные жирные спирты и др. Катионные детергенты включают, не ограничиваясь этим, цетримид (цетилтриметиламмония бромид или "ЦТАБ"), хлорид бензалкония, ДДА (бромид диметилдиоктодециламмония), ДОТАП (диолеоил-3-триметиламмонийпропан) и др. Неионные детергенты включают, не ограничиваясь этим, неионные поверхностно-активные вещества, такие как ПВС, повидон (известный также, как поливинилпирролидон или ПВП), сложные эфиры сорбитана, полисорбаты, полиоксиэтилированные гликолевые моноэфиры, полиоксиэтилированные алкилфенолы, полоксамеры и др.
После образования микрочастиц детергент может быть связан или не связан с ними. В случае наличия связи детергент может быть присоединен к микрочастицам посредством любого механизма, включая, но не ограничиваясь этим, ионную связь, водородную связь, ковалентную связь, физический захват, связь Ван-дер-Ваальса, а также связь по типу гидрофильного/гидрофобного взаимодействия.
Термин "макромолекула" в контексте настоящего описания относится, без ограничения, к фармацевтическому агенту, полинуклеотиду, полипептиду, гормону, ферменту, медиатору транскрипции или трансляции, интермедиату метаболического пути, иммуномодулятору, антигену, адъюванту или к их сочетаниям. Ниже более подробно описаны конкретные макромолекулы, используемые согласно настоящему изобретению. "Комплексованная" (в виде комплекса) макромолекула представляет собой макромолекулу, которая сформировала ассоциацию с детергентом и которая после этого стала способна к адсорбции на микрочастице.
Термин "фармацевтический агент" относится к биологически активным соединениям, таким как антибиотики, противовирусные средства, факторы роста, гормоны и др., которые ниже обсуждаются более детально.
Термин "адъювант" относится к любому веществу, которое способствует действию фармацевтического агента или модифицирует его, включая, но не ограничиваясь, иммунологические адъюванты, которые повышают или разнообразят иммунную реакцию на антиген.
"Полинуклеотид" представляет полимер нуклеиновой кислоты, который в типичном случае кодирует биологически активный (например, иммуногенный или терапевтический) белок или полипептид. В зависимости от природы полипептида, кодируемого полинуклеотидом, полинуклеотид может включать всего лишь 10 нуклеотидов, например, когда полинуклеотид кодирует антиген. Далее, "полинуклеотид" может включать двухцепочечные и одноцепочечные последовательности и относиться, не ограничиваясь этим, к кДНК на основе вирусной, прокариотической или эукариотической мРНК, последовательностям геномной РНК и ДНК из вирусной (например, РНК и ДНК вирусов и ретровирусов) или прокариотической ДНК, и в особенности, синтетическим последовательностям ДНК. Указанный термин также охватывает последовательности, которые включают любые из известных аналогов оснований ДНК и РНК. Термин также включает модификации, такие как делеции, добавки и замещения (в основном, консервативные по природе) на основе природных последовательностей, предпочтительно, таких, когда молекула нуклеиновой кислоты кодирует терапевтический или антигенный белок. Указанные модификации могут быть осуществлены как через сайт-направленный мутагенез, так и в ходе случайных событий, таких как последствия мутаций хозяйских клеток, продуцирующих антигены.
Термины "полипептид" и "белок" относятся к полимерам из аминокислотных остатков, причем без ограничения минимальной длины продукта. Так, пептиды, олигопептиды, димеры, мультимеры и им подобные включены в настоящее определение. Данным определением охватываются и белки полной длины, и их фрагменты. Указанные термины включают также модификации, такие как делеции, добавки и замещения (в основном, консервативные по своей природе) природных последовательностей, предпочтительно, таких, когда белок сохраняет способность вызывать иммунологическую реакцию или оказывать терапевтическое воздействие у субъекта, которому вводят белок.
Термин "антиген" обозначает молекулу, которая содержит один или более эпитопов, способных к стимуляции иммунной системы хозяйской клетки с генерированием клеточного антигенспецифичного иммунного ответа, когда антиген присутствует в соответствии с настоящим изобретением, или гуморального ответа, опосредованного антителами. Антиген может обладать способностью к генерированию клеточного или гуморального ответа либо сам по себе, либо когда он присутствует в комбинации с другой молекулой. В норме эпитоп будет включать примерно от 3 до 15, в основном, примерно от 5 до 15 аминокислот. Эпитопы соответствующего белка могут быть идентифицированы с помощью множества методик картирования эпитопа, хорошо известных в данной области техники. См., например, Epitope Mapping Protocols in Methods in Molecular Biology, Vol. 66 (Glenn E. Morris, Ed., 1996) Humana Press, Totowa, New Jersey. Так, например, линейные эпитопы могут быть определены, например, посредством одновременного синтеза большого числа пептидов на твердых подложках, причем пептиды соответствуют частям белковой молекулы, и взаимодействием пептидов с антителами, когда пептиды все еще остаются прикрепленными к подложкам. Такие методики известны в данной области техники и описаны в патенте США № 4701871 и Geysen et al. (1984) Proc. Natl. Acad. Sci. USA, 81: 3998-4002; Geysen et al. (1986) Molec. Immunol. 23, 709-715, которые полностью включены в настоящее описание в качестве ссылки. Аналогично, легко могут быть идентифицированы конформационные эпитопы посредством определения пространственной структуры аминокислот, например, методами рентгеновской кристаллографии и 2-мерного ядерного магнитного резонанса. См., например, Epitope Mapping Protocols, указано выше.
Термин "антиген" в контексте настоящего описания обозначает как субъединичные антигены, то есть антигены, которые были очищены и выделены из целого организма, с которым антиген связан в природе, так и убитые, аттенцированные или инактивированные бактерии, вирусы, паразиты или другие микробы. Антитела, такие как антиидиотипические антитела, или их фрагменты, и синтетические пептидные мимотопы, которые могут имитировать антиген или антигенную детерминанту, также охватываются определением антигена в контексте настоящего описания. Аналогично, в определение антигена в контексте настоящего описания включены олигонуклеотид или полинуклеотид, которые экспрессируют терапевтический или иммуногенный белок, или антигенную детерминанту in vivo, из числа тех, что находят применение в генной терапии и при иммунизации нуклеиновой кислотой.
Кроме того, для целей настоящего изобретения антигены могут быть получены из любого представителя ряда известных вирусов, бактерий, паразитов и грибов, а также из любого из множества опухолевых антигенов. Кроме того, для целей настоящего изобретения термин "антиген" относится к белку, который включает модификации, такие как делеции, добавки и замещения (в основном, консервативные по природе), природных последовательностей при том условии, что белок сохраняет способность вызывать иммунологический ответ. Указанные модификации могут быть осуществлены либо посредством сайт-направленного мутагенеза, либо они могут быть результатом случайных событий, таких, например, которые возникают при мутации хозяйских клеток, продуцирующих антигены.
Понятие "иммунологическая реакция" на антиген или композицию представляет собой развитие у субъекта гуморального и/или клеточного иммунного ответа на молекулы, присутствующие в интересующей композиции. В рамках настоящего изобретения термин "гуморальная иммунная реакция" относится к иммунной реакции, опосредованной молекулами антител, в то время как понятие "клеточная иммунная реакция" представляет собой иммунную реакцию, опосредованную через Т-лимфоциты и/или иные лейкоциты. Один важный аспект клеточного иммунитета включает антигенспецифичную реакцию цитолитических Т-клеток (ЦТК). ЦТК обладают специфичностью к пептидным антигенам, которые присутствуют в сочетании с белками, кодируемыми основным гистосовместимым комплексом (ОГК [MHC]) и экспрессирующимися на поверхности клеток. ЦТК содействуют индукции и усилению внутриклеточной деструкции внутриклеточных микробов или лизису клеток, инфицированных такими микробами. Другой аспект клеточного иммунитета включает антигенспецифичные реакции Т-хелперов. Т-хелперы действуют в направлении стимуляции функции и концентрации активности неспецифических эффекторных клеток против клеток, несущих на своей поверхности пептидные антигены в сочетании с молекулами ОГК. Термин "клеточная иммунная реакция" также относится к образованию цитокинов, хемокинов и других таких молекул, продуцируемых активированными Т-клетками и/или другими лейкоцитами, включая те из них, которые получены из CD4+ и CD8+ Т-клеток.
Композиция, такая как иммуногенная композиция, или вакцина, которая вызывает клеточную иммунную реакцию, могут служить для сенсибилизации позвоночного субъекта посредством презентирования антигена в сочетании с молекулами ОГК на клеточной поверхности. Опосредованная через клетки иммунная реакция направлена на клетки, несущие на своей поверхности антиген, или на участки рядом с ними. Кроме того, антигенспецифичные Т-лимфоциты могут быть генерированы с целью осуществления последующей защиты иммунизированного хозяина.
Способность конкретного антигена или композиции стимулировать опосредованную через клетки иммунологическую реакцию может быть обнаружена с помощью множества тестов, таких как тесты на лимфопролиферацию (активацию лимфоцитов), тесты на цитотоксичность ЦТЛ путем исследования специфичности Т-лимфоцитов на указанный антиген у сенсибилизированного субъекта, или посредством измерения образования цитокина Т-клетками в ответ на повторную стимуляцию антигеном. Такие тесты хорошо известны в данной области техники. См., например, Erickson et al., J. Immunol (1993) 151: 4189-4199; Doe et al., Eur. J. Immunol. (1994) 24, 2369-2376; и приведенные ниже примеры.
Таким образом, иммунологическая реакция в контексте настоящего описания может представлять собой такую реакцию, которая стимулирует продукцию ЦТЛ и/или продукцию или активацию Т-хелперных клеток. Интересующий антиген может также вызывать иммунную реакцию, опосредованную антителами. Следовательно, иммунологическая реакция может включать один или более следующих эффектов: образование антител В-клетками и/или активацию супрессорных Т-клеток и/или γδ-Т-клеток, специфически направленную на антиген или антигены, присутствующие в интересующей композиции или вакцине. Указанные реакции могут служить для нейтрализации инфекционности и/или играть роль посредника в системе антитело – комплемент или в антителозависимой клеточной цитотоксичности (AОКЦ) с целью обеспечения защиты иммунизированного хозяина. Такие реакции могут быть определены с помощью стандартных иммунологических методов анализа и методов нейтрализации, известных в данной области техники.
Композиция, которая содержит выбранный антиген, адсорбированный на микрочастице, проявляет "повышенную иммуногенность", которая характеризуется тем, что она проявляет более высокую способность вызывать иммунный ответ по сравнению с иммунным ответом, вызываемым эквивалентным количеством антигена в случае его доставки без сочетания с микрочастицей. Таким образом, композиция может проявлять "повышенную иммуногенность", поскольку антиген характеризуется более высокой иммуногенностью за счет его адсорбции на микрочастице, или поскольку необходима меньшая доза антигена для проявления иммунной реакции у субъекта, которому вводится данная композиция. Такая повышенная иммуногенность может быть определена посредством введения композиции микрочастица/антиген и антигенного контроля животным и сравнения титра антител в обоих вариантах с использованием стандартных методов анализа, таких как радиоиммуноанализ и ELISA (ИФТФА), известных в данной области техники.
Термины "эффективное количество" или "фармацевтически эффективное количество" композиции, содержащей микрочастицы с адсорбированными макромолекулами, в контексте настоящего описания относятся к нетоксичному, но достаточному количеству композиции микрочастица/макромолекула для лечения или диагностики данного состояния. Так, например, указанные выражения могут относиться к количеству, достаточному для обеспечения желательной реакции, такой как иммунологическая реакция, и соответствующего терапевтического эффекта, или в случае доставки терапевтического белка, к количеству, достаточному для эффективного лечения субъекта, как указано ниже. Как будет также указано ниже, точное необходимое количество будет варьировать от субъекта к субъекту в зависимости от вида, возраста и общего состояния здоровья субъекта, от тяжести состояния, которое предстоит лечить, от конкретной природы интересующей макромолекулы, от способа введения и др. Соответствующее "эффективное" количество в любом индивидуальном случае может быть определено специалистом в данной области техники с использованием рутинных экспериментов.
Термин "позвоночный субъект" обозначает любого представителя позвоночных, включая, без ограничения, млекопитающих, таких как крупный рогатый скот, овцы, свиньи, козы, лошади и человек; домашних животных, таких как собаки и кошки; и птиц, включая домашних, диких и поющих птиц, таких как петухи и куры, включая цыплят, индеек и других представителей группы куриных. Термин не указывает на конкретный возраст субъекта. Так, и взрослые, и новорожденные животные охватываются данным термином.
Термин "фармацевтически приемлемый" или "фармакологически приемлемый" относится к материалу, который не является биологически или по какой-либо иной причине нежелательным, то есть указанный материал может вводиться индивидууму в сочетании с композицией микрочастиц, не вызывая каких-либо нежелательных биологических эффектов у индивидуума или не вступая во вредные взаимодействия с какими-либо компонентами композиции, в составе которой они находятся.
Термин "эксципиент" относится к веществам, которые обычно входят в состав готовых дозированных форм и которые включают носители, связующие вещества, дезинтегранты, наполнители (разбавители), лубриканты, глиданты (усилители текучести), добавки для прессования, красители, подсластители, консерванты, суспендирующие/диспергирующие средства, пленкообразующие средства/покрытия, вкусовые вещества и маркировочные краски.
Понятие "физиологический рН" или "рН в физиологическом диапазоне" обозначает значение рН в диапазоне приблизительно 7,2-8,0, включительно, более типично, в диапазоне приблизительно 7,2-7,6, включительно.
В контексте настоящего описания термин "лечение" (включая его вариации, например, "лечить" или "подвергнуть лечению") относится к любому из следующих определений: (i) профилактика инфекции или повторной инфекции, как в случае традиционной вакцины; (ii) снижение или устранение симптомов и (iii) существенная или полная элиминация патогена или рассматриваемого заболевания. Лечение может осуществляться профилактически (до инфекции) или терапевтически (в процессе инфекции).
В контексте настоящего описания выражение "нуклеиновая кислота" относится к ДНК, РНК или химерным формам, образованным на их основе.
В контексте настоящего описания выражение "олигонуклеотид, включающий, по меньшей мере, один мотив CpG", относится к полинуклеотиду, включающему, по меньшей мере, один динуклеотид CpG. Олигонуклеотиды, включающие, по меньшей мере, один мотив CpG, могут включать множественные CpG мотивы. Указанные олигонуклеотиды известны в данной области техники также, как "CpG олигонуклеотиды". В контексте настоящего описания выражение "CpG мотив" относится к динуклеотидной части олигонуклеотида, которая включает цитозиновый нуклеотид, за которым следует гуанозиновый нуклеотид. Вместо цитозина может также использоваться 5-метилцитозин.
В контексте настоящего описания термин "репликон вектора альфа-вирусной РНК", "конструкция РНК-вектора" и "репликон" относится к молекуле РНК, которая способна осуществлять свою собственную амплификацию или саморепликацию in vivo, внутри целевой клетки. Репликон вектора альфа-вирусной по происхождению РНК должен содержать следующую порядковую последовательность элементов: вирусные 5'-последовательности, которые необходимы в цис-форме для репликации (также обозначаемые, как 5'-CSE), последовательности, которые при их экспрессии кодируют биологически активные неструктурные белки альфа-вирусов (например, nsP1, nsP2, nsP3, nsP4), вирусные 3'-последовательности, необходимые в цис-форме для репликации (также обозначаемые, как 3'-CSE), и полиаденилатный участок. Репликон вектора альфа-вирусной по происхождению РНК может также содержать промотор вирусного субгеномного "узлового участка", представляющий собой последовательности генов, кодирующих один или более структурных белков, или их частей, молекулу(ы) чужеродной нуклеиновой кислоты, которая(ые) имеет(ют) размер, достаточный для продуцирования жизнеспособного вируса, а также гетерологичную(ые) последовательность(и) для последующей экспрессии.
В контексте настоящего описания выражение "эукариотический слоистый вектор системы инициации", "ELVIS" или "ELVIS-вектор" относится к конструкции, которая способна к осуществлению экспрессии интересующей(их) последовательности(ей) или интересующего(их) гена(ов). Эукариотический слоистый вектор системы инициации должен содержать 5'-промотор, который способен к инициации in vivo (то есть внутри клетки) синтеза РНК из кДНК, и вирусную векторную последовательность, которая способна осуществлять свою собственную репликацию в эукариотической клетке, а также экспрессировать гетерологичную последовательность. В предпочтительных вариантах осуществления изобретения векторная последовательность нуклеиновой кислоты представляет собой последовательность из альфа-вируса и включает 5'-последовательность, способную к инициации транскрипции альфа-вирусной РНК (также обозначаемую, как 5'-CSE), а также последовательности, которые при их экспрессии кодируют биологически активные неструктурные белки альфа-вирусов (например, nsP1, nsP2, nsP3, nsP4), а также распознаваемую РНК-полимеразой последовательность альфа-вируса (также обозначаемую, как 3'-CSE). Кроме того, векторная последовательность может включать промотор вирусного субгеномного "узлового участка", представляющий собой последовательности генов, кодирующих один или более структурных белков или их частей, молекулу(ы) чужеродной нуклеиновой кислоты, которая(ые) имеет(ют) размер, достаточный для оптимальной амплификации, гетерологичную последовательность для последующей экспрессии, один или более сайтов рестрикции для вставки гетерологичных последовательностей, а также полиаденилатную последовательность. Эукариотический слоистый вектор системы инициации может также содержать последовательности распознавания расщепления, последовательность каталитического процессинга рибозимами, экспортный ядерный сигнал, а также последовательность терминирования транскрипции.
Понятие "конструкция вектора альфа-вируса" относится к конструкции, которая способна осуществлять экспрессию интересующей последовательности или гена. Подобные векторные конструкции, в основном, включают 5'-последовательность, которая способна инициировать транскрипцию альфа-вирусной РНК (обозначаемую также, как 5'-CSE), а также последовательности, которые при своей экспрессии кодируют биологически активные неструктурные белки альфа-вирусов (например, nsP1, nsP2, nsP3, nsP4), распознаваемую РНК-полимеразой последовательность альфа-вируса (также обозначаемую, как 3'-CSE) и полиаденилатный участок. Кроме того, векторная конструкция может включать промотор вирусного субгеномного "узлового участка", последовательности генов, кодирующих один или более структурных белков, или их частей, молекулу(ы) чужеродной нуклеиновой кислоты, которая(ые) имеет(ют) размер, достаточный для продуцирования жизнеспособного вируса, 5'-промотор, который способен инициировать синтез вирусной РНК из кДНК in vitro или in vivo, гетерологичную последовательность для последующей экспрессии и один или более сайтов рестрикции для вставки гетерологичных последовательностей.
В контексте настоящего описания выражение "векторная конструкция" относится, в основном, к ELVIS-векторам, которые включают кДНК комплемент к РНК-векторным конструкциям, сами РНК-векторные конструкции, альфа-вирусные векторные конструкции и подобное.
В соответствии с некоторыми вариантами осуществления настоящего изобретения предлагаются композиции и способы, которые могут применяться для лечения, включая профилактическую и/или терапевтическую иммунизацию, животного-хозяина против вирусных, грибковых, микоплазменных, бактериальных или протозойных инфекций, а также против опухолей. Способы согласно настоящему изобретению используются для выработки профилактического и/или терапевтического иммунитета у млекопитающих, предпочтительно у человека. Способы согласно настоящему изобретению могут также применяться в отношении млекопитающих, отличных от человека, включая проведение биомедицинских исследований.
В. Общие методы
Авторы настоящего изобретения обнаружили, что адсорбция макромолекул на микрочастицах может быть улучшена путем создания условий, при которых детергент становится способен к образованию комплекса с макромолекулами при адсорбции. Кроме того, может быть адсорбировано множество различных молекул, включая заряженные и/или объемные макромолекулы. Таким образом, композиции микрочастица/макромолекула согласно настоящему изобретению могут быть использованы в качестве системы доставки для доставки биологически активных компонентов с целью лечения, профилактики и/или диагностики большого числа заболеваний.
Настоящее изобретение может использоваться для доставки множества макромолекул, включая, но не ограничиваясь этим, фармацевтические средства, такие как антибиотики и противовирусные средства, нестероидные противовоспалительные средства, анальгетики, вазодилататоры, сердечно-сосудистые средства, психотропные средства, нейролептики, антидепрессанты, средства лечения паркинсонизма, бета-блокаторы, блокаторы кальциевых каналов, ингибиторы брадикинина, АХЭ-ингибиторы, вазодилататоры, ингибиторы пролактина, стероиды, антагонисты гормонов, антигистаминные средства, антагонисты серотонина, гепарин, химиотерапевтические средства, антинеопластические средства и факторы роста, включая, но не ограничиваясь этим, ФРТ (фактор роста, полученный из тромбоцитов), ЭФР (эпидермальный фактор роста), ФРЭ (фактор роста, полученный из эритробластов), ИФР-1 (инсулиноподобный фактор роста 1), ИФР-2, ФРФ (фактор роста фибробластов), полинуклеотиды, которые кодируют терапевтические или иммуногенные белки, иммуногенные белки и их эпитопы, используемые в вакцинах, гормоны, включая пептидные гормоны, такие как инсулин, проинсулин, гормон роста, РФРГ (рилизинг-фактор ростового гормона), РФЛГ (рилизинг-фактор лютеинизирующего гормона), ЭФР (эпидермальный фактор роста), соматостатин, SNX-111, BNP, инсулинотропин, А-норпрогестерон, ФСГ (фолликулостимулирующий гормон), ЛГ (лютеинизирующий гормон), ФСП (фактор, стимулирующий персистирующие клетки) и чХГ (человеческий хорионический гонадотропин), половые стероидные гормоны (андрогены, эстрогены и прогестерон), тиреотропный гормон, ингибин, холецистокинин, АКТГ (адренокортикотропный гормон), КРФ (кортикотропин-рилизинг-фактор), динорфины, эндорфины, эндотелин, фрагменты фибронектина, галанин, гастрин, инсулинотропин, глюкагон, фрагменты ГТФ-связывающего белка, гуанилин, лейкокинины, магаинин, мастопараны, дермасептин, системин, нейромедины, нейротензин, панкреастатин, панкреатический полипептид, вещество Р, секретин, тимозин и им подобные, ферменты, медиаторы транскрипции или трансляции, интермедиаты метаболического пути, иммуномодуляторы, такие как любые из различных цитокинов, включая интерлейкин-1, интерлейкин-2, интерлейкин-3, интерлейкин-4 и гамма-интерферон, антигены и адъюванты.
В предпочтительном варианте осуществления изобретения макромолекула представляет собой антиген. Особым достоинством настоящего изобретения является способность микрочастиц с адсорбированным антигеном генерировать клеточно-опосредованные иммунные ответы у позвоночного субъекта. Способность комплекса антигена/микрочастиц согласно настоящему изобретению вызывать клеточно-опосредованный иммунный ответ против выбранного антигена обеспечивает мощный инструмент воздействия на инфекцию, вызванную широким кругом патогенов. Соответственно, указанный комплекс антиген/микрочастицы согласно настоящему изобретению может быть включен в вакцинные композиции.
Эффективность различных вариантов использования плазмидных векторов и ELVIS-векторов, описанных в уровне техники, может быть усилена за счет адсорбции выбранной плазмиды и ELVIS-векторов на микрочастицах с адсорбирующими поверхностями, что облегчает введение вектора и гетерологичных последовательностей нуклеиновой кислоты, включенных в вектор, в клетки животного. Альтернативно, конструкции на основе РНК-векторов могут быть адсорбированы на полимерных микрочастицах или эмульсиях субмикронного размера согласно настоящему изобретению с целью эффективной доставки гетерологичных последовательностей нуклеиновых кислот в клетки животного. Предварительная заявка на патент США совместного владения, поданная 28 сентября 2000 года (досье патентного поверенного № CHIR-0270; серийный номер 60/236105), раскрывает использование таких нуклеотидов, адсорбированных на некоторых микрочастицах. Так, в предпочтительном варианте осуществления макромолекула представляет собой полинуклеотид, такой как плазмида, ELVIS-вектор или РНК-векторная конструкция. Особым преимуществом настоящего изобретения является способность микрочастиц с адсорбированным ELVIS-вектором генерировать клеточно-опосредованные иммунные реакции у позвоночного субъекта. Патентная заявка, серийный номер 60/236105, также раскрывает адсорбцию полипептидных антигенов, включая полипептидные антигены ВИЧ, на микрочастицах. Способность комплекса антиген/микрочастицы согласно настоящему изобретению вызывать клеточно-опосредованный иммунный ответ против выбранного антигена обеспечивает мощный инструмент борьбы с инфекциями, вызванными огромным множеством патогенов. Соответственно, комплекс антиген/микрочастицы согласно настоящему изобретению может быть включен в вакцинные композиции.
Таким образом, в дополнение к традиционной антительной реакции описанная в настоящем изобретении система может обеспечить, например, ассоциацию экспрессированных антигенов с ОГК-молекулами класса I, так что возникающая in vivo клеточная иммунная реакция на интересующий антиген может быть усилена, что стимулирует образование ЦТК с последующим распознаваем антигена. Кроме того, указанные способы могут выявить антигенспецифичный ответ хелперных Т-клеток. Соответственно, способы согласно настоящему изобретению будут полезны при использовании любой макромолекулы, в отношении которой желательно генерировать клеточный и/или гуморальный иммунный ответ, предпочтительно, в отношении антигенов, полученных из вирусных патогенов, которые могут индуцировать образование антител, эпитопов Т-клеточных хелперов и цитотоксичных эпитопов Т-клеток. Такие антигены включают, не ограничиваясь этим, те из них, которые кодируют вирусами человека и животных и могут соответствовать любым структурным или неструктурным белкам.
Микрочастицы согласно настоящему изобретению особенно полезны для иммунизации против внутриклеточных вирусов, которые в норме вызывают слабые иммунные реакции. Например, настоящее изобретение может быть использовано для стимуляции иммунитета против большого числа белков из семейства вирусов герпеса, включая белки, полученные из вируса простого герпеса (HSV) типа 1 и типа 2, таких как гликопротеины gB, gD и gH из HSV-1 и HSV-2; антигены, полученные из вируса Varicella zoster (VZV), вируса Эпштейна-Барра (EBV) и цитомегаловирусов (CMV), включая CMV gB и gH; а также антигены, полученные из других вирусов герпеса человека, таких как HHV6 и HHV7. (См., например, Chee et al., Cytomegaloviruses (J.K. McDougall, ed., Springer-Verlag 1990), pp. 125-169, содержащий обзор, посвященный кодированию белков цитомегаловируса; McGeoch et al., J. Gen. Virol. (1988) 69: 1531-1574, в указанной работе приведено обсуждение различных белков, кодируемых HSV-1; патент США № 5171568, в котором обсуждаются gB и gD белки HVS-1 и HVS-2 и кодирующие их гены; Baer et al., Nature (1984) 310: 207-211, в которой приведена идентификация кодирующих белок последовательностей в геноме EBV; и Davison and Scott, J. Gen. Virol. (1986) 67: 1759-1816, в котором приведен обзор VZV).
Антигены из семейства вирусов гепатитов, включая вирус гепатита А (HAV), вирус гепатита В (HBV), вирус гепатита С (HCV), вирус гепатита дельта (HDV), вирус гепатита Е (HEV) и вирус гепатита G (HGV), также могут легко использоваться в описанных в настоящей заявке методиках. В качестве примера можно указать на то, что известны как последовательность генома вируса HCV, так и методы получения указанной последовательности. См., например, международные заявки №№ WO 89/04669; WO 90/11089 и WO 90/14436. Геном HCV кодирует несколько вирусных белков, включая Е1 (также известный, как Е) и Е2 (также известный, как E2/NSI), а также N-концевой нуклеокапсидный белок (называемый термином "ядро") (см. Houghton et al., Hepatology (1991) 14: 381-388, где содержится обсуждение белков HCV, включая Е1 и Е2). Каждый из указанных белков, а также их антигенные фрагменты могут найти применение в композиции и способах согласно настоящему изобретению.
Аналогично, имеются также сведения о последовательности δ-антигена из HDV (см., например, патент США № 5378814), и указанный антиген также может успешно использоваться в композиции и способах согласно настоящему изобретению. Дополнительно, антигены, полученные из HBV, такие как ядерный антиген, поверхностный антиген, sAg, также как и "предповерхностные" последовательности pre-S1 и pre-S2 (ранее называвшиеся pre-S), равно как и их сочетания, такие как sAg/pre-S1, sAg/pre-S2, sAg/pre-S1/pre-S2 и pre-S1/pre-S2, могут найти применение в рамках настоящего изобретения. См., например, "HBV Vaccines – from the laboratory to license: a case study" in Mackett, M. and Williamson, J.D., Human Vaccines and Vaccination, pp. 159-176, где содержится обсуждение структуры HBV, а также патенты США №№ 4722840, 5098704, 5324513, включенные в настоящее описание полностью в качестве ссылок; Beames et al., J. Virol. (1995) 69: 6833-6838, Birnbaum et al., J. Virol. (1990) 64: 3319-3330 и Zhou et al., J. Virol. (1991) 65: 5457-5464.
В заявленных композициях и способах также могут найти применение антигены, полученные из других вирусов, такие как, без ограничения, белки - представители семейств Picornaviridae (например, вирусы полиомиелита и др.), Caliciviridae, Togaviridae (например, вирус коревой краснухи, вирус лихорадки Денге и др.), Flaviviridae, Coronaviridae, Reoviridae, Birnaviridae, Rhabodoviridae (например, вирус бешенства и др.), Filoviridae, Paramyxoviridae (например, вирус эпидемического паротита, вирус кори, респираторно-синцитиальный вирус и др.), Orthomyxoviridae (например, вирусы гриппа типа А, В и С и др.), Bunyaviridae, Arenaviridae, Retroviridae (например, HTLV-I, HTLV-II, HIV-1 (известный также, как HTLV-III, LAV, ARV, hTLR и др.)), включая в числе других, но не ограничиваясь этим, антигены из изолятов HIVIIIb, HIVSF2, HIVLAV, HIVLAI, HIVMN, HIV-1CM235, HIV-1US4, HIV-2, вирус иммунодефицита обезьян (SIV). Дополнительно, антигены могут быть также получены из вирусов папилломы человека (HPV) и вирусов клещевого энцефалита. См., например, Virology, 3rd Edition (W.K. Joklik ed. 1988); Fundamental Virology, 2nd Edition (B.N. Fields and D.M. Knipe, eds. 1991), в которых содержится описание перечисленных и других вирусов.
Более конкретно, белки оболочки gp120 или gp140 из любого из указанных выше HIV-изолятов, включая представителей различных генетических подтипов HIV, известны и описаны в литературе (см., например, Myers et al., Los Alamos Database, Los Alamos National Laboratory, Los Alamos, New Mexico (1992); Myers et al., Human Retroviruses and Aids, 1990, Los Alamos, New Mexico: Los Alamos National Laboratory; и Modrow et al., J. Virol. (1987) 61: 570-578, в которых содержится сравнение последовательностей оболочек различных HIV-изолятов), при этом антигены, полученные из любого из указанных изолятов, могут найти применение в способах согласно настоящему изобретению. Кроме того, настоящее изобретение равным образом применимо к другим иммуногенным белкам, полученным из любого из различных HIV-изолятов, включая любой из различных белков оболочки, таких как gp160 и gp41, gag-антигенам, таким как p24gag и p55gag, а также к белкам, полученным из pol и tat участков.
Вирус гриппа представляет собой другой пример вируса, который особенно пригоден для использования в рамках настоящего изобретения. Конкретно, оболочечные гликопротеины HA и NA вируса гриппа А представляют особый интерес с точки зрения генерирования иммунного ответа. Были идентифицированы различные подтипы HA вируса гриппа А (Kawaoka et al., Virology (1990) 179: 759-767; Webster et al., "Antigenic variation among type A influenza viruses", p. 127-168, In P. Palese and D.W. Kingsbury (ed.), Genetics of influenza viruses. Springer-Verlag, New York). Таким образом, белки, полученные из любого из указанных изолятов, могут также найти применение в композициях и в способах, приведенных в настоящем описании.
Раскрытые в настоящем описании композиции и способы также могут найти применение в отношении многих бактериальных антигенов, таких как антигены, полученные из организмов, которые вызывают дифтерию, холеру, туберкулез, столбняк, коклюш, менингит и другие патогенные состояния, включая, без ограничения, Bordetella pertussis, Neisseria meningitidis (A, B, C, Y), Neisseria gonorrhoeae, Helicobacter pylori, Haemophilus influenza тип А, Haemophilus influenza тип В (HIB), Helicobacter pylori и их сочетания. Примеры антигенов из Neisseria meningitidis B были раскрыты в приведенных ниже заявках на совместный патент: PCT/US99/09346, PCT IB98/01665 и PCT IB99/00103. Примеры паразитарных антигенов включают те антигены, которые получены из организмов, вызывающих малярию и болезнь Лайма.
Дополнительные антигены, пригодные для использования согласно настоящему изобретению, некоторые из которых также указаны в настоящей заявке, включают следующий перечень (ссылки приведены далее):
- белковый антиген из N. meningitidis серологической группы В, такой как указанный в ссылках 1-7 ниже;
- препарат везикул внешней мембраны (OMV) из N. meningitidis серологической группы В, такой как указанный в ссылках 8, 9, 10, 11 и др. ниже;
- сахаридный антиген из N. meningitidis серологической группы A, C, W135 и/или Y, такой как олигосахарид, указанный в ссылке 12 ниже, из серологической группы С (см. также ссылку 13);
- сахаридный антиген из Streptococcus pneumoniae [например, ссылки 14, 15, 16];
- антиген из N. gonorrhoeae [например, ссылки 1, 2, 3];
- антиген из Chlamydia pneumoniae [например, ссылки 17, 18, 19, 20, 21, 22, 23];
- антиген из Chlamydia trachomatis [например, 24];
- антиген из вируса гепатита А, такой как инактивированный вирус [например, ссылки 25, 26];
- антиген из вируса гепатита В, такой как поверхностный и/или ядерный антигены [например, ссылки 26, 27];
- антиген из вируса гепатита С [например, ссылка 28];
- антиген из Bordetella pertussis, такой как голотоксин коклюша (PT), и нитевидный гемагглютинин (FHA) из B. pertussis, необязательно также в сочетании с пертактином и/или агглютиногенами 2 и 3 [например, ссылки 29 и 30];
- дифтерийный антиген, такой как дифтерийный токсоид [например, глава 3 ссылки 31], например, мутант CRM197 [например, ссылка 32];
- антиген столбняка, такой как столбнячный токсоид [например, глава 4 ссылки 31];
- белковый антиген из Helicobacter pylori, такой как CagA [например, ссылка 33], VacA [например, ссылка 33], NAP [например, ссылка 34], HopX [например, ссылка 35], HopY [например, ссылка 35] и/или уреаза;
- сахаридный антиген из Haemophilus influenzae B [например, ссылка 13];
- антиген из Porphyramonas gingivalis [например, ссылка 36];
- антиген(ы) полиомиелита [например, ссылки 37, 38], такой как IPV или OPV;
- антиген(ы) бешенства [например, ссылка 39], такой как лиофилизованный инактивированный вирус [например, ссылка 40, Rabavert™];
- антигены кори, паротита и/или коревой краснухи [например, главы 9, 10 и 11 ссылки 31];
- антиген(ы) гриппа [например, глава 19 ссылки 31], такой как белки гемагглютинин и/или поверхностная нейраминидаза;
- антиген из Moraxella catarrhalis [например, ссылка 41];
- антиген из Streptococcus agalactiae (стрептококк группы В) [например, ссылки 42, 43];
- антиген из Streptococcus pyogenes (стрептококк группы А) [например, ссылки 43, 44, 45];
- антиген из Staphylococcus aureus [например, ссылка 46];
- композиции, включающие один или более из указанных антигенов.
В том случае, когда используется сахаридный или углеводный антиген, предпочтительно провести конъюгацию с белком-носителем с целью повышения иммуногенности [например, ссылки с 47 по 56]. Предпочтительными белками-носителями являются бактериальные токсины или токсоиды, такие как токсоиды дифтерии или столбняка. Особенно предпочтителен дифтерийный токсоид CRM197. Другие приемлемые белки-носители включают белок внешней мембраны N. meningitidis [например, ссылка 57], синтетические пептиды [например, ссылки 58, 59], белки теплового шока [например, ссылка 60], белки вируса коклюша [например, ссылки 61, 62], белок D из H. influenzae [например, ссылка 63], токсины А или В из C. difficile [например, ссылка 64] и др. В том случае, когда смесь включает капсулярные сахариды обеих серологических групп А и С, предпочтительно, чтобы массовое соотношение сахарид MenA: сахарид MenC было больше, чем 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или выше). Сахариды из различных серологических групп N. meningitidis могут быть конъюгированы с одинаковыми или с разными белками-носителями.
Могут использоваться любые приемлемые реакции конъюгации в сочетании с любыми приемлемыми линкерами там, где это необходимо.
При необходимости токсичные белковые антигены могут быть подвергнуты детоксикации (например, детоксикация токсина коклюша с помощью химических и/или других средств [например, ссылка 30]).
В том случае, когда в композицию включается дифтерийный антиген, предпочтительно включать в нее также антиген столбняка и антигены коклюша. Аналогично, в том случае, когда в композицию включается антиген столбняка, предпочтительно также включать в нее антигены дифтерии и коклюша. И аналогично, когда в композицию включается антиген коклюша, предпочтительно также включать в нее антигены дифтерии и столбняка.
Совершенно очевидно, что объект настоящего изобретения может использоваться для доставки огромного множества макромолекул и, следовательно, для лечения и/или диагностики большого числа заболеваний. В некоторых вариантах осуществления изобретения композиции макромолекула/микрочастица согласно настоящему изобретению могут использоваться для сайт-специфичной целевой доставки. Так, например, внутривенное введение композиций макромолекула/микрочастица может использоваться для целевой доставки в легкое, печень, селезенку, кровеносное русло или в костный мозг.
Адсорбция макромолекул на поверхности адсорбирующих микрочастиц осуществляется посредством любого механизма связывания-взаимодействия, включая, но не ограничиваясь этим, ионную связь, водородную связь, ковалентную связь, связь Ван-дер-Ваальса и связь, осуществляемую посредством гидрофильного/гидрофобного взаимодействия. Специалист в данной области техники может без труда выбрать детергенты, приемлемые для конкретного типа адсорбируемой макромолекулы.
Так, например, микрочастицы, образуемые в присутствии заряженных детергентов, таких как анионные или катионные детергенты, могут представлять собой микрочастицы с поверхностью, имеющей отрицательный или положительный заряд, которые могут адсорбировать множество разнообразных молекул.
Так, например, микрочастицы, полученные с использованием анионных детергентов, таких как додецилсульфат натрия (ДСН), например, ДСН-ПЛГ микрочастицы, адсорбируют положительно заряженные антигены, такие как белки. Аналогично, микрочастицы, полученные с использованием катионных детергентов, таких как ЦТАБ, например, ПЛГ/ЦТАБ микрочастицы, адсорбируют отрицательно заряженные молекулы, такие как ДНК. В тех случаях, когда адсорбируемые макромолекулы содержат участки с положительным и отрицательным зарядом, приемлемыми могут быть либо катионные, либо анионные, либо неионные детергенты.
Биоразлагаемые полимеры, пригодные для получения микрочастиц с целью их использования в рамках настоящего изобретения, легко могут быть получены из коммерческих источников, например, от компании Берингер (Boehringer Ingelheim, Germany and Birmingham Polymers, Inc., Birmingham, AL.). Например, полимеры, пригодные для образования рассматриваемых в настоящем описании микрочастиц, включают гомополимеры, сополимеры и полимерные смеси, полученные из следующих компонентов: полигидроксимасляной кислоты (также известной, как полиоксибутират), полигидроксивалериановой кислоты (также известной, как полиоксивалерат), полигликолевой кислоты (ПГК) (также известной, как полигликолид), полимолочной кислоты (ПМК) (также известной, как полилактид), полидиоксанона, поликапролактона, полиортоэфира и полиангидрида. Более предпочтительными являются поли(α-гидрокси)кислота, такая как поли(L-лактид), поли(D,L-лактид) (обе обозначены в настоящем описании как "ПМК"), поли(гидроксибутират), сополимеры D,L-лактида и гликолида, такие как поли(D,L-лактидкогликолид) (обозначаемые в настоящем описании как "ПЛГ" или "ПЛГК"), или сополимер D,L-лактида и капролактона. Особенно предпочтительными для использования согласно настоящему изобретению полимерами являются полимеры ПМК и ПЛГ. Указанные полимеры доступны в виде полимеров с различными молекулярными массами, и подходящую молекулярную массу для конкретного вида использования может легко определить специалист в данной области. Так, например, для ПМК подходящей молекулярной массой может быть масса порядка примерно от 2000 до 5000. Для ПЛГ подходящая молекулярная масса составляет, в основном, от примерно 10000 до примерно 200000, предпочтительно, от примерно 15000 до примерно 150000.
Если для формирования микрочастиц используется такой сополимер, как ПЛГ, то для применения может быть использовано большое число различных соотношений лактид:гликолид, при этом соотношение определяется, в основном, выбором, связанным частично с совместно вводимой макромолекулой и с желательной степенью деградации. Так, например, полимер ПЛГ 50:50, содержащий 50% D,L-лактида и 50% гликолида, приведет к образованию сополимера с быстрой ресорбцией, тогда как полимер ПЛГ 75:25 разлагается значительно медленнее, а полимер с соотношением 85:15 и 90:10 еще медленнее в связи с увеличением лактидного компонента. Видно, что соответствующее соотношение лактид:гликолид может быть без труда определено специалистом в данной области на основании, например, природы антигена и рассматриваемого заболевания. Кроме того, смеси микрочастиц с различными соотношениями лактид:гликолид могут найти применение с целью достижения желательной кинетики высвобождения для данного типа макромолекулы и для генерирования первичного и вторичного иммунного ответа. Скорость разложения микрочастиц согласно настоящему изобретению может также контролироваться такими факторами, как молекулярная масса полимера и кристалличность полимера. Сополимеры ПЛГ с различными соотношениями лактид:гликолид и с различными молекулярными массами могут быть получены из доступных коммерческих источников, включая компанию Берингер (Boehringer Ingelheim, Germany and Birmingham Polymers, Inc., Birmingham, AL.). Указанные полимеры могут быть также синтезированы посредством простой поликонденсации компонента молочной кислоты с использованием хорошо известных в данной области техники способов, таких как методика, описанная в работе Tabata et al., J. Biomed. Mater. Res. (1998) 22: 837-858.
Микрочастицы получают с использованием любого из нескольких методов, известных в данной области техники. Так, например, в ряде вариантов осуществления настоящего изобретения для получения микрочастиц могут использоваться методики выпаривания двойной эмульсии/растворителя, как это описано в патенте США № 3523907 и в работе Ogawa et al., Chem. Pharm. Bull. (1988) 36: 1095-1103. Указанные методики включают образование первичной эмульсии, состоящей из капелек раствора полимера, которую затем смешивают с непрерывной водной фазой, содержащей стабилизатор частиц/поверхностно-активное вещество.
В других вариантах осуществления изобретения микрочастицы могут быть также образованы с использованием распылительной сушки и коацервации, как описано в литературе (например, Thomasin et al., J. Controlled Release (1996) 41: 131; патент США № 2800457; Masters, K. (1976) Spray Drying 2nd Ed. Wiley, New York), технологий нанесения суспензионных покрытий воздухом, таких как покрытие в барабане и Wurster-покрытия, как это описано в работе Hall et al., (1980), The "Wurster Process" in Controlled Release Technologies: Methods, Theory, and Applications (A.F. Kydonieus, ed.), Vol. 2, pp. 133-154 CRC Press, Boca Raton, Florida and Deasy, P.B., Crit. Rev. Ther. Drug Carrier Syst. (1988) S(2): 99-139, и ионного желирования, как описано, например, Lim et al., Science (1980) 210: 908-910.
В предпочтительных вариантах осуществления изобретения для образования микрочастиц может быть использована система выпаривания растворителя из смеси вода-в-масле-в-воде (в/м/в) согласно процессу, описанному O'Hagan et al., Vaccine (1993) 11: 965-969; PCT/US99/177308 (WO 00/06123) (O'Hagan et al.) и Jeffery et al., Pharm. Res. (1993) 10:362.
В целом, конкретный полимер растворяют в органическом растворителе, таком как этилацетат, диметилхлорид (также называемый метиленхлорид и дихлорметан), ацетонитрил, ацетон, хлороформ и им подобные. Указанный полимер будет представлять примерно 1-30%, предпочтительно, примерно 2-15%, более предпочтительно, примерно 3-10% и, наиболее предпочтительно, примерно 4-6% раствор в органическом растворителе. Полученный раствор полимера затем объединяют с водным раствором и эмульгируют с образованием эмульсии м/в. Водный раствор может представлять собой, например, деионизированную воду, нормальный солевой раствор или забуференный раствор, такой как фосфатно-буферный раствор (ФБР), или буферный раствор, включающий цитрат натрия/этилендиаминтетрауксусную кислоту (цитрат натрия/ЭДТА). Предпочтительно, объемное соотношение раствора полимера и водного раствора варьирует от примерно 5:1 до примерно 20:1 и, более предпочтительно, составляет примерно 10:1. Эмульгирование проводят с использованием любого подходящего для данной задачи оборудования, и в типичном случае оно представляет собой устройство с высокой степенью сдвига, такое как, например, гомогенизатор.
Определенный объем м/в эмульсии затем, предпочтительно, объединяют с большим объемом водного раствора, который, предпочтительно, содержит катионный, анионный или неионный детергент. Объемное соотношение водного раствора и м/в эмульсии составляет в общем случае примерно от 2:1 до 10:1 и, типично, составляет примерно 4:1. Примеры анионного, катионного и неионного детергентов, приемлемых для использования в практике осуществления настоящего изобретения, перечислены выше и включают ДСН, ЦТАБ и ПВС, соответственно. Некоторые макромолекулы могут более легко адсорбироваться на микрочастицах, включающих комбинацию детергентов, например сочетание ПВС и ДОТАП. Кроме того, в ряде случаев может быть желательно добавлять детергент к указанному выше органическому раствору. В случае использования неионного детергента, такого как ПВС, он обычно применяется в виде примерно 2-15% раствора, более типично, примерно 4-10% раствора. В случае использования катионного или анионного детергента он обычно применяется в виде примерно 0,05-5% раствора, более типично, примерно 0,25-1% раствора. В основном, будет использоваться соотношение массы детергента к массе полимера в диапазоне от примерно 0,00001:1 до примерно 0,5:1, более предпочтительно, в диапазоне от примерно 0,0001:1 до примерно 0,5:1, еще более предпочтительно, от примерно 0,001:1 до примерно 0,5:1 и, даже еще более предпочтительно, от примерно 0,005:1 до примерно 0,5:1.
Далее смесь гомогенизируют с получением стабильной двойной эмульсии в/м/в. После этого органические растворители выпаривают. Путем манипулирования параметрами составляемой композиции можно получить препарат от мелких микрочастиц размером порядка 0,05 мкм (50 нм) до более крупных микрочастиц размером 50 мкм или даже более. См., например, Jeffery et al., Pharm. Res. (1993) 10: 362-368; McGee et al., J. Microencap (1996). Так, например, снижение интенсивности перемешивания приводит к получению микрочастиц большего размера, равно как и увеличение объема внутренней фазы. Мелкие частицы образуются при малых объемах водной фазы с высокими концентрациями стабилизаторов эмульсии.
На чертеже схематически показано предпочтительное устройство для осуществления приведенных выше стадий. На чертеже приводится конструкция производственного резервуара, обозначенного, в целом, номером 102. Конструкция указанного резервуара 102 обозначена как "закрытая система", так что в процессе обработки сохраняются асептические условия. Все детали и составные части оборудования, предпочтительно, подбирают таким образом, чтобы их можно было чистить по месту расположения и автоклавировать. Все фильтры 104a-d, предпочтительно, представляют собой фторполимерные фильтры, такие как полностью фторполимерные фильтры Super-Cheminert™ от компании Pall Corporation. Вначале водный раствор, такой как буферная система цитрат натрия/ЭДТА (106), и органический раствор полимера, такой как раствор ПЛГ в метиленхлориде (108), фильтруют и вводят в резервуар 110, где происходит непрерывное смешивание с помощью смесителя 112. Затем смесь пропускают через проточный гомогенизатор 114 (например, высокоскоростной, с высокой степенью сдвига, автоклавируемый проточный гомогенизатор, такой как Kinematica MT 5000) с образованием эмульсии м/в. Полученную эмульсию после ее выхода из проточного гомогенизатора 114 охлаждают, например, с помощью охлаждаемого водой конденсатора 116, после чего возвращают ее в резервуар 110. После того, как все содержимое доводится до нужной степени эмульгирования, в резервуар 110 добавляют водный раствор детергента, например раствор ЦТАБ в воде 118, после чего получают эмульсию типа в/м/в посредством повторного пропускания всего содержимого резервуара через проточный смеситель 114. После достижения достаточной степени эмульгирования через полученную эмульсию в/м/в с помощью распределителя 119 пропускают азот для удаления органического растворителя. Пары растворителя с азотом фильтруют и охлаждают в конденсаторе 120, накапливая растворитель в контейнере 122.
В тех вариантах, где используется относительно высокое соотношение массы детергента к массе полимера (например, массовые соотношения детергента и полимера составляют от примерно 0,05:1 до примерно 0,5:1, более предпочтительно, от примерно 0,10:1 до примерно 0,50:1 и, наиболее предпочтительно, от примерно 0,2:1 до примерно 0,4:1), желательно промывать частицы для удаления избыточных количеств детергента. В типичном случае указанную стадию промывания проводят после удаления из готовой эмульсии органического растворителя, например, посредством выпаривания растворителя (как это представлено на чертеже), посредством экстракции растворителями или обоими указанными способами.
В некоторых вариантах осуществления изобретения микрочастицы промывают с последующим центрифугированием. Указанный способ снижает общее количество детергента и ведет к получению готовой композиции, которая содержит относительно небольшие количества несвязанного детергента по сравнению со связанным детергентом. Так, например, в приведенном ниже примере 2 осуществление указанных стадий промывания (то есть четырехкратного промывания водой с последующим центрифугированием) приводит к получению микрочастиц, содержащих примерно 1 мас.% ЦТАБ, более чем 99% которого связано с микрочастицами, и менее чем 1% обнаруживается в несвязанной форме.
В других более предпочтительных вариантах осуществления изобретения микрочастицы подвергают обработке, направленной на снижение уровня детергента, которая тем не менее оставляет значительное количество детергента в несвязанной форме. Так, например, может быть проведена стадия фильтрования в поперечном потоке для удержания значительного количества несвязанного детергента. В типичном случае стадия фильтрования указанного типа приводит к образованию микрочастиц, содержащих примерно 0,2-5 мас.% детергента в целом, из которых приблизительно от 10 до 60% связано с микрочастицами и приблизительно 40-90% обнаруживается в несвязанной форме. Более предпочтительно, приблизительно от 25 до 40% детергента связано с микрочастицами, и приблизительно 60-75% находится в несвязанной форме. Так, например, при осуществлении процедуры, описанной в приведенном ниже примере 5, образуются микрочастицы, включающие, в целом, примерно 1 мас.% ЦТАБ, из которых приблизительно 30% связано с микрочастицами и приблизительно 70% находится в несвязанной форме.
В тех вариантах осуществления изобретения, где используется достаточно низкое соотношение между детергентом и полимером (например, отношение детергента к полимеру составляет примерно от 0,001:1 до 0,05:1, более предпочтительно, от примерно 0,002:1 до примерно 0,04:1 и, еще более предпочтительно, от примерно 0,006:1 до примерно 0,02:1), нет необходимости промывать микрочастицы для удаления избыточных количеств детергента. В типичном случае процесс такого типа приводит к образованию микрочастиц, содержащих примерно от 0,2 до 5 мас.% детергента, из которых приблизительно от 10 до 60% связано с микрочастицами и приблизительно 40-90% находится в несвязанной форме. Более предпочтительно, приблизительно от 25 до 40% детергента связано с микрочастицами и приблизительно 60-75% находится в несвязанной форме. Так, например, при осуществлении процедуры, описанной в приведенном ниже примере 6, образуются микрочастицы, содержащие приблизительно 1 мас.% ЦТАБ, из которых приблизительно 30% связано с микрочастицами и приблизительно 70% находится в несвязанной форме.
Размер частиц может быть определен, например, с помощью метода лазерного светового рассеяния с использованием, например, спектрометра со встроенным гелий-неоновым лазером. В основном, размер частиц определяют при комнатной температуре, и указанное определение включает многократные анализы исследуемого образца (например, 5-10 раз), что дает среднее значение диаметра частиц. Размер частиц можно также легко определить с помощью сканирующей электронной микроскопии (СЭМ). После получения препаратов микрочастицы могут храниться в том же виде или их лиофилизируют для последующего использования. Для того чтобы адсорбировать макромолекулы на микрочастицы, препарат микрочастиц может быть просто смешан с интересующими макромолекулами, и полученная композиция может быть вновь лиофилизирована до момента использования. Однако, как указывалось выше, авторы настоящего изобретения обнаружили, что адсорбция макромолекул на полимерные микрочастицы может быть улучшена, если создать условия, при которых значительное количество детергента при адсорбции макромолекул находится в несвязанной форме. В том случае, когда в полученной композиции микрочастиц в несвязанной форме находится очень малое количество детергента (например, приблизительно 5% или менее), предпочтительно провести инкубирование указанных микрочастиц совместно с макромолекулой и с дополнительным количеством детергента. Предпочтительно, используют соотношение массы детергента к массе макромолекулы примерно от 0,002:1 до 0,05:1, более предпочтительно, примерно от 0,005:1 до 0,02:1.
С другой стороны, в случае наличия в полученной композиции микрочастиц значительных количеств детергента в несвязанной форме (например, приблизительно 50-90% несвязанного детергента, более предпочтительно, приблизительно 60-75%), хорошие результаты могут быть получены при простом инкубировании микрочастиц с интересующей макромолекулой, и использование дополнительного детергента становится необязательным.
Не ограничивая себя какой-либо теорией, считается, в обоих указанных выше случаях, что несвязанный детергент доступен для образования комплекса с интересующей макромолекулой, делая макромолекулу более способной к адсорбции на микрочастице.
В основном, макромолекулы добавляют к микрочастицам с получением микрочастиц с адсорбированными на них макромолекулами, характеризующихся соотношением массы макромолекул к массе микрочастиц от примерно 0,0001:1 до 0,25:1, предпочтительно, от 0,001:1 до 0,1:1, более предпочтительно, от 0,01:1 до 0,05:1. Содержание макромолекул в микрочастицах может быть определено с помощью стандартных методик.
Микрочастицы согласно настоящему изобретению могут содержать макромолекулы, захваченные или инкапсулированные внутри указанных микрочастиц, а также могут содержать макромолекулы, адсорбированные на них. Так, например, специалист в данной области может получить на основе настоящего изобретения микрочастицы, включающие инкапсулированные адъюванты с адсорбированными на них белками, или микрочастицы, содержащие инкапсулированные белки с адсорбированными на них адъювантами.
Специалист в данной области может, аналогично, получить на основе настоящего изобретения микрочастицы, содержащие инкапсулированные адъюванты с комплексом адсорбированных на них ELVIS-векторов, или микрочастицы, содержащие инкапсулированный антиген с адсорбированными на нем нуклеиновыми кислотами плазмид. Настоящее изобретение охватывает множество сочетаний комплексов макромолекул, адсорбированных на микрочастицах или заключенных внутри микрочастиц, наряду с другими макромолекулами, такими как антигенные молекулы.
Сразу же после получения микрочастиц с адсорбированными макромолекулами они могут быть введены в состав фармацевтических композиций, включая вакцины, для лечения и/или диагностики большого числа заболеваний, указанных выше. Такие композиции, в основном, включают один или более фармацевтически приемлемых эксципиентов. Например, могут использоваться носители, такие как вода, физиологический раствор, глицерин, полиэтиленгликоль, гиалуроновая кислота, этанол и др. В подобных носителях могут также присутствовать другие эксципиенты, такие как смачивающие или эмульгирующие вещества, биологические буферные вещества и им подобные. Биологический буфер может представлять собой фактически любой раствор, который является фармакологически приемлемым и который позволяет получать композицию с желательным значением рН, то есть со значением рН в физиологическом диапазоне. Примеры буферных растворов включают физиологический раствор, фосфатно-буферный раствор, забуференный Трисом физиологический раствор, физиологический раствор с буфером Хэнкса и др. В готовую дозированную форму также могут быть включены другие известные в данной области техники эксципиенты, включая связующие вещества, дезинтегранты, наполнители (разбавители), лубриканты, глиданты (усилители текучести), добавки для прессования, красители, подсластители, консерванты, суспендирующие/диспергирующие средства, пленкообразующие средства/покрытия, вкусовые вещества и маркировочные краски.
Адъюванты могут использоваться для повышения эффективности фармацевтических композиций. Адъюванты могут вводиться одновременно с микрочастицами согласно настоящему изобретению, то есть в составе той же композиции или в виде отдельной композиции. Альтернативно, адъювант может вводиться до или после композиций микрочастиц согласно настоящему изобретению. В другом варианте реализации адъювант, такой как иммунологический адъювант, может быть инкапсулирован в микрочастицы. Адъюванты так же, как и любые макромолекулы, могут быть инкапсулированы внутрь микрочастиц с использованием любых из ряда известных в данной области техники методик. См., например, патент США № 3523907; Ogawa et al., Chem. Pharm. Bull. (1988) 36: 1095-1103; O'Hagan et al., Vaccine (1993) 11: 965-969; Jeffrey et al., Pharm. Res. (1993) 10: 362. Альтернативно, адъюванты могут быть адсорбированы на микрочастицах, как было описано выше относительно любой макромолекулы.
Иммунологические адъюванты включают, но не ограничиваясь этим: (1) соединения алюминия (квасцы), такие как гидроксид алюминия, фосфат алюминия, сульфат алюминия и др.; (2) другие эмульсионные композиции по типу масло – в – воде (при наличии или в отсутствие других специфических иммуностимулирующих средств, таких как мурамилпептиды (см. ниже) или компоненты клеточной стенки бактерий), такие как, например, (а) MF59 (международная публикация № WO90/14837; глава 10 в Vaccine design: the subunit an adjuvant approach, eds. Powell & Newman, Plenum Press 1995), содержащий 5% сквалена, 5% Твин-80 и 0,5% Спан-85 (необязательно содержащий различные количества МТФ-ПЭ (см. ниже), хотя этого и не требуется), который вводится в субмикронные частицы с помощью микрораспылителя, такого как Model 110Y microfluidizer (Microfluidics, Newton, MA), (b) SAF, содержащий 10% сквалена, 0,4% Твин-80, 5% плуроник-блок-сополимера L121 и thr-MDP (см. ниже), который либо подвергается микрораспылению с образованием субмикронной эмульсии, либо обработке в вихревом смесителе с образованием эмульсии частиц более крупного размера, и (с) адъювантная система Ribi™ (RAS), (Ribi Immunochem, Hamilton, MT), содержащая 2% сквалена, 0,2% Твин-80 и один или более компонентов клеточной стенки бактерий из группы, состоящей из монофосфориллипида А (МФЛ), трегалозы димиколата (ТДМ) и скелета клеточной стенки (СКС), предпочтительно, МФЛ+СКС (Detox™) (дополнительную информацию о приемлемых субмикронных эмульсиях типа масло – в – воде с целью использования в рамках настоящего изобретения можно получить в заявке на патент совместного владения № 09/015736, поданной 29 января 1998 года); (3) сапониновые адъюванты, такие как Quil A или QS21 (см. Stimulon™ (Cambridge Bioscience, Worcester, MA)), могут использоваться, или частицы, полученные из них, такие как ИСКОМы (иммуностимулирующие комплексы), при этом ИСКОМы могут не требовать введения дополнительного детергента, см., например, WO 00/07621; (4) полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA); (5) цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 (WO 99/44636) и др.), интерфероны (например, гамма-интерферон), колоний-стимулирующий фактор макрофагов (М-КСФ), фактор некроза опухолевых клеток (ФНО) и др.; (6) монофосфориллипид А (МФЛ) или 3-О-деацилированный МФЛ (3дМФЛ), см., например, GB-2220221, EP-A-0689454, необязательно при отсутствии, по существу, соединений алюминия в случае использования с пневмококковыми сахаридами, как, например, в WO 00/56358; (7) сочетания 3дМФЛ, например, с QS21 и/или с эмульсиями типа масло – в – воде, см., например, EP-A-0835318, EP-A-0735898, EP-A-0761231; (8) олигонуклеотиды, включающие CpG мотивы (Roman et al., Nat. Med., 1997, 3, 849-854; Weiner et al., PNAS USA, 1997, 94, 10833-10837; Davis et al., J. Immunol. 1988, 160, 870-876; Chu et al., J. Exp. Med., 1997, 186, 1623-1631; Lipford et al., Eur. J. Immunol., 1997, 27, 2340-2344; Moldoveanu et al., Vaccine, 1988, 16, 1216-1224; Krieg et al., Nature, 1995, 374, 546-549; Klinman et la., PNAS USA, 1996, 93, 2879-2883; Ballas et al., J. Immunol., 1996, 157, 1840-1845; Cowdery et al., J. Immunol., 1996, 156, 4570-4575; Halpern et al., Cell Immunol., 1996, 167, 72-78; Yamamoto et al., Jpn. J. Cancer Res., 1988, 79, 866-873; Stacey et al., J. Immunol., 1996, 157, 2116-2122; Messina et al., J. Immunol., 1991, 147, 1759-1764; Yi et al., J. Immunol., 1996, 157, 4918-4925; Yi et al., J. Immunol., 1996, 157, 5394-5402; Yi et al., J. Immunol., 1998, 160, 4755-4761; и Yi et al., J. Immunol., 1998, 160, 5898-5906; международные патентные заявки WO 96/02555, WO 98/16247, WO 98/18810, WO 98/40100, WO 98/55495, WO 98/37919 и WO 98/52581), то есть содержащие, по меньшей мере, один CG динуклеотид, при этом вместо цитозина может необязательно использоваться 5-метилцитозин; (9) простой или сложный полиоксиэтиленовый эфир, см., например, WO 99/52549; (10) поверхностно-активное вещество на основе сложного эфира полиоксиэтиленсорбитана в сочетании с октоксинолом (WO 01/21207) или поверхностно-активное вещество на основе простого или сложного полиоксиэтиленалкилового эфира в сочетании с, по меньшей мере, одним дополнительным неионным поверхностно-активным веществом, таким как октоксинол (WO 01/21152); (11) сапонин и иммуностимулирующий олигонуклеотид (например, CpG олигонуклеотид) (WO 00/62800); (12) иммуностимулятор и частицы соли металла, см., например, WO 00/23105; (13) сапонин и эмульсия типа масло – в – воде, см., например, WO 99/11241; (14) сапонин (например, QS21) +3дМФЛ+IL-12 (необязательно +стерол), см., например, WO 98/57659; (15) детоксифицированные мутанты бактериального АДФ-рибозилированного токсина, такого как холерный токсин (CT), токсин коклюша (PT) или термолабильный токсин E. coli (LT), в частности, LT-K63 (в котором лизин замещает аминокислоту в молекуле дикого типа в положении 63), LT-R72 (в котором аргинин замещает аминокислоту в молекуле дикого типа в положении 72), CT-S109 (в котором серин замещает аминокислоту в молекуле дикого типа в положении 109) и PT-K9/G129 (в котором в молекуле дикого типа лизин замещает аминокислоту в положении 9 и глицин замещает аминокислоту в положении 129) (см., например, международные публикации №№ WO 93/13202 и WO 92/19265); и (16) другие вещества, которые действуют как иммуностимуляторы для усиления эффективности композиции. Соединения алюминия (в особенности фосфат и/или гидроксид алюминия) и MF59 являются предпочтительными.
Мурамилпептиды включают, не ограничиваясь этим, N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетил-нор-мурамил-L-аланил-D-изоглу(тамин) (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланил-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (MTP-PE) и др.
Информация о других примерах адъювантов, см. Vaccine Design, The Subunit and the Adjuvant Approach, Powell, M.F. and Newman, M.J. eds., Plenium Press, 1995.
Композиции будут содержать "терапевтически эффективное количество" интересующей макромолекулы. Т.е. то количество комплекса макромолекула/микрочастица, которое следует включить в композицию и которое заставляет субъекта продуцировать достаточный ответ для целей предотвращения, снижения, устранения или диагностики симптомов. Необходимое точное количество будет варьировать в зависимости, например, от субъекта, подлежащего лечению; от возраста и основного состояния субъекта, подлежащего лечению; от тяжести указанного состояния; в случае иммунологического ответа – от способности иммунной системы субъекта синтезировать антитела; от желательной степени защиты и от выбранного конкретного антигена, а также от способа введения, в числе других факторов. Подходящее эффективное количество может быть легко определено специалистом в данной области. Так, "терапевтически эффективное количество" в типичном случае охватывает относительно широкий диапазон, который может быть определен обычными испытаниями. Так, например, для целей настоящего изобретения в том случае, когда макромолекула является полинуклеотидом, эффективная доза будет обычно варьировать от примерно 1 нг до примерно 1 мг, более предпочтительно, от примерно 10 нг до примерно 1 мкг и, наиболее предпочтительно, от примерно 50 нг до примерно 500 нг макромолекулы, доставляемой в виде дозы; в том случае, когда макромолекула представляет собой антиген, эффективная доза будет в типичном случае варьировать от примерно 1 мкг до примерно 100 мг, более предпочтительно, от примерно 10 мкг до примерно 1 мг и, наиболее предпочтительно, от примерно 50 мкг до примерно 500 мкг макромолекулы, доставляемой в виде дозы.
Изготовленные композиции согласно настоящему изобретению могут вводиться парентерально, например, посредством инъекции. Композиции могут вводиться подкожно, внутрибрюшинно, внутривенно или внутримышечно. Другие способы введения включают назальный, слизистый, ректальный, вагинальный, оральный и легочный способы введения, введение с помощью суппозиториев и с помощью чрескожного или чресслизистого способа.
Режим дозирования при лечении может представлять собой введение однократной или множественной дозы. Режим введения множественной дозы представляет собой режим, при котором первичный курс введения может включать 1-10 отдельных доз, после которых могут вводиться другие дозы через определенные интервалы времени, выбранные таким образом, чтобы поддерживать и/или усиливать терапевтический ответ, например через 1-4 месяца для второй дозы и, если потребуется, через несколько месяцев для введения последующей(их) дозы (доз). Режим дозирования может также, по крайней мере, частично определяться потребностями самого субъекта и выбором лечащего врача.
Кроме того, если желательна профилактика заболевания, макромолекулы в вакцинах вводят, в основном, до проявления первичной инфекции рассматриваемым патогеном. Если желательно провести лечение, т.е. добиться ослабления симптомов заболевания или предупреждения его рецидивов, макромолекулы вводят, в основном, после проявления первичной инфекции.
Экспериментальная часть
Ниже приведены конкретные примеры осуществления настоящего изобретения. Примеры даны лишь с целью иллюстрации и не должны рассматриваться как ограничивающие объем настоящего изобретения.
Следует принять все меры, способствующие соблюдению точности экспериментов с точки зрения используемых количественных характеристик (например, количества, значения температур и др.), хотя, конечно, некоторые экспериментальные ошибки и отклонения в значениях данных могут быть допущены.
Пример 1
Получение контрольного варианта микрочастиц с использованием ПВС
Контрольные микрочастицы (т.е. без адсорбированных или захваченных макромолекул) получают с использованием поливинилового спирта (ПВС) следующим образом. Используют растворы:
(1) 6% RG 504 ПЛГ (Boehringer Ingelheim) в дихлорметане.
(2) 10% поливиниловый спирт (ПВС) (ICN) в воде.
В частности, микрочастицы получали посредством объединения 10 мл раствора полимера с 1,0 мл дистиллированной воды с последующей гомогенизацией в течение 3 минут в гомогенизаторе Omni benchtop c 10 мм зондом при 10 К об/мин с образованием эмульсии вода/масло (в/м). Эмульсию в/м добавляют к 40 мл 10% раствора ПВС и гомогенизируют в течение 3 минут с образованием эмульсии вода/масло/вода (в/м/в). Указанную эмульсию вода/масло/вода оставляют на ночь для выпаривания растворителя, что приводит к образованию микрочастиц. Полученные микрочастицы промывают водой, центрифугируя 4 раза, и лиофилизируют. Затем определяют размер микрочастиц на измерителе Malvern Master для дальнейшего использования.
Пример 2
Получение контрольного варианта микрочастиц с использованием ЦТАБ
Контрольные микрочастицы получают с использованием ЦТАБ следующим образом. Используют растворы:
(1) 6% RG 504 ПЛГ (Boehringer Ingelheim) в диметилхлориде.
(2) 0,5% ЦТАБ (Sigma Chemical Co., St. Louis, MO) в воде.
В частности, микрочастицы получали посредством объединения 12,5 мл раствора полимера с 1,25 мл дистиллированной воды с последующей гомогенизацией в течение 3 минут в гомогенизаторе Omni benchtop c 10 мм зондом при 10 К об/мин с образованием эмульсии вода/масло (в/м). Эмульсию в/м добавляют к 50 мл 0,5% раствора ЦТАБ и гомогенизируют в течение 3 минут с образованием эмульсии вода/масло/вода (в/м/в). Указанную эмульсию вода/масло/вода оставляют на ночь для выпаривания растворителя, что приводит к образованию микрочастиц. Далее полученные микрочастицы фильтруют через сито 38 мкм, промывают водой, центрифугируя 4 раза, и лиофилизируют. Определяют размер микрочастиц на измерителе Malvern Master для дальнейшего использования.
Пример 3
Получение контрольного варианта микрочастиц с использованием ДСН
Контрольные микрочастицы получают с использованием ДСН следующим образом. Используют растворы:
(1) 6% RG 504 ПЛГ (Boehringer Ingelheim) в диметилхлориде.
(2) 1% ДСН (Sigma Chemical Co., St. Louis, MO) в воде.
В частности, микрочастицы получали посредством объединения 12,5 мл раствора полимера с 50 мл раствора ДСН с последующей гомогенизацией в течение 3 минут в гомогенизаторе Omni benchtop c 10 мм зондом при 10 К об/мин. Эмульсию оставляют на ночь для выпаривания растворителя. Полученные микрочастицы фильтруют через сито 38 мкм, промывают водой, центрифугируя 4 раза, и лиофилизируют. Определяют размер микрочастиц на измерителе Malvern Master для дальнейшего использования.
Пример 4
Микрочастицы с адсорбированным комплексом ДНК/ЦТАБ
Предварительно получают контрольные микрочастицы ПЛГ/ПВС с использованием стандартного метода выпаривания растворителя. Для получения партии размером 1 г 2 мл деионизированной воды (ДИ) гомогенизируют с 16 мл 6% (масса/объем) раствора RG 504 (полимер ПЛГ) в дихлорметане (ДХМ). Указанную эмульсию гомогенизируют в течение 2 минут и к данной смеси добавляют 60 мл 10% (масса/объем) раствора поливинилового спирта (ПВС). Множественную эмульсию далее гомогенизируют в течение 3 минут и затем ставят на магнитную мешалку для выпаривания растворителя в течение ночи. Полученные микрочастицы промывают дважды деионизированной водой и сушат вымораживанием. Определяют размер микрочастиц, равный примерно 1 мкм.
Для получения композиции с ДНК 100 мг ПЛГ/ПВС микрочастиц инкубируют с 1 мг ЦТАБ и 1 мг ДНК (pCMV-p55gag) в 5 мл ТЭ буфера. Суспензию осторожно перемешивают в течение ночи при 4° до достижения полной адсорбции. Далее микрочастицы центрифугируют один раз при 5000 об/мин и осадок промывают один раз 50 мл ТЭ буфера. Полученный осадок суспендируют в 3 мл ДИ и микрочастицы сушат вымораживанием.
Количество фактически адсорбированной ДНК определяют по методу определения убывания количества (измерение супернатанта) и при проведении основного гидролиза микрочастиц. Было обнаружено, что включение ДНК достигает 0,91 мас.%, и эффективность включения составляет 91%.
10 мг композиции не демонстрирует высвобождения какой-либо свободной ДНК in vitro в 1 мл ТЭ буфера на день 1.
Пример 5
Получение контрольного варианта микрочастиц с использованием ЦТАБ
Методика поперечно-точного фильтрования
Контрольные микрочастицы получают с использованием ЦТАБ следующим образом. Используют растворы:
(1) 6% RG 504 ПЛГ (Boehringer Ingelheim) в метиленхлориде.
(2) 0,5% ЦТАБ (Sigma Chemical Co., St. Louis, MO) в воде.
(3) Цитрат натрия/ЭДТА в воде.
Микрочастицы получают в аппарате, подобном тому, что изображен на чертеже при объединении 80 мл раствора полимера с 10 мл раствора цитрата натрия/ЭДТА в резервуаре при постоянном перемешивании. Затем смесь гомогенизируют в проточном гомогенизаторе до получения эмульсии м/в с наличием дисперсной фазы (водной фазы), имеющей средний размер частиц 1-2 микрона. В указанный момент в резервуар при постоянном перемешивании добавляют 310 мл раствора ЦТАБ. Далее смесь гомогенизируют в проточном гомогенизаторе до образования стабильной эмульсии в/м/в с наличием дисперсной фазы (м/в фазы), имеющей средний размер частиц 1 микрон. Через полученную в/м/в эмульсию пропускают азот для удаления органического растворителя, и полученные таким образом микрочастицы фильтруют с помощью 0,1 мкм поперечно-точной фильтровальной кассеты Millipore с использованием 4,0 л деионизированной воды для удаления избытка ЦТАБ. После проведения окончательного поперечно-точного фильтрования собирают суспензию, которая содержит примерно 1% ЦТАБ, из которых 30% присутствует в связанной форме и 70% присутствует в несвязанной форме.
Пример 6
Получение контрольного варианта микрочастиц с использованием ЦТАБ
Методика без промывания
Контрольные микрочастицы получают с использованием ЦТАБ следующим образом. Используют растворы:
(1) 6% RG 504 ПЛГ (Boehringer Ingelheim) в метиленхлориде.
(2) 0,01825% ЦТАБ (Sigma Chemical Co., St. Louis, MO) в воде.
(3) Цитрат натрия/ЭДТА в воде.
Микрочастицы получают в аппарате, подобном тому, что изображен на чертеже при объединении 300 мл раствора полимера с 60 мл раствора цитрата натрия/ЭДТА в резервуаре при постоянном перемешивании. Затем смесь гомогенизируют в проточном гомогенизаторе до получения эмульсии м/в с наличием дисперсной фазы (водной фазы), имеющей средний размер частиц 1 микрон. В указанный момент в резервуар при постоянном перемешивании добавляют 1,8 литра раствора ЦТАБ. Далее смесь гомогенизируют в проточном гомогенизаторе до образования стабильной эмульсии в/м/в с наличием дисперсной фазы (м/в фазы), имеющей средний размер частиц 1 микрон. Через полученную в/м/в эмульсию пропускают азот для удаления органического растворителя. Определяют размер суспензии микрочастиц на измерителе Malvern Master для дальнейшего использования. Указанные микрочастицы содержат примерно 1% ЦТАБ, из которого 30% присутствует в связанной форме и 70% присутствует в несвязанной форме.
Пример 7
Иммуногенность микрочастиц с адсорбированной ДНК р55
Готовят композицию ДНК инкубированием 100 мг суспензии микрочастиц (в объеме 10 мл), полученной в примере 6, с 1,0 мг ДНК (плазмида pCMVgag, кодирующая белок HIV p55 gag, под контролем раннего промотора цитомегаловируса) в объеме 0,5 нл Трис-ЭДТА буфера. Суспензию инкубируют при 4°С в течение 12 часов. После инкубации центрифугируют ДНК-содержащие микрочастицы, промывают их Трис-ЭДТА буфером, суспендируют в деионизированной воде и сушат вымораживанием (лиофилизируют). Содержание ДНК в образованных микрочастицах составляет примерно 1 мас.%.
Далее ДНК-содержащие микрочастицы инъецируют внутримышечно мышам в двух дозах по содержанию ДНК. Одну ДНК также инъецируют в тех же количествах в качестве контроля. Каждую композицию инъецируют десяти мышам. Мышей вторично иммунизируют через 28 дней. Через две недели после второй иммунизации собирают сыворотку и определяют среднее геометрическое значение титра (СГТ) для каждой из исследуемых сывороток вместе с величиной стандартной ошибки (СО). Полученные результаты приведены ниже в таблице:
Несмотря на то, что в настоящем описании подробно рассмотрены предпочтительные варианты осуществления настоящего изобретения, следует понимать, что могут быть осуществлены очевидные вариации без отступления от принципов и объема изобретения, которые определяются прилагаемой формулой изобретения.
Цитированная литература:
Ссылка 1 - Международная патентная заявка WO 99/24578.
Ссылка 2 - Международная патентная заявка WO 99/36544.
Ссылка 3 - Международная патентная заявка WO 99/57280.
Ссылка 4 - Международная патентная заявка WO 00/22430.
Ссылка 5 - Tettelin et al. (2000) Science 287:1809-1815.
Ссылка 6 - Международная патентная заявка WO 96/29412.
Ссылка 7 – Pizza et al. (2000) Science 287:1816-1820.
Ссылка 8 - Международная патентная заявка PCT/IB01/00166.
Ссылка 9 - Bjune et al. (1991) Lancet 338(8775):1093-1096.
Ссылка 10 - Fukasawa et al. (1990) Vaccine 17:2951-2958.
Ссылка 11 - Rosenqvist et al. (1998) Dev. Biol. Stand. 92:323-333.
Ссылка 12 - Costantino et al. (1992) Vaccine 10:691-698.
Ссылка 13 - Costantino et al. (1999) Vaccine 17:1251-1263.
Ссылка 14 – Watson (2000) Padiatr Infect Dis J 19:331-332.
Ссылка 15 - Rubin (2000) Pediatr Clin North Am 47:269-285, v.
Ссылка 16 - Jedrzejas (2001) Microbiol Mol Biol Rev 65:187-207.
Ссылка 17 - Международная патентная заявка, поданная 3 июля 2001 г., с приоритетом от GB-0016363.4].
Ссылка 18 - Kalman et al. (1999) Nature Genetics 21:385-389.
Ссылка 19 - Read et al. (2000) Nucleic Acids Res 28:1397-406.
Ссылка 20 – Shirai et al. (2000) J. Infect. Dis. 181(Suppl 3):S524-S527.
Ссылка 21 - Международная патентная заявка WO 99/27105.
Ссылка 22 - Международная патентная заявка WO 00/27994.
Ссылка 23 - Международная патентная заявка WO 00/37494.
Ссылка 24 - Международная патентная заявка WO 99/28475.
Ссылка 25 - Bell (2000) Pediatr Infect Dis J 19:1187-1188.
Ссылка 26 - Iwarson (1995) APMIS 103:321-326.
Ссылка 27 - Gerlich et al. (1990) Vaccine 8 Suppl:S63-68 & 79-80.
Ссылка 28 - Hsu et al. (1999) Clin Liver Dis 3:901-915.
Ссылка 29 - Gustafsson et al. (1996) N. Engl. J. Med. 334:349-355.
Ссылка 30 - Rappuoli et al. (1991) TIBTECH 9:232-238.
Ссылка 31 - Vaccines (1988) eds. Plotkin & Mortimer. ISBN 0-7216-1946-0.
Ссылка 32 - Del Guidice et al. (1998) Molecular Aspects of Medicine 19:1-70.
Ссылка 33 - Международная патентная заявка WO 93/18150.
Ссылка 34 - Международная патентная заявка WO 99/53310.
Ссылка 35 - Международная патентная заявка WO 98/04702.
Ссылка 36 - Ross et al. (2001) Vaccine 19:4135-4142.
Ссылка 37 - Sutter et al. (2000) Pediatr Clin North Am 47:287-308.
Ссылка 38 - Zimmerman & Spann (1999) Am Fam Physician 59:113-118, 125-126.
Ссылка 39 - Dreesen (1997) Vaccine 15 Suppl:S2-6.
Ссылка 40 – MMWR Morb Mortal Wkly Rep 1998 Jan 16;47(1):12, 19.
Ссылка 41 - McMichael (2000) Vaccine 19 Suppl 1:S101-107.
Ссылка 42 - Schuchat (1999) Lancet 353(9146):51-6.
Ссылка 43 – Патентные заявки GB 0026333.5, 0028727.6 & 0105640.7.
Ссылка 44 - Dale (1999) Infect Dis Clin North Am 13:227-43, viii.
Ссылка 45 - Ferretti et al. (2001) PNAS USA 98:4658-4663.
Ссылка 46 - Kuroda et al. (2001) Lancet 357(9264):1225-1240; см. также страницы 1218-1219.
Ссылка 47 - Ramsay et al. (2001) Lancet 357(9251):195-196.
Ссылка 48 - Lindberg (1999) Vaccine 17 Suppl 2:S28-36.
Ссылка 49 - Buttery & Moxon (2000) J R Coll Physicians London 34:163-168.
Ссылка 50 - Ahmad & Chapnick (1999) Infect Dis Clin North Am 13:113-133, vii.
Ссылка 51 – Goldblatt (1998) J. Med. Microbiol. 47:563-567.
Ссылка 52 - Европейский патент 0477508.
Ссылка 53 – Патент США № 5306492.
Ссылка 54 - Международная патентная заявка WO 98/42721.
Ссылка 55 – Conjugate Vaccines (eds. Cruse et al.) ISBN 3805549326, особенно vol.10:48-114.
Ссылка 56 - Hermanson (1996) Bioconjugate Techniques ISBN: 0123423368 & 012342335X.
Ссылка 57 - Европейская патентная заявка 0372501.
Ссылка 58 - Европейская патентная заявка 0378881.
Ссылка 59 - Европейская патентная заявка 0427347.
Ссылка 60 - Международная патентная заявка WO 93/17712.
Ссылка 61 - Международная патентная заявка WO 98/58668.
Ссылка 62 - Европейская патентная заявка 0471177.
Ссылка 63 - Международная патентная заявка WO 00/56360.
Ссылка 64 - Международная патентная заявка WO 00/61761.
| название | год | авторы | номер документа |
|---|---|---|---|
| МИКРОЧАСТИЦЫ ДЛЯ ДОСТАВКИ ГЕТЕРОЛОГИЧНЫХ НУКЛЕИНОВЫХ КИСЛОТ | 2001 |
|
RU2295954C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КАТИОННЫЕ МИКРОЧАСТИЦЫ И ДНК HCV Е1Е2, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2004 |
|
RU2364419C2 |
| КОМПОЗИЦИИ МЕНИНГОКОККОВЫХ ВАКЦИН С АДЪЮВАНТАМИ | 2002 |
|
RU2360699C2 |
| МУТАНТНЫЕ АНТИГЕНЫ GAS57 И АНТИТЕЛА ПРОТИВ GAS57 | 2008 |
|
RU2471497C2 |
| МУТАНТНЫЕ ФОРМЫ СТРЕПТОЛИЗИНА О | 2008 |
|
RU2498994C2 |
| СПОСОБ ОЧИСТКИ БАКТЕРИАЛЬНОГО КАПСУЛЯРНОГО ПОЛИСАХАРИДА NEISSERIA MENINGITIDIS ИЛИ HAEMOPHILUS INFLUENZAE И СПОСОБ ПОЛУЧЕНИЯ ВАКЦИНЫ | 2002 |
|
RU2381814C2 |
| СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ ПРИОНОВ ПЕПТИДНЫЕ РЕАГЕНТЫ | 2004 |
|
RU2381033C2 |
| НЕКОТОРЫЕ АМИНОАЛКИЛГЛЮКОЗАМИНИДФОСФАТНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2004 |
|
RU2389732C2 |
| НЕКОТОРЫЕ АМИНОАЛКИЛГЛЮКОЗАМИНИДФОСФАТНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2004 |
|
RU2544850C2 |
| ВАКЦИНЫ НА ОСНОВЕ СОЛЮБИЛИЗИРОВАННЫХ И КОМБИНИРОВАННЫХ КАПСУЛЯРНЫХ ПОЛИСАХАРИДОВ | 2002 |
|
RU2528066C2 |
Изобретение относится к биологически активной композиции микрочастиц, содержащей микрочастицы, которые включают (а) полимер, выбранный из группы, состоящей из поли (α-гидроксикислоты), полигидроксимасляной кислоты, поликапролактона, полиортоэфира, полиангидрида и полицианоакрилата, и (b) первую часть детергента, которая связана с полимером; и адсорбированный на поверхности микрочастиц комплекс, который включает (а) биологически активную макромолекулу и (b) вторую часть детергента, где первая часть детергента и вторая часть детергента включают один и тот же детергент или разные детергенты, и где биологически активную макромолекулу выбирают из группы, состоящей из полипептида, полинуклеотида, полинуклеозида, антигена, фармацевтического средства, гормона, фермента, медиатора транскрипции или трансляции, интермедиата метаболического пути, иммуномодулятора и адъюванта, а также к способам получения композиции и ее применению. Технический результат: улучшение адсорбции биологически активных агентов на поверхности микрочастиц в системах доставки, в особенности для лекарственных средств, которые характеризуются высокой чувствительностью и сложностями при составлении на их основе композиции. 6 н. и 38 з.п. ф-лы, 1 табл., 1 ил.
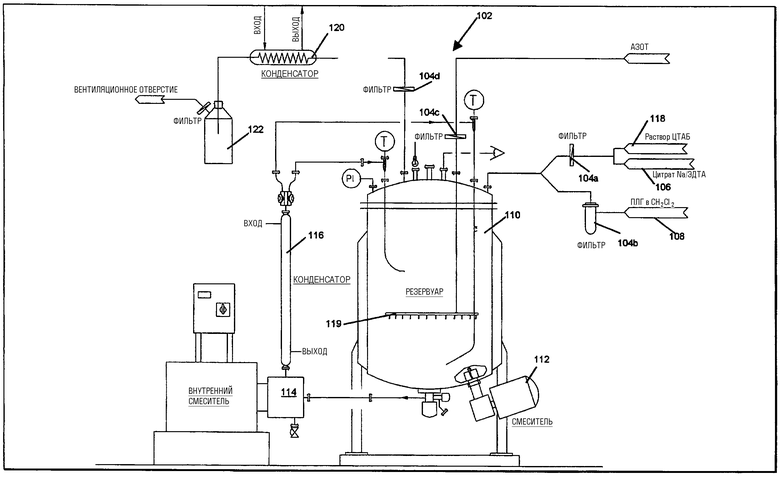
(a) получение эмульсии, содержащей (i) полимер, выбранный из группы, состоящей из поли(α-гидроксикислоты), полигидроксимасляной кислоты, поликапролактона, полиортоэфира, полиангидрида и полицианоакрилата, (ii) органический растворитель, (iii) детергент и (iv) воду;
(b) удаление органического растворителя из эмульсии с образованием микрочастиц;
где примерно 10-90% всего детергента в композиции микрочастиц связано с микрочастицами и оставшаяся часть не связана и где указанные микрочастицы не подвергают стадии промывки.
(a) эмульгирование органической фазы, содержащей полимер и органический растворитель, с первой водной фазой, содержащей воду, с образованием эмульсии вода-в-масле; и
(b) эмульгирование второй водной фазы, содержащей катионный детергент и воду, с эмульсией, образованной на стадии (а), с получением эмульсии вода-в-масле-в-воде.
(a) образование композиции микрочастиц способом по любому из пп.24-29 и
(b) инкубирование композиции микрочастиц с биологически активной макромолекулой.
получение микрочастиц процессом эмульгирования, причем указанные микрочастицы включают (а) полимер, выбранный из группы, состоящей из поли(α-гидроксикислоты), полигидроксимасляной кислоты, поликапролактона, полиортоэфира, полиангидрида и полицианоакрилата, и (b) первую часть детергента, которая связана с полимером; и адсорбирование комплекса биологически активной макромолекулы и второй части детергента на поверхности микрочастицы, где первая часть детергента и вторая часть детергента включают один и тот же детергент или разные детергенты и биологически активную макромолекулу выбирают из группы, состоящей из полипептида, полинуклеотида, полинуклеозида, антигена, фармацевтического средства, гормона, фермента, медиатора транскрипции или трансляции, интермедиата метаболического пути, иммуномодулятора и адъюванта.
(a) эмульгирование органической фазы, содержащей полимер и органический растворитель, с первой водной фазой, содержащей воду, с образованием эмульсии вода-в-масле и
(b) эмульгирование второй водной фазы, содержащей детергент и воду, с эмульсией, полученной на стадии (а), с образованием эмульсии вода-в-масле-в-воде.
| ДВУХКОРПУСНОЙ ПЛОСКИЙ РАССЕВ И МЕХАНИЗМ ДЛЯ ПРИВЕДЕНИЯ ЕГО В ДЕЙСТВИЕ | 1926 |
|
SU6123A1 |
| Fattal et all., “Biodegradable polyalkylcyanoacrylate nanoparticles for the delivery of oligonucleotides”, J | |||
| Controlled Release, 30.04.1998, 53:137-43 | |||
| WO 9702810 А2, 30.01.1997 | |||
| WO 9620698 А2, 11.07.1996 | |||
| МИКРОЧАСТИЦЫ, ВКЛЮЧАЮЩИЕ СОЛИ ПЕПТИДОВ С ПОЛИЭФИРАМИ, ИМЕЮЩИМИ КОНЦЕВЫЕ КАРБОКСИГРУППЫ, И СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ | 1993 |
|
RU2152225C1 |
| ИОННЫЙ КОНЪЮГАТ С ДЛИТЕЛЬНЫМ ПЕРИОДОМ ВЫСВОБОЖДЕНИЯ ПЕПТИДА, СПОСОБ СИНТЕЗИРОВАНИЯ ИОННОГО КОНЪЮГАТА, СПОСОБ СИНТЕЗИРОВАНИЯ МИКРОЧАСТИЦ | 1994 |
|
RU2146128C1 |
Авторы
Даты
2005-07-27—Публикация
2001-09-28—Подача