Изобретение касается новых солей, состоящих из катиона, полученного из пептида, содержащего по меньшей мере одну основную группу, и аниона, полученного из полиэфира с концевыми карбоксигруппами, способов приготовления таких солей и применения этих солей в производстве фармацевтических композиций пролонгированного действия. Соли данного изобретения обладают множеством свойств, ценных для приготовления фармацевтических композиций пролонгированного действия, независимо от того, находятся ли эти соли в чистом виде, или в смеси либо с избытком свободной, несвязанной формы пептида, либо с избытком свободного полиэфира. Такие соли являются алифатическими, поскольку состоят частично из пептида, который является гидрофильным и липофобным, и частично из полиэфира, который является гидрофобным и липофильным.
Слово "пептид" применяется здесь в его общем смысле, обозначающем поли (аминокислоты), которые обычно называют "пептидами", полипептидами" или "белками", а "основной пептид" - это пептид, который имеет основную природу, обусловленную присутствием избытка основных аминокислот, например, аргинина или лизина, или N - концом данного пептида, или это просто пептид, который содержит по меньшей мере одну основную группу, иногда в присутствии одной или нескольких кислых аминогрупп. Термин охватывает также синтетические аналоги пептидов, неприродные аминокислоты, имеющие основные группы или любой иной вид введенной основности. Слово "полиэфир" применяют далее в значении полиэфира с концевыми карбоксигруппами.
Европейский Патент N 58481 ссылается на возможность специфических химических взаимодействий между концевой карбоксильной группой полиэфира и основной группой или группами внутри пептида.
Zowter et ad. , Proc. Jnt. Symp. Control Rel. Bioact. Mafer., 14, 19/1987/ и Okada et al., Pharmaceufical Research, 8, 584 - 587 /1991/ также называют эту возможность, но эти публикации являются в этом отношении умозрительными, поскольку они не описывают конкретно такие специфические пептид-полиэфирные соли, не дают указаний на способ получения таких солей и не упоминают каких-либо полезных эффектов, которые могли бы возникать в результате применения подобных солей в производстве фармацевтических композиций.
Согласно же данному изобретению обеспечена композиция, содержащая исходно соль, образованную из катиона, произведенного из пептида, содержащего по меньшей мере одну основную группу, и аниона, произведенного из полиэфира с концевой карбоксигруппой; эта композиция находится в форме раствора или дисперсии этой соли в растворителе, являющемся растворителем для свободного полиэфира, а не растворителем для свободного пептида, и размер частиц соли в упомянутой дисперсии менее 5 мкм и предпочтительно менее 0,2 мкм, или в форме микрочастиц или имплантатов для инъекции или подкожной имплантации.
Катионный компонент соли может быть получен из основного пептида, который фармакологически активен, или из фармакологически неактивного основного пептида. Если основной пептид фармакологически активен, соль данного изобретения может быть приготовлена в виде фармацевтической композиции пролонгированного действия. Если основной пептид фармакологически неактивен, то соль данного изобретения может быть использована в качестве наполнителя при приготовлении композиций пролонгированного действия других, фармакологически активных пептидов, которые имеют либо кислую природу /содержат избыток кислых аминокислот, таких как аспаргиновая кислота и глутаминовая кислота/, либо имеют нейтральную природу.
В препаратах пролонгированного действия пептидов дальнейшим требованием, разумеется, является требование, чтобы пептид был стабильным в препарате в течение предусмотренного периода высвобождения. Термин "в основном стабилен" означает, что лекарственное средство не становится полностью нерастворимым или денатурированным с полной потерей фармакологической активности в течение периода применения, предусмотренного для этого препарата.
Пригодные для этого фармакологически активные пептиды имеют мол. массу по меньшей мере 300 Да и предпочтительно не менее 800 Да. Примерами таких пептидов, которые могут быть в основном стабильными в препаратах пролонгированного действия в течение предусмотренного периода высвобождения и которые, следовательно, могут быть использованы в композициях данного изобретения, являются окситоцин, вазопрессин, адренокортикотропный гормон /АСТН/, эпидермальный фактор роста /EGF/, пролактин, лютеинизирующий гормон, фолликулостимулирующий гормон, люлиберин, или гормон высбождения лютенизирующего гормона /LHRH/, инсулин, соматостатин, глюкагон, интерферон, гастрин, тетрагастрин, урогастрин, секретин, кальцитонин, энкефалины, эндорфины, киоторфин, тафтсин, тимопоэтин, тимозин, тимостимулин, гуморальный фактор вилочковой железы, сывороточный фактор вилочковой железы, фактор некроза опухолей, колониестимулирующий фактор, мотилин, бомбезин, динорфин, нейротензин, церулеин, брадикинин, урокиназа, калликреин, аналоги и антагонисты вещества P, ангиотензин II, фактор роста нерва, фактор коагуляции крови VII и IX, хлорид лизозима, ренин, брадикинин, тироцидин, грамицидины, ростовые гормоны, меланоцитостимулирующий гормон, гормон высвобождения тиреоидного гормона, тиреостимулирующий гормон, паращитовидный гормон, панкреозимин, холецистокинин, человеческий плацентарный лактоген, человеческий хорионический гонадотропин, стимулирующий белковый синтез пептид, желудочный ингибиторный пептид, вазоактивный кишечный пептид, тромбоцитарный фактор роста, фактор, стимулирующий выделение гормона роста, белок морфогенеза костей и синтетические аналоги и модификации и фармакологически активные фрагменты этих пептидов.
Предпочтительными пептидными компонентами композиции данного изобретения являются синтетические аналоги LHRH, которые включают /но не ограничены ими/ бусерелин ([D-Ser(Bat)6, des-Gly-NH2 10] -LHRH (1-9) NHEt, дезлорелин ([D-Trp6, des-Gly-NH2 10]-LHRH (1-9) NHEt, фертирелин ([des-Gly-NH2 10]-LHRH (1-9) NH-Et, госерелин ([D-ser(But)6, Azgly10] -LHRH), гистрелин ([D-His(Bzl)6, des-Gly-NH2 10] -LHRH (1-9) NHEt, лейпрорелин ([D-Leu6des-Gly-NH2 10]-LHRH (1-9) NHEt), лутрелин ([D-Trp6, MeLeu7, des'-Gly-NH2 10]-LHRH(1-9)NHEt, нафарелин ([D-Nal6]-LHRH, трипторелин ([D-Trp]6 - LHRH, и их фармакологически активные соли.
Пригодными фармакологически неактивными основными пептидами, которые можно использовать в солях данного изобретения, являются полиаргинин, полилизин и поли /аргинин-лизин/, (со) полимеры нейтральных аминокислот в D-, L-, или D, L - форме с аргинином и/или лизином в D-, L- или рацемической форме или пептиды или (со) полипептиды, в которых пептидные цепи заканчиваются в целом или в их части основной группой на конце и каркас структуры состоит из остатков нейтральных аминокислот.
Полиэфир с концевой карбоксигруппой, применимый в качестве источника аниона в соли данного изобретения, может быть сложным гомополиэфиром или сополиэфиром. Предпочтительными являются такие полиэфиры, которые расщепляются или разрушаются в водной физиологической среде, которая присутствует во внутримышечной или подкожной ткани, до низкомолекулярных водорастворимых фрагментов. В такой среде доминирующим процессом деградации является простой гидролиз с гидролитическим расщеплением эфирных групп, который приводит к образованию низкомолекулярных фрагментов гомо- или сополиэфира и в конечном счете к исчезновению препарата из места его введения. Однако вполне понятно, что в этих местах инъекции или имплантации так же, как и в других местах в живой ткани, могут иметь место и другие механизмы деградации, например, опосредованные ферментами.
Пригодными гомо- и сополиэфирами являются полиэфиры, произведенные из гидроксикислот или образованные в результате поликонденсации диолов и/или полиолов, например, /но не только/, полиэтиленгликолей, полипропиленгликолей, 2 - 10C - алкиленгликолей, глицерина, триметилолпропана, и поликсиэтилированных форм полифункциональных спиртов, таких как глицерин, триметилолпропан и сахара, с дикарбоновыми кислотами и/или поликарбоновыми кислотами, например /но не только/, 1 - 10C - алкандикарбоновыми кислотами, в частности малоновой, янтарной и глутаровой кислотами, фталевой, меллитовой и пиромеллитоновой кислотами, иногда в присутствии гидроксикислоты (кислот/и/или моноолов).
Предпочтительными способами получения гомо- и сополиэфиров на основе гидроксикислот являются полимеризация с раскрытием цикла димеров циклических кислот или прямая поликонденсация или сополиконденсация гидроксикислот или смесей гидроксикислот или лактонов, произведенных из таких гидроксикислот. Полимеризации такого рода, как полимеризацию с раскрытием цикла, так и поликонденсацию, проводят предпочтительно таким образом, что образующиеся гомо- или сополиэфиры содержат в целом виде или частью полимерные цепи, имеющие функциональные группы карбоновых кислот. Так, поликонденсацию кислотных димеров с раскрытием цикла проводят в присутствии подходящего агента переноса полимерной цепи или ко-инициатора, который контролирует как мол. массу, так и структуру образующегося гомо- или сополиэфира. Пригодными агентами переноса являются вода, гидроксикарбоновые кислоты, монокарбоновые кислоты, дикарбоновые кислоты и поликарбоновые кислоты.
Для полиэфиров, получаемых поликонденсацией или сополиконденсацией, полимеризацию проводят в таких условиях, когда присутствует избыток карбоновой кислоты, т. е. отношение [-COOH] к [-OH] равно 1 или больше 1. Структура и мол. масса поликонденсата определяются природой применяемых спиртов / моноолы. диолы, полиолы или их смесь/, природой применяемых кислот /моно-, ди- или поликарбоновые кислоты или их смесь/ и количеством избытка карбоновой кислоты. В частности, применимы кислоты, участвующие в цикле Кребса.
Примерами подходящих гидроксикислот или лактонов, которые могут применяться в приготовлении гомо- или сополиэфиров, применимых в данном изобретении, являются β- пропионолактон, β- бутиролактон, γ- бутиролактон и пивалолактон и α- гидроксимасляная кислота, α- гидроксиизомасляная кислота, α- гидроксивалериановая кислота, α- гидроксиизовалериановая кислота,α- гидроксикапроновая кислота, α- гидроксиизокапроновая кислота, α- гидрокси- β- метилвалериановая кислота, α- гидроксигептановая кислота, α- гидроксидекановая кислота, α- гидроксимиристиновая кислота и α- гидроксистеариновая кислота. Предпочтительны такие гомо- и сополиэфиры, которые произведены из молочной кислоты в ее D, L- или DL - форме м гликолевой кислоты, или соответствующие димеры лактид и гликолид, и предпочтительным ингибитором полимеризации является молочная кислота.
Хотя макромолекулярное основное пептидное лекарственное средство может существовать полностью или частично в виде полимерного катиона, а полиэфир может существовать целиком или частично в виде полимерного аниона, образование соли, возникающей в результате кислотно-основного взаимодействия между такими полимерными молекулами, при обычных способах смешивания или применения органических растворителей является чрезвычайно трудным или даже невозможным. Например, смешивание с расплавлением этих двух компонентов не годится, т.к. хорошо известно, что пептиды обычно не расплавляются, а скорее разрушаются при повышенных температурах, обычно применяемых для расплавления полимеров. Однако даже в случае расплавления пептидов /что не происходит/ они были бы несовместимы с гомо- или сополиэфиром /или нерастворимы в нем/ вследствие следующих термодинамических причин.
Пептиды представляют собой макромолекулы и обладают многими типичными свойствами обычных полимеров. В силу этого они /в отсутствие специфических химических или физических взаимодействий/ совершенно несовместимы с другими молекулами /или нерастворимы в них/, которые имеют отличающуюся химическую структуру и полимерную структуру, т.к. свободная энергия смешивания двух несхожих типов полимеров высокоположительна и поэтому термодинамически неблагоприятна. В конденсированном состоянии пептиды представляют собой высокополярные молекулы с большим количеством водородных связей, что приводит к тому, что энтальпия смешения пептидов с гомо- или сополиэфиров /которые относительно неполярны и в которых водородные связи либо отсутствуют, либо являются слабыми/ высокоположительна; т. е. эндотермически и термодинамически неблагоприятна. Далее, макромолекулы по определению являются большими и поэтому имеют низкую внутреннюю энтропию, что приводит к тому, что энтропия смешения двух различных макромолекулярных видов является очень низкой или даже отрицательной (см., например, P.J. Florey; "Principles of Polymer Chemistry", Cornell Unwersity: 1953, 555; Z. Bohn, "Polymer Handbook", 2 nd Edition, J. Wiley, 1975, 111 - 211; and Z. Bohn, Rubber Chemistry and Technology, 1966, 493). В результате смешение пептида с полиэфиром при повышенной температуре в расплавленном состоянии не приводит к смешиванию на молекулярном уровне, необходимому для образования соли. Таким образом, простое смешивание пептида и полиэфира не приводит к образованию соли.
Подобные трудности существуют и при попытках образования солей пептидов и полиэфиров при помощи органических растворителей, если пептид не имеет некоторой растворимости или набухаемости в этом растворителе. Свойства растворимости полиэфиров и пептидов совершенно различны. Растворители, которые растворяют пептид, такие как вода, абсолютно не растворяются - полиэфир; и наоборот, хорошие растворители для полиэфира, такие как дихлорметан, как правило, не являются растворителями для пептида. Растворители, которые растворяют как пептид, так и полиэфир, такие как диметилсульфоксид, диметилформамид и N - метилпирролидон, имеют другие проблемы, поскольку они являются относительно нелетучими, имеют высокие точки кипения и вследствие этого трудноудаляемы. Кроме того, некоторые из этих растворителей обладают неприемлемой токсичностью. Можно найти определенные растворители для обоих компонентов, которые более летучи и приемлемы токсилогически, однако эти растворители представляют другие трудности при их применении. Например, уксусная кислота является таким растворителем как для пептидов, так и для полиэфиров, но использование большого количества кислого растворителя приводит к тому, что пептид существует в виде соли уксусной кислоты - вследствие эффектов действия масс/, так что удаление уксусной кислоты при комнатной температуре /скажем 20 - 25oC/ или лиофильным высушиванием приводит к разделению фаз пептида и полиэфира, так что желаемого образования их соли не происходит.
Таким образом объектом данного изобретения является обеспечение способа приготовления соли, содержащей катион основного пептида и анион полиэфира с концевой карбоксигруппой.
Получение пептид-полиэфирных солей данного изобретения можно проводить с применением гомо- или сополиэфиров, содержащих карбоксигруппы, и пептидов, в которых основные остатки находятся в виде свободного основания или в виде солей слабой кислоты, предпочтительно летучей кислоты, имеющей константу диссоциации менее 10-3 или pKA(pKa = -log 10a K, где Ka - константа диссоциации кислоты) более 3. Особенно предпочтительной солью такого основного пептида является соль с уксусной кислотой. Однако вследствие присущей им несовместимости этих двух видов макромолекул следует применять особые условия, в которых могут образоваться эти пептид-полиэфирные соли.
Одним из способов достижения этого является применение растворителя, который растворяет как пептид, так и полиэфир с образованием раствора, из которого можно непосредственно удалить этот растворитель, оставляя либо, во-первых, амфипатическую соль, либо, во-вторых, смесь полиэфира и пептида в физическом состоянии, которое ведет к образованию амфипатической соли при дальнейшем процессировании.
Примером первого подхода является применение растворителей, таких как /но не только/, диметилсульфоксид, диметилформамид, диметилацетамид и N-метилпирролидон, которые в основном нейтральны и могут служит растворителем как для пептида, так и для полиэфира. При обычных условиях, как указано выше, эти растворители чрезвычайно трудно удалить вследствие их высоких точек кипения и относительной нелетучести. При растворении пептида /например, в виде соли уксусной кислоты/ и полиэфира в одном их этих растворителей пептид имеет тенденцию образования соли с полиэфиром, поскольку группа с большей кислотностью молочной или гликолевой кислоты в полиэфира вытесняет более слабую карбоновую кислоту. Весь растворитель и высвобожденная уксусная кислота /или другая слабая, но летучая карбоновая кислота/ могут быть удалены в вакууме, и оставшийся раствор, содержащий соль пептида с полиэфиром, добавляют к дистиллированной воде для осаждения нерастворимой полимерной соли.
Предпочтительно дистиллированная вода не должна содержать диоксид углерода во избежание образования солей угольной кислоты путем замещения полиэфирного аниона. Затем оставшийся растворитель в пептид-полиэфирной соли может быть удален дальнейшим промыванием водой, также предпочтительно не содержащей диоксида углерода. В некоторых случаях полимерную соль можно выделить прямым осаждением в воду без необходимости удаления растворителя. Этот подход особенно применим при применении пептида в виде основания.
Поэтому согласно следующему аспекту данного изобретения обеспечен способ приготовления соли, содержащей основной пептид и полиэфир с концевой карбоксигруппой, который предусматривает растворение основного пептида, в свободной форме или в форме соли со слабой кислотой, например уксусной кислотой, и полиэфира с концевой карбоксигруппой в нейтральном полярном растворителе, в котором растворимы оба компонента, удаление растворителя или его большей части и добавление оставшегося концентрированного раствора к избытку растворителя, не являющегося растворителем для пептидно-полиэфирной соли.
Второй подход, также основанный на применении растворителя, который растворяет как пептид, так и полиэфир, использует растворитель, который может быть удален замораживанием и обычной лиофилизацией или сушкой распылением. Основной частью этого способа является удаление растворителя из пептид-полиэфирной смеси при очень высокой, почти мгновенной скорости и предпочтительно при температуре, которая ниже температуры стеклования полиэфира и пептида. В этом случае растворитель может быть нейтральным или кислым и предпочтительным растворителем является уксусная кислота.
Такое очень быстрое удаление растворителя из раствора, обнаруживающего в некоторой степени признаки вязкого или вязкоэластичного течения, приводит к разделению фаз двух несовместимых типов макромолекул, происходящему на очень низкой коллоидальной шкале. Т.е. полученная пептид-полиэфирная смесь имеет очень высокую площадь поверхности и поверхностную энергию. В результате при добавлении другого, отличающегося растворителя для полиэфира, который обычно не является растворителем для пептида, к почти не содержащим растворителя пептидполиэфирным смесям высокая поверхностная энергия диссипирует с образованием соли и происходит исчезновение коллоидной природы пептида в полиэфире. Подходящие для этого второго подхода растворители должны быть удаляемы сушкой замораживанием и включают /но не лимитированы ими/ уксусную кислоту, смеси диоксана с водой и смеси трет-бутанола с водой, или они должны быть удаляемы сушкой распылением.
Таким образом, согласно следующему аспекту данного изобретения обеспечен способ приготовления соли, содержащей основной пептид и полиэфир с концевой карбоксигруппой, предусматривающий растворение основного пептида, в свободной форме или в форме соли со слабой кислотой, например, с уксусной кислотой, и полиэфира с концевой карбоксигруппой в растворителе, в котором растворимы оба компонента и который может быть удален сушкой вымораживанием, замораживанием образующегося раствора при высокой скорости, сушку вымораживанием образующейся замороженной смеси, диспергирование образующейся смеси в растворителе для полиэфирного компонента и растворение смеси по мере образования пептид-полиэфирной соли.
Более конкретно в этом способе раствор пептида и полимолочной кислоты, или сополимера молочной и гликолевой кислот, в уксусной кислоте добавляют к жидкому азоту в виде капель. Это приводит к более или менее мгновенному замораживанию раствора уксусной кислоты и более или менее мгновенному образованию не содержащей растворителя пептид-полиэфирной смеси. Высушивание вымораживанием для удаления растворителя уксусной кислоты дает пептид-полиэфирный продукт, смешанный на чрезвычайно мелкой коллоидной шкале. Для многих пептидов коллоидная природа такого материала продемонстрирована при добавлении растворителя для полиэфира, например дихлорметана, когда образуется мелколлоидальная суспензия. При условии, что в смеси присутствует избыток карбоновой кислоты, прозрачный раствор можно получить при стоянии через некоторое время с потерей избытка поверхностной энергии по мере образования пептид-полиэфиной соли. Вместо добавления каплями к жидкому азоту можно применять и другие процедуры для более или менее мгновенного замораживания смеси пептид/полиэфир/уксусная кислота, например добавление каплями этой смеси в смесь твердого диоксида углерода и гексана.
Гипотетически, конечно, полностью нерастворимое соединение можно сделать растворимым, если оно может быть уменьшено до достаточно малого среднего размера частиц. Если предложить, что частица представляет собой сферу радиуса r, имеет плотность σ и имеет поверхностную энергию γ , то такая частица будет иметь ассоциированную в ней поверхностную энергию 4πr2γ . Она будет также иметь массу 4/3πr3 и поверхностная энергия на единицу массы будет равна 3πγ/σr .
Растворим теперь два случая насыщенных растворов: - /i/ когда избыток твердого вещества очень крупнозернистый и поэтому имеет очень мало поверхностной энергии и насыщенный раствор имеет концентрацию CS. Тогда свободная энергия Гиббса равна:
G1 раствор = G0 = RTlnCS = G1 тверд.мат,
/ii/ когда избыток твердого вещества состоит из мелких частиц с радиусом r, тогда свободная энергия Гиббса раствора, находящегося в равновесии с чрезвычайно малыми частицами, равна:
G2 раствор. = G0 + RTlnC,
но в этом случае твердый материал имеет свободную энергию Гиббса
G
и G
или G
Но из /i/ выше
G1 тверд. = G0 + RTlnCS,
и, следовательно,
Go+RTlnC-3πγ/σr = Go+RTlnCs,
или C = Cs•e3πγ/σr
так, что по мере уменьшения r, C /гипотетически/ увеличивается.
В обычном случае более высокая, чем нормальная, растворимость, обусловленная малым размером частиц, является неустойчивой и частицы растут в размере, например, в результате растворения и перекристаллизации, так что эффект высокой поверхностной энергии отвергается. Однако при малом размере частиц пептид-полиэфирных смесей может происходить образование соли и это дает альтернативное средство снижения поверхностной энергии коллоидных частиц при помощи образования растворимой амфипатической соли, которая в виде раствора обладает самой низкой свободной энергией.
Согласно дальнейшему аспекту данного изобретения, обеспечен способ приготовления соли, состоящей из основного пептида и полиэфира с концевой карбоксигруппой, предусматривающий реакцию основного пептида в форме соли с сильной кислотой, например, такой как соляная или серная кислоты, с полиэфиром, который весь или частично находится в форме соли карбоновой кислоты с подходящим щелочным металлом или щелочноземельным металлом, например, соли натрия, калия, кальция или магния. Для низкомолекулярных полиэфиров /имеющих среднюю мол. массу менее 10000/ соли со щелочами могут быть растворены или очень мелко диспергированы в воде. Добавление такого раствора или дисперсии к водному раствору /предпочтительно не содержащему диоксида углерода/ пептида приводит к осаждению водонерастворимой амфипатической пептид-полиэфирной соли.
Подобным образом хлориды или сульфаты основных пептидов в виде полиоксиэтиленовых конъюгатов пептидов являются или могут быть частично совместимыми или растворимыми в растворителях, таких как дихлорметан, и соли натрия или калия полиэфиров с концевыми карбоксигруппами также могут быть растворены в дихлорметане. Поэтому при смешивании таких двух солей в подходящих соотношениях растворимая пептид-полиэфирная соль образуется путем двойного разрушения с осаждением хлорида или сульфата щелочного металла.
Термодинамическая несовместимость различных макромолекул, описанная выше, была известна в течение многих лет, но редко принималась во внимание ранее при получении пептидных лекарственных средств пролонгированного выделения из полиэфирных матриксов. Необходимым последствием этой термодинамической несовместимости или нерастворимости является то, что в обычных случаях полиэфиры совершенно непроницаемы для пептидных лекарственных средств. Для того чтобы происходила диффузия Фика пептидного лекарственного средства через полиэфир, пептид должен иметь некоторую растворимость в этом полиэфире. Однако вследствие обсуждаемых выше причин это не имеет места и, следовательно, транспорт пептида через полиэфир путем зависимой от границы раздела диффузии Фика невозможен.
Кроме того, даже если дискуссии ради пептидное лекарственное средство имеет некоторую растворимость в полиэфире или совместимость с ним, транспорт путем диффузии через полиэфирную фазу все равно было бы невозможным. Уже давно известно, что свободный объем в полиэфире, который возникает из ротационной и трансляционной подвижности полиэфирного сегмента и который мог бы позволить прохождение диффундирующих молекул, является недостаточно большим для диффузии макромолекул с мол. массами более 500 Да /см., например R.W. Baker and H. K. Zonsdale, "Controlled Release : Mechanisms and Rafes" in "Controlled Release of Biologically Active Agents, ed. A.C. Tanguavy and R. E. Zacey, Plenum Press, 1974, 15 et. Seg./.
Однако даже хотя транспорт пептидного лекарственного средства через полиэфир при помощи диффузии Фика в основном невозможен для пептидов с мол. массами более 500 Да, тем не менее достигается постоянное высвобождение полипептидов. EP N 58481 описывает, как можно получить непрерывное высвобождение пептидного лекарственного средства из полиэфира путем использования очень разных свойств этих двух макромолекул, гидрофильности и водорастворимости пептидов и гидрофобности и водонерастворимости полиэфиров. В препаратах, описанных в этом патенте, высвобождение пептидного лекарственного средства достигается первично через водные поры, которые образуются исходно простым выщелачиванием пептида из доменов на поверхности препарата или из доменов пептидного лекарственного средства, которые являются сплошными или смежными с поверхностью препарата. Это выщелачивание обеспечивает начальную фазу высвобождения, а дальнейшее гидролитическое разрушение полиэфира приводит к генерированию дальнейшей пористости внутри полиэфира, в результате чего может происходит дальнейшее высвобождение пептида, регулируемое деградацией и эрозией. Если пористость, возникающая при гидролитической деградации полиэфира, не происходит достаточно быстро, то начальное высвобождение из фазы выщелачивания завершается до того, как образуется достаточная обусловленная деградацией пористость в системе доставки лекарства и получают прерывистое высвобождение пептида. Параметры такого препарата, описанного в EP 58481, выбирают поэтому таким образом, чтобы эти две фазы высвобождения перекрывались, приводя к непрерывному высвобождению пептидного лекарственного средства.
Однако в то время как транспорт при помощи диффузии Фика пептида через полиэфирную фазу невозможен в случае простых пептид-полиэфирных смесей, совершенно иная ситуация возникает в случае препаратов пептид-полиэфирных солей данного изобретения, иногда в присутствии свободного полимера. В препаратах, содержащих подобные материалы, нет отдельной фазы, состоящей только из полиэфира, скорее непрерывной фазой, контролирующей высвобождение пептида, является целиком или частично пептид- полиэфирная соль. Свободный пептид имеет некоторую растворимость в этой фазе пептид-полиэфирной соли и поэтому в препаратах с применением таких материалов возможна истинная диффузия Фика, зависимая от разделения фаз пептида, если присутствуют другие необходимые условия, такие как эффективный свободный объем.
Поскольку пептид-полиэфирная соль содержит высокогидрофильный сегмент, препарат пептид-полиэфирной соли поглощает гораздо больше воды, чем один полиэфир. Кроме того, в таких препаратах поглощение воды усиливается еще более благодаря ионной природе пептид-полиэфирного взаимодействия и сольватации ионов или пар ионов в макромолекулярной соли водой. Это подразумевает в основном гидрогельную природу пептид-полиэфирной соли и обеспечивает увеличение степени подвижности макромолекулярных сегментов в поликатион-полианионном комплексе. Т.е. увеличивается эффективный свободный объем матричного материала, который помогает движению макромолекулярного пептида.
Суммарный эффект этих свойств пептид-полиэфирной соли /иногда в присутствии свободного полимера/ заключается в том, чтобы появилась возможность диффузионного транспорта макромолекулярного пептида через мактрикс пептид-полиэфирной соли или смешанную фазу и свободного полимера. Это совершенно иная ситуация, чем та, которая существует только с одним полиэфиром с простыми смесями пептидов и полиэфиров. Поэтому матриксы или мембраны, основанные на увеличенной проницаемости, возникающей при применении пептид-полиэфирной соли, являются центральной проблемой для препаратов с контролируемым высвобождением пептидов, описанных далее в этой заявке.
Таким образом, пептид-полиэфирные соли данного изобретения обеспечивают новые и неожиданные преимущества в конструировании систем парентеральной доставки лекарственных средств на основе растворов и дисперсий с применением различных смесей свободных пептидных лекарственных средств, свободного полиэфира и пептид-полиэфирной соли как в водных, так и неводных фармацевтически приемлемых носителях для инъекций и на основе подкожных имплантатов, которые могут быть инъецированы, внутримышечно или подкожно, или имплантированы благодаря новой и неожиданной растворимости этих пептидсодержащих молекулярных частиц в липофильных растворителях. Кроме того, препараты, основанные на этих пептид-полиэфирных солях, в частности, с применением высокомолекулярных полиэфиров, можно также водить другими путями. Особое значение имеет пероральный путь введения, в котором можно применять с хорошим результатом различные комбинации пептид-полиэфирной соли и/или свободного пептидного лекарственного средства и/или свободного полиэфира. Во многих случаях для перорального введения предпочтительно применять фармацевтически приемлемый носитель, такой как растительное масло и его разновидность и в том числе моно-, ди- и триглицериды, либо отдельно, либо в смеси с другими маслами. Менее важны топический, ректальный и интраназальный пути введения.
Кроме EP 58481 /1982/, на который дана ссылка выше, только Lawter et al. /loc. cit./ и Okada et al /loc. cit/
констатировали возможность получения пептид-полиэфирных солей, но обе эти публикации являются спекулятивными, т.к. они не описывают, как можно реализовать или использовать это возможное взаимодействие. Дальнейшим объектом данного изобретения является обеспечение фармацевтических препаратов, содержащих различные комбинации пептид-полиэфирной соли и/или свободного пептидного лекарственного средства и/или свободного полиэфира в различных соотношениях, для получения по меньшей мере трех различных профилей контролируемого высвобождения лекарственного средства.
Таким образом, согласно следующему аспекту данного изобретения, обеспечена фармацевтическая композиция пролонгированного действия, содержащая пептид-полиэфирную соль, описанную выше, и/или свободное пептидное лекарственное средство и/или свободный полиэфир и иногда другой фармацевтический наполнитель или наполнители.
Эта конструкция фармацевтических композиций данного изобретения основана на следующих рассмотрениях. В то время как простое пептидное лекарственное средство обычно растворимо в воде, как его соль с полиэфиром, так и сам свободный полиэфир обычно совершенно нерастворимы в воде /хотя признается, что хотя очень низкоолигомерные формы полиэфиров и сополиэфиров сами нерастворимы в воде, они могут быть водорастворимыми в форме пептид-полиэфирной соли/. Однако инкубирование смеси пептидного лекарственного средства и полиэфира, в которой весь пептид или его часть присутствовала в виде пептид-полиэфирной соли, в водных физиологических жидкостях приводит к некоторой деградации полиэфира. Если продукты деградации водонерастворимы, то деградирующая пептид-полиэфирная соль будет оставаться нерастворимой. С другой стороны, если полиэфир исходно имеет низкую мол. массу или содержит полимерный компонент приблизительно такой же низкой мол. массы, так что образуются водонерастворимые кислые фрагменты полиэфира, то эти фрагменты /как анионы/ транспортируются вместе с полипептидным катионом. Для новой композиции пептид-полиэфирной соли данного изобретения было показано, что немедленное высвобождение зависит от мол. массы и от молекулярно-массового распределения полиэфирного компонента.
Молекулярно-массовое распределение определяется как
Mw/Mn,
где Mw - среднемассовая мол. масса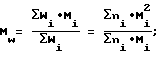
Mn - среднечисловая мол. масса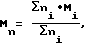
где Wi - фракция масс полимерных молекул, имеющих мол. массу Mi,
a ni - число полимерных молекул, имеющих мол. массу Mi.
Молекулярно-массовое распределение часто называют полидисперсностью и хорошо известны различные величины для узкого, нормального или наиболее вероятного и широкого распределения /см. например, "Polymer Handbook", 2nd Edition, y. Wiley
1975, IV-3/. В основном принято, что полидисперсность менее 1,8 соответствует узкому распределению или низкой полидисперсности, приблизительно 1,8 - 2,2 - нормальному или наиболее вероятному распределению или нормальной полидисперсности, а приблизительно более 2,2 - широкому распределению или высокой полидисперсности.
Для введения пептидных лекарственных средств парентеральным путем, например, внутримышечной или подкожной инъекцией или подкожной имплантацией системы запаса или доставки, предпочтительны полиэфиры, имеющие среднечисловую мол. массу более 2000 Да или характеристическую вязкость при 1% /вес/об. / при 25oC в хлороформе более или равную 0,08 дл/г и до 4,0 дл/г /включительно/. Для введения другими путями, например, перорально, предпочтительным диапазоном среднечисловой массы является диапазон 500 - 5000 Да.
Из приведенных выше соображений, которые в значительной степени игнорировались в этой области исследований, очевидно, что деградация полиэфиров, в частности, в присутствии основного пептида, с образованием даже небольшой фракции водорастворимых фрагментов, и временной интервал, необходимый для этого, будут контролироваться молекулярной массой и молекулярно-массовым распределением. По существу непосредственная деградация до водорастворимых фрагментов происходит при использовании полиэфиров с узким и нормальным распределением, имеющих среднемассовые мол. массы менее 10000 Да и менее 15000 Да соответственно/ в зависимости от типа молекулярно-массового распределения/, но, как правило, чем ниже полидисперсность полиэфира, тем более низкая среднемассовая мол. масса требуется для непосредственной деградации до водорастворимых фрагментов. Для полиэфиров со среднемассовой мол. массой более 15000 Да требуются нормальное или широкое распределение. Опять-таки, хотя это зависит от природы и типа молекулярно-массового распределения, но, как правило, чем выше среднемассовая мол. масса, тем более высокая полидисперсность требуется для достижения ранней деградации до водорастворимых фрагментов.
Для композиций пептида и полиэфира или сополиэфира, в которых весь пептид или его часть находятся в форме пептид-полиэфирной соли, можно получить три различных профиля высвобождения. Первый из них наблюдается, когда происходит по существу сразу же деградация полиэфира с образованием кислых водорастворимых или гидрофильных фрагментов, что приводит к непосредственному высвобождению пептида по следующему механизму: -
где P - водорастворимый деградированный фрагмент полиэфира или гидрофильный водонерастворимый фрагмент деградированного полиэфира, который становится водорастворимым, присутствуя в виде соли с основным пептидом;
D - основной пептид.
В первом случае композиция может либо содержать все лекарственное средство в виде пептид-полиэфирной соли, либо она может содержать некоторое количество свободного несвязанного лекарственного средства в дополнение и пептид-полиэфирной соли, в обоих случаях иногда может присутствовать свободный полимер. Однако полимер разрушается до водорастворимых фрагментов в присутствии пептида почти сразу, вследствие чего начинается почти мгновенное непрерывное пролонгированное выделение пептида. Следует отметить, что диффузия свободного водорастворимого пептида через разрушающуюся композицию облегчается повышенной проницаемостью матрикса, обусловленной присутствием пептид-полиэфирной соли в непрерывной фазе, которая модулирует выделение.
Во втором случае все пептидное лекарственное средство присутствует в виде пептид-полиэфирной соли /иногда в присутствии свободного полиэфира/, но полиэфир не разрушается сразу до водорастворимых фрагментов. Это приводит к начальному интервалу, когда нет выделения пептидного лекарственного средства. Даже хотя пептид- полиэфирная соль увеличивает проницаемость матрикса для свободно диффундирующего пептида, свободное пептидное лекарственное средство, которое могло бы диффундировать, отсутствует. Весь пептид находится в форме водонерастворимой пептид-полиэфирной соли и только после некоторого времени полиэфир деградирует до водорастворимых фрагментов и вызывает образование свободного и транспортируемого лекарственного средства. Это приводит к длительному индукционному периоду, во время которого нет начального выделения пептида, после которого начинается выделение. Этот второй случай является идеальным для рассчитанного и ритмичного выделения растворимых вакцин и пептидов.
В третьем случае препарат на основе пептид-полиэфирной системы, содержащей пептидное лекарственное средство как в свободном виде, так и в форме соли полимера с лекарственным средством, иногда также в присутствии свободного полиэфира, имеющего среднемассовую мол. массу более 15000 Да / и предпочтительно более 30000 Да/ и узкое или наиболее вероятное молекулярно-массовое распределение, помещают в физиологическую среду, характерную для внутримышечных и подкожных сайтов. При этом может происходить прерывистое выделение лекарственного средства. Первая фаза выделения возникает из-за присутствия свободного пептидного лекарственного средства и его способности транспортироваться через более проницаемую систему пептид-полиэфирной соли. Если эта первая фаза выделения свободного пептида завершается до того, как деградация полиэфира в пептид-полиэфирной соли начнет давать следующие порции свободного пептида, то последует прерывистое выделение пептидного лекарственного средства.
Очевидно, что если не интервала, во время которого отсутствует свободный пептид, во время деградации, то можно получить непрерывное выделение пептида. Такой профиль выделения похож на описанный в EP N 58481, но механизм высвобождения в EP N 58481 и применяемые материалы / не пептид-полиэфирная соль/ совершенно отличны от механизмов и материалов, описанных в данной заявке. В зависимости от типа профиля выделения эти смеси являются идеальными для непрерывного выделения пептидов, белков и растворимых вакцин
Как уже упомянуто выше, эти системы лекарственных солей пептид/полиэфир, их физико-химические характеристики и механизмы, по которым происходит выделение пептида, совершенно отличны от описанных в EP N 56481 и 52510 и во всех других публикациях, касающихся выделения пептиов из гомо- и сополимеров молочной и гликолевой кислот, известных заявителю. Из них только EP N 58,481, Lawter et al /loc. cit/ и Okada et al. /loc. cit./ упоминают образование соли в результате ионного взаимодействия карбоксигрупп полиэфира и основных аминокислот в пептидах, но композиция, приготовленная, как описано в этих публикациях, не содержат соли пептидного лекарственного средства и полиэфира. Эти более ранние описания являются спекулятивными в этом отношении и не делают окончательного вывода о том, что такие взаимодействия действительно имеют место, а также не показывают, как можно приготовить и выделить такие пептид-полиэфирные соли и затем использовать их для воздействия на выделение пептидов с различными профилями выделения на основе их неожиданной растворимости в липофильных органических растворителях.
Среди свойств пептид-полиэфирных смесей, определяющих выделение, которые пока не были упомянуты, находятся число основных функциональных групп в пептиде и число карбоксигрупп в полиэфире. Вышеупомянутые публикации также ничего не сообщают относительно значительных и неожиданных эффектов, возникающих при применении пептид-полиэфирных солей, и удивительно высокой проницаемости систем, содержащих в целом или в их части пептид-полиэфирную соль, по сравнению с проницаемостью одного полиэфира, или смесей, в которых эти два компонента просто смешаны и поэтому не содержат пептид-полиэфирной соли.
Это различие в проницаемости можно продемонстрировать в простых диффузионных экспериментах, в которых сплошная и безупречная полиэфирная мембрана, разделяющая два водных компартмента, один из которых содержит водный раствор пептида, а другой содержит только водную фазу, не позволит пептиду проходить через нее до значительного разрушения мембранного полиэфира. В противоположность этому мембраны, содержащие во всей их массе или в части их пептид-полиэфирную соль, позволяют лекарственному средству проходить через содержащую соль мембрану путем зависимой от перегородки диффузии, даже если пептид имеет мол. массу более 500 Да.
Пептид-полиэфирные соли данного изобретения имеют много других удивительных и ценных полезных свойств, неизвестных в прежних материалах подобного рода, которые особенно ценны для приготовления фармацевтических систем доставки. Одним из наиболее ценных свойств является хорошая растворимость пептида в форме полиэфирной соли в органических растворителях, в которых пептиды в норме совершенно нерастворимы. Это предоставляет много преимуществ в производстве фармацевтических средств, поскольку это позволяет применять новые способы и процедуры для производства систем доставки лекарственных средств, и, в частности, облегчает асептическое производство. Эти способы и процедуры и применяемые материал значительно отличаются от процедур и материала, описанных ранее.
Так, растворы пептид-полиэфирной соли, иногда содержащие свободный полимер и/или свободный пептид в солюбилизированной или диспергированной форме, могут стерильно фильтроваться, облегчая таким образом проблемы, связанные обычно со стерильным производством твердых или суспензионных пептидных препаратов. Отфильтрованный стерильно раствор пептид-полиэфирной соли можно затем подвергать различным способам высушивания в асептической среде. Предпочтительными способами, пригодными для асептических операций, являются распылительная сушка, сушка вымораживанием и другие.
Особенно ценным является образование микрочастиц с размером в диапазоне от 0,2 мкм до 500 мкм, которые можно суспендировать в фармацевтически приемлемом носителе для инъекций. Такие микрочастицы можно суспендировать в водном носителе для инъекций перед применением или альтернативно и органическом носителе для инъекций, который не является растворителем для применяемых материалов. Для систем доставки, основанных на гомо- и сополимерах молочной и гликолевой кислот, подходящими органическими растворителями являются высоколипофильные масла, такие как /но не только/ этилолеат, изопропилмиристат, растительные масла и различные жирные глицериды. В некоторых случаях предпочтительно применять смеси таких липофильных носителей.
Хотя такие липофильные носители не являются растворителями для форм доставки, основанных на молочной и гликолевой кислотах, они непригодны для применения с высоколипофильными полиэфирами, основанными на гидроксикислотах с длинной цепью таких как гидроксистеариновая кислота. Для таких высоколипофильных полиэфиров или сополиэфиров предпочтительны гидрофильные органические носители для инъекций, такие как /но не только/ пропиленгликоль и низкомолекулярный полиэтиленгликоль.
Очевидно, что водные носители для инъекций также пригодны для
систем доставки на основе более липофильных полимеров.
Альтернативный способ получения микрочастиц использует другое неожиданное и полезное свойство пептид-полиэфирных солей данного изобретения. Пептид-полиэфирная соль содержит гидрофильный пептид, который предпочитает термодинамически существовать или растворяться в водной или полярной среде или фазе, и цепь полиэфира, которая гидрофобна и предпочитает термодинамически растворяться в гидрофобной фазе. Т.е. пептид-полиэфирная соль амфипатична и имеет поверхностно-активные свойства, которыми не обладают простые соли пептидов.
Эта поверхностная активность приводит к тому, что пептид-полиэфирная соль существует предпочтительно в интерфазе (поверхности раздела фаз) и вследствие основной природы соли /доля и длина гидрофобной цепи/ наиболее термодинамически стабильным типом дисперсии в водной фазе является дисперсия в воде /т.к. критическая концентрация мицелл очень низка и во многих ситуациях не вся соль может существовать в интерфазе/.
Таким образом, модно видеть, что пептид-полиэфирная соль представляет собой чрезвычайно эффективный диспергатор для создания и сохранения стабильности водных дисперсий. Во втором способе приготовления фармацевтических препаратов из микрочастиц пептид-полиэфирный раствор/ скажем, например, в дихлорметане/ просто диспергируют в водной фазе, которая может иногда содержать повышающий вязкость полимер, такой как /но не только/, поливиниловый спирт, при помощи поверхностно-активных свойств пептид-полиэфирной соли. Хотя некоторые органические растворы, содержащие такие пептид-полиэфирные соли, могут диспергироваться самопроизвольно, как правило, приготовление водной дисперсии требует перемешивания.
Дальнейшим аспектом этого способа, как указано выше, является проведение этих операций таким образом, чтобы диспергирование осуществлялось в отсутствие диоксида углерода и в инертной атмосфере. Далее, предпочтительно, чтобы органический раствор пептид-полиэфирной соли не содержал диоксида углерода, поскольку концентрация диоксида углерода в воздухе и воде при обычных условиях достаточна высока по сравнению с концентрациями карбоксигрупп полиэфира для вступления в конкурентное образование соли благодаря эффектам действия масс, согласно уравнению: -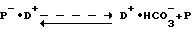 ,
,
где P - полиэфир и D - пептидное лекарственное средство. Полученные водные дисперсии можно затем высушить разными способами, такими как удаление органического растворителя в вакууме с последующим высушиванием, вымораживанием или прямым удалением как растворителя, так и воды в одной операции сушки вымораживанием. Образующийся продукт можно затем применять для приготовления фармацевтических препаратов описанным выше способом.
В другом способе приготовления фармацевтических препаратов в виде микрочастиц используют в основном сухой раствор пептид-полиэфирной соли, содержащий коллоидно-диспергированный свободный пептид, в подходящем органическом растворителе или носителе /Термин "в основном сухой" применен потому, что фактически невозможно удалить все следы воды из пептида и, кроме того, он означает, что лекарственное средство не существует в виде водного раствора в отдельной водной фазе/. Добавление растворителя/ не являющегося растворителем для полимера/ в условиях сильного перемешивания с последующим добавлением набухшей в растворителе пептид-полиэфирной соли /иногда содержащей свободный полимер и иногда содержащей свободное лекарственное средство/ к большому объему второго растворителя/ не для полимера/ дает окончательную форму. Очевидно, при проходящих условиях или в присутствии подходящих поверхностно-активных веществ, такие как /но не только/ эфиры сорбита и жирной кислоты, осаждение микрочастиц можно проводить с применением одного и того же растворителя/ не являющегося растворителем для полиэфира/, например парафина, такого как гексан.
Микрочастицы, приготовленные различными описанными здесь способами, структурно совершенно не похожи на микрокапсулы, приготовленные согласно способам, описанным в EP N52 510/ /Syntex/ 145240/ Takeda/, по которым пептиды капсулируют в фазе одного полиэфира. Микрокапсулы представляют собой один или несколько "коров" /центральных частей/ соединения или материала внутри сплошной второй фазы, так что непрерывное покрытие материала второй фазы полностью покрывает или микрокапсулирует "коровый" материал таким образом, что он абсолютно отсутствует на поверхности микрокапсул. Микрокапсулированный "коровый" материал сохраняет во всех отношениях физико-химические и термодинамические свойства некапсулированного соединения или материала кора.
Так, в EP N 52 510 был применен способ коацервации с разделением фаз для покрытия капелек водного разбавленного раствора пептида, так что вокруг капельки образовалось сплошное покрытие из одного полимера. Т.е. были получены истинные микрокапсулы, имеющие геометрию и форму микросфер. После выделения осажденных микрокапсул и отверждения и высушивания был получен продукт, в котором пептидное лекарственное средство существует в виде дискретного кора или коров внутри полимерной оболочки. Вследствие присутствия воды внутри микрокапсулы перед высушиванием ее удаление во время процесса дегидратации при температуре ниже температуры стеклования полимера может приводить к образованию частицы, имеющей отверстия. Ни на одной стадии этого способа и ни в одном из применяемых в нем материалов, описанных в EP N 52510, не принимает участия пептид-полиэфирная соль. Описанный способ не позволяет проводить стерильное фильтрование раствора или суспензии пептид-полиэфира в случае необходимости асептического производства.
Кроме того, этот патент используют специфически полиэфиры на основе молочной и/или/гликолевой кислот, описанные в US Patent N 3773919 /Boswell/, отличающиеся тем, что они растворимы в бензоле при 25oC. В данном изобретении нерастворимые в бензоле полиэфиры на основе молочной и/или/гликолевой кислот, но растворимые в хлороформе, предпочтительны для относительно коротких периодов доставки, скажем, менее двух месяцев.
В EP N 190833 /Takeda/ пептид был уловлен гелированным водным раствором лекарственного средства и водная гелированная фаза была диспергирована в растворе полимера. Затем эту дисперсию типа вода/водный гель лекарственного средства в масле /раствор полимера/ диспергировали в условиях срезывающих сил в воде с образованием двойной дисперсии типа масло-в-воде-в-воде. После удаления органического растворителя под вакуумом и лиофилизации были получены микрокапсулы, в которых комплекс лекарственное средство/ желирующий агент капсулирован только полимером. Продукты этого способа сохраняют лекарственное средство в виде простой соли, а не в виде полимерной соли пептида. Поэтому фармацевтические препараты данного изобретения имеют физико-химические характеристики и термодинамические свойства, которые совершенно иные, чем описанные для продуктов EP N 52510, 145240 и 190833, в которых микрокапсулы имеют форму и геометрию микросфер, где кор или коры лекарственного средства полностью покрыты одним полимером.
Продукты данной заявки могут также иметь геометрию и форму /но не только/ микросфер, но они либо вообще не являются микрокапсулами, описанными выше, а скорее представляют собой растворы пептид-полиэфирной соли/ иногда содержание также свободный полимер/, либо они представляют собой микрокапсулы, в которых свободное пептидное лекарственное средство капсулировано внутри непрерывной фазы или покрытия из соли полимера с лекарственным средством, содержащей также иногда свободный полимер. Как указано выше, свойства проницаемости такой соли полимера с лекарственным средством совершенно отличны от свойств одного свободного полимера, так что продукты данного изобретения выделяют пептидное лекарственное средство способом, совершенно отличающимся от способов, описанных ранее в EP N 52510, 145240 и 190833.
Таким образом, дальнейшим вариантом данного изобретения является приготовление либо микросфер, которые не являются микрокапсулами, с применением раствора пептид-полиэфирной соли, иногда содержащей свободный полимер, либо микросфер, являющихся микрокапсулами, но содержащих свободное лекарственное средство, капсулированное фазой или покрытием из пептид-полиэфирной соли, иногда содержащей свободный полимер.
Такие отличающиеся частицы могут быть приготовлены множеством различных способов, таких как осаждение, коацервация с разделением фаз, распылительная сушка и сушка вымораживанием. Предпочтительный размер частиц лежит в диапазоне от 0,2 мкм до 500 мкм и частицы моно инъецировать в виде суспензии в подходящем носителе для инъекции.
Особенно эффективные и ценные парентеральные фармацевтические препараты пептидных лекарственных средств могут быть также приготовлены в форме растворов соли лекарственного средства с полиэфиром, иногда содержащих свободный полиэфир и иногда содержащих диспергированное или солюбилизированное свободное лекарственное средство в фармацевтически приемлемом органическом растворителе, который является растворителем для свободного полиэфира, но не является растворителем для пептидов и их простых солей, таких как хлориды и ацетаты.
Таким образом, согласно данному изобретению, обеспечена фармацевтическая композиция, содержащая пептидное лекарственное средство и полиэфир для пролонгированного высвобождения лекарственного средства, отличающаяся тем, что эта композиция находится в виде раствора, содержащего:
/а/ основное пептидное лекарственное средство, описанное выше, имеющее мол. массу по меньшей мере 300 Да, предпочтительно не менее 800 Да, которое находится в форме соли с полиэфиром, содержащей катион основного пептида и анион полиэфира с концевыми карбоксигруппами,
/b/ фармацевтически приемлемый органический растворитель, являющийся растворителем для свободного полиэфира, но не являющийся растворителем для свободного пептида,
/c/ избыток полиэфира и иногда
/d/ избыток свободного пептидного лекарственного средства в солюбилизированной или коллоидно-диспергированной форме.
Подходящими основными пептидами и полиэфирами с концевыми карбоксигруппами являются описанные выше пептиды и полиэфиры и, в частности, предпочтительными пептидами являются синтетические аналоги LHRH, описанные выше.
Для солей полиэфира с пептидным лекарственным средством, в которых полиэфир основан на гомо- и сополимерах молочной и гликолевой кислот, пригодными фармацевтически приемлемыми органическими растворителями являются /но не лимитированы ими/ бензилбензоат, бензильный спирт, этиллактат, глицерилтриацетат, сложные эфиры лимонной кислоты и низкомолекулярные /менее 1000/ полиэтиленгликоли, алкоксиполиэтиленгликоли и ацетаты полиэтиленгликолей и т. д. и из них предпочтительны бензилбензоат и бензиловый спирт, особенно бензилбензоат.
Единственным требованием для такого органического растворителя является то, что он должен быть фармацевтически приемлемым и соль полиэфира с пептидным лекарственным средством должна растворяться в нем. Как в случае единственного такого растворителя, так и в случае нескольких растворителей, пригодность их можно определить легко в простом эксперименте. Гомо- и сополимеры молочной и гликолевой кислот относятся к наиболее полярным и липофобным полиэфирам и поэтому они не будут растворяться в таких органических растворителях для инъекций, как этилолеат, растительные масла и другие липофильные носители, но гомо- и сополимеры на основе липофильных мономеров или со-мономеров или на основе липофильных гидроксикислот, таких как гидроксистеариновая кислота, растворимы в таких липофильных носителях для инъекций.
Отношение пептидного лекарственного средства к полиэфиру в твердых веществах, которые растворяются с образованием раствора-композиции данного изобретения, будет естественно варьировать согласно силе пептидного лекарственного средства, природе применяемого полиэфира и желательному периоду выделения пептидного лекарственного средства.
Предпочтительный уровень введения в препарат пептидного лекарственного средства - 0,1 - 30% (вес/об). Как правило, оптимальная загрузка лекарственного средства зависит от мол. массы полиэфира и его молекулярно-массового распределения, желаемого периода выделения и силы пептидного лекарственного средства. Очевидно, что для лекарственных средств относительно низкой силы действия могут требоваться более высокие уровни включения.
Поглощение воды композицией является важным фактором в контролировании скорости гидролитического расщепления полиэфира и скорость поглощения воды до некоторой степени определяется содержанием /загрузкой/ лекарственного средства в композиции. Так, в случаях, когда требуется относительно быстрое выделение лекарственного средства в течение относительно короткого периода времени, скажем, трех месяцев, загрузка лекарственным средством может составлять до 30%.
Мономерный состав сополиэфира, например, отношение лактида к гликолиду в лактид-гликолидных полиэфирах, также важен в определении скоростей разрушения полиэфира и выделения пептидного лекарственного средства. Продолжительность выделения также может быть частично определена по среднемассовой мол. массе полиэфира, но количество пептидного лекарственного средства, которое может быть включено в соль лекарственного средства с полиэфиром, определяется среднечисловой мол. массой. Т.е. полидисперсность /отношение среднемассовой мол. массы к среднечисловой мол. массе/ представляет собой важный параметр.
Так, для продолжительности выделения пептидного лекарственного средства от 1 до 4 месяцев предпочтительны композиции, содержащие полиэфиры среднемассовой мол. массы от 4000 до 20000 с полидисперсностями от 1,2 до 2,2, и содержанием пептидного лекарственного средства от 0,1 до 30%. Как правило, чем ниже загрузка лекарственного средства, тем меньшая среднемассовая мол. масса и тем более высокая полидисперсность полиэфира требуются. Для более длительных периодов выделения, скажем, от 2 до 6 месяцев, предпочтительны загрузки пептидным лекарственным средством от 0,1 до 20% и полиэфиры, имеющие среднемассовые мол. массы от 8000 до 20000 и полидисперсности от 1,5 до более 2,2. Для периодов выделения более 6 месяцев предпочтительны загрузки пептидным лекарственным средством от 0,1 до 10% полиэфиры, имеющие среднемассовые мол. массы от 20000 до 50000 и полидисперсности более 1,8.
Уровень включения общего количества пептид-полиэфирной соли в композицию данного изобретения будет естественно варьировать в зависимости от силы пептидного компонента, желательного периода выделения пептидного лекарственного средства, растворимости всех твердых веществ в выбранном растворителе и объема и вязкости растворенной композиции, которую собираются вводить.
Вязкость растворенной композиции данного изобретения определяется мол. массой полиэфира и загрузкой пептидного лекарственного средства. Как правило, растворы, содержащие более 40% твердых веществ /вес/объем/ /пептидное лекарственное средство/ полиэфирная соль, свободное лекарственное средство, свободный полиэфир/, в которых полиэфир имеет среднемассовую мол. массу более 8000, трудно вводит инъекцией вследствие их вязкости. Для этих полиэфиров предпочтительны 40% растворы /или менее 40%/. Для композиций в виде растворов, содержащих полиэфиры со среднемассовой мол. массой от 8000 до 20000, предпочтительны концентрации 30% или менее, а для композиций, содержащих полиэфиры с мол. массой от 20000 до 50000, предпочтительны концентрации 20% или менее (вес/об). В некоторых случаях, например, если нужно инъецировать композицию при помощи очень тонкой иглы, могут быть предпочтительными растворы с низкой вязкостью, и концентрация может быть уменьшена до 2% (вес/об) или даже менее, но, конечно, должен быть баланс между уменьшением вязкости и увеличением объема, требуемого для инъекции.
Согласно следующему аспекту изобретения, обеспечен способ приготовления композиции изобретения, который предусматривает:
1. Растворение указанной смеси основного пептидного лекарственного средства и полиэфира в фармацевтически приемлемом растворителе; или
2. Медленное добавление раствора пептидного лекарственного средства в 1-6C-алканоле к раствору полиэфира в растворителе, пригодном для инъекции, после чего если гидроксильный растворитель фармацевтически неприемлем для инъекции, его удаляют выпариванием, или если гидроксильный растворитель фармацевтически приемлем для инъекций, его удаление не является необходимым.
Сообщенную смесь основного пептидного лекарственного средства и полиэфира, примененную в способе 1 выше, получают предпочтительно растворением основного пептида и полиэфира в растворителе или смеси растворителей, которые способны растворять как основное пептидное лекарственное средство, так и полиэфир, и которые могут быть высушены вымораживанием. Подходящими примерами таких растворителей или смесей растворителей являются ледяная уксусная кислота и смеси диоксана и воды, которые затем высушиваются вымораживанием. Альтернативно два компонента могут быть растворены, например, в диметилсульфоксиде, который затем удаляется.
Сообщенная смесь может быть также получена растворением пептидного лекарственного средства в гидроксильном растворителе, например метаноле, и добавлением этого раствора к раствору полиэфира, например, в дихлорметане, с последующим удалением растворителей, например, выпариванием.
Альтернативно водный раствор пептидного лекарственного средства в виде хлорида может быть добавлен к водному раствору или дисперсии натриевой соли полиэфира. Смесь высушивают вымораживанием и получают смесь соли пептидного лекарственного средства с полиэфиром и хлорида натрия. Последний может быть удален, если нужно, путем смешивания продукта в органическом растворителе и отфильтровывания нерастворимого хлорида натрия.
В способе 1 растворение смеси в фармацевтически приемлемом растворителе может быть ускорено нагреванием и/или перемешиванием реакционной смеси.
В способе 2 пригодным спиртовым растворителем для пептида является, например, метанол, этанол или пропилен-1,2-диол.
Основным преимуществом фармацевтических пептидных лекарственных продуктов в форме растворов соли полиэфира с пептидным лекарственным средством, иногда содержащих свободное лекарственное средство и/или свободный полиэфир, является то, что приготовление препарата инъецируемого продукта в стерильной форме для непосредственного применения без необходимости смешивания перед введением в больного можно проводить при помощи стериального фильтрования. Это значительно более простая операция, чем стерилизация твердого или суспензионного продукта. Альтернативным способом приготовления стериальных инъецируемых растворов является растворение стериальной полиэфир-пептидной соли, иногда содержащей свободное лекарственное средство и/или/ свободный полиэфир в фармацевтически приемлемом органическом носителе, пригодном для инъекций.
Хотя первично эти препараты предназначены для парентеральных путей введения, соли полиэфира с лекарственными средствами можно применять также в приготовлении перорально вводимых препаратов.
Совершенно другим типом препарата, который может быть имплантирован подкожно, является система доставки лекарственного средства, основанная на имплантатах или смесях различных типов имплантата. Они могут быть приготовлены из полиэфирпептидных солей изобретения, иногда содержащих свободное лекарственное средство и/или свободный полиэфир, при помощи обычных способов обработки полимеров путем плавления, таких как /но не только/ экструзия и прессование в формах и инжекционное прессование, при которых применяют повышенные температуры /предпочтительно менее 100oC/ для расплава полиэфирпептидной соли в препарате имплантата. Приготовление таких имплантатов можно проводить при асептических условиях или альтернативно конечной стерилизацией облучением /но не только/ γ- или X-лучами - /рентгеновскими лучами/. Эти твердые лекарственные формы могут быть превращены в форму микрочастиц измельчением или размалыванием. Предпочтительные размеры частиц находятся в диапазоне от 1 мкм до 500 мкм. Эти системы доставки в виде микрочастиц /которые не являются ни микросферами, ни микрокапсулами/ можно суспендировать в подходящем общепринятом фармацевтически приемлемом носителе для инъекций.
Обработка с расплавлением соли полиэфира с пептидным лекарственным средством воплощает в себе и иллюстрируют наиболее значительное и важное различие между физико-химическими и термодинамическими свойствами пептид-полиэфирных солей данного изобретения и свободных пептидов и их простых солей. Пептид-полиэфирные соли данного изобретения во многих случаях расплавляются и становятся текучими в противоположность свободным пептидам и их простым солям, таким как хлориды и ацетаты, которые не расплавляются, а разрушаются при повышенной температуре.
Деградация полиэфиров отчасти зависит от их мол. массы и полидисперсности. Очевидно, для того чтобы произошла деградация в основном гидролитическим расщеплением эфирных групп, полиэфир или содержащая его фармацевтическая композиция должны поглотить воду. Для систем, в которых контролирующие высвобождение матрикс или мембрана содержат во всем объеме или в части его пептид-полиэфирную лекарственную соль, матрикс или мембрана будут поглощать больше воды, чем один полиэфир. В результате сплошные фазы матрикса или мембраны, содержащие полиэфир-пептидную соль, будут разрушаться не так, как фазы матрикса или мембраны, содержащие только полиэфир. Понятно также, что скорость диффузии воды или физиологических жидкостей в такой контролирующий высвобождение полиэфирный матрикс или в такую мембрану будет отчасти контролировать скорость деградации. Диффузия воды или физиологических жидкостей зависит также от размеров и формы препарата, поэтому выделение лекарственного средства из композиций, содержащих полимерные соли полипептидов и полиэфиров, также зависит от этих факторов.
Особенный интерес в качестве полиэфирного компонента пептид-полиэфирных солей данного изобретения представляют собой полиэфиры на основе гомо- и сополимеров молочной и гликолевой кислот, в которых молочная кислота может присутствовать в одной или обеих оптически активных формах или в виде рацемической смеси. Полиэфиры этого общего типа были известны в течение многих лет и изучались детально во множестве систем доставки с контролируемым высвобождением лекарственного средства /см., например, "Controlled Release of Bioactive Agents from Lactide/Glycolide Polymers", by D.H. Lewis in "Biodegradable Polymers as Ohig Delivery Systems". ed. M. Chasin and R. Langer , Marcel Dekker, и ссылки на них/.
Например, US Patent N 3773919 указывает, что могут быть приготовлены фармацевтические препараты с контролируемым выделением из лактидных полиэфиров и лактидных сополиэфиров, содержащие антимикробные полипептиды. Однако описанные антимикробные пептиды неприемлемы для образования соли полиэфира, т. к. они существуют либо в виде сульфатов, либо имеют другие признаки, которые ингибируют или предотвращают образование полиэфир-пептидной лекарственной соли. Действительно, если следовать примерам, приведенным в этом патенте, то видно, что смешивание пептидного лекарственного средства, независимо от его природы, с полимером при указанной повышенной температуре приводит к катастрофическому разрушению пептидного лекарственного средства.
Подобным образом в EP N 25698 описан антимикробный полипептид колистин в качестве одного из многих перечисленных соединений, которые могут якобы быть приготовлены в сочетании с полилактидом. Но опять-таки это соединение имеет структурные черты, которые предотвращают образование соли с концевыми карбоксигруппами полиэфира. Колистин применяют фармацевтически только в виде натриевой соли колистинсульфата или колистинсульфометата, ни одна из которых не позволяет приготовить амфипатические соли полиэфиров в соответствии с данным изобретением. Как уже было упомянуто ранее, EP N 52510, 58481, 145240 и 190833 описывают также применение полипептидов с биодеградируемыми полимерами на основе гомо- и сополимеров молочной и гликолевой кислот.
Хотя сополимеры молочной и гликолевой кислот были известны в течение многих лет, сложность их структуры в отношении распределения со-мономерных единиц и их последовательности /серии одной и той же индивидуальной со-мономерной единицы в сополимере, которые не являются беспорядочными/ и влияние таких структурных вариаций при использовании в качестве матриксов для выделения лекарственного средства в прежних исследованиях в значительной степени игнорировались.
Для иллюстрации этой точки зрения US Patent N 3773919 описывает некоторые препараты с контролируемым выделением лекарственного средства, содержащие 50/50 сополиэфиры молочной и гликолевой кислот, которые растворимы в бензоле, и фактически этот патент специфически ограничивается /в отношении сополимеров молочной и гликолевой кислоты/ теми, которые растворимы в бензоле. Применимость этих растворимых в бензоле сополиэфиров подтверждается далее их специфическим применением в EP N 52510. Однако ранее в US Patent N 2703316 описаны 50/50 лактид/гликодиные сополиэфиры, которые нерастворимы в бензоле. Поскольку эти два патента US имеют один источник /du Pont/, можно предположить, что в изобретении, заявленном в более позднем из этих патентов, нерастворимые в бензоле сополимеры были в некотором отношении хуже, чем растворимые в бензоле. Эта точка зрения подтверждается EP Patent N 52510, который применял только растворимые в бензоле сополимеры Patent N 3773919.
Прежние исследования, за исключением нашего собственного патента EP Patent N 58481, игнорировали влияние, которое структура сополиэфиров молочной и гликолевой кислот оказывала на их растворимость и деградируемость. Мы показали, что для полиэфиров с близкими мол. массами и молекулярно-массовым распределением следующая общая зависимость применима в большинстве случаев для полиэфиров, которые растворимы в хлороформе при 25oC, а именно: нерастворимые в бензоле полиэфиры деградируют быстрее, чем полиэфиры, которые набухают, но не растворяются в бензоле, и такие набухаемые в бензоле полиэфиры деградируют быстрее, чем легко растворимые в бензоле полиэфиры, при проведении эксперимента по деградации в водных физиологических жидкостях или в буфере при pH 7,4 при 37oC. В результате особенно выгодно применять полиэфиры, нерастворимые в бензоле, для обеспечения непрерывного выделения пептидов из парентеральных препаратов в течение относительно короткого периода времени, скажем, от одной недели до двух месяцев.
Так, для композиций, содержащих от 0,1% (вес/об) до 75% пептида, в отношении полиэфирного состава, его взаимосвязи со структурой, вязкости и полидисперсности имеет силу следующее:
Для приготовления пептид-полиэфирных лекарственных солей, которые могут быть получены в соответствии с данным изобретением, обеспечивающих непрерывное выделение лекарственного средства в течение периода от недели до двух месяцев, молярный состав таких нерастворимых в бензоле полиэфиров, имеющих предпочтительно нормальную или широкую полидисперсность, предпочтительно лежит в диапазоне от 60% гликолевой кислоты (или гликолида)/40% молочной кислоты (или лактида до 25% гликолевой кислоты (или гликолида)/75% молочной кислоты (или лактида). Такие полиэфиры предпочтительно имеют характеристическую вязкость от 0,08 до 4,0 дл/г при 1% (вес/об) в хлороформе при 25oC.
Путем выбора подходящих параметров полиэфира, в том числе мол. массы и молекулярно-массового распределения, можно также получить непрерывное выделение полипептидов в течение периода от одной недели до двух месяцев из препаратов, приготовленных согласно данному изобретению из гомополимера полимолочной кислоты или сополимеров, имеющих молярный состав от 35% гликолевой кислоты (или гликолида)/65% молочной кислоты (или лактида) до 10% гликолевой кислоты (или гликолида)/90% молочной кислоты (или лактида), которые растворимы в бензоле, имеют характеристическую вязкость от 0,08 до 0,5 дл/г при 1% в хлороформе при 25oC и имеют полидисперсность от узкой до широкой.
Непрерывное выделение пептидов в течение относительно более длительного периода времени, скажем, от 2 до 6 месяцев, из препаратов данного изобретения может быть достигнуто с применением гомополимера или сополимеров полимолочной кислоты, имеющих молярный состав от 35% гликолевой кислоты (или гликолида)/65% молочной кислоты (или лактида) до 0% гликолевой кислоты (или гликолида)/100% молочной кислоты (или лактида), которые растворимы в бензоле, имеют характеристическую вязкость от 0,08 до 0,8 дл/г при 1% (вес/об) в хлороформе при 25oC и имеют полидисперсность от узкой до широкой.
Непрерывное высвобождение пептидов в течение очень длительного периода времени, скажем, до 2 лет, из препаратов данного изобретения может быть достигнуто с применением гомополимера полимолочной кислоты или сополимеров, имеющих молярный состав от 25% гликолевой кислоты (или гликолида)/75% молочной кислоты (или лактида) до 0% гликолевой кислоты (или гликолида)/100% молочной кислоты (или лактида), которые растворимы в бензоле, имеют характеристическую вязкость от 0,2 до 4,0 дл/г при 1% (вес/об) в хлороформе при 25oC и полидисперсность от нормальной до широкой.
Рассчитанное во времени или пульсирующее выделение /с индукционным периодом перед выделением/ или прерывистое выделение (когда имеется начальная фаза выделения, после которой следует период без выделения или с неэффективным выделением с последующей второй фазой выделения) в течение относительно короткого периода времени, скажем, до 2 месяцев, может быть достигнуто с применением препарата данного изобретения, приготовленного из нерастворимых в бензоле полимеров, которые имеют молекулярно-массовое распределение от узкого до наиболее вероятного и характеристическую вязкость от 0,3 до 4,0 дл/г при 1% (вес/об) в хлороформе при 25oC.
Еще одной чертой данного изобретения, которая является новой и отличает данное изобретение от всех других, описавших систему доставки с контролируемым выделением лекарственного средства, основанную на полиэфирах или сополиэфирах, и которая далее контролирует скорость выделения, является уровень включения пептида в виде полиэфирной соли /иногда в присутствии свободного лекарственного средства и/или свободного полимера/. Эта еще одна контролирующая черта отличается полностью от тех параметров, которые приводят к повышенной скорости в более обычных системах доставки на основе полиэфиров, которые предназначены для доставки высоколипофильных лекарственных средств, имеющих относительно низкую растворимость в воде, таких как стероиды. В таких случаях по мере увеличения уровня включения лекарственного средства обычно наблюдается повышенная скорость выделения его, даже при уменьшении поглощения воды в таких системах, что обусловлено увеличенным фазовым объемом липофильного лекарственного средства. Фактически такие повышенные скорости выделения лекарственных средств, таких как стероиды, зависят от сохранения ими их термодинамической идентичности и от кинетики простой диффузии Фика /см. Baker and Lonsdale. loc. cet./.
Т. е. для таких лекарственных средств, как стероиды, по мере увеличения загрузки и при условии, что липофильное лекарственное средство имеет некоторую растворимость в липофильном полимере, увеличиваются скорости простой диффузии Фика.
Совершенно иная ситуация, однако, имеет место с продуктами данного изобретения. Сейчас известно, что основной составной частью деградации полиэфиров и сополиэфиров является гидролиз эфирных групп, и скорость, с которой он происходит, зависит от поглощения воды /см. Pitt and Lhong-wei Gu. J. Controlled Release, 4, 283-192 /1987/, Hutchinson and Furr, ibid., 13, 279-294 /1990//. Пептиды гидрофильны и образование их солей с полиэфирами приводит к образованию фазы, содержащей соль полиэфира с лекарственным средством, которая имеет более высокое поглощение воды, чем один свободный полиэфир. Т.е. полиэфирная цепь в соли может деградировать быстрее, чем свободный полиэфир, который имеет сходные состав, мол. массу и полидисперсность. Поскольку выделение пептида сильно зависит от деградации, выделение определяется отчасти как уровнем включения полиэфир-пептидной лекарственной соли в композицию, так и долей пептида в соли. Для полиэфиров и сополиэфиров одного и того же состава и одной и той же структуры увеличение одного из этих двух параметров приводит к увеличенным скоростям выделения и по существу может уменьшать в некоторых случаях периоды времени, в течение которых происходит выделение лекарственного средства. Уровни включения пептидного лекарственного средства либо в виде полиэфир-пептидной соли, либо в виде полиэфир-пептидной соли в комбинации со свободным пептидом предпочтительно лежат в диапазоне от 0,1% (вес/вес) до 75% в препарате полиэфир-лекарственное средство.
Загрузка пептидным лекарственным средством в композиции данного изобретения и ее вариации в отношении мол. массы и полидисперсности полиэфира являются следующими. Для непрерывного выделения пептида в течение очень длительных периодов времени, скажем, до 2 лет, предпочтительны низкие уровни включения лекарственного средства, от 1,0% до 20% (вес/вес) при применении полиэфиров, имеющих предпочтительно среднемассовую мол. массу 20000 Да и более и полидисперсности более 2,2 и предпочтительно более 3,5. Эти параметры для очень длительных периодов выделения зависят также частично от других свойств внутри лекарственного препарата, таких как состав в отношении содержания со-мономера, структура, растворимость/нерастворимость в бензоле и геометрии и размеры лекарственной формы. Полиэфир со среднемассовой мол. массой около 20000 имеет характеристическую вязкость приблизительно 0,2, в зависимости от таких факторов как его структура, состав и полидисперсность. Для непрерывного выделения в течение относительно больших периодов времени, скажем, до 6 месяцев, предпочтительными уровнями включения пептидного лекарственного средства являются 0,5 - 35% (вес/вес) при применении полиэфиров или сополиэфиров, имеющих среднемассовые мол. массы предпочтительно 10000 Да или более и полидисперсности более 1,8 или предпочтительно более 2,2, зависящие от всех других параметров, такие как состав, структура, растворимость/нерастворимость в бензоле, геометрия и размеры лекарственных форм.
Для непрерывного выделения в течение относительно коротких периодов времени, скажем, до 2 месяцев, предпочтительны уровни включения пептидного лекарственного средства от 0,1% до 75% (вес/вес) при применении полиэфиров, имеющих предпочтительно среднемассовые мол. массы 2000 Да или более и полидисперсности более 1,2, и они зависят от всех других параметров, таких как состав, структура, растворимость/нерастворимость в бензоле, геометрия и размеры лекарственных форм.
Дополнительным параметром, который также контролирует выделение пептидного лекарственного средства из препарата в соответствии с данным изобретением и который отсутствовал в системах доставки прежнего типа, основанных на гомо- и сополимерах молочной и гликолевой кислоты, является функциональность пептида, т.е. количество основных групп, таких как остатки аргинина и лизина в молекуле пептидного лекарственного средства, и функциональность полиэфира или сополиэфира, т. е. среднее число карбоксигрупп, содержащееся в средней полимерной или сополимерной цели. Как правило, для непрерывного выделения пептидного лекарственного средства, чем больше уровень таких полифункциональных взаимодействий в пептид-полиэфирном полиэлектролитном комплексе, тем большая полидисперсность требуется. В противоположность этому для прерывистого или пульсирующего выделения предпочтительна полидисперсность менее 2,2.
Один из относительно редких случаев взаимной совместимости или растворимости двух типов полимеров, имеющих разные химические структуры, представлен смесями полиэфиров на основе гомо- и сополимеров молочной и гликолевой кислот с низкомолекулярными полиоксиэтиленами и, в частности, низкомолекулярными полиэтиленгликолями. Эта совместимость привела к хорошему эффекту в приготовлении полиэфир-пептидных лекарственных солей в данном изобретении новым и неожиданным образом. Так, известно, что определенные фармакологически активные пептиды могут быть конъюгированы с полиэтиленгликолем или алкоксиполиэтиленгликолем таким образом, что при этом сохраняется фармакологическая активность пептида. Присутствие закрепленной пептидной молекулы конъюгированной полиоксиэтиленовой цепи делает закрепленный пептид частично совместимым с полиэфиром или сополиэфиром.
Таким образом, при условии, что оставшиеся остатки лизина или аргинина в таком закрепленном пептиде находятся в виде солей слабых кислот, эта совместимость облегчает приготовление полиэфир-пептидной лекарственной соли, а также добавляет еще один элемент контроля выделения пептида. Фармакологически активные конъюгаты пептидов с другими водорастворимыми полимерами, такими как полисахариды, синтетические полипептиды и поливинилпирролидон, также применимы, но менее предпочтительны, т.к. ни один из этих последних водорастворимых полимеров нерастворим и несовместим с полиэфиром или сополиэфиром.
Данное изобретение предпочтительно применимо к фармакологически активным лекарственным средствам, имеющим основную функциональность /основные группы/. Однако оно может быть также применимо к пептидам, которые фармакологически активны и являются либо нейтральными, либо имеют тенденцию существовать в значительной степени в виде полианионов /полипептиды, имеющие избыток карбоксигрупп/.
В первом из этих случаев /фармакологически активный нейтральный полипептид, не содержащий ни кислых, ни основных остатков/ применяют соль синтетического полипептида, содержащего основную группу и фармакологически неактивного, и полиэфира. Такая соль фармакологически неактивного синтетического полипептида и полиэфира или сополиэфира также амфипатична и поэтому может действовать как диспергирующий агент для солюбилизации или коллоидного диспергирования фармакологически активного, но нейтрального пептида в органической фазе.
Во втором из этих случаев /фармакологически активный пептид содержит карбоксигруппы/ применяют соль синтетического пептида, имеющего по меньшей мере две основные группы в синтетической полипептидной цепи, который фармакологически неактивен, и полиэфира или сополиэфира. Во втором случае в соли синтетического полипептида и полиэфира концентрация основных функциональных групп в соли больше, чем концентрация карбоксигрупп в кислом фармакологически активном пептиде. Образующийся комплекс солей можно затем солюбилизировать или диспергировать в органическом растворителе или фазе, которая обычно совершенно не растворяет данный пептид, но является растворителем для полиэфира или сополиэфира, как это описано выше для других полиэфир-пептидных солей.
Поскольку соли пептидов, содержащих основные группы, с полиэфирами или сополиэфирами, содержащими карбоксигруппы, являются амфипатическими, их поверхностно-активные свойства могут быть использованы для облегчения диспергирования других гидрофильных лекарственных средств или их суспендирования в воде, в органическом растворителе или в фазе, содержащей полиэфир-пептидную соль. Применение таких амфипатических солей пептидов с полиэфирами или сополиэфирами в качестве диспергирующих или солюбилизирующих агентов является следующим аспектом данного изобретения.
Изобретение иллюстрируется, но не ограничивается следующими примерами.
Примеры
Измерения вязкости и их связь со среднемассовыми и среднечисловыми мол. массами обсуждаются в Sorensen and Campbell. "Preparative Methods of Polymer Chemistry", 2nd edition, 1968. Interscience Division of John Wiley, pp. 43-50.
В примерах, описанных ниже, применяют Ubbelohde вискозиметр, дающий время течения для одного хлороформа, равное 100 с. Хлороформ использовали в качестве растворителя, т.к. он является растворителем как для растворимых в бензоле, так и для нерастворимых в бензоле полимеров в описанном диапазоне композиций.
Мол. масса и молекулярно-массовые распределения полиэфиров, описанных в этой заявке, с мол. массами более 2000 Да определяли гель-хроматографией по отношению к полистироловым стандартам, с применением 3 х 30 см PL Jel, 10 мкм смешанных B колонок /Polymer Laboratories, Church Stretton, Shropshire, UK/, соединенных последовательно и снабженных 10 мкм guard колонкой. В качестве растворителя использовали тетрагидрофуран при 40oC со скоростью тока 1 мл/мин. Характеристики мол. масс рассчитывали при помощи Data Analysis Package Perkin-Elmer 7700 Professional Computer с математическим обеспечением GPC.
Для измерения мол. масс менее 2000 Да гель-хроматография /гель-фильтрация/ не является предпочтительным способом определения мол. массы и вместо нее можно применять потенциометрическое титрование, получая либо мол. массу, либо эквивалентную массу полиэфира прямым измерением содержания карбоксигрупп полиэфира или сополиэфира. Неводные потенциометрические титрования, как правило, проводили с применением известного веса полиэфира или сополиэфира, растворенного в ацетоне, содержащем 10% (об/об) воды. Титрования проводили с применением растворов гидроксида натрия на оборудовании, снабженном радиометром /Copenhagen, Denmark/. Он состоит из титратора /TTT 80/ и автобюретки (ABU 80/, pH-метра /PHM 83/ и электрода Russell CMAWK. Титрование было выражено в виде графика на Serrograph /REC 80/ и мол. масса полимера равна
где w - вес /масса/ применяемого полимера,
f - среднее число карбоксигрупп на цепь полимера,
v - объем применяемого гидроксида натрия,
n - нормальность применяемого гидроксида натрия.
Пример 1
Ацетат госерелина /100,6 мг, эквивалентно приблизительно 86 мг пептида в виде свободного основания/ и 50/50% (молярных) сополимера D, L-лактида/гликолида /300,3 мг/, содержащего одну концевую карбоксигруппу на цепь полимера и имеющего среднемассовую мол. массу 4300 Да и характеристическую вязкость 0,08 дл/г при 1% (вес/об) в хлороформе при 25oC и нерастворимого в бензоле, растворяли в не содержащей ангидрида ледяной уксусной кислоте /3 мл/. Раствор в уксусной кислоте лекарственного средства и полимера добавляли каплями к жидкому азоту и замерзшие капельки высушивали вымораживанием в течение 24 ч под высоким вакуумом. Высушенный вымораживанием продукт досушивали при 50oC в течение 24 ч под вакуумом, получая смесь полиэфира и лекарственного средства, содержащую номинально приблизительно 25% (вес/вес) ацетата госерилина /эквивалентно приблизительно 22,3% (вес/вес) пептида в виде свободного основания/.
Высушенную смесь полиэфира с лекарственным средством /400 мг/ добавляли к дихлорметану и доводили до 4 мл. Сначала получали мутную коллоидную смесь, но в течение часа она постепенно прояснялась с образованием прозрачного раствора. Этот раствор был отлит в виде пленки и его высушивали при комнатной температуре в течение приблизительно 6 ч, а затем 20 часов при 50oC под высоким вакуумом. Таким образом была получена ясная прозрачная пленка, содержащая соль полиэфира и лекарственного средства.
(i) Полученную прозрачную пленку /100 мг/ расплавляли и прессовали в формах при 80oC, получая прозрачную пленку приблизительно 0,02 см толщиной. При погружении в воду при 37oC в течение 24 ч вес гидратированной пленки увеличивался до 225 мг. В противоположность этому, один полиэфир /100 мг/, обработанный таким же образом, увеличивался в весе только до 126 мг, а пленка, содержащая простую смесь ацетата госерелина /25 мг/ и полимера /75 мг/ /полученную добавлением лекарственного средства к раствору полимера в дихлорметане, удалением растворителя и прессованием в формах образующегося материала с образованием пленки толщиной 0,02 см/ весила только 136 мг после 24 ч погружения в воду при 37oC. Их этого эксперимента видно, что композиция соли полиэфира с лекарственным средством значительно более гидрофильна и имеет более высокое поглощение воды, чем один полиэфир или простые смеси лекарственного средства и полиэфира.
В простой смеси лекарственного средства и полимера в дихлорметане лекарственное средство не обнаруживало признаков растворения даже после 1 месяца и при высушивании и прессовании в формах простая смесь образовала непрозрачную пленку. Однако в следующем эксперименте осветленную прозрачную пленку, полученную выше /100 мг/, растворяли в дихлорметане /1 мл/, получая светлый прозрачный раствор полиэфира - лекарственного средства. К этому раствору добавляли трифторуксусную кислоту /50 мкл/ и смесь энергично перемешивали. Происходило осаждение госерелина в виде соли трифторацетата.
Эти два эксперимента показывают, что ясная прозрачная пленка, содержащая соль полиэфира с лекарственным средством, полученную как описано выше, способна процессировать до имеющей форму системы доставки при помощи общепринятого способа изготовления полимерного расплава. Далее, этот продукт действительно не содержит уксусной кислоты или иона ацетата и, следовательно, лекарственное средство должно существовать в форме соли полиэфира. Соль полиэфира с лекарственным средством возникает вследствие того, что концевые группы молочной и гликолевой кислоты на сополимере являются гораздо более сильными кислотами, чем уксусная кислота, и поэтому более слабая уксусная кислота вытесняется полимером. Полимерная карбоновая кислота в растворимой в дихлорметане соли полиэфира и лекарственного средства может, в свою очередь, быть вытеснена гораздо более сильной карбоновой кислотой, такой как трифторуксусная кислота. При этом образуется соль трифторуксусной кислоты и пептида, и если она нерастворима в дихлорметане, она выпадает в осадок.
/ii/ Светлую прозрачную пленку, полученную как описано выше, содержащую соль полиэфира и лекарственного средства, расплавляли, получая пленку толщиной приблизительно 0,02 см. Пленку инкубировали в солевом растворе с буфером /содержащем 0,02% азида натрия/ при pH 7,4 и 37oC. Буферный раствор тестировали периодически при помощи УФ для определения количества выделенного госерелина. Этот расплавленный продукт выделял госерелин непрерывно в течение приблизительно 2 недель и к 3 неделям фактически полностью разрушался и исчезал из инкубационной среды.
Этот эксперимент демонстрирует применимость очень низкомолекулярных нерастворимых в бензоле полимеров для доставки лекарственного средства в течение короткого периода времени.
Подобные отлитые препараты могут быть приготовлены с применением вместо ацетата госерелина либо природных высвобождающих гонадотропин гормонов, либо других мощных синтетических аналогов /агонистов или антагонистов/ высвобождающего гонадотропин гормона, таких как трипторелин, лейпрорелин, бусерелин и нафарелин, предпочтительно в воде солей уксусной кислоты или солей с другими слабыми кислотами; или любого другого полипептидного гормона, контролирующего секрецию интактного гонадотропина или любой из субъединиц гонадотропина.
Пример 2
Прозрачный продукт в виде пленки, полученный в примере 1 /100 мг/, и 50/50% /мол. / D,L-лактид/гликолидного сополимера /1,05 г/, имеющего среднемассовую мол. массу 121000 Да и характеристическую вязкость 0,84 дл/г при 1% (вес/об) в хлороформе при 25oC и нерастворимого в бензоле, растворяли в дихлорметане /100 мл/. Раствор сильно перемешивали при 1000 об/мин /rpm/ и медленно добавляли силиконовое масло /50 мл/ в течение 1 ч для осаждения как соли полиэфира с лекарственным средством, так и свободного полиэфира. По истечении часа частично осажденную смесь соли, свободного полиэфира, силиконового масла и дихлорметана добавляли к интенсивно перемешиваемому гексану /2 л/ для отверждения микрочастиц соли полиэфира с лекарственным средством и свободного полиэфира. Эту смесь перемешивали в течение 2 ч и затем ей давали осесть, после чего выбрасывали гексановый слой. Микрочастицы /содержащие приблизительно 1,95% (в/в) госерелина в виде свободного
основания/ промывали трижды свежим гексаном /500 мл/ и наконец выделяли фильтрованием и сушили при 35oC в течение 24 ч под высоким вакуумом. Средний размер приблизительно сферических полученных микрочастиц, содержащих раствор соли полиэфира и лекарственного средства в свободном полиэфире, был приблизительно 30 мкм.
Часть этого продукта /250 мг/ инкубировали в солевом растворе с фосфатным буфером /содержащим 0,02% азида натрия/ при pH 7,4 и 37oC и буферный раствор тестировали периодически при помощи УФ для определения количества выделенного госерелина. Эти микрочастицы выделяли лекарственное средство приблизительно 5 недель и к 7 неделям практически исчезали из инкубационной среды.
Полимерная композиция, примененная в этом эксперименте, была смесью двух сополимеров одной и той же лактид/гликолидной композиции, но имеющей сильно различающиеся мол. массы. В виде смеси, описанной здесь, она была нерастворима в бензоле, имела среднемассовую мол. массу 108000 Да, полидисперсность 5,1 и характеристическую вязкость 0,72 дл/г при 1% (в/об), в хлороформе.
Эти эксперименты показывают применимость нерастворимых в бензоле полиэфиров с высокой мол. массой и высокой полидисперсностью для выделения госерелина в течение относительно коротких периодов времени 5-7 недель.
Подобные препараты из микрочастиц можно приготовить с применением вместо ацетата госерелина либо природных аналогов высвобождающих гонадотропин гормонов или других мощных синтетических аналогов /агонистов или антагонистов/ высвобождающего гонадотропин гормона, таких как трипторелин, лейпрорелин, бусерелин или нафарелин, предпочтительно в виде солей уксусной кислоты или солей с другими слабыми кислотами; или любого другого полипептидного гормона, контролирующего или модулирующего секрецию интактных гонадотропинов или любой из отдельных субъединиц гонадотропина.
Пример 3
Ацетат госерелина /101 мг, эквивалентно приблизительно 86 мг госерелина в виде свободного основания/ и 100% (мол.) поли-D,L-молочной кислоты /299,7 мг/, растворимой в бензоле, имеющей среднемассовую мол. массу приблизительно 5400 Да, характеристическую вязкость 0,08 дл/г при 1% (в/об) в хлороформе при 25oC и полидисперсность 1,8, растворяли в не содержащей ангидрида ледяной уксусной кислоте /4 мл/. Раствор в уксусной кислоте госерелина и полиэфира добавляли каплями к жидкому азоту, выделяли замерзшие капельки, сушили их вымораживанием под вакуумом в течение 24 ч и затем сушили при 55oC в течение 24 ч под высоким вакуумом.
/i/ Образующийся сухой продукт добавляли к дихлорметану /4 мл/, получая вначале мутную смесь, которая быстро растворялась, давая прозрачный раствор, который отфильтровывали через стерилизующий фильтр из 0,2 мкм найлона.
Этот эксперимент показывает, что растворы полиэфирной соли госерелина можно подвергать стерильному фильтрованию в противоположность смесям и дисперсиям простых солей лекарственного средства в органическом растворе полиэфира. /ii/ Трифторуксусную кислоту /50 мкл/ добавляли к прозрачному раствору в дихлорметане /i/ /1 мл/ при интенсивном встряхивании. Происходило немедленное осаждение госерелина в виде его соли с трифторуксусной кислотой, что свидетельствует о том, что госерелин присутствовал в дихлорметановом растворе в виде соли с полиэфиром, имеющим концевые карбоксигруппы.
Подобные стерильные препараты в виде растворов можно приготовить с применением вместо ацетата госерелина либо природных высвобождающих гонадотропин гормонов или других сильных синтетических аналогов /агонистов или антагонистов/ высвобождающего гонадотропин гормона, таких как трипторелин, лейпрорелин, бусерелин или нафарелин, предпочтительно в виде солей уксусной кислоты или солей с другими слабыми кислотами, либо любого иного полипептидного гормона, контролирующего или модулирующего секрецию интактных гонадотропинов или любой из их индивидуальных субъединиц.
Пример 4
Раствор в дихлорметане госерелин-полиэфира, полученный в примере 3 /2 мл/, разбавляли дихлорметаном до 10 мл. Этот раствор распыляли в интенсивно перемешиваемый гексан /1 л/, получая микрочастицы, которые, после выделения и высушивания в вакууме при 45oC в течение 24 ч, имели размеры от 2 мкм до 30 мкм со средним размером приблизительно 10 мкм. Содержание госерелина этих микрочастиц было эквивалентно приблизительно 22% в виде свободного основания.
Эти микрочастицы инкубировали в солевом растворе, забуференном фосфатом до pH 7,4, при 37oC и супернатант периодически тестировали при помощи УФ на госерелин. Госерелин выделялся непрерывно, высвобождение завершалось к концу 8 недель и к 11 неделям микрочастицы полностью разрушались и исчезали из инкубационной среды. Этот эксперимент показывает применимость растворимых в бензоле полиэфиров с очень низкой мол. массой в обеспечении непрерывного выделения пептида в течение приблизительно 2 недель.
Если ацетат госерелина в описанных выше экспериментах заменяли солью трифторуксусной кислоты, то прозрачный раствор не был получен. Вместо этого раствор полиэфира в дихлорметане содержит в основном дисперсию трифторацетата госерелина. Эта смесь не будет проходить через 0,2 мкм фильтр, поэтому она не может стерильно фильтроваться; такая дисперсия трифторацетата госерелина в растворе полиэфира при распылении ее в перемешиваемый гексан образовывала свернувшуюся и флокколированную массу, а не микрочастицы.
Таким образом, госерелин-полиэфирная соль имеет свойства, которые облегчают получение ее в форме микрочастиц, в противоположность смесям простой соли в растворе полимера с очень низкой мол. массой.
Подобные препараты из микрочастиц можно приготовить с применением вместо ацетата госерелина либо природных высвобождающих гонадотропин гормонов или других сильных синтетических аналогов /агонистов или антагонистов/ высвобождающего гонадоторпин гормона, таких как трипторелин, лейпрорелин, бусерелин или нафарелин, предпочтительно в виде солей уксусной кислоты или солей с другими слабыми кислотами; либо любого другого гормона, контролирующего или модулирующего секрецию интактных гонадотропинов или любой из отдельных субъединиц гонадотропина.
Пример 5
Ацетат госерелина /304 мг, эквивалентно приблизительно 248 мг госерелина в виде свободного основания/ и 100% (мол.) поли (D,L-молочной кислоты) /102 мг/, имеющий среднемассовую мол. массу приблизительно 5400, характеристическую вязкость 0,08 дл/г при 1% /в/об./ в хлороформе при 25oC и полидисперсность 1,8, растворяли в не содержащей ангидрида ледяной уксусной кислоте /2 мл/. Затем раствор в уксусной кислоте госерелина и полиэфира добавляли каплями к жидкому азоту, замерзшие капельки выделяли, сушили вымораживанием под высоким вакуумом в течение 24 ч и затем сушили под вакуумом при 55oC в течение 24 ч.
Образующийся продукт добавляли к дихлорметану /2 мл/, получая мутную коллоидную смесь, которая со временем не осветлялась полностью. Эта смесь в дихлорметане содержала в основном дисперсию ацетата госерелина в госерелин-полиэфирной соли.
Из этой дисперсии ацетата госерелина в дихлорметановом растворе госерелин-полиэфирной соли готовили микрочастицы, содержащие госерелин в количестве, эквивалентном приблизительно 72% (в/в) в виде свободного основания, в которых свободный ацетат госерелина диспергирован в непрерывной фазе госерелин-полиэфирной соли. Микрочастицы готовили распылительной сушкой, сушкой вымораживанием, простым осаждением или коацервацией с разделением фаз.
Подобные препараты в виде микрочастиц можно приготовить с применением вместо ацетата госерелина либо природных высвобождающих гонадотропин гормонов или других очень сильных синтетических аналогов /агонистов или антагонистов/ высвобождающих гонадотропин гормонов, таких как трипторелин, лейпрорелин, бусерелин или нафарелин, предпочтительно в виде солей уксусной кислоты или солей с другими слабыми кислотами; либо любого другого полипептидного гормона, контролирующего или модулирующего секрецию интактного гонадотропина или любой из его отдельных субъединиц.
Пример 6
Сополиэфир D,L-молочной кислоты и гликолевой кислоты с молярным составом 78% D, L-молочной кислоты и 22% гликолевой кислоты готовили сополиконденсацией двух гидроксикислот. После очистки этого сополимера добавлением раствора сополиэфира в ацетоне к метанолу для осаждения сополиэфира и отделения и высушивания осажденного материала сополиэфир имел среднемассовую мол. массу приблизительно 11000 Да, среднечисловую мол. массу /определенную неводным потенциометрическим титрованием и при допущении, что каждая сополиэфирная цепь имеет только дну концевую карбоксигруппу /61000 Да и, следовательно, полидисперсность 1,6 и характеристическую вязкость 0,15 дл/г при 1% (в/об.) в хлороформе при 25oC.
Ацетат госерелина /228,9 мг, эквивалентно приблизительно 200 мг госерелина в виде свободного основания/ и описанный выше сополиэфир /1,8 г/ растворяли в не содержащей ангидрида ледяной уксусной кислоте /10 мл/. Госерелин-полиэфирный раствор добавляли каплями к жидкому азоту и замерзшие капельки выделяли, сушили вымораживанием в течение 24 ч и затем досушивали при 50oC в течение 24 ч под вакуумом.
Высушенную госерелин-полиэфирную смесь добавляли к дихлорметану /10 мл/, получая сначала мутную коллоидную смесь, превращающуся после 24 ч в прозрачный раствор, который можно было фильтровать через стерилизующий фильтр из 0,2 мкм найлона.
При добавлении трифторуксусной кислоты к малой аликвоте этого прозрачного раствора происходило немедленное осаждение госерелина в виде его соли с трифторуксусной кислотой, показывая, что в прозрачном дихлорметановом растворе госерелин присутствовал в госерелин-полиэфирной смеси в основном или полностью в виде полиэфирной соли.
Дихлорметановой раствор госерелин-полиэфирной соли упаривали досуха и полученное твердое вещество сушили при комнатной температуре в течение 6 ч и затем при 55oC в течение 20 ч под вакуумом, получая прозрачную отлитую пленку, содержащую госерелин-полиэфирную соль.
Высушенную госерелин-полиэфирную смесь, приготовленную как описано выше, /1 г/, растворяли в 8 мл дихлорметана. Полученный раствор помещали в 250-миллиметровую многогорловую колбу с круглым дном и продували током азота для удаления всего воздуха и создания не содержащей диоксида углерода атмосферы. Воду /90 мл/, которую предварительно дегазировали для удаления всего диоксида углерода и затем хранили под не содержащим диоксида углерода азотом, вводили в колбу и смесь интенсивно перемешивали при 500 об/мин в атмосфере, в основном не содержащей диоксида углерода. Дихлорметановый раствор госерелинполиэфирной соли быстро диспергировали, давая стабильную дисперсию масло (дихлорметановый раствор соли лекарственного средства с полимером) - в - воде. С сохранением перемешивания приблизительно 200 об/мин постепенно создавали вакуум и основную массу дихлорметана выпаривали под вакуумом, получая дисперсию госерелин-полиэфирной соли в воде. Высушивание вымораживанием этой дисперсии продуцировало микрочастицы, в которых госерелин присутствовал в виде госерелин-полиэфирной соли, имеющие средний размер частиц приблизительно 20 мкм. Микрочастицы выделяли госерелин в течение 6 недель при инкубировании в солевом растворе с фосфатным буфером при pH 7,4 при 37oC. Супернатант периодически тестировали при помощи УФ на госерелин.
Подобные микрочастицы можно также приготовить включением в водную фазу агентов, которые, как известно, улучшают стабильность полипептидов, таких как маннит. Хотя описанный выше способ предпочтительно проводить в не содержащей диоксид углерода атмосфере, можно тем не менее получить удовлетворительные результаты в присутствии следов диоксида углерода, в зависимости от мол. массы полиэфира и загрузки лекарственным средством.
Подобные стерильный раствор, отлитую пленку и препараты микрочастиц можно приготовить подобным образом с применением вместо ацетата госерелина либо природных аналогов высвобождающих гонадотропин гормонов или других очень сильных синтетических аналогов /агонистов или антагонистов/, такие как трипторелин, лейпрорелин, бусерелин или нафарелин, предпочтительно в виде солей уксусной кислоты или солей с другими слабыми кислотами; либо любого другого полипетидного гормона, контролирующего или модулирующего секрецию интактных гонадотропинов или любой из них субъединиц.
Пример 7
Способ, описанный в примере 5, повторяли, получая прозрачную пленку, которую /1 г/ растворяли в дихлорметане /4 мл/.
Раствор подогревали приблизительно до 35oC и затем водный раствор очищенного желатина /15 мг/ в воде /100 мкл/ приблизительно при 40oC добавляли к дихлорметановому раствору госерелин-полиэфирной соли и смесь интенсивно перемешивали при 35oC, получая очень мелкую дисперсию водного раствора желатина в дихлорметановом растворе госерелин-полиэфирной соли. При охлаждении при комнатной температуре сохранялось коллоидная природа суспензии.
Этот эксперимент демонстрирует, что госерелин-полиэфирная соль имеет поверхностно-активные свойства и может быть использована для получения стабильных дисперсий в масляной фазе, например, в дихлорметане, водных растворов других водорастворимых агентов, например желатина, полисахаридов и других гидрофильных полимеров, или наоборот.
Процесс, описанный в примере 6, повторяли с применением дисперсии водного желатина в дихлорметановом растворе описанной выше госерелин-полиэфирной соли, получая продукт из микрокапсул, который содержит как желатин, так и госерелин-полиэфирную соль.
В водную фазу полимера могут быть включены другие низкомолекулярные продукты. В частности, иногда полезно включать соединения, например маннит, которые, как известно, повышают стабильность пептидов. Альтернативно эти стабилизирующие агенты могут быть включены в обе водные фазы комплексной дисперсии вода-в-масле-в-воде, содержащей водный желатин, диспергированный в дихлорметановом растворе госерелин-полиэфирной соли, причем полученная дисперсия вода-в-масле в свою очередь диспергирована в воде.
Подобные препараты суспензий и микрочастиц можно приготовить подобным образом с применением вместо ацетата госерелина других высокоактивных аналогов /агонистов или антагонистов/ высвобождающего гонадотропин гормона, таких как трипторелин, лейпрорелин, бусерелин или нафарелин, предпочтительно в виде солей уксусной кислоты или солей с другими слабыми кислотами; либо любого другого полипептидного гормона, контролирующего или модулирующего секрецию интактных гонадотропинов или любой из их субъединиц.
Пример 8
Ацетат госерелина /771 мг, эквивалентно приблизительно 670 мг госерелина в виде свободного основания/ и 95/5% (мол.) D,L-лактид/гликолидного сополимера /1,8 г/, имеющего среднемассовую мол. массу приблизительно 3600 Да и характеристическую вязкость 0,08 дл/г при 1% (вес/об) в хлороформе при 25oC, и 95/5% (мол.) D,L-лактид/гликолидного сополимера, имеющего среднемассовую мол. массу приблизительно 15000 Да и характеристическую вязкость 0,17 дл/г при 1% (вес/об) в хлороформе при 25oC /4,2 г/ растворяли в не содержащей ангидрида ледяной уксусной кислоте /70 мл/. Объединенные полимеры имеют среднемассовую мол. массу приблизительно 12300 Да и полидисперсность приблизительно 2,6. Госерелин-полиэфирный раствор добавляли каплями к жидкому азоту, замершие капельки выделяли и сушили вымораживанием под высоким вакуумом в течение 18 ч. Продукт в виде смеси лекарственного средства с полимером окончательно досушивали при 55oC в течение 24 ч под высоким вакуумом.
Высушенную смесь /6 г/ добавляли к дихлорметану /60 мл/, получая вначале мутную коллоидную смесь, в течение часа превращающуюся в прозрачный раствор соли госерелин-полиэфир в дихлорметане.
Этот раствор сушили распылительной сушкой при помощи Buchi spray dryer с температурой на входе 60oC и температурой на выходе 35oC, получая приблизительно сферические микрочастицы с диаметром от 1 мкм до 10 мкм.
В этих микрочастицах лекарственное средство присутствует в основном полностью в виде госерелин-полиэфирной соли, т.к. свободная кислота или анион составляет 0,06% или менее, вместо 0,6 - 0,7%, которые требовались бы, если бы госерелин присутствовал в виде ацетата.
Эти микрочастицы при дальнейшей обработке прессованием в формах при 80oC давали прозрачную и хрупкую пленку.
Этот эксперимент показывает применимость пептидных солей с растворимыми в бензоле полиэфирами низкомолекулярных полимеров, иногда с высокой полидисперсностью.
Подобные препараты растворов, микрочастицы и отлитых пленок можно готовить с применением вместо ацетата госерелина либо природных высвобождающих гонадотропин гормонов или других очень сильных аналогов /агонистов или антагонистов/ высвобождающего гонадотропин гормона, таких как трипторелин, лейпрорелин, бусерелин или нафарелин, предпочтительно в виде соли с уксусной кислотой или солей с другими слабыми кислотами; либо любых других полипептидных гормонов, контролирующих секрецию интактивных гонадотропинов или любой из субъединиц гонадотропина.
Пример 9
Ацетат госерелина и другие сильные синтетические агонисты высвобождающего гонадотропин гормона являются средствами химической кастрации, которые применимы в лечении зависимых от гормонов раков, такие как рак предстательной железы у мужчин и предклимактерический рак грудной железы у женщин. Эти лекарственные средства также применимы для лечения незлокачественных гинекологических состояний у женщин и могут подавлять секрецию гонадотропинов гипофизом, что в свою очередь ведет к подавлению половых гормонов, таких как экстраген у женщин и тестостерон у мужчин.
Вследствие этого непрерывное замедленное высвобождение таких лекарственных средств можно оценивать in vivo в нормальных самках крыс, имеющих регулярные эстральные циклы. У этого животного эстральный цикл равен приблизительно 4 дням и наличие цикла обнаруживается присутствием только ороговевших клеток в вагинальных мазках, взятых в день эструса. Если животное подвергают химической кастрации при помощи лекарственного средства, такого как госерелин, то эструс не происходит, что приводит к отсутствию кератинизированных клеток в вагинальных мазках. Животные вступают в длительный период диоэструса, индуцированный химической кастрацией, который поддерживается до тех пор, пока не выделятся эффективные количества лекарственного средства.
/i/ Микрочастицы, полученные в примере 8 /450 г/, диспергировали в воде, содержащей 2% (вес/об) натриевой карбоксиметилцеллюлозы и 0,2% (вес/об) полисорбата 80 и доводили до 3 мл водой. 0,2 мл/эквивалентно 3 мг госерелина в виде свободного основания/инъецировали подкожно в 10 нормальных взрослых самок крыс с регулярной цикличностью и последовавшее действие на экстральную цикличность определяли микроскопическим исследованием вагинальных мазков. Животные вступали в непрерывную диоэстральную фазу, т.е. химическую кастрацию, длящуюся 95 ± 3 дня.
Этот эксперимент показывает, что водный суспензионный препарат госерелин-полиэфирной соли на основе низкомолекулярного растворимого в бензоле полиэфира обеспечивает относительно длительный период контролируемого выделения в течение приблизительно трех месяцев пептидного лекарственного средства, имеющего полупериод жизни только 4-5 ч.
/ii/ Микрочастицы, полученные в примере 8/450 мг/, диспергировали в этилолеате и доводили до 3 мл. Опять по 0,2 мл препарата вводили 6 самкам крыс с регулярной цикличностью путем подкожной инъекции. Животные вступали в непрерывную фазу диоэструса, длящуюся 81 ± 3 дня.
Этот эксперимент показывает, что препарат в виде раствора госерелин-полиэфирной соли в органическом носителе для инъекций, который не является растворителем для одного полиэфира, обеспечивает относительно длительный период контролируемого выделения лекарственного средства.
Пример 10
Ацетат лейпрорелина /50,3 мг/ и сополиэфир, содержащий 78% (мол.) D,L - молочной кислоты и 22% (мол. ) гликолевой кислоты, описанной в примере 6 /453,2 мг/, растворяли в не содержащей ангидрида ледяной уксусной кислоте /5 мл/. Полученный раствор добавляли в виде капель к жидкому азоту, замерзшие капельки сушили вымораживанием под высоким вакуумом в течение 22 ч и сушили далее при 55oC в течение 24 ч под высоким вакуумом.
Образующийся продукт /500 мг/ растворяли в редистиллированном ацетоне /10 мл/ в 100-миллилитровой колбе в круглым дном, получая вначале мутную коллоидную смесь, которая постепенно светлела до прозрачного раствора. Ацетон выпаривали под вакуумом и образующуюся прозрачную пленку сушили при 55oC 4 ч под высоким вакуумом. Эту пленку лейпрорелин-полиэфирной соли перерастворяли в ацетон /10 мл/, раствор дегазировали и затем продували азотом.
Свежедистиллированную воду /200 мл/ перемешивали интенсивно под азотом и ацетоном раствор лейпрорелин /полиэфирной соли распыляли на поверхность перемешиваемой воды. После распыления всего ацетонового раствора перемешивание поддерживали еще в течение часа и затем смеси давали отстояться. Микрочастицы лейпрорелин-полиэфирной соли осаждались, а водный супернатант выбрасывали. Микрочастицы ресуспендировали в следующей порции не содержащей диоксида углерода воды /200 мл/ и суспензию перемешивали под азотом еще в течение часа. Микрочастицы отделяли, давая смеси отстояться и фильтруя осадок для отделения микрочастиц от избытка воды. Микрочастицы сушилил при 30oC в течение 24 ч под высоким вакуумом, получая продукт, который имел средний размер частиц приблизительно 15 мкм.
Этот препарат микрочастиц лейпрорелин-полиэфирной соли инкубировали в солевой растворе, забуференном фосфатом до pH 7,4, при 37oC и супернатант тестировали периодически при помощи УФ на лейпрорелин. Лейпрорелин выделяли непрерывно в течение приблизительно 5 недель, после чего препарат полностью разрушался.
Подобные препараты микрочастиц можно готовить подобным образом с применением вместо лейпрорелина либо природных высвобождающих гонадотропин гормонов или других сильных синтетических аналогов /агонистов или антагонистов/, таких как трипторелин, госерелин, бусерилин или нафаредин, предпочтительно в виде ацетатных солей или солей с другими слабыми кислотами; либо любых других полипептидных гормонов, контролирующих секрецию интактных гонадотропинов или любой из субъединиц гонадотропина.
Пример 11
/i/ Ацетат госерелина /2,28 г эквивалентно приблизительно 2,00 г госерелина в виде свободного основания/ растворяли в не содержащей ангидрида ледяной уксусной кислоте /60 мл/. Смесь двух 95,5% (мол.) сополимеров поли (D, L-молочной кислоты) /полигликолевой кислоты/ /12,6 г сополимера со среднемассовой мол.массой 15846 и полидисперсностью 1,38 и 5,4 г сополимера со среднемассовой мол.массой 3896 и полидисперсностью 1,78/, обеспечивающих избыток концевых карбоксигрупп сополимеров по отношению к основному лекарственному средству, растворяли перемешиванием в не содержащей ангидрида ледяной уксусной кислоте /150 мл/, получая прозрачный раствор. Раствор лекарственного средства добавляли к раствору сополимера и тщательно смешивали. Затем эту смесь добавляли каплями к жидкому азоту для замораживания в виде маленьких гранул и замерзшие капельки высушивали вымораживанием в течение двух дней при помощи Edwards high vacuum freeze drier. Высушенный материал далее сушили при 50-55oC в вакуумной печи в течение 24 ч.
Высушенный продукт /100 мг/ добавляли к дихлорметану /1 мл/, где он полностью растворялся в течение 2 ч, давая прозрачный раствор. Это пример показывает, что образование полиэфир-госерелиновой соли делает лекарственное средство хорошо растворимым, так что оно может растворяться в неполярном растворителе.
/ii/ Ацетат госерелина /2,28 г эквивалентно приблизительно 2,00 г госерелина в виде свободного основания/ растворяли в не содержащей ангидрид ледяной уксусной кислоте /60 мл/. Смесь двух 100% (мол.) полимеров поли (D, L-молочной кислоты) /12,6 г полимера со среднемассовой мол. массой 15178 и полидисперсностью 1,27 и 5,4 г полимера со среднемассовой мол. массой 4,204 и полидисперсностью 1,84/, обеспечивающих избыток концевых карбоксигрупп сополимера по отношению к основному лекарственному средству, растворяли при перемешивании в не содержащей ангидрид ледяной уксусной кислоте /150 мл/ с образованием прозрачного раствора. Раствор лекарственного средства добавляли к раствору полимера и тщательно смешивали и эту смесь, затем добавляли каплями к жидкому азоту для замораживания их в мелкие гранулы. Твердый материал высушивали вымораживанием в упомянутом выше приборе Edwards high под высоким вакуумом и высушенный материал досушивали далее при 50-55oC в вакуумной печи в течение 24 ч.
Высушенный продукт добавляли к дихлорметану /1 мл/ и он полностью растворялся в течение 2 ч, давая прозрачный раствор. Это свидетельствует о том, что образование полиэфиргосерелиновой соли делает лекарственное средство хорошо растворимым, так что оно может растворяться в неполярном растворителе.
/iii/ Ацетат госерелина /2,28 г, эквивалентное приблизительно 2,00 г, госерелина в виде свободного основания/ растворяли в не содержащей ангидрид ледяной уксусной кислоте /60 мл/. Смесь 80/20%/ сополимера поли (D,L-молочной)/гликолевой кислоты/ 12,6 г сополимера со среднемассовой мол.массой 106510 и полидисперсностью 2,27/ и 95/5% (мол.) сополимера поли (D,L-молочной кислоты)/полигликолевой кислоты/ /5,4 г сополимера со среднемассовой мол. массой 3896 и полидисперсностью 1,78/, обеспечивающая избыток концевых карбоксигрупп сополимера по отношению к основному лекарственному средству, растворяли при перемешивании в не содержащей ангидрид ледяной уксусной кислоте /150 мл/ с образованием прозрачного раствора. Затем добавляли раствор лекарственного средства к раствору сополимера и тщательно перемешивали. Смесь добавляли каплями к жидкому азоту, замораживая их до мелких гранул. Твердый материал сушили вымораживанием в течение двух дней при помощи вышеупомянутого прибора Edwards под высоким вакуумом и досушивали далее при 50-55oC в вакуумной печи в течение 24 ч.
Высушенный продукт /100 мг/ добавляли к дихлорметану /1 мл/, где он полностью растворялся с образованием прозрачного раствора. Этот пример показывает, что образование полиэфиргосерелиновой соли делает лекарственное средство хорошо растворимым, так что оно может растворяться в неполярном растворителе.
/iv/ Ацетат госерелина /2,17 г эквивалентно приблизительно 1,90 г госерелина в виде свободного основания/ растворяли в не содержащей ангидрид ледяной уксусной кислоте /60 мл/. Смесь двух сополимеров 67/33% (мол.) поли (D, L-молочной кислоты) /полигликолевой кислоты/ 12,0 г сополимера со среднемассовой мол. массой 35833 и полидисперсностью 1,83 и 5,15 г полимера со среднемассовой мол. массой 4116 и полидисперсностью 1,86/, обеспечивающая избыток концевых карбоксигрупп полимера по отношению к основному лекарственному средству, растворяли при перемешивании в не содержащей ангидрида ледяной уксусной кислоте /150 мл/ с образованием прозрачного раствора. Раствор лекарственного средства добавляли к раствору сополимера и тщательно смешивали. Затем эту смесь добавляли каплями к жидкому азоту для замораживания их в мелкие гранулы. Твердый материал сушили вымораживанием в течение двух дней при помощи вышеупомянутого прибора Edwards под высоким вакуумом и досушивали при 50-55oC в вакууме печи в течение 24 ч.
Высушенные продукт /100 мг/ добавляли к дихлорметану /1 мл/, где он полностью растворялся в течение 10 мин, давая прозрачный раствор. Этот пример показывает, что образование полиэфир-госерелиновой соли делает лекарственное средство хорошо растворимым, так что оно может растворяться в неполярном растворителе.
Сравнительный пример
Ацетат госерелина /2,28 г эквивалентно приблизительно 2,00 г госерелина в виде свободного основания/ растворяли в не содержащей ангидрида ледяной уксусной кислоте /60 мл/. Сополимер 50/50% (мол.) поли (D,L-молочной кислоты) /полигликолевой кислоты/ 18,0 г полимера со среднемассовой мол. массой 22307 и полидисперсностью 2,07/, обеспечивающий приблизительно стехиометрический эквивалент концевых карбоксигрупп сополимера по отношению к основному лекарственному средству, растворяли при перемешивании в не содержащей ангидрида ледяной уксусной кислоте с образованием прозрачного раствора. Раствор лекарственного средства добавляли к раствору сополимера и интенсивно перемешивали. Эту смесь затем добавляли каплями к жидкому азоту для замораживания капель в мелкие гранулы. Твердый материал сушили вымораживанием в течение двух дней в приборе Edwards под высоким вакуумом и досушивали далее при 50-55oC в вакуумной печи в течение 24 ч.
Высушенный продукт /100 мг/ добавляли к дихлорметану /1 мл/ и он не растворялся полностью в течение 4 ч и давал прозрачный раствор после 4 дней. Этот пример показывает, что образование полиэфир-госерелиновой соли, делающее лекарственное средство хорошо растворимым, так что оно может растворяться в неполярном растворителе, происходит более легко, если концевые карбоксигруппы сополимера присутствуют в избытке по отношению к основному лекарственному средству.
Высушенные продукты i-iv растворяли в дихлорметане и сушили распылительной сушкой при помощи Buchi 190 lab scale spray drier в соответствии с таблицей.
Сушка распылением продуктов i-iv дала малые частицы с диаметром приблизительно 1-10 мкм, как определено сканирующей электронной микроскопией. Конечные частицы исследовали на содержание уксусной кислоты при помощи газовой хроматографии с границей детектирования приблизительно 0,03%.
Этим способом в препаратах не была обнаружена уксусная кислота, что демонстрирует, что лекарственное средство присутствует в виде соли с полиэфиром, а не в виде соли уксусной кислоты, т.к. для соли уксусной кислоты можно бы ожидать уровни уксусной кислоты приблизительно 0,5%.
Высушенные распылением частицы /50 мг/ i-iv растворяли в дихлорметане /0,5 мл/ с образованием прозрачного раствора. Добавление одной капли трифторуксусной кислоты к каждому раствору приводило к образованию белого осадка. Пробы центрифугировали для сбора осадков, которые промывали дихлорметаном. HPLC-анализ показал, что осажденный материал представляет собой госерелин. Эти примеры показывают, что лекарственное средство может быть вытеснено из соли лекарственного средства с полиэфиром в растворе в полярном растворителе добавлением сильной кислоты, что вызывает возвращение свойств растворимости лекарственного средства в неполярном растворителе к свойствам, ожидаемым для кислой соли пептидного лекарственного средства /т.е. отсутствие растворимости/.
Пример 12
Высушенные распылением частицы i-iv в примере 11 диспергировали (18% (вес/об) в водном носителе, пригодном для инъекций/ 2% натриевая карбоксиметилцеллюлоза [Fluka, средней вязкости], 0,2% полисорбата 80 [Tween (trade mark), Fluka].
Высушенные распылением частицы из примера 11, диспергированные в носителе для инъекций, описанном выше, инъецировали в 10 самок Wistar - произведенных крыс. Пробы крови брали из хвостов 5 крыс на 7-, 14- и 28 -й дни. Пробы анализировали на госерелин при помощи радиоиммунного анализа с известной специфичностью для этого лекарственного средства и обнаружили отсутствие перекрестной реактивности с метаболитами. Результаты этих экспериментов показали, что этот препарат достигал измеримых уровней в крови госерелина в течение по меньшей мере 4 недель.
Пример 13
Высушенный продукт ii примера 11 диспергировали в следующих водных носителях для инъекций.
a. натриевая карбоксиметилцеллюлоза /средней вязкости, Fluka/ 1,0% и полисорбат 80 /Tween/ 0,75%.
b. метилцеллюлоза /15 мРа. с, Fluka/ 0,75% и полисорбат 80/Tween/ 0,75%.
Эти препараты диспергировались хорошо в этих носителях и были пригодны для парентерального введения.
Пример 14
Высушенный распылением продукт ii примера 11 /400 мг/ растворяли в дихлорметане /4 мл/. Раствор добавляли шприцем к раствору 0,25% поливинилового спирта /PVA/ в воде /Aldrich, 75% гидролизованный, мол. масса 2000/ и перемешивали при 2500 об/мин. После двух мин скорость перемешивания снижали до 800 об/мин и перемешивание продолжали еще 30 мин. Затем перемешивание прекращали и образовавшимся частицам давали осесть. Раствор PVA декантировали, после чего частицы промывали дважды ледяной холодной водой и собирали центрифугированием. Частицы сушили сушкой вымораживанием и конечный продукт представлял собой материал из мелких частиц, содержащих госерелин.
Пример 15
Высушенный распылением препарат iv примера 11 экструдировали при 82oC, получая цилиндрический экструдат с диаметром приблизительно 1 мм. Экструдат разрезали до кусочков с весом приблизительно 36 мг, содержащих приблизительно 3,6 мг госерелина. Экструдат был полностью прозрачным для света, а не белым. Белый цвет типичен для простой смеси лекарственного средства и полимера, полученной без образования соли пептида с полиэфиром / как, например, в коммерчески доступной "Zoladex" depot - "Zoladex" - коммерческий знак/. Прозрачность экструдата указывает, что пептид госерелин совместим с полиэфирной фазой, а не находится в отдельной фазе, что приводило бы к рассеиванию света и белому внешнему виду. Эта совместимость может существовать только, если пептид находится в той же фазе, что и полимер, т.е. он присутствует в виде соли этого полиэфира.
Отдельные депо по 3,6 мг были имплантированы в крыс /21 Wistar-derived/ при анастезии. В последовательных точках времени группы из трех животных убивали и депо извлекали из них. Извлеченные депо растворяли в ледяной уксусной кислоте в мерной колбе и полимер осаждали путем добавления избытка воды. Затем его фильтровали /Millex 0,5 мкм/ и фильтрат анализировали на содержание лекарственного средства при помощи HPLC. Профиль выделения из депо рассчитывали сравнением с содержанием в депо, которые не были имплантированы и которые анализировали в том же самом анализе. Депо соли лекарственного средства с полиэфиром дали пролонгированнное выделение госерелина in vivo в течение периода по меньшей мере 4 недель.
Пример 16
/i/ Лактид /гликолидный сополимер /95/5/ с единственной концевой карбоксигруппой /8,87 г Mw = 5750, полидисперсность = 2,5, мол. масса по титрованию конечной групп = 2516 г/моль, характеристическая вязкость при 1% (вес/об) в хлороформе = 0,10 дл/г/ растворяли в дихлорметане /50 мл/ при перемешивании. К раствору добавляли 1,13 г ацетата госерелина с образованием мутной суспензии. Метанол /5 мл/ добавляли при перемешивании и после 30 мин смесь становилась совершенно прозрачной. Затем удаляли растворитель из раствора ротационным испарением, получая прозрачный твердый материал. Его перерастворяли в дихлорметане /50 мл/ и растворитель опять удаляли ротационным испарением. Стадии перерастворения и удаления растворителя повторяли еще два раза, получая очень вязкую жидкость, которую сушили под высоким вакуумом, получая белую пену. Пену разбивали и сушили под вакуумом еще 24 ч при комнатном температуре, получая мелкий аморфный твердый материал.
/ii/ Способ, описанный в i/ выше, повторяли с применением лактид/гликолидного сополимера /75/25/ с единственной концевой карбоксигруппой /8,87 г, Mw = 10900, полидисперсность = 1,85, мол. масса по титрованию конечных групп = 3210 г/моль, характеристическая вязкость при 1% (вес/об) в хлороформе = 0,14 дл/г, получая мелкий аморфный твердый материал.
Препарат 1
Соль госерелин-лактид/гликолидного полимера из /i/ /1 г/ добавляли к бензилбензоату /99%, ex Janssen, 2 мл/ и нагревали при помощи ручного пистолета с горячим воздухом при перемешивании смеси для растворения твердого вещества. 110 мкл этого препарата в виде раствора содержали 3,6 мг госерелина.
Препарат 2
Готовили, как препарат 1, за исключением того, что растворителем служили смесь /1,7 мл/ 67% бензилбензоата /99%, ex Janssen/ и 33% бензилового спирта/безводный, 99% ex Aldrich/. 100 мкл этого препарата в виде раствора содержали 3,6 мг госерелина.
Препарат 3
Готовили, как препарат 1, за исключением того, что растворителем был бензиловый спирт /1,7 мл, безводный, 99%, ex Aldrich/. 100 мкл этого препарата в виде раствора содержали 3,6 мг госерелина.
Препарат 4
Готовили, как препарат 1, за исключением того, что использовали соль госерелина с лактид/ гликолидным полимером из /ii/ /1 г/ и 3 мл бензилбензоата. 150 мкл этого препарата в виде раствора содержали 3,6 мг госерелина.
Препарат 5
Готовили, как препарат 4, за исключением того, что использовали смесь растворителей препарат 2. 100 мкл этого препарат содержали 3,6 мг госерелина.
Препарат 6
Готовили, как препарат 4, за исключением того, что использовали растворитель препарат 3. 100 мкл этого раствора содержали 3,6 мг госерелина.
Биологическая оценка
Выделение госерелина из препаратов 1-6, описанных выше, in vivo определяли исследованием один раз в день вагинальных мазков получивших дозу препарат самок крыс. Нормальный экстральный цикл /эструс, диоэструс, мет-эструс, про-эструс/ может быть прослежен по отношению различных типов клеток (лейкоцитов, эпителиальных клеток и кератинизированных клеток) в мазке. Если выделение лекарственного средства из препаратов непрерывное, то нормальный эстральный цикл прерывается и крысы остаются в диоэструсе, пока выделение госерелина продолжается.
Препараты 1-6 дозировали группами /n=6/ самок крыс с нормальным эстральным циклом в дозе 3,6 мг госерелина на крысу. Для подкожного дозирования препаратов использовали шприц с иглой калибра 20. В качестве контроля использовали 5 крыс, не получавших препараты. Вагинальные мазки брали ежедневно из этих крыс и исследовали для определения состояния эстрального цикла животных. Были получены следующие результаты:
Номер препарат - Средняя продолжительность диоэструса, дни (± s.e.)
1 - 100 ± 2,7
2 - 120 ± 6,3
3 - 69 ± 5,9
4 - 59 ± 1,2
5 - 61 ± 2,1
6 - 53 ± 3,7
Из этих результатов видно, что все шесть препаратов дали периоды выделения госерелина более 6 недель и что препараты 1 и 2 выделяли госерелин в течение трех или более месяцев. Можно видеть далее из этих примеров, что препараты госерелина-полиэфирной соли могут быть обеспечены в виде растворов, которые можно легко вводить парентерально при помощи иглы малого размера и что такие препараты удобны для лечения гормон-зависимых опухолей у мужчин.
Пример 17
Препарат 1
Готовили, как препарат 1 из примера 16.
Препарат 2
Процесс, описанный в примере 16 /i/, повторяли с применением полилактидного полимера с единственной концевой карбоксигруппой /Mw = 5092, полидисперсность = 1,44, мол.масса по титрованию концевой группы = 2270 г/моль и ацетата госерелина /0,46 г/. Содержание уксусной кислоты этого аморфного твердого вещества определяли газовой хроматографией и оно было равно 0,14%.
Эту соль госерелина и лактидного полимера /1 г/ добавляли к бензолбензоату /99% ex Janssen, 2 мл/ и нагревали при помощи ручного пистолета с горячим воздухом, перемешивая смесь, пока твердое вещество не растворялось. 110 мкл этого препарата в виде раствора содержали 3,6 мг госерелина.
Препарат 3
Лактид/гликолидный сополимер/ 95/5 с единственной концевой карбоксигруппой /7,86 г, Mw = 5750, полидисперсность = 1,50, мол.масса по титрованию концевой группы = 2516 г/моль/ и ацетат госерелина /0,98 г/ растворяли в ледяной уксусной кислоте /100 мл/. Этот раствор замораживали, добавляя каплями к жидкому азоту, с последующим высушиванием вымораживанием в течение 2 дней. Полученный твердый материал сушили еще 24 ч при 40oC. Содержание уксусной кислоты полученного твердого вещества определяли газовой хроматографией и оно было равно 0,17%.
Эту смесь госерелина с лактид/гликолидным сополимером /1 г/ добавляли к бензилбензоату /2 мл, 99%, ex Janssen/ и нагревали при помощи ручного пистолета с горячим воздухом, перемешивали смесь, пока твердое вещество не растворялось. 110 мкл этого препарат в виде раствора содержали 3,6 мг госерелина.
Таким образом, можно видеть, что препарат госерелина в виде полиэфирной соли делает лекарственное средство хорошо растворимым, так что оно может растворяться в липофильных растворителях, таких как бензилбензоат, в которых сам ацетат госерелина нерастворим.
Биологическая оценка
Препараты 1-3 вводили группам /n=10/ самок крыс с регулярным эстральным циклом в дозе 3,6 мг госерелина на крысу, как описано в примере 16. Было обнаружено, что после введения животных вступали в период непрерывающегося диоэструса, что свидетельствовало о непрерывном выделении госерелина. Средняя продолжительность периода диоэструса для каждой группы крыс дана в следующей таблице. Из этой таблицы можно видеть, что все три препарата дали периоды выделения госерелина более 14 недель.
Номер препарата - Средняя продолжительность диоэструса, дни (± s.e.)
1 - 104 /± 5,4/
2 - 99 /± 3,9/
3 - 101 /± 2,8/
Кроме того, из этих примеров можно видеть, что препараты соли госерелина с полиэфиром могут быть приготовлены в виде растворов, которые можно легко вводить парентерально при помощи узкой иглы, и что такие препараты удобны для лечения гормон-зависимых опухолей у мужчин.
Пример 18
Препарат 1
Лактид/гликолидный сополимер /95/5/ с единственной концевой карбоксигруппой /4,5 г, Mw= 6806, полидисперсность = 1,55, мол. масса по титрованию концевой группы = 3027 г/моль, характеристическая вязкость при 1% (вес/об) в хлороформе = 0,108 дл/г/ растворяли в ледяной уксусной кислоте/ 50 мл/. К этому раствору добавляли ацетат госерелина /0,56 г эквивалентно 0,5 г госерелина/ и смесь перемешивали 10 мин, получая прозрачный бесцветный раствор. Его замораживали добавлением каплями к жидкому азоту с последующим высушиванием вымораживанием в течение 2 дней. Полученный твердый материал сушили затем еще 24 ч при 40oC. Содержание уксусной кислоты в полученном материале газовой хроматографией и оно было равно 0,3%.
Эту смесь госерелина с лактид/гликолидным сополимером /1,0 г./ добавляли к безилбензоату /2,0 мл, 99% ex Janssen/ и растворяли с подогревом и перемешиванием. Конечный раствор содержали 3,67 мг госерелина в 110 мкл и содержание госерелина в конечном продукте было 10,0% вес/вес.
Препарат 2
Процесс, описанный выше для препарата 1, повторяли с применением лактид/гликолидного сополимера /95/5/ с единственной концевой карбоксигруппой /4,0 г, Mw = 6011, полидисперсность = 1,56 мол. масса по титрованию концевой группы = 2700 г/ моль, характеристическая вязкость при 1% (вес/об) в хлороформе = 0,099 дл/г/ и ацетата госерелина /1,12 г (эквивалентно 1,0 г госерелина). Содержание уксусной кислоты высушенного вымораживанием твердого материала определяли газовой хроматографией и оно было равно 0,83%. Содержание госерелина конечного продукта было 19,46% вес/вес,
Эту смесь госерелина с лактид/гликолидным сополимером /0,54 г/ добавляли к бензилбензоату/ 2,46 мл, 99%, ex
Janssen/ и растворяли с подогревом и перемешиванием. Конечный раствор содержал 3,5 мг госерелина в 110 мкл.
Препарат 3
Процесс, описанный выше для препарата 2, повторяли с применением 2,1 г лактид/гликолидного сополимера и 1,0 г ацетат госерелина /эквивалентно 0,9 г госерелина/. Содержание уксусной кислоты высушенного вымораживанием твердого материала определяли газовой хроматографией и оно было равно 1,14%. Содержание госерелина конечного продукта было 28,91% (вес/вес)
Эту смесь госерелина с лактид/гликолидным сополимером /0,36 г/ добавляли к бензилбензоату /2,64 мл, 99%, ex Janssen/ и растворяли с подогревом и перемешиванием. Конечный раствор содержал 3,47 мг госерелина в 110 мкл.
Препарат 4
Процесс, описанный выше для препарата 1, повторяли с применением лактид/гликолидного сополимера /95/5/ с единственной концевой карбоксигруппой (8,66 г, Mw = 5604, полидисперсность = 1,71 мол. масса по титрованию концевой группы = 1960 г/моль, характеристическая вязкость при 1% вес /об в хлороформе = 0,094 дл/г), и 1,08 г ацетата госерелина (эквивалентно 0,96 г. госерелина). Содержание уксусной кислоты высушенного вымораживанием твердого материала определяли газовой хроматографией и оно было равно 0,08%. Содержание госерелина конечного продукта было 9,90% вес/вес
Эту смесь госерелина с лактид/гликолидным сополимером /1,0 г/ добавляли к бензилбензоату /2,0 мл, 99% ex Janssen/ и растворяли с подогревом и перемешиванием. Конечный раствор содержал 3,67 мг госерелина в 110 мкл.
Биологическая оценка
Препараты 1-4 вводили группам /n = 9 или 10/ самок крыс с регулярным эстральным циклом в дозе 3,6 мг, госерелина на крысу, как описано в примере 16. Было обнаружено, что после введения животные вступали в период непрерывного диоэструса, что свидетельствовало о непрерывном выделении госерелина. Средняя продолжительность периода диоэструса для каждой группы крыс дана в следующей таблице. Из этой таблице видно, что все три препарата дали период выделения госерелина приблизительно 3 месяца или более.
Номер препарата - Средняя продолжительность диоэструса, дни (± S.e)
1 - 114 ± 1,8
2 - 94 ± 4,6
3 - 97 ± 5,3
4 - 83 ± 4,3
Кроме того, из этих примеров можно видеть, что препараты соли лекарственного средства с полиэфиром можно готовить в виде растворов, которые можно легко вводить парентерально при помощи узкой иглы, и что такие препараты удобны для лечения гормон-зависимых опухолей у мужчин.
Пример 19
Соль госерелина с полиэфиром /ii/ примера 16 (3,75 г) растворяли в дихлорметане /50 мл/, который предварительно фильтровали через фильтр 0,45 мкм. Полученный раствор фильтровали через тефлоновый мембранный фильтр 0,5 мкм (Whatman WTP) в колбу, которую стерилизовали в автоклаве. Растворитель удаляли при помощи роторного испарителя, получая вязкую жидкость, и затем в роторный испаритель впускали воздух через фильтр 0,5 мкм. Вязкую жидкость нагревали и высушивали в вакууме, получая белую пену. Полученную пену взвешивали в автоклавированные пузырьки с гофрированным верхом в камере ламинарного течения и добавляли свежеперегнанные растворители для получения препарата растворов госерелин-полиэфирной соли, которые практически не содержали твердых частиц.
Препарат 1
1 г твердого вещества добавляли к бензилбензоату /перегнанный, т.к. 106oC при 0,3 mb, 3 мл/ и нагревали при помощи пистолета с горячим воздухом до растворения. 145 мкл этого препарата в виде раствора содержали 3,6 мг госерелина.
Препарат 2
1 г твердого вещества добавляли к бензиловому спирту /перегнанный, т.к. 44oC при 0,3 mb, 1,7 мл/ и нагревали пистолетом с горячим воздухом до растворения. 100 мкл этого раствора содержали 3,6 мг госерелина.
Биологическая оценка
Две группы по 10 самок крыс получили подкожно при помощи иглы 20 препараты 1 и 2 в дозе 3,6 мг. на крысу. Пробы крови брали у этих крыс в последовательных временных точка /1 неделя (n = 4), 4 недели и 6 недель (n = 3)/. Пробы крови анализировали на госерелин при помощи радиоиммуноанализа. Измеримые уровни госерелина в крови были обнаружены обоими препаратами, что свидетельствует о том, что препараты в виде растворов привели к пролонгированному выделению лекарственного средства в течение нескольких недель. Профили уровня препарата 1 в крови обнаруживают пик приблизительно при 4 неделях, тогда как препарат 2 дает пик при 1 неделе, после чего уровни госерелина в крови прогрессивно снижаются со временем. Профиль уровня препарата 1 в крови считают более желательным, чем профиль уровня препарата 2, благодаря тому, что более константные уровни получены при применении бензилбензоата в качестве растворителя для этого препарата.
Кроме того, из этих примеров можно видеть, что можно приготовить препараты соли лекарственного средства с полиэфиром в виде растворов, которые можно легко вводить парентерально при помощи узкой иглы, и что такие препараты удобны для лечения гормон-зависимых опухолей у мужчин.
Пример 20
Лактид /гликолидный сополимер/ 95/5/ с единственной концевой карбоксигруппой /9,0 г, Mw = 6011, полидисперсность = 1,56, мол. масса по титрованию концевой группы = 2700 г/моль, характеристическая вязкость при 1% вес/об в хлороформе = 0,099 дл/г. растворяли в дихлорметане /100 мл/. К полученному раствору добавляли ацетат госерелина /1,124 г эквивалентно 1 г госерелина/ при перемешивании с последующим добавлением метанола /10 мл/. Полученную мутную суспензию перемешивали при комнатной температуре в течение приблизительно 1 ч до получения прозрачного раствора. Растворитель удаляли при помощи роторного испарителя, получая прозрачную вязкую жидкость. Ее перерастворяли в дихлорметане и сушили, как выше описано. Эту стадию повторяли еще два раза и полученную в результате вязкую жидкость высушивали под высоким вакуумом, получая белую пену, которую досушивали в течение ночи. Пену разбивали до мелкого порошка, который сушили под вакуумом в течение одного дня при комнатной температуре. К этому порошку добавляли бензилбензоат /20 мл, 99%, ex Janssen/ и образующуюся смесь слегка подогревали при перемешивании, получая раствор.
Биологическая оценка
Этот препарат госерелина в виде раствора вводили подкожно при помощи иглы 20 в каждую из 45 самок крыс /220 мкл, эквивалентно 7,3 мг госерелина/. У групп из 5 крыс брали пробы крови на 1- и 4-й дни и после 1, 3, 5, 7, 9, 11 и 13 недель. Кроме того, пробы крови брали из вены хвоста у групп из 5 крыс после 2, 4, 6, 8, 10 и 12 недель. Пробы анализировали на госерелин при помощи радиоиммуноанализа. Результаты показали, что этот жидкий препарата давал измеримые уровни лекарственного средства в крови в течение приблизительно 11 недель после дозирования, что свидетельствует о том, что этот препарат дает пролонгированное выделение госерелина in vivo.
Кроме того, из этих примеров видно, что можно приготовить препараты соли лекарственного средства с полиэфиром в виде растворов, которые можно легко вводить парентерально при помощи узкой иглы, и что такие препараты могут быть пригодны для лечения гормон-зависимых опухолей у мужчин.
Пример 21
Пептид, известный как Вещество P в форме его ацетатной соли /ex Sigma, 2 мг/, добавляли к дихлорметану /3 мл/и интенсивно перемешивали. Пептид не обнаружил признаков растворения в этом растворителе и образовал мутную суспензию.
Лактид/гликолидный сополимер /70/30/ с единственной концевой карбоксигруппой /225 мг, Mw = 9755, полидисперсность = 1,52, мол. масса по титрованию концевой группы = 1800/ добавляли к дихлорметану /25 мл/. Смесь перемешивали 15 мин, получая прозрачный бесцветный раствор. К нему добавляли раствор Вещества P /25 мг/ в метаноле /0,5 мл/. Полученную мутную суспензию перемешивали в течение 1 ч, получая совершенно прозрачный раствор. Растворитель удаляли в роторном испарителе и полученный прозрачный "стекловидный" твердый материал перерастворяли в дихлорметане /5 мл/ и повторно упаривали. Эту процедуру повторяли дважды. Конечный твердый материал растворяли в дихлорметане /3 мл/ и раствор добавляли медленно по каплям на покрытую PTFE /политетрафторэтиленом/ ткань, давая растворителю испаряться с образованием тонкой пленки из прозрачного бесцветного стекловидного твердого вещества /содержание пептида 9,1% вес/вес/.
Эту пленку /96,8 мг/ помещали в небольшой пузырек и добавляли забуференный фосфатом солевой раствор (2 мл pH 7,4) - /буфер предварительно фильтровали через фильтр 0,2 мкм и он содержал 0,02% азида натрия в качестве консерванта/. Пузырек помещали в инкубатор при 37oC и буфер периодически удаляли и заменяли. Удаляемый буфер анализировали на выделение Вещества P при помощи УФ - спектрофотометра /Hewlett Packard 8452A/ при 210 нм против стандартных растворов Вещества P. Результаты показывают, что Вещество P может быть растворено в дихлорметане при приготовлении его в виде соли лактид/гликолидного сополимера с концевыми карбоксигруппами и может быть обработано в этом растворителе с образованием тонкой пленки, которая дает непрерывное выделение пептида в течение приблизительно 4 недель.
Пример 22
Водный раствор ацетата лейпролида /известного так же как ацетат лейпрорелина/ (300 мкл раствора 330 мг/мл) добавляли при высоких срезающих усилиях к 20 мл 10% вес/вес к раствору поли(гидроксистеариновой) кислоты, имеющей среднечисловую мол. массу приблизительно 2000, в Miglyol 812 /триглицериды насыщенных жирных кислот со средней цепью, в том числе линоленовой кислоты, ex Dynamit Nobel, UK/ для образования лейпролид-полимерной соли, частично в интерфазе масло/вода. Эта соль стабилизирует образующуюся коллоидную суспензию вода-в-масле. Воду удаляют при 50oC при перемешивании под высоким вакуумом до тех пор, пока смесь не перестанет пениться и булькать, получая маслянистую композицию, обнаруживающую слабую белесоватость /мутность/ и пригодную для перорального введения.
Пример 23
Ацетат Lys8 - вазопрессина /2 мг, ex Sigma/ добавляли к дихлорметану /3 мл/ и перемешивали. Пептид не обнаруживал признаков растворения в растворителе и оставался в виде мутной суспензии.
Лактид/гликолидный сополимер /70/30/ с единственной концевой карбоксигруппой /225 мг, Mw = 9755, полидисперсность = 1,52, мол. масса по титрованию концевых групп = 1800/ добавляли к дихлорметану /5 мл/. Смесь перемешивали 15 мин, получая прозрачный бесцветный раствор. К нему добавляли Lys8 = вазопрессин /25 мг ex Sigma /и метанол/ 0,5 мл/. Полученную мутную суспензию перемешивали в течение 1 ч, получая полностью прозрачный раствор. Растворитель удаляли в роторном испарителе и прозрачный "стекловидный" твердый материал перерастворяли в дихлорметане /5 мл/ и повторно упаривали. Эту процедуру повторяли дважды. Конечный твердый материал растворяли в дихлорметане /3 мл/ и раствор медленно капали на покрытую PTFE ткань, позволяя растворителю испариться с образованием тонкой пленки прозрачного бесцветного стекловидного твердого вещества /содержание Lys8 - вазопрессина 10% (вес/вес)/.
Эту пленку /97,31 мг/ помещали в небольшой пузырек и добавляли забуференный фосфатом солевой раствор /2 мл, pH 7,4/ /буфер был предварительно профильтрован через фильтр 0,2 мкм и содержал 0,02% азида натрия в качестве консерванта/. Пузырек помещали в инкубатор при 37oC и буфер периодически удаляли и заменяли. Буфер анализировали на выделение Lys8-вазопрессина при помощи УФ-спектрофотометра /Hewlett Packard 8452A/ при 210 нм против стандартных растворов Lys8-вазопрессина. Результаты этого анализа показаны в следующей таблице. Этот эксперимент показывает, что Lys8-вазопрессин может быть растворен в дихлорметане при приготовлении его в виде соли с лактид/гликолидным сополимером с концевыми карбоксигруппами и что образующаяся смесь дает непрерывное выделение этого пептида в течение периода по меньшей мере 4 недель.
Выделение Lys8 - вазопрессина in vitro
Время, дни - Выделение Lys8 -вазопрессина из пленки, %
1 - 4,11
4 - 5,45
7 - 5,55
14 - 5,75
21 - 26,82
28 - 47,27
Пример 24
Два препарата ZENECA ZD 6003 ([Met-1, Arg11, Ser17,27, 60,65] G - CSF человека (колониестимулирующий фактор гранулоцитов), модифицированный полиэтиленгликолем 5000, как описано в Стандартном примере 4 или 7 EP Publication N 0473268) в лактид/гликолидном сополимере готовили следующим образом.
/i/ Дихлорметан /4 мл/ добавляли к высушенному вымораживанием препарату ZD 6003 /39,72 мм/. Это приводило к образованию непрозрачной дисперсии лекарственного средства в растворителе. Добавляли лактид /гликолидный сополимер/ 75/25/ с единственной концевой карбоксигруппой /363,6 мг, Mw = 9963, полидисперсность = 2,19,мол. масса по титрованию концевой группы = 2815 /и получали прозрачный раствор.
Этот раствор добавляли к раствору /400 мл/ метилцелюлозы /0,25% вес/об Methocel, 15 mPa • c, ex Fluka/ в воде при срезающих усилиях /2150 об./мин, Heidolph RZR 50 мешалка/. После перемешивания при этой скорости в течение 3 мин скорость перемешивания снижали до 800 об/мин. Полученным частицам давали осесть под действием гравитационных сил в течение 30 мин, выдерживая раствор на льду. Затем супернатант выбрасывали и частицы промывали ресуспендированием в охлажденной на льду дистиллированной воде /50 мл/ и центрифугированием при 1000 об/мин. Это повторяли 4 раза и частицы затем сушили лиофильно.
Полученные таким образом частицы были хорошего качества, поскольку они были сферическими и имели средний размер 32 мкм, как определено томографическим анализом оптической микроскопии. Содержание лекарственного средства этих частиц определяли экстракцией с последующей жидкостной хроматографией высокого разрешения /HPLC/ и оно было 9,45%, давая эффективность включения 96% лекарственного средства, примененного для образования микрочастиц.
/ii/ Дихлорметан /4 мл/ добавляли к лиофильно высушенному препарату ZD 6003 /44,18 мг/. Это приводило к образованию непрозрачной дисперсии лекарственного средства в растворителе. Лактид /гликолидный сополимер/ 75/25, 364,4 мг, Mw = 16800 по гель-фильтрации, полидисперсность = 2,2, ex Boehringer Ingelheim /добавляли к дисперсии. Попытка определения мол. массы полимера титрованием концевой группы не удалась из-за очень низких уровней титруемых частей молекул, вследствие чего можно думать, что этот полимер не имеет концевых карбоксигрупп. Смесь раствора лекарственного средства и полимера не становилась прозрачной после добавления полимера и смесь оставалась мутной дисперсией, что указывает на то, что, как и ожидалось, в отсутствие концевых карбоксигрупп в полимере пептид-полиэфирная соль не может образоваться.
Эту смесь добавляли к раствору /400 мл/ метилцеллюлозы /0,25% вес/об Methocel, 15 mPa • c, Fluka/ в воде при срезывающих усилиях об/мин, Heidolph RZR 50 stirrer/ мешалка). После перемешивания при этой скорости в течение 3 мин скорость перемешивания снижали до 800 об/мин. Затем полученным частицам давали оседать под действием гравитации в течение 30 мин, выдерживая раствор на льду. Затем супернатант выбрасывали и частицы промывали ресуспендированием в дистиллированной воде /50 мл/ и центрифугированием при 100 об/мин. Эту процедуру повторили 4 раза и затем частицы сушили вымораживанием /лиофильно/.
Полученные таким образом частицы были худшего качества по сравнению с частицами, полученными в /i/, поскольку некоторые из них имеют неправильную форму и средний размер частиц 40 мкм, как определено томографическим анализом оптической микроскопии. Содержание лекарственного средства этих частиц определяли экстракцией в последующем HPLC анализом и оно было 2,05%, давая эффективность включения этого лекарственного средства 19%.
Приведенный выше пример показывает, что ZD 6003 может быть растворен в дихлорметане в присутствии полимера с единственной концевой карбоксигруппой, хотя сам дихлорметан не является растворителем для этого лекарственного средства. Кроме того, такой раствор можно использовать для образования микрочастиц лекарственного средства и полимера с высокой скоростью включения лекарственного средства. В противоположность этому приведенный пример показывает также, что ZD 6003 не может растворяться в дихлорметане в присутствии полимера, не имеющего концевых карбоксигрупп, и образует только белесоватые дисперсии. Более того, такие белесоватые /мутные/ дисперсии ZD 6003 в растворе полимера, не имеющего концевых карбоксигрупп, приводят к низкому включению лекарственного средства при образовании микрочастиц.
Пример 25
/i/ /Ацетат госерелина/ 22,47 мг, эквивалентно 19,99 мг госерелина /добавляли к бензилбензоату/ 2,21 г 99%, ex Janssen/. Эту смесь помещали в инкубатор при 40oC и перемешивали непрерывно в течение 9 дней при помощи магнитной мешалки. После 2 и 9 дней брали аликвоты и центрифугировали 15 мин при 13000 об/мин для осаждения нерастворившегося лекарственного средства. Аликвоты супернатанта /прибл. 100 мг/ взвешивали аккуратно в 50-миллилитровые мерные колбы. К каждой добавляли ледяную уксусную кислоту /2 мл/ с последующим доведением объема водным раствором трифторуксусной кислоты /0,5% (об/об)/. Часть этого раствора помещали в центрифужную пробирку и центрифугировали при 13000 об/мин 15 мин для отделения суспендированного материала. Затем супернатант анализировали на содержание госерелина при помощи HPLC. Ни в одной пробе не был обнаружен госерелин. Предел детектирования госерелина в этом анализе HPLC был 0,2 мкг/мл и предел для количественного определения был 0,5 мкг/мл. Поэтому равновесная растворимость /при 40oC/ госерелина в бензилбензоате может быть оценена как менее чем 0,2 мкг/мг.
/ii/ Лактид-гликолидный сополимер /95/5/ с единственной концевой карбоксигруппой /291,9 мг, Mw = 6742, полидисперсность = 1,61, мол. масса по титрованию концевой группой = 2565 г/моль, характеристическая вязкость при 1% вес/об в хлороформе = 0,103 дл/г добавляли к бензилбензоату /3,38 г, ex Janssem /для образования раствора. К нему добавляли ацетат госерелина /22,52 мг, эквивалентно 20,03 мг госерелина/. Смесь инкубировали и брали пробы, как описано в /i/ выше. При 2 днях инкубирования госерелин не обнаруживали в бензилбензоате, но при 9 днях инкубирования детектировали уровень приблизительно 0,2 мкг госерелина на мг, бензилбензоата. Предел детектирования госерелина в примененном HPLC анализе был указан в /i/ выше. На основании этого можно показать, что равновесная растворимость /при 40oC/ госерелина в бензилбензоате, когда он присутствует в виде простой смеси с лактид/гликолидным полимером, равна 0,2 - 0,5 мкг/мг.
/iii/ Лактид/гликолидный сополимер /95/5/ с единственной концевой карбоксигруппой /9,0 г, Mw = 6011, полидисперсность = 1,56, мол. масса по титрованию концевой группы = 2700 г/моль, характеристическая вязкость при 1% вес/об в хлороформе = 0,099 дл/г /растворяли в дихлорметане /100 мл/. К раствору добавляли ацетат госерелина /1,1244 г. эквивалентно 1 г госерелина/ при перемешивании с последующим добавлением метанола/ /10 мл/. Полученную мутную суспензию перемешивали при комнатной температуре в течение 1 ч до полного растворения с образованием прозрачного раствора. Растворитель удаляли при помощи роторного испарителя, получая прозрачную вязкую жидкость. Ее перерастворяли в дихлорметане и повторно высушивали, как описано ранее. Эту стадию затем повторяли еще 2 раза и полученную в результате вязкую жидкость сушили под высоким вакуумом, получая белую пену, которая затем сушили под вакуумом в течение ночи. Пену разбивали до тонкого порошка, который высушивали под вакуумом в течение 1 дня при комнатной температуре. К этому порошку добавляли бензилбензоат /20 мл, 99%, ex Janssen/ и образующуюся смесь слегка подогревали при перемешивании, получая раствор.
Раствор интенсивно перемешивали и 1 мл пробу помещали в центрифугу и откручивали при 14000 об/мин в течение 30 мин. Аликвоту супернатанта осторожно брали и взвешивали в мерную колбу на 50 мл. Пробу анализировали на содержание госерелина, как описано в /i/. Содержание госерелина в этом растворе было 24,6 мкг/мг бензилбензоата.
Этот пример показывает, что бензилбензоат является очень плохим растворителем для ацетата госерелина. Кроме того, добавление лактид/гликолидного полимера с образованием простой смеси с ацетатом госерелина в бензилбензоате не приводит к заметному увеличению равновесной растворимости ацетата госерелина в бензилбензоате. Однако госерелин-полиэфирная соль может быть растворена в бензилбензоате с образованием раствора, содержащего госерелин в концентрации, гораздо более высокой, чем оцененная равновесная растворимость свободного госерелина в этом растворителе.
Изобретение касается микрочастиц новых солей, состоящих из катиона, произведенного из пептида, содержащего по меньшей мере одну основную группу, и аниона, произведенного из полиэфира с концевыми карбоксигруппами, способов приготовления, применения в производстве фармацевтических композиций с пролонгированным действием. Частицы могут быть использованы для приготовления фармацевтических препаратов пролонгированного действия независимо от того, находятся ли эти соли в чистой форме или в смеси либо с избытком свободной, несвязанной формы пептида, либо с избытком свободного полиэфира. Предлагаем композиции более стабильны. 4 с. и 14 з.п. ф-лы, 1 табл.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| 0 |
|
SU350246A1 | |
| Преобразователь перемещение-код | 1970 |
|
SU467388A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МОРОЗОСТОЙКОСТИ ОБРАЗЦОВ СТРОИТЕЛЬНОГО МАТЕРИАЛА | 1970 |
|
SU453621A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| US 4997643 A, 1991 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Способ получения солей канцеролитических пептидов | 1959 |
|
SU132229A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Способ иммобилизации ферментов | 1975 |
|
SU548613A1 |
Авторы
Даты
2000-07-10—Публикация
1993-05-25—Подача