Изобретение относится к области медицины и касается способов и устройств, используемых для профилактики и лечения ран и раневой инфекции, а также в инфектологии.
Проблемы здравоохранения все более осложняются. Военные конфликты с применением оружия массового поражения, экологические, техногенные и природные катастрофы, террористические акты приводят к резкому увеличению боевых травм и увечий, травм мирного времени, требующих, как правило, своевременного оперативного вмешательства.
Инфекция является основным видом послеоперационных осложнений, источником значительного удлинения сроков лечения и основной причиной летальных исходов после операций. Ее видовой состав в 50-70% случаев является смешанным. В патологическом материале могут быть обнаружены как аэробные и факультативно-анаэробные микроорганизмы (стафилококк, кишечная и синегнойная палочки, стрептококк и пр.), так и облигатные анаэробные микроорганизмы (бактероиды, фузобактерии, пептококки, дифтероиды, клостридии и пр.). Огромное количество патогенных микроорганизмов, их высокая способность к мутациям и малое время репликации не позволяют иммунной системе человека вовремя отвечать на быструю приспособляемость микроорганизмов.
Угрозы появления новых болезней, распространения инфекций и их осложнений, требуют разработки современных медицинских технологий лечения и соответствующих технических средств, позволяющих внедрить в клинику высокоэффективные, простые в исполнении и доступные для большинства населения методы лечения ран и раневой инфекции, воспалительных и инфекционных заболеваний, в том числе и опасных заболеваний.
В этой связи, применение озонных технологий и их модификаций для профилактики и лечения заболеваний, позволяющих достижение высоких бактерицидных, фунгицидных, вирулицидных, иммунокоррегирующих, детоксицирующих, противоацидозных, оксигенирующих и пр. эффектов в сочетании с другими видами энергии является перспективным направлением в решении возникающих проблем здравоохранения.
Известен аппарат для стерилизации объекта газом, в качестве которого используют возбужденные атомарный О* и молекулярный кислород О2*, получаемые из озоно-воздушной смеси, непрерывно обдувающей стерилизуемый объект, при ее периодическом облучении квантами света с длиной волны 1500-3080 Ангстрем и энергией >5,26 эВ [1].
Данный аппарат содержит: озонатор в виде электродной системы, подключенной к источнику переменного тока и генерирующей при подаче питания искровой разряд, продуцирующий, в свою очередь, из нагнетаемого в озонатор компрессором атмосферного воздуха озоно-воздушную смесь, непрерывно обдувающую объект стерилизации, контактную камеру с расположенным в ней объектом стерилизации, кварцевые лампы (источники квантов света с длиной волны 1500-3080 Ангстрем и энергией >5,26 эВ.
Недостатками данного аппарата являются:
- ненадежность обеззараживания очагов инфекции, инфицированных ран и полостей организма сложной конфигурации и большой глубины, а также необходимость применения длительных экспозиций воздействия на них из-за наличия небольших количеств возбужденных атомарного О* и молекулярного О2* кислорода, получаемых при периодическом облучении квантами света озоно-воздушной смеси, имеющей исходную малую концентрацию озона, продуцируемого искровыми разрядами;
- наличие озонатора, имеющего ненадежную и малопроизводительную (в отношении продукции озона) электродную систему, генерирующую искровые разряды в прокачиваемом через нее рабочем газе - воздухе, который не является оптимальным исходным рабочим газом для достижения максимально возможной концентрации озона в получаемой в озонаторе озоно-воздушной смеси;
- невозможность использования аппарата, сложного в конструктивном и технологическом исполнении, в клинических условиях при обработке инфицированных ран, расположенных на теле пациента как локально, так и всего тела в целом из-за больших габаритов и массы его исполнительного устройства - контактной камеры, содержащей кварцевые лампы, а также невозможность манипулирования им в области раны;
- невозможность использования при обработке очагов инфекции открыто излучающих кварцевых ламп, не безопасных как для пациента, так и окружающего медицинского персонала.
Наиболее близким по технической сущности и достигаемому результату является аппарат для высоковольтной импульсной электроразрядной обработки инфицированных ран, содержащий генератор высоковольтных электрических импульсов (ГВЭИ) с малогабаритным высоковольтным импульсным электроразрядным узлом (ВИЭР-узел), в несущем диэлектрическом корпусе которого размещена коаксиальная электродная система, состоящая из кольцевого и стержневого электродов, разделенных диэлектрическим изолятором, а также сменная оптически прозрачная насадка в виде кварцевой шайбы с центральным сопловым отверстием на рабочей части [2].
При возбуждении высоковольтного импульсного электрического разряда (ВИЭР) в зоне разрядного промежутка коаксиальной разрядной системы возникают вторичные факторы: импульсное электромагнитное излучение, потоки светового и УФ излучений с длиной волны 1500-6000 Ангстрем и энергией ≫5,26 эВ [3], а также ионизированный озоно-воздушный поток, которые проходят через прозрачную поверхность кварцевой шайбы и сопловое отверстие в ней и локально воздействуют на раневую поверхность, способствуя подавлению патогенной микрофлоры и стимулированию репаративной регенерации в очаге инфекции.
Однако данная конструкция аппарата, реализующего плазмодинамические процессы при обработке инфицированных ран, имеет следующие недостатки, снижающих эффективность обработки очагов инфекции инфицированных ран и полостей организма сложной конфигурации и большой глубины, а следовательно увеличивающих сроки их лечения:
- при инициировании ВИЭР, относящихся к плазмодинамическим искровым разрядам, на окружающую среду (вблизи разрядного промежутка разрядной системы преобразователя), например воздух, воздействуют высокоинтенсивные потоки широкополосного УФ излучения (от 1500 до 6000 Ангстрем), ударных волн (давление за фронтом 10-200 атм), и прежде всего высокотемпературной плазмы (Т=10-60 кК) и пр., реализующих комплекс фотохимических, плазмохимических и термобарических реакций [4, 5], приводящих как к получению озона (при длине волны ниже 1900 Ангстрем) в образуемой (в разрядной зоне) озоно-воздушной смеси, так и к разрушению озона (при длине волны выше 1900 Ангстрем в условиях критичных яркостных температур 20-40 кК). В последнем случае в канале искрового разряда и вблизи него наблюдается сильнейший разогрев газа, вызывающий снижение выработки озона вплоть до прекращения его синтеза [6], что делает невозможным получение сколько нибудь значимых количеств возбужденных атомарного О* и молекулярного О2* кислорода, получаемых при облучении "следовых" количеств озона в озоно-воздушной смеси квантами света и УФ излучения, продуцируемых искровыми разрядами;
- так как малогабаритный ВИЭР-узел известного аппарата предназначен лишь для дистанционного воздействия на очаги инфекции, то его невозможно подвести, в процессе их обработки, к инфицированной поверхности ран и полостей организма сложной конфигурации и большой глубины, что не позволяет повысить эффективность их лечения;
- недостаточное количество озона и его производных (возбужденных атомарного О* и молекулярного О2* кислорода), производимых малогабаритным ВИЭР-узлом известного аппарата, резко снижает эффективность лечения очагов инфекции, что требует длительного времени их обработки и, как следствие, значительно сокращает срок службы электродной системы малогабаритного ВИЭР-узла.
Задачей изобретения является повышение эффективности лечения инфицированных ран и полостей организма сложной конфигурации и большой глубины при их плазмодинамической обработке путем увеличения количества возбужденных атомарного O* и молекулярного О2* кислорода в озоно-кислородной смеси, производимых малогабаритным ВИЭР-узлом с обеспечением их подвода к инфицированным поверхностям ран и полостей организма.
Задача изобретения достигается тем, что в аппарате для плазмодинамической обработки инфицированных ран и полостей организма, содержащем генератор высоковольтных электрических импульсов с малогабаритным высоковольтным импульсным электроразрядным узлом, в несущем диэлектрическом корпусе которого размещена коаксиальная электродная система, состоящая из кольцевого и стержневого электродов, разделенных диэлектрическим изолятором, а также сменная оптически прозрачная кварцевая насадка с центральным сопловым отверстием на рабочей части, его коаксиальная электродная система размещена внутри оптически прозрачного кварцевого элемента, выполненного в виде колбы с перфорированным полусферическим рабочим окончанием, установленной с зазором относительно внутренней поверхности несущего корпуса узла, часть внутренней поверхности которого в области полусферического рабочего окончания колбы выполнена из материала, отражающего излучение видимого и УФ спектра, на рабочей части несущего корпуса узла установлен сменный выпускной штуцер с присоединенным к нему патрубком, соединенным с канюлей, имеющей на противоположной конце перфорированное полусферическое рабочее окончание, а на противоположной торцевой части несущего корпуса узла установлена опорная герметизирующая втулка с впускным штуцером, соединенным с генератором озона, сопряженным с емкостью с кислородом, и сообщенным с зазором между внутренней поверхностью несущего корпуса узла и наружной поверхностью колбы.
Кроме того, при плазмодинамической обработке инфицированных ран, расположенных на участках тела с поверхностной неровностью, канюля с перфорированным полусферическим рабочим окончанием проведена через центральное отверстие раноограничителя с упругоэластичным деформируемым основанием, а при обработке инфицированных ран и полостей организма сложной конфигурации и большой глубины, указанная канюля проведена через центратор решетчатого расширителя-ограничителя.
К настоящему времени неизвестны технические решения, реализующие конструктивные особенности предлагаемого аппарата для плазмодинамической обработки инфицированных ран и полостей организма сложной конфигурации и большой глубины с вышеуказанными отличительными признаками.
Сущность изобретения, позволяющая повысить эффективность лечения инфицированных ран и полостей организма сложной конфигурации и большой глубины, основана на комплексном и последовательном использовании кинетики плазмохимических и фотохимических процессов, реализуемых предлагаемой конструкцией аппарата для плазмодинамической обработки инфицированных ран и полостей организма, следствием которых являются:
- первоначально - генерирование озона (из чистого "медицинского" кислорода) с получением озоно-кислородной смеси (О3+О2);
- затем одновременное и независимое генерирование импульсного, высокоинтенсивного и широкополостного потока светового и УФ излучений;
- стимулируемое импульсным, высокоинтенсивным и широкополосным УФ излучением фоторазложение полученного озона из озоно-кислородной смеси (О3+О2) на атомарный О и молекулярный О2 кислород со снижением концентрации озона в озонсодержащем газовом компоненте и последующим переходом их в возбужденное состояние: атомарный О* и молекулярный О2* кислород;
- образование высокоактивного газового компонента в виде сложной смеси: возбужденные атомарный O* и молекулярный О2* кислород + следы (О3+О2);
- воздействие на очаг инфекции высокоактивными компонентами, обладающими выраженными биохимическими лечебными свойствами: высокоактивным газовым компонентом в виде сложной смеси: возбужденные атомарный О* и молекулярный О2* кислород + следы (О3+О2), а также широкополосным потоком высокоэнергетического УФ излучения как непосредственно О*, О2*+ (О3+О2) + УФ, так и в растворе O*, O2*+ (О3+O2), позволяющих реализовать различные варианты многоэтапной технологии лечения инфицированных ран и полостей организма.
На фиг.1 показана схема общего вида и блок-схема аппарата для плазмодинамической обработки инфицированных ран и полостей организма;
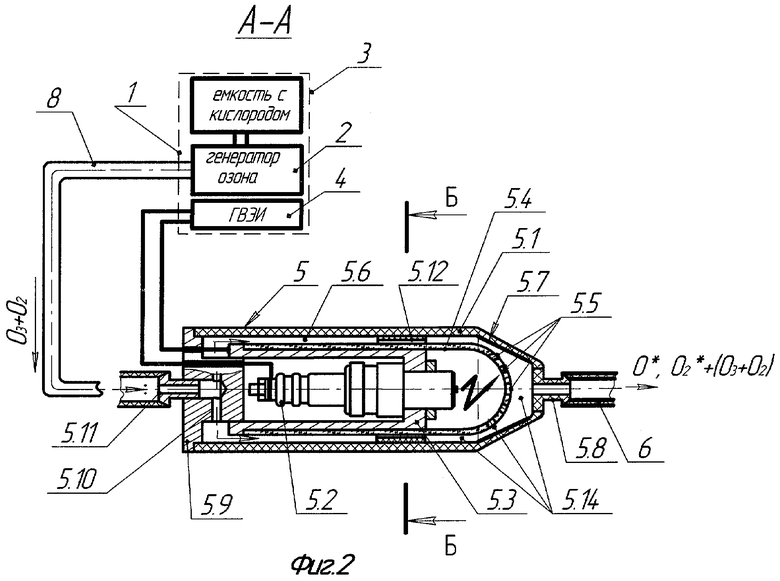
на фиг.2 - сечение ВИЭР-узла аппарата для плазмодинамической обработки инфицированных ран и полостей организма (сечение А-А на фиг.1);
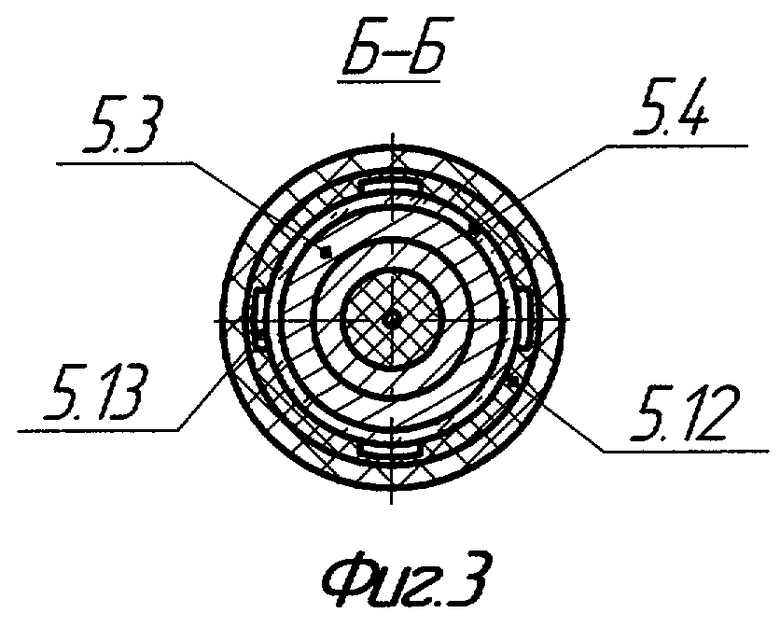
на фиг.3 - сечение зоны сопряжения коаксиальной электродной системы ВИЭР-узла, кварцевой колбы и несущего корпуса ВИЭР-узла (сечение Б-Б на фиг.2);
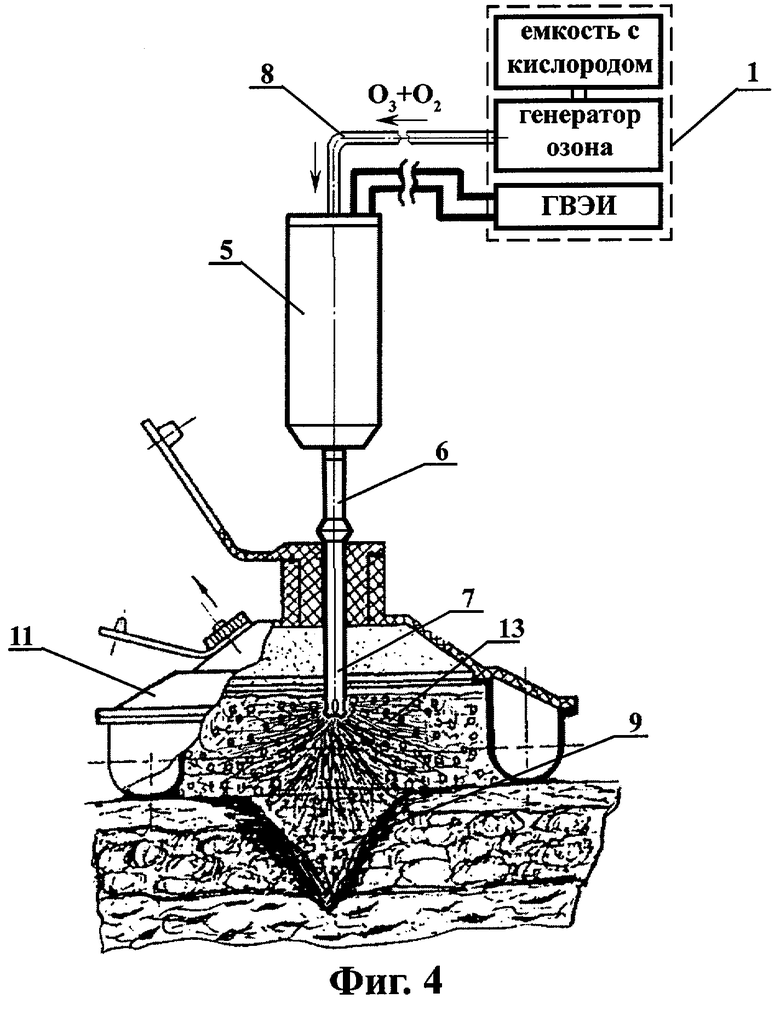
на фиг.4 - схема плазмодинамической обработки через промежуточный лекарственный раствор инфицированной раны, расположенной на участке тела с поверхностной неровностью;
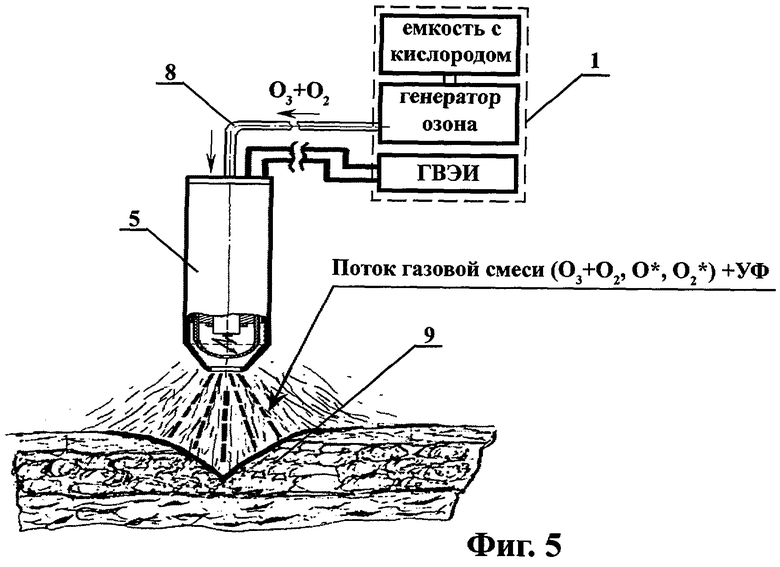
на фиг.5 - схема плазмодинамической обработки поверхностно расположенной инфицированной раны;
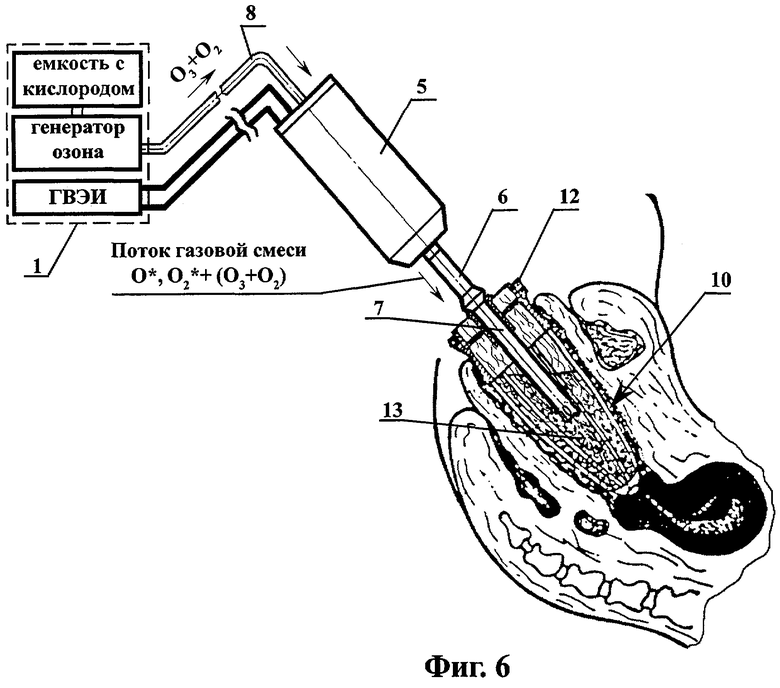
на фиг.6 - схема плазмодинамической обработки через промежуточный лекарственный раствор инфицированной полости организма сложной конфигурации и большой глубины;
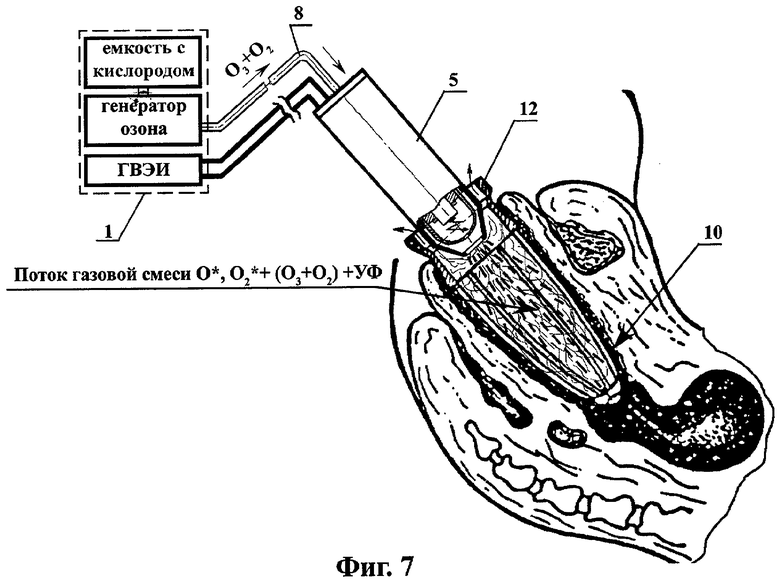
на фиг.7 - схема плазмодинамической обработки инфицированной полости организма сложной конфигурации и большой глубины;
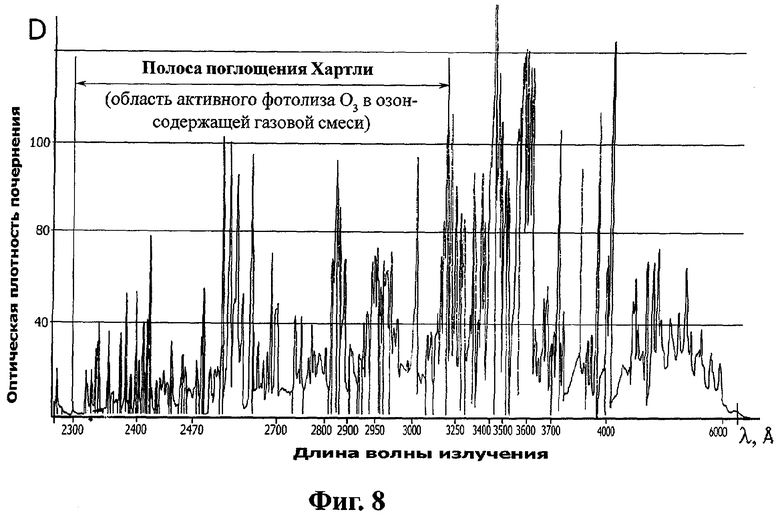
на фиг.8 - регистрограмма излучения ВИЭР, работающей коаксиальной электродной системы ВИЭР-узла.
Аппарат для плазмодинамической обработки инфицированных ран и полостей организма содержит (фиг.1-3): аппаратный комплекс "ВИЭРТОН" 1, включающий в себя генератор озона 2 с микрокомпрессором (не показан), сопряженный с кислородным баллоном 3 и понижающим редуктором (не показан), а также генератор высоковольтных электрических импульсов (ГВЭИ) 4 и высоковольтный импульсный электроразрядный узел (ВИЭР-узел) 5.
В предлагаемом аппарате при использовании в качестве рабочего газа - "медицинского" кислорода, микрокомпрессор отключают, а кислород через понижающий редуктор подают напрямую на разрядные электроды генератора озона 2 с получением озона из кислорода в барьерном разряде, а далее на выходе получают исходный рабочий газ - озоно-кислородную смесь.
В предлагаемом аппарате (при отсутствии "медицинского" кислорода) возможно, также, и получение исходного рабочего газа в виде озоно-воздушной смеси при прокачивании компрессором рабочего газа - воздуха (из окружающей среды) через систему разрядных электродов генератора озона 2 с получением на выходе исходного рабочего газа озоно-воздушной смеси.
ВИЭР-узел 5 состоит из несущего диэлектрического корпуса 5.1, в котором размещены: коаксиальная электродная система 5.2, в качестве которой применена стандартная автомобильная свеча зажигания (серийно выпускается промышленностью, где производство и контроль качества продукции являются гарантией ее высокой надежности при использовании в виде электроразрядного элемента в ВИЭР-узле), установленная через держатель 5.3 внутри оптически прозрачного кварцевого элемента, выполненного в виде колбы 5.4, полусферическое рабочее окончание которой снабжено дренажными отверстиями 5.5, сообщающими полость колбы с внешней средой. Колба 5.4 установлена с зазором 5.6 (двусторонне открытая полость), образованным между внутренней поверхностью несущего корпуса 5.1 ВИЭР-узла 5 и наружной поверхностью кварцевой колбы 5.4. Конусная часть внутренней поверхности несущего корпуса 5.1 в области полусферического рабочего окончания колбы 5.4 выполнена из материала, отражающего излучение видимого и УФ-спектра, например тонкостенного усеченного конуса 5.7 из нержавеющей стали с полированной внутренней поверхностью. Кроме того, на рабочей части несущего корпуса 5.1 установлен сменный выпускной штуцер 5.8 с присоединенным к нему патрубком 6, соединенным с канюлей 7, имеющей на противоположном конце перфорированное полусферическое рабочее окончание (для равномерного распределения потока, получаемого ВИЭР-узлом высокоактивного газового компонента и исключения травмирования тканей глубоких ран или инфицированных полостей при их обработке "вслепую"). На противоположной торцевой части несущего корпуса 5.1 установлена опорная герметизирующая втулка 5.9 с дренажными отверстиями 5.10 и присоединенным к ней впускным штуцером 5.11. К впускному штуцеру 5.11 присоединен патрубок 8, подающий от генератора озона 2 исходный рабочий газ (озоно-кислородная смесь), который через дренажные отверстия 5.10, зазор 5.6 и центратор 5.12 с отверстиями 5.13 подается в зону его активации 5.14. Далее после разложения основной части озоно-кислородной смеси на высокоактивные (возбужденные) атомарный О* и молекулярный О2* кислород, они вместе с остаточным количеством озоно-кислородной смеси (О3+О2) через патрубок 6 и канюлю 7 с перфорированным полусферическим рабочим окончанием подводятся к очагу инфекции - ране 9 или инфицированной полости организма 10. При этом, при плазмодинамической обработке инфицированных ран, расположенных на участках тела с поверхностной неровностью, используют раноограничитель 11 с упругоэластичным деформируемым основанием, позволяющем увеличить уровень промежуточного раствора над раневой поверхностью, обеспечивающем заполнение полости раноограничителя 11 промежуточным раствором 13 и исключающем его растекание при обработке очага инфекции, а при плазмодинамической обработке инфицированных ран и полостей организма сложной конфигурации и большой глубины используют решетчатый расширитель-ограничитель 12, обеспечивающем расширение полости и расправление тканей в очаге инфекции для равномерного подвода к ним и очагу инфекции промежуточного раствора 13 и/или вышеуказанного высокоактивного газового компонента.
Аппарат работает следующим образом (фиг.1-8). Включают аппаратный комплекс "ВИЭРТОН" 1. Одновременно включаются в работу генератор озона 2, генератор высоковольтных электрических импульсов (ГВЭИ) 4 и ВИЭР-узел 5. "Медицинский" кислород из кислородного баллона через понижающий редуктор напрямую под давлением подается на разрядные электроды генератора озона 2, к которым подводится переменный ток высокого напряжения. В межэлектродном пространстве создается переменное поле высокой напряженности с созданием условий для образования большого количества свободных электронов, обладающих значительной энергией, приводящих к разрушению части молекул кислорода до атомов и ионов с образованием озона (О3) и, в конечном итоге, исходного рабочего газа в виде озоно-кислородной смеси (О3+О2). Полученная озоно-кислородная смесь (О3+О2) проходит через патрубок 8, впускной штуцер 5.11, дренажные отверстия 5.10 опорной герметизирующей втулки 5.9 и далее через зазор 5.6 между внутренней поверхностью несущего корпуса 5.1 и наружной поверхностью кварцевой колбы 5.4, отверстия 5.13 центратора 5.12 подается в область активации 5.14 ВИЭР-узла 5. При этом, проходя с наружной стороны оптически прозрачного кварцевого элемента колбы 5.4 ВИЭР-узла 5, с работающей внутри нее коаксиальной электродной системой 5.2 в виде высоконадежной свечи зажигания (например, автомобильной), озоно-кислородная смесь (О3+О2) подвергается активному фотолизу под воздействием широкополосного потока светового и УФ излучений (при достаточном энергетическом воздействии УФ излучения на полосе поглощения Хартли-частота от 2300 до 3100 Ангстрем и энергии ≫5,26 эВ (фиг.8 [7]), а также импульсного электромагнитного излучения.
В процессе активного фотолиза основной части озоно-кислородной смеси (О3+О2), подаваемой от генератора озона, возбужденные атомарный О* и молекулярный О2* кислород вместе с малой частью остаточного количества озоно-кислородной смеси (О3+О2), а также "следовыми" количествами озона (О3), продуцируемого искровыми разрядами в разрядном промежутке электродной системы 5.2, проникающих через дренажные отверстия 5.5 рабочего окончания колбы 5.4, смешиваются в области активации 5.14 конусной части внутренней поверхности несущего корпуса 5.1. Здесь они дополнительно подвергаются воздействию отраженного потока светового и УФ излучений от полированной поверхности усеченного конуса 5.7, еще более увеличивающих долю возбужденных атомарного О* и молекулярного О2* кислорода и, соответственно резко уменьшающих долю остаточного количества озоно-кислородной смеси (О3+O2), а также, сводя практически до нуля "следовые" количества озона (О3).
Возбужденные атомарный О* и молекулярный О2* кислород являются высокоактивными "короткоживущими" окислителями, уничтожающими или ингибирующими, при контакте с ними, жизнедеятельность практически всех видов патогенной микрофлоры (аэробов, анаэробов и их ассоциаций) в течение нескольких секунд. В то же время, они не являются для сурфактанта легочной ткани организма человека и животных таким мощным разрушающим газообразным компонентом как озон (О3), т.к. сразу же после взаимодействия с объектом воздействия или в свободном режиме, переходят в свое нормальное состояние - атомарный О* или молекулярный О2 кислород, не нарушая ПДК окружающей среды в технологической зоне обработки инфицированной раны или полости организма.
Далее под давлением смесь атомарного О* и молекулярного О2* кислорода, а также остаточных количеств озоно-кислородной смеси (О3+O2), а именно O*, O2*+(О3+O2), через сменный выпускной штуцер 5.8 и присоединенный к нему патрубок 6 и канюлю 7, непрерывно подается в отграниченную раноограничителем 11 инфицированную рану 9 (I фаза раневого процесса - фаза воспаления и гидратации, очищения раны от некротических тканей), заполненную промежуточным раствором 13 (например, дистиллятом или 0,9% физиологическим раствором) (фиг.4). При фотоплазмодинамической обработке поверхностно расположенной инфицированной раны 9 или раны, находящейся во II или III фазе раневого процесса, сменный выпускной штуцер 5.8 с присоединенным к нему патрубком 6, соединенным с канюлей 7 отсоединяют от рабочей части несущего корпуса 5.1 и обработку очага инфекции осуществляют путем непосредственной подачи на раневую поверхность и ее обдув вышеуказанной смесью высокоактивных газовых компонентов и облучения УФ излучением - O*, O2*+(О3+O2)+УФ без применения раноограничителя 11 и промежуточного раствора 13 (Фиг.5).
При плазмодинамической обработке инфицированной полости организма, находящейся в I фазе раневого процесса - фазе воспаления и гидратации, очищения раны от некротических тканей, вышеуказанную смесь высокоактивных газовых компонентов - O*, O2*+(О3+O2), через патрубок 6 и канюлю 7, подают в расширенную решетчатым расширителем-ограничителем 12 полость организма 10, заполненную промежуточным раствором 13 (например, дистиллятом или 0,9% физиологическим раствором) (фиг.6). В случае плазмодинамической обработки инфицированной полости организма, находящейся во II или III фазе раневого процесса, обработку очага инфекции осуществляют путем непосредственной подачи на раневую поверхность и ее обдув вышеуказанной смесью высокоактивных газовых компонентов - O*, O2*+(О3+O2)+УФ без применения промежуточного раствора 13 (фиг.7).
После окончания многоэтапного технологического цикла лечения с применением плазмодинамической обработки инфицированной раны или полости организма, находящихся в той или иной фазе раневого процесса, аппаратный комплекс "ВИЭРТОН" 1 отключают. При этом, отключают подачу "медицинского" кислорода на разрядные электроды генератора озона, а затем выключают генератор озона и генератор высоковольтных электрических импульсов (ГВЭИ). Отводят ВИЭР-узел (с канюлей или без нее) от области обработки очага инфекции, снимают раноограничитель с поверхности раны или выводят решетчатый расширитель-ограничитель из полости организма, эвакуируют промежуточный раствор из раны или полости, если он используется на том или ином этапе обработки очага инфекции и осуществляют контрольный осмотр. При установлении недостаточности санации раны или полости ее обработку, при необходимости, повторяют. По достижении санации раны или полости ее дальнейшее ведение проводят по общепринятым методикам. Количество сеансов обработки очагов инфекции раны или полости организма с применением предложенного аппаратного комплекса "ВИЭРТОН" определяется в каждом конкретном случае врачом на основании динамики репаративных процессов, протекающих в ране или полости организма при их лечении.
ПРИМЕР 1. Больной Д., 24 года. Диагноз: постиньекционный абсцесс ягодичной области слева. При осмотре: в верхне-наружном квадранте определен воспалительный инфильтрат размером 4,5 х 6 см. Под местной анестезией проведена диагностическая пункция гнойника. Содержимое гнойника направлено на бактериологическое исследование и экспресс-диагностику наличия анаэробной микрофлоры. Анализ материала показал наличие в гнойном содержимом большого количества ЛЖК, свидетельствующих о наличии анаэробной инфекции. Под масочным наркозом произведено широкое рассечение гнойного очага, содержащего гнойно-гнилостный экссудат, имеющего неприятный запах. Подкожно-жировая клетчатка охвачена инфекционным процессом.
Предварительно, проведена традиционная хирургическая обработка очага инфекции, аспирация содержимого гнойника, иссечение некротических тканей с последующим проведением общепринятой низкочастотной ультразвуковой санации в течение 1-2 минут вскрытого гнойника через промежуточный раствор антисептика (раствор фурацилина 1:5000). После проведения ультразвуковой санации раны осуществляют контрольный осмотр. При установлении недостаточности санации раны ее обработку, при необходимости, повторяют.
После этого, интраоперационно осуществляли лечение раны 9, находящейся в I фазе раневого процесса, согласно предложенному способу плазмодинамической обработки инфицированных ран и полостей организма сложной конфигурации и большой глубины.
Для этого (фиг.4), с учетом большой поверхностной неровности участка тела, где расположена инфицированная рана, использовали раноограничитель 11 с упругоэластичным деформируемым основанием. Устанавливали раноограничитель над очагом инфекции и заполняли его полость и полость раны промежуточным раствором 13 (дистиллят). Проводили через центральное отверстие раноограничителя канюлю 7, заглубляли ее перфорированное полу сферическое рабочее окончание в промежуточный раствор и подводили его к очагу инфекции. Включали аппаратный комплекс "ВИЭРТОН" 1 с одновременным включением в работу: генератора озона 2 с кислородной емкостью генератора высоковольтных электрических импульсов (ГВЭИ) 4 и ВИЭР-узла 5. После этого, проводили плазмодинамическую обработку инфицированной полости раны, заполненной циркулирующим промежуточным раствором путем его непрерывного барбатирования потоком высокоактивной газовой смеси - O*, O2*+(О3+O2) в течение 3-5 минут в зависимости от объема раневой полости и выраженности раневого процесса. После окончания процедуры плазмодинамической обработки раны выключали аппаратный комплекс "ВИЭРТОН", прекращали подачу в раневую полость потока вышеуказанной высокоактивной газовой смеси и циркуляцию промежуточного раствора, эвакуировали из полости его остатки и снимали с раневой поверхности раноограничитель. Рану дренировали традиционным способом. В последующие дни лечение раны проводили по изложенной выше методике. На 3-и сутки рана очистилась от некротических тканей, появилась грануляционная ткань, на контрольных хроматограммах ЛЖК отсутствуют.
На следующем этапе лечения раны (фиг.5), на II и III фазах раневого процесса, раноограничитель и промежуточный раствор не применяли. После удаления сменного выпускного штуцера 5.8 с присоединенными к нему патрубком 6 и канюлей 7, поверхность раны обрабатывалась в течение 1-2 минут потоком высокоактивной газовой смеси - O*, O2*+(О3+O2) и УФ излучения. При этом одновременно на рану оказывалось импульсное воздействие УФ излучения и электромагнитного поля искрового разряда, генерируемого коаксиальной электродной системой 5.2 ВИЭР-узла, приближенного к ране, и проходящих к ее поверхности через кварцевую колбу 5.4, дренажные отверстия 5.5 и отверстие в конусной части несущего корпуса 5.1.
На 5-е сутки рана выполнена грануляциями, отмечена краевая эпителизация раны. Наложены первично отсроченные швы, которые сняты на 8 день. Заживление первичным натяжением с формированием нежного рубца. Заживление раны достигнуто, в среднем, на 4-5 дней ранее сроков заживления аналогичных по тяжести ран у больных контрольной группы, леченных известными методами лечения инфицированных ран.
ПРИМЕР 2. Больная Л., 20 лет. Диагноз: генитальный кандидоз. Лечение заболевания традиционными методами в течение более 6 месяцев без положительного результата.
По известным методикам проводили клинические анализы крови и мочи, исследовали влагалищно-шеечные мазки на флору и степень чистоты, проводили кольпоскопию. По результатам исследований выбирали тактику лечения и виды лекарственных препаратов.
Больную укладывали на гинекологическое кресло в тренделенбурговское положение, обеспечивая угол наклона оси вагинальной полости 70-80° относительно горизонтали, для исключения вытекания, в последующем, заливаемого во влагалище промежуточного лекарственного раствора.
Предварительно, при осуществлении каждого сеанса лечения проводили общепринятую процедуру низкочастотной ультразвуковой санации очага инфекции в вагинальной полости путем озвучивания в течение 1-2 минут тканей влагалища и влагалищной части шейки матки через промежуточный раствор антисептика (попеременно - 3% раствор перекиси водорода или содовый раствор). После проведения ультразвуковой санации полости осуществляют ее контрольный осмотр. При установлении недостаточности санации ее обработку повторяли.
После этого, осуществляли следующую процедуру - первый этап плазмодинамической обработки вагинальной полости (полость организма сложной конфигурации и большой глубины) через промежуточный раствор 13 (фиг.6).
Во влагалище вводили решетчатый расширитель-ограничитель 12, заполняли вагинальную полость промежуточным лекарственным раствором (0,9% физиологический раствор), проводили через центратор расширителя-ограничителя в заполненную раствором полость канюлю 7 с перфорированным полусферическим рабочим окончанием, связанную через патрубок 6 с ВИЭР-узлом 5. После этого включали аппаратный комплекс "ВИЭРТОН" 1 с одновременным включением в работу: генератора озона 2 с кислородной емкостью, генератора высоковольтных электрических импульсов (ГВЭИ) 4 и ВИЭР-узла. После этого проводили плазмодинамическую обработку инфицированных тканей влагалища и влагалищной части шейки матки через промежуточный раствор путем его непрерывного барбатирования потоком высокоактивной газовой смеси - O*, O2*+(О3+O2) в течение 2-5 минут в зависимости от объема вагинальной полости и выраженности воспалительного процесса. После окончания процедуры плазмодинамической обработки очага инфекции во влагалище и влагалищной части шейки матки выключали аппаратный комплекс "ВИЭРТОН", прекращая подачу потока вышеуказанной высокоактивной газовой смеси, отводили из вагинальной полости канюлю, эвакуировали из полости остатки отработанного лекарственного промежуточного раствора и убирали из влагалища расширитель-ограничитель.
Следующая процедура лечения генитального кандидоза - второй этап плазмодинамической обработки вагинальной полости (фиг.7), включающем в себя обработку ранее санированных (на предварительном и первом этапах лечения) тканей влагалища и влагалищной части шейки матки в течение 1-2 минут (без использования промежуточного раствора) потоком высокоактивной газовой смеси - O*, O2*+(О3+O2) и УФ излучения. Для этого из конусной части несущего корпуса 5.1 ВИЭР-узла 5 удаляли сменный выпускной штуцер 5.8 с присоединенными к нему патрубком 6 и канюлей 7 с обеспечением одновременного воздействия на очаг инфекции потоком O*, O2*+(О3+O2), а также потоком импульсного УФ излучения и электромагнитным полем искрового разряда, генерируемых коаксиальной электродной системой 5.2 ВИЭР-узла, конусная часть которого устанавливается на место снятого ранее центратора расширителя-ограничителя.
Общее количество сеансов за один цикл лечения генитального кандидоза, проводимого с применением аппарата для плазмодинамической обработки инфицированных ран и полостей - 8-10. За один сеанс проводят не менее 3 процедур, в обязательном порядке включающих этапы ультразвуковой санации и санациии тканей влагалища и влагалищной части шейки матки через промежуточный раствор с его барбатированием потоком высокоактивной газовой смеси - О*, O2*+(О3+O2), а также этап аэрации (без использования промежуточного раствора) тканей влагалища и влагалищной части шейки матки потоками высокоактивной газовой смеси - O*, O2*+(О3+O2) и УФ излучения.
По окончании цикла лечения производили забор из влагалища и влагалищной части шейки матки мазок, проводили кольпоскопию с выдачей заключения о необходимости прекращения или продолжения лечения. Положительный результат лечения у пациентки генитального кандидоза достигнут за 8 сеансов (по 1 сеансу лечения в день), что в среднем в 2-3 раза сокращает время лечения пациентов, страдающих этим видом заболевания.
Клиническая апробация технического решения в виде опытного образца "Аппарата "ВИЭРТОН" для плазмодинамической обработки инфицированных ран и полостей организма" в клиниках кафедры онкологии ОмГМА и кафедры акушерства и гинекологии ОмГМА при лечении инфицированных ран и полостей организма у 11 больных (6 - пациенты акушерско-гинекологического профиля) показала возможность повышения эффективности лечения больных в виде: сокращения сроков лечения травматических и операционных ран, уменьшения количества используемых при лечении дорогостоящих лекарственных средств и лекарственной нагрузки на организм больного.
Заявляемое техническое решение - "Аппарат для плазмодинамической обработки инфицированных ран и полостей организма" может быть использовано в разных отраслях клинической медицины при лечении воспалительных заболеваний, инфицированных ран и полостей организма в общей хирургии, травматологии и ортопедии, оториноларингологии, бронхологии, гинекологии, стоматологии, нейрохирургии, косметологической хирургии и пр., вирусных инфекций в инфектологии, а также в косметологии и спортивной медицине.
Источники информации
1. Патент РФ №2040935 "Способ стерилизации объекта", кл. A 61 L 2/14, 1995.
2. Патент РФ №2080092 "Аппарат для высоковольтной импульсной электроразрядной обработки инфицированных ран", кл. A 61 B 17/00, 1997.
3. Горожанкина Г.И., Педдер В.В. и др. Исследование интенсивности излучения ВИЭР в УФ-диапазоне при ЭГ-обработке биосистем в разных режимах работы ЭГ-преобразователя.//Биомедицинская технология и приборостроение. Омск, 1989. - С.24-34.
4. Гришин Ю.М., Козлов Н.П., Кутырев М.В. Импульсные излучающие разряды в системах очистки газов и переработки токсичных органических веществ.//Материалы научно-технич. конф. "Экология-97". С.-Петербург, 1997. - С.119-120.
5. Лунин В.В., Попович М.П., Ткаченко С.Н. Физическая химия озона. М.: МГУ, 1998. - 480 с.
6. Патент РФ №2038289 "Электроразрядный озонатор с неоднородным электрическим полем", кл. C 01 B 13/11, 1995.
7. Отчет о НИР "Разработка и внедрение в клинику технологии и аппаратуры для электрогидравлической обработки ран и стерилизации хирургического инструмента" (заключительный)/Научный рук. В.В.Педдер. - Тема №347-НПУ, - Гос. регистр. №01870096263. - Омск: ОМПИ, 1989.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОФИЛАКТИКИ ИМПЛАНТАЦИОННОГО МЕТАСТАЗИРОВАНИЯ ПРИ ХИРУРГИЧЕСКОМ ЛЕЧЕНИИ ОПУХОЛЕЙ | 2005 |
|
RU2300324C1 |
| АППАРАТ ДЛЯ ВЫСОКОВОЛЬТНОЙ ИМПУЛЬСНОЙ ЭЛЕКТРОРАЗРЯДНОЙ ОБРАБОТКИ ИНФИЦИРОВАННЫХ РАН | 1994 |
|
RU2080092C1 |
| СПОСОБ ОБРАБОТКИ ИНФИЦИРОВАННЫХ РАН И УСТАНОВКА ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1997 |
|
RU2175539C2 |
| Устройство индивидуальное для защиты органов дыхания от инфицирования | 2020 |
|
RU2740273C1 |
| СПОСОБ ОБРАБОТКИ БИОТКАНЕЙ ОЧАГА ИНФЕКЦИИ ПРИ ЛЕЧЕНИИ ОДОНТОГЕННЫХ ФЛЕГМОН ЧЕЛЮСТНО-ЛИЦЕВОЙ ОБЛАСТИ | 2000 |
|
RU2175258C1 |
| СПОСОБ ЛЕЧЕНИЯ СИНДРОМА ДИАБЕТИЧЕСКОЙ СТОПЫ | 2004 |
|
RU2277002C1 |
| СПОСОБ ОЗОН/NO-УЛЬТРАЗВУКОВОЙ ТЕРАПИИ ЭКССУДАТИВНЫХ СИНУСИТОВ | 2006 |
|
RU2322217C2 |
| Устройство дистантной озон/NO-ультразвуковой обработки гнойных ран | 2022 |
|
RU2790116C1 |
| СПОСОБ ЛЕЧЕНИЯ РОЖИ | 1999 |
|
RU2190438C2 |
| УСТРОЙСТВО ДЛЯ ТЕРМО- И ФОТОХРОМО-УЛЬТРАЗВУКОВОЙ ОБРАБОТКИ БИОТКАНЕЙ | 2010 |
|
RU2433785C1 |
Изобретение относится к области медицины, в частности к устройствам, используемым для профилактики и лечения ран и раневой инфекции, а так же в инфектологии. Аппарат для плазмодинамической обработки инфицированных ран и полостей организма, содержащий генератор высоковольтных электрических импульсов с малогабаритным высоковольтным импульсным электроразрядным узлом, в несущем диэлектрическом корпусе которого размещена коаксиальная электродная система, состоящая из кольцевого и стержневого электродов, разделенных диэлектрическим изолятором. Коаксиальная электродная система размещена внутри оптически прозрачного кварцевого элемента, выполненного в виде колбы с перфорированным полусферическим рабочим окончанием, установленной с зазором относительно внутренней поверхности несущего корпуса узла, часть внутренней поверхности которого в области полусферического рабочего окончания колбы выполнена из материала, отражающего излучение видимого и УФ спектра. На рабочей части несущего корпуса узла установлен сменный выпускной штуцер с присоединенным к нему патрубком, соединенным с канюлей, имеющей на противоположном конце перфорированное полусферическое рабочее окончание, а на противоположной торцевой части несущего корпуса узла установлена опорная герметизирующая втулка с впускным штуцером, соединенным с генератором озона, сопряженным с емкостью с кислородом, и сообщенным с зазором между внутренней поверхностью несущего корпуса узла и наружной поверхностью колбы. Использование изобретения позволяет повысить эффективность лечения инфицированных ран и полостей организма сложной конфигурации и повысить надежность работы аппарата. 1 з.п. ф-лы, 8 ил.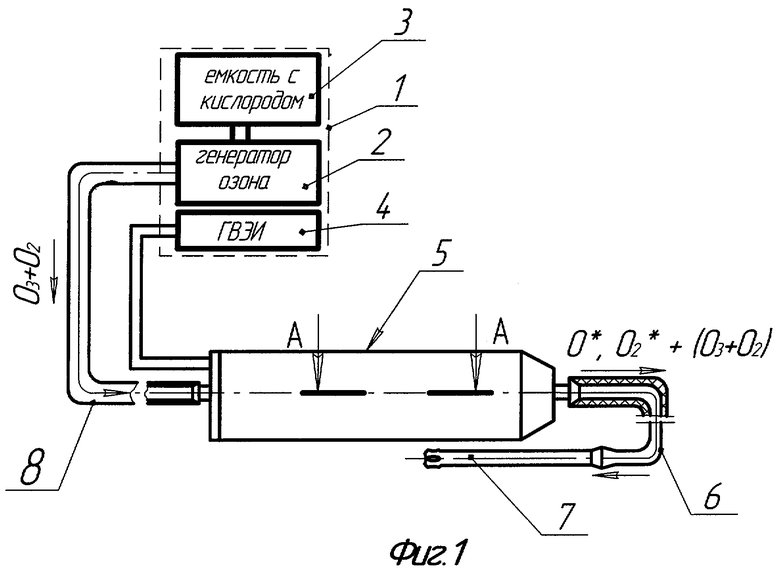
| АППАРАТ ДЛЯ ВЫСОКОВОЛЬТНОЙ ИМПУЛЬСНОЙ ЭЛЕКТРОРАЗРЯДНОЙ ОБРАБОТКИ ИНФИЦИРОВАННЫХ РАН | 1994 |
|
RU2080092C1 |
| УСТРОЙСТВО ДЛЯ КОМБИНИРОВАННОЙ БАКТЕРИЦИДНОЙ ОБРАБОТКИ | 2001 |
|
RU2211051C2 |
| СПОСОБ ЛЕЧЕНИЯ РАН И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1992 |
|
RU2008042C1 |
| УСТРОЙСТВО ДЛЯ УЛЬТРАФИОЛЕТОВОГО ОБЛУЧЕНИЯ | 2001 |
|
RU2184579C1 |
| РАЗРЯДНАЯ КАМЕРА ОЗОНАТОРА | 2001 |
|
RU2184076C1 |
Авторы
Даты
2005-08-20—Публикация
2004-01-09—Подача