Изобретение относится к новым производным витамина D3. Более детально, данное изобретение относится к производным витамина D3, замещенным атомом серы в положении 22, к способам получения таких производных. Данное изобретение относится также к промежуточным продуктам, применяемым для получения указанных соединений, и к способам получения таких промежуточных продуктов.
Известно, что витамин D3, проявляет различные типы физиологической активности, в том числе регуляцию кальциевого метаболизма, индукцию дифференциации, иммунорегуляцию и т.д.
В последние годы физиологическая активность D-витаминов была подробно исследована. Известно, что D-витамины, например, 1α, 25-дигидроксивитамин D3, проявляет широкий спектр физиологических активностей, в том числе регулирует кальциевый метаболизм, ингибирует пролиферацию или вызывает дифференциацию онкоцитов или подобных клеток, является иммунорегулятором и т.д. Однако 1α, 25-дигидроксивитамин D3 не подходит для применения в качестве, например, противоопухолевого, противоревматического и им подобных средств, т.к. он вызывает гиперкальциемию после длительного и непрерывного введения. Недавно синтезирован ряд производных витамина D с целью разделения указанных активностей витамина D и была изучена физиологическая активность этих новых производных.
Одним из примеров таких производных является 1α,3β-дигидрокси-20(S)-(3-гидрокси-3-метилбутилокси-9,10-секопрегна- 5,7,10(19)-триен, которое является производным витамина D3, замещенным атомом кислорода в 22-положении, описанное в JPA (Unexamimed Japanese, Patent Application) 61 - 267550 (1986).
Краткое изложение существа изобретения.
После тщательного изучения производных витамина D авторы данного изобретения обнаружили, что производные витамина D, замещенные атомом серы в 22-положении, проявляют сильное ингибирующее действие в отношении пролиферации кератиноцитов.
Данное изобретение относится к производным 22-тиавитамина D следующей общей формулы I: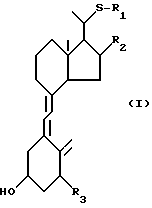
где R1 представляет собой C1-10-алкил, который может быть замещен одной или более гидроксильными группами; R2 представляет собой атом водорода или гидроксильную группу; и R3 представляет собой атом водорода или гидроксильную группу; и к способам получения таких производных.
Данное изобретение относится также к синтетическим промежуточным продуктам, которые используются для получения соединений общей формулы I, и к способам получения таких промежуточных продуктов.
Фиг. 1 представляет собой график, показывающий ингибирующее действие на пролиферацию кератиноцитов человека при различных концентрациях 1α, 25-дигидроксивитамина D3.
Фиг. 2 представляет собой график, показывающий ингибирующее действие на пролиферацию кератиноцитов человека при различных концентрациях соединения по примеру 88.
Фиг. 3 представляет собой график, показывающий ингибирующее действие на пролиферацию кератиноцитов человека при различных концентрациях 1α, 25-дигидроксивитамина D3.
Фиг. 4 представляет собой график, показывающий ингибирующее действие на пролиферацию кератиноцитов человека при различных концентрациях соединения по примеру 33.
Фиг. 5 представляет собой график, показывающий ингибирующее действие на пролиферацию кератиноцитов человека при различных концентрациях соединения по примеру 35.
Предпочтительные варианты воплощения изобретения.
Как описано выше, данное изобретение относится к производным 22-тиавитамина D следующей общей формулы I: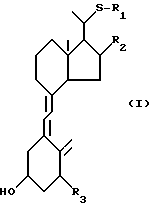
где R1 представляет собой C1-10-алкил, который может быть замещен одной или более гидроксильными группами; R2 представляет собой атом водорода или гидроксильную группу; и R3 представляет собой атом водорода или гидроксильную группу.
В соединениях общей формулы I R3 предпочтительно является гидроксильной группой. R1 предпочтительно является C1-10-алкилом, замещенным одной или более гидроксильными группами, и более предпочтительно является группой следующей общей формулы III: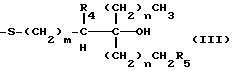
где R4 и R5, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или гидроксильную группу, при условии, что оба они не могут быть гидроксильными группами; m представляет собой целое число от 1 до 4, и n представляет собой целое число от 0 до 2. Более предпочтительно, R4 и R5 представляют собой атомы водорода.
Стереоконфигурация соединений общей формулы I специально не ограничена, но предпочтительно соответствует общей формуле II:
где R1 представляет собой C1-10-алкил, который может быть замещен одной или более гидроксильными группами, и R2 представляет собой атом водорода или гидроксильную группу.
Данное изобретение относится также к способам получения производных витамина D3, замещенным атомом серы в 22-положении. Соответственно данное изобретение относится к способу получения соединений общей формулы XVI: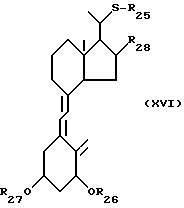
где R25 представляет собой C1-10-алкил, который может быть замещен одной или более гидроксильными группами; R26 и R27, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или защитную группу; и R28 представляет собой атом водорода или гидроксильную группу, облучением светом и термической изомеризацией соединений общей формулы XV: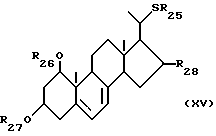
где R25 представляет собой C1-10-алкил, который может быть замещен одной или более гидроксильными группами, R26 и R27, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или защитную группу, и R28 представляют собой атом водорода или гидроксильную группу.
Данное изобретение относится также к синтетическим промежуточным соединениям, которые используются для получения соединений общей формулы I, и к способам получения таких промежуточных соединений.
Характерные примеры синтетических промежуточных соединений включают, например, соединения общей формулы VI: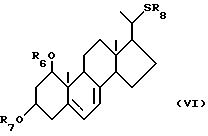
где R6 и R7, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или защитную группу, a R8 представляет собой C1-10-алкил, который может быть замещен;
- соединения общей формулы XI: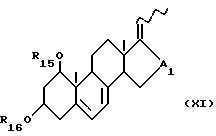
где R15 и R16, которые могут быть одинаковыми или различными, каждый представляет атом водорода или защитную группу и A1 представляет собой -CHOH- или -CO-; и
- соединения общей формулы XIII: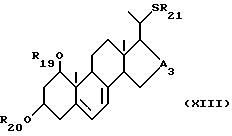
где R19 и R20, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или защитную группу, R21 представляет собой C1-10-алкил, который может быть замещен, и A3 является -CHOH- или -CO-.
Особенно предпочтительными примерами синтетических промежуточных веществ являются, например,
- соединения общей формулы X: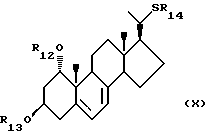
где R12 и R13, которые могут быть одинаковыми или различными, каждый представляет собой
- атом водорода или защитную группу, а R14 представляет собой C1-10-алкил, который может быть замещен;
- соединения общей формулы XII: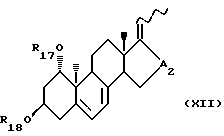
где R17 и R18, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или защитную группу и A2 является -CHOH- или -CO-; и
- соединения общей формулы XIV: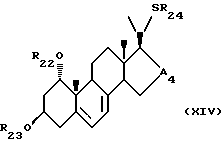
где R22 и R23, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или защитную группу, R24 представляет собой C1-10-алкил, который может быть замещен и A4 является -CHOH- или -CO-.
Каждый из R8, R11, R14, R21, и R24 предпочтительно представляют собой C1-10-алкил, замещенный одной или более гидроксильными группами, более предпочтительно - группу общей формулы III: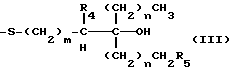
где R4 и R5, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или гидроксильную группу, причем оба они не могут быть гидроксильными группами, m представляет собой целое число от 1 до 4 и n представляет собой целое число от 0 до 2, и более предпочтительна группа общей формулы III, где R4 и R5 являются атомами водорода.
В настоящем изобретении C1-10-алкильная группа, которая может быть замещена гидроксильными группами, представляет собой алкильные группы с прямой или разветвленной цепью, такие как метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил и деканил. Предпочтительными примерами являются 3-метилбутил, 3-этилпентил, 4-метилпентил, 3-(н-пропил)гексил, 4-этилгексил, 5-метилгексил, 6-метилгептил, 5-этилгептил и 4-(н-пропил)гептил, более предпочтительны 3-метилбутил, 3-этилпентил и 4-метилпентил.
В C1-10-алкилах, которые могут быть замещены одной или более гидроксильными группами, количество гидроксильных заместителей равно, например, 0, 1, 2, 3, предпочтительно 1 или 2, более предпочтительно 1.
Примерами C1-10-алкилов, замещенных одной или более гидроксильными группами, являются 3-гидрокси-3-метилбутил, 2-гидрокси-3-метилбутил, 4-гидрокси-3-метилбутил,2,3-дигидрокси-3-метилбутил, 2,4-дигидрокси-3-метилбутил, 3,4-дигидрокси-3-метилбутил, 3-гидрокси-3-этилпентил, 2-гидрокси-3-этилпентил, 4-гидрокси-3-этилпентил, 2,3-дигидрокси-3-этилпентил, 2,4-дигидрокси-3-этилпентил, 3,4-дигидрокси-3-этилпентил, 4-гидрокси-4-метилпентил, 3-гидрокси-4-метилпентил, 5-гидрокси-4-метилпентил, 3,4-дигидрокси-4-метилпентил, 3,5-дигидрокси-4-метилпентил, 4,5-дигидрокси-4-метилпентил, 3-гидрокси-3-(н-пропил)гексил, 4-гидрокси-3-(н-пропил)гексил, 2-гидрокси-3-(н-пропил)гексил, 2,3-дигидрокси-3-(н-пропил)гексил, 3,4-дигидрокси-3-(н-пропилгексил), 2,4-дигидрокси-3-(н-пропил)гексил, 3-гидрокси-4-этилгексил, 4-гидрокси-4-этилгексил, 5-гидрокси-4-этилгексил, 3,4-дигидрокси-4-этилгексил, 3,5-дигидрокси-4-этилгексил, 4,5-дигидрокси-4-этилгексил, 4-гидрокси-5-метилгексил, 5-гидрокси-5-метилгексил, 6-гидрокси-5-метилгексил, 4,5-дигидрокси-5-метилгексил, 4,6-дигидрокси-5-метилгексил, 5,6-дигидрокси-5-метилгексил, 5-гидрокси-6-метилгептил, 6-гидрокси-6-метилгептил, 7-гидрокси-6-метилгептил, 5,6-дигидрокси-6-метилгептил, 5,7-дигидрокси-6-метилгептил, 6,7-дигидрокси-6-метилгептил, 4-гидрокси-5-этилгептил, 5-гидрокси-5-этилгептил, 6-гидрокси-5-этилгептил, 4,5-дигидрокси-5-этилгептил, 4,6-дигидрокси-5-этилгептил, 5,6-дигидрокси-5-этилгептил, 3-гидрокси-4-(н-пропил)гептил, 4-гидрокси-4-(н-пропил)гептил, 5-гидрокси-4-(н-пропил)гептил, 3,4-дигидрокси-4-(н-пропил)гептил, 3,5-дигидрокси-4-(н-пропил)гептил и 4,5-дигидрокси-4-(н-пропил)гептил; предпочтительны 3-гидрокси-3-метилбутил, 2,3-дигидрокси-3-метилбутил, 3,4-дигидрокси-3-метилбутил, 3-гидрокси-3-этилпентил, 2,3-дигидрокси-3-этилпентил, 3,4-дигидрокси-3-этилпентил, 4-гидрокси-4-метилпентил, 3,4-дигидрокси-4-метилпентил и 4,5-дигидрокси-4-метилпентил; более предпочтительны 3-гидрокси-3-метилбутил, 3-гидрокси-3-этилпентил и 4-гидрокси-4-метилпентил.
Защитные группы, используемые в настоящем изобретении, включают ацил, замещенный силил, замещенный алкил или подобные группы; предпочтительными являются ацил и замещенный силил.
Ацильные группы в данном изобретении представляют собой формильную группу, низшую алкилкарбонильную группу, которая может быть замещена, арилкарбонильную группу, которая может быть замещена, аралкилкарбонильную группу, которая может быть замещена, низшую алкилоксикарбонильную группу, которая может быть замещена, арилоксикарбонильную группу, которая может быть замещена, или аралкилоксикарбонильную группу, которая может быть замещена; предпочтительны формильная группа, низшая алкилкарбонильная группа, фенилкарбонильная группа, которая может быть замещена, низшая алкилоксикарбонильная группа, фенилалкилоксикарбонильная группа, которая может быть замещена; более предпочтительны формил, ацетил, пропионил, бутирил, пивалоил, бензоил, этоксикарбонил, трет-бутоксикарбонил, бензилоксикарбонил.
Замещенными силильными группами являются силильная группа, которая замещена одним или более алкилами, которые могут быть замещены, или арилами, которые могут быть замещены, и т.п., предпочтительна тризамещенная силильная группа. Примеры предпочтительных замещенных силильных групп включают триметилсилил, триэтилсилил, триизопропилсилил, трет-бутилдифенилсилил и трет-бутилдиметилсилил.
Замещенными алкильными группами являются алкил, содержащий один или более заместителей. Предпочтительными примерами заместителей являются арил, который может быть замещен, алкилоксигруппа, которая может быть замещена, и т. п. , особенно алкилоксигруппы, которые могут быть замещены алкилокси- или другой группой. Алкилоксигруппами, которые могут быть замещены алкилокси- или другой группой, могут быть, например, метоксиметил, 2-метоксиэтоксиметил и тетрагидропиран-2-ил.
Защитными группами для каждого из R6, R7, R12, R13 являются предпочтительно группы, устойчивые в кислых условиях, более предпочтительно ацил, и наиболее предпочтительно - ацетил. Защитными группами для каждого из R9, R10, R15, R16, R17, R18, R19, R20, R22, R23 являются предпочтительно силильные группы, более предпочтительно триметилсилил, триэтилсилил, триизопропилсилил, трет-бутилдиметилсилил и трет-бутилдифенилсилил; более предпочтителен трет-бутилдиметилсилил.
Восстановительные условия в данном изобретении означают то, что в реакционной системе присутствует восстанавливающий агент; восстанавливающие агенты включают боран, триалкилсилан, предпочтительно триалкилсилан, более предпочтительно триэтилсилан.
Основные условия в данном изобретении означают присутствие в реакционной системе основания, которое может существовать в виде тиоалкоголята; основания включают гидроксид калия, гидроксид натрия, тетраборат натрия, предпочтителен тетраборат натрия.
Заместители в данном изобретении включают например, атом галогена и циано-, нитро-, гидрокси-, алкокси-, амино-, меркапто- и ацилоксигруппы.
Особенно предпочтительными примерами заместителей в R8, R11, R14, R21, R24 являются, например, гидроксил, алкокси- и ацилоксигруппы, наиболее предпочтительна гидроксильная группа.
Соединения данного изобретения обладают сильным ингибирующим действием в отношении пролиферации кератиноцитов. В соединениях данного изобретения пространственная конфигурация в 20-положении и пространственная конфигурация гидроксильных групп могут быть либо R, либо S или либо α, либо β.
Соединения данного изобретения предпочтительно замещены в положении 1 гидроксильной группой, которая предпочтительно находится в α-конфигурации.
Все соединения данного изобретения являются новыми и синтезированы, например, как описано ниже.
Тиол, используемый в качестве исходного материала для синтеза боковой цепи в 22-положении, был получен в соответствии со способом, описанным в JPA-5-505613 (1993) или в соответствии со способом следующей схемы 1: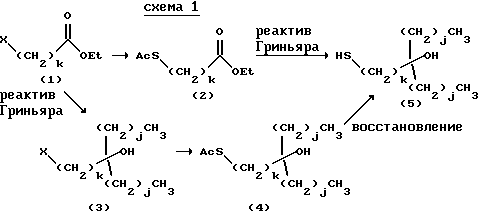
где X представляет собой атом галогена, j представляет собой целое число от 0 до 2 и k представляет собой целое число от 2 до 5.
А именно, он получен исходя из галогенированного сложного эфира реакцией с (1) металлической солью тиокарбоновой кислоты типа тиоацетата калия и (2) с реактивом Гриньяра. Он также может быть получен реакцией исходного материала сначала с (2), а затем с (1) с последующим гидролизом полученного таким образом соединения в восстанавливающих или щелочных условиях.
Соединения общей формулы I, где R2 представляет атом водорода, получают, например, способом по схеме 2: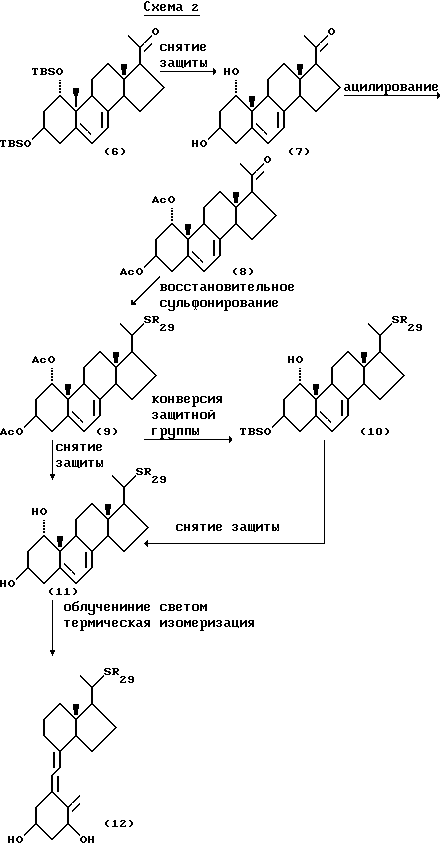
где R29 представляет собой C1-10-алкил, который может быть замещен.
В схеме 2 исходное соединение (6) получают, например, по способу Murayama и др. (Вioorg. Med. Chem. Zett. 2, 1289 (1992). Защитную группу у гидроксильной группы указанного соединения (6) удаляют и затем гидроксил снова защищают ацильной группой, предпочтительно ацетилом, получая соединение (8). Соединение (8) подвергают реакции восстановительного сульфирования с получением соединения (9). Восстановительное сульфирование проводят, например, с применением комплексов трехфтористый бор/простой эфир или моногидрат трехфтористого бора/триэтилсилан или трифторуксусная кислота/боранпиридин, предпочтительно применение комплексa эфир-трехфтористый бор/триэтилсилан.
Растворители, используемые в данной реакции, могут включать, например, галогенсодержащие растворители, простые эфиры, ароматические углеводороды, предпочтительны галогенсодержащие растворители, более предпочтителен дихлорметан.
Температура реакции зависит от природы соединения, реагентов и других факторов, но в основном соответствует температуре, при которой не происходит изомеризация 5,7-диеновой части, предпочтительно от -30oC до комнатной температуры, более предпочтительно около 0oC.
Время реакции зависит от используемых реагентов, количества соединений и других факторов, как правило, равно от 1 до 12 ч, предпочтительно 3-10 ч, более предпочтительно 5-7 ч.
Затем у полученного соединения (9) обычным способом удаляют защитные группы и после необязательного разделения диастереомеров облучают светом и термически изомеризуют, получая соединение (12). Если трудно разделить диастереомеры на данной стадии, защитные группы у гидроксильных групп в одном или обоих положениях 1-3 могут быть превращены в соответствующие защитные группы, которые необходимы для осуществления процесса разделения диастереомеров.
Соединения общей формулы I, где R2 является гидроксильной группой, получены, например, способом по схеме 3: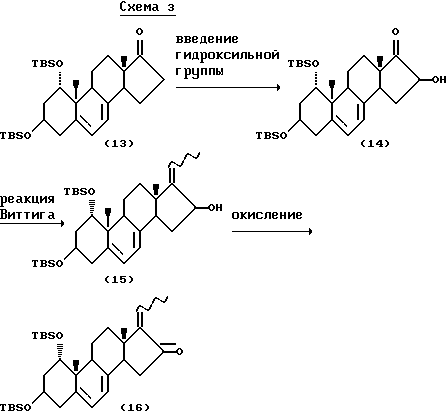
В схеме 3 исходное вещество (13) синтезировано, например, по способу Murayama и др. (Chem. Pharm. Bull. 34, 4410 (1986)). Сначала в положение 16 соединения (13) вводят кислородсодержащую функциональную группу. Кислородсодержащую функциональную группу вводят, например, с применением 2-(фенилсульфонил)-3-фенилоксазилидина в присутствии основания или путем введения в положение 16 сначала галогена с последующим превращением его в гидроксильную группу, предпочтительно применение 2-(фенилсульфонил)-3-фенилоксазилидина в присутствии основания. В качестве основания используют алкоксиды металлов, амиды металлов, гидриды металлов и т.п., предпочтительны алкоксиды, металлов, более предпочтителен трет-бутоксид калия.
Полученное соединение (14) вводят в реакцию Виттига и получают соединение (15) в виде смеси E, Z - изомеров, которое затем окисляют с получением соединения (16). Последняя реакция может быть обычной реакцией окисления с применением хромата, диметилсульфоксида и т.п., предпочтительно использование в реакции окисления диметилсульфоксида. Если E,Z-смесь соединения (15) окисляют на данной стадии двуокисью марганца, в реакцию вступает только Е-изомер, и образуется соединение (16), состоящее из Е-изомера. Непрореагировавший Z-изомер соединения (15) может быть стереоселективно превращен в соединение (16), состоящее из Z-изомера, окислением по Шверну (Swern) или как показано на следующей схеме 4: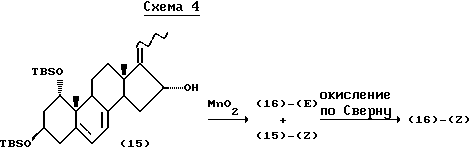
Е-изомер соединения (15) может также быть получен способом по следующей схеме 5: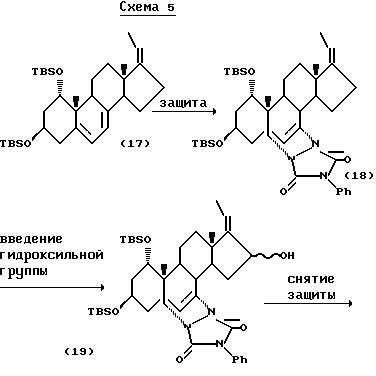
Исходное соединение (17) в схеме 5 может быть синтезировано, например, по способу Murayama и др. (Chem, Pham. Bull. 34, 4410 (1986)). 5,7-Диеновую часть соединения (17) защищают защитной группой типа 4-фенил-1,2,4-триазолин-3,5-диона, после этого окисляют окислителем типа двуокиси селена, хромовой кислоты, ацетата марганца (III), предпочтительно двуокисью селена, и затем удаляют защитную группу с получением Е-изомера соединения (15).
Соединение (16), полученное по способу, описанному выше, превращают в соединение (20) 1,4-присоединением различных тиолов, как показано на следующей схеме 6: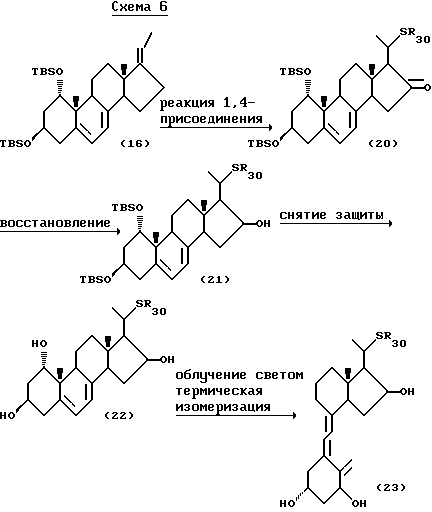
где R30, представляет собой C1-10-алкил, который может быть замещен.
Указанная реакция может быть осуществлена обычной реакцией 1, 4-присоединения к α,β-ненасыщенным кетонам. Эта реакция может быть проведена, например, в основных условиях, предпочтительно с применением гидроксида натрия, тетрабората натрия, более предпочтительно тетрабората натрия.
Выбор используемого растворителя зависит от применяемого реагента и других факторов. Если используют тетраборат натрия, в качестве растворителя используют простые эфиры или спирты в чистом виде или в смеси с водой, предпочтительна смесь простого эфира и воды, более предпочтительна смесь тетрагидрофурана и воды.
Температура реакции зависит от используемых реагентов и других факторов и, как правило, находится в пределах от -20 до 60oC, предпочтительно от 0 до 40oC, более предпочтительно от 15 до 25oC.
Время реакции зависит от используемого реагента, количества соединения и других факторов, и обычно составляет от 3 до 24 ч, предпочтительно от 9 до 15 ч, более предпочтительно от 12 до 15 ч.
Соединение (20), полученное выше, может быть превращено в соединение (23) восстановлением, удалением защитных групп, облучением светом и термической изомеризацией обычным способом.
Следующие примеры объясняют данное изобретение в деталях, но не предназначены для ограничения объема данного изобретения.
Используемые обозначения.
В описании ЯМР спектров используют следующие обозначения:
m - мультиплет;
d - дублет;
t - триплет;
dd - двойной дублет;
brs - уширенный синглет;
S - синглет;
q - квартет.
Пример 1.
4-Этил-4-гидрокси-1-гексантиол.
К ацетону (30 мл) прибавляли этиловый эфир 4-броммасляной кислоты (1,5 мл, 10,5 ммоль) и тиоацетат калия (1,8 г, 15,8 ммоль), смесь перемешивали при комнатной температуре 30 мин и затем фильтровали; твердый осадок промывали ацетоном. Фильтрат концентрировали и затем очищали колоночной хроматографией на силикагеле (гексан:этилацетат=5:1), получая этиловый эфир 4-ацетилтиомасляной кислоты (2,03 г). Далее этилмагнийбромид (1,04 М раствор в тетрагидрофуране, 31,3 мл, 32,6 ммоль) в сухом тетрагидрофуране (8 мл) охлаждали до 0oC в атмосфере аргона и добавляли по каплям раствор 886 г полученного выше соединения в сухом тетрагидрофуране (4 мл); смесь перемешивали при комнатной температуре 2 ч. Реакционную смесь гасили водным насыщенным раствором хлористого аммония, подкисляли 10%-ной соляной кислотой и экстрагировали этилацетатом. Экстракт промывали рассолом и сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении, и остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат=4:1), получая соединение, указанное в заголовке (221 мг, 2 стадии, 29%).
ИК-спектр (чистый): 3450, 2950, 2550, 1460, 1370, 1240, 1170 см-1.
Спектр 1H ЯМР (60 МГц) δ: 2,47 (t, 2Н), 1,74-1,08 (m, 8Н), 0,84 (t, 6H).
Пример 2.
5-Гидрокси-5-метил-1-гексантиол.
В атмосфере аргона к раствору метилмагнийбромида (0,99 М раствор в тетрагидрофуране, 70 мл, 69,3 ммоль) в сухом тетрагидрофуране (80 мл) добавляли по каплям раствор этилового эфира 5-бромвалериановой кислоты (3,66 мл, 23,1 ммоль) в сухом тетрагидрофуране (10 мл) при 0oC, и смесь перемешивали при комнатной температуре 1,5 ч; затем гасили водным насыщенным раствором хлористого аммония, выливали в воду и экстрагировали этилацетатом. Экстракт промывали рассолом и сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении и получали неочищенный 6-бром-2-метил-2-гексанол (5,28 г). Этот неочищенный продукт растворяли в ацетоне (80 мл) и добавляли тиоацетат калия (3,96 г, 34,7 ммоль). Смесь перемешивали 1,5 ч при комнатной температуре и фильтровали, затем фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан: этилацетат= 4: 1) и получали 6-ацетилтио-2-метил-2-гексанол (3,75 г). Полученный таким образом 6-ацетилтио-2-метил-2-гексанол растворяли в тетрагидрофуране (130 мл) и порциями при 0oC добавляли алюмогидрид лития (2,24 г, 59,0 ммоль). После этого суспензию перемешивали при комнатной температуре 1,5 ч, избыток алюмогидрида лития обрабатывали этилацетатом и реакционный раствор подкисляли 4N соляной кислотой. Раствор экстрагировали этилацетатом, органический слой промывали рассолом, сушили над сульфатом магния, и растворитель затем удаляли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат = 4:10), получая соединение, указанное в заголовке (2,95 г, 3 стадии, 85%).
ИК-спектр (чистый): 3400, 2950, 2550, 1460, 1370, 1240, 1140, 1040 см-1.
Спектр 1H ЯМР (60 МГц ) δ: 2,47 (t, 2Н), 1,92-1,28 (m, 6Н), 1,18 (S, 6Н).
Пример 3.
6-Гидрокси-6-метил-1-гептантиол.
Соединение, указанное в заголовке, синтезировали из этилового эфира 6-бромкапроновой кислоты по способу примера 2.
ИК-спектр (чистый): 3400, 2950, 2550, 1460, 1370, 1240, 1140, 1040 см-1.
Спектр 1H ЯМР (60 МГц) δ: 2,47 (t, 2Н), 1,92-1,28 (m, 8Н), 1,18 (S, 6Н).
Пример 4.
3-Гидрокси-3-н-пропил-1-гексантиол.
Соединение, указанное в заголовке, синтезировали из этилового эфира 3-бромпропионовой кислоты и н-пропилмагнийбромида по способу примера 2.
ИК-спектр (чистый): 3450, 2950, 2550, 1460, 1370, 1240, 1150, 1040 см-1.
Спектр 1H ЯМР (60 МГц) δ: 2,47 (t, 2Н), 1,94-0,74 (m, 16H).
Пример 5.
1α, 3β-Дигидрокси-20-оксопрегна-5,7-диен.
В атмосфере аргона к раствору 1α,3β-бис(трет-бутилдиметилсилилокси)-20-оксопрегна-5,7-диена (4,10 г, 7,33 ммоль) в сухом тетрагидрофуране (80 мл) прибавляли фторид тетра-н-бутиламмония (1М раствор в тетрагидрофуране, 74 мл, 74,0 ммоль) и смесь кипятили 16 ч. Затем смесь выливали в воду и экстрагировали этилацетатом. Органический слой тщательно промывали 10%-ной соляной кислотой, водным насыщенным раствором бикарбоната натрия и рассолом и сушили над сульфатом магния. После отгонки растворителя при пониженном давлении остаток очищали колоночной хроматографией на силикагеле (дихлорметан: этанол = 15: 1), получая указанное в заголовке соединение (1,68 г, 69%) в виде белого твердого вещества.
ИК-спектр (чистый): 3400, 2930, 1700, 1360, 1050 см-1.
Спектр 1H ЯМР δ: 5,73-5,66 (m, 1H), 5,43-5,36 (m, 1H), 4,12-3,93 (m, 1H), 3,80-3,73 (brs, 1H), 2,16 (S, 3H), 0,93 (S, 3H), 0,59 (S, 3H).
Масс-спектр масса/заряд (m/z): 330 (M+), 251 (100%).
УФ-спектр λmax нм: 271, 283, 294.
Пример 6.
1α,3β-Диацетокси-20-оксопрегна-5,7-диен.
Раствор соединения, полученного в примере 5 (1,68 г, 5,08 ммоль), уксусного ангидрида (30 мл) и 4-диметиламинопиридина (ДМАП, 60 мг) в пиридине (60 мл) перемешивали при комнатной температуре 4 ч. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали рассолом и сушили над сульфатом магния. Растворитель отгоняли при пониженном давлении и остаток очищали колоночной хроматографией на силикагеле (гексан: этилацетат= 3: 1), получая указанное в заголовке соединение (1,65 г, 78%) в виде белого твердого вещества.
ИК-спектр (чистый): 2970, 1740, 1700, 1440, 1360, 1240, 1040 см-1.
Спектр 1H ЯМР δ: 5,70-5,60 (m, 1Н), 5,44-5,34 (m, 1H), 5,07-4,85 (m, 2Н), 2,14 (S, 3Н), 2,10 (S, 3Н), 2,04 (S, 3Н), 1,01 (S, 3Н), 0,57 (S, 3Н).
Масс-спектр m/z: 414 (М+), 294 (100%).
УФ-спектр λmax нм: 270, 281, 292.
Пример 7.
1α,3β-Диацетокси-20-(3-гидрокси-3-метилбутилтио)-прегна-5,7-диен (смесь 20R- и S-изомеров).
В атмосфере аргона раствор соединения, полученного в примере 6 (100 мг, 0,241 ммоль), и 3-метил-3-гидрокси-1-бутандиола (34,7 мг, 0,289 ммоль) в сухом дихлорметане (0,5 мл) охлаждали до 0oC и перемешивали с комплексом трехфтористый бор - простой эфир (35,5 мкл, 0,289 ммоль) 3 мин, затем перемешивали с триэтилсиланом (57,8 мкл, 0,362 ммоль) при 0oC 5,5 ч. Затем реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали водным насыщенным раствором бикарбоната натрия и рассолом и сушили над сульфатом магния, затем растворитель удаляли при пониженном давлении. Остаток очищали препаративной тонкослойной хроматографией (2 пластинки, дихлорметан: этанол = 20: 1, однократное проявление), получая указанную в заголовке смесь соединений (55,7 мг, 45%) в виде бесцветного масла. Исходный материал (43,3 мг, 35%) также возвращали.
ИК-спектр (чистый): 3460, 2960, 1740, 1370, 1240, 1030 см-1
Спектр -1H ЯМР δ: 5,70-5,60 (m, 1H), 5,42-5,32 (m, 1H), 5,07-4,84 (m, 2H), 2,09 (S, 3Н), 2,03 (S, 3Н), 1,39 и 1,30 (d каждого диастереомера, J=6,3 и 6,6 Гц, 3Н), 1,25 (S, 6Н), 1,01 (S, 3Н), 0,69 и 0,65 (S каждого диастереомера, 3Н).
Масс-спектр m/z: 518 (М+), 69 (100%).
УФ-спектр λmax нм: 273, 282, 293.
Пример 8.
1α,3β-Диацетокси-20(S)-(4-этил-4-гидроксигексилтио)-прегна-5,7-диен и 1α,3β-диацетокси-20(R)-(4-этил-4-гидроксигексилтио)прегна-5,7-диен.
По примеру процесса, описанного в примере 7, проводили реакции, используя соединение, полученное в примере 6 (150 мг, 0,361 ммоль), соединение, полученное в примере 1 (73,0 мг, 0,450 ммоль), комплекс трехфтористый бор - простой эфир (55,3 мкл, 0,450 ммоль), сухой дихлорметан (1 мл) и триэтилсилан (201 мкл, 1,26 ммоль), остаток очищали препаративной тонкослойной хроматографией (4 пластинки, дихлорметан:этилацетат = 9:1, однократное проявление), получая смесь указанных в заголовке соединений (38,8 мг, 19%) в виде бесцветного масла, а также регенерированный 1α,3β-диацетокси-20-оксопрегна-5,7-диен (89,4 мг). Полученную смесь далее очищали препаративной тонкослойной хроматографией (4 пластинки, дихлорметан:этилацетат = 25:1, проявляли 5 раз) и получали 20S-изомер (8,6 мг, 4%) и 20R-изомер (21,1 мг, 10%) указанного в заголовке соединения, оба в виде бесцветных масел.
20S-изомер:
ИК-спектр (чистый): 3500, 2950, 1740, 1460, 1370, 1240, 1030 см-1.
Спектр 1H ЯМР δ: 5,69-5,63 (m, 1Н), 5,42-5,35 (m, 1Н), 5,04-4,88 (m, 2H), 2,09 (S, 3H), 2,04 (S, 3H), 1,46 (q, J =7,3 Гц, 4H), 1,38 (d, J = 6,3 Гц, 3H), 1,01 (S, 3H), 0,86 (t, J=7,3 Гц, 6Н), 0,65 (S, 3Н).
Масс-спектр m/z: 560 (M+), 143 (100%).
УФ-спектр λmax нм: 270, 281, 293.
20R-изомер:
ИК-спектр (чистый): 3500, 2950, 1740, 1460, 1370, 1240, 1050 см-1.
Спектр 1H ЯМР δ: 5,69-5,61 (m, 1Н), 5,40-5,31 (m, 1Н), 5,06-4,97 (m, 2H), 2,08 (S, 3H), 2,04 (S, 3H), 1,49 (q, J=7,3 Гц, 4H), 1,29 (d, J = 6,6 Гц, 3Н), 1,01 (S, 3H), 0,86 (t, J = 7,3 Гц, 6Н), 0,69 (S, 3Н).
Масс-спектр m/z: 560 (М+), 143 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 9.
1α,3β-Диацетокси-20-(4-гидрокси-4-метилпентилтио)прегна-5,7-диен (смесь 20R- и S-изомеров).
Использовали методику по примеру 7, соединение, полученное в примере 6 (200 мг, 0,482 ммоль), 4-гидрокси-4-метилпентандиол (77,6 мг, 0,578 ммоль), комплекс трехфтористый бор - простой эфир (71,0 мкл, 0,578 ммоль), сухой дихлорметан (1 мл) и триэтилсилан (115 мкл, 0,723 ммоль), остаток очищали препаративной тонкослойной хроматографией (4 пластинки, гексан:этилацетат = 1:1, однократное проявление), получая смесь указанных в заголовке соединений (93,3 мг, 36%) в виде бесцветного масла, а также регенерированный материал (133 мг).
ИК-спектр (чистый): 3450, 2950, 1740, 1371, 1240, 1030 -1см.
Спектр 1H ЯМР δ: 5,70-5,60 (m, 1Н), 5,42-5,32 (m, 1H), 5,07-4,84 (m, 2H), 2,54 (t, J = 7,3 Гц, 2Н), 2,09 (S, 3Н), 2,03 (S, 3Н), 1,39 и 1,29 (d для каждого диастереомера, J = 7,3 и 6,6 Гц, 3Н), 1,23 (S, 6Н), 1,01 (S, 3Н), 0,69 и 0,65 (S для каждого диастереомера, 3Н).
Масс-спектр m/z: 532 (М+), 55 (100%).
УФ-спектр λmax нм: 270, 282, 293.
Пример 10.
1α,3β-Диацетокси-20(S)-(3-этил-3-гидроксипентилтио)-прегна-5,7-диен и 1α,3β-диацетокси-20(R)-(3-этил-3-гидроксипентилтио)-прегна-5,7-диен.
Использовали методику примера 7, соединение, полученное в примере 6 (180 мг, 0,434 ммоль), 3-этил-3-гидроксипентантиол (85,7 мг, 0,578 ммоль), комплекс трехфтористый бор - простой эфир (71,0 мкл, 0,578 ммоль), сухой дихлорметан (1 мл) и триэтилсилан (115 мкл, 0,723 ммоль), остаток очищали препаративной тонкослойной хроматографией (4 пластинки, дихлорметан:этилацетат = 9: 1, однократное проявление, получая смесь указанных в заголовке соединений в виде бесцветного масла, а также регенерированный материал (50,1 мг). Полученную смесь далее очищали препаративной тонкослойной хроматографией (4 пластинки, дихлорметан:этилацетат = 30:1, проявляли 5 раз) и получали 20S-изомер (12,5 мг, 5%) и 20R-изомер (28,2 мг, 12%) указанного в заголовке соединения, оба в виде бесцветных масел.
20S-изомер:
ИК-спектр (чистый): 3500, 2950, 1740, 1460, 1370, 1240, 1030 см-1.
Спектр 1H ЯМР δ: 5,68-5,60 (m, 1Н), 5,40-5,31 (m, 1H), 5,07-4,85 (m, 2Н), 2,59 (t, J = 7,8 Гц, 2Н), 2,09 (S, 3Н), 2,04 (S, 3Н), 1,49 (q, J = 7,3 Гц, 4Н), 1,40 (d, J = 6,6 Гц, 3Н), 1,01 (S, 3Н), 0,87 (t, J = 7,3 Гц, 6Н), 0,65 (S, 3Н).
Масс-спектр m/z: 546 (M+), 55 (100%).
УФ-спектр λmax нм: 270, 281, 293.
20R-изомер:
ИК-спектр (чистый): 3500, 2950, 1740, 1460, 1370, 1240, 1030 см-1.
Спектр 1H ЯМР δ: 5,70-5,60 (m, 1H), 5,41-5,30 (m, 1H), 5,05-4,84 (m, 2Н), 2,56 (t, J = 8,2 Гц, 2Н), 2,08 (S, 3Н), 2,03 (S, 3Н), 1,49 (q, J = 7,3 Гц, 4Н), 1,30 (d, J = 6,6 Гц, 3Н), 1,01 (S, 3Н), 0,87 (t, J = 7,3 Гц, 6Н), 0,69 (S, 3Н).
Масс-спектр m/z: 546 (М+), 55 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 11.
1α,3β-Диацетокси-20(S)-(5-гидрокси-5-метилгексилтио)-прегна-5,7-диен и 1α,3β-диацетокси-20(R)-(5-гидрокси-5-метилгексилтио)-прегна-5,7-диен.
Использовали методику примера 7, соединение, полученное в примере 6 (200 мг, 0,482 ммоль), соединение, полученное в примере 2 (85,7 мг, 0,578 ммоль), комплекс трехфтористый бор - простой эфир (71,0 мкл, 0,578 ммоль), сухой дихлорметан (1 мл) и триэтилсилан (115 мкл, 0,723 ммоль), остаток очищали препаративной тонкослойной хроматографией (4 пластинки, дихлорметан:этилацетат = 10: 1, проявляли 3 раза, получая S-изомер (10,6 мг, 4%) и R-изомер (37,8 мг, 14%) указанного в заголовке соединения, оба в виде бесцветных масел.
20S-изомер:
ИК-спектр (чистый): 3500, 2950, 1740, 1460, 1370, 1240, 1030 см-1.
Спектр 1H ЯМР δ: 5,71-5,63 (m, 1H), 5,43-5,35 (m, 1H), 5,07-4,88 (m, 2H), 2,09 (S, 3Н), 2,04 (S, 3Н), 1,38 (d, J = 6,3 Гц, 3Н), 1,22 (S, 6Н), 1,01 (S, 3Н), 0,65 (S, 3Н).
Масс-спектр m/z: 546 (М+), 278 (100%).
УФ-спектр λmax нм: 270, 281, 293.
20R-изомер:
ИК-спектр (чистый): 3500, 2950, 1740, 1460, 1370, 1240, 1030 см-1.
Спектр 1H ЯМР δ: 5,71-5,64 (m, 1Н), 5,43-5,34 (m, 1H), 5,08-4,88 (m, 2H), 2,08 (S, 3Н), 2,03 (S, 3Н), 1,29 (q, J = 6,6 Гц, 3Н), 1,22 (S, 6Н), 1,01 (S, 3Н), 0,69 (S, 3Н).
Масс-спектр m/z: 546 (М+), 278 (100%).
Уф-спектр λmax нм: 270, 281, 293.
Пример 12.
1α,3β-Диацетокси-20(S)-(6-гидрокси-6-метилгептилтио)прегна-5,7-диен и 1α,3β-диацетокси-20(R)-6-гидрокси-6-метилгептилтио)прегна-5,7-диен.
Использовали методику примера 7, соединение, полученное в примере 6 (200 мг, 0,482 ммоль), соединение, полученное в примере 3 (93,8 мг, 0,578 ммоль), комплекс трехфтористый бор - простой эфир (71,0 мкл, 0,578 ммоль), сухой дихлорметан (1 мл) и триэтилсилан (115 мкл, 0,723 ммоль), остаток очищали препаративной тонкослойной хроматографией (4 пластинки, дихлорметан:этилацетат = 7: 1, однократное проявление), получая смесь указанных в заголовке соединений и исходных тиолов в виде бесцветного масла, а также регенерированный материал (109 мг). Полученную смесь далее очищали препаративной тонкослойной хроматографией (4 пластинки, дихлорметан:этилацетат = 12:1, проявляли 5 раз) и получали смесь 20S-изомера, указанного в заголовке соединения и исходного тиола (33,9 мг), а также 20R-изомер (26,4 мг, 10%) указанного в заголовке соединения (оба в виде бесцветных масел). Первый использовали в последующих реакциях в виде указанной смеси.
20R-изомер:
ИК-спектр (чистый): 3500, 2950, 1740, 1460, 1370, 1240, 1030 см-1.
Спектр 1H ЯМР δ: 5,71-5,62 (m, 1H), 5,40-5,32 (m, 1Н), 5,07-4,86(m, 2H), 2,08 (8, 3Н), 2,03 (S, 3Н), 1,28 (d, J = 6,8 Гц, 3Н), 1,21 (S, 6Н), 1,01 (S, 3Н), 0,69 (S, 3Н).
Масс-спектр m/z: 560 (М+), 278 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 13.
1α,3β-Диацетокси-20(S)-(3-гидрокси-3-н-пропилгексилтио)прегна-5,7-диен и 1α,3β-диацетокси-20(R)-(3-гидрокси-3-н-пропилгексилтио)прегна-5,7-диен.
Использовали методику примера 7, соединение, полученное в примере 6 (200 мг, 0,482 ммоль), соединение, полученное в примере 4 (102 мг, 0,578 ммоль), комплекс трехфтористый бор - простой эфир (71,0 мкл, 0,578 ммоль), сухой дихлорметан (1 мл) и триэтилсилан (115 мкл, 0,723 ммоль), остаток очищали препаративной тонкослойной хроматографией (4 пластинки, гексан:этилацетат: этанол = 4:1:0,1, однократное проявление), получая смесь указанных в заголовке соединений (134 мг, 48%) в виде бесцветного масла, а также регенерированный материал (48,1 мг). Полученную смесь далее очищали препаративной тонкослойной хроматографией (4 пластинки, дихлорметан:этилацетат = 30:1, проявляли 4 раза) и получали 20S-изомер (23,6 мг, 9%) и 20R-изомер (78,2 мг, 28%) указанного в заголовке соединения, оба в виде бесцветных масел.
20S-изомер:
ИК-спектр (чистый): 3500, 2950, 1740, 1460, 1370, 1240, 1030 см-1.
Спектр 1H ЯМР δ: 5,71-5,61 (m, 1H), 5,44-5,32 (m, 1H), 5,08-4,87 (m, 2H), 2,57 (t, J = 7,8 Гц, 2Н), 2,09 (S, 3Н), 2,03 (S, 3Н), 1,01 (S, 3Н), 0,92 (t, J = 6,S Гц, 6Н), 0,65 (S, 3H).
Масс-спектр m/z: 574 (М+), 157 (100%).
УФ-спектр λmax нм: 270, 281, 293.
20R-изомер:
ИК-спектр (чистый): 3500, 2950, 1740, 1460, 1370, 1240, 1030 см-1.
Спектр 1H ЯМР δ: 5,72-5,63 (m, 1Н), 5,44-5,33 (m, 1H), 5,07-4,90 (m, 2H), 2,54 (t, J = 7,8 Гц, 2H), 2,08 (S, 3H), 2,03 (S, 3H), 1,01 (S, 3H), 0,92 (t, J = 6,6 Гц, 6Н), 0,69 (S, 3H).
Масс-спектр m/x: 574 (М+), 157 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 14.
1α-Гидрокси-3β-(трет-бутилдиметилсилилокси)-20(S)-(4-гидрокси-4-метилпентилтио)прегна-5,7-диен и 1α- гидрокси-3β-(трет-бутилдиметилсилилокси)-20(R)-(4-гидрокси-4-метилпентилтио)прегна-5,7-диен.
В атмосфере аргона к раствору соединения, полученного в примере 9 (93,3 мг, 0,175 ммоль), в сухом тетрагидрофуране (4 мл) порциями прибавляли алюмогидрид лития (13,3 мг, 0,350 ммоль). Смесь перемешивали при комнатной температуре 30 мин, затем гасили 10%-ным водным раствором гидроокиси аммония и экстрагировали этилацетатом. Экстракт промывали рассолом и сушили над сульфатом магния, растворитель удаляли при пониженном давлении. Остаток очищали препаративной тонкослойной хроматографией (2 пластинки, дихлорметан: этанол = 17: 3, однократное проявление) и получали 40,1 мг бесцветного твердого вещества. В атмосфере аргона это твердое вещество растворяли в диметилформамиде (2,6 мл) и перемешивали с трет-бутилдиметилсилилхлоридом (72,5 мг, 0,481 ммоль) и имидазолом (65,5 мг, 0,962 ммоль) при комнатной температуре 2 ч. Затем реакционную смесь выливали в воду и экстрагировали смесью гексан:этилацетат = 3:1. Органический слой промывали рассолом, сушили над сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток очищали препаративной тонкослойной хроматографией (2 пластинки, гексан: этилацетат = 5:1, проявляли 6 раз) и получали 20S-изомер (12,9 мг, 13%) и 20R-изомер (23,7 мг, 24%) указанных в заголовке соединений, оба в виде бесцветных масел.
20S-изомер:
ИК-спектр (чистый): 3450, 2950, 1460, 1380, 1260, 1090 см-1.
Спектр 1H ЯМР δ: 5,73-5,64 (m, 1H), 5,41-5,31 (m, 1Н), 4,11-3,91 (m, 1H), 3,72 (brs, 1H), 1,40 (d, J = 6,6 Гц, 3Н), 1,22 (S, 6Н), 0,94 (S, 3Н), 0,89 (S, 9Н), 0,66 (S, 3Н), 0,08 (S, 6Н).
Масс-спектр m/z: 562 (M+), 73 (100%).
УФ-спектр λmax нм: 271, 282, 294.
20R-изомер:
ИК-спектр (чистый): 3450, 2950, 1460, 1380, 1260, 1090 см-1.
Спектр 1H ЯМР δ: 5,72-5,63 (m, 1H), 5,38-5,29 (m, 1Н), 4,12-3,92 (m, 1H), 3,72 (brs, 1H), 1,23 (d, J = 6,6 Гц, 3H), 1,22 (S, 6Н), 0,94 (S, 3Н), 0,88 (S, 9Н), 1,71 (S, 3Н), 0,08 (S, 6Н).
Масс-спектр m/z: 562 (М+), 73 (100%).
УФ-спектр λmax нм: 271, 282, 294.
Пример 15.
1α,3β-Дигидрокси-20(S)-(3-гидрокси-3-метилбутилтио)прегна-5,7-диен и 1α,3β-дигидрокси-20(R)-(3-гидрокси-3-метилбутилтио)прегна-5,7-диен.
В атмосфере аргона к раствору соединения, полученного в примере 7 (смесь) (55,0 мг, 0,106 ммоль), в сухом тетрагидрофуране (2 мл) порциями прибавляли алюмогидрид лития (8,0 мг, 0,212 ммоль) и смесь перемешивали при комнатной температуре 30 мин. Реакцию гасили 10%-ным водным раствором гидроокиси аммония и экстрагировали этилацетатом. Органический слой промывали рассолом, сушили над сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан: этанол = 17:1, проявляли 8 раз) и получали 20S-изомер (10,1 мг, 42%) и 20R-изомер (19,3 мг, 42%) указанного в заголовке соединения, оба в виде бесцветных масел.
20S-изомер:
ИК-спектр (чистый): 3400, 2950, 1460, 1380, 1050 см-1.
Спектр 1H ЯМР δ: 5,72-5,64 (m, 1H), 5,39-5,29 (m, 1Н), 4,23-3,92 (m, 1H), 3,76 (brs, 1H), 2,64 (t, J = 7,9 Гц, 2Н), 1,41 (d, J = 6,6 Гц, 3Н), 1,25 (S, 6Н), 0,95 (S, 3Н), 0,67 (S, 3Н).
Масс-спектр m/z: 434 (М+), 69 (100%).
УФ-спектр λmax нм: 272, 282, 293.
20R-изомер:
ИК-спектр (чистый): 3400, 2950, 1460, 1380, 1050 см-1.
Спектр 1H ЯМР δ: 5,72-5,63 (m, 1H), 5,38-5,27 (m, 1Н), 4,15-3,95 (m, 1H), 3,76 (brs, 1H), 2,62 (t, J = 8,0 Гц, 2Н), 1,31 (d, J = 6,6 Гц, 3Н), 1,25 (S, 6Н), 0,93 (S, 3Н), 0,70 (S, 3Н).
Масс-спектр m/z: 434 (М+), 69 (100%).
УФ-спект λmax нм: 272, 282, 293.
Пример 16.
1α, 3δ-Дигидрокси-20(S)-(4-этил-4-гидроксигексилтио)прегна-5,7-диен.
Использовали методику примера 15, 20S-изомер, полученный в примере 8 (8,6 мг, 15,3 мкмоль), сухой тетрагидрофуран (1,5 мл) и алюмогидрид лития (1,7 мг, 46,0 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 8:1, однократное проявление) и получали указанное в заголовке соединение в виде белого твердого вещества (5,7 мг, 78%).
ИК-спектр (чистый): 3400, 2950, 1460, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 5,77-5,64 (m, 1H), 5,43-5,34 (m, 1H), 4,12-4,00 (m, 1H), 3,77 (brs, 1H), 1,47 (q, J = 7,3 Гц, 4Н), 1,40 (d, J = 6,3 Гц, 3Н), 0,95 (S, 3Н), 0,86 (t, J = 7,3 Гц, 6Н), 0,66 (S, 3Н).
Масс-спектр m/z: 476 (М+), 143 (100%).
УФ-спектр λmax нм: 271, 282, 294.
Пример 17.
1α, 3δ-Дигидрокси-20(R)-(4-этил-4-гидроксигексилтио)прегна-5,7-диен.
Использовали методику примера 15, 20R-изомер, полученный в примере 8 (21,1 мг, 37,6 мкмоль), сухой тетрагидрофуран (2 мл) и алюмогидрид лития (4,3 мг, 0,113 ммоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 8:1, однократное проявление) и получали указанное в заголовке соединение в виде белого твердого вещества (16,0 мг, 89%).
ИК-спектр (KBr): 3400, 2950, 1460, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 5,76-5,68 (m, 1Н), 5,43-5,34 (m, 1H), 4,15-4,00 (m, 1H), 3,78 (brs, 1H), 1,47 (d, J = 7,3 Гц, 4Н), 1,29 (d, J = 6,3 Гц, 3Н), 0,95 (d, 3Н), 0,86 (t, J = 7,3 Гц, 6Н), 0,71 (S, 3Н).
Масс-спектр m/z: 476 (M+), 143 (100%).
УФ-спектр λmax нм : 271, 282, 294.
Пример 18.
1α,3β-Дигидрокси-20(S)-(4-гидрокси-4-метилпентилтио)прегна-5,7-диен.
В атмосфере аргона к раствору 20S-изомера, полученному в примере 14 (12,9 мг, 22,9 мкмоль), в сухом тетрагидрофуране (1,5 мл) порциями прибавляли фторид тетра-н-бутиламмония (1М раствор в тетрагидрофуране, 1 мл) и смесь осторожно кипятили 16 ч. Реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали водным насыщенным раствором бикарбоната натрия и рассолом, сушили над сульфатом магния, и растворитель удаляли при пониженном давлении. Остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 9:1, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (7,7 мг, 75%).
ИК-спектр (чистый): 3400, 2950, 1460, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 5,72-5,64 (m, 1Н), 5,39-5,29 (m, 1Н), 4,23-3,42 (m, 1Н), 3,77 (brs, 1Н), 1,40 (d, J = 6,6 Гц, 3Н), 1,23 (S, 6Н), 0,95 (S, 3Н), 0,66 (S, 3Н).
Масс-спектр m/z: 448 (М+), 55 (100%).
УФ-спектр λmax нм: 271, 282, 294.
Пример 19.
1α,3β-Дигидрокси-20(R)-(4-гидрокси-4-метилпентилтио)прегна-5,7-диен.
Использовали методику примера 18, 20R-изомер, полученный в примере 14 (23,7 мг, 42,1 мкмоль), сухой тетрагидрофуран (1,5 мл) и фторид тетра-н-бутиламмония (1М раствор в тетрагидрофуране, 1 мл), получая указанное в заголовке соединение в виде бесцветного масла (10,0 мг, 53%).
ИК-спектр (чистый): 3400, 2950, 1460, 1370, 1060 см-1.
Спектр 1H ЯМР δ: 5,80-5,67 (m, 1Н), 5,41-5,31 (m, 1Н), 4,18-3,96 (m, 1Н), 3,78 (brs, 1Н), 1,29 (d, J = 6,6 Гц, 3Н), 1,22 (S, 6Н), 0,95 (S, 3Н), 0,71 (S, 3Н).
Масс-спектр m/z : 448 (М+), 55 (100%).
УФ-спектр λmax нм: 271, 282, 294.
Пример 20.
1α,3β-Дигидрокси-20(S)-(3-этил-3-гидроксипентилтио)прегна-5,7-диен.
Использовали методику примера 15, 20S-изомер, полученный в примере 10 (12,5 мг, 22,9 мкмоль), сухой тетрагидрофуран (1 мл) и алюмогидрид лития (2,6 мг, 68,7 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 9:1, однократное проявление), получая указанное в заголовке соединение в виде бесцветного масла (8,2 мг, 77%).
ИК-спектр (чистый): 3400, 2950, 1460, 1370, 1030 см-1.
Спектр 1H ЯМР δ: 15,76-5,67 (m, 1H), 5,40-5,30 (m, 1Н), 4,15-3,99 (m, 1H), 3,76 (brs, 1H), 2,58 (t, J = 8,0 Гц, 2Н), 1,50 (q, J = 7,3 Гц, 4Н), 1,41 (d, J = 6,8 Гц, 3Н), 0,95 (S, 3Н), 0,87 (t, J = 7,3 Гц, 6Н), 0,67 (S, 3Н).
Масс-спектр m/z: 462 (М+), 55 (100%).
УФ-спектр λmax нм: 271, 282, 294.
Пример 21.
1α,3β-Дигидрокси-20(R)-(3-этил-3-гидроксипентилтио)прегна-5,7-диен.
Использовали методику примера 15, 20R-изомер, полученный в примере 10 (28,2 мг, 51,6 мкмоль), сухой тетрагидрофуран (2 мл) и алюмогидрид лития (5,9 мг, 0,155 ммоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 9:1, однократное проявление), получая указанное в заголовке соединение в виде бесцветного масла (8,2 мг, 77%).
ИК-спектр (чистый): 3400, 2950, 1460, 1370, 1030 см-1.
Спектр 1H ЯМР δ: 5,73-5,65 (m, 1Н), 5,38-5,29 (m, 1Н), 4,15-3,95 (m, 1Н), 3,77 (brs, 1Н), 2,56 (t, J = 8,0 Гц, 2Н), 1,49 (q, J = 7,3 Гц, 4Н), 1,31 (d, J = 6,6 Гц, 3Н), 0,94 (S, 3Н), 0,87 (t, J = 7,3 Гц, 6Н), 0,71 (S, 3Н).
Масс-спектр m/z: 462 (М+), 55 (100%).
УФ-спектр λmax нм: 271, 282, 294.
Пример 22.
1α,3β-Дигидрокси-20(S)-(5-гидрокси-5-метилгексилтио)прегна-5,7-диен.
Использовали методику примера 15, 20S-изомер, полученный в примере 11 (10,6 мг, 19,4 мкмоль), сухой тетрагидрофуран (1 мл) и алюмогидрид лития (2,5 мг, 65,8 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 7:1, однократное проявление), получая указанное в заголовке соединение в виде твердого белого вещества (6,1 мг, 68%).
ИК-спектр (чистый): 3400, 2950, 1460, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 5,79-5,68 (m, 1Н), 5,43-5,35 (m, 1Н), 4,13-3,97 (m, 1Н), 3,75 (brs, 1Н), 1,40 (d, J = 6,6 Гц, 3Н), 1,22 (S, 6Н), 0,94 (S, 3Н), 0,66 (S, 3Н).
Масс-спектр m/z : 462 (М+), 131 (100%).
УФ-спектр λmax нм: 271, 282, 294.
Пример 23.
1α,3β-Дигидрокси-20(R)-(5-гидрокси-5-метилгексилтио)прегна-5,7-диен.
Использовали методику примера 15, 20R-изомер, полученный в примере 11 (36,5 мг, 69,1 мкмоль), сухой тетрагидрофуран (2 мл) и алюмогидрид лития (7,9 мг, 0,207 ммоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 7:1, однократное проявление), получая указанное в заголовке соединение в виде бесцветного масла (25,0 мг, 78%).
ИК-спектр (чистый): 3400, 2950, 1460, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 5,73-5,65 (m, 1Н), 5,39-5,30 (m, 1H), 4,14-3,95 (m, 1H), 3,77 (brs, 1H), 1,29 (d, J = 6,3 Гц, 3Н), 1,21 (S, 6H), 0,94 (S, 3Н), 0,70 (S, 3Н).
Масс-спектр m/z: 462 (М+), 131 (100%).
УФ-спектр λmax нм: 271, 282, 294.
Пример 24.
1α,3β-Дигидрокси-20(S)-(6-гидрокси-6-метилгептилтио)прегна-5,7-диен.
Использовали методику примера 15, смесь 20S-изомера и исходного тиола, полученную в примере 12 (33,9 мг), сухой тетрагидрофуран (1 мл) и алюмогидрид лития (20,0 мг, 0,527 ммоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 7:1, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (5,8 мг).
ИК-спектр (чистый): 3400, 2940, 1460, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 5,75-5,68 (m, 1Н), 5,42-5,33 (m, 1Н), 4,12-3,97 (m, 1Н), 3,75 (brs, 1Н), 1,40 (d, J = 6,6 Гц, 3Н), 1,21 (S, 6Н), 0,94 (S, 3Н), 0,66 (S, 3Н).
Масс-спектр m/z: 476 (M+), 171 (100%).
УФ-спектр λmax нм: 271, 282, 294.
Пример 25.
1α,3β-Дигидрокси-20(R)-(6-гидрокси-6-метилгептилтио)прегна-5,7-диен.
Использовали методику примера 15, 20R-изомер, полученный в примере 12 (26,4 мг, 47,1 мкмоль), сухой тетрагидрофуран (2 мл) и алюмогидрид лития (5,4 мг, 0,141 ммоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 7,1, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (15,0 мг, 67%).
ИК-спектр (чистый): 3400, 2940, 1460, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 5,75-5,65 (m, 1Н), 5,39-5,30 (m, 1Н), 4,14-3,96 (m, 1Н), 3,78 (brs, 1Н), 1,29 (d, J = 6,3 Гц, 3Н), 1,21 (S, 6Н), 0,95 (S, 3Н), 0,71 (S, 3Н).
Масс-спектр m/z: 476 (М+), 171 (100%).
УФ-спектр λmax нм: 271, 282, 294.
Пример 26.
1α,3β-Дигидрокси-20(S)-(3-гидрокси-3-н-пропилгексилтио)прегна-5,7-диен.
Использовали методику примера 15, 20S-изомер, полученный в примере 13 (35,9 мг, 62,4 мкмоль), сухой тетрагидрофуран (3 мл) и алюмогидрид лития (7,1 мг, 0,187 ммоль) остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан: этанол = 6:1, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (21,4 мг, 70%).
ИК-спектр (чистый): 3400, 2950, 1460, 1370, 1030 см-1.
Спектр 1H ЯМР δ: 5,76-5,66 (m, 1Н), 5,42-5,32 (m, 1H), 4,16-3,96 (m, 1H), 3,76 (brs, 1H), 2,58 (t, J = 8,0 Гц, 2Н), 0,94 (S, 3Н), 0,92 (t, J = 6,8 Гц, 6Н), 0,66 (S, 3Н).
Масс-спектр m/z: 490(M+), 157 (100%).
УФ-спектр λmax нм: 271, 282, 294.
Пример 27.
1α,3β-Дигидрокси-20(R)-(3-гидрокси-3-н-пропилгексилтио)прегна-5,7-диен.
Использовали методику примера 15, 20R-изомер, полученный в примере 13 (126 мг, 0,220 ммоль), сухой тетрагидрофуран (10 мл) и алюмогидрид лития (25 мг, 0,660 ммоль), остаток очищали препаративной тонкослойной хроматографией (2 пластинки, дихлорметан:этанол = 6:1, однократное проявление) и получали указанное в заголовке соединение в виде твердого белого вещества (74,4 мг, 69%).
ИК-спектр (чистый): 3400, 2950, 1460, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 5,75-5,63 (m, 1H), 5,41-5,29 (m, 1H), 4,16-3,93 (m, 1H), 3,75 (brs, 1H), 2,55 (t, J = 7,8 Гц, 2Н), 1,00 - 0,84 (S и t, 9Н), 0,70 (S, 3Н).
Масс-спектр m/z: 490 (M+): 157 (100%).
УФ-спектр λmax нм: 271, 282, 294.
Пример 28.
1α,3β-Дигидрокси-20(S)-(3-гидрокси-3-метилбутилтио)-9,10-секопрегна-5,7,10(19-триен).
20S-изомер, полученный в примере 15 (10,1 мг, 23,2 мкмоль) растворяли в этаноле (200 мл) и облучали ртутной лампой высокого давления мощностью 400 Вт с фильтром Викора (Vycor) в течение 2 мин при барботировании аргона при 0oC и затем осторожно кипятили 2 ч. Растворитель удаляли, остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 10: 1, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (1,7 мг, 17%).
ИК-спектр (чистый): 3380, 2920, 1440, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 6,37 (d, J = 11,1 Гц, 1Н), 6,02 (d, J = 11,1 Гц, 1Н), 5,33 (S, 1H), 5,00 (S, 1Н), 4,48-4,35 (br, 1Н), 4,30-4,17 (br, 1Н), 2,63 (t, J = 7,8 Гц, 2Н), 1,39 (d, J = 6,6 Гц, 3Н), 1,25 (S, 6Н), 0,58 (S, 3Н).
Масс-спектр m/z : 434 (М+), 69 (100%).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 29.
1α,3β-Дигидрокси-20(R)-(3-гидрокси-3-метилбутилтио)-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 28 (облучение 3,75 мин) с применением 20R-изомера, полученного в примере 15 (19,3 мг, 44,4 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 10:1, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (1,6 мг, 8%).
ИК-спектр (чистый): 3390, 2920, 1450, 1380, 1060 см-1.
Спектр 1H ЯМР δ: 6,37 (d, J = 11,1 Гц, 1Н), 6,01 (d, J = 11,1 Гц, 1Н), 5,33 (S, 1Н), 5,00 (5, 1Н), 4,48-4,36 (br, 1Н), 4,30-4,13 (br, 1Н), 2,61 (t, J = 8,3 Гц, 2Н), 1,30 (d, J = 6,6 Гц, 3Н), 1,25 (S, 6Н), 0,62 (S, 3Н).
Масс-спектр m/z: 434 (M+), 69 (100%).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 30.
1α,3β-Дигидрокси-20(S)-(4-этил-4-гидроксигексилтио)-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 28 (облучение 1,5 мин) с применением соединения, полученного в примере 16 (5,1 мг, 10,7 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 9: 1, проявляли дважды) и получали указанное в заголовке соединение в виде бесцветного масла (1,1 мг, 22%).
ИК-спектр (чистый): 3400, 2950, 1450, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 6,37 (d, J = 11,1 Гц, 1Н), 6,02 (d, J = 11,1 Гц, 1Н), 5,33 (S, 1H), 5,00 (S, 1H), 4,50-4,38 (br, 1Н), 4,30-4,17 (br, 1H), 1,47 (q, J = 7,3 Гц, 4Н), 1,38 (d, J = 6,3 Гц, 3Н), 0,86 (t, J = 7,3 Гц, 6Н), 0,58 (S, 3Н).
Масс-спектр m/z: 476 (М+), 69 (100%).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 31.
1α,3β-Дигидрокси-20(R)-(4-этил-4-гидроксигексилтио)-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 28 (облучение 2,5 мин) с применением соединения, полученного в примере 17 (16,0 мг, 33,6 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 9:1, проявляли 3 раза; затем 1 пластинка, гексан:этилацетат:этанол= 5:5:0,3, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (2,2 мг, 14%).
ИК-спектр (чистый): 3400, 2950, 1460, 1380, 1060 см-1.
Спектр 1H ЯМР δ: 6,38 (d, J = 11,2 Гц, 1H), 6,01 (d, J = 11,2 Гц, 1H), 5,33 (S, 1H), 5,00 (S, 1H), 4,52-4,38 (br, 1H), 4,29-4,16 (br, 1H), 1,47 (q, J = 7,3 Гц, 4Н), 1,28 (d, J = 6,6 Гц, 3Н), 0,68 (t, J = 7,3 Гц, 6Н), 0,62 (S, 3Н).
Масс-спектр m/z: 476 (М+), 69 (100%).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 32.
1α,3β-Дигидрокси-20(S)-(4-гидрокси-4-метилпентилтио)-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 28 (облучение 1,75 мин)
с применением соединения, полученного в примере 18 (7,7 мг, 17,2 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 9:1, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (2,0 мг, 26%).
ИК-спектр (чистый): 3400, 2950, 1450, 1380 см-1.
Спектр 1H ЯМР δ: 6,37 (d, J = 11,2 Гц, 1Н), 6,02 (d, J = 11,2 Гц, 1Н), 5,33 (S, 1Н), 5,00 (S, 1Н), 4,48-3,35 (br, 1Н), 4,28-4,16 (br, 1Н), 1,38 (d, J = 6,3 Гц, 3Н), 1,22 (S, 6H), 0,58 (S, 3Н).
Масс-спектр m/z: 448 (М+), 117 (100%).
УФ-спектр λmax нм: 262, λmin нм: 227.
Пример 33.
1α,3β-Дигидрокси-20(R)-(4-гидрокси-4-метилпентилтио)-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 28 (облучение 1,25 мин) с применением соединения, полученного в примере 19 (10,0 мг, 22,3 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 9: 1, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (1,9 мг, 19%).
ИК-спектр (чистый): 3400, 2950, 1450, 1380, 1060 см-1.
Спектр 1H ЯМР δ: 6,38 (d, J = 11,2 Гц, 1Н), 6,01 (d, J = 11,2 Гц, 1Н), 5,33 (S, 1Н), 5,00 (S, 1Н), 4,48-4,37 (br, 1Н), 4,28-4,16 (br, 1Н), 1,28 (d, J = 6,6 Гц, 3Н), 1,22 (S, 6Н), 0,62 (S, 3Н).
Масс-спектр m/z : 448 (М+), 117 (100%).
УФ-спектр λmax нм: 262, λmin нм: 227.
Пример 34.
1α,3β-Дигидрокси-20(S)-(3-этил-3-гидроксипентилтио)-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 28 (облучение 1,5 мин) с применением соединения, полученного в примере 20 (8,2 мг, 17,7 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 9: 1, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (1,7 мг, 21%).
ИК-спектр (чистый): 3400, 2950, 1460, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 6,37 (d, J = 11,2 Гц, 1Н), 6,02 (d, J = 11,2 Гц, 1Н), 5,33 (S, 1Н), 5,00 (S, 1Н), 4,49-4,40 (br, 1Н), 4,29-4,18 (brs, 1Н), 2,58 (t, J, 9 Гц, 2Н), 1,49 (q, J = 7,3 Гц, 4Н), 1,39 (d, J = 6,6 Гц, 3Н), 0,87 (t, J = 7,3 Гц, 6Н), 0,58 (S, 3Н).
Масс-спектр m/z: 462 (М+), 55 (100%).
УФ-спектр λmax нм: 262, λmin нм: 227.
Пример 35.
1α,3β-Дигидрокси-20(R)-(3-этил-3-гидроксипентилтио)-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 28 (облучение 3,25 мин) с применением соединения, полученного в примере 21 (20,9 мг, 45,2 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 9: 1, проявляли 3 раза; затем 1 пластинка, гексан:этилацетат:этанол = 5:5: 0,3, проявляли 4 раза) и получали указанное в заголовке соединение в виде бесцветного масла (2,3 мг, 11%).
ИК-спектр (чистый): 3400, 2950, 1460, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 6,38 (d, J = 11,2 Гц, 1Н), 6,01 (d, J = 11,2 Гц, 1Н), 5,33 (S, 1Н), 5,00 (S, 1Н), 4,48-4,40 (br, 1Н), 4,30-4,15 (br, 1Н), 2,55 (t, J = 7,9 Гц, 2Н), 1,52 (q, J = 7,3 Гц, 4Н), 1,30 (d, J = 6,6 Гц, 3Н), 0,87 (t, J = 7,3 Гц, 6Н), 0,62 (S, 3Н).
Масс-спектр m/z: 462 (М+), 55 (100%).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 36.
1α,3β-Дигидрокси-20(S)-(5-гидрокси-5-метилгексилтио)-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 28 (облучение 1,75 мин) с применением соединения, полученного в примере 22 (6,1 мг, 13,2 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 12: 1, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (1,2 мг, 20%).
ИК-спектр (чистый): 3400, 2950, 1460, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 6,37 (d, J = 11,2 Гц, 1Н), 6,02( d, J = 11,2 Гц, 1Н), 5,33 (S, 1Н), 5,00 (S, 1Н), 4,48-4,37 (br, 1H), 4,29-4,13 (br, 1H), 1,38 (d, J = 6,3 Гц, 3Н), 1,22 (S, 6Н), 0,58 (S, 3Н).
Масс-спектр m/z: 462 (М+), 131 (100%).
УФ-спектр λmax нм: 262, λmin нм: 227.
Пример 37.
1α,3β-Дигидрокси-20(R)-(5-гидрокси-5-метилгексилтио)-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 28 (облучение 3,5 мин) с применением соединения, полученного в примере 23 (25,0 мг, 54,0 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 12: 1, проявляли 4 раза; затем 1 пластинка, гексан:этилацетат:этанол = 5:5: 0,1, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (2,3 мг, 9%).
ИК-спектр (чистый): 3400, 2950, 1460, 1380, 1060 см-1.
Спектр 1H ЯМР δ: 6,38 (d, J = 11,2 Гц, 1Н), 6,01 (d, J = 11,2 Гц, 1Н), 5,33 (S, 1Н), 5,00 (S, 1Н), 4,50-4,35 (br, 1Н), 4,28-4,16 (br, 1Н), 1,28 (d, J = 6,8 Гц, 3Н), 1,21 (S, 6Н), 0,62 (S, 3Н).
Масс-спектр m/z: 462 (М+), 131 (100%).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 38.
1α,3β-Дигидрокси-20(S)-(6-гидрокси-6-метилгептилтио)-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 28 (облучение 1,75 мин) с применением соединения, полученного в примере 24 (5,8 мг, 12,2 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 12: 1, проявляли 4 раза) и получали указанное в заголовке соединение в виде бесцветного масла (0,99 мг, 17%).
ИК-спектр (чистый): 3400, 2950, 1460, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 6,37 (d, J = 11,2 Гц, 1Н), 6,02 (d, J = 11,2 Гц, 1Н), 5,33 (S, 1Н), 5,00 (S, 1Н), 4,48-4,38 (br, 1Н), 4,30- 4,15 (br, 1Н), 1,38 (d,J = 6,6 Гц, 3Н), 1,21 (S, 6Н), 0,58 (S, 3Н).
Масс-спектр m/z: 476 (М+), 60 (100%).
УФ-спектр λmax нм: 262, λmin нм: 227.
Пример 39.
1α,3β-Дигидрокси-20(R)-(6-гидрокси-6-метилгептилтио)-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 28 (облучение 2,5 мин) с применением соединения, полученного в примере 25 (15,0 мг, 31,5 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 12: 1, проявляли 3 раза; затем 1 пластинка, гексан; этилацетат:этанол = 5:5: 0,1, проявляли 4 раза) и получали указанное в заголовке соединение в виде бесцветного масла (2,0 мг, 13%).
ИК-спектр (чистый): 3400, 2950, 1460, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 6,38 (d, J = 11,2 Гц, 1Н), 6,01 (d, J = 11,2 Гц, 1Н), 5,33 (S, 1Н), 5,00 (S, 1Н), 4,49-4,38 (br, 1Н), 4,29-4,17 (br, 1Н), 1,28 (d, J = 6,6 Гц, 3Н), 1,21 (S, 6Н), 0,62 (S, 3Н).
Масс-спектр m/z: 476 (М+), 60 (100%).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 40.
1α,3β-Дигидрокси-20(S)-(3-гидрокси-3-н-пропилгексилтио)-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 28 (облучение 3,5 мин) с применением соединения, полученного в примере 26 (20,2 мг, 41,2 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 10: 1, проявляли 3 раза; затем 1 пластинка, гексан:этилацетат:этанол = 6:4: 0,5, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (1,8 мг, 9%).
ИК-спектр (чистый): 3400, 2950, 1450, 1370, 1050 см-1.
Спектр 1H ЯМР δ: 6,37 (d, J = 11,1 Гц, 1Н), 6,03 (d, J = 11,1 Гц, 1Н), 5,33 (S, 1Н), 5,00 (S, 1Н), 4,52-4,38 (br, 1Н), 4,30-4,18 (br, 1Н), 2,57 (t, J = 8,0 Гц, 2Н), 0,93 (t, J = 6,8 Гц, 6Н), 0,53 (S, 3Н).
Масс-спектр m/z: 490 (М+), 157 (100%).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 41.
1α,3β-Дигидрокси-20(R)-(3-гидрокси-3-н-пропилгексилтио)-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 28 (облучение 4,75 мин) с применением соединения, полученного в примере 27 (41,3 мг, 84,2 мкмоль), остаток очищали препаративной тонкослойной хроматографией (2 пластинки, дихлорметан:этанол = 10: 1, проявляли 3 раза; затем 1 пластинка, гексан:этилацетат:этанол = 6:4: 0,5, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (4,6 мг, 11%).
ИК-спектр (чистый): 3400, 2950, 1450, 1380, 1060 см-1.
Спектр 1H ЯМР δ: 6,38 (d, J = 11,2 Гц, 1Н), 6,01 (d, J = 11,2 Гц, 1H), 5,33 (S, 1Н), 5,00 (S, 1Н), 4,48-4,38 (br, 1Н), 4,30-4,16 (br, 1Н), 2,55 (t, J = 8,0 Гц, 2Н), 0,92 (t, J = 6,8 Гц, 6Н), 0,62 (S, 3Н).
Масс-спектр m/z: 490 (М+), 157 (100%).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 42.
1α,3β-Бис(трет-бутилдиметилсилилокси)-16-α-гидрокси-17-оксоандроста-5,7-диен.
В атмосфере аргона раствор трет-бутилата калия (4,13 г, 36,8 ммоль) в сухом тетрагидрофуране (500 мл) охлаждали до -78oC и прибавляли к нему по каплям раствор 1α,3β-бис(трет-бутилдиметилсилилокси)-17-оксоандроста-5,7-диена (13,0 г, 24,5 ммоль) в тетрагидрофуране (40 мл). После этого смесь перемешивали при той же температуре 1 ч, прибавляли по каплям раствор 2-(фенилсульфонил)-3-фенилоксазилидина (9,62 г, 36,8 ммоль) в тетрагидрофуране (40 мл), и смесь продолжали перемешивать при -78oC еще 1,5 ч. Затем реакцию гасили водным насыщенным раствором хлорида аммония, выливали в воду и экстрагировали этилацетатом. Органический слой промывали рассолом и сушили над безводным сульфатом магния. Смесь концентрировали при пониженном давлении и выпавший осадок отфильтровывали; фильтрат снова концентрировали, и остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат:хлороформ = 7: 1: 2), получая указанное в заголовке соединение в виде белого твердого вещества (3,10 г, 23%).
ИК-спектр (KBr): 3480, 2950, 2850, 1750, 1460, 1380, 1250, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 6Н), 0,07 (S, 3Н), 0,11 (S, 3Н), 0,88 (S, 9Н), 0,89 (S, 9Н), 0,90 (S, 3Н), 0,93 (S, 3Н), 3,71 (brs, 1Н), 3,97-4,16 (m, 1Н), 4,42 (d, J = 8,0 Гц, 1Н), 5,43-5,51 (m, 1H), 5,56-5,64 (m, 1Н).
Масс-спектр (20 эВ) m/z : 546 (M+), 355 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 43.
1α,3β-Бис(трет-бутилдиметилсилилокси)-16-α-гидроксипрегна-5,7,17(Е)-триен и 1α,3β-бис(трет-бутилдиметилсилилокси)-16α-гидроксипрегна-5,7,17(Z)-триен.
В атмосфере аргона смесь трет-бутилата калия (1,29 г, 11,4 ммоль) и этилтрифенилфосфонийбромида (4,28 г, 11,4 ммоль) в тетрагидрофуране (50 мл) перемешивали при 60oC 1,5 ч и затем доводили до комнатной температуры. Далее добавляли раствор соединения, полученного в примере 42 (2,10 г, 3,84 ммоль) в тетрагидрофуране (20 мл), и смесь перемешивали при 60oC 1 ч. Затем реакционную смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали рассолом и сушили над безводным сульфатом магния; затем растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат = 7:1), получая E-изомер (375 мг, 18%) и Z-изомер (351 мг, 16%) указанного в заголовке соединения, а также смесь обоих изомеров (142 мг, 6%).
E-изомер:
ИК-спектр (нуйол): 3450, 2950, 2850, 1460, 1380, 1250, 1100, 1080 см-1.
Спектр 1H ЯМР δ: 0,06 (S, 3Н), 0,07 (S, 6Н), 0,11 (S, 3Н), 0,59 (S, 3Н), 0,89 (S, 18H), 0,91 (S, 3Н), 3,71 (brs, 1Н), 3,84-4,12 (m, 2Н), 5,28-5,39 (m, 1Н), 5,47-5,64 (m, 2Н).
Масс-спектр (20 эВ) m/z: 558 (М+), 369 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Z-изомер:
ИК-спектр (нуйол): 3450, 2950, 2850, 1450, 1380, 1255, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 3Н), 0,06 (S, 6Н), 0,11 (S, 3Н), 0,70 (S, 3Н), 0,88 (S, 18H), 0,90 (S, 3Н), 1,80 (d, J = 8,8 Гц, 3Н), 3,71 (brs, 1Н), 3,97-4,16 (m, 1Н), 4,17-4,27 (m, 1Н), 5,26-5,36 (m, 1Н), 5,52-5,70 (m, 2Н).
Масс-спектр (20 эВ) m/z : 558 (М+), 369 (100%).
УФ-спектр λmax нм: 270, 282, 293.
Пример 44.
1α,3β-Бис(трет-бутилдиметилсилилокси)-16-оксопрегна-5,7,17(Е)-триен.
В атмосфере аргона раствор трихлорметилхлорформиата 118 мкл, 0,68 ммоль) в сухом дихлорметане (3 мл) охлаждали до -78oC, перемешивали с диметилсульфоксидом (186 мкл, 2,61 ммоль) 5 мин и прибавляли по каплям раствор E-изомера соединения, полученного в примере 43 (350 мг, 0,63 ммоль) в сухом дихлорметане (2 мл). После перемешивания полученного раствора при -78oC 15 мин добавляли триэтиламин (435 мкл, 3,10 ммоль) в тетрагидрофуране (40 мл), и смесь продолжали перемешивать при -78oC 15 мин и при комнатной температуре еще 30 мин. Затем реакционный раствор выливали в воду и экстрагировали дихлорметаном. Органический слой промывали рассолом и сушили над безводным сульфатом магния; затем растворитель отгоняли при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат = 50:3), получая указанное в заголовке соединение в виде бледно-желтого твердого вещества (147 мг, 42%).
ИК-спектр (KBr): 2950, 2850, 1730, 1650, 1460, 1380, 1250, 1100 см-1.
Спектр 1H ЯМР δ: 0,06 (S, 3Н), 0,07 (S, 3Н), 0,08 (S, 3Н), 0,12 (S, 3Н), 0,87 (S, 3Н), 0,89 (S, 18Н), 0,99 (S, 3Н), 1,88 (d, J = 7,4 Гц, 3Н), 3,73 (brs, 1Н), 3,92-4,10 (m, 1Н), 5,28-5,36 (m, 1Н), 5,54-5,67 (m, 1Н), 6,56 (q, J = 7,4 Гц, 1Н).
Масс-спектр (20 эВ) m/z: 556 (М+), 367 (100%).
УФ-спектр λmax нм: 242, 258, 270, 281, 293.
Пример 45.
1α,3β-Бис(трет-бутилдиметилсилилокси)-16-оксопрегна-5,7,17(Z)-триен.
Использовали методику примера 44, раствор Z-изомера соединения, полученного в примере 43 (347 мг, 0,62 ммоль) в сухом дихлорметане (2 мл), раствор трихлорметилтрихлорформиата (118 мкл, 0,68 ммоль в сухом дихлорметане (3 мл), диметилсульфоксид (186 мкл, 2,61 ммоль) и триэтиламин (435 мкл, 3,10 ммоль), получая указанное в заголовке соединение в виде бледно-желтого твердого вещества (111 мг, 32%).
ИК-спектр (KBr): 2950, 2850, 1720, 1640, 1460, 1380, 1255, 1080 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 6H), 0,06 (S, 3Н), 0,11 (S, 3Н), 0,85 (S, 3Н), 0,86 (S, 9Н), 0,88 (S, 9Н), 0,93 (S, 3Н), 2,16 (d, J = 7,4 Гц, 3Н), 3,72 (brs, 1Н), 3,93-4,12 (m, 1H), 5,36-5,47 (m, 1H), 5,56-5,64 (m, 1H), 6,17 (q, J = 7,4 Гц, 1H).
Масс-спектр (20 эВ) m/z: 556 (М+), 367 (100%).
УФ-спектр λmax нм: 242, 258, 270, 281, 293.
Пример 46.
1α,3β-Бис(трет-бутилдиметилсилилокси)-16-оксопрегна-5,7,17(E)-триен.
Смесь E-изомера и Z-изомера соединения, полученного в примере 43 (смесь ≈ 1:1, 1,76 г, 3,15 ммоль) растворяли в хлороформе (150 мл) и перемешивали с диоксидом марганца (70 г) при комнатной температуре 1,5 ч. Реакционный раствор фильтровали через целит, и фильтрат концентрировали. Затем остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат:хлороформ = 84: 6:1), получая указанное в заголовке соединение в виде белого твердого вещества (879 мг, 50%) и исходный Z-изомер (возврат 560 мг, 32%).
Пример 47.
1α,3β-Бис(трет-бутилдиметилсилилокси)-16-оксопрегна-5,7,17(Z)-триен.
Использовали методику примера 44, раствор Z-изомера полученного в примере 46 (533 мг, 0,95 ммоль) в сухом дихлорметане (1,5 мл), раствор бис(трихлорметил)карбоната (312 мг, 1,05 ммоль) в сухом дихлорметане (3 мл), диметилсульфоксид (284 мкл, 4,00 ммоль) и триэтиламин (666 мкл, 4,78 ммоль), остаток очищали колоночной хроматографией на силикагеле (гексан:этилацетат = 14:1), получая указанное в заголовке соединение в виде бледно-желтого твердого вещества (333 мг, 63%).
Пример 48.
Аддукт 1α,3β-бис(трет-бутилдиметилсилилокси)прегна-5,7,17(Е)-триена с 4-фенил-1,2,4-триазолин-3,5-дионом.
Раствор 1α,3β-бис(трет-бутилдиметилсилилокси)прегна-5,7,17(Е)-триена (1,00 г, 1,84 ммоль) в дихлорметане (90 мл) перемешивали с раствором 4-фенил-1,2,4-триазолин-3,5-диона (330 мг, 1,88 ммоль) в дихлорметане (10 мл) при комнатной температуре 30 мин, затем растворитель отгоняли, и остаток очищали колоночной хроматографией на силикагеле (дихлорметан:этилацетат = 150: 1), получая указанное в заголовке соединение в виде бледно-желтого твердого вещества (1,02 г, 77%).
Спектр 1H ЯМР δ: 0,07(S, 3Н), 0,08 (S, 3Н), 0,10 (S, 3Н), 0,13 (S, 3Н), 0,88 (S, 9Н), 0,89 (S, 9Н), 0,93 (S, 3Н), 1,01 (S, 3Н), 1,68 (d, J = 7,1 Гц, 3Н), 3,25 (dd, J = 4,0, 14,0 Гц, 1Н), 3,85 (t, J = 2,7 Гц, 1Н), 4,79 (m, 1Н), 5,17 (q, J = 7,1 Гц, 1Н), 6,22 (d, J = 8,2 Гц, 1Н), 6,38 (d, J = 8,2 Гц, 1Н), 7,19-7,49 (m, 5H).
УФ-спектр λmax нм: 206, 258.
Пример 49.
Аддукт 1α,3β-бис(трет-бутилдиметилсилилокси)-α-гидроксипрегна-5,7,17(Е)-триена с 4-фенил-1,2,4-триазолин-3,5-дионом.
Соединение, полученное в примере 48 (931 мг, 1,3 ммоль) растворяли в дихлорметане (40 мл) и перемешивали с диоксидом селена (5,1 мг, 45,5 мкмоль) и гидропероксидом трет-бутила (70%, 442 мг, 4,68 ммоль) при комнатной температуре 27 ч. Реакционный раствор разбавляли дихлорметаном, промывали рассолом и сушили над безводным сульфатом магния, затем растворитель отгоняли. Остаток очищали колоночной хроматографией на силикагеле (дихлорметан:этилацетат = 20: 1), получая указанное в заголовке соединение в виде бледно-желтого твердого вещества (885 мг, 92%).
ИК-спектр (чистый): 2950, 2850, 1700, 1460, 1400, 1310, 1260, 1100, 1060 см-1.
Спектр 1H ЯМР δ: 0,07 (S, 3Н), 0,09 (S, 3Н), 0,10 (S, 3H), 0,13 (S, 3H), 0,88 (S, 9Н), 0,89 (S, 9H), 0,93 (S, 3Н), 1,01 (S, 3Н), 1,77 (d, J = 7,2 Гц, 3Н), 2,94 (dd, J =4,6, 11,7 Гц, 1Н), 3,25 (dd, J = 4,6, 12,3 Гц, 1Н), 3,85 (brs, 1Н), 4,54 (brs, 1H), 4,78 (m, 1Н), 5,69 (q, J = 7,2 Гц, 1Н), 6,24 (d, J = 8,1 Гц, 1Н), 6,30 (d, J = 8,1 Гц, 1Н), 7,22-7,48 (m, 5H).
Масс-спектр m/z: 733 (M+), 73 (100%).
УФ-спектр λmax нм: 210, 258.
Пример 50.
1α,3β-Бис(трет-бутилдиметилсилилокси)-16α-гидроксипрегна-5,7,17(Е)-триен.
Соединение, полученное в примере 49 (80,0 мг, 109 мкмоль), растворяли в 1,3-диметил-2-имидазолидиноне (6 мл), и смесь перемешивали при 140oC в течение 16 ч. Смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали рассолом и сушили над безводным сульфатом магния. Растворитель отгоняли и остаток очищали препаративной тонкослойной хроматографией (1 пластинка, гексан:этилацетат = 4:1, однократное проявление), получая указанное в заголовке соединение (39,2 мг, 64%).
Пример 51.
1α,3β-Бис(трет-бутилдиметилсилилокси)-20(S)-(3-гидрокси-3-метилбутилтио)-16-оксопрегна-5,7-диен и 1α,3β-бис(трет-бутилдиметилсилилокси)-20(R)-(3-гидрокси-3-метилбутилтио)-16-прегна-5,7-диен.
Соединение, полученное в примере 44 (140 мг, 251 мкмоль) растворяли в тетрагидрофуране (4 мл) и перемешивали с 0,1 М тетраборатом натрия (4 мл) и 3-гидрокси-3-метилбутантиолом (121 мкл) при комнатной температуре 12 ч. Затем добавляли воду, и смесь экстрагировали хлороформом. Органический слой промывали рассолом и сушили над безводным сульфатом магния. После удаления растворителя при пониженном давлении остаток очищали препаративной тонкослойной хроматографией (3 пластинки, гексан:этилацетат = 3:1, проявляли 3 раза) и получали S-изомер указанного в заголовке соединения (115 мг, 68%) в виде белого твердого вещества и R-изомер (52,0 мг, 31%) в виде бесцветного масла.
20S-изомер:
ИК-спектр (чистый): 3460, 2950, 2850, 1740, 1460, 1380, 1260, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 3H), 0,06 (S, 3Н), 0,07 (S, 3H), 0,11 (S, 3Н), 0,87 (S, 3H), 0,88 (S, 9Н), 0,89 (S, 9H), 0,93 (S, 3Н), 1,24 (S, 6H), 1,57 (d, J = 6,6 Гц, 3Н), 2,64 (t, J = 7,8 Гц, 2Н), 2,97-3,12 (m, 1H), 3,73 (brs, 1H), 3,96-4,12 (m, 1H), 5,24-5,32 (m, 1H), 5,56-6,03 (m, 1H).
Масс-спектр (20 эВ) м/z: 676 (М+), 365 (100%).
УФ-спектр λmax нм: 270, 281, 293.
20R-изомер:
ИК-спектр (чистый): 3460, 2950, 2850, 1740, 1460, 1370, 1260, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 6H), 0,07 (S, 3Н), 0,11 (S, 3Н), 0,86 (S, 3Н), 0,87 (S, 9Н), 0,89 (S, 9Н), 0,94 (S, 3Н), 1,23 (d, 6H), 1,44 (d, J = 6,3 Гц, 3Н), 2,60 (t, J = 8,2 Гц, 2Н), 3,25-3,38 (m, 1H), 3,70 (brs, 1H), 3,95-4,10 (m, 1H), 5,44-5,52 (m, 1H), 5,58-5,65 (m, 1H).
Масс-спектр (20 эВ) m/z: 676 (М+), 365 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 52.
1α,3β-Бис(трет-бутилдиметилсилилокси)-20(S)-(3-гидрокси-3-метилбутилтио)-16-оксопрегна-5,7-диен и 1α,3β-бис(трет-бутилдиметилсилилокси)-20(R)-(3-гидрокси-3-метилбутилтио)-16-оксопрегна-5,7-диен.
Использовали методику примера 51, соединение, полученное в примере 45 (80,0 мг, 144 мкмоль), 0,1 М тетраборат натрия (2,3 мл), 3-гидрокси-3-метилбутантиол (80 мкл) и тетрагидрофуран (2,3 мл), остаток очищали препаративной тонкослойной хроматографией (2 пластинки, гексан:этилацетат = 3:1, проявляли 3 раза) и получали S-изомер указанного в заголовке соединения (13,6 мг, 14%) и R-изомер (62,5 мг, 64%).
Пример 53.
1α,3β-Бис(трет-бутилдиметилсилилокси)-20(S)-(4-этил-4-гидроксигексилтио)-16-оксопрегна-5,7-диен и 1α,3β- бис(трет-бутилдиметилсилилокси)-20(R)-(4-этил-4-гидроксигексилтио)-16-оксопрегна-5,7-диен.
Использовали методику примера 51, соединение, полученное в примере 44 (110 мг, 197 мкмоль) 0,1 М тетраборат натрия (3 мл), 4-этил-4-гидроксигексантиол (100 мкл) и тетрагидрофуран (3 мл), остаток очищали препаративной тонкослойной хроматографией (2 пластинки, дихлорметан:этилацетат:этанол = 15:1:0,1, проявляли дважды; затем 2 пластинки, гексан:этилацетат = 4:1, проявляли 5 раз) и получали S-изомер указанного в заголовке соединения (64,2 мг, 45%) и R-изомер (8,1 мг, 6%). Использовали методику примера 51, соединение, полученное в примере 45 (90,0 мг, 162 мкмоль), 0,1 М тетраборат натрия (2,5 мл), 4-этил-4-гидроксигексантиол (90 мкл) и тетрагидрофуран (2,5 мл), остаток очищали препаративной тонкослойной хроматографией (2 пластинки, дихлорметан: этилацетат:этанол = 15:1:0,1, проявляли дважды) и получали S-изомер (следы) и R-изомер (49,9 мг, 45%) указанных в заголовке соединений.
20S-изомер:
ИК-спектр (чистый): 3500, 2950, 2850, 1740, 1460, 1370, 1250, 1100, 1010 см-1.
Спектр 1H ЯМР δ: 0,06 (S, 3Н), 0,07 (S, 3Н), 0,08 (S, 3Н), 0,12 (S, 3Н), 0,80-0,98 (m, 30Н), 1,46 (q, J = 7,3 Гц, 4Н), 1,56 (d, J = 6,6 Гц, 3Н), 2,90-3,08 (m, 1H), 3,73 (brs, 1Н), 3,93-4,15 (m, 1H), 5,23-5,32 (m, 1H), 5,54-5,64 (m, 1H).
Масс-спектр m/z: 718 (M+), 73 (100%).
УФ-спектр λmax нм: 270, 281, 293.
20R-изомер:
ИК-спектр (чистый): 3500, 2950, 2860, 1740, 1460, 1380, 1260, 1100, 1010 см-1.
Спектр 1H ЯМР δ: 0,06 (S, 6Н), 0,07 (S, 3Н), 0,11 (S, 3Н), 0,76-0,94 (m, 30Н), 3,23-3,38 (m, 1H), 3,71 (brs, 1H), 3,96-4,13 (brs, 1H), 5,46-5,54 (m, 1H), 5,59-5,66 (m, 1H).
Масс-спектр m/z: 718 (M+), 73 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 54.
1α,3β-Бис(трет-бутилдиметилсилилокси)-20(S)-(4-гидрокси-4-метилпентилтио)-16-оксопрегна-5,7-диен и 1α,3β-бис(трет-бутилдиметилсилилокси)-20(R)-(4-гидрокси-4-метилпентилтио)-16-оксопрегна-5,7-диен.
Использовали методику примера 51, соединение, полученное в примере 44 (100 мг, 180 мкмоль), 0,1 М тетраборат натрия (3 мл), 4-гидрокси-4-метил-1-пентантиол (100 мкл) и тетрагидрофуран (3 мл), остаток очищали препаративной тонкослойной хроматографией (2 пластинки, гексан:этилацетат = 3:1, проявляли 3 раза) и получали S-изомер указанного в заголовке соединения (85,8 мг, 69%) и R-изомер (19,7 мг, 16%). Использовали методику примера 51, соединение, полученное в примере 45 (80,0 мг, 144 мкмоль), 0,1 М тетраборат натрия (2,3 мл), 4-гидрокси-4-метил-1-пентантиол (100 мкл) и тетрагидрофуран (2,3 мл), остаток очищали препаративной тонкослойной хроматографией (2 пластинки, гексан: этилацетат = 3: 1, проявляли 3 раза) и получали S-изомер (следы) и R-изомер (91,7 мг, 92%) указанных в заголовке соединений.
20S-изомер:
ИК-спектр (чистый): 3450, 2950, 2850, 1740, 1460, 1380, 1260, 1100 см-1.
Спектр 1H ЯМР δ: 0,06 (S, 3Н), 0,07 (m, 3Н), 0,08 (S, 3Н), 0,12 (S, 3Н), 0,87 (S, 3Н), 0,89 (S, 3Н), 0,90 (S, 3Н), 0,94 (S, 3Н), 1,22 (S, 6Н), 1,56 (d, J = 6,6 Гц, 3Н), 2,97-3,05 (m, 1Н), 3,72 (brs, 1Н), 3,95-4,16 (m, 1Н), 5,23-5,34 (m, 1Н), 5,56-5,64 (m, 1H).
Масс-спектр m/z: 690 (M+), 73 (100%).
УФ-спектр λmax нм: 270, 281, 293.
20R-изомер:
ИК-спектр (чистый): 3450, 2950, 2850, 1740, 1460, 1380, 1250, 1100 см-1.
Спектр 1H ЯМР δ: 0,06 (S, 6H), 0,07 (S, 3Н), 0,11 (S, 3Н), 0,84 (S, 3Н), 0,88 (S, 9Н), 0,89 (S, 9H), 0,94 (S, 3Н), 1,23 (S, 6H), 1,42 (d, J = 6,4 Гц, 3Н), 3,21-3,39 (m, 1Н), 3,71 (brs, 1Н), 3,94-4,14 (m, 1Н), 5,45-5,56 (m, 1Н), 5,59-5,67 (m, 1Н).
Масс-спектр m/z: 690 (М+), 73 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 55.
1α,3β-Бис(трет-бутилдиметилсилилокси)-20(S)-(3-этил-3-гидроксипентилтио)-16-оксопрегна-5,7-диен и 1α,3β- бис(трет-бутилдиметилсилилокси)-20(R)-(3-этил-3-гидроксипентилтио)-16-оксопрегна-5,7-диен.
Использовали методику примера 51, соединение, полученное в примере 44 (152 мг, 273 мкмоль), 0,1 М тетраборат натрия (4,2 мл), 3-этил-3-гидрокси-1-пентантиол (140 мкл) и тетрагидрофуран (4,2 мл), остаток очищали препаративной тонкослойной хроматографией (2 пластинки, гексан:этилацетат = 3:1, проявляли 3 раза; затем 2 пластинки, дихлорметан:этилацетат:этанол = 15:1: 0,1, проявляли дважды и получали S-изомер указанного в заголовке соединения (100 мг, 52%) и R-изомер (17,7 мг, 9%). Использовали методику примера 51, соединение, полученное в примере 45 (42,1 мг, 75,6 мкмоль), 0,1 М тетраборат натрия (1,2 мл), 3-этил-3-гидрокси-1-пентантиол (40 мкл) и тетрагидрофуран (1,2 мл), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, гексан: этилацетат = 4: 1, проявляли 3 раза) и получали S-изомер (следы) и R-изомер (34,3 мг, 64%) указанных в заголовке соединений.
20S-изомер:
ИК-спектр (чистый): 3500, 2950, 2850, 1740, 1460, 1380, 1250, 1100, 1010 см-1.
Спектр 1H ЯМР δ: 0,06 (S, 3Н), 0,07 (S, 3H), 0,08 (S, 3Н), 0,12 (S, 3Н), 0,80-0,98 (m, 30Н), 1,46 (q, J = 7,3 Гц, 4Н), 2,59 (t, J = 8,3 Гц, 2Н), 2,95-3,09 (m, 1Н), 3,72 (brs, 1Н), 3,94-4,16 (m, 1Н), 5,23-5,34 (m, 1Н), 5,56-5,64 (m, 1Н).
Масс-спектр m/z: 704 (М+), 73 (100%).
УФ-спектр λmax нм: 270, 281, 293.
20R-изомер:
ИК-спектр (чистый): 3500, 2950, 2850, 1740, 1460, 1370, 1250, 1100, 1010 см-1.
Спектр 1H ЯМР δ: 0,06 (S, 6Н), 0,07 (S, 3Н), 0,11 (S, 3Н), 0,76-0,94 (m, 30Н), 3,23-3,38 (m, 1Н), 3,71 (brs, 1Н), 3,96-4,13 (m, 1Н), 5,46-5,54 (m, 1Н), 5,59-5,65 (m, 1Н).
Масс-спектр m/z: 704 (М+), 73 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 56.
1α,3β-Бис(трет-бутилдиметилсилилокси)-20(S)-(3-гидрокси-3-метилбутилтио)-16β-гидроксипрегна-5,7-диен и 1α,3β-бис(трет-бутилдиметилсилилокси)-20(S)-(3-гидрокси-3-метилбутилтио)-16α-гидроксипрегна-5,7-диен.
20S-Изомер соединения, полученного в примере 51 (113 мг, 167 мкмоль) растворяли в тетрагидрофуране (3,5 мл) и порциями прибавляли алюмогидрид лития (10,1 мг, 266 мкмоль). Смесь перемешивали при комнатной температуре 30 мин, затем реакцию прекращали добавлением 10%-ного водного раствора гидроксида натрия. Добавляли воду, и смесь экстрагировали этилацетатом. Органический слой промывали рассолом и сушили над безводным сульфатом магния. Растворитель отгоняли и остаток очищали препаративной тонкослойной хроматографией (2 пластинки, гексан:этилацетат = 1:1, проявляли дважды) и получали (β-изомер указанного в заголовке соединения (73,4 мг, 65%) в виде белого твердого вещества и α-изомер (22,0 мг, 19%) в виде бесцветного масла.
16β-изомер:
ИК-спектр (KBr): 3450, 2950, 2850, 1460, 1370, 1250, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 6Н), 0,06 (S, 3Н), 0,10 (S, 3H), 0,87 (S, 9Н), 0,88 (S, 9Н), 0,91 (S, 3Н), 0,93 (S, 3Н), 1,25 (S, 6Н), 1,48 (d, J = 6,2 Гц, 3Н), 2,65 (t, J = 8,1 Гц, 2Н), 3,11-3,25 (m, 1Н), 3,70 (brs, 1Н), 3,97-4,13 (m, 1Н), 4,38-4,55 (m, 1Н), 5,27-5,36 (m, 1Н), 5,47-5,63 (m, 1Н).
Масс-спектр m/z: 678 (M+), 73 (100%).
УФ-спектр λmax нм: 271, 282, 294.
16α-изомер:
ИК-спектр (чистый): 3400, 2950, 2850, 1460, 1380, 1250, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 3Н), 0,06 (S, 6Н), 0,10 (S, 3H), 0,72 (S, 3Н), 0,88 (S, 21H), 1,25 (S, 6Н), 1,48 (d, J = 6,5 Гц, 3Н), 2,65 (t, J = 8,0 Гц, 2Н), 2,84-3,02 (m, 1Н), 3,70 (brs, 1Н), 3,97-4,28 (m, 2Н), 5,25-5,34 (m, 1Н), 5,55-5,63 (m, 1Н).
Масс-спектр m/z: 678 (М+), 73 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 57.
1α,3β-Бис(трет-бутилдиметилсилилокси)-20(R)-(3-гидрокси-3-метилбутилтио)-16β-гидроксипрегна-5,7-диен и 1α,3β-бис(трет-бутилдиметилсилилокси)-20(R)-(3-гидрокси-3-метилбутилтио)-16α-гидроксипрегна-5,7-диен.
Использовали методику примера 56, 20R-изомер соединения полученного в примере 51 (51,7 мг, 76,3 мкмоль), тетрагидрофуран (1,5 мл) и алюмогидрид лития (4,6 мг, 122 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, гексан:этилацетат = 1:1, проявляли дважды) и получали β-изомер указанного в заголовке соединения (13,2 мг, 25%) и α-изомер (10,1 мг, 19%), оба в виде бесцветных масел.
16β-изомер:
ИК-спектр (чистый): 3450, 2950, 2850, 1460, 1380, 1250, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 3Н), 0,06 (S, 6Н), 0,11 (S, 3Н), 0,79 (S, 3Н), 0,88 (S, 18H), 0,92 (S, 3Н), 1,25 (S, 6Н), 1,44 (d, J = 6,6 Гц, 3Н), 2,69 (t, J = 8,1 Гц, 2Н), 3,06-3,19 (m, 1Н), 3,71 (brs, 1Н), 3,81-3,95 (m, 1Н), 3,96-4,11 (m, 1Н), 5,31-5,39 (m, 1Н), 5,55-5,63 (m, 1Н).
Масс-спектр m/z: 678 (М+), 73 (100%).
УФ-спектр λmax нм: 270, 282, 293.
16α-изомер:
ИК-спектр (чистый): 3450, 2950, 2850, 1460, 1380, 1250, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (brs, 9H), 0,11 (S, 3Н), 0,84 (S, 3Н), 0,88 (S, 18Н), 0,91 (S, 3Н), 1,26 (S, 6Н), 1,46 (d, J = 6,6 Гц, 3Н), 2,70 (t, J = 8,1 Гц, 2Н), 3,02-3,19 (m, 1Н), 3,69 (brs, 1Н), 3,95-4,11 (m, 1Н), 4,39-4,53 (m, 1Н), 5,33-5,42 (m, 1Н), 5,56-5,66 (m, 1Н).
Масс-спектр m/z: 678 (М+), 73 (100%).
УФ-спектр λmax нм: 270, 282, 293.
Пример 58.
1α,3β-Бис(трет-бутилдиметилсилилокси)-20(S)-(4-этил-4-гидроксигексилтио)-16-β-гидроксипрегна-5,7-диен и 1α,3β-бис(трет-бутилдиметилсилилокси)-20(S)-(4-этил-4- гидроксигексилтио)-16α-гидроксипрегна-5,7-диен.
Использовали методику примера 56, 20S-изомер соединения, полученного в примере 53 (61,0 мг, 84,8 мкмоль), тетрагидрофуран (2,4 мл) и алюмогидрид лития (5,2 мг, 136 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, гексан:этилацетат = 3:1, проявляли 3 раза) и получали β-изомер указанного в заголовке соединения (40,4 мг, 66%) и α-изомер (12,1 мг, 20%), оба в виде бесцветных масел.
16β-изомер:
ИК-спектр (чистый): 3450, 2950, 2850, 1460, 1370, 1250, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 6Н), 0,06 (S, 3Н), 0,10 (S, 3H), 0,78-0,94 (m, 30Н), 3,08-3,22 (m, 1Н), 3,70 (brs, 1H), 3,97- 4,13 (m, 1H), 4,39-4,52 (m, 1H), 5,26-5,36 (m, 1H), 5,55-5,66 (m, 1H).
Масс-спектр m/z: 720 (M+), 73 (100%).
УФ-спектр λmax нм: 270, 282, 294.
16α-изомер:
ИК-спектр (чистый): 3440, 2950, 2850, 1460, 1380, 1250, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 3Н), 0,06 (S, 6Н), 0,11 (S, 3H), 0,71 (S, 3H), 0,78-0,94 (m, 27H), 2,81-2,98 (m, 1H), 3,70 (brs 1H), 3,97-4,11 (m, 1H), 4,15-4,25 (m, 1H), 5,25-5,33 (m, 1H), 5,55-5,61 (m, 1H).
Масс-спектр m/z: 720 (М+), 73 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 59.
1α,3β-Бис(трет-бутилдиметилсилилокси)-20(R)-(4-этил-4-гидроксигексилтио)-16β-гидpoкcипpегнa-5,7-диен.
Использовали методику примера 56, 20R-изомер соединения, полученного в примере 53 (49,9 мг, 69,4 мкмоль), тетрагидрофуран (2,0 мл) и алюмогидрид лития (4,2 мг, 111 мкмоль), остаток очищали препаративной тонкослойной хроматографией (2 пластинки, гексан:этилацетат = 3:1, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (36,7 мг, 73%).
ИК-спектр (чистый): 3450, 2950, 2850, 1460, 1380, 1250, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 3Н), 0,07 (S, 6Н), 0,11 (S, 3Н), 0,78-0,94 (m, 30Н), 3,06-3,18 (m, 1Н), 3,71 (brs, 1Н), 3,81-3,95 (m, 1Н), 3,98-4,13 (m, 1Н), 5,31-5,39 (m, 1Н), 5,55-5,63 (m, 1Н).
Масс-спектр m/z: 720 (M+), 73 (100%).
УФ-спектр λmax нм: 270, 282, 293.
Пример 60.
1α,3β-Бис(трет-бутилдиметилсилилокси)-20(S)-(4-гидрокси-4-метилпентилтио)-16β-гидроксипрегна-5,7-диен и 1α,3β-бис(трет-бутилдиметилсилилокси)-20(S)-(4-гидрокси-4-метилпентилтио)-16α-гидроксипрегна-5,7-диен.
Использовали методику примера 56, 20S-изомер соединения, полученного в примере 54 (85,0 мг, 123 мкмоль), тетрагидрофуран (2,5 мл) и алюмогидрид лития (7,5 мг, 197 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, гексан: этилацетат = 1:1, проявляли 3 раза; затем 1 пластинка, дихлорметан:этанол = 30:1, проявляли 5 раз) и получали β-изомер указанного в заголовке соединения (58,3 мг, 68%) и α-изомер (9,7 мг, 11%), оба в виде бесцветных масел.
16β-изомер:
ИК-спектр (чистый): 3400, 2950, 2850, 1460, 1380, 1250, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 6Н), 0,06 (S, 3Н), 0,10 (S, 3Н), 0,87 (S, 9Н), 0,88 (S, 9Н), 0,92 (S, 3Н), 0,93 (S, 3Н), 1,25 (S, 6Н), 1,46 (d, J = 6,3 Гц, 3Н), 3,07-3,22 (m, 1Н), 3,70 (brs, 1Н), 3,97-4,12 (m, 1Н), 4,38-4,51 (m, 1Н), 5,25-5,35 (m, 1H), 5,54-5,66 (m, 1Н).
Масс-спектр m/z: 692 (М+), 73 (100%).
УФ-спектр λmax нм: 270, 282, 293.
16α-изомер:
ИК-спектр (чистый): 3420, 2950, 2850, 1460, 1370, 1250, 1090 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 3Н), 0,06 (S, 6H), 0,10 (S, 3H), 0,72 (S, 3Н), 0,88 (S, 21Н), 1,25 (S, 6Н), 1,48 (d, J = 6,4 Гц, 3Н), 2,85-3,03 (m, 1Н), 3,71 (brs, 1Н), 3,96-4,27 (brs, 2H), 5,25-5,34 (m, 1Н), 5,54-5,64 (m, 1Н).
Масс-спектр m/z: 692 (М+), 73 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 61.
1α,3β-Бис(трет-бутилдиметилсилилокси)-20(R)-(4-гидрокси-4-метилпентилтио)-16β-гидроксипрегна-5,7-диен.
Использовали методику примера 56, 20R-изомер соединения,
полученный в примере 54 (91,1 мг, 132 мкмоль), тетрагидрофуран (2,5 мл) и алюмогидрид лития (8,0 мг, 211 мкмоль), остаток очищали препаративной тонкослойной хроматографией (2 пластинки, дихлорметан:этанол = 20:1, проявляли 5 раз) и получали указанное в заголовке соединение в виде бесцветного масла (57,0 мг, 62%).
ИК-спектр(чистый): 3450, 2950, 2850, 1460, 1380, 1250, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 3Н), 0,06 (S, 6Н), 0,11 (S, 3Н), 0,72 (S, 3Н), 0,88 (S, 18Н), 0,92 (S, 3Н), 1,26 (S, 6Н), 1,44 (d, J = 6,6 Гц, 3Н), 2,69 (t, J = 8,0 Гц, 2Н), 2,97-3,08 (m, 1H), 3,71 (brs, 1H), 3,81-3,94 (m, 1H), 3,96-4,11 (m, 1H), 5,30-5,39 (m, 1H), 5,55-5,62 (m, 1H).
Масс-спектр m/z: 692 (М+), 73 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 62.
1α,3β-Бис(трет-бутилдиметилсилилокси)-20(S)-(2-этил-3-гидроксипентилтио)-16β-гидроксипрегна-5,7-диен и 1α,3β-бис(трет-бутилдиметилсилилокси)-20(S)-(3-этил-3-гидроксипентилтио)-16α-гидроксипрегна-5,7-диен.
Использовали методику примера 56, 20S-изомер соединения, полученный в примере 55 (98,8 мг, 140 мкмоль), тетрагидрофуран (5,0 мл) и алюмогидрид лития (8,5 мг, 224 мкмоль), остаток очищали препаративной тонкослойной хроматографией (2 пластинки, гексан:этилацетат = 3:1, проявляли 3 раза) и получали β-изомер указанного в заголовке соединения (42,6 мг, 43%) и α-изомер (12,2 мг, 12%), оба в виде бесцветных масел.
16β-изомер:
ИК-спектр (чистый): 3450, 2950, 2850, 1460, 1380, 1260, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 6Н), 0,06 (S, 3Н), 0,10 (S, 3Н), 0,81-0,97 (m, 30Н), 2,60 (t, J = 8,1 Гц, 2Н), 3,09-3,25 (m, 1H), 3,69 (brs, 1H), 3,94-4,14 (m, 1H), 4,38-4,51 (m, 1H), 5,26 (m, 1H), 5,55-5,60 (m, 1H).
Масс-спектр m/z: 706 (M+), 73 (100%).
УФ-спектр λmax нм: 271, 282, 294.
16α-изомер:
ИК-спектр (чистый): 3400, 2950, 2850, 1460, 1370, 1250, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 3Н), 0,06 (S, 6Н), 0,10 (S, 3H), 0,72 (S, 3Н), 0,80-0,94 (m, 27H), 2,59 (t, J = 8,1 Гц, 2Н), 2,84-2,98 (m, 1H), 3,69 (brs, 1H), 3,95-4,10 (m, 1H), 4,12-4,19 (m, 1H), 5,25-5,34 (m, 1H), 5,55-5,63 (m, 1H).
Масс-спектр m/z: 706 (M+), 73 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 63.
1α,3β-Бис(трет-бутилдиметилсилилокси)-20(R)-(3-этил-3-гидроксипентилтио)-16β-гидроксипрегна-5,7-диен.
Использовали методику примера 56, 20R-изомер соединения полученный в примере 55 (33,3 мг, 47,2 мкмоль), тетрагидрофуран (1,1 мл) и алюмогидрид лития 2,9 мг, 75,2 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, гексан:этилацетат = 3:1, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (18,2 мг, 55%).
ИК-спектр (чистый): 3430, 2950, 2850, 1460, 1380, 1250, 1100 см-1.
Спектр 1H ЯМР δ: 0,05 (S, 3Н), 0,06 (S, 6Н), 0,11 (S, 3Н), 0,78 (S, 3Н), 0,81-0,94 (m, 27Н), 2,64 (t, J = 8,2 Гц, 2Н), 3,07-3,19 (m, 1Н), 3,71 (brs, 1Н), 3,82-3,94 (m, 1H), 3,97-4,11 (m, 1Н), 5,31-5,39 (m, 1Н), 5,55-6,63 (m, 1Н).
Масс-спектр m/z: 706 (M+), 73 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 64.
20(S)-(3-Гидрокси-3-метилбутилтио)-1α,3β,16β-тригидроксипрегна-5,7-диен.
В атмосфере аргона 16-β-изомер соединения, полученного в примере 56 (70,1 мг, 103 мкмоль), растворяли в сухом тетрагидрофуране (1,1 мл) и прибавляли тетра-н-бутиламмонийфторид (1М раствор в тетрагидрофуране, 1,1 мл), и смесь осторожно кипятили 16 ч. Смесь выливали в воду и экстрагировали этилацетатом. Органический слой промывали последовательно 10%-ной соляной кислотой, водным насыщенным раствором бикарбоната натрия и рассолом и сушили над безводным сульфатом магния. После отгонки растворителя при пониженном давлении остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан: этанол = 5: 1, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (41,1 мг, 89%).
ИК-спектр (чистый): 3400, 2950, 1460, 1420, 1380, 1210, 1150, 1050 см-1.
Спектр 1H ЯМР δ: 0,93 (S, 3Н), 0,94 (S, 3Н), 1,24 (S, 6Н), 1,46 (d, J = 6,3 Гц, 3Н), 2,62 (t, J = 7,8 Гц, 2Н), 3,06-3,24 (m, 1Н), 3,73 (brs, 1Н), 3,91-4,10 (m, 1H), 4,33-4,49 (m, 1H), 5,30-5,40 (m, 1H), 5,61-5,71 (m, 1H).
Масс-спектр m/z: 450 (M+), 69 (100%).
УФ-сектр λmax нм: 271, 282, 293.
Пример 65.
20(S)-(3-Гидрокси-3-метилбутилтио)-1α,3β,16α-тригидроксипрегна-5,7-диен.
Использовали методику примера 64, 16α-изомер соединения, полученный в примере 56 (22,0 мг, 32,4 мкмоль), сухой тетрагидрофуран (1,1 мл) и тетра-н-бутиламмонийфторид (1М раствор в тетрагидрофуране, 1,1 мл), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан: этанол = 5:1, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (11,5 мг, 79%).
ИК-спектр (чистый): 3350, 2950, 1450, 1380, 1050 см-1.
Спектр 1H ЯМР δ: 0,72 (S, 3Н), 0,93 (S, 3Н), 1,25 (S, 6H), 1,48 (d, J = 6,9 Гц, 3Н), 2,65 (t, J = 8,1 Гц, 2Н), 2,85-3,00 (m, 1H), 3,77 (brs, 1H), 4,00-4,26 (m, 2Н), 5,31-5,40 (m, 1H), 5,68-5,76 (m, 1H).
Масс-спектр m/z: 450 (M+), 69 (100%).
УФ-спектр λmax нм: 270, 282, 293.
Пример 66.
20(R)-(3-Гидрокси-3-метилбутилтио)-1α,3β,16β-тригидроксипрегна-5,7-диен.
Использовали методику примера 64, 16β-изомер соединения, полученный в примере 57 (55,1 мг, 81,1 мкмоль), сухой тетрагидрофуран (1,0 мл) и тетра-н-бутиламмонийфторид (1М раствор в тетрагидрофуране, 1,0 мл), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан: этанол = 5:1, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (31,9 мг, 88%).
ИК-спектр (чистый): 3400, 2950, 1450, 1380, 1210, 1030 см-1.
Спектр 1H ЯМР δ: 0,79 (S, 3Н), 0,95 (S, 3H), 1,24 (S, 6Н), 1,44 (d, J = 6,9 Гц, 3Н), 2,69 (t, J = 8,3 Гц, 2Н), 3,06-3,20 (m, 1Н), 3,76 (brs, 1Н), 3,28-3,95 (m, 1Н), 3,98-4,15 (m, 1H), 5,37-5,45 (m, 1Н), 5,66-5,75 (м, 1Н).
Масс-спектр m/z: 450 (M+), 69 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 67.
20(R)-(3-Гидрокси-3-метилбутилтио)-1α,3β,16α- тpигидpoкcипрегна-5,7-диен.
Использовали методику примера 64, 16α-изомер соединения, полученный в примере 57 (15,8 мг, 23,3 мкмоль), сухой тетрагидрофуран (1,0 мл) и тетра-н-бутиламмонийфторид (1М раствор в тетрагидрофуране, 0,8 мл), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан: этанол = 5:1, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (8,6 мг, 82%).
ИК-спектр (чистый): 3400, 2950, 1450, 1380, 1330, 1210, 1030 см-1.
Спектр 1H ЯМР δ: 0,85 (S, 3Н), 0,96 (S, 3Н), 1,26 (S, 6Н), 1,46 (d, J = 6,6 Гц, 3Н), 2,70 (t, J = 7,9 Гц, 2Н), 3,04-3,19 (m, 1Н), 3,75 (brs, 1Н), 3,97-4,13 (m, 1H), 4,42-4,53 (m, 1Н), 5,39-5,47 (m, 1Н), 5,71-5,78 (m, 1Н).
Масс-спектр m/z: 450 (М+), 69 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 68.
20(S)-(4-этил-4-гидроксигексилтио)-1α,3β,16β- тригидроксипрегна-5,7-диен.
Использовали методику примера 64, 16β-изомер соединения, полученный в примере 58 (36,5 мг, 50,6 мкмоль), сухой тетрагидрофуран (1,0 мл) и тетра-н-бутиламмонийфторид (1М раствор в тетрагидрофуране, 1,0 мл) остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 16: 3, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (21,3 мг, 86%).
ИК-спектр (чистый): 3400, 2950, 1460, 1420, 1370, 1250, 1030 см-1.
Спектр 1H ЯМР δ: 0,86 (t, J = 7,3 Гц, 6Н), 0,93 (S, 3Н), 0,96 (S, 3Н), 3,03-3,23 (m, 1H), 3,77 (brs, 1H), 3,96-4,15 (m, 1H), 4,26-4,52 (m, 1H), 5,31-5,40 (m, 1H), 5,67-5,76 (m, 1H).
Масс-спектр m/z: 492 (М+), 143 (100%).
УФ-спектр λmax нм: 271, 282, 293.
Пример 69.
20(S)-(4-этил-4-гидроксигексилтио)-1α,3β,16α- тригидроксипрегна-5,7-диен.
Использовали методику примера 64, 16α-изомер соединения, полученный в примере 58 (12,0 мг, 16,6 мкмоль), сухой тетрагидрофуран (1,0 мл) и тетра-н-бутиламмонийфторид (1М раствор в тетрагидрофуране, 1,0 мл), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан: этанол = 16: 3, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (6,3 мг, 77%).
ИК-спектр (чистый): 3400, 2950, 1450, 1380, 1040 см-1.
Спектр 1H ЯМР δ: 0,72 (S, 3Н), 0,86 (t, J = 7,3 Гц, 6Н), 0,94 (S, 3Н), 2,80-2,98 (m, 1H), 3,77 (brs, 1H), 3,96-4,28 (m, 2Н), 5,29-5,39 (m, 1H), 5,67-5,75 (m, 1H).
Масс-спектр m/z: 492 (M+), 143 (100%).
УФ-спектр λmax нм: 271, 282, 293.
Пример 70.
20(R)-(4-этил-4-гидроксигексилтио)-1α,3β,16β- тригидроксипрегна-5,7-диен.
Использовали методику примера 64, соединение, полученное в примере 59 (34,0 мг, 47,1 мкмоль), сухой тетрагидрофуран (1,0 мл) и тетра-н-бутиламмонийфторид (1М раствор в тетрагидрофуране, 1,0 мл), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 16: 3, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (12,1 мг, 52%).
ИК-спектр (чистый): 3400, 2950, 1460, 1380, 1040 см-1.
Спектр 1H ЯМР δ: 0,80 (S, 3Н), 0,86 (t, J = 7,3 Гц, 6Н), 0,97 (S, 3Н), 3,06-3,17 (m, 1Н), 3,78 (brs, 1Н), 3,80-4,06 (m, 2Н), 5,36-5,45 (m, 1Н), 5,67-5,76 (m, 1Н).
Масс-спектр m/z: 492 (М+), 143 (100%).
УФ-спектр λmax нм: 271, 282, 293.
Пример 71.
20(S)-(4-Гидрокси-4-метилпентилтио)-1α,3β,16β- тригидроксипрегна-5,7-диен.
Использовали методику примера 64, 16 β- изомер соединения, полученный в примере 60 (58,3 мг, 84,1 мкмоль), сухой тетрагидрофуран (1,0 мл) и тетра-н-бутиламмонийфторид (1М раствор в тетрагидрофуране, 1,0 мл) остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 5: 1, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (22,9 мг, 59%).
ИК-спектр (чистый): 3400, 2950, 1450, 1380, 1050 см-1.
Спектр 1H ЯМР δ: 0,94 (S, 3H), 0,97 (S, 3Н), 1,23 (S, 6Н), 1,47 (d, J = 6,3 Гц, 3Н), 3,07-3,22 (m, 1Н), 3,78 (brs, 1Н), 4,00-4,16 (m, 1Н), 4,40-4,52 (m, 1Н), 5,34-5,41 (m, 1Н), 5,69-5,76 (m, 1H).
Масс-спектр m/z: 464 (М+), 117 (100%).
УФ-спектр λmax нм: 270, 282, 293.
Пример 72.
20(S)-(4-Гидрокси-4-метилпентилтио)-1α,3β,16α- тpигидpoкcипрегна-5,7-диен.
Использовали методику примера 64, 16α-изомер соединения, полученный в примере 60 (9,7 мг, 14,0 мкмоль), сухой тетрагидрофуран (1,0 мл) и тетра-н-бутиламмонийфторид (1М раствор в тетрагидрофуране, 1,0 мл) остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 5: 1, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (4,6 мг, 71%).
ИК-спектр (чистый): 3400, 2950, 1450, 1380, 1040 см-1.
Спектр 1H ЯМР δ: 0,72 (S, 3Н), 0,94 (S, 3Н), 1,22 (S, 6Н), 1,46 (d, J = 6,6 Гц, 3Н), 2,83-2,98 (m, 1H), 3,77 (brs, 1H), 4,00-4,13 (m, 1H), 4,16-4,24 (m, 1H), 5,32-5,39 (m, 1H), 5,68-5,75 (m, 1H).
Масс-спектр m/z: 464 (М+), 117 (100%).
УФ-спектр λmax нм: 270, 282, 293.
Пример 73.
20(R)-(4-Гидрокси-4-метилпентилтио)-1α,3β,16β- тригидроксипрегна-5,7-диен.
Использовали методику примера 64, соединение, полученное в примере 61 (57,0 мг, 82,2 мкмоль), сухой тетрагидрофуран (1,0 мл) и тетра-н-бутиламмонийфторид (1М раствор в тетрагидрофуране, 1,0 мл), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 5: 1, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (30,4 мг, 80%).
ИК-спектр (чистый): 3400, 2950, 1450, 1380, 1220, 1040 см-1.
Спектр 1H ЯМР δ: 0,80 (S, 3Н), 0,96 (S, 3Н), 1,22 (S, 6H), 1,42 (d, J = 6,9 Гц, 3Н), 3,05-3,18 (m, 1Н), 3,77 (brs, 1H), 3,80-3,96 (m, 1Н), 3,98-4,16 (m, 1Н), 5,38-5,47 (m, 1Н), 5,68-5,75 (m, 1Н).
Масс-спектр m/z: 464 (М+), 117 (100%).
УФ-спектр λmax нм: 270, 282, 293.
Пример 74.
20(S)-(3-Этил-3-гидроксипентилтио)-1α,3β,16β- тригидроксипрегна-5,7-диен.
Использовали методику примера 64, 16β-изомер соединения, полученный в примере 62 (42,6 мг, 60,2 мкмоль), сухой тетрагидрофуран (1,0 мл) и тетра-н-бутиламмонийфторид (1М раствор в тетрагидрофуране, 1,2 мл), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан: этанол = 5:1, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (23,9 мг, 83%).
ИК-спектр (чистый): 3400, 2950, 1460, 1380, 1330, 1260, 1050 см-1.
Спектр 1H ЯМР δ: 0,87 (t, J = 7,3 Гц, 6H), 0,93 (S, 3Н), 0,95 (S, 3Н), 2,59 (t, J = 8,2 Гц, 2Н), 3,03-3,24 (m, 1H), 3,75 (brs, 1H), 3,93-4,13 (m, 1H), 4,33-4,51 (m, 1H), 5,28-5,40 (m, 1H), 5,65-5,74 (m, 1H).
Масс-спектр m/z: 478 (М+), 87 (100%).
УФ-спектр λmax нм: 271, 282, 294.
Пример 75.
20(S)-(3-Этил-3-гидроксипентилтио)-1α,3β,16α- тригидроксипрегна-5,7-диен.
Использовали методику примера 64, 16α-изомер соединения, полученный в примере 62 (12,2 мг, 17,2 мкмоль), сухой тетрагидрофуран (1,0 мл) и тетра-н-бутиламмонийфторид (1М раствор в тетрагидрофуране, 1,0 мл), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан: этанол = 5:1, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (6,3 мг, 77%).
ИК-спектр (чистый): 3400, 2950, 1460, 1380, 1330, 1220, 1040 см-1.
Спектр 1H ЯМР δ: 0,72 (S, 3Н), 0,87 (t, J = 7,3 Гц, 6Н), 0,93 (S, 3Н), 2,59 (t, J = 7,9 Гц, 2Н), 2,84-2,99 (m, 1H), 3,77 (brs, 1H), 3,96-4,24 (m, 2Н), 5,31-5,40 (m, 1H), 5,67-5,76 (m, 1H).
Масс-спектр m/z: 478 (M+), 87 (100%).
УФ-спектр λmax нм: 271, 282, 293.
Пример 76.
20(R)-(3-Этил-3-гидроксипентилтио)-1α,3β,16β- тригидроксипрегна-5,7-диен.
Использовали методику примера 64, соединение, полученное в примере 63 (18,0 мг, 25,5 мкмоль), сухой тетрагидрофуран (1,0 мл) и тетра-н-бутиламмонийфторид (1М раствор в тетрагидрофуране, 1,0 мл), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 5: 1, однократное проявление) и получали указанное в заголовке соединение в виде бесцветного масла (8,5 мг, 70%).
ИК-спектр (чистый): 3400, 2950, 1460, 1380, 1280, 1030 см-1.
Спектр 1H ЯМР δ: 0,80 (S, 3Н), 0,87 (t, J = 7,3 Гц, 6Н), 0,97 (S, 3Н), 2,64 (t, J = 8,31 Гц, 2Н), 3,07-3,18 (m, 1Н), 3,78 (brs, 1Н), 3,83-3,96 (m, 1Н), 3,99-4,15 (m, 1Н), 5,40-5,48 (m, 1H), 5,69-5,77 (m, 1Н).
Масс-спектр m/z: 478 (М+, 87 (100%).
УФ-спектр λmax нм: 270, 281, 293.
Пример 77.
20(S)-(3-Гидрокси-3-метилбутилтио)-1α,3β,16β- тригидрокси-9,10-секопрегна-5,7,10(19)-триен.
Соединение, полученное в примере 64 (40,2 мг, 89,2 мкмоль), растворяли в этаноле (200 мл) и облучали ртутной лампой высокого давления мощностью 400 Вт 2,5 мин с фильтром Викора (Vycor) при барботировании аргона при 0oC и затем осторожно кипятили 2 ч. Растворитель отгоняли при пониженном давлении, и остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 5:1, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (4,6 мг, 11%).
ИК-спектр (чистый): 3400, 2950, 1450, 1370, 1200, 1050 см-1.
Спектр 1H ЯМР δ: 0,84 (S, 3Н), 1,25 (S, 6Н), 1,47 (d, J = 6,3 Гц, 3Н), 2,64 (t, J = 7,9 Гц, 2Н), 3,05-3,24 (m, 1Н), 4,16-4,29 (brs, 1Н), 4,34-4,49 (brs, 2Н), 5,00 (S, 1Н), 5,33 (S, 1Н), 6,02 (d, J = 11,6 Гц, 1Н), 6,36 (d, J =11,6 Гц, 1Н).
Масс-спектр m/z: 450 (M+), 69 (100%).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 78.
20(S)-(3-Гидрокси-3-метилбутилтио)-1α,3β,16α- тригидрокси-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 77 (облучение 2,5 мин), соединение, полученное в примере 65 (11,5 мг, 25,5 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 6:1, проявляли 5 раз) и получали указанное в заголовке соединение в виде бесцветного масла (0,7 мг, 6%).
ИК-спектр (чистый): 3350, 2950, 1450, 1380, 1200, 1050 см-1.
Спектр 1H ЯМР δ: 0,64 (S, 3Н), 1,25 (S, 6Н), 1,46 (d, J = 6,9 Гц, 3Н), 2,64 (t, J = 7,9 Гц, 2Н), 2,82-2,97 (m, 1Н), 4,10-4,30 (br, 2Н), 4,40-4,51 (br, 1Н), 4,99 (S, 1Н), 5,33 (S, 1Н), 5,96 (d, J = 11,1 Гц, 1Н), 6,37 (d, J = 11,1 Гц, 1Н).
Масс-спектр m/z: 450 (М+), 69 (100>).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 79.
20(R)-(3-Гидрокси-3-метилбутилтио)-1α,3β,16α- тригидрокси-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 77 (облучение 2,5 мин), соединение, полученное в примере 66 (31,9 мг, 70,8 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 6:1, проявляли дважды) и получали указанное в заголовке соединение в виде бесцветного масла (3,5 мг, 11%).
ИК-спектр (чистый): 3350, 2950, 1450, 1380, 1210, 1060 см-1.
Спектр 1H ЯМР δ: 0,71 (S, 3Н), 1,25 (S, 6H), 1,44 (d, J = 6,6 Гц, 3Н), 2,70 (t, J = 7,9 Гц, 2Н), 3,04-3,20 (m, 1H), 3,84-3,97 (br, 1H), 4,16-4,35 (br, 1H), 4,37-4,50 (br, 1H), 5,00 (S, 1Н), 5,34 (S, 1H), 5,97 (d, J = 11,7 Гц, 1H), 6,35 (d, J = 11,7 Гц, 1H).
Масс-спектр m/z: 450 (M+), 69 (100%).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 80.
20(R)-(3-Гидрокси-3-метилбутилтио)-1α,3β,16α- тригидрокси-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 77 (облучение 2,0 мин), соединение, полученное в примере 67 (8,6 мг, 19,1 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 6:1, проявляли 5 раз) и получали указанное в заголовке соединение в виде бесцветного масла (1,3 мг, 15%).
ИК-спектр (чистый): 3400, 2950, 1460, 1380, 1200, 1060 см-1.
Спектр 1H ЯМР δ: 0,76 (S, 3Н), 1,26 (S, 6Н), 1,44 (d, J = 6,6 Гц, 3Н), 2,70 (t, J = 8,1 Гц, 2Н), 3,00-3,16 (m, 1H), 4,18- 4,31 (br, 1H), 4,37-4,51 (br, 2Н), 5,00 (S, 1H), 5,31 (S, 1H), 6,07 (d, J = 11,2 Гц, 1H), 6,36 (d, J = 11,2 Гц, 1H).
Масс-спектр m/z: 450 (М+), 69 (100%).
УФ-спектр λmax нм: 262, λmin нм: 227.
Пример 81.
20(S)-4-Этил-4-гидроксигексилтио)-1α,3β,16β- тригидрокси-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 77 (облучение 2,5 мин), соединение, полученное в примере 68 (21,3 мг, 43,2 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 10:1, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (3,9 мг, 18%).
ИК-спектр (чистый): 3400, 2930, 1450, 1380, 1050 см-1.
Спектр 1H ЯМР δ: 0,67-0,90 (m, 9Н), 3,03-3,19 (m, 2H), 4,16-4,28 (br, 1H), 4,34-4,50 (br, 2Н), 5,01 (S, 1H), 5,33 (S, 1H), 6,02 (d, J = 11,2 Гц, 1H), 6,37 (d, J = 11,2 Гц, 1H).
Масс-спектр m/z: 492 (М+), 69 (100%).
УФ-спектр λmax нм: 262, λmin нм: 227.
Пример 82.
20(S)-(4-Этил-4-гидроксигексилтио)-1α,3β,16α- тригидрокси-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 77 (облучение 1,75 мин), соединение, полученное в примере 69 (6,3 мг, 12,7 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 10:1, проявляли 5 раз) и получали указанное в заголовке соединение в виде бесцветного масла (1,3 мг, 21%).
ИК-спектр (чистый): 3400, 2930, 1460, 1380, 1050 см-1.
Спектр 1H ЯМР δ: 0,64 (S, 3Н), 0,86 (t, J = 7,3 Гц, 6Н), 2,79-2,96 (m, 1Н), 4,07-4,30 (m, 2Н), 4,39-4,50 (br, 1H), 4,99 (S, 1H), 5,33 (S, 1H), 5,96 (d, J = 11,2 Гц, 1H), 6,37 (d, J = 11,2 Гц, 1H).
Масс-спектр m/z: 492 (М+), 69 (100%).
УФ-спектр λmax нм: 262, λmin нм: 227.
Пример 83.
20(R)-(4-этил-4-гидpoкcигекcилтиo)-1α,3β,16β- тригидрокси-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 77 (облучение 1,75 мин), соединение, полученное в примере 70 (12,1 мг, 24,6 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 10:1, проявляли 3 раза) и получали указанное в заголовке соединение в виде бесцветного масла (1,5 мг, 12%).
ИК-спектр (чистый): 3400, 2930, 1460, 1380, 1050 см-1.
Спектр 1H ЯМР δ: 0,72 (S, 3Н), 0,86 (t, J = 7,3 Гц, 6Н), 3,04-3,20 (m, 1Н), 3,81-3,97 (m, 1Н), 4,26-4,31 (br, 1Н), 4,38-4,50 (br, 1Н), 5,01 (S, 1Н), 5,35 (S, 1Н), 5,97 (d, J = 11,2 Гц, 1Н), 6,36 (d, J = 11,2 Гц, 1Н).
Масс-спектр m/z: 492 (М+), 69 (100%).
УФ-спектр λmax нм: 262, λmin нм: 227.
Пример 84.
20(S)-(4-Гидpoкcи-4-метилпентилтиo)-1α,3β,16β- тригидрокси-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 77 (облучение 2,5 мин), соединение, полученное в примере 71 (22,9 мг, 49,2 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 10:1, проявляли 7 раз) и получали указанное в заголовке соединение в виде бесцветного масла (2,4 мг, 10%).
ИК-спектр (чистый): 3400, 2930, 1450, 1370, 1200, 1050 см-1.
Спектр 1H ЯМР δ: 0,84 (S, 3Н), 1,22 (S, 6Н), 1,46 (d, J = 6,1 Гц, 3Н), 3,00-3,20 (m, 1Н), 4,16-4,29 (br, 1Н), 4,34-4,50 (br, 2Н), 5,01 (S, 1Н), 5,33 (S, 1Н), 6,01 (d, J = 11,2 Гц, 1Н), 6,37 (d, J = 11,2 Гц, 1Н).
Масс-спектр m/z: 464 (М+), 117 (100%).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 85.
20(S)-(4-Гидрокси-4-метилпентилтио)-1α,3β,16α- тригидрокси-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 77 (облучение 1,25 мин), соединение, полученное в примере 72 (5,9 мг, 12,7 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 10:1, проявляли 5 раз) и получали указанное в заголовке соединение в виде бесцветного масла (0,5 мг, 8%).
ИК-спектр (чистый): 3350, 2920, 1450, 1370, 1260, 1050 см-1.
Спектр 1H ЯМР δ: 0,64 (S, 3Н), 1,22 (S, 6Н), 1,45 (d, J = 6,6 Гц, 3Н), 2,79-2,92 (m, 1Н), 4,40-4,34 (br, 2Н), 4,37-4,50 (br, 1Н), 4,99 (S, 1Н), 5,33 (S, 1Н), 5,95 (d, J = 11,2 Гц, 1Н), 6,35 (d, J = 11,2 Гц, 1H).
Масс-спектр m/z: 464 (М+), 117 (100%).
УФ-спектр λmax нм: 262, λmin нм: 227.
Пример 86.
20(R)-(4-Гидрокси-4-метилпентилтио)-1α,3β,16β- тригидрокси-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 77 (облучение 2,25 мин), соединение, полученное в примере 73 (18,3 мг, 39,4 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 10:1, проявляли 5 раз) и получали указанное в заголовке соединение в виде бесцветного масла (1,5 мг, 8%).
ИК-спектр (чистый): 3400, 2920, 1450, 1380, 1260, 1050 см-1.
Спектр 1H ЯМР δ: 0,72 (S, 3Н), 1,22 (S, 6Н), 1,42 (d, J = 6,9 Гц, 3Н), 3,04-3,17 (m, 1H), 3,84-3,97 (m, 1H), 4,19-4,31 (br, 1Н), 4,38-4,50 (br, 1H), 5,01 (S, 1H), 5,34 (S, 1H), 6,00 (d, J = 11,2 Гц, 1H), 6,37 (d, J = 11,2 Гц, 1H).
Масс-спектр m/z: 464 (М+), 117 (100%).
УФ-спектр λmax нм: 262, λmin нм: 227.
Пример 87.
20(S)-(3-Этил-3-гидроксипентилтио)-1α,3β,16β- тригидрокси-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 77 (облучение 2,5 мин), соединение, полученное в примере 74 (23,9 мг, 49,9 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 10:1, проявляли 6 раз) и получали указанное в заголовке соединение в виде бесцветного масла (4,3 мг, 18%).
ИК-спектр (чистый): 3400, 2930, 1450, 1380, 1050 см-1.
Спектр 1H ЯМР δ: 0,84 (S, 3Н), 0,87 (t, J = 7,3 Гц, 6Н), 2,59 (t, J = 8,3 Гц, 2Н), 3,06-3,22 (m, 1H), 4,18-4,31 (br, 1H), 4,34-4,50 (br, 2Н), 5,01 (S, 1H), 5,33 (S, 1H), 6,02 (d, J = 11,2 Гц, 1H), 6,37 (d, J = 11,2 Гц, 1H).
Масс-спектр m/z: 478 (М+), 131 (100%).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 88.
20(S)-(3-Этил-3-гидроксипентилтио)-1α,3β,16α- тригидрокси-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 77 (облучение 1,5 мин), соединение, полученное в примере 75 (6,3 мг, 13,2 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 10:1, проявляли 8 раз) и получали указанное в заголовке соединение в виде бесцветного масла (1,0 мг, 18%).
ИК-спектр (чистый): 3400, 2950, 1450, 1380, 1050 см-1.
Спектр 1H ЯМР δ: 0,64 (S, 3Н), 0,87 (t, J = 7,3 Гц, 6Н), 2,59 (t, J = 7,9 Гц, 2Н), 2,83-2,98 (m, 1H), 4,07-4,31 (m, 2H), 4,39-4,49 (br, 1H), 4,99 (S, 1H), 5,34 (S, 1H), 5,96 (d, J = 11,2 Гц, 1H), 6,37 (d, J = 11,2 Гц, 1H).
Масс-спектр m/z: 478 (М+), 131 (100%).
УФ-спектр λmax нм: 263, λmin нм: 227.
Пример 89.
20(R)-(3-Этил-3-гидроксипентилтио)-1α,3β,16β- тригидрокси-9,10-секопрегна-5,7,10(19)-триен.
Использовали методику примера 77 (облучение 1,75 мин), соединение, полученное в примере 76 (8,5 мг, 17,8 мкмоль), остаток очищали препаративной тонкослойной хроматографией (1 пластинка, дихлорметан:этанол = 10:1, проявляли 8 раз) и получали указанное в заголовке соединение в виде бесцветного масла (1,1 мг, 13%).
ИК-спектр (чистый): 3400, 2920, 1450, 1380, 1140, 1050 см-1.
Спектр 1H ЯМР δ: 0,71 (S, 3Н), 0,87 (t, J = 7,3 Гц, 6Н), 2,65 (t, J = 8,2 Гц, 2Н), 3,08-3,17 (m, 1Н), 3,84-3,97 (m, 1Н), 4,18-4,31 (m, 1Н), 4,40-4,50 (br, 1Н), 5,01 (S, 1Н), 5,34 (S, 1Н), 5,98 (d, J = 11,2 Гц, 1Н), 6,36 (d, J = 11,2 Гц, 1Н).
Масс-спектр m/z : 478 (М+), 131 (100%).
УФ-спектр λmax нм: 262, λmin нм: 227.
Пример испытаний 1.
Эксперимент по ингибированию пролиферации кератиноцитов человека.
1. Кератиноциты человека помещали при концентрации, 2,4•103 клеток на ячейку (0,32 см2) 96-ячеечного планшета, в который предварительно помещали J2-клетки, обработанные рентгеновскими лучами, и затем планшет инкубировали с тестируемым соединением в различных концентрациях в среде KGM/DMEM (1:1) в течение 3 дней при 37oC в атмосфере 5% CO2 и 95% воздуха.
2. Добавляли [3H]-тимидин в количестве, обеспечивающем конечную концентрацию 1 мккюри/мл, и планшет инкубировали еще 3 дня.
3. После двукратного промывания планшета фосфатно-солевым буферным раствором, клетки отделяли при помощи 0,25% трипсина и измеряли количество внедрившегося в ДНК [3H]-тимидина методом Betaplate (Pharmacia). Строили график скорости поглощения тестового соединения при различных концентрациях в сравнении со 100%-ным поглощением [3H]-тимидина в отсутствие тестового соединения. На фиг. 1 и 2 показаны результаты испытаний 1α, 25-дигидроксивитамина D3 и соединения, полученного в примере 88 соответственно.
Пример испытаний 2.
1. Кератиноциты человека помещали в каждую ячейку 96-ячеечного планшета при концентрации 2,2•103 клеток на ячейку (0,32 см2), и затем планшет инкубировали с тестовым соединением в различных концентрациях в среде KGM/DMEM (1:1) в течение 1 дня при 37oC в атмосфере 5% CO2 и 95% воздуха.
2. Добавляли [3H]-тимидин в количестве, обеспечивающем конечную концентрацию 1 мккюри/мл, и планшет инкубировали еще 3 дня.
3. После двукратного промывания планшета фосфатно-солевым буферным раствором, клетки отделяли при помощи 0,25% трипсина и измеряли количество внедрившегося в ДНК[3H]-тимидина методом Betaplate (Pharmacia). Строили график скорости поглощения тестового соединения при различных концентрациях в сравнении со 100%-ным поглощением [3H]-тимидина в отсутствие тестового соединения. На фиг. 3 и 4 и 5 показаны результаты испытаний 1α, 25-дигидроксивитамина D3, соединения, полученного в примере 33, и соединения, полученного в примере 35 соответственно.
На графиках, приведенных на фиг. 1-5, x, xx и xxx обозначают различия вероятностей в 5, 1 и 0,1% соответственно. Как очевидно из фиг. 1-5, соединения данного изобретения проявляют сильное ингибирующее действие на пролиферацию кератиноцитов человека.
Промышленная применимость.
Соединения данного изобретения, производные витамина D3, замещенные атомом серы в 22-положении, обладают сильным ингибирующим действием по отношению к пролиферации кератиноцитов.
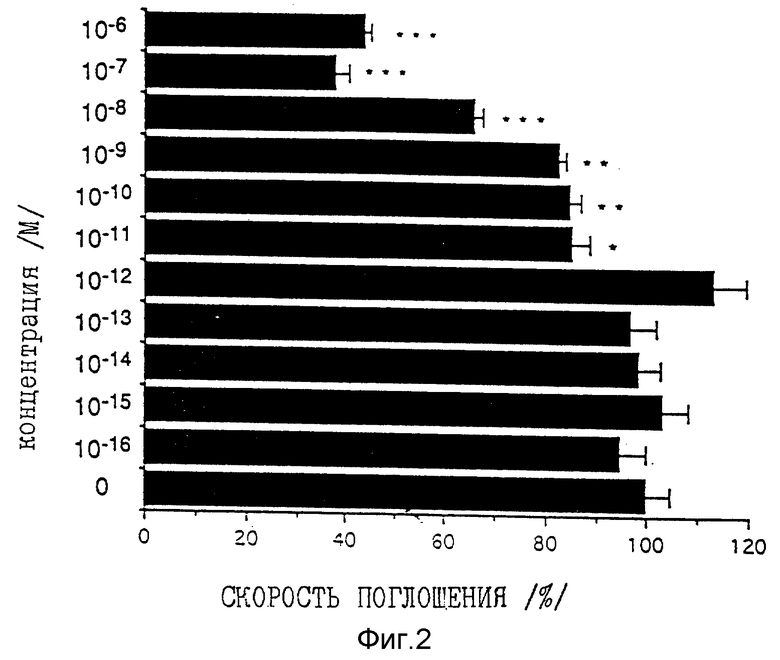
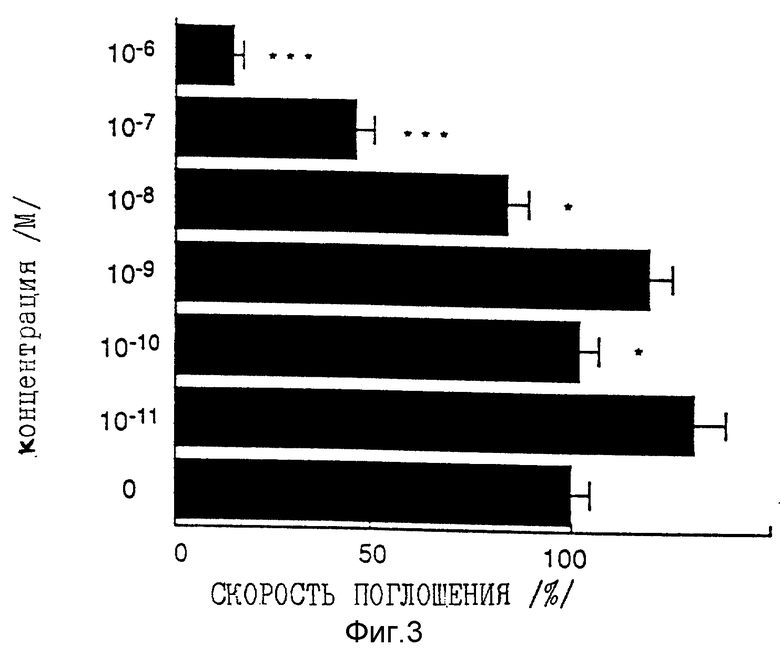
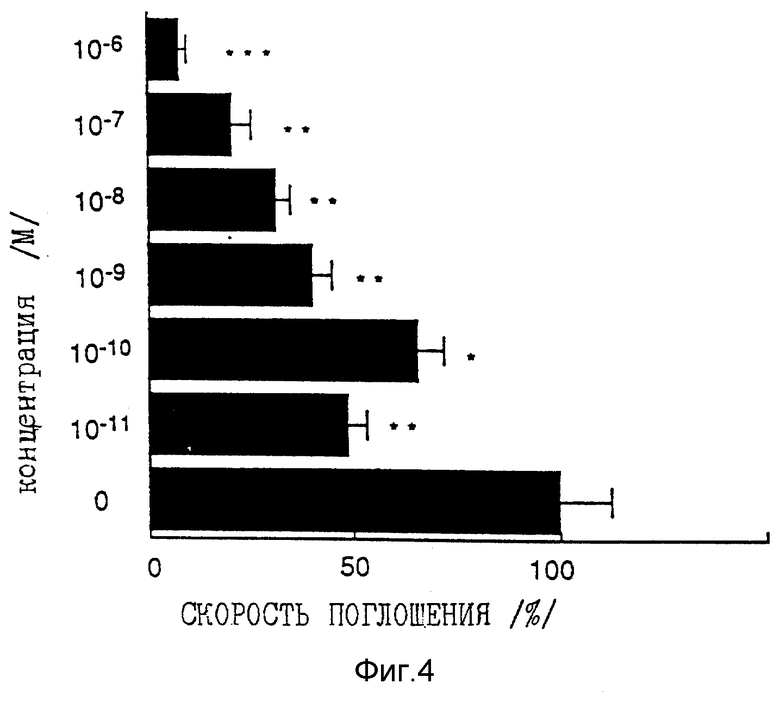
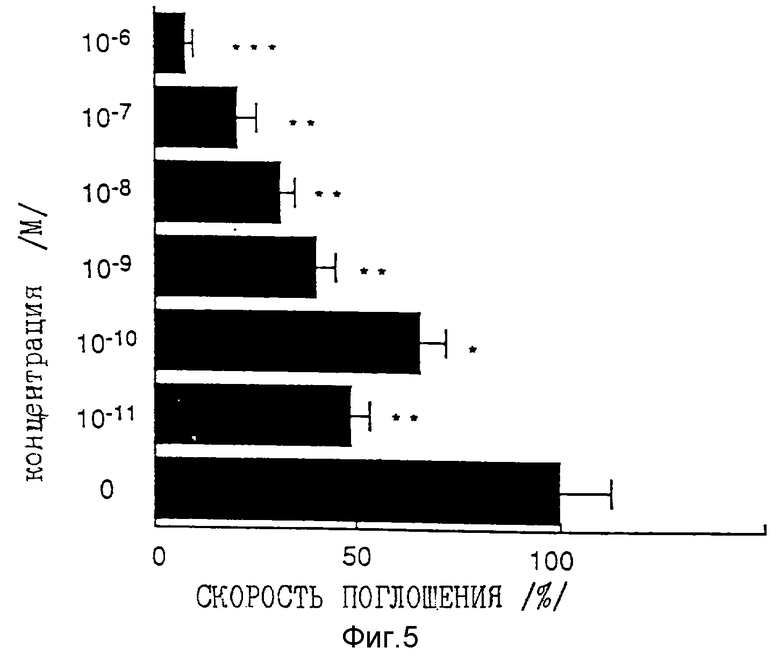
Описываются новые производные 22-тиавитамина D3 общей формулы I,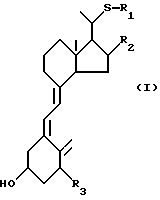
где R1 представляет собой С1-10-алкил, который может быть замещен одной гидроксильной группой, R2 представляет собой атом водорода или гидроксильную группу и R3 представляет собой гидроксильную группу. D-витамины проявляют широкий спектр физиологических активностей. Описываются также промежуточные продукты и синтетические способы получения соединений формулы I и промежуточных продуктов. Соединения данного изобретения, производные витамина D, замещенные атомами серы в 22-положении, обладают сильным ингибирующим действием на пролиферацию кератиноцитов. 7 с. и 29 з.п.ф-лы, 5 ил.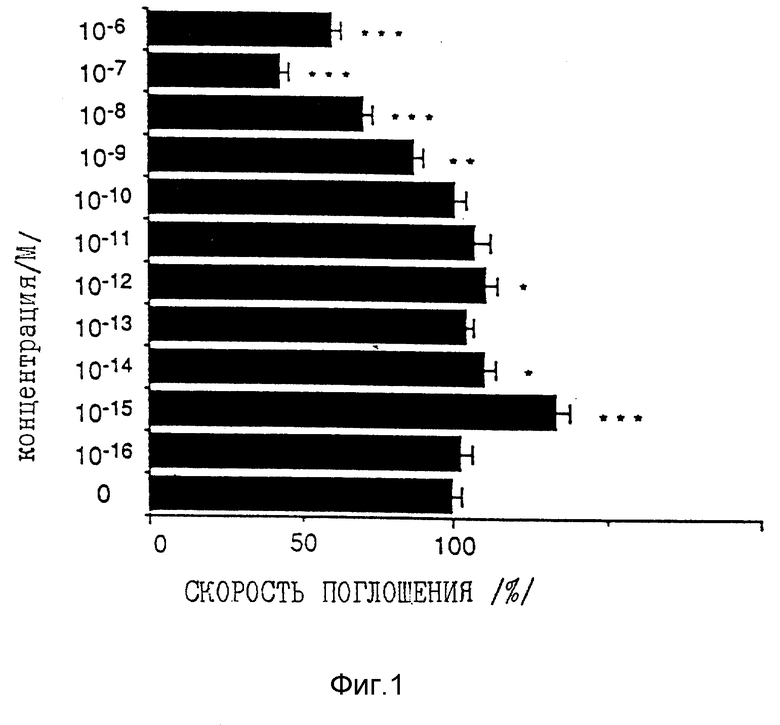
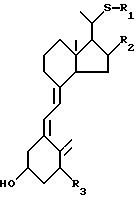
где R1 представляет собой C1-10-алкил, который может быть замещен одной гидроксильной группой;
R2 представляет собой атом водорода или гидроксильную группу;
R3 представляет собой гидроксильную группу.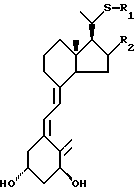
где R1 представляет собой C1-10-алкил, который может быть замещен одной гидроксильной группой;
R2 представляет собой атом водорода или гидроксильную группу.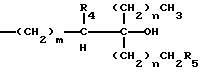
где R4 и R5 каждый представляет собой атом водорода;
m равно целому числу от 1 до 4;
n равно целому числу от 0 до 2.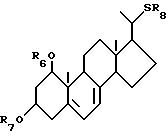
где R6 и R7, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или защитную группу;
R8 представляет собой C1-10-алкил, который может быть замещен гидроксильной группой,
указанный способ включает стадию взаимодействия соединения общей формулы IV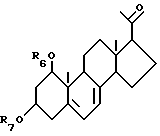
где R6 и R7 определены выше,
с соединением общей формулы V
R8 - SH,
где R8 определен выше,
в восстанавливающих условиях.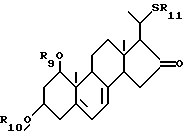
где R9 и R10, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или защитную группу;
R11 представляет собой C1-10-алкил, который может быть замещен,
указанный способ включает стадию взаимодействия соединения общей формулы VII
где R9 и R10 определены выше,
с соединением общей формулы VIII
R11 - SH,
где R11 определен выше,
в основных условиях.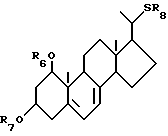
где R6 и R7, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или защитную группу;
R8 представляет собой C1-10-алкил, который может быть замещен гидроксильной группой.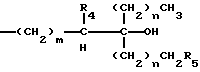
где R4 и R5 каждый представляет атом водорода;
m равно целому числу от 1 до 4;
n равно целому числу от 0 до 2.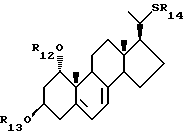
где R12 и R13, которые могут быть одинаковыми или различными, каждый представляет атом водорода или защитную группу;
R14 представляет собой C1-10-алкил, который может быть замещен гидроксильной группой.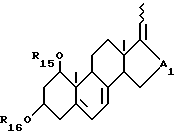
где R15 и R16, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или защитную группу;
A1 представляет собой -CHOH-или -СО-.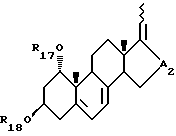
где R17 и R18 которые могут быть одинаковыми или различными, каждый представляет атом водорода или защитную группу;
A2 является -CHOH- или -СО-.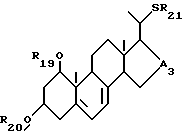
где R19 и R20, которые могут быть одинаковыми или различными, каждый представляет атом водорода или защитную группу;
R21 представляет собой C1-10-алкил, который может быть замещен гидроксильной группой;
A3 является -CHOH- или -СО-.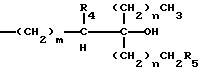
где R4 и R5 каждый представляет собой атом водорода;
n равно целому числу от 1 до 4;
m равно целому числу от 0 до 2.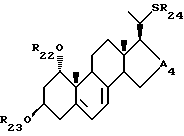
где R22 и R23, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или защитную группу;
R24 представляет собой C1-10-алкил, который может быть замещен гидроксильной группой;
A4 является -CHOH- или -СО-.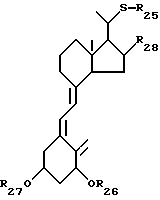
где R25 представляет собой C1-10-алкил, который может быть замещен одной гидроксильной группой;
R26 и R27, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или защитную группу;
R28 представляет собой атом водорода или гидроксильную группу,
указанный процесс включает стадию воздействия светом на соединение общей формулы XV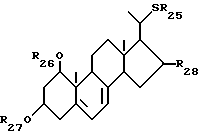
где R25, R26, R27 и R28 определены выше,
и реакцию термической изомеризации.
| Экономайзер | 0 |
|
SU94A1 |
| Мотовило жатки зерноуборочной машины | 1974 |
|
SU489473A1 |
| Тринус Ф.П | |||
| Фармако-терапевтический справочник.-Киев: Здоровья, 1989, с.275. | |||
Авторы
Даты
1999-12-20—Публикация
1995-04-10—Подача