Изобретение относится к области биологии и медицины, в частности к молекулярной иммунологии, и может быть использовано для дифференциальной диагностики урогенитального хламидиоза и неспецифических уретритов.
Наиболее близким способом того же назначения к заявленному изобретению по совокупности признаков является способ определения растворимой формы димера CD38 антигена в сыворотке крови человека с использованием СD38-специфических моноклональных антител (Mallone R., Ferrua S., Morra M. et al. Characterization of a CD38-like 78-kilodalton soluble protein released from В cell lines derived from patients with X-linked agammaglobulinemia // J. Clin. Invest., 1998, Vol.101, №12, P.2821-2830), который принят нами за прототип.
Недостатком способа является то, что он применим лишь для качественной идентификации растворимой формы димера CD38 антигена в сыворотке крови человека и не позволяет определять ее количественно, что и является причиной, препятствующей достижению требуемого технического результата.
Задача изобретения - разработка способа определения растворимой формы димера CD38 антигена в сыворотке крови человека.
Технический результат - количественное определение растворимой формы димера CD38 антигена в сыворотке крови человека.
Указанный технический результат при осуществлении изобретения достигается тем, что в известном способе определения растворимой формы димера CD38 антигена в сыворотке крови человека с использованием CD38-специфических моноклональных антител особенность заключается в том, что в лунки планшета вносят используемые в качестве CD38-специфических моноклональных антител моноклональные антитела ИКО-20 (Барышников А.Ю., Тоневицкий А.Г. Моноклональные антитела, Москва, 1997, 212 с.), разведенные в соотношении 1:1000 0,85% раствором NaCl, в объеме 100 мкл, выдерживают планшет во влажной камере при температуре 18-25°С в течение 18-24 часов, отмывают несвязавшиеся антитела 5-6 раз фосфатно-солевым раствором (ФСР-Т) (рН 7,2-7,6), 25-кратный концентрат которого состоит из 250 г NaCl, 25 г NaHPO4×12H2O, 100 г мочевины, 8 мл тритона Х100 и 25 мл твин-80, растворенных в 1 л дистиллированной воды, вносят 3-4% раствор пептона в объеме 100 мкл, выдерживают планшет во влажной камере при температуре 18-25°С в течение 1-2 часов, отмывают ФСР-Т 5-6 раз, вносят в первый ряд лунок планшета по 100 мкл положительной контрольной сыворотки, разведенной ФСР-Т в следующих соотношениях: цельная сыворотка, 1:1, 1:3, 1:7, 1:15, 1:31, 1:63, 1:127, в 3 лунки вносят ФСР-Т в объеме 100 мкл, в другую лунку вносят анализируемую сыворотку, разведенную ФСР-Т в соотношении 1:1, в объеме 100 мкл, выдерживают планшет во влажной камере при температуре 18-25°С в течение 18-24 часов, отмывают несвязавшиеся компоненты реакции ФСР-Т 5-6 раз, вносят моноклональные антитела ИКО-20, связанные с ферментом - пероксидазой хрена, разведенные ФСР-Т в соотношении 1:600 (при использовании в качестве субстрата ортофенилендиамина) или 1:1200 (при использовании в качестве субстрата тетраметилбензидина), в объеме 100 мкл, выдерживают планшет в течение 1 часа при температуре 36-38°С, отмывают непрореагировавшие компоненты реакции ФСР-Т 5-6 раз, вносят субстратный раствор в объеме 100 мкл, состоящий из 10 мг ортофенилендиамина или 500 мг тетраметилбензидина, растворенных в 10 мл 0,1 М цитратного буферного раствора (рН 4,9-5,1), содержащего 0,05% перекиси водорода и состоящего из 2 г лимонной кислоты, 6 г лимоннокислого натрия трехзамещенного, растворенных в 1 л дистиллированной воды, выдерживают планшет в темном месте при температуре 18-25°С в течение 15-20 мин, вносят 5% раствор серной кислоты в объеме 50 мкл (при использовании ортофенилендиамина) или 100 мкл (при использовании тетраметилбензидина), измеряют оптическую плотность окрашенного продукта пероксидазной активности при длине волны 492 нм (при использовании ортофенилендиамина) или 450 нм (при использовании тетраметилбензидина) и переводят значения оптической плотности в условные единицы с помощью калибровочной кривой, построенной на основании раститровки положительной контрольной сыворотки (Егоров А.М., Осипов А.П., Дзантиев Б.Б., Гаврилова Е.М. Теория и практика иммуноферментного анализа - М.: Высш.шк., 1991, 288 с.).
Проведенный заявителем анализ уровня техники, включающий поиск по патентным и научно-техническим источникам информации и выявление источников, содержащих сведения об аналогах заявленного изобретения позволил установить, что заявитель не обнаружил источник, характеризующийся признаками, идентичными всем существенным признакам заявленного изобретения.
Определение прототипа позволило установить совокупность существенных по отношению к усматриваемому заявителем техническому результату отличительных признаков в заявленном способе, изложенных в формуле изобретения.
Следовательно, заявленное изобретение соответствует условию "новизна".
Для проверки соответствия заявленного изобретения условию "изобретательский уровень" заявитель провел дополнительный поиск известных решений, чтобы выявить признаки, совпадающие с отличительными от прототипа признаками заявленного способа. Результаты поиска показали, что заявленное изобретение не вытекает для специалиста явным образом из известного уровня техники, поскольку из уровня техники, определенного заявителем, не выявлено влияние предусмотренных существенными признаками заявленного изобретения преобразований для достижения технического результата.
Что касается отличительных признаков изобретения, то они известны как иммуноферментный метод анализа, однако использование в нем два раза моноклональных антител ИКО-20 - первый раз в качестве CD38-специфических моноклональных антител и второй раз в виде конъюгата с ферментом, что позволяет количественно определить содержание растворимой формы димера CD38 антигена в сыворотке крови человека, не известно.
Следовательно, заявленное изобретение соответствует условию "изобретательский уровень".
Способ определения растворимой формы димера CD38 антигена в сыворотке крови человека осуществляют следующим образом.
Применяют мышиные моноклональные антитела ИКО-20, продуцируемые гибридомами, полученными в Онкологическом научном центре АМН РФ, г. Москва. Антитела нарабатывают в асцитной форме. Очистку антител сульфатом аммония и риванолом проводят общепринятыми методами (Фримель Г. Иммунологические методы - М.: Медицина, 1987, С.390-413).
Для синтеза конъюгата "Моноклональные антитела ИКО-20-пероксидаза хрена" перйодатным методом применяют CD38-специфические моноклональные антитела ИКО-20. К раствору, содержащему 5 мг пероксидазы хрена (RZ=3,0) в 1 мл Н2О, добавляют 0,2 мл свежеприготовленного 0,02 М раствора перйодата натрия NaIO4 и перемешивают 20 минут при температуре 20°С в темной камере. Полученный раствор диализуют против 0,001 М Na-ацетатного буфера (рН 4,4) в течение 24 часов при температуре 4°С. К раствору добавляют 10 мг антител, растворенных в 2 мл 0,2 М Na-карбонатного буфера (рН 9,6). Раствор перемешивают в течение 2 часов при температуре 20°С в темной камере, добавляют 0,1 мл свежеприготовленного водного раствора NaHB4 (4 мг/мл) и перемешивают два часа при температуре 4°С. Полученный конъюгат осаждают насыщенным раствором (NH4)2SO4 и затем диализуют против физиологического раствора. Для стабилизации конъюгата добавляют равный объем глицерина и хранят при температуре -20°С (Егоров А.М., Осипов А.П., Дзантиев Б.Б., Гаврилова Е.М. Теория и практика иммуноферментного анализа - М.: Высш. шк., 1991, 288 с.).
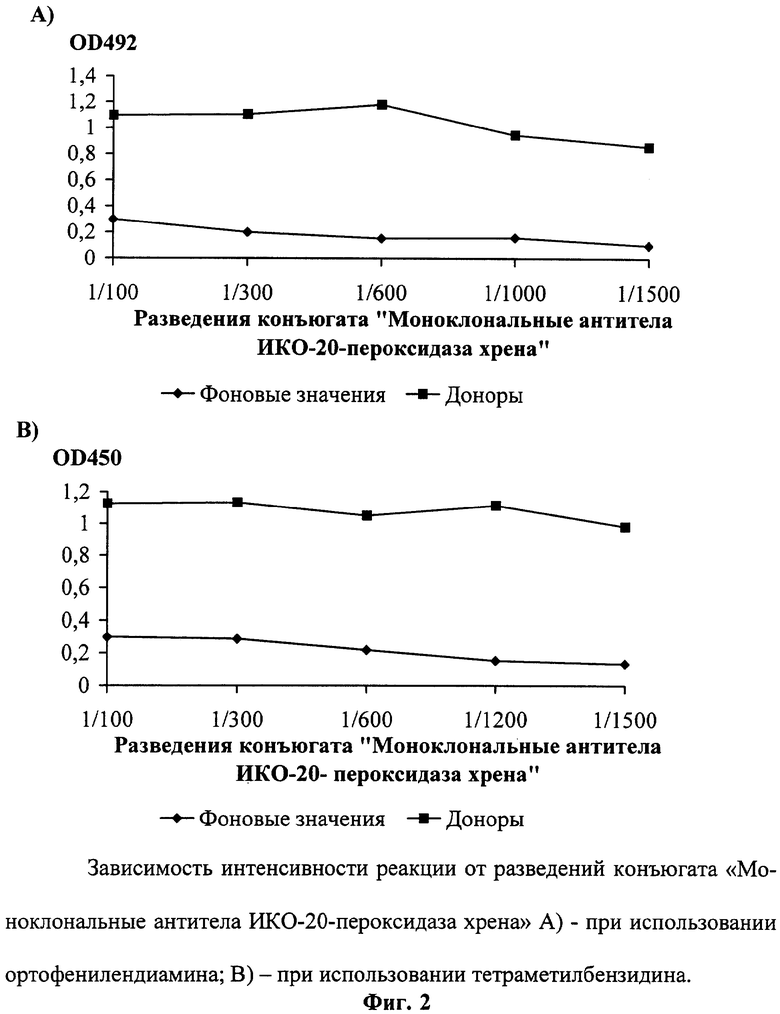
Оптимальную концентрацию моноклональных антител ИКО-20 для внесения в планшет определяют, измеряя оптическую плотность при различных разведениях от 1:200 до 1:1500. Максимальная разница между опытным и фоновым значениями наблюдалась при тысячекратном разведении моноклональных антител ИКО-20 как при использовании ортофенилендиамина в качестве субстрата (фиг.1А), так и при использовании тетраметилбензидина (фиг.1В). Наиболее эффективную концентрацию моноклональных антител ИКО-20, конъюгированных с пероксидазой хрена, также определяют, используя разведения конъюгата от 1:100 до 1:1500. При использовании в качестве субстрата ортофенилендиамина оптимальным явилось разведение конъюгата в 600 раз (фиг.2А). При использовании в качестве субстрата тетраметилбензидина наиболее эффективным оказалось разведение конъюгата 1:1200 (фиг.2В).
Пример 1. В лунки планшета, подвергнутого ультрафиолетовому облучению, вносят очищенные моноклональные антитела ИКО-20, разведенные в соотношении 1:1000 0,85%-раствором NaCl, в объеме 100 мкл.
Планшет выдерживают во влажной камере при температуре 18°С в течение 18 часов. Несвязавшиеся антитела 6 раз отмывают ФСР-Т.
Затем вносят по 100 мкл 3% раствора пептона.
Планшет выдерживают во влажной камере при температуре 18°С в течение 2 часов и отмывают 6 раз ФСР-Т.
В первый ряд лунок планшета вносят по 100 мкл положительной контрольной сыворотки, разведенной ФСР-Т в следующих соотношениях: цельная сыворотка, 1:1, 1:3, 1:7, 1:15, 1:31, 1:63; 1:127.
В 3 лунки вносят по 100 мкл ФСР-Т для контроля фоновых реакций.
В другую лунку вносят 100 мкл анализируемой сыворотки, разведенной ФСР-Т в соотношении 1:1.
Планшет выдерживают во влажной камере при температуре 18°С в течение 18 часов и отмывают 6 раз ФСР-Т.
Затем вносят по 100 мкл раствора конъюгата "Моноклональные антитела ИКО-20-пероксидаза хрена", разведенного ФСР-Т в соотношении 1:1200.
Планшет выдерживают при температуре 37°С в течение 1 часа и отмывают 6 раз ФСР-Т.
Вносят по 100 мкл субстратного раствора, в качестве которого используют раствор тетраметилбензидина, приготовленного непосредственно перед употреблением. Для этого 500 мг тетраметилбензидина растворяют в 10 мл 0,1 М нитратного буферного раствора (рН 4,9-5,1), содержащего 0,05% перекиси водорода.
Планшет выдерживают 15 мин при температуре 18°С в темном месте.
Добавляют по 100 мкл 5% раствора серной кислоты и немедленно определяют оптическую плотность окрашенного продукта при длине волны 450 нм с использованием фотометра АИФ-М/340. Переводят единицы оптической плотности в условные единицы (U/ml) с помощью калибровочной кривой, построенной на основании раститровки положительной контрольной сыворотки. За 1000 U/ml принимают значение оптической плотности, соответствующее рабочему разведению анализируемого образца сыворотки. Содержание растворимой формы димера CD38 антигена в анализируемой сыворотке составило 153 U/ml.
Пример 2. В лунки планшета, подвергнутого ультрафиолетовому облучению, вносят очищенные моноклональные антитела ИКО-20, разведенные в соотношении 1:1000 0,85%-раствором NaCl, в объеме 100 мкл.
Планшет выдерживают во влажной камере при температуре 22°С в течение 21 часа. Несвязавшиеся антитела 6 раз отмывают ФСР-Т.
Затем вносят по 100 мкл 3% раствора пептона.
Планшет выдерживают во влажной камере при температуре 22°С в течение 2 часов и отмывают 6 раз ФСР-Т.
В первый ряд лунок планшета вносят по 100 мкл положительной контрольной сыворотки, разведенной ФСР-Т в следующих соотношениях: цельная сыворотка, 1:1, 1:3, 1:7, 1:15, 1:31, 1:63; 1:127.
В 3 лунки вносят по 100 мкл ФСР-Т для контроля фоновых реакций.
В другую лунку вносят 100 мкл анализируемой сыворотки, разведенной ФСР-Т в соотношении 1:1.
Планшет выдерживают во влажной камере при температуре 22°С в течение 21 часа и отмывают 6 раз ФСР-Т.
Затем вносят по 100 мкл раствора конъюгата "Моноклональные антитела ИКО-20-пероксидаза хрена", разведенного ФСР-Т в соотношении 1:600.
Планшет выдерживают при температуре 37°С в течение 1 часа и отмывают 6 раз ФСР-Т.
Вносят по 100 мкл субстратного раствора, в качестве которого используют раствор ортофенилендиамина, приготовленного непосредственно перед употреблением. Для этого 10 мг ортофенилендиамина растворяют в 10 мл 0,1 М цитратного буферного раствора (рН 4,9-5,1), содержащего 0,05% перекиси водорода.
Планшет выдерживают 15 мин при температуре 22°С в темном месте.
Добавляют по 50 мкл 5% раствора серной кислоты и немедленно определяют оптическую плотность окрашенного продукта при длине волны 492 нм с использованием фотометра АИФ-М/340. Переводят единицы оптической плотности в условные единицы с помощью калибровочной кривой, построенной на основании раститровки положительной контрольной сыворотки. За 1000 U/ml принимают значение оптической плотности, соответствующее рабочему разведению анализируемого образца сыворотки. Содержание растворимой формы димера CD38 антигена в анализируемой сыворотке составило 161 U/ml.
Пример 3. В лунки планшета, подвергнутого ультрафиолетовому облучению, вносят очищенные моноклональные антитела ИКО-20, разведенные в соотношении 1:1000 0,85%-раствором NaCl, в объеме 100 мкл.
Планшет выдерживают во влажной камере при температуре 25°С в течение 24 часов. Несвязавшиеся антитела 6 раз отмывают ФСР-Т.
Затем вносят по 100 мкл 3% раствора пептона.
Планшет выдерживают во влажной камере при температуре 25°С в течение 2 часов и отмывают 6 раз ФСР-Т.
В первый ряд лунок планшета вносят по 100 мкл положительной контрольной сыворотки, разведенной ФСР-Т в следующих соотношениях: цельная сыворотка, 1:1, 1:3, 1:7, 1:15, 1:31, 1:63; 1:127.
В 3 лунки вносят по 100 мкл ФСР-Т для контроля фоновых реакций.
В другую лунку вносят 100 мкл анализируемой сыворотки, разведенной ФСР-Т в соотношении 1:1.
Планшет выдерживают во влажной камере при температуре 25°С в течение 24 часов и отмывают 6 раз ФСР-Т.
Затем вносят по 100 мкл раствора конъюгата "Моноклональные антитела ИКО-20-пероксидаза хрена", разведенного ФСР-Т в соотношении 1:600.
Планшет выдерживают при температуре 37°С в течение 1 часа и отмывают 6 раз ФСР-Т.
Вносят по 100 мкл субстратного раствора, в качестве которого используют раствор ортофенилендиамина, приготовленного непосредственно перед употреблением. Для этого 10 мг ортофенилендиамина растворяют в 10 мл 0,1 М нитратного буферного раствора (рН 4,9-5,1), содержащего 0,05% перекиси водорода.
Планшет выдерживают 15 мин при температуре 25°С в темном месте.
Добавляют по 50 мкл 5% раствора серной кислоты и немедленно определяют оптическую плотность окрашенного продукта при длине волны 492 нм с использованием фотометра АИФ-М/340. Переводят единицы оптической плотности в условные единицы с помощью калибровочной кривой, построенной на основании раститровки положительной контрольной сыворотки. За 1000 U/ml принимают значение оптической плотности, соответствующее рабочему разведению анализируемого образца сыворотки. Содержание растворимой формы димера CD38 антигена в анализируемой сыворотке составило 165 U/ml.
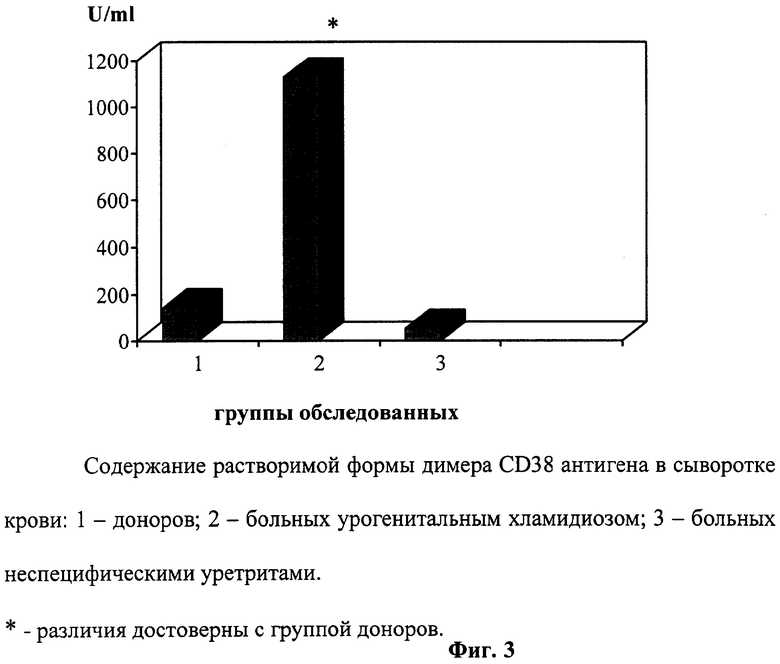
При определении растворимой формы димера CD38 антигена в сыворотке крови 85 здоровых доноров было показано, что ее содержание в норме составляет 142,9±21,6 U/ml (фиг.3). Образцы сыворотки были получены также от 32 пациентов с урогенитальным хламидиозом (диагноз подтвержден в реакции прямой иммунофлуоресценции), 13 больных неспецифическими уретритами. Содержание растворимой формы димера CD38 антигена в группе больных урогенитальным хламидиозом превысило нормальные значения в 8 раз и составило 1129,0±300,2 U/ml (фиг.3). Различия оказались статистически значимы (р<0,001). Индивидуальный анализ данных показал, что при урогенитальном хламидиозе относительное количество больных со значительно повышенным значением растворимой формы димера CD38 антигена составляет 41%. При неспецифических уретритах не обнаружилось достоверно значимых различий в содержании растворимой формы димера CD38 антигена в сыворотке крови, которое составило 50,1±15,9 U/ml (фиг. 3). При этом 100% сывороток имели нормальное или пониженное содержание растворимой формы димера CD38 антигена.
Таким образом, определение растворимой формы димера CD38 антигена правомерно использовать для дифференциальной диагностики урогенитального хламидиоза и неспецифических уретритов в качестве дополнительного вспомогательного теста.
К достоинствам разработанного способа относится возможность количественного определения растворимой формы димера CD38 антигена в сыворотке крови человека.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ РАСТВОРИМОЙ ФОРМЫ ДИМЕРА CD50 АНТИГЕНА В СЫВОРОТКЕ КРОВИ ЧЕЛОВЕКА | 2009 |
|
RU2416800C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АВИДНОСТИ ИММУНОГЛОБУЛИНОВ КЛАССА G К ВИРУСУ ГЕРПЕСА 6 ТИПА | 2015 |
|
RU2596794C1 |
| СПОСОБ ОЦЕНКИ ТЯЖЕСТИ ТЕЧЕНИЯ ПСОРИАЗА | 2003 |
|
RU2242001C1 |
| Способ диагностики риккетсиозов группы клещевой пятнистой лихорадки, иммуноферментная диагностическая тест-система для его осуществления | 2019 |
|
RU2726484C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ MUS MUSCULUS L. EN-4E4 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ПРОТИВ ЭНДОГЛИНА (CD105) ЧЕЛОВЕКА | 2015 |
|
RU2604192C1 |
| Метод непрямого конкурентного иммуноферментного анализа для определения содержания тетродотоксина и его аналогов в экстрактах морских организмов | 2020 |
|
RU2744705C1 |
| ШТАММ ГИБРИДНЫХ КУЛЬТИВИРУЕМЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus L. - EN-4C9 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ ПРОТИВ ЭНДОГЛИНА (CD105) ЧЕЛОВЕКА | 2015 |
|
RU2607029C1 |
| СПОСОБ ДИАГНОСТИКИ ПСЕВДОТУБЕРКУЛЕЗА | 2009 |
|
RU2429480C1 |
| ИММУНОФЕРМЕНТНАЯ ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСА ГЕПАТИТА В И СПОСОБ ОПРЕДЕЛЕНИЯ ПОВЕРХНОСТНОГО АНТИГЕНА ВИРУСНОГО ГЕПАТИТА В | 2006 |
|
RU2325655C9 |
| ТЕСТ-СИСТЕМА ДЛЯ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АНТИ-HBS В БИОЛОГИЧЕСКОМ ОБРАЗЦЕ | 2005 |
|
RU2290642C2 |
Изобретение относится к области биологической химии. Сущность изобретения состоит в том, что разработан способ определения растворимой формы димера CD38 антигена в сыворотке крови человека, включающий использование СD38-специфических моноклональных антител, реакцию проводят на планшете с применением ортофенилендиамина и тетраметилбензидина в качестве субстратов. Технический результат - расширение арсенала способов, предназначенных для определения растворимой формы димера CD38 антигена в сыворотке крови человека. 1 з.п.ф-лы., 3 ил.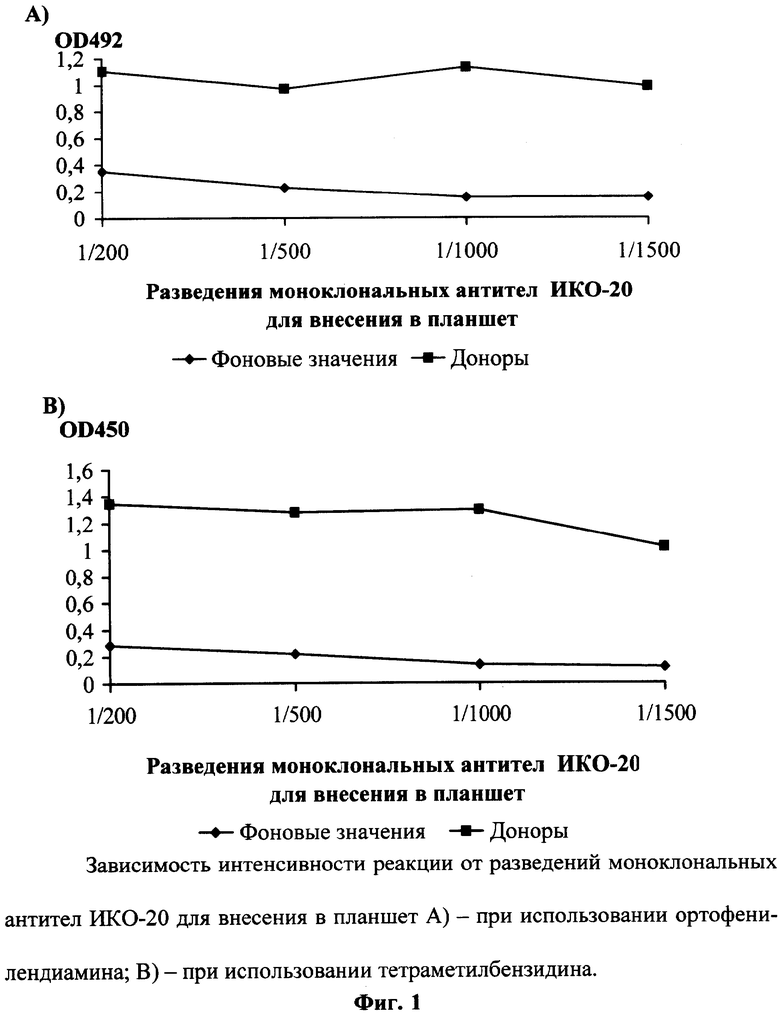
| Mallone R | |||
| et al | |||
| Способ сужения чугунных изделий | 1922 |
|
SU38A1 |
| J.Clin.Invest, 1998, v.101, p.2021-2830 | |||
| М.А.ПАЛЬЦЕВ, А.А.ИВАНОВ | |||
| Межклеточные взаимодействия | |||
| - М., "Медицина", 1995, с.82-103. | |||
Авторы
Даты
2005-09-27—Публикация
2002-12-05—Подача