Изобретение относится к области биохимии, ветеринарии и пищевой промышленности, а именно к лабораторной диагностике, и может быть использовано для определения содержания тетродотоксина (ТТХ) и его аналогов у морских организмов.
В последнее время инвазивные TTX-содержащие виды все чаще обнаруживаются в Европе, Америке и Океании, их распространение в этих регионах приводит к увеличению случаев отравления TTX. Наряду с ТТХ, в биологических объектах часто обнаруживаются его аналоги, имеющие разную токсичность из-за их различного сродства к потенциал-зависимым натриевым каналам (NaV). Большинство исследованных аналогов TTX имеют более низкое сродство к NaV каналам по сравнению с TTX; однако сродство некоторых аналогов TTX сравнимо с ТТХ или превышает его, при этом содержание этих аналогов может превышать содержание TTX в некоторых организмах. Таким образом, аналоги ТТХ могут вносить значительный вклад в общую токсичность организма. Поэтому крайне важно измерять общее содержание ТТХ и его аналогов при мониторинге токсинов в морепродуктах. На сегодняшний день TTX обычно выявляют с использованием биотеста на мышах, жидкостной хроматографии в комбинации с флуоресцентным или масс-спектрометрическим детектированием и газовой хроматографии с масс-спектрометрией. Однако хроматографические методы дороги и трудоемки, а биотесты показывают низкую точность. Наиболее быстрым, простым в использовании и достаточно чувствительным методом обнаружения низкомолекулярных токсинов является иммуноферментный анализ (ИФА). В большинстве методик ИФА, разработанных для определения TTX, используются TTX-специфические моноклональные антитела, что исключает возможность обнаружения аналогов TTX.
Известен метод непрямого конкурентного ИФА для определения содержания ТТХ в экстрактах морских организмов, заключающийся в том, что планшет с поверхностью, покрытой малеимидом, активируют, для этого планшет промывают три раза промывочным буфером, содержащим 0,1 M фосфатно-солевой буфер (ФСБ) и 0,05% Tween 20, pH 7,2, приливают раствор дитиол-карбоксилата в этаноле, инкубируют в течение 3 часов при комнатной температуре, промывают три раза промывочным буфером, приливают раствор N-гидроксисукцинимида, раствор 1-этил-3-(3-диметиламинопропил)карбодиимида, инкубируют в течение 30 минут при комнатной температуре, промывают три раза промывочным буфером, приливают раствор этилендиамина, инкубируют в течение 30 минут при комнатной температуре, промывают три раза промывочным буфером, приливают раствор этаноламина, инкубируют в течение 30 минут при комнатной температуре, промывают три раза промывочным буфером, приливают раствор ТТХ и 37% формальдегида, инкубируют в течение 15 часов при комнатной температуре и ТТХ и промывают три раза промывочным буфером. После активации в планшет приливают исследуемый экстракт, смешивают с раствором моноклональных антител, инкубируют в течение 30 минут при комнатной температуре, промывают три раза промывочным буфером, планшет инкубируют в блокирующем буфере, содержащем 1% BSA в течение 30 минут при комнатной температуре, промывают три раза промывочным буфером, добавляют конъюгат вторичных антител с пероксидазой хрена, инкубируют в течение 30 минут при комнатной температуре, промывают три раза промывочным буфером, после чего добавляют субстрат – тетраметилбензидин, выдерживают в течение 10 минут при комнатной температуре и измеряют оптическую плотность при длине волны 620 нм (Reverté, L., de la Iglesia, P., del Río, V., Campbell, K., Elliott, C. T., Kawatsu, K., Campàs, M. Detection of Tetrodotoxins in Puffer Fish by a Self-Assembled Monolayer-Based Immunoassay and Comparison with Surface Plasmon Resonance, LC-MS/MS, and Mouse Bioassay // Analytical Chemistry, 2015, v. 87(21), pp. 10839–10847).
К недостаткам метода следует отнести:
- специфичность моноклональных антител исключительно к ТТХ, а значит, их неспособность связывать аналоги ТТХ, и как следствие, невозможность использования метода для подсчета общей концентрации ТТХ и его аналогов;
- высокая стоимость планшетов с поверхностью, покрытой малеимидом;
- длительный многостадийный процесс активации планшета.
Известен метод ИФА для определения содержания токсинов в экстрактах токсичных организмов, заключающийся в том, что планшет сенсибилизируют раствором поликлональных антител к ТТХ, полученных иммунизацией кроликов конъюгатом гемоцианина лимфы улитки с ТТХ (KLH-TTX) и выделенных с помощью аффинной хроматографии на сорбенте EAH-Sepharose 4B, ковалентно связанным с TTX, инкубацией при температуре 5°С в течение ночи, промывают ФСБ, приливают блокирующий раствор, содержащий 4% реагента Block Ace, инкубируют при температуре 5°С в течение ночи и промывают дважды промывочным буфером, содержащим ФСБ и 0,05% Tween 20. После этого добавляют исследуемый экстракт и конъюгат биотин-ТТХ, инкубируют при температуре 37°С в течение 15 минут, промывают промывочным буфером и добавляют конъюгат стрептавидина с пероксидазой хрена, инкубируют при температуре 37°С в течение 15 минут, промывают три раза промывочным буфером. После этого добавляют субстрат – ортофениендиамин, выдерживают при температуре 37°С в течение 5 минут, останавливают реакцию добавлением 2 М раствора соляной кислоты и измеряют оптическую плотность при 490 нм (Sato S., Takaishi S., Yasumoto K., & Watabe S. Novel Polyclonal Antibody Raised against Tetrodotoxin Using Its Haptenic Antigen Prepared from 4,9-anhydrotetrodotoxin Reacted with 1,2-Ethaneditiol and Further Reacted with Keyhole Limpet Hemocyanin // Toxins, 2019, v. 11(10), p. 551.).
К недостаткам метода следует отнести:
- Длительность анализа – на проведение требуется около 2 суток;
- Ограниченность определения аналогов тетродотоксина – 4-эпиТТХ, 11-оксоТТХ, 5,6,11-тридеоксиТТХ;
- Трудоемкий процесс получения конъюгата для иммунизации;
- В состав конъюгата для иммунизации в качестве белка-носителя входит гемоцианин лимфы улитки – животный белок. Антитела, полученные к такому конъюгату, могут иметь перекрестную реакцию с компонентами экстрактов морских организмов.
Наиболее близким техническим решением по количеству существенных признаков является метод непрямого конкурентного ИФА для определения содержания ТТХ в экстрактах морских организмов, заключающийся в том, что планшет сенсибилизируют раствором конъюгата BSA-ТТХ в 0,05 М карбонатном буфере инкубацией при температуре 4°С в течение ночи, промывают три раза промывочным буфером, содержащим 0,01 M ФСБ и 0,05% Tween 20, pH 7,2–7,4, после чего планшет инкубируют в блокирующем буфере, содержащим 1% BSA (0.01 M ФСБ, pH 7,2–7,4 при комнатной температуре в течение 2 часов, промывают три раза промывочным буфером. В планшете исследуемый экстракт смешивают с раствором моноклональных антител, инкубируют при температуре 37°С в течение 1,5 часов, промывают три раза промывочным буфером. Добавляют конъюгат вторичных антител с пероксидазой хрена, инкубируют при температуре 37°С в течение 1 часа, промывают пять раз промывочным буфером. После чего добавляют субстрат - тетраметилбензидин, выдерживают при температуре 37°С в течение 15 минут, останавливают реакцию добавлением 2 н раствора серной кислоты и измеряют оптическую плотность при длине волны 450 нм (Tao, J., Wei, W. J., Nan, L., Lei, L. H., Hui, H. C., Fen, G. X., Rong, J. Development of competitive indirect ELISA for the detection of tetrodotoxin and a survey of the distribution of tetrodotoxin in the tissues of wild puffer fish in the waters of south-east China // Food Additives & Contaminants: Part A, 2010, v. 27(11), pp.1589–1597).
К недостаткам метода следует отнести:
- специфичность моноклональных антител исключительно к ТТХ, а значит, их неспособность связывать аналоги ТТХ, и как следствие, невозможность использования метода для подсчета общей концентрации ТТХ и его аналогов;
- высокую стоимость субстрата – тетраметилбензидина;
- длительность процесса, поскольку для проведения анализа требуется около суток.
Технической проблемой, поставленной перед изобретением, является сокращение длительности анализа содержания ТТХ с одновременным расширением ассортимента выявляемых аналогов, упрощение процесса подготовки конъюгата для иммунизации, исключение перекрестной реакции между получаемыми антителами и компонентами исследуемых экстрактов.
Поставленная техническая проблема решается тем, что в известном методе непрямого конкурентного иммуноферментного анализа для определения содержания токсинов в экстрактах морских организмов, включающем сенсибилизацию планшета инкубацией с раствором конъюгата бычьего сывороточного альбумина с ТТХ (BSA-ТТХ), промывку сенсибилизированного планшета буферным раствором, инкубацию в блокирующем буфере, промывку планшета от блокирующего буфера промывочным буфером, внесение в лунки планшета экстрактов морских организмов и раствора специфических антител с последующей инкубацией планшета, промывку планшета промывочным буфером, добавление конъюгата вторичных антител с пероксидазой хрена, инкубацию с последующей промывкой промывочным буфером, добавление субстрата, выдержку при температуре 37°С в течение 15 минут, остановку реакции добавлением раствора серной кислоты и измерение оптической плотности, согласно изобретению, в качестве специфических антител используют поликлональные антитела, которые получают иммунизацией мышей конъюгатом фитогемагглютинина с ТТХ (PHA-ТТХ) и выделяют с помощью аффинной хроматографии на сорбенте Affigel-10, ковалентно связанным с ТТХ; в качестве субстрата берут ортофениленамин, а измерение оптической плотности ведут при длине волны 492 нм.
Использование поликлональных антител, полученных иммунизацией мышей конъюгатом PHA-ТТХ и выделенных с помощью аффинной хроматографии на сорбенте Affigel-10, ковалентно связанным с TTX, позволяет расширить спектр выявляемых токсинов в экстрактах морских организмов, и обеспечивает выявление ТТХ и его пяти аналогов – 4-эпиТТХ, 4,9-ангидроТТХ, 5-дезоксиТТХ, 11-дезоксиТТХ и 5,6,11-тридеоксиTTX. Вследствие того, что в состав конъюгата для иммунизации в качестве белка-носителя входит растительный белок – PHA, исключается перекрестная реакция полученных антител с компонентами исследуемых экстрактов.
Использование в качестве субстрата более дешевого ортофенилендиамина вместо дорогостоящего тетраметилбензидина, применяемого в прототипе, позволяет уменьшить стоимость проведения анализов.
Разработанный метод позволяет определять токсины, содержащиеся в морских организмах, в частности в немертинах, полихетах, крабах, осьминогах.
В качестве блокирующего буфера используют буфер ТБС-Тритон-X-100, содержащий 0,05 М Трис-HCl, 0,15 М NaCl, 0,005% Тритон Х-100, 1 мг/мл обезжиренного молока рН 7,4.
Для сокращения времени проведения анализа инкубацию для сенсибилизации планшета, инкубацию в блокирующем буфере, инкубацию планшета с раствором специфических антител и инкубацию с конъюгатом вторичных антител с пероксидазой хрена ведут при температуре 20-37°С в течение 30-100 минут. Сокращение времени инкубации для сенсибилизации планшета и инкубации в блокирующем буфере не ведет к снижению чувствительности, при этом, позволяет ускорить процесс получения результата.
Проведение вышеуказанных инкубаций в заявленных параметрах обеспечивает оптимальные условия как для подготовки самих планшетов, так и для проведения последующего анализа что в итоге позволяет получить достоверные данные по содержанию ТТХ и его аналогов в экстрактах морских организмов. Понижение температуры инкубации при сенсибилизации планшета ведет к увеличению времени инкубации, в результате чего возрастает общее время проведения анализа. Повышение температуры выше 37°С не дает увеличения степени сенсибилизации планшета. Кроме того, инкубация планшета с поликлонольными антителами и со вторичными антителами, конъюгированными с пероксидазой хрена, при температуре ниже 20°С ведет к увеличению общего времени проведения образца, повышение температуры выше 37 °С может вести к изменению сродства компонентов комплекса антиген-антитело, что может повлиять на точность определения содержания токсинов. Инкубация в течение 30-100 минут обеспечивает достаточное связывание антител с антигеном.
Промывку промывочным буфером после инкубации с раствором конъюгата BSA-ТТХ, инкубации в блокирующем буфере, инкубации планшета с раствором специфических антител и инкубации с конъюгатом вторичных антител с пероксидазой хрена проводят не более четырех раз. Это обеспечивает удаление несвязавшихся компонентов из системы, одновременно с этим не понижая долю связавшихся молекул, что позволяет повысить точность определения количественного содержания токсинов в морских организмах.
Сенсибилизацию планшета проводят раствором конъюгата BSA-ТТХ в 0,05 М карбонатном буфере, содержащем 0,15 М NaCl, рН 9,5, что обеспечивает лучшую растворимость конъюгата, и, как следствие, более однородное покрытие поверхности лунок планшета слоем конъюгата.
Для осуществления способа предварительно готовили по известным методикам с некоторыми изменениями. Коммерческий цитрат ТТХ (Alomone Labs, Израиль) использовали для приготовления антигена по методике Wang et al. (Wang, R., Huang, A., Liu, L., Xiang, S., Li, X., Ling, S., Wang, S. Construction of a single chain variable fragment antibody (scFv) against tetrodotoxin (TTX) and its interaction with TTX // Toxicon, 2014, v. 83, pp. 22–34.) с некоторыми изменениями. Вкратце, 0,2 мл раствора цитрата ТТХ (1 мг/мл) смешивали с 1 мл раствора PHA в 0,01 М ФСБ с 0,15 М NaCl, pH 6,0 (2 мг/мл) и 0,21 мл 8% формалина в ФСБ, рН 7,8. Смесь инкубировали при постоянном перемешивании при 37°С в течение 72 часов. Полученный конъюгат очищали от остатка несвязанного ТТХ и формалина с помощью диализа с отсечением по молекулярной массе 10 кДа четырьмя сменами 50 мл ФСБ, рН 7,2. Конъюгат разбавляли с использованием ФСБ, рН 6,0 до конечной концентрации 0,5 мг/мл, хранили при -20°С до дальнейшего использования.
Десять самцов мышей BALB/c использовали для иммунизации. Для первой иммунизации раствор конъюгата смешивали с полным адъювантом Фрейнда (Sigma, США) в соотношении 1:1. Аликвоту суспензии объемом 0,2 мл вводили в мышцу бедра задней ноги животного. Через месяц после первой иммунизации мышам вводили суспензию конъюгата с неполным адъювантом Фрейнда (Sigma, США) в соотношении 1:1. Три недели спустя была проведена третья иммунизация путем инъекции антигена без адъюванта внутрибрюшинно. Инъекции повторяли каждую четную неделю. Кровь объемом 0,2 мл отбирали от каждой мыши из хвостовой вены каждую нечетную неделю. В качестве антикоагулянта добавляли 50 мкл раствора гепарина (5000 ед/мл). Сыворотку отделяли центрифугированием (1000×g, 10 мин, 4°С), объединяли, разбавляли глицерином в соотношении 1:1 и хранили при -20°С до дальнейшего использования. Для выделения ТТХ-специфических иммуноглобулинов использовали колонку с ТТХ, ковалентно связанным с сорбентом Affigel-10 (Bio-Rad, США). Сорбент был синтезирован в соответствии с протоколом Takati et al. (Takati, N., Mountassif, D., Taleb, H., Lee, K., Blaghen, M. Purification and partial characterization of paralytic shellfish poison-binding protein from Acanthocardia tuberculatum // Toxicon, 2007, v. 50(3), pp. 311–321) с некоторыми изменениями. Вкратце, 5 мл Affigel-10 в изопропаноле обрабатывали 50 мкл этилендиамина и 250 мкл диметилформамида при 20 °C в течение 30 минут. Затем его промывали 50 мМ фосфатным буфером (ФБ, pH 7,4), добавляли 5% глутаральдегид (Sigma, США) и смесь инкубировали при 20 °C в течение 30 минут. Сорбент промывали ФБ, добавляли 20 мкг цитрата ТТХ и инкубировали при 20 °С в течение 4 часов. Несвязанный токсин вымывали с помощью ФБ. Затем сорбент инкубировали в 5 мл ФБ с 0,1 М NaBH4 при 20 °C в течение 2 часов. Сыворотку наносили на колонку, промывали 0,05 М Трис-HCl с 0,15 М NaCl, рН 7,5. Антитела, связанные с ТТХ, элюировали, используя глициновый буфер, содержащий 0,15 М NaCl, рН 3,0, с последующим элюированием глициновым буфером, содержащим 0,15 М NaCl, рН 2,2. Для предотвращения необратимой денатурации иммуноглобулинов рН элюатов доводили до 7,5 с использованием 1,5 М Трис-HCl, рН 7,5. Антитела концентрировали, используя центриконы Vivaspin с отсечением по молекулярной массе 30 кДа (Sartorius, Германия), смешивали с глицерином в соотношении 1:1 до конечной концентрации 0,5 мг/мл и хранили при -20°С до дальнейшего использования.
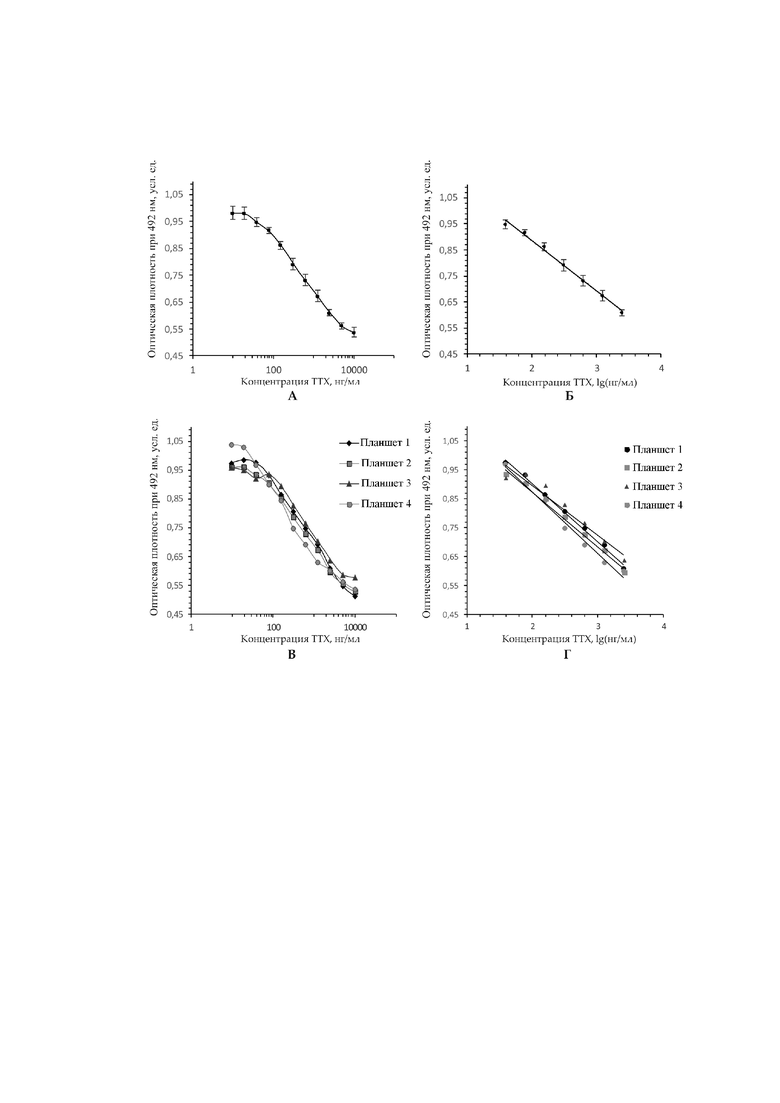
Для конкурентного ИФА 96-луночный планшет (Nunc Maxisorp, Thermo Fisher Scientific, США) сенсибилизировали конъюгатом BSA-ТТХ в 0,1 М карбонатном буфере, содержащем 0,15 М NaCl, рН 9,5. Конъюгат BSA-TTX получали по той же методике, что и для конъюгата PHA-TTX (см. выше). 100 мкл конъюгата BSA-TTX (4 мкг/мл) добавляли в каждую лунку и инкубировали при 20-37°С в течение 30-100 минут. Затем его промывали четырьмя сменами буфера ТБС-Тритон-X-100, содержащего 0,05 М Трис-HCl, 0,15 М NaCl и 0,005% Тритон Х-100, рН 7,4. После этого в каждую лунку добавляли 120 мкл блокирующего раствора, содержащего 1 мг/мл обезжиренного молока в буфере ТБС-Тритон-X-100, планшет инкубировали при 20-37°C в течение 30-100 минут и промывали четыре раза буфером ТБС-Тритон-Х-100. 50 мкл тестового экстракта или калибровочного раствора ТТХ добавляли в первую лунку в каждом ряду, и каждый ряд (за исключением последней лунки) заполняли двукратными серийными разведениями соответствующих растворов. После этого в каждую лунку добавляли 50 мкл раствора поликлональных антител к ТТХ (разведение 1:150) в буфере ТБС-Тритон-X-100. В последние лунки планшета добавляли раствор антител без ТТХ в качестве положительного контроля. Планшет инкубировали при 20-37°С в течение 30-100 минут. Затем его промывали четыре раза буфером ТБС-Тритон-X-100; 100 мкл козьих анти-мышиных антител, конъюгированных с пероксидазой хрена (Thermo Fisher Scientific, США) в растворе ТБС-Тритон-X-100 (разведение 1:1600) добавляли в каждую лунку и инкубировали при 20-37°C в течение 30-100 минут. Планшет отмывали, как указано выше. Затем в каждую лунку добавляли 100 мкл раствора ортофениленамина в 0,1 М фосфат-цитратном буфере, рН 5,0 и инкубировали в течение 15 минут. После этого в каждую лунку добавляли 50 мкл 5% H2SO4, чтобы остановить реакцию. Поглощение образцов измеряли при 492 нм с использованием планшетного ридера ELx800uv (Bio-Tek Instruments Inc., США). Содержание ТТХ во всех лунках было рассчитано с использованием калибровочной кривой (рис. 1 Б).
Были рассчитаны пределы обнаружения (LoD), пределы количественного определения (LoQ), рабочий диапазон, среднее значение, стандартное отклонение (S.D.), извлечение и коэффициент вариации (CV) метода ИФА. LoD и LoQ были рассчитаны с использованием метода международной конференции по гармонизации (Shrivastava, A., Gupta, V. Methods for the determination of limit of detection and limit of quantitation of the analytical methods // Chronicles of Young Scientists, 2011, v. 2(1), p. 21) следующим образом: LoD = 3,3×S.D./s, LoQ = 10×S.D./s, где s - наклон стандартной кривой. Все статистические процедуры, включая вычисление среднего значения, S.D. и CV, выполнялись с использованием пакета инструментов анализа Microsoft Excel 2010 (Microsoft Corp, Редмонд, Вашингтон, США). Степень извлечения рассчитывали на основе анализа экстрактов ТТХ-несодержащих немертин вида Cerebratulus marginatus, с внесенным TTX концентрацией 70, 200, 350, 1000 нг/мл. LoD и LoQ составиляли 25,54 и 77,34 нг/мл соответственно. Рабочий диапазон составлял 25,54–2500 нг/мл (рис. 1А, Б). В линейном диапазоне средний внутрипланшетный CV для повторов составлял 2,02–4,67% (фиг. 1B), в то время как средний межпланшетный CV составлял 5,66% (Фиг. 1C, D). Извлечение метода составило 101,6% для 1000 нг/мл и 70% для диапазона 70–350 нг/мл. CV для данных, полученных с помощью ИФА и высокоэффективной жидкостной хроматографией-тандемной масс-спектрометрией (ВЭЖХ-МС/МС), составил 14,64%. Таким образом, данные, полученные с помощью ВЭЖХ-МС/МС и ИФА, согласуются, и предлагаемая модификация ИФА является воспроизводимым, чувствительным и точным методом измерения общего содержания ТТХ. Константу ассоциации Ka взаимодействия антиген-антитело определяли по методике линеаризации (Orosz, F., Ovádi, J. A simple method for the determination of dissociation constants by displacement ELISA // Journal of Immunological Methods, 2002, v. 270(2), pp. 155–162, ее значение составляло 6*108 М-1.
Предварительно для определения количественного и качественного содержания ТТХ и его аналогов строили калибровочную кривую с использованием калибровочных растворов.
Изобретение иллюстрируется фигурой 1, где:
на фигуре 1А представлена стандартная кривая метода ИФА для количественного определения общей концентрации ТТХ и его аналогов;
на фиг.1Б – представлена линейная часть стандартной кривой. Число повторных измерений для каждой концентрации (n) равно 8. Кривая хорошо соответствует экспериментальным данным (R² = 0,994, y = -0,1938x + 1,2743);
на фиг. 1В – приведены стандартные кривые для четырех повторов ИФА на разных планшетах;
на фиг. 1Г – приведена линейная часть стандартных кривых для четырех ИФА, проведенных на разных планшетах.
Пример 1
Экстракт немертин вида Cephalothrix simula готовили, как описано ранее (Vlasenko, A.E., Velansky, P. V., Chernyshev, A. V., Kuznetsov, V.G., Magarlamov, T.Y. Tetrodotoxin and its analogues profile in nemertean species from the sea of Japan // Toxicon, 2018, v. 156, pp. 48–51.), используя образцы ткани по 100 мг. рН доводили до ~ 7,5 с помощью 0,5 М Трис-HCl, 1,5 М NaCl, рН 7,5. Конечные экстракты хранили при -20°С до дальнейшего использования.
Для конкурентного ИФА 96-луночный планшет (Nunc Maxisorp, Thermo Fisher Scientific, США) сенсибилизировали конъюгатом BSA-ТТХ в 0,1 М карбонатном буфере, содержащем 0,15 М NaCl, рН 9,5. 100 мкл конъюгата BSA-TTX (4 мкг/мл) добавляли в каждую лунку и инкубировали при 37°С в течение 30 минут. Затем его промывали четырьмя сменами буфера ТБС-Тритон-X-100, содержащего 0,05 М Трис-HCl, 0,15 М NaCl и 0,005% Тритон Х-100, рН 7,4. После этого в каждую лунку добавляли 120 мкл блокирующего раствора, содержащего 1 мг/мл обезжиренного молока в ТБС-Тритон-X-100, и планшет инкубировали при 37°C в течение 30 минут и промывали буфером ТБС-Тритон-X-100. 50 мкл тестового экстракта или калибровочного раствора ТТХ добавляли в первую лунку в каждом ряду, и каждый ряд (за исключением последней лунки) заполняли двукратными серийными разведениями соответствующих растворов. После этого в каждую лунку добавляли 50 мкл раствора поликлональных антител к ТТХ (разведение 1:150) в буфере ТБС-Тритон-X-100. В последние лунки планшета добавляли раствор антител без ТТХ в качестве положительного контроля. Планшет инкубировали при 37°С в течение 30 минут. Затем его промывали буфером ТБС-Тритон-X-100; 100 мкл козьих анти-мышиных антител, конъюгированных с пероксидазой хрена (Thermo Fisher Scientific, США) в растворе ТБС-Тритон-X-100 (разведение 1:1600) добавляли в каждую лунку и инкубировали при 37°C в течение 30 минут. Планшет отмывали, как указано выше. Затем в каждую лунку добавляли 100 мкл раствора ортофениленамина в 0,1 М фосфат-цитратном буфере, рН 5,0 и инкубировали в течение 15 минут. После этого в каждую лунку добавляли 50 мкл 5% H2SO4, чтобы остановить реакцию. Поглощение образцов измеряли при 492 нм с использованием планшетного ридера ELx800uv (Bio-Tek Instruments Inc., США). Содержание ТТХ во всех лунках было рассчитано с использованием калибровочной кривой (фиг. 1 Б). Согласно ВЭЖХ-МС/МС, экстракт C.simula содержал 23 616 нг ТТХ и его аналогов (в том числе, 4-эпитТТХ, 4,9-ангидроТТХ, 5-дезоксиТТХ, 11-дезоксиТТХ и 5,6,11-тридеоксиTTX) на 1 г массы тела. Содержание TTX и его аналогов, выявленное методом ИФА, составляло 29 069 ± 4 874 нг/г массы тела.
Пример 2
Экстракт немертин вида Cerebratulus marginatus готовили, как описано ранее (Vlasenko, A.E., Velansky, P. V., Chernyshev, A. V., Kuznetsov, V.G., Magarlamov, T.Y. Tetrodotoxin and its analogues profile in nemertean species from the sea of Japan // Toxicon, 2018, v. 156, pp. 48–51.), используя образцы ткани по 100 мг, добавляли 200 нг ТТХ. рН доводили до ~ 7,5 с помощью 0,5 М Трис-HCl, 1,5 М NaCl, рН 7,5. Конечные экстракты хранили при -20°С до дальнейшего использования.
Для конкурентного ИФА 96-луночный планшет (Nunc Maxisorp, Thermo Fisher Scientific, США) сенсибилизировали конъюгатом BSA-ТТХ в 0,1 М карбонатном буфере, содержащем 0,15 М NaCl, рН 9,5. 100 мкл конъюгата BSA-TTX (4 мкг/мл) добавляли в каждую лунку и инкубировали при 30°С в течение 45 минут. Затем его промывали четырьмя сменами буфера ТБС-Тритон-Х-100, содержащего 0,05 М Трис-HCl, 0,15 М NaCl и 0,005% Тритон Х-100, рН 7,4. После этого в каждую лунку добавляли 120 мкл блокирующего раствора, содержащего 1 мг/мл обезжиренного молока в буфере ТБС-Тритон-Х-100, и планшет инкубировали при 30°С в течение 45 минут и промывали буфером ТБС-Тритон-Х-100. 50 мкл тестового экстракта или калибровочного раствора ТТХ добавляли в первую лунку в каждом ряду, и каждый ряд (за исключением последней лунки) заполняли двукратными серийными разведениями соответствующих растворов. После этого в каждую лунку добавляли 50 мкл раствора поликлональных антител к ТТХ (разведение 1:150) в буфере ТБС-Тритон-Х-100. В последние лунки планшета добавляли раствор антител без ТТХ в качестве положительного контроля. Планшет инкубировали при 30°С в течение 45 минут. Затем его промывали буфером ТБС-Тритон-Х-100; 100 мкл козьих анти-мышиных антител, конъюгированных с пероксидазой хрена (Thermo Fisher Scientific, США) в растворе ТБС-Тритон-Х-100 (разведение 1:1600) добавляли в каждую лунку и инкубировали при 30°С в течение 45 минут. Планшет отмывали, как указано выше. Затем в каждую лунку добавляли 100 мкл раствора ортофениленамина в 0,1 М фосфат-цитратном буфере, рН 5,0 и инкубировали в течение 15 минут. После этого в каждую лунку добавляли 50 мкл 5% H2SO4, чтобы остановить реакцию. Поглощение образцов измеряли при 492 нм с использованием планшетного ридера ELx800uv (Bio-Tek Instruments Inc., США). Содержание ТТХ во всех лунках было рассчитано с использованием калибровочной кривой (фиг. 1 Б) и составило 142 ± 8 нг/мл.
Пример 3
Экстракт полихет Nereis sp. (готовили согласно процедуре, описанной ранее для немертин (Vlasenko, A.E., Velansky, P. V., Chernyshev, A. V., Kuznetsov, V.G., Magarlamov, T.Y. Tetrodotoxin and its analogues profile in nemertean species from the sea of Japan // Toxicon, 2018, v. 156, pp. 48–51.), используя образцы ткани по 100 мг, добавляли 1000 нг ТТХ. рН доводили до ~ 7,5 с помощью 0,5 М Трис-HCl, 1,5 М NaCl, рН 7,5. Конечные экстракты хранили при -20°С до дальнейшего использования.
Для конкурентного ИФА 96-луночный планшет (Nunc Maxisorp, Thermo Fisher Scientific, США) сенсибилизировали конъюгатом BSA-ТТХ в 0,1 М карбонатном буфере, содержащем 0,15 М NaCl, рН 9,5. 100 мкл конъюгата BSA-TTX (4 мкг/мл) добавляли в каждую лунку и инкубировали при 20°С в течение 100 минут. Затем его промывали четырьмя сменами буфера ТБС-Тритон-Х-100, содержащего 0,05 М Трис-HCl, 0,15 М NaCl и 0,005% Тритон Х-100, рН 7,4. После этого в каждую лунку добавляли 120 мкл блокирующего раствора, содержащего 1 мг/мл обезжиренного молока в буфере ТБС-Тритон-Х-100, и планшет инкубировали при 20°С в течение 100 минут и промывали буфером ТБС-Тритон-Х-100. 50 мкл тестового экстракта или калибровочного раствора ТТХ добавляли в первую лунку в каждом ряду, и каждый ряд (за исключением последней лунки) заполняли двукратными серийными разведениями соответствующих растворов. После этого в каждую лунку добавляли 50 мкл раствора поликлональных антител к ТТХ (разведение 1:150) в буфере ТБС-Тритон-Х-100. В последние лунки планшета добавляли раствор антител без ТТХ в качестве положительного контроля. Планшет инкубировали при 20°С в течение 100 минут. Затем его промывали буфером ТБС-Тритон-Х-100; 100 мкл козьих анти-мышиных антител, конъюгированных с пероксидазой хрена (Thermo Fisher Scientific, США) в растворе ТБС-Тритон-Х-100 (разведение 1:1600) добавляли в каждую лунку и инкубировали при 20°С в течение 100 минут. Планшет отмывали, как указано выше. Затем в каждую лунку добавляли 100 мкл раствора ортофениленамина в 0,1 М фосфат-цитратном буфере, рН 5,0 и инкубировали в течение 15 минут. После этого в каждую лунку добавляли 50 мкл 5% H2SO4, чтобы остановить реакцию. Поглощение образцов измеряли при 492 нм с использованием планшетного ридера ELx800uv (Bio-Tek Instruments Inc., США). Содержание ТТХ во всех лунках было рассчитано с использованием калибровочной кривой (рис. 1 Б) и составило 1010± 10 нг/мл.
Приведенные примеры подтверждают, что заявленный метод позволяет определить суммарную концентрацию ТТХ и его аналогов в экстрактах морских организмов, в частности, 4-эпиТТХ, 4,9-ангидроТТХ, 5-дезоксиТТХ, 11-дезоксиТТХ и 5,6,11-тридеоксиTTX, 11-оксоТТХ, 5,6,11-тридеоксиТТХ. Время проведения анализа меньше, чем у прототипа, и составляет 5 часов. Метод исключает возможность перекрестной реакции между получаемыми антителами и компонентами исследуемых экстрактов, что позволяет упростить процедуру подготовки экстрактов и сократить суммарное время проведения анализа и его стоимость.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (РФФИ), грант № 18-04-00808 А.
| название | год | авторы | номер документа |
|---|---|---|---|
| Моноклональное антиидиотипическое антитело АИ-К11В, обладающее антигенными свойствами морфина | 2020 |
|
RU2745374C1 |
| Способ определения содержания продуктов протеолиза MUC1 и диагностическая тест-система для его осуществления | 2016 |
|
RU2676258C2 |
| Способ получения конъюгатов ферментов и антител для иммуноферментного анализа | 1986 |
|
SU1429026A1 |
| Мозаичный рекомбинантный полипептид, содержащий фрагменты белков вируса гепатита Е 1 и 3 генотипов в одной полипептидной цепи, предназначенный для использования в тест-системах, применяемых в серодиагностике гепатита Е | 2020 |
|
RU2754791C1 |
| НАБОР ДЛЯ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АВЕРМЕКТИНОВ МЕТОДОМ ОДНОСТАДИЙНОГО КОНКУРЕНТНОГО ИММУНОФЕРМЕНТНОГО АНАЛИЗА | 2009 |
|
RU2416094C1 |
| Способ дифференциации вирулентных штаммов Listeria monocytogenes от авирулентных штаммов с использованием поликлональных антител против факторов патогенности интерналина А (InlA) и интерналина В (InlB). | 2023 |
|
RU2808590C1 |
| СПОСОБ ДИАГНОСТИКИ ПОЛЛИНОЗА "IN VITRO" В СЛЮНЕ | 2007 |
|
RU2340895C1 |
| ШТАММ ГИБРИДНЫХ КЛЕТОК ЖИВОТНЫХ Mus musculus 3F11 - ПРОДУЦЕНТ МОНОКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ К БОТУЛИНИЧЕСКОМУ ТОКСИНУ ТИПА B | 2014 |
|
RU2566553C1 |
| Способ определения биологических макромолекул на основе ЯМР-релаксометрии | 2020 |
|
RU2743426C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ОДИНОЧНОЙ В-КЛЕТКИ | 2011 |
|
RU2575569C2 |
Изобретение относится к области биохимии, а именно к способу осуществления непрямого конкурентного иммуноферментного анализа для определения содержания в экстрактах морских организмов тетродотоксина (ТТХ), 4-эпиТТХ, 4,9-ангидроТТХ, 5-дезоксиТТХ, 11-дезоксиТТХ и 5,6,11-тридеоксиТТХ, согласно которому сенсибилизируют планшет инкубацией с раствором конъюгата бычьего сывороточного альбумина с ТТХ в карбонатном буфере с последующими промывками и инкубацией в блокирующем буфере, вносят в лунки экстракты морских организмов и раствор поликлональных антител, полученных иммунизацией мышей конъюгатом фитогемагглютинина с ТТХ, с последующими инкубацией и промывкой планшета, добавляют конъюгат вторичных антител с пероксидазой хрена с последующими инкубацией и промывкой, добавляют ортофенилендиамин в качестве субстрата, выдерживают, затем останавливают реакцию и измеряют оптическую плотность при длине волны 492 нм. Технический результат заключается в сокращении длительности анализа содержания тетродотоксина с расширением ассортимента выявляемых аналогов, упрощении процесса подготовки конъюгата для иммунизации, исключении перекрестной реакции между получаемыми антителами и компонентами исследуемых экстрактов. 5 з.п. ф-лы, 3 пр., 1 ил.
1. Способ осуществления непрямого конкурентного иммуноферментного анализа для определения содержания в экстрактах морских организмов токсинов, выбранных из тетродотоксина (ТТХ), 4-эпиТТХ, 4,9-ангидроТТХ, 5-дезоксиТТХ, 11-дезоксиТТХ и 5,6,11-тридеоксиТТХ, согласно которому сенсибилизируют планшет инкубацией с раствором конъюгата бычьего сывороточного альбумина с тетродотоксином (BSA-ТТХ) в 0,05 М карбонатном буфере, промывают сенсибилизированный планшет буферным раствором, инкубируют в блокирующем буфере, промывают планшет от блокирующего буфера промывочным буфером, вносят в лунки планшета экстракты морских организмов и раствор специфических антител с последующей инкубацией планшета, промывают планшет промывочным буфером, добавляют конъюгат вторичных антител с пероксидазой хрена, инкубируют с последующей промывкой промывочным буфером, добавляют субстрат, выдерживают при температуре 37°С в течение 15 минут, останавливают реакцию добавлением раствора серной кислоты и измеряют оптическую плотность, причем в качестве специфических антител используют поликлональные антитела, которые получают иммунизацией мышей конъюгатом фитогемагглютинина с ТТХ (PHA-ТТХ) и выделяют с помощью аффинной хроматографии на сорбенте Affigel-10, ковалентно связанном с ТТХ; в качестве субстрата берут ортофенилендиамин, а измерение оптической плотности ведут при длине волны 492 нм.
2. Способ по п. 1, согласно которому в качестве блокирующего буфера используют буфер, содержащий 0,05 М Трис-HCl, 0,15 М NaCl, 0,005% Тритон Х-100, с добавлением 1 мг/мл обезжиренного молока.
3. Способ по п. 1, согласно которому инкубацию для сенсибилизации планшета, инкубацию в блокирующем буфере, инкубацию планшета с экстрактами морских организмов и раствором специфических антител и инкубацию с конъюгатом вторичных антител с пероксидазой хрена ведут при температуре 20-37°С в течение 30-100 минут.
4. Способ по п. 1, согласно которому в качестве промывочного буфера используют буфер, содержащий 0,05 М Трис-HCl, 0,15 М NaCl с 0,005% Тритон Х-100, рН 7,4.
5. Способ по п. 1, согласно которому промывку лунок планшета промывочным буфером ведут не более четырех раз.
6. Способ по п. 1, согласно которому в 0,05 М карбонатный буфер дополнительно вводят раствор 0,15 М NaCl.
| КУЗНЕЦОВ В | |||
| Г | |||
| Антитела против низкомолекулярных гуанидиновых нейротоксинов как средство детоксикации и аналитической диагностики // Известия Самарского научного центра Российской академии наук | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| - Т | |||
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| - N | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| - С | |||
| Способ получения древесного угля | 1921 |
|
SU313A1 |
| TAO J | |||
| et al | |||
| Development of competitive indirect ELISA for the detection of tetrodotoxin and a survey of the | |||
Авторы
Даты
2021-03-15—Публикация
2020-04-30—Подача