Изобретение относится к медицине, в частности к способам измерения радиоактивности в живых организмах, и может быть использовано для определения реально поглощенной дозы в условиях интраоперационного лучевого воздействия.
Известен способ контроля радиоактивного облучения человека, предназначенный для обнаружения и определения дозы внутреннего облучения человека, а также для контроля при проведении лучевой терапии и заключающийся в том, что регистрируют величину зарядного состояния точки акупунктуры, биоэлектрически связанной с обследуемой частью тела человека, контроль радиоактивного облучения человека осуществляют по величине заряда в этой точке акупунктуры, а для определения абсолютной дозы облучения величину заряда в точке акупунктуры калибруют по внешнему источнику радиоактивного излучения с заданными характеристиками (патент РФ №2112993, публ. 10.06.98. Бюл. №16). Известный способ не может быть использован для определения реально поглощенной внутренними органами дозы в условиях интраоперационного лучевого воздействия.
Известен также способ интраоперационного определения и лечения опухоли при помощи меченых радиоактивных меткой антител, которые накапливаются в опухоли и определяются интраоперационно (US 4932412). Однако в случае использования известного способа не представляется возможным определить величину реально поглощенной внутренними органами дозы в условиях интраоперационного лучевого воздействия.
Заявляемое изобретение направлено на решение задачи адекватного прогноза лечебного результата интраоперационной лучевой терапии (далее - ИОЛТ) и планирования последующего лечения.
Использование в клинической практике заявляемого способа позволяет достичь нескольких технических (лечебных) результатов:
- возможность определения истинного распределения дозы в реальных условиях ИОЛТ,
- возможность определения величины реально поглощенной тканями дозы во всех точках интереса независимо от их месторасположения на раневой поверхности,
- возможность прогноза лечебного результата ИОЛТ,
- возможность экстраполяции данных измерений для последующих сеансов ИОЛТ,
- возможность индивидуального планирования послеоперационного облучения.
Указанные лечебные результаты при осуществлении изобретения достигаются за счет того, что интраоперационную дозиметрию проводят путем определения клинического объема мишени лучевого воздействия, формирования плана лучевого воздействия на основании данных, полученных с использованием тканеэквивалентных фантомов, размещения в точках интереса фрагментов дозиметрического устройства, представляющего собой геометрически правильную матрицу, содержащую термолюминесцентные детекторы (далее - ТЛД), герметично зафиксированные между слоями гибкого биосовместимого материала, протоколирования размещения детекторов, осуществления сеанса ИОЛТ, удаления из операционного поля фрагментов дозиметрического устройства, разгерметизации детекторов, считывания полученной информации, ее протоколирования и анализа.
Сущность изобретения заключается в следующем.
При проведении ИОЛТ прежде всего определяют клинический объем мишени, включающий объем здоровых тканей, прилежащих к визуализируемому объему злокачественной опухоли и подлежащих лучевому воздействию. Для осуществления непосредственно сеанса облучения формируют план лучевого воздействия с использованием стандартных программ планирования облучения, исходными параметрами для которых служат результаты, полученные с помощью абсолютных дозиметров на тканеэквивалентных фантомах. На данном этапе лечения величину поглощенной дозы в заданном клиническом объеме облучения определяют на основании дозиметрических расчетов, произведенных на системах планирования (непрямая дозиметрия). Однако при использовании известных систем планирования лучевого воздействия не представляется возможным определить истинное распределение дозы в реальных условиях сеанса облучения. В то же время информация об указанном истинном распределении дозы необходима при прогнозировании и планировании последующего лечения. А именно:
- прогноза лечебного результата ИОЛТ,
- экстраполяции данных измерений для последующих сеансов интраоперационного облучения,
- индивидуального планирования послеоперационного облучения.
Заявляемый способ интраоперационной дозиметрии позволяет определить абсолютную величину индивидуальной поглощенной дозы, полученной в условиях интраоперационного облучения, с помощью ТЛД. В медицинской практике для осуществления дозиметрического контроля используют различные типы детекторов (полупроводниковые, алмазные, ионизационные камеры и т.д.). Для реализации разработанного способа интраоперационной дозиметрии были выбраны ТЛД по нескольким причинам: малые габариты (размер ТЛД составляет около 5,0 мм в диаметре, толщина около 1,0 мм) надежность при эксплуатации, автономия от источника питания, удобство обработки информации. Последнее преимущество обусловлено свойствами материала, из которого изготовлены ТЛД, накапливать энергию излучения и сохранять информацию об ее количестве на протяжении значительного временного интервала. Это особенно важно при осуществлении прямой дозиметрии в условиях непосредственного лучевого воздействия во время операции. Кроме того, выпускаемые промышленностью ТЛД обеспечивают возможность измерения доз облучения в широком диапазоне радиоактивного излучения малой, средней и высокой энергии и могут быть использованы при различных видах лучевого воздействия.
Способ осуществляют следующим образом.
В дооперационном периоде изготавливают дозиметрическое устройство, представляющее собой геометрически правильную матрицу, содержащую ТЛД, герметично зафиксированные между слоями гибкого биосовместимого материала. Материал для матрицы должен быть достаточно гибким для того, чтобы готовые фрагменты дозиметрического устройства могли быть размещены на раневом пространстве с соблюдением условия плотного контакта с живой тканью без использования дополнительных средств фиксации и в то же время не создающим препятствий для их удаления. Кроме того, указанный материал должен отвечать определенным санитарно-гигиеническим, а также техническим требованиям, а именно:
- не обладать свойством накопления радиоизлучения;
- быть нетоксичным для раневой ткани;
- подлежать холодной стерилизации;
- обладать возможностью произвольного деления на отдельные фрагменты;
В качестве биосовместимого материала с успехом может быть использована полипропиленовая или полиэтиленовая медицинская пленка, которая отвечает всем вышеперечисленным требованиям и, кроме того, позволят достичь высокого уровня герметизации, что обеспечивает целостность детекторов, исключает их прямой контакт с живыми тканями и, следовательно, не искажает данные при считывании. Для изготовления дозиметрического устройства на прямоугольной основе из двух слоев полипропиленовой или полиэтиленовой медицинской пленки (размер определяют индивидуально в каждом конкретном случае) параллельными прямыми рядами размещают детекторы таким образом чтобы расстояние между краями детекторов составляло 10 мм, заготовку укрывают двумя слоями того же материала. С помощью высокотемпературного пресса основу и верхний пласт пленки фиксируют друг с другом таким образом, чтобы каждый из детекторов был изолирован от соседнего детектора полосой фиксации. При этом ширина полосы краевой фиксации матрицы составляет по крайней мере 5 мм. Указанные геометрические параметры размещения детекторов в матрице отвечают условию необходимого и достаточного количества детекторов на единицу площади раневой поверхности для измерения реально поглощенной дозы излучения, а также условию плотной фиксации каждого отдельного детектора внутри ячейки матрицы. Таким образом формируют герметичную матрицу, которая может быть использована в поле облучения любой конфигурации и любой площади и позволяет избежать миграции детекторов по операционной ране и искажения данных. В зависимости от планируемой задачи готовую матрицу делят на фрагменты, содержащие различное количество функциональных единиц - частей матрицы, включающих один детектор. Двойной слой пленки и высокий уровень герметизации позволяют сохранить целостность детекторов и обеспечить возможность стерилизации изготовленной матрицы. Это позволяет произвести измерения дозы облучения непосредственно в условия асептической раны, и в то же время исключает прямой контакт детекторов с живыми тканями.
На этапе предоперационной подготовки осуществляют предварительное моделирование планируемого объема облучения с учетом исходной распространенности опухолевого процесса и планируемого объема оперативного вмешательства. Предварительное планирование сеансов интраоперационного облучения проводят с помощью системы компьютерного дозиметрического планирования «Гаммаплан». При этом в зависимости от конкретной клинической ситуации используют данные распределения поглощенной дозы электронного излучения в гомогенном тканеэквивалентном фантоме.
Во время оперативного вмешательства производят стерилизацию заготовленной матрицы раствором антисептика (1% хлоргексидин) путем погружения ее в раствор на 30 минут.
После осуществления хирургического доступа к планируемому объему облучения (ложе опухоли или непосредственно опухоль) определяют необходимое и достаточное количество детекторов, располагаемых в зоне облучения, а также количество и форму фрагментов матрицы. Подготовленные стерилизованные фрагменты матрицы устанавливают в точках интереса - критические органы (органы и ткани, расположенные в и/или вне поля облучения, нарушение функции которых может привести к угрозе жизни), границы поля облучения, уровни, расположенные максимально поверхностно и максимально глубоко, пространство за границами поля облучения. Схему расположения фрагментов матрицы определяют индивидуально, исходя из конкретной клинической ситуации. Расположение детекторов протоколируют.
Осуществляют сеанс ИОЛТ. По окончании сеанса ИОЛТ герметичные фрагменты матрицы удаляют из операционной раны, промывают раствором антисептика, осушают, разгерметизируют путем вскрытия пленочной основы, выдерживают в течение 24 часов при комнатной температуре и осуществляют считывание информации в аппарате TLD, например, harshaw tdl 3500. На заключительном этапе полученную информацию протоколируют и анализируют. В соответствии с результатами анализа прогнозируют результат произведенной ИОЛТ, планируют оптимальное дозное распределение в заданном объеме в случае использования дополнительного (послеоперационного или повторного интраоперационного) облучения с включением известного объема облучения.
Клинический пример.
Пациент А., после удаления злокачественной опухоли слизистой альвеолярного отростка верхней челюсти, образовался обширный дефект размерами 20×15 см, распространяющийся от срединной линии шеи, до переднего края задней группы мышц шеи, до верхнего края ключицы, до уровня скуловой дуги. Планируемый объем облучения - операционная рана, включающая ствол общей сонной артерии, корень языка, часть щитовидной железы. Таким образом, имеется заданный клинической ситуацией объем облучения неправильной формы с неровными контурами и различными параметрами глубины. Подготовленные стерилизованные фрагменты матрицы были размещены в заданных точках интереса. Расположение фрагментов дозиметрического устройства на раневой поверхности представлено на чертеже.
- фрагмент №1-5 функциональных единиц - область щитовидной железы,
- фрагмент №2-5 функциональных единиц - ложе опухоли между трансплантатом сонной артерии и латеральным краем раны,
- фрагмент №3-5 функциональных единиц - по верхнему краю раны (поверхность),
- фрагмент №4-10 функциональных единиц - передняя поверхность ствола общей сонной артерии вдоль трансплантата,
- фрагмент №5-2 функциональные единицы - максимальная глубина операционной раны,
- фрагмент №6-5 функциональных единиц - (на фото не отражен) ложе опухоли под трансплантатом (максимально удаленные от поверхности раны точки ложа опухоли),
- фрагмент №7-10 функциональных единиц - по латеральному краю раны, начиная от ушной раковины,
- фрагмент №8-9 функциональных единиц - поверхностная зона операционной раны.
Расположение детекторов протоколировано. В соответствии со стандартной программой Гаммаплан, исходя из параметров сформированного после удаления опухоли ложа, спланирован режим сеанса интраоперационного облучения. Планируемая поглощенная доза, рассчитанная на глубину 3 см, составила 15 Гр. Для осуществления сеанса в соответствии с этими параметрами решено использовать электронный пучок 19 мэВ. Осуществлен сеанс ИОЛТ. По окончании сеанса ИОЛТ герметичные фрагменты матрицы были удалены из операционной раны, промыты раствором антисептика, осушены, разгерметизированы и по истечении 24 часов произведено считывание информации в аппарате TLD harshaw tdl 3500. В результате считывания информации с дозиметров, заключенных во фрагмент №6 (5 функциональных единиц - ложе удаленной опухоли под трансплантатом на глубине 3 см), было установлено, что реальная поглощенная доза в исследуемых точках составила от 13,75 до 14,77 Гр, что отличается от планируемой дозы. В результате считывания информации с дозиметров, заключенных во фрагмент №4 (10 функциональных единиц - передняя поверхность ствола общей сонной артерии вдоль трансплантата на глубине 2,5 см от поверхности раны, было установлено, что реальная поглощенная доза в различных точках трансплантата составила от 12,27 до 14,26 Гр, то есть поглощенная доза в определенных точках трансплантата оказалась сходной по величине с дозой, поглощенной некоторыми точками ложа трансплантата. Полученные результаты были использованы для дифференцированного подхода при планировании дозы послеоперационного облучения в этих точках в связи с необходимостью избежать недооблучения ложа опухоли и переоблучения трансплантата, что могло впоследствии отразиться на результатах лечения (осложнения и/или местные рецидивы).
Таким образом, заявляемый способ обладает значительными преимуществами по сравнению с известными способами того же предназначения и отвечает критериям патентоспособности.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ дозиметрического контроля при лучевой терапии органов области таза и устройство для его осуществления | 1988 |
|
SU1782615A1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПОВРЕЖДАЮЩЕГО ДЕЙСТВИЯ ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ НА ТВЕРДЫЕ ТКАНИ ЗУБА ЧЕЛОВЕКА | 2011 |
|
RU2462282C1 |
| СПОСОБ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ МЕСТНОРАСПРОСТРАНЕННЫХ ФОРМ РАКА ВЕРХНЕЧЕЛЮСТНОЙ ПАЗУХИ | 1996 |
|
RU2153906C2 |
| СПОСОБ РЕГИСТРАЦИИ ДОЗ В СМЕШАННЫХ ГАММА-НЕЙТРОННЫХ ПОЛЯХ ИЗЛУЧЕНИЙ | 2020 |
|
RU2742872C1 |
| СИСТЕМА ЛУЧЕВОЙ ТЕРАПИИ, СНАБЖЕННАЯ ПРОГРАММОЙ ДЛЯ ВЫЧИСЛЕНИЯ ИНТЕНСИВНОСТИ ЛУЧА ЭЛЕКТРОНОВ | 2014 |
|
RU2655070C2 |
| СПОСОБ ТЕРМОЛУЧЕВОЙ ПОДГОТОВКИ К ЭКСПОЗИЦИЯМ ТЕРМОЛЮМИНЕСЦЕНТНЫХ ДЕТЕКТОРОВ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ НА ОСНОВЕ ОКСИДА АЛЮМИНИЯ | 2005 |
|
RU2288485C1 |
| СПОСОБ ПРОВЕДЕНИЯ ОБЛУЧЕНИЯ ПРИ КОМБИНИРОВАННОМ ЛЕЧЕНИИ БОЛЬНЫХ СО ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА | 2006 |
|
RU2318555C1 |
| ИЗБИРАТЕЛЬНЫЙ ТЕРМОЛЮМИНОФОР НА ОСНОВЕ ФТОРИДА КАЛЬЦИЯ, АКТИВИРОВАННОГО ТУЛИЕМ | 1992 |
|
RU2053248C1 |
| ИНДИВИДУАЛЬНЫЙ АППЛИКАТОР ДЛЯ КОНТАКТНОЙ ЛУЧЕВОЙ ТЕРАПИИ | 2004 |
|
RU2254881C1 |
| Детектор ионизирующего излучения | 1977 |
|
SU717679A1 |
Изобретение относится к медицине, в частности к способам измерения радиоактивности в живых организмах, и может быть использовано для определения реально поглощенной дозы в условиях интраоперационного воздействия. Способ интраоперационной дозиметрии включает определение клинического объема мишени лучевого воздействия, включающий объем здоровых тканей, прилежащих к визуализируемому объему злокачественной опухоли, подлежащих лучевому воздействию, формирование плана лучевого воздействия на основании данных, полученных с использованием тканеэквивалентных фантомов, размещение в точках интереса клинического объема стерилизованных отдельных фрагментов дозиметрического устройства, представляющего собой матрицу функциональных единиц, выполненную в виде термолюминесцентных детекторов, герметично и изолированно, на расстоянии 10 мм между их краями, зафиксированных между слоями гибкого биосовместимого материала, протоколирование размещения детекторов, проведение сеанса интраоперационной лучевой терапии и удаление из объема мишени отдельных фрагментов дозиметрического устройства. Считывание информации проводится с термолюминесцентных детекторов. Использование изобретения позволяет повысить точность измерения истинного распределения дозы облучения в реальных условиях проведения сеанса облучения. 1 з.п. ф-лы, 1 ил.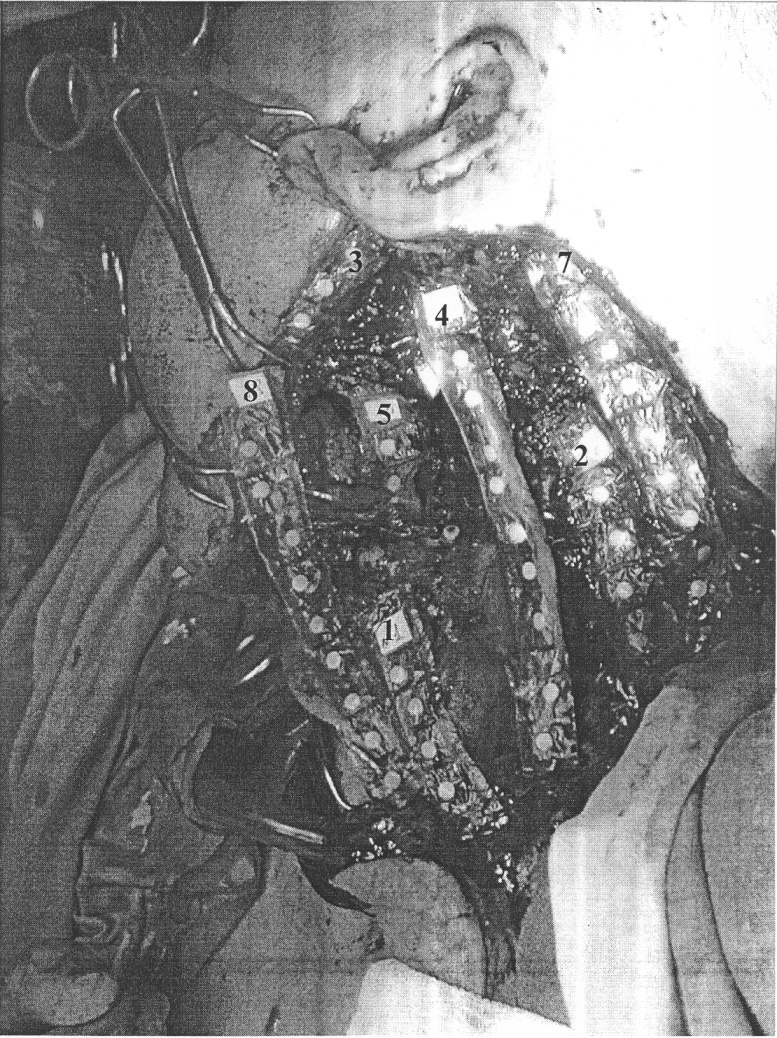
| US 4932412 А, 12.06.1990 | |||
| US 5844241 A, 01.12.1998 | |||
| US 5079426 А, 07.01.1992 | |||
| НОВЫЕ РАДИОФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И МАТРИЦЫ И ИХ ИСПОЛЬЗОВАНИЕ | 1997 |
|
RU2199348C2 |
| Способ дозиметрического контроля при лучевой терапии органов области таза и устройство для его осуществления | 1988 |
|
SU1782615A1 |
Авторы
Даты
2005-11-10—Публикация
2004-09-28—Подача