Настоящее изобретение относится к композициям для применения при лечении болезни Паркинсона. В частности, оно относится к применению блокаторов внешнего переноса L-дофа в почечных клетках как компонентов указанных композиций.
Болезнь Паркинсона (PD) представляет собой хроническое нейродегенеративное заболевание неизвестной этиологии, в значительной степени влияющее на дофаминергические нейроны головного мозга, составляющие черное вещество и проникающие в полосатое тело. Клиническим проявлением PD является наблюдающаяся у больных постепенно развивающаяся двигательная недостаточность, которая обычно проявляется в виде тремора, ригидности и аномальных изменений походки. У больных PD наблюдаются заметные улучшения моторики в результате применения L-дофа, предшественника нейромедиатора головного мозга - дофамина - в сочетании с карбидофа или бензеразидом. Последние соединения являются мощными ингибиторами периферической декарбоксилазы ароматических L-аминокислот, и полагают, что их применение может предотвратить превращение L-дофа в дофамин в периферических тканях и тем самым предотвратить нежелательные побочные эффекты, связанные с действием дофамина на периферические органы (сердечно-сосудистую систему и желудочно-кишечный тракт). Ингибирование периферической AADC также сопровождается повышенной биодоступностью L-дофа, что приводит к более эффективному пополнению запасов дофамина в непораженных дофаминергических нейронах головного мозга.
Однако относительно короткий полупериод существования L-дофа является ограничением для поддерживающей терапии больных PD, требующей введения многих доз L-дофа. По этой причине в последнее время созданы препараты L-дофа пролонгированного действия с целью улучшения двигательных функций на более длительное время и снижения числа суточных приемов. Эта стратегия все еще не очень успешна, так как циркулирующий L-дофа быстро выводится с мочой, причем этот путь выведения наиболее важен. Хотя основную часть L-дофа в моче составляет отфильтрованный L-дофа, известно, что значительное количество L-дофа реабсорбируется нефроном с помощью натрий-зависимых и натрий-независимых переносчиков аминокислот; на уровне проксимальных канальцев абсорбированный L-дофа легко превращается в дофамин. У больных PD L-дофа плюс ингибитор AADC блокируют превращение L-дофа в дофамин в почечных проксимальных канальцах, и полагают, что основная часть внутриклеточного L-дофа выводится из клетки через ее апикальную границу: это опосредуемая носителем транспортная система, ингибирование которой может привести к значительному аккумулированию L-дофа во внутриклеточном компартменте.
Обнаружено, что эта внешняя система переноса L-дофа в почечных канальцах восприимчива к циклоспорину A (Pestana et al., 1995, Br. J. Pharmacol. 115, 1349-1358), и дополнительное доказательство подтвердило, что Р-гликопротеин участвует во внешнем переносе L-дофа (Soares-da-Silva, et al., 1998, Br, J. Pharmacol. 123, 13-22; Soares-da-Silva and Serrao, 2000, J. Pharmacol. Exp. Ther. 293, 697-704). Так как основная проблема при лечении больных PD с помощью L-дофа связана с его коротким полупериодом существования и пониженной биодоступностью (Cederbaum, 1989, Clin. Neuropharmacol. 12, 147-166; Koller and Tolosa, 1998, Neurology, 50 (suppl. 6), S1-S48), полагают, что ингибиторы апикального внешнего переноса L-дофа в почечные канальцы (которые промотируют его почечную секрецию) могут понизить его выведение с мочой и повысить биодоступность. Это должно способствовать движению L-дофа от эпителия канальцев в почечный интерстиций, а затем обратно в кровоток. К сожалению, большинство ингибиторов Р-гликопротеина, которые могли бы доказать положительное влияние повышения биодоступности L-дофа на больных PD, являются хорошо известными цитотоксическими агентами или, если они не являются токсическими, то концентрации их, требующиеся для ингибирования Р-гликопротеина, нереальны в условиях in vivo.
Таким образом, целью настоящего изобретения является создание композиций для лечения PD, которые содержат соединения, способные понижать выведение L-дофа почками. Целью данного изобретения является также обеспечить применение, по меньшей мере, одного из указанных соединений для приготовления лекарственного препарата для лечения PD с помощью последовательного или одновременного приема вместе с L-дофа.
В соответствии с другим аспектом изобретения предлагается, по меньшей мере, один блокатор внешнего переноса L-дофа в почечных клетках в составе лекарственного препарата для лечения болезни Паркинсона или нарушений двигательной функции с помощью последовательного или одновременного применения вместе с L-дофа.
Блокатор внешнего переноса L-дофа в почечных клетках, в соответствии с изобретением выбирают из группы, состоящей из производных фенилбензопирана, производных транс-стильбена или 3-(4-гидроксифенил)-1-(2,4,6-тригидроксифенил)-1-пропанона (флоретина).
Предпочтительными производными фенилбензопирана являются флавоноиды, в частности флавоноид, имеющий общую формулу:
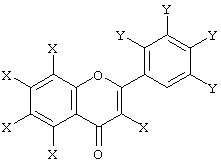
в которой группы Х одинаковы или различны и выбираются из Н и ОН, группы Y одинаковы или различны и выбираются из Н и OR, где R обозначает Н, СН3 и СН2-фенил, включая соответствующие 3-C6H5(Y4) - производные.
Предпочтительное производное транс-стильбена имеет общую формулу:
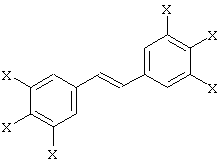
в которой группы Х одинаковы или различны и обозначают Н или ОН. Наиболее предпочтительными являются блокаторы, выбранные из группы, состоящей из:
5,7-дигидрокси-2-(4-метоксифенил)-4Н-1-бензопиран-4-она(акацетин),
5,7-дигидрокси-2-(4-гидроксифенил)-4Н-1 -бензопиран-4-она (апигенин),
5,6,7-тригидрокси-2-фенил-4Н-1-бензопиран-4-она(байкалеин),
5,7-дигидрокси-2-фенил-4Н-1 -бензопиран-4-она (хризин),
([2R,3R])-2-[3,4-дигидроксифенил]-3,4-дигидро-1[2Н]бензопиран-3,5,7-триола
((-)-эпикатехин),
2-(3,4-дигидроксифенил)-3,7-дигидрокси-4Н-1-бензопиран-4-она(физетин),
5,7-дигидрокси-3-(4-гидроксифенил)-4Н-1-бензопиран-4-она(генистеин),
3,5,7-тригидрокси-2-(4-гидроксифенил)-4Н-1-бензопиран-4-она(камферол),
2-(2,4-дигидроксифенил)-3,5,7-тригидрокси-4Н-1-бензопиран-4-она (морин),
3,5,7-тригидрокси-2-(3,4,5-тригидроксифенил)-4Н-1-бензопиран-4-она (мирицетин),
3-(4-гидроксифенил)-1-(2,4,6-тригидроксифенил)-пропанона(флоретин),
2-(3,4-дигидроксифенил)-3,5,7-тригидрокси-4Н-1-бензопиран-4-она(кверцетин),
2-(3,4-дигидроксифенил)-3,5,б,7-тетрагидрокси-4Н-1-бензопиран-4-она (кверцетагетин),
4'-бензилокси-3',5'-диметокси-3,5,7-тригидроксифлавон,
3,7-дигидрокси-3',4',5'-триметоксифлавона,
3',4',7,8-тетрагидроксифлавона,
3,5,7-тригидрокси-3',4',5'-триметоксифлавона,
3,3',4,5'-тетрагидрокси-транс-стильбена (пицетаннол),
транс-4-стирилфенола и
3,4',5'-тригидрокси-транс-стильбена(ресвератрол).
В соответствии с еще одним аспектом изобретения предлагается способ лечения болезни Паркинсона, заключающийся во введении нуждающемуся в таком лечении субъекту одновременно или последовательно с L-дофа терапевтически эффективного количества, по меньшей мере, одного блокатора внешнего переноса L-дофа в почечных клетках, выбранного из группы, состоящей из вышеуказанных производных фенилбензопирана, производных транс-стильбена или 3-(4-гидроксифенил)-1-(2,4,6-тригидроксифенил)-1-пропанона (флоретина).
Помимо этого, в соответствии с еще одним аспектом данного изобретения предлагается способ регуляции движения больного паркинсонизмом, при котором вводят эффективное количество блокатора внешнего переноса L-дофа в почечных клетках в соответствии с изобретением с целью повысить доступность последовательно или одновременно вводимого L-дофа для головного мозга и регуляции движения.
В соответствии с другим аспектом данного изобретения также предоставляет способ как повышения уровней вводимого L-дофа в крови млекопитающих, так и увеличения доступности L-дофа в головном мозге, причем этот способ заключается во введении указанным млекопитающим эффективного количества, по меньшей мере, одного из описанных выше блокаторов одновременно или последовательно с введением L-дофа.
Помимо ингибирования апикального внешнего переноса L-дофа в почечных канальцах, блокаторы, представленные в данном описании, одновременно ингибируют периферическую AADC. Эти соединения повышают уровень циркулирующей L-дофа в плазме, ингибируют AADC на периферии и повышают доступность L-дофа в головном мозге.
Предпочтительно заявляемые способы включают введение известных ингибиторов AADC (таких как бензеразид или карбидофа) или катехол-о-метилтрансферазы (таких как энтакапон или толкапон) либо последовательно, либо одновременно с другими активными соединениями. Помимо этого, в смеси с активными соединениями применяются инертные фармацевтически приемлемые носители. Фармацевтически приемлемые носители могут быть либо жидкими, либо твердыми. Твердые препараты включают порошки, таблетки, дисперсионные гранулы и капсулы. Твердый носитель может представлять собой одно или более веществ, которые могут также являться разбавителями, вкусовыми добавками, солюбилизаторами, суспендирующими агентами, связующими или веществами, способствующими измельчению таблеток; он также может быть материалом для инкапсулирования.
Предпочтительно фармацевтический препарат находится в виде стандартной дозы, например, в упаковке, причем упаковка содержит отдельное (дискретное) количество препарата, например пакетированные таблетки, капсулы и порошки во флаконах или ампулах.
Дозировки могут меняться в зависимости от потребностей больного, тяжести заболевания и конкретного применяемого соединения. Для удобства общую дневную дозу можно разделить на части и вводить их в течение дня. Установление соответствующей дозы в конкретной ситуации находится в компетенции специалиста-медика, но предпочтительно эта доза составляет около 40-30000 мкг/кг на курс лечения в случае указанных блокаторов.
Далее подробно описываются варианты настоящего изобретения на примерах и со ссылкой на прилагаемые Фигуры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 представляет собой график, показывающий действие испытуемых соединений на аккумуляцию L-дофа в клетках LLC-PK1, инкубированных в течение 6 мин при 37°С с 2,5 мкМ субстрата (L-дофа).
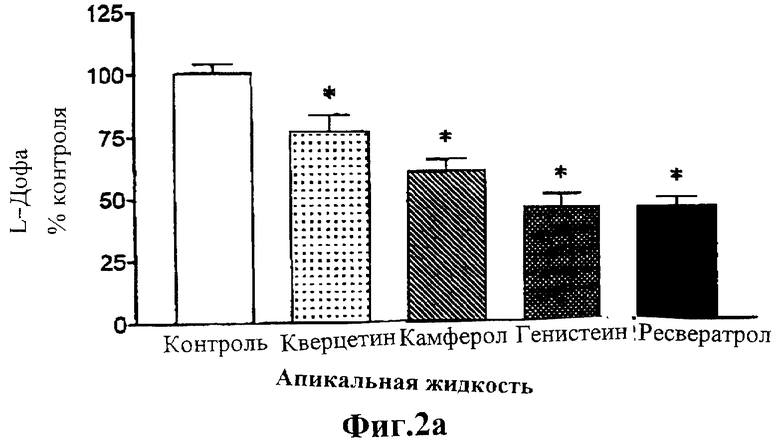
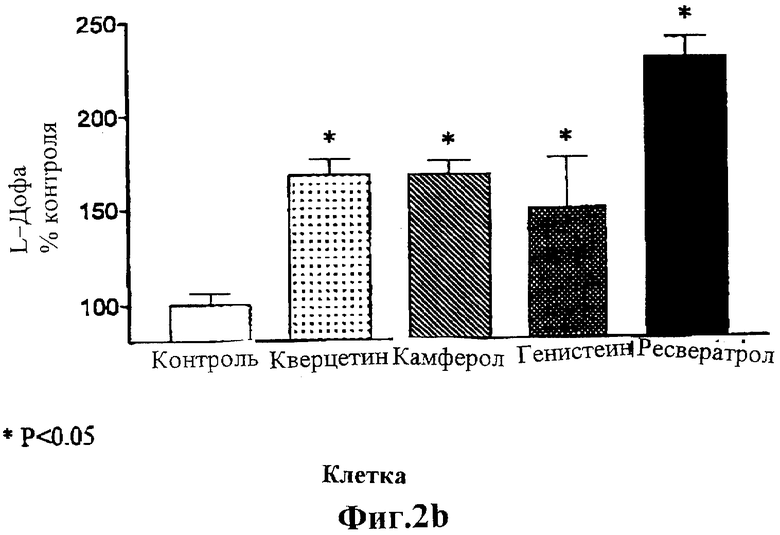
На Фиг.2 изображены два графика, показывающие влияние испытуемых соединений на апикальные выделения (Фигура 2а) и клеточное аккумулирование (Фигура 2b) L-дофа в клетках LLC-PK1, инкубированных в течение 6 мин при 37°С с 25 мкМ субстрата (L-дофа), поступающего с базолатеральной границы клетки.
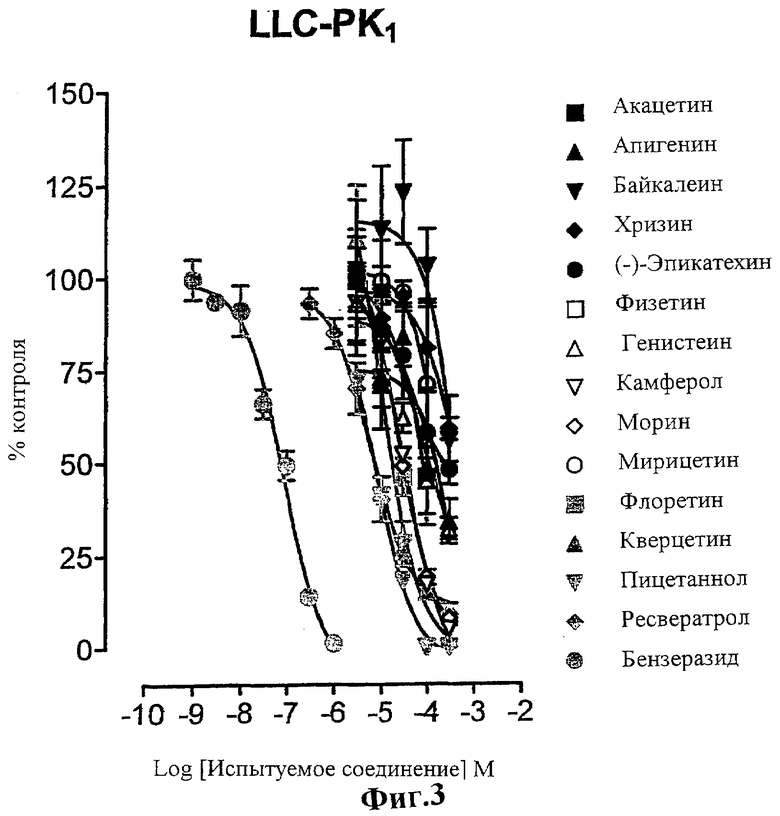
Фиг.3 представляет собой график, показывающий влияние испытуемых соединений на декарбоксилирование L-дофа в клетках LLC-PK1, инкубированных в течение 6 мин при 37°С с 250 мкМ субстрата (L-дофа).
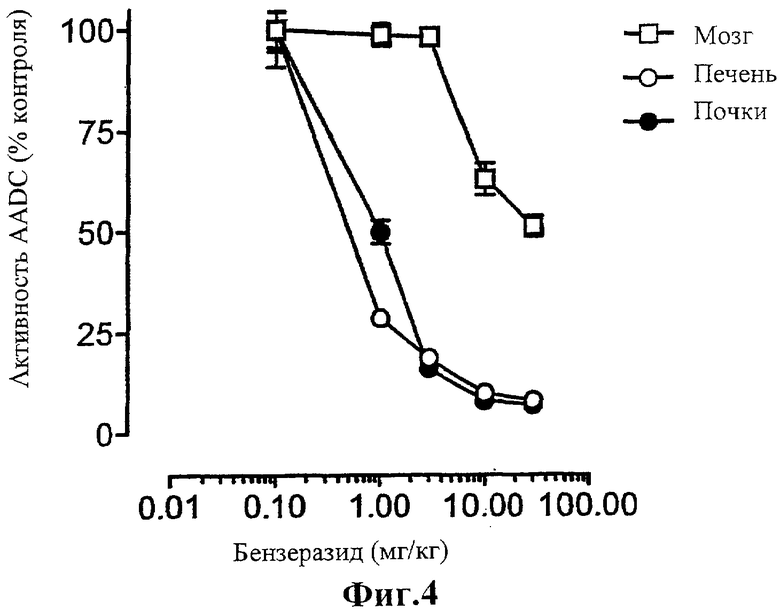
Фиг.4 представляет собой график, показывающий влияние увеличения концентрации бензеразида на активность декарбоксилазы ароматических L-аминокислот (AADC), определяемую в условиях Vmax (5 мМ L-дофа; инкубация 15 мин).
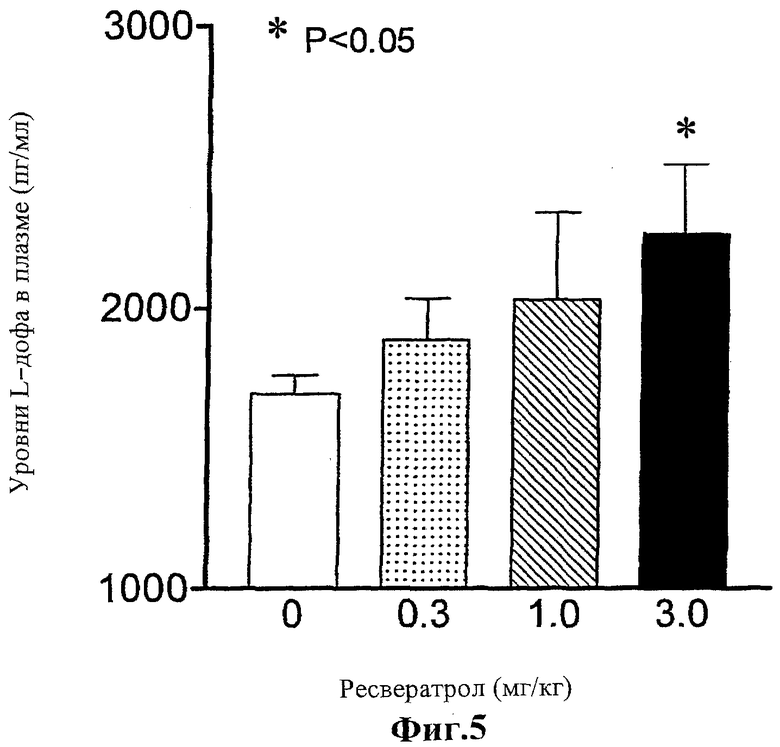
Фиг.5 представляет собой график, показывающий влияние ресвератрола на уровень L-дофа в плазме крыс, если присутствуют L-дофа (12 мг/кг) плюс бензеразид (3 мг/кг) и ресвератрол.
МАТЕРИАЛЫ И МЕТОДЫ
ИССЛЕДОВАНИЯ IN VITRO
Культуру клеток LLC-PK1, эпителиальной клеточной линии проксимальных почечных канальцев свиньи, сохраняющей некоторые свойства эпителиальных клеток проксимальных канальцев в культуре (Hull, R.N., et al., 1976, In Vitro 12, 670-677), получают от Американской Коллекции Культур Клеток (Rockville, MD). Клетки LLC-PK; (ATCC CRL 1392; пассажи 198-206) выдерживают во влажной атмосфере 5% CO2 - 95% воздуха при 37°С и выращивают в среде Medium 199 (Sigma Chemical Company, St. Louis, Mo, USA), дополненной 100 Ед/мл пенициллина G, 0,25 мкг/мл амфотерицина В, 100 мкг/мл стрептомицина (Sigma), 3% фетальной телячьей сывороткой (Sigma) и 25 мМ N-2-гидроксиэтилпиперазин-N'-2-этансульфоновой кислоты (HEPES; Sigma). Для пересева клетки диссоциируют 0,05% трипсином-EDTA, разделяют 1:4 и субкультивируют на матрасах Costar с площадью поверхности выращивания 75 или 162 см2 (Costar, Badhoevedorp, The Netherlands). С целью изучения поглощения клетки засевают в обработанные коллагеном 24-луночные пластиковые кластеры для культур (внутренний диаметр 16 мм, Costar) при плотности 40000 клеток на лунку или на обработанные коллагеном фильтр-подложки из поликарбоната 0,2 мкм (внутренний диаметр 12 мм Transwell, Costar) при плотности 13000 клеток на лунку (2,0×104 клеток см2). Среду для выращивания клеток меняют каждые 2 дня, и клетки достигают состояния монослоя после 3-5 дней инкубации. За 24 часа до эксперимента из среды для выращивания клеток удаляют фетальную телячью сыворотку. Опыты обычно проводят через 2-3 дня после достижения состояния монослоя и через 6-8 дней после первичного посева, и каждый см2 содержит около 80 мкг клеточного белка.
Изучение транспорта в клетках LLC-PK1
В день эксперимента питательную среду отсасывают и клетки отмывают средой Хэнкса; затем клетки монослоя предварительно инкубируют 15 мин в среде Хэнкса при 37°С. Среда Хэнкса имеет следующий состав (мМ): NaCl 137; KCl 5; MgSO4 0,8; Na2HPO4 0,33; КН2PO4 0,44; CaCl2 0,25; MgCl2 1,0; Tris HCl 0,15 и бутират натрия, 1,0 рН 7,4. Среда для инкубации также содержит бензеразид (1 мкМ) и толкапон (1 мкМ) для ингибирования ферментов AADC и катехол-O-метилтрансферазы соответственно. Изучение хода процесса во времени осуществляют в экспериментах, в которых клетки инкубируют с 0,5 мкМ субстрата в течение 1, 3, 6 и 12 дней. Эксперименты по насыщению проводят на клетках, инкубированных в течение 6 мин при увеличивающихся концентрациях L-дофа (2,5-250 мкМ). Испытуемые вещества берут только с апикальной стороны, и они присутствуют как в период перед инкубацией, так и в инкубационный период. Во время перед инкубацией и в период инкубации клетки непрерывно встряхивают и выдерживают при 37°С. Апикальное включение (поглощение) инициируют добавлением 2 мл среды Хэнкса с заданной концентрацией субстрата. Поглощение прекращают, быстро удаляя раствор для поглощения с помощью вакуумного насоса, соединенного с пастеровской пипеткой, с последующим быстрым отмыванием холодной средой Хэнкса и добавлением 250 мкл 0,2 мМ перхлорной кислоты. Подкисленные образцы хранят при 4°С до момента закола в жидкостной хроматограф высокого давления для анализа L-дофа.
Предыдущие исследования показали, что некоторое количество L-дофа, аккумулируемое в клетках LLC-PK1, может уходить из клетки при участии апикальных внешних переносчиков (Soares-da-Silva, et al., 1998, Am. J. Physiol. 274, F243-F251), ингибирование которых ведет к повышению клеточного аккумулирования L-дофа (Soares-da-Silva, et al., 1998, Br. J. Pharmacol. 123, 13-22). Поэтому в экспериментах по изучению эффекта лекарственных веществ, которые повышают внутриклеточное аккумулирование L-дофа, клетки инкубируют с 25 мкМ L-дофа с базальной границы клетки и через 6 мин определяют поглощение (аккумулирование в клеточном монослое) и выделение (перенос в противоположную камеру). Используют испытуемые соединения только с апикальной стороны, и они присутствуют в период перед инкубацией и во время инкубации. По окончании инкубации клетки помещают на лед и собирают среду для промывания апикальной границы клеток, подкисляют ее перхлорной кислотой и хранят при 4°С до момента анализа на L-дофа. Клетки отмывают охлажденной льдом средой Хэнкса и добавляют 0,2 мМ перхлорной кислоты (100 мкл и 500 мкл в верхней и нижней камерах соответственно); подкисленные образцы хранят при 4°С до момента закола в жидкостной хроматограф высокого давления для анализа на L-дофа.
Исследование декарбоксилирования.
В день эксперимента питательную среду отсасывают и клетки (LLC-PK1) отмывают средой Хэнкса; затем клетки монослоя предварительно инкубируют 15 мин в среде Хэнкса при 37°С. Среда Хэнкса имеет следующий состав (мМ): NaCl 137; KCl 5; MgSO4 0,8; Na2HPO4 0,33; КН2РО4 0,44; CaCl2 0,25; MgCl2 1,0; Tris HCl 0,15 и бутират натрия 1,0; рН 7,4. Среда для инкубации также содержит пиридоксаль фосфат (120 мкМ), толкарпон (1 мкМ) и паргилин (100 мкМ). Эксперименты по изучению насыщения осуществляют в клетках, инкубированных в течение 6 мин при возрастающих концентрациях L-дофа (2,5-250 мкМ). В экспериментах по изучению влияния испытуемых соединений на декарбоксилирование L-дофа клетки предварительно инкубируют в течение 30 мин в присутствии испытуемых соединений. После предварительной инкубации клетки инкубируют 6 мин в среде Хэнкса с 250 мкМ L-дофа. Реакцию прекращают, добавляя 250 мкл 0,2 мМ перхлорной кислоты. Подкисленные образцы хранят при 4°С перед введением в жидкостной хроматограф высокого давления для анализа на дофамин.
Жизнеспособность клеток
Клетки, выращенные на пластиковых подложках, предварительно инкубируют 15 мин при 37°С, а затем инкубируют в отсутствие или в присутствии L-дофа и испытуемых соединений еще 6 мин. Затем клетки инкубируют при 37°С в течение 2 мин в присутствии трипана синего (0,2% об/вес) в фосфатном буфере. Инкубацию прекращают, дважды промывая клетки средой Хэнкса, и клетки изучают с помощью микроскопа Leica. В этих условиях у более 95% клеток наблюдается исключение красителя.
ИССЛЕДОВАНИЯ IN VIVO
Эти эксперименты предприняты для того, чтобы оценить влияние испытуемых соединений на биодоступность L-дофа и его доступ в мозг. Для этого эксперимента берут самцов крыс Wistar в контролируемых внешних условиях весом 170-280 г, которых держат по двое в клетке в (12-часовой световой день и внешняя температура 24°С). Через определенные интервалы крыс обезглавливают, удаляют мозг, печень и почки и используют их для определения L-дофа, дофамина и дигидроксифенилуксусной кислоты (DOPAC).
Анализ AADC в тканях крыс.
В ряде экспериментов определяют AADC в тканях головного мозга, печени и почек в условиях Vmax (5 мМ L-дофа; инкубация 15 мин), как описано ранее (Soares-da-Silva, et al., 1994, Br. J. Pharmacol. 112, 611-615). Реакцию прекращают, добавляя 500 мкл 2М перхлорной кислоты, и препарат выдерживают при 4°С в течение 60 мин. Затем образцы центрифугируют (200g, 2 мин, 4°С) и для анализа дофамина используют аликвоты 500 мл супернатанта, отфильтрованные в пробирках с фильтром Spin-X (Costar).
АНАЛИЗ L-ДОФА, ДОФАМИНА И МЕТАБОЛИТОВ
L-Дофа, дофамин и метаболиты (DOPAC и HVA) определяют количественно методом жидкостной хроматографии высокого давления с электрохимическим детектором, как сообщалось ранее (Soares-da-Silva and Garrett, 1990, Neuropharmacol. 29, 869-874; Soares-da-Silva, et al., 1998, Am. J. Physiol. 274, F243-F251). Жидкостная хроматографическая система высокого давления состоит из насоса (Gilson model 302; Gilson Medical Electronics, Villiers le Bel, France), соединенного с манометрическим модулем (Gilson model 802C), и колонки ODS 5 мкм из нержавеющей стали (Biophase; Bioanalytical Systems, West Lafayette, IN) длиной 25 см; образцы вводят с помощью автоматического инжектора для образцов (Gilson model 231), соединенного с дилютером Gilson (модель 401). Подвижная фаза представляет собой дегазированный раствор лимонной кислоты (0,1 мМ), октилсульфата натрия (0,5мМ), ацетата натрия (0,1 М), EDTA (0,17 мМ), дибутиламина (1 мМ) и метанола (8 об.%), доведенный с помощью хлорной кислоты (2М) до рН 3,5 и вводимый со скоростью 1,0 мл мин-1. Обнаружение проводят электрохимическим способом на стеклографитовом электроде с электродом сравнения Ag/AgCl и с амперметрическим детектором (Gilson model 141); ячейка детектора работает при 0,75 V. Мониторинг образующегося тока осуществляют с помощью программного обеспечения Gilson 712 HPLC. Нижний предел обнаружения L-дофа, дофамина, DOPAC, 3-МТ и HVA составляет около 350-500 фмол.
АНАЛИЗ ДАННЫХ
Значения Кm и Vmax для поглощения L-дофа, по определению в экспериментах по насыщению, вычисляют методами нелинейного регрессионного анализа, используя программное обеспечение GraphPad Prism statistics (Motulsky, P. Spannard, R.Neubig. GraphPad Prism (version 1.0). San Diego, USA: GraphPad Prism Software Inc., 1994).
Апикальное фракционное истечение (отток) рассчитывают по выражению
L-дофаапикальная жидкость/(L-дофаапикальнаяжидкость + L-дофаклетка)
где L-дофаапикальнаяжидкость обозначает количество L-дофа (в нмол/мг белка), которое достигло апикальной (верхушечной) камеры, а L-дофаклетка (в нмол/мг белка) обозначает количество L-дофа, накапливаемое в монослое клеток.
Арифметические средние значения даны с S.E.M. Статистический анализ осуществляют методом одностороннего вариационного анализа (ANOVA) с последующей проверкой по Ньюмену-Кейлзу (Newman-Keuls) для множественных сравнений. Считают, что значение Р меньше 0,05 указывает на значительную разницу.
РЕЗУЛЬТАТЫ
Накопление в ненасыщенном растворе (0,5 мкМ) L-дофа в ходе эксперимента происходит (увеличивается) линейно во времени в течение нескольких минут. Через 6 мин инкубации, когда поглощение линейно зависит от времени, и при условии, что содержание внутриклеточной воды составляет 7,0±0,7 мкл/мг белка (Soares-da-Silva, et al., 1998, Am. J. Physiol. 274, F243-F251), концентрация L-дофа внутри клетки составляет 4,0±0,4 мкМ при концентрации в среде 0,5 мкМ. То есть концентрация L-дофа в клетке в 8,0±0,8 раз выше, чем соответствующая концентрация среды. В опытах по определению кинетических параметров апикального переносчика (транспортера) L-дофа клетки инкубируют в течение 6 мин с повышающейся концентрацией (1-250 мкМ) субстрата. Нелинейный анализ кривой насыщения дает значения: Кm (в мкМ) 47±8 и Vmax (в пмол/мг белка/6 мин) 3069±224.
Для того чтобы определить необходимые условия поглощения L-дофа в процессе обмена веществ, инкубируют клетки при 4°С. Результатом понижения температуры во время предварительной инкубации («прединкубации») и инкубации от 37 до 4°С является заметное уменьшение (снижение на 77±2%) накопления (аккумулирования) L-дофа (2,5 мкМ).
Уменьшение содержания внеклеточного натрия (со 140 мМ до 70, 35 и 0 мМ) не влияет на аккумулирование L-дофа. Более того, в отсутствие внеклеточного натрия ( замененного на холин в эквимолярной концентрации) значения Km и Vmax для L-дофа аналогичны значениям, получаемым в присутствии натрия. N-(метиламино)-изомасляная кислота (MeAIB) не влияет на поглощение L-дофа, тогда как 2-аминобицикло(2,2,1)-гептан-2-карбоновая кислота (ВНС) вызывает зависящее от концентрации ингибирование поглощения L-дофа (IC50=407 мкМ). Ингибирующее действие, оказываемое 1 мМ ВНС на аккумулирование L-дофа, имеет конкурентный характер, что явствует из увеличения для поглощения L-дофа значения Кm (130±19 мкМ), но не Vmax (3783±244 пмол/мг белка/6 мин). Взятые вместе, эти результаты наводят на мысль, что апикальный внутренний перенос L-дофа можно промотировать с помощью ВНС-восприимчивого и натрий-независимого переносчика L-аминокислот (Audus and Borchardt, 1986, J.Neurochem. 47, 484-488).
Найдено, что блокаторы внешнего переноса L-дофа в почечных клетках увеличивают накопление L-дофа (2,5 мкМ) в зависимости от концентрации при значениях ЕС50 от 6 до 339 мкМ (Фигура 1). Выяснилось, что предварительная обработка клеток испытуемым соединением значительно повышает (Р<0,05) максимальное аккумулирование (V мах) возрастающих концентраций L-дофа без заметных изменений значений Кm.
Для того чтобы продемонстрировать, что повышенное аккумулирование L-дофа, индуцируемое испытуемыми соединениями, вызвано уменьшением внешнего переноса внутриклеточного (ранее аккумулированного) L-дофа, клетки, культивируемые на поликарбонатных фильтрах, инкубируют с L-дофа (25 мкМ), поступающим с базальной границы клетки, и определяют истечение L-дофа в направлении от базального к апикальному. Как показано на Фигуре 2, испытуемые соединения заметно снижают базально-апикальный ток L-дофа и повышают аккумулирование L-дофа в клетке, что четко указывает на их действие в качестве блокаторов внешнего переноса L-дофа в почечных клетках.
В следующей серии экспериментов предпринята попытка оценить ингибирующую активность испытуемых соединений в отношении AADC. С этой целью клетки LLC-PK1 предварительно инкубируют в течение 30 мин в присутствии увеличивающихся концентраций испытуемых соединений или бензеразида; затем клетки инкубируют в присутствии L-дофа в концентрации, близкой к насыщению (250 мкМ). Как показано на Фигуре 3, испытуемые соединения ингибируют активность AADC в зависимости от концентрации, что определяют по превращению L-дофа в дофамин. Значения IC50 варьируются от 0,07 мкМ (для бензеразида) до 393 мкМ (для наименее активного соединения).
В экспериментах in vivo испытуемые соединения вводят крысам перорально за 30 мин до введения L-дофа или L-дофа плюс бензеразид. Так как высокие дозы бензеразида могут вызвать ингибирование AADC в тканях головного мозга (Da Prada, et al., 1987, Eur. Neurol. 27, 9-20), проводят предварительные эксперименты для определения дозы бензеразида, которая не влияет на активность AADC в головном мозге.
Как показано на Фигуре 4, доза бензеразида, вызывающая максимальное ингибирование AADC в печени и в почках, не оказывающая влияния на AADC головного мозга, составляет 3 мг/кг, что вполне согласуется с данными, полученными другими исследователями (Da Prada, et al., 1987, Eur. Neurol. 27, 9-20). Чтобы соотношение L-дофа/бензеразид соответствовало соотношению, обычно применяемому при лечении людей, дозу L-дофа устанавливают 12 мг/кг.
Когда крысам без анестезии за 3 0 мин до приема L-дофа (12 мг/кг) плюс бензеразид (3 мг/кг) дают ресвератрол, результатом является заметное увеличение уровней L-дофа, дофамина и метаболитов амина в тканях головного мозга (Таблица 1). Эти эффекты сопровождаются повышением уровней L-дофа в плазме (Фигура 5) и повышением уровней L-дофа и дофамина в тканях почек (таблица 1). Возможно, что AADC-ингибирующий эффект ресвератрола не оказывает значительного влияния на увеличение биодоступности L-дофа. Во-первых, уровни дофамина в почках крыс, участвующих в данном эксперименте, выше, чем у соответствующих контрольных (получавших L-дофа плюс бензеразид). Во-вторых, ингибирующее действие ресвератрола (30 мг/кг) на AADC-активность в тканях печени и почек (печень, уменьшение на 48%; почки, уменьшение на 3 8%) заметно меньше, чем в случае бензеразида (Фигура 4).
Все вышеприведенные данные показывают, что блокаторы внешнего переноса L-дофа в почечных клетках повышают уровни L-дофа в плазме и биодоступность в тканях головного мозга.
Таблица 1. Уровни ( в нг/г) L-3,4-дигидроксифенилаланина (L-дофа), дофамина (DA), 3,4-дигидроксифенилуксусной кислоты (DOPAC) и гомованилиновой кислоты (HVA) в тканях мозга и почек после введения носителя (0,5% раствор карбоксиметилцеллюлозы, 4 мл/кг), L-дофа (L, 12 мг/кг), L-дофа (L, 12 мг/кг) плюс бензеразид (В, 3 мг/кг) и ресвератрола (R) плюс L-дофа (L; 12 мг/кг) плюс бензеразид (В, 3 мг/кг). Ресвератрол вводят за 30 мин до приема L-дофа + бензеразид и крыс умерщвляют через 60 мин после введения L-дофа + бензеразид.
Заметно отличается от соответствующих значений для крыс, обработанных L-дофа (L, 12 мг/кг) плюс бензеразид (В, 3 мг/кг) (*Р<0,05).
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНАЦИИ РИЛУЗОЛА С L-ДОФА ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 1999 |
|
RU2225204C2 |
| ДИАРИЛАЛКАНЫ В КАЧЕСТВЕ ЭФФЕКТИВНЫХ ИНГИБИТОРОВ ДВУХЪЯДЕРНЫХ ФЕРМЕНТОВ | 2005 |
|
RU2466981C1 |
| ПРЕПАРАТ L-ТРИПТОФАНА, СОДЕРЖАЩИЙ КАРБИДОПУ/БЕНСЕРАЗИД | 2005 |
|
RU2377983C2 |
| СРЕДСТВА НА ОСНОВЕ МЕДЬ (II) СОДЕРЖАЩЕГО КОМПЛЕКСНОГО СОЕДИНЕНИЯ ДИГИДРОКВЕРЦЕТИНА, ОБЛАДАЮЩЕЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ | 2013 |
|
RU2553627C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2024 |
|
RU2839611C1 |
| СПОСОБ ПОВЫШЕНИЯ БИОЛОГИЧЕСКОЙ ДОСТУПНОСТИ ФЕКСОФЕНАДИНА И ЕГО ПРОИЗВОДНЫХ | 1998 |
|
RU2197967C2 |
| МЕЗИЛАТНОЕ ПРОЛЕКАРСТВО ЛЕВОДОПЫ, ЕГО КОМПОЗИЦИИ И ПРИМЕНЕНИЕ | 2006 |
|
RU2429223C2 |
| РЕЖИМ ДОЗИРОВАНИЯ ИНГИБИТОРОВ КОМТ | 2007 |
|
RU2518483C2 |
| ЗАМЕЩЕННЫЕ 2-ФЕНИЛ-1-(3,4-ДИГИДРОКСИ-5-НИТРОФЕНИЛ)-1-ЭТАНОНЫ, СПОСОБ ЛЕЧЕНИЯ НЕКОТОРЫХ НАРУШЕНИЙ ЦЕНТРАЛЬНОЙ И ПЕРИФЕРИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ УКАЗАННЫЕ ВЕЩЕСТВА | 1999 |
|
RU2232748C2 |
| СРЕДСТВО ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2006 |
|
RU2324492C1 |
Изобретение относится к области фармации. Сущность изобретения составляет фармацевтическая композиция для лечения болезни Паркинсона, которая содержит L-дофа и, по меньшей мере, одно соединение, способное блокировать внешний перенос L-дофа в почечных клетках. Указанный блокатор выбирают из следующих веществ: флавоноида-производного фенилбензопирана, производного транс-стильбена и флоретина [3-(4-гидроксифенил)-1-(2,4-тригидроксифенил)-1-пропанон]. Композиция также может содержать ингибитор фермента декарбоксилазы аминокислот, такой как карбидофа или бензеразид, и/или ингибитор фермента катехол-о-метилтрансферазы, такой как энтакапон или толкапон. Композицию можно применять в твердом виде и L-дофа можно вводить одновременно или последовательно с блокатором внешнего переноса L-дофа в почечных клетках. Технический результат изобретения - расширение арсенала средств для лечения болезни Паркинсона. 6 н. и 22 з.п.ф-лы, 1 табл., 5 ил.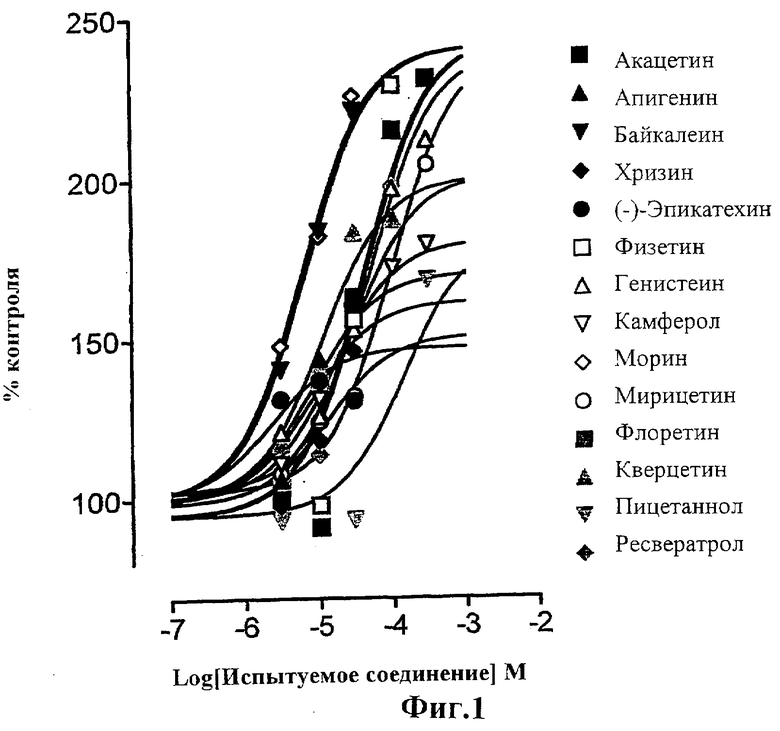
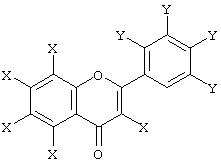
в которой группы Х одинаковы или различны и выбираются из Н и ОН, группы Y одинаковы или различны и выбираются из Н и OR, где R обозначает Н, СН3 и СН2-фенил, включая соответствующие 3-С6Н5(Y4) - производные.
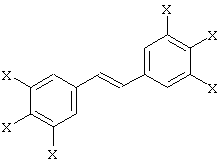
в которой группы Х одинаковы или различны и обозначают Н или ОН.
5,7-дигидрокси-2-(4-метоксифенил)-4Н-1-бензопиран-4-она (акацетин),
5,7-дигидрокси-2-(4-гидроксифенил)-4Н-1-бензопиран-4-она (апигенин),
5,6,7-тригадрокси-2-фенил-4Н-1-бензопиран-4-она (байкалеин),
5,7-дигидрокси-2-фенил-4Н-1-бензопиран-4-она (хризин),
([2R,3R])-2-[3,4-дигидроксифенил]-3,4-дигидро-1[2Н]бензопиран-3,5,7-триола ((-)-эпикатехин),
2-(3,4-дигидроксифенил)-3,7-дигидрокси-4Н-1-бензопиран-4-она (физетин),
5,7-дигидрокси-3-(4-гидроксифенил)-4Н-1-бензопиран-4-она(генистеин),
3,5,7-тригидрокси-2-(4-гидроксифенил)-4Н-1-бензопиран-4-она (камферол),
2-(2,4-дигидроксифенил)-3,5,7-тригидрокси-4Н-1-бензопиран-4-она(морин),
3,5,7-тригидрокси-2-(3,4,5-тригидроксифенил)-4Н-1-бензопиран-4-она (мирицетин),
3-(4-гидроксифенил)-1-(2,4,6-тригидроксифенил)-пропанона(флоретин),
2-(3,4-дигидроксифенил)-3,5,7-тригидрокси-4Н-1-бензопиран-4-она (кверцетин),
2-(3,4-дигидроксифенил)-3,5,6,7-тетрагидрокси-4Н-1-бензопиран-4-она (кверцетагетин),
4'-бензилокси-3',5'-диметокси-3,5,7-тригидроксифлавон,
3,7-дигидрокси-3',4',5'-триметоксифлавона, 3',4',7,8-тетрагидроксифлавона,
3,5,7-тригидрокси-3',4',5'-триметоксифлавона,
3,3',4,5'-тетрагидрокси-транс-стильбена (пицетаннол),
транс-4-стирилфенола и
3,4',5'-тригидрокси-транс-стильбена (ресвератрол).

в которой группы Х одинаковы или различны и выбираются из Н и ОН, группы Y одинаковы или различны и выбираются из Н и OR, где R обозначает Н, СН3 и СН2-фенил, включая соответствующие 3-С6Н5(Y4) - производные.

в которой группы Х одинаковы или различны и обозначают Н или ОН.
5,7-дигидрокси-2-(4-метоксифенил)-4Н-1-бензопиран-4-она (акацетин),
5,7-дигидрокси-2-(4-гидроксифенил)-4Н-1-бензопиран-4-она(апигенин),
5,6,7-тригидрокси-2-фенил-4Н-1-бензопиран-4-она(байкалеин),
5,7-дигидрокси-2-фенил-4Н-1-бензопиран-4-она (хризин),
([2R,3R])-2-[3,4-дигидроксифенил]-3,4-дигидро-1[2Н]бензопиран-3,5,7-триола ((-)-эпикатехин),
2-(3,4-дигидроксифенил)-3,7-дигидрокси-4Н-1-бензопиран-4-она (физетин),
5,7-дигидрокси-3-(4-гидроксифенил)-4Н-1-бензопиран-4-она (генистеин),
3,5,7-тригидрокси-2-(4-гидроксифенил)-4Н-1-бензопиран-4-она (камферол),
2-(2,4-дигидроксифенил)-3,5,7-тригидрокси-4Н-1-бензопиран-4-она(морин),
3,5,7-тригидрокси-2-(3,4,5-тригидроксифенил)-4Н-1-бензопиран-4-она (мирицетин),
3-(4-гидроксифенил)-1-(2,4,6-тригидроксифенил)-пропанона(флоретин),
2-(3,4-дигидроксифенил)-3,5,7-тригидрокси-4Н-1-бензопиран-4-она(кверцетин),
2-(3,4-дигидроксифенил)-3,5,6,7-тетрагидрокси-4Н-1-бензопиран-4-она (кверцетагетин),
4'-бензилокси-3',5'-диметокси-3,5,7-тригидроксифлавон,
3,7-дигидрокси-3',4',5'-триметоксифлавона, 3',4',7,8-тетрагидроксифлавона,
3,5,7-тригидрокси-3',4',5'-триметоксифлавона,
3,3',4,5'-тетрагидрокси-транс-стильбена (пицетаннол),
транс-4-стирилфенола и
3,4',5'-тригидрокси-транс-стильбена (ресвератрол).
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| US 4190672 А, 26.02.1980 | |||
| Чугунов В.В., Васильев В.Н | |||
| Симпатико-адреналовая система человека | |||
| М.: Медицина, 1976, с.112-128. | |||
Авторы
Даты
2005-12-20—Публикация
2001-03-13—Подача