Техническая область изобретения
Настоящее изобретение относится к препарату натеглинида, который пригоден в качестве антидиабетического средства, более конкретно к препарату натеглинида с немедленным высвобождением.
Предпосылки изобретения
Известно, что натеглинид [название соединения: N-(транс-4-изопропилциклогексилкарбонил)-D-фенилаланин] обладает превосходным эффектом снижения содержания глюкозы в крови после перорального введения и, следовательно, является пригодным в качестве терапевтического агента для лечения диабета (патентная публикация Японии № Hei 4-15221).
С другой стороны, натеглинид представляет собой вещество, которое плохо растворяется в воде, и, следовательно, капсулы, наполненные порошкообразным лекарственным веществом натеглинидом, или обычные таблетки, содержащие натеглинид, плохо растворяются после перорального введения, в силу плохой способности к дезинтеграции. В результате подобные препараты, содержащие натеглинид, не могут оказывать быстрого и короткого по продолжительности действия по понижению уровня глюкозы в крови (быстродействующий гипогликемический агент), что характерно для натеглинида. Для того, чтобы показать характерную эффективность натеглинида, лекарственное средство должно быстро высвобождаться из препаратов, и, таким образом, существует потребность в улучшении указанных препаратов.
В качестве способов разрешения данной проблемы был создан препарат, в который в качестве разрыхлителя была включена низкозамещенная гидроксипропилцеллюлоза (патент Японии № 2508949).
Между тем, натеглинид имеет кристаллические полиморфы. Подобный способ, при котором в препарат включают разрыхлитель, эффективно усиливает способность препарата, содержащего натеглинид в стабильной кристаллической форме Н-типа и полустабильной кристаллической форме, дезинтегрироваться и увеличивать степень растворения. Однако он не может считаться таким же эффективным при всех кристаллических формах натеглинида.
Кроме того, когда натеглинид используется в других кристаллических формах, кроме наиболее стабильных кристаллических форм Н-типа и полустабильных кристаллических форм, известно, что во время изготовления или консервирования препаратов происходит кристаллический переход. Обычно предпочтительно, чтобы кристаллический переход лекарственных средств не имел места во время изготовления или консервирования фармацевтических препаратов.
Описание изобретения
Целью настоящего изобретения является обеспечение в качестве препарата, содержащего натеглинид, фармацевтического препарата, содержащего аморфный натеглинид, в котором скорость растворения лекарственных средств была бы высокой, а во время изготовления или консервирования препаратов не происходило бы кристаллического перехода.
Для решения указанных проблем были проведены интенсивные исследования и установлено, что свойства растворимости можно улучшить путем использования в препаратах натеглинида в аморфной форме. Настоящее изобретение было осуществлено на основе данного открытия. Согласно способу по настоящему изобретению возможно создание из натеглинида в виде любого кристаллического полиморфа препарата натеглинида с немедленным высвобождением, в котором скорость растворения лекарственных средств является высокой, а во время изготовления или консервирования препаратов не происходит кристаллического перехода. Настоящее изобретение в основном относится к препарату, содержащему натеглинид в качестве активного ингредиента, в котором натеглинид является аморфным. Настоящее изобретение включает каждое из следующих изобретений:
(1) Препарат, содержащий натеглинид, включающий натеглинид в качестве активного ингредиента, в котором натеглинид является аморфным.
(2) Препарат, содержащий натеглинид, согласно (1), в котором аморфный натеглинид получают посредством процесса удаления растворителя из раствора натеглинида в растворителе.
(3) Препарат, содержащий натеглинид, согласно (2), в котором растворитель, используемый в процессе удаления растворителя, представляет собой смесь этанола и воды.
(4) Препарат, содержащий натеглинид, согласно (1), в котором аморфный натеглинид получают с помощью приложения высокого усилия сдвига.
(5) Препарат, содержащий натеглинид, согласно (1), в котором аморфный натеглинид получают с помощью процесса грануляции расплава.
(6) Препарат, содержащий натеглинид, согласно (2), который включает гидрофильные материалы в качестве носителей.
(7) Препарат, содержащий натеглинид, согласно (6), в котором гидрофильные материалы выбирают из группы, состоящей из водорастворимых полимеров, набухающих в воде полимеров, сахарных спиртов и солей.
(8) Препарат, содержащий натеглинид, согласно (7), в котором водорастворимые полимеры или набухающие в воде полимеры выбирают из группы, состоящей из производных поливинилпирролидона, полисахаридных производных, производных полиакриловой кислоты, производных полимолочной кислоты, производных полиоксиэтилена, производных поливинилового спирта и поверхностно-активных веществ.
(9) Препарат, содержащий натеглинид, согласно (8), в котором полисахаридные производные выбирают из группы, состоящей из метилцеллюлозы SM-4, гидроксипропилцеллюлозы SL и гидроксипропилцеллюлозы SSL.
(10) Препарат, содержащий натеглинид, согласно (8), в котором производные полиоксиэтилена представляют собой полиэтиленгликоль.
(11) Препарат, содержащий натеглинид, согласно (7), в котором сахарные спирты выбирают из группы, состоящей из сорбита, ксилита и маннита.
(12) Препарат, содержащий натеглинид, согласно (7), в котором набухающие в воде полимеры представляют собой кросповидон (COLIDONE CL-M).
(13) Препарат, содержащий натеглинид, согласно (1), который представляет собой таблетку, содержащую аморфный натеглинид.
(14) Препарат, содержащий натеглинид, согласно (1), который представляет собой продукт в виде капсулы, наполненной жидкостью, в которой растворен натеглинид.
(15) Препарат, содержащий натеглинид, согласно (14), в котором жидкость, в которой растворен натеглинид, представляет собой водорастворимые полимеры или поверхностно-активные вещества.
(16) Препарат, содержащий натеглинид, согласно (15), в котором водорастворимые полимеры или поверхностно-активные вещества, растворяющие натеглинид, представляют собой производные полиоксиэтилена.
(17) Способ изготовления препарата, содержащего аморфный натеглинид, который включает стадию растворения кристаллов натеглинида в фармакологически приемлемом растворителе вместе с гидрофильными материалами, выбранными из группы, состоящей из водорастворимых полимеров, набухающих в воде полимеров, сахарных спиртов и солей, и стадию подвергания полученного раствора процессу, выбранному из группы, состоящей из процесса гранулирования в псевдоожиженном слое, процесса гранулирования с использованием перемешивания с высокой скоростью, процесса сушки распылением и процесса нанесения покрытия для гранулирования аморфного натеглинида.
(18) Способ изготовления препарата, содержащего аморфный натеглинид, который включает стадию смешивания кристаллов натеглинида с гидрофильными материалами, выбранными из группы, состоящей из водорастворимых полимеров, набухающих в воде полимеров, сахарных спиртов и солей, и стадию приложения к полученной смеси усилия сдвига.
(19) Способ изготовления препарата, содержащего аморфный натеглинид, который включает стадию смешивания кристаллов натеглинида с гидрофильными материалами, выбранными из группы, состоящей из водорастворимых полимеров, набухающих в воде полимеров, сахарных спиртов и солей, и стадию подвергания полученной смеси пластицированию расплава с нагреванием и измельчением при охлаждении.
(20) Способ изготовления препарата, содержащего аморфный натеглинид, который включает стадию растворения кристаллов натеглинида в фармакологически приемлемых жидких добавках.
Краткое описание чертежей
Фигура 1 показывает результаты DSC (дифференциальной сканирующей калориметрии) таблеток аморфного натеглинида.
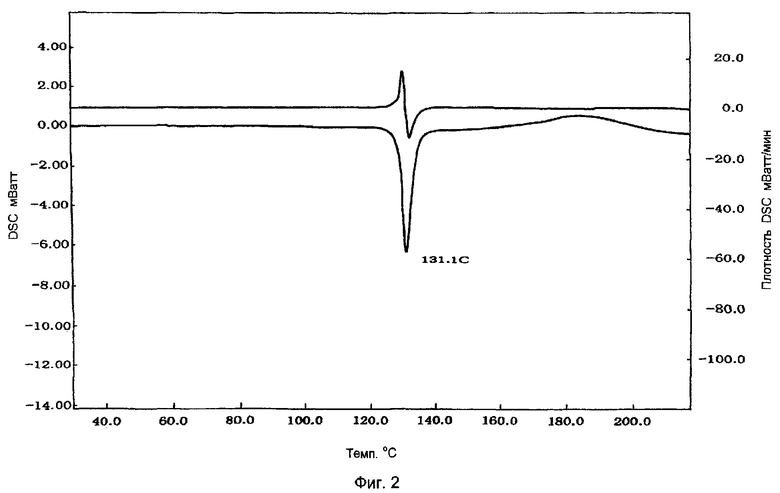
Фигура 2 показывает картину DSC лекарственного средства натеглинида в кристаллической форме В-типа.
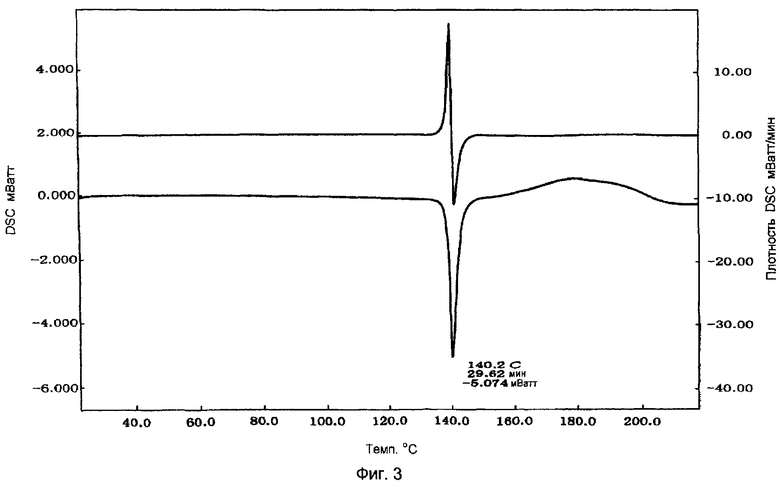
Фигура 3 показывает картину DSC лекарственного средства натеглинида в кристаллической форме Н-типа.
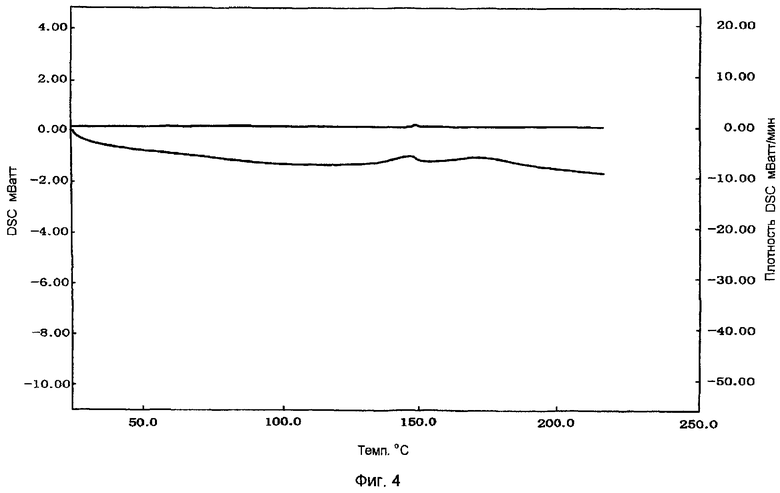
Фигура 4 показывает картину DSC таблеток аморфного натеглинида после одной недели консервации, упакованных в алюминиевом пакетике при 50°С.
Фигура 5 показывает картину DSC таблеток аморфного натеглинида после одного месяца консервации, упакованных в алюминиевом пакетике при 40°С, 75% ОВ.
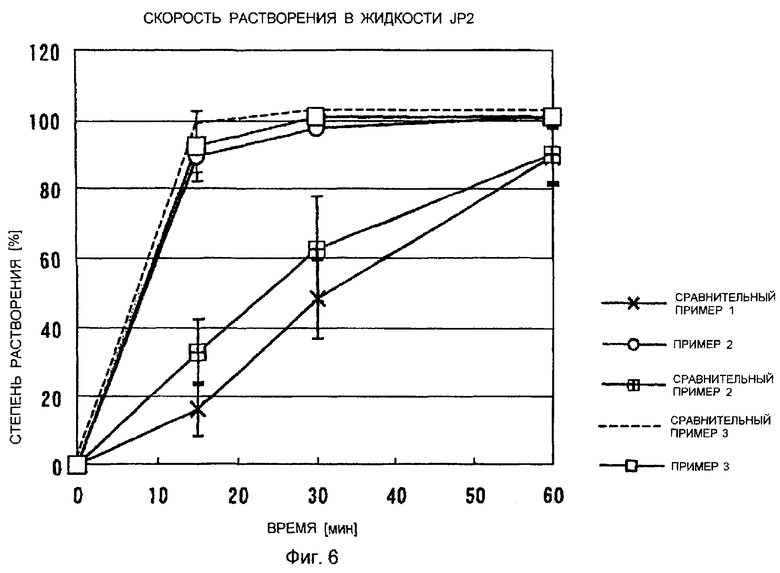
Фигура 6 показывает сравнительную диаграмму профилей растворения каждого препарата примеров 2 и 3 и сравнительных примеров 1-3.
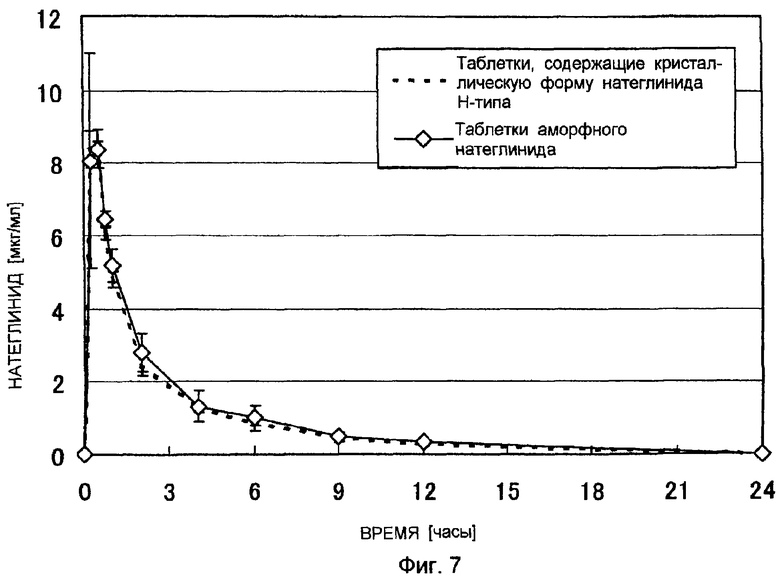
Фигура 7 показывает изменение концентрации натеглинида в плазме крови после введения таблеток натеглинида собакам породы бигль за 5 минут до кормления. Среднее ± СО, n = 3.
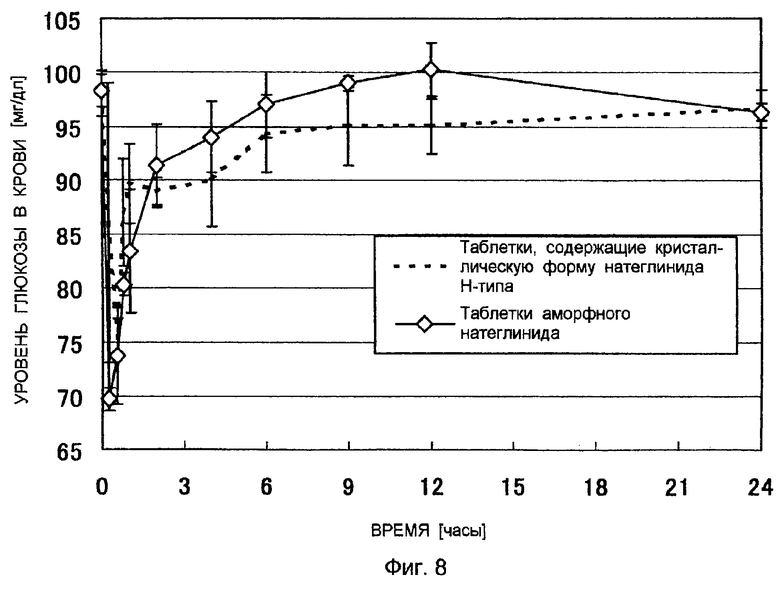
Фигура 8 показывает изменение уровня глюкозы в крови после введения таблеток натеглинида собакам породы бигль за 5 минут до кормления. Среднее ± СО, n = 3.
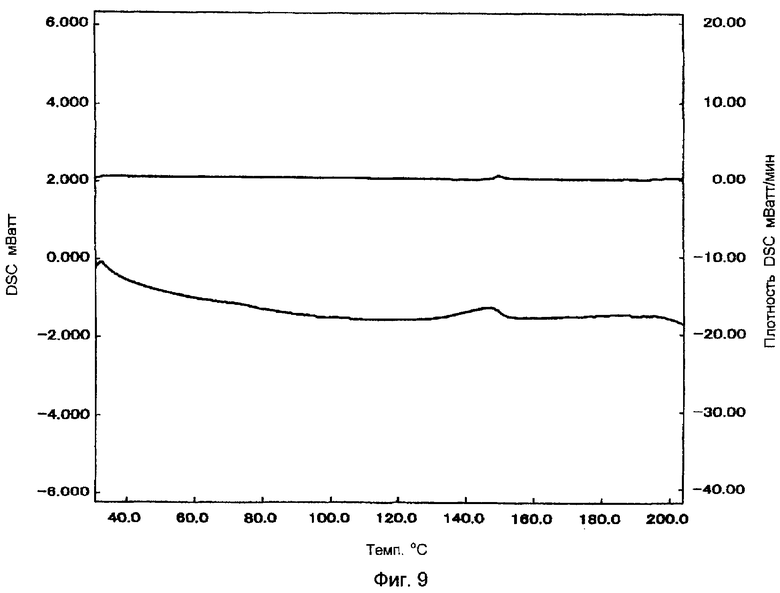
Фигура 9 показывает картину DSC таблеток аморфного натеглинида после шести месяцев консервации, упакованных в алюминиевом пакетике при 40°С, 75% ОВ.
Лучший вариант осуществления настоящего изобретения
Натеглинид, который представляет собой исходный материал аморфного натеглинида, содержащийся в фармацевтическом препарате по настоящему изобретению, можно синтезировать способом, описанным, например, в патентной публикации Японии № Hei 4-15221, а его кристаллические формы особым образом не ограничиваются.
Способы получения аморфного натеглинида включают, например, процесс удаления растворителя, процесс приложения высокого усилия сдвига, процесс гранулирования расплава и процесс растворения в фармацевтически приемлемом растворителе. Другие способы также являются приемлемыми, если они могут придавать натеглиниду аморфность. Среди указанных способов предпочтительными являются процесс удаления растворителя и процесс растворения в фармацевтически приемлемом растворителе с точки зрения простоты изготовления и т.п. Получение аморфного состояния можно осуществлять без носителя.
Гидрофильный материал является предпочтительным в качестве носителя, который делает натеглинид аморфным. Примеры включают водорастворимые полимеры, набухающие в воде полимеры, сахарные спирты и соли. Носителями могут быть любые из перечисленных агентов, которые могут делать натеглинид аморфным и быстро растворяются или набухают в воде. Добавляемое количество предпочтительно составляет 0,1 или более мас. частей по отношению к лекарственным средствам. Более предпочтительно оно составляет от 0,1 до 100 мас. частей и еще более предпочтительно от 0,1 до 50 мас. частей по отношению к натеглиниду.
Растворитель для растворения натеглинида предпочтительно представляет собой фармацевтически приемлемую жидкость при температуре около 37°С. Примерами их являются водорастворимые полимеры и поверхностно-активные вещества. Растворитель добавляют в количестве предпочтительно 0,1 или более мас. частей по отношению к лекарственным средствам. Более предпочтительно от 0,1 до 1000 мас. частей по отношению к натеглиниду и еще более предпочтительно от 0,1 до 100 мас. частей по отношению к натеглиниду. Предпочтительно добавлять его в количестве от 0 до 100 мас. частей и более предпочтительно от 0 до 50 мас. частей по отношению к носителю, который делает натеглинид аморфным.
Процесс удаления растворителя для получения аморфного натеглинида, используемого в фармацевтических препаратах по настоящему изобретению, представляет собой способ, при котором лекарственные средства и носитель для придания аморфного состояния растворяют в растворителе, а затем растворитель удаляют, чтобы придать лекарственным средствам аморфность. Растворителем может быть любой растворитель водного типа, органического типа или смешанного типа воды и органического растворителя, если только лекарственные средства и носитель могут в них растворяться. Конкретно, он включает спирты, такие как метанол, этанол и изопропиловый спирт, кетоны, такие как ацетон и метилэтилкетон, циклические простые эфиры, такие как диоксан и тетрагидрофуран, и ацетонитрил. Среди них предпочтительным является этанол. Когда используют смешанный тип воды и органического растворителя, их соотношение (соотношение масс) составляет предпочтительно вода: органический растворитель = от 99:1 до 1:99 и более предпочтительно от 90:10 до 10:90.
Пример процесса удаления растворителя включает способ, при котором лекарственные вещества и носитель, который делает натеглинид аморфным, такой как водорастворимые полимеры, растворяют в растворителе, таком как этанол, а затем раствор сушат в условиях вакуума, выпаривают или применяют какой-либо другой способ для удаления растворителя. Условия удаления растворителя особым образом не ограничиваются, если только в результате аморфный натеглинид может существовать в стабильной форме. Операцию можно осуществлять с использованием натеглинида и растворителя без носителя для придания аморфного состояния. Аморфный натеглинид можно подвергать процессу гранулирования в псевдоожиженном слое, процессу гранулирования перемешиванием с высокой скоростью, процессу сушки распылением, процессу нанесения покрытия и т.п., для получения гранул, содержащих аморфный натеглинид. Без удаления растворителей из раствора, в котором растворены натеглинид и носитель, который придает натеглиниду аморфность, раствор можно непосредственно подвергать процессу гранулирования в псевдоожиженном слое, процессу гранулирования перемешиванием с высокой скоростью, процессу сушки распылением, процессу нанесения покрытия и т.п., для получения гранулированного препарата, содержащего натеглинид. Условия гранулирования в псевдоожиженном слое и т.п. процессов специальным образом не ограничиваются, если только они обеспечивают аморфному натеглиниду стабильное существование. Операцию можно осуществлять только с одним натеглинидом. Полученные гранулы можно использовать в виде лекарственной формы, гранул или их можно затем прессовать в таблетки. Лекарственные формы препарата, содержащего натеглинид, по настоящему изобретению специальным образом не ограничиваются.
Способ приготовления препаратов путем приложения высокого усилия сдвига представляет собой способ, при котором к смеси лекарственных средств и носителя для придания натеглиниду аморфного состояния прилагается высокое усилие сдвига с помощью подходящего способа, придающего лекарственным средствам аморфность. Приложенное усилие сдвига особым образом не ограничивается, если оно может обеспечить аморфному натеглиниду стабильное существование. Операцию можно осуществлять только с одним натеглинидом.
Например, существует способ, при котором лекарственные средства и водорастворимые полимеры смешивают, а затем смесь совместно измельчают на ультрацентрифужной мельнице, или высокое усилие сдвига прилагается к смеси с использованием экструзионного гранулятора для получения гранул, содержащих аморфные лекарственные средства. Полученные гранулы можно использовать в виде лекарственной формы, гранул или их можно прессовать в таблетки. Лекарственные формы препарата, содержащего натеглинид, по настоящему изобретению специальным образом не ограничиваются.
Процесс гранулирования расплава представляет собой способ, при котором смесь лекарственных средств и носителя для придания аморфного состояния нагревают и расплавляют, а затем охлаждают и отверждают, чтобы сделать лекарственные средства аморфными.
Например, лекарственные средства и водорастворимые полимеры помещают в жаропрочный многоцелевой миксер или подобное устройство, пластицируют расплав с нагреванием и измельчают при охлаждении с получением гранул, содержащих аморфные лекарственные средства. Полученные гранулы можно использовать в виде лекарственных форм, гранул, или, пока сохраняется аморфное состояние, лекарственные формы препарата, содержащего натеглинид, по настоящему изобретению особым образом не ограничиваются. Операцию можно осуществлять только с одним натеглинидом.
Способ растворения в фармацевтически приемлемых жидких добавках представляет собой способ, при котором лекарственные средства растворяют в фармацевтически приемлемой жидкой добавке для придания лекарственным средствам аморфности. Например, это может быть способ, при котором лекарственные средства растворяют в водорастворимых полимерах, которые представляют собой жидкость при 37°С, для получения раствора. Данным раствором наполняют оболочки твердых желатиновых капсул или наполняют оболочки мягких желатиновых капсул, получая капсулы, наполненные жидкостью.
Препарат, содержащий аморфный натеглинид по настоящему изобретению, может дополнительно включать гидрофильные материалы. Гидрофильные материалы включают водорастворимые полимеры, набухающие в воде полимеры, сахарные спирты, соли и т.п. Гидрофильные материалы, как таковые, можно использовать и в качестве носителя, который придает натеглиниду аморфность, или также можно использовать другие материалы.
Примерами водорастворимых полимеров или набухающих в воде полимеров являются производные поливинилпирролидона, полисахаридные производные, производные полиакриловых кислот, производные полимолочных кислот, производные полиоксиэтилена, производные поливинилового спирта и поверхностно-активные вещества.
Производные поливинилпирролидона включают поперечно-связанный поливинилпирролидон, более конкретно кросповидон (COLIDONE CL-M, BASF).
Полисахаридные производные в качестве гидрофильных материалов включают производные целлюлозы и т.п. Примерами их являются метилцеллюлоза, гидроксипропилцеллюлоза и карбоксиметилцеллюлоза. Более конкретно, они включают метилцеллюлозу SM-4, гидроксипропилцеллюлозу SL и гидроксипропилцеллюлозу SSL. Производные полиакриловых кислот включают сополимер метакриловой кислоты L, сополимер метакриловой кислоты S и сополимер метакриловой кислоты LD (Rohm).
Производные полимолочных кислот включают сополимер молочной кислоты и гликолевой кислоты (1:1), имеющий молекулярную массу от 17000 до 24000.
В качестве примера производных полиоксиэтилена предпочтительным является полиэтиленгликоль. В частности, его молекулярная масса предпочтительно составляет от 200 до 20000 и более предпочтительно от 200 до 6000. Конкретно, он включает макрогол 300, 400, 600, 1000, 1500, 4000, 6000 или т.п.
Производные поливинилового спирта включают поливиниловые спирты (полностью омыленные вещества), поливиниловые спирты (частично омыленные вещества) и т.п.
Поверхностно-активные вещества включают полисорбат 80, лаурилсульфат натрия и т.п.
В качестве набухающих в воде полимеров предпочтительным является кросповидон (COLIDONE CL-M).
Сахарные спирты включают сорбит, ксилит, маннит и т.п. Среди них предпочтительным является маннит.
Соли включают хлорид, фосфаты, цитраты натрия и т.п.
Примеры
Следующие примеры, которые никоим образом не ограничивают изобретение, далее будут иллюстрировать настоящее изобретение.
Пример 1: Получение аморфного натеглинида
4 г натеглинида в кристаллической форме В-типа и 32 г поливинилпирролидона растворяли в этаноле. Этанол удаляли выпариванием (60°С) и смесь высушивали в условиях вакуума при 60°С в течение 3 часов или более. Твердый материал измельчали в ступке с получением 36 г натеглинида в форме твердой дисперсии.
Пример 2: Изготовление таблеток, содержащих аморфный натеглинид
60 г натеглинида (кристаллы В-типа), 4 г гидроксипропилцеллюлозы и 60 г кросповидона (COLIDONE CL-M, BASF) растворяли и суспендировали в 160 г этанола с получением связующего раствора. 180 г кросповидона (COLIDONE CL-M, BASF) и 96 г кристаллической целлюлозы помещали в гранулятор с псевдоожиженным слоем (тип FLO-1, Freund Industrial Co., Ltd.) и перемешивали. Затем связующий раствор распыляли на гранулят в псевдоожиженном слое (температура на входе: 80°С, скорость распыления: 4,9 г/мин, давление распыления: 1,8 кг силы/см2).
250 г полученных гранул и 3,8 г стеарата магния перемешивали в мешалке V-типа с получением гранул для таблетирования. Использовали ротационную таблетировочную машину (HT-AP15ssII, Hata Factory) со штампом 8 мм ⊘ - 14R2r с получением 253,8 г ядер таблеток (масса ядра таблетки 203,1 мг).
80 г гидроксипропилметилцеллюлозы, 15 г макрогола 6000, 24 г талька и 5 г оксида титана растворяли и суспендировали в 876 г воды с получением жидкости для покрытия. 300 г ядер таблеток помещали в устройство для нанесения покрытия на таблетки ("High Coater Mini", Freund Industrial Co., Ltd.). На таблетки наносили покрытие таким образом, что на одно ядро приходилось 2,54 г гидроксипропилметилцеллюлозы с получением 303,8 г таблеток с покрытием.
Изготовленные таблетки упаковывали в алюминиевый мешочек и проводили тест на стабильность при 50°С в течение одной недели или при 40°С, 75% ОВ, в течение одного месяца.
Пример 3: Изготовление капсул, наполненных жидкостью
186 мг натеглинида, 1456 мг макрогола 400 и 1456 мг полисорбата 80 перемешивали в мешалке при комнатной температуре до растворения и получения прозрачного раствора натеглинида. 500 мг раствора лекарственного средства наполняли капсулы 0 размера с получением капсул, содержащих жидкость (натеглинид: 30 мг).
Сравнительный пример 1: Изготовление капсулы 1, наполненной порошкообразным лекарственным средством
300 мг порошкообразного лекарственного средства натеглинида (кристаллы В-типа) наполняли желатиновую капсулу (размер 2) с получением капсулы, наполненной порошкообразным лекарственным средством - натеглинидом в форме В-типа.
Сравнительный пример 2: Изготовление капсулы 2, наполненной порошкообразным лекарственным средством
30 мг порошкообразного лекарственного средства натеглинида (кристаллы Н-типа) наполняли желатиновую капсулу (размер 2) с получением капсулы, наполненной порошкообразным лекарственным средством - натеглинидом в форме Н-типа.
Сравнительный пример 3: Изготовление таблеток с использованием натеглинида в форме кристаллов Н-типа
Ядро таблетки (масса: 120 мг) 7 мм ⊘ - 9R2r получали с использованием натеглинида (кристаллы Н-типа) согласно примеру 1 патентной публикации Японии № Hei 10-194969. Затем на него наносили покрытие с получением таблетки с покрытием, содержащей натеглинид в форме кристаллов Н-типа.
Пример 4: Измерение DSC
Таблетки, изготовленные в примере 2, измельчали в агатовой ступке и приблизительно 10 мг порошка помещали на серебряный поддон и запечатывали серебряной крышкой. Затем измеряли DSC с использованием инструмента SII-DSC в условиях повышения температуры от 25°С до 250°С, со скоростью нагревания: 5°С/мин. Результаты представлены на фигуре 1. Их сравнивали с результатами, полученными с порошкообразным лекарственным средством натеглинидом в форме В-типа (фигура 2) и результатами, полученными с порошкообразным лекарственным средством натеглинидом в форме Н-типа (фигура 3). Как видно из фигур 1-3, подтвердилось, что таблетки, изготовленные в примере 2, содержали аморфный натеглинид, поскольку они не показали абсорбции, которая характерна для кристаллов натеглинида.
Между тем, производили испытание консервированного образца препаратов примера 2 с использованием той же процедуры. Полученные картины DSC (фигура 4 и фигура 5) были такими же, как те, которые были получены до проведения теста на консервацию. Следовательно, было подтверждено, что натеглинид не кристаллизовался и был аморфным (не наблюдалось перехода кристаллических форм).
Пример 5: Измерение скорости растворения
Свойства растворения препаратов, изготовленных в примере 2 и примере 3, измеряли в 900 мл второй жидкости теста на дезинтеграцию Японской Фармакопеи, в соответствии с Японской Фармакопеей (далее упоминается как JP), глава 13, способ трамбования (50 об/мин). Результаты представлены на фигуре 6. Препараты, изготовленные в сравнительных примерах 1-3, измеряли тем же способом, который упомянут выше. Результаты представлены на фигуре 6.
Как видно из фигуры 6, скорости растворения таблеток, изготовленных в примере 2, и наполненных жидкостью капсул, изготовленных в примере 3, в которых натеглинид находился в аморфном состоянии, улучшаются по сравнению с теми же показателями для капсул, наполненных порошкообразным лекарственным средством, изготовленных в сравнительном примере 1 и сравнительном примере 2. Средняя скорость растворения таблеток, содержавших аморфный натеглинид, и наполненных жидкостью капсул в каждый момент времени подтверждалась как соответствующая тем же показателям растворения, что и для таблеток натеглинида (таблетки с использованием кристаллов Н-типа) сравнительного примера 3.
Между тем, свойства растворения препаратов, изготовленных в примере 2, и их же после теста на консервацию измеряли в 500 мл второй жидкости теста на дезинтеграцию Японской Фармакопеи в соответствии с JP, глава 13, способ трамбования (50 об/мин, спустя 30 минут). Результаты представлены в таблице 1. Как видно из таблицы 1, никакого изменения степени растворения не наблюдалось ни до, ни после теста на консервацию.
Пример 6: Оценка абсорбционной способности после перорального введения собакам породы бигль
Профиль концентрации натеглинида в плазме крови, изменение уровня глюкозы в плазме крови и фармакокинетический параметр оценивали после введения собакам породы бигль за пять минут до кормления таблеток аморфного натеглинида, полученных в примере 2, и таблеток натеглинида в кристаллической форме Н-типа, полученных в сравнительном примере 3. Результаты представлены на фигуре 7, фигуре 8 и в таблице 2.
Выяснилось, что таблетки аморфного натеглинида демонстрируют эквивалентную или лучшую абсорбционную способность при пероральном введении и эффективность по сравнению с таблетками натеглинида в кристаллической форме Н-типа.
Таблица 2: Фармакокинетический параметр после введения таблеток натеглинида собакам породы бигль за пять минут до кормления (n=3)
Пример 7: Оценка стабильности таблеток аморфного натеглинида при хранении
Таблетки аморфного натеглинида, полученные в примере 2, упаковывали в алюминиевый мешочек и сохраняли при 40°С, 75% ОВ в течение шести месяцев. Свойства растворения оценивали в 500 мл второй жидкости теста на дезинтеграцию JP, в соответствии с JP, глава 13, способ трамбования (50 об/мин, спустя 30 минут). Результаты представлены в таблице 3, а картина DSC показана на фигуре 9.
Как до, так и после хранения никаких изменений в скорости растворения и характере DSC на наблюдалось. Это показывает, что таблетки аморфного натеглинида представляют собой препарат, имеющий высокую стабильность при хранении.
Таблица 3: Сравнение растворимости до и после хранения
Как видно из каждой фигуры и таблицы 1, аморфный натеглинид, который использовали в препарате по настоящему изобретению, не переходит в кристаллические формы в процессе его изготовления и хранения. Согласно настоящему изобретению, которое относится к препарату с использованием аморфного натеглинида, поскольку он содержит натеглинид, пригодный в качестве антидиабетического агента, в некристаллической форме, возможно изготовление препаратов, имеющих хорошие свойства растворения, эквивалентные указанным свойствам препаратов, содержащих кристаллический натеглинид.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГИДРОФИЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ, СОДЕРЖАЩИЙ НАТЕГЛИНИД | 2001 |
|
RU2283104C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ДИАЦЕРЕИН | 2009 |
|
RU2542461C2 |
| ТАБЛЕТКА, БЫСТРО РАСПАДАЮЩАЯСЯ В ЩЕЧНОМ КАРМАНЕ, И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 1998 |
|
RU2204996C2 |
| НЕПОСРЕДСТВЕННО ПРЕССУЕМАЯ МАТРИЦА ДЛЯ РЕГУЛИРУЕМОГО ВЫСВОБОЖДЕНИЯ ОДНОКРАТНЫХ ЕЖЕДНЕВНЫХ ДОЗ КЛАРИТРОМИЦИНА | 2000 |
|
RU2237480C2 |
| ЧАСТИЦЫ АНТАГОНИСТА CRTH2 | 2008 |
|
RU2468012C2 |
| КОМПОЗИЦИЯ ТАБЛЕТКИ ЛЕНАЛИДОМИДА ДЛЯ ПЕРОРАЛЬНОГО ПРИЕМА | 2017 |
|
RU2725074C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ТЕТРАМЕТИЛТЕТРААЗОБИЦИКЛООКТАНДИОНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2611194C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2008 |
|
RU2470637C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АМОРФНЫЙ ЭМОДЕПСИД | 2012 |
|
RU2651761C2 |
| НОВЫЕ КРИСТАЛЛИЧЕСКИЕ ФОРМЫ | 2007 |
|
RU2446156C2 |

Изобретение относится к препарату, содержащему натеглинид, для лечения диабета, включающий натеглинид в качестве активного ингредиента и носитель, где натеглинид является аморфным и указанный носитель представляет собой гидрофильный материал. Аморфность кристаллическому натеглиниду придается следующими способами: 1) растворением кристаллов натеглинида в фармакологически приемлемом растворителе вместе с гидрофильными материалами, выбранными из группы, состоящей из водорастворимых полимеров, набухающих в воде полимеров, сахарных спиртов и солей, с последующим гранулированием в псевдоожиженом слое, гранулированием с использованием перемешивания с высокой скоростью, сушкой распылением и процесса нанесения покрытия для гранулирования аморфного натеглинида; 2) смешением кристаллов натеглинида с гидрофильными материалами, выбранными из группы водорастворимых полимеров, набухающих в воде полимеров, сахарных спиртов и солей с последующим приложением к полученной смеси высокого усилия сдвига; 3) смешением кристаллов натеглинида с гидрофильными материалами, выбранными из группы водорастворимых полимеров, набухающих в воде полимеров, сахарных спиртов и солей с последующим пластицированием полученной смеси в расплаве с нагреванием и измельчением при охлаждении; 4) растворением кристаллов натеглинида в фармакологически приемлемых жидких добавках, где жидкие добавки представляют собой водорастворимые полимеры, которые являются жидкими при 37°С. Использование аморфного натеглинида позволяет получать препарат натеглинида с немедленным высвобождением, в котором скорость растворения лекарственных средств является высокой, а во время изготовления или консервирования препаратов не происходит кристаллического перехода. 6 н. и 15 з.п. ф-лы, 3 табл., 9 ил.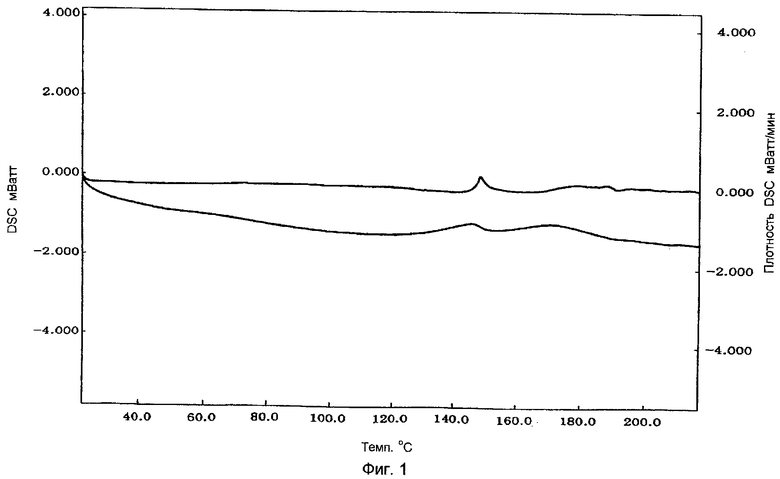
| Трусы-подгузники | 1978 |
|
SU965339A3 |
| ПРОДУКТ, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ПРОГЛАТЫВАНИЯ (ВАРИАНТЫ), СПОСОБ СНИЖЕНИЯ ГОРЕЧИ В ПРОДУКТЕ, ПРЕДНАЗНАЧЕННОМ ДЛЯ ПРОГЛАТЫВАНИЯ | 1991 |
|
RU2050795C1 |
Авторы
Даты
2006-03-20—Публикация
2001-10-23—Подача