ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новым производным 5-амидино-2-гидроксибензолсульфонамида или их фармацевтически приемлемым солям, применяемым в качестве лекарственных средств.
Более конкретно, настоящее изобретение относится к производным 5-амидино-2-гидроксибензолсульфонамида или их фармацевтически приемлемым солям, обладающим отличной ингибирующей активностью по отношению к активированному фактору X системы свертывания крови и применяемым в качестве ингибиторов активированного фактора X системы свертывания крови, к содержащим их фармацевтическим композициям, их фармацевтическому применению и промежуточным продуктам для их получения.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Антикоагулянтная терапия широко применялась для профилактики и лечения тромбоэмболических заболеваний, обусловленных ускоренным образованием кровяного сгустка, и в настоящее время в качестве противосвертывающих средств часто применяются такие лекарственные средства, как гепарин и варфарин-калий.
Однако было показано, что гепарин обладает антитромбиновой активностью и ингибирующей активностью по отношению к активированному фактору X системы свертывания крови и склонен обуславливать кровотечения.
Варфарин-калий представляет собой противосвертывающее средство, которое контролирует биосинтез витамин K-зависимого фактора свертывания, и при использовании данного лекарственного средства для профилактики и лечения тромбоэмболических заболеваний вследствие механизма его действия сложно осуществлять контроль антикоагулянтной активности. Поэтому данное лекарственное средство очень сложно использовать в клинической практике.
В последние годы были разработаны и использовались в клинической практике избирательные ингибиторы тромбина. Однако вследствие того, что тромбин играет близкую роль в превращении фибриногена в фибрин в каскаде реакций свертывания крови и активации и агрегации тромбоцитов, с точки зрения безопасности ингибиторы тромбина также обладают сходными с гепарином проблемами, такими как склонность к кровотечению, и сообщалось, что их эффекты необязательно являются достаточными.
С другой стороны, активированный фактор X системы свертывания крови, действующий в точке объединения внешнего и внутреннего каскада реакций свертывания крови, располагается в каскаде выше тромбина, поэтому ингибирование свертывания является более эффективным по сравнению с ингибиторами тромбина, а ингибиторы активированного фактора X системы свертывания крови привлекают внимание в качестве лекарственных средств, возможно обладающих большей ингибирующей эффективностью по отношению к системе свертывания крови.
Кроме того, в связи с изменениями в европейском и американском образе жизни и увеличением числа жителей пожилого возраста в последние годы частота возникновения тромбоэмболических заболеваний, таких как инфаркт миокарда и артериовенозная блокада, продолжает расти, и, следовательно, необходимость разработок более эффективных противосвертывающих средств для их лечения является высоко социально значимой задачей и все более и более возрастает.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения интенсивно занимались изысканием новых соединений, обладающих отличной ингибирующей активностью по отношению к активированному фактору X системы свертывания крови. В результате неожиданно было обнаружено, что обычные производные 5-амидино-2-гидроксибензолсульфонамида обладают мощной и избирательной ингибирующей активностью по отношению к активированному фактору X системы свертывания крови, составляя тем самым основу настоящего изобретения.
Настоящее изобретение относится к новым соединениям, обладающим сильной и избирательной ингибирующей активностью по отношению к активированному фактору X системы свертывания крови.
То есть настоящее изобретение относится к производному 5-амидино-2-гидроксибензолсульфонамида, представленному общей формулой:

где R1 представляет собой атом водорода или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (A);
(A) -COORA, -CONRBRC, 3-10-членная циклоалкильная группа, 6-10-членная арильная группа, 3-10-членная гетероциклоалкильная группа, которая может содержать оксогруппу, и 5-10-членная ароматическая гетероциклическая группа, которая может содержать оксогруппу или низшую алкильную группу;
где RA представляет собой атом водорода, 3-10-членную циклоалкильную группу или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (i);
(i) -COORA1, в которой RA1 является атомом водорода, 3-10-членной циклоалкильной группой или низшей алкильной группой, -OCORA2, в которой RA2 является 3-10-членной циклоалкильной группой или низшей алкильной группой, -OCOORA3, в которой RA3 является 3-10-членной циклоалкильной группой или низшей алкильной группой, -ORA4, в которой RA4 является атомом водорода, 3-10-членной циклоалкильной группой или низшей алкильной группой, -CONRA5RA6, в которой RA5 и RA6 независимо являются атомом водорода или низшей алкильной группой, или -NRA5RA6 образует циклическую аминогруппу, 3-10-членную циклоалкильную группу, 6-10-членную арильную группу, 3-10-членную гетероциклоалкильную группу и 5-10-членную ароматическую гетероциклическую группу;
где RB и RC независимо представляют собой атом водорода или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (ii), или -NRBRC образует циклическую аминогруппу;
(ii) -COORB1, в которой RB1 является атомом водорода, 3-10-членной циклоалкильной группой или низшей алкильной группой, -CONRB2RC2, в которой RB2 и RC2 независимо являются атомом водорода или низшей алкильной группой, или -NRB2RC2 образует циклическую аминогруппу, 3-10-членную циклоалкильную группу, 6-10-членную арильную группу, 3-10-членную гетероциклоалкильную группу и 5-10-членную ароматическую гетероциклическую группу;
Т представляет собой атом кислорода, атом серы или сульфонильную группу; или TR1 представляет собой -SO2NRB3RC3, в которой RB3 и RC3 независимо являются атомом водорода или низшей алкильной группой;
R2 представляет собой дизамещенную низшими алкилами аминогруппу, низшую алкильную группу, 3-10-членную циклоалкильную группу, 6-10-членную арильную группу, которая может содержать 1-3 заместителя, выбранных из следующей группы (В), 3-10-членную гетероциклоалкильную группу, которая может содержать оксогруппу, или 5-10-членную ароматическую гетероциклическую группу, которая может содержать заместитель, выбранный из следующей группы (C);
(B) оксогруппа, низшая алкильная группа, замещенная галогеном низшая алкильная группа, -Y-RD, атом галогена, нитрогруппа, аминогруппа, -COORЕ, карбамоильная группа, сульфамоильная группа, низшая алкилсульфонильная группа, монозамещенная низшим алкилом сульфамоильная группа, которая может содержать -COORF, и замещенная низшей алкилсульфониламиногруппой низшая алкильная группа;
где Y представляет собой атом кислорода или атом серы;
RD представляет собой атом водорода, замещенную галогеном низшую алкильную группу или низшую алкильную группу, которая может содержать -COORD1, в которой RD1 является атомом водорода, 3-10-членной циклоалкильной группой или низшей алкильной группой;
RE представляет собой атом водорода, 3-10-членную циклоалкильную группу или низшую алкильную группу;
RF представляет собой атом водорода, 3-10-членную циклоалкильную группу или низшую алкильную группу;
(C) низшая алкильная группа, аминогруппа и -COORG;
где RG является атомом водорода, 3-10-членной циклоалкильной группой или низшей алкильной группой;
Q представляет собой атом водорода или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (D);
(D) -ORH, -COORI, -CONRJRK, 6-10-членная арильная группа, которая может содержать 1-3 заместителя, выбранных из следующей группы (iii), и 5-10-членная ароматическая гетероциклическая группа, которая может содержать 1-3 заместителя, выбранных из следующей группы (iv);
где RH представляет собой атом водорода или низшую алкильную группу, которая может содержать -ORH1, в которой RH1 является атомом водорода или низшей алкильной группой;
RI независимо имеет то же значение, что и RА;
RJ и RK независимо представляют собой атом водорода, 6-10-членную арильную группу, которая может содержать карбамоильную группу, 5-10-членную ароматическую гетероциклическую группу, которая может содержать заместитель, выбранный из следующей группы (v), или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (vi), или -NRJRK образует циклическую аминогруппу, которая может содержать заместитель, выбранный из следующей группы (vii);
(v) атом галогена, низшая алкильная группа, карбамоильная группа и -COORJ1, в которой RJ1 является атомом водорода или низшей алкильной группой;
(vi) -ORJ2, в которой RJ2 является атомом водорода или низшей алкильной группой, и 5-10-членная ароматическая гетероциклическая группа;
(vii) гидроксигруппа, низшая алкильная группа, замещенная гидроксигруппой низшая алкильная группа, карбамоильная группа, дизамещенная низшими алкилами аминогруппа, низшая ацильная группа и -COORJ3, в которой RJ3 является атомом водорода или низшей алкильной группой;
(iii) атом галогена, нитрогруппа, низшая алкильная группа, -ORL, в которой RL является атомом водорода или низшей алкильной группой, и -COORM, в которой RM является атомом водорода или низшей алкильной группой;
(iv) атом галогена, оксогруппа, низшая алкильная группа и фенильная группа; и
Z представляет собой атом водорода, гидроксильную группу или -COORN, где RN представляет собой замещеную галогеном низшую алкильную группу, 6-10-членную арильную группу или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (viii);
(viii) -ORN1, в которой RN1 является атомом водорода или низшей алкильной группой, -COORN2, в которой RN2 является низшей алкильной группой, которая может содержать -COORN21, где RN21 является низшей алкильной группой, -CONRN3RN4, в которой RN3 и RN4 независимо являются атомом водорода или низшей алкильной группой, или -NRN3RN4 образует циклическую аминогруппу, -OCORN5, в которой RN5 является низшей алкильной группой, которая может содержать -OCORN51, где RN51 является низшей алкильной группой, 3-10-членной гетероциклоалкильной группой и 6-10-членной арильной группой;
или его фармацевтически приемлемой соли.
Настоящее изобретение также относится к фармацевтической композиции, включающей в качестве активного ингредиента производное 5-амидино-2-гидроксибензолсульфоната, представленное выше общей формулой (I), или его фармацевтически приемлемую соль.
Настоящее изобретение относится к ингибитору активированного фактора X системы свертывания крови, включающему в качестве активного ингредиента производное 5-амидино-2-гидроксибензолсульфоната, представленное выше общей формулой (I), или его фармацевтически приемлемую соль.
Настоящее изобретение относится к средству для профилактики или лечения заболевания, ассоциированного с активированным фактором X системы свертывания крови, включающему в качестве активного ингредиента производное 5-амидино-2-гидроксибензолсульфоната, представленное выше общей формулой (I), или его фармацевтически приемлемую соль.
Настоящее изобретение относится к способу профилактики или лечения заболевания, ассоциированного с активированным фактором X системы свертывания крови, включающему введение терапевтически эффективного количества производного 5-амидино-2-гидроксибензолсульфоната, представленного выше общей формулой (I), или его фармацевтически приемлемой соли.
Настоящее изобретение относится к применению производного 5-амидино-2-гидроксибензолсульфоната, представленного выше общей формулой (I), или его фармацевтически приемлемой соли, для производства фармацевтической композиции для профилактики или лечения заболевания, ассоциированного с активированным фактором X системы свертывания крови.
Кроме того, настоящее изобретение относится к производному 5-циано-2-гидроксибензолсульфонамида, представленному общей формулой:
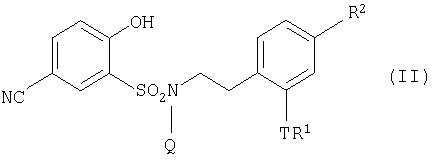
где R1 представляет собой атом водорода или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (A);
(A) -COORA, -CONRBRC, 3-10-членная циклоалкильная группа, 6-10-членная арильная группа, 3-10-членная гетероциклоалкильная группа, которая может содержать оксогруппу, и 5-10-членная ароматическая гетероциклическая группа, которая может содержать оксогруппу или низшую алкильную группу;
где RA представляет собой атом водорода, 3-10-членную циклоалкильную группу или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (i);
(i) -COORA1, в которой RA1 является атомом водорода, 3-10-членной циклоалкильной группой или низшей алкильной группой, -OCORA2, в которой RA2 является 3-10-членной циклоалкильной группой или низшей алкильной группой, -OCOORA3, в которой RA3 является 3-10-членной циклоалкильной группой или низшей алкильной группой, -ORA4, в которой RA4 является атомом водорода, 3-10-членной циклоалкильной группой или низшей алкильной группой, -CONRA5RA6, в которой RA5 и RA6 независимо являются атомом водорода или низшей алкильной группой, или -NRA5RA6 образует циклическую аминогруппу, 3-10-членную циклоалкильную группу, 6-10-членную арильную группу, 3-10-членную гетероциклоалкильную группу и 5-10-членную ароматическую гетероциклическую группу;
где RB и RC независимо представляют собой атом водорода или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (ii), или -NRBRC образует циклическую аминогруппу;
(ii) -COORB1, в которой RB1 является атомом водорода, 3-10-членной циклоалкильной группой или низшей алкильной группой, -CONRB2RC2, в которой RB2 и RC2 независимо являются атомом водорода или низшей алкильной группой, или -NRB2RC2 образует циклическую аминогруппу, 3-10-членную циклоалкильную группу, 6-10-членную арильную группу, 3-10-членную гетероциклоалкильную группу и 5-10-членную ароматическую гетероциклическую группу;
Т представляет собой атом кислорода, атом серы или сульфонильную группу; или TR1 представляет собой -SO2NRB3RC3, в которой RB3 и RC3 независимо являются атомом водорода или низшей алкильной группой;
R2 представляет собой дизамещенную низшими алкилами аминогруппу, низшую алкильную группу, 3-10-членную циклоалкильную группу, 6-10-членную арильную группу, которая может содержать 1-3 заместителя, выбранных из следующей группы (В), 3-10-членную гетероциклоалкильную группу, которая может содержать оксогруппу, или 5-10-членную ароматическую гетероциклическую группу, которая может содержать заместитель, выбранный из следующей группы (C);
(B) оксогруппа, низшая алкильная группа, замещенная галогеном низшая алкильная группа, -Y-RD, атом галогена, нитрогруппа, аминогруппа, -COORЕ, карбамоильная группа, сульфамоильная группа, низшая алкилсульфонильная группа, монозамещенная низшим алкилом сульфамоильная группа, которая может содержать -COORF, и замещенная низшей алкилсульфониламиногруппой низшая алкильная группа;
где Y представляет собой атом кислорода или атом серы;
RD представляет собой атом водорода, замещенную галогеном низшую алкильную группу или низшую алкильную группу, которая может содержать -COORD1, в которой RD1 является атомом водорода, 3-10-членной циклоалкильной группой или низшей алкильной группой;
RE представляет собой атом водорода, 3-10-членную циклоалкильную группу или низшую алкильную группу;
RF представляет собой атом водорода, 3-10-членную циклоалкильную группу или низшую алкильную группу;
(C) низшая алкильная группа, аминогруппа и -COORG;
где RG представляет собой атом водорода, 3-10-членную циклоалкильную группу или низшую алкильную группу;
Q представляет собой атом водорода или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (D);
(D) -ORH, -COORI, -CONRJRK, 6-10-членная арильная группа, которая может содержать 1-3 заместителя, выбранных из следующей группы (iii), и 5-10-членная ароматическая гетероциклическая группа, которая может содержать 1-3 заместителя, выбранных из следующей группы (iv);
где RH представляет собой атом водорода или низшую алкильную группу, которая может содержать -ORH1, в которой RH1 является атомом водорода или низшей алкильной группой;
RI независимо имеет то же самое значение, что и RА;
RJ и RK независимо представляют собой атом водорода, 6-10-членную арильную группу, которая может содержать карбамоильную группу, 5-10-членную ароматическую гетероциклическую группу, которая может содержать заместитель, выбранный из следующей группы (v), или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (vi), или -NRJRK образует циклическую аминогруппу, которая может содержать заместитель, выбранный из следующей группы (vii);
(v) атом галогена, низшая алкильная группа, карбамоильная группа и -COORJ1, в которой RJ1 является атомом водорода или низшей алкильной группой;
(vi) -ORJ2, в которой RJ2 является атомом водорода, низшей алкильной группой или 5-10-членной ароматической гетероциклической группой;
(vii) гидроксигруппа, низшая алкильная группа, замещенная гидроксигруппой низшая алкильная группа, карбамоильная группа, дизамещенная низшими алкилами аминогруппа, низшая ацильная группа и -COORJ3, в которой RJ3 является атомом водорода или низшей алкильной группой;
(iii) атом галогена, нитрогруппа, низшая алкильная группа, -ORL, в которой RL является атомом водорода или низшей алкильной группой, и -COORM, в которой RM является атомом водорода или низшей алкильной группой; и
(iv) атом галогена, оксогруппа, низшая алкильная группа и фенильная группа;
или его соли.
В настоящем изобретении термин «низшая алкильная группа» означает содержащую от 1 до 6 атомов углерода алкильную группу с неразветвленной или разветвленной цепью, такую как метильная группа, этильная группа, пропильная группа, изопропильная группа, бутильная группа, изобутильная группа, втор-бутильная группа, пентильная группа, изопентильная группа, неопентильная группа, 1-метилбутильная группа, 2-метилбутильная группа, гексильная группа и тому подобное. Термин «низшая алкилсульфонильная группа» означает содержащую определенную выше низшую алкильную группу сульфонильную группу, такую как метансульфонильная группа, этансульфонильная группа, пропансульфонильная группа, изопропансульфонильная группа, бутансульфонильная группа, изобутансульфонильная группа, втор-бутансульфонильная группа, пентансульфонильная группа, изопентансульфонильная группа, неопентансульфонильная группа, гексансульфонильная группа и тому подобное. Термин «монозамещенная низшим алкилом сульфамоильная группа» означает моноалкилсульфамоильную группу, где алкильный заместитель является тем же, что и определенная выше низшая алкильная группа. Термин «дизамещенная низшими алкилами аминогруппа» означает аминогруппу, замещенную двумя одинаковыми или разными определенными выше низшими алкильными группами. Термин «замещенная низшей алкилсульфониламиногруппой низшая алкильная группа» означает определенную выше алкильную группу, содержащую аминогруппу, N-замещенную определенной выше низшей алкилсульфонильной группой. Термин «замещенная гидроксигруппой низшая алкильная группа» означает содержащую от 2 до 6 атомов углерода алкильную группу с неразветвленной или разветвленной цепью, замещенную гидроксигруппой. Термин «низшая ацильная группа» означает содержащую от 2 до 6 атомов углерода алкоксикарбонильную группу с неразветвленной или разветвленной цепью, такую как ацетильная группа, пропионильная группа, бутирильная группа, изобутирильная группа, валерильная группа, гексаноильная группа и тому подобное. Термин «низшая алкиленовая группа» означает содержащую от 1 до 6 атомов углерода алкиленовую группу с неразветвленной или разветвленной цепью, такую как метиленовая группа, этиленовая группа, триметиленовая группа, пропиленовая группа и тому подобное.
Термин «3-10-членная циклоалкильная группа» означает 3-7-членную моноциклическую алифатическую алкильную группу, такую как циклопропильная группа, циклобутильная группа, циклопентильная группа, циклогексильная группа или циклогептильная группа, или конденсированную с бензольным кольцом циклопентильную или циклогексильную группу. Термин «6-10-членная арильная группа» означает фенильную группу, нафтильную группу, или фенильную группу, конденсированную с циклопентановым кольцом или циклогексановым кольцом.
Термин «3-10-членная гетероциклоалкильная группа» означает 3-7-членную моноциклическую гетероалкильную группу, содержащую в составе кольца 1-2 гетероатома, выбранных из атома азота, атома кислорода или атома серы, или бициклическую гетероалкильную группу, которая является конденсированной с бензолом 5- или 6-членной определенной выше моноциклической гетероалкильной группой, а в качестве примеров подобных групп могут быть представлены, например, одновалентная группа, полученная из морфолина, тиоморфолина, пирролидина, имидазолина, оксазолина, пиперидина, пиперазина, тетрагидрофурана, азиридина, азетидина, индолина, изоиндолина, хромана, изохромана и тому подобное. В качестве примеров содержащей оксогруппу гетероциклоалкильной группы могут быть представлены, например, одновалентная группа, полученная из 2-оксазолидона и тому подобное.
Термин «5-10-членная ароматическая гетероциклическая группа» означает 5-6-членную моноциклическую ароматическую группу, содержащую в составе кольца 1-4 гетероатома, выбранных из атома азота, атома кислорода или атома серы, или бициклическую гетероалкильную группу, которая является конденсированной с бензолом или пиридином 5- или 6-членной определенной выше моноциклической ароматической группой, а в качестве примеров подобных групп могут быть представлены, например, одновалентная группа, полученная из пиридина, пиримидина, пиразина, пиридазина, пиррола, тиофена, оксазола, тиазола, имидазола, пиразола, оксадиазола, тиодиазола, тетразола, индола, индолизина, бензофурана, бензотиофена, хинолина, изохинолина, фталазина, нафтиридина, хиноксалина, хиназолина, цинолина и тому подобное. В качестве примеров содержащей оксогруппу ароматической гетероциклической группы могут быть представлены, например, одновалентная группа, полученная из 1,3,4-оксадиазол-2-она и тому подобное.
Термин «циклическая аминогруппа» означает 5-6-членную моноциклическую аминогруппу, содержащую в составе кольца 1 гетероатом, выбранный из атома азота, атома кислорода или атома серы и отличный от атома азота в месте связывания, такую как 1-пирролодинильная группа, пиперидиногруппа, морфолиногруппа, тиоморфолиногруппа, 1-пиперазинильная группа и тому подобное.
Термин «атом галогена» означает атом фтора, атом хлора, атом брома или атом йода. Термин «замещенная галогеном низшая алкильная группа» означает определенную выше алкильную группу, замещенную 1-3 определенными выше атомами галогена, такую как трифторметильная группа, 2,2,2-трифторэтильная группа и тому подобное.
Термин «гидроксизащитная группа» означает обычно применяемую в органическом синтезе гидроксизащитную группу, описанную в PROTECTIVE GROUPS IN ORGANIC SYNTHESIS, THEODORA W.GREENE, PETER G.WUTS by JOHN WILEY&SONS, INC, такую как бензильная группа, метоксиметильная группа, ацетильная группа и тому подобное.
Например, представленные выше общей формулой (I) соединения по настоящему изобретению могут быть получены путем взаимодействия производного 5-циано-2-гидроксибензолсульфонамида, представленного выше общей формулой (II), или его соли, со спиртом в присутствии хлороводорода (здесь и далее обозначаемый как способ 1), с последующим обеспечением взаимодействия полученного соединения с аммиаком или его солью, или с гидроксиламином или его солью (здесь и далее обозначаемый как способ 2), выполняя, по необходимости, подлежащим образом 1-4 способа, выбранных из группы, состоящей из (1) гидролиза полученной сложноэфирной группы (здесь и далее обозначаемый как способ 3), (2) сложноэфирного обмена или этерификации полученного соединения с применением спирта, представленного общей формулой:

где RA имеет то же значение, что и определено выше, или этерификации полученного соединения с применением соединения, представленного общей формулой:

где X1 представляет собой уходящую группу, такую как атом галогена, толуолсульфонилоксигруппа, метансульфонилоксигруппа и тому подобное; и RA имеет то же значение, что и определено выше (здесь и далее обозначаемый как способ 4), (3) введение защитной группы в фенольную гидроксигруппу (здесь и далее обозначаемый как способ 5) и (4) N-ацилирование полученного соединения с применением соединения, представленного общей формулой:

где X2 представляет собой уходящую группу, такую как атом галогена, 4-нитрофеноксигруппа и тому подобное; и RN имеет то же значение, что и определено выше, и подвергая, по необходимости, снятию защитной группы фенольной гидроксигруппы или O-дезацилированию обычным способом.
В вышеуказанном способе получения подробное описание получения производного 5-амидино-2-гидроксибензолсульфонамида, представленного выше общей формулой (I), из производного 5-циано-2-гидроксибензолсульфонамида, представленного выше общей формулой (II), является следующим.
Способ 1
Соответствующий имидат может быть получен путем взаимодействия производного 5-циано-2-гидроксибензолсульфонамида, представленного выше общей формулой (II), со спиртом, таким как метанол или этанол, в присутствии галогенводорода, такого как хлороводрод или бромоводород, обычно при температуре от -20°C до комнатной температуры. В качестве примеров применяемых растворителей могут быть представлены метанол, этанол, смесь данного спирта с тетрагидрофураном, дихлорметаном или N,N-диметилформамидом и тому подобное. В зависимости от видов и объемов применяемого исходного материала и растворителя время реакции обычно составляет от 1 часа до 3 суток.
Способ 2
Соответствующее амидиносоединение может быть получено путем взаимодействия имидата с аммиаком или солью аммония, такой как карбонат аммония, хлорид аммония или ацетат аммония, или гидроксиламином или его солью, в присутствии или в отсутствие основания, такого как триэтиламин, обычно при температуре от 0°C до комнатной температуры. В качестве примеров применяемых растворителей могут быть представлены метанол, этанол, тетрагидрофуран, дихлорметаном и тому подобное. В зависимости от видов и объемов применяемого исходного материала и растворителя время реакции обычно составляет от 1 часа до 3 суток.
Способ 3
В случае соединений, имеющих сложноэфирную группу в амидинопроизводных, полученных по способу 2, соответствующая карбоновая кислота может быть получена путем гидролиза такого соединения с применением кислоты, такой как хлористо-водородная кислота или серная кислота, обычно при температуре от комнатной до температуры дефлегмации, или основания, такого как гидроксид натрия, обычно при температуре от 0°C до температуры дефлегмации. В качестве примеров применяемых растворителей могут быть представлены вода, ацетонитрил, тетрагидрофуран, спирты, их смесь и тому подобное. В зависимости от видов и объемов применяемого исходного материала и растворителя время реакции обычно составляет от 1 часа до 2 суток.
Способ 4
Соответствующий сложный эфир может быть получен путем 1) сложноэфирного обмена или этерификации содержащего сложноэфирную группу или карбоксигруппу амидинопроизводного, полученного по способу 2 или 3, с применением спирта, представленного выше общей формулой (III), в присутствии кислоты, такой как хлористо-водородная кислота, серная кислота или пара-толуолсульфоновая кислота, обычно при температуре от 0°C до температуры дефлегмации, путем 2) этерификации содержащего карбоксигруппу амидинопроизводного, полученного по способу 2 или 3, с применением спирта, представленного выше общей формулой (III), в присутствии конденсирующего агента, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид, обычно при температуре от 0°C до температуры дефлегмации, или путем 3) этерификации содержащего карбоксигруппу амидинопроизводного, полученного в способе 2 или 3, с применением соединения, представленного выше общей формулой (IV), в присутствии основания, такого как карбонат калия или триметиламин, или карбоната серебра, обычно при температуре от 0°C до температуры дефлегмации. В качестве примера применяемого растворителя может быть представлен апротонный растворитель, такой как тетрагидрофуран и тому подобное. В зависимости от видов и объемов применяемого исходного материала и растворителя время реакции обычно составляет от 1 часа до 2 суток.
Способ 5
Соответствующее О-защищенное соединение может быть получено путем подходящей защиты фенольной гидроксигруппы содержащего амидиногруппу соединения, полученного по способам 2-4, в соответствии со способом, описанным в PROTECTIVE GROUPS IN ORGANIC SYNTHESIS, THEODORA W.GREENE, PETER G.WUTS by JOHN WILEY&SONS, INC.
Способ 6
Соответствующий карбамат может быть получен путем взаимодействия содержащего амидиногруппу соединения, полученного по способам 2-5, с соединением, представленным выше общей формулой (V), в присутствии или в отсутствие основания, такого как триэтиламин или диизопропилэтиламин, обычно при температуре от 0°C до комнатной температуры. В качестве примера применяемого растворителя может быть представлен N,N-диметилформамид и тому подобное. В зависимости от видов и объемов применяемого исходного материала и растворителя время реакции обычно составляет от 1 часа до 2 суток.
Удаление гидроксизащитной группы обычно может быть выполнено в соответствии со способом, описанным в PROTECTIVE GROUPS IN ORGANIC SYNTHESIS, THEODORA W. GREENE, PETER G.WUTS by JOHN WILEY&SONS, INC.
Из соединений по настоящему изобретению, представленных выше общей формулой (I), соединение, представленное общей формулой:

где Q, R1, R2 и Т имеют те же значения, что и определено выше, также могут быть получены путем взаимодействия производного 5-циано-2-гидроксибензолсульфонамида, представленного выше общей формулой (II), или его соли, с гидроксиламином или его солью в присутствии или в отсутствие основания (здесь и далее обозначаемый как способ 9), и подвергая, при необходимости, полученное соединение сложноэфирному обмену или этерификации с применением спирта, представленного выше общей формулой (III), или этерификации с применением соединения, представленного выше общей формулой (IV) (здесь и далее обозначаемый как способ 10). В том случае, если применяемые в качестве исходных материалов производные 5-циано-2-гидроксибензолсульфонамида, представленные выше общей формулой (II), содержат карбоксигруппу, выполнение способа 9 является предпочтительным после преобразования производного в неорганическую соль соответствующей карбоновой кислоты (например, соль натрия, соль калия) (здесь и далее обозначаемый как способ 8). В том случае, если применяемые в качестве исходных материалов производные 5-циано-2-гидроксибензолсульфонамида, представленные выше общей формулой (II), содержат сложноэфирную группу, осуществление способа 9 является предпочтительным после гидролиза сложноэфирной группы (здесь и далее обозначаемый как способ 7) и способа 8.
В вышеуказанном способе получения подробное описание получения производного 5-амидино-2-гидроксибензолсульфонамида, представленного выше общей формулой (Ia), из производного 5-циано-2-гидроксибензолсульфонамида, представленного выше общей формулой (II), является следующим.
Способ 7
Соответствующая карбоновая кислота может быть получена путем гидролиза соответствующего производного 5-циано-2-гидроксибензолсульфонамида, содержащего сложноэфирную группу, с применением кислоты, такой как хлористо-водородная кислота или серная кислота, обычно при температуре от комнатной до температуры дефлегмации, или с применением основания, такого как гидроксид натрия, обычно при температуре от 0°C до температуры дефлегмации. В качестве примеров применяемых растворителей могут быть представлены вода, ацетонитрил, тетрагидрофуран, спирты, их смесь и тому подобное. В зависимости от видов и объемов применяемого исходного материала и растворителя время реакции обычно составляет от 1 часов до 2 суток.
Способ 8
Соответствующее производное 5-циано-2-гидроксибензолсульфонамида, содержащее карбоксигруппу, может быть преобразовано в соответствующую неорганическую соль карбоновой кислоты путем обработки основанием, таким как гидроксид натрия или гидроксид калия, в присутствии различных растворителей или без растворителя, обычно при температуре от -20°C до комнатной температуры. В качестве примеров применяемых растворителей могут быть представлены вода, этанол, тетрагидрофуран, их смесь и тому подобное. В зависимости от видов и объемов применяемого исходного материала и растворителя время реакции обычно составляет от 1 часа до 2 суток.
Способ 9
Соответствующий амидоксим может быть получен путем взаимодействия производного 5-циано-2-гидроксибензолсульфонамида, представленного выше общей формулой (II) и полученного в соответствии с способами 7 и 8, при необходимости, с гидроксиламином или его солью в присутствии или в отсутствие основания, такого как триэтиламин, обычно при температуре от 50°C до температуры дефлегмации. В качестве примеров применяемых растворителей могут быть представлены вода, метанол, этанол, тетрагидрофуран, толуол, их смесь и тому подобное. В зависимости от видов и объемов применяемого исходного материала и растворителя время реакции обычно составляет от 1 часа до 3 суток.
Способ 10
Соответствующий сложный эфир может быть получен путем 1) сложноэфирного обмена или этерификации содержащего сложноэфирную группу амидоксима, полученного в способе 9, с применением спирта, представленного выше общей формулой (III), в присутствии кислоты, такой как хлористо-водородная кислота, серная кислота или пара-толуолсульфоновая кислота, обычно при температуре от 0°C до температуры дефлегмации, путем 2) этерификации содержащего карбоксигруппу амидоксима, полученного в способе 9, с применением спирта, представленного выше общей формулой (III), в присутствии конденсирующего агента, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид, обычно при температуре от 0°C до температуры дефлегмации, или путем 3) этерификации содержащего карбоксигруппу амидинопроизводного, полученного в способе 9, с применением соединения, представленного выше общей формулой (IV), в присутствии основания, такого как карбонат калия или триметиламин, или карбоната серебра, обычно при температуре от 0°C до температуры дефлегмации. В качестве примера применяемого растворителя может быть представлен апротонный растворитель, такой как тетрагидрофуран и тому подобное. В зависимости от видов и объемов применяемого исходного материала и растворителя время реакции обычно составляет от 1 часа до 2 суток.
Из соединений по настоящему изобретению, представленных выше общей формулой (I), соединение, представленное общей формулой:

где R3 представляет собой -COORA7, в которой RA7 является низшей алкильной группой, содержащей -CONRA5RA6, где RA5 и RA6, или -NRA5RA6 имеют те же значения, что и определено выше, или низшую алкильную группу, содержащую -CONRBRC, где RB и RC, или -NRBRC имеют те же значения, что и определено выше; и R2, Q, Т и Z имеют те же значения, что и определено выше, может быть получено путем взаимодействия соединения, представленного общей формулой:
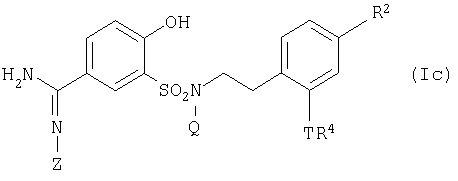
где R4 представляет собой -COORА8, в которой RА8 является атомом водорода или низшей алкильной группой, содержащей -COOH; и R2, Q, Т и Z имеют те же значения, что и определено выше, или его соли, с амином, представленным общей формулой:
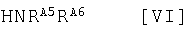
где RA5 и RA6, или -NRА5RА6 имеют те же значения, что и определено выше, или его солью, или с амином, представленным общей формулой:

где RB и RC, или -NRBRC имеют те же значения, что и определено выше, или его солью (здесь и далее обозначаемый как способ 11).
В вышеуказанном способе получения подробное описание получения производного 5-амидино-2-гидроксибензолсульфонамида, представленного выше общей формулой (Ib), из производного 5-амидино-2-гидроксибензолсульфонамида, представленного выше общей формулой (Ic), является следующим.
Способ 11
Производное 5-амидино-2-гидроксибензолсульфонамида, представленное выше общей формулой (Ib), может быть получено путем взаимодействия производного 5-амидино-2-гидрокси-бензолсульфонамида, представленного выше общей формулой (Ic), или его соли, с амином, представленным общей формулой (VI), или его солью, или с амином, представленным общей формулой (VII), или его солью, в присутствии конденсирующего агента, такого как 1-(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид, дифенилфосфорилазид и тому подобное, и в присутствии или в отсутствие агента активации сложного эфира, такого как 1-гидроксибензотриазолмоногидрат, и основания, такого как триэтиламин, обычно при температуре от 0°C до комнатной температуры. В качестве примеров применяемых растворителей могут быть представлены дихлорметан, N,N-диметилформамид и тому подобное. В зависимости от видов и объемов применяемого исходного материала и растворителя время реакции обычно составляет от 1 часа до 2 суток.
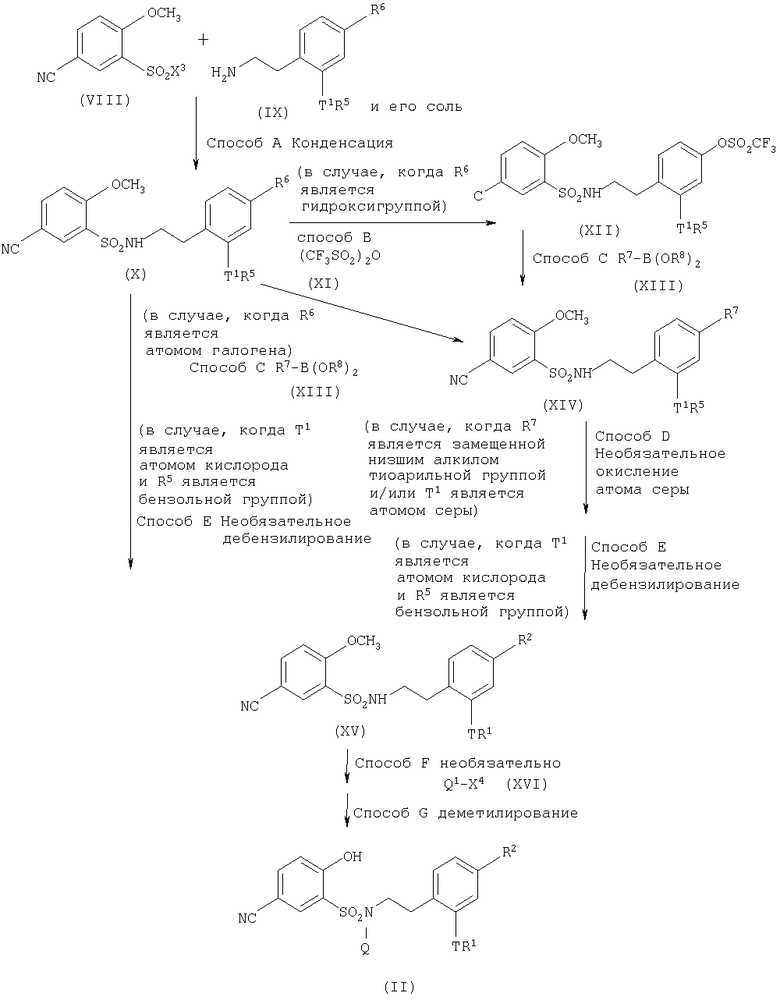
Например, производные 5-циано-2-гидроксибензолсульфонамида, представленные выше общей формулой (II) и применяемые в качестве исходных материалов в вышеуказанных способах получения, могут быть получены в соответствии со следующим способом:
где R5 представляет собой низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (A);
(A) -COORA, -CONRBRC, 3-10-членная циклоалкильная группа, 6-10-членная арильная группа, 3-10-членная гетероциклоалкильная группа, которая может содержать оксогруппу, 5-10-членная ароматическая гетероциклическая группа, которая может содержать оксогруппу или низшую алкильную группу;
где RA, RB и RC, или -NRBRC имеют те же значения, что определены выше;
R6 представляет собой атом галогена, гидроксильную группу, замещенную двумя низшими алкилами аминогруппу, низшую алкильную группу, 3-10-членную циклоалкильную группу, или 3-10-членную гетероциклоалкильную группу, которая может содержать оксогруппу;
R7 представляет собой 5-10-членную ароматическую гетероциклическую группу, которая может содержать заместитель, выбранный из следующей группы (C), или 6-10-членную арильную группу, которая может содержать 1-3 заместителя, выбранных из следующей группы (E);
(C) низшая алкильная группа, аминогруппа и -COORG, в которой RG имеет то же значение, что и определено выше;
(E) оксогруппа, низшая алкильная группа, замещенная галогеном низшая алкильная группа, -Y-RD, атом галогена, нитрогруппа, аминогруппа, -COORE, карбамоильная группа, сульфамоильная группа, монозамещенная низшим алкилом сульфамоильная группа, которая может содержать -COORF, и замещенная низшей алкилсульфониламиногруппой низшая алкильная группа;
где RD, RE, RF и Y имеют те же значения, что и определено выше;
R8 представляет собой атом водорода или низшую алкильную группу, или оба R8 связаны с образованием низшей алкиленовой группы;
Q1 представляет собой низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (D);
(D) -ORH, -COORI, -CONRJRК, 6-10-членная арильная группа, которая может содержать 1-3 заместителя, выбранных из следующей группы (iii), и 5-10-членная ароматическая гетероциклическая группа, которая может содержать 1-3 заместителя, выбранных из следующей группы (iv);
где RH, RI, RJ и RK, или -NRJRK имеют те же значения, что и определено выше;
(iii) атом галогена, нитрогруппа, низшая алкильная группа, -ORL, в которой RL имеет то же значение, что и определено выше, и -COORM, в которой RM имеет то же значение, что и определено выше;
(iv) атом галогена, оксогруппа, низшая алкильная группа и фенильная группа; и
Т1 представляет собой атом кислорода или атом серы;
X3 представляет собой атом хлора, атом брома или атом йода;
X4 представляет собой атом хлора, атом брома или атом йода; и
Q, R1, R2 и Т имеют те же значения, что и определены выше.
Способ A
Представленное выше общей формулой (X) производное бензолсульфонамида может быть получено путем конденсации производного бензолсульфонилгалогенида, представленного выше общей формулой (VIII), с производным фенетиламина, представленным выше общей формулой (IX), или его солью, в присутствии или в отсутствие основания, такого как триэтиламин или карбонат калия, в полярном растворителе, таком как тетрагидрофуран, N,N-диметилформамид или смеси такого растворителя с водой, обычно при температуре от 0°C до комнатной температуры.
Способ В
Представленное выше общей формулой (XII) производное бензолсульфонамида может быть получено путем конденсации представленного выше общей формулой (X) производного бензолсульфонамида, где R6 является гидроксигруппой, с трифторметансульфоновым ангидридом, представленным выше общей формулой (XI), в присутствии основания, такого как N,N-диметиламинопиридин, в растворителе, таком как дихлорметан, тетрагидрофуран, обычно при температуре от 0°C до температуры дефлегмации.
Способ С
Представленное выше общей формулой (XIV) производное бензолсульфонамида может быть получено путем конденсации представленного выше общей формулой (XII) производного бензолсульфонамида или представленного выше общей формулой (X) производного бензолсульфонамида, где R6 представляет собой атом галогена, с бораном, представленным выше общей формулой (XIII), в присутствии катализатора, такого как тетракис(трифенилфосфин)палладий(0), ацетат палладия (II) или [1,1'-бис-(дифенилфосфино)ферроцен]хлорникель(II), и основания, такого как карбонат натрия, гидрокарбонат натрия, фосфат калия или триэтиламин, и в присутствии или в отсутствие межфазного катализатора, такого как тетрабутиламмонийбромид, в растворителе, таком как толуол, тетрагидрофуран, N,N-диметилформамид или вода, или их смесь, обычно при температуре от комнатной до температуры дефлегмации.
Способ D
Соединение, где R7 является замещенной низшим алкилом тиоарильной группой, и/или Т1 является атомом серы представленного выше общей формулой (XIV) соединения, может быть преобразовано в соответствующее сульфонильное соединение путем его обработки окислителем, таким как OXONE (торговая марка) или мета-хлорпербензойная кислота, в растворителе, таком как ацетон или дихлорметан, или смесь такого растворителя с водой, обычно при температуре от 0°C до температуры дефлегмации.
Способ E
Соединение, представленное выше общей формулой (X) или (XIV), или соединение, где Т1 является атомом кислорода и R5 является бензильной группой соединения, где R7 является окисляющей атом серы и замещенной низшим алкилом тиоарильной группой, представленной выше общей формулой (XIV), может быть преобразовано в соответствующее фенольное соединение, представленное выше общей формулой (XV), путем его каталитического гидрирования с применением палладиевого катализатора, такого как палладий на угле или гидроксид палладия, при атмосферном давлении в полярном растворителе, таком как этанол, обычно при температуре от комнатной до температуры дефлегмации, и при атмосферном давлении или повышенном давлении для удаления бензильной группы. После следующего способа F или G этот способ может быть выполнен сходным образом с применением соединения, где Т1 или Т является атомом кислорода и R1 является бензильной группой.
Способ F
Соответствующее N-алкилированное соединение может быть получено путем N-алкилирования соединения, представленного выше общей формулой (XV), с применением представленного выше общей формулой (XVI) алкилирующего агента в присутствии основания, такого триэтиламин или карбонат калия, в растворителе, таком как N,N-диметилформамид, обычно при температуре от -20°C до температуры дефлегмации.
Способ G
Производное бензолсульфонамида, представленное выше общей формулой (II), может быть получено путем N-алкилирования соединения, представленного выше общей формулой (XV), или деметилирования соединения, N-алкилированного в ходе способа F, при нагревании в присутствии хлорида лития в растворителе, таком как N,N-диметилформамид или N,N-диметилацетамид, обычно при температуре от 100°C до температуры дефлегмации.
Например, из соединений, представленных выше общей формулой (XV) в вышеуказанном способе получения, соединение, представленное следующей общей формулой (XVb), где R1 содержит амидную группу, также может быть получено следующим способом:

где R9 представляет собой низшую алкильную группу, содержащую заместитель, выбранный из следующей группы (F);
(F) -COORA9 или -CONRB4RC4;
где RA9 представляет собой низшую алкильную группу;
RВ4 и RС4 независимо представляют собой атом водорода или низшую алкильную группу, содержащую -COORB5, в которой RB5 является низшей алкильной группой, при условии, что оба не являются атомами водорода;
R10 представляет собой низшую алкильную группу, содержащую заместитель, выбранный из следующей группы (G);
(G) -COOH или -CONRB6RC6;
где RB6 и RC6 независимо представляют собой атом водорода или низшую алкильную группу, содержащую -COOH, при условии, что оба не являются атомами водорода; и
R2, R3, RA5, RA6, RB и RC, -NRBRC и Т имеют те же значения, что и определено выше.
Способ H
Соединение, представленное выше общей формулой (XVI), может быть гидролизовано с получением соответствующей карбоновой кислоты, представленной выше общей формулой (XVa), путем обработки кислотой, такой как хлористо-водородная кислота или серная кислота, при температуре от комнатной до температуры дефлегмации, или основанием, таким как гидроксид натрия в воде, и растворителем, таким как ацетонитрил, тетрагидрофуран или спирты, обычно при температуре от 0°C до температуры дефлегмации.
Способ I
Представленное выше общей формулой (XVa) соединение может быть преобразовано в соответствующий амид, представленный выше общей формулой (XVb), путем его взаимодействия с амином, представленным выше общей формулой (VI), или его солью, или амином, представленным выше общей формулой (VII), или его солью, в присутствии конденсирующего агента, такого как 1-(3-диметиаминопропил)-3-этилкарбодиимидгидрохлорид или дифенилфосфорилазид, и в присутствии или в отсутствие агента для активации сложного эфира, такого как 1-гидроксибензотриазолмоно-гидрат, и основания, такого как триэтиламин, в растворителе, таком как дихлорметан или N,N-диметилформамид, обычно при температуре от 0°C до комнатной температуры.
В вышеуказанном способе получения, например, представленное выше общей формулой (XIV) соединение также может быть получено следующим способом:

где X5 представляет собой атом брома, атом хлора или атом йода; и R5, R7 и Т1 имеют те же самые значения, что и определено выше.
Способ J
Производное бензолсульфонамида, представленное выше общей формулой (XIV), может быть получено путем конденсирования производного бензолсульфонамида, представленного выше общей формулой (XII), с галогеном, представленным выше общей формулой (XVII), в присутствии бората, такого как бис(пинаколято)диборан, и катализатора, такого как комплекс дихлорида [1,1'-бис-(дифенилфосфино)ферроцен]палладия (II) с дихлорметаном, в растворителе, таком как диоксан, обычно при температуре от комнатной до температуры дефлегмации.
Например, соединение, представленное в вышеуказанном способе получения общей формулой (XV), может быть также получено из представленного выше общей формулой (IX) соответствующего исходного соединения, где R5 является метоксиметильной группой, с применением соединения, представленного следующей общей формулой (XVIII) и полученного в ходе реакции, сходной с представленной выше при рассмотрении способов А, В, С и J, следующим способом:
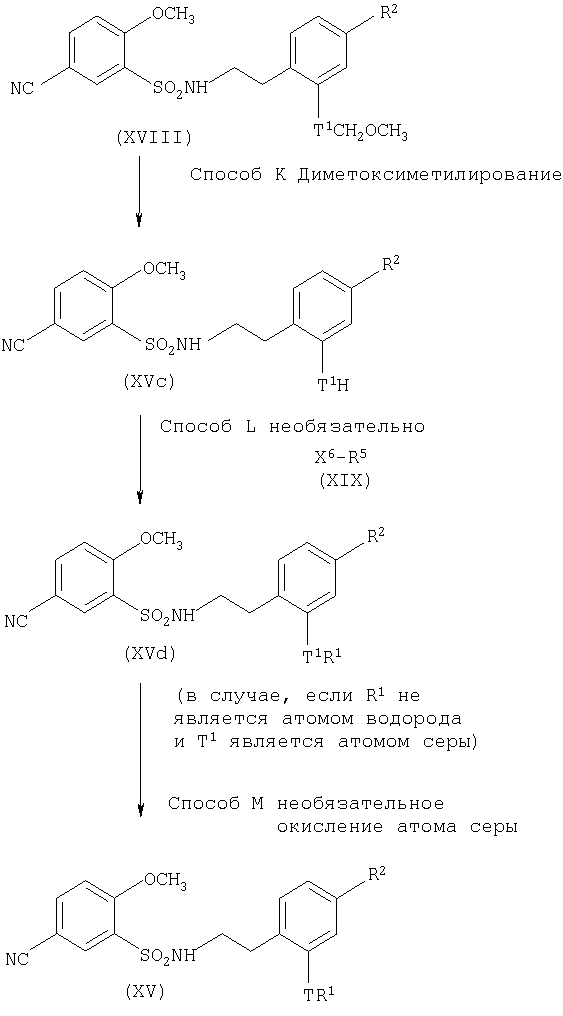
где X6 представляет собой атом брома, атом хлора или атом йода; и R1, R2, R5, Т и Т1 имеют те же значения, что и определено выше.
Способ К
Соединение, представленное выше общей формулой (XVIII), может быть преобразовано в фенольное соединение или тиофенольное соединение, представленное выше общей формулой (XVc), путем обработки его в присутствии кислоты, такой как хлористо-водородная кислота или серная кислота, в растворителе, таком как тетрагидрофуран или изопропанол, или их смесь, обычно при температуре от 0°C до температуры дефлегмации.
Способ L
Соответствующее O- или S-алкилированное соединение, представленное выше общей формулой (XVd), может быть получено путем конденсации соединения, представленного выше общей формулой (XVc), с галогеном, представленным выше общей формулой (XIX), в присутствии основания, такого как N,N-диизопропилэтиламин, триэтиламин или карбонат калия, в растворителе, таком как N,N-диметилформамид, тетрагидрофуран или этанол, обычно при температуре от -20°C до температуры дефлегмации.
Способ M
Соединение, где Т1 является атомом серы и R1 не является атомом водорода соединения, представленного выше общей формулой (XVd), может быть преобразовано в соответствующее сульфонильное соединение путем обработки его окислителем, таким как OXONE (торговая марка) или мета-хлорпербензойная кислота, в растворителе, таком как ацетон или дихлорметан, или смесь такого расторителя с водой, обычно при температуре от 0°C до температуры дефлегмации.
Например, соединение, представленное в вышеуказанном способе получения общей формулой (V), является коммерчески доступным или может быть получено при помощи методов, описанных в литературе и тому подобное (Michael Folkmann, Synthesis, 1159 (1990); Jose Alxander, J. Med. Chem., 318-322, 31 (1988)).
Соединения по настоящему изобретению, полученные в соответствии в определенным выше способом получения, могут быть легко выделены и очищены обычными методами разделения, таких как фракционная перекристаллизация, осаждение, очистка с помощью колоночной хроматографии, экстракция растворителем и тому подобное.
Производные 5-амидино-2-гидроксибензолсульфонамида по настоящему изобретению, представленные выше общей формулой (I), могут быть преобразованы в их фармацевтически приемлемые соли обычным путем. Примеры подобных солей включают соли добавления кислоты с неорганическими кислотами (например, хлористо-водородная кислота, бромисто-водородная кислота, йодисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное), соли добавления кислот с органическими кислотами (например, муравьиная кислота, уксусная кислота, метансульфоновая кислота, бензолсульфоновая кислота, пара-толуолсульфоновая кислота, пропионовая кислота, лимонная кислота, янтарная кислота, винная кислота, фумаровая кислота, масляная кислота, щавелевая кислота, малоновая кислота, малеиновая кислота, молочная кислота, яблочная кислота, угольная кислота, глутаминовая кислота, аспарагиновая кислота и тому подобное), соли с органическими аминами (например, морфолин, пирролидин, пиперидин, пиперазин, лизин и тому подобное), и соли с неорганическими основаниями, такие как соль натрия, соль калия и соль кальция.
В дополнение, соединения по настоящему изобретению, представленные выше общей формулой (I), также включают их гидраты и сольваты с фармацевтически приемлемыми растворителями (например, с этанолом).
Из соединений по настоящему изобретению, представленных выше общей формулой (I), содержащие асимметричный атом углерода соединения существуют в виде двух оптических изомеров (R)-конфигурации и (S)-конфигурации. В настоящем изобретении могут использоваться или один из изомеров, или их смесь. В случае существования геометрических изомеров или таутомеров соединений по настоящему изобретению, представленных выше общей формулой (I), настоящее изобретение включает все геометрические изомеры и таутомеры.
Соединения по настоящему изобретению, представленные выше общей формулой (I), являются соединениями, обладающими отличной ингибирующей активностью по отношению к активированному фактору X системы свертывания крови и противосвертывающей активностью. Соединения по настоящему изобретению, представленные выше общей формулой (I), также обладают очень слабой ингибирующей активностью по отношению к тромбину и поэтому являются высокоизбирательными ингибиторами активированного фактора X системы свертывания крови.
Кроме того, в соединениях по настоящему изобретению, представленных выше общей формулой (I), заместитель R1 предпочтительно является низшей алкильной группой, содержащей -COORA, где RA имеет то же значение, что и определено выше, и более предпочтительно метильной группой, содержащей -COORA10, где RA10 является 3-10-членной циклоалкильной группой или низшей алкильной группой. Заместитель R2 предпочтительно является фенильной группой, содержащей заместитель, выбранный из определенной выше группы (B) и предпочтительно находящийся в пара-положении. Кроме того, заместитель R2 более предпочтительно является фенильной группой, содержащей заместитель, выбранный из группы, состоящей из сульфамоильной группы, низшей алкилсульфонильной группы и монозамещенной низшим алкилом сульфамоильной группы, и наиболее предпочтительно является фенильной группой, содержащей низшую алкилсульфонильную группу. Заместитель Q предпочтительно является атомом водорода. Заместитель Т предпочтительно является атомом кислорода. Заместитель Z предпочтительно является гидроксигруппой или -COORN, где RN имеет то же значение, что и определено выше, и более предпочтительно гидроксигруппой. Соединения, содержащие заместитель Z, и их фармацевтически приемлемые соли являются соединениями, которые при их пероральном введении обладают отличной ингибирующей активностью по отношению к активированному фактору X системы свертывания крови. В качестве соединений по настоящему изобретению, представленных выше общей формулой (I), предпочтительными являются этил [4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетат, изопропил[4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетат, н-бутил[4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетат и циклогексил[4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетат, и более предпочтительными являются изопропил[4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетат, н-бутил[4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетат и циклогексил[4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетат.
Соединения по настоящему изобретению, представленные выше общей формулой (I), являются избирательными ингибиторами активированного фактора X системы свертывания крови. Следовательно, соединения по настоящему изобретению особенно применимы в качестве средств для профилактики и лечения инфаркта головного мозга, тромбоза сосудов головного мозга, эмболии сосудов головного мозга, преходящего нарушения мозгового кровообращения (TIA), вызванного субарахноидальным кровотечением сужения кровеносных сосудов головного мозга, болезни Альцгеймера, инфаркта миокарда, нестабильной стенокардии, сердечной недостаточности, фибриллярного тромбоза предсердий, тромбоза легочной артерии, эмболии легочной артерии, острого респираторного дистресс-синдрома, болезни Бергера, закупорки периферических артерий, тромбоза глубоких вен, синдрома диссеминированного внутрисосудистого свертывания, атеросклероза, болезни Бехчета, диабетической нейропатии, диабетической регинопатии, тромботических осложнений сахарного диабета, отторжения зачатка органа, синдрома системного воспалительного ответа (SIRS), вызванной диализом или операцией тромбоцитопении, тромбообразования после операций с применением искусственных кровеносных сосудов или после постановки искусственного клапана, рестеноза и реокклюзии после коронарного вмешательства, такого как чрескожная транслюминальная коронарная ангиопластика (PTCA) или чрескожное транслюминальное восстановление просвета коронарных сосудов (PTCR), тромбообразования во время экстракорпорального кровообращения и тому подобное, средств для профилактики свертывания крови во время введения катетера в кровеносный сосуд и средств для профилактики и лечения инфекции, вызванной вирусом гриппа, на основе ингибирования роста вируса гриппа.
В случае применения в практике производных 5-амидино-2-гидроксибензолсульфонамида по настоящему изобретению, представленных выше общей формулой (I), и их фармацевтически приемлемых солей они вводятся перорально или парентерально в форме подходящих фармацевтических композиций, таких как таблетки, порошки, мелкодисперсные гранулы, гранулы, капсулы, растворы для инъекций, растворы, адгезивные препараты, мази, летучие препараты, свечи и тому подобное. Данные фармацевтические композиции могут быть составлены в соответствии с традиционными фармацевтическими методиками с применением традиционных фармацевтических носителей, наполнителей и других добавок.
Дозировка определяется соответствующим образом для каждого пациента в зависимости от пола, возраста, массы тела, степени выраженности симптомов и тому подобное, и приблизительно находится в диапазоне от 1 до 5000 мг в сутки для взрослого человека в случае перорального введения и приблизительно в диапазоне от 0,01 до 500 мг в сутки для взрослого человека в случае парентерального введения, такого как инъекция, а дневная доза может быть однократной или разделена на несколько приемов в течение суток.
ПРИМЕРЫ
Настоящее изобретение дополнительно более детально иллюстрируется посредством следующих ссылочных примеров, примеров и примеров исследования. Однако настоящее изобретение этим не ограничивается.
Ссылочный пример 1
7-Гидроксихроман-2-он
Смесь 100 г 7-гидроксихроман-2-она, 10 г 10% палладия на угле, 500 мл тетрагидрофурана и 800 мл этанола перемешивали в атмосфере водорода при 65°C в течение 15 часов. К реакционной смеси при охлаждении на льду добавляли суспензию 10 г 10% палладия на угле в 200 мл этанола и перемешивали смесь в атмосфере водорода при 65°C в течение 15 часов. Реакционную смесь фильтровали через диатомовую землю и концентрировали фильтрат при пониженном давлении с получением 106,5 г бесцветного 7-гидроксихроман-2-она.
1Н-ЯМР (CDCl3) δ м.д.:
2,75-2,96 (4H, м), 5,81 (1H, ушир.с), 6,59-6,66 (2H, м), 7,04 (1H, д, J=7,9 Гц)
Ссылочный пример 2
7-Бензилоксихроман-2-он
К перемешиваемой суспензии 202,4 г 7-гидроксихроман-2-она и 341,0 г карбоната калия в N,N-диметилформамиде при комнатной температуре добавляли 153,2 мл бензилхлорида и перемешивали смесь при комнатной температуре в течение 15 часов. После концентрирования реакционной смеси при пониженном давлении с целью удаления растворителя остаток добавляли в смесь этилацетата и воды. Органический слой отделяли, промывали водой, сушили над безводным сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении и растирали остаток в диизопропиловом эфире/гексане. Твердое вещество собирали путем фильтрации с получением 266,1 г 7-бензилоксихроман-2-она в виде бледно-коричневого твердого вещества.
1Н-ЯМР (CDCl3) δ м.д.:
2,73-2,81 (2H, м), 2,90-2,98 (2H, м), 5,05 (2H, с), 6,68 (1H, д, J=2,5 Гц), 6,73 (1H, дд, J=8,3, 2,5 Гц), 7,08 (1H, д, J=8,3 Гц), 7,30-7,46 (5H, м)
Ссылочный пример 3
3-(4-Бензилокси-2-гидроксифенил)пропионамид
К раствору 33,26 г 7-бензилоксихроман-2-она в 264 мл тетрагидрофурана при комнатной температуре добавляли 82 мл 28% водного раствора аммиака. После перемешивания смеси при комнатной температуре в течение 20 минут к реакционной смеси в ледяной бане добавляли 654 мл 1 моль/л хлористо-водородной кислоты. Полученную суспензию разбавляли приблизительно 1 л воды и собирали осадок путем фильтрации с получением 34,8 г 3-(4-бензилокси-2-гидроксифенил)пропионамида в виде бесцветного порошка.
1Н-ЯМР (CDCl3) δ м.д.:
2,60-2,70 (2H, м), 2,80-2,90 (2H, м), 5,01 (2H, с), 5,46 (2H, ушир.с), 6,49 (1H, дд, J=8,5, 2,5 Гц), 6,58 (1H, д, J=2,5 Гц), 6,93 (1H, д, J=8,5 Гц), 7,28-7,45 (5H, м), 8,67 (1H, с)
Ссылочный пример 4
3-(4-Бензилокси-2-метоксиметоксифенил)пропионамид
К перемешиваемой суспензии 5,64 г 60% гидрида натрия в масле в 628 мл N,N-диметилформамида при охлаждении на льду добавляли 34,8 г 3-(4-бензилокси-2-гидроксифенил)пропионамида и перемешивали смесь при 50°C в течение 40 минут. К реакционной смеси при охлаждении на льду добавляли 12,39 г хлорметилметилового эфира и перемешивали смесь при комнатной температуре в течение 15 часов. После концентрирования реакционной смеси при пониженном давлении с целью удаления растворителя остаток вливали в смесь 500 мл этилацетата, 100 мл толуола и 200 мл воды. Органический слой отделяли, промывали водой, сушили над безводным сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении с получением бесцветного твердого вещества. Твердое вещество растирали в этилацетате/диизопропиловом эфире с получением путем фильтрации 35,3 г 3-(4-бензилокси-2-метоксиметоксифенил)пропионамида в виде бесцветного твердого вещества.
1Н-ЯМР (CDCl3) δ м.д.:
2,50 (2H, т, J=7,6 Гц), 2,91 (2H, т, J=7,6 Гц), 3,47 (3H, с), 5,02 (2H, с), 5,18 (2H, с), 5,25-5,45 (2H, м), 6,56 (1H, дд, J=8,5, 2,5 Гц), 6,77 (1H, д, J=2,5 Гц), 7,07 (1H, д, J=8,5 Гц), 7,30-7,45 (5H, м)
Ссылочный пример 5
2-(4-Бензилокси-2-метоксиметоксифенил)этиламин
К раствору 28,42 г 3-(4-бензилокси-2-метоксиметоксифенил)-пропионамида и 40,4 мл 1,8-диазабицикло-[5.4.0]-7-ундецена в 895 мл метанола при 65°C добавляли 16,04 г N-бромсукцинимида. После перемешивания смеси при 65°C в течение 15 минут к реакционной смеси при 65°C дополнительно добавляли 16,04 г N-бромсукцинимида. После перемешивания при 65°C в течение 15 минут полученную смесь концентрировали при пониженном давлении с целью удаления растворителя. К остатку добавляли воду и этилацетат, и отделяли органический слой. Органический слой промывали водой, сушили над безводным сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении с получением маслянистого продукта. К раствору этого остатка в 242 мл этанола добавляли 67,6 мл 8 моль/л водного раствора гидроксида калия и нагревали смесь с обратным холодильником в течение 15 часов. Реакционную смесь концентрировали при пониженном давлении с целью удаления растворителя. К остатку добавляли 500 мл этилацетата, 50 мл толуола и 300 мл воды, и отделяли органический слой. Органический слой промывали водой, сушили над безводным сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали остаток методом жидкостной колоночной хроматографии среднего давления на силикагеле (элюент: гексан/этилацетат) с получением 80,0 г 2-(4-бензилокси-2-метоксиметоксифенил)этиламина в виде бесцветного масла.
1Н-ЯМР (CDCl3) δ м.д.:
1,31 (2H, ушир.с), 2,71 (2H, т, J=6,9 Гц), 2,90 (2H, т, J=6,9 Гц), 3,47 (3H, с), 5,03 (2H, с), 5,17 (2H, с), 6,56 (1H, дд, J=8,2, 2,5 Гц), 6,79 (1H, д, J=2,5 Гц), 7,04 (1H, д, J=8,2 Гц), 7,29-7,45 (5H, м)
Ссылочный пример 6
4-(2-Аминоэтил)-3-метоксиметоксифенол
Смесь 18,00 г 2-(4-бензилокси-2-метоксиметоксифенил)этиламина, 3,6 г 10% палладия на угле (Degussa Inc.: E101 NE/W) и 230 мл этанола перемешивали в атмосфере водорода при комнатной температуре в течение 1 часа. После отфильтровывания катализатора через диатомовую землю фильтрат концентрировали при пониженном давлении с получением 12,65 г 4-(2-аминоэтил)-3-метоксиметоксифенола в виде бесцветного твердого вещества.
1Н-ЯМР (CD3OD) δ м.д.:
2,65-2,75 (2H, м), 2,75-2,85 (2H, м), 3,45 (3H, с), 5,16 (2H, с), 6,36 (1H, дд, J=8,1, 2,3 Гц), 6,58 (1H, д, J=2,3 Гц), 6,94 (1H, д, J=8,1 Гц)
Ссылочный пример 7
N-Цианометил-2,2,2-трифторацетамид
Гидросульфат аминоацетонитрила (50 г) и 77 мл пиридина суспендировали в 300 мл дихлорметана и к перемешиваемой смеси при охлаждении на льду добавляли 80 мл трифторуксусного ангидрида. После перемешивания смеси при комнатной температуре в течение 29 часов нерастворимый материал удаляли путем фильтрации и промывали этилацетатом. После концентрирования фильтрата при пониженном давлении к остатку добавляли воду. Смесь экстрагировали этилацетатом и промывали органический слой разбавленной хлористо-водородной кислотой и водой. После этого экстракт сушили над безводным сульфатом магния и удаляли растворитель при пониженном давлении с получением 66 г N-цианометил-2,2,2-трифторацетамида.
1Н-ЯМР (CDCl3) δ м.д.:
4,31 (2H, д, J=6,6 Гц), 7,10 (1H, ушир.с)
Ссылочный пример 8
2,2,2-Трифтор-N-[2-(2-гидрокси-4-изопропилфенил)-2-оксоэтил]ацетамид
Раствор 28,5 мл 3-изопропилфенола в 130 мл дихлорметана, 38 г N-цианометил-2,2,2-трифторацетамида и 14,2 г хлорида алюминия добавляли в атмосфере аргона при перемешивании в ледяной бане к 250 мл 1,0 моль/л раствора трихлорида бора в дихлорметане. После перемешивания смеси при комнатной температуре в течение 16 часов к реакционной смеси при охлаждении на льду добавляли лед и 2 моль/л хлористо-водородную кислоту. После перемешивания смеси при комнатной температуре в течение 40 минут отделяли органический слой и экстрагировали водный слой дихлорметаном. Органические слои объединяли, промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и добавляли к остатку 100 мл гексана. Полученное кристаллическое вещество собирали путем фильтрации, промывали гексаном и сушили при пониженном давлении с получением 22,9 г 2,2,2-трифтор-N-[2-(2-гидрокси-4-изопропилфенил)-2-оксоэтил]ацетамида.
1Н-ЯМР (CDCl3) δ м.д.:
1,26 (6H, д, J=8,8 Гц), 2,86-2,98 (1H, м), 4,83 (2H, д, J=4,1 Гц), 6,85 (1H, дд, J=8,2, 1,6 Гц), 6,90 (1H, д, J=1,6 Гц), 7,42 (1H, ушир.с), 7,59 (1H, д, J=8,2 Гц), 11,42 (1H, ушир.с)
Ссылочный пример 9
Этил [5-изопропил-2-[2-(2,2,2-трифторацетиламино)этил]фенокси]ацетат
К раствору 500 мг 2,2,2-трифтор-N-[2-(2-гидрокси-4-изопропилфенил)-2-оксоэтил]ацетамида в 2,63 мл трифторуксусной кислоты добавляли 0,94 мл триэтилсилана. После перемешивания при комнатной температуре в течение 13 часов реакционную смесь концентрировали и тщательно высушивали. Полученный остаток и 382 мг карбоната калия суспендировали в 10 мл N,N-диметилформамида и к перемешиваемой смеси при охлаждении на льду добавляли 0,288 мл этилбромацетата. Смесь перемешивали при комнатной температуре в течение 15 часов и добавляли к реакционной смеси воду. После экстракции смеси этилацетатом органический слой последовательно промывали водой и насыщенным солевым раствором, и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и очищали полученный остаток методом колоночной хроматографии на силикагеле (элюент: этилацетат/гексан) с получением 535 мг этил [5-изопропил-2-[2-(2,2,2-трифторацетиламино)этил]фенокси]ацетата.
1Н-ЯМР (DMSO-d6) δ м.д.:
1,10-1,30 (9H, м), 2,75-2,95 (3H, м), 3,35-3,50 (2H, м), 4,17 (2H, кв., J=7,3 Гц), 4,81 (2H, с), 6,70-6,90 (2H, м), 7,03 (1H, д, J=7,5 Гц), 9,40-9,55 (1H, м)
Ссылочный пример 10
Следующее соединение было получено путем, сходным с описанным в ссылочном примере 9.
Этил-2-[5-изопропил-2-[2-(2,2,2-трифторацетиламино)этил]-фенокси]пропионат
1Н-ЯМР (CDCl3) δ м.д.:
1,18-1,22 (6H, м), 1,25 (3H, т, J=6,9 Гц), 1,64 (3H, д, J=6,6 Гц), 2,79-2,93 (2H, м), 2,95-3,02 (1H, м), 3,55-3,64 (1H, м), 3,68-3,76 (1H, м), 4,21 (2H, кв., J=6,9 Гц), 4,88 (1H, кв., J=6,6 Гц), 6,59-6,61 (1H, м), 6,79-6,83 (1H, м), 7,05 (1H, д, J=7,3 Гц), 7,16 (1H, ушир.с)
Ссылочный пример 11
Этил [2-(2-аминоэтил)-5-изопропилфенокси]ацетатгидрохлорид
К раствору 26,4 г этил [5-изопропил-2-[2-(2,2,2-трифторацетиламино)этил]фенокси]ацетата в смеси 300 мл метанола и 15 мл воды добавляли 30,3 г карбоната калия. После перемешивания смеси при комнатной температуре в течение 20 часов нерастворимый материал удаляли путем фильтрации и концентрировали фильтрат при пониженном давлении. К остатку добавляли 300 мл 35% этанольного раствора хлороводорода и перемешивали смесь при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении с получением 24,8 г неочищенного продукта этил [2-(2-аминоэтил)-5-изопропилфенокси]ацетатгидрохлорида.
1Н-ЯМР (DMSO-d6) δ м.д.:
1,17 (6H, д, J=6,9 Гц), 1,21 (3H, т, J=7,3 Гц), 2,75-2,95 (3H, м), 2,95-3,05 (2H, м), 4,18 (2H, кв., J=7,3 Гц), 4,84 (2H, с), 6,75-6,79 (1H, м), 6,81 (1H, дд, J=7,9, 1,6 Гц), 7,10 (1H, д, J=7,9 Гц), 8,13 (3H, ушир.с)
Ссылочный пример 12
Следующее соединение было получено путем, сходным с описанным в ссылочном примере 11.
Этил 2-[2-(2-аминоэтил)-5-изопропилфенокси]пропионатгидрохлорид
1Н-ЯМР (CDCl3) δ м.д.:
1,12-1,19 (9H, м), 1,54 (3H, д, J=6,5 Гц), 2,75-3,11 (5H, м), 4,09-4,18 (2H, м), 5,06 (1H, кв., J=6,5 Гц), 6,71 (1H, с), 6,78-6,82 (1H, м), 7,09 (1H, д, J=8,0 Гц), 7,93 (3H, ушир.с)
Ссылочный пример 13
2-Гидрокси-4-изопропилбензальдегид
К 100 мл трифторуксусной кислоты добавляли 25,39 г 3-изопропилфенола и 26,14 г гексаметилентетрамина. После перемешивания при 60°C в течение 1 часа реакционную смесь концентрировали при пониженном давлении. К остатку добавляли разбавленную хлористо-водородную кислоту и перемешивали смесь при комнатной температуре в течение 30 минут. После экстракции реакционной смеси этилацетатом органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и очищали остаток методом колоночной хроматографии на силикагеле (элюент: этилацетат/гексан) с получением 6,69 г 2-гидрокси-4-изопропилбензальдегида.
1Н-ЯМР (CDCl3) δ м.д.:
1,26 (6Н, д, J=6,9 Гц), 2,92 (1H, септ, J=6,9 Гц), 6,83-6,87 (1H, м), 6,88 (1H, дд, J=7,9, 1,6 Гц), 7,47 (1H, д, J=7,9 Гц), 9,83 (1H, с), 11,03 (1H, ушир.с)
Ссылочный пример 14
2-Бензилокси-4-изопропилбензальдегид
2-Гидрокси-4-изопропилбензальдегид (6,69 г) и 11,26 г карбоната калия суспендировали в 100 мл N,N-диметилформамиде и к перемешиваемой смеси при комнатной температуре добавляли 5,33 мл бензилбромида. После перемешивания смеси при комнатной температуре в течение 16 часов нерастворимый материал удаляли путем фильтрации. К остатку добавляли 10 мл воды и 10 мл разбавленной хлористо-водородной кислоты, и экстрагировали смесь этилацетатом. После промывания насыщенным солевым раствором органический слой сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и очищали полученный остаток методом колоночной хроматографии на силикагеле (элюент: этилацетат/гексан) с получением 10,44 г 2-бензилокси-4-изопропилбензальдегида.
1Н-ЯМР (CDCl3) δ м.д.:
1,25 (6H, д, J=6,9 Гц), 2,88-2,97 (1H, м), 5,19 (2H, с), 6,90 (1H, с), 6,92 (1H, д, J=7,9 Гц), 7,32-7,47 (5H, м), 7,79 (1H, д, J=7,9 Гц), 10,49 (1H, с)
Ссылочный пример 15
2-Бензилокси-4-изопропил-1-(2-нитровинил)бензол
К 100 мл нитрометана добавляли 10,44 г 2-бензилокси-4-изопропилбензальдегида и 4,71 г ацетата аммония. После перемешивания при наружной температуре, равной 100°C, в течение 3 часов реакционную смесь концентрировали при пониженном давлении. Полученный остаток растворяли в этилацетате и последовательно промывали органический слой 1 моль/л хлористо-водородной кислотой и насыщенным водным раствором бикарбоната натрия, и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением 9,45 г 2-бензилокси-4-изопропил-1-(2-нитровинил)бензола.
1Н-ЯМР (CDCl3) δ м.д.:
1,24 (6H, д, J=7,3 Гц), 2,87-2,95 (1H, м), 5,21 (2H, с), 6,86-6,93 (2H, м), 7,33-7,48 (6H, м), 7,82 (1H, д, J=13,2 Гц), 8,15 (1Н, д, J=13,2 Гц)
Ссылочный пример 16
2-(2-Бензилокси-4-изопропилфенил)этиламин
К перемешиваемой суспензии 3,01 г литийалюминийгидрида в 100 мл безводного диэтилового эфира при охлаждении на льду при перемешивании в течение 10 минут по каплям добавляли раствор 9,45 г 2-бензилокси-4-изопропил-1-(2-нитровинил)бензола в 10 мл диэтилового эфира. После перемешивания смеси в течение 1 часа к перемешиваемой реакционной смеси при охлаждении на льду по каплям добавляли 63,5 мл 2 моль/л раствора гидроксида натрия и перемешивали смесь в течение 1 часа. К смеси добавляли безводный сульфат натрия и перемешивали смесь в течение 15 минут. Нерастворимый материал отфильтровывали через диатомовую землю и добавляли к фильтрату 100 мл воды. Смесь экстрагировали этилацетатом, последовательно промывали органический слой насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении с получением 8,56 г 2-(2-бензилокси-4-изопропилфенил)этиламина.
1Н-ЯМР (CDCl3) δ м.д.:
1,23 (6H, д, J=6,9 Гц), 2,80 (2H, т, J=6,9 Гц), 2,83-2,91 (1H, м), 2,96 (2H, т, J=6,9 Гц), 5,07 (2H, с), 6,76-6,80 (2H, м), 7,08 (1H, д, J=7,3 Гц), 7,29-7,47 (5H, м)
Ссылочный пример 17
трет-Бутил-N-[2-(2-бензилокси-4-изопропилфенил)этил]карбамат
К 100 мл тетрагидрофурана добавляли 8,56 г 2-(2-бензилокси-4-изопропилфенил)этиламина и 7,63 г ди-трет-бутилдикарбоната, и перемешивали смесь при комнатной температуре в течение 12 часов. Растворитель удаляли при пониженном давлении и очищали полученный остаток методом колоночной хроматографии на силикагеле (элюент: этилацетат/гексан) с получением 12,00 г трет-бутил-N-[2-(2-бензилокси-4-изопропилфенил)этил]карбамата.
1Н-ЯМР (CDCl3) δ м.д.:
1,23 (6H, д, J=6,9 Гц), 1,41 (9H, с), 2,76-2,91 (3H, м), 3,27-3,42 (2H, м), 4,69 (1H, ушир.с), 5,08 (2H, с), 6,75-6,82 (2H, м), 7,07 (1H, д, J=7,9 Гц), 7,30-7,48 (5H, м)
Ссылочный пример 18
трет-Бутил-N-[2-(2-гидрокси-4-изопропилфенил)этил]карбамат
трет-Бутил-N-[2-(2-бензилокси-4-изопропилфенил)этил]-карбамат (12,00 г) растворяли в 150 мл этанола. К перемешиваемому раствору при охлаждении на льду добавляли 1,10 г 10% палладия на угле и перемешивали смесь в атмосфере водорода при обычном давлении при 30°C в течение 16 часов. Нерастворимый материал фильтровали и концентрировали фильтрат при пониженном давлении с получением 6,66 г трет-бутил-N-[2-(2-гидрокси-4-изопропилфенил)этил]карбамата.
1Н-ЯМР (CDCl3) δ м.д.:
1,21 (6H, д, J=6,9 Гц), 1,45 (9H, с), 2,75-2,86 (3H, м), 3,25-3,32 (2H, м), 4, 92 (1H, ушир.с), 6,65-6,71 (1H, м), 6,72-6,75 (1H, м), 6,96 (1H, д, J=7,9 Гц), 7,03 (1H, ушир.с)
Ссылочный пример 19
Этил 4-[2-(2-трет-бутоксикарбониламиноэтил)-5-изопропилфенокси]бутират
трет-Бутил-N-[2-(2-гидрокси-4-изопропилфенил)этил]карбамат (0,234 г) и 0,116 г карбоната калия суспендировали в 5 мл N,N-диметилформамиде. К перемешиваемой суспензии при комнатной температуре по каплям добавляли 0,126 мл этил-4-бромбутирата и перемешивали смесь при комнатной температуре в течение 16 часов. К реакционной смеси добавляли 10 мл 1 моль/л хлористо-водородной кислоты и затем 20 мл воды, и экстрагировали смесь этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и очищали полученный остаток методом колоночной хроматографии на силикагеле (элюент: этилацетат/гексан) с получением 0,283 г этил-4-[2-(2-трет-бутоксикарбониламиноэтил)-5-изопропилфенокси]бутирата.
1Н-ЯМР (CDCl3) δ м.д.:
1,24 (6H, д, J=7,3 Гц), 1,26 (3H, т, J=7,3 Гц), 1,42 (9H, с), 2,10-2,19 (2H, м), 2,53 (2H, т, J=7,3 Гц), 2,72-2,79 (2H, м), 2,81-2,89 (1H, м), 3,28-3,38 (2H, м), 4,02 (2H, т, J=6,0 Гц), 4,15 (2H, кв., J=7,3 Гц), 4,75 (1H, ушир.с), 6,68-6,71 (1H, м), 6,74-6,79 (1H, м), 7,04 (1H, д, J=7,6 Гц)
Ссылочный пример 20
Этил 4-[2-(2-аминоэтил)-5-изопропилфенокси]бутиратгидрохлорид
Этил-4-[2-(2-трет-бутоксикарбониламиноэтил)-5-изопропилфенокси]бутират (0,283 г) растворяли в 10 мл 35% этанольного раствора хлороводорода и перемешивали смесь при комнатной температуре в течение 5 часов. Растворитель удаляли при пониженном давлении с получением 0,235 г этил-4-[2-(2-аминоэтил)-5-изопропилфенокси]бутиратгидрохлорида.
1Н-ЯМР (CDCl3) δ м.д.:
1,18 (3H, т, J=6,9 Гц), 1,19 (6H, д, J=6,9 Гц), 1,94-2,04 (2H, м), 2,78-2,89 (3H, м), 2,90-2,99 (2H, м), 4,01 (2H, т, J=6,3 Гц), 4,08 (2H, кв., J=6,9 Гц), 6,75-6,79 (1H, м), 6,81-6,85 (1H, м), 7,07 (1H, д, J=7,6 Гц), 7,93 (3H, ушир.с)
Ссылочный пример 21
2-(2-Бензилокси-4-изопропилфенил)этиламингидрохлорид
К раствору 0,300 г трет-бутил-N-[2-(2-бензилокси-4-изопропилфенил)этил]карбамата в 2 мл этанола при комнатной температуре добавляли 2 мл 21% этанольного раствора хлороводорода. После перемешивания при той же самой температуре в течение 2 часов реакционную смесь концентрировали при пониженном давлении с получением 0,261 г 2-(2-бензилокси-4-изопропилфенил)-этиламингидрохлорида.
1Н-ЯМР (CDCl3) δ м.д.:
1,20 (6H, д, J=6,9 Гц), 2,78-2,87 (1H, м), 3,04-3,12 (2H, м), 3,15-3,25 (2H, м), 5,10 (2H, с), 6,74 (1H, д, J=7,6 Гц), 6,78 (1H, с), 7,14 (1H, д, J=7,6 Гц), 7,33-7,48 (4H, м), 8,25 (3H, ушир.с)
Ссылочный пример 22
5-Карбамоил-2-метоксибензолсульфонилхлорид
К 1733 г хлорсульфоновой кислоты при охлаждении на льду при перемешивании в течение 15 минут небольшими порциями добавляли 150 г 4-метоксибензамида и перемешивали смесь при комнатной температуре в течение 14 часов. После перемешивания при 50°C в течение дополнительных 1,5 часов реакционную смесь вливали в 7 кг льда. Осадок собирали путем фильтрации, промывали водой и гексаном с получением 230 г 5-карбамоил-2-метоксибензолсульфонилхлорида.
1Н-ЯМР (CDCl3) δ м.д.:
3,81 (3Н, с), 7,00 (1Н, д, J=8,5 Гц), 7,10 (1H, ушир.с), 7,84 (1H, дд, J=8,5, 2,5 Гц), 7,87 (1H, ушир.с), 8,23 (1H, д, J=2,5 Гц)
Ссылочный пример 23
5-Циано-2-метоксибензолсульфонилхлорид
5-Карбамоил-2-метоксибензолсульфонилхлорид (150 г) суспендировали в 1800 мл этилацетата. После добавления к перемешиваемой суспензии при охлаждении на льду 219 мл тионилхлорида к смеси добавляли 2,3 мл N,N-диметилформамида. После перемешивания при 55°C в течение 3 часов реакционную смесь концентрировали при пониженном давлении. К остатку добавляли этилацетат и воду, промывали выделенный органический слой водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и перекристаллизовывали полученный неочищенный продукт из этилацетата/гексана с получением 86,8 г 5-циано-2-метоксибензолсульфонилхлорида.
1Н-ЯМР (CDCl3) δ м.д.:
4,16 (3H, с), 7,24 (1H, д, J=8,8 Гц), 7,96 (1H, дд, J=8,8, 2,2 Гц), 8,28 (1H, д, J=2,2 Гц)
Ссылочный пример 24
2-(Метилтио)фенилбороновая кислота
Магний (9,52 г) суспендировали в 119 мл тетрагидрофурана и добавляли к суспензии 3,00 г 2-бромтиоанизола и приблизительно 20 мг иода. После запуска реакции путем нагревания с использованием сушилки к реакционной смеси в течение 20 минут добавляли 72 г 2-бромтиоанизола. После нагревания в течение 1 часа реакционную смесь разбавляли 1000 мл тетрагидрофурана и охлаждали до 0°C. К смеси при той же самой температуре добавляли 102 мл триизопропилбората и перемешивали смесь при комнатной температуре в течение 4 часов. К реакционной смеси добавляли воду и удаляли растворитель при пониженном давлении. Добавляли остаток к 500 мл 2 моль/л хлористо-водородной кислоты и экстрагировали смесь 300 мл диэтилового эфира. Органический слой экстрагировали 500 мл 2 моль/л водного раствора гидроксида натрия и при охлаждении на льду подкисляли водный слой путем добавления концентрированной хлористо-водородной кислоты. Оставшийся диэтиловый эфир удаляли при пониженном давлении и собирали осадок путем фильтрации с получением 45,95 г 2-(метилтио)фенилбороновой кислоты.
1Н-ЯМР (CDCl3) δ м.д.:
2,50 (3H, с), 6,21-6,29 (2H, ушир.с), 7,34 (1H, тд, J=7,3, 1,3 Гц), 7,42 (1H, тд, J=7,3, 1,3 Гц), 7,52 (1H, дд, J=7,3, 1,3 Гц), 8,01 (1H, дд, J=7,3, 1,3 Гц)
Ссылочный пример 25
Гидроксиламмонийацетат
К 100 мл 50% водного раствора гидроксиламина при охлаждении на льду при перемешивании медленно добавляли 86,6 мл уксусной кислоты и перемешивали смесь при той же самой температуре в течение 40 минут, а затем при комнатной температуре в течение 40 минут. После концентрирования реакционной смеси при пониженном давлении остаток растворяли в 50 мл этанола и концентировали раствор при пониженном давлении. К остатку добавляли толуол, концентировали смесь при пониженном давлении и сушили с получением 76,4 г гидроксиламмонийацетата в виде бесцветного твердого вещества.
1Н-ЯМР (CDCl3) δ м.д.:
1,88 (3H, с), 7,63 (4H, ушир.с)
Ссылочный пример 26
5-Циано-N-[2-(4-гидрокси-2-метоксиметоксифенил)этил]-2-метоксибензолсульфонамид
4-(2-Аминоэтил)-3-метоксиметоксифенол (12,3 г) и 7,9 г бикарбоната натрия суспендировали в смеси 133 мл тетрагидрофурана и 14,4 мл воды, порциями по 18 мл каждые 10 минут добавляли к суспензии раствор 14,50 г 5-циано-2-метоксибензолсульфонилхлорида в 180 мл тетрагидрофурана при условии сохранения внутренней температуры в диапазоне 10-20°C. После перемешивания при комнатной температуре в течение 8 часов реакционную смесь очищали методом колоночной хроматографии на аминопропилированном силикагеле (элюент: этилацетат) и перекристаллизовывали из этилацетата/диизопропилового эфира с получением 21,87 г 5-циано-N-[2-(4-гидрокси-2-метоксиметоксифенил)этил]-2-метоксибензолсульфонамида в виде бесцветного кристаллического вещества.
1Н-ЯМР (CDCl3) δ м.д.:
2,74 (2H, т, J=6,3 Гц), 3,10-3,20 (2H, м), 3,40 (3H, с), 3,81 (3H, с), 4,85-4,95 (2H, м), 5,08 (2H, с), 6,38 (1H, дд, J=8,2, 2,2 Гц), 6,59 (1H, д, J=2,2 Гц), 6,87 (1H, д, J=8,2 Гц), 7,00 (1H, д, J=8,5 Гц), 7,78 (1H, дд, J=8,5, 2,2 Гц), 8,16 (1H, д, J=2,2 Гц)
Ссылочный пример 27
Этил [2-[2-(5-циано-2-метоксибензолсульфониламино)этил]-5-изопропилфенокси]ацетат
К перемешиваемому раствору 326 мг этил [2-(2-аминоэтил)-5-изопропилфенокси]ацетатгидрохлорида и 0,452 мл триэтиламина в смеси 10 мл тетрагидрофурана и 5 мл воды при охлаждении на льду добавляли 238 мг 5-циано-2-метоксибензолсульфонилхлорида, и перемешивали смесь при комнатной температуре в течение 6 часов. К реакционной смеси добавляли 30 мл воды и экстрагировали смесь 120 мл этилацетата. Органический слой промывали 100 мл воды и 100 мл насыщенного солевого раствора, и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и очищали остаток методом колоночной хроматографии на силикагеле (элюент: этилацетат/гексан) с получением 343 мг этил [2-[2-(5-циано-2-метоксибензолсульфониламино)этил]-5-изопропилфенокси]-ацетата.
1Н-ЯМР (DMSO-d6) δ м.д.:
1,14 (6H, д, J=6,9 Гц), 1,19 (3H, т, J=7,3 Гц), 2,60-2,70 (2H, м), 2,78 (1H, септ, J=6,9 Гц), 3,02-3,07 (2H, м), 3,94 (3H, с), (2H, кв., J=7,3 Гц), 4,70 (2H, с), 6,65 (1H, д, J=1,7 Гц), 6,71 (1H, дд, J=7,6, 1,7 Гц), 6,95 (1H, д, J=7,6 Гц), 7,35 (1H, д, J=8,5 Гц), 7,49 (1H, ушир.с), 8,00-8,10 (2H, м)
Ссылочный пример 28
Следующие соединения были получены путем, сходным с описанным в ссылочном примере 26 или 27.
Этил 4-[2-[2-(5-циано-2-метоксибензолсульфониламино)этил]-5-изопропилфенокси]бутират
1Н-ЯМР (CDCl3) δ м.д.:
1,22 (6H, д, J=6,9 Гц), 1,27 (3H, т, J=7,3 Гц), 2,01-2,09 (2H, м), 2,44 (2H, т, J=7,3 Гц), 2,76 (2H, т, J=6,6 Гц), 2,80-2,90 (1H, м), 3,11-3,19 (2H, м), 3,79 (3H, с), 3,94 (2H, т, J=6,0 Гц), 4,16 (2H, кв., J=7,3 Гц), 4,99 (1H, т, J=5,7 Гц), 6,64-6,68 (1H, м), 6,71-6,76 (1H, м), 6,94 (1H, д, J=7,6 Гц), 6,99 (1H, д, J=8,8 Гц), 7,78 (1H, дд, J=8,8, 2,2 Гц), 8,20 (1H, д, J=2,2 Гц)
N-[2-(2-бензилокси-4-изопропилфенил)этил]-5-циано-2-метоксибензолсульфонамид
1Н-ЯМР (CDCl3) δ м.д.:
1,23 (6H, д, J=6,9 Гц), 2,76-2,91 (3H, м), 3,14-3,21 (2H, м), 3,66 (3H, с), 4,85-4,91 (1H, м), 4,98 (2H, с), 6,74-6,79 (2H, м), 6,92 (1H, д, J=8,5 Гц), 6,97 (1H, д, J=8,2 Гц), 7,29-7,43 (5H, м), 7,73 (1H, дд, J=8,5, 1,9 Гц), 8,15 (1H, д, J=1,9 Гц)
Этил 2-[2-[2-(5-циано-2-метоксибензолсульфониламино)этил]-5-изопропилфенокси]пропионат
1Н-ЯМР (CDCl3) δ м.д.:
1,16-1,22 (6H, м), 1,23-1,29 (3H, м), 1,57 (3H, д, J=6,8 Гц), 2,68-2,96 (3H, м), 3,16-3,37 (2H, м), 3,73 (3H, с), 4,15-4,24 (2H, м), 4,77 (1H, кв., J=6,8 Гц), 5,26 (1H, т, J=5,7 Гц), 6,51-6,53 (1H, м), 6,72-6,76 (1H, м), 6,90 (1H, д, J=7,6 Гц), 6,98 (1H, д, J=8,6 Гц), 7,77 (1H, дд, J=8,6, 3,2 Гц), 8,30 (1H, д, J=3,2 Гц)
Ссылочный пример 29
4-[2-(5-Циано-2-метоксибензолсульфониламино)этил]-3-метоксиметоксифенилтрифторметансульфонат
К перемешиваемому раствору 21,87 г 5-циано-N-[2-(4-гидрокси-2-метоксиметоксифенил)этил]-2-метоксибензолсульфонамида и 10,21 г N,N-диметиламинопиридина в 230 мл дихлорметана добавляли 9,38 мл трифторметансульфонового ангидрида при охлаждении на льду. Смесь перемешивали в течение 1 часа, и добавляли к реакционной смеси приблизительно 50 г измельченного льда. Смесь концентрировали при пониженном давлении для удаления дихлорметана, и вливали остаток в смесь 500 мл этилацетата и 200 мл воды. Органический слой отделяли, промывали водой, сушили над безводным сульфатом магния, и фильтровали. Фильтрат концентрировали при пониженном давлении, и перекристаллизовывали остаток из этилацетата/диизопропилового эфира с получением 24,75 г 4-[2-(5-циано-2-метоксибензолсульфониламино)этил]-3-метоксиметоксифенилтрифторметансульфоната в виде бесцветного порошка.
1Н-ЯМР (CDCl3) δ м.д.:
2,86 (2H, т, J=6,6 Гц), 3,15-3,25 (2H, м), 3,44 (3H, с), 3,86 (3H, с), 4,89 (1H, т, J=6,0 Гц), 5,16 (2H, с), 6,86 (1H, дд, J=8,5, 2,2 Гц), 7,00-7,05 (2H, м), 7,12 (1H, д, J=8,5 Гц), 7,81 (1H, дд, J=8,5, 2,2 Гц), 8,20 (1H, д, J=2,2 Гц)
Ссылочный пример 30
5-Циано-2-метокси-N-[2-(3-метоксиметокси-2'-метилтиобифенил-4-ил)этил]бензолсульфонамид
Смесь 24,75 г 4-[2-(5-циано-2-метоксибензолсульфониламино)-этил]-3-метоксиметоксифенилтрифторметансульфоната, 8,32 г 2-(метилтио)фенилбороновой кислоты, 2,73 г тетракис(трифенилфосфин)палладия(0), 728 мг тетра-н-бутиламмонийбромида, 10,00 г карбоната натрия, 48 мл воды и 285 мл толуола нагревали в атмосфере аргона при 85°C в течение 15 часов. Осадок собирали путем фильтрации, последовательно промывали этилацетатом и водой с получением 19,74 г 5-циано-2-метокси-N-[2-(3-метоксиметокси-2'-метилтиобифенил-4-ил)этил]бензолсульфонамида в виде желтого порошка.
1Н-ЯМР (CDCl3) δ м.д.:
2,40 (3H, с), 2,88 (2H, т, J=6,3 Гц), 3,19-3,27 (2H, м), 3,43 (3H, с), 3,82 (3H, с), 5,04 (1H, т, J=5,7H z), 5,17 (2H, с), 6,95-7,05 (2H, м), 7,08 (1H, д, J=7,6 Гц), 7,10-7,25 (3H, м), 7,25-7,30 (1H, м), 7,30-7,40 (1H, м), 7,79 (1H, дд, J=8,8, 2,2 Гц), 8,22 (1H, д, J=2,2 Гц)
Ссылочный пример 31
Следующее соединение было получено путем, сходным с описанным в ссылочном примере 30.
N-трет-Бутил-4'-[2-(5-циано-2-метоксибензолсульфониламино)-этил]-3'-метоксиметоксибифенил-2-сульфонамид
1Н-ЯМР (CDCl3) δ м.д.:
1,01 (9Н, с), 2,89 (2Н, т, J=6,6 Гц), 3,23 (2H, м), 3,43 (3Н, с), 3,79 (1H, с), 3,96 (3H, с), 4,99 (1H, т, J=6,0 Гц), 5,22 (2H, с), 7,06 (1H, дд, J=7,6, 1,6 Гц), 7,09 (1H, д, J=8,8 Гц), 7,15 (1H, д, J=7,6 Гц), 7,28-7,35 (2H, м), 7,49 (1H, тд, J=7,6, 1,3 Гц), 7,57 (1H, тд, J=7,6, 1,3 Гц), 7,82 (1H, дд, J=8,8, 2,2 Гц), 8,17 (1H, дд, J=7,6, 1,3 Гц), 8,22 (1H, д, J=2,2 Гц)
Ссылочный пример 32
5-Циано-2-метокси-N-[2-(3',4',5'-трифтор-3-метоксиметоксибифенил-4-ил)этил]бензолсульфонамид
Смесь 10,0 г 4-[2-(5-циано-2-метоксибензолсульфониламино)этил]-3-метоксиметоксифенилтрифторметансульфоната, 5,33 г бис(пинаколято)диборана, 467 мг комплекса дихлорида 1,1'-бис(дифенилфосфино)ферроценпалладия(II) и дихлорметана, 317 мг 1,1'-бис-(дифенилфосфино)ферроценпалладия(II), 5,61 г карбоната калия и 113 мл 1,4-диоксана перемешивали в атмосфере аргона при 80°C в течение 15 часов. К реакционной смеси добавляли 4,02 г 1-бром-3,4,5-трифторбензола, 467 мг комплекса дихлорида 1,1'-бис(дифенилфосфино)ферроценпалладия(II) и дихлорметана, 12,14 г фосфината калия и 40 мл 1,4-диоксана. Смесь перемешивали в атмосфере аргона при 80°C в течение 24 часов и добавляли к реакционной смеси этилацетат и воду. Органический слой отделяли, промывали водой, сушили над безводным сульфатом магния, и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали остаток методом колоночной хроматографии на аминопропилированном силикагеле (элюент: этилацетат/гексан) с получением 10,09 г 5-циано-2-метокси-N-[2-(3',4',5'-трифтор-3-метоксиметоксибифенил-4-ил)этил]-бензолсульфонамида.
1Н-ЯМР (CDCl3) δ м.д.:
2,87 (2H, т, J=6,6 Гц), 3,18-3,26 (2H, м), 3,46 (3H, с), 3,85 (3H, с), 4,92 (1H, т, J=6,0 Гц), 5,21 (2H, с), 7,02 (1H, д, J=8,5 Гц), 7,06 (1H, дд, J=7,9, 1,6 Гц), 7,10-7,20 (4H, м), 7,79 (1H, дд, J=8,5, 2,2 Гц), 8,20 (1H, д, J=2,2 Гц)
Ссылочный пример 33
5-Циано-N-[2-(2'-метансульфонил-3-метоксиметоксибифенил-4-ил)этил]-2-метоксибензолсульфонамид
К перемешиваемой суспензии 26,44 г 5-циано-2-метокси-N-[2-(3-метоксиметокси-2'-метилтиобифенил-4-ил)этил]бензолсульфонамида и 35,6 г бикарбоната калия в смеси 530 мл ацетона и 106 мл воды каждые 15 минут при охлаждении на льду добавляли две порции 81,5 г OXONE (торговая марка). Смесь перемешивали при тех же условиях в течение 3 часов и добавляли к перемешиваемой реакционной смеси при охлаждении на льду 100 мл диэтилового эфира, 100 мл воды и насыщенный водный раствор сульфата натрия. Полученную смесь концентрировали при пониженном давлении для удаления ацетона, и добавляли к перемешиваемому остатку при охлаждении на льду 300 мл воды и диэтиловый эфир/гексан. Смесь перемешивали в течение 30 минут, собирали осадок путем фильтрации, промывали водой и диэтиловым эфиром/гексаном с получением 27,1 г 5-циано-N-[2-(2'-метансульфонил-3-метоксиметоксибифенил-4-ил)этил]-2-метоксибензолсульфонамида в виде белого порошка.
1Н-ЯМР (DMSO-d6) δ м.д.:
2,65-2,75 (2H, м), 2,79 (3H, с), 3,05-3,15 (2H, м), 3,30-3,35 (3H, м), 4,00 (3H, с), 5,15 (2H, с), 6,94 (1H, дд, J=7,6, 1,6 Гц), 7,06 (1H, д, J=1,6 Гц), 7,16 (1H, д, J=7,6 Гц), 7,35-7,45 (2H, м), 7,66 (1H, тд, J=7,6, 1,3 Гц), 7,70-7,80 (2H, м), 8,05-8,15 (3H, м)
Ссылочный пример 34
5-Циано-N-[2-(3-гидрокси-2'-метансульфонилбифенил-4-ил)этил]-2-метоксибензолсульфонамид
К суспензии 14,89 г 5-циано-N-[2-(2'-метансульфонил-3-метоксиметоксибифенил-4-ил)этил]-2-метоксибензолсульфонамида в смеси 30 мл изопропанола и 90 мл тетрагидрофурана добавляли 11,7 мл концентрированной хлористо-водородной кислоты. После перемешивания при 50°C в течение 2 часов, реакционную смесь разбавляли 50 мл воды и экстрагировали 150 мл этилацетата. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали остаток методом колоночной хроматографии на аминопропилированном силикагеле (элюент: этилацетат/метанол) с получением 10,22 г 5-циано-N-[2-(3-гидрокси-2'-метансульфонилбифенил-4-ил)этил]-2-метоксибензолсульфонамида в виде бесцветного аморфного вещества.
1Н-ЯМР (CDCl3) δ м.д.:
2,69 (3Н, с), 2,87 (2Н, т, J=6,9 Гц), 3,20-3,30 (2H, м), 3,98 (3H, с), 5,34 (1H, т, J=5,7 Гц), 5,93 (1H, с), 6,88 (1H, дд, J=7,6, 1,6 Гц), 6,97 (1H, д, J=1,6 Гц), 7,05-7,15 (2H, м), 7,33 (1H, дд, J=7,6, 1,3 Гц), 7,56 (1H, тд, J=7,6, 1,3 Гц), 7,65 (1H, тд, J=7,6, 1,3 Гц), 7,82 (1H, дд, J=8,5, 2,2 Гц), 8,15-8,25 (2H, м)
Ссылочный пример 35
Следующие соединения были получены путем, сходным с описанным в ссылочном примере 34.
5-Циано-2-метокси-N-[2-(3',4',5'-трифтор-3-гидроксибифенил-4-ил)этил]бензолсульфонамид
1Н-ЯМР (DMSO-d6) δ м.д.:
2,64 (2H, т, J=7,3 Гц), 3,07 (2H, т, J=7,3 Гц), 3,96 (3H, с), 6,93 (1H, д, J=1,9 Гц), 6,99 (1H, дд, J=7,6, 1,9 Гц), 7,05 (1H, д, J=7,6 Гц), 7,35 (1H, д, J=8,5 Гц), 7,40-7,50 (2H, м), 7,95-8,05 (2H, м)
N-трет-Бутил-4'-[2-(5-циано-2-метоксибензолсульфониламино)-этил]-3'-гидроксибифенил-2-сульфонамид
1Н-ЯМР (CDCl3) δ м.д.:
1,00 (9H, с), 2,87 (2H, т, J=6,6 Гц), 3,23 (2H, м), 3,98 (3H, с), 5,28 (1H, т, J=5,7 Гц), 6,10 (1H, с), 6,91 (1H, дд, J=7,6, 1,6 Гц), 7,06 (1H, д, J=1,6 Гц), 7,10 (1H, д, J=8,5 Гц), 7,13-7,20 (2H, м), 7,29 (1H, дд, J=7,6, 1,3 Гц), 7,48 (1H, тд, J=7,6, 1,3 Гц), 7,56 (1H, тд, J=7,6, 1,3 Гц), 7,82 (1H, дд, J=7,6, 1,3 Гц), 8,14 (1H, дд, J=8,5, 2,2 Гц), 8,21 (1H, д, J=2,2 Гц)
Ссылочный пример 36
Следующее соединение было получено путем, сходным с описанным в ссылочном примере 32 и 34.
Метил 4'-[2-(5-циано-2-метоксибензолсульфониламино)этил]-3'-гидроксибифенил-2-карбоксилат
1Н-ЯМР (CDCl3) δ м.д.:
2,84 (2H, т, J=6,3 Гц), 3,20-3,30 (2H, м), 3,70 (3H, с), 3,90 (3H, с), 5,53 (1H, т, J=5,4 Гц), 5,93 (1H, ушир.), 6, 67 (1H, д, J=1,6 Гц), 6,78 (1H, дд, J=7,9, 1,6 Гц), 7,00-7,05 (2H, м), 7,41 (1H, тд, J=7,6, 1,3 Гц), 7,51 (1H, тд, J=7,6, 1,3 Гц), 7,73 (1H, дд, J=8,8, 2,2 Гц), 7,77 (1H, дд, J=7,6, 1,3 Гц), 8,21 (1H, д, J=2,2 Гц)
Ссылочный пример 37
Этил [4-[2-(5-циано-2-метоксибензолсульфониламино)этил]-2'-метансульфонилбифенил-3-илокси]ацетат
К раствору 5,72 г 5-циано-N-[2-(3-гидрокси-2'-метансульфонилбифенил-4-ил)этил]-2-метоксибензолсульфонамида в 57 мл N,N-диметилформамида добавляли 2,46 мл N,N-диизопропилэтиламина и 1,37 мл этилбромацетата. После перемешивания при 50°C в течение 15 часов реакционную смесь вливали в 100 мл воды и экстрагировали смесь 150 мл этилацетата и 20 мл толуола. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали остаток методом колоночной хроматографии на аминопропилированном силикагеле (элюент: этилацетат/гексан) с получением 2,96 г этил [4-[2-(5-циано-2-метоксибензолсульфониламино)этил]-2'-метан-сульфонилбифенил-3-илокси]ацетата в виде аморфного вещества.
1Н-ЯМР (CDCl3) δ м.д.:
1,28 (3H, т, J=6,9 Гц), 2,59 (3H, с), 2,95 (2H, т, J=6,6 Гц), 3,30-3,60 (2H, м), 3,99 (3H, с), 4,23 (2H, кв., J=6,9 Гц), 4,68 (2H, с), 5,43 (1H, т, J=6,3 Гц), 6,95 (1H, дд, J=7,6, 1,6 Гц), 7,04 (1H, д, J=1,6 Гц), 7,09 (1H, д, J=8,5 Гц), 7,20 (1H, д, J=7,6 Гц), 7,36 (1H, дд, J=7,6, 1,3 Гц), 7,57 (1H, тд, J=7,6, 1,3 Гц), 7,65 (1H, тд, J=7,6, 1,3 Гц), 7,80 (1H, дд, J=8,5, 2,2 Гц), 8,20-8,25 (2H, м)
Ссылочный пример 38
Следующие соединения были получены путем, сходным с описанным в ссылочном примере 37.
Этил [4-[2-(5-циано-2-метоксибензолсульфониламино)этил]-3',4',5'-трифторбифенил-3-илокси]ацетат
1Н-ЯМР (CDCl3) δ м.д.:
1,32 (3H, т, J=7,3 Гц), 2, 92 (2H, т, J=6, 6 Гц), 3,30 (2H, кв., J=6,6 Гц), 3,88 (3Н, с), 4,27 (2H, кв., J=7,3 Гц), 4,68 (2H, с), 5,26 (1H, т, J=6,6 Гц), 6,78 (1H, д, J=1,6 Гц), 7,00-7,14 (4H, м), 7,16 (1H, д, J=7,6 Гц), 7,78 (1H, дд, J=8,8, 2,2 Гц), 8,20 (1H, д, J=2,2 Гц)
Метил-4'-[2-(5-циано-2-метоксибензолсульфониламино)этил]-3'-этоксикарбонилметоксибифенил-2-карбоксилат
1Н-ЯМР (CDCl3) δ м.д.:
1,29 (3H, т, J=6,9 Гц), 2,91 (2H, т, J=6,3 Гц), 3,25-3,35 (2H, м), 3,68 (3H, с), 3,89 (3H, с), 4,25 (2H, кв., J=6,3 Гц), 4,59 (2H, с), 5,33 (1H, т, J=6,0 Гц), 6,66 (1H, д, J=1,6 Гц), 6,88 (1H, дд, J=7,6, 1,6 Гц), 7,05 (1H, д, J=8,5 Гц), 7,08 (1H, д, J=7,6 Гц), 7,30 (1H, дд, J=7,6, 1,3 Гц), 7,42 (1H, тд, J=7,6, 1,3 Гц), 7,53 (1H, тд, J=7,6, 1,3 Гц), 7,75-7,85 (2H, м), 8,22 (1H, д, J=2,2 Гц)
Этил [2'-трет-бутилсульфамоил-4-[2-(5-циано-2-метоксибензол-сульфониламино)этил]бифенил-3-илокси]ацетат
1Н-ЯМР (CDCl3) δ м.д.:
0,94 (9H, с), 1,31 (3H, т, J=7,3 Гц), 2,94 (2H, т, J=6,6 Гц), 3,32 (2H, м), 3,86 (1H, с), 3,99 (3H, с), 4,27 (2H, кв., J=7,3 Гц), 4,72 (2H, с), 5,28 (1H, т, J=6,3 Гц), 6,94 (1H, дд, J=7,6, 1,9 Гц), 7,08 (1H, д, J=8,8 Гц), 7,22 (1H, д, J=1,3 Гц), 7,24 (1H, д, J=7,6 Гц), 7,33 (1H, дд, J=7,6, 1,3 Гц), 7,48 (1H, тд, J=7,6, 1,3 Гц), 7,56 (1H, тд, J=7,6, 1,3 Гц), 7,81 (1H, дд, J=8,8, 2,2 Гц), 8,17 (1H, дд, J=7,6, 1,3 Гц), 8,21 (1H, д, J=2,2 Гц)
Ссылочный пример 39
[2-[2-(5-Циано-2-метоксибензолсульфониламино)этил]-5-изопропилфенокси]уксусная кислота
К раствору 4,52 г этил [2-[2-(5-циано-2-метоксибензол-сульфониламино)этил]-5-изопропилфенокси]ацетата в этаноле для нейтрализации добавляли 12,3 мл 2 моль/л раствора гидроксида натрия. После перемешивания при комнатной температуре в течение 3 часов реакционную смесь концентрировали и добавляли к остатку 1 моль/л хлористо-водородной кислоты. Затем экстрагировали смесь этилацетатом, промывали органический слой водой и насыщенным солевым раствором, и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении с получением 4,16 г [2-[2-(5-циано-2-метоксибензолсульфониламино)этил]-5-изопропилфенокси]уксусной кислоты.
1Н-ЯМР (CDCl3) δ м.д.:
1,22 (6H, д, J=6,3 Гц), 2,80-2,89 (3H, м), 3,18-3,24 (2H, м), 3,74 (3H, с), 4,68 (2H, с), 5,35 (1H, т, J=5,7 Гц), 6,58-6,62 (1H, м), 6,80 (1H, д,J=7,3 Гц), 6,97 (1H, д, J=7,3 Гц), 6,99 (1H, д, J=8,5 Гц), 7,30-8,10 (2H, м), 8,18 (1H, д, J=2,2 Гц)
Ссылочный пример 40
Следующее соединение было получено путем, сходным с описанным в ссылочном примере 39.
4-[2-(5-Циано-2-метоксибензолсульфониламино)этил]-3',4',5'-трифторбифенил-3-илокси]уксусная кислота
1Н-ЯМР (CDCl3) δ м.д.:
2,71 (2H, т, J=7,3 Гц), 3,05-3,20 (2H, м), 3,93 (3H, с), 4,78 (2H, с), 7,10-7,15 (2H, м), 7,19 (1H, дд, J=7,9, 1,6 Гц), 7,30-7,35 (1H, м), 7,60-7,75 (3H, м), 8,00-8,05 (2H, м), 12,5-13,5 (1H, ушир.)
Ссылочный пример 41
Этил [2-[2-[2-(5-циано-2-метоксибензолсульфониламино)этил]-5-изопропилфенокси]ацетиламино]ацетат
К перемешиваемому раствору 0,3 г [2-[2-(5-циано-2-метокси-бензолсульфониламино)этил]-5-изопропилфенокси]уксусной кислоты, 0,107 г гидрохлорида этилового эфира глицина и 0,103 г 1-гидроксибензотриазолмоногидрата в N,N-диметилформамиде при охлаждении на льду добавляли 0,106 мл триэтиламина и 0,146 г 1-[3-(диметиламино)пропил]-3-этилкарбодиимидгидрохлорида, и перемешивали смесь при комнатной температуре 15 часов. К реакционной смеси добавляли воду и экстрагировали смесь этилацетатом. Органический слой промывали хлористо-водородной кислотой (1 моль/л), насыщенным водным раствором бикарбоната натрия, водой и насыщенным солевым раствором, и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и очищали полученный остаток методом колоночной хроматографии на силикагеле (элюент: этилацетат/гексан) с получением 0,33 г этил [2-[2-[2-(5-циано-2-метоксибензолсульфониламино)этил]-5-изопропилфенокси]ацетиламино]ацетата.
1Н-ЯМР (CDCl3) δ м.д.:
1,22 (6H, д, J=7,3 Гц), 1,31 (3H, т, J=7,3 Гц), 2,80-3,00 (3H, м), 3,17-3,24 (2H, м), 3,91 (3H, с), 4,16 (2H, д, J=5,5 Гц), 4,27 (2H, кв., J=7,3 Гц), 4,53 (2H, с), 5,24 (1H, т, J=6,3 Гц), 6,68 (1H, д, J=1,1 Гц), 6,83 (1H, дд, J=7,9, 1,1 Гц), 7,01 (1H, д, J=7,9 Гц), 7,05 (1H, д, J=8,4 Гц), 7,80 (1H, дд, J=8,4, 2,2 Гц), 8,21 (1H, д, J=2,2 Гц)
Ссылочный пример 42
Следующее соединение было получено путем, сходным с описанным в ссылочном примере 41.
Этил 3-[2-[4-[2-(5-циано-2-метоксибензолсульфониламино)этил]-3',4',5'-трифторбифенил-3-илокси]ацетиламино]пропионат
1Н-ЯМР (DMSO-d6) δ м.д.:
1,14 (3H, т, J=7,3 Гц), 2,78 (2H, т, J=6, 9 Гц), 3,12 (2H, кв., J=6,9 Гц), 3,35-3,45 (2H, м), 3,93 (3H, с), 4,01 (2H, кв., J=7,3 Гц), 4,59 (2H, с), 7,10-7,20 (2H, м), 7,22 (1H, дд, J=7,9, 1,6 Гц), 7,34 (1H, д, J=8,5 Гц), 7,61-7,66 (1H, м), 7,67-7,75 (2H, м), 7,87 (1H, т, J=6,0 Гц), 8,00-8,05 (2H, м)
Ссылочный пример 43
2-[2-[2-(5-Циано-2-метоксибензолсульфониламино)этил]-5-изопропилфенокси]ацетамид
Смесь 0,169 г [2-[2-(5-циано-2-метоксибензолсульфонамино)-этил]-5-изопропилфенокси]уксусной кислоты, 41,8 мг хлорида аммония, 79,2 мг 1-гидроксибензотриазолмоногидрата, 0,272 мл N,N-диизопропилэтиламина и 0,112 г 1-[3-(диметиламино)пропил]-3-этилкарбодиимидгидрохлорида перемешивали при комнатной температуре в течение 27 часов. Реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель удаляли при пониженном давлении и очищали полученный остаток методом колоночной хроматографии на аминопропилированном силикагеле (элюент: дихлорметан/этилацетат) с получением 151,4 мг 2-[2-[2-(5-циано-2-метоксибензолсульфониламино)этил]-5-изопропилфенокси]ацетамида.
1Н-ЯМР (CDCl3) δ м.д.:
1,22 (6Н, д, J=7,3 Гц), 2,83-2,92 (3H, м), 3,14-3,21 (2H, м), 3,90 (3H, с), 4,51 (2H, с), 5,21 (1H, ушир.с), 5,87 (1H, ушир.с), 6,10 (1H, д, J=1,3 Гц), 6,80 (1H, ушир.с), 6,82 (1H, дд, J=7,9, 1,3 Гц), 7,00 (1H, д, J=7,9 Гц), 7,06 (1H, д, J=8,5 Гц), 7,81 (1H, дд, J=8,5, 1,9 Гц), 8,17 (1H, д, J=1,9 Гц)
Ссылочный пример 44
Следующие соединения были получены путем, сходным с описанным в ссылочном примере 43.
2-[2-[2-(5-Циано-2-метоксибензолсульфониламино)этил]-5-изопропилфенокси]-N,N-диметилацетамид
1Н-ЯМР (CDCl3) δ м.д.:
1,22 (6H, д, J=6,9 Гц), 2,80-2,90 (3H, м), 2,99 (3H, с), 3,06 (3H, с), 3,21-3,28 (2H, м), 3,80 (3H, с), 4,67 (2H, с), 5,71 (1H, т, J=6,0 Гц), 6,64 (1H, д, J=1,3 Гц), 6,77 (1H, дд, J=7,6, 1,3 Гц), 6,95 (1H, д, J=7,6 Гц), 6,99 (1H, д, J=8,5 Гц), 7,76 (1H, дд, J=8,5, 2,2 Гц), 8,18 (1H, д, J=2,2 Гц)
5-Циано-N-[2-[4-изопропил-2-(2-морфолин-4-ил-2-оксоэтокси)фенил]этил]-2-метоксибензолсульфонамид
1Н-ЯМР (CDCl3) δ м.д.:
1,22 (6H, д, J=6,9 Гц), 2,79-2,90 (3H, м), 3,22 (2H, кв., J=6,0 Гц), 3,50-3,56 (2H, м), 3,60-3,72 (6H, м), 3,82 (3H, с), 4,68 (2H, с), 5,47 (1H, т, J=6,0 Гц), 6,66 (1H, д, J=1,3 Гц), 6,79 (1H, дд, J=7,9, 1,3 Гц), 6,96 (1H, д, J=7,9 Гц), 7,00 (1H, д, J=8,5 Гц), 7,77 (1H, дд, J=8,5, 2,2 Гц), 8,18 (1H, д, J=2,2 Гц)
Ссылочный пример 45
(4-Изопропилфенил)ацетонитрил
К перемешиваемому раствору 100 г 4-изопропилбензилхлорида в 1500 мл N,N-диметилформамида при охлаждении на льду добавляли 32,0 г цианида натрия. Смесь перемешивали при 70°C в течение 4 часов и добавляли к реакционной смеси воду. Смесь экстрагировали этилацетатом и промывали органический слой водой и насыщенным солевым раствором, и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении с получением 96,5 г (4-изопропилфенил)ацетонитрила.
1Н-ЯМР (CDCl3) δ м.д.:
1,24 (6H, д, J=6,9 Гц), 2,91 (1H, септ, J=6,9 Гц), 3,70 (2H, с), 7,22-7,27 (4H, м)
Ссылочный пример 46
2-(4-Изопропилфенил)этиламингидрохлорид
К 1000 мл 1,0 моль/л комплекса боран/тетрагдрофуран при охлаждении на льду при перемешивании по каплям добавляли раствор 79,6 г (4-изопропилфенл)ацетонитрила в 400 мл тетрагидрофурана и перемешивали смесь при комнатной температуре в течение 2 часов. К перемешиваемой реакционной смеси при охлаждении на льду в течение 30 минут добавляли 500 мл метанола и перемешивали смесь при той же температуре в течение 20 минут. После концентрирования смеси при пониженном давлении к остатку добавляли изопропанол и 500 мл 2 моль/л хлористо-водородной кислоты. Удаляли растворитель при пониженном давлении и перекристаллизовывали остаток из изопропанол/диизопропилового эфира с получением 41,5 г 2-(4-изопропилфенил)этиламиногидрохлорида.
1Н-ЯМР (CDCl3) δ м.д.:
1,18 (6H, д, J=6,9 Гц), 2,81-2,92 (3H, м), 2,96-3,05 (2H, м), 7,14-7,26 (4H, м), 8,05 (3H, ушир.с)
Ссылочный пример 47
2,2,2-трифтор-N-[2-(4-изопропилфенил)этил]ацетамид
К перемешиваемому раствору 2,59 г 2-(4-изопропилфенил)-этиламин в 10 мл N,N-диметилформамида при охлаждении на льду добавляли 4,0 мл триэтиламина и 1,95 мл трифторуксусного ангидрида, и перемешивали смесь при комнатной температуре в течение часа. К реакционной смеси добавляли воду и 10 мл 1 моль/л хлористо-водородной кислоты, и трижды экстрагировали смесь 20 мл этилацетата. Органические слои объединяли и промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Смесь сушили над безводным сульфатом магния и удаляли растворитель при пониженном давлении. К остатку добавляли гексан и собирали кристаллическое вещество путем фильтрации с получением 2,39 г 2,2,2-трифтор-N-[2-(4-изопропилфенил)этил]ацетамида.
1Н-ЯМР (CDCl3) δ м.д.:
1,24 (6H, д, J=6,9 Гц), 2,79-2,96 (3H, м), 3,60 (2H, кв., J=6,6 Гц), 6,33 (1H, ушир.с), 7,11 (2H, д, J=7,9 Гц), 7,20 (2H, д, J=7,9 Гц)
Ссылочный пример 48
5-Изопропил-2-[2-(2,2,2-трифторацетиламино)этил]бензолсульфонилхлорид
Хлорсульфоновую кислоту (2,05 мл) добавляли к 1,6 г 2,2,2-трифтор-N-[2-(4-изопропилфенил)этил]ацетамида и перемешивали смесь при комнатной температуре в течение 3 часов. Реакционную смесь вливали в ледяную воду и добавляли в смесь воду. Смесь экстрагировали этилацетатом, промывали органический слой насыщенным солевым раствором и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении и очищали остаток методом колоночной хроматографии на силикагеле (элюент: этилацетат/гексан) с получением 0,463 г 5-изопропил-2-[2-(2,2,2-трифторацетиламино)этил]бензолсульфонилхлорида.
1Н-ЯМР (CDCl3) δ м.д.:
1,30 (6H, д, J=6,9 Гц), 3,02 (1H, септ, J=6,9 Гц), 3,39 (2H, т, J=7,3 Гц), 3,68-3,77 (2H, м), 6,66 (1H, ушир.с), 7,42 (1H, д, J=7,9 Гц), 7,57 (1H, дд, J=7,9, 1,9 Гц), 7,95 (1H, д, J=1,9 Гц)
Ссылочный пример 49
N-[2-(2-трет-бутилсульфамоил-5-изопропилфенил)этил]-2,2,2-трифторацетамид
К раствору 0,463 г 5-изопропил-2-[2-(2,2,2-трифторацетиламино)этил]бензолсульфонилхлорида в 30 мл тетрагидрофурана добавляли 0,500 мл трет-бутиламина. Смесь герметизировали и перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и растворяли остаток в 30 мл воды и 10 мл 1 моль/л хлористо-водородной кислоты. Смесь экстрагировали этилацетатом и промывали органический слой водой, насыщенным водным раствором бикарбонатом натрия и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния и удаляли растворитель при пониженном давлении с получением 0,481 г N-[2-(2-трет-бутилсульфамоил-5-изопропилфенил)этил]-2,2,2-трифторацетамида.
1Н-ЯМР (CDCl3) δ м.д.:
1,21-1,35 (15H, м), 2,90-3,05 (1H, м), 3,22-3,36 (2H, м), 3,61-3,75 (2H, м), 4,54-4,66 (1H, м), 7,32-7,49 (2H, м), 7,84-7,95 (1H, м)
Ссылочный пример 50
2-(2-Аминоэтил)-N-трет-бутил-5-изопропилбензолсульфонамид
К раствору 0,481 г N-[2-(2-трет-бутилсульфамоил-5-изопропилфенил)этил]-2,2,2-трифторацетамида в 5 мл этанола добавляли 5 мл 2 моль/л раствора гидроксида натрия и выдерживали смесь при комнатной температуре в течение 4 часов. К реакционной смеси добавляли 5 мл 2 моль/л хлористо-водородной кислоты и концентрировали смесь при пониженном давлении. К остатку добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали смесь этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении с получением 0,288 г 2-(2-аминоэтил)-N-трет-бутил-5-изопропилбензолсульфонамида.
1Н-ЯМР (CDCl3) δ м.д.:
1,20-1,28 (15H, м), 2,94 (1H, септ, J=6,9 Гц), 3,09 (2H, т, J=6,6 Гц), 3,21 (2H, т, J=6,6 Гц), 7,23-7,28 (1H, м), 7,33 (1H, дд, J=7,9, 1,9 Гц), 7,91 (1H, д, J=1,9 Гц)
Ссылочный пример 51
3-[[2-(2-трет-бутилсульфамоил-4-изопропилфенил)этил]сульфамоил]-4-метоксибензамид
К суспензии 241 мг 5-карбамоил-2-метоксибензолсульфонилхлорида и 288 мг 2-(2-аминоэтил)-N-трет-бутил-5-изопропилбензолсульфонамида в 10 мл N,N-диметилформамида добавляли 0,32 мл триэтиламина и перемешивали смесь при комнатной температуре в течение 3 суток. К реакционной смеси добавляли 30 мл воды и перемешивали смесь при той же температуре в течение 1 часа. К смеси добавляли 10 мл 1 моль/л хлористо-водородной кислоты и трижды экстрагировали смесь 20 мл этилацетата. Органические слои объединяли, промывали 30 мл воды и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении с получением 426 мг 3-[[2-(2-трет-бутилсульфамоил-4-изопропилфенил)этил]сульфамоил]-4-метоксибензамида.
1Н-ЯМР (CDCl3) δ м.д.:
1,23 (6H, д, J=6,9 Гц), 1,25 (9H, с), 2,86-2,97 (1H, м), 3,13-3,20 (2H, м), 3,21-3,30 (2H, м), 3,99 (3H, с), 5,20 (1H, ушир.с), 5,37 (1H, т, J=6,0 Гц), 5,43-5,69 (1H, ушир.), 6,60-6,88 (1H, ушир.), 7,05 (1H, д, J=8,8 Гц), 7,14 (1H, д, J=7,9 Гц), 7,25-7,30 (1H, м), 7,88 (1H, д, J=1,9 Гц), 8,13 (1H, дд, J=8,8, 2,5 Гц), 8,32 (1H, д, J=2,5 Гц)
Ссылочный пример 52
N-трет-бутил-2-[2-(5-циано-2-метоксибензолсульфониламино)-этил]-5-изопропилбензолсульфонамид
К перемешиваемому раствору 420 мг 3-[[2-(2-трет-бутил-сульфамоил-4-изопропилфенил)этил]сульфамоил]-4-метоксибензамида в 30 мл дихлорметана при охлаждении на льду добавляли 0,48 мл триэтиламина и 0,245 мг трифторуксусного ангидрида, и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли 1 мл триэтиламина и перемешивали смесь при той же температуре в течение 2 часов. К реакционной смеси добавляли воду и 30 мл 1 моль/л хлористо-водородной кислоты, и трижды экстрагировали смесь 30 мл дихлорметана. Органические слои объединяли, промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. После удаления растворителя при пониженном давлении к остатку добавляли этилацетат и гексан, и собирали кристаллическое вещество путем фильтрации с получением 325 мг N-трет-бутил-2-[2-(5-циано-2-метоксибензолсульфониламино)этил]-5-изопропилбензолсульфонамида.
1Н-ЯМР (CDCl3) δ м.д.:
1,23 (9H, с), 1,25 (6H, д, J=6,9 Гц), 2,93 (1H, септ, J=6,9 Гц), 3,17 (2H, т, J=6,6 Гц), 3,22-3,29 (2H, м), 3,94 (3H, с), 4,36 (1H, ушир.с), 5,43 (1H, т, J=5,7 Гц), 6,99 (1H, д, J=8,5 Гц), 7,20 (1H, д, J=7,9 Гц), 7,29 (1H, дд, J=7,9, 1,6 Гц), 7,79 (1H, дд, J=8,5, 1,9 Гц), 7,84 (1H, д, J=1,6 Гц), 8,15 (1H, д, J=1,9 Гц)
Ссылочный пример 53
Этил [2-[2-[(5-циано-2-метоксибензолсульфонил)-(2-метил-1,3-тиазол-4-илметил)амино]этил]-5-изопропилфенокси]ацетат
Суспензию 300 мг этил [2-[2-(5-циано-2-метоксибензолсульфониламино)этил]-5-изопропилфенокси]ацетата, 132 мг 4-хлорметил-2-метил-1,3-тиазолгидрохлорида и 189 мг карбоната калия в 2,0 мл N,N-диметилформамида перемешивали при комнатной температуре в течение 18 часов, затем при 50°C в течение 3 часов. К реакционной смеси добавляли 60 мг 4-хлорметил-2-метил-1,3-тиазолгидрохлорида и 45 мг карбоната калия, и перемешивали смесь при той же температуре в течение 2,7 часа. К реакционной смеси добавляли 60 мг 4-хлорметил-2-метил-1,3-тиазолгидрохлорида и 45 мг карбоната калия, и перемешивали смесь при той же температуре в течение 3 часов. Затем к реакционной смеси добавляли 2 мл N,N-диметилформамида и перемешивали смесь при той же температуре в течение 1,5 часов. К реакционной смеси добавляли воду и насыщенный водный раствор бикарбоната натрия, и экстрагировали смесь этилацетатом. Органический слой промывали водой, водным раствором хлорида натрия и насыщенным солевым раствором, и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении и очищали остаток методом колоночной хроматографии на силикагеле (элюент: этилацетат/гексан) с получением 311 мг этил [2-[2-[(5-циано-2-метоксибензолсульфонил)-(2-метил-1,3-тиазол-4-илметил)амино]этил]-5-изопропилфенокси]ацетата.
1Н-ЯМР (CDCl3) δ м.д.:
1,19 (6Н, д, J=6,9 Гц), 1,27 (3H, т, J=7,3 Гц), 2,60 (3H, с), 2,76-2,87 (3H, м), 3,57-3,65 (2H, м), 3,92 (3H, с), 4,24 (2H, кв., J=7,3 Гц), 4,56 (2H, с), 4,67 (2H, с), 6,49 (1H, д, J=1,6 Гц), 6,73 (1H, дд, J=7,6, 1,6 Гц), 6,95 (1H, д, J=8,5 Гц), 6,97 (1H, д, J=7,6 Гц), 7,02 (1H, с), 7,71 (1H, дд, J=8,5, 2,2 Гц), 8,22 (1H, д, J=2,2 Гц)
Ссылочный пример 54
Амино[4-бензилокси-3-[[2-[4-изопропил-2-(этоксикарбонилметокси)фенил]этил]сульфамоил]фенил]метиленкарбамоилоксиметил-2,2-диметилпропионат
К раствору 131 мг этил [2-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]ацетата в 5 мл N,N-диметилформамида добавляли 0,91 мл N,N-диизопропилэтиламина. К перемешиваемой смеси при 40°C добавляли 0,069 мл бензилбромида и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли 0,91 мл N,N-диизопропилэтиламина и 86 мг 4-нитрофеноксикарбонилоксиметил-2,2-диметилпропионата, и перемешивали смесь при комнатной температуре в течение 6 часов. К реакционной смеси добавляли 10 мл воды и 10 мл насыщенного солевого раствора, и экстрагировали смесь этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении и очищали остаток методом колоночной хроматографии на силикагеле (элюент: этилацетат/гексан) с получением 99 мг амино[4-бензилокси-3-[[2-[4-изопропил-2-(этоксикарбонилметокси)фенил]этил]сульфамоил]-фенил]метиленкарбамоилоксиметил-2,2-диметилпропионата.
1Н-ЯМР (CDCl3) δ м.д.:
1,19 (6H, д, J=6,9 Гц), 1,22 (9H, с), 1,27 (3H, т, J=7,3 Гц), 2,70-2,86 (3H, м), 3,17-3,25 (2H, м), 4,21 (2H, кв., J=7,3 Гц), 4,47 (2H, с), 5,05-5,11 (1H, м), 5,17 (2H, с), 5,86 (2H, с), 6,50 (1H, д, J=1,6 Гц), 6,71 (1H, дд, J=7,6, 1,6 Гц), 6,86 (1H, д, J=7,6 Гц), 7,04 (1H, д, J=8,8 Гц), 7,29-7,48 (6H, м), 8,28 (1H, дд, J=8,8, 2,5 Гц), 8,32 (1H, д, J=2,5 Гц), 9,40-9,80 (1H, ушир.)
Ссылочный пример 55
Следующие соединения были получены путем, сходным с описанным в ссылочном примере 54.
Амино[4-бензилокси-3-[[2-[4-изопропил-2-(этоксикарбонилметокси)фенил]этил]сульфамоил]фенил]метиленкарбамоилоксиметил-2-ацетокси-2-метилпропионат
1Н-ЯМР (CDCl3) δ м.д.:
1,19 (6H, д, J=6,9 Гц), 1,27 (3H, т, J=7,3 Гц), 1,56 (6H, с), 2,04 (3H, с), 2,73 (2H, т, J=6,9 Гц), 2,81 (1H, септ, J=6,9 Гц), 3,17-3,24 (2H, м), 4,21 (2H, кв., J=7,3 Гц), 4,47 (2H, с), 5,09 (1H, т, J=6,0 Гц), 5,16 (2H, с), 5,88 (2H, с), 6,50 (1H, д, J=1,6 Гц), 6,70 (1H, дд, J=7,6, 1,6 Гц), 6,86 (1H, д, J=7,6 Гц), 6,88-7,17 (1H, м), 7,30-7,48 (5H, м), 8,27 (1H, дд, J=8,8, 2,5 Гц), 8,32 (1H, д, J=2,5 Гц), 9,20-9,90 (1H, ушир.)
Этил [4-[2-[5-[амино(бутоксикарбонилимино)метил]-2-бензилоксибензолсульфониламино]этил]-2'-метансульфонилбифенил-3-ил]оксиацетат
1Н-ЯМР (CDCl3) δ м.д.:
0,95 (3H, т, J=7,3 Гц), 1,24 (3H, т, J=7,3 Гц), 1,39-1,50 (2H, м), 1,66-1,76 (2H, м), 2,54 (3H, с), 2,85 (2H, т, J=6,9 Гц), 3,21-3,30 (2H, м), 4,12-4,21 (4H, м), 4,58 (2H, с), 5,18 (1H, т, J=6,0 Гц), 5,29 (2H, с), 6,89 (1H, дд, J=7,6, 1,6 Гц), 6,98 (1H, д, J=1,6 Гц), 7,098 (1H, д, J=7,6 Гц), 7,103 (1H, д, J=8,8 Гц), 7,32 (1H, дд, J=7,6, 1,S Гц), 7,34-7,43 (3H, м), 7,44-7,50 (2H, м), 7,55 (1H, тд, J=7,6, 1,6 Гц), 7,63 (1H, тд, J=7,6, 1,3 Гц), 8,22 (1H, дд, J=7,6, 1,6 Гц), 8,26 (1H, дд, J=8,8, 2,5 Гц), 8,33 (1H, д, J=2,5 Гц), 9,20-10,00 (1H, ушир.)
Пример 1
Этил [4-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-2'-метансульфонилбифенил-3-илокси]ацетат (соединение 1)
К раствору 4,62 г этил [4-[2-(5-циано-2-метоксибензолсульфониламино)этил]-2'-метансульфонилбифенил-3-илокси]ацетата в 40 мл N,N-диметилформамида добавляли 1,03 г хлорида лития и перемешивали смесь при 140°C в течение 2 часов. После охлаждения до комнатной температуры реакционную смесь вливали в смесь 60 мл этилацетата, 6 мл толуола и 32 мл 1 моль/л хлористо-водородной кислоты. Органический слой отделяли и промывали 1 моль/л хлористо-водородной кислотой и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали остаток методом колоночной хроматографии на аминопропилированном силикагеле (элюент: уксусная кислота/этилацетат) с получением 3,67 г этил [4-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-2'-метансульфонилбифенил-3-илокси]ацетата в виде бесцветного аморфного вещества.
1Н-ЯМР (DMSO-d6) δ м.д.:
1,14 (3H, т, J=7,3 Гц), 2,71 (3H, с), 2,75-2,82 (2H, м), 3,07-3,16 (2H, м), 4,10 (2H, кв., J=7,3 Гц), 4,75 (2H, с), 6,90-6,95 (2H, м), 7,12 (1H, д, J=8,5 Гц), 7,20-7,30 (1H, м), 7,38 (1H, дд, J=7,6, 1,3 Гц), 7,45-7,60 (1H, ушир.с), 7,65 (1H, тд, J=7,6, 1,3 Гц), 7,75 (1H, тд, J=7,6, 1,3 Гц), 7,87 (1H, дд, J=8,5, 2,2 Гц), 8,01 (1H, д, J=2,2 Гц), 8,07 (1H, дд, J=7,6, 1,3 Гц), 11,80-12,30 (1H, ушир.)
Пример 2
Этил [2-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]ацетат (соединение 2)
К раствору 148 мг этил [2-[2-(5-циано-2-метоксибензолсульфониламино)этил]-5-изопропилфенокси]ацетата в 3 мл N,N-диметилформамида добавляли 41 мг хлорида лития и перемешивали смесь при 140°C в течение 3 часов. После охлаждения до комнатной температуры реакционную смесь концентрировали при пониженном давлении. К остатку добавляли 10% водный раствор лимонной кислоты для доведения значения pH до 4 и экстрагировали смесь 100 мл этилацетата. Органический слой промывали водой и насыщенным солевым раствором, и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении с получением 139 мг этил [2-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]ацетата.
1Н-ЯМР (DMSO-d6) δ м.д.:
1,14 (6H, д, J=6,9 Гц), 1,18 (3H, т, J=7,3 Гц), 2,60-2,70 (2H, м), 2,78 (1H, септ, J=6,9 Гц), 2,95-3,10 (2H, м), 4,14 (2H, кв., J=7,3 Гц), 4,73 (2H, с), 6,66 (1H, д, J=1,4 Гц), 6,72 (1H, дд, J=7,9, 1,4 Гц), 6,97 (1H, д, J=7,9 Гц), 7,09 (1H, д, J=8,5 Гц), 7,45 (1H, т, J=5,7 Гц), 7,85 (1H, дд, J=8,5, 2,3 Гц), 7,98 (1H, д, J=2,3 Гц), 11,95 (1H, ушир.с)
Пример 3
Следующие соединения были получены путем, сходным с описанным в примере 1 или 2.
Этил [4-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-3',4',5'-трифторбифенил-3-илокси]ацетат (соединение 3)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,19 (3H, т, J=7,3 Гц), 2,70-2,80 (2H, м), 3,05-3,15 (2H, м), 4,15 (2H, кв., J=7,3 Гц), 4,90 (2H, с), 7,06 (1H, д, J=8,5 Гц), 7,15-7,25 (3H, м), 7,48 (1H, т, J=5,7 Гц), 7,65-7,75 (2H, м), 7,83 (1H, дд, J=8,5, 2,2 Гц), 7,96(1H, д, J=2,2 Гц), 11,93 (1H, с)
Метил 4'-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-3'-этоксикарбонилметоксибифенил-2-карбоксилат (соединение 4)
1Н-ЯМР (CDCl3) δ м.д.:
1,32 (3H, т, J=7,3 Гц), 2,94 (2H, т, J=6,0 Гц), 3,30-3,40 (2H, м), 3,79 (3H, с), 4,31 (2H, кв., J=7,3 Гц), 4,50 (2H, с), 5,84 (1H, т, J=5,0 Гц), 6,60 (1H, д, J=1,6 Гц), 6,82 (1H, дд, J=7,6, 1,6 Гц), 6,89 (1Н, д, J=8,5 Гц), 7,05 (1H, д, J=7,6 Гц), 7,32 (1H, дд, J=7,9, 1,3 Гц), 7,44 (1H, тд, J=7,9, 1,3 Гц), 7,55-7,60 (2H, м), 7,91 (1H, дд, J=7,9, 1,3 Гц), 8,06 (1H, д, J=2,2 Гц), 8,90-9,10 (1H, ушир.)
Этил [2-[2-[2-(5-циано-2-гидроксибензолсульфониламино)-этил]-5-изопропилфенокси]ацетиламино]ацетат (соединение 5)
1Н-ЯМР (CDCl3) δ м.д.:
1,23 (6H, д, J=6,9 Гц), 1,35 (3H, т, J=6,9 Гц), 2,84-2,92 (3H, м), 3,22-3,28 (2H, м), 4,18 (2H, д, J=5,4 Гц), 4, 32 (2H, кв., J=6,9 Гц), 4,53 (2H, с), 5,89-5,94 (1H, м), 6, 65 (1H, д, J=1,3 Гц), 6,85 (1H, дд, J=7,9, 1,3 Гц), 7,03-7,10 (3H, м), 7,65 (1H, дд, J=8,8, 2,2 Гц), 7,95 (1H, д, J=2,2 Гц), 9,35 (1H, ушир.с)
2-[2-[2-(5-Циано-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]ацетамид (соединение 6)
1Н-ЯМР (CDCl3) δ м.д.:
1,16 (6H, д, J=6,9 Гц), 2,68-2,74 (2H, м); 2,77-2,84 (1H, м), 2,98-3,06 (2H, м), 4,41 (2H, с), 6,70 (1H, д, J=1,3 Гц), 6,73 (1H, дд, J=1,6, 1,3 Гц), 6,98 (1H, д, J=7,6 Гц), 7,11 (1H, д, J=8,8 Гц), 7,24 (1H, ушир.с), 7,47-7,54 (2H, м), 7,86 (1H, дд, J=8,8, 2,5 Гц), 7,98 (1H, д, J=2,5 Гц), 12,00 (1H, ушир.с)
Этил 4-[2-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]ацетат (соединение 7)
1Н-ЯМР (CDCl3) δ м.д.:
1,23 (6H, д, J=6,9 Гц), 1,29 (3H, т, J=7,3 Гц), 2,09-2,17 (2H, м), 2,52 (2Н, т, J=7,3 Гц), 2,76 (2Н, т, J=6,9 Гц), 2,81-2,90 (1H, м), 3,14-3,24 (2H, м), 4,00 (2H, т, J=6,0 Гц), 4,19 (2H, кв., J=7,3 Гц), 5,53 (1H, т, J=5,7 Гц), 6,66 (1H, д, J=1,3 Гц), 6,74 (1H, дд, J=7,6, 1,3 Гц), 6,94 (1H, д, J=7,6 Гц), 7,05 (1H, д, J=8,8 Гц), 7,63 (1H, дд, J=8,8, 1,9 Гц), 7,94 (1H, д, J=1,9 Гц), 9,73 (1H, ушир.с)
N-[2-(2-Бензилокси-4-изопропилфенил)этил]-5-циано-2-гидроксибензолсульфонамид (соединение 8)
1Н-ЯМР (CDCl3) δ м.д.:
1,24 (6H, д, J=6,9 Гц), 2,78 (2H, т, J=6,3 Гц), 2,83-2,93 (1H, м), 3,24 (2H, т, J=6,3 Гц), 5,04 (2H, с), 5,29 (1H, ушир.с), 6,77 (1H, д, J=7,9 Гц), 6,80 (1H, с), 6,94 (1H, д, J=7,9 Гц), 7,00 (1H, д, J=8,5 Гц), 7,29-7,49 (5H, м), 7,58 (1H, дд, J=8,5, 1,9 Гц), 7,69 (1H, д, J=1,9 Гц)
Этил-2-[2-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]пропионат (соединение 9)
1Н-ЯМР (CDCl3) δ м.д.:
1,17-1,23 (6H, м), 1,32 (3H, т, J=7,0 Гц), 1,63 (3H, д, J=6,8 Гц), 2,59-2,66 (1H, м), 2,79-2,87 (1H, м), 3,05-3,19 (2H, м), 3,47-3,56 (1H, м), 4,25-4,35 (2H, м), 4,91 (1H, кв., J=6,8 Гц), 6,31-6,37 (1H, м), 6,50-6,53 (1H, м), 6,71-6,75 (1H, м), 6,91 (1H, д, J=7,6 Гц), 6,99 (1H, д, J=8,7 Гц), 7,59 (1H, дд, J=8,7, 2,2 Гц), 7,93 (1H, д, J=2,2 Гц), 9,39 (1H, ушир.с)
2-[2-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]-N,N-диметилацетамид (соединение 10)
1Н-ЯМР (CDCl3) δ м.д.:
1,15 (6H, д, J=6,9 Гц), 2,61-2,70 (2H, м), 2,72-2,84 (1H, м), 2,84 (3H, с), 2,99 (3H, с), 3,00-3,10 (2H, м), 4,74 (2H, с), 6,66-6,75 (2H, м), 6,95 (1H, д, J=7,9 Гц), 7,12 (1H, д, J=8,3 Гц), 7,42-7,51 (1H, м), 7,85 (1H, дд, J=8,3, 2,2 Гц), 7,97 (1H, д, J=2,2 Гц), 12,00 (1H, ушир.с)
5-Циано-2-гидрокси-N-[2-[4-изопропил-2-(2-морфолин-4-ил-2-оксоэтокси)фенил]этил]бензолсульфонамид (соединение 11)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,15 (6H, д, J=6,9 Гц), 2,61-2,69 (2H, м), 2,74-2,83 (1H, м), 2,99-3,10 (2H, м), 3,42-3,52 (4H, м), 3,53-3,63 (4H, м), 4,76 (2H, с), 6,68-6,75 (2H, м), 6,96 (1H, д, J=7,6 Гц), 7,10 (1H, д, J=8,2 Гц), 7,47 (1H, т, J=5,7 Гц), 7,85 (1H, дд, J=8,2, 1,9 Гц), 7,98 (1H, д, J=1,9 Гц), 11,95 (1H, ушир.с)
Этил [2'-трет-бутилсульфамоил-4-[2-(5-циано-2-гидроксибензол-сульфониламино)этил]бифенил-3-илокси]ацетат (соединение 12)
1Н-ЯМР (DMSO-d6) δ м.д.:
0,92 (9H,с), 1,16 (3H, т, J=6,9 Гц), 2,70-2,80 (2H, м), 3,00-3,15 (2H, м), 4,12 (2H, кв., J=6,9 Гц), 4,71 (2H, с), 6,89 (1H, дд, J=7,6, 1,6 Гц), 6,95 (1H, д, J=1,6 Гц), 7,00-7,10 (1H, ушир.с), 7,10-7,50 (4H, м), 7,54 (1H, тд, J=7,6, 1,3 Гц), 7,62 (1H, тд, J=7,6, 1,3 Гц), 7,78 (1H, ушир.с), 7,94 (1H, ушир.с), 8,03 (1H, дд, J=7,6, 1,3 Гц), 11,50-12,50 (1H, ушир.)
Этил [2-[2-[(5-циано-2-гидроксибензолсульфонил)-(2-метил-1,3-тиазол-4-илметил)амино)этил]-5-изопропилфенокси]ацетат (соединение 13)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,08-1,20 (9H, м), 2,56-2,65 (5H, м), 2,68-2,83 (1H, м), 3,16-3,36 (2H, м), 4,12 (2H, кв., J=7,3 Гц), 4,62 (2H, с), 4,68 (2H, с), 6,12 (1H, д, J=8,8 Гц), 6,55-6,65 (2H, м), 6,66-6,72 (1H, м), 6,83-6,89 (1H, м), 7,09 (1H, дд, J=8,8, 2,5 Гц), 7,19 (1H, с), 7,58-7,63 (1H, м)
N-трет-бутил-2-[2-(5-циано-2-гидроксибензолсульфониламино)-этил]-5-изопропилбензолсульфонамид (соединение 14)
1Н-ЯМР (CDCl3) δ м.д.:
1,20-1,31 (15H, м), 2,93-3,01 (1H, м), 3,14-3,24 (2H, м), 3,30-3,41 (2H, м), 4,41-4,55 (1H, м), 5,55-6,30 (1H, ушир.), 6,97-7,09 (1H, м), 7,11-7,21 (1H, м), 7,56-7,66 (1H, м), 7,81-7,90 (1H, м), 7,97-8,11 (1H, м)
Пример 4
Следующее соединение было получено путем, сходным с описанным в ссылочном примере 37 и примере 1 или 2.
Этил 3-[2-[4-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-3',4',5'-трифторбифенил-3-илокси]ацетиламино]пропионат (соединение 15)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,14 (3Н, т, J=7,3 Гц), 2,80 (2H, т, J=7,3 Гц), 3,07-3,14 (2H, м), 3,35-3,45 (2H, м), 4,01 (2H, кв., J=7,3 Гц), 4,60 (2H, с), 7,07 (1H, д, J=8,5 Гц), 7,15-7,25 (3H, м), 7,47-7,54 (1H, м), 7,65-7,75 (2H, м), 7,83 (1H, дд, J=8,5, 2,2 Гц), 7,87 (1H, т, J=6,0 Гц), 7,96 (1H, д, J=2,2 Гц), 11,96 (1H, ушир.с)
Пример 5
5-Циано-N-[2-(2-гидразинокарбонилметокси-4-изопропилфенил)-этил]-2-гидроксибензолсульфонамид (соединение 16)
Этил [2-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]ацетат (0,266 г) растворяли в 5 мл этанола. К раствору при комнатной температуре добавляли 0,087 мл гидразинмоногидрата и нагревали смесь с обратным холодильником в течение 1 часа. Удаляли растворитель при пониженном давлении с получением 0,258 г 5-циано-N-[2-(2-гидразинокарбонилметокси-4-изопропилфенил)этил]-2-гидроксибензолсульфонамида.
1Н-ЯМР (DMSO-d6) δ м.д.:
1,17 (6H, д, J=6,9 Гц), 2,66-2,73 (2H, м), 2,75-2,84 (3H, м), 4,47 (2H, с), 5,42 (1H, ушир.с), 6,30 (1H, д, J=8,8 Гц), 6,73-6,77 (2H, м), 7,01 (1H, д, J=7,9 Гц), 7,22 (1H, дд, J=8,8, 2,5 Гц), 7,56 (1H, д, J=2,5 Гц), 9,00-9,60 (1H, м)
Пример 6
5-Циано-2-гидрокси-N-[2-[4-изопропил-2-(5-оксо-4,5-дигидро-[1,3,4]оксадиазол-2-илметокси)фенил]этил]бензолсульфонамид (соединение 17)
5-Циано-N-[2-(2-гидразинокарбонилметокси-4-изопропилфенил)-этил]-2-гидроксибензолсульфонамид (0,258 г) растворяли в 10 мл тетрагидрофурана. К перемешиваемому раствору при охлаждении на льду добавляли 0,177 г трифосгена и перемешивали смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли воду и экстрагировали смесь этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Удаляли растворитель при пониженном давлении с получением 0,26 г 5-циано-2-гидрокси-N-[2-[4-изопропил-2-(5-оксо-4,5-дигидро-[1,3,4]оксадиазол-2-ил-метокси)фенил]этил]бензолсульфонамида.
1Н-ЯМР (CDCl3) δ м.д.:
1,23 (6H, д, J=6,9 Гц), 2,74-2,91 (3H, м), 3,18-3,24 (2H, м), 4,96 (2H, с), 5,50-5,55 (1H, м), 6,70-6,71 (1H, м), 6,81-6,85 (1H, м), 6,99 (1H, д, J=8,5 Гц), 7,07 (1H, д, J=8,5 Гц), 7,64 (1H, дд, J=8,8, 1,9 Гц), 7,92 (1H, д, J=1,9 Гц), 9,17-9,57 (2H, м)
Пример 7
5-Циано-2-гидрокси-N-[2-(2-гидрокси-4-изопропилфенил)-этил]бензолсульфонамид (соединение 18)
К перемешиваемому раствору 0,203 г N-[2-(2-бензилокси-4-изопропилфенил)этил]-5-циано-2-гидроксибензолсульфонамида в этаноле добавляли 0,04 г 10% палладия на угле и перемешивали смесь в атмосфере водорода и при обычном давлении в течение 3 часов. После удаления нерастворимого материла путем фильтрации фильтрат концентрировали при пониженном давлении с получением 0,143 г 5-циано-2-гидрокси-N-[2-(2-гидрокси-4-изопропилфенил)-этил]бензолсульфонамида.
1Н-ЯМР (CDCl3) δ м.д.:
1,21 (6H, д, J=7,3 Гц), 2,71-2,86 (3H, м), 3,22-3,32 (2H, м), 6,59 (1H, с), 6,72 (1H, д, J=7,6 Гц), 6,89 (1H, д, J=7,6 Гц), 7,02 (1H, д, J=8,5 Гц), 7,59-7,64 (1H, м), 7,85-7,89 (1H, м)
Пример 8
Этил [4-[2-(5-карбамимидоил-2-гидроксибензолсульфонил-амино)-этил]-2'-метансульфонилбифенил-3-илокси]ацетат (соединение 19)
Суспензию 149 мг этил [4-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-2'-метансульфонилбифенил-3-илокси]ацетата в 1,0 мл насыщенного этанольного раствора хлороводорода перемешивали при комнатной температуре в течение 3 часов и концентрировали реакционную смесь при пониженном давлении. К раствору остатка в 1,0 мл этанола добавляли 206 мг ацетата аммония и перемешивали смесь при комнатной температуре в течение 13 часов. Реакционную смесь концентрировали при пониженном давлении с получением белого твердого вещества, которое последовательно растирали с водой и этилацетатом/этанолом с получением 141 мг этил [4-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-2'-метансульфонилбифенил-3-илокси]ацетат в виде белого порошка.
1Н-ЯМР (DMSO-d6) δ м.д.:
1,13 (3H, т, J=7,3 Гц), 2,72 (3H, с), 2,75-2,85 (2H, м), 2,90-3,00 (2H, м), 4,09 (2H, кв., J=7,3 Гц), 4,76 (2H, с), 6,43 (1H, д, J=8,9 Гц), 6,90-6,95 (2H, м), 7,20 (1H, д, J=7,9 Гц), 7,39 (1H, дд, J=7,6, 1,3 Гц), 7,57 (1H, дд, J=8,9, 2,3 Гц), 7,65 (1H, тд, J=7,6, 1,3 Гц), 7,74 (1Н, тд, J=7,6, 1,3 Гц), 7,85-8,15 (4H, м), 8,45-8,80 (2H, ушир.)
Пример 9
Этил [2-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]ацетат (соединение 20)
Раствор 16,09 г этил [2-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]ацетата в 200 мл 37% этанольном растворе хлороводорода перемешивали при комнатной температуре в течение 4 часов и концентрировали реакционную смесь при пониженном давлении. К перемешиваемому раствору остатка в 180 мл этанола при охлаждении на льду добавляли 27,78 г ацетата аммония и перемешивали смесь при комнатной температуре в течение 18 часов. Реакционную смесь концентрировали при пониженном давлении, и последовательно добавляли к остатку 10 мл этилацетата, 200 мл воды и 40 мл гексана. Осадки собирали путем фильтрации и последовательно промывали 1000 мл воды и смесью 80 мл гексана и 20 мл этилацетата с получением 15,11 г этил [2-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]ацетата.
1Н-ЯМР (DMSO-d6) δ м.д.:
1,15 (6H, д, J=6,9 Гц), 1,17 (3H, т, J=7,3 Гц), 2,65-2,75 (2H, м), 2,75-2,90 (3H, м), 4,13 (2H, кв., J=7,3 Гц), 4,75 (2H, с), 6,27 (1H, д, J=9,1 Гц), 6,67 (1H, д, J=1,1 Гц), 6,70-6,85 (2H, м), 7,00 (1H, д, J=7,3 Гц), 7,50 (1H, дд, J=9,1, 2,6 Гц), 7,85 (2H, ушир.с), 7,95 (1H, д, J=2,6 Гц), 8,47 (1H, ушир.с)
Пример 10
Следующие соединения были получены путем, сходным с описанным в примере 8 или 9.
Этил [4-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)-этил]-3',4',5'-трифторбифенил-3-илокси]ацетат (соединение 21)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,18 (3H, т, J=7,3 Гц), 2,77 (2H, т, J=6,9 Гц), 2, 87 (2H, т, J=6,9 Гц), 4,13 (2H, кв., J=7,3 Гц), 4,93 (2H, с), 6,26 (1H, д, J=9,1 Гц), 6,80-6,90 (1H, ушир.с), 7,20-7,30 (3H, м), 7,50 (1H, дд, J=9,1, 2,8 Гц), 7,65-7,75 (2H, м), 7,90-8,35 (4H, м)
Этил 3-[2-[4-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-3',4',5'-трифторбифенил-3-илокси]ацетиламино]пропионат (соединение 22)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,14 (3H, т, J=7,3 Гц), 2,75-2,95 (4H, м), 3,44 (2H, кв., J=6,0 Гц), 4,02 (2H, кв., J=7,3 Гц), 4,62 (2H, с), 6,29 (1H, д, J=9,1 Гц), 6,86 (1H, ушир.с), 7,15-7,30 (3H, м), 7,51 (1H, дд, J=9,1, 2,8 Гц), 7,65-7,75 (2H, м), 7,86 (1,5H, ушир.с), 7,96 (1H, д, J=2,8 Гц), 8,12 (1H, т, J=6,0 Гц), 8,51 (1,5H, ушир.с)
Метил 4'-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-3'-этоксикарбонилметоксибифенил-2-карбоксилат (соединение 23)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,17 (3Н, т, J=6,9 Гц), 2,77 (2H, т, J=7,3 Гц), 2,89 (2H, т, J=7,3 Гц), (3H, с), 4,14 (2H, кв., J=6,9 Гц), 4,32-4,38 (1H, ушир.), 4,78 (2H, с), 6,30 (1H, д, J=9,5 Гц), 6,73 (1H, д, J=1,6 Гц), 6,80 (1H, дд, J=7,9, 1,6 Гц), 7,16 (1H, д, J=7,9 Гц), 7,35-7,55 (3H, м), (1H, тд, J=7,9, 1,3 Гц), 7,68 (1H, дд, J=7,9, 1,3 Гц), 7,85 (1,5H, ушир.с), 7,97 (1H, д, J=2,8 Гц), 8,50 (1,5H, ушир.с)
Этил [2-[2-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]ацетиламино]ацетат (соединение 24)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,17 (6H, д, J=7,3 Гц), 1,20 (3H, т, J=7,3 Гц), 2,70-2,75 (2H, м), 2,78-2,85 (3H, м), 3, 97 (2H, д, J=5,4 Гц), 4,11 (2H, кв., J=7,3 Гц), 4,52 (2H, с), 6,27 (1H, д, J=9,1 Гц), 6,75-6,81 (3H, м), 7,04 (1H, д, J=8,2 Гц), 7,50 (1H, дд, J=9,1, 2,5 Гц), 7,86 (2H, ушир.с), 7,94 (1H, д, J=2,5 Гц), 8,43-8,53 (3H, м)
Соль добавления уксусной кислоты к 2-[2-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]ацетамиду (соединение 25)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,16 (6H, д, J=6,9 Гц), 1,89 (3H, с), 2,68-2,74 (2H, м), 2,77-2, 84 (3H, м), 4,39 (2H, с), 6,30 (1H, д, J=9,5 Гц), 6,71 (1H, д, J=1,3 Гц), 6,76 (1H, дд, J=7,6, 1,3 Гц), 7,02 (1H, д, J=7,6 Гц), 7,42-7,48 (3H, м), 7,50 (1H, дд, J=9,5, 2,5 Гц), 7,94 (1H, д, J=2,5 Гц), 7,95-8,68 (4H, м)
4-Гидрокси-3-[2-[4-изопропил-2-(5-оксо-4,5-дигидро[1,3,4]-оксадиазол-2-илметокси)фенил]этилсульфамоил]бензамидингидрохлорид (соединение 26)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,16 (6H, д, J=6,9 Гц), 2,61-2,67 (2H, м), 2,77-2,86 (1H, м), 2,92-3,02 (2H, м), 5,01 (2H, с), 6,77 (1H, дд, J=7,9, 1,3 Гц), 6,92 (1H, д, J=1,3 Гц), 6,99 (1H, д, J=7,9 Гц), 7,20 (1H, д, J=8,5 Гц), 7,39 (1H, т, J=6,0 Гц), 7,88 (1H, дд, J=8,5, 2,5 Гц), 8,14 (1H, д, J=2,5 Гц), 8,87 (2H, ушир.с), 9,24 (2H, ушир.с), 12,01 (1H, ушир.с), 12,51 (1H, ушир.с)
Этил 4-[2-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]бутиратгидрохлорид (соединение 27)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,16 (6H, д, J=6,6 Гц), 1,17 (3H, т, J=7,3 Гц), 1,87-1,95 (2H, м), 2,45 (2H, т, J=7,3 Гц), 2,60-2,66 (2H, м), 2,75-2,85 (1H, м), 2,92-3,00 (2H, м), 3,92 (2H, т, J=6,3 Гц), 4,06 (2H, кв., J=7,3 Гц), 6,66-6,71 (1H, м), 6,72-6,76 (1H, м), 6,94 (1H, д, J=7,9 Гц), 7,19 (1H, д, J=8,8 Гц), 7,37 (1H, т, J=5,7 Гц), 7,87 (1H, дд, J=8,8, 2,5 Гц), 8,15 (1H, д, J=2,5 Гц), 8,86 (2H, ушир.с), 9,25 (2H, ушир.с), 12,01 (1H, ушир.с)
4-Гидрокси-3-[2-(2-гидрокси-4-изопропилфенил)этилсульфамоил]бензамидин (соединение 28)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,13 (6H, д, J=6,9 Гц), 2,56-2,62 (2H, м), 2,66-2,81 (3H, м), 6,27 (1Н, д, J=9,1 Гц), 6,56 (1H, дд, J=7,6, 1,6 Гц), 6,61 (1H, д, J=1,6 Гц), 6,89 (1H, д, J=7,6 Гц), 7,49 (1H, дд, J=9,1, 2,8 Гц), 7,79 (2H, ушир.с), 7,93 (1H, д, J=2,8 Гц), 8,46 (2H, ушир.с)
Этил 2-[2-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]пропионат (соединение 29)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,09-1,14 (9H, м), 1,45 (3H, д, J=6,6 Гц), 2,61-2,88 (5H, м), 4,09 (2H, кв., J=6,9 Гц), 4,88 (1H, кв., J=6,6 Гц), 6,27 (1H, д, J=9,1 Гц), 6,58 (1H, д, J=1,6 Гц), 6,72 (1H, дд, J=7,9, 1,6 Гц), 7,00 (1H, д, J=7,9 Гц), 7,42 (1H, д, J=9,1, 2,8 Гц), 7,93 (1H, д, J=2,8 Гц)
2-[2-[2-(5-Карбамимидоил-2-гидроксибензолсульфониламино)-этил]-5-изопропилфенокси]-N,N-диметилацетамид (соединение 30)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,15 (6H, д, J=6,9 Гц), 2,62-2,70 (2H, м), 2,73-2,85 (6H, м), 2,98 (3H, с), 4,73 (2H, с), 6,26 (1H, д, J=9,5 Гц), 6,70-6,74 (2H, м), 6,85 (1H, ушир.с), 6,99 (1H, д, J=8,4 Гц), 7,49 (1H, дд, J=9,5, 3,2 Гц), 7,92 (1H, д, J=3,2 Гц), 8,32 (2H, ушир.с), 8,94 (2H, ушир.с)
4-Гидрокси-3-[2-[4-изопропил-2-(2-морфолин-4-ил-2-оксоэтокси)фенил]этилсульфамоил]бензамидин (соединение 31)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,15 (6H, д, J=6,9 Гц), 2,60-2,70 (2H, м), 2,73-2,88 (3H, м), 3,39-3,59 (8H, м), 4,31-4,36 (1H, м), 4,76 (2H, с), 6,26 (1H, д, J=9,5 Гц), 6,69-6,76 (2H, м), 6,82 (1H, ушир.с), 7,00 (1H, д, J=8,2 Гц), 7,49 (1H, дд, J=9,5, 2,5 Гц), 7,68-8,62 (4H, м)
Соль добавления уксусной кислоты к этил [4-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-2'-сульфамоилбифенил-3-илокси]ацетату (соединение 32)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,12 (3H, т, J=7,3 Гц), 1,90 (3H, с), 2,80 (2H, т, J=6,3 Гц), 2,90-3,00 (2H, м), 4,01 (2H, кв., J=7,3 Гц), 4,53 (2H, с), 6,42 (1H, д, J=9,1 Гц), 6,91 (1H, дд, J=7,6, 1,6 Гц), 6,98 (1H, д, J=1,6 Гц), 7,15 (1H, д, J=7,6 Гц), 7,30 (1H, дд, J=7,6, 1,3 Гц), 7,50-7,57 (2H, м), 7,61 (1H, тд, J=7,6, 1,3 Гц), 7,69 (2H, ушир.с), 7,96 (1H, д, J=2,8 Гц), 8,06 (1H, дд, J=7,6, 1,3 Гц), 8,10-8,25 (1,5H, ушир.), 8,40-8,60 (1,5H, ушир.)
Пример 11
Гидрохлорид [4-[2-(5-Карбамимидоил-2-гидроксибензолсульфониламино)этил]-2'-метансульфоноилбифенил-3-илокси]уксусной кислоты (соединение 33)
К раствору 290 мг этил[4-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-2'-метансульфоноилбифенил-3-илокси]ацетата в 1,0 мл ацетонитрила добавляли 0,756 мл 2 моль/л раствора гидроксида натрия и перемешивали смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли 1,26 мл 2 моль/л хлористо-водородной кислоты и концентрировали смесь при пониженном давлении. К остатку добавляли воду и очищали смесь методом колоночной хроматографии на триметиламинопропилированном силикагеле (элюент: 10% 1 моль/л хлористо-водородная кислота/ацетонитрил). Элюент концентрировали при пониженном давлении с получением 260 мг гидрохлорида [4-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-2'-метансульфоноилбифенил-3-илокси]уксусной кислоты в виде белого твердого вещества.
1Н-ЯМР (DMSO-d6) δ м.д.:
2,73 (3H, с), 2,80 (2H, т, J=7,3 Гц), 3,10 (2H, т, J=7,3 Гц), 4,65 (2H, с), 6,85-6,95 (2H, м), 7,16 (1H, д, J=7,6 Гц), 7,23 (1H, д, J=8,3 Гц), 7,37 (1H, дд, J=7,3, 1,3 Гц), 7,66 (1H, тд, J=7,6, 1,3 Гц), 7,75 (1H, тд, J=7,6, 1,3 Гц), 7,89 (1H, дд, J=8,3, 2,1 Гц) 8,08 (1H, дд, J=7,9, 1,S Гц), 8,17 (1H, д, J=2,1 Гц), 8,91 (2H, ушир.с), 9,28 (2H, ушир.с)
Пример 12
Следующие соединения были получены путем, сходным с описанным в примере 11.
Гидрохлорид [4-[2-(5-карбамимидоил-2-гидрокси-бензолсульфонил-амино)этил]-3',4',5'-трифторбифенил-3-илокси]уксусной кислоты (соединение 34)
1Н-ЯМР (DMSO-d6) δ м.д.:
2,76 (2H, т, J=7,3 Гц), 3,00-3,15 (2H, м), 4,82 (2H, с), 7,10-7,25 (4H, м), 7,35-7,45 (1H, ушир.с), 7,65-7,75 (2H, м), 7,87 (1H, дд, J=8,6, 2,1 Гц), 8,14 (1H, д, J=2,1 Гц), 8,89 (2H, ушир.с), 9,27 (2H, ушир.с), 11,70-12,40 (1H, ушир.), 12,60-13,30 (1H, ушир.)
3-[2-[4-[2-(5-Карбамимидоил-2-гидроксибензолсульфониламино) этил]-3',4',5'-трифторбифенил-3-илокси]ацетиламино]пропионовая кислота (соединение 35)
1Н-ЯМР (DMSO-d6) δ м.д.:
2,45 (2H, т, J=6,0 Гц), 2,75-2,90 (4H, м), 3,41 (2H, кв., J=6,0 Гц), 4,56 (2H, с), 6,55 (1H, д, J=8,8 Гц), 7,20-7,30 (3H, м), 7,61 (1H, дд, J=8,8, 2,8 Гц), 7,70-7,80 (2H, м), 7,89 (1H, т, J=6,0 Гц), 8,00 (1H, д, J=2,8 Гц), 8,17 (1,5H, ушир.с), 8,77 (1,5H, ушир.с)
Метил-4'-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-3'-карбоксиметоксибифенил-2-карбоксилатгидрохлорид (соединение 36)
1Н-ЯМР (DMSO-d6) δ м.д.:
2,77 (2H, т, J=7,3 Гц), 3,08 (2H, т, J=7,3 Гц), 3,59 (3H, с), 4,64 (2H, с), 6,71 (1H, д, J=1,6 Гц), 6,78 (1H, дд, J=7,6, 1,6 Гц), 7,10-7,20 (2H, м), 7,40 (1H, д, J=7,3 Гц), 7,47 (1H, д, J=7,6, 1,3 Гц), 7,60 (1H, тд, J=7,3, 1,3 Гц), 7,68 (1H, дд, J=7,6, 1,3 Гц), 7,86 (1H, дд, J=8,5, 2,2 Гц), 8,15 (1H, д, J=2,2 Гц), 8,82 (2H, ушир.с), 9,25 (2H, ушир.с)
Гидрохлорид [2-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]уксусной кислоты (соединение 37)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,14 (6H, д, J=6,9 Гц), 2,68 (2H, т, J=7,6 Гц), 2,78 (1H, септ, J=6,9 Гц), 2,95-3,05 (2H, м), 4,64 (2H, с), 6,65-6,70 (1H, м), 6,72 (1H, дд, J=7,8, 1,2 Гц), 6,97 (1H, д, J=7,8 Гц), 7,25 (1H, д, J=8,4 Гц), 7,30-7,45 (1H, м), 7,90 (1H, дд, J=8,4, 2,8 Гц), 8,15 (1Н, дд, J=2,8 Гц), 8,99 (2H, ушир.с), 9,29 (2H, с), 12,13 (1H, ушир.с), 12,94 (1H, ушир.с)
[2-[2-[2-(5-Карбамимидоил-2-гидроксибензолсульфониламино)-этил]-5-изопропилфенокси]ацетиламино]уксусная кислота (соединение 38)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,16 (6H, д, J=6,9 Гц), 2,72-2,77 (2H, м), 2,78-2,86 (3H, м), 3,79 (2H, д, J=5,7 Гц), 4,47 (2H, с), 6,54 (1H, д, J=9,1 Гц), 6,76 (1H, дд, J=7,6, 1,3 Гц), 6,78-6,79 (1H, м), 7,03 (1H, д, J=7,6 Гц), 7,59 (1H, дд, J=9,1, 2,5 Гц), 7,99 (1H, д, J=2,5 Гц), 8,09-8,21 (3H, м), 8,70-8,86 (2H, м)
4-[2-[2-(5-Карбамимидоил-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]масляная кислота (соединение 39)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,15 (6H, д, J=7,3 Гц), 1,85-1,98 (2H, м), 2,42 (2H, т, J=7,3 Гц), 2,59-2,69 (2H, м), 2,72-2,86 (3H, м), 3,90 (2H, т, J=6,0 Гц), 6,68 (1H, д, J=7,6 Гц), 6,72 (1H, с), 6,80 (1H, д, J=8,5 Гц), 6,97 (1H, д, J=7,6 Гц), 7,66-7,77 (1H, м), 8,00-8,11 (1H, м), 8,49 (2H, ушир.с), 8,93 (2H, ушир.с)
Гидрохлорид 2-[2-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]пропионовой кислоты (соединение 40)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,09-1,16 (6H, м), 1,43 (3H, д, J=6,6 Гц), 2,56-2,81 (3H, м), 2,91-3,08 (2Н, м), 4,77 (1Н, кв., J=6,6 Гц), 6,59 (1H, с), 6,70 (1H, д, J=7,9 Гц), 6,96 (1H, д, J=7,9 Гц), 7,23 (1H, д, J=8,8 Гц), 7,35 (1H, ушир.с), 7,89 (1H, д, J=8,8, 2,5 Гц), 8,15 (1H, д, J=2,5 Гц), 8,96 (2H, ушир.с), 9,28 (2H, ушир.с), 12,12 (1H, ушир.с), 12,95 (1H, ушир.с)
Гидрохлорид [4-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-2'-сульфамоилбифенил-3-илокси]уксусной кислоты (соединение 41)
1Н-ЯМР (DMSO-d6) δ м.д.:
2,75-2,85 (2H, м), 3,05-3,15 (2H, м), 4,63 (2H, с), 6,87 (1H, д, J=1,6 Гц), 6,91 (1H, дд, J=7,6, 1,6 Гц), 7,05-7,12 (3H, м), 7,20 (1H, д, J=8,5 Гц), 7,29 (1H, дд, J=7,6, 1,3 Гц), 7,40-7,50 (1H, ушир.с), 7,55 (1H, тд, J=7,6, 1,3 Гц), 7,61 (1H, тд, J=7,6, 1,3 Гц), 7,88 (1H, дд, J=8,5, 2,5 Гц), 8,02 (1H, дд, J=7,6, 1,3 Гц), 8,17 (1H, д, J=2,5 Гц), 8,83 (2H, ушир.с), 9,26 (2H, ушир.с), 12,00 (1H, ушир.с), 12,90 (1H, ушир.с)
Пример 13
[2-[2-(5-Карбамимидоил-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]уксусная кислота (соединение 42)
Этил [2-[2-(5-карбамимидоил-2-гидроксибензолсульфонил-амино)этил]-5-изопропилфенокси]ацетат (50 мг) растворяли при 60°C в смеси 3 мл 1 моль/л хлористо-водородной кислоты и 1 мл ацетонитрила. Раствор перемешивали при 60°C в течение 4 часов, и растворяли при 60°C бесцветное твердое вещество, полученное при концентрации реакционной смеси при пониженном давлении, в смеси 3 мл 1 моль/л хлористо-водородной кислоты и 1 мл ацетонитрила. После перемешивания раствора при 60°C в течение 4 часов а затем при комнатной температуре в течение 10 часов реакционную смесь концентрировали при пониженном давлении с получением бесцветного твердого вещества. Твердое вещество растирали с водой и диэтиловым эфиром и собирали путем фильтрации с получением 31 мг [2-[2-(5-карбамимидоил-2-гидроксибензолсульфониламино)этил]-5-изопропилфенокси]уксусной кислоты.
1Н-ЯМР (DMSO-d6) δ м.д.:
1,15 (6H, д, J=6,9 Гц), 2,61-2,83 (3H, м), 3,05 (2H, т, J=7,6 Гц), 4,42 (2H, с), 6,67 (1H, с), 6,69 (1H, д, J=7,5 Гц), 6,82 (1H, д, J=9,1 Гц), 6,98 (1H, д, J=7,5 Гц), 7,69 (1H, дд, J=9,1, 2,5 Гц), 8,05 (1H, д, J=2,5 Гц), 8,56 (2H, ушир.с), 8,94 (2H, ушир.с)
Пример 14
Этил [4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)-бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетат (соединение 43)
Суспензию 2,01 г этил [4-[2-(5-циано-2-гидроксибензолсульфониламино)этил-2'-метансульфонилбифенил-3-илокси]ацетата в 1,0 мл насыщенном этанольном растворе хлороводорода перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении и растворяли остаток в 20,0 мл этанола. К раствору добавляли 3,34 г ацетата гидроксиламмония и перемешивали смесь при комнатной температуре в течение 13 часов. Реакционную смесь вливали в этилацетат/воду и отделяли органический слой. После экстракции водного слоя этилацетатом органические слои объединяли и промывали насыщенным солевым раствором. Органические слои сушили над безводным сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении и очищали остаток методом колоночной хроматографии на силикагеле (элюент: этилацетат) с получением 1,90 г этил [4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетата в виде аморфного вещества.
1Н-ЯМР (DMSO-d6) δ м.д.:
1,12 (3H, т, J=6,9 Гц), 2,70 (3H, с), 2,75-2,85 (2, м), 3,00-3,10 (2H, м), 4,08 (2H, кв., J=6,9 Гц), 4,75 (2H, с), 5,77 (2H, ушир.с), 6,85-6,95 (2H, м), 6,97 (1H, д, J=8,5 Гц), 7,10-7,25 (2H, м), 7,35-7,40 (1H, м) 7,60-7,80 (3H, м), 7,95-8,10 (2H, м), 9,53 (1H, ушир.с), 10,9 (1H, ушир.с)
Пример 15
Следующее соединение было получено путем, сходным с описанным в примере 14.
Этил [2-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-5-изопропилфенокси]ацетат (соединение 44)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,13 (6H, д, J=6,9 Гц), 1,16 (3H, т, J=7,3 Гц), 2,65-2,71 (2H, м), 2,73-2,84 (1H, м), 2,93-3,00 (2H, м), 4,12 (2H, кв., J=7,3 Гц), 4,73 (2H, с), 5,77 (2H, ушир.с), 6,65 (1H, д, J=1,3 Гц), 6,72 (1H, дд, J=7,9, 1,3 Гц), 6,95 (1H, д, J=8,5 Гц), 6,96 (1H, д, J=7,9 Гц), 7,08 (1H, ушир.с), 7,69 (1H, дд,J=8,5, 2,2 Гц), 7,99 (1H, д, J=2,2 Гц), 9,53 (1H, ушир.с), 10,85 (1H, ушир.с)
Пример 16
[4-[2-(5-Циано-2-гидроксибензолсульфониламино)этил]-2'-метансульфонилбифенил-3-илокси]уксусная кислота (соединение 45)
К перемешиваемому раствору 154 г этил [4-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-2'-метансульфонилбифенил-3-илокси]ацетата в 1,23 л этанола при охлаждении на льду добавляли 275 мл 2 моль/л раствора гидроксида натрия и перемешивали смесь при охлаждении на льду в течение 1,5 часов. К реакционной смеси по каплям добавляли 275 мл 2 моль/л хлористо-водородной кислоты и удаляли этанол при пониженном давлении. Остаток экстрагировали этилацетатом и промывали органический слой насыщенным солевым раствором. Растворитель сушили над безводным сульфатом магния и удаляли при пониженном давлении с получением 149 г [4-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-2'-метансульфонилбифенил-3-илокси]уксусной кислоты.
1Н-ЯМР (DMSO-d6) δ м.д.:
2,73 (3H, с), 2,75-2,85 (2H, м), 3,05-3,20 (2H, м), 4,66 (2H, с), 6,85-6,95 (2H, м), 7,13 (1H, д, J=8,5 Гц), 7,17 (1H, д, J=7,6 Гц), 7,39 (1H, дд, J=7,5, 1,3 Гц), 7,50-7,60 (1H, м), 7,60-7,70 (1H, м), 7,88 (1H, дд, J=8,5, 2,1 Гц), 8,02 (1H, д, J=2,1 Гц), 8,08 (1H, дд, J=8,0, 1,3 Гц), 11,80-12,20 (1H, ушир.), 12,70-13,30 (1H, ушир.)
Пример 17
[4-[2-(5-Циано-2-гидроксибензолсульфониламино)этил]-2'-метансульфонилбифенил-3-илокси]ацетат натрия (соединение 46)
К перемешиваемому раствору 146 г [4-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-2'-метансульфонилбифенил-3-илокси]уксусной кислоты в 580 мл этанола при охлаждении на льду добавляли 137 мл 2 моль/л раствора гидроксида натрия и удаляли растворитель при пониженном давлении. Остаток суспендировали в 1,16 л этанола и перемешивали смесь при нагревании с обратным холодильником в течение часа, а затем при комнатной температуре в течение ночи. Полученное белое твердое вещество собирали путем фильтрации с получением 129 г [4-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-2'-метансульфонилбифенил-3-илокси]ацетата натрия.
1Н-ЯМР (DMSO-d6) δ м.д.:
2,71 (3H, с), 2,75-2,85 (2H, м), 3,10-3,25 (2H, м), 4,39 (2H, с), 6,73 (1H, д, J=8,5 Гц), 6,80-6,90 (2H, м), 7,17 (1H, д, J=8,2 Гц), 7,40 (1H, дд, J=7,6, 1,3 Гц), 7,49 (1H, дд, J=8,8, 2,2 Гц), 7, 60-7,70 (1H, м), 7,70-7,80 (2H, м), 8,08 (1H, дд, J=8,2, 1,3 Гц)
Пример 18
[4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)-бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]уксусная кислота (соединение 47)
Способ 1) К суспензии 79 мг этил [4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетата в ацетонитриле добавляли 0,401 мл 1 моль/л раствора гидроксида натрия и перемешивали смесь при комнатной температуре в течение 30 минут. К реакционной смеси добавляли 0,401 мл 1 моль/л хлористо-водородной кислоты и концентрировали смесь при пониженном давлении. К остатку добавляли воду и очищали смесь методом колоночной хроматографии на триметиламинопропилированном силикагеле (элюент: 10% 1 моль/л хлористо-водородная кислота/ацетонитрил). Элюент концентрировали при пониженном давлении и растирали остаток с этилацетатом для сбора путем фильтрации 70 мг [4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]уксусной кислоты в виде желтого порошка.
Способ 2) К перемешиваемому раствору 117 г [4-[2-(5-циано-2-гидроксибензолсульфониламино)этил]-2'-метансульфонилбифенил-3-илокси]ацетата натрия в 1,17 л воды добавляли 56 г 50% водного раствора гидроксиламина при комнатной температуре и перемешивали смесь при 70°C в течение 4 часов. К реакционной смеси по каплям добавляли 1 моль/л хлористо-водородной кислоты при комнатной температуре и перемешивали смесь при той же температуре. Полученное твердое вещество собирали путем фильтрации с получением с получением 110 г [4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]уксусной кислоты.
1Н-ЯМР (DMSO-d6) δ м.д.:
2,73 (3H, с), 2,75-2,85 (2H, м), 3,05-3,15 (2H, м), 4,67 (2H, с), 6,85-6,95 (2H, м), 7,16 (1H, д, J=7,9 Гц), 7,24 (1H, д, J=8,5 Гц), 7,35-7,50 (2H, м), 7,66 (1H, тд, J=7,6, 1,S Гц), 7,70-7,85 (2H, м), 8,00-8,10 (2H, м), 8,45-9,60 (1H, ушир.), 10,80-13,30 (3H, ушир.)
Пример 19
Гидрохлорид н-бутил [4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетата (соединение 48)
Способ 1) Раствор 1,499 г этил [4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетата в 20 мл 34% раствора хлороводорода в н-бутанольном растворе перемешивали при 60°C в течение 3 часов. После концентрации при пониженном давлении реакционную смесь перекристаллизовывали из н-бутанола/диизопропилового эфира с получением 1,472 г гидрохлорида н-бутил[4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетата в виде белого кристаллического вещества.
Способ 2) Раствор 110 г [4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]уксусной кислоты в 1,00 л 14% растворе хлороводорода в н-бутаноле перемешивали при 100°C в течение 2,5 часов. Реакционную смесь концентрировали при пониженном давлении и промывали остаток этилацетатом с получением 111 г неочищенного кристаллического вещества. Неочищенное кристаллическое вещество перекристаллизовывали из н-бутанола/диизопропилового эфира с получением 83,3 г гидрохлорида н-бутил[4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]-этил]-2'-метансульфонилбифенил-3-илокси]ацетата.
1Н-ЯМР (DMSO-d6) δ м.д.:
0,78 (3H, т, J=7,6 Гц), 1,15-1,30 (2H, м), 1,40-1,55 (2H, м), 2,72 (3H, с), 2,75-2,85 (2H, м), 3,05-3,15 (2H, м), 4,05 (2H, т, J=6,6 Гц), 4,78 (2H, с), 6,90-6,95 (2H, м), 7,18 (1H, д, J=7,6 Гц), 7,20-7,30 (1H, м), 7,37 (1H, д, J=7,6 Гц), 7,42-7,50 (1H, м), 7,66 (1H, тд, J=7,6, 1,3 Гц), 7,72-7,82 (2H, м), 8,02-8,10 (2H, м), 8,60-9,60 (1H, ушир.), 10,85-11,30 (1H, ушир.), 11,80-12,20 (1H, ушир.), 12,50-13,05 (1H, ушир.)
Пример 20
Следующие соединения были получены путем, сходным с описанным в примере 19.
Циклогексил[4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетат (соединение 49)
1Н-ЯМР (CDCl3) δ м.д.:
1,10-1,60 (6H, м), 1,64-1,74 (2H, м), 1,78-1,88 (2H, м), 2,66 (3H, с), 2,93 (2H, т, J=6,0 Гц), 3,35 (2H, т, J=6,0 Гц), 4,62 (2H, с), 4,82-4,90 (1H, м), 4,95 (2H, с), 5,90-6,05 (1H, ушир.с), 6,85-7,00 (3H, м), 7,12 (1H, д, J=7,6 Гц), 7,36 (1H, дд, J=7,9, 1,3 Гц), 7,57 (1H, тд, J=7,9, 1,3 Гц), 7,62-7,73 (2H, м), 7,96 (1H, д, J=2,2 Гц), 8,21 (1H, дд, J=7,9, 1,3 Гц)
Изопропил[4-[2-[2-гидрокси-5-(N-гидроксикарбамимидоил)бензолсульфониламино]этил]-2'-метансульфонилбифенил-3-илокси]ацетат (соединение 50)
1Н-ЯМР (CDCl3) δ м.д.:
1,26 (6Н, д, J=6,3 Гц), 2,65 (3H, с), 2,93 (2H, т, J=6,0 Гц), 3,30-3,40 (2H, м), 4,61 (2H, с), 4,99 (2H, ушир.с), 5,05-5,15 (1H, м), 6,04 (1H, ушир.с), 6,85-7,05 (3H, м), 7,12 (1H, д, J=7,6 Гц), 7,34-7,45 (1H, м), 7,50-7,80 (3H, м), 7,95-8,00 (1H, м), 8,15-8,30 (1H, м)
Пример 21
Этил [2-[2-[(5-карбамимидоил-2-гидроксибензолсульфонил)-(2-метил-1,3-тиазол-4-илметил)амино]этил]-5-изопропилфенокси]ацетат (соединение 51)
Раствор 174 мг этил [2-[2-[(5-циано-2-гидроксибензолсульфонил)-(2-метил-1,3-тиазол-4-илметил)амино]этил]-5-изопропилфенокси]ацетат в этанольном растворе хлороводорода перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и растворяли остаток в 3 мл этанола. К перемешиваемой суспензии при охлаждении на льду добавляли 135 мг ацетата аммония и перемешивали смесь при комнатной температуре в течение 2 суток. К реакционной смеси добавляли воду, собирали осадок путем фильтрации и промывали водой с получением 71 мг этил [2-[2-[(5-карбамимидоил-2-гидроксибензолсульфонил)-(2-метил-1,3-тиазол-4-илметил)амино]этил]-5-изопропилфенокси]ацетата.
1Н-ЯМР (DMSO-d6) δ м.д.:
1,08-1,19 (9H, м), 2,56-2,67 (5H, м), 2,70-2,81 (1H, м), 3,25-3,33 (2H, м), 4,11 (2H, кв., J=7,3 Гц), 4,63 (2H, с), 4,67 (2H, с), 6,22 (1H, д, J=9,1 Гц), 6,62 (1H, с), 6,66-6,72 (1H, м), 6,88 (1Н, д, J=7,6 Гц), 7,20 (1H, с), 7,45 (1H, дд, J=9,1, 2,8 Гц), 7,54-7,96 (2H, ушир.), 8,06 (1H, д, J=2,8 Гц), 8,14-8,67 (2H, ушир.)
Пример 22
Следующее соединение было получено путем, сходным с описанным в примере 21.
5-Карбамимидоил-2-гидрокси-N-[2-(4-изопропил-2-сульфамоилфенил)этил]бензолсульфонамид (соединение 52)
1Н-ЯМР (DMSO-d6) δ м.д.:
1,20 (6H, д, J=6,9 Гц), 2,87-2,97 (3H, м), 3,07 (2H, т, J=7,3 Гц), 6,27 (1H, д, J=9,1 Гц), 7,00-7,65 (5H, м), 7,72 (1H, д, J=1,9 Гц), 7,75-7,90 (2H, ушир.), 7,95 (1H, д, J=2,8 Гц), 8,40-8,60 (2H, м)
Пример 23
[2-[2-[(5-Карбамимидоил-2-гидроксибензолсульфонил)-(2-метил-1,3-тиазол-4-илметил)амино]этил]-5-изопропилфенокси]уксусная кислота (соединение 53)
К перемешиваемому раствору 100 мг этил [2-[2-[(5-карбамимидоил-2-гидроксибензолсульфонил)-(2-метил-1,3-тиазол-4-илметил)амино]этил]-5-изопропилфенокси]ацетата в 0,8 мл этанола при охлаждении на льду добавляли 0,183 мл 2 моль/л раствора гидроксида натрия. После перемешивания при той же температуре в течение 30 минут реакционную смесь концентрировали при пониженном давлении. К перемешиваемому раствору остатка в смеси 0,8 мл ацетонитрила 0,8 мл воды при охлаждении на льду добавляли 0,174 мл 1 моль/л хлористо-водородной кислоты и перемешивали смесь при той же температуре в течение 5 минут. При охлаждении на льду к смеси дополнительно добавляли 0,174 мл 1 моль/л хлористо-водородной кислоты и перемешивали смесь при той же температуре в течение 5 минут. Осадок собирали путем фильтрации и промывали водой с получением 74 мг [2-[2-[(5-карбамимидоил-2-гидроксибензолсульфонил)-(2-метил-1,3-тиазол-4-илметил)амино]этил]-5-изопропилфенокси]уксусной кислоты.
1Н-ЯМР (DMSO-d6) δ м.д.:
1,15 (6H, д, J=6,9 Гц), 2,62 (3H, с), 2,73-2,84 (3H, м), 3,40-3,50 (2H, м), 4,33 (2H, с), 4,53 (2H, с), 6,66 (1H, дд, J=7,6, 1,3 Гц), 6,69 (1H, д, J=1,3 Гц), 6,83 (1H, д, J=7,6 Гц), 6, 98 (1H, д, J=8,8 Гц), 7,26 (1H, с), 7,72 (1H, дд, J=8,8, 2,5 Гц), 8,12 (1H, д, J=2,5 Гц), 8,48 (2H, ушир.с), 9,14 (2H, ушир.с)
Пример 24
Амино-[4-гидрокси-3-[[2-[4-изопропил-2-(этоксикарбонилметокси)фенил]этил]сульфамоил]фенил]метиленкарбамоилоксиметил 2,2-диметилпропионат (соединение 54)
К перемешиваемому раствору 99 мг амино-[4-бензилокси-3-[[2-[4-изопропил-2-(этоксикарбонилметокси)фенил]этил]сульфамоил]фенил]метиленкарбамоилоксиметил 2,2-диметилпропионата в 3 мл тетрагидрофурана при охлаждении на льду добавляли 9,2 мг 10% палладия на угле и перемешивали смесь в атмосфере водорода при 30°C в течение 1 часа. Нерастворимый материал удаляли путем фильтрации и концентрировали фильтрат при пониженном давлении. Остаток очищали методом колоночной хроматографии на силикагеле (элюент: этилацетат/гексан) с получением 75 мг амино[4-гидрокси-3-[[2-[4-изопропил-2-(этоксикарбонилметокси)фенил]этил]-сульфамоил]фенил]метиленкарбамоилоксиметил-2,2-диметилпропионата.
1Н-ЯМР (CDCl3) δ м.д.:
1,19 (6H, д, J=6,9 Гц), 1,22 (9H, с), 1,35 (3H, т, J=7,3 Гц), 2,73-2,88 (3H, м), 3,20-3,32 (2H, м), 4,32 (2H, кв., J=7,3 Гц), 4,87 (2H, с), 5,86 (2H, с), 6,11 (1H, ушир.с), 6,52 (1H, с), 6,72 (1H, д, J=7,6 Гц), 6,95 (1H, д, J=7,6 Гц), 7,01 (1H, д, J=8,8 Гц), 8,08-8,15 (1H, м), 8,20 (1H, д, J=2,2 Гц), 8,72-9,90 (2H, ушир.)
Пример 25
Следующие соединения были получены путем, сходным с описанным в примере 24.
Амино-[4-гидрокси-3-[[2-[4-изопропил-2-(этоксикарбонилметокси)фенил]этил]сульфамоил]фенил]метиленкарбамоилоксиметил 2-ацетокси-2-метилпропионат (соединение 55)
1Н-ЯМР (CDCl3) δ м.д.:
1,20 (6H, д, J=6,9 Гц), 1,35 (3H, т, J=7,3 Гц), 1,57 (6H, с), 2,04 (3H, с), 2,75-2,88 (3H, м), 3,22-3,32 (2H, м), 4,32 (2H, кв., J=7,3 Гц), 4,69 (2H, с), 5,89 (2H, с), 6,12 (1H, ушир.с), 6,51-6,56 (1H, м), 6,73-6,79 (1H, м), 6,95 (1H, д, J=7,9 Гц), 7,01 (1H, д, J=8,8 Гц), 8,11 (1H, дд, J=8,8, 2,2 Гц), 8,21 (1H, д, J=2,2 Гц), 8,65-9,95 (2H, м)
Этил [4-[2-[5-амино(бутоксикарбонилимино)метил]-2-гидроксибензолсульфониламино]этил]-2'-метансульфонилбифенил-3-ил]оксиацетат (соединение 56)
1Н-ЯМР (DMSO-d6) δ м.д.:
0,90 (3H, т, J=7,3 Гц), 1,11 (3H, т, J=7,3 Гц), 1,31-1,40 (2H, м), 1,54-1,63 (2H, м), 2, 69 (3H, с), 2,74-2,82 (2H, м), 3,02-3,11 (2H, м), 4,00 (2H, т, J=6,6 Гц), 4,05 (2H, кв., J=7,3 Гц), 4,74 (2H, с), 6,88-6,92 (2H, м), 6,96-7,06 (1H, м), 7,15 (1H, д, J=7,6 Гц), 7,19-7,47 (2H, м), 7,65 (1H, тд, J=7,6, 0,9 Гц), 7,74 (1H, тд, J=7,6, 1,3 Гц), 8,00-8,11 (2H, м), 8,39 (1H, д, J=1,9 Гц), 8,85-9,35 (2H, м), 11,30-11,70 (1H, ушир.)
Пример исследования 1
Измерение ингибирующей активности по отношению к активированному фактору X системы свертывания крови
В 96-луночную микроплашку помещали 2,5 мкл раствора тестируемого соединения в диметилсульфоксиде, 187,5 мкл 100 мМ трис-200 мМ NaCl буферного раствора (pH=8,4) и 50 мкл 1 мМ водного раствора S-2222 (Daiichi Pure Chemicals). Затем добавляли 10 мкл раствора активированного фактора X системы свертывания крови (0,6 ед/мл, Calbiochem) в желатино-глициновом буферном растворе и инкубировали смесь в течение 10 минут при 37°C. Реакцию останавливали добавлением 50 мкл 60% уксусной кислоты и измеряли поглощение при 405 нм в микропланшетном ридере (SPECTRAmax250, Molecular Devices).
В качестве контроля использовали группу с 2,5 мкл раствора диметилсульфоксида вместо раствора тестируемого соединения, а в качестве контрольной пробы - группу с 10 мкл желатино-глицинового буферного раствора вместо активированного фактора X системы свертывания крови человека. Определяли концентрацию тестируемого соединения, ингибирующую поглощение в контроле на 50% (IC50), и использовали этот показатель в качестве индекса ингибирующей активности по отношению к активированному фактору X системы свертывания крови человека. Результаты представлены в таблице 1.
Пример исследования 2
Измерение ингибирующей активности по отношению к тромбину
В 96-луночную микроплашку помещали 2,5 мкл раствора тестируемого соединения в диметилсульфоксиде, 187,5 мкл 100 мМ трис-200 мМ NaCl буферного раствора (pH=8,4) и 50 мкл 1 мМ водного раствора S-2238 (Daiichi Pure Chemicals). Затем добавляли 10 мкл раствора тромбина человека (2,0 ед/мл, Calbiochem) в желатино-глициновом буферном растворе и инкубировали смесь в течение 10 минут при 37°C. Реакцию останавливали добавлением 50 мкл 60% уксусной кислоты и измеряли поглощение при 405 нм в микропланшетном ридере (SPECTRAmax250, Molecular Devices).
В качестве контроля использовали группу с 2,5 мкл раствора диметилсульфоксида вместо раствора тестируемого соединения, а в качестве контрольной пробы - группу с 10 мкл желатино-глицинового буферного раствора вместо тромбина человека. Определяли концентрацию тестируемого соединения, ингибирующую поглощение в контроле на 50% (IC50), и использовали этот показатель в качестве индекса ингибирующей активности по отношению к тромбину. Результаты представлены в таблице 2.
Пример исследования 3
Измерение противосвертывающих эффектов (удлинение протромбинового времени)
Раствор тестируемого соединения в диметилсульфоксиде (2 мкл) помещали в пробирку и инкубировали при 37°C. Спустя 1 минуту после добавления 48 мкл нормальной плазмы человека (George King Bio-Medical Inc) к смеси добавляли 100 мкл реагента для измерения протромбинового времени (Boehringer Mannheim), предварительно нагретого до 37°C. Протромбиновое время определяли при помощи коагулометра (ST4, Boehringer Mannheim).
В качестве контроля использовали группу без тестируемого соединения. Определяли концентрацию тестируемого соединения, увеличивающую время свертывания крови в 2 раза по отношению к контролю (CT2), и использовали этот показатель в качестве индекса противосвертывающей активности. Результаты представлены в таблице 3.
Пример исследования 4
Тест на пероральное введение на крысах
1) Сбор плазмы
В качестве экспериментальных животных использовали неполучавших в течение ночи корма крыс Wistar (SLC, самцы, в возрасте 6-9 недель). Тестируемое соединение растворяли или суспендировали в 0,5% растворе метилцеллюлозы в концентрации 6,0 мг/мл. Затем крысам перорально вводили этот раствор в дозе 5,0 мл/кг. Перед введением и через определенное время после введения тестируемого соединения производили отбор крови из яремной вены и обрабатывали ее цитратом (разбавление 1:10 3,13% раствором цитрата натрия). Образцы плазмы получали путем центрифугирования.
2) Определение ингибирующей активности по отношению к активированному фактору X системы свертывания крови в плазме
В 96-луночную микроплашку помещали 2,5 мкл образца плазмы, 200 мкл 100 мМ трис-200 мМ NaCl буферного раствора (pH=8,4) и 10 мкл раствора активированного фактора X системы свертывания крови человека (0,06 ед/мл, Calbiochem). Затем добавляли 50 мкл 1 мМ водного раствора S-2222 (Daiichi Pure Chemicals) в желатино-глициновом буферном растворе и инкубировали смесь в течение 10 минут при комнатной температуре. Реакцию останавливали добавлением 50 мкл 60% уксусной кислоты и измеряли поглощение при 405 нм в микропланшетном ридере (SPECTRAmax250, Molecular Devices).
В качестве контроля использовали группу с 2,5 мкл контрольной плазмы вместо тестируемого образца плазмы, а в качестве контрольной пробы - группу с 10 мкл желатино-глицинового буферного раствора вместо активированного фактора X системы свертывания крови человека. Принимая поглощение в контроле за 100%, определяли ингибирование поглощения в тестируемом образце плазмы, и использовали этот показатель в качестве индекса ингибирующей активности по отношению к активированному фактору X системы свертывания крови человека.
3) Измерение протромбинового времени
В пробирку помещали 50 мкл плазмы и затем инкубировали при 37°C. Через 1 минуту к смеси добавляли 100 мкл реагента для измерения протромбинового времени (Boehringer Mannheim), предварительно нагретого до 37°C. Протромбиновое время определяли при помощи коагулометра (ST4, Boehringer Mannheim).
Отношение протромбинового времени в каждый момент времени после введения тестируемого соединения к таковому до введения использовали в качестве индекса противосвертывающей активности.
4) Результаты измерения ингибирующей активности по отношению к активированному фактору X системы свертывания крови в плазме и отношение протромбинового времени через 30 минут после перорального введения каждого тестируемого соединения в дозе 30 мг/кг представлены в таблице 4.
Пример исследования 5
Тест на острую токсичность
В качестве экспериментальных животных использовали мышей ICR (SLC, самцы, в возрасте 7 недель), разделенных на несколько групп, состоящих из 5 мышей. Содержащий тестируемое соединение раствор приготавливали в такой концентрации, чтобы объем для введения составлял 50,0 мг/10,0 мл/кг. Раствор вводили в хвостовую вену со скоростью введения 1 мл/мин. Наблюдения проводили с определенным интервалом, и проводили оценку выживаемости спустя 24 часа. Как показано в таблице 5, летального эффекта не наблюдалось.
Промышленная применимость
Производные 5-амидино-2-гидроксибензолсульфонамида по настоящему изобретению и их фармацевтически приемлемые соли обладают отличной и избирательной ингибирующей активностью по отношению к активированному фактору X системы свертывания крови. Настоящее изобретение относится к новым соединениям, являющимся отличными ингибиторами активированного фактора X системы свертывания крови. В дополнение, производные 5-циано-2-гидроксибензолсульфонамида по настоящему изобретению, представленные выше общими формулами (II), и их фармацевтически приемлемые соли важны в качестве промежуточных продуктов для получения соединений, представленных выше общей формулой (I). Соответственно, соединения по настоящему изобретению, представленные выше общей формулой (I), могут быть легко получены через эти соединения.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ СОЕДИНЕНИЕ ИНДОЛИНА И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2003 |
|
RU2318808C2 |
| КОНДЕНСИРОВАННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ, СОДЕРЖАЩАЯ ЕГО ЛЕЧЕБНАЯ КОМПОЗИЦИЯ И ЕЕ ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2006 |
|
RU2418803C2 |
| ПРОИЗВОДНЫЕ 2-ПИРИДОНА | 2010 |
|
RU2551847C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛА | 2004 |
|
RU2332412C2 |
| N,N-ЗАМЕЩЕННЫЕ 3-АМИНОПИРРОЛИДИНОВЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПОВТОРНОГО ПОГЛОЩЕНИЯ МОНОАМИНОВ | 2006 |
|
RU2574406C2 |
| КОНДЕНСИРОВАННОЕ 4-ОКСОПИРИМИДИНОВОЕ ПРОИЗВОДНОЕ | 2005 |
|
RU2358969C2 |
| ПРОИЗВОДНЫЕ АМИДОКАРБОНОВОЙ КИСЛОТЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ СНИЖЕНИЯ ГЛЮКОЗЫ В КРОВИ | 1998 |
|
RU2176999C2 |
| ПРОИЗВОДНЫЕ ГУАНИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ ИНГИБИРОВАНИЯ NA/H - ОБМЕНА В КЛЕТКАХ | 1994 |
|
RU2141946C1 |
| НОВОЕ СОЕДИНЕНИЕ, ПРОЯВЛЯЮЩЕЕ ИНГИБИТОРНУЮ АКТИВНОСТЬ В ОТНОШЕНИИ PARP | 2012 |
|
RU2606635C2 |
| ИНГИБИТОРЫ СИГМА-РЕЦЕПТОРА | 2005 |
|
RU2417987C2 |
Изобретение относится к производному 5-амидино-2-гидроксибензолсульфонамида, общей формулы:
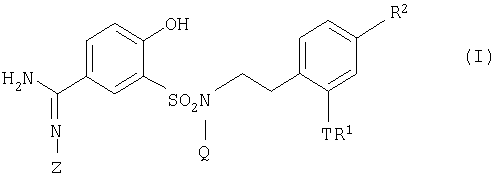
где R1 означает Н, низший алкил, который может иметь заместитель, выбранный из группы (А); (А) означает -COORA, -CONRBRC, 3-7-членная моноциклическая гетероциклоалкильная группа, содержащая в кольце один или два гетероатома, выбранных из N, О, S, которая может содержать оксогруппу, и 5-6-членная моноциклическая ароматическая гетероциклическая группа, содержащая в кольце один-три гетероатома, выбранных из N, О, S, которая может содержать оксогруппу или низший алкил; где RA означает Н, 3-7-членную моноциклическую алифатическую алкильную группу, низший алкил, который может иметь заместитель, выбранный из группы (i); (i) означает -COORA1, где RA1 означает Н, низший алкил, -OCORA2, где RA2 является низшей алкильной группой, -OCOORA3, где RA3 является низшим алкилом ORA4, где RA4, означает Н, низший алкил -CONRA5RA6, где RA5 и RA6 независимо означают Н, низший алкил, или -NRA5RA6 образует 5-6-членную моноциклическую аминогруппу, содержащую в кольце один гетероатом, выбранный из N, О, S, и другой, отличный от N, вместо связи; где RB и RC независимо означают Н, низший алкил, который может иметь заместитель, выбранный из группы (ii), или -NRBRC образует 5-6-членную моноциклическую аминогруппу, содержащую в кольце один гетероатом, выбранный из N, О, S, и другой, отличный от N, вместо связи; (ii) означает -COORB1, где RB1 означает Н, низший алкил; Т означает О, сульфонильную группу; или TR1 означает -SO2NRB3RC3, где RB3 и RC3 независимо означают Н, низший алкил; R2 означает низший алкил, фенил, который может содержать один-три заместителя, выбранных из группы (В); (В) означает галоген, -COORE, сульфамоил, низший алкилсульфонил; где RE означает низший алкил; Q означает Н, низший алкил, который может иметь заместитель, выбранный из группы (D); (D) означает 5-6-членную моноциклическую ароматическую гетероциклическую группу, которая может иметь один-три гетероатома, выбранные из N, О, S, которая может иметь заместитель, выбранный из группы (iv); (iv) означает оксогруппу, низший алкил; и
Z означает Н, ОН, гидроксильную группу -COORN, где RN означает низший алкил, который может иметь заместитель, выбранный из группы (viii); (viii) означает -OCORN5, где RN5 означает низший алкил, который может содержать -OCORN51, где RN51 означает низший алкил; или его фармацевтически приемлемая соль. Соединения I ингибируют активированный фактор Х системы свертывания крови, что позволяет использовать их в фармацевтической композиции. Описаны промежуточные соединения. 3 н. и 9 з.п. ф-лы, 5 табл.

где R1 представляет собой атом водорода или низшую алкильную группу, которая может иметь заместитель, выбранный из следующей группы (А);
(А) -COORA -CONRBRC, 3-7-членная моноциклическая гетероциклоалкильная группа, содержащая в кольце один или два гетероатома, выбранных из атома азота, атома кислорода или атома серы, которая может содержать оксогруппу, и 5-6-членная моноциклическая ароматическая гетероциклическая группа, содержащая в кольце один-три гетероатома, выбранных из атома азота, атома кислорода или атома серы, которая может содержать оксогруппу или низшую алкильную группу;
где RA представляет собой атом водорода, 3-7-членную моноциклическую алифатическую алкильную группу или низшую алкильную группу, которая может иметь заместитель, выбранный из следующей группы (i);
(i) -COORA1, где RA1 является атомом водорода или низшей алкильной группой, -OCORA2, где RA2 является низшей алкильной группой, -OCOORA3, где RA3 является низшей алкильной группой, -ORA4, где RA4 является атомом водорода или низшей алкильной группой, -CONRA5RA6, где RA5 и RA6 независимо являются атомом водорода или низшей алкильной группой, или -NRA5RA6 образует 5-6-членную моноциклическую аминогруппу, содержащую в кольце один гетероатом, выбранный из атома азота, атома кислорода или атома серы, и другой, отличный от атома азота, вместо связи;
где RB и RC независимо представляют собой атом водорода или низшую алкильную группу, которая может иметь заместитель, выбранный из следующей группы (ii), или -NRBRC образует 5-6-членную моноциклическую аминогруппу, содержащую в кольце один гетероатом, выбранный из атома азота, атома кислорода или атома серы, и другой, отличный от атома азота вместо связи;
(ii) -COORB1, где RB1 является атомом водорода или низшей алкильной группой;
Т представляет собой атом кислорода или сульфонильную группу; или TR1 представляет собой -SO2NRB3RB3, где RB3 и RC3 независимо являются атомом водорода или низшей алкильной группой;
R2 представляет собой низшую алкильную группу, фенильную группу, которая может содержать один-три заместителя, выбранных из следующей группы (В),
(В) атом галогена, -COORE, сульфамоильная группа и низшая алкилсульфонильная группа;
где RE представляет собой низшую алкильную группу;
Q представляет собой атом водорода или низшую алкильную группу, которая может иметь заместитель, выбранный из следующей группы (D);
(D) 5-6-членную моноциклическую ароматическую гетероциклическую группу, которая содержит один-три гетероатома, выбранные из атома азота, атома кислорода или атома серы, которая может иметь заместитель, выбранный из следующей группы (iv);
(iv) оксогруппа и низшая алкильная группа; и
Z представляет собой атом водорода, гидроксильную группу или -COORN,
где RN представляет собой низшую алкильную группу, которая может иметь заместитель, выбранный из следующей группы (viii);
(viii) -OCORN5, где RN45 является низшей алкильной группой, которая может содержать -OCORN51, где RN51 является низшей алкильной группой;
или его фармацевтически приемлемая соль.
(i) -COORA1, где RA1 является атомом водорода или низшей алкильной группой, -OCORA2, где RA2 является низшей алкильной группой, -OCOORA3, где RA3 является низшей алкильной группой, -ORA4, где RA4 является атомом водорода или низшей алкильной группой, -CONRA5RA6, где RA5 и RA6 независимо являются атомом водорода или низшей алкильной группой, или -NRA5RA6 образует 5-6-членную моноциклическую аминогруппу;
R2 является фенильной группой, содержащей заместитель, выбранный из следующей группы (В);
(В) атом галогена, -COORE сульфамоильная группа и низшая алкилсульфонильная группа;
где RE является низшей алкильной группой;
Т является атомом кислорода; и
Z является гидроксигруппой.
где R1 является метильной группой, содержащей заместитель -COORA10, где RA10 является 3-7-членной моноциклической алифатической алкильной группой или низшей алкильной группой; и
R2 является фенильной группой, содержащей заместитель, выбранный из группы, включающей сульфамоильную группу и низшую алкилсульфонильную группу.
где R1 является низшей алкильной группой, содержащей заместитель -COORA10, где RA10 является 3-7-членной моноциклической алифатической алкильной группой или низшей алкильной группой;
R2 является фенильной группой, содержащей заместитель, выбранный из группы, включающей сульфамоильную группу и низшую алкилсульфонильную группу;
Q является атомом водорода,
Т является атомом кислорода; и
Z является атомом водорода.
или его фармацевтически приемлемая соль.

или его фармацевтически приемлемая соль.

или его фармацевтически приемлемая соль.

или его фармацевтически приемлемая соль.

где R1 представляет собой атом водорода или низшую алкильную группу, которая может иметь заместитель, выбранный из следующей группы (А);
(A) -COORA, -CONRBRC, 3-7-членная моноциклическая гетероциклоалкильная группа, содержащая в кольце один или два гетероатома, выбранных из атома азота, атома кислорода или атома серы, которая может содержать оксогруппу, и 5-6-членная моноциклическая ароматическая гетероциклическая группа, содержащая в кольце один-три гетероатома, выбранных из атома азота, атома кислорода или атома серы, которая может содержать оксогруппу или низшую алкильную группу;
где RA представляет собой атом водорода, 3-7-членную моноциклическую алифатическую алкильную группу или низшую алкильную группу, которая может иметь заместитель, выбранный из следующей группы (i);
(i) -COORA1, где RA1 является атомом водорода или низшей алкильной группой, -OCORA2, где RA2 является низшей алкильной группой, -OCOORA3, где RA3 является низшей алкильной группой, -ORA4, где RA4 является атомом водорода или низшей алкильной группой, -CONRA5RA6, где RA5 и RA6 независимо являются атомом водорода или низшей алкильной группой, или -NRA5RA6 образует 5-6-членную моноциклическую аминогруппу, содержащую в кольце один гетероатом, выбранный из атома азота, атома кислорода или атома серы, и другой, отличный от атома азота вместо связи;
где RB и RC независимо представляют собой атом водорода или низшую алкильную группу, которая может иметь заместитель, выбранный из следующей группы (ii), или -NRBRC образует 5-6-членную моноциклическую аминогруппу, содержащую в кольце один гетероатом, выбранный из атома азота, атома кислорода или атома серы, и другой, отличный от атома азота, вместо связи;
(ii) -COORB1, где RB1 является атомом водорода или низшей алкильной группой;
Т представляет собой атом кислорода или сульфонильную группу; или TR1 представляет собой -SO2NRB3RB3, где RB3 и RB3 независимо являются атомом водорода или низшей алкильной группой;
R2 представляет собой низшую алкильную группу, фенильную группу, которая может иметь один-три заместителя, выбранных из следующей группы (В):
(В) атом галогена, -COOR8 сульфамоильная группа и низшая алкилсульфонильная группа;
где RE представляет собой низшую алкильную группу;
Q представляет собой атом водорода или низшую алкильную группу, которая может иметь заместитель, выбранный из следующей группы (D);
(D) 5-6-членную моноциклическую ароматическую гетероциклическую группу, содержащую в кольце один-три гетероатома, выбранные из атома азота, атома кислорода или атома серы, которая может иметь заместитель, выбранный из следующей группы (iv);
(iv) оксогруппа и низшая алкильная группа;
или его соль.
Приоритет по пунктам:
(A) -COORA, -CONRBRC, 3-7-членная моноциклическая гетероциклоалкильная группа, содержащая в кольце один или два гетероатома, выбранных из атома азота, атома кислорода или атома серы, которая может содержать оксогруппу, и 5-6-членная моноциклическая ароматическая гетероциклическая группа, которая содержит в кольце один-три гетероатома, выбранных из атома азота, атома кислорода или атома серы, которая может содержать оксогруппу или низшую алкильную группу; где RА представляет собой 3-7-членную моноциклическую алифатическую алкильную группу или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (i);
(i) -COORA1, где RA1 является атомом водорода или низшей алкильной группой, -OCORA2, где RA2 является низшей алкильной группой, -OCOORA3, где RA3 является низшей алкильной группой, -ORA4, где RA4 является атомом водорода или низшей алкильной группой, -CONRA5RA6, где RA5 и RA6 независимо являются атомом водорода или низшей алкильной группой, или -NRA5RA6 образует 5-6-членную моноциклическую аминогруппу, содержащую в кольце один гетероатом, выбранный из атома азота, атома кислорода или атома серы, и другой, отличный от атома азота вместо связи;
где RB и RC независимо представляют собой атом водорода или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (ii), или -NRBRC образует 5-6-членную моноциклическую аминогруппу, содержащую в кольце один гетероатом, выбранный из атома азота, атома кислорода или атома серы, и другой, отличный от атома азота вместо связи;
(ii) -COORB1, где RB1 является атомом водорода или низшей алкильной группой;
Т представляет собой атом О;
R2 представляет собой низшую алкильную группу, фенильную группу, которая может содержать один-три заместителя, выбранных из следующей группы (В),
(В) атом галогена, -COORE сульфамоильная группа и низшая алкилсульфонильная группа;
где R8 представляет собой низшую алкильную группу;
Q представляет собой атом Н3 и
Z представляет собой атом водорода или гидроксильную группу;
или его фармацевтически приемлемая соль;
пп.2-11, где R1 представляет собой атом водорода или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (А);
(A) -COORA -CONRBRC, 3-7-членная моноциклическая гетероциклоалкильная группа, содержащая в кольце один или два гетероатома, выбранных из атома азота, атома кислорода или атома серы, которая может содержать оксогруппу, и 5-6-членная моноциклическая ароматическая гетероциклическая группа, содержащая в кольце один-три гетероатома, выбранных из атома азота, атома кислорода или атома серы, которая может содержать оксогруппу или низшую алкильную группу;
где RA представляет собой атом водорода, 3-7-членную моноциклическую алифатическую алкильную группу или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (i);
(i) -COORA1, где RA1 является атомом водорода или низшей алкильной группой, -OCORA2, где RA2 является низшей алкильной группой, -OCOORA3, где RA3 является низшей алкильной группой, -ORA4, где RA4 является атомом водорода или низшей алкильной группой, -CONRA5RA6, где RA5 и RA6 независимо являются атомом водорода или низшей алкильной группой, или -NRA5RA6 образует 3-7-членную моноциклическую аминогруппу, содержащую в кольце один гетероатом, выбранный из атома азота, атома кислорода или атома серы, и другой, отличный от атома азота вместо связи;
где RB и RC независимо представляют собой атом водорода или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (ii), или -NRBRC образует 5-6-членную моноциклическую аминогруппу, содержащую в кольце один гетероатом, выбранный из атома азота, атома кислорода или атома серы, и другой, отличный от атома азота вместо связи;
(ii) -COORB1, где RB1 является атомом водорода или низшей алкильной группой;
Т представляет собой атом кислорода;
R2 представляет собой низшую алкильную группу, фенильную группу, которая может содержать один-три заместителя, выбранных из следующей группы (В),
(В) атом галогена, -COORE сульфамоильная группа и низшая алкилсульфонильная группа;
где RE представляет собой низшую алкильную группу;
Q представляет собой атом водорода или низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (D);
(D) 5-6-членную моноциклическую ароматическую гетероциклическую группу, содержащую в кольце один-три гетероатома, выбранные из атома азота, атома кислорода или атома серы, которая может иметь заместитель, выбранный из следующей группы (iv);
(iv) оксогруппа и низшая алкильная группа;
или его соль;
Т представляет собой сульфонильную группу; или TR1 представляет собой -SO2NRB3RC3, где RB3 и RC3 независимо являются атомом водорода или низшей алкильной группой;
Q представляет собой низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (D);
(D) 5-6-членную моноциклическую ароматическую гетероциклическую группу, которая может иметь один-три гетероатома, выбранные из атома азота, атома кислорода или атома серы, которая может иметь заместитель, выбранный из следующей группы (iv);
(iv) оксогруппа и низшая алкильная группа; и
Z представляет собой -COORN, где RN представляет собой низшую алкильную группу, которая может содержать заместитель, выбранный из следующей группы (viii);
(viii) -OCORN45, где RN5 является низшей алкильной группой, которая может содержать -OCORN51, где RN51 является низшей алкильной группой;
п.12 - где Т представляет собой сульфонильную группу; или TR1 представляет собой -SO2NRB3RC3, где RB3 и RC3 независимо являются атомом водорода или низшей алкильной группой.
| WO 00/50390 A1, 31.08.2000 | |||
| Барабан для обработки кож | 1981 |
|
SU1020434A1 |
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| 4-АМИНОПИРИДИНЫ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2126388C1 |
| СПОСОБ ПОЛУЧЕНИЯ АМИДОВ КАРБОНОВЫХ ИЛИ СУЛЬФОНОВЫХ КИСЛОТ ИЛИ ИХ ФИЗИОЛОГИЧЕСКИ СОВМЕСТИМЫХ СОЛЕЙ | 1990 |
|
RU2072986C1 |
Авторы
Даты
2006-04-10—Публикация
2001-10-02—Подача