Изобретение относится к новым производным гуанидина и к их фармацевтически приемлемым солям, применимым в качестве лекарственных средств.
Раскрытие сущности изобретения
Данное изобретение относится к новым производным гуанидина. Более конкретно, данное изобретение относится к новым производным гуанидина и к их фармацевтически приемлемым солям, обладающим фармакологической активностью, к способам их получения, к содержащим их лекарственным формам и к их применению.
Соответственно, одна из целей данного изобретения состоит в получении новых полезных производных гуанидина и их фармацевтически приемлемых солей, обладающих сильным ингибирующим действием на Na+/H+-обмен в клетках.
Другая цель изобретения заключается в создании способов получения производных гуанидина и их солей.
Еще одна цель изобретения состоит в создании лекарственных форм, содержащих производные гуанидина или их фармацевтически приемлемые соли.
И еще одна цель изобретения заключается в создании способов применения указанных производных гуанидина или их фармацевтически приемлемых солей в качестве лекарственных средств для лечения и/или профилактики сердечно-сосудистых заболеваний, сосудисто-мозговых заболеваний, почечных заболеваний, артериосклероза, шока и т.п. у человека и животных.
Целевые производные гуанидина настоящего изобретения являются новыми соединениями, которые могут быть представлены следующей общей формулой (I):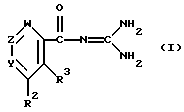
где Y - представляет N или C-R1, в которой R1 представляет водород; (низший)алкил; гидрокси; (низший)алкоксигруппу; гидрокси(низший)алкил; защищенный амино(низший)алкил; карбокси(низший)алкоксигруппу; гидрокси(низший) алкоксигруппу; фенил; или 5- или 6-членную гетероциклическую группу, имеющую в качестве гетероатомов 1 или 2 атома азота;
R2 представляет водород; арил, который может иметь один заместитель, выбранный из группы, включающей: галоген, нитро, циано, (низший)алкил, тригалоген (низший)алкил, защищенную аминогруппу; арилоксигруппу; тригалоген (низший)алкил; ацил; 5- или 6-членную гетероциклическую группу с 1-4 гетероатомами, независимо выбранными из группы, включающей азот, серу и кислород, которая может иметь заместитель(ли), выбранный(ые) из группы, включающей: карбоксигруппу, защищенную карбоксигруппу, ацил, (низший)алкил, галоген, гидркосиимино(низший)алкил, ди(низший)алкиламино(низший) алкил, цианогруппу, аминогруппу, защищенную аминогруппу, карбокси(низший)алкенил, защищенный карбокси(низший)алкенил, карбокси (низший)алкил; или гетероцикл(низший)алкил;
R3 - представляет водород; (низшую)алкоксигруппу; гидроксигруппу, 5-членную гетероциклическую группу с атомом азота в качестве гетероатома; или
R2 и R3 - соединены друг с другом с образованием 2-х валентного радикала формулы:
в которой R5 - водород или (низший)алкил;
R6 - водород или (низший)алкил;
R11 -водород или цианогруппа;
Z представляет N или C-R4, в которой R4 представляет водород; галоген; цианогруппу; гидрокси(низший)алкил; 5-членную гетероциклическую группу с 1-4 атомами азота в качестве гетероатомов; ацил; W представляет N или C-R12, в которой R12 представляет водород; или фармацевтически приемлемые соли этого соединения.
Целевые соединения формулы (I) настоящего изобретения могут быть синтезированы следующим способом (см. в конце описания).
К подходящим фармацевтически приемлемым солям целевых соединений формулы (I) относятся обычные неядовитые соли, которые могут включать соли с основаниями или соли, образованные добавлением кислот, такие как соли с неорганическими основаниями, например соли щелочных металлов (например, натриевая соль, калиевая соль и т.д.), соли щелочноземельных металлов (например, кальциевая соль, магниевая соль и т.д.), соли аммония; соли с органическими основаниями, например соли с органическими аминами (например, соль с триэтиламином, соль с пиридином, соль с пиколином, соль с этаноламином, соль с триэтаноламином, соль с дициклогексиламином, соль с N,N'-дибензилэтилендиамином и т. д. ); соли, образованные добавлением неорганических кислот (например, гидрохлорид, гидробромид, сульфат, фосфат и т.д); соли, образованные добавлением органических карбоновых или сульфоновых кислот (например, формат, ацетат, трифторацетат, малеат, тартрат, цитрат, фумарат, изэтионат, метансульфонат, бензолсульфонат, толуолсульфонат и т.д.); соли с аминокислотами основного или кислотного характера (например, аргинином, аспаратиновой кислотой, глютаминовой кислотой и т.д.),
В вышеприведенном и нижеследующем тексте настоящего описания соответствующие примеры и иллюстрации разнообразных определений, намеренно включенных в объем изобретения, подробно разъясняются ниже.
Термин "низший(ая)" применяется для обозначения группы, имеющей 1-6, предпочтительно 1-4, атомов углерода, если нет особых указаний.
Термин "высший(ая)" применяется для обозначения группы, имеющей 7-20 атомов углерода, если нет особых указаний.
Приемлемый "низший алкил" и "низший алкильный фрагмент" в терминах "защищенный гидрокси(низший)алкил", "гидрокси(низший) алкил", "амино(низший)алкил", "защищенный амино(низший)алкил", "гетероцикл(низший)алкил", "моно(ди или три) галоген(низший) алкил", "ди(низший)алкиламино(низший)алкил", гидроксиимино (низший)алкил" и "(низшая)алкокси(низший)алкил" включает алкил с прямой или разветвленной цепью и 1-6 атомами углерода, например метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет- бутил, трет-пентил, пентил, гексил и т.п., предпочтительно алкил с 1-4 атомами углерода.
Приемлемый "низший алкенил" и "низший алкенильный фрагмент" в терминах "карбокси(низший)алкенил" и "защищенный карбокси (низший)алкенил" может включать: винил, 1-(или 2-)-пропенил, 1-(2- или 3-)бутенил, 1-(2-, 3- или 4-)пентенил, 1-(2-3-, 4- или 5-)гексенил, метилвинил, этилвинил, 1-(2- или 3)-метил-1-(или 2-)пропенил, 1-(2- или 3-) этил-1-(или 2-)пропенил, 1-(2-, 3- или 4-)метил-1-(2- или 3-)бутенил и т.п., из которых более предпочтителен(C2-C4)алкенил.
Приемлемый "низший алкинил" может включать: этинил, 1- пропинил, пропаргил, 1-метилпропаргил, 1-, 2- или 3-бутинил, 1-, 2-, 3- или 4-пентинил, 1-, 2-, 3-, 4- или 5-гексинил и т.п.
Приемлемая "низшая алкоксигруппа" или "низший алкокси- фрагмент" в терминах "(низшая)алкокси(низший)алкил", "карбокси (низшая)алкоксигруппа", "защищенная карбокси(низшая)алкокси- группа", "гидрокси(низшая)алкоксигруппа" и "защищенная гидрокси (низшая)алкоксигруппа" может включать: метокси-, этокси-, пропокси-, изопропокси-, бутокси-, изобутокси-, трет-бутокси-, пентилокси-, трет-пентилокси-, гексилоксигруппу и т.п.
Приемлемый "цикло(низший)алкил" может включать: циклопентил, циклогексил и т.п.
Приемлемый "цикло(низший)алкенил" может включать: циклогексенил, циклогексадиенил и т.п.
Приемлемые "защищенная аминогруппа" и "защищенный амино- фрагмент" в термине "защищенный амино(низший)алкил" может включать защищенную обычным образом аминогруппу и т.п.
Приемлемые "обычным образом защищенные аминогруппы" могут включать ациламиногруппу или аминогруппу, защищенную обычной защитной группой, например ар(низшим) алкилом, в котором содержится приемлемый заместитель(например, бензил, тритил и т.д.), или аналогичной группой.
Приемлемые "ацил" и "ацильный фрагмент" в термине "ацил- аминогруппа" могут включать: карбамоил, алифатическую ацильную группу и ацильную группу, содержащуюся в ароматическом цикле, которая называется ароматическим ацилом, или гетероциклическом ядре, который называется гетероциклическим ацилом.
Указанные ацилы могут быть иллюстрированы следующими приемлемыми примерами; карбамоил, тиокарбамоил, сульфамоил, алифатический ацил, такой как низший и высший алканоил (например, формил, ацетил, пропаноил, бутаноил, 2-метилпропаноил, пентаноил, 2,2-диметилпропаноил, гексаноил, гептаноил, октаноил, нонаноил, деканоил, ундеканоил, додеканоил, тридеканоил, тетрадеканоил, пентадеканоил, гексадеканоил, гептадеканоил, октадеканоил, нонадеканоил, эйкозаноил и т.д.), низший или высший алкоксикарбонил (например, метоксикарбонил, этоксикарбонил, трет-бутоксикарбонил, трет-пентилоксикарбонил, гептил)оксикарбонил и т.д.), низший или высший алкилсульфонил (например, метилсульфонил, этилсульфонил и т. д. ), низший или высший алкоксисульфонил (например, метоксисульфонил, этоксисульфонил и т. д.), моно(ди- или три- )галоген(низший)алкилсульфонил (например, фторметилсульфонил, дифторметилсульфонил, трифторметилсульфонил, хлорметилсульфонил, дихлорметилсульфонил, трихлорметилсульфонил, 1- или 2- фторэтилсульфонил, 1-или 2-хлорэтилсульфонил и т.д.) или аналогичные группы.
Ароматические ацилы включают, например, ароил (например, бензоил, толуоил, нафтоил и т. д.), ар(низший)алканоил (например, фенил(низший)алканоил (например, фенилацетил, фенилпропаноил, фенилбутаноил, фенилизобутаноил, фенилпентаноил, фенилгексаноил и т.д.); нафтил(низший)алканоил (например, нафтилацетил, нафтилпропаноил, нафтил бутаноил и т.д.) и т.д.); ар(низший)алкеноил (например, фенил(низший)алкеноил (например, фенилпропеноил, фенилбутеноил, фенилметакрилоил, фенилпентеноил, фенилгексеноил и т.д. ), нафтил(низший)алкеноил (например, нафтилпропеноил, нафтилбутеноил и т.д.) и т. д.); ар(низший)алкоксикарбонил (например, фенил(низший)алкоксикарбонил (например, бензилоксикарбонил) и т.д.); арилоксикарбонил (например, феноксикарбонил, нафтилоксикарбонил и т.д.); арилокси- (низший)алканоил (например, феноксиацетил, феноксипропионил и т. д. ); арилглиоксилоил (например, фенилглиоксилоил, нафтил- глиоксилоил и т.д.), арилсульфонил (например, фенилсульфонил, п-толилсульфонил и т.д.) и аналогичные группы.
Примеры гетероциклических ацилов включают: гетероциклкарбонил, гетероцикл(низший)алканоил (например, гетероциклацетил, гетероциклпропаноил, гетероцикл бутаноил, гетероциклпентаноил, гетероциклгексаноил и т.д.), гетероцикл(низший)алкеноил (например, гетероциклпропеноил, гетероцикл бутеноил, гетероциклпентеноил, гетероциклгексеноил и т.д.), гетероциклглиоксилоил и аналогичные группы, в которых "гетероциклический фрагмент" для терминов "гетероциклкарбонил", "гетероцикл(низший)алкил", "гетероцикл (низший)алкеноил" и "гетероциклглиоксилоил", упомянутых выше, более конкретно означает насыщенный или ненасыщенный, моноциклический или полициклический гетероциклический радикал, содержащий по меньшей мере один гетероатом, например атом кислорода, серы, азота и т.п.
К особенно предпочтительным гетероциклическим группам относятся такие гетероциклические группы, как:
ненасыщенные 3-8-членные (более предпочтительно 5- или 6-членные) гетеромоноциклические группы, содержащие 1-4 атомов азота, например пирролил, пирролинил, имидазолил, пиразолил, пиридил, дигидропиридил, пиримидинил, пиразинил, пиридазинил, триазолил (например, 4Н-1,2,4-триазолил, 1Н-1,2,3-триазолил, 2Н-1,2,3-триазолил и т. д.), тетразолил (например, 1H-тетразолил, 2Н-тетразолил и т.д.) и т.д.;
насыщенные 3-8-членные (более предпочтительно 5- или 6-членные) гетеромоноциклические группы, содержащие 1-4 атомов азота, например пирролидинил, имидазолидинил, пиперидил, пиперазинил и т.д.;
ненасыщенные конденсированные гетероциклические группы, содержащие 1-4 атома азота, например индолил, изоиндолил, индолинил, индолизинил, бензимидазолил, хинолил, изохинолил, индазолил, бензотриазолил и т.д.;
ненасыщенные 3-8-членные (более предпочтительно 5- или 6-членные гетеромоноциклические группы, содержащие 1-2 атома кислорода и 1-3 атома азота, например оксазолил, изоксазолил, оксадиазолил (например, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, 1,2,5-оксадиазолил и т.д.) и т.д.;
насыщенные 3-8-членные (более предпочтительно 5- или 6-членные) гетеромоноциклические группы, содержащие 1-2 атома кислорода и 1-3 атома азота, например оксазолидинил, морфолинил, синдионил и т.д.;
ненасыщенные конденсированные гетероциклические группы, содержащие 1-2 атома кислорода и 1-3 атома азота, например, бензоксазолил, бензоксадиазолил и т.д.;
ненасыщенные 3-8-членные (более предпочтительно 5- или 6-членные) гетеромоноциклические группы, содержащие 1-2 атома серы и 1-3 атома азота, например тиазолил, изотиазолил, тиадиазолил (например, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил и т.д.), дигидротиазинил и т.д.;
насыщенные 3-8-членные (более предпочтительно 5- или 6-членные) гетеромоноциклические группы, содержащие 1-2 атома серы и 1-3 атома азота, например тиазолидинил и т.д.;
ненасыщенные 3-8-членные (более предпочтительно 5- или 6- тичленные) гетеромоноциклические группы, содержащие 1-2 атома серы, например тиенил, дигидродитинил, дигидродитионил и т.д.;
ненасыщенные конденсированные гетероциклические группы, содержащие 1-2 атома серы и 1-3 атома азота, например бензотиазолил, бензотиадиазолил и т. д.;
ненасыщенные 3-8-членные (более предпочтительно 5- или 6- тичленные) гетеромоноциклические группы, содержащие атом кислорода, например фурил и т.д. ;
ненасыщенные 3-8-членные (более предпочтительно 5- или 6- тичленные) гетеромоноциклические группы, содержащие атом кислорода и 1-2 атома серы, например дигидрооксадитиинил и т.д.;
ненасыщенные конденсированные гетероциклические группы, содержащие 1-2 атома серы, например бензотиенил, бензодитиинил и т.д.;
ненасыщенные конденсированные гетероциклические группы, содержащие атом кислорода и 1-2 атома серы, например бензооксатиинил и т.д., и аналогичные группы.
Ацильный фрагмент, как указано выше, может иметь 1-10 одинаковых или различных приемлемых заместителей, таких как низший алкил, примеры которого приведены выше, низшая алкокси- группа, примеры которой приведены выше, низшая алкилтиогруппа, в которой низший алкильный фрагмент указан в виде примеров выше, низшая алкиламиногруппа, в которой примеры низшего алкильного фрагмента указаны выше, цикло(низший)алкил, примеры которого приведены выше, цикло(низший)алкенил, примеры которого приведены выше, галоген, аминогруппа, защищенная аминогруппа, примеры которой приведены выше, гидроксигруппа, защищенная гидроксигруппа, цианогруппа, нитрогруппа, карбоксигруппа, защищенная карбоксигруппа, сульфогруппа, сульфамоил, иминогруппа, оксогруппа, амино(низший)алкил, в котором примеры низшего алкильного фрагмента указаны выше, карбомоилоксигруппа, гидрокси(низший) алкил, для которого примеры низшего алкильного фрагмента указаны выше, диамино(низший)алкилиден(например диаминометилен и т.д.), ди(низший)алкиламиногруппа, для которой примеры низшего алкильного фрагмента указаны выше, ди(низший)алкиламино(низший) алкил, для которого примеры низшего алкильного фрагмента указаны выше, гетероцикл(низший)алкил, для которого примеры гетероциклического фрагмента и низшего алкильного фрагмента приведены выше, или аналогичные группы.
Приемлемый "арил" и "арильный фрагмент" в термине "арилоксигруппа" может включать фенил, нафтил и т.п.
Приемлемая "удаляемая группа" может включать кислотный остаток, низшую алкоксильную группу, примеры которой приведены выше, и т.п., и приемлемые примеры "кислотного остатка" могут включать галоген, ацилоксигруппу, для которой примеры ацильного фрагмента приведены выше, или аналогичные группы.
Приемлемый "галоген" и "галогеновый фрагмент" в термине "моно(ди- или три-) галоген(низший)алкил" могут включать фтор, бром, хлор и иод.
Приемлемые "защищенная карбоксигруппа" и "защищенный карбоксифрагмент" в терминах "защищенная карбокси(низшая) алкоксигруппа" и "защищенный карбокси(низший)алкенил" могут включать защищенную обычным образом карбоксигруппу и т.п.
Приемлемые "обычным образом защищенные карбоксигруппы" могут включать этерифицированную карбоксигруппу и т.п. И приемлемые примеры таких сложных эфиров могут включать такие эфиры, как низшие алкиловые сложные эфиры (например, метиловый эфир, этиловый эфир, пропиловый эфир, изопропиловый эфир, бутиловый эфир, изобутиловый эфир, трет-бутиловый эфир, пентиловый эфир, трет-пентиловый эфир, гексиловый эфир и т.д.); низшие алкениловые сложные эфиры (например, виниловый эфир, аллиловый эфир и т.д.); низшие алкиниловые сложные эфиры (например, этиниловый эфир, пропиниловый эфир и т. д. ); (низшая)алкокси(низшие) алкиловые сложные эфиры (например, метоксиметиловый эфир, этоксиметиловый эфир, изопропоксиметиловый эфир, 1-метоксиэтиловый эфир, 1-этоксиэтиловый эфир и т.д.); (низшая)алкилтио(низшие) алкиловые сложные эфиры (например, метилтиометиловый эфир, этилтиометиловый эфир, этилтиоэтиловый эфир, изопропилтиометиловый эфир и т.д.); моно(ди- или три-) галоген(низшие) алкиловые сложные эфиры (например, 2- иодэтиловый эфир, 2,2,2-трихлорэтиловый эфир и т.д.); (низшая)- алканоилокси(низшие)алкиловые сложные эфиры (например, ацетоксиметиловый эфир, пропионилоксиметиловый эфир, бутирилоксиметиловый эфир, валерилоксиметиловый эфир, пивалоилоксиметиловый эфир, гексаноилоксиметиловый эфир, 1-ацетоксиэтиловый эфир, 2-ацетоксиэтиловый эфир, 2-пропионилоксиэтиловый эфир и т.д. ), (низшая)алкоксикарбонилокси(низшие)алкиловые сложные эфиры (например, метоксикарбонилоксиметиловый эфир, этоксикарбонилоксиметиловый эфир, пропоксикарбонилоксиметиловый эфир, 1-(или 2-)-[мeтoкcикapбoнилoкcи] этилoвый эфир, 1-(или 2-)-[этоксикарбонилокси] этиловый эфир, 1-(или 2-)-[пропоксикарбонилокси] - этиловый эфир, 1-(или 2-)-[изопропоксикарбонилокси] этиловый эфир и т. д. ); (низший)алкансульфонил(низшие)алкиловые эфиры (например, мезилметиловый эфир, 2-мезилэтиловый эфир и т.д.); (низшая) алкоксикарбонилокси(низшие)алкиловые эфиры (например, метоксикарбонилоксиметиловый эфир, этоксикарбонилоксиметиловый эфир, пропоксикарбонилоксиметиловый эфир, трет-бутоксикарбонилоксиметиловый эфир, 1-(или 2-)метоксикарбонилоксиэтиловый эфир, 1-(или 2-)этоксикарбонилоксиэтиловый эфир, 1-(или 2-)-2- изопропоксикарбонилоксиэтиловый эфир и т.д.); фталидилиден (низший)алкиловый сложный эфир; (5-низший алкил-2-оксо-1,3- диoкcoл-4-ил)(низший)алкиловый сложный эфир [например, (5-метил-2-оксо-1,3-диоксол-4-ил)метиловый эфир, (5-этил-2-оксо- 1,3-диоксол-4-ил)метиловый эфир, (5-пропил-2-оксо-1,3-диоксол-4- ил)этиловый эфир и т.д.]; моно(ди- или три-) арил(низшие) алкиловые сложные эфиры, например моно(ди- или три-)фенил(низшие)- алкиловые сложные эфиры, которые могут иметь один или несколько приемлемых заместителей (например, бензиловый эфир, 4-метоксибензиловый эфир, 4-нитробензиловый эфир, фенэтиловый эфир, тритиловый эфир, бензгидриловый эфир, бис (метоксифенил) метиловый эфир, 3,4-диметоксибензиловый эфир, 4-гидрокси-3,5-ди-трет- бутилбензиловый эфир и т.д.); ариловые сложные эфиры, которые могут иметь один или несколько заместителей, например замещенные или незамещенные фениловые сложные эфиры (например, фениловый эфир, толиловый эфир, трет-бутилфениловый эфир, ксилиловый эфир, мезитиловый эфир, кумениловый эфир, 4-хлорфениловый эфир, 4-метоксифениловый эфир и т.д.); три(низший)алкилсилиловый сложный эфир; низший алкилтио (сложный) эфир (например, метилтиоэфир, этилтиоэфир и т.д.) и т.п.
Приемлемые "гидрокси-защитные группы" в терминах "защищенная гидроксигруппа", "защищенная гидрокси(низшая)алкокси-группа" и "защищенная гидрокси(низший)алкил" могут включать обычные защитные группы и т.п.
Приемлемые "обычные защитные группы" могут включать ацил, упоминаемый выше, моно(ди- или три-)фенил(низший)алкил, который может иметь один или несколько приемлемых заместителей (например, бензил, 4-метоксибензил, тритил и т.д.), тризамещенный силил, например три(низший)алкилсилил (например, триметилсилил, трет- бутилдиметилсилил и т.д.) и т.д., тетрагидропиранил и т.п.
Приемлемые "гетероциклическая группа" и "гетероциклический фрагмент" в термине "гетероцикл(низший)алкил" могут быть указаны на примере вышеперечисленных гетероциклов.
Приемлемый "заместитель" в определении "гетероциклическая группа, которая может иметь приемлемый заместитель(и)", может включать низший алкил, примеры которого приведены выше, низшую алкоксигруппу, примеры которой приведены выше, низший алкенил, примеры которого приведены выше, низший алкинил, примеры которого приведены выше, моно(ди- или три-) галоген(низший)алкил, для которого примеры галогена и низшего алкильного фрагмента приведены выше, цикло(низший)алкил, примеры которого приведены выше, цикло(низший)алкенил, примеры которого приведены выше, галоген, примеры которого приведены выше, карбоксигруппа, защищенная карбоксигруппа, примеры которой приведены выше, гидроксигруппа, защищенная гидроксигруппа, примеры которой приведены выше, арил, примеры которого приведены выше, ар(низший)алкил, для которого примеры арильного фрагмента и низшего алкильного фрагмента приведены выше, карбокси(низший)алкил, для которого примеры низшего алкильного фрагмента приведены выше, защищенный карбокси (низший)алкил, для которого примеры защищенного карбоксифрагмента и низшего алкильного фрагмента приведены выше, нитрогруппа, аминогруппа, защищенная аминогруппа, примеры которой приведены выше, ди(низший)алкиламиногруппа, для которой примеры низшего алкильного фрагмента приведены выше, амино(низший)алкил, для которого примеры низшего алкильного фрагмента приведены выше, защищенный амино(низший)алкил, для которого примеры защищенного аминофрагмента и низшего алкильного фрагмента приведены выше, гидрокси(низший)алкил, для которого примеры низшего алкильного фрагмента приведены выше, защищенный гидрокси(низший)алкил, для которого примеры защищенного гидроксифрагмента и низшего алкильного фрагмента приведены выше, ацил, примеры которого приведены выше, цианогруппа, сульфогруппа, оксогруппа, карбамоилгруппа, меркаптогруппа, низшая алкилтиогруппа, для которой примеры низшего алкильного фрагмента приведены выше, иминогруппа, гидроксиимино(низший)алкил, для которого примеры низшего алкильного фрагмента приведены выше, (низшая)алкоксиимино (низший)алкил, для которого примеры низшего алкоксифрагмента и низшего алкильного фрагмента приведены выше, ди(низшая) алкиламино(низший)алкил, для которого примеры низшего алкильного фрагмента приведены выше, карбокси(низший)алкенил, для которого примеры низшего алкенила приведены выше, защищенный карбокси (низший)алкенил, для которого примеры защищенного карбоксифрагмента и низшего алкенильного фрагмента приведены выше, и т.п.
Приемлемый заместитель в выражении "арил, который может иметь один приемлемый заместитель", может включать низший алкил, примеры которого приведены выше, низшую алкоксигруппу, примеры которой приведены выше, низший алкенил, примеры которого приведены выше, низший алкинил, примеры которого приведены выше, моно(ди- или три-) галоген(низший)алкил, для которого примеры галогена и низшего алкильного фрагмента приведены выше, цикло(низший)алкил, примеры которого приведены выше, цикло(низший)алкенил, примеры которого приведены выше, галоген, примеры которого приведены выше, карбоксигруппу, защищенную карбоксигруппу, примеры которой приведены выше, гидроксигруппу, защищенную гидроксигруппу, примеры которой приведены выше, арил, примеры которого приведены выше, ар (низший)алкил, для которого примеры арильного фрагмента и низшего алкильного фрагмента приведены выше, карбокси(низший)алкил, для которого примеры низшего алкильного фрагмента приведены выше, защищенный карбокси(низший)алкил, для которого примеры защищенного карбоксифрагмента и низшего алкильного фрагмента приведены выше, нитрогруппу, аминогруппу, защищенную аминогруппу, примеры которой приведены выше, ди(низший)алкиламиногруппу, для которой примеры низшего алкильного фрагмента приведены выше, амино(низший)алкил, для которого примеры низшего алкильного фрагмента приведены выше, защищенный амино(низший)алкил, для которого примеры защищенного аминофрагмента и низшего алкильного фрагмента приведены выше, гидрокси(низший)алкил, для которого примеры низшего алкильного фрагмента приведены выше, защищенный гидрокси(низший)алкил, для которого примеры защищенного гидроксифрагмента и низшего алкильного фрагмента приведены выше, ацил, примеры которого приведены выше, цианогруппу, сульфогруппу, оксогруппу, карбамоилоксигруппу, меркаптогруппу, низшую алкилтиогруппу, для которой примеры низшего алкильного фрагмента приведены выше, иминогруппу и т.п.
Приемлемый "заместитель" в выражении "гетероцикл(низший)- алкил, который может иметь приемлемый заместитель(и)", может включать низший алкил, примеры которого приведены выше, низшую алкоксигруппу, примеры которой приведены выше, низший алкенил, примеры которого приведены выше, низший алкинил, примеры которого приведены выше, моно(ди- или три-) галоген(низший)алкил, для которого примеры галогена и низшего алкильного фрагмента приведены выше, цикло(низший)алкил, примеры которого приведены выше, цикло (низший)алкенил, примеры которого приведены выше, галоген, примеры которого приведены выше, карбоксигруппу, защищенную карбоксигруппу, примеры которой приведены выше, гидроксигруппу, защищенную гидроксигруппу, примеры которой приведены выше, арил, примеры которого приведены выше, ар(низший) алкил, для которого примеры арильного фрагмента и низшего алкильного фрагмента приведены выше, карбокси(низший)алкил, для которого примеры низшего алкильного фрагмента приведены выше, защищенный карбокси(низший)алкил, для которого примеры защищенного карбоксифрагмента и низшего алкильного фрагмента приведены выше, нитрогруппу, аминогруппу, защищенную аминогруппу, примеры которой приведены выше, ди(низший)алкиламиногруппу, для которой примеры низшей алкильной группы приведены выше, амино (низший)алкил, для которого примеры низшего алкильного фрагмента приведены выше, защищенный амино(низший)алкил, для которого примеры защищенного аминофрагмента и низшего алкильного фрагмента приведены выше, гидрокси(низший)алкил, для которого примеры низшего алкильного фрагмента приведены выше, защищенный гидрокси (низший)алкил, для которого примеры защищенного гидроксифрагмента и низшего алкильного фрагмента приведены выше, ацил, примеры которого приведены выше, цианогруппу, сульфогруппу, оксогруппу, карбамоилоксигруппу, меркаптогруппу, низшую алкилтиогруппу, для которой примеры низшего алкильного фрагмента приведены выше, иминогруппу и т.п.
Приемлемая "амидированная карбоксигруппа" может включать карбамоил, который может иметь один или два приемлемых заместителя и т.п.
Приемлемый "заместитель" в выражении "карбамоил, который может иметь один или два приемлемых заместителя", может включать низший алкил, примеры которого приведены выше, низшую алкоксигруппу, примеры которой приведены выше, низшую алкилтиогруппу, для которой примеры низшего алкильного фрагмента приведены выше, низшую алкиламиногруппу, для которой примеры низшего алкильного фрагмента приведены выше, цикло(низший)алкил, примеры которого приведены выше, цикло(низший)алкенил, примеры которого приведены выше, галоген, примеры которого приведены выше, аминогруппу, защищенную аминогруппу, примеры которой приведены выше, гидроксигруппу, защищенную гидроксигруппу, примеры которой приведены выше, цианогруппу, нитрогруппу, карбоксигруппу, защищенную карбоксигруппу, примеры которой приведены выше, сульфогруппу, сульфамоил, иминогруппу, оксогруппу, амино(низший) алкил, для которого примеры низшего алкильного фрагмента приведены выше, карбамоилоксигруппу, гидрокси(низший)алкил, для которого примеры низшего алкильного фрагмента приведены выше, диамино (низший)алкилиден(например, диаминометилен и т.д.), ди(низший) алкиламиногруппу, для которой примеры низшего алкильного фрагмента приведены выше, ди(низшая)алкиламино(низший)алкил, для которого примеры низшего алкильного фрагмента приведены выше, гетероцикл (низший)алкил, для которого примеры низшего алкильного фрагмента и гетероциклического фрагмента приведены выше, и т.п.
Рекомендуемые воплощения целевых соединений формулы (I) включают следующие соединения, в которых:
Y - группа N или C - R1 (в которых R1 представляет водород, (низший)алкил, гидроксигруппу, (низшую)алкоксигруппу, гидрокси(низший)алкил, ациламино(низший)алкил (более предпочтительно (низшая) алканоиламино(низший)алкил), карбокси(низшую)алкоксигруппу, гидрокси(низшую)алкоксигруппу, фенил, пиперидил или пирролил);
R2 представляет водород, нафтил, фенил, который может иметь один приемлемый заместитель (более предпочтительно заместитель, выбранный из группы, включающей: тригалоген(низший)алкил, цианогруппу, (низший)алкил, галоген, нитрогруппу и защищенную аминогруппу (наиболее предпочтительно тригалоген(низший)алкилсульфониламиногруппу), фенилоксигруппу, тригалоген(низший)алкил, ароил (более предпочтительно бензоил), пирролил, тетразолил, пиразолил, тиенил, фурил, тиазолил, пиридил или пиримидинил, каждый из которых может иметь от одного до трех приемлемых заместителей (более предпочтительно заместитель, выбранный из группы, включающей: карбоксигруппу, защищенную карбоксигруппу (более предпочтительно этерифицированную карбоксигруппу, наиболее предпочтительно дифенил(низшая)алкоксикарбонил), ацил (более предпочтительно низший алканоил или карбамоил), низший алкил, галоген, гидроксиимино(низший)алкил, ди(низшая)алкиламино(низший)алкил, цианогруппу, аминогруппу, защищенную аминогруппу (более предпочтительно ациламиногруппу), карбокси(низший)алкенил, защищенный карбокси (низший)алкенил (более предпочтительно этерифицированный карбокси (низший)алкенил, наиболее предпочтительно(низшая)алкоксикарбонил (низший)алкенил), карбокси(низший)алкил [более предпочтительно пирролил, который может иметь от одного до трех заместителей, выбранных из группы, включающей: карбоксигруппу, (низший)алканоил, карбамоил, (низший)алкил, галоген, гидроксиимино(низший)алкил,(низшая)алкоксиимино (низший)алкил, ди(низшая)алкиламино(низший)алкил, цианогруппу, карбокси(низший)алкенил, (низшая)алкоксикарбонил(низший) алкенил и карбокси(низший)алкил (более предпочтительно пирролил, карбоксипирролил, низший алканоилпирролил, карбамоилпирролил, моно(ди-) (низший)алкилпирролил, гидроксиимино(низший)алкилпирролил, (низшая)алкоксиимино(низший)алкилпирролил, [ди(низшая)алкил- амино(низший))алкилпирролил, цианопирролил, карбокси(низший)- алкенилпирролил, (низшая)алкоксикарбонил(низший) алкенилпирролил, карбокси(низший)алкилпирролил, дигалогенпирролил, пирролил, замещенный(низшим) алкилом и цианогруппой, пирролил, замещенный ди(низшая)алкиламино(низшим) алкилом и цианогруппой, пирролил, замещенный двумя (низшими) алкилами и цианогруппой), тетразолил, пиразолил, возможно замещенный аминогруппой, тиснил, возможно замещенный цианогруппой, фурил, возможно замещенный цианогруппой, тиазолил, пиридил или пиримидинил] или пирролил(низший)алкил;
R3 представляет водород, низшую алкоксигруппу, гидроксигруппу, или пирролил, или
R2 и R3 соединены друг с другом с образованием двухвалентного радикала формулы: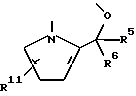
в которой R5 - водород или низший алкил, R6 - водород или низший алкил и R11 - водород или цианогруппа;
Z - группа N или C - R4 (в которой R4 представляет водород, галоген, гидрокси(низший)алкил, цианогруппу, пирролил, тетразолил, карбамоил, который может иметь один заместитель, выбранный из группы, включающей: диамино(низший)алкилиден, ди(низшая) алкиламино(низший)алкил и гетероцикл(низший)алкил (более предпочтительно морфолинил(низший)алкил, более предпочтительно диамино(низший)алкилиденкарбамоил, ди(низшая)алкиламино (низший)алкилкарбамоил или морфолинил(низший)алкилкарбамоил); и
W - группа N или C - R12, в которой R12 представляет водород;
Более предпочтительны варианты целевых соединений формулы (I), представленные следующими общими формулами (A) - (C):
в которой R2 представляет водород, нафтил, фенил, который может иметь один приемлемый заместитель (более предпочтительно заместитель, выбранный из группы, включающей тригалоген(низший)алкил, цианогруппу, низший алкил, галоген, нитрогруппу и защищенную аминогруппу (наиболее предпочтительно тригалоген(низший)алкилсульфониламиногруппу) [более предпочтительно фенил, тригалоген(низший)алкилфенил, цианофенил, (низший) алкилфенил, галогенфенил, нитрофенил, тригалоген(низший) алкилсульфониламинофенил или нафтил], фенилоксигруппу, тригалоген (низший)алкил, ароил (более предпочтительно бензоил), пирролил, тетразолил, пиразолил, тиенил, фурил, тиазолил, пиридил или пиримидинил, каждый из которых может иметь 1-3 приемлемых заместителей (более предпочтительно заместитель, выбранный из группы, включающей: карбоксигруппу, ацил (более предпочтительно низший алканиол или карбамоил) (низший)алкил, галоген, гидроксиимино(низший)алкил, ди(низшая) алкиламино(низший)алкил, цианогруппу, аминогруппу, карбокси(низший)алкенил, защищенный карбокси(низший)алкенил (более предпочтительно этерифицированный карбокси(низший)алкенил, наиболее предпочтительно(низшая) алкоксикарбонил(низший)алкенил) карбокси(низший)алкил (более предпочтительно пирролил, который может иметь 1-3 заместителя, выбранные из группы, включающей: карбоксигруппу, (низший)алканоил, карбамоил, (низший)алкил, галоген, гидроксиимино(низший)алкил, (низшая)алкоксиимино(низший)алкил, ди(низшая)алкиламино(низший)алкил, цианогруппу, карбокси (низший)алкенил, (низшая)алкоксикарбонил(низший)алкенил и карбокси(низший)алкил (более предпочтительно пирролил, карбоксипирролил, (низший)алканоилпирролил, карбамоилпирролил, моно(или ди-) (низший)алкилпирролил, гидроксиимино(низший)алкилпирролил, (низшая)алкоксиимино(низший)алкилпирролил, [ди(низшая)алкиламино(низший)] алкилпирролил, цианопирролил, карбокси(низший)алкенилпирролил, (низшая) алкоксикарбонил(низший)алкенилпирролил, карбокси(низший) алкилпирролил, дигалогенпирролил, пирролил, замещенный(низшим) алкилом и цианогруппой, пирролил, замещенный ди(низшая)алкиламино(низшим) алкилом и цианогруппой, пирролил, замещенный двумя (низшими) алкилами и цианогруппой), тетразолил, пиразолил, возможно замещенный аминогруппой, тиенил, возможно замещенный цианогруппой, фурил, возможно замещенный цианогруппой, тиазолил, пиридил или пиримидинил] или пирролил (низший)алкил, и
R4 представляет водород, галоген, гидрокси(низший)алкил, цианогруппу; пирролил, тетразолил, карбамоил, который может иметь один заместитель выбранный из группы, включающей: диамино(низший)алкилиден, ди(низшая)алкиламино(низший) алкил и гетероцикл(низший)алкил (более предпочтительно морфолинил (низший)алкил) [более предпочтительно диамино(низший)алкилиденкарбамоил, ди(низшая)алкиламино (низший)алкилкарбамоил, морфолинил(низший)алкилкарбамоил];
в которой R1 представляет водород, (низший)алкил, гидроксигруппу, (низшую)алкоксигруппу, гидрокси(низший)алкил, ациламино(низший)алкил (более предпочтительно(низшая) алканоиламино(низший)алкил), карбокси(низшую) алкоксигруппу, гидрокси(низшую) алкоксигруппу, фенил, пиперидил или пирролил;
R2 представляет водород, нафтил, фенил, который может иметь один приемлемый заместитель (более предпочтительно заместитель, выбранный из группы, включающей: тригалоген(низший)алкил, цианогруппу, (низший)алкил, галоген, нитрогруппу и защищенную аминогруппу (наиболее предпочтительно тригалоген(низший) алкилсульфониламиногруппу) [более предпочтительно фенил, тригалоген(низший)алкилфенил, цианофенил, (низший) алкилфенил, галогенфенил, нитрофенил, тригалоген(низший) алкилсульфониламинофенил или нафтил], фенилоксигруппу, тригалоген-(низший)алкил, ароил, (более предпочтительно бензоипирролил, тетразолил, пиразолил, тиенил, фурил, тиазолил, пиридил или пиримидинил, каждый из которых может иметь 1-3 приемлемых заместителей (более предпочтительно заместитель, выбранный из группы, включающей: карбоксигруппу, ацил (более предпочтительно алканоил или карбамоил), (низший) алкил, галоген, гидроксиимино(низший)алкил, ди(низшая)алкиламино(низший)алкил, цианогруппу, аминогруппу, карбокси(низший)алкенил, защищенный карбокси(низший)алкенил (более предпочтительно этерифицированный карбокси(низший)алкенил, наиболее предпочтительно(низшая)алкоксикарбонил(низший) алкенил), карбокси(низший)алкил [более предпочтительно пирролил, который может иметь 1-3 заместителя, выбранные из группы, включающей: карбоксигруппу, (низший)алканоил, карбамоил, (низший)алкил, галоген, гидроксиимино(низший)алкил, (низшая)алкоксиимино(низший)алкил, ди(низшая)алкиламино(низший)алкил, цианогруппу, карбокси(низший) алкенил, (низшая)алкоксикарбонил(низший)алкенил и карбокси (низший)алкил (более предпочтительно пирролил, карбоксипирролил, (низший)алканоилпирролил, карбамоилпирролил, моно(или ди-)- (низший)алкилпирролил, гидроксиимино(низший)алкилпирролил, (низшая)алкоксиимино(низший)алкилпирролил, [ди(низшая) алкиламино(низший)алкилпирролил, цианопирролил, карбокси(низший) алкенилпирролил, (низшая)алкоксикарбонил(низший)алкенилпирролил, карбокси(низший)алкилпирролил, дигалогенпирролил, пирролил, замещенный (низшим)алкилом и цианогруппой, пирролил, замещенный ди(низший)алкиламино(низшим) алкилом и цианогруппой, пирролил, замещенный двумя (низшими) алкилами и цианогруппой), тетразолил, пиразолил, возможно замещенный аминогруппой, тиенил, возможно замещенный цианогруппой, фурил, возможно замещенный цианогруппой, тиазолил, пиридил или пиримидинил] или пирролил(низший)алкил; и
в которой R5 - водород или низший алкил, R6 - водород или низший алкил, и R11 - водород или цианогруппа.
Способы получения целевых и исходных соединений настоящего изобретения подробно разъясняются ниже.
Способ (1)
Соединение формулы (I) или его соль могут быть получены реакцией соединения формулы (II) или его реакционноспособного производного по карбоксигруппе, или его соли с соединением формулы (III) или его реакционноспособным производным по иминогруппе, или его солью.
Приемлемое реакционноспособное производное по иминогруппе соединения формулы (III) может включать силильное производное, образованное реакцией соединения формулы (III) с сильным производным, например бис(триметилсилил)ацетамидом, моно(триметилсилил)ацетамидом (например, N-(триметилсилил)ацетамидом), бис(триметилсилил(мочевиной и т.п., производное, образованное реакцией соединения формулы (III) с треххлористым фосфором или фосгеном и т.п.
Приемлемые реакционноспособные производные по карбоксигруппе соединения формулы (II) могут включать обычные производные, например галогенангидриды кислот, ангидриды кислот, активированные амиды, активированные эфиры и т.п.
Приемлемые примеры реакционноспособных производных могут включать хлорангидрид кислоты, азид кислоты, смешанный ангидрид с такой кислотой, как замещенная фосфорная кислота (например, диалкилфосфорная кислота, фенилфосфорная кислота, дифенилфосфорная кислота, дибензилфосфорная кислота, галогенированная фосфорная кислота и т.д.), диалкилфосфористая кислота, сернистая кислота, тиосерная кислота, серная кислота, сульфокислота (например, метансульфоновая кислота и т.д.), алифатическая карбоновая кислота (например, уксусная кислота, пропионовая кислота, масляная кислота, изомасляная кислота, пивалевая кислота, валериановая кислота, изовалериановая кислота, 2-этилмасляная кислота, трихлоруксусная кислота и т.д.) или ароматическая карбоновая кислота (например, бензойная кислота и т.д.), симметричный ангидрид кислоты, амид, активированный имидазолом, 1-гидрокси-1Н-бензотриазолом, 4-замещенным имидазолом, диметилпиразолом, триазолом или тетразолом, или активированный сложный эфир (например, цианометиловый эфир, метиловый эфир, этиловый эфир, метоксиметиловый эфир, диметилиминометиловый эфир), [(CH3)2-N+=CH-] эфир, виниловый эфир, пропаргиловый эфир, п-нитрофениловый эфир, 2,4-динитрофениловый эфир, трихлорфениловый эфир, пентахлорфениловый эфир, мезилфениловый эфир, фенилазофениловый эфир, фениловый тиоэфир, п-нитрофениловый тиоэфир, п-крезиловый тиоэфир, бензотиазолиловый тиоэфир, карбоксиметиловый тиоэфир, пираниловый эфир, пиридиловый эфир, пиперидиловый эфир, 8-хинолиловый тиоэфир и т.д.) или сложный эфир с N-гидроксипроизводным (например, N,N-диметилгидроксиамином, 1-гидрокси-2(1H)-пиридоном, N-гидроксисукцинимидом, N-гидроксифтальимидом, 1-гидрокси-1H-бензотриазолом и т.д.) и т.п. Указанные реакционноспособные производные могут быть выбраны в зависимости от типа соединения формулы (II), намеченного к использованию.
Реакцию обычно проводят в обычном растворителе, например воде, спирте (например, метаноле, этаноле и т. д. ), ацетоне, диоксане, ацетонитриле, хлороформе, хлористом метилене, хлористом этилене, тетрагидрофуране, этилацетате, N, N-диметилформамиде, пиридине или любом органическом растворителе, не оказывающем неблагоприятного воздействия на ход реакции. Перечисленные обычные растворители могут также применяться в смеси с водой.
В данной реакции, если соединение формулы (II) применяют в виде свободной кислоты или ее соли, реакцию рекомендуют проводить в присутствии обычного конденсирующего средства, например N,N-дициклогексилкарбодиимида, N-циклогексил-N'- морфолиноэтилкарбодиимида, N-циклогексил-N'-(4-диэтиламиноциклогексил)карбодиимида, N, N'-диэтилкарбодиимида, - -диизопропилкарбодиимида, N-этил-N'- -(3-диэтиламинопропил)карбодиимида, N-N'-карбонилбис(2-метилимидазола), пентаметиленкетен-циклогексилимина, дифенилкетен-N-циклогексилимина, этоксиацетилена, 1-алкокси-1-хлорэтилена, триалкилфосфита, этилполифосфата, изопропилполифосфата, хлорокиси фосфора (фосфорилхлорида), треххлористого фосфора, тионилхлорида, оксалилхлорида, (низший)алкилгалогенформата [например, этилхлорформата, изопропилхлорформата и т.д.], трифенилфосфина, соли 2-этил-7-гидроксибензизоксазолия, внутримолекулярной соли гидроксида 2-этил-5-(м-сульфофенил)изоксазоля, комплекса N-(низший)алкилгалогенпиридинийгалогенида (например, 1-метил-2-хлорпиридинийиодида и т.д.) с три(низший)алкиламином (например, триэтиламином и т.д.), 1-(п-хлорбензолсульфонилокси)-6-хлор-1Н-бензотриазола, так называемого реактива Вильсмайера, полученного реакцией N,N-диметилформамида c тионилхлоридом, фосгеном, трихлорметилхлорформатом, хлорокисью фосфора и т.д., или аналогичными конденсирующими средствами.
Реакция может быть также проведена в присутствии неорганического или органического основания, например, бикарбоната щелочного металла, три(низший)алкиламина (например, триэтиламина и т. д. ), пиридина, N-(низший)алкилморфолина, N-N-ди(низший)алкилбензиламина, низшего алкоксида щелочного металла (например, метоксида натрия и т.д.) и т.п.
Температура реакции решающей роли не играет, и обычно реакцию проводят в условиях от охлаждения до нагревания.
Способ (A).
Соединение формулы (IIa) или его соль могут быть получены реакцией соединения формулы (IV) или его соли с соединением формулы (V) или его солью.
Указанную реакцию обычно проводят в растворителе, например воде, спирте (например, метаноле, этаноле и т.д.), бензоле, N,N-диметилформамиде, тетрагидрофуране, толуоле, хлористом метилене, хлористом этилене, хлороформе, диоксане, диэтиловом эфире или любом другом растворителе, не оказывающем на реакцию неблагоприятного воздействия. Эти обычные растворители могут также применяться в смеси с водой.
Температура реакции решающей роли не играет, и реакцию обычно проводят в условиях от слабого до сильного нагревания.
Реакцию обычно проводят в присутствии кислоты, в том числе кислоты Льюиса.
Приемлемые кислоты могут включать органические кислоты (например, муравьиную кислоту, уксусную кислоту, пропионовую кислоту, трихлоруксусную кислоту, трифторуксусную кислоту и т.д.) и неорганические кислоты (например, хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, хлористый водород, бромистый водород, галогенид цинка (например, хлорид цинка, бромид цинка и т.д.) и т.д.) и т.п.
Если кислота и/или исходное соединение находятся в жидком состоянии, их можно использовать также и в качестве растворителя.
Способ (B) 
Соединение формулы (IIc) или его соль могут быть получены обработкой соединения формулы (IIb) или его соли в условиях реакции элиминирования карбокси-защитной группы.
Данная реакция может быть осуществлена по методике, приведенной в препаративном примере 56, или аналогичным способом.
Способ (B) 
Соединение формулы (IId) или его соль могут быть получены восстановлением соединения формулы (IIс) или его соли.
Данная реакция может быть осуществлена по методике, приведенной в препаративном примере 52, или аналогичным способом.
Способ (C)
Соединение формулы (IIe) или его соль могут быть получены реакцией соединения (IIa) или его соли с соединением формулы (IV) или его солью.
Реакция может быть проведена по методике, приведенной в препаративных примерах 37 и 38, или аналогичным способом.
Способ (D)
Соединение формулы (II) или его соль могут быть получены обработкой соединения формулы (IIf) или его соли в условиях реакции элиминирования карбокси-защитной группы.
Данная реакция может быть проведена по методике, приведенной в препаративном примере 45, или аналогичным способом.
Способ (E)
Соединение формулы (IIh) или его соль могут быть получены реакцией соединения формулы (IIg) или его соли с соединением формулы (VII) или его солью.
Реакция может быть проведена по методике, приведенной в препаративных примерах 32 и 34, или аналогичным способом.
Способ (F) 
Соединение формулы (IIr) или его соль могут быть получены реакцией соединения формулы (VIII) или его соли с соединением формулы (IX) или его солью.
Реакция может быть проведена по методике, приведенной в препаративном примере 26, или аналогичным способом.
Способ (F) 
Соединение формулы (IIi) или его соль могут быть получены обработкой соединения формулы (IIr) или его соли в условиях реакции цианогенирования.
Реакция может быть проведена по методике, приведенной в препаративном примере 28, или аналогичным способом.
Способ (G)
Соединение формулы (IIj) или его соль могут быть получены обработкой соединения формулы (IIc) или его реакционноспособного производного по карбоксигруппе, или его соли в условиях реакции амидирования.
Приемлемым амидирующим реактивом, предназначенным для использования в данной реакции амидирования, является соединение формулы
H-R15
где R15 принимает вышеуказанные значения, или его реакционноспособное производное, или его соль и т.п.
Приемлемое реакционноспособное производное соединения формулы (X) может включать основание Шиффа типа иминогруппы или ее таутомерный изомер типа енамина, образованные реакцией соединения формулы (X) с карбонильным соединением, например альдегидом, кетоном и т.п.; силильное производное, например бис(триметилсилил)ацетамид, моно(триметилсилил)ацетамид/(например, N-(триметилсилил)ацетамид/, бис(триметилсилил)мочевина и т.п.; производное, образованное реакцией соединения формулы (X) с треххлористым фосфором, фосгеном и т.п.
Приемлемое реакционноспособное производное по карбокси-группе соединения формулы (IIc) может включать галогенангидрид кислоты, ангидрид кислоты, активированный амид, активированный сложный эфир и т.п. Примеры приемлемых реакционноспособных производных могут включать хлорангидрид кислоты, азид кислоты, смешанный ангидрид кислоты с такой кислотой, как замещенная фосфорная кислота (например, диалкилфосфорной кислотой, фенилфосфорной кислотой, дифенилфосфорной кислотой, дибензилфосфорной кислотой, галогенированной фосфорной кислотой и т.д.), диалкилфосфористой кислотой, сернистой кислотой, тиосерной кислотой, серной кислотой, сульфоновой кислотой (например, метансульфоновой кислотой и т.д.), алифатической карбоновой кислотой (например, уксусной кислотой, пропионовой кислотой, масляной кислотой, изомасляной кислотой, пивалевой кислотой, валериановой кислотой, изовалериановой кислотой, 2-этилмасляной кислотой, трихлоруксусной кислотой и т.д.) или ароматической карбоновой кислотой (например, бензойной кислотой и т.д.), симметричный ангидрид, активированный амид с имидазолом, 4-замещенным имидазолом, диметилпиразолом, триазолом или тетразолом, или активированный сложный эфир (например, цианометиловый эфир, метоксиметиловый эфир, диметилиминометиловый эфир [(CH3)2N+=CH-] эфир, виниловый эфир, этиловый эфир, пропаргиловый эфир, п-нитрофениловый эфир, 2,4-динитрофениловый эфир, трихлорфениловый эфир, пентахлорфениловый эфир, мезилфениловый эфир, фенилазофениловый эфир, фениловый тиоэфир, п-нитрофениловый тиоэфир, п-крезиловый тиоэфир, карбоксиметиловый тиоэфир, пираниловый эфир, пиридиловый эфир, пиперидиловый эфир, 8-хинолиловый тиоэфир и т. д. ) или сложный эфир с N-гидроксипроизводным (например, N,N-диметилгидроксиламинон, 1-гидрокси-2(1Н)-пиридоном, N-гидроксисукцинимидом, N-гидроксифтальимидом, 1-гидрокси-1H-бензотриазолом и т.д.) и т.п. Указанные реакционноспособные производные возможно могут быть подобраны с учетом типа намеченного к применению соединения формулы (IIc).
Реакцию, как правило, проводят в обычном растворителе, например воде, спирте (например, метаноле, этаноле и т.д.), ацетоне, диоксане, ацетонитриле, хлороформе, хлористом метилене, хлористом этилене, тетрагидрофуране, толуола, этилацетате, N,N-диметилформамиде, пиридине или любом другом органическом растворителе, не оказывающем неблагоприятного воздействия на ход реакции. Такие обычные растворители могут также применяться в смеси с водой. Если основание и/или исходное соединение находится в жидком состоянии, они также могут быть использованы и в качестве растворителя.
В данной реакции, если соединение формулы (II) применяют в виде свободной кислоты или ее соли, реакцию рекомендуют проводить в присутствии обычного конденсирующего средства, например N,N'-дициклогексилкарбодиимида, N-циклогексил-N'- морфолиноэтилкарбодиимида, N-циклогексил-N'-(4-диэтиламиноциклогексил)карбодиимида, N, N'-диэтилкарбодиимида, N,N'-диизопропилкарбодиимида, N-этил-N'-(3-диметиламинопропил)карбодиимида, N,N'-карбонилбис(2-метилимидазола), пентаметиленкетен-N-циклогексилимина, дифенилкетен-N-циклогексилимида, этоксиацетилена, 1-алкокси-1-хлорэтилена, триалкилфосфита, этилполифосфата, изопропилполифосфата, хлорокиси фосфора (фосфорилхлорида), треххлористого фосфора, тионилхлорида, оксалилхлорида, (низший)алкилгалогенформата (например, этилхлорформата, изопропилхлорформата и т.д.), трифенилфосфина, соли 2-этил-7-гидроксибензизоксазолия, внутримолекулярной соли гидроксида 2-этил-5-(м-сульфофенил)изоксазолия, 1-(п-хлорбензолсульфонилокси)-6-хлор-1Н-бензотриазола, так называемого реактива Вильсмайера, получаемого реакцией N, N-диметилформамида с тионилхлоридом, фосгеном, трихлорметилхлорформатом, хлорокисью фосфора и т.д., и т.п.
Реакция может быть также проведена в присутствии неорганического или органического основания, например бикарбоната щелочного металла, три (низший) алкиламина, пиридина, -N-(низший )алкилморфолина, N,N-ди(низший)алкилбензиламина и т.п.
Температура реакции решающей роли не играет, и реакцию обычно проводят в условиях от охлаждения до нагревания.
Способ (H) 
Соединение формулы (IIb) или его соль могут быть получены обработкой соединения формулы (IIk) или его соли в условиях реакции формилирования.
Реакция может быть проведена по методике, приведенной в препаративном примере 118, или аналогичным способом.
Способ (Н) 
Соединение формулы (IIm) или его соль могут быть получены восстановлением соединения формулы (IIb) или его соли.
Восстановление может быть осуществлено по методике, приведенной в препаративном примере 119, или аналогичным способом.
Способ (I)
Соединение формулы (IIo) или его соль могут быть получены циклизацией соединения формулы (IIn) или его соли.
Циклизация может быть проведена по методике, приведенной в препаративном примере 120, или аналогичным способом.
Способ (J)
Соединение (IIq) или его соль могут быть получены обработкой соединения формулы (IIp) или его соли в условиях реакции цианогенирования.
Реакция может быть проведена по методикам, приведенным в препаративных примерах 37 и 38, или аналогичными способами.
Что касается приемлемых солей целевых и исходных соединений и их реакционноспособных производных в способах (I) и (A)-(J), то в качестве примеров можно указать на соли, указанные для соединений формулы (I).
Новые производные гуанидина формулы (I) и их фармацевтически приемлемые соли настоящего изобретения обладают сильной ингибирующей активностью, направленной на Na+/H+ - обмен в клетках, вследствие чего применимы в качестве ингибиторов клеточного Na+/H+-обмена.
Соответственно, новые производные гуанидина формулы (I) и их фармацевтически приемлемые соли могут быть использованы для лечения и/или профилактики сердечно-сосудистых заболеваний (например, гипертензии, стенокардии, инфаркта миокарда, сердечной недостаточности (например, застойной сердечной недостаточности, острой сердечной недостаточности, гипертрофии сердца и т.д. ), аритмии (например, ишемической аритмии, аритмии вследствие инфаркта миокарда, аритмии после РТСА или после тромболиза и т.д.), рестеноза после РТСА и т. д. ), заболеваний сосудов мозга (например, приступа ишемии, приступов кровотечения и т.д.), почечных заболеваний (например, диабетической нефропатии, ишемической острой почечной недостаточности и т.д.), артериосклероза, шока (например, связанного с кровотечением шока, вызванного эндотоксинами шока и т. д. ) и т.п., и могут быть также использованы в качестве средства защиты миокарда, защиты органов при трансплантации органов, при операциях на открытом сердце и т.п.
С целью показать применимость производных гуанидина формулы (X) и их фармацевтически приемлемых солей настоящего изобретения ниже приведены данные фармакологических испытаний представительного производного гуанидина формулы (I) в качестве испытуемого соединения, иллюстрируемые следующим.
/I/ Испытуемое соединение
(а) 2-/3-Метилсульфонил-5-(пиррол-1-ил)бензоил/гуанидин
/2/ Ингибирующая активность, направленная на клеточный Na+/H+-обмен
/i/ Метод испытания
Используемая методика аналогична методике, приведенной в работе: Enzymology 173, 777 (1989).
Клеточный препарат. Одного самца линии SD весом 250-300 г забивают ударом по голове. Затем удаленный тимус переносят в охлаждаемую льдом среду с NaCl (140 мМ хлорида натрия, 1 мМ хлорида калия, 1 мМ хлорида кальция, 1 мМ хлорида магния, 10 мМ глюкозы и 20 мМ N-2-гидроксиэтилпиперазин-N'-2-этансульфоновой кислоты (ГЭПЭС), pH 7,3), нарезают небольшими кусочками и переносят в стеклянный гомогенизатор. Клетки разделяют осторожными ударами и образовавшуюся суспензию фильтруют через шесть слоев хирургической марли, и фильтрат центрифугируют 5 минут при 4oC и 1000g. Осадок вновь суспендируют в RPMI 1640 среде (pH 7,3) при комнатной температуре с установлением конечной концентрации клеток 1 • 107 клеток/мл.
Анализ. Данным методом выявляют набухание, сопутствующее активации вещества, способствующего Na+/H+ обмену в клетках, инкубируемых с пропионатом натрия. Пропионовая кислота быстро проникает через клеточную мембрану. Внутриклеточная диссоциация приводит к цитоплазмическому подкислению и, как следствию, к активации Na+/H+-обмена, при котором происходит обмен внеклеточного Na+ на цитоплазмический Н+. Поглощение осмотически захваченной воды проявляется в набухании клеток.
Размер клеток и их число определяют на электроприборе Каултер Каунтер-Чэннелайзер (АТ-11). Раствор тимоцитов (0,1 мл) суспендируют в 20 мл натрийпропионатной среды (140 мМ пропионата натрия, 1 мМ хлорида калия, 1 мМ хлорида кальция, 1 мМ хлорида магния, 10 мМ глюкозы, 20 мМ N-2-гидроксиэтилпиперазин- -N'-2-этансульфоновой кислоты (ГЭПЭС), pH 6.8) с добавкой испытуемого соединения, растворенного в диметилсульфоксиде (конечная концентрация диметилсульфоксида 0,1%). В течение 4 минут увеличение объема клеток, индуцируемое Na+/H+- обменом, сохраняет линейный характер, и ход набухания со временем наблюдают каждую минуту после добавления тимоцитов. Скорость набухания (объем/мин) определяют использованием 3-5 концентраций испытуемого соединения. Затем с помощью линейного графика Бурка рассчитывают величину кажущейся Ки.
/3/ Результаты испытаний
Целевые соединения формулы (I) или их фармацевтически приемлемые соли обычно вводят млекопитающим, в том числе и человеку, в виде обычной лекарственной формы, например пероральной дозированной формы (например, капсул, микрокапсул, таблеток, гранул, порошков, пастилок, сиропов, аэрозолей, ингаляций, суспензий, эмульсий и т.д.), инъектируемых дозированных форм, суппозитория, мази и т.п.
Лекарственные формы данного изобретения могут содержать разнообразные органические или неорганические носители, обычно применяемые в фармацевтических целях, например наполнители (например, сахарозу, крахмал, маннит, сорбит, лактозу, глюкозу, целлюлозу, тальк, фосфат кальция, карбонат кальция и т.д.), связующее средство (например, целлюлозу, метилцеллюлозу, гидроксипропилцеллюлозу, полипропилпирролидон, желатин, гуммиарабик, полиэтиленгликоль, сахарозу, крахмал и т.д.), структуратор (например, крахмал, карбоксиметилцеллюлозу, кальциевую соль карбоксиметилцеллюлозы, гидроксипропилкрахмал, натрийгликоль крахмал, бикарбонат натрия, фосфат кальция, цитрат кальция и т.д.), смазку (например, стеарат магния, тальк, лаурилсульфат натрия и т.д.), корригент (например, лимонную кислоту, ментол, глицин, апельсиновые порошки и т. д. ), консервант (например, бензоат натрия, бисульфит натрия, метилпарабен, пропилпарабен и т.д.), стабилизатор (например, лимонную кислоту, цитрат натрия, уксусную кислоту и т.д.), суспендирующее средство (например, метилцеллюлозу, поливинил-пирролидон, стеарат алюминия и т.д. ), диспергирующее средство, водные разбавители (например, воду и т.д.), восковые основы (например, масло какао, полиэтиленгликоль, белый вазелин и т.д.).
Активный компонент обычно вводят в единичной дозированной форме в количестве 0,01-500 мг/кг 1-4 раза в день. Однако, указанная дозировка может быть увеличена или уменьшена в зависимости от возраста, веса, состояния больного или способа введения.
Следующие препаративные примеры и примеры приведены с целью более подробной иллюстрации настоящего изобретения.
Препаративный пример 1.
К смеси концентрированной серной кислоты (53,3 мл) и конц. азотной кислоты (36 мл) в течение 10 минут при 20o-30oC по каплям прибавляют раствор 4-хлор-3-метилсульфонилбензойной кислоты (22,5 г) в конц. серной кислоте (135 мл) и смесь перемешивают 5 часов при 75-80oC. После охлаждения льдом смесь переносят в ледяную воду и образовавшийся осадок отфильтровывают с получением 4-хлор-3-метилсульфонил-5-нитробензойной кислоты (24,85 г).
Т.пл. 196oC.
ИК (ньюджол): 1690, 1535, 1320, 1140 см-1.
ЯМР (ДМСО-d6) δ : 3,52 (3H,с), 8,69 (1H, д, J=2 Гц), 8,8 (1H, д, J=2 Гц), 14,25 (1, ш.с).
Препаративный пример 2.
Смесь 4-хлор-3-метилсульфонил-5-нитробензойной кислоты (10 г) и конц. серной кислоты (5 мл) в метаноле (100 мл) кипятят 10 часов и затем испаряют в вакууме. К остатку добавляют воду и добавлением карбоната калия в смеси устанавливают pH 8. Смесь экстрагируют смесью этилацетата с тетрагидрофураном. Экстракт промывают рассолом, сушат над сульфатом магния и испаряют в вакууме. Ополаскиванием остатка диизопропиловым эфиром получают метиловый эфир 4-хлор-3-метилсульфонил-5-нитробензойной кислоты (10,23 г).
Т.пл. 168o-169o.
ИК (ньюджол): 1730, 1605, 1525, 1360, 1315, 1140 см-1.
ЯМР (ДМСО-d6) δ 3,52 (3H,с), 3,96 (3H,с), 8,68 (1H, д, J=2 Гц), 8,85 (1H, д, J = 2 Гц).
Препаративный пример 3.
По методике, аналогичной методике препаративного примера 2, получено следующее соединение: метиловый эфир 3-метилсульфонил-5-нитро-4-пиперидинбензойной кислоты.
Т.пл. 147o-150o.
ИК (ньюджол): 1720, 1600, 1525, 1360, 1140 см-1.
ЯМР (ДМСО-d6) δ: : 1,48-1,72 (6H, м), 3-3,12 (4H, м), 3,45 (3H, с), 3,92 (3H, с), 8,54 (1H, д, J=2,2 Гц), 8,64 (1H, a, J =2,2 Гц).
Препаративный пример 4.
К смеси метилового эфира 4-хлор-3-метилсульфонил-5-нитробензойной кислоты (9,5 г) и триэтиламииа (5 мл) в метаноле (150 мл) и тетрагидрофуране (100 мл) добавляют 10% палладия на угле (2,5 г) и смесь подвергают каталитическому восстановлению при комнатной температуре и атмосферном давлении. Катализатор отфильтровывают и фильтрат испаряют в вакууме. К остатку добавляют смесь этилацетата с водой и добавлением 20%-го водного раствора карбоната калия устанавливают pH 9. Отделенный органический слой промывают рассолом, сушат над сульфатом магния и испаряют в вакууме. Ополаскиванием остатка диизопропиловым эфиром получают метиловый эфир 5-амино-3-метилсульфонилбензойной кислоты (5,85 г).
Т.пл. 181-183oC.
ИК (ньюджол): 3480, 3440, 3370, 1725, 1605, 1330, 1150 см-1.
ЯМР (ДМСО-d6) δ: : 3,17 (3H, С), 3,86 (3H, с), 6,03 (2H, с), 7,28- 7,32 (1H, м), 7,43-7,48 (1H, м), 7,48-7,54 (1H, м).
Препаративный пример 5.
Смесь метилового эфира 5-амино-3-метилсульфонилбензойной кислоты (1,5 г) и 2,5-диметокситетрагидрофурана (1,3 мл) в уксусной кислоте (4,5 мл) кипятят с перемешиванием 2 часа. После охлаждения смесь переносят в водный этилацетат и добавлением 20%-го водного раствора карбоната калия устанавливают pH 8. Отделенный органический слой промывают рассолом и сушат над сульфатом магния. Растворитель удаляют концентрированием и ополаскиванием остатка диизопропиловым эфиром получают метиловый эфир 3-метилсульфонил-5-(пиррол-1-ил)бензойной кислоты (1,58 г).
Т.пл. 117-121o.
ИК (ньюджол): 1720, 1605, 1310, 1150 см-1.
ЯМР (ДМСО-d6) δ: : 3,39 (3H, с), 3,95 (3H, с), 6,37 (2H, с), 7,62 (2H, С), 8,23 (1H, С), 8,35 (2H, С).
Препаративный пример 6.
По методике, аналогичной методике препаративного примера 5, получены следующие соединения:
(1) метиловый эфир 3-метилсульфонил-4-пиперидино-5-(пиррол-1-ил)бензойной кислоты
Т.пл. 175-176oC.
ИК (ньюджол): 1720, 1605, 1340, 1145 см-1.
ЯМР (ДМСО-d6) δ: : 1,18-1,7 (6H, м), 2,3-3,1 (4H, м), 3,44 (4H, с), 3,89 (3H, с), 6,26-6,33 (2H, м), 6,95-7,02 (2H, м), 7,93 (1H, H, J = 2,2 Гц), 8,55 (1H, д, J = 2,2 Гц).
(2) Этиловый эфир 3-(пиррол-1-ил)бензойной кислоты
Т.пл. 46-48oC.
ИК (ньюджол): 1710, 1590 см-1.
ЯМР (ДМСО-d6) δ: 1,35 (3H, т, J=7,1 Гц), 4,36 (2H, к, J = 7,1 Гц), 6,26-6,37 (2H, м), 7,37-7,5 (2H, м), 7,61 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,83 (1H, д, J = 7,8 Гц), 7,87 (1H, д, 7-7,8 Гц), 8,03 (1H, с).
Элементный анализ для C13H13NO2:
Вычислено: C 72,54, H 6,09, N 6,51
Найдено: C 72,42, H 6,21, N 6,56
(3) Метиловый эфир 3-(пиррол-1-ил)бензойной кислоты
ИК (пленка); 1720, 1590 см-1.
ЯМР (ДМСО-d6) δ: : 3-91 (3H, С), 6,3-6,38 (2H, м), 7,4-7,48 (2H, м), 7,59 (1H, дд, J = 7,9 Гц), 7,9 Гц), 7,8-7,92 (2H, м), 8,05 (1H, дд, J = 1,9 Гц, 1,9 Гц).
(4) Этиловый эфир 2-(пиррол-1-ил)бензойной кислоты
ИК (ньюджол): 1710, 1600 см-1.
ЯМР (ДМСО-d6) δ: : 1,06 (3H, т, J=7,1 Га), 4,09 (2H, к, 7-7,1 Гц), 6,19-6,27 (2H, м), 6,86-6,93 (2H, м), 7,42-7,53 (2H, м), 7,64 (1H, дд, J=1,7 Гц, 7,2 Гц), 7,69-7,77 (1H, м).
(5) Метиловый эфир 3,5-ди(пиррол-1-ил)бензойной кислоты
Т.пл. 111-113oC.
ИК (ньюджол): 1720, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,92 (3H, с), 6,28-6,4 (4H, м), 7,55-7,67 (4H, м), 7,89 (2H, д, J=2,1 Гц), 8,03 (1H, дд, J=2,1 Гц, 2,1 Гц).
Элементный анализ для C16H14N2O2
Вычислено; C 72,17, H 5,30, N 10,52
Найдено: C 72,31, H 5,28, N 10,44
(6) Метиловый эфир 3-нитро-5-(пиррол-1-ил)бензойной кислоты
Т.пл. 147-148oC.
ИК (ньюджол): 1720, 1540, 1360, 1340, 1260, 740, 730 см-1.
ЯМР (ДМСО-d6) δ: : 3,96 (3H, с), 6,36-6,4 (2H, м), 7,6-7,7 (2H, м), 8,4-8,5 (2H, м), 7,6-8,65 (1H, м).
МАСС (м/z) : 246 (М+),
Элементный анализ для C12H10N2O4
Вычислено: C 58,53, H 4,09, N 11,30
Найдено; C 58,63, H 4,02, N 11,29
(7) Диметиловый эфир 5-(пиррол-1-ил)изофталевой кислоты
Т.пл. 108-109oC.
ИК (ньюджол): 3125, 1720, 1605, 1235 см-1.
ЯМР (ДМСО-d6) δ: 3,92 (6H, с), 6,32-6,35 (2H, м), 7,49-7,52 (2H, м), 8,23-8,27 (3H, м),
МАСС (m/z): 260 (М+ + 1).
Элементный анализ для C14H13NO4
Вычислено: C 64,85, H 5,05, N 5,40
Найдено: C 64,96, H 5,15, N 5,44
(8) Метиловый эфир 2-метокси-5-метилсульфонил-3-(пиррол-1-ил)бензойной кислоты
Т.пл. 97-98oC.
ИК (ньюджол): 1720, 1150, 1080, 750 см-1.
ЯМР (ДМСО-d6) δ: 3,34 (3H, с), 3,49 (3H, с), 3,91 (3H, с), 6,32 - 6,35 (2H, м), 7,15 - 7,22 (2H, м), 8,08 (1H, д, J = 2,4 Гц).
Препаративный пример 7.
К смеси метилового эфира 3-метилсульфонил-5-нитро-4-пиперидинобензойной кислоты (5,6 г) с метанолом (50 мл) и тетрагидрофураном (50 мл) добавляют 10% палладия на угле (1,5 г) и смесь подвергают каталитическому восстановлению при комнатной температуре и атмосферном давлении. Катализатор отфильтровывают и фильтрат испаряют в вакууме. Ополаскиванием остатка смесью диизопропилового эфира с н-гексаном получают метиловый эфир 5-амино-3-метилсульфонил-4-пиперидинобензойной кислоты (4,88 г).
Т.пл. 178-179oC.
ИК (ньюджол): 3350, 3250, 1710, 1330, 1130 см-1.
ЯМР (ДМСО-d6) δ: 1,35 - 1,8 (6H, м), 2,74 - 3,91 (2H, м), 3,28 - 3,46 (2H, м), 3,35 (3H, с), 3,84 (3H, с), 7,46 (1H, д, J = 2,1 Гц), 7,62 (1H, д, J = 2,1 Гц).
Препаративный пример 8.
Смесь 4-хлор-3-метилсульфонил-5-нитробензойной кислоты (5 г) и пиперидина (25 мл) перемешивают 1 час при комнатной температуре. К смеси добавляют водный этилацетат и добавлением конц. соляной кислотой в смеси устанавливают pH 1. Отделенный органический слой промывают водой и сушат над сульфатом магния. Растворитель удаляют концентрированием и ополаскиванием остатка смесью диизопропилового эфира с н-гексаном получают 3-метилсульфонил-5-нитро-4-пиперидинобензойную кислоту (5,66 г).
Т.пл. 197-199oC.
ИК (ньюджол): 1700, 1530, 1305, 1125 см-1.
ЯМР (ДМСО-d6) δ: 1,47-1,74 (6H, м), 3,01 - 3,13 (4H, м), 3,45 (3H, с), 8,48 (1H, д, J = 2,1 Гц), 8,65 (1H, д, J = 2,1 Гц), 13,91 (1H, ш.с).
Препаративный пример 9.
Смесь этилового эфира 3-аминобензойной кислоты (3 г), три(этокси)метана (3 мл) и азида натрия (1,2 г) в уксусной кислоте (30 мл) перемешивают 5 часов при 60-70oC. К реакционной смеси добавляют воду и добавлением карбоната калия устанавливают pH 8. Образовавшийся осадок отфильтровывают и осадок растворяют в смеси этилацетата с тетрагидрофураном. Смесь промывают водой, сушат над сульфатом магния и испаряют в вакууме. Перекристаллизацией остатка из смеси этанола с диизопропиловым эфиром получают этиловый эфир 3-(1H-тетразол-1-ил)бензойной кислоты (2,44 Г).
Т.пл. 104-105oC.
ИК (ньюджол): 3120, 1700, 1590 см-1.
ЯМР (ДМСО-d6) δ: 1,37 (3H, т, J = 7,1 Гц), 4,4 (2H, к, J = 7,1 Гц), 7,82 (1H, дд, J = 7,9 Гц, 7,9 Гц), 8,1 - 8,18 (1H, м), 8,44 (1H, дд, J = 1,8 Гц, 1,8 Гц), 10,24 (1H, с).
МАСС (m/z): 219 (M+ + 1).
Элементный анализ для C10H10N4O2
Вычислено: C 55,04, H 4,62, N 25,68
Найдено: C 55,19, H 4,61, N 25,66
Препаративный пример 10.
Смесь этилового эфира 3-аминобейзойной кислоты (2 г), гексан-2,5-диона (1,8 мл) и уксусной кислоты ((0,7 мл) в бензоле (10 мл) кипятят 5 часов с одновременным удалением воды в насадку Дина-Старка. К смеси добавляют водный этилацетат и добавлением карбоната калия в смеси устанавливают pH 8. Отделенный органический слой промывают рассолом, сушат над сульфатом магния и испарением в вакууме получают этиловый эфир 3-(2,5-диметилпиррол-1-ил)бензойной кислоты (2,9 г) в виде масла.
ИК (ньюджол): 1715, 1585 см-1.
ЯМР (ДМСО-d6) δ: 1,33 (3H, т, J = 7,1 Гц), 1,96 (6H, с), 4,32 (2H, к, J= 7,1 Гц), 5,84 (2H, с), 7,55 - 7,77 (3H, м), 8-8,8 (1H, м).
Препаративный пример 11.
Смесь 3-гидразинобензойной кислоты (2 г), 1,1,3,3-тетраметоксипропана (2,2 мл) и конц. соляной кислоты (2,4 мл) в метаноле (10 мл) кипятят 2 часа и затем испаряют в вакууме. Остаток растворяют в этилацетате, промывают насыщенным водным раствором бикарбоната натрия и рассолом. Полученный испарением растворителя остаток очищают колоночной хроматографией на силикагеле с элюированием дихлорметаном. Содержащие целевой продукт фракции собирают и их испарением в вакууме получают метиловый эфир 3-(пиразол-1-ил)бензойной кислоты (1,33 г).
Т.пл. 48-50oC.
ИК (ньюджол): 3130, 1705, 1610, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,92 (3H, с), 6,57 - 6,63 (1H, м), 7,66 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,82 (1H, д, J = 1,6 Гц), 7,86 - 7,94 (1H, м), 8,1 - 8,2 (1H, м), 8,4 - 8,47 (1H, м), 8,64 (1H, д, J = 2,5 Гц).
МАСС: 203 (M++1)
Элементный анализ для C11H10N2O2
Вычислено: C 65,34, H 4,98, N 13,85
Найдено: C 65,11, H 4,94, N 13,78
Препаративный пример 12.
Смесь метилового эфира 5-ацетил-3-пиридинкарбоновой кислоты (3 г) и диметилацеталя N,N-диметилформамида (6,7 мл) в тетрагидрофуране (30 мл) кипятят 6 часов. К смеси добавляют этилацетат с тетрагидрофураном, смесь промывают рассолом и сушат над сульфатом магния. Растворитель удаляют концентрированием и ополаскиванием остатка диизопропиловым эфиром получают метиловый эфир 5-(3-диметиламино-1-оксо-2-пропенил)-3-пиридинкарбоновой кислоты (1,88 г).
Т.пл. 135 - 137oC.
ИК (ньюджол): 1720, 1640, 1600 см-1.
ЯМР (ДМСО-d6) δ: 2,98 (3H, с), 3,19 (3H, с), 3,92 (3H, с), 5,94 (1H, д, J = 12,1 Гц), 7,84 (1H, д, J = 12,1 Гц), 8,63 (1H, дд, J = 2,1 Гц, 2,1 Гц), 9,15 (1H, д, J = 2,1 Гц), 9,32 (1H, д, J= 2,1 Гц).
Препаративный пример 13.
Смесь метилового эфира 5-(3-диметиламино-1-оксо-2-пропенил)-3-пиридинкарбоновой кислоты (1,7 г), уксусной кислоты (0,62 мл) и моногидрата гидразина (0.53 мл) в метаноле (34 мл) перемешивают 24 часа при комнатной температуре и затем испаряют в вакууме. К остатку добавляют смесь тетрагидрофурана, этилацетата и воды и добавлением карбоната калия в смеси устанавливают pH 9. Отделенный органический слой промывают рассолом и сушат над сульфатом магния. Растворитель удаляют концентрированием и ополаскиванием остатка диизопропиловым эфиром получают метиловый эфир 5-(пиразол-3-ил)-3-пиридинкарбоновой кислоты (1,24 г).
Т.пл. 138-141oC.
ИК (ньюджол): 3100, 1720, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,93 (3H, с), 6,98 (1H, с), 7,89 (1H, с), 8,64 (1H, с), 9,01 (1H, с), 9,27 (1H, с), 13,2 (1H, с),
Препаративный пример 14.
К охлажденному до 7-9oC метанолу (25 мл) по каплям прибавляют тионилхлорид. После перемешивания смеси 30 минут при той же температуре добавляют 5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пиридинкарбоновую кислоту (2,5 г) и смесь кипятят 3 часа. После охлаждения смеси до комнатной температуры ее переносят в смесь этилацетата (100 мл) с водой (100 мл). Органический слой последовательно промывают 10%-ным водным раствором карбоната калия и рассолом, после чего сушат над сульфатом магния. Растворитель испаряют в вакууме и перекристаллизацией остатка из диэтилового эфира получают метиловый эфир 5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пиридинкарбоновой кислоты (2,12 г).
Т.пл. 131-132oC.
ИК (ньюджол): 1720, 1610, 1100, 740 см-1.
ЯМР (ДМСО-d6) δ: 2,47 (3H, с), 3,96 (3H, с), 8,77 (1H, дд, J = 2,1 Гц, 2,1 Гц), 9,31 (1H, д, J = 2,1 Гц), 9,45 (1H, д, J = 2,1 Гц).
МАСС: (m/z): 218 (M+-1).
Препаративный пример 15.
К суспензии 1-(гидроксиимино)этиламино (7,4 г) в сухом тетрагидрофуране (450 мл) осторожно прибавляют гидрид натрия (3,7 г, 60% в минеральном масле). Смесь перемешивают 15 минут при комнатной температуре и кипятят 30 минут. К полученной смеси добавляют 3,5-бис(метоксикарбонил)пиридин (15 г) и смесь кипятят 3 часа. После охлаждения до комнатной температуры реакционную смесь переносят в смесь этилацетата (200 мл) и воды (200 мл) при перемешивании. Добавлением 10%-ой соляной кислоты в водном слое устанавливают pH 3,5. Образовавшийся осадок отфильтровывают, промывают водой и после сушки в вакууме получают 5-(3-метил-1,2,4-оксадиазол-5-ил)-3-пиридинкарбоновую кислоту (5,04 г).
Т.пл. 242-244oC (разл.).
ИК (ньюджол): 1710, 1455, 1170 см-1.
ЯМР (ДМСО-d6) δ: 2,47 (3H, с), 8,63 (1H, т, J = 2,1 Гц), 9,28 (1H, т, J = 2,1 Гц), 9,41 (1H, д, J = 2,1 Гц),
МАСС (m/z): 203 (M+ - 2).
Препаративный пример 16.
Смесь метилового эфира 5-трет-бутоксикарбониламино-3-пиридинкарбоновой кислоты (5,7 г) и конц. соляной кислоты (11,4 мл) в метаноле (57 мл) перемешивают 1 час при 40oC. После охлаждения до комнатной температуры реакционную смесь переносят в смесь этилацетата (100 мл) с водой (100 мл) при перемешивании и добавлением 10%-ного водного раствора карбоната калия устанавливают pH 9. Органический слой промывают рассолом и сушат над сульфатом магния. Растворитель испаряют в вакууме и перекристаллизацией остатка из смеси диэтиловый эфир-метанол получают метиловый эфир 5-амино-3-пиридинкарбоновой кислоты (2,03 г).
Т.пл. 128-130oC.
ИК (ньюджол): 3300, 3125, 1720, 1245, 1120 см-1.
ЯМР (ДМСО-d6) δ: 3,84 (3H, с), 7,4 - 7,5 (1H, м), 8,12 - 8,15 (1H, м), 8,2 - 8,3 (1H, м).
МАСС: 151 (M+ - 1).
Препаративный пример 17
Смесь метилового эфира 5-амино-3-пиридинкарбоновой кислоты (1,7 г) и 2,5-диметокситетрагидрофурана (2,2 г) в уксусной кислоте (5 мл) кипятят 30 минут. После охлаждения до комнатной температуры реакционную смесь переносят в перемешиваемую смесь этилацетата (50 мл) с водой (50 мл) и добавлением 10%-го водного раствора карбоната калия устанавливают pH 8,5. Органический слой промывают рассолом и сушат над сульфатом магния. Растворитель испаряют в вакууме и перекристаллизацией остатка из смеси диэтиловый эфир-н-гексан получают метиловый эфир 5-(пиррол-1-ил)-3-пиридинкарбоновой кислоты (1,29 г). Т.пл. 101-102oC.
ИК: 1710, 1590, 1260 см-1.
ЯМР (ДМСJ-d6) δ: 3,93 (3H, с), 6,3 - 6,4 (2H, м), 7,55 - 7,65 (2H, м), 8,35 - 8,4 (1H, м), 8,93 (1H, д, J = 1,7 Гц), 9,17 (1H, д, J = 2,7 Гц).
МАСС: 203 (M+).
Элементный анализ для C11H10N2O3
Вычислено: C 65,34, H 4,98, N 13,85
Найдено: C 65,11, H 5,03, N 13,63
Препаративный пример 18.
К перемешиваемому при 0oC раствору 1-метилтио-2-бромбензола (5 г) в сухом эфире (30 мл) в течение 15 минут по каплям прибавляют 1,63 М раствор бутиллития в гексане (16,6 мл). Реакционную смесь перемешивают 1,5 часа при 0oC и затем в течение 40 минут прибавляют к охлажденному до -78oC раствору триизопропилбората (7,4 мл) в тетрагидрофуране (40 мл). После перемешивания 1 час при -78oC реакционную смесь оставляют примерно на сутки нагреваться до комнатной температуры. Образовавшуюся суспензию переносят в 2 М соляную кислоту (40 мл) и слои разделяют. Водную фазу экстрагируют эфиром (2 и 80 мл), объединенные органические фазы промывают рассолом, сушат над сульфатом магния, испаряют и промывают петролейным эфиром (2х20 мл), получают 2-метилтиофенилдигидроксиборан.
Т.пл. 83-84oC.
ИК (ньюджол): 3250, 1580, 1010, 740 см01.
ЯМР (ДМСО-d6) δ: 2,41 (3H, с), 7,07 - 7,36 (4H, м), 8,09 (2H, с).
МАСС (m/z): 168 (M+).
Препаративный пример 19.
По методике, аналогичной методике препаративного примера 18, получаем следующие соединения:
(1) 2-Метоксифенилдигидроксиборан
Т.пл. 105-106oC.
ИК (ньюджол): 3350, 1600, 1220, 1160, 1050, 1020, 750 см-1.
ЯМР (ДМСО-d6) δ: 3,8 (3H, с), 6,9 - 6,99 (2H, м), 7,39 (1H, ддд, J = 7,2 Гц, 7,2 Гц, 1,8 Гц), 7,57 (1H, дд, J = 7,2 Гц, 1,8 Гц), 7,7 (2H, с).
МАСС (m/z): 152.
(2) 2-Трифторметилфенилдигидроксиборан
Т.пл. 144 - 145oC.
ИК (ньюджол): 3250, 1100, 770, 720 см-1
ЯМР (ДМСО-d6) δ: 7,5-7,67 (4H, м), 8,33 (2H, с).
Препаративный пример 20.
Смесь 2-метилтиофенилдигидроксиборана (1,55 г) и 3-иод-бензойной кислоты (2,08 г) в воде (30 мл) перемешивают при комнатной температуре, после чего добавляют карбонат натрия (2,67 г) и ацетат палладия (11) (0,019 г). После перемешивания примерно сутки при 40oC реакционную смесь фильтруют и промывают эфиром (2 х 20 мл). Добавлением 6 н. соляной кислоты в водном слое устанавливают pH 2. Кристаллический продукт отделяют, промывают и после сушки получают 3-(2-метилтиофенил)бензойную кислоту.
ИК (ньюджол): 1680, 1275, 945, 759 см-1.
Препаративный пример 21.
По методике, аналогичной методике препаративного примера 20, получены следующие соединения:
(1) 3-(2-Метилфенил)бензойная кислота
Т.пл. 135-137oC.
ИК (ньюджол): 1670, 750 см-1.
ЯМР (ДМСО-d6) δ: 2,23 (3H, с), 7,2 - 7,35 (4H, м), 7,57 - 7,64 (2H, м), 7,86 (1H, с), 7,93 - 7,98 (1H, м), 13,05 (1H, ш.с.).
МАСС (m/z): 211 (M+-1).
(2) 3-(4-Метоксифенил)бензойная кислота
Т.пл. 212-213oC.
ИК (ньюджол): 1675, 1250, 1020 см-1.
ЯМР (ДМСО-d6) δ: 3,81 (3H, с), 7,05 (2H. дд, J = 6,7 Гц, 2,1 Гц), 7,56 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,65 (2H, дд, J = 6,7 Гц, 2,1 Гц), 7,85 - 7,91 (2H, м), 8,14 (1H, дд, J = 1,7 Гц, 1,7 Гц), 13,07 (1H, ш.с.).
МАСС (m/z): 227 (M+-1).
(3) 3-(3-Метоксифенил)бензойная кислота
Т.пл. 129-131oC.
ИК (ньюджол): 1690, 1310, 1210, 1040, 750 см-1.
ЯМР (ДМСО-d6) δ: 3,84 (3H, с), 6,96 - 7,01 (1H, м), 7,21 - 7,28 (2H, м), 7,42 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,59 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,9 - 7,97 (2H, м), 8,18 (1H. дд, J = 1,5 Гц, 1,5 Гц).
МАСС (m/z): (M+-1).
(4) 3-(1-Нафтил)бензойная кислота
Т.пл. 185-187oC.
ИК (ньюджол): 1670, 1300, 770 см-1.
ЯМР (ДМСО-d6) δ: 7,47 - 7,79 (7H, м), 7,98 - 8,09 (4H, м)
МАСС (m/z): 247 (M+-1).
(5) 3-(2-Нафтил)бензойная кислота
Т.пл. 213-215oC.
ИК (ньюджол): 1670, 1310, 1250, 810, 750 см-1.
ЯМР (ДМСО-d6) δ: 7,52 - 7,71 (3H, м), 7,86 - 8,11 (6H. м), 8,3 (1H, с), 8,37 - 8,39 (1H, м), 13,17 (1H, ш.с.).
МАСС (m/z): 247 (M+-1).
(6) 3-(2-Метоксифенил)бензойная кислота
Т.пл. 176-178oC.
ИК (ньюджол): 1690, 1310, 1250, 1020, 720 см-1.
ЯМР (ДМСО-d6) δ: 3,78 (3H, с), 7,03 - 7,16 (2H, м), 7,3 - 7,42 (2H, м), 7,54 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,72 (1H, ддд, J = 7,9 Гц, 1,6 Гц, 1,6 Гц), 7,91 (1H, ддд, J = 7,7 Гц, 1,5 Гц, 1,5 Гц), 8,05 (1H, дд, J = 1,6 Гц, 1,6 Гц), 13,02 (1H, ш.с).
МАСС (m/z): 227 (M+-1).
(7) 3-(2-Трифторметилфенил)бензойная кислота
ИК (ньюджол): 1680, 1310, 1110, 750 см-1.
Препаративный пример 22.
По методике, аналогичной методике препаративного примера 2, получены следующие соединения:
(1) Метиловый эфир 3-(4-метоксифенил)бензойной кислоты
Т.пл. 62-64oC.
ИК (ньюджол): 1720, 1610, 1020, 835 см-1.
ЯМР (ДМСО-d6) δ: 3,81 (3H, с), 3,89 (3H, с), 7,05 (2H, дд, J = 7,9 Гц, 1,7 Гц), 7,59 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,85 - 7,95 (2H, м), 8,15 (1H, дд, J = 1,7 Гц).
МАСС (m/z): 243 (M + 1)
(2) Метиловый эфир 3-(3-метоксифенил)бензойной кислоты
ИК (ньюджол): 1720, 1250, 1210, 1110, 750 см-1.
ЯМР (ДМСО-d6) δ: 3,84 (3H, с), 3,9 (3H, с), 6,97 - 7,02 (1H, м), 7,02 (1H, м), 7,21 - 7,28 (2H, м), 7,42 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,62 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,94 - 7,99 (2H, м), 8,18 (1H, дд, J = 1,7 Гц, 1,7 Гц).
МАСС (m/z): 243 (M+ + 1)
(3) Метиловый эфир (1-нафтил)бензойной кислоты
Т.пл. 73-74oC.
ИК (ньюджол): 1720, 1300, 1260, 1240, 1100, 800, 770, 750 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 7,47 - 7,78 (7H, м), 7,99 8,1 (4H, м)
МАСС (m/z): 263 (M+ + 1)
(4) Метиловый эфир 3-(2-нафтил)бензойной кислоты
Т.пл. 51-52oC.
ИК (ньюджол): 1720, 1290, 1250, 1110, 810, 750 см-1.
ЯМР (ДМСО-d6) δ: 3,93 (3H, с), 7,52 - 7,72 (3H, м), 7,85 -8,13 (6H, м), 8,29 (1H, с), 8,36 (1H. с).
МАСС (m/z): 263 (M+ + 1).
(5) Метиловый эфир 3-(2-метоксифенил)бензойной кислоты
Т.пл. 91-93oC.
ИК (ньюджол): 1710, 1310, 1250, 1100, 1020, 760 см-1.
ЯМР (ДМСО-d6) δ: 3,78 (3H, с), 3,88 (3H, с), 7,05 - 7,16 (2H, м), 7,3 - 7,4 (2H, м), 7,57 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,76 (1H, ддд, J = 8 Гц, 1,6 Гц, 1,6 Гц), 7,93 (1H, ддд, J = 7,8 Гц, 1,5 Гц, 1,5 Гц), 8,07 (1H, дд, J = 1,6 Гц, 1,6 Гц).
МАСС (m/z): 243 (M+ +1).
(6) Метиловый эфир 3-(2-трифторметилфенил)бензойной кислоты
Т.пл. 41-43oC.
ИК (ньюджол): 1730, 1310, 1240, 1170, 1130, 1040, 740 см-1.
ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 7,46 (1H, д, J = 7,3 Гц), 7,62 - 7,8 (4H, м), 7,85 - 7,88 (2H, м), 7,99 - 8,06 (1H, м).
МАСС (m/z): 281 (M+ + 1).
(7) Метиловый эфир (2-метилфенил)бензойной кислоты
ИК (чистый): 1720, 1580, 1300, 1240, 1110, 970, 740 см-1.
ЯМР (ДМСО-d6) δ: 2,22 (3H, с), 3,88 (3H, с), 7,21 - 7,35 (4H, м), 7,6 - 7,67 (2H, м), 7,88 (1H, дд, J = 1,5 Гц, 1,5 Гц), 7,97 (1H, ддд, J = 6,9 Гц, 1,9 Гц, 1,9 Гц).
МАСС (m/z): 227 (M++1).
(8) Метиловый эфир 3-(2-метилтиофенил)бензойной кислоты
Т.пл. 91-92oC.
ИК (ньюджол): 1710, 1300, 1230, 750 см-1.
ЯМР (ДМСО-d6) δ: 2,38 (3H, с), 3,87 (3H, с), 7,22 - 7,3 (2H, м), 7,35 - 7,46 (2H, м), 7,56 - 7,68 (2H, м), 7,94 - 8,01 (2H, м),
МАСС (m/z): 259 (M++1).
Препаративный пример 23.
По методике, аналогичной методике препаративного примера 5, получены следующие соединения:
(1) Метиловый эфир 4-н-бутил-3-(пиррол-1-ил)бензойной кислоты.
ИК (пленка): 1720, 1610 см-1.
ЯМР (ДМСО-d6) δ: 0,77 (3H, т, J = 7,1 Гц), 1,05 - 1,45 (4H, м), 2,48 - 2,6 (2H, м), 3,85 (3H, с), 6,22 - 6,28 (2H, м), 6,91 - 6,96 (2H, м), 7,55 (1H, д, J = 8 Гц), 7,72 (1H, д, J = 1,7 Гц), 7,93 (1H, дд, J = 1,7 Гц, 8 Гц).
(2) Метиловый эфир 4-метил-3-(пиррол-1-ил)бензойной кислоты
Т.пл. 46oC.
ИК (ньюджол): 1715 см-1.
ЯМР (ДМСО-d6) δ: 2,25 (3H, c), 3,86 (3H, c), 6,23 - 6,29 (2H, м), 6,95 - 7,01 (2H, м), 7,53 (1H, д, J = 7,9 Гц), 7,74 (1H, д, J = 1,8 Гц), 7,88 (1H, дд, J = 7,9 Гц).
(3) Метиловый эфир 5-циано-3-(пиррол-1-ил)бензойной кислоты
Т.пл. 124-126oC.
ИК (ньюджол): 2240, 1700, 1595 см-1.
ЯМР (ДМСО-d6) δ: 3,93 (3H, c), 6,31 - 6,36 (2H, м), 7,57 - 7,6 (2H, м), 8,13 (1H, дд, J = 1,4 Гц, 1,4 Гц), 8,32 (1H, дд, J = 1,4 Гц, 2,3 Гц), 8,45 (1H, дд, J = 1,4 Гц, 2,3 Гц).
(4) Метиловый эфир 3-хлор-5-(пиррол-1-ил)бензойной кислоты
Т.пл. 70-72oC.
ИК (ньюджол): 1720, 1580, 1340, 1260, 760, 720 см-1.
ЯМР (ДМСО-d6) δ: 3,9 (3H, c), 6,3 - 6,35 (2H, м), 7,5 - 7,55 (2H, м), 7,75 - 7,8 (1H, м), 8 - 8,03 (1H, м), 8,03 - 8,06 (1H, м).
MACC (m/z): 236 (M + 1).
(5) Метиловый эфир 3-(3-формилпиррол-1-ил)бензойной кислоты
ИК (пленка): 1720, 1665, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 6,72 (1H, дд, J = 1,6 Гц, 3,1 Гц), 7,61 - 7,65 (1H, м), 7,67 - 7,74 (1H, 1H, м), 7,91 - 8,04 (2H, м), 8,12 - 8,18 (1H, м), 8,35 - 8,4 (1H, м), (1H, м), 9,81 (1H, с).
(6) Метиловый эфир 4-гидрокси-3-(пиррол-1-ил)бензойной кислоты
Т.пл. 98-100oC.
ИК (ньюджол): 3220, 1677, 1605 см-1.
ЯМР (ДМСО-d6) δ: 3,82 (3H, c), 6,17 - 6,23 (2H, м), 7,07 - 7,19 (3H, м), 7,74 - 7,85 (2H, м), 11 (1H, с)
Препаративный пример 24.
Смесь диметилового эфира 5-(пиррол-1-ил)изофталевой кислоты (3 г), метилацетата (0,86 г) и метоксида натрия (0,81 г) в N,N-диметилформамиде (21 мл) нагревают 3 часа при 55oC. После охлаждения до комнатной температуры реакционную смесь переносят в воду (100 мл) и добавлением 10%-ной соляной кислоты устанавливают pH 3. Образовавшийся осадок отделяют и промывают водой. Полученный сырой продукт очищают колоночной хроматографией на силикагеле (150 мл) с применением в качестве элюента смеси бензол-этилацетат (30:1). Содержание целевой продукт фракции собирают и испаряют в вакууме. Перекристаллизаций остатка из метанола получают метиловый эфир 3-[3-метоксикарбонил-5-(пиррол-1-ил)фенил]-3-оксопропионовой кислоты (0,31 г).
Т.пл. 82-84oC.
ИК (ньюджол): 1720, 1690, 1260, 720 см-1.
ЯМР (ДМСО-d6) δ: 3,68 (3H, с), 3,93 (3H, с), 4,42 (2H, с), 6,3 - 6,4 (2H, м), 7,55 - 7,65 (2H, м), 8,29 (2H, с), 8,34 (1H, с).
MACC (m/z): 300 (M - 1).
Препаративный пример 25.
Раствор метилового эфира 3-/3-метоксикарбонил-5-(пиррол-1-ил) фенил/-3-оксопропионовой кислоты (0,1 г) в смеси воды (1 мл), метанола (3 мл) и концентрированной серной кислоты (40 мг) кипятят 16 часов. После охлаждения до комнатной температуры реакционную смесь переносят в смесь этилацетата (50 мл) с водой (50 мл). Органический слой последовательно промывают насыщенным водным раствором гидрокарбоната натрия и рассолом, сушат над сульфатом магния и после испарения в вакууме получают метиловый эфир 3-ацетил-5-(пиррол-1-ил)бензойной кислоты (20,1 мг).
Т.пл. 101-103oC.
ИК (ньюджол): 1720, 1690, 1230, 730 см-1.
ЯМР (ДМСО-d6) δ: 2,71 (3H, с), 3,93 (3H, с), 6,3 - 6,36 (2H, м), 7,36 - 7,59 (2H, м), 8,25 - 8,33 (3H, м).
MACC (m/z): 243 (M+).
Препаративный пример 26.
Суспензию 1-три(н-бутил)станнил-2-(4,4-диметил-4,5-дигидрооксазол-2-ил)бензола (5 г), метилового эфира 3-иодбензойной кислоты (2,17 г) и тетракис(трифенилфосфин)палладия (0,29 г) в диоксане кипятят 18 часов. После охлаждения до комнатной температуры к реакционной смеси добавляют 25%-ый водный раствор фторида калия (11 мл) и смесь перемешивают 15 минут. Нерастворимые вещества отфильтровывают с помощью целита. Фильтрат экстрагируют этилацетатом (50 мл), промывают рассолом, сушат над фильтром магния, фильтруют и испаряют в вакууме. Остаток очищают колоночной хроматографией на силикагеле (200 г) со смесью бензол-этилацетат (20:1) в качестве элюента. Содержащие целевое соединение фракции объединяют и испаряют метиловый эфир 3-[2-(4,4-диметил-4,5-дигидрооксазол-2-ил)фенил]бензойной кислоты (370 мг).
Т.пл. 103-104oC.
ИК (ньюджол): 1710, 1635, 1300, 745 см-1.
ЯМР (ДМСО-d6) δ: 1,17 (6H, с), 3,79 (2H, с), 3,86 (3H, с), 7,3 - 7,7 (7H, м), 7,9 - 8 (2H, м).
MACC (m/z): 310 (M + 1).
Препаративный пример 27.
По методике, аналогичной методике препаративного примера 26, получены следующие соединения:
(1) Метиловый эфир 3-(тиофен-3-ил)бензойной кислоты
Т.пл. 50-51oC.
ИК (ньюджол): 1710, 1285, 1235, 780, 745 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 7,54 - 7,71 (3H, м), 7,85 - 7,9 (1H, м), 7,98 - 8,05 (2H, м), 8,23 - 8,25 (2H, м),.
MACC (m/z): 219 (M + 1).
(2) Метиловый эфир 3-(тиофен-2-ил)бензойной кислоты
ИК (ньюджол): 1615, 1440, 1290, 750 см-1.
ЯМР (ДМСО-d6) δ: 3,9 (3H, с), 7,15 - 7,2 (1H, м), 7,5 - 7,65 (3H, м), 7,85 - 8 (2H, м), 8,16 - 8,17 (1H, м).
MACC (m/z): 219 (M + 1).
(3) Метиловый эфир 3-(тиазол-2-ил)бензойной кислоты
Т.пл. 50-52oC.
ИК (ньюджол): 1700, 1295, 1220, 755 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 7,68 (1H, д, J = 7,8 Гц), 7,88 (1H, д, J = 3,2 Гц), 7,99 (1H, д, J = 3,2 Гц), 8,03 - 8,09 (1H, м), 8,19 - 8,25 (1H, м), 8,49 - 8,51 (1H, м).
MACC (m/z): 220 (M + 1).
(4) Метиловый эфир 3-[4-(4,4-диметил-4,5-дигидрооксазол-2-ил) фенил] бензойной кислоты
ИК (чистый): 2950, 1720, 1640, 1440, 1300, 1240 см-1.
ЯМР (ДМСО-d6) δ: 1,31 (6H, с), 3,9 (3H, с), 4,14 (2H, с), 7,66 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,82 (2H, д, J = 8,5 Гц), 7,94 - 8,05 (4H, м), 8,24 (1H, с).
MACC (m/z): 310 (M+ + 1).
Препаративный пример 28.
К раствору метилового эфира 3-[2-(4,4-диметил-4,5-дигидрооксазол-2-ил)фенил] бензойной кислоты (1,25 г) в пиридине (5 мл) при 7oC по каплям прибавляют фосфорилхлорид (0,75 мл), поддерживая температуру ниже 20oC. Затем реакционную смесь перемешивают 4 часа при 100oC. После охлаждения до комнатной температуры смесь нейтрализуют водой и эмульсию экстрагируют этилацетатом (50 мл). Органический слой последовательно промывают 6 н. соляной кислотой и рассолом, сушат над сульфатом магния, фильтруют и испаряют в вакууме. Остаток очищают колоночной хроматографией на силикагеле (25 г) с дихлорметаном в качестве элюента. Содержащие целевое соединение фракции объединяют и испаряют в вакууме. Перекристаллизацией кристаллического остатка из метанола получают метиловый эфир 3-(2-цианофенил)бензойной кислоты (0,7 г).
Т.пл. 83-85oC.
ИК (ньюджол): 2225, 1720, 1245, 730 см-1.
ЯМР (ДМСО-d6) δ: 3,9 (3H, с), 7,5 - 8,2 (8H, м).
MACC (m/z): 238 (M + 1).
Препаративный пример 29.
По методике, аналогичной методике препаративного примера 28, получено следующее соединение:
Метиловый эфир 3-(4-цианофенил)бензойной кислоты
Т.пл. 123-125oC.
ИК (ньюджол): 2230, 1720 см-1.
ЯМР (ДМСО-d6) δ: 3,9 (3H, с), 7,68 (1H, д, J = 7,8 Гц, 8 Гц), 7,9 - 8,06 (6H, м), 8,25 (1H, с).
MACC (m/z): 238 (M + 1).
Препаративный пример 30.
К смеси 3-метоксикарбонил-5-(пиррол-1-ил)бензойной кислоты (3 г), 4-гидроксипиперидина (1,23 г) и 1-гидроксибензотриазола (1,81 г), в дихлорметане (100 мл) при охлаждении добавляют 1-этил-3-(3-диметиламино)карбодиимид (2,57 г) и раствор перемешивают 30 часов при комнатной температуре. После испарения растворителя остаток при перемешивании растворяют в смеси этилацетата с насыщенным водным раствором гидрокарбоната натрия. Органический слой последовательно промывают водой и рассолом и сушат над сульфатом магния. Растворитель испаряют в вакууме и остаток очищают колоночной хроматографией на силикагеле с элюированием смесью хлороформ-метанол (50: 1). Содержание целевой продукт фракции собирают и после испарения в вакууме получают метиловый эфир 3-[(4-гидроксипиперидин-1-ил)карбонил]-5-(пиррол-1-ил)бензойной кислоты (3,56 г).
Т.пл. 158-159oC.
ИК (ньюджол): 3350, 1730, 1600 см-1.
ЯМР (ДМСО-d6) δ: 1,2-2 (4H, м), 3 - 4,2 (6H, м), 3,91 (3H, с), 6,3 - 6,4 (2H, м), 7,5 - 7,6 (2H, м), 7,7 - 7,8 (1H, м), 7,9 - 8 (1H, м), 8,1 - 8,2 (1H, м),
МАСС: (m/z): 329 (M+ + 1).
Препаративный пример 31.
По методике, аналогичной методике препаративного примера 30, получены следующие соединения:
(1) Метиловый эфир 3-[(2-диметиламиноэтил)карбамоил] -5-(пиррол-1-ил)бензойной кислоты
Т.пл. 108-109oC.
ИК (ньюджол): 3370, 1720, 1640, 1600 см-1.
ЯМР (ДМСО-d6) δ: 2,28 (6H, с), 2,5 - 2,6 (2H, м), 3,5 - 3,6 (2H, м), 3,98 (3H, с), 6,3 - 6,4 (2H, м), 6,97 (1H, ш.с), 7,1 - 7,2 (2H, м), 8,1 - 8,3 (3H, м).
МАСС (m/z): 316 (M+ + 1).
(2) Метиловый эфир 3-[(4-метилпиперазин-1-ил)карбонил] -5-(пиррол-1-ил)бензойной кислоты
ИК (пленка): 2950, 2800, 1720, 1630, 1600 см-1.
ЯМР (ДМСО-d6) δ: 2,2 (3H, с), 2,1 - 2,5 (6H, м), 3,5 - 3,8 (2H, м), 3,91 (3H, с), 6,3 - 6,4 (2H, м), 7,5 - 7,6 (2H, м), 7,7 - 7,8 (1H, м), 7,9 - 8 (1H, м), 8,1 - 8,2 (1H, м).
МАСС (m/z): 328 (M+ + 1).
Препаративный пример 32.
К смеси гидрохлорида гидроксиламина (3,1 г), и 28%-го метанольного раствора метоксида натрия (8,6 мл) в метаноле (100 мл) добавляют метиловый эфир 3-(3-формилпиррол-1-ил)бензойной кислоты (10,2 г) и все перемешивают 3 часа при комнатной температуре. Затем концентрированием удаляют растворитель. К остатку добавляют смесь этилацетата, тетрагидрофурана и воды и добавлением 6 н. соляной кислоты в смеси устанавливают pH 2. Отделенный органический слой промывают рассолом, сушат над сульфатом магния и после испарения в вакууме получают в виде масла метиловый эфир 3-[(3-(гидроксииминометил)пиррол-1-ил] бензойной кислоты (9,24 г).
ИК (пленка): 3170 (ш.) 1720 (ш.) см-1.
ЯМР (ДМСО-d6) δ: 3,9 (3H, с), 6,5 - 6,54 и 6,68 - 6,72 (всего 1H, каждый м), 7,31 - 7,77 (3H, м), 7,81 - 7,95 (2H, м), 7,98 - 8,06 (2H, м), 10,64 и 11,17 (всего 1H, каждый с).
Препаративный пример 33.
По методике, аналогичной методике препаративного примера 32, получено следующее соединение:
Метиловый эфир 3-(2-гидроксииминометил)-пиррол-1-ил)бензойной кислоты
ИК (пленка): 3150, 1720 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 6,29 - 6,34 и 6,34 - 6,4 (всего 1H, каждый м), 6,61 - 6,66 и 7,28 - 7,32 (всего 1H, каждый м), 7,03 и 7,85 (всего 1H, каждый с), 7,12 - 7,17 и 7,16 - 7,2 (всего 1H и каждый м), 7,64 - 7,75 (2H, м), 7,82 - 7,88 (1H, м), 7,96 - 8,12 (1H, м), 10,88 т 11,49 (всего 1H, каждый с).
Препаративный пример 34.
К смеси гидрохлорида гидроксиламина (1,5 г) и 20%-го метанольного раствора метоксида натрия (4,9 г) в метаноле (50 мл) добавляют метиловый эфир 3-(2-формилпиррол-1-ил)бензойной кислоты (5 г) и смесь перемешивают 4 часа при комнатной температуре. Растворитель удаляют концентрированием и остаток растворяют в смеси этилацетата с водой. Добавлением 6 н. соляной кислоты в смеси устанавливают pH 2. Отделенный органический слой промывают рассолом, сушат над сульфатом магния и испаряют в вакууме. Остаток подвергают колоночной хроматографии на силикагеле с элюированием смесью хлороформ-этилацетат (19: 1). Элюируемые первыми фракции, содержащие целевой продукт, собирают, испаряют в вакууме и после ополаскивания смесью диизопропилового эфира с н-гексаном получают метиловый эфир 3-[(E)-2-гидроксииминометилпиррол-1-ил] бензойной кислоты (соединение А) (0,8 г). Элюируемые позднее фракции, содержащие целевой продукт, собирают и после испарения в вакууме получают метиловый эфир 3-[(Z)-2-гидроксииминометилпиррол-1-ил] бензойной кислоты (соединение B) (1,43 г) в виде масла.
Соединение 4:
Т.пл. 87-88oC.
ИК (ньюджол): 1720, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 6,29 - 6,34 (1H, м), 6,61 - 6,66 (1H, м), 7,12 - 7,17 (1H, м), 7,64 - 7,72 (2H, м), 7,82 - 7,88 (1H, м), 7,85 (1H, с), 7,96 - 8,08 (1H, м), 10,85 (1H, с).
МАСС (m/z): 245 (M+ + 1).
Соединение B:
ИК (пленка): 1705-1725, 1630, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 6,34 - 6,4 (1H, м, 7,03 (1H, с), 7,16 - 7,2 (1H, м), 7,28 - 7,32 (1H, м), 7,69 - 7,75 (2H, м), 7,82 - 7,85 (1H, м), 8 - 8,12 (1H, м), 11,45 (1H, с).
МАСС (m/z): 245 (M+ + 1).
Препаративный пример 35.
Смесь метилового эфира 3-(3-гидроксииминометилпиррол-1-ил)бензойной кислоты (9 г) и уксусного ангидрида (45 мл) кипятят с перемешиванием 3 часа и затем реакционную смесь концентрируют в вакууме. К остатку добавляют смесь этилацетата с водой и добавлением карбоната калия устанавливают pH 8. Отделенный органический слой промывают водой, сушат над сульфатом магния и испаряют в вакууме. Остаток очищают колоночной хроматографией на силикагеле с элюированием хлороформом. Элюируемые фракции, содержащие целевой продукт, объединяют и испаряют в вакууме. Ополаскиванием остатка смесью диизопропилового эфира с н-гексаном получают метиловый эфир 3-(3-цианопиррол-1-ил)бензойной кислоты (6,2 г).
Т.пл. 105-106oC.
ИК (ньюджол): 2230, 1725, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,9 (3H, с) 6,73 - 6,79 (1H, м), 7,62 - 7,74 (2H, м), 7,91 - 7,99 (2H, м), 8,1- 8,15 (1H, м), 8,32 - 8,37 (1H, м).
МАСС (m/z): 227 (M+ + 1).
Препаративный пример 36.
По методике, аналогичной методике препаративного примера 35, получено следующее соединение:
Метиловый эфир 3-(2-цианопиррол-1-ил)бензойной кислоты
Т.пл. 89 - 90oC.
ИК (ньюджол): 2220, 1715, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 6,49 (1H, дд, J = 2,8 Гц), 3,9 Гц), 7,28 (1H, дд, J = 1,6 Гц), 3,9 Гц), 7,65 (1H, дд, J = 1,6 Гц, 2,8 Гц), 7,76 (1H, дд, J = 8 Гц, 8 Гц), 7,85 - 7,92 (1H, м), 8,04 - 8,1 (2H, м).
Препаративный пример 37.
К раствору метилового эфира 3-ацетоксиметил-5-(пиррол-1-ил)бензойной кислоты (4,68 г) в дихлорметане (94 мл) добавляют при -20oC в атмосфере азота хлорсульфонилизоцианата (2,1 мл). После перемешивания 1 час при -20oC к реакционной смеси при той же температуре добавляют N,N-диметилформамид (14 мл). После перемешивания 1 час в температурном интервале от -20oC до -10oC реакционную смесь переносят в воду и продукт экстрагируют этилацетатом. Экстракт промывают рассолом и сушат над сульфатом магния. Растворитель испаряют в вакууме и остаток очищают колоночной хроматографией на силикагеле с элюированием смесью гексан-этилацетат (5:1). Элюируемые фракции, содержащие целевой продукт, собирают и их испарением в вакууме получают метиловый эфир 3-ацетоксиметил-5-(2-цианопиррол-1-ил)бензойной кислоты (4,26 г).
Т.пл. 85-84oC.
ИК (ньюджол): 2220, 1735, 1720 см-1.
ЯМР (ДМСО-d6) δ: 2,11 (3H, с), 3,91 (3H, с), 5,24 (2H, с), 6,4 - 6,6 (1H, м), 7,2 - 7,3 (1H, м), 7,6 - 7,7 (1H, м), 7,9 - 8,1 (3H, м).
МАСС (m/z): 299 (M+ + 1).
Препаративный пример 38.
К смеси метилового эфира 3-(2-диметиламинометилпиррол-1-ил)бензойной кислоты (1 г) и дихлорметана (15 мл) при охлаждении льдом добавляют 4 н. раствор хлористого водорода в этилацетате (0,97 мл) и смесь перемешивают 5 минут при той же температуре. К охлаждаемой льдом смеси по каплям прибавляют хлорсульфонилизоцианат (0,4 мл) и смесь перемешивают 1 час при той же температуре. К охлаждаемой льдом смеси по каплям прибавляют N,N-диметилформамид (3 мл) и смесь перемешивают 1 час при той же температуре. Затем реакционную смесь переносят в смесь дихлорметана с водой и добавляют 5 н. раствора гидроксида натрия в отделенном водном слое устанавливают pH 12. Затем водный слой экстрагируют этилацетатом. Экстракт промывают рассолом, сушат над сульфатом магния и после испарения в вакууме получают метиловый эфир 3-(2-циано-5-диметиламинометилпиррол-1-ил)бензойной кислоты (1,1 г) в виде масла.
ИК (ньюджол): 3450, 2220, 1728 см-1.
ЯМР (ДМСО-d6) δ: 2,04 (6H, с), 3,21 (2H, с), 3,9 (3H, с), 6,37 (1H, д, J = 3,9 Гц), 7,17 (1H, д, J = 3,9 Гц), 7,74 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,78 - 7,86 (1H, м), 8,06 - 8,16 (2H, м).
Препаративный пример 39.
Раствор метилового эфира 3-(2-метилтиофенил)бензойной кислоты (1,4 г) в хлороформе (21 мл) перемешивают в бане со льдом в атмосфере азота. К раствору медленно прибавляют м-хлорбензойную кислоту и смесь перемешивают 5 часов при комнатной температуре. Затем реакционную смесь экстрагируют хлороформом (70 мл). Экстракт последовательно промывают водным раствором иодида натрия, водным раствором тиосульфата натрия, водным раствором бикарбоната натрия и рассолом и сушат над сульфатом магния. После испарения растворителя перекристаллизацией остатка из диэтилового эфира получают метиловый эфир 3-(2-метилсульфонилфенил)бензойной кислоты.
Т.пл. 100-102oC.
ИК (ньюджол): 1710, 1300, 1150, 950, 750 см-1.
ЯМР (ДМСО-d6) δ: 2,87 (3H, с), 3,87 (3H, с), 7,44 (1H, дд, J = 7,4 Гц, 1,4 Гц), 7,61 - 7,8 (4H, м), 7,96 (1H, дд, J = 1,5 Гц, 1,5 Гц), 8,04 (1H, ддд, J = 7,5 Гц, 1,6 Гц, 1,6 Гц), 8,12 (1H, дд, J = 7,5 Гц, 1,5 Гц).
Препаративный пример 40.
Смесь метилового эфира 3-(2-трихлорацетилпиррол-1-ил)-бензойной кислоты (10 г), бензилового эфира (3,3 мл) и карбоната калия (4,4 г) в N,N-диметилформамиде (30 мл) перемешивают 6 часов при комнатной температуре. Затем реакционную смесь переносят в воду и смесь экстрагируют этилацетатом. Экстракт промывают водой, сушат над сульфатом магния и испаряют. Остаток очищают колоночной хроматографией на силикагеле с элюированием толуолом. Элюируемые фракции, содержащие целевой продукт, собирают и их испарением в вакууме получают в виде масла метиловый эфир 3-(2-бензилоксикарбонилпиррол-1-ил)бензойной кислоты (8,35 г).
ИК (пленка): 1700-1725 (ш.). 1590 см-1
ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 5,12 (2H, с), 6,37 (1H, дд, 2,7 Гц, 3,9 Гц), 7,14 (1H, дд, J = 1,8 Гц, 3,9 Гц), 7,21 - 7,35 (6H, м), 7,57 - 7,69 (2H, ш), 7,8 - 7,84 (1H, м), 7,93 - 8,02 (1H, м).
Препаративный пример 41.
Смесь метилового эфира 3-(пиррол-1-ил)бензойной кислоты (20 г), гидрохлорида диметиламина (12,2 г) и параформальдегида (13,4 г) в этаноле (60 мл) кипятят с перемешиванием 3 часа. После удаления растворителя концентрированием остаток переносят в смесь этилацетата с водой. Добавлением 5 н. раствора гидроксида натрия в смеси устанавливают pH 12. Отделенный органический слой промывают рассолом, сушат над сульфатом магния и испаряют. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью хлороформ-метанол (9: 1, об./об.). Элюируемые фракции, содержащие целевой продукт, собирают и их испарением в вакууме получают метиловый эфир 3-(2-диметиламинометилпиррол-1-ил)бензойной кислоты (15,3 г) в виде масла.
ИК (ньюджол): 1728, 1605, 1590 см-1.
ЯМР (ДМСО-d6) δ: 2,13 (6H, с), 3,2 (2H, с), 3,88 (3H, с), 6,15 - 6,23 (2H, м), 7,04 - 7,1 (1H, м), 7,62 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,8 - 7,88 (1H, м), 7,88 - 7,96 (1H, м), 8,29 - 8,34 (1H, м).
МАСС (m/z): 259 (M+ + 1).
Препаративный пример 42.
К смеси метилового эфира 3-(2-диметиламинометилпиррол-1-ил)бензойной кислоты (10 г) и этилацетата (50 мл) добавляют при комнатной температуре метиоиодид (4,8 мл) и смесь перемешивают 2 часа при той же температуре. Образовавшийся осадок отфильтровывают и после сушки получают метиловый эфир 3-(2-триметиламмониометилпиррол-1-ил)бензойной кислоты-иодида (13,52 г).
Т.пл. 255-256oC.
ИК (ньюджол): 3430, 1720, 1585 см-1
ЯМР (ДМСО-d6) δ: 2,76 (9H, с), 3,89 (3H, с), 7,54 (2H, с, 6,39 (1H, дд, J = 2,9 Гц, 3,5 Гц), 6,69 (1H, дд, J = 1,7 Гц, 3,5 Гц), 7,23 (1H, дд, J = 1,7 Гц, 2,9 Гц), 7,65 - 7,8 (2H, м), 7,89 - 7,93 (1H, м), 8 - 8,1 (1H, м),
Препаративный пример 43.
К смеси метилового эфира иодида 3-(2-триметиламмониометилпиррол-1-ил)бензойной кислоты (2 г) и 1,3-диметилимидазолидин-2-она (6 мл) добавляют комплекс боран-пиридин (1,1 мл) и смесь перемешивают 1,5 часа при 105oC. После добавления к смеси дихлорметана ее последовательно промывают водой, 1 н. соляной кислотой и водой. Смесь сушат над сульфатом магния и после испарения в вакууме получают в виде масла метиловый эфир 3-(2-метилпиррол-1-ил)бензойной кислоты (1,01 г).
ИК (ньюджол): 1725, 1588 см-1.
ЯМР (ДМСО-d6) δ: 2,18 (3H, с), 3,89 (3H, с), 6 - 6,04 (1H, м), 6,09 - 6,15 (1H, м), 6,89 - 6,94 (1H, м), 7,55 - 8,1 (4H, м).
МАСС (m/z): 216 (M+ + 1).
Препаративный пример 44.
К смеси метилового эфира 3-(2-трихлорацетилпиррол-1-ил)бензойной кислоты (1 г) и N,N-диметилформамида (2 мл) добавляют 28%-ый водный раствор аммиака (0,4 мл) и смесь перемешивают 1,5 часа при комнатной температуре. Затем смесь переносят в водный этилацетат. Отделенный органический слой промывают водой, сушат над сульфатом магния и испаряют в вакууме. Ополаскиванием остатка диизопропиловым эфиром получают метиловый эфир 3-(2-карбамоилпиррол-1-ил)бензойной кислоты (0,61 г).
Т.пл. 157 - 158oC.
ИК (ньюджол): 3400, 3200, 1715, 1650, 1610 см-1.
ЯМР (ДМСО-d6) δ: 3,87 (3H, c), 6,22 - 6,29 (1H, м), 6,9 - 6,98 (2H, м), 7,09 - 7,14 (1H, м), 7,53 - 7,6 (2H, м), 7,63 (1H, c), 7,76 (1H, c), 7,87 - 7,96 (1H, м).
Препаративный пример 45.
К смеси метилового эфира 3-(2-бензилоксикарбонилпиррол-1-ил)бензойной кислоты (0,5 г) и диоксана (20 мл) добавляют 1 н. раствор гидроксида натрия (1,5 мл) и смесь перемешивают 3 дня при комнатной температуре. Затем смесь переносят в водный этилацетат и добавлением 1 н. соляной кислоты в отделенном органическом слое устанавливают pH 1. Смесь экстрагируют этилацетатом, экстракт промывают водой и сушат над сульфатом магния. Растворитель удаляют концентрированием и ополаскиванием остатка н-гексаном получают 3-(2-бензилоксикарбонил)бензойную кислоту (0,24 г).
Т.пл. 161-165oC.
ИК (ньюджол): 1710 см-1.
ЯМР (ДМСО-d6) δ: 5,13 (2H, с), 6,36 (1H, дд, J = 2,8 Гц, 3,9 Гц), 7,13 (1H, дд, J = 1,7 Гц, 3,9 Гц), 7,21 - 7,37 (6H, м), 7,5 - 7,66 (2H, м), 7,78 - 7,83 (1H, м), 7,92 - 8 (1H, м), 13,1 (1H, м).
Препаративный пример 46.
По методике, аналогичной методике препаративного примера 45, получены следующие соединения:
(1) 3-(3-Цианопиррол-1-ил)бензойная кислота
Т.пл. 194-196oC.
ИК (ньюджол): 2230, 1695, 1590 см-1.
ЯМР (ДМСО-d6) δ: 6,76 (1H, дд, J = 1,6 Гц, 3,1 Гц), 7,6 - 7,72 (2H, м), 7,87 - 7,98 (2H, м), 8,08 - 8,14 (1H, м), 8,31 - 8,37 (1H, м),
(2) 3-(2-Цианопиррол-1-ил)бензойная кислота
Т.пл. 195-196oC.
ИК (ньюджол): 2220, 1690-1705 (ш.), 1590 см-1.
ЯМР (ДМСО-d6) δ: 6,48 (1H, дд, J = 2,8 Гц, 3,9 Гц), 7,27 (1H, дд, J = 1,6 Гц, 3,9 Гц), 7,64 (1H, дд, J = 1,6 Гц, 2,8 Гц), 7,73 (1H, дд, J = 8,1 Гц, 8,1 Гц), 7,81 - 7,89 (1H, м), 8,02 - 8,09 (2H, м).
МАСС (m/z): 221 (M+ - 1).
(3) 5-Циано-3-(пиррол-1-ил)бензойная кислота
Т.пл. 181-184oC.
ИК (ньюджол): 2230, 1700, 1600 см-1.
ЯМР (ДМСО-d6) δ: 6,31 - 6,37 (2H, м), 7,55 - 7,62 (2H, м), 8,11 (1H, дд, J = 1,4 Гц, 1,4 Гц), 8,31 (1H, дд, J = 1,4 Гц, 2,3 Гц), 8,42 (1H, дд, J = 1,4 Гц, 2,3 Гц).
Препаративный пример 47.
К охлаждаемой льдом смеси метилового эфира 3-(пиррол-1-ил)бензойной кислоты (2 г) и N,N-диметилформамида (20 мл) добавляют N-хлорсукцинимид (2,7 г) и смесь перемешивают 20 часов при комнатной температуре. Затем реакционную смесь переносят в смесь этилацетата с водой и добавлением карбоната калия в смеси устанавливают pH 8. Отделенный органический слой промывают водой, сушат над сульфатом магния и после испарения в вакууме получают метиловый эфир 3-(2,5-дихлорпиррол-1-ил)бензойная кислота (2,44 г) в виде масла.
ИК (пленка): 1725, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,9 (3H, с), 6,4 (2H, c), 7,66 - 7,88 (3H, м), 8,09 - 8,18 (1H, м).
МАСС (m/z): 270 (M+ + 1).
Препаративный пример 48.
К охлаждаемому льдом N,N-диметилформамиду (4,6 мл) прибавляют по каплям фосфорилхлорид (5,5 мл) и смесь перемешивают 15 минут при 40-50oC. К смеси добавляют при комнатной температуре раствор метилового эфира 3-(пиррол-1-ил)бензойной кислоты (6 г) в N,N-диметилформамиде (30 мл) и все перемешивают 3 часа при 110-120oC. Охлажденную льдом смесь переносят в ледяную воду и добавлением карбоната калия в смеси устанавливают pH 9. Затем смесь экстрагируют этилацетатом. Экстракт промывают рассолом, сушат над сульфатом магния и испаряют в вакууме. Ополаскиванием остатка диизопропиловым эфиром получают метиловый эфир 3-(2-формилпиррол-1-ил)бензойной кислоты (5,31 г).
Т.пл. 61-64oC.
ИК (ньюджол): 1720, 1660, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 6,5 (1H, дд, J = 2,6 Гц, 3,9 Гц), 7,28 (1H, дд, J = 1,7 Гц, 3,9 Гц), 7,5 - 7,55 (1H, м), 7,65 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,69 - 7,77 (1H, м), 7,88 - 7,92 (1H, м), 7,97 - 8,05 (1H, м), 9,54 (1H, с).
Препаративный пример 49.
Смесь метилового эфира 4-гидрокси-3-(пиррол-1-ил)бензойной кислоты (4 г), ацетона (40 мл) и п-толуолсульфокислоты (0,8 г) в толуоле кипятят с перемешиванием 15 часов. После удаления растворителя испарения к остатку добавляют смесь этилацетата с водой. Добавлением карбоната калия в смеси устанавливают pH 8 и отделенный органический слой промывают рассолом, сушат над сульфатом магния и испаряют в вакууме. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью толуола с н-гексаном (1:1, об./об.). Элюируемые фракции, содержащие целевой продукт, собирают и испаряют в вакууме. Ополаскиванием остатка смесью диизопропилового эфира с н-гексаном получают 8-метоксикарбонил-4,4-диметил-4Н-пирроло/2,1-с//1,4/бензоксазин.
Т.пл. 128-129oC.
ИК (ньюджол): 1715 см-1.
ЯМР (ДМСО-d6) δ: 1,58 (6H, с), 3,86 (3H, с), 6,1 - 6,17 (1H, м), 6,26 - 6,34 (1H, м), 7,14 (1H, д, J = 8,4 Гц), 7,59 - 7,65 (1H, м), 7,71 (1H, дд, J = 1,9 Гц, 8,4 Гц), 8,16 (1H, д, J = 1,9 Гц).
МАСС (m/z): 258 (M+ + 1).
Препаративный пример 50.
К смеси хлористого алюминия (2,7 г), и 1,2-дихлорэтана (10 мл) при охлаждении льдом добавляют уксусный ангидрид (1,3 мл) и смесь перемешивают 20 минут при той же температуре. К смеси при 0-5oC прибавляют по каплям в течение 10 минут смесь метилового эфира 3-(пиррол-1-ил)бензойной кислоты (2 г) и дихлорэтана (3 мл) и смесь перемешивают 3 часа при той же температуре. Реакционную смесь переносят в ледяную воду и экстрагируют хлороформом. Экстракт промывают насыщенным раствором бикарбоната натрия в воде и водой. Органический слой сушат над сульфатом магния и после испарения в вакууме получают метиловый эфир 3-(2-ацетилпиррол-1-ил)бензойной кислоты (0,94 г).
Т.пл. 86-87oC.
ИК (ньюджол): 1720, 1645 см-1.
ЯМР (ДМСО-d6) δ: 2,42 (3H, с), 3,91 (3H, с), 6,64 - 6,7 (1H, м), 7,52 - 7,58 (1H, м), 7,68 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,92 (1H, д, J = 7,9 Гц), 7,96 - 8,04 (1H, м), 8,15 - 8,19 (1H, м), 8,31 - 8,35 (1H, м).
МАСС (m/z): 244 (M+ + 1).
Препаративный пример 51.
К смеси метилового эфира 3-(пиррол-1-ил)бензойной кислоты (14 г) и пиридина (16,9 мл) в 1,2-дихлорэтане (70 мл) при охлаждении льдом добавляют трихлорацетилхлорид (15,5 мл) и смесь перемешивают 7 дней при комнатной температуре. Смесь переносят в хлороформ с водой и добавляют с водой и добавлением 6 н. соляной кислоты в смеси устанавливают pH 1. Отделенный органический слой промывают насыщенным водным раствором бикарбоната натрия и водой. Смесь сушат над сульфатом магния и испаряют в вакууме. Ополаскиванием остатка диизопропиловым эфиром получают метиловый эфир 3-(2-трихлорацетилпиррол-1-ил)бензойной кислоты (21,23 г).
Т.пл. 94-95oC.
ИК (ньюджол): 1725, 1670, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 6,56 (1H, дд, J = 2,6 Гц, 4,3 Гц), 7,6-7,71 (4H, м), 7,82 (1H, c), 8,01 - 8,1 (1H, м).
МАСС (m/z): 346 (M+ + 1).
Препаративный пример 52.
К раствору 5-(пиррол-1-ил)-3-метоксикарбонилбензойной кислоты (9,37 г) в тетрагидрофуране (100 мл) в атмосфере азота и при температуре от -40 до 30oC добавляют триэтиламин (6,4 мл) с последующим прибавлением изобутилхлорформата (5,9 мл). Затем реакционную смесь перемешивают 45 минут при температуре ниже -20oC. После этого гидрохлорид триэтиламина отфильтровывают и промывают холодным тетрагидрофураном, а фильтрат возможно быстрее прибавляют к интенсивно перемешиваемой суспензии боргидрида натрия (4,35 г) в смеси тетрагидрофуран-вода (8: 1, 80 мл). Перемешивание продолжают 5 часов при комнатной температуре, после чего раствор подкисляют до pH 5. Тетрагидрофуран удаляют при пониженном давлении и продукт экстрагируют этилацетатом. Этилацетатные экстракты промывают водой и рассолом, сушат над сульфатом магния и испаряют при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью хлороформметанол (30:1). Элюируемые фракции, содержащие целевой продукт, собирают и их испарением в вакууме получают метиловый эфир 3-гидроксиметил-5-(пиррол-1-ил)бензойной кислоты (7,33 г).
Т.пл. 83-85oC.
ИК (ньюджол): 3200, 1710, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, c), 4,63 (2H, д, J = 5,8 Гц), 5,47 (1H, т, J = 5,8 Гц), 6,2 - 6,4 (2H, м), 7,3 - 7,5 (2H, м), 7,7 - 7,8 (3H, м).
МАСС (m/z): 232 (M+ + 1).
Препаративный пример 53.
К раствору метилового эфира 3-гидроксиметил-5-(пиррол-1-ил)бензойной кислоты (2 г) в хлороформе (30 мл) добавляют оксид серебра (1) (8 г) и иодметан (4,3 мл) и реакционную смесь перемешивают 4,5 часа при 50oC. После охлаждения до комнатной температуры взвесь фильтруют и фильтрат испаряют в вакууме. Остаток очищают колоночной хроматографией на силикагеле с элюированием смесью гексана с этилацетатом (10:1). Элюируемые фракции, содержащие целевой продукт, собирают и испарением в вакууме получают в виде масла метиловый эфир 3-метоксиметил-5-(пиррол-1-ил)бензойной кислоты (1,72 г).
ИК (пленка): 2950, 1720, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,35 (3H, с), 3,9 (3H, с), 4,54 (2H, с), 6,3 - 6,4 (2H, м), 7,4 - 7,5 (2H, м), 7,8 - 8 (3H, м).
МАСС (m/z): 246 (M+ + 1).
Препаративный пример 54.
К раствору метилового эфира 3-гидроксиметил-5-(пиррол-1-ил)бензойной кислоты (4 г) в пиридине (40 мл) при охлаждении льдом добавляют уксусный ангидрид (4,9 мл). После перемешивания 3 часа при охлаждении льдом реакционную смесь переносят в ледяную воду и экстрагируют диэтиловым эфиром. Эфирные экстракты промывают водой, 1 н. соляной кислотой и рассолом, и сушат над сульфатом магния. Растворитель испаряют в вакууме и остаток очищают колоночной хроматографией с элюированием смесью гексан-этилацетат (5:1). Элюируемые фракции, содержащие целевой продукт, собирают и их испарением в вакууме получают метиловый эфир 3-ацетоксиметил-5-(пиррол-1-ил)бензойной кислоты (4,68 г).
Т.пл. 68-70oC.
ИК (ньюджол): 1740, 1720, 1620, 1600 см-1.
ЯМР (ДМСО-d6) δ: 2,11 (3H, c), 3,9 (3H, c), 5,19 (2H, c), 6,3 - 6,4 (2H, м), 7,4 - 7,5 (2H, м), 7,8 - 8 (3H, м).
МАСС (m/z): 274 (M+ + 1).
Препаративный пример 55.
По методике, приведенной в препаративных примерах 37 и 38, получены следующие соединения:
(1) Метиловый эфир 3-(2-цианопиррол-1-ил)бензойной кислоты.
Т.пл. 89-90oC.
ИК (ньюджол): 2220, 1715, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 6,49 (1H, дд, J = 2,8 Гц, 3,9 Гц), 7,28 (1H, дд, J = 1,6 Гц, 3,9 Гц), 7,65 (1H, дд, J = 1,6 Гц, 2,8 Гц), 7,76 (1H, дд, J = 8 Гц, 8 Гц), 7,85 - 7,92 (1H, м), 8.04 - 8,1 (2H, м).
МАСС (m/z): 227 (M+ + 1).
(2) Метиловый эфир 3-(2-циано-5-метилпиррол-1-ил)бензойной кислоты
Т.пл. 82-84oC.
ИК (ньюджол): 2220, 1715 см-1.
ЯМР (ДМСО-d6)  2,12 (3H, с), 3,9 (3H, с), 6,21 (1H, д, J = 3,9 Гц), 7,11 (1H, д, J = 3,9 Гц), 7,7 - 7,84 (2H, м), 7,92 - 7,96 (1H, м), 8,09 - 8,17 (1H, м).
2,12 (3H, с), 3,9 (3H, с), 6,21 (1H, д, J = 3,9 Гц), 7,11 (1H, д, J = 3,9 Гц), 7,7 - 7,84 (2H, м), 7,92 - 7,96 (1H, м), 8,09 - 8,17 (1H, м).
МАСС (m/z): 241 (M+ + 1).
(3) Метиловый эфир 4-н-бутил-3-(2-цианопиррол-1-ил)бензойной кислоты
ИК (пленка): 2230, 1725 см-1.
ЯМР (ДМСО-d6) δ: 0,76 (3H, т, J = 7,2 Гц), 1,04 - 1,27 (2H, м), 1,27 - 1,47 (2H, м), 2,37 - 2,55 (2H, м), 3,88 (3H, с), 6,47 (1H, дд, J = 2,7 Гц, 4 Гц), 7,22 (1H, дд, J = 1,6 Гц, 4 Гц), 7,43 (1H, дд, J = 1,6 Гц, 2,7 Гц), 7,66 (1H, д, J = 8,1 Гц), 7,84 (1H, д, J = 1,8 Гц), 8,07 (1H, дд, J = 1,8 Гц, 8,1 Гц).
(4) Диметиловый эфир 5-(2-цианопиррол-1-ил)бензойной кислоты
Т.пл. 208oC.
ИК (ньюджол): 2220, 1727 см-1.
ЯМР (ДМСО-d6) δ: 3,94 (6H, с), 6,48 - 6,54 (1H, м), 7,29 - 7,33 (1H, м), 7,72 - 7,76 (1H, м), 8,33 (2H, с), 8,53 (1H, с).
Препаративный пример 56.
Смесь диметилового эфира 5-(пиррол-1-ил)изофталевой кислоты (80 г) и гидроксида калия (20,2 г) в метаноле (3,1 л) перемешивают 62 часа при 68oC. После охлаждения до комнатной температуры растворитель испаряют в вакууме. Остаток растворяют в воде и раствор промывают этилацетатом. Водный слой подкисляют соляной кислотой (25,5 мл) и экстрагируют этилацетатом. Органический слой промывают рассолом и сушат над сульфатом магния. Растворитель испаряют в вакууме и ополаскиванием остатка диэтиловым эфиром получают 3-метоксикарбонил-5-(пиррол-1-ил)бензойную кислоту (53,7 г).
Т.пл. 178 - 179oC.
ИК (ньюджол): 3050, 1720, 1680 см-1.
ЯМР (ДМСО-d6) δ: 3,93 (3H, с), 6,3 - 6,4 (2H, м), 7,5 - 7,6 (2H, м), 8,2 - 8,4 (3H, м), 13,6 (1H, ш.с).
МАСС (m/z): 244 (M+ + 1).
Препаративный пример 57.
Смесь диметилового эфира 5-(пиррол-1-ил)изофталевой кислоты (1 г) и 4-(2-аминометил)морфолина (0,65 г) нагревают 2 часа при 120oC. Остаток очищают колоночной хроматографией на силикагеле (50 г) с применением в качестве элюента смеси хлороформ-метанол (30:1). Содержащие целевой продукт фракции объединяют и испаряют в вакууме. Перекристаллизацией кристаллического остатка из смеси этанол-эфир получен N-[2-(морфолин-4-ил)этил]-3-метоксикарбонил-5-(пиррол-1-ил)бензамид (353 мг).
Т.пл. 144 - 146oC.
ИК (ньюджол): 3250, 1725, 1635, 1250, 720 см-1.
ЯМР (ДМСО-d6) δ: 2,3 - 2,6 (6H, м), 3,35 - 3,55 (2H, м), 3,55 - 3,7 (4H, м), 3,93 (3H, м), 6,3 - 6,4 (2H, м), 7,45 - 7,55 (2H, м), 8,15 - 8,27 (3H, м), 8,76 (1H, т, J = 5,6 Гц).
МАСС (m/z): 358 (M+1).
Препаративный пример 58.
По методике, аналогичной методике препаративного примера 57, получено следующее соединение:
N-[3-(морфолин-4-ил)пропил]-3-метоксикарбонил-5-(пиррол-1-ил)-бензамид
Т.пл. 126-127oC.
ИК (ньюджол): 3250, 1730, 1635, 1250, 720 см-1.
ЯМР (ДМСО-d6) δ: 1,6 - 1,8 (2H, м), 2,3 - 2,4 (6H, м), 3,3 - 3,4 (2H, м), 3,5 - 3,6 (4H, м), 3,93 (3H, м), 6,32 - 6,35 (2H, м), 7,49 - 7,52 (2H, м), 8,15 - 8,17 (1H, м), 8,23 - 8,28 (2H, м), 8,79 (1H, т, J = 5,4 Гц).
МАСС (m/z): 372 (M+1).
Препаративный пример 59.
По методикам, аналогичным методикам препаративных примеров 5 и 17, получены следующие соединения:
(1) Метиловый эфир 2-метокси-5-(пиррол-1-ил)бензойной кислоты
Т.пл. 96 - 98oC.
ИК (ньюджол): 1730 см-1.
ЯМР (ДМСО-d6) δ: 3,82 (3H, с), 3,85 (3H, с), 6,2 - 6,28 (2H, м), 7,23 (1H, д, J = 9,1 Гц), 7,26 - 7,33 (2H, м), 7,67 - 7,78 (2H, м).
(+) APCI МАСС (m/z): 232/М+H/+.
Элементный анализ для C13H13NO3
Вычислено: C 67,52, H 5,67, N 6,06
Найдено: C 67,45, H 5,75, N 6,04
(2) Метиловый эфир 2-гидрокси-5-(пиррол-1-ил)бензойной кислоты
Т.пл. 80-81oC.
ИК (ньюджол): 3170, 1670, 1617 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 6,21 - 6,27 (2H, м), 7,09 (1H, д, J = 8,8 Гц), 7,23 - 7,29 (2H, м), 7,73 (1H, дд, J = 2,8 Гц), 8,8 Гц), 7,81 (1H, д, J = 2,8 Гц), 10,4 (1H, с).
(+) APCI МАСС (m/z): 218 /M+H/+.
Элементный анализ для C12H11NO3
Вычислено: C 66,35, H 5,10, N 6,45
Найдено: C 66,63, H 5,16, N 6,45
(3) Метиловый эфир 2-нитро-5-(пиррол-1-ил) бензойной кислоты
Т.пл. 86 - 87oC.
ИК (ньюджол): 1727, 1585, 1325 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 6,36 - 6,42 (2H, м), 7,61 - 7,7 (2H, м), 8,01 (1H, дд, J = 2,6 Гц, 8,9 Гц), 8,06 (1H, д, J = 2,6 Гц), 8,23 (1H, д, J = 8,9 Гц).
Элементный анализ для C12H10N2O4
Вычислено: C 58,54, H 4,09, N 11,38
Найдено: C 58,66, H 3,90, N 11,21
(4) Метиловый эфир 5-(пиррол-1-ил)-3-сульфамоилбензойной кислоты
Т.пл. 178-179oC.
ИК (ньюджол): 3310, 3220, 1702, 1605, 1350, 1168 см-1.
ЯМР (ДМСО-d6) δ: 3,94 (3H, с), 6,34 - 6,39 (2H, м), 7,48 - 7,54 (2H, м), 7,6 (2H, c), 8,17 - 8,28 (3H, с).
(5) Диметиловый эфир 2-(пиррол-1-ил)терефталевой кислоты
Т.пл. 55-57oC.
ИК (ньюджол): 1715 (ш.) см-1.
ЯМР (ДМСО-d6) δ: 3,69 (3H, с), 3,91 (3H, с), 6,23 - 6,29 (2H, м), 6,95 - 7,01 (2H, м), 7,88 (1H, д, J = 8,1 Гц), 7,91 (1H, д, J = 1,6 Гц), 8.01 (1H, дд, J = 1,6 Гц, 8,1 Гц).
Элементный анализ для C14H14NO4
Вычислено: C 64,86, H 5,05, N 5,40
Найдено: C 64,57, H 5,15, N 5,38
(6) Метиловый эфир 4-ацетиламинометил-3-(пиррол-1-ил)-бензойной кислоты
Т.пл. 135-137oC.
ИК (ньюджол): 3280 (ш.), 1730, 1630 см-1.
ЯМР (ДМСО-d6) δ: 1,88 (3H, с), 3,86 (3H, с), 4,17 (2H, д, J=5,8 Гц) 6,24 - 6,03 (2H, м), 7-7,06 (2H, м), 7,55 (1H,д, J = 8,2 Гц), 7,75 (1H, д, J = 1,7 Гц), 7,97 (1H, дд, J = 1,7 Гц,8.2 Гц), 8,38 (1H, J = 5,8 Гц).
Элементный анализ для C15H16N2O3
Вычислено: C 66,16, H 5,92, N 10,29
Найдено: C 66,35, H 5,05, N 9,95
(7) Метиловый эфир 2-(пиррол-1-ил) изоникотиновой кислоты
Т.пл. 51-53oC.
Ик (ньюждол): 1724, 1605 см-1
ЯМР (ДМСО-d6) δ: 3.94 (6.31 - 6,37 (3H, с), 7,65 (1H, д, J = 5 Гц), 7,74 - 7,8 (2H, м), 8,04 (1H, м), 8,62 (1H, д, J = 5 Гц).
Элементный анализ для C11H10N2O2
Вычислено: C 65,34, H 4,98, N 13,85
Найдено: C 65,24, H 4,74, N 13,59
(8) Метиловый эфир 4-(пиррол-1-ил) -2-карбоновой кислоты
Т.пл. 109-111oC.
ИК (ньюждол): 3100, 1715, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,92 (3H, с), 6,36 - 6,41 (2H, м), 7,68 -7,74 (2H, м), 7,92 (1H, дд, J = 2,4 Гц, 5,5 Гц), 8,21 (1H, д, J = 2,4 Гц), 8,69 (1H, д, J = 5,5 Гц).
(+) APCI МАСС (m/z: 203 /M+H/+.
(9) Метиловый эфир 2-гидрокси-3-(пиррол-1-ил)бензойной кислоты
Т.пл. 41-42oC.
ИК (ньюджол): 1683 см-1.
ЯМР (ДМСО-d6) δ: 3,93 (3H, с), 6,19 - 6,26 (2H, м), 7,05 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,08 - 7,17 (2H, м), 7,64 (1H, дд, J = 1,7 Гц, 7,9 Гц), 7,79 (1H, дд, J = 1,7 Гц, 7,9 Гц), 11,17 (1H, с).
(10) Метиловый эфир 4-гидроксиметил-3-(пиррол-1-ил)-бензойной кислоты
ИК (пленка): 3420, 1720, 1575 см-1.
ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 4,44 (2H, д, J = 5,4 Гц), 5,48 (1H, т, J = 5,4 Гц), 6,23 - 6,29 (2H, м), 7-7,06 (2H, м), 7,75 (1H, д, J = 1,7 Гц), 7,78 ( 1H, д, J = 8,1 Гц), 8 (1H, дд, J = 1,7 Гц, 8,1 Гц).
Препаративный пример 60.
По методике, аналогичной методике препаративного примера 34, получены каждые два следующие стереоизомеры:
(1) (A) Метиловый эфир 3-2-(E)-гидроксииминоэтил)пиррол-1-ил бензойной кислоты
Т.пл. 121-122oC.
ИК (ньюджол): 1717 см-.
ЯМР (ДМСО-d6) δ: 2,1 (3H, с), 3,9 (3H, с), 6,54 (1H, дд, J = 1,6 Гц, 3 Гц), 7,44 - 7,49 (1H, м), 7,63 (1H, дд, J = 7,9 Гц 7,9 Гц), 7,76 - 7,8 (1H, м), 7,84 (1H, д, J = 7,9 Гц), 7,89 - 7,93 (1H, м), 8,09 (1H, д, 1,6 Гц), 10,61 (1H, с).
Элементный анализ для C14H14N2O3
Вычислено: C 65,11, H 5,46, N 10,85
Найдено: C 65,26, H 5,54, N 10,78
(1) (b) Метиловый эфир 3-[2-(Z)-гидроксииминоэтил)пиррол-1-ил] бензойной кислоты
Т.пл. 120-122oC.
ИК (ньюджол): 1717 см-1.
ЯМР (ДМСО-d6) δ: 2,12 (3H, с), 3,9 (3H, с), 6,75 - 6,79 (1H, м), 7,46 - 7,51 (1H, м), 7,64 (1H, дд, J = 7,9 Гц 7,9 Гц), 7,84 - 7,97 (2H, м), 8,03 - 8,09 (2H, м), 10,73 (1H, с).
Элементный анализ для C14H14N2O3
Вычислено: C 65,11, H 5,46, N 10,85
Найдено: C 64,72, H 5,17, N 10,59
(2) (A) Метиловый эфир 3-(E)-2-метоксииминометилпиррол-1-ил)бензойной кислоты
ИК (пленка): 1728 см-1.
ЯМР (ДМСО-d6) δ: 3,69 (3H, с), 3,89 (3H, с), 6,31 - 6,37 (1H, м), 6,68 - 6,74 (1H, м), 7,2 - 7,25 (1H, м), 7,64 - 7,7 (2H, м), 7,82 - 7,87 (1H, м), 7,89 (1H, с), 7,95 - 8,04 (1H, м).
(+) APCI MACC (m/z): 259 /M + H/+.
(2) (B) Метиловый эфир 3-[(Z)-2-метоксииминометилпиррол-1-ил)бензойной кислоты
ИК (пленка): 1720, 1605 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 3,92 (3H, с), 6,36 - 6,42 (1H, м), 7,05 (1H, с), 7,18 - 7,27 (1H, м), 7,67 - 7,72 (2H, м), 7,81 - 7,86 (1H, м), 8,01 - 8,08 (1H, м).
(+) APCI MACC (m/z): 259 /M + H/+.
Препаративный пример 61.
Раствор метилового эфира 3-(2-формилпиррол-1-ил)бензойной кислоты (1 г) и бензил(трифенилфосфоранилиден)ацетата (1,8 г) в тетрагидрофуране (10 мл) кипятят 30 часов. После испарения растворителя остаток очищают колоночной хроматографией на силикагеле с элюированием толуолом. Содержащие целевой продукт фракции собирают и их испарением в вакууме получают в виде масла метиловый эфир 3-[2-((E)-2-бензилоксикарбониэтенил)пиррол-1-ил)] бензойной кислоты (0,77 г).
ИК (пленка): 1700 - 1725 (ш.), 1620 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 5,13 (2H, с), 6,3 (1H, д, J = 15,7 Гц), 6,38 - 6,44 (1H, м), 7,09 - 7,28 (3H, м), 7,34 (5H, с), 7,65 - 7,8 (2H, м), 7,84 - 7,88 (1H, м), 8,04 - 8,12 (1H, м).
Препаративный пример 62.
К раствору метилового эфира 3-[2-((E)-2-бензилоксикарбонилэтенил)пиррол-1-ил)] бензойной кислоты (2,5 г) в метаноле (50 мл) добавляют 10%-ый палладий на угле (0,25 г) и смесь подвергают каталитическому восстановлению при комнатной температуре и атмосферном давлении. Катализатор удаляют фильтрованием и фильтрат испаряют в вакууме. Ополаскиванием остатка диизопропиловым эфиром получают метиловый эфир 3-2-(2-карбоксиэтил)пиррол-1-ил]бензойной кислоты (1,02 г).
Т.пл. 126-128oC.
ИК (ньюджол): 1728, 1703 см-1.
ЯМР (ДМСО-d6) δ: 2,45 (2H, т, J = 7 Гц), 2,73 (2H, т, J = 7 Гц), 3,88 (3H, с), 6 - 6,07 (1H, м), 6,11 - 6,17 (1H, м), 6,67 - 6,92 (1H, м), 7,62 - 7,73 (2H, м), 7,84 (1H, с), 7,95 - 8,02 (1H, м).
Препаративный пример 63.
К раствору метилового эфира 4-бензилоксикарбонилметокси-3-\ (пиррол-1-ил)бензойной кислоты (5 г) в метаноле (50 мл) и тетрагидрофуране (20 мл) добавляют 10%-ый палладий на угле (0,5 г) и смесь подвергают каталитическому восстановлению при комнатной температуре и атмосферном давлении. Катализатор удаляют фильтрованием и фильтрат испаряют в вакууме. К остатку добавляют смесь этилацетата с водой и добавлением карбоната калия в смеси устанавливают pH 8. В отделенном водном слое добавлением 6 н. соляной кислоты устанавливают pH 2 и смесь экстрагируют этилацетатом. Слой экстракта промывают рассолом, сушат над сульфатом магния и после испарения в вакууме получают метиловый эфир 4-карбоксиметокси-3-(пиррол-1-ил)бензойной кислоты (2,26 г).
Т.пл. 98-102oC.
ИК (ньюджол): 1715, 1605 см-1.
ЯМР (ДМСО-d6) δ: 3,84 (3H, с), 4,92 (2H, с), 6,2 - 6,26 (2H, м), 7,16 - 7,21 (2H, м), 7,26 (1H, д, J = 8,6 Гц), 7,83 (1H, д, J = 2 Гц), 7,88 (1H, дд, J = 2 Гц, 8,6 Гц), 13,21 (1H, с).
Препаративный пример 64.
По методике, аналогичной методике препаративного примера 4, получено следующее соединение:
Метиловый эфир 5-амино-3-сульфамоилбезойной кислоты
Т.пл. 163-165oC.
ИК (ньюджол): 3480, 3380, 3280, 3220, 1700, 1330, 1165 см-1.
ЯМР (ДМСО-d6) δ: 3,85 (3H, с), 5,89 (2H, с), 7,2 - 7,25 (1H, м), 7,3 - 7,37 (3H, м), 7,5 - 7,55 (1H, м).
Препаративный пример 65.
Смесь метилового эфира 5-циано-3-(пиррол-1-ил)бензойной кислоты (3 г), азида натрия (5,2 г) и хлорида аммония (4,3 г) в N,N-диметилформамиде (12 мл) перемешивают 4 часа при 120-125o. Смесь переносят в ледяную воду (100 мл) и к смеси добавляют нитрит натрия (5,5 г). Добавлением 6 н. соляной кислоты в смеси устанавливают pH 1 и смесь перемешивают 30 минут. Затем смесь экстрагируют этилацетатом. Слой экстракта промывают рассолом и сушат над сульфатом магния. Растворитель удаляют концентрированием и ополаскиванием остатка диизопропиловым эфиром получают метиловый эфир 3-(пиррол-1-ил)-5-(1H-тетразол-5-ил)бензойной кислоты (3,35 г).
Т.пл. 217-218oC.
ИК (ньюджол): 1720, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,95 (3H, с), 6,35 - 6,4 (2H, м), 7,51 - 7,56 (2H, м), 8,16 - 8,22 (1H, м), 8,4 - 8,48 (2H, м).
Препаративный пример 66.
По методике, аналогичной методике препаративного примера 65, получено следующее соединение:
Метиловый эфир 3-(1H-тетразол-5-ил)бензойной кислоты
Т.пл. 178-179oC.
ИК (ньюджол): 3159, 1692 см-1.
ЯМР (ДМСО-d6) δ: 3,93 (3H, с), 7,78 (1H, дд, J = 7,8 Гц, 7,8 Гц), 8,11 - 8,2 (1H, м), 8,28 - 8,38 (1H, м), 8,65 (1H, дд, J = 1,5 Гц, 1,5 Гц),
(-) APCI MACC (m/z): 203 /M-H/-.
Элементный анализ для C9H8N4O2
Вычислено: C 52,94, H 3,95, N 27,44
Найдено: C 52,61, H 3,81, N 27,49
Препаративный пример 67.
Смесь метилового эфира 4-гидрокси-3-(пиррол-1-ил)бензойной кислоты (1,5 г), 2-оксо-1,3-диоксолана (0,61 г) и тетраэтиламмонийиодида (0,38 г) нагревают 3 часа при 140oC. Полученную смесь растворяют в растворе этилацетата в тетрагидрофуране. Раствор промывают водой и сушат над сульфатом магния. Испарением растворителя получают остаток, который очищают колоночной хроматографией на силикагеле с элюированием смесью хлороформ-этилацетат (9:1, об. /об.). Элюируемые фракции, содержащие целевой продукт, собирают и испарением в вакууме получают в виде масла метиловый эфир 4-(2-гидроксиэтокси)-3-(пиррол-1-ил)бензойной кислоты (1,25 г).
ИК (ньюджол): 3420, 1710, 1607 см-1.
ЯМР (ДМСО-d6) δ: 3,67 - 3,8 (2H, м), 3,84 (3H, с), 4,19 (2H, т, J = 4,8 Гц), 4,92 (1H, т, J = 5,2 Гц), 6,18 - 6,25 (2H, м), 7,18 - 7,25 (2H, м), 7,34 (1H, д, J = 8,7 Гц), 7,82 (1H, д, J = 2,1 Гц), 7,88 (1H, дд, J = 2,1 Гц, 8,7 Гц).
(+) APCI MACC (m/z): 262 /M+H/+.
Препаративный пример 68.
По методике, аналогичной методике препаративного примера 67, получено следующее соединение:
Метиловый эфир 3-(2-гидроксиэтокси)-5-фенилбензойной кислоты
ИК (чистый): 3400, 1800, 1710, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,74 - 3,8 (2H, м), 3,89 (3H, с), 3,97 - 4,14 (2H, м), 4,9 - 4,96 (1H, м), 7,46 - 7,78 (8H, м).
(+) APCI MACC (m/z): 273 /M+H/+.
Препаративный пример 69.
К смеси метилового эфира 4-гидрокси-3-(пиррол-1-ил)бензойной кислоты (5 г) и трет-бутоксида калия (2,7 г) в N,N-диметилформамиде (40 мл) при охлаждении льдом добавляют бензилбромид (2,9 мл) и смесь перемешивают 5 часов при комнатной температуре. Затем реакционную смесь переносят в воду и экстрагируют этилацетатом. Слой экстракта промывают рассолом и сушат над сульфатом магния. Растворитель удаляют концентрированием. Остаток кристаллизуют из смеси толуола с диизопропиловым эфиром с получением метилового эфира 4-бензилокси-3-(пиррол-1-ил)бензойной кислоты (4,2 г).
Т.пл. 103-104oC.
ИК (ньюджол): 1710, 1605 см-1.
ЯМР (ДМСО-d6) δ: 3,84 (3H, с), 5,28 (2H, с), 6,18 - 6,24 (2H, м), 7,08 - 7,15 (2H, м), 7,3 - 7,45 (6H, м), 7,83 (1H, д, J = 2,1 Гц), 7,92 (1H, дд, J = 2,1 Гц, 8,6 Гц).
Препаративный пример 70.
По методике, аналогичной методике препаративного примера 69, получены следующие соединения:
(1) Метиловый эфир 4-метокси-3-(пиррол-1-ил)бензойной кислоты
Т.пл. 74-75oC.
ИК (ньюджол): 1712, 1698, 1605 см-1.
ЯМР (ДМСО-d6) δ: 3,86 (3H, с), 3,9 (3H, с), 6,19 - 6,25 (2H, м), 7,05 - 7,1 (2H, м), 7,34 (1H, д, J = 8,7 Гц), 7,8 (1H, д, J = 2,1 Гц), 7,94 (1H, дд, J = 2,1 Гц, 8,7 Гц).
Элементный анализ для C13H13NO3
Вычислено: C 67,52, H 5,67, N 6,04
Найдено: C 67,68, H 5,82, N 6,05
(2) Метиловый эфир 4-бензилоксикарбонилметокси-3-(пиррол-1- ил)бензойной кислоты
ИК (ньюджол): 1720 (ш.), 1605 см-1.
ЯМР (ДМСО-d6) δ: 3,85 (2H, с), 5,1 (2H, с), 6,18 - 6,24 (2H, м), 7,14 - 7,2 (2H, м), 7,3 (1H, д, J = 8,9 Гц), 7,34 - 7,42 (5H, м), 7,81 - 7,9 (2H, м).
Препаративный пример 71.
По методике, аналогичным методикам препаративных примеров 37 и 38, получены следующие соединения:
(1) 8-Метоксикарбонил-1-циано-4,4-диметил-4H- пирроло-/2,1-с//1,4/бензоксазин
Т.пл. 114 - 116o.
ИК (ньюджол): 2220, 1720 см-1.
ЯМР (ДМСО-d6) δ: 1,62 (6H, с), 3,88 (3H, с), 6,44 (1H, д, J = 4 Гц), 7,26 (1H, д, J = 8,5 Гц), 7,36 (1H, дд, J = 4 Гц, 8,7 Гц), 7,86 (1H, дд, J = 1,9 Гц, 8,5 Гц), 8,68 (1H, д, J = 1,9 Гц).
(2) Метиловый эфир 3-(2-цианотиофен-3-ил)бензойной кислоты
Т.пл. 87-88oC.
ИК (ньюджол): 2200, 1720, 740 см-1.
ЯМР (ДМСО-d6) δ: 3,9 (3H, с), 7,65 (1H, д, J = 5,1 Гц), 7,72 (1H, дд, J = 7,8 Гц, 7,8 Гц), 8 - 8,1 (2H, м), 8,18 (1H, д, J = 5,1 Гц), 8,3 (1H, с).
(+) APCI MACC (m/z): 244 /M+N/+.
Элементный анализ для C13H9NO2
Вычислено: C 64,18, H 3,73, N 5,76
Найдено: C 64,16, H 3,50, N 5,67
(3) Метиловый эфир 3-(2-цианофуран-3-ил)бензойной кислоты
Т.пл. 114-115oC.
ИК (ньюджол): 2220, 1500, 1420, 1260 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 7,37 (1H, д, J = 1,9 Гц), 7,72 (1H, дд, J = 7,8 Гц, 7,8 Гц), 8,01 - 8,08 (2H, м), 8,2 (1H, д, J = 1,9 Гц), 8,33 (1H, с).
(+) APCI MACC m/z): 228 /M+N/+.
(4) 4-Метоксикарбонил-1-циано-4E-пирроло/2,1-c//1,4/бензоксазин
Т.пл. 141-144oC.
ИК (ньюджол): 2210, 1725 см-1.
ЯМР (ДМСО-d6) δ: 3,84 (3H, с), 5,29 (2H, с), 6,37 (1H, д, J = 4 Гц), 7,31 (1H, дд, J = 8 Гц, 8 Гц), 7,36 (1H, д, J = 4 Гц), 7,64 (1H, дд, J = 1,5 Гц, 8 Гц), 8,13 (1H, дд, J = 1,5 Гц, 8 Гц).
(+) APCI MACC m/z): 255 /M+N/+.
Препаративный пример 72.
По методике, аналогичной методике препаративного примера 41, получено следующее соединение:
8-Метоксикарбонил-1-диметиламинометил-4,4-диметил-4H- пирроло-/2,1-c//1,4/бензоксазин
ИК (пленка): 1715 (ш.), 1610, 1590 см-1.
ЯМР (ДМСО-d6) δ: 1,56 (6H, с), 2,29 (6H, с), 3,35 (2H, с), 3,85 (3H, с), 6,06 (1H, д, J = 3,5 Гц), 6,21 (1H, д, J = 3,5 Гц), 7,14 (1H, д, J = 8,14 Гц), 7,73 (1H, дд, J = 2 Гц, 8,4 Гц), 8,91 (1H, д, J = 2 Гц).
(+) APCI MACC (m/z): 315 /M+N/+.
Препаративный пример 73.
По методике, аналогичной методике препаративного примера 2, получены следующие соединения:
(1) Метиловый эфир 4-хлор-5-нитро-3-сульфамоилбензойной кислоты
Т.пл. 138-139oC.
ИК (ньюджол): 3380, 3290, 1728, 1600, 1350, 1168 см-1.
ЯМР (ДМСО-d6) δ: 3,94 (3H, с), 8,14 (2H, с), 8,68 (1H, д, J = 2,1 Гц), 8,73 (1H, д, J = 2,1 Гц).
(2) Метиловый эфир 3-(5-аминопиррол-1-ил)бензойной кислоты
Т.пл. 160-162oC.
ИК (ньюджол): 3370, 3290, 3200, 1700, 1633 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 5,46 (2H, с), 5,52 (1H, д, J = 1,8 Гц), 7,34 (1H, д, J = 1,8 Гц), 7,63 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,83 - 7,97 (2H, м), 8,17 - 8,23 (1H, м).
(3) Метиловый эфир 3-(3-нитрофенил)бензойной кислоты
Т.пл. 90-91oC.
ИК (ньюджол): 1720, 1535, 1350 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 7,68 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,79 (1H, дд, J = 8 Гц, 8 Гц), 8 - 8,3 (5H, с), 8,44 (1H, дд, J = 2 Гц, 2 Гц).
(+) APCI MACC (m/z): 258 /M+N/+.
(4) Метиловый эфир 3-(2-хлорфенил)бензойной кислоты
Т.пл. 46-48oC.
ИК (ньюджол): 1720, 1300, 1240, 1110 см-1.
ЯМР (ДМСО-d6) δ: 3,88 (3H, с), 7,44 - 7,48 (3H, м), 7,58 - 7,76 (3H, м), 7,98 - 8,04 (2H, м).
(+) APCI MACC (m/z): 247 /M+N/+.
(5) Метиловый эфир 3-(3-фторфенил)бензойной кислоты
ИК (чистый): 1720, 1590, 1430, 1250, 1180 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 7,21 - 7,31 (1H, м), 7,52 - 7,68 (4H, м), 7,99 (2H, ддд, 8,0 Гц, 1,7 Гц, 1,7 Гц), 8,21 (1H, дд, J = 1,7 Гц, 1,7 Гц).
(+) APCI MACC (m/z): 231 /M+N/+.
(6) Метиловый эфир 3-(4-фторфенил)бензойной кислоты
Т.пл. 52-54oC.
ИК (чистый): 1720, 1600, 1510, 1440, 1300, 1110 см-1.
ЯМР (ДМСО-d6) δ: 3,9 (3H, с), 7,25 - 7,38 (2H, м), 7,66 (1H, дд, 7,5 Гц, 7,5 Гц), 7,71 - 7,8 (2H, м), 7,91 - 7,99 (2H, м), 8,17 (1H, дд, J = 1,7 Гц, 1,7 Гц).
(+) APCI MACC (m/z): 231 /M+N/+.
(7) Метиловый эфир 3-(3-трифторметилфенил)бензойной кислоты
ИК (чистый): 1720, 1440, 1330, 1280, 1240, 1110 см-1.
ЯМР (ДМСО-d6) δ: 3,92 (3H, с), 7,62 - 7,81 (3H, м), 8 - - 8,06 (4H, м), 8,23 (1H, дд, J = 1,7 Гц, 1,7 Гц).
(+) APCI MACC (m/z): 281 /M+N/+.
(8) Метиловый эфир 3-(3-хлорфенил)бензойной кислоты
ИК (чистый): 1720, 1590, 1560, 1300, 1240, 1110 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 7,48 - 7,57 (2H, м), 7,59 - 7,69 (2H, м), 7,75 (1H, дд, J = 1,6 Гц, 1,6 Гц), 7,95 - 8,01 (2H, м), 8,19 (1H, дд, J = 1,6 Гц).
(+) APCI MACC (m/z): 247 /M+N/+.
(9) Метиловый эфир 3-(фуран-3-ил)бензойной кислоты
ИК (чистый): 1720, 1610, 1510, 1430, 1250 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 7,04 (1H, дд, J = 1,7 Гц, 0,9 Гц), 7,55 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,79 (1H, дд, J = 1,7 Гц, 1,7 Гц), 7,83 - 7,94 (2H, м), 8,16 (1H, дд, J = 1,7 Гц, 0,9 Гц), 8,32 (1H, с).
(+) APCI MACC (m/z): 203 /M+N/+.
(10) Метиловый эфир 3-(3-метилфенил)бензойной кислоты
ИК (пленка): 1720, 1435, 1310, 1250 см-1.
ЯМР (ДМСО-d6) δ: 2,4 (3H, с), 3,9 (3H, с), 7,2 - 7,26 (1H, м), 7,34 - 7,65 (4H, м), 7,92 - 7,98 (2H, м), 8,16 - 8,19 (1H, м).
(11) Метиловый эфир 3-(2-фторфенил)бензойной кислоты
ИК (пленка): 1720, 1310, 1240, 1110 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 7,3 - 7,7 (5H, м), 7,8 - - 8,12 (3H, м).
(+) APCI MACC (m/z): 231 /M+N/+.
Препаративный пример 74.
Раствор метилового эфира 4-гидрокси-3-(пиррол-1-ил)бензойной кислоты (15 г), пиридина (8,4 мл) и уксусного ангидрида (9,8 мл) в дихлорметане (75 мл) перемешивают 15 часов при комнатной температуре. Затем к смеси добавляют смесь дихлорметана с водой и добавлением 20%-го водного раствора карбоната калия в смеси устанавливают pH 8. Отделенный органический слой промывают последовательно 1 н. соляной кислотой и водой. Органический слой сушат над сульфатом магния и после испарения в вакууме получают метиловый эфир 4-ацетокси-3-(пиррол-1-ил)бенpойной кислоты (15,9 г).
ИК (ньюджол): 1770, 1722 см-1.
ЯМР (ДМСО-d6) δ: 2,2 (3H, с), 3,89 (3H, с), 6,25 - 6,31 (2H, м), 7,2 - 7,08 (2H, м), 7,5 (1H, дд, J = 9 Гц), 7,92 - 8,02 (2H, м).
Препаративный пример 75.
К раствору хлорокиси фосфора (8,3 мл) и N,N-диметилформамида (70 мл) добавляют при комнатной температуре метиловый эфир 4-ацетокси-3-(пиррол-1-ил)бензойной кислоты (11,7 г) и смесь перемешивают 20 часов при той же температуре. Реакционную смесь переносят в воду и экстрагируют этилацетатом. Слой экстракта промывают водой, сушат над сульфатом магния и испаряют в вакууме. Остаток растворяют в тетрагидрофуране. К раствору при охлаждении льдом добавляют 28%-ый метанольный раствор метоксида натрия (9,7 мл) и смесь перемешивают 30 минут при той же температуре. После добавления к смеси уксусной кислоты (6 мл) смесь испаряют в вакууме. К смеси добавляют водный этилацетат и добавлением 20%-го водного карбоната калия в смеси устанавливают pH 7. Отделенный органический слой промывают водой, сушат над сульфатом магния и испаряют в вакууме. Кристаллизованный из толуола остаток фильтруют и промыванием осадка эфиром получают метиловый эфир 3-(2-формилпиррол-1-ил)-4-гидроксибензойной кислоты (7,89 г).
Т.пл. 147-148oC.
ИК (ньюджол): 1715, 1640, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,81 (3H, с), 6,4 - 6,46 (1H, м), 7,05 - - 7,2 (2H, м), 7,25 - 7,33 (1H, м), 7,75 (1H, с), 7,83 - 7,93 (1H, м), 9,01 (1H, с), 11,02 (1H, с).
Препаративный пример 76.
К раствору метилового эфира 3-(2-формилпиррол-1-ил)-4-гидроксибензойной кислоты (3 г) в тетрагидрофуране (30 мл) добавляют боргидрид натрия (0,46 г) и смесь перемешивают 1 час при комнатной температуре. Реакционную смесь переносят в водный этилацетат и добавлением 6 н. соляной кислоты устанавливают pH 7,5. Отделенный органический слой промывают водой, сушат над сульфатом магния и после испарения в вакууме получают метиловый эфир 4-гидрокси-3-(2-гидроксиметилпиррол-1-ил) бензойной кислоты (2,54 г).
Т.пл. 152-153oC.
ИК (ньюджол): 3400, 1695, 1603 см-1.
ЯМР (ДМСО-d6) δ: 3,8 (3H, с), 4,21 (2H, с), 6,05 - 6,15 (2H, м), 6,7 - 6,76 (1H, м), 7,09 (1H, д, J = 8,5 Гц ), 7,79 (1H, д, J = 2,1 Гц), 7,85 (1H, д, J = 2,1 Гц, 8,5 Гц).
Препаративный пример 77.
К охлаждаемой льдом смеси метилового эфира 4-гидрокси-3-(2-гидроксиметилпиррол-1-ил)бензойной кислоты (2,5 г) и трифенилфосфина (4 г) прибавляют по каплям диэтилазодикарбоксилат (2,3 мл), после чего смесь перемешивают 2 часа при комнатной температуре. Затем смесь переносят в водный этилацетат. Отделенный органический слой промывают рассолом и сушат над сульфатом магния. Испарением растворителя получают остаток, который очищают колоночной хроматографией на силикагеле с элюированием хлороформом. Элюируемые фракции, содержащие целевой продукт, собирают и испарением в вакууме получают 8-метоксикарбонил-4H-пирроло/2,1-c//1,4/бензоксазин (0,61 г).
Т.пл. 60-62oC.
ИК (ньюджол): 1710 см-1.
ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 5,26 (2H, с), 6,08 - 6,14 (1H, м), 6,28 - 6,36 (1H, м), 7,18 (1H, д, J = 8,5 Гц ), 7,61 - 7,67 (1H, м), 7,7 (1H, дд, J = 8,5 Гц, 8,5 Гц), 8,16 (1H, д, J = 2 Гц).
Элементный анализ для C13H11NO3
Вычислено: C 68,11, N 4,84, N 6,11
Найдено: C 67,83, H 4,92, N 6,12
Препаративный пример 78.
К охлаждаемой льдом смеси пиррола (2,3 мл) и 60%-го гидрида натрия (1,3 г) в N,N-диметилформамиде (50 мл) добавляют метиловый эфир 3-(бромметил)бензойной кислоты (5 г) и смесь перемешивают 3 часа при комнатной температуре. Реакционную смесь переносят в воду и экстрагируют этилацетатом. Слой экстракта промывают водой, сушат над сульфатом магния и после испарения получают в виде масла метиловый эфир 3-(пиррол-1-ил)метилбензойной кислоты (4,14 г).
ИК (пленка): 1715 см-1.
ЯМР (ДМСО-d6) δ: 3,83 (3H, с), 5,19 (2H, с), 6,01 - 6,06 (2H, м), 6,81 - 6,86 (2H, м), 7,4 - 7,58 (2H, м), 7,77 (1H, с), 7,86 (1H, д, J = 6,7 Гц).
Препаративный пример 79.
По методике, аналогичной методике препаративного примера 12, получено следующее соединение:
Метиловый эфир 3-(3-диметилпропеноил)бензойной кислоты
Т.пл. 70-73oC.
ИК (ньюджол): 1720, 1630 см-1.
ЯМР (ДМСО-d6) δ: 2,95 (3H, с), 3,18 (3H, с), 3,89 (3H, с), 5,86 (1H, д, J = 12,2 Гц), 7,6 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,8 (1H, д, J, 12,2 Гц), 8,02 - 8,11 (1H, м), 8,13 - 8,23 (1H, м), 8,41 - 8,46 (1H, м).
Препаративный пример 80.
По методике, аналогичной методике препаративного примера 13, получено следующее соединение:
Метиловый эфир 3-(пиразол-3-ил)бензойной кислоты.
Т.пл. 107-108oC.
ИК (ньюджол): 3160, 1720 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 6,78 - 6,83 (1H, м), 7,57 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,83 (1H, с), 7,89 (1H, д, J = 7,7 Гц), 8,08 (1H, д, J = 7,7 Гц), 8,42 (1H, с), 13,02 (1H, с), .
Препаративный пример 81.
Смесь метилового эфира 3-(3-диметиламинопропеноил)бензойной кислоты (1,4 г), формамидинацетата (2,8 г) и 28%-го метанольного раствора метоксида натрия (5,2 мл) в метаноле (38 мл) кипятят с перемешиванием 64 часа. Растворитель удаляют концентрированием и к остатку добавляют воду. Добавлением 20%-го водного раствора карбоната калия в смеси устанавливают pH 9 и смесь экстрагируют этилацетатом. Слой экстракта промывают рассолом, сушат над сульфатом магния и испаряют в вакууме. Остаток переосаждают из раствора диизопропилового эфира в н-гексане и фильтрованием осадка получают метиловый эфир 3-(пиримидин-4-ил)бензойной кислоты (0,8 г).
Т.пл. 69-71oC.
ИК (ньюджол): 1722, 1580 см-1.
ЯМР (ДМСО-d6) δ: 3,92 (3H, с), 7,73 (1H, д, J = 7,8 Гц, 7,8 Гц), 8,14 (1H, д, J = 7,8 Гц), 8,2 (1H, д, J = 5,4 Гц), 8,48 (1H, д, J = 7,8 Гц), 8,8 (1H, с), 8,93 (1H, д, J = 5,4 Гц), 9,31 (1H, с).
(+) APCI MACC (m/z): 215 /M+H/+.
Элементный анализ для C12H10N2O2
Вычислено: C 67,28, H 4,70, N 13,08
Найдено C 67,00, H 4,68, N 12,93
Препаративный пример 82.
По методике, аналогичной методике препаративного примера 18, получены следующие соединения:
(1) 2-Хлорфенилдигидроксиборан
Т.пл. 158-160oC.
ИК (ньюджол): 3250, 1590 см-1.
ЯМР (ДМСО-d6) δ: 7,22 - 7,43 (4H, м), 8,31 (2H, с).
(2) 3-Фторфенилдигидроксиборан
Т.пл. 213-215oC.
ИК (ньюджол): 1580, 1350, 1190 см-1.
ЯМР (ДМСО-d6) δ: 7,17 - 7,27 (1H, м), 7,35 - 7,64 (2H, м), 7,72 (1H, д, J = 7,2 Гц).
(3) 4-Фторфенилдигидроксиборан
Т.пл. 254-256oC.
ИК (ньюджол): 1600, 1400, 1220, 1150 см-1.
ЯМР (ДМСО-d6) δ: 7,06 - 7,26 (2H, м), 7,81 - 8,03 (2H, м).
(4) 3-Хлорфенилдигидроксиборан
Т.пл. 177-179oC.
ИК (ньюджол): 1590, 1410 см-1.
ЯМР (ДМСО-d6) δ: 7,33 - 7,5 (2H, м), 7,71 - 7,84 (2H, м).
(5) 3-Фурилдигидроксиборан
Т.пл. 128-130oC.
ИК (ньюджол): 3200, 1560, 1500, 1320 см-1.
ЯМР (ДМСО-d6)  6,64 (1H, дд, J = 1,6 Гц, 0,6 Гц), 7,62 (1H, дд, J = 1,6 Гц, 1,3 Гц), 7,84 (1H, дд, J = 1,3 Гц, 0,6 Гц), 7,91 (2H, с).
6,64 (1H, дд, J = 1,6 Гц, 0,6 Гц), 7,62 (1H, дд, J = 1,6 Гц, 1,3 Гц), 7,84 (1H, дд, J = 1,3 Гц, 0,6 Гц), 7,91 (2H, с).
(6) 3-(4,4-Диметил-4,5-дигидрооксазол-2-ил)фенилдигидроксиборан
Т.пл. 105-107oC.
ИК (ньюджол): 3300 (ш.), 1640, 1360, 1180 см-1.
ЯМР (ДМСО-d6) δ: 1,3 (6H, с), 4,11 (2H, с), 7,39 - 7,54 (1H, м), 7,82 - 8,38 (2H, м).
Препаративный пример 83.
По методике, аналогичной методике препаративного примера 20, получены следующие соединения:
(1) 3-(2-Хлорфенил)бензойная кислота
Т.пл. 185-187oC.
ИК (ньюджол): 1670, 1320, 1250 см-1.
ЯМР (ДМСО-d6) δ: 7,44 - 7,48 (3H, м), 7,57 - 7,73 (3H, м), 7,98 - 8,03 (2H, м), 13,16 (1H, ш.с.).
(-) APCI MACC (m/z): 231 /M-H/-.
(2) 3-(3-Фторфенил)бензойная кислота
Т.пл. 145-147oC.
ИК (ньюджол): 1680, 1580, 1320, 1260 см-1.
ЯМР (ДМСО-d6) δ: 7,21 - 7,29 (1H, м), 7,52 - 7,66 (4H, м), 7,94 - 8,01 (2H, м), 8,21 (1H, дд, J = 1,7 Гц, 1,7 Гц), 13,16 (1H, ш.с).
(+) APCI MACC (m/z): 217 /M+H/+.
(3) 3-(4-Фторфенил)бензойная кислота
Т.пл. 181-183oC.
ИК (ньюджол): 1690, 1310, 1230 см-1.
ЯМР (ДМСО-d6) δ: 7,27 - 7,38 (2H, м), 7,6 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,71 - 7,8 (2H, м), 7,88 - 7,97 (2H, м), 8,16 (1H, дд, J = 1,6 Гц, 1,6 Гц), 13,12 (1H, с).
(-) APCI MACC (m/z): 215 /M-H/-.
(4) 3-(3-Трифторметилфенил)бензойная кислота
Т.пл. 138-140oC.
ИК (ньюджол): 1680, 1340, 1120 см-1.
ЯМР (ДМСО-d6) δ: 7,59 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,67 - 7,79 (2H, м), 7,9 - 8,04 (4H, м), 8,28 (1H, с).
(-) APCI MACC (m/z): 264 /M-H/-.
(5) 3-(3-Хлорфенил)бензойная кислота
Т.пл. 178-180oC.
ИК (ньюджол): 1680, 1310, 1250 см-1.
ЯМР (ДМСО-d6) δ: 7,48 - 7,71 (4H, м), 7,77 (1H, дд, J = 1,9 Гц, 1,9 Гц), 7,94 - 8,01 (1H, дд, J = 1,8 Гц, 1,8 Гц).
(-) APCI MACC (m/z): 231 /M-H/-.
(6) 3-(Фуран-3-ил)бензойная кислота
Т.пл. 145-147oC.
ИК (ньюджол): 1680, 1580, 1370, 1290 см-1.
ЯМР (ДМСО-d6) δ: 7,03 (1H, дд, J = 1,6 Гц, 1,6 Гц), 7,53 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,79 (1H, дд, J = 1,6 Гц, 1,6 Гц), 7,83 - 7,91 (2H, м), 8,16 (1H, дд, J = 1,6 Гц, 1 Гц), 8,31 (1H, с), 13,07 (1H, с).
(+) APCI MACC (m/z): 189 /M+H/+.
(7) 3-(2-Фторфенил)бензойная кислота
Т.пл. 144-146oC.
ИК (ньюджол): 1680, 1250, 745 см-1.
ЯМР (ДМСО-d6) δ: 7,29 - 7,67 (5H, м), 7,79 - 7,84 (1H, м), 7,96 - 8,02 (1H, м), 8,1 - 8,12 (1H, м).
(8) 3-(3-Метилфенил)бензойная кислота
Т.пл. 123o-125oC.
ИК (ньюджол): 1680, 1305, 1280, 750 см-1.
ЯМР (ДМСО-d6) δ: 2,4 (3H, с), 7,2 - 7,65 (5H, м), 7,88 - 7,97 (2H, м), 8,16 - 8,19 (1H, м), 13,09 (1H, с).
Препаративный пример 84.
По методике, аналогичной методике препаративного примера 26, получены следующие соединения:
(1) Метиловый эфир 3-(пиридин-2-ил)бензойной кислоты
ИК (пленка): 1720, 1580 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 7,41 - 7,47 (H, м), 7,66 (1H, дд, J = 7,6 Гц, 7,6 Гц), 7,91 - 8,03 (1H, м), 8 - 8,1 (2H, м), 8,3 - 8,4 (1H, м), 8,69 - 8,76 (2H, м).
(+) APCI MACC (m/z): 214 /M+H/+.
(2) Метиловый эфир 3-(пиридин-3-ил)бензойной кислоты
ИК (пленка): 1720, 1580 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 7,47 - 7,58 (1H, м), 7,68 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,97 - 8,07 (2H, м), 8,08 - 8,18 (1H, м), 8,23 (1H, д, J = 1,6 Гц, 1,6 Гц), 8,63 (1H, д, J = 1,6 Гц, 4,8 Гц), 8,93 (1H, дд, J = 0,7 Гц, 2,4 Гц).
(+) APCI MACC (m/z): 214 /M+H/+.
(3) Диметиловый эфир 5-[2-(4,4-диметил-4,5-дигидрооксазол-2- ил)фенил] изофталевой кислоты
Т.пл. 89-90oC.
ИК (ньюджол): 1725, 1660, 1235 см-1.
ЯМР (ДМСО-d6) δ: 1,15 (6H, с), 3,81 (2H, с), 3,91 (6H, с), 7,49 - 7,76 (4H, м), 8,14 (2H, с), 8,46 (1H, с).
(+) APCI MACC (m/z): 368 /M+H/+.
(4) 4,4-Диметил-2-[3-(2-нитрофенил)фенил]4,5-дигидрооксазол
ИК (чистый): 2960, 1730, 1640, 1520 см-1.
ЯМР (ДМСО-d6) δ: 1,29 (6H, с), 4,13 (2H, с), 7,51 - 7,72 (4H, м), 7,76 - 7,8 (2H, м), 7,91 (1H, ддд, J = 7,1 Гц, 1,7 Гц), 8,04 (1H, д, J = 7,9 Гц, 1,3 Гц).
(+) APCI MACC (m/z): 297 /M+H/+.
(5) Метиловый эфир 3-3-(4,4-диметил-4,5- дигидрооксазол-2-ил)фенил бензойной кислоты
Т.пл. 53-55oC.
ИК (чистый): 2950, 1720, 1650, 1440, 1300 см-1.
ЯМР (ДМСО-d6) δ: 1,32 (6H, с), 3,91 (3H, с), 4,15 (2H, с), 7,61 (1H, дд, J = 1,7 Гц, 7,7 Гц), 7,66 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,86 - 7,92 (2H, с), 7,97 - 8,03 (2H, м), 8,11 (1H, дд, J = 1,6 Гц, 1,6 Гц), 8,19 (1H, д, 1,7 Гц, 1,7 Гц).
(+) APCI MACC (m/z): 310 /M+H/+.
Элементный анализ для C19H19NO3
Вычислено: C 73,77, H 6,19, N 4,53
Найдено: C 73,89, H 6,40, N 4,34
Препаративный пример 85.
По методике, аналогичной методике препаративного примера 28, получены следующие соединения:
(1) Диметиловый эфир 5-(2-цианофенил)изофталевой кислоты
Т.пл. 185-187oC.
ИК (ньюджол): 2225, 1720, 1240, 990, 755 см-1.
ЯМР (ДМСО-d6) δ: 3,94 (6H, с), 7,63 - 7,9 (4H, м), 8,01 (1H, д, J = 7,8 Гц), 8,37 (2H, с), 8,58 (1H, с).
(+) APCI MACC (m/z): 296 /M+H/+.
(2) Метиловый эфир 3-(3-цианофенил) бензойной кислоты
Т.пл. 82-84oC.
ИК (ньюджол): 2230, 1720, 1250 см-1.
ЯМР (ДМСО-d6) δ: 3,9 (3H, с), 7,67 (1H, дд, J = 7,6 Гц, 7,6 Гц), 7,7 (1H, дд, J = 7,6 Гц, 7,6 Гц), 7,89 (1H, ддд, J = 7,6 Гц, 1,4 Гц, 1,4 Гц), 7,98 - 8,1 (3H, м), 8,22 - 8,26 (2H, м).
(+) APCI MACC (m/z): 238 /M+H/+.
Элементный анализ для C15H11NO2
Вычислено: C 75,94, H 4,67, N 5,90
Найдено: C 75,91, H 4,74, N 5,89
Препаративный пример 86.
По методике, аналогичной методике препаративного примера 30, получено следующее соединение:
Метил 3-диметилкарбамоил-5-(пиррол-1-ил)бензоат
ИК (пленка): 3450, 3130, 2950, 1720, 1630 см-1.
ЯМР (ДМСО-d6) δ: 2,93 (3H, с), 3,02 (3H, с), 3,91 (3H, с), 6,3 - 6,4 (2H, м), 7,5 - 7,6 (2H, м), 7,7 - 7,8 (1H, м), 7,9 - 8 (1H, м), 8,1 - 8,2 (1H, м).
(+) APCI MACC (m/z): 273 /M+H/+.
Препаративный пример 87.
К смеси гидрохлорида гидроксиламина (0,61 г) и 28%-го метанольного раствора метоксида натрия (1,8 мл) в метаноле (20 мл) добавляют метиловый эфир 3-формил-5-(пиррол-1-ил)бензойной кислоты (2 г) и все перемешивают 22 часа при комнатной температуре. Реакционную смесь переносят в водный этилацетат. Органический слой последовательно промывают рассолом и сушат над сульфатом магния. Растворитель испаряют в вакууме и остаток очищают колоночной хроматографией на силикагеле с элюированием смесью хлороформ-этилацетат (20: 1). Элюируемые фракции, содержащие целевой продукт, собирают и испарением в вакууме получают метиловый эфир 3-гидроксииминометил-5-(пиррол-1-ил)бензойной кислоты (1,69 г).
Т.пл. 154-155oC.
ИК (ньюджол): 3250, 1720, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 6,3 - 6,4 (2H, м), 7,4 - 7,5 (2H, м), 8 - 8,3 (4H, м), 11,59 (1H, с).
(+) APCI MACC (m/z): 245 /M+H/+.
Элементный анализ для C13H12N2O3
Вычислено: C 63,93, H 4,95, N 11,47
Найдено: C 64,02, H 5,15, N 11,46
Препаративный пример 88.
По методике, аналогичной методике препаративного примера 52, получено следующее соединение:
Метиловый эфир 3-гидроксиметил-5-фенилбензойной кислоты
Т.пл. 89-90oC.
ИК (ньюджол): 3475, 1720, 1250, 760 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 4,65 (2H, д, 5,8 Гц), 5,43 (1H, т, J = 5,8 Гц), 7,37 - 7,55 (3H, м), 7,67 - 7,72 (2H, м), 7,87 (1H, с), 7,95 (1H, с), 8,05 (1H, с).
(+) APCI MACC (m/z): 243 /M+H/+.
Препаративный пример 89.
По методике, аналогичной методике препаративного примера 86, получено следующее соединение:
3-Метоксикарбонил-5-фенилбезойная кислота
Т.пл. 170-172oC.
ИК (ньюджол): 1720, 1685, 750 см-1.
ЯМР (ДМСО-d6) δ: 3,93 (3H, с), 7,4 - 7,6 (3H, м), 7,7 - 7,8 (2H, м), 8,38 - 8,41 (2H, м), 8,47 (1H, с), 13,44 (1H, с).
(+) APCI MACC (m/z): 257 /M+H/+.
Препаративный пример 90.
Смесь 3-гидразинбензойной кислоты (5 г) и этилового эфира 2-этоксиметилен-2-цианоуксусной кислоты (5,6 г) в этаноле (50 мл) кипятят с перемешиванием 2 часа, после чего смесь испаряют в вакууме. К остатку добавляют смесь этилацетата с водой и добавлением 20%-го водного раствора карбоната калия в смеси устанавливают pH 8. В отделенном водном слое добавлением 6 н. соляной кислоты устанавливают pH 4 и затем экстрагируют этилацетатом. Слой экстракта промывают водой, сушат над сульфатом магния и испаряют в вакууме. Осадок переосаждают из смеси этилацетат-диизопропиловый эфир и фильтрованием осадка получают 3-(5-амино-4-этоксикарбонилпиразол-1-ил)бензойную кислоту (6 г).
Т.пл. 172-174oC.
ИК (ньюджол): 3360, 3250, 1688, 1605 см-1.
ЯМР (ДМСО-d6) δ: 1,28 (3H, т, J = 7,1 Гц), 4,23 (2H, к, J = 7,1 Гц), 6,46 (2H, с), 7,67 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,75 (1H, ч), 7,81 (1H, т, J = 7,8 Гц), 7,96 (1H, д, J = 7,8 Гц), 8,08 (1H, с), 13,27 (1H, с).
Препаративный пример 91.
Смесь 3-(5-амино-4-этоксикарбонилпиразол-1-ил)бензойной кислоты (5,9 г) и гидроксида натрия (2,1 г) в воде (15 мл) перемешивают 2 часа при 80oC. К реакционной смеси добавляют воду и добавлением 6 н. соляной кислоты в смеси устанавливают pH 3,5. Образовавшийся осадок отфильтровывают, промывают водой и после сушки получают 3-(5-амино-4-карбоксипаризол-1-ил)бензойную кислоту (5,1 г).
Т.пл. 194-196oC.
ИК (ньюджол): 3540, 3420, 3200, 1678 см-1.
ЯМР (ДМСО-d6) δ: 6,41 (2H, с), 7,66 (1H, т, J = 7,8 Гц, 7,8 Гц), 7,72 (1H, с), 7,82 (1H, д, J = 7,8 Гц), 7,95 (1H, д, J = 7,8 Гц), 8,08 (1H, с), 12,88 (1H, с).
Препаративный пример 92.
Смесь 3-(5-амино-4-карбоксипиразол-1-ил)бензойной кислоты (19,4 г) и диглима (200 мл) кипятят 6 часов. К смеси добавляют водный этилацетат и добавлением 20%-го водного раствора карбоната калия в смеси устанавливают pH 9. Добавлением к отделенному водному слою 6 н. соляной кислоты в нем устанавливают pH 3,5 и смесь экстрагируют раствором этилацетата в тетргидрофуране. Слой экстракта промывают рассолом, сушат над сульфатом магния и испарением в вакууме получают 3-(5-аминопиразол-1-ил)бензойную кислоту (7,59 г).
Т.пл. 155-156oC.
ИК (ньюджол): 3300, 3210, 1700, 1635 см-1.
ЯМР (ДМСО-d6) δ: 5,43 (2H, с), 5,51 (1H, д, J = 1,8 Гц), 7,33 (1H, д, J = 1,8 Гц), 7,6 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,82 - 7,91 (2H, м), 8,15 - 8,21 (1H, м), 13,15 (1H, с).
(+) APCI MACC (m/z): 204 /M+H/+.
Препаративный пример 93.
К раствору диметилового эфира изофталевой кислоты (10 г) в ацетонитриле (90 мл) при комнатной температуре добавляют трет-бутоксид калия (6,4 г) и смесь перемешивают 1 час при 60-64oC. Реакционную смесь переносят в раствор конц. соляной кислоты (4,7 мл) в воде (150 мл) и экстрагируют этилацетатом. Слой экстракта промывают водой и сушат над сульфатом магния. Испарением растворителя получают остаток, который очищают колоночной хроматографией на силикагеле с элюированием хлороформом. Элюируемые фракции, содержащие целевой продукт, собирают и испарением в вакууме получают метиловый эфир 3-цианоацетил)бензойную кислоту (4,72 г).
Т.пл. 48-52oC.
ИК (ньюджол): 2250, 1723, 1693, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 4,85 (2H, с), 7,73 1H, дд, J = 7,6 Гц, 7,6 Гц), 8,1 - 8,32 (2H, м), 8,43 (1H, с).
Препаративный пример 94.
К перемешиваемой смеси метилового эфира 3-(цианоацетил)бензойной кислоты (2 г), триэтиламина (1,4 мл), гидрохлорида триэтиламина (1,4 г) и 40%-го водного раствора метиламина (0,93 мл) при комнатной температуре добавляют хлорацетон (0,86 мл) и смесь перемешивают 2 часа при той же температуре. К реакционной смеси добавляют этилацетат и смесь промывают водой. Органический слой сушат над сульфатом магния и испаряют в вакууме. Перекристаллизацией остатка из этанола получают метиловый эфир 3-(3-циано-1,5-диметилпиррол-2-ил)бензойной кислоты (1,6 г).
Т.пл. 125-126oC.
ИК (ньюджол): 2220, 1720 см-1.
ЯМР (ДМСО-d6) δ: 2,26 (3H, с), 3,47 (3H, с), 3,89 (3H, с), 6,37 (1H, с), 7,64 - 7,82 (2H, м), 8 (1H, с), 8,02 - 8,01 (1H, м).
(+) APCI MACC (m/z): 255 /M+H/+.
Препаративный пример 95.
К раствору диметилового эфира 5-гидроксиизофталевой кислоты (5 г), 4-диметиламинопиридина (0,45 г) и 2,6-лутидина в дихлорметане (60 мл) прибавляют по каплям при -30oC бис(трифторметансульфоновый)ангидрид (4,8 мл). После перемешивания 20 минут при -30oC охлаждающую баню удаляют и реакционную смесь перемешивают 3 часа при комнатной температуре. К реакционной смеси прибавляют насыщенный водный раствор хлорида аммония, водный слой отделяют и дважды экстрагируют хлористым метиленом. Объединенные экстракты сушат над сульфатом магния и испаряют в вакууме. Остаток растворяют в этилацетате и промывают последовательно водой, 10%-ой соляной кислотой, насыщенным раствором бикарбоната натрия, рассолом и сушат над сульфатом магния. Растворитель удаляют в вакууме и кристаллизацией остатка из н-гексана и диэтилового эфира получают диметиловый эфир 5-(трифторметилсульфонилокси)изофталевой кислоты (5,59 г).
Т.пл. 73-74oC.
ИК (ньюджол): 1725, 1135, 990 см-1.
ЯМР (ДМСО-d6) δ: 3,94 (6H, с), 8,27 (2H, с), 8,52 (1H, с).
(+) APCI MACC (m/z): 343 /M+H/+.
Препаративный пример 96.
По методике, аналогичной методике препаративного примера 95, получено следующее соединение:
Метиловый эфир 5-Бензилокси-3-(трифторметилсульфонилокси)- бензойной кислоты
ИК (чистый): 1720, 1580, 1300, 1220, 1130 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 5,26 (2H, с), 7,31 - 7,57 (7H, м), 7,64 - 7,66 (1H, м).
(+) APCI MACC (m/z): 391 /M+H/+.
Препаративный пример 97.
Смесь диметилового эфира 5-(трифторметилсульфонилокси)- изофталевой кислоты (2,3 г), дигидроксифенилборана (1,23 г) и триэтиламина (2,04 г) в N, N-диметилформамиде (30 мл) перемешивают 3 часа при 100oC в атмосфере азота. После испарения растворителя остаток растворяют в смеси дихлорметана (100 мл) с водой. Органический слой последовательно промывают водным 10%-ым раствором карбоната натрия и рассолом, сушат над сульфатом магния и испаряют в вакууме. Кристаллизацией остатка из гексана получают диметиловый эфир 5-фенилизофталевой кислоты.
Т.пл. 91-92oC.
ИК (ньюджол): 1730, 1235, 745 см-1.
ЯМР (ДМСО-d6) δ: 3,93 (6H, с), 7,4 - 7,6 (3H, м), 7,7 - 7,8 (2H, м), 8,39 (2H, с), 8,44 (1H, с).
(+) APCI MACC (m/z): 271 /M+H/+.
Препаративный пример 98.
По методике, аналогичной методике препаративного примера 97, получено следующее соединение:
Метиловый эфир 3-бензилокси-5-фенилбензойной кислоты.
Т.пл. 83-84oC.
ИК (ньюджол): 1720, 1590, 1340, 1240 см-1.
ЯМР (ДМСО-d6) δ: 3,88 (3H, с), 5,27 (2H, с), 7,32 - 7,6 (10H, м), 7,69 (1H, дд, J = 1,4 Гц, 1,4 Гц), 7,73 (1H, дд, J = 1,4 Гц, 1,4 Гц), 7,8 (1H, дд, J = 1,4 Гц, 1,4 Гц).
(+) APCI MACC (m/z): 319 /M+H/+.
Препаративный пример 99.
К раствору метилового эфира 3-(3-нитрофенил)бензойной кислоты (2 г) в метаноле (30 мл) добавляют 10%-ый палладий на угле (0,4 г) и смесь подвергают каталитическому восстановлению при комнатной температуре и атмосферном давлении. Спустя один час катализатор удаляют фильтрованием и фильтрат испаряют в вакууме. Кристаллизацией остатка из диэтилового эфира получают метиловый эфир 3-(3-аминофенил)бензойной кислоты (1,45 г).
Т.пл. 63-65oC.
ИК (ньюджол): 3400, 1705, 1220, 755 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, с), 6,6 - 6,66 (1H, м), 6,8 - 6,95 (2H, м), 7,15 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,59 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,8 - 7,95 (2H, м), 8,1 - 8,13 (1H, м).
Препаративный пример 100.
4,4-Диметил-2-[3-(2-нитрофенил)фенил]-4,5-дигидрооксазол (1,7 г) кипятят в 95%-ном метанольном растворе серной кислоты (приготовлен смешиванием метанола (15 мл), концентрированной серной кислоты (1,15 мл) и воды (1,44 мл) и доведением общего объема до 28,7 мл добавлением дополнительного количества метанола). После охлаждения раствор концентрируют примерно до 7 мл и переносят в эфир (60 мл). Эфирный раствор промывают водным раствором карбоната калия и рассолом, сушат над сульфатом магния и концентрированием в вакууме получают метиловый эфир 3-(2-нитрофенил)бензойной кислоты в виде желтого твердого вещества.
Т.пл. 88-90oC.
ИК (ньюджол): 1720, 1520 см-1.
ЯМР (ДМСО-d6) δ: 3,88 (3H, с), 7,58 - 7,82 (5H, м), 7,89 (1H, с), 8 - 8,04 (2H, м).
(+) APCI MACC (m/z): 258 /M+H/+.
Препаративный пример 101.
По методике, аналогичной методике препаративного примера 100, получено следующее соединение:
Метиловый эфир 3-3-(метоксикарбонил)фенил бензойной кислоты.
Т.пл. 99-101oC.
ИК (ньюджол): 1730, 1320, 1260, 1240 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (6H, с), 7,66 (2H, дд, J = 7,8 Гц, 7,8 Гц), 8,01 (4H, дд, J = 7,8 Гц, 1,8 Гц), 8,2 (2H, дд, J = 1,6 Гц, 1,6 Гц).
(+) APCI MACC (m/z): 271 /M+H/+.
Препаративный пример 102.
К раствору метилового эфира 3-бензилокси-5-фенилбензойной кислоты (10 г) в уксусной кислоте (300 мл) добавляют 10%-ый палладий на угле (1 г) и смесь подвергают каталитическому гидрированию при 80oC и атмосферном давлении. Катализатор удаляют фильтрованием и фильтрат испаряют в вакууме. К остатку добавляют этилацетат и воду и добавлением карбоната калия устанавливают pH 5. Отделенный органический слой промывают рассолом, сушат над сульфатом магния и испарением в вакууме получают метиловый эфир 3-гидрокси-5-фенилбензойной кислоты.
Т.пл. 108-110oC.
ИК (ньюджол): 3400, 1710, 1590, 1350, 1250 см-1.
ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 7,29 (1H, дд, J = 1,7 Гц, 1,7 Гц), 7,36 - 7,54 (4H, м), 7,62 - 7,67 (3H, м), 10,05 (1H, с).
(+) APCI MACC (m/z): 229 /M+H/+.
Препаративный пример 103.
Смесь метилового эфира 3-гидроксиметил-5-(пиррол-1-ил)бензойной кислоты (20 г) и диоксида марганца (100 г) в дихлорметане (0,5 л) перемешивают 22 часа при комнатной температуре. Диоксид марганца отфильтровывают и фильтрат испаряют в вакууме. Измельчением остатка в диизопропиловом эфире и петролейном эфире получают метиловый эфир 3-формил-5-(пиррол-1-ил)бензойной кислоты (17,6 г).
Т.пл. 85-86oC.
ИК (ньюджол): 1710, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,94 (3H, с), 6,3 - 6,4 (2H, м), 7,5 - 7,6 (2H, м), 8,2 - 8,4 (3H, м), 10,12 (1H, с).
(+) APCI MACC (m/z): 230 /M+H/+.
Препаративный пример 104.
В охлаждаемой льдом смеси метилового эфира 3-амино-5-(пиррол-1-ил)бензойной кислоты (1 г) и пиридина (0,41 мл) в дихлорметане (20 мл) добавляют бромацетилбромид (0,44 мл). После перемешивания 6 часов при комнатной температуре реакционную смесь переносят в смесь этилацетата с ледяной водой. Органический слой последовательно промывают рассолом и сушат над сульфатом магния. Растворитель испаряют в вакууме и измельчением остатка в диэтиловом эфире получают метиловый эфир 3-(бромацетиламино-5-(пиррол-1-ил)бензойной кислоты (1,51 г).
Т.пл. 154 - 157oC
ИК (ньюджол): 3250, 1715, 1650, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,9 (3H, с), 4,09 (2H, с), 6,3 - 6,4 (2H, м), 7,3 - 7,4 (2H, м), 7,7 - 7,8 (1H, м), 8 - 8,1 (2H, м), 10,78 (1H, с).
(+) APCI MACC (m/z): 337, 339 /M+H/+
Препаративный пример 105.
Смесь метилового эфира 3-бромацетиламино-5-(пиррол-1-ил)бензойной кислоты (0,5 г) и морфолина (0,28 мл) в дихлорметане (5 мл) и тетрагидрофуране (7 мл) перемешивают 17 часов при комнатной температуре. Затем реакционную смесь переносят в смесь этилацетата с водой. Органический слой последовательно промывают рассолом и сушат над сульфатом магния. Растворитель испаряют в вакууме и остаток очищают колоночной хроматографией на силикагеле с элюированием хлороформом. Элюируемые фракции, содержащие целевой продукт, собирают и испарением в вакууме получают метиловый эфир 3-морфолиноацетиламино-5-(пиррол-1-ил)бензойной кислоты (0,48 г). Т.пл. 108-109oC.
ИК (ньюджол): 1725, 1690, 1605 см-1.
ЯМР (ДМСО-d6) δ: 2,4-2,6 (4H, м), 3,18 (2H, с), 3,6 - 3,8 (4H, м), 3,89 (3H, с), 6,3 - 6,4 (2H, м), 7,2 - 7,3 (2H, м), 7,7 - 7,8 (1H, м), 8,1 - 8,3 (2H, м), 10,08 (1H, с).
(+) APCI MACC (m/z): 344 /M+H/+
Препаративный пример 106.
По методике, аналогичной методике препаративного примера 105, получено следующее соединение:
Метиловый эфир 3-диэтиламиноацетиламино-5-(пиррол-1-ил)-бензойной кислоты
Т.пл. 103-105oC.
ИК (ньюджол): 3250, 2960, 1720, 1685, 1600 см-1.
ЯМР (ДМСО-d6) δ: 1,03 (6H, т, J = 7,1 Гц), 2,62 (4H, к, J = 7,1 Гц), 3,19 (2H, с), 3,89 (2H, с), 6,2 - 6,4 (2H, м), 7,3 - 7,4 (2H, м), 7,73 (1H, с), 8,13 (1H, с), 8,31 (1H, с), 10,01 (1H, с).
(+) APCI MACC (m/z): 330 /N+H/+.
Препаративный пример 107.
К смеси метилового эфира 3-амино-5-(пиррол-1-ил)бензойной кислоты (2 г) и триэтиламина (1,4 мл) в дихлорметане (130 мл) при -78oC добавляют бис(трифторметансульфоновый)ангидрид (1,7 мл). Реакционную смесь оставляют нагреваться до комнатной температуры и затем переносят в смесь этилацетата с водой. Органический слой последовательно промывают рассолом и сушат над сульфатом магния. Растворитель испаряют в вакууме и измельчением остатка в петролейном эфире получают метиловый эфир 3-трифторметилсульфониламино-5-(пиррол-1-ил)бензойной кислоты (3,17 г).
Т.пл. 147-148oC.
ИК (ньюджол): 3150, 1705, 1600 см-1
ЯМР (ДМСО-d6): δ: 3,91 (3H, с), 6,3-6,4 (2H, м), 7,4 - 7,5 (2H, м), 7,6 - 8 (3H, с).
(+) APCI MACC (m/z): 349 /M+H/+.
Препаративный пример 108.
По методике, аналогичной методике препаративного примера 107, получено следующее соединение:
Метиловый эфир 3-(3-трифторметилсульфониламинофенил)-бензойной кислоты
Т.пл. 103 - 104oC
ИК (ньюджол): 3200, 1705, 960, 750 см-1.
ЯМР (ДМСО-d6) δ: 3,9 (3H, с), 7,31 - 7,36 (1H, м), 7,5 - 7,72 (4H, м), 7,9 - 8,05 (2H, м), 8,14 - 8,17 (1H, м),
(+) APCI MACC (m/z): 360 /M+H/+.
Препаративный пример 109.
Смесь метилового эфира 3-формил-5-(пиррол-1-ил)бензойной кислоты (3 г), малоновой кислоты (2,73 г), пиперидина (0,3 мл) и пиридина (30 мл) перемешивают 1 час при 80oC. После охлаждения до комнатной температуры реакционную смесь переносят в воду. Раствор подкисляют до pH 1 и экстрагируют этилацетатом. Экстракт промывают водой и рассолом и сушат над сульфатом магния. Растворитель испаряют в вакууме и остаток очищают колоночной хроматографией на силикагеле с элюированием смесью хлороформ-метанол (15:1). Элюируемые фракции, содержащие целевой продукт, собирают и испарением в вакууме получают метиловый эфир 3-[(E)-2-карбоксиэтенил]-5-(пиррол-1-ил)бензойной кислоты (2,43 г).
Т.пл. 210 - 211oC.
ИК (ньюджол): 1720, 1630, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,9 (3H, с), 6,3 - 6,4 (2H, м), 6,81 (1H, д, J = 16 Гц), 7,5 - 7,6 (2H, м), 7,65 (1H, д, J = 16 Гц), 7,9 - 8,3 (3H, м),
(+) APCI MACC (m/z): 272 /M+H/+.
Препаративный пример 110.
К смеси метилового эфира 3-[(E)-карбоксиэтенил]-5-(пиррол-1-ил)бензойной кислоты (1,9 г) и хлорида никеля (11) в метаноле (40 мл) добавляют порциями боргидрид натрия (1,24 г). После перемешивания 7 часов при комнатной температуре реакционную смесь фильтруют и переносят в воду с последующим подкислением до pH 2. Образовавшийся осадок отфильтровывают и после промывания водой получают метиловый эфир 3-(2-карбоксиэтил)-5-(пиррол-1-ил)бензойной кислоты (1,72 г).
Т.пл. 129 - 130oC.
ИК (ньюджол): 1720, 1700, 1600 см-1.
ЯМР (ДМСО-d6) δ: 2,64 (2H, т, J = 7,4 Гц), 2,95 (2H, т, J = 7,4 Гц), 3,88 (3H, с), 6,3 - 6,4 (2H, м), 7,4 - 7,5 (2H, м), 7,7 - 7,9 (3H, м), 12,19 (1H,ш.с).
(+) APCI MACC (m/z): 274 /M+H/+.
Элементный анализ для C15H15NO4
Вычислено: C 65,93, H 5,53, N 5,13
Найдено: C 65,88, H 5,68, N 5,05
Препаративный пример 111.
Смесь метилового эфира 3-(2-формилпиррол-1-ил)бензойной кислоты (3 г), малоновой кислоты (2,7 г), пиридина (30 мл) и пиперидина (0,3 мл) перемешивают 3 часа при 90-100oC. Реакционную смесь переносят в воду и добавлением 6 н. соляной кислоты смесь подкисляют до pH 1. Затем смесь экстрагируют смесью этилацетата с тетрагидрофураном. Слой экстракта промывают рассолом, сушат над сульфатом магния и испаряют в вакууме. Перекристаллизацией остатка из этанола получают метиловый эфир -3[2-((E)-2-карбоксиэтенил)пиррол-1-ил] бензойной кислоты.
Т.пл. 201 - 203oC.
ИК (ньюджол): 1728, 1673, 1610 см-1.
ЯМР (ДМСО-d6) δ: 3,89 (3H, c), 6,12 (1H, д, J = 15,7 Гц), 6,35 - 6,39 (1H, м), 7 - 7,04 (1H, м), 7,17 (1H, д, J = 15,7 Гц), 7,29 (1H, с), 7,6 - 7,8 (2H, м), 7,84 (1H, c), 8,04 - 8,11 (1H, м), 12,11 (1H, c).
Препаративный пример 112.
Смесь метилового эфира 3-(2-карбоксиэтил)-5-(пиррол-1-ил)бензойной кислоты (1,5 г), дифенилфосфорилазида (1,25 г) и триэтиламина (0,8 мл) в трет-бутиловом спирте (20 мл) кипятят 7 часов. После охлаждения до комнатной температуры реакционную смесь переносят в водный этилацетат. Органический слой последовательно промывают 1 н. соляной кислотой, водой и рассолом и сушат над сульфатом магния. Растворитель испаряют в вакууме и остаток очищают колоночной хроматографией на силикагеле с элюированием хлороформом. Элюируемые фракции, содержащие целевой продукт, собирают и испарением в вакууме получают метиловый эфир 3-(2-трет-бутоксикарбониламиноэтил)-5-(пиррол-1-ил)бензойной кислоты (0,89 г).
Т.пл. 82 - 83oC.
ИК (ньюджол): 3350, 1725, 1685, 1600 см-1.
ЯМР (ДМСО-d6) δ: 1,32 (9H, c), 2,7 - 2,9 (2H, м), 3,1 - 3,3 (2H, м), 3,88 (3H, с), 6,2 - 6,3 (2H, м), 6,8 - 7 (1H, м), 7,4 - 7,5 (2H, м), 7,6 - 7,9 (3H, м).
(+) APCI MACC (m/z): 345 /M+H/+.
Препаративный пример 113.
Смесь метилового эфира 3-формил-5-(пиррол-1-ил)бензойной кислоты (1,66 г), 2-аминоэтанола (0,88 мл) и молекулярных сит 4А (1,7 г) в метаноле (40 мл) перемешивают 6 часов при комнатной температуре. Затем к реакционной смеси добавляют боргидрид натрия (0,55 г). После перемешивания 3 часа при комнатной температуре реакционную смесь переносят в насыщенный водный раствор гидрокарбоната натрия и фильтруют. Фильтрат испаряют в вакууме и остаток очищают колоночной хроматографией на силикагеле с элюированием смесью хлороформ-метанол (20: 1), элюируемые фракции, содержащие целевой продукт, собирают и испарением в вакууме получают метиловый эфир 3-(2-гидроксиэтиламинометил)-5-пиррол-1-ил)бензойной кислоты (0,8 г).
Т.пл. 85 - 87oC.
ИК (ньюджол): 3150, 1715, 1600 см-1.
ЯМР (ДМСО-d6 ) δ: 2,32 (1H, ш.2), 2,58 (2H, т, J = 5,8 Гц), 3,4 - 3,6 (2H, м), 3,80 (2H, с), 3,89 (3H, с), 4,4 - 4,6 (1H, м), 6,2 - 6,4 (2H, м), 7,4 - 7,5 (2H, м), 7,8 - 8 (3H, м),
(+) APCI MACC (m/Z): 275 /M+H/+.
Препаративный пример 114.
По методике, аналогичной методике препаративного примера 113, получено следующее соединение:
Метиловый эфир 3-диметиламинометил-5-(пиррол-1-ил)-бензойной кислоты
ИК (ньюджол): 2590, 2565, 2555, 1720, 1600 см-1.
ЯМР (ДМСО-d6 ) δ: 2,19 (6H, с), 3,51 (2H, с) 3,89 (3H, с), 6,2 - 6,4 (2H, м), 7,4 - 7,5 (2H, м), 7,7 - 8 (3H, м).
(+) APCI MACC (m/Z): 259 /M+H/+.
Препаративный пример 115.
К раствору метилового эфира 3-нитро-5-(пиррол-1-ил)бензойной кислоты (35,8 г) в концентрированной соляной кислоте (79 мл) и метаноле (79 мл) прибавляют порциями железо (48,6 г). После перемешивания 3,5 часа при комнатной температуре реакционную смесь переносят в смесь этилацетата с водой и фильтруют. Органический слой последовательно промывают водой и рассолом и сушат над сульфатом магния. Растворитель испаряют в вакууме и измельчением остатка в петролейном эфире и диизопропиловом эфире получают метиловый эфир 3-амино-5-(пиррол-1-ил)бензойной кислоты (22,7 г).
Т.пл. 116 - 117oC.
ИК (ньюджол): 3430, 3330, 1710, 1620, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,84 (3H, с), 5,65 (2H, ш.с), 6,2 - 6,3 (2H, м), 6,9 - 7,3 (5H, м).
(+) APCI MACC (m/Z): 217 /M+H/+.
Препаративный пример 116.
К охлаждаемой льдом смеси метилового эфира 3-(2-гидроксиэтиламинометил)-5-(пиррол-1-ил)бензойной кислоты (0,8 г) и триэтиламина (0,48 мл) добавляют бензилхлорформат (0,46 мл). После перемешивания 2 часа при охлаждении льдом реакционную смесь переносят в смесь этилацетата с водой. Органический слой промывают рассолом и сушат над сульфатом магния. Растворитель испаряют в вакууме и остаток очищают колоночной хроматографией на силикагеле и элюированием смесью хлороформметанол (15:1). Элюируемые фракции, содержащие целевой продукт, собирают и испарением в вакууме получают метиловый эфир 3-[N-бензилоксикарбонил-N-(2-гидроксиэтил)аминометил] - 5-(пиррол-1-ил)бензойной кислоты (1,11 г).
ИК (пленка): 1420, 2950, 1715, 1695, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,3 - 3,6 (4H, м), 3,88 (3H, с), 4,63 (2H, с), 4,79 (1H, т, J = 5,2 Гц), 5,1 - 5,2 (2H, м), 6,3 - 6,4 (2H, м), 7,1 - 7,2 (7H, м), 7,6 - 7,8 (2H, м), 7,93 (1H, с).
(+) APCI (MACC (m/Z): 409 /M+H/+.
Препаративный пример 117.
По методике, аналогичной методике препаративного примера 74, получено следующее соединение:
Метиловый эфир 2-ацетокси-3-(пиррол-1-ил)бензойной кислоты
ИК (пленка): 1765, 1725, 1585 см-1.
ЯМР (ДМСО-d6) δ: 2,17 (3H, с), 3,84 (3H, с), 6,23 - 6,29 (2H, м), 6,96 - 7,02 (2H, м), 7,52 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,76 (1H, дд, J = 1,6 Гц, 7,9 Гц), 7,92 (1H, дд, J = 1,6 Гц, 7,9 Гц).
Препаративный пример 118.
По методике, аналогичной методике препаративного примера 75, получено следующее соединение:
Метиловый эфир 3-(2-формилпиррол-1-ил)-2-гидроксибензойной кислоты
ИК (ньюджимол): 1660 см-1.
ЯМР (ДМСР-d6) δ: 3,94 (3H, с), 6,42 - 6,49 (1H, м), 7,07 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,14 - 7,21 (1H, м), 7,28 - 7,33 (1H, м), 7,61 (1H, дд, J = 1,7 Гц, 7,9 Гц), 7,88 - 7,96 (1H, м), 9,43 (1H, с), 10,89 (1H, с).
Препаративный пример 119.
По методике, аналогичной методике препаративного примера 76, получено следующее соединение:
Метиловый эфир 2-гидрокси-3-(2-гидроксиметилпирол-1-ил)-бензойной кислоты
ИК (пленка): 1670 см-1.
ЯМР (ДМСО-d6) δ: 3,94 (3H, с), 4,23 (2H, д, J = 5,1 Гц), 4,71 (1H, т, J = 5,1 Гц), 6,06 - 6,16 (2H, м), 6,73 - 6,79 (1H, м), 7,05 (1H, т, J = 7,9 Гц, 7,9 Гц), 7,61 (1H, дд, J = 1,7 Гц, 7,9 Гц), 7,88 (1H, дд, J = 1,7 Гц, 7,9 Гц), 10,9 (1H, с).
Препаративный пример 120.
По методике, аналогичной методике препаративного примера 77, получено следующее соединение:
6-Метоксикарбонил-4H-пирроло/2,1-с//1,4/бензоксазин.
ИК (пленка): 1725 см-1.
ЯМР (ДМСО-d6) δ: 3,82 (3H, с), 5,23 (2H, с), 6,07 - 6,13 (1H, м), 6,28 - 6,36 (1H, м), 7,14 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,42 - 7,66 (2H, м), 7,88 (1H, дд, J = 1,6 Гц, 7,9 Гц).
(+) APCI MACC (m/Z): 230 /M+H/+.
Препаративный пример 121.
Смесь метилового эфира 3-аминобензойной кислоты (110 г) и 2,5-диметокситетрагидрофурана (141,4 мл) в уксусной кислоте (330 мл) кипятят с перемешиванием 50 минут, после чего растворитель удаляют концентрированием в вакууме. К остатку добавляют смесь этилацетата с водой и добавлением карбоната калия устанавливают pH 8. Отделенный органический слой промывают водой и сушат над сульфатом магния. Испарением растворителя получают остаток, который очищают колоночной хроматографией на силикагеле с элюированием хлороформом. Элюируемые фракции, содержащие целевой продукт, собирают и испарением в вакууме получают метиловый эфир 3-(пиррол-1-ил)бензойной кислоты (112,84 г) в виде масла.
ИК (пленка): 1720, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 6,3 - 6,38 (2H, с), 7,4 - 7,48 (2H, м), 7,59 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,8 - 7,92 (2H, м), 8,05 (1H, дд, J = 1,9 Гц, 1,9 Гц).
Препаративный пример 122.
К раствору метилового эфира 3-(пиррол-1-ил)бензойной кислоты (35 г) и дихлорметане (350 мл) прибавляют при температуре от -10oC до -20oC по каплям хлорсульфонилизоцианат (18,2 мл) и смесь перемешивают 1 час при той же температуре. К смеси при указанной температуре прибавляют по каплям N,N-диметилформамид (105 мл) и смесь перемешивают 1 час при 0o-5oC. Затем реакционную смесь переносят в воду. Отделенный органический слой промывают насыщенным водным раствором бикарбоната натрия и водой. Органический раствор сушат над сульфатом магния и испарением в вакууме получают метиловый эфир 3-(2-цианопиррол-1-ил)бензойной кислоты (30,67 г)
Т.пл. 89-90oC.
ИК (ньюджол): 2220, 1715, 1590 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 6,49 (1H, дд, J = 2,8 Гц, 3,9 Гц), 7,28 (1H, дд, J = 1,6 Гц, 3,9 Гц), 7,65 (1H, дд, J = 1,6 Гц), 2,8 Гц), 7,76 (1H, дд, J = 8 Гц), 8 Гц), 7,85 - 7,92 (1H, м), 8,04 - 8,1 (2H, м).
(+) APCI МАСС (m/z): 227 (M+H)+.
Элементный анализ для C13H10N2O2
Вычислено: C 69,02, H 4,46, N 12,38
Найдено: C 68,69, H 4,46, N 12,26
Пример 1.
К раствору гидрохлорида гуанидина (3,2 г) в сухом метаноле (40 мл) добавляют 28%-ный метанольный раствор метоксида натрия (6,2 мл) и смесь перемешивают 30 минут при комнатной температуре. К смеси добавляют метиловый эфир 3-метилсульфонил-5-(пиррол-1-ил)бензойной кислоты (1,9 г) и смесь перемешивают 7 часов при той же температуре. Растворитель удаляют концентрированием и к остатку добавляют смесь этилацетата, тетрагидрофурана и воды. Отделенный органический слой промывают рассолом и сушат над сульфатом магния. Остаток, полученный испарением растворителя, очищают колоночной хроматографией на оксиде алюминия с элюированием смесью хлороформ-метанол (19:1, об. /об. ). Фракции, содержащие целевой продукт, собирают и испаряют в вакууме. Перекристаллизацией остатка из смеси метанола с диизопропиловым эфиром получают 2-[3-метилсульфонил-5-(пиррол-1-ил)бензоил]гуанидин (0,44 г).
Т. пл. 235 - 236oC.
ИК (ньюджол): 3500, 3440, 3340, 3240, 1635, 1600, 1320, 1135 см-1.
ЯМР (ДМСО-d6) δ: 3,34 (3H, с), 6,3 - 6,4 (2H, с), 6,6 - 8,5 (4H, ш.), 7,47 - 7,57 (2H, м), 8,1 - 8,17 (1H, м), 8,4 - 8,48 (2H, м).
МАСС (m/z): 306 (M+).
Пример 2.
По методике, аналогичной методике примера 1, получены следующие соединения:
(1) 2-[{5-(Пиррол-1-ил)пиридин-3-ил}карбонил]гуанидин
Т. пл. 147 - 150oC. (разл).
ИК (ньюджол): 3400, 3300, 1590, 725 см-1.
ЯМР (ДМСО-d6) δ: 6,3 - 6,4 (2H, м), 7,4 - 7,5 (2H, м), 8,39 (1H, дд, J = 2,7 Гц, 1,7 Гц), 8,94 (1H, дд, J = 2,7 Гц), 9,06 (1H, д, J = 1,7 Гц), 6,4 - 7,4 (2H, ш.), 7,6 - 8,4 (2H, ш.).
(2) 2-[{5-(3-Метил-1,2,4-оксадиазол-5-ил)пиридин-3-ил}- карбонил]гуанидин
Т. пл. 219 - 221oC.
ИК (ньюджол): 3400, 3310, 1660, 1520 см-1.
ЯМР (ДМСО-d6) δ: 2,46 (3H, с), 8,96 (1H, т, J = 2,1 Гц), 9,28 (1H, д, J = 2,1 Гц), 9,38 (1H, д, J = 2,1 Гц).
МАСС (m/z): 247 (M+ + 1).
(3) 2-[2-Метокси-5-метилсульфонил-3-(пиррол-1-ил)-бензоил] гуанидин
Т. пл. 180 - 183oC.
ИК (ньюджол): 3410, 3300, 1675, 1605 см-1.
ЯМР (ДМСО-d6) δ: 3,28 (3H, с), 3,56 (3H, м), 6,29 (2H, с), 7,16 (2H, с), 6,6 - 7,4 (2H, ш.), 7,81 (1H, д, J = 2,3 Гц), 7,9 (1H, д, J = 2,3 Гц), 7,5 - 8,3 (2H, ш.).
(4) 2-[3-Нитро-5-(пиррол-1-ил)бензоил]гуанидин
Т. пл. 211oC.
ИК (ньюджол): 1710, 1530, 1355, 1335, 1260, см-1.
ЯМР (ДМСО-d6) δ: 6,36 (2H, м), 7,55 (2H, м), 6,6 - 7,4 (2H, ш.), 7,8 - 8,4 (2H, ш.), 8,4 - 8,45 (1H, м), 8,5 - 8,55 (1H, м), 8,65 - 8,7 (1H, м).
МАСС (m/z): 274 (M+ + 1).
(5) 2-[3-Метоксикарбонил-5-(пиррол-1-ил)бензоил]гуанидин
Т. пл. 248 - 250oC.
ИК (ньюджол): 3450, 3400, 3325, 1715, 1630, 720 см-1.
ЯМР (ДМСО-d6) δ: 3,91 (3H, с), 6,32 (2H, м), 7,41 2H, м), 8,08 - 8,1 (1H, м), 8,37 - 8,4 (1H, м), 8,5 - 8,6 (1H, м).
МАСС (m/z): 287 (M+ + 1).
(6) 2-[3-Феноксибензоил]гуанидина гидрохлорид
Т. пл. 144 - 145oC.
ИК (ньюджол): 3340, 1700, 1360, 1260, 990, 860 см-1.
ЯМР (ДМСО-d6) δ: 7,05 - 7,12 (3H, м), 7,15 - 7,5 (3H, м), 7,6 - 7,7 (2H, м), 7,95 - 8,1 (1H, м), 8,63 (2H ш.с), 8,77 (2H, ш.с), 12,11 (1H, с).
(7) 2-[3-(3-Тиенил)бензоил]гуанидина гидрохлорид
Т, пл. 224 - 225oC.
ИК (ньюджол): 3350, 1690, 1280, 745, 720 см-1.
ЯМР (ДМСО-d6) δ: 7,6 - 7,8 (3H, м), 7,96 - 8,2 (3H, м), 8,57 (2H, с), 8,62 (1H, с), 8,88 (2H, с), 12,28 (1H, с).
МАСС (m/z): 246 (M+ + 1).
(8) 2-[3-Пиразол-1-ил)бензоил]гуанидин
Т. пл. 155 - 157oC.
ИК (ньюджол): 3430, 3330, 3200, 3100, 1670 см-1.
ЯМР (ДМСО-d6) δ: 6,13 - 8,7 (4H, ш.), 6,55 (1H, дд, J = 1,8 Гц, 2,4 Гц), 7,51 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,76 (1H, д, J = 1,4 Гц), 7,83 - 7,95 (1H, м), 7,99 (1H, д, J = 7,9 Гц), 8,49 (1H, д, J = 2,4 Гц), 8,54 (1H<д, J = 1,8 Гц).
(9) 2-[3-(Пиррол-1-ил)бензоил]гуанидин
Т. пл. 172 - 173oC.
ИК (ньюджол): 3310, 3120, 1665, 1635, 1600 см-1.
ЯМР (ДМСО-d6) δ: 6,13 - 8,6 (4H, ш.), 6,22 - 6,35 (2H, м), 7,28 - 7,39 (2H, м), 7,47 (1H, д, J = 7,8 Гц, 7,8 Гц), 7,64 (1H, д, J = 7,8 Гц), 7,94 (1H, д, J = 7,8 Гц), 8,17 (1H, с).
МАСС (m/z): 229 (M+ + 1).
Элемент анализ для C12H12N4O
Вычислено: C 63,15, H 5,30, N 24,55
Найдено: C 62,95, H 5,29, N 24,59
(10) 2-[3-(1H-тетразол-1-ил)бензоил]гуанидин
Т. пл. 227 - 230oC.
ИК (ньюджол): 3410, 3325, 3280, 3220, 3125, 1655, 1600 см-1.
ЯМР (ДМСО-d6) δ: 6,37 - 8,6 (4H, ш.), 7,68 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,98 (1H, д, J = 7,9 Гц), 8,23 (1H, д, J = 7,9 Гц), 8,55 (1H, дд, J = 1,7 Гц, 1,7 Гц), 10,16 (1H, с).
(11) 2-[3-(Пиррол-1-ил)бензоил]гуанидин
Т. пл. 172 - 173oC.
ИК (ньюджол): 3310, 3120, 1665, 1635, 1600 см-1.
ЯМР (ДМСО-d6) δ: 6,13 - 8,6 (4H, ш.), 6,22 - 6,35 (2H, м), 7,28 - 7,39 (2H, м), 7,47 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,4 (1H, д. J = 7,8 Гц), 7,94 (1H, д, J = 7,8 Гц), 8,17 (1H, с).
(12) 2-[5-(Пиразол-3-ил)пиридин-3-ил-карбонил]гуанидин
Т. пл. 264 - 265oC.
ИК (ньюджол): 3440, 3310, 3170, 3100, 1690 см-1.
ЯМР (ДМСО-d6) δ: 6,37 - 8,4 (4H, ш.), 6,85 (1H, д, J = 2,3 Гц), 7,84 (1H, д, J = 2,3 Гц), 8,74 (1H, дд, J = 2 Гц, 2 Гц), 9,06 (1H, д, J = 2 Гц), 9,11 (1H, д, J = 2 Гц), 13,11 (1H, ш.с).
МАСС (m/z): 231 (M + + 1).
Элементный анализ для C10H10N6O
Вычислено: C 52,17, H 4,38, N 36,50
Найдено: C 52,22, H 4,50, N 36,31
(13) 2-[3,5-Ди(пиррол-1-ил)бензоил]гуанидин
Т. пл. 220 - 221oC.
ИК (ньюджол): 3480, 3430, 3300, 3200, 1630, 1600 см-1.
ЯМР (ДМСО-d6) δ: 6,28 - 6,39 (4H, м), 6,5 - 8,4 (4H, ш.), 7,45 - 7,53 (4H, м), 7,82 (1H, дд, J = 2,1 Гц, 2,1 Гц), 8,03 (2H, д, J = 2,1 Гц).
МАСС (m/z): 294 (M+ + 1).
Элементный анализ для C16H15N5O
Вычислено: C 65,52, H 5,15, N 23,88
Найдено: C 65,79, H 5,22, N 23,60
(14) 2-[3-(2,5-Диметилпиррол-1-ил)бензоил]гуанидин
Т. пл. 204 - 205oC.
ИК (ньюджол): 3430, 3350, 3300, 1650, 1600 см-1.
ЯМР (ДМСО-d6) δ: 1,95 (6H, с), 5,8 (2H, с), 6 - 8,3 (4H, ш.), 7,32 - 7,39 (1H, м), 7,53 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,92 (1H, дд. J = 1,7 Гц, 1,7 Гц), 8,06 - 8,12 (1H, м).
МАСС (m/z): 257 (M + 1).
Элементный анализ для C14H16N4O
Вычислено: C 65,61, H 6,29, N 21,86
Найдено: C 65,77, H 6,54, N 21,70
(15) 2-[2-(Пиррол-1-ил)бензоил]гуанидин
Т. пл. 172 - 173oC.
ИК (ньюджол): 3380, 1655, 1595 см-1.
ЯМР (ДМСО-d6) δ: 6,1 - 6,18 (2H, м), 6,35 - 8,2 (4H, ш.), 6,94 - 7,03 (2H, м), 7,25 (1H, дд, J = 1,6 Гц, 7,1 Гц), 7,3 - 7,48 (3H, м).
МАСС (m/z): 229 (M + + 1).
(16) 2-[3-Метилсульфонил-4-пиперидино-5-(пиррол-1-ил)- бензоил]гуанидин
Т. пл. 178 - 179oC.
ИК (ньюджол): 3425, 3350, 3170, 1650, 1590, 1140 см-1.
ЯМР (ДМСО-d6) δ: 0,8 - 1,8 (6H, м), 2,1 - 2,48 (2H, м), 2,95 - 3,28 (2H, м), 3,4 (3H, с), 6,22 - 6,32 (2H, м), 6,4 - 8,4 (4H, ш.), 6,29 - 7,02 (2H, м), 8,14 (1H, д, J = 2 Гц), 8,7 (1H, д, J = 2 Гц).
МАСС (m/z): 389 (M+).
Пример 3.
К раствору гидрохлорида гуанидина (2,7 г) в метаноле (12 мл) добавляют метоксид натрия (5,13 г, 28% в метаноле) и смесь перемешивают 15 минут в атмосфере азота. К полученной смеси добавляют раствор метилового эфира 3-фенилбензойной кислоты (1,2 г) в метаноле (2 мл) и смесь перемешивают 6 часов. Затем реакционную смесь переносят в смесь этилацетата (100 мл) с водой (50 мл). Органический слой последовательно промывают 5 н. водным раствором гидроксида натрия и рассолом, сушат над сульфатом магния и испаряют в вакууме. Остаток очищают колоночной хроматографией на оксиде алюминия (100 мл) с элюированием смесью хлороформ-метанол (10:1). Содержащие целевой продукт фракции собирают и испаряют в вакууме. Остаток кристаллизуют 4 н. раствора хлористого водорода в этилацетате. Перекристаллизацией кристаллического продукта из этанола получают 2-[3-фенилбензоил]гуанидина гидрохлорид (274 мг).
Т. пл. 168 - 169oC.
ИК (ньюджол): 3325, 1700, 1630, 1260, 740 см-1.
ЯМР (ДМСО-d6) δ: 7,4 - 7,6 (3H, м), 7,7 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,8 - 7,9 (2H, м), 8 - 8,01 (2H, м), 8,4 - 8,45 (1H, м), 8,58 (2H, ш.), 8,82 (2H, ш.), 12,25 (1H, с).
МАСС (m/z): 240 (M+ + 1).
Пример 4.
По методике, аналогичной методике примера 3, получено следующее соединение:
4,4-Диметил-5-диаминометиленаминокарбонил-8-метилсульфонил- 4H-пирроло/2,1-c//1,4/бензоксазина гидрохлорид
Т. пл. 165 - 166oC.
ИК (ньюджол): 3370, 3280, 3200, 1695, 1320, 1130 см-1.
ЯМР (ДМСО-d6) δ: 1,64 (6H, с), 3,57 (3H, с), 6,22 (1H, дд, J = 1,3 Гц, 3,2 Гц), 6,38 (1H, дд, J = 3,2 Гц, 3,2 Гц), 7,74 (2H, дд, J = 1,3 Гц, 3,2 Гц), 7,98 (1H, д, J = 2,1 Гц), 8,39 (1H, д, J = 2,1 Гц), 8,45 - 8,85 (4H, м), 12,01 (1H, с).
МАСС (m/z): 363 (M+ + 1 свободного основания).
Пример 5.
К охлаждаемому льдом раствору 6-карбокси-8-хлор-4,4-диметил- 4H-пирроло/2,1-c//1,4/бензоксазина (0,7 г) и триэтиламина (0,39 мл) в тетрагидрофуране (7 мл) и пиридине (14 мл) добавляют изобутилхлорформат (0,38 г). После перемешивания 2 часа при 7 - 10oC к реакционной смеси добавляют гуанидин (0,3 г) и все перемешивают 8 часов при комнатной температуре. Затем реакционную смесь переносят в смесь этилацетата (100 мл) с водой (100 мл). Органический слой последовательно промывают 10%-ным водным раствором карбоната калия, рассолом, сушат над сульфатом магния и испаряют в вакууме. Обработкой остатка этанольным раствором хлористого водорода порлучают гидрохлорид 8-хлор-4,4-диметил-6-диаминометиленкарбонил- 4H-пирроло/2,1-c//1,4/бензоксазина.
Т. пл. 150oC.
ИК (ньюджол): 3350, 1690, 730 см-1.
ЯМР (ДМСО-d6)  1,6 (6H, с), 6,17 (1H, дд, J = 3,4 Гц, 1,3 Гц), 6,33 (1H, дд, J = 3,4 Гц, 3,4 Гц), 7,51 (1H, д. J = 2,4 Гц), 7,63 (1H, дд, J = 3,4 Гц, 1,3 Гц), 8,11 (1H, д, J = 2,4 Гц), 8,4 - 8,9 (4H, м), 11,77 (1H, с).
1,6 (6H, с), 6,17 (1H, дд, J = 3,4 Гц, 1,3 Гц), 6,33 (1H, дд, J = 3,4 Гц, 3,4 Гц), 7,51 (1H, д. J = 2,4 Гц), 7,63 (1H, дд, J = 3,4 Гц, 1,3 Гц), 8,11 (1H, д, J = 2,4 Гц), 8,4 - 8,9 (4H, м), 11,77 (1H, с).
Пример 6.
К смеси 2-3-(1H-тетразол-1-ил)бензоил гуанидина (1,4 г) и метанола (30 мл) добавляют 4 н. раствора хлористого водорода в диоксане (3 мл) и смесь перемешивают 1 час при комнатной температуре. К смеси добавляют диизопропиловый эфир (30 мл) и осадок отфильтровывают. Перекристаллизацией осадка из метанола получают гидрохлорид 2-[3-(1H-тетразол-1-ил)бензоил]гуанидина (1,05 г).
Т. пл. 250 - 251oC.
ИК (ньюджол): 3390, 3230, 3080, 1715, 1605 см-1.
ЯМР (ДМСО-d6) δ: 7,89 (1H, дд, J = 8 Гц, 8 Гц), 8,28 (1H, д, J = 8 Гц), 8,32 (1H, д, J = 8 Гц), 8,53 - 8,9 (5H, м), 10,28 (1H, с), 12,36 (1H, с).
МАСС (m/z): 232 (M+ + 1 свободного основания).
Пример 7.
По методике, аналогичной методике примера 6, получены следующие соединения:
(1) 2-[3-(Пиразол-1-ил)бензоил]гуанидина гидрохлорид
Т. пл. 252 - 253oC.
ИК (ньюджол): 3360, 3270, 1700, 1620, 1585 см-1.
ЯМР (ДМСО-d6) δ: 6,57 - 6,67 (1H, м), 7,73 (1H, дд, J = 8 Гц, 8 Гц), 7,83 (1H, д, J = 1,6 Гц), 8 - 8,1 (1H, м), 8,17 - 8,26 (1H, м), 8,55 - 8,73 (3H, м), 8,73 - 8,9 (3H, м), 12,28 (1H, с).
МАСС (m/z): 230 (M1 + 1) свободного основания).
(2) 2-[3-(Пиррол-1-ил)бензоил]гуанидина гидрохлорид
Т. пл. 215 - 216oC.
ИК (ньюджол): 3350, 3100, 1700, 1690, 1625 см-1.
ЯМР (ДМСО-d6) δ: 6,28 - 6,38 (2H, м), 7,6 - 7,75 (3H, м), 7,9 - 8,63 (2H, м), 8,45 (1H, с), 8,61 (2H, с), 8,88 (2H, с), 12,43 (1H, с).
Элементный анализ для C12H12N4O • HCl
Вычислено: C 54,45, H 4,95, N 21,17, Cl 13,39
Найдено: C 54,52, H 5,04 N 21,11, Cl 13,22
Пример 8.
К раствору гидрохлорида гуанидина (62,1 г) в N,N-диметилформамиде (150 мл) в атмосфере азота добавляют 28%-ный раствор метоксида натрия в метаноле (106 мл). После перемешивания 30 минут при комнатной температуре к реакционной смеси добавляют раствор метилового эфира 3-гидроксиметил-5-(пиррол-1-ил)бензойной кислоты (30 г) в N,N-диметилформамиде (150 мл). После перемешивания 21 час при комнатной температуре реакционную смесь переносят с перемешиванием в воду (1,5 л). Образовавшийся осадок отфильтровывают, промывают водой и очищают колоночной хроматографией на силикагеле с элюированием смесью хлороформ-метанол (10:1). Элюируемые фракции, содержащие целевой продукт, собирают и испаряют в вакууме.
Остаток растворяют в этаноле (70 мл) и кристаллизуют из небольшого избытка 4 н. раствора хлористого водорода в этилацетате. Перекристаллизацией кристаллического продукта из водного этанола получают гидрохлорид 2-[3-гидроксиметил-5-(пиррол-1-ил)бензоил]гуанидина (7,3 г).
Т. пл. 198 - 199oC.
ИК (ньюджл): 3350, 3100, 1720 см-1.
ЯМР (ДМСО-d6) δ: 4,64 (2H, с), 6,3 - 6,4 (2H, м), 7,6 - 7,7 (2H, м), 7,86 (2H, м), 8,34 (1H, м), 8,59 (2H, ш.с), 8,84 (2H, ш.с), 12,32 (1H, с)
МАСС (m/z): 259 (M+ + 1).
Пример 9.
По методике, аналогичной методикам примеров 1, 3 и 8, получены следующие соединения:
(1) 2-[3-(2-Метилфенил)бензоил]гуанидина гидрохлорид
Т. пл. 187 - 189oC.
ИК (ньюджол): 1680, 1560, 1230, 740 см-1.
ЯМР (ДМСО-d6) δ: 2,26 (3H, с), 7,28 - 7,34 (4H, м), 7,63 - 7,74 (2H, м), 8,07 (1H, с), 8,14 (1H, ддд, J = 6,7 Гц, 2,1 Гц, 2,1 Гц), 8,58 (2H, ш.с), 8,75 (2H, ш.с), 12,04 (1H, м).
МАСС (m/z): 254 (M+ + 1).
(2) 2-[3-(2,5-Дихлорпиррол-1-ил)бензоил]гуанидин
Т. пл. 201 - 204oC.
ИК (ньюджол): 3460, 3300, 3180, 1630, 1595 см-1.
ЯМР (ДМСО-d6) δ: 6,2 - 6,83 (4H, м), 6,36 (2H, с), 7,45 (1H, д, J = 7,7 Гц), 7,6 (1H, дд, J = 7,7 Гц), 7,99 (1H, с), 8,18 (1H, д, J = 7,7 Гц).
(3) 2-[3-(2-Ацетилпиррол-1-ил)бензоил]гуанидин
ИК (ньюджол): 3100 - 3300, 1600 - 1660 см-1.
ЯМР (ДМСО-d6) δ: 2,41 (3H, с), 6,3 - 8,3 (4H, ш.), 6,65 - 6,7 (1H, м), 7,38 - 7,45 (1H, м), 7,53 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,75 (1H, д, J = 7,8 Гц), 8,04 (1H, д, J = 7,8 Гц), 8,15 - 8,18 (1H, м), 8,21 - 8,24 (1H, м).
(4) 2-[4-н-Бутил-3-(пиррол-1-ил)бензоил]гуанидин
Т. пл. 163 - 165oC.
ИК (ньюджол): 3400, 3170, 1635, 1590 см-1.
ЯМР (ДМСО-d6) δ: 0,77 (3H, т, J = 7,1 Гц), 1,05 - 1,45 (4H, м), 2,42 - 2,53 (2H, м), 6,1 - 8,4 (4H, ш.), 6,19 - 6,25 (2H, м), 6,95 - 6,9 (2H, м), 7,38 (1H, д, J = 7,9 Гц), 7,92 - 8,03 (2H, м).
(5) 2-[4-Метил-3-(пиррол-1-ил)бензоил]гуанидин
Т. пл. 182 - 185oC.
ИК (ньюджол): 3400, 3170, 1635, 1590 см-1.
ЯМР (ДМСО-d6) δ: 2,19 (3H, с), 6,1 - 8,4 (4H, ш.), 6,2 - 6,25 (2H, м), 6,9 - 6,95 (2H, м), 7,37 (1H, д, J = 8,3 Гц), 7,91 - 8 (2H, м).
(6) 2-[3-(2-Карбамоилпиррол-1-ил)бензоил]гуанидин
Т. пл. 155 - 156oC.
ИК (ньюджол): 3450, 3360, 1655, 1600 см-1.
ЯМР (ДМСО-d6) δ: 6,21 (1H, дд. J = 2,8 Гц, 3,7 Гц), 6,38 - 8,2 (6H, ш.), 6,9 (1H, дд. J = 1,7 Гц, 3,7 Гц), 7 - 7,05 (1H, м), 7,27 - 7,36 (1H, м), 7,43 (1H, дд, J = 1,6 Гц, 7,6 Гц), 7,91 - 7,95 (1H, м), 7,95 - 8,03 (1H, м).
(7) 2-[-[(Z)-2-Гидроксииминометилпиррол-1-ил]бензоил]гуанидин
Т. пл. 131 - 132oC.
ИК (ньюджол): 3380, 3100, 1650, 1600 см-1.
ЯМР (ДМСО-d6) δ: 6,2 - 8,7 (4H, ш.), 6,33 - 6,39 (1H, м), 7,02 (4H, с), 7,11 - 7,16 (1H, м), 7,28 - 7,34 (1H, м), 7,46 - 7,64 (2H, м), 8 - 8,2 (2H, м), 11,45 (1H, с).
(8) 2-[3-(E)-2-гидроксииминометилпиррол-1-ил]бензоил]гуанидин
Т. пл. 158 - 159oC.
ИК (ньюджол): 3440, 3300, 3130, 1660, 1600 см-1.
ЯМР (ДМСО-d6)δ: 6,15 - 8,4 (4H, м), 6,26 - 6,32 (1H, м), 6,6 - 6,64 (1H, м), 7,08 - 7,11 (1H, м), 7,44 (1H, д, J = 7,8 Гц), 7,53 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,77 (1H, с), 8,01 (1H, с), 8,09 (1H, д, J = 7,8 Гц), 10,84 (1H, с).
(9) 2-[3-(2-Диметиламинометилпиррол-1-ил)бензоил]гуанидин
Т. пл. 91 - 94oC.
ИК (ньюджол): 3370, 3200, 1650, 1595 см-1.
ЯМР (ДМСО-d6) δ: 2,08 (6H, с), 3,22 (2H, с), 6,12 - 6,18 (1H, м), 6,3 - 8,4 (4H, ш. ), 7,47 (1H, д, J = 7,8 Гц, 7,8 Гц), 7,65 (1H, д, J = 7,8 Гц), 8,03 (1H, д, J = 7,8 Гц), 8,15 (1H, с).
(10) 2-[3-(2-Цианопиррол-1-ил)бензоил]гуанидин
Т. пл. 136 - 138oC.
ИК (ньюджол): 3390, 2220, 1637 см-1.
ЯМР (ДМСО-d6) δ: 6,3 - 8,4 (4H, ш.), 6,46 (1H, дд, J = 2,8 Гц, 3,9 Гц), 7,24 (1H, дд, J = 1,6 Гц, 3,9 Гц), 7,56 (1H, дд, J = 1,6 Гц, 2,8 Гц), 7,58 - 7,69 (2H, м), 8,11 - 8,19 (2H, м).
(11) 2-[4-н-Бутил-3-(2-цианопиррол-1-ил)бензоил]гуанидин
ИК (пленка): 3350, 2230, 1660 - 1590 (ш.) см-1.
ЯМР (ДМСО-d6) δ: 0,76 (3H, т, J = 7,2 Гц), 1,05 - 1,46 (4H, м), 2,3 - 2,55 (2H, м), 6,2 - 8,7 (4H, ш.), 6,44 (1H, дд, J = 2,7 Гц, 3,9 Гц), 7,15 - 7,22 (1H, дд, J = 1,5 Гц, 3,9 Гц), 7,36 - 7,41 (1H, дд, J = 1,5 Гц, 2,7 Гц), 7,5 (1H, д, J = 8 Гц), 8,01 (1H, д, J = 1,5 Гц), 8,13 (1H, дд, J = 1,5 Гц, 8 Гц).
(12) 2-[3-[(4-Гидроксипиперидин-1-ил)карбонил]-5-(пиррол-1-ил) бензоил] гуанидин
Т. пл. 227 - 228oC.
ИК (ньюджол): 3400, 1630, 1610 см-1.
ЯМР (ДМСО-d6) δ: 1,2 - 2 (4H, м), 3 - 4,2 (5H, м), 4,82 (1H, д, J = 3,4 Гц), 6,2 - 6,4 (2H, м), 7,3 - 7,5 (2H, м), 7,6 - 7,7 (1H, м), 7,8 - 7,9 (1H, м), 8,1 - 8,2 (1H, м).
МАСС (m/z): 356 (M+ + 1).
(13) 2-[3-Карбокси-5-(пиррол-1-ил)бензоил]гуанидин
Т. пл. > 250oC.
ИК (ньюджол): 3370, 1680, 1580 см-1.
ЯМР (ДМСО-d6) δ: 6,2 - 6,4 (2H, м), 7,4 - 7,5 (2H, м), 8,1 - 8,2 (1H, м), 8,3 - 8,4 (1H, м), 8,8 - 8,9 (1H, м).
МАСС (m/z): 273 (M+ + 1).
(14) 2-[3-[(4-Метилпиперазин-1-ил)карбонил] -5-(пиррол-1-ил) бензоил] гуанидина гидрохлорид
Т. пл. 220 - 221oC.
ИК (ньюджол): 3300, 1700, 1640, 1600 см-1.
ЯМР (ДМСО-d6) δ: 2,78 (3H, с), 3 - 3,8 (8H, м), 6,3 - 6,4 (2H, м), 7,7 - 7,8 (2H, м), 7,9 - 8,1 (2H, м), 8,5 - 8,6 (1H, м), 8,7 (2H, ш.с), 8,91 (2H, ш.с).
МАСС (m/z): 355 (M+ + 1).
(15) 2-[3-Метоксиметил-5-(пиррол-1-ил)бензоил]гуанидина гидрохлорид
Т. пл. 193 - 194oC.
ИК (ньюджол): 3340 - 3100, 1690, 1620, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,36 (3H, с), 4,55 (2H, с), 6,3 - 6,4 (2H, м), 7,6 - 7,7 (2H, м), 7,8 - 7,9 (2H, м), 8,3 - 8,4 (1H, м), 8,61 (2H, ш.с), 8,65 (2H, ш.с), 12,39 (1H, с).
МАСС (m/z): 273 (M+ + 1).
(16) 2-[5-(2-Цианопиррол-1-ил)-3-гидроксиметилбензоил] гуанидина гидрохлорид
Т. пл. 246 - 247oC.
ИК (ньюджол): 3150, 2220, 1710 см-1.
ЯМР (ДМСО-d6) δ: 4,68 (2H, с), 6,5 - 6,6 (1H, м), 7,2 - 7,4 (1H, м), 7,7 - 7,8 (1H, м), 7,8 - 7,9 (1H, м), 8,1 - 8,2 (1H, м). 8,2 - 8,3 (1H, м), 8,69 (4H, ш.с), 12,28 (1H, с).
MACC (m/z): 284 (M++1).
(17) 2-[3-[(2-Диметиламиноэтил)карбамоил] -5-(пиррол-1-ил) бензоил]гуанидин
Т.пл. 140-145oC.
ИК (ньюджол): 3400, 1640, 1580 см-1.
ЯМР (ДМСО-d6) δ: 2,25 (6H, с), 2,4-2,6 (2H, м), 3,3-3,5 (2H, м), 6,3-6,4 (2H, м), 7,4-7,5 (2H, м), 8-1,1 (1H, м), 8,2-8,3 (1H, м), 8,4 -8,5 (1H, м), 8,64 (1H, т, J=5,6 Гц).
MACC (m/z): 343 (M++1).
(18) 2-[3-(2-Циано-5-диметиламинометилпиррол-1-ил)бензоил] - гуанидина гидрохлорид
Т.пл. 135-138oC.
ИК (ньюджол): 3300, 2230, 1700 см-1.
ЯМР (ДМСО-d6) δ: 2,57 (6H, с), 4,28 (2H, с), 6,95 (1H, д, J=4 Гц), 7,32 (1H, д, J=4 Гц), 7,86 91H, дд, J=7,9 Гц), 7,96 (1H, д, J=7,9 Гц), 8,34-8,42 (2H, м), 8,7 (2H, с), 8,85 (2H, с), 10,94 (1H, с), 12,52 (1H, с).
MACC (m/z) : 311 (M++1 свободного основания).
(19) 2-[3-(2-Метилпиррол-1-ил)бензоил]гуанидина гидрохлорид
Т.пл. 213-214oC.
ИК (ньюджол) : 3350, 1700 см-1.
ЯМР (ДМСО-d6) δ: 2,23 (3H, с), 6-6,04 (1H, м), 6,1-6,16 (1H, м), 7-7,05 (1H, м), 7,68-7,8 (2H, м), 8,03-8,11 (2H, м), 8,56 (2H, с), 8,67 (2H, с), 12,07 (1H, с).
MACC (m/z): 243 (M++1 свободного основания).
(20) 2-[3-(4-Цианофенил)бензоил]гуанидина гидрохлорид
Т.пл. 243-245oC.
ИК (ньюджол): 3350, 2230, 1710 см-1.
ЯМР (ДМСО-d6) δ: 7,75 (1H, дд, J=7,7 Гц, 7,7 Гц), 7,98 (2H, д, J=8,6 Гц), 8,08-8,15 (4H, м ), 8,54 (1H, с), 8,56 (2H, ш.с.), 8,77 (2H, ш.с.), 12,27 (1H, с).
(21) 2-[3-(2-(2-Метилсульфонилфенил)бензоил]гуанидина гидрохлорид
Т.пл. 236-238oC.
ИК (ньюджол): 3200, 1710, 1560, 1300, 1230, 1140, 960, 760 см-1.
ЯМР (DMCO-d6) δ: 2,93 (3H, с), 7,48 (1H, дд, J=7,2 Гц, 1,6 Гц), 7,62-7,85 (4 H, м), 8,1-8,14 (2H, м), 8,23 (1H, д, J=7,7 Гц), 8,59 (2H, ш.с.), 8,77 (2H, ш.с.), 12,17 (1H, с).
МАСС (m/z): 318 (M++1).
(22) 2-[3-(2-Трифторметилфенил)бензоил]гуанидина гидрохлорид
Т.пл. 141-143oC.
ИК (ньюджол): 3300, 1700, 1230, 1110, 740 см-1.
ЯМР (ДМСО-d6) δ: 7,51 (1H, д, J=7,5 Гц), 7,62-7,82 (4H, м), 7,88 (1H, д, J=7,6 Гц), 8,02 (1H, с), 8,2-8,25 (1H, м), 8,57 (2H, ш.с.), 8,67 (2H, ш.с.), 11,99 (1H, с).
МАСС (m/z): 308 (M++1).
(23) 2-[3-(2-Метоксифенил)бензоил]гуанидина гидрохлорид
Т.пл. 182-183oC.
ИК (ньюджол): 3340, 1700, 1250, 1020, 730 см-1.
ЯМР (ДМСО-d6) δ: 3,79 (3H, с), 7,03-7,17 (2H, м), 7,36-7,47 (2H, м), 7,62 (1H, дд, J=7,9 Гц, 7,9 Гц), 7,84 (1H, д, J=7,9 Гц), 8,11 (1H, д, J=7,9 Гц), 8,18 (1H, с), 8,61 (2H, ш.с), 8,79 (2H, ш.с.). 12,1 (1H, с).
МАСС (m/z): 270 (M++1).
(24) 2-[3-(-Нафтил)бензоил]гуанидина гидрохлорид
Т.пл. 132-134oC.
ИК (ньюджол): 1700, 1560, 1250, 750 см-1.
ЯМР (ДМСО-d6) δ: 7,55-7,59 (2H, м), 7,75 (1H, дд, J=7,8 Гц, 7,8 Гц), 7,96-8,22 (6H, м), 8,49 (1H, с), 8,55 (2H, ш.с), 8,61 (1H, с), 8,78 (1H, ш. с), 12,2 (1H, с).
МАСС (m/z): 290 (M++1).
(25) 2-[3-(1-Нафтил)бензоил]гуанидина гидрохлорид
Т.пл. 208-210oC.
ИК (ньюджол): 3300, 1700, 1250, 1230, 720 см-1.
ЯМР (ДМСО-d6) δ: 7,52-7,88 (7H, м), 8-8,07 (2H, м), 8,2-8,3 (2H, м), 8,66 (2H, ш.с), 8,79 (2H, ш.с), 12,17 (1H, с).
МАСС (m/z): 290 (M++1).
(26) 2-[3-(3-Метоксифенил)бензоил]гуанидина гидрохлорид
Т.пл. 166-167oC.
ИК (ньюджол): 3250, 1700, 1250, 1030, 730 см-1.
ЯМР (ДМСО-d6) δ: 3,87 (3H, с), 6,96-7,04 (1H, м), 7,35-7,42 (3H, м), 7,68 (1H, дд, J=7,8 Гц), 7,8 Гц), 8,01-8,1 (2H, м), 8,5 (1H, с), 8,62 (2H, ш.с.), 8,89 (2H, ш.с.), 12,38 (1H, с).
МАСС (m/z): 270 (M++1).
(27) 2-[3-(2-Морфолиноэтилкарбамоил)-5-(пиррол-1-ил) бензоил]гуанидина дигидрохлорид
Т.пл. 195-198oC.
ИК (ньюджол): 1695, 1250, 720 см-1.
ЯМР (ДМСО-d6) δ: 3-4,1 (10H, м), 6,3-6,36 (2H, м), 7,79-7,81 (2H, м), 8,35 (1H, с), 8,53 (1H, с), 8,63 (1H, с). 8,8 (2H, с). 9,34 (1H, м), 10,85 (1H, ш.с), 12,47 (1H, с).
МАСС (m/z): 385 (M+1).
(28) 2-[3-(Тиофен-2-ил)бензоил]гуанидина гидрохлорид
Т.пл. 225-226oC.
ИК (ньюджол): 3360, 1700, 1280, 725 см-1.
ЯМР (ДМСО-d6) δ: 7,15-7,25 (1H, м), 7,6-7,7 (2H, м), 7,8-7,85 (1H, м), 7,95-8,05 (2H, м), 8,48-8,5 (1H, м), 8,59 (2H, ш.), 8,81 (2H, ш.), 12,21 (1H, с).
МАСС (m/z): 246 (M+1).
(29) 2-[3-(Тиазол-2-ил)бензоил]гуанидина дигидрохлорид
Т.пл. 236-239oC (разл).
ИК (ньюджол): 3375, 1700, 1455, 750 см-1.
ЯМР (ДМСО-d6) δ: 7,84 (1H, т, J=7,8 Гц, 7,8 Гц), 7,91 (1H, д, J=3,2 Гц), 8,01 (1 H, д, J=3,2 Гц), 8,25-8,32 (2H, м), 8,63-8,65 (1H, м), 8,75 (2H, ш. ), 8,83 (2H, ш.), 12,34 (1H, с).
МАСС (m/z) : 247 (M+1).
(30) 2-[3-Хлор-5-(пиррол-1-ил)бензоил]гуанидина гидрохлорид
Т.пл. 244-245oC.
ИК (ньюджол): 1690, 1580, 720 см-1.
ЯМР (ДМСО-d6) δ: 6,3-6,34 (2H, м), 7,68-7,73 (2H, м), 7,87 (1H, дд, J= 1,5 Гц, 1,5 Гц), 8,11 (1H, дд, J=1,5 Гц, 1,5 Гц), 8,4 (1H, дд, J=1,5 Гц, 1,5 Гц), 8,58 (2H, ш.с), 8,77 (2H, ш.с), 12,42 (1H, ш.с).
МАСС (m/z): 263 (M+1).
(31) 2-[3-Ацетил-5-(пиррол-1-ил)бензоил]гуанидина гидрохлорид
Т.пл. 292-293oC.
ИК (ньюждол): 1690, 1240, 1080, 870 см-1.
ЯМР (ДМСО-d6) δ: 2,75 (3H, с), 6,3-6,4 (2H, м), 7,7-7,8 (2H, м). 8,34 (1H, с), 8,4 (1H, с), 8,62 (2H, ш.с.), 8,83 (2H, ш.с.), 12,55 (1H, с).
МАСС (m/z) : 271 (M+1).
(32) 2-[3-(4-Метоксифенил)бензоил]гуанидина гидрохлорид
Т.пл. 242-243oC.
ИК (ньюджол): 1690, 1295, 830 см-1.
ЯМР (ДМСО-d6) δ: 3,81 (3H, с), 7,06 (2H, д, J=8,8 Гц), 7,65 (1H, дд, J= 7,9 Гц), 7,81 (2H, д, J=8,8 Гц), 7,95-8,05 (2H, м), 8,41 (1H, дд, J=1,7 Гц), 8,56 (2H, ш.с.), 8,81 (2H, ш.с.), 12.2 (1H, с).
МАСС (m/z): 270 (M+1).
(33) 2-[3-(3-Морфолинопропилкарбамоил)-5-пиррол-1-ил)- бензоил]гуанидина дигидрохлорид
Т.пл. 195-197oC. (разл.).
ИК (ньюджол): 1700, 1650, 1240 см-1.
ЯМР (ДМСО-d6) δ: 1,9-2,2 (2H, м), 2,9-3,3 (4H, м), 3,3-3,55 (4H, м), 3.7-4,1 (4H, м), 6,3-6,4 (2H, м), 7,7-7,8 (2H, м), 8,37 (1H, с), 8,41 (1H, с), 8,61 (1H, c), 8,72 (2H, с), 8,85 (1H, с), 9,16 (1H, т, J = 5,6 Гц), 10,96 (1H, ш.с.), 12,55 (1H, с).
MACC (m/z): 399 (M+1).
(34) 2-[2-Нафтоил]гуанидина гидрохлорид
Т.пл. 276-279oC,
ИК (ньюджол): 1690, 1620, 1200 см-1.
ЯМР (ДМСО-d6) δ: 7,6-7,8 (2H, м), 8-8,2 (4H, м), 8,67 (2H, с), 8,88 (2H, с), 8,96 (1H, с), 12,33 (1H, с).
MACC (m/z): 214 (M+1).
(35) 2-[3-(2-Цианофенил)бензоил]гуанидина гидрохлорид
Т.пл. 204-205oC.
ИК (ньюджол): 2225, 1690, 720 см-1.
ЯМР (ДМСО-d6) δ: 7,6-7,9 (4H, м), 8 (1H, дд, J = 7,2 Гц, 7,2 Гц), 8,2-8,35 (2H, м), 8,6 (2H, ш.с.), 8,77 (2H, ш.с.), 12,25 (1H, с).
MACC (m/z): 265 (M+1).
(35) 4,4-Диметил-8-(диаминоэтиленаминокарбонил)-4H-пирроло /2,1-с//1,4/бензоксазина гидрохлорид
Т.пл. 276-277oC.
ИК (ньюджол): 3480, 3180, 1692, 1630 см-1.
ЯМР (ДМСО-d6) δ: 1,6 (6H, с), 6,15 (1H, дд, J = 1,4 Гц, 3,2 Гц), 6,33 (1H, дд, J = 3,2 Гц, 3,2 Гц), 7,23 (1H, д, J = 8,6 Гц), 7,77 (1H, дд, J = 1.4 Гц, 3,2 Гц), 7,83 (1H, дд, J = 2,1 Гц), 8,6 Гц), 8,47 (2H, с), 8,71 (1H, д, J = 2,1 Гц), 8,79 (2H, с), 12,13 (1H, м).
MACC (m/z): 285 (M++1 свободного основания).
Пример 10.
К смеси гидрохлорида гуанидина (1,6 г) и 28%-го метанольного раствора метоксида натрия (3 мл) в N,N-диметилформамиде (8 мл) прибавляют метиловый эфир 3-(2-циано-5-метилпиррол-1-ил)бензойной кислоты (0,8 г) и смесь перемешивают 4 часа при комнатной температуре. Затем смесь переносят в водный этилацетат. Отделенный органический слой промывают водой, сушат над сульфатом магния и испаряют в вакууме. Остаток растворяют в метаноле (10 мл) и к смеси добавляют метансульфоновую кислоту (0,4 мл). Смесь перемешивают 30 минут и затем к смеси добавляют диизопропиловый эфир. Образовавшийся осадок отфильтровывают и перекристаллизацией из смеси метанол-вода получают 2-[3-(2-циано-5-метилпиррол-1-ил)бензоил]гуанидина метансульфонат (0,98 г).
Т.пл. 233-234oC.
ИК (ньюджол): 3300, 2220, 1165, 1045 см-1.
ЯМР (ДМСО-d6) δ: 2,15 (3H, с), 2,34 (3H, с), 6,26 (1H, д, J = 3,9 Гц), 7,14 (1H, д, J = 3,9 Гц), 7,83-7,89 (2H, м), 7,96-7,99 (1H, М), 8,07-8,14 (1H, м), 8,14-8,6 (4H, ш.с.), 11,34 (1H, с).
MACC (m/z): 268 (M++1 свободного основания).
Пример 11.
По методике, аналогичной методике примера 10, получено следующее соединение:
2-[3-Гидроксиметил-5-пиррол-1-ил)бензоил]гуанидина метансульфонат
Т.пл. 171-172oC.
ИК (ньюджол): 3330, 3120, 1690, 1600 см-1.
ЯМР (ДМСО-d6) δ: 2,42 (3H, с), 4,66 (2H, с), 6,3-6,4 (2H, м), 7,4-7,5 (2H, м), 7,7-8 (3H, м), 8,43 (4H, ш.с.), 11,41 (1H, с).
MAC (m/z): 259 (M++1).
Пример 12.
К гидрохлориду гуанидина (4,7 г) в сухом N,N-диметилформамиде (14 мл) добавляют 28%-ый раствор метоксида натрия в метаноле (8,6 мл) и смесь перемешивают 20 минут при комнатной температуре. Затем к смеси добавляют диметиловый эфир 5-(2-цианопиррол-1-ил)изофталевой кислоты (1,4 г) и смесь перемешивают 4 часа при той же температуре. Затем реакционную смесь при перемешивании переносят в воду (150 мл). Образовавшийся осадок отфильтровывают, промывают водой и сушкой в вакууме получают 2-[3-(2-цианопиррол-1-ил)-5- (диаминометиленаминокарбонил)бензоил]гуанидин (0,88 г).
Т.пл. 251-253oC
ИК (ньюджол): 3340 (ш.), 2220, 1690, 1640 см-1.
ЯМР (ДМСО-d6) δ: 6,03-8,7 (8H, ш), 6,42-6,49 (1H, м), 7,2-7,26 (1H, м), 7,54-7,59 (1H, м), 8,22 (2H, с), 8,85 (1H, с).
Пример 13.
По методике, аналогичной методике примера 12, получено следующее соединение:
2-[3-(Диаминометиленаминокарбонил)-5-(пиррол-1-ил)-бензоил] - гуанидина гидрохлорид
Т.пл. 257oC.
ИК (ньюджол): 1700, 1575, 1070 см-1.
ЯМР (ДМСО-d6) δ: 6,34-6,37 (2H, м), 7,8-7,93 (2H, м), 8,37 (1H, с), 8,66 (2H, ш.с.), 8,79 (4H, ш.с.), 12,58 (1H, с).
Пример 14.
К смеси 5-циано-3-(пиррол-1-ил)бензойной кислоты (2 г), гидрохлорида гуанидина (2,7 г) и триэтиламина (7,2 мл) в N,N-диметилформамиде (30 мл) добавляют 2-хлор-1-метил-пиридинийиодид (3,6 г) и смесь перемешивают 4 часа при комнатной температуре. Затем реакционную смесь переносят в смесь этилацетат-тетрагидрофуран-вода и добавлением карбоната калия устанавливают pH 10. Отдельный органический слой промывают рассолом и сушат над сульфатом магния. Растворитель удаляют концентрированием и переосаждением остатка из эфира получают 2- 5-циано-3-(пиррол-1-ил)бензоил гуанидин (1,49 г).
Т.пл. 198-200oC.
ИК (ньюджол): 3480, 3400, 3300, 2230, 1620, 1600 см-1.
ЯМР (ДМСО-d6) δ: 6,2-8,6 (4H, м), 6,32-6,36 (2H, м), 7,47-7,51 (2H, м), 8,24 (2H, с), 8,43 (1H, с).
Пример 15.
По методике, аналогичной методике примера 14, получены следующие соединения:
(1) 2-[3-(2-Цианопиррол-1-ил)бензоил]гуанидин
Т.пл. 136-138oC.
ИК (ньюджол): 3390, 2220, 1637 см-1.
ЯМР (ДМСО-d6) δ: 6,3-8,4 (4H, ш.), 6,46 (1H, дд, J = 2,8 Гц, 3,9 Гц), 7,24 (1H, дд, J = 1,6 Гц, 3,9 Гц), 7,56 (1H, дд, J = 1,6 Гц, 2,8 Гц), 7,58-7,69 (2H, м), 8,11-8,19 (2H, м).
(2) 2-[3-(3-Цианопиррол-1-ил)бензоил]гуанидин
Т.пл. 203-205oC.
ИК (ньюджол): 3420, 3300, 3140, 2220, 1655, 1630, 1660 см-1.
ЯМР (ДМСО-d6) δ: 6,4-8,2 (4H, ш.), 6,72-7,76 (1H, м), 7,47-7,75 (3H, м), 8-8,1 (1H, м), 8,18-8,23 (2H, м).
(3) 2-[3-(2-Бензилоксикарбонилпиррол-1-ил)бензоил]гуанидин
ИК (пленка): 3400, 1705, 1630 см-1.
ЯМР (ДМСО-d6) δ: 5,12 (2H, с), 6,28-8,35 (4H, ш.), 6,34 (1H, дд, J = 2,7 Гц, 3,9 Гц), 7,1 (1H, дд, J = 1,8 Гц, 3,9 Гц), 7,2-7,51 (8H, м), 7,98-8,02 (1H, м), 8,03-8,09 (1H, м).
(4) 2-[4-Фенилбензоил]гуанидина гидрохлорид
Т.пл. 270-272oC.
ИК (ньюджол): 3300, 1685, 1260, 745 см-1.
ЯМР (ДМСО-d6) δ: 7,4-7,65 (3H, м), 7,7-7,9 (2H, м), 7,92 (2H, д, J = 8,5 Гц), 8,26 (2H, д, J = 8,5 Гц), 8,63 (2H, с), 8,84 (2H, с), 12,14 (1H, с).
MACC (m/z): 240 (M+1).
Пример 16.
По методике, аналогичной методике примера 6, получены следующие соединения:
(1) 2-[3-[(Z)-2-Гидроксииминометилпиррол-1-ил]бензоил]-гуанидина гидрохлорид
Т.пл. 176-178oC.
ИК (ньюджол): 3320, 3100, 1705, 1630 см-1.
ЯМР (ДМСО-d6) δ: 6,36-6,42 (1H, м), 7,11 (1H, с), 7,28-7,36 (2H, м), 7,72-7,81 (1H, м), 8,12 (1H, с), 8,19-8,25 (1H, м), 8,72 (2H, с), 8,79 (2H, с), 12,36 (1H, с).
МАСС (m/z; 272 (М++1 свободного основания).
(2) 2-3-[(E)-2-Гидроксииминометилпиррол-1-ил] бензоил] -гуанидина гидрохлорид
Т.пл. 207-208oC.
ИК (ньюджол): 3250, 3100, 1695 см-1.
ЯМР (ДМСО-d6) δ: 6,36-6,42 (1H, м), 7,09 (1H, с), 7,25-7,35 (2H, м), 7,73-7,82 (2H, м), 8,08 (1H, с), 8,15-8,22 (1H, c), 8,5-8.82 (4H, m), 11,47 (1H, с), 12,17 (1H, с).
Масс (m/z): 272 (М++1 свободного основания).
(3) 2-[3-(2-Диметиламинометилпиррол-1-ил] бензоил] -гуанидина дигидрохлорид
Т.пл. 210-211oC.
ИК (ньюджол): 3350, 3080, 1690-1705 (ш.), 1630 см-1.
ЯМР (ДМСО-d6) δ: 2,49 (6H, с), 4,32 (2H, с), 6,32-6,38 (1H, м), 6,7-6,75 (1H, м), 7,2-7,25 (1H, m), 7,68-7,8 (2H, м), 8,15-8,25 (2H, m), 8,76 (2H, с), 8,89 (2H,c), 10,49 (1H, c), 12,56 (1H, c).
МАСС (m/z); 286 (М+1 свободного основания).
(4) 2-[3-(2,5-Дихлорпиррол-1-ил)бензоил]гуанидина гидрохлорид
Т.пл. 204-205oC.
ИК (ньюджол): 3330, 3240, 3100, 1685 см-1.
ЯМР (ДМСО-d6) δ: 6,41 (2H, c), 7,71-7,89 (2H, м), 8,06 (1H, с), 8,37 (1H, д, J = 7,3 Гц), 8,67 (2H, с), 8,71 (1H, с), 12,2 (1H, с).
Масс (m/z): 297 (M++1) свободного основания).
(5) 2-[3-(2-Карбамоилпиррол-1-ил)бензоил]гуанидина гидрохлорид
Т.пл. 155-158oC.
ИК (ньюджол): 3300, 3120, 1700, 1650, 1585 см-1.
ЯМР (ДМСО-d6) δ: 6,27 (2H, dd, J=2,9 Гц, 3,6 Гц), 6,7-8,2 (2H, ш), 6,97 (1H, дд, J= 1,6 Гц), 7,23-7,28 (1H, м), 7,54- 7,67(2H, м), 8,01 (1H, с), 8,07-8,15 (1H, м), 8,66 (2H, с), 8,77 (2H, с), 12,22 (1H, с).
Масс (m/z): 272 (M++1) свободного основания).
(6) 2-[3-(2-Ацетилпиррол-1-ил)бензоил]гуанидина гидрохлорид
Т.пл. 87-89oC.
ИК (ньюджол): 3100-3300, (ш), 1690, 1630 см-1.
ЯМР (ДМСО-d6) δ: 2,43 (3H, c), 6,68 (1H, dd, J=1,6 Гц), 7,68-7,79 (2H, м), 7,99 (1H, д, J = 8,1 Гц), 8.08 (1H, д, J= 8,1 Гц), 8,49-8,7(4H, с), 8,81 (2H, с), 12,38 (1H, с).
Масс (m/z): 271 (M++1) свободного основания).
(7) 2-[3-(2-Цианопиррол-1-ил)бензоил]гуанидина гидрохлорид
Т.пл. 220-221oC.
ИК (ньюджол): 3300, 3080, 1700, 1615, 1585 см-1.
ЯМР (ДМСО-d6) δ: 6,52 (1H, дд, J= 2,9 Гц), 7,3 (1H, дд, J= 1,5 Гц, 3,9 Гц), 7,75-7,88 (2H, м), 7,91-8,01 (1H, м), 8,18-8,26 (1H, м), 8,3-8,34 (1H, м), 8,65 (2H, с), 8,77 (2H, с), 12,42 (1H, с).
Масс (m/z): 254 (М++1 свободного основания).
(8) 2-[3-(3-Цианопиррол-1-ил)бензоил]гуанидина гидрохлорид
Т.пл. 259-261oC.
ИК (ньюджол): 3350, 3100, 2230, 1700, 1610, 1590 см-1.
ЯМР (ДМСО-d6) δ: 6,79 (1H, дд, J= 1,5 Гц), 7,75 (1H, дд, J= 8 Гц), 7,8-7,85 (1H, м), 7,99-8,1 (2H, м), 8,43-8,51 (2H, м), 8,56 (1H, с), 8,75 (2H, с), 12,35 (1H, с).
Масс (m/z): 254 (М++1 свободного основания).
(9) 2-[4-н-Бутил-3-(2-цианопиррл-1-ил)бензоил]-гуанидина гидрохлорид
Т.пл. 193-194oC
ИК (ньюджол): 3260, 3120, 2220, 1710, 1610 см-1.
ЯМР (ДМСО-d6)  0,76 (3H, т, J =7,2 Гц), 1,05-1,27 (2H, м), 1,3-1,45 (2H, м), 2,39-2,55 (2H, м), 6,48 (1H, дд, J= 2,7 Гц, 4 Гц), 7,24 (1H, дд, J= 1,6 Гц, 4 Гц), 7,44 (1H, дд, J= 1,6 Гц, 2,7 Гц), 7,74 (1H, д, J= 8,1 Гц), 7,08 (1H, д, J = 1,8 Гц), 8,29 (1H, дд, J= 1,8 Гц), 8,1 Гц), 8,47-8,75 (4H, м), 12,1 (1H, с).
0,76 (3H, т, J =7,2 Гц), 1,05-1,27 (2H, м), 1,3-1,45 (2H, м), 2,39-2,55 (2H, м), 6,48 (1H, дд, J= 2,7 Гц, 4 Гц), 7,24 (1H, дд, J= 1,6 Гц, 4 Гц), 7,44 (1H, дд, J= 1,6 Гц, 2,7 Гц), 7,74 (1H, д, J= 8,1 Гц), 7,08 (1H, д, J = 1,8 Гц), 8,29 (1H, дд, J= 1,8 Гц), 8,1 Гц), 8,47-8,75 (4H, м), 12,1 (1H, с).
Масс (m/z): 310 (М++1 свободного основания).
(10) 2-[4-н-Бутил-3-(пиррол-1-ил)бензоил]гуанидина гидрохлорид
Т.пл. 188o-189oC.
ИК (ньюджол): 3370, 3260, 1700, 1670, 1610 см-1.
ЯМР (ДМСО-d6) δ: 0,77 (3H т, J= 7,1 Гц), 1,06-1,45 (4H, м), 2,5-2,65 (2H, м), 6,24-6,28 (2H, м), 6,98-7,03 (2H, м), 7,61 (1H, д, J = 8,1 Гц), 7,97 (1H, с), 8,12 (1H, д, J = 8,1 Гц), 8,64 (2H, с), 8,75 (2H, с), 12,17 (1H, с).
Масс (m/z): 285 (М++1 свободного основания).
(11) 2-[4-Метил-3-(пиррол-1-ил)бензоил]гуанидина гидрохлорид
Т.пл. 251-252oC.
ИК (ньюджол): 3400, 3250, 3130, 2230, 1700, 1610 см-1.
ЯМР (ДМСО-d6) δ: 2,3 (3H, с), 6,24-6,3 (2H, м), 7,05-7,11 (2H, м), 7,6 (1H, д J= 8,1 Гц), 7,98 (1H, д, J=1,8 Гц), 8,05 (1H, дд, J= 1,8 Гц, 8,1 Гц), 8,59 (2H, с), 8,71 (2H, с), 12,11 (1H, с).
Масс (m/z): 243 (М++1 свободного основания).
(12) 2-[5-Циано-3-(пиррол-1-)бензоил]гуанидина гидрохлорид
Т.пл. 267-268oC.
ИК (ньюджол): 3400, 3250, 3130, 2230, 1700, 1610 см-1.
ЯМР (ДМСО-d6) δ: 6,33-6,38 (2H, м), 7,72-7,78 (2H, м), 8,25 (1H, с), 8,5 (1H, с), 8,65 (2H, с), 8,72 (1H, с), 8,79 (2H, с), 12,62 (1H, с).
Масс (m/z): 254 (М++1 свободного основания).
Пример 17.
К смеси 2-[3-(2-цианопиррол-1-ил)бензоил]гуанидина (2 г) и метанола (20 мл) добавляют конц. серную кислоту (0,42 мл) и смесь перемешивают 30 минут при комнатной температуре. Затем к смеси добавляют этилацетат (20 мл) и образовавшийся осадок отфильтровывают. Перекристаллизацией осадка из смеси метанол-вода получают полисульфат 2-[3-(2-цианопиррол-1-ил)бензоил]гуанидина (1,53 г).
Т.пл. 170-171oC.
ИК (ньюджол): 3300, 3110, 2220, 1720, 1690, 1610, 1100 см-1.
ЯМР (ДМСО-d6) δ: 6,48 (1H, дд, J= 2,8 Гц, 3,9 Гц), 7-8,4 (4H, ш.), 7,27 (1H, дд, J= 1,6 Гц, 3,9 Гц), 7,61 (1H, дд, J= 1,6 Гц, 2,8 Гц), 7,66-7,84 (2H, м), 8,07-8,14 (2H, м).
Пример 18.
К раствору 2-[3-(2-цианопиррол-1-ил)бензоил]гуанидина (1 г) в метаноле (10 мл) добавляют раствор фумаровой кислоты (0,46 г) в метаноле (10 мл) и все перемешивают 1 час при комнатной температуре. Образовавшийся осадок отфильтровывают и после перекристаллизации из водного метанола получают фумарат 2-[3-(2-цианопиррол-1-ил)бензоил]гуанидина (1,03 г).
Т. пл. 216-217oC.
ИК (ньюджол): 3360, 3130, 2220, 1730, 1705, 1610 см-1.
ЯМР (ДМСО-d6) δ: 6,46 (1H, дд, J= 2,8 Гц, 3,9 Гц), 6,55-8,6 (4H, ш.), 6,61 (2H, с), 7,24 (1H, дд, J=1,6 Гц, 3,9 Гц), 7,57 (1H, дд, J = 1,6 Гц, 2,8 Гц), 7,61 -7,71 (2H, м), 8,11-8,19 (2H, м).
Пример 19.
По методикам, аналогичным методикам примеров 6, 17 и 18, получены следующие соединения:
(1) 2-[3-(2-Цианопиррол-1-ил)бензоил]гуанидина полуцитрат
Т.пл. 158-160oC.
ИК (ньюджол): 3330, 2220, 1700, 1610, 1590 см-1.
ЯМР (ДМСО-d6) δ: 2,55-2,77 (2H, м), 6,47 (1H, дд, J = 2,8 Гц, 3,9 Гц), 6,77-8,6 (4H, ш.), 7,24 (1H, дд, J = 1,6 Гц, 3,9 Гц), 7,56 (1H, дд, J = 1,6 Гц, 2,8 Гц), 7,59-7,75 (2H, м), 8,1-8,19 (2H, м).
(2) 2-[3-(2-Цианопиррол-1-ил)бензоил]гуанидина малеат
Т.пл. 211-213oC.
ИК (ньюджол): 3400, 3250, 3100, 2220, 1705, 1685 см-1.
(ДМСО-d6) δ: 6,1 (2H, c), 6,51 (1H, дд, J = 2,8 Гц, 3,9 Гц), 7,29 (1H, дд, J = 1,6, 3,9 Гц), 7,62 (1H, дд, J = 1,6 Гц, 2,8 Гц), 7,8 (1H, дд, J = 8,2 Гц, 8,2 Гц), 7,85-7,94 (1H, м), 8,04-8,12 (2H, м), 8,19 (4H, м).
Пример 20.
К раствору 2-[3-(2-цианопиррол-1-ил)-5-(диаминометиленаминокарбонил) бензоил]гуанидина (0,8 г) в метаноле (16 мл) добавляют метансульфоновую кислоту (0,5 мл) и все перемешивают 1 час при комнатной температуре. Образовавшийся осадок отфильтровывают и его перекристаллизацией из воды получают 2-[3-(2-цианопиррол-1-ил)-5- (диаминометиленаминокарбонил)бензоил]гуанидинна диметансульфонат (0,65 г).
Т.пл. 250-251oC.
ИК (ньюджол): 3350, 3100, 2220, 1725, 1600, 1210, 1050 см-1.
(ДМСО-d6) δ: 2,43 (6H, c), 6,57 (1H, дд, J = 2,9 Гц, 3,9 Гц), 7,36 (1H, дд, J = 1,6 Гц, 3,9 Гц), 7,77 (1H, дд, J = 1,6 Гц, 2,9 Гц), 8,3-8,8 (4H, м), 8,41 (2H, c), 8,55 (1H, c), 11,67 (2H, c).
МАСС (m/z): 339 (M++1 свободного основания).
Пример 21.
По методике, аналогичной методике примера 20, получены следующие соединения:
(1) 2-[3-(2-Цианопиррол-1-ил)бензоил]гуанидина метансульфонат
Т.пл. 200-201oC.
ИК (ньюджол): 3350, 3100, 2220, 1720, 1585, 1165, 1045 см-1.
ЯМР (ДМСО-d6) δ: 2,36 (3H, c), 6,49-6,55 (1H, м), 7,27-7,33 (1H, м), 7,64-7,67 (1H, м), 7,84 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,96 (1H, д, J = 7,7 Гц), 8-8,1 (2H, м), 8,2-8,6 (4H, м), 11,42 (1H, c).
(2) 2-[3-(Пиррол-1-ил)бензоил]гуанидина метансульфонат
Т.пл. 216oC.
ИК (ньюджол): 3350, 3150, 1700, 1695, 1180, 1050 см-1.
ЯМР (ДМСО-d6) δ: 2,38 (3H, c), 6,31-6,36 (2H, м), 7,45-7,5 (2H, м), 7,69 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,79 (1H, д, J = 7,8 Гц), 7,95 (1H, д, J = 7,8 Гц), 8,07 (1H, c), 8,4 (4H, c), 11,39 (1H, c).
Пример 22.
К раствору 2-[3-нитро-5-(пиррол-1-ил)бензоил]гуанидина (0,3 г) в смеси метанола (10 мл) с тетрагидрофураном (5 мл) добавляют 10%-ый палладий на угле (50% в воде) и все гидрируют при комнатной температуре и атмосферном давлении. Катализатор отфильтровывают и фильтрат испаряют в вакууме. Остаток растворяют в этаноле и после обработки небольшим избытком 4 н. раствора хлористого водорода в этилацетате получают дигидрохлорид 2-[3-амино-5-(пиррол-1-ил)бензоил]гуанидина (310 мг).
Т.пл. 269-270oC (разл.).
ИК (ньюджол): 3340, 1685, 1355, 715 см-1.
ЯМР (ДМСО-d6) δ: 6,29-6,31 (2H, м), 7,37-7,41 (2H, м), 7,52-7,56 (2H, м), 8-8,05 (1H, м), 8,65 (2H, ш.), 8,88 (2H, ш.), 12,33 (1H, ш.).
МАСС (m/z): 244 (M+1).
Пример 23.
К смеси 2-[3-(2-бензилоксикарбонилпиррол-1-ил)бензоил]]гуанидина (1,2 г) и метанола добавляют 10%-ый палладий на угле (0,2 г) и смесь гидрируют при комнатной температуре и атмосферном давлении. Затем смесь переносят в воду и добавлением карбоната калия в смеси устанавливают pH 10. Катализатор отфильтровывают и фильтрат испаряют в вакууме. Остаток растворяют в смеси воды с этилацетатом и отделенный водный слой подкисляют 6 н. соляной кислотой до pH 5. Образовавшийся осадок отфильтровывают и его перекристаллизацией из смеси метанол-диоксан-диизопропиловый эфир получают 2-[3-(2-карбоксипиррол-1-ил)бензоил]гуанидин (0,41 г).
Т.пл. 213oC.
ИК (ньюджол): 3270, 1690 см-1.
ЯМР (ДМСО-d6) δ: 6,15-6,5 (4H, м), 6,29 (1H, дд, J = 2,7 Гц, 3,8 Гц), 6,99 (1H, дд, J = 1,8 Гц, 3,8 Гц), 7,17 (1H, дд, J = 1,8 Гц, 2,7 Гц), 7,36-7,51 (2H, м), 7,97-8,09 (2H, м).
МАСС (m/z): 273 (M++1).
Пример 24.
К смеси гидрохлорида гуанидина (2,26 г) и 28%-го метанольного раствора метоксида натрия (4,1 мл) в N,N-диметилформамиде (17 мл) добавляют метиловый эфир 3-(3-трифторметилсульфониламинофенил)бензойной кислоты (1,7 г) и реакционную смесь перемешивают 6 часов при комнатной температуре. После испарения растворителя остаток переносят в смесь этилацетата (50 мл) с водой (50 мл). Добавлением 10%-ой соляной кислоты смесь подкисляют до pH 6,2. Кристаллический продукт отфильтровывают, промывают последовательно водой и метанолом и после сушки в вакууме получают 2-[3-(3-трифторметилсульфониламиннофенил)бензоил]гуанидин (0,28 г).
Т.пл. 259-260oC.
ИК (ньюджол): 3375, 3250, 1705, 1010 см-1.
ЯМР (ДМСО-d6): δ: 7,04-7,32 (4H, м), 7,67 (1H, дд, J = 8 Гц, 7,5 Гц), 7,87-7,93 (2H, м), 8,12 (1H, c), 8,23 (4H, c).
(+) APCI МАСС (m/z): 387 /M+H/+.
Пример 25.
По методикам, аналогичным методикам примеров 1, 3, 8, 10, 14 и 24, получены следующие соединения:
(1) 2-[2-Метокси-5-(пиррол-1-ил)бензоил]гуанидин
Т.пл. 208-209oC.
ИК (ньюджол): 3400, 1662, 1590 см-1.
(ДМСО-d6) δ: 3,75 (3H, c), 6,1-8,3 (4H, ш.), 6,18-6,24 (2H, м), 7,03 (1H, д, J = 8,6 Гц), 7,18-7,24 (2H, м), 7,38-7,51 (2H, м).
(2) 2-[2-Гидрокси-5-(пиррол-1-ил)бензоил]гуанидин
Т.пл. 191-193oC.
ИК (ньюджол): 3370, 3180, 1668, 1610 см-1.
ЯМР (ДМСО-d6) δ: 6,18-6,24 (2H, м), 6,7-8,9 (4H, ш.), 6,87 (1H, д, J = 8,7 Гц), 7,14-7,2 (2H, м), 7,48 (1H, дд, J = 3 Гц, 8,7 Гц), 7,86 (1H, д, J = 3 Гц), 14,75 (1H, c).
(+) APCI МАСС (m/z): 245 /M+H/+.
Элементный анализ для C12H12N4O2
Вычислено: C 59,01, H 4,95, N 22,94
Найдено: C 59,16, H 5,04, N 22,59
(3) 2-[-Нитро-5-(пиррол-1-ил)бензоил]гуанидин
Т.пл. 212-213oC.
ИК (ньюджол): 3420, 1655, 1600, 1585, 1355 см-1.
ЯМР (ДМСО-d6) δ: 6,2-8,5 (4H, ш.), 6,32-6,38 (2H, м), 7,51-7,57 (2H, м), 7,76 (1H, дд, J = 2,5 Гц, 8,7 Гц), 7,83 (1H, д, J = 2,5 Гц), 7,95 (1H, д, J = 8,7 Гц).
(4) 2-[3-[2-((E)-1-Гидроксииминоэтил)пиррол-1-ил]бензоил]гуанидин
Т.пл. 210-211oC.
ИК (ньюджол): 3450, 3380, 1655, 1610 см-1.
ЯМР (ДМСО-d6) δ: 2,09 (3H, c), 6,4-8,3 (4H, ш.), 6,53 (1H, дд, J = 1,6 Гц, 2,9 Гц), 7,31-7,36 (1H, м), 7,48 (1H, дд, J = 7,8 Гц, 7.8 Гц), 7,61 -7,65 (1H, м), 7,65 - 7,72 (1H, м), 7,95 (1H, д, J = 7,8 Гц), 8,18 (1H, с), 10.56 (1H, с).
(+) APCI МАСС (m/z): 286 /M + H/+.
Элементный анализ для C14H15N5O2
Вычислено: C 58,94, H 5,30, N 24,55
Найдено: C 58,90, H 5,45, N 24,27
(5) 2-[3-[2-((Z)-1-Гидроксииминоэтил)пиррол-1-ил]-бензоил]-гуанидин
Т.пл. 195-197oC (разл.).
ИК (ньюджол): 3360, 1600 см-1.
ЯМР (ДМСО-D6) δ: 2,11 (3H, с), 6,4 - 6,84 (4H, ш.), 6,72 (1H, дд, J = 1,5 Гц, 2,9 Гц), 7,34 - 7,39 (1H, м), 7,5 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,64 - 7,71 (1H, м), 7,95 - 8,04 (2H, м), 8,17 (1H, м).
(6) 2-[3-(2-Метоксииминометилпиррол-1-ил)бензоил] -гуанидина метансульфонат
Т.пл. 162-164oC.
ИК (ньюджол): 3350, 1715, 1695, 1170, 1045 см-1.
ЯМР (ДМСО-d6) δ: 2,39 (3H, с), 3,7 и 3,93 (всего 3H, каждый с), 6,35 - 6,46 (1H, м), 6,71 - 6,75 и 7,21 - 7,29 (всего 2H, каждый м), 7,1 и 7,92 (всего 1H, каждый с), 7,72 - 8,06 (4H, м), 8,38 (2H, с), 8,52 (2H, с), 11,37 (1H, с).
Элементный анализ для C14H15N5O2 • CH4O3S:
Вычислено: C 47,24, H 5,02, N 18,36
Найдено: C 47,31, H 4,73, N 18,07
(7) 2-[3-[2-((E)-2-Карбоксиэтенил)пиррол-1-ил)-бензоил]гуанидин
Т.пл. 204 - 206oC.
ИК (ньюджол): 3340, 1700, 1663, 1618 см-1.
ЯМР (ДМСО-d6) δ: 6,09 (1H, д, J = 15,7 Гц), 6,3 - 8,4 (4H, ш.), 6,33 - 6,39 (1H, м), 6,97 - 7,02 (1H, м), 7,17 (1H, д, J = 15,7 Гц), 7,2 - 7,25 (1H, м), 7,41 - 7,49 (1H, м), 7,59 (1H, дд, J = 7,7 Гц, 7,7 Гц), 8,01 (1H, с), 8,16 (1H, д, J = 7,7 Гц).
(+) APCI МАСС (m/z): 299 /M+H/+.
(8) 2-[3-[2-(2-Карбоксиэтил)пиррол-1-ил]-бензоил]гуанидин
Т.пл. 221oC.
ИК (ньюджол): 3470, 3380, 1695, 1585 см-1.
ЯМР (ДМСО-d6) δ: 2,43 (2H, т, J = 7 Гц), 2,71 (2H, т, J = 7 Гц), 5,98 - 6,03 (1H, м), 6,07 - 6,15 (1H, м), 6,3 - 8,4 (4H, м), 6,79 - 6,86 (1H, м), 7,41 - 7,58 (2H, м), 8-8,1 (2H, м).
(+) APCI МАСС (m/z): 301 /M+H/+.
Элементный анализ для C15H16N4O3
Вычислено: C 59,99, H 5,37, N 18,66
Найдено: C 59,79, H 5,49, N 18,38
(9) 2-[5-(Пиррол-1-ил)-3-сульфамоилбензоил]гуанидин
Т.пл. 173 - 174oC.
ИК (ньюджол): 3350, 3230, 1628, 1365 см-1.
ЯМР (ДМСО-d6) δ: 6,32 - 6,38 (2H, м), 6,4 - 8,7 (4H, ш.), 7,35 - 7,41 (2H, м), 7,46 (2H, с), 8 - 8,05 (1H, м), 8,31 - 8,36 (1H, м), 8,37 - 8,42 (1H, м).
(10) 2-[3-(Пиррол-1-)-5-(1H-тетразол-5-ил)бензоил]гуанидин
Т.пл. ≥ 270oC.
ИК (ньюджол): 3350, 3100, 1700, 1650, 1597 см-1.
ЯМР (ДМСО-d6) δ: 6,32 - 6,38 (2H, м), 7,15 - 8,5 (4H, ш.), 7,42 - 7,48 (2H, м), 8,18 - 8,22 (1H, м), 8,27 - 8,32 (1H, м), 8,56 - 8,6 (1H, м).
(+) APCI МАСС (m/z): 297 /M+H/+.
Элементный анализ для C13H12N8O
Вычислено: C 52,7, H 4,08, N 37,82
Найдено: C 52,6, H 3,98, N 37,46
(11) 2-[4-(2-Гидроксиэтокси)-3-(пиррол-1-ил)бензоил]гуанидин
Т.пл. 182 - 185oC.
ИК (ньюджол): 3350, 1628, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,65 - 3,77 (2H, м), 4,13 (2H, т, J = 4,9 Гц), 4,86 (1H, т, J = 5,2 Гц), 6,16 - 6,22 (2H, м), 6,4 - 8,3 (4H, ш.), 7,1 - 7,15 (2H, м), 7,19 (1H, д, J = 8,6 Гц), 7,96 (1H, дд, J = 2,1 Гц, 8,6 Гц), 8,01 (1H, д, J = 2,1 Гц).
(12) 2-[4-Бензилокси-3-пиррол-1-ил)бензоил]гуанидин
Т.пл. 150 - 153oC.
ИК (ньюджол): 3320, 1630, 1600 см-1.
ЯМР (ДМСО-d6) δ: 5,21 (2H, с), 6,16 - 6,24 (2H, м), 6,3 - 6,84 (4H, ш.), 7,02 - 7,08 (2H, м), 7,27 - 7,47 (6H, м), 7,94 - 8,06 (2H, м),
(13) 2-[4-Метокси-3-(пиррол-1-ил)бензоил]гуанидин
Т.пл. 155 - 156oC.
ИК (ньюджол): 3450, 3320, 1660, 1633, 1695 см-1.
ЯМР (ДМСО-d6) δ: 3,85 (3H, с), 6,16 - 6,22 (2H, м), 6,3 - 8,3 (4H, ш.), 6,96 - 7,02 (2H, м), 7,19 (1H, д, J = 9,2 Гц), 7,96 - 8,06 (2H, м).
(14) 2-[4-Карбоксиметокси-3-(пиррол-1-ил)бензоил]гуанидин
Т.пл. 250 - 253oC.
Ик (ньюджол) δ: 3300, 1708, 1675, 1600 (ш.) см-1
ЯМР (ДМСО-d6) δ: 4,64 (2H, с), 6,16 - 6,23 (2H, м), 6,4 - 9,4 (4H, ш.), 6,98 (1H, д, J = 8,8 Гц), 7,17 - 7,23 (2H, м), 7.9 (1H, дд, J = 2 Гц, 8,8 Гц), 8,01 (1H, д, J = 2 Гц),
(+) APCI МАСС (m/z): 303 /M+H/+.
(15) 2-[3-Диметилкарбамоил-5-(пиррол-1-ил)бензоил] гуанидина метансульфонат
Т.пл. 203 - 204oC.
ИК (ньюджол): 3350, 3280, 1710, 1630. 1590 см-1.
ЯМР (ДМСО-d6) δ: 2,42 (3H, с), 2,95 (3H, с), 3,04 (3H, с), 6,3 - 6,4 (2H, м), 7,5 - 7,6 (2H, м), 7,75 (1H, с), 7,98 (1H, с), 8,13 (1H, т, J = 1,8 Гц), 8,42 (2H, ш.с.), 8,56 (2H, ш.с.), 11,48 (1H, с).
(+) APCI МАСС (m/z): 300/M свободного основания + H/+.
Элементный анализ для C15H17N5O2 • CH4O3S :
Вычислено: C 48,60, H 5,35, N 17,71
Найдено: C 48,27, H 5,32, N 17,47
(16) 2-[4-Ацетиламинометил-3-(пиррол-1-ил)бензоил]гуанидин
Т.пл. 183 - 185oC.
ИК (ньюджол): 3400, 3320, 3180, 1640, 1590 см-1.
ЯМР (ДМСО-d6) δ: 1,87 (3H, c), 4,12 (2H, д, J = 5,6 ГЦ), 6,21 - 6,27 (2H, м), 6,83 - 6,99 (2H, м), 7,41 (1H, д, J = 8 Гц), 7,98 (1H, с), 8,02 (1H, д, J = 8 Гц), 8,28 (1H, т, J = 5,6 Гц).
(17) 8-(Диаминометиленаминокарбонил)-1-диметиламинометил-4,4- диметил-4H-пирроло/2,1-с//1,4/бензоксазин
Т.пл. 182 - 186oC.
ИК (ньюджол): 3400, 1660, 1600 см-1.
ЯМР (ДМСО-d6) δ: 1,53 (6H, с), 2,29 (6H, с), 3,37 (2H, с), 6,01 (1H, д, J = 3,4 Гц), 6,15 (1H, д, J = 3,4 Гц), 6,3 - 8,4 (4H, ш.), 6,99 (1H, д, J = 8,4 Гц), 7,86 (1H, дд, J = 1,7 Гц, 8,4 Гц), 8,75 (1H, д, J = 1,7 Гц).
(18) 2-[4-(Пиррол-1-ил)бензоил]гуанидин
Т.пл. 184 - 186oC.
ИК (ньюджол): 3300, 1595 см-1.
ЯМР (ДМСО-d6) δ: 6,1 - 8,4 (4H, ш.), 6,26 - 6,32 (2H, м), 7,41 -7,47 (2H, м), 7,59 (2H,д, J = 8,8 гц), 8,13 (2H, д, J = 8,8, Гц).
(19) 2-[3-[(Пиррол-1-ил)метил]бензоил]гуанидин
Т.пл. 165 - 166oC.
ИК (ньюджол): 3430, 3280, 1647, 1600 см-1.
ЯМР (ДМСО-d6) δ: 5,11 (2H, с), 5,99 - 6,05 (2H, м), 6,2 - 8,4 (4H, ш.), 6,76 - 6,82 (2H, м), 7,22 (1H, д, J = 7,5 Гц), 7,33 (1H, дд, J = 7,5 Гц, 7,5 Гц), 7,92 (1H, c), 7,98 (1H, д, J = 7,5 Гц).
(20) 2-[3-(Пиразол-3-ил)бензоил]гуанидин
Т.пл. 228-230oC.
ИК (ньюджол) : 3440, 3310, 3130, 1690 см-1.
ЯМР (ДМСО-d6) δ: 6,4 - 8,8 (4H, ш.), 6,68 (1H, с), 7,41 (1H, дд, J = 7,2 Гц, 7,2 Гц), 7,8 (1H, с), 7,85 (1H, д, J = 7,2 Гц), 7,98 (1H, д, J = 7,2 Гц), 8,53 (1H, с), 12,9 (1H, с).
(21) 2-[3-(Пиримидин-4-ил)бензоил]гуанидин
Т.пл. 173-175oC.
ИК (ньюджол): 3320, 3150, 1680, 1605, 1575 см-1.
ЯМР (ДМСО-d6) δ: 6,2-8,7 (4H, ш.), 7,59 (1H, дд, J = 7,7 Гц, 7,7 Гц), 8,1 (1H, д, J = 5,4 Гц), 8,2-8,3 (2H, м), 8,86-8,95 (2H, м), 9,28 (1H, c).
(22) 2-[3-(Пиридин-2-ил)бензоил]гуанидин
Т.пл. 190-191oC.
ИК (ньюджол): 3310, 3140, 1670, 1605, 1585, 1570 см-1.
ЯМР (ДМСО-d6) δ: 6,3-8,6 (4H, ш.), 7,31-7,43 (1H, м), 7,51 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,83-7,99 (2H, м), 8,08-8,18 (2H, м), 8,65-8,73 (1H, м), 8,78-8,84 (1H, м).
(23) 2-[3-(Пиридин-3-ил)бензоил]гуанидин.
Т.пл. 182-185oC.
ИК (ньюджол): 3430, 3290, 1690, 1670, 1625 см-1.
ЯМР (ДМСО-d6) δ: 6,3-8,6 (4H, ш.), 7,46-7,58 (2H, м), 7,76-7,83 (1H, м), 8,02-8,15 (2H, м), 8,35-8,41 (1H, м), 8,56-8,62 (1H, м), 8,85-8,89 (1H, м).
(24) 2-[3-(5-Аминопиразол-1-ил)бензоил]гуанидин
Т.пл. 140-143oC.
ИК (ньюджол): 3320, 3180, 1645 см-1.
ЯМР (ДМСО-d6) δ: 5,3 (2H, c), 5,48 (1H, д, J = 1,8 Гц), 6,2-8,6 (4H, ш. ), 7,29 (1H, д, J = 1,8 Гц), 7,47 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,61-7,69 (1H, м), 7,95-8,02 (1H, м), 8,27-8,32 (1H, м).
(25) 2-[3-(1H-тетразол-5-ил)бензоил]гуанидин
Т.пл. >300oC.
ИК (ньюджол): 3300, 3100, 1700, 1670, 1610 см-1.
ЯМР (D2O + NaOD) δ: 7,56 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,98 (1H, д, J = 7,8 Гц), 8,12 (1H, д, J = 7,8 Гц), 8,5 (1H, c).
(+) APCI МАСС (m/z): 232 /M+H/+.
(26) 2-[3-(3-Циано-1,5-диметилпиррол-2-ил)бензоил]гуанидин
Т.пл. 112-124oC.
ИК (ньюджол): 3320, 3350, 1662, 1640, 1610, 1590 см-1.
ЯМР (ДМСО-d6) δ: 2,26 (3H, c), 3,45 (3H, c), 6,2-8,4 (4H, м), 7,5-7,62 (2H, м), 8,1-8,2 (2H, м).
(27) 2-[2-(Пиррол-1-ил)изоникотиноил]гуанидин
Т.пл. 165-169oC.
ИК (ньюджол): 3440, 3350, 3070, 1685, 1625, 1605 см-1.
(ДМСО-d6) δ: 6,29-6,35 (2H, м), 6,5-8,9 (4H, ш.), 7,63-7,69 (2H, м), 7,71-7,77 (1H, м), 8,06 (1H, c), 8,45-8,52 (1H, м).
(28) 2-[[4-(Пиррол-1-ил)пиридин-1-ил]карбонил]гуанидин
Т.пл. 176-180oC.
ИК (ньюджол): 3320, 3100, 1663, 1584 см-1.
ЯМР (ДМСО-d6) δ: 6,2-8,7 (4H, ш.), 6,34-6,4 (2H, м), 7,55-7,61 (2H, м), 7,7 (1H, дд, J = 2,2 Гц, 5,4 Гц), 8,2 (1H, д, J = 2,2 Гц), 8,58 (1H, д, J = 5,4 Гц).
(29) 2-[3-(3-Метилфенил)бензоил]гуанидина гидрохлорид
Т.пл. 168-169oC.
ИК (ньюджол): 1690, 1300, 1250 см-1.
ЯМР (ДМСО-d6) δ: 2,4 (3H, c), 7,24 (1H, д, J = 7,4 Гц), 7,39 (1H, дд, J = 7,6 Гц, 7,6 Гц), 7,6-7,75 (3H, м), 7,95-8,15 (2H, м), 8,47 (1H, c), 8,63 (2H, ш.c), 8,89 (2H, ш.c), 12,3 (1H, c).
(+) APCI МАСС (m/z): 254 /M свободного основания + H/+.
(30) 2-[3-[(2-Фторфенил)бензоил]гуанидина гидрохлорид
Т.пл. 168-169oC.
ИК (ньюджол): 3350, 3150, 1700, 1685, 1235 см-1.
ЯМР (ДМСО-d6) δ: 7,3-7,55 (3H, м), 7,67-7,8 (2H, м), 7,9-7,94 (1H, м), 8,17 (1H, д, J = 7,9 Гц), 8,3 (1H, c), 8,63 (2H, ш. c), 8,81 (2H, ш.c).
(+) APCI МАСС (m/z): 258 /M свободного основания + H/+.
Элементный анализ для C14H12FN3•HCl
Вычислено: C 56,55, H 4,54, N 14,13
Найдено: C 56,65, H 4,43, N 14,15
(31) 2-[3-(3-Нитрофенил)бензоил]гуанидина гидрохлорид
Т.пл. 239-240oC.
ИК (ньюджол): 3325, 1690, 1520, 1360 см-1.
ЯМР (ДМСО-d6) δ: 7,7-7,9 (2H, м), 8,1-8,2 (2H, м), 8,2-8,3 (1H, м), 8,3-8,4 (1H, м), 8,4-8,9 (6H, м), 12,31 (1H, c).
(+) APCI МАСС (m/z): 285 /M свободного основания + H/+.
(32) 2-[3-(2-Нитрофенил)бензоил]гуанидина гидрохлорид
Т.пл. 206-208oC.
ИК (ньюджол): 3350, 1700, 1590, 1520, 1230 см-1.
ЯМР (ДМСО-d6) δ: 7,67-7,88 (5H, м), 8,05-8,23 (3H, м), 8,59 (2H, ш.c), 8,73 (2H, ш.c), 12,17 (1H, c).
(+) APCI МАСС (m/z): 285 /M свободного основания + H/+.
(33) 2-[3-(3-Цианофенил)бензоил]гуанидина гидрохлорид
Т.пл. 268oC (разл.).
ИК (ньюджол): 3350, 2230, 1700, 1560 см-1.
ЯМР (ДМСО-d6) δ: 7,67-7,77 (2H, м), 7,9 (1H, д, J = 7,8 Гц), 8,12 (2H, д, J = 7,8 Гц), 8,27 (1H, д, J = 7,8 Гц), 8,4 (1H, c), 8,59 (1H, c), 8,61 (2H, ш.c), 8,85 (2H, ш.c), 12,4 (1H, c).
(+) APCI МАСС (m/z): 265 /M свободного основания + H/+.
(34) 2-[3-(2-Хлорфенил)бензоил]гуанидина гидрохлорид
Т.пл. 191-192oC.
ИК (ньюджол): 3200, 1690, 1560, 1230 см-1.
ЯМР (ДМСО-d6) δ: 7,44-7,74 (5H, м), 7,82 (1H, ддд, J = 7,8 Гц, 1,4 Гц, 1,4 Гц), 8,15-8,24 (2H, м), 8,65 (2H, ш.c), 8,8 (2H, ш.c), 12,2 (1H, c).
(+) APCI МАСС (m/z): 274 /M свободного основания + H/+.
Элементный анализ для C14H12ClN3O•HCl
Вычислено: C 54,21, H 4,22, N 13,55
Найдено: C 54,11, H 4,24, N 13,42
(35) 2-[3-(3-Фторфенил)бензоил]гуанидина гидрохлорид
Т.пл. 214-216oC.
ИК (ньюджол): 3100, 1690, 1270 см-1.
ЯМР (ДМСО-d6) δ: 7,22-7,31 (1H, м), 7,49-7,84 (4H, м), 8,05-8,13 (2H, м), 8,54 (1H, c), 8,64 (2H, ш.c), 8,89 (2H, ш.c), 12,41 (1H, c).
(+) APCI МАСС (m/z): 258 /M свободного основания + H/+.
(36) 2-[3-(4-Фторфенил)бензоил]гуанидина гидрохлорид
Т.пл. 160-162oC.
ИК (ньюджол): 3120, 1700, 1630, 1260 см-1.
ЯМР (ДМСО-d6) δ: 7,29-7,38 (2H, м), 7,69 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,9-8,09 (4H, м), 8,47 (1H, c), 8,61 (2H, ш.c), 8,86 (2H, ш.c), 12,34 (1H, c).
(+) APCI МАСС (m/z): 258 /M свободного основания + H/+.
(37) 2-[3-(3-Трифторметилфенил)бензоил]гуанидина гидрохлорид
Т.пл. 179-181oC.
ИК (ньюджол): 3300, 1690, 1640, 1150, 1110 см-1.
ЯМР (ДМСО-d6) δ: 7,69-7,82 (3H, м), 8,09-8,15 (2H, м), 8,2-8,23 (2H, м), 8,55 (1H, c), 8,59 (2H, ш.c), 8,82 (2H, ш.c), 12,37 (1H, c).
(+) APCI МАСС (m/z): 308 /M свободного основания + H/+.
(38) 2-[3-[(E)-2-карбоксиэтенил]-5-(пиррол-1-ил)бензоил]гуанидин
Т.пл. >250oC.
ИК (ньюджол): 3300, 1690, 1580 см-1.
ЯМР (ДМСО-d6) δ: 6,2-6,4 (2H, м), 6,7 (1H, д, J = 16 Гц), 7,4-7,5 (2H, м), 7,66 (1H, д, J = 16 Гц), 8-8,2 (3H, м).
(+) APCI МАСС (m/z): 299 /M+H/+.
(39) 2-[3-Трифторметилсульфониламино-5-(пиррол-1-ил)бензоил]гуанидин
Т.пл. >250oC.
ИК (ньюджол): 3370, 1700, 1595 см-1.
ЯМР (ДМСО-d6) δ: 6,2-6,3 (2H, м), 7,2-7,3 (2H, м), 7,4-7,5 (3H, м), 8,1-8,4 (4H, ш.c), 11,09 (1H, ш.c).
(+) APCI МАСС (m/z): 376 /M+H/+.
(40) 2-[3-(Диэтиламиноацетиламино)-5-(пиррол-1-ил)-бензоил] гуанидина дигидрохлорид
Т.пл. 188-195oC.
ИК (ньюджол): 3200, 1700, 1590 см-1.
ЯМР (ДМСО-d6) δ: 1,27 (6H, т, J = 7,2 Гц), 3,2-3,4 (4H, м), 4,24 (2H, c), 6,3-6,4 (2H, м), 7,5-7,6 (2H, м), 8,15 (1H, c), 8,18 (1H, c), 8,38 (1H, c), 8,7 (2H, ш.c), 8,92 (2H, ш.c), 9,95 (1H, ш.c), 11,66 (1H, c), 12,57 (1H, c).
(+) APCI МАСС (m/z): 357 /M свободного основания + H/+.
(41) 2-[3-Морфолиноацетиламино)-5-(пиррол-1-ил)бензоил] гуанидина дигидрохлорид
Т.пл. >250oC.
ИК (ньюджол): 3320, 1690, 1615, 1580 см-1.
ЯМР (ДМСО-d6) δ: 3,1-3,6 (4H, м), 3,7-4,1 (4H, м), 4,27 (2H, c), 6,2-6,4 (2H, м), 7,5-7,6 (2H, м), 8,11 (1H, c), 8,16 (1H, c), 8,35 (1H, c), 8,64 (2H, ш.c), 8,9 (2H, ш.c), 10,7 (1H, ш.c), 11,43 (1H, c), 12,53 (1H, c).
(+) APCI МАСС (m/z): 371 /M свободного основания + H/+.
(42) 2-[3-Диметиламинометил-5-(пиррол-1-ил)бензоил] гуанидина дигидрохлорид
Т.пл. >250oC.
ИК (ньюджол): 3300, 1690, 1600 см-1.
ЯМР (ДМСО-d6) δ: 2,75 (6H, c), 4,43 (2H, c), 6,3-6,4 (2H, м), 7,7-7,8 (2H, м), 8,02 (1H, c), 8,38 (1H, c), 8,6 (1H, c), 8,71 (1H, ш.c), 8,93 (1H, ш.c), 11,2 (1H, ш.c), 12,67 (1H, ш.c).
(+) APCI МАСС (m/z): 286 /M свободного основания + H/+.
(43) 2-[3-(2-Аминоэтил)-5-(пиррол-1-ил)бензоил]гуанидина дигидрохлорид
Т.пл. 216-218oC.
ИК (ньюджол): 3350, 1690, 1600 см-1.
ЯМР (ДМСО-d6) δ: 2,9-3,3 (4H, м), 6,2-6,4 (2H, м), 7,6-7,7 (2H, м), 7,8-7,9 (2H, м), 8-8,3 (3H, м), 8,33 (1H, c), 8,72 (2H, ш.c), 8,95 (2H, ш. c), 12,6 (1H, c).
(+) APCI МАСС (m/z): 272 /M свободного основания + H/+.
(44) 2-[3-Гидроксииминометил-5-(пиррол-1-ил))бензоил]гуанидин
Т.пл. 185-187oC.
ИК (ньюджол): 3360, 3130, 1660, 1625, 1585 см-1.
ЯМР (ДМСО-d6) δ: 6,2-6,4 (2H, м), 7,3-7,4 (2H, м), 7,7-8,3 (4H, м), 11,39 (1H, c).
(+) APCI МАСС (m/z): 272 /M+H/+.
(45) 2-[3-Гидроксиметил-5-(пиррол-1-ил)бензоил]гуанидин
Т.пл. 188-189oC.
ИК (ньюджол): 3420, 3300, 3150, 1635, 1600 см-1.
ЯМР (ДМСО-d6) δ: 4,5-4,7 (2H, м), 5,2-5,4 (1H, м), 6,2-6,3 (2H, м), 7,3-7,4 (2H, м), 7,5-7,6 (1H, c), 7,9-8,1 (2H, м).
(+) APCI МАСС (m/z): 259 /M+H/+.
(46) 1-Циано-8-(диаминометиленаминокарбонил)-4,4-диметил-4H- пирроло/2,1-c//1,4/бензоксазина метансульфонат
Т.пл. 276-278oC.
ИК (ньюджол): 3330, 3160, 3100, 2210, 1712, 1694, 1610, 1597, 1195, 1040 см-1.
ЯМР (ДМСО-d6) δ: 1,64 (6H, c), 2,38 (3H, c), 6,47 (1H, д, J = 4 Гц), 7,39 (1H, д, J = 4 Гц), 7,41 (1H, д, J = 8,6 Гц), 7,9 (1H, дд, J = 2 Гц, 8,6 Гц), 8,39 (4H, c), 8,66 (1H, д, J = 2 Гц), 11,31 (1H, c).
(+) APCI МАСС (m/z): 310 /M свободного основания + H/+.
Элементный анализ для C16H15N5O2•CH4O3S:
Вычислено: C 50,36, H 4,72, N 17,27
Найдено: C 50,17, H 4,84, N 17,12
(47) 8-Диаминометиленаминокарбонил)-4H-пирроло/2,3-c//1,4/бензоксазина метансульфонат
Т.пл. 232-233oC.
ИК (ньюджол): 3330, 1695, 1585, 1170, 1045 см-1.
ЯМР (ДМСО-d6) δ: 2,42 (3H, c), 5,31 (2H, c), 6,11-6,17 (1H, м), 6,33-6,4 (1H, м), 7,28 (1H, д, J = 8,5 Гц), 7,57-7,65 (1H, м), 7,71 (1H, дд, J = 2,1 Гц, 8,5 Гц), 8,21 (1H, д, J = 2,1 Гц), 8,42 (4H, c), 11,28 (1H, c).
(+) APCI МАСС (m/z): 257 /M свободного основания + H/+.
Элементный анализ для C13H12N4O2•CH4O3S:
Вычислено: C 47,72, H 4,58, N 15,90
Найдено: C 47,80, H 4,59, N 15,79
(48) 2-[3-Гидроксиметил-5-фенилбензоил]гуанидина метансульфонат
Т.пл. 129-130oC.
ИК (ньюджол): 3350, 1690, 1170, 1040 см-1.
ЯМР (ДМСО-d6) δ: 4,68 (2H, c), 7,4-7,6 (3H, м), 7,73-7,78 (2H, м), 7,9-7,95 (2H, м), 8,09 (1H, c), 8,3-8,7 (4H, ш.), 11,38 (1H, c).
(+) APCI МАСС (m/z): 270 /M свободного основания + H/+.
(49) 2-[3-Бензоилбензоил гуанидина]метансульфонат
Т.пл. 208-210oC.
ИК (ньюджол): 3300, 1710, 1040, 700 см-1.
ЯМР (ДМСО-d6) δ: 2,38 (3H, c), 7,56-7,85 (6H, м), 8,03-8,08 (1H, м), 8,22-8,3 (2H, м), 8,2-8,7 (4H, ш.), 11,45 (1H, c).
(+) APCI МАСС (m/z): 268 /M свободного основания + H/+.
(50) 2-[3-Трифторметилбензоил]гуанидина гидрохлорид
Т.пл. 156-157oC.
ИК (ньюджол): 3400, 3200, 1715, 1700, 1690 см-1.
ЯМР (ДМСО-d6) δ: 7,85 (1H, дд, J = 7,8 Гц, 7,7 Гц), 8,09 (1H, д, J = 7,8 Гц), 8,43 (1H, д, J = 7,7 Гц), 8,48 (1H, c), 8,67 (2H, ш.c), 8,77 (2H, ш.c), 12,42 (1H, c).
(+) APCI МАСС (m/z): 232 /M свободного основания + H/+.
(51) 2-[3-(3-Хлорфенил)бензоил]гуанидина метансульфонат
Т.пл. 213-214oC.
ИК (ньюджол): 3340, 3100, 1710, 1160 см-1.
ЯМР (ДМСО-d6) δ: 2,4 (3H, c), 7,49-7,61 (2H, м), 7,68-7,79 (2H, м), 7,86 (1H, c), 7,97 (1H, д, J = 7,9 Гц), 8,07 (1H, д, J = 7,9 Гц), 8,22 (1H, c), 8,45 (4H, ш.c), 11,42 (1H, c).
(+) APCI МАСС (m/z): 276 /M свободного основания + H/+.
Элементный анализ для C14H12ClN3O•CH3SO3H
Вычислено: C 48,72, H 4,36, N 11,36
Найдено: C 48,74, H 4,40, N 11,22
(52) 2-[3-(Фуран-3-ил)бензоил]гуанидина метансульфонат
Т.пл. 214-216oC.
ИК (ньюджол): 3350, 3100, 1690, 1590, 1260 см-1.
ЯМР (ДМСО-d6) δ: 2,42 (3H, c), 7,07 (1H, дд, J = 1,6 Гц, 0,6 Гц), 7,63 (1H, дд, J = 7,8 Гц, 7,8 Гц), 7,8-7,85 (2H, м), 7,97 (1H, д, J = 7,8 Гц), 8,15 (1H, дд, J = 1,6 Гц, 0,6 Гц), 8,34 (1H, c), 8,46 (4H, ш.c), 11,38 (1H, c).
(+) APCI МАСС (m/z): 230 /M свободного основания + H/+.
Элементный анализ для C12H11N3O2•CH3SO3H
Вычислено: C 47,99, H 4,65, S 12,92
Найдено: C 48,17, H 4,75, S 12,46
(53) 2-[3-Гидрокси-5-фенилбензоил]гуанидина метансульфонат
Т.пл. 287-288oC.
ИК (ньюджол): 3300, 3150, 1700, 1600, 1340, 1150 см-1.
ЯМР (ДМСО-d6) δ: 2,42 (3H, c), 7,36 (2H, ддд, J = 7,8 Гц, 2,1 Гц, 2,1 Гц), 7,4-7,56 (3H, м), 7,65-7,73 (3H, м), 8,42 (4H, ш.c), 10,22 (1H, c), 11,27 (1H, c).
(+) APCI МАСС (m/z): 256 /M свободного основания + H/+.
(54) 2-[3-(2-Гидроксиэтокси))-5-фенилбензоил]гуанидина метансульфонат
Т.пл. 175-176oC.
ИК (ньюджол): 3350, 3100, 1700, 1590, 1170 см-1.
ЯМР (ДМСО-d6) δ: 2,43 (3H, с), 3,78 (2H, т, J = 4,8 Гц), 4,19 (2H, т, J = 4,8 Гц), 7,39 - 7,55 (5H, м), 7,76 - 7,8 (3H, м), 8,44 (4H, ш.с.), 11,36 (1H, с).
(+) APCI MACC (m/z): 300 /M свободного основания + H/+.
(55) 2-[3-(2-Цианотиофен-3-ил)бензоил]гуанидина метансульфонат
Т.пл. 188 - 189oC.
ИК (ньюджол): 3320, 2200, 1710, 1050 см-1.
ЯМР (ДМСО-d6) δ: 2,38 (3H, с), 7,68 (1H, д, J = 5,1 Гц), 7,82 (1H, дд, J = 7,8 Гц, 7,8 Гц), 8 - 8,15 (2H, м), 8,22 (1H, д, J = 5,1 Гц), 8,24 - 8,26 (1H, м), 8,3 - 8,6 (4H, ш.с), 11,42 (1H, с).
(+) APCI MACC (m/z): 271 /M+H/+.
Элементный анализ для C13H10N4OS•CH4O3S:
Вычислено: C 45,89, H 3,85, N 15,29
Найдено: C 45,81, H 3,74, N 15,13
(56) 2-[3-(2-Цианофуран-3-ил)бензоил]гуанидина метансульфонат
Т.пл . 208oC (разл.).
ИК (ньюджол): 3300, 2220, 1720, 1170 см-1.
ЯМР (ДМСО-d6) δ: 2,37 (3H, с), 7,38 (1H, д, J = 1,9 Гц), 7,81 (1H, дд, J = 7,8 Гц, 7,8 Гц), 8,04 (1H, д, J = 7,8 Гц), 8,11 (1H, д, J = 7,8 Гц), 8,24 (1H, д, J = 1,9 Гц), 8,28 (1H, дд, J = 1,7 Гц, 1,7 Гц), 8,43 (4H, ш.с), 11,44 (1H, с).
(+) APCI MACC (m/z): 244 /M+H/+.
(57) 2-[2-Гидрокси-3-(пиррол-1-ил)бензоил]гуанидина метансульфонат
Т.пл. 176-177oC.
ИК (ньюджол): 3390, 3280, 1694, 1665, 1575, 1237, 1028 см-1.
ЯМР (ДМСО-d6) δ: 2,36 (3H, с), 6,18 - 6,24 (2H, м), 6,99 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,07 - 7,13 (2H, м), 7,4 (1H, дд, J = 1,5 Гц, 7,9 Гц), 7,75 (1H, дд, J = 1,5 Гц, 7,9 Гц), 7,8 - 8,6 (4H, ш.).
Элементный анализ для C12H12N4O2•CH4O3S:
Вычислено: C 45,88, H 4,74, N 16,46
Найдено: C 46,04, H 4,83, N 16,48
(58) 6-(Диаминометиленаминокарбонил)-4H-пирроло /2,1-c//1,4/-бензоксазина метансульфонат
ЯМР (ДМСО-d6) δ: 2,35 (3H, с), 5,38 (2H, с), 6,15 - 6,2 (1H, м), 6,31 - 6,39 (1H, м), 7,25 (1H, дд, J = 7,9 Гц, 7,9 Гц), 7,5 - 7,62 (2H, м), 7,98 (1H, дд, J = 1,5 Гц), 8,58 (4H, с), 11,05 (1H, с).
(59) 1-Циано-6-(диаминометиленаминокарбонил)-4H-пирроло-/2,1-c//1,4/бензоксазина метансульфонат
ЯМР (ДМСО-d6) δ: 2,36 (3H, с), 5,42 (2H, с), 6,45 (1H, д, J = 4 Гц), 7,34 - 7,44 (2H, м), 7,68 (1H, дд, J = 1,4 Гц, 7,9 Гц), 8,2 (1H, дд, J = 1,4 Гц, 7,9 Гц), 8,56 (4H, с), 11,18 (1H, с).
(60) 2-[4-Гидроксиметил-3-(пиррол-1-ил)бензоил]-гуанидина метансульфонат
Т.пл. 131-133oC.
ИК (ньюджол): 3340, 3120, 1707, 1590, 1190, 1040 см-1
ЯМР (ДМСО-d6)  2,4 (3H, с), 4,47 (2H, с), 6,25 - 6,31 (2H, м), 7,05 - 7,11 (2H, м), 7,8 - 7,9 (2H, м), 8 (1H, д, J = 8,7 Гц), 8,22 - 8,7 (4H, ш.), 11,33 (1H, с).
2,4 (3H, с), 4,47 (2H, с), 6,25 - 6,31 (2H, м), 7,05 - 7,11 (2H, м), 7,8 - 7,9 (2H, м), 8 (1H, д, J = 8,7 Гц), 8,22 - 8,7 (4H, ш.), 11,33 (1H, с).
Пример 26.
По методикам, аналогичным методикам примеров 6, 17 и 18, получены следующие соединения:
(1) 2-[2-Метокси-5-(пиррол-1-ил)бензоил]гуанидина метансульфонат
Т.пл. 197-198oC.
ИК (ньюджол): 3290, 3130, 1710, 1180, 1050 см-1.
ЯМР (ДМСО-d6) δ: 2,42 (3H, с), 3,98 (3H, с), 6,25 - 6,3 (2H, м), 7,31 - 7,39 (3H, м), 7,8 - 7,89 (2H, м), 8,65 (4H, с), 11,11 (1H, с).
Элементный анализ для C13 H14N4O2•CH4O3S:
Вычислено: C 47,45, H 5,12, N 15,81
Найдено: C 47,09, H 5,16, N 15,52
(2) 2-[5-(Пиррол-1-ил)-3-сульфамоилбензоил]гуанидина метансульфонат
Т.пл. 240-241oC.
ИК (ньюджол): 3300, 3150, 1718, 1695, 1585, 1335, 1165 см-1.
ЯМР (ДМСО-d6) δ: 2,43 (3H, с), 6,37 - 6,43 (2H, м), 7,51 - 7,56 (2H, м), 7,65 (2H, с), 8,16 (1H, с), 8,25 - 8,31 (2H, м), 8,31 - 8,8 (4H, м), 11,64 (1H, с).
Элементный анализ для C12 H13N5O3S•CH4O3S:
Вычислено: C 38,70, H 4,25, N 17,36
Найдено: C 38,45, H 4,25, N 17,08
(3) 2-[4-Метокси-3-(пиррол-1-ил)бензоил]гуанидина метансульфонат
Т.пл. 220-221oC.
ИК (ньюджол): 3320, 3100, 1705, 1605, 1260, 1048 см-1.
ЯМР (ДМСО-d6) δ: 2,38 (3H, с), 3,94 (3H, с), 6,22 - 6,28 (2H, м), 7,09 - 7,15 (2H, м), 7,44 (1h, д, J = 8,7 Гц), 7,91 (1H, д, J = 2,2 Гц), 7,97 (1H, дд, J = 2,2 Гц, 8,7 Гц), 8,38 (4H, с), 11,19 (1H, с).
(+) APCI MACC (m/z): 259 /M свободного основания + H/+.
Элементный анализ для C13 H14N4O2•CH4O3S:
Вычислено: C 47,45, H 5,12, N 15,81
Найдено: C 47,30, H 5,17, N 15,72
(4) 2-[4-Ацетиламинометил-3-(пиррол-1-ил)бензоил] гуанидина метансульфонат
Т.пл. 193-194oC.
ИК (ньюджол): 3370, 3270, 1705, 1648, 1175, 1050 см-1.
ЯМР (ДМСО-d6) δ: 1,89 (3H, с), 2,37 (3H, с), 4,2 (2H, д, J = 5,7 Гц), 6,26 - 6,34 (2H, м), 7,03 - 7,12 (2H, м), 7,61 (1H, д, J = 8,2 Гц), 7,85 (1H, с), 7,97 (1H, д, J = 8,2 Гц), 8,19 - 8,65 (5H, м), 11,3 (1H, с).
(+) APCI MACC (m/z): 300 /M свободного основания + H/+.
Элементный анализ для C15 H17N5O2•CH4O3S:
Вычислено: C 48,60, H 5,35, N 17,71
Найдено: C 48,79 H 5,41, N 17,39
(5) 2-[3-(3-Циано-1,5-диметилпиррол-2-ил)бензоил] гуанидина метансульфонат
Т.пл. 230-132oC.
ИК (ньюджол): 3330, 3080, 2220, 1700, 1650, 1600, 1170, 1050 см-1.
ЯМР (ДМСО-d6) δ: 2,27 (3H, с), 2,34 (3H, с), 3,49 (3H, с), 6,4 (1H, с), 7,72 - 7,88 (2H, м), 7,95 - 8,08 (2H, м), 8,35 (4H, с), 11,32 (1H, с).
(+) APCI MACC (m/z): 282 /M свободного основания + H/+.
Элементный анализ для C15 H15N5O•CH4O3S:
Вычислено: C 50,92, H 5,07, N 18,56
Найдено: C 50,85, H 5,02, N 18,36
(6) 2-[3-Гидроксиметил-5-(пиррол-1-ил)бензоил]гуанидина изотионат
Т.пл. 154-156oC.
ИК (ньюджол): 3350, 1700, 1590 см-1.
ЯМР (ДМСО-d6) δ: 2,73 (2H, т, J = 7 Гц), 3,67 (2H, т, J = 7 Гц), 4,66 (2H, с), 6,3 - 6,4 (2H, м), 7,4 - 7,5 (2H, м), 7,7 - 8 (3H, м), 8,44 (4H, ш. с), 11,38 (1H, с).
(+) APCI MACC (m/z): 259 /M свободного основания + H/+.
Элементный анализ для C13 H14N4O2•C2H6O4S:
Вычислено: C 46,87, H 5,24, N 14,57
Найдено: C 46,43, H 5,32, N 14,45
(7) 2-[3-Гидроксииминометил-5-(пиррол-1-ил)бензоил]-гуанидина метансульфонат
Т.пл. 224-226oC.
ИК (ньджол): 3350, 3170, 1700, 1645, 1590 см-1.
ЯМР (ДМСО-d6) δ: 2,42 (3H, с), 6,3 - 6,4 (2H, м), 7,5 - 7,6 (2H, м), 8 - 8,1 (3H, м), 8,31 (1H, с), 8,42 (4H, ш.с), 11,51 (1H, с), 11,64 (1H, с).
(+) APCI MACC (m/z): 272 /M свободного основания + H/+.
Элементный анализ для C13 H13N5O2•CH4O3S:
Вычислено: C 45,77, H 6,66, N 19,06
Найдено: C 45,69, H 4,75, N 18,87
(8) 2-[2-Нитро-5-(пиррол-1-)бензоил]гуанидина гидрохлорид
Т.пл. 253-254oC.
ИК (ньюджол): 3350, 3120, 1720, 1690, 1620, 1590, 1570, 1330 см-1.
ЯМР (ДМСО-d6) δ: 6,38-6,44 (2H, м), 7,65-7,71 (2H, м), 8,06 (1 H, дд, J= 2,5 Гц, 9 Гц), 8,21 (1H, д, J=2,5 Гц), 8,31 (1H, д, J=9 Гц), 8,45 (2H, с), 8,74 (2H, с), 12,77 (1H, с).
(+) APCl МАСС (m/z): 274 /M свободного основания + H/+.
Элементный анализ для C12H11N5O3 • HCl
Вычислено: C 46,54, H 3,91, N 22,61
Найдено: C 46,24, H 3,90, N 22,27
(9) 2-[3-[2-((Z)-1-гидроксииминоэтил)пиррол-1-ил] бензоил] - гуанидина гидрохлорид
Т.пл. 184-186oC.
Ик (ньюджол): 3300, 1685 см-1.
ЯМР (ДМСО-d6) δ: 2,26 (3H, с), 6,9-6,95 (1H, м), 7,65-7,77 (2H, м), 7,97-8,07 (2H, м), 8,36 (1H, с), 8,51 (1H, с), 8,65 (2H, с), 8,86 (2H, с), 12,46 (1H, с).
(+) APCl МАСС (m/z): 286/M свободного основания +H/+.
(10) 2-[4-(2-Гидроксиэтокси)-3-(пиррол-1-ил)бензоил] -гуанидина гидрохлорид
Т.пл. 140-142oC.
ИК (ньюджол) 3330, 3150, 1707, 1685, 1600 см-1.
ЯМР (ДМСО-d6) δ: 3,75 (2H, т, J=4,7 Гц), 4,24 (2H, т), J=4,7 Гц), 6,2-6,26 (2H, м), 7,33-7,39 (2H, м), 7,42 (1H, д, J=8,8 Гц), 8,05 (1H, дд, J=2,3 Гц, 8,8 Гц), 8,12 (1H, д, J=2,3 Гц), 8,51 (2H, с), 8,72 (2H, с), 12,06 (1H, с).
(+) APCl MACC (m/z): 289/M свободного основания + H/+.
(11) 8-(Диаминометиленаминокарбонил)-1-диметиламинометил-4,4- диметил-4H-пирроло/2,1-с//1,4/бензоксазина дигидрохлорид
Т.пл. 212-213oC.
ИК (ньюджол): 3320, 1703, 1616 см-1.
ЯМР (ДМСО-d6) δ: 1,58 (6H, с), 2,8 (3H, с), 2,82 (3H, с), 4,88 (2H, ш. с), 6,29 (1H, д, J=3,7 Гц), 6,7 (1H, д, J= 3,7 Гц), 7,31 (1H, д, J=8,5 гЦ), 8,02 (1h, Д, J=8,5 Гц), 8,28 (1H, с), 8,65 (2H, с), 8,84 (2H, c), 10,22 (1H, с). 12, 31 (1H, с).
(+) APCl МАСС (m/z): 342 /M свободного основания + H/+.
(12) 2-[4-(Пиррол-1-ил)бензоил]гуанидина гидрохлорид
Т.пл. 267-268oC.
Ик (ньюджол): 3350, 3130, 1685, 1600 см-1.
ЯМР (ДМСО-d6) 6,32-6,38 (2H, м), 7,56-7,36 (2H, м), 7,85 (2H, д, J=8,8 Гц), 8,29 (2H, д, J=8,8 Гц), 8,63 (2H, с), 8,85 (2H, с), 12,15 (1H, с).
(+) APCI МАСС (m/z): 229 /M свободного основания + H/+.
(13) 2-[3-[(Пиррол-1-ил)метил]бензоил]гуанидина гидрохлорид
Т.пл. 210-212oC.
ИК (ньюджол): 3340, 3240, 3120, 1695, 1630, 1570 см-1.
ЯМР (ДМСО-d6) δ: 5,19 (2H, с), 6-6,1 (2H, м), 6,84-6,93 (2H, м), 7,45-7,61 (2H, м), 7,99 (1H, с), 8,1 (1H, д, J=7,6 Гц), 8,57 (2H, c), 8,77 (2H, с), 12,1 (1H, с).
(+) APCl MACC (m/z): 243/M свободного основания + H/+.
Элементный анализ для C13H14N4O • HCl
Вычислено: C 56,02, H, 5,42, N 20,10
Найдено: C 56,31, H 5.43, N 20,01
(14) 2-[3-(Пиразол-3-ил)бензоил]гуанидина гидрохлорид
Т.пл. 258-260oC.
ИК (ньюджол): 3380, 3150, 1680, 1630 см-1.
ЯМР (ДМСО-d6) δ: 7,05 (1H, д, J=2,3 Гц), 7,64 (1H, дд, J=7,8 Гц), 7,83 (1H, д, J=2,3 Гц), 8,08 (1H, д, J=7,8 Гц), 8,18 (1H, д, J=7,8 Гц), 8,67 (3H, с), 8,9 (2H с), 12,23 (1H, с).
(+) APCl MACC (m/z) : 230 /M свободного основания + H/+.
(15) 2-[3-(пиримидин-4-ил)бензоил]гуанидина гидрохлорид
Т.пл. 285-286oC (разл.).
ИК (ньюджол): 3270, 3050, 1710, 1575 см-1.
ЯМР (ДМСО-d6) δ: 7,8 (1H, дд, J=8 Гц, 8 Гц), 8,31 (1H, д, J=8 Гц), 8,42 (1H, д, J= 5,4 Гц), 8,57 (1H, д, J=8 Гц), 8,66 (2H, с), 8,84 (2H, с), 8,96 (1H, д, J=5,4 Гц), 8,98-9,02 (1H, м), 9,3-9,35 (1H, м), 12,37 (1H, с).
Элементный анализ для C12H11N5O • HCl
Вычислено: C 51,90, H 4,36, N 25,22
Найдено: C 51,94, H 4,35, N 24,88
(+) APCI MACC (m/z): 242 /M свободного основания + H/+.
(16) 2-[3-(Пиридин-2-ил)бензоил]гуанидина дигидрохлорид
Т.пл. 257-258oC.
ИК (ньюджол): 3400-3100 (ш.), 1685, 1620 см-1.
ЯМР (ДМСО-d6) δ: 7,7-7,87 (2H, м), 8,27-8,38 (2H, м), 8,43-8,58 (2H, м), 8,76-8,94 (6H, м), 12,56 (1H, с).
(+) APCl MACC (m/z): 241 /M свободного основания + H/+.
(17) 2-[3-(Пиридин-3-ил)бензоил]гуанидина дигидрохлорид
Т.пл. 255-256oC.
ИК (ньюджол): 3250-3150 (Ш.), 1700, 1615 см-1.
ЯМР (ДМСО-d6) δ: 7,8 (1H, дд, J=7,8 Гц), 8,06-8,17 (1H, м), 8,18-8,3 (2H, м), 8,65-9 (6H, м), 9,03-9,12 (1H, м), 9,46-9,52 (1H, м). 12,66 (1H, с).
Элементный анализ для C13H12N4O • 2HCl
Вычислено: C 49,86, H 4,51, N 17,89
Найдено: C 49,77, H 4,54, N 18,19
(18) 2-[3-(5-Аминопиразол-1-ил)бензоил]гуанидина дигидрохлорид
Т.пл. 248-250o.
ИК (ньюджол): 3400, 3270, 3150, 2700, 1705, 1685, 1625 см-1.
ЯМР (ДМСО-d6) δ: 5,74 (1H, д, J=2,4 Гц), 7,71-7,84 (2H, м), 7,96 (1H, д, J=7,9 Гц), 8,26 (1H, д, 17,9 Гц), 8,34 (1H, с), 8,82 (4H, с). 12,47 (1H, с).
(+) APCl MACC (m/z): 245 /M свободного основания + H/+.
Элементный анализ для C11H12N6O • 2HCl
Вычислено: C 41,66, H 4,13, N 26,50
Найдено: C 41,69, H 4,53, N 26,21
(19) 2-[2-(Пиррол-1-ил)изоникотиноил]гуанидина гидрохлорид
Т.пл. 255-256oC (разл.)
ИК (ньюджол): 3350, 3120, 1700, 1620, 1560 см-1.
ЯМР (ДМСО-d6) δ: 6,33-6,39 (2H, м), 7,76 (1H, дд, J=1,3 Гц, 5,2 Гц), 7,83-7,89 (2H, м), 8,54 (1H, J=1,3 Гц), 8,6-8,95 (4H, м), 8,67 (1H, д, J=5,2 Гц). 12,63 (1H, с).
(+) APCl MACC (m/z): 230 /M свободного основания + H/+.
Элементный анализ для C11H11N5O • HCl
Вычислено: C 49,73, H 4,55, N 26,36
Найдено: C 49,73, H 4,56, N 26,07
(20) 2-[[4-(Пиррол-1-ил)пиридин-2-ил]карбонил]гуанидина гидрохлорид
Т.пл. 257-258o.
ИК (ньюджол): 3400 1690, 1600 см-1.
ЯМР (ДМСО-d6) δ: 6,38-6,45 (2H, м), 7,74-7,81 (2H, м), 8,07 (1H, дд, J= 2,4 Гц, 5,6 Гц), 8,31 (1H, д, J=2,4 Гц). 8,75 (1H, д, J=5.6 Гц), 8,76 (2H, с), 8,84 (2H, с), 11,77 (1H, с).
(21) 2-[3-(2-Цианопиррол-1-ил)бензоил]гуанидина изотионат
Т.пл. 149-150oC.
ИК (ньюджол): 3320, 2220, 1717, 1585, 1172, 1033 см-1.
ЯМР (ДМСО-d6) δ: 2,66 (2H, т, J=6,9 Гц), 3,64 (2H, т, J=6,9 Гц), 6,48-6,55 (1H, м), 7,27-7,33 (1H, м), 7,63-7,68 (1H, м), 7,84 (1H, дд, J=8 Гц, 8 Гц), 7,92-7,8 (1H, м), 8,01-8,09 (2H, м), 8,38 (4H, с). 11,4 (1H, с).
Пример 27.
Реакцией метилового эфира 3-[[N-(2-гидроксиэтил)-N-бензилоксикарбониламино] метил]-5-(пиррол-1-ил)бензойной кислоты с гидрохлоридом гуанидина по методикам, аналогичным методикам примеров 1, 3, 8, 10, 14 и 24, получено следующее соединение:
2-[3-[(2-Оксооксазолидин-3-ил)метил-5-(пиррол-1-ил)- бензоил] гуанидина метансульфонат.
Т.пл. 162-163oC.
ИК (ньюджол): 3350, 3150, 1730, 1700, 1600 см-1.
ЯМР (ДМСО-d6) δ: 2,44 (3H, с), 3,5-3,6 (2H, м), 4,3-4,4 (2H, м), 4,5 (2H, с), 6,3-6,4 (2H, м), 7,5-7,6 (2H, м), 7,69 (1H, с), 7,85 (1H, с), 8,02 (1H, с), 8,47 (4H, ш.с). 11,5 (1H, с).
(+) APCl MACC (m/z): 328 /M свободного основания + H/+.
Элементный анализ для C16H17N5O3 • CH4O3S:
Вычислено: C 48,22, H 5,0, N 16,54
Найдено: C 48,40, H 5,1, N 16,44
Пример 28.
По методике, аналогичной методике примера 12, получено следующее соединение:
2-[4-(Диаминометиленаминокарбонил)-2-(пиррол-1-ил)-бензоил]гуанидин
Т.пл. 228-229oC.
ИК (ньюджол): 3300, 1650, 1577 см-1.
ЯМР (ДМСО-d6) δ: 6-6,5 (8H, ш.), 6,11-6,17 (2H, м), 6,93-6,99 (2H, м), 7,44 (1H, д, J=7,6 Гц), 7,9-7,99 (2H, м).
Пример 29.
По методике, аналогичной методике примера 20, получено следующее соединение:
2-[4-(Диаминометиленаминокарбонил)-2-(пиррол-1-ил)- бензоил] гуанидина диметансульфонат.
Т.пл. 276-278oC.
ИК (ньюджол): 3350, 3110, 1725, 1710, 1660, 1605, 1250, 1405 см-1.
ЯМР (ДМСО-d6) δ: 2,36 (6H, с), 6,28-6,34 (2H, м), 7,04-7,1 (2H, м), 7,87-8,07 (3H, м), 8,07-8,75 (8H, м), 11,53 (1H, с), 11,86 (1H, с).
(+) APCI MACC (m/z): 314 /M свободного основания + H/+.
Элементный анализ для C14H15N7O2 • 2CH4O3S:
Вычислено: C 38,02, H 4,59, N 19,40
Найдено: C 37,79, H 4,40, N 19,06
Пример 30.
По методике, аналогичным методикам примеров 12 и 20, получены следующие соединения:
(1) 2-[5-(2-Цианофенил)-3-(диаминометиленаминокарбонил)- бензоил] гуанидина диметансульфонат
Т.пл. 270-271oC.
ИК (ньюджол): 3350, 1720, 1205, 1050 см-1.
ЯМР (ДМСО-d6) δ: 2,42 (6H, с), 7,6-8,1 (4H, м), 8,44 (2H, с), 8,59 (1H, с), 8-8,7 (4H, ш.), 11,64 (1H, ш.).
(+) APCI MACC (m/z): 350 /М свободного основания + H/+.
Элементный анализ для C17H15N7O2 • 2CH3SO3H
Вычислено: C 42,14, H 4,28, N 18,10
Найдено: C 42,07, H 4,26, N 17,77
(2) 2-[3-(Диаминометиленаминокарбонил)-5-фенилбензоил] - гуанидина диметансульфонат
Т.пл. 265-266oC.
ИК (ньюджол): 3350, 1720, 1205, 1040 см-1.
ЯМР (ДМСО-d6) δ: 2,45 (6H, с), 7,45-7,7 (3H, м), 7,85-7,93 (2H, м), 8,4-8,8 (11H, м), 11,66 (2H, с).
(+) APCI MACC (m/z): 325 /M свободного основания + H/+.
Элементный анализ для C16H16N6O2 • C2H8S2O6
Вычислено: C 41,85, H 4,68, N 16,27
Найдено: C 41,69, H 4,76, N 15,93
(3) 2-[3-(3-Диаминометиленаминокарбонилфенил)-бензоил] -гуанидина диметансульфонат
Т.пл. > 300oC.
ИК (ньюджол): 3350, 3100, 1710, 1580, 1270, 1040 см-1.
ЯМР (ДМСО-d6) δ: 2,36 (6H, с), 7,88 (2H, дд, J = 7,8 Гц, 7,8 Гц), 8 (2H, д, J = 7,8 Гц), 8,13 (2H, д, J = 7,8 Гц), 8,27 (2H, с), 8,4 (8H, ш.с.), 11,41 (2H, с).
(+) APCI MACC (m/z): 325 /M свободного основания + H/+.
Пример 31.
К смеси 2-[3-[2-((E)-2-карбоксиэтенил)пиррол-1-ил] бензоил]- гуанидина (0,25 г), тетрагидрофурана (5 мл) и метанола (5 мл) добавляют 2 M раствор (триметилсилил)диазометана в гексане (0,84 мл) и смесь перемешивают 25 минут при комнатной температуре. К реакционной смеси добавляют уксусную кислоту (2 мл) и перемешивают 5 минут. Затем к полученной смеси добавляют этилацетат и воду и добавлением 20%-го водного раствора карбоната калия устанавливают pH 8. Отделенный органический слой промывают рассолом, сушат над сульфатом магния и испаряют в вакууме. Перекристаллизацией остатка из смеси этанола с диизопропиловым эфиром получают 2-[3-[2-((E)-2-метоксикарбонилэтенил)пиррол-1-ил]бензоил]- гуанидин (0,15 г).
Т.пл. 165-168oC (разл.).
ИК (ньюджол): 3270, 1690, 1620 см-1.
ЯМР (ДМСО-d6) δ: 3,6 (3H, с), 6-8,2 (4H, ш.), 6,15 (1H, д, J = 15,7 Гц), 6,34-6,4 (1H, м), 7,02-7,06 (1H, м), 7,21 (1H, д, J = 15,7 Гц), 7,25 (1H, с), 7,42-7,49 (1H, м), 7,59 (1H, дд, J = 7,7 Гц, 7,7 Гц), 8,01 (1H, с), 8,15 (1H, д, J = 7.7 Гц).
(+) APCI MACC (m/z): 313 /M+H/+.
Элементный анализ для C16H16N4O3
Вычислено: C 61,53, H 5,16, N 17,94
Найдено: C 61,31, H 5,22, N 18,07
Пример 32.
К раствору 2-[4-бензилокси-3-(пиррол-1-ил)бензоил] гуанидина (1,9 г) в метаноле (20 мл) и тетрагидрофуране (20 мл) добавляют 10%-ый палладий на угле (0,2 г) и смесь в течение 30 минут подвергают каталитическому восстановлению при комнатной температуре и атмосферном давлении. Катализатор отфильтровывают и фильтрат испаряют в вакууме. Остаток растворяют в метаноле (15 мл) и к раствору при перемешивании добавляют метансульфоновую кислоту (0,4 мл). Образовавшийся после добавления к раствору диизопропилового эфира осадок отфильтровывают. Перекристаллизацией осадка из смеси метанола с диизопропиловым эфиром получают метансульфонат 2-[4-гидрокси-3-(пиррол-1- ил)бензоил]гуанидина.
Т.пл. 128-133oC.
ИК (ньюджол): 3350, 3150, 1690, 1595, 1240, 1045 см-1.
ЯМР (ДМСО-d6) δ: 2,39 (3H, с), 6,2-6,26 (2H, м), 7,12-7,22 (3H, м), 7,81 (1H, дд, J = 2,2 Гц, 8,5 Гц), 7,9 (1H, д, J = 2,2 Гц), 8,29 (4H, с), 11,17 (1H, с).
Пример 33.
К раствору гидрохлорида гуанидина (63,7 г) в сухом N,N-диметилформамиде (300 мл) добавляют 28%-ый раствор метоксида натрия в метаноле (122,2 мл) и смесь перемешивают 20 минут при комнатной температуре. После добавления к смеси метилового эфира 3-(2-цианопиррол-1-ил)бензойной кислоты (30,5 г) смесь перемешивают 2 часа при той же температуре. Затем реакционную смесь при перемешивании переносят в воду. Фильтрованием образовавшегося осадка получают 2-[3-(2-цианопиррол-1-ил)бензоил]гуанидин (21,66 г).
Т.пл. 136-138oC.
ИК (ньюджол): 3390, 2220, 1637 см-1.
ЯМР (ДМСО-d6) δ: 6,3-6,4 (4H, ш.), 6,46 (1H, дд, J = 2,8 Гц, 3,9 Гц), 7,24 (1H, дд, J = 1,6 Гц, 3,9 Гц), 7,56 (1H, дд, J = 1,6 Гц, 2,8 Гц), 7,58-7,69 (2H, м), 8,11-8,19 (2H, м).
Пример 34.
К смеси 2-[3-(2-цианопиррол-1-ил)бензоил]гуанидина (2 г) и метанола (20 мл) добавляют метансульфоновую кислоту (0,8 мл) и смесь перемешивают 30 минут при комнатной температуре. После добавления к смеси этилацетата (20 мл) образовавшийся осадок отфильтровывают. Перекристаллизацией осадка из воды получают метансульфонат 2-[3-(2-цианопиррол-1-ил)бензоил] гуанидина (1,48 г).
Т.пл. 200-201oC.
ИК (ньюджол): 3350, 3100, 2220, 1720, 1585, 1165, 1045 см-1.
ЯМР (ДМСО-d6) δ: 2,36 (3H, с), 6,49-6,55 (1H, м), 7,27-7,33 (1H, м), 7,64-7,67 (1H, м), 7,84 (1H, дд, J = 7,7 Гц, 7,7 Гц), 7,96 (1H, д, J = 7,7 Гц), 8-8,1 (2H, м), 8,2-8,6 (4H, м), 11,42 (1H, с).
Элементный анализ для C13H11N5O • CH4O3S:
Вычислено: C 48,13, H 4,33, N 20,05
Найдено: C 48,16, H 4,21, N 19,83
Приложение A. Ингибирование Na+/H+-обмена Ki (M) 2,51 • 10-8.
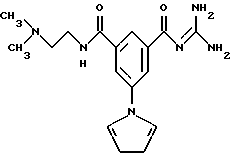
(Пример 9-17)
Приложение B см. в конце описания.
Приложение C.
Методы
Измерение активности Na+/H+ - обмена в крысиных лимфоцитах.
Активацию Na+/H+ обмена в крысиных лимфоцитах по методу Grinstein et al. (1989). Крыс-самцов Спрегью-Даули (8-9 недель) убивали и извлекали тимус и хранили в среде NaCl, содержащей 140 мМ NaCl, 1 мМ KCl, 1 мМ CaCl2, 1 мМ MgCl2, 10 мМ глюкозы, 20 мМ Hepes буфера (pH 7,3) при комнатной температуре. Затем тимус острыми ножницами резали на маленькие кусочки, разбавляли 20 мл среды NaCl и переносили в гомогенизатор типа Dounce, снабженный нетуго закрепленным пестиком. Клетки разделяли с помощью 10 мягких ударов. Для удаления крупных клеточных конгломеров и соединительной ткани, полученную суспензию профильтровывали через 12 слоев хирургической марли и затем фильтрат центрифугировали при 1000 g в течение 10 минут. Осадок повторно суспендировали в 20 мл среды NaCl и повторно осаждали, как описано ранее. Конечный осадок вновь суспендировали в 10 мл RPMI, забуфериренной Hepes (pH 7,3) при 4oC.
Активность Na+/H+-обмена определяли по измерению увеличения клеточного объема, индуцированного внутриклеточным подкислением. Реакцию начинали внесением 0,1 лимфоцитов, приготовленных, как описано выше, в 20 мл Na-пропионового буфера, содержащего 140 мМ Na-пропионата, 1 мМ KCl, 1 мМ CaCl2, 1 мМ MgCl2, 10 мМ глюкозы, 20 мМ Hepes буфера (pH 6,7). Количественное распределение популяции клеток определяли на счетчике Coulter модель TAII (Многоканальный счетчик частиц, Coulter Electronics Inc), снабженном 50 мкм апертурой. Средний диаметр клеток определяли через 0,5, 1, 1,26, 2, 3, 4, 5 минут при комнатной температуре. Затем вычисляли объема клеток и определяли первоначальную скорость увеличения объема за счет Na+/H+-обмена. На основе значений этих скоростей оценивали ингибирующее действие препарата и выражали в значении Ki.
Аритмия, индуцированная ишемией и восстановленной перфузией.
Для этого опыта использовали метод Crome et al. (1986) в модификации. Крыс-самцом SD (в возрасте 9-10 недель) усыпляли с помощью пентобарбитала натрия (50 мг/кг, внутрибрюшинно), интубировали и проводили легочную вентиляцию комнатным воздухом с ударным объемом 4,5 мл с частотой 50 ударов. ЭКГ записывали со свинцового электрода. Физиологический раствор или тестируемое соединение вводили в левую бедренную вену (капельная внутривенная инъекция) в течение 5 минут во избежание закупорки. Проводили торакотомию для наложения лигатуры на коронарную артерию с левой стороны грудной клетки выше над сердцем и проводили закупорку начала левой передней нисходящей коронарной артерии путем приложения давления при аспирации, при которой достигается возникновение регионарной ишемии. Успешное выполнение закупорки подтверждали изменением ЭКГ, индуцированным ишемией. Через 5 минут ишемии, проводили восстановление перфузии остановкой аспирации и определяли частоту проявления вентрикулярной тахикардии и вентрикулярной фибрилляции, с продолжительностью более, чем в 5 секунд.
Определение размера инфаркта миокарда.
Размер инфаркта определяли по методу Bernaner (1985). Торакотомию для наложения лигатуры на коронарную артерию осуществляли, как описано выше. Крысам вводили две капельные внутривенные инъекции физиологического раствора и испытуемого вещества за 5 минут до наложения лигатуры и за 5 минут до восстановления перфузии. На левую переднюю нисходящую коронарную артерию наложили лигатуру примерно 2-3 мм от ее начала. Успешное выполнение закупорки было подтверждено типичным подъемом зубца ST на электрокардиограмме. После 60-минутной ишемии, которая сменилась восстановленной перфузией в течение 60 минут, сердца были сразу же изъяты, обмыты физиологическим раствором и порезаны на 6 срезов примерно в 5 мм параллельно артерио-венозной борозде. Затем все срезы были окрашены при инкубации в 0,5% трифенилтетразолии хлориде на забуференном физиологическом растворе (-) в течение 10 минут при 37oC и зафиксированы в 10% формалине. Через 24 часа они были сфотографированы и с помощью компьютерной планиметровой программы (Luzlx, Nickon) определяли инфарктную область (не окрашенная TTC) и неинфарктную область. Размер инфаркта были вычислен как сумма некротических полей на 6 срезах по отношению к целому участку (сумма некротических полей и полей без некроза) и его выражали в процентах от целого участка.
Статистика.
Результаты по величинам размера инфаркта миокарда выражали как среднее значение ± SEM, а статистическую сравнительную обработку проводили с помощью Kruskal-Wallis теста, и при выявлении с помощью этого теста статистически значимой разницы, данные затем анализировали с помощью теста анализировали с помощью X2 теста. Уровень P < 0,05 рассматривался как достоверный.
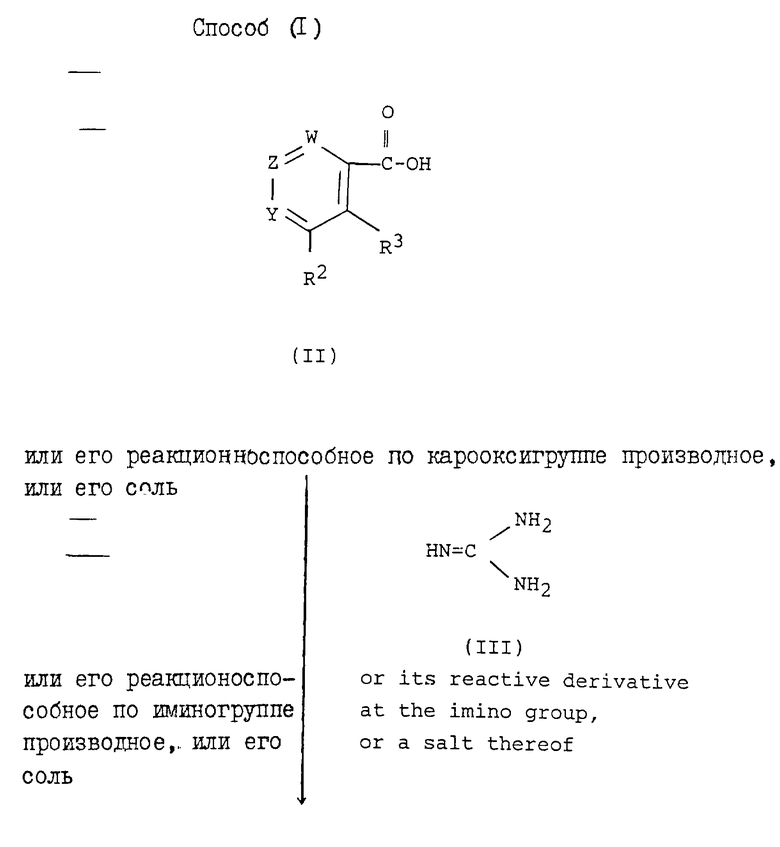
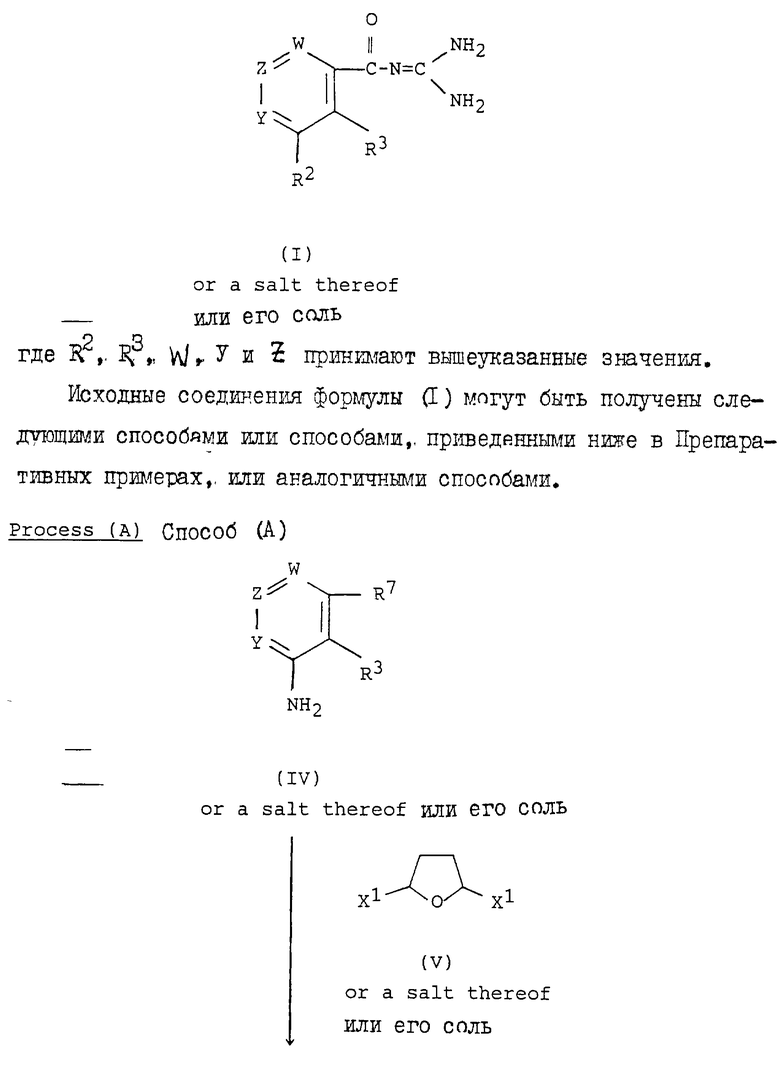
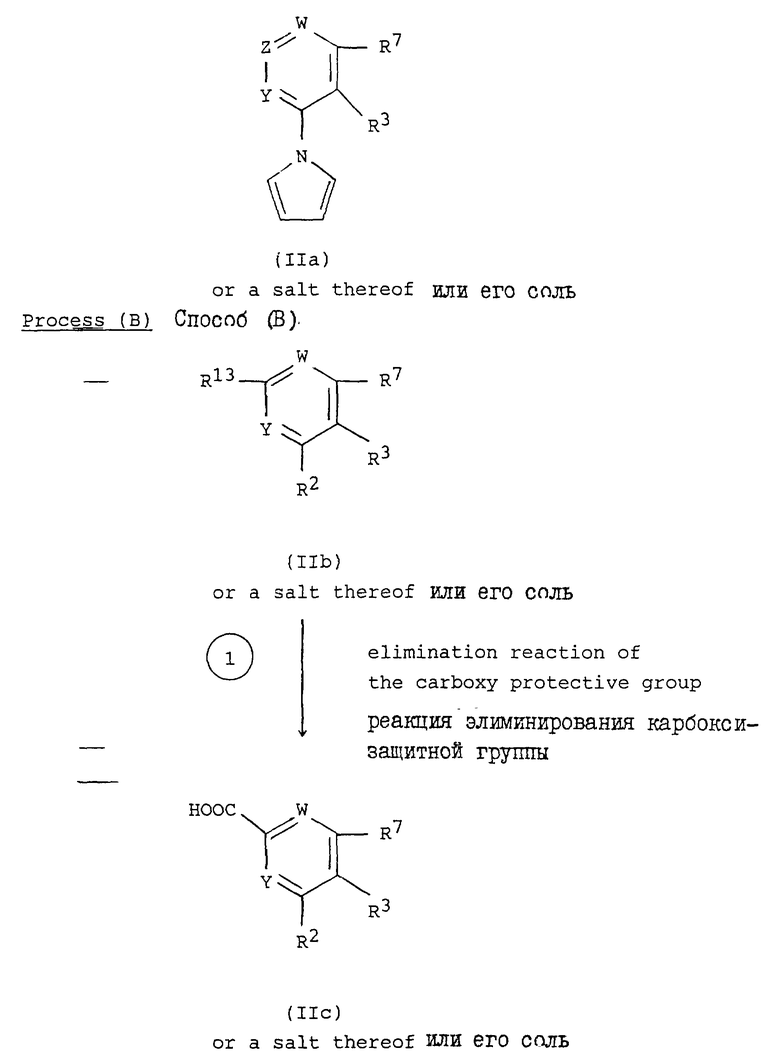






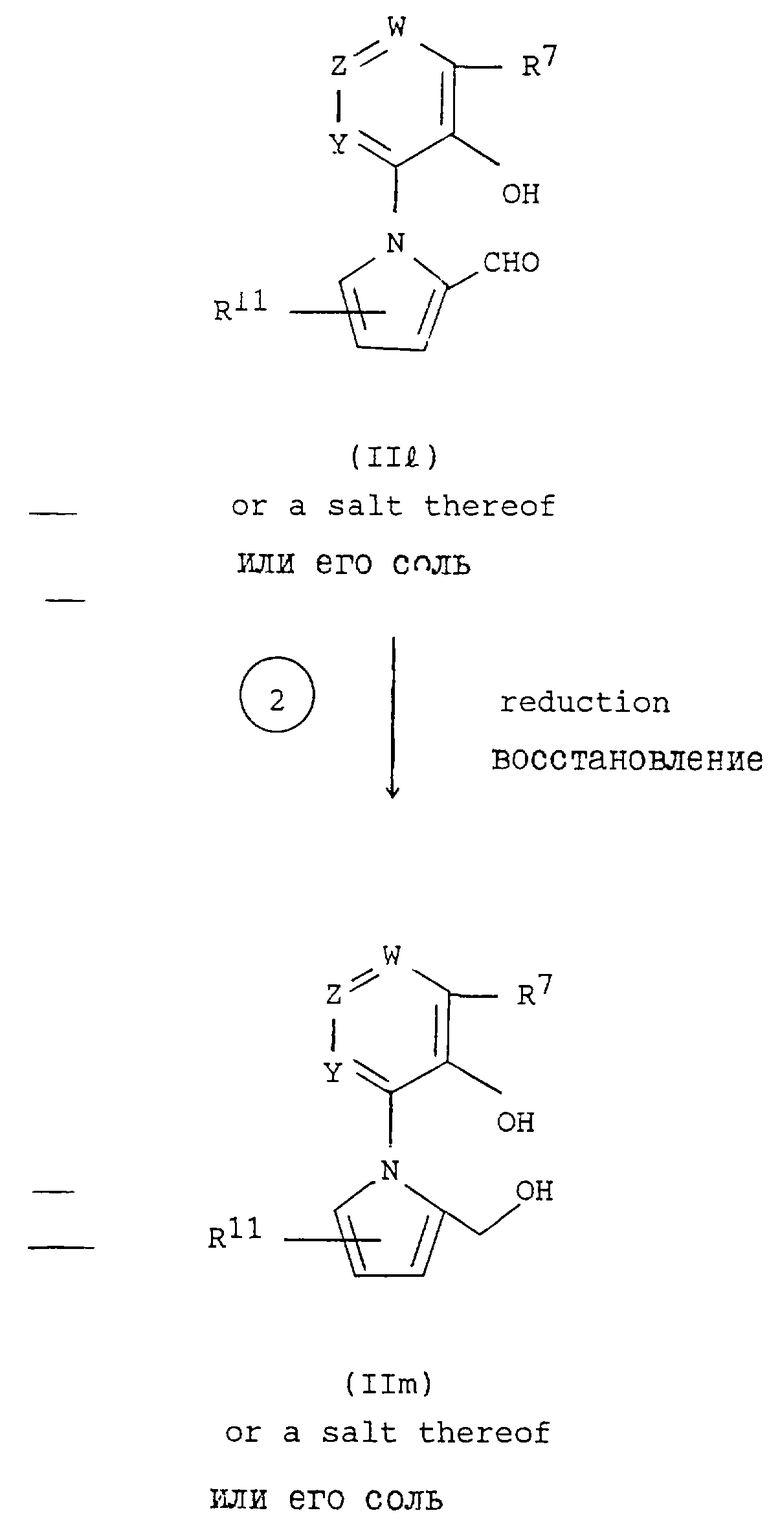



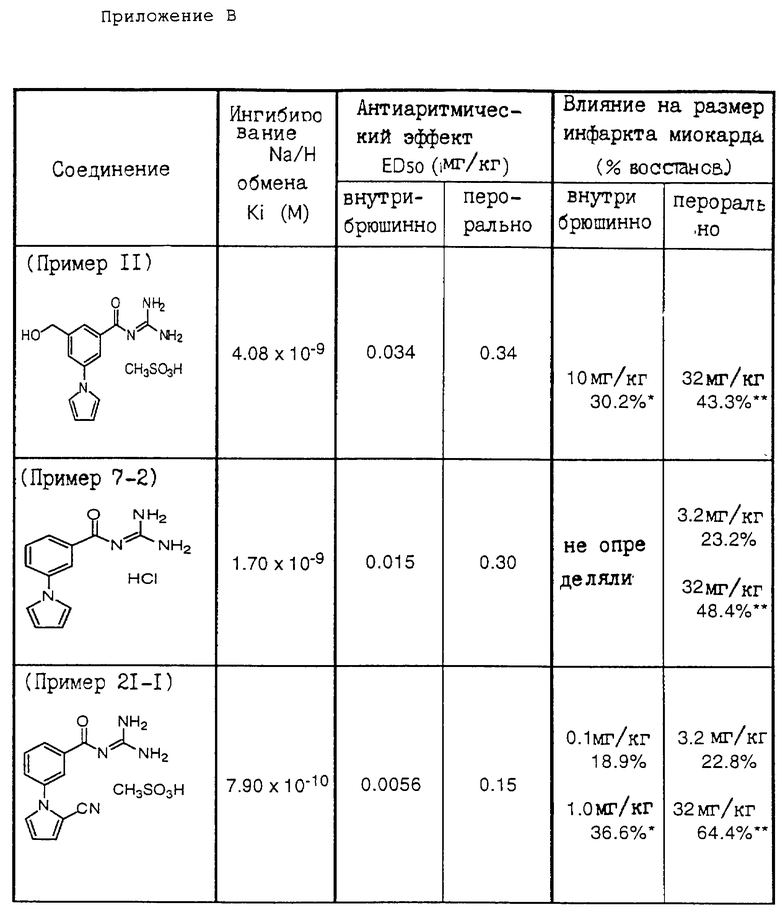
Описаны новые производные гуанидина формулы (I), где Y - группа N или С-R1, в которой R1 - водород, низший алкил, гидроксигруппа и т.д.; R2 - водород, арил, который может иметь один приемлемый заместитель, арилоксигруппа и т. д. ; R3 - вoдopoд, низшая алкоксигруппа, гидроксигруппа и т.д.; Z - группа N или C-R4, в которой R4 - водород, галоген, гидрокси(низший)алкил и т. д. ; W - группа N или C - R12, в которой R12 - водород, и их фармацевтически приемлемые соли, применимые в качестве лекарственных средств для лечения и/или профилактики инфаркта миокарда и ишемической аритмии у человека или животных. Кроме того, раскрыт способ получения указанных производных гуанидина и их солей. 3 с. и 12 з.п.ф-лы, 1 табл.
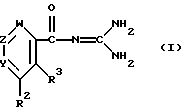
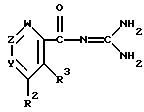
где Y - N или C - R1, в которой R1 - водород, (низший)алкил, гидрокси, (низшая)алкоксигруппа, гидрокси(низший)алкил, защищенный амино(низший)алкил, карбокси(низшая)алкоксигруппа, гидрокси(низшая)алкоксигруппа, фенил или 5- или 6-членная гетероциклическая группа, имеющая в качестве гетероатомов 1 или 2 атома азота;
R2 представляет водород, арил, который может иметь один заместитель, выбранный из группы, включающей галоген, нитро, циано, (низший)алкил, тригалоген(низший)алкил, защищенную аминогруппу; арилоксигруппу, тригалоген(низший)алкил, ацил 5- или 6-членную гетероциклическую группу с 1 - 4 гетероатомами, независимо выбранными из группы, включающей азот, серу и кислород, которая может иметь заместитель(ли), выбранный(ые) из группы, включающей карбоксигруппу, защищенную карбоксигруппу, ацил, (низший)алкил, галоген, гидроксиимино(низший)алкил, ди(низший)алкиламино(низший)алкил, цианогруппу, аминогруппу, защищенную аминогруппу, карбокси(низший)алкенил, защищенный карбокси(низший)алкенил, карбокси(низший)алкил или гетероциклил(низший)алкил;
R3 - водород, (низшая)алкоксигруппа, гидроксигруппа, 5-членная гетероциклическая группа с атомом азота в качестве гетероатома или
R2 и R3 соединены друг с другом с образованием 2-валентного радикала формулы
в которой R5 - водород или (низший)алкил, R6 - водород или (низший)алкил, R11 - водород или цианогруппа;
Z - N или C - R4, в которой R4 - водород, галоген, цианогруппа, гидрокси(низший)алкил, 5-членная гетероциклическая группа с 1 - 4 атомами азота в качестве гетероатомов, ацил;
W - N или C - R12, в которой R12 - водород,
или фармацевтически приемлемые соли этого соединения.
в которой R5 - водород или (низший)алкил; R6 - водород или (низший)алкил; R11 - водород или цианогруппа;
Z - N или C - R4, в которой R4 - водород, галоген, гидрокси(низший)алкил, цианогруппа, пирролил, тетразолил, карбамоил, который может иметь заместитель, выбранный из группы, включающей диамино(низший)алкилиден, ди(низший)алкиламино(низший)алкил и гетероцикл(низший)алкил; W - N или C - R12, в которой R12 - водород.
в которой R5 - водород или (низший)алкил; R6 - водород или (низший)алкил; R11 - водород или цианогруппа;
Z - N или C - R4, в которой R4 - водород, галоген, цианогруппа, гидрокси(низший)алкил, пирролил, тетразолил, диамино(низший)алкилиденкарбамоил, ди(низший)алкиламино(низший)алкилкарбамоил или морфолинил(низший)алкилкарбамоил.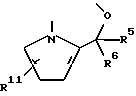
в которой R5 - водород или (низший)алкил; R6 - водород или (низший)алкил; R11 - водород или цианогруппа.
2-[3-(пиррол-1-ил)бензоил] гуанидин или его гидрохлорид или метансульфонат,
2-[3,5-ди-(пиррол-1-ил)бензоил]гуанидин,
2-[3-нитро-5-(пиррол-1-ил)бензоил]гуанидин,
2[3-(2-морфолиноэтилкарбамоил)-5-(пиррол-1-ил)бензоил] гуанидин или его дигидрохлорид,
2-[3-(3-морфолинопропилкарбамоил)-5-(пиррол-1-ил)бензоил] гуанидин или его дигидрохлорид,
2-[3-гидроксиметил-5-(пиррол-1-ил)бензоил] гуанидин или его гидрохлорид, метансульфонат или изотианат,
2-[3-(2-цианопиррол-1-ил)бензоил] гуанидин или его гидрохлорид, полусульфат, фумарат, малеат, полуцитрат, метансульфонат или изотионат,
2-[3-(2-цианопиррол-1-ил)-5-(диаминометиленаминокарбонил)бензоил] гуанидин или его метансульфонат,
2-[3-(Z)-2-гидроксииминометилпиррол-1-ил] бензоил/гуанидин или его гидрохлорид,
2-[3-(2-цианотиофен-3-ил)бензоил]гуанидин или его метансульфонат и
2-[3-(2-цианофуран-3-ил)бензоил]гуанидин или его метансульфонат,
2-[3-(2-диметиламиноэтил)карбамоил]-5-(пиррол-1-ил)бензоил/гуанидин.
в котором R5 - водород, R6 - водород и R11 - водород или цианогруппа,
Z - C - R4, где R4 - водород и W - C - R12, где R12 - водород.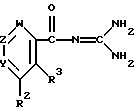
где Y - N или C - R1, где R1 - водород, (низший)алкил, гидроксигруппа, (низшая)алкоксигруппа, гидрокси(низший)алкил, защищенный амино(низший)алкил, карбокси(низшая)алкоксигруппа, гидрокси(низшая)алкоксигруппа, фенил, 5- или 6-членная гетероциклическая группа, имеющая в качестве гетероатомов 1 или 2 атома азота;
R2 представляет водород, арил, который может иметь один заместитель, выбранный из группы, включающей галоген, нитро, циано, (низший)алкил, тригалоген(низший)алкил и защищенную аминогруппу, арилоксигруппу, тригалоген(низший)алкил, ацил, 5- или 6-членную гетероциклическую группу с 1 - 4 гетероатомами, независимо выбранными из группы, включающей азот, серу и кислород, которая может иметь заместитель(и), выбранный(ые), из группы, включающей карбоксигруппу, защищенную карбоксигруппу, ацил, галоген, (низший)алкил, гидроксиимино(низший)алкил, ди(низший)алкиламино(низший)алкил, цианогруппу, аминогруппу, защищенную аминогруппу, карокси(низший)алкенил, защищенный карбокси(низший)алкенил, карбокси(низший)алкил или гетероцикл(низший)алкил.
R3 - водород, (низшая)алкоксигруппа, гидроксигруппа, 5-членная гетероциклическая группа с 1 атомом азота в качестве гетероатома или
R2 и R3 соединены друг с другом с образованием двухвалентного радикала формулы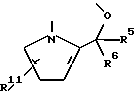
в которой R5 - водород или (низший)алкил, R6 - водород или (низший)алкил, R11 - водород или цианогруппа;
Z - N или C - R4, где R4 - водород, галоген, гидрокси(низший)алкил, цианогруппа, 5-членная гетероциклическая группа с 1 - 4 атомами азота в качестве гетероатомов или ацил;
W - N или C - R12, где R12 - водород,
или его соли, включающий реакцию соединения формулы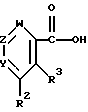
где R2, R3, Y, W и Z каждый принимает указанные значения,
или его реакционно-способного по карбоксигруппе производного, или его соли с соединением формулы
или его реакционно-способным по иминогруппе производным, или его солью.
Приоритет по пунктам и признакам:
17.05.93 по пп.1 - 5, 7, 9 и 13, где R2 - водород, арил, арилоксигруппа, 5- или 6-членная гетероциклическая группа с 1 - 4 гетероатомами, независимо выбранными из группы, включающей азот, серу и кислород, которая может иметь заместитель(ли), выбранный(ые) из группы, включающей карбоксигруппу, защищенную карбоксигруппу, ацил, (низший)алкил, галоген, гидроксиимино(низший)алкил, ди(низший)алкиламино(низший)алкил, цианогруппу, аминогруппу, защищенную аминогруппу, карбокси(низший)алкенил, защищенный карбокси(низший)алкенил, карбокси(низший)алкил; R3 - водород, (низшая)алкоксигруппа, 5-членная гетероциклическая группа с атомом азота в качестве гетероатома или R2 и R3 соединены друг с другом с образованием 2-валентного радикала формулы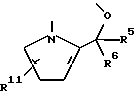
в которой R5 - (низший)алкил, R6 - (низший)алкил, R11 - водород;
Z - N или C - R4, в которой R4 - водород, галоген, 5-членная гетероциклическая группа с 1 - 4 атомами азота в качестве гетероатомов, ацил.
| СПОСОБ ПОЛУЧЕНИЯ 1-АМИДИН-3-(ЗАМЕЩЕННЫЙ ФЕНИЛ)-КАРБАМИДА | 0 |
|
SU271410A1 |
| US 4251545 A, 17.02.81 | |||
| Пасечный нож | 1988 |
|
SU1576097A1 |
| WO 9304048 A, 04.03.93 | |||
| Супорт фанерного лущильного станка | 1949 |
|
SU83779A1 |
| Машковский М.Д | |||
| Лекарственные средства | |||
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ПРИСПОСОБЛЕНИЕ ДЛЯ АВТОМАТИЧЕСКОЙ БОКОВОЙ СТАБИЛИЗАЦИИ | 1921 |
|
SU445A1 |
Авторы
Даты
1999-11-27—Публикация
1994-05-12—Подача