Область изобретения
Данное изобретение относится к области микробиологии и, в частности, к созданию питательной смеси и способу идентификации и дифференциального и раннего определения количества грамотрицательных микроорганизмов.
Несколько способов обнаружения и определения количества микроорганизмов-мишеней, например, E.coli и колиформных бактерий интенсивно используют для микробиологического контроля качества различных продуктов (воды, пищи и т.д.). Тем не менее продолжаются исследования для создания наиболее простых и эффективных способов.
Вообще, известно очень немного биохимических характеристик, которые можно было бы связать только с одним определенным видом грамотрицательных бактерий, поэтому оказывается необходимым применение различных наборов соответствующих тестов для установления точного диагноза.
Действительно, имеется большое разнообразие культуральных методов для выявления различных групп грамотрицательных бактерий; некоторые из них являются качественными, а другие количественными методами.
Агар с желчью и фиолетовым красным (Violet Red Bile Agar) объединяет в себе соли желчных кислот и кристаллы фиолетового красителя, которые ингибируют грамположительные бактерии (Soria Melquizo, F. Manual Difco. Décima edición. 1984; Manual MERCK de Medios de Cultivo. 1990; Manual de Medios de Cultivo OXOID. 1995). Упомянутая среда также содержит лактозу и рН-индикатор, нейтральный красный. Колиформные бактерии растут на среде и сбраживают лактозу. Нейтральный красный обеспечивает интенсивно красный цвет колонии и окружающей зоны среды. Требуются дополнительные подтверждающие тесты для безошибочной дифференциации E. coli и колиформных микроорганизмов, например, при культивировании в бульоне с бриллиантовым зеленым и лактозой или "штриховке" в агаре с эозином и метиленовым синим (Eosine Methylene Blue Agar) (Soria Melquizo, F. Manual Difco. Décima edición. 1984; Manual MERCK de Medios de Cultivo. 1990; Manual de Medios de Cultivo OXOID. 1995). Однако результаты тестирования оказываются известными не раньше, чем через 48 часов инкубации образца.
С другой стороны, для обнаружения сальмонелл имеется группа твердых культуральных сред, в которых используют, по крайней мере, два биохимических свойства названного рода бактерий, которые выявляются по присутствию или отсутствию колонии или окрасок культуральной среды. Из сред можно упомянуть: цитратный агар с дезоксихолатом натрия (Desoxycholate Citrate Agar), энтерический агар Гектоена (Hektoen Enteric Agar), S.S-агар (S.S.Agar), XLD агар (XLD Agar), агар Кристенсена (Christensen Agar) и агар с бриллиантовым зеленым (Brilliant Green Agar) (Soria Melquizo, F. Manual Difco. Décima edición. 1984; Manual MERCK de Medios de Cultivo. 1990; Manual de Medios de Cultivo OXOID. 1995).
Упомянутые среды обычно содержат ингибиторы грамположительных и некоторых грамотрицательных бактерий, например соли желчных кислот, цитрат натрия и бриллиантовый зеленый. Способ обнаружения сальмонелл основан на их способности ферментировать один или более углеводов и продуцировать сероводород в присутствии тиосульфата натрия и соли железа. На деле упомянутые культуральные среды не являются достаточно специфичными, так как некоторые виды (Proteus vulgaris, P. mirabilis, Citrobacter freundii) могут образовывать бесцветные колонии с черным центром, характерные для сальмонелл. Кроме того, штаммы сальмонелл не всегда продуцируют H2S, что обусловлено некоторыми факторами, такими как рН среды и концентрация кислорода вокруг колоний, что может оказывать влияние на эти биохимические реакции.
В 1993 г. Alain Rambach запатентовал среду для идентификации сальмонелл (патент США №5194374), которая включает применение хромогенного субстрата, образующего голубой цвет в результате гидролиза, осуществляемого ферментом β-галактозидазой, и расщепления пропиленгликоля. Основной биохимический тест, используемый в названной среде для обнаружения сальмонелл, заключается в ферментациии пропиленгликоля, что определяют визуально по изменению цвета индикатора рН - нейтрального красного.
Продукт делает возможной дифференциацию только колиформной бактерии и сальмонеллы "небрюшнотифозной" от Proteus и других грамотрицательных бактерий. Кроме того, на практике приблизительно 9% штаммов сальмонелл могут проявлять активность β-галактозидазы и около 30% из них не ферментируют пропиленгликоль (Kaluzewski y Tomczuk, Med. Dosw. Mikrobiol., 1995, 47: 155-168).
Roth и сотрудники получили решение на патент США №5393662, в котором предложены среда и способ идентификации и определения количества E. coli и колиформных микроорганизмов, с использованием субстратов с различными хромофорными группами. Предложенная среда не позволяет идентифицировать и определять количество E. coli О157:Н7, сальмонелл и других неколиформных энтеробактерий. Следует заметить, что Shigella sonnei является причиной ложных положительных результатов, так как она образует колонии с такими же цветными характеристиками, как E. coli.
В 1995 г. было получено положительное решение на патентную заявку Monget et al (патент США №4277561), представляющую способ для бактерилогического анализа и среду для выявления сальмонелл. Предложенный способ основан на специфической способности сальмонелл ферментировать глюкуроновую кислоту или одну из ее солей и не продуцировать β-галактозидазу. Упомянутая среда содержит питательные вещества, флуорогенный или хромогенный субстрат для β-галактозидазы, глюкуроновую кислоту или одну из ее солей и индикатор рН. Упомянутая культуральная среда также содержит ингибиторы для рода несальмонелл (бриллиантовый зеленый и дезоксихолат натрия), которые ограничивают возможность выявления других грамотрицательных микроорганизмов и делают невозможным их применение для точного определения микроорганизмов. Среда включает в себя глюкуронат натрия в виде добавки после стерилизации. По данным Denis и сотрудников специфичность упомянутой культуральной среды составляет 93,3%, тогда как специфичность других традиционных сред для обнаружения сальмонелл (энтерического агара Гектоена) составляет 85,3% (Denis, et to the, Revue francaise des laboratoires, Décembre 1994, No 271).
Rambach представил заявку на патент, касающуюся культуральной среды и способа обнаружения энтероагеморрагических штаммов E. coli (заявка на патент WO №97/39103). Изобретение включает избирательную культуральную среду для дифференциации E. coli, в частности, серотипов 0157 и/или 011. Среда содержит хромогенный субстрат для α-галактозидазы. Для повышения дифференцирующей способности способа были добавлены другие хромогенные субстаты, особенно для β-глюкозидазы, которая является характерным признаком большого количества колиформных бактерий, и для β-глюкуронидазы, которая является отличительным признаком E. coli, за исключением серогрупп 0157 и 011. Однако названная культуральная среда не позволяет дифференцировать другие грамотрицательные бактерии, и, с другой стороны, описано, что некоторые штаммы E. coli и Citrobacter могут быть причиной ложно-позитивных результатов (Wallace and Jones, J. Appl. Bacteriol., 1996, 81: 663-668).
В марте 1998 г. Roth и сотрудники получили положительное решение по патенту США №5726031. В патенте описаны среда для тестирования и количественный способ идентификации и дифференциации биологических веществ в тестируемом образце. Способ заключается в применении одного хромогенного субстрата, который является специфичным для первого биологического вещества и дает первую окраску; и другого хромогенного субстрата, который специфичен в отношении второго биологического вещества и вызывает появление второго цвета, а третье биологическое вещество способно расщеплять один из названных субстратов. Первое и второе биологические вещества способны расщеплять один сахар, а третье биологическое вещество не расщепляет этот сахар. Кроме того, в состав среды введен индикатор рН, который изменяет цвет среды около колоний, окрашиваемых хромогенными субстратами при расщеплении сахара.
Основными ингредиентами являются 6-хлор-3-индолилгалактозид, 5-бром-4-хлор-3-индолилглюкуронид, сорбит и феноловый красный. Другие соединения представляют собой соли желчных кислот, лаурилсульфат натрия, дезоксихолат натрия, полигликолевый эфир, антибиотики и производные акрифлавина.
В состав среды следует вводить индуктор энзиматических реакций: изопропил-β-D-тиогалактопиранозид.
В него включаются агары, пектины, карагенаны, альгинаты, ксантин, в качестве гелеобразующих агентов, и пептоны. Этот прототип можно рассматривать как наиболее близкий данному изобретению, но он проявляет ряд недостатков:
- Среда позволяет идентифицировать и точно подсчитывать E. coli, E. coli 0157:H7 и колиформные микроорганизмы, однако оказалось трудно осуществлять соответствующую идентификацию сальмонелл, а в отношении некоторых штаммов это даже невозможно, так как они могут образовывать белую окраску, как это происходит с другими грамотрицательными бактериями, такими как Proteus. В случае сосуществования различных видов трудно установить наличие желтой зоны вокруг колонии, которая является отличительным признаком сальмонелл, так как она образуется в результате закисления культуральной среды.
- Невозможно дифференцировать сальмонеллу брюшнотифозную от сальмонеллы небрюшнотифозной.
- Колиформные микроорганизмы невозможно дифференцировать в среде и необходимо применять другие дополнительные диагностические среды для дальнейшей идентификации очень важных возбудителей заболеваний, таких как Klebsiella.
- Среда не позволяет идентифицировать и определить количество неколиформных грамотрицательных бактерий, таких как Pseudomonas.
- Применяемый способ требует от 24 до 48 часов для проведения идентификации и определения количества заявленных микроорганизмов, что делает его таким же продолжительным, как традиционные способы с культивированием.
- Состав среды оказался более сложным, дорогостоящим и нестойким вследствие включения додецилсульфата натрия, акрифлавина и/или антибиотиков. Это происходит, главным образом, в результате присутствия антибиотиков, которые должны быть добавлены в виде дополнения, так как они являются термочувствительными и их нельзя добавлять к порошкообразному, обезвоженному препарату.
- Недостаточность способствующих росту ингредиентов, самих по себе, чтобы способствовать быстрому развитию (до 24 часов) реакций, которые предоставляют возможность идентифицировать микроорганизмы. В среде даже необходим индуктор β-галактозидазы в виде IPTG.
- Способ предусматривает реакции, которые протекают только до 40°С, а не при 44°С, установленных в традиционных способах. Этот факт требует установления нового параметра в обычном оборудовании или способах.
- В обычных способах микробиологического анализа не предусмотрена инкубационная температура 40°С, поэтому требуются широкая оценка и одобрение данного способа как официального способа.
Описание изобретения
Цель данного изобретения заключается в обеспечении питательной смесью и способом идентификации и раннего точного подсчета грамотрицательных микроорганизмов.
Нововведение данного изобретения заключается в: обеспечении, впервые, питательной смесью для идентификации и раннего определения количества грамотрицательных микроорганизмов и способом, в котором используется названная смесь, основанном на появлении в колониях, по крайней мере, пяти различных окрасок в видимом свете и трех флуоресцентных цветных излучений; ореолов трех различных цветов и зон преципитации вокруг таких колоний и/или комбинаций всех перечисленных элементов и изменений в окраске культуральной среды.
Новые элементы обеспечивают достаточное количество триптофана. Эта незаменимая аминокислота принимает участие в значительном количестве метаболических реакций, являющихся основой идентификационных способов. Используемые количества вводят, учитывая их соотношение с органическими и неорганическими солями и с веществами, обеспечивающими окрашивание и/или флуоресценцию. Назначением такой смеси является обеспечение раннего проявления однозначных реакций. Новые и неожиданные элементы оказались очевидными, когда было показано, что определенные мишени-микроорганизмы проявляют неописанные окрашивания, или демонстрируют флуоресцентные излучения ранее не описанных цветов, или образуют вокруг колонии темные зоны окрашивания (ореол), не описанные ранее, например Enterobacter (серовато-зеленый центр колонии и желтоватая флуоресценция), Citrobacter freundii (темно-фиолетовая колония с голубым ореолом), сальмонелла "небрюшнотифозная" (центр и желтая флуоресценция через 24 часа), сальмонелла брюшнотифозная (окружающая колонию зона с непрозрачным преципитатом).
Экспериментальным путем установлено соотношение между компонентами смеси и выбраны элементы, с помощью которых создана новая смесь. Такое соотношение соединений никогда еще не было описано.
Данное изобретение характеризуется следующими преимуществами:
- Вся идентификация и дифференциация мишеней-микроорганизмов происходит только в присутствии полученной смеси и нет никакой необходимости в дополнительных тестах или культуральных средах.
- Композиция делает возможным рост грамотрицательных бактерий, так как она не содержит ингибиторов этой группы, а также позволяет идентифицировать большую часть клинически и/или санитарно важных видов, таких как E. coli, Salmonella, Pseudomonas, Klebsiella, а также точно определить количество Е. coli и колиформных микроорганизмов.
- Смесь обеспечивает надежность идентификации различных микроорганизмов, так как идентификацию проводят комбинируя несколько реакций, которые происходят одновременно. Упомянутые реакции основаны на метаболической специфичности тестируемых микроорганизмов и происходят вследствие соответствующих количественных соотношений соединений смеси. Некоторые из этих реакций описаны впервые и могут рассматриваться как новые результаты, такие как в случае Enterobacter (E. aerogenes, E. agglomerans, E. cloacae), которые проявляются в виде окрашенной от розового до красного цвета колонии с серовато-зеленым центром колонии, сальмонелла "небрюшнотифозная", которая проявляется в виде красной или красной с желтоватым центром колонии. Оба вида излучают желтоватую флуоресценцию (после 24 часов инкубации). Приведенные характеристики делают возможной недвусмысленную идентификацию микроорганизмов.
- Композиция делает возможными идентификацию и раннее определение количества большого разнообразия грамотрицательных микроорганизмов. Она делает возможной идентификацию E. coli и дифференциацию сальмонеллы брюшнотифозной от "небрюшнотифозной" и колиформных микроорганизмов и других санитарно-показательных неколиформных грамотрицательных бактерий, таких как Pseudomonas. Все из перечисленных микроорганизмов можно дифференцировать одним и тем же способом в той же чашке и максимально в течение 22 часов.
- Идентификацию выполняют, главным образом, комбинированной визуализацией появления пяти различных окрасок колоний, трех различных флуоресцентных окрасок, ореолов из трех различных окрасок вокруг колоний и непрозрачной зоны преципитации, окружающей колонии. Изменения цвета среды могут иметь вторичное значение или даже вообще не играть никакой роли в идентификации определенных видов, таких как Shigella sonnei, E. coli 0157:H7, Pseudomonas aeruginosa. Данный факт снижает риск ошибочной идентификации различных микроорганизмов в образцах, зараженных различными микробами.
- Композицию получают очень просто; она не требует автоклавирования, никакого добавления дополнений, которые увеличивают риск заражения образца.
- Вследствие отказа от стерилизации в автоклаве питательные вещества и ростовые факторы лучше сохраняются, а значение рН композиции поддерживается более стабильно.
- Питательные вещества и ростовые факторы, введенные в смесь, главным образом, обогащенные триптофаном, имеют то соотношение их абсолютных количеств в композиции, которое гарантирует осуществление ранних биохимических реакций, в большинстве случаев раньше 22 часов.
- Природа твердых ингредиентов, соответствующих слоям смеси, делает возможным концентрирование флуоресцентных излучений в зоне, окружающей колонию, и не позволяет диффундировать по основанию чашки. Смесь делает возможным достоверное определение количества флуоресцирующих микроорганизмов, так как флуоресценция не рассеивается по поверхности среды.
- Выбор ингибиторов роста грамположительных микроорганизмов, их абсолютных количеств и соотношения с другими компонентами делают возможным соответствующий рост мишеней-микроорганизмов, в то время как достигается полное ингибирование (отсутствие роста) грамположительных микроорганизмов.
- Большое разнообразие веществ, предшественников или субстратов для энзиматических реакций позволяет осуществляться другим реакциям, а также делает возможной дальнейшую идентификацию других грамотрицательных микроорганизмов, если в композицию в часть чашки добавляют третий слой с индикаторами или проявителями реакций.
- Диагностическая специфичность смеси составляет 100% для тестируемых микроорганизмов, а аналитическая чувствительность достигает 10-6 КОЕ/мл, начиная от стандартизированной суспензии до 50% прозрачности.
- Баланс между питательными веществами и ингибиторами делает возможными раннюю идентификацию и избыточный рост мишеней-микроорганизмов, даже тех, которые обычно вырастают через 24 часа, как сальмонелла.
- Результаты могут быть легко проанализированы неспециализированным персоналом, так как идентификация или дифференциация не включают анализ морфологических характеристик микроорганизмов.
Подробное описание изобретения
В данном изобретении предусматривают питательную смесь для идентификации и раннего определения количества грамотрицательных микроорганизмов, которая содержит следующие необходимые компоненты:
- смесь богатых триптофаном белковых фракций или свободного триптофана, количество которой составляет от 22 до 46% от всей смеси (масса/масса);
- смесь выбранных органических и/или неорганических солей в количестве от 15 до 20% всей смеси (масса/масса);
- смесь веществ, обеспечивающих цвет или флуоресценцию, в количестве от 0,3 до 37% всей смеси (масса/масса);
- ингибиторы грамположительных микроорганизмов в количестве от 2 до 4,5% от всей смеси (масса/масса); и
- смесь веществ, обеспечивающих твердую структуру среды, в количестве от 20 до 50%.
Пропорцию каждого компонента смеси изменяют в пределах установленного диапазона в зависимости от питательной среды, которую требуется получить.
В питательной смеси изобретения содержание аминокислоты триптофана в смеси обогащенных белковых фракций составляет от 0,25 до 3,8% названной смеси.
Смесь данного изобретения также содержит смесь органических и/или неорганических солей, которые выбраны из группы, состоящей из NaCl, K2HPO4, KH2PO4, (NH4)2SO4, Na2CO3 и пирувата натрия и их смесей, при этом предпочтительно выбраны NaCl и Na2CO3.
В названной смеси органических и неорганических солей предусмотрены следующие количества (масса/масса) относительно всей смеси:
- NaCl от 7 до 18%;
- К2HPO4 от 6 до 11%;
- КН2PO4 от 2 до 5%;
- (NH4)2SO4 от 1 до 4%;
- Na2CO3 от 0,1 до 0,4%; и
- пирувата натрия от 0,7 до 3%.
Другой компонент питательной смеси изобретения - смесь веществ, которые обеспечивают появление цвета и флуоресценции, которые выбирают из группы, состоящей из X-GAL, MUG, сорбита и нейтрального красного, при этом предпочтительно выбраны X-GAL и MUG. Названные вещества содержатся в смеси в следующих количествах (масса/масса) относительно всей смеси:
- X-GAL от 0,1 до 0,36%;
- MUG от 0,1 до 0,2%;
- сорбит от 15 до 36,5%; и
- нейтральный красный от 0,06 до 0,11%.
С другой стороны, смесь также содержит ингибиторы грамположительных микроорганизмов, из которых могут быть использованы дезоксихолат натрия и соли желчных кислот.
Наконец, питательная смесь изобретения содержит смесь веществ, обеспечивающих твердую структуру культуральной среды, при выращивании тестируемых микроорганизмов, которая может содержать следующие комбинации и количества (масса/масса) относительно общей смеси:
- агарозу и агаропектин в количестве от 19 до 48%, в комбинации с нитратом целлюлозы в количестве от 0,1 до 0,4%; или
- целлюлозу и гемицеллюлозу в количествах от 1,4 до 3%, в комбинации с нитратом целлюлозы в количестве от 0,1 до 0,4%; или
- только агарозу и агаропектин в количестве от 19 до 48%.
Свежеприготовленная питательная смесь по изобретению имеет рН от 6,6 до 7,2.
Другой аспект изобретения заключается в обеспечении способом для идентификации и раннего определения количества грамотрицательных микроорганизмов, по которому, после затвердевания и контакта питательной смеси с микроорганизмами или образцами, содержащими их, смесь инкубируют в течение периода от 12 до 22 часов при температуре от 30 до 45°С, после чего возможно проведение визуальной идентификации названных микроорганизмов, тогда как обнаружение флуоресценции проводят в ультрафиолете от 360 до 366 нм.
Способ изобретения предоставляет возможность идентификации микроорганизмов по появлению пяти различных окрасок колоний, флуоресцентных излучений трех цветов, ореолов трех цветов, изменений окраски в среде и по появлению зон преципитации, окружающих колонии, а также с помощью комбинаций этих характеристик.
Используя способ изобретения, идентификацию тестируемых микроорганизмов осуществляют следующим образом:
Shigella sonnei - по появлению зеленовато-голубых колоний с голубой флуоресценцией и оранжевой средой;
Shigella flexneri - по появлению бледно-розовых колоний, желтоватого ореола и оранжевого цвета среды;
Enterobacter (E. aerogenes, E. cloacae, E. agglomerans) - по появлению розового до красного цвета колоний с серовато-зеленым центром, желтой флуоресценции и красной среды;
Escherichia coli, исключая веротоксикогенные штаммы - по появлению светло-фиолетовых колоний, голубой флуоресценции и красной среды;
Escherichia coli 0157:Н7 - по появлению зеленовато-голубых колоний и оранжевой среды;
Citrobacter freundii - по появлению темно-фиолетовых колоний с голубым ореолом и красной среды;
Klebsiella pneumoniae - по появлению светло-фиолетовых колоний и красной среды;
Salmonella typhi - по появлению красных колоний и красной среды с зоной непрозрачного преципитата;
Salmonella "no typhi" - по появлению красных колоний и красной среды; после 24 часа инкубации цвет центра становится желтым и проявляется желтая флуоресценция;
Pseudomonas aeruginosa - по появлению бледно-розовых колоний, зеленоватой флуоресценции до 24 часов инкубации и оранжевой среды; после 24 часов инкубации - зеленовато-коричневых колоний и зеленоватой окружающей зоны, зеленоватой флуоресценции;
Proteus, Providencia, Alcaligenes и другие грамотрицательные микроорганизмы - по появлению бесцветных или прозрачных колоний и оранжевой среды.
В особом аспекте способа изобретения, при использовании Х-gal и MUG в качестве единственных компонентов смеси, которые обеспечивают цвет или флуоресценцию, идентификацию всех колиформных бактерий производили по зеленовато-голубой окраске колоний, а также, в частности, для Е. coli по ее голубой флуоресценции.
Чтобы подготовить питательную смесь, осуществляют следующие процедуры.
Вещества, которые представляют собой богатые триптофаном белковые фракции и/или свободный триптофан, в количестве от 22 до 46%, взвешивают в конической колбе, учитывая, что смесь должна содержать от 0,25 до 3,8% упомянутой аминокислоты, относительно ее сухой массы. Эта колба должна иметь двойной номинальный объем питательной смеси, которую получают.
Затем группу органических и неорганических солей взвешивают и добавляют к предшествующей смеси в количестве между 15 и 20% относительно сухой массы питательной смеси. Эту группу органических и неорганических солей выбирают в следующих количествах относительно массы обезвоженной питательной смеси: NaCl от 7 до 18%, К2HPO4 от 6 до 11%, КН2PO4 от 2 до 5%, (NH4)2SO4 от 1 до 4%, Na2CO3 от 0,1 до 0,4% и пирувата натрия от 0,7 до 3%.
Затем взвешивают ингибиторы грамположительных микроорганизмов и добавляют в количестве от 2 до 4,5%, из ингибиторов можно использовать дезоксихолат натрия и соли желчных кислот.
Отдельно, на аналитических весах взвешивают предварительно приготовленную смесь веществ, которые обеспечивают появление цвета или флуоресценции, в количестве от 0,3 до 37%.
Предварительно приготовленная смесь должна содержать сорбит в количестве от 15 до 36,5%, MUG - от 0,1 до 0,2%, X-GAL - от 0,1 до 0,36% и нейтральный красный - от 0,06 до 0,11% относительно сухой массы питательной смеси.
Все вышеупомянутые компоненты тщательно смешивают с дистиллированной или деионизованной водой, чтобы получить однородный раствор при концентрации растворенных веществ от 3,5 до 6,5% и с диапазоном рН 6,6-7,2.
Наконец, полученный раствор добавляют к смеси агарозы и агаропектина и/или разливают на структуры, образованные различными видами смесей целлюлозы и гемицеллюлозы.
Если первую смесь агарозы и агаропектина добавляют к полученному раствору, образованную суспензию перемешивают и оставляют для набухания, по крайней мере, в течение 15 минут. Затем смесь нагревают до кипения, охлаждают приблизительно до 45°С и распределяют в конечные опытные контейнеры. Смесь в контейнерах следует оставлять для затвердевания при комнатной температуре в течение 20-30 минут. Если происходит аккумулирование влаги, контейнеры следует высушить в асептических условиях перед осуществлением заражения.
Если используют смесь целлюлозы и гемицеллюлозы, во-первых, смесь следует стерилизовать (влажным паром при 121°С в течение 15 минут или окисью этилена или облучением). Позднее смесь помещают в конечные опытные контейнеры и добавляют объемы от 2 до 4 мл предварительно полученного раствора (на каждый контейнер).
В обоих случаях другие слои, образованные нитроцеллюлозой или/и другими производными целлюлозы, такими как ацетатцеллюлоза, могут быть присоединены как во время, так и после инокуляции, чтобы обеспечить твердую поверхность для образования колоний мишеней-микроорганизмов или выявления специфической реакции.
Тестируемые образцы можно инокулировать посредством различной штриховой разводки или способов разведения посевного материала и инкубировать при 33 до 45°С, по крайней мере, в течение 6 часов для обнаружения Е. coli, предпочтительно между 12 и 22 часами и между 18 и 22 часами для дифференциации других грамотрицательных микроорганизмов.
Для оценки результатов исследуют окраску изолированной колонии и среды, наличие непрозрачного преципитата или окрашенной зоны вокруг колоний (ореол), наличие и цвет флуоресцентных излучений и, возможно, также изучением морфологии колоний.
В изолированных колониях различных грамотрицательных бактерий изучали следующие параметры, представленные в таблице 1.
Различные штаммы грамотрицательных бактерий образуют колонии, которые могут достигать 5 мм в диаметре в соответствии со временем инкубации.
ПРИМЕРЫ
Пример №1
Состав питательной смеси для дифференциации грамотрицательных бактериальных штаммов был следующим (таблица 2).
48 г этой смеси суспендировали в 1 л деионизованной или дистиллированной воды.
Исследование проводили, контролируя поведение различных штаммов энтеробактерий, учитывая установленные биохимические тесты.
Получены следующие результаты (таблица 3).
После инкубации в течение 24 часов при 35±2°С тонкий слой целлюлозы, пропитанный реагентом Ковача (Kovacs), помещали на крышки контейнеров. В контейнерах, в которые были инокулированы индол-продуцирующие микроорганизмы (E. coli, P. vulgaris и Aeromonas hydrophila), цвет целлюлозного слоя становился розовым с интервалом 30 минут.
Пример № 2
Питательную смесь получали в соответствии с составом, описанным в примере 1, но содержание компонентов группы белковых фракций, богатых триптофаном, было следующим (таблица 4).
Инокуляцию различных микроорганизмов из коллекции АТСС производили по способу "штриховки" поверхности, чтобы получить изолированные колонии.
Оценку результатов проводили за 6, 11, 19 и 24 часа инкубации и получены следующие результаты (таблицы 5, 6, 7 и 8, соответственно):
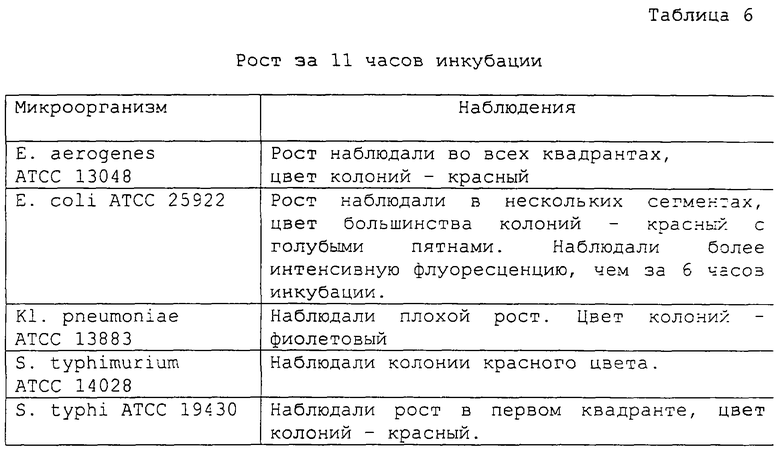
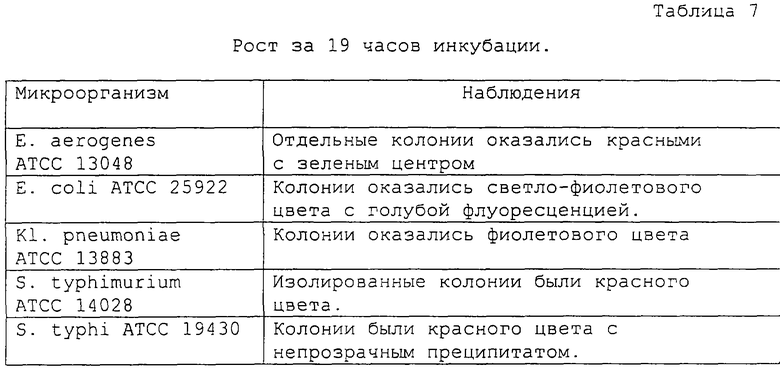
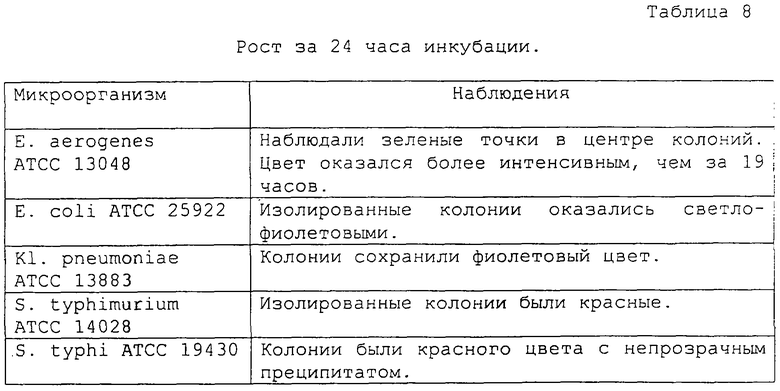
Обращает на себя внимание тот факт, что в среде образовались непрозрачные преципитаты вокруг колоний S. typhi, которые представляют собой дополнительную характеристику для дифференциации данного вида от других штаммов сальмонелл.
Впоследствии тот же самый препарат питательной смеси (далее идентифицируемый как экспериментальный - эксп.) инокулировали разведениями 10-6 суспензий выбранных тестируемых микроорганизмов (стандартизированных до 50% прозрачности).
Микроорганизмы исследовали одновременно в бульоне ЕС с MUG, добавляя агар (13 г/л) и X-GAL (0,1 г/л), и смесь была названа как референсная смесь (С).
Анализ результатов роста осуществляли через 6, 12, 19, 24 и 40 часов инкубации (таблицы 9, 10 и 11). Результаты представлены следующим образом.
С: контроль
С: контроль
Неожиданно, в отличие от других колиформных микроорганизмов, E. aerogenes и E. cloacae, демонстрировали отличающуюся окраску в центре и по краям колоний.
Рост за 24 часа инкубации
Число колоний не изменялось, а голубой цвет в центре колонии стал более интенсивным.
Рост за 40 часов инкубации
Красный цвет исчезал, а голубой цвет преобладал в колониях колиформных бактерий, а красные колонии сальмонел становились желтыми.
Пример №3
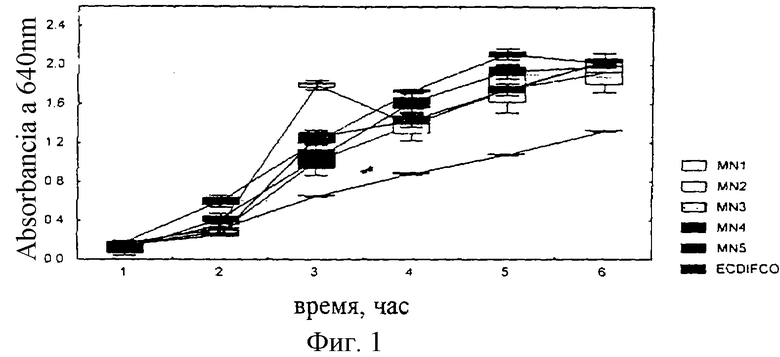
Исследовали влияния различных активаторов роста колиформных микроорганизмов, ингибиторов и различных комбинаций белковых фракций, обогащенных триптофаном, посредством анализа кривых роста двух штаммов:
Escherichia coli ATCC 10536
Streptococcus faecalis ATCC 29212
Одновременно инокулировали бульон ЕС с MUG (Difco).
Экспериментальные композиции (MN), составленные из различных экспериментальных факторов, представлены в таблице 12.
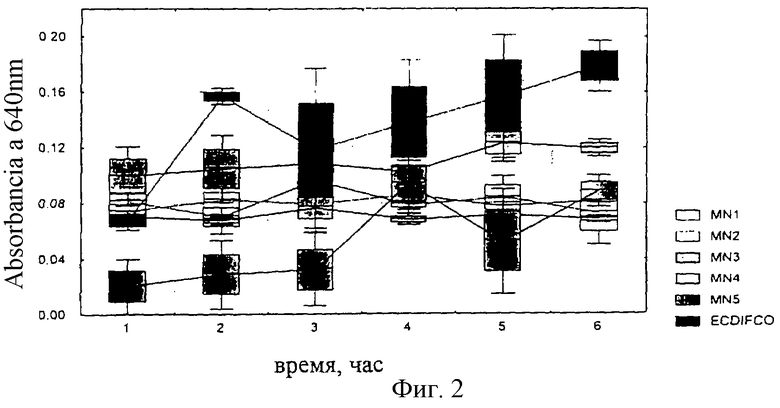
Полученные результаты представлены на фиг.1 и 2 приложений.
Как показано на фиг.1, на питательной смеси MN3 скорость роста E. coli оказалась ниже, чем на референсных смесях, тогда как вариант MN2 лучше стимулировал рост в течение 3 часов инкубации. Через 6 часов практически не наблюдалось никаких различий в стимуляции роста между вариантами, за исключением смеси MN3.
На фиг.2 показано, что во всех композициях, предлагаемых данным изобретением, штамм Streptococcus faecalis ингибировался в большей степени, чем в референсной диагностической среде.
Пример №4
В данном исследовании использовали композицию, представленную в таблице 13.
В данном исследовании для инокуляции использовали способ рассеивания посева.
Все контейнеры инкубировали при 35°С в течение 24 часов.
Инокулировали разведенные 10-6 суспензии колиформных микроорганизмов, Escherichia coli ATCC 25922 и Enterobacter aerogenes ATCC 13048 и суспензию Streptococcus faecalis ATCC 29212 в разведении 10-1.
Бульон ЕС с MUG (Difco) с добавлением агара (13,0 г/л) использовали как референсную среду и назвали "контроль" (С).
Были получены следующие результаты (таблица 14).
С: контрольная композиция
Не выявлено никакого значимого различия (р<0,05) в количестве КОЕ Escherichia coli ATCC 25922 между экспериментальным вариантом смеси и бульоном ЕС с MUG (Difco), хотя размер колоний на экспериментальной питательной смеси оказался немного больше. Количество колоний Enterobacter aerogenes ATCC 13048 выше в экспериментальном варианте; однако нет никаких значимых различий среди них (р≅0,06).
Неожиданно E. aerogenes давал различное окрашивание в центре и по краям колонии и его можно было идентифицировать по желтой флуоресценции.
С другой стороны, Streptococcus faecalis ATCC 29212 ингибировался полностью во всех исследованных вариантах (микроорганизм инкубировали вплоть до 72 часов).
Впоследствии 10 мл пробу питьевой воды из накопительного резервуара инокулировали в те же варианты питательных смесей (таблица 15).
С: контрольная композиция
Проводили подсчет только колоний со свойствами предполагаемого колиформного микроорганизма. С помощью проведенных биохимических тестов (представлено далее) подтверждено, что выделенные колонии относятся к Enterobacter.
Имеется значимое различие (p<0,05) в количествах колоний между экспериментальным вариантом питательной смеси и референсной средой (Difco) с добавлением агара (13 г/л) и X-Gal (1,0 г/л) в пользу первого.
Пример №5
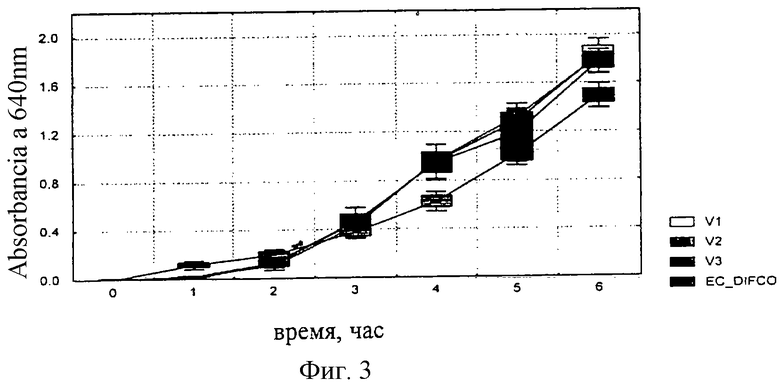
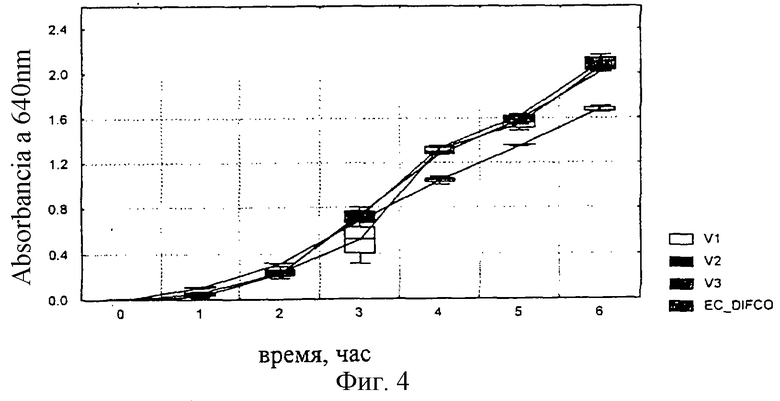
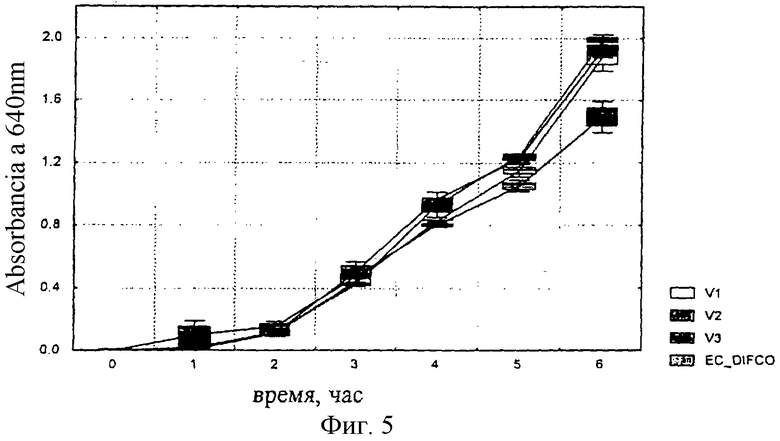
Получали такую же питательную смесь, как в примере №4, но общее количество богатых триптофаном белковых фракций соответствовало: 40,4; 37,7 и 34,8% сухой массы (V1, V2 и V3, соответственно).
Исследовали три варианта в присутствии смеси агарозы и агаропектина и без нее. В первые три варианта инокулировали 10-6-разведения Escherichia coli ATCC 25922 и Salmonella typhimurium ATCC 14028 посредством способа распределения в чашке.
В проведенном исследовании получены следующие результаты (таблица 16).
Количество колоний Escherichia coli ATCC 25922, Enterobacter aerogenes ATCC 13048 и Salmonella typhimurium ATCC 14028, полученных на всех из вариантов, было одинаковым (р>0,05).
Одновременно использовали другие три варианта без смеси агарозы и агаропектина для анализа кривых роста грамотрицательных (позитивный контроль) и грамположительных (отрицательный контроль) микроорганизмов. Бульон ЕС с MUG от Difco использовали как референсную среду.
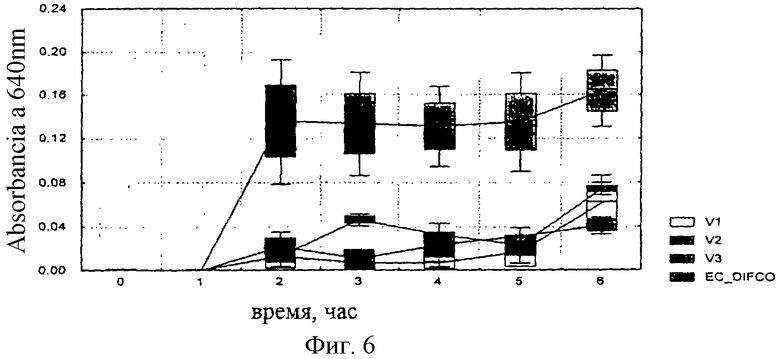
Неожиданно было отмечено, что к 6 часам инкубации скорость роста (оптическая плотность) штаммов Escherichia coli ATCC 25922, Enterobacter aerogenes ATCC 13048 и Salmonella typhimurium АТСС 14028 во всех трех экспериментальных вариантах оказалась значительно выше (р <0,05), чем в стандартной среде. В то же время ингибирование штамма Streptococcus faecalis ATCC 29212 (отрицательный контроль) было значительно выше в тех же вариантах, соответствующих данному изобретению (фиг.3-6).
Пример №6
Получали питательную смесь, такую как вариант V2 примера №5, с двойными прямолинейными концентрациями нейтрального красного и MUG. Смесь агарозы и агаропектина заменяли смесью целлюлозы и гемицеллюлозы, чтобы обеспечить твердую структуру для образования колоний мишеней-микроорганизмов (экспер.). Все вышеупомянутые ингредиенты формировали первый слой питательной среды.
С помощью способа мембранной фильтрации инокулировали 1 мл 10-6-разведенной суспензии микроорганизмов; представителей нескольких видов энтеробактерий, 10-5-разведенная суспензия Klebsiella pneumoniae ATCC 13883 и 10-1-разведенная суспензия Staphylococcus aureus ATCC 25923 (отрицательный контроль). Для фильтрования использовали нитратцеллюлозную подложку, которую размещали как другой слой питательной смеси.
Одновременно инокулировали агар с желчью и фиолетовым красным способом распределения в чашке (С).
Результаты исследования через 18 часов инкубации представлены в таблице 17.
С: контрольная композиция
Количество колоний Escherichia coli, Salmonella typhimurium, Klebsiella pneumoniae, Citrobacter freundii, Shigella sonnei и Enterobacter aerogenes на экспериментальной питательной смеси и агаре с желчью и фиолетовым красным значительно не отличалось (р<0,05). В то же время количество колоний Escherichia coli 0157:Н7 и Shigella flexneri в питательной смеси было значительно выше. Суспензия Staphylococcus aureus с низким разведением (10-1) была полностью ингибирована (инкубация вплоть до 48 часов).
Проводили сравнительное исследование восстановления различных грамотрицательных бактерий в той же композиции питательной среды и в среде m-Эндо (Difco). Обе среды инокулировали по способу мембранной фильтрации, получены следующие результаты (таблица 18).
Дифференциация различных представителей колиформной группы оказалась очевидной на питательной смеси. Однако в среде m-Эндо колонии Enterobacter aerogenes легко могут быть ошибочно приняты за некоторые колонии E. coli, которые обладают легким металлическим блеском.
Неожиданно образование голубого ореола (зоны, окружающей колонию) обнаружено вокруг колоний Citrobacter freundii в описанной композиции питательной среды.
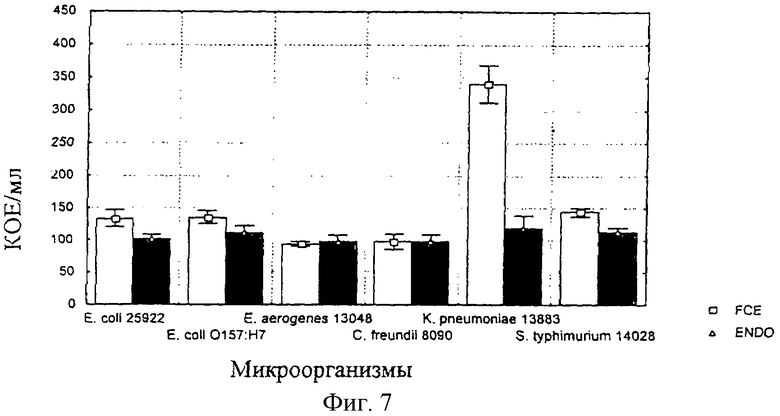
В экспериментальной смеси количество колоний E. coli ATCC 25922, K. pneumoniae ATCC 13883 и S. typhimurium ATCC 14028 оказалось значительно выше (р<0,05), тогда как количество колоний других микроорганизмов на обоих смесях было одинаковым. Полученные результаты представлены на фиг.7 приложений.
Пример №7
Одновременно инокулировали сразу питательную смесь с тем же составом варианта V2 примера №5 и агар S.S.
Цель данного исследования заключалась в сравнении специфичности питательной смеси, предмета изучения данного изобретения, и агара S.S относительно обнаружения сальмонеллы в полимикробной смеси.
Посевной материал получали следующим образом.
Первичные суспензии Salmonella typhimurium ATCC 14028, Citrobacter freundii ATCC 8090, Serratia marcescens ATCC 8100, Enterobacter cloacae ATCC 23355 и Pseudomonas aeruginosa ATCC 27835 получали из одной свежевырасщенной колонии в 10 мл стерильного физиологического раствора.
Из каждой суспензии готовили десятичные разведения (вплоть до 10-4). Затем из каждого разведения 10-4 по 1 мл добавляли в пробирку с 9 мл стерильного физиологического раствора и тщательно перемешивали на вихревой мешалке.
Обогащение проводили в 10 мл селенитовой среды, инокулированной 1 мл полученной смеси, которую инкубировали в течение 24 часов при 43°С.
Образцы, взятые калиброванной петлей из культуры селенитовой среды, засевали на чашки Петри с питательной смесью, согласно изобретению, и с агаром S.S. Все чашки инкубировали при 43°С.
Результаты роста оценивали после инкубации в течение 24 часов.
Три типа колоний были обнаружены на чашках с питательной средой:
1. Голубые колонии с голубым ореолом (Citrobacter freundii, предположительно)
2. Красные колонии с желтоватым центром (Salmonella, предположительно)
3. Бесцветные колонии с розовым центром и зеленоватой флуоресценцией (по-видимому, Pseudomonas aeruginosa).
В агаре S.S наблюдали четыре типа колоний:
1. Большие белые колонии с черным центром (Salmonella или Citrobacter)
2. Средние бесцветные колонии с белым центром (Salmonella или Citrobacter)
3. Большие розовые колонии (колиформные бактерии)
4. Небольшие розовые колонии (колиформные бактерии).
Биохимические тесты дали следующие результаты (таблица 19).
Результаты предполагаемой идентификации на питательной смеси, объекта изучения данного изобретения, были подтверждены серологическими тестами с сальмонелльной поливалентной антисывороткой. На агаре S.S подтвердили как сальмонеллу только бесцветные колонии (в них происходило декарбоксилирование лизина).
Пример №8
Питательную смесь получали в соответствии с составом, описанным в таблице 20.
Функциональность питательной смеси оценивали по обнаружению E. coli и колиформных бактерий в образцах мочи (где инфицирование посредством E. coli и колиформных бактерий составляет приблизительно 90% при мочевом сепсисе). Позднее подтверждение присутствия патогенных микроорганизмов, которые появляются при мочевом сепсисе, осуществляя с помощью биохимических тестов.
В таблице 21 суммированы величины распространенности всех идентифицированных патогенных микроорганизмов.
Диагностическую чувствительность и специфичность определяли на экспериментальной смеси. В процессе оценки после идентификации не было обнаружено никаких ошибочных отрицательных данных, и этот факт дает возможность утверждать, что диагностическая специфичность составляла 100%. В одном штамме Klebsiella обнаружили флуоресценцию, рассматривая ее как ошибочный позитивный результат. Вследствие отмеченного факта диагностическая чувствительность составила 98,04%.
Краткое описание чертежей:
Фиг.1: результаты роста E. coli ATCC 10536. Обнаружено, что только на питательной смеси MN3 скорость роста E. coli была ниже, чем на референсной среде, в то время как вариант MN2 лучше стимулировал рост за 3 часа инкубации. К 6 часам практически не имелось никаких различий в стимуляции роста между вариантами, исключая смесь MN3.
Фиг.2: Рост Streptococcus faecalis ATCC. Обнаружено, что, по сравнению с референсной диагностической средой, на всех предлагаемых изобретением смесях Streptococcus faecalis был ингибирован.
Фиг.3: Рост Escherichia coli ATCC 25922 в композициях V1, V2 и V3 и на референсной среде.
Фиг.4: Рост Enterobacter aerogenes ATCC 13048 на смесях V1, V2 и V3 и на референсной среде.
Фиг.5: Рост Salmonella typhimurium ATCC 14028 на смесях V1, V2 и V3 и на референсной среде.
Фиг.6: Рост Streptococcus faecalis ATCC 29212 на смесях V1, V2 и V3 и на референсной среде.
Фиг.7: Поведение различных микроорганизмов в экспериментальной смеси (FCE) и в референсной композиции.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИЯ И СПОСОБ ОБНАРУЖЕНИЯ И РАННЕГО И ДИФФЕРЕНЦИРОВАННОГО ПОДСЧЕТА ГРАМОТРИЦАТЕЛЬНЫХ МИКРООРГАНИЗМОВ | 2001 |
|
RU2264466C2 |
| КУЛЬТУРАЛЬНАЯ СРЕДА И СПОСОБ ИДЕНТИФИКАЦИИ ГРАМОТРИЦАТЕЛЬНЫХ МИКРООРГАНИЗМОВ | 2001 |
|
RU2286392C2 |
| СЕЛЕКТИВНАЯ КУЛЬТУРАЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ И ВЫЯВЛЕНИЯ ВИДОВ РОДА STREPTOCOCCUS | 2004 |
|
RU2342435C2 |
| Дифференциально-селективная питательная среда для выделения шигелл и сальмонелл сухая (Гектоеновый энтеро-агар) | 2023 |
|
RU2812423C1 |
| СУХАЯ ХРОМОГЕННАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ОБНАРУЖЕНИЯ КОЛИФОРМНЫХ БАКТЕРИЙ И E.coli (ВАРИАНТЫ) | 2012 |
|
RU2508400C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ДРОЖЖЕЙ | 2006 |
|
RU2430156C2 |
| СПОСОБ ВЫЯВЛЕНИЯ БАКТЕРИЙ РОДА SALMONELLA В ПИЩЕВЫХ ПРОДУКТАХ | 2014 |
|
RU2570386C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРЕХМЕРНЫХ СТРУКТУР, ИСПОЛЬЗУЕМЫХ ДЛЯ ДЕТЕКЦИИ, ВЫДЕЛЕНИЯ ИЛИ ПОДСЧЕТА МИКРООРГАНИЗМОВ | 2013 |
|
RU2644683C2 |
| ПРОТИВОМИКРОБНОЕ СРЕДСТВО | 2014 |
|
RU2556509C2 |
| СПОСОБЫ ХАРАКТЕРИЗАЦИИ МИКРООРГАНИЗМОВ НА ТВЕРДЫХ И ПОЛУТВЕРДЫХ СРЕДАХ | 2009 |
|
RU2523903C2 |
Изобретение относится к микробиологии. Питательная смесь включает смесь богатых триптофаном белковых фракций, свободного триптофана, гемицеллюлозы, смесь органических и неорганических солей, смесь веществ, обеспечивающих цвет и флуоресценцию и твердую структуру при определенном соотношении компонентов. Способ обеспечивает появление пяти различных окрасок колоний микроорганизмов, а также появление трех окрашенных флуоресцентных эмиссий и трех различных цветов феолов и зон с непрозрачными преципитатами, окружающими колонии микроорганизмов. Изобретение позволяет провести дифференциацию исследуемых микроорганизмов с высоким уровнем чувствительности и специфичности. 2 н. и 5 з.п. ф-лы, 7 ил., 21 табл.
смесь богатых триптофаном белковых фракций или свободного триптофана в количестве от 22 до 46% общей массы (масса/масса), в которой указанная аминокислота триптофан находится в количестве от 0,25 до 3,8% названной смеси;
смесь органических и неорганических солей в количестве от 15 до 20% всей смеси (масса/масса), в которой названная органическая и/или неорганическая соль выбрана из группы, состоящей из NaCl, K2HPO4, КН2PO4, (NH4)2SO4, Na2CO3 и пирувата натрия и их смесей, предпочтительно NaCl и Na2СО3, которые в названной смеси находятся в следующих количествах, %:
NaCl 7-18
КН2HPO4 6-11
КН2PO4 2-5
(NH4)2SO4 1-4
Na2CO3 0,1-0,4
Пируват натрия 0,7-3
смесь веществ, обеспечивающих цвет и флуоресценцию, в количествах от 0,3 до 37% всей смеси (масса/масса), в которой названные вещества выбраны из группы, состоящей из X-GAL, MUG, сорбита и нейтрального красного, предпочтительно X-GAL и MUG, и эти вещества в названной смеси находятся в следующих количествах, %:
X-GAL 0,1-0,36
MUG 0,1-0,2
сорбит 15-36,5
Нейтральный красный 0,06-0,11
ингибиторы грамположительных микроорганизмов в количествах от 2 до 4,5% всей смеси (масса/масса) и
смесь веществ, обеспечивающих твердую структуру в среде, в количествах от 20 до 50%;
и указанная свежеприготовленная питательная смесь имеет рН от 6,6 до 7,2.
смесь агарозы и агаропектина в количестве от 19 до 48% с нитратом целлюлозы в количестве от 0,1 до 0,4%, или
смесь целлюлозы и гемицеллюлозы в количестве от 1,4 до 3% с нитратом целлюлозы в количестве от 0,1 до 0,4%, или
смесь только агарозы и агаропектина в количестве от 19 до 48%.
Shigella sonnei - по появлению зеленовато-голубых колоний с голубой флуоресценцией и оранжевой среды;
Shigella flexneri - по появлению бледно-розовых колоний, желтоватого ореола и оранжевого цвета среды;
Enterobacter (E. aerogenes, E. cloacae, E. agglomerans) - по появлению от розового до красного цвета колоний с серовато-зеленым центром, желтой флуоресценции и красной среды;
Escherichia coli, исключая веротоксингенные штаммы, - по появлению светло-фиолетовых колоний, голубой флуоресценции и красной среды;
Escherichia coli 0157:H7 - по появлению зеленовато-голубых колоний и оранжевой среды;
Citrobacter freundii - по появлению темно-фиолетовых колоний с голубым ореолом и красной среды;
Klebsiella pneumoniae - по появлению светло-фиолетовых колоний и красной среды;
Salmonella typhi - по появлению красных колоний и красной среды с зоной непрозрачного преципитата;
Salmonella "no-typhi" - по появлению красных колоний и красной среды; после 24 ч инкубации цвет центра становится желтым и появляется желтая флуоресценция;
Pseudomonas aeruginosa - по появлению бледно-розовых колоний, зеленоватой флуоресценции до 24 ч инкубации и оранжевой среды;
после 24 ч инкубации - зеленовато-коричневые колонии и зеленоватая окружающая зона, зеленоватая флуоресценция;
Proteus, Providencia, Alcaligenes и другие грамотрицательные микроорганизмы - по появлению бесцветных или прозрачных колоний и оранжевой среды.
| US 5194374 А, 16.03.1993 | |||
| US 5723308 А, 11.03.1996 | |||
| WO 9630543 А, 01.01.1996. |
Авторы
Даты
2006-04-27—Публикация
2001-06-29—Подача