Область техники, к которой относится изобретение
Настоящее изобретение относится к R-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазолу(R-(-)-сертаконазолу) и его солям, способу его получения, к композициям, которые содержат упомянутое соединение, и к применению указанных композиций для лечения грибковых инфекций и борьбы с болезнями сельскохозяйственных культур.
Уровень техники
Рацемический 1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазол является известным соединением с названием сертаконазол (WHO, INN), которое используют в качестве противогрибкового агента для лечения заболеваний, вызванных грибами и дрожжами у человека и животных. Получение указанного соединения и его мононитрата описано в европейском патенте No 151477.
Раскрытие изобретения
Настоящее изобретение относится к R-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазолу формулы I
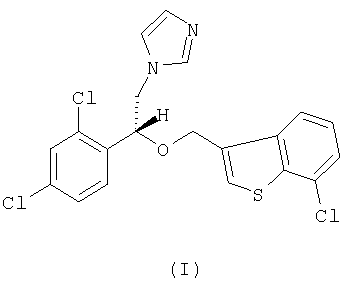
а также к его фармацевтически приемлемым аддитивным солям.
R-(-)-энантиомер сертаконазола обладает активностью в отношении грибов и дрожжей, которая приблизительно в 2 раза выше по сравнению с рацемической смесью, (так как его сродство к мишени в 2 раза выше), как показано в таблице 1. Эти данные позволяют предположить, что введение R-(-)-сертаконазола в дозе, составляющей 1/2 дозы рацемического сертаконазола, таким образом позволит снизить риск побочных действий и обеспечит подавление неспецифической токсичности, связанной с нежелательной примесью S-(+)-энантиомера.
Мононитрат является предпочтительной солью R-(-)-сертаконазола.
Настоящее изобретение относится также к способу получения R-(-)-энантиомера сертаконазола и его фармацевтически приемлемых солей, причем способ включает взаимодействие R-(-)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола формулы ((R)-(-)-III)
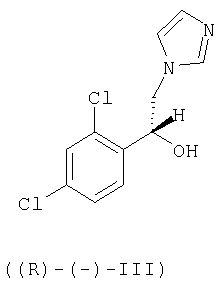
с 3-галогенметил-7-хлорбензо[b]тиофеном формулы IV
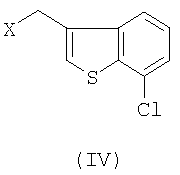
где Х означает галоген.
Соединение можно выделить из реакционной смеси известными в данной области способами. При необходимости неочищенный продукт можно затем очистить известными в данной области способами, например кристаллизацией и/или хроматографией.
Получение S-(+)-энантиомера сертаконазола можно проводить соответствующим способом с использованием S-(+)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола вместо R-(-)-энантиомера.
Необходимым условием для получения энантиомеров сертаконазола упомянутым выше способом является получение соответствующих энантиомеров промежуточного производного 1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола (III).
Два энантиомера 1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола (III) можно получить путем разделения соответствующей рацемической смеси с использованием оптически активной кислоты, предпочтительно L-винной кислоты, D-винной кислоты, дибензоил-L-винной кислоты, дибензоил-D-винной кислоты или т.п., и с использованием метода, описанного в патенте Великобритании No 1244530 и в статье Lammerhofer M. and Lindner W., Chiralitiy, 6:261-269,1994.(R)-(-)-1-(2,4-Дихлорфенил)-2-имидазол-1-илэтанол получают также методом энантиоселективного восстановления 1-(2,4-дихлорфенил)-2-имидазол-1-илэтанона (II) с использованием (-)-β-хлордиизопинокамфенилборана [(-)-DIP-хлорида] с образованием (R)-(-)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола ((R)-(-)-III) с приемлемой оптической чистотой.
Взаимодействие одного из энантиомеров промежуточного производного формулы (III) с 3-галогенметил-7-хлорбензо[b]тиофеном (IV) приводит к образованию соответствующего энантиомера сертаконазола в виде свободного основания. В качестве 3-галогенметил-7-хлорбензо[b]тиофена предпочтительными являются 3-хлорметил-7-хлорбензо[b]тиофен и 3-бромметил-7-хлорбензо[b]тиофен.
Энантиомеры сертаконазола в виде свободного основания могут быть превращены в фармацевтически приемлемые соли известными в данной области способами. Предпочтительно получают мононитраты с помощью обработки азотной кислотой.
Стадии получения энантиомеров сертаконазола представлены на следующей схеме.
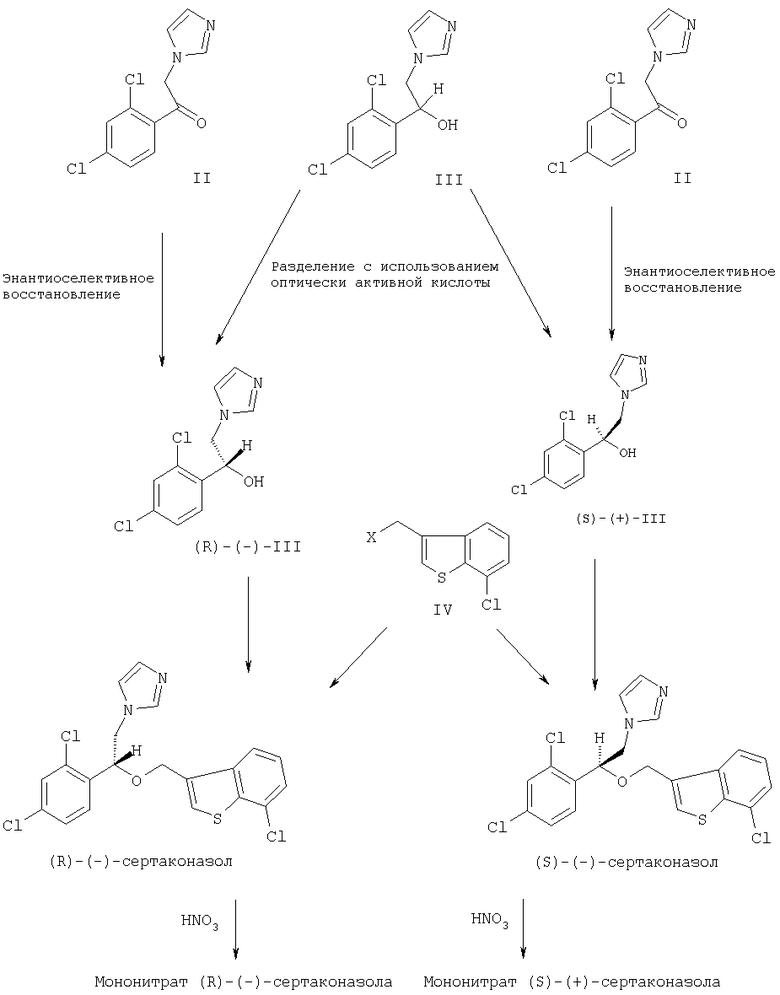
Кроме того, настоящее изобретение относится к фармацевтическим композициям, включающим (R)-(-)-сертаконазол и/или его соль, и к применению (R)-(-)-сертаконазола и/или его соли для лечения инфекций, вызванных грибами и дрожжами, у человека и животных, а также для борьбы с болезнями сельскохозяйственных культур, вызванными такими микроорганизмами.
Соединения по настоящему изобретению, по выбору смешанные с фармацевтически приемлемыми носителями, можно вводить человеку или животным пероральным путем в форме таблеток, капсул, таблеток с покрытием, сиропов, растворов, порошков, гранул, эмульсий, гелей для перорального применения, паст для перорального применения, буккофарингеальных растворов, буккофарингеальных суспензий, буккофарингеальных гелей, буккофарингеальных паст и т.п.; инъекционным способом, ректальным способом и вагинально-внутриматочным способом в форме, подобной яйцеклетке, вагинальной таблетки, вагинальной капсулы, лечебного вагинального тампона, мази, крема, геля, пены, раствора, эмульсии, суспензии, пессария, лосьона и т.п., в суточной дозе от 50 до 400 мг; и местным способом в форме крема, лосьона, пасты, суспензии, мази, эмульсии, раствора, пены, шампуня, порошка, геля и т.п., в концентрации в диапазоне от 0,05 до 3%.
Соединения по настоящему изобретению можно также по выбору смешивать с разбавителем или носителем и использовать для борьбы с болезнями сельскохозяйственных культур посредством нанесения на почву путем поливки, распыления, орошения, опыливания или в форме порошка, крема, пасты и т.п. при норме нанесения 0,05-10 кг на 1 гектар почвы.
Осуществление изобретения
Следующие примеры представлены для иллюстрации способов получения энантиомеров сертаконазола, их содержащих фармацевтических составов и их биологической активности в отношении различных микроорганизмов.
Пример 1: R-(-)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанол
В одногорлой колбе объемом 50 мл, снабженной капельной воронкой, охлаждающей баней, магнитной мешалкой и баллоном с азотом, смешивают 3,14 г (9,8 ммоль, 2,5 экв.) хлорида (-)-DIP и 9 мл безводного этилового эфира (молекулярные сита 4 Å). К полученной смеси по каплям при комнатной температуре в атмосфере азота добавляют раствор 1 г (3,92 ммоль, 1 экв.) 1-(2,4-дихлорфенил)-2-имидазол-1-илэтанона в 10 мл безводного тетрагидрофурана (молекулярные сита 4 Å). Смесь перемешивают в течение 24 ч при комнатной температуре в атмосфере азота. К смеси добавляют 0,4 мл метанола, перемешивают в течение 10 мин и растворители удаляют упариванием при пониженном давлении.
К полученному неочищенному продукту добавляют 10 мл н-гексана и 10 мл воды. Смесь подкисляют добавлением 1,6 мл 6 М соляной кислоты. Две фазы разделяют и органический слой удаляют. Водную фазу нейтрализуют 3 М NaOH до значения рН 10-11 в присутствии 10 мл этилового эфира. Две фазы разделяют и органический слой промывают 10 мл этилового эфира. Два слоя эфира сушат над безводным сульфатом натрия и упаривают досуха при пониженном давлении, при этом получают 1,27 г неочищенного продукта, который кристаллизуют из смеси 5 мл смеси этанол/вода, 1:1 об./об., при этом получают 0,8 г (выход 80%) R-(-)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола. Результаты анализа:
ДСК: пик при 107,4°С
ИК-спектр: соответствует указанной структуре
1H-13С-ЯМР (ДМСО) спектр: соответствует указанной структуре
[α]D 20 (С=1%, МеОН)=-80
Пример 2: R-(-)-1-(2,4-Дихлорфенил)-2-имидазол-1-илэтанол
Раствор 5 г 1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола в смеси ацетон/метанол (25 мл/20 мл) медленно добавляют к D-винной кислоте (3,21 г), растворенной в смеси ацетон/метанол (25 мл-10 мл) при комнатной температуре. После завершения добавления реагента реакционную смесь перемешивают в течение еще 30 мин при комантной температуре. Образующееся твердое вещество отфильтровывают и перекристаллизовывают из метанола. Выход составляет 1,85 г (37%), энанатиомерная чистота R-изомера >98%.
Пример 3: (R)-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазол
В трехгорлой колбе объемом 100 мл, снабженной обратным холодильником, погружным термометром, капельной воронкой, охлаждающей баней и баллоном с азотом, смешивают 10 мл сухого N,N-диметилформамида (молекулярные сита 4 Å) и 1,27 г (11,3 ммоль, 1,03 экв.) трет-бутоксида калия. К полученной смеси, охлажденной на водяной бане, по каплям добавляют раствор 2,83 г (11 ммоль) (R)-(-)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола в 15 мл сухого N,N-диметилформамида. После завершения добавления смесь перемешивают в течение 45 мин и к раствору добавляют 2,93 г (11,2 ммоль, 1,02 экв.) 3-бромметил-7-хлорбензо[b]тиофена в 7 мл сухого N,N-диметилформамида. Реакционную смесь перемешивают в течение 4 ч при комнатной температуре. Растворитель удаляют отгонкой при пониженном давлении и остаток обрабатывают 50 мл хлористого метилена. Полученный раствор промывают 2 раза по 30 мл воды, сушат над безводным сульфатом натрия, фильтруют и упаривают досуха при пониженном давлении, при этом получают 4,62 г неочищенного продукта. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле с использованием в качестве элюента градиента хлористый метилен/метанол. Полученную смолу (2,0 г) кристаллизуют из этилового эфира (10 мл). Твердое вещество отфильтровывают и сушат, при этом получают 1,22 г (выход 25,1%) (R)-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола.
Результаты анализа:
ДСК: пик при 74,5°С
ИК-спектр: соответствует указанной структуре
1H-13С-ЯМР (ДМСО) спектр: соответствует указанной структуре
[α]D 20 (С=1%, МеОН)=-61,0
Пример 4: (S)-(+)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазол
В трехгорлой колбе объемом 100 мл, снабженной обратным холодильником, погружным термометром, капельной воронкой, охлаждающей баней и баллоном с азотом, смешивают 16 мл сухого N,N-диметилформамида (молекулярные сита 4 Å) и 2,04 г (18,43 ммоль, 1,05 экв.) трет-бутоксида калия. К полученной смеси, охлажденной на водяной бане, по каплям добавляют раствор 4,44 г (17,2 ммоль) (S)-(+)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола в 25 мл сухого N,N-диметилформамида. После завершения добавления смесь перемешивают в течение 45 мин и к раствору добавляют 4,61 г (17,62 ммоль, 1,02 экв.) 3-бромметил-7-хлорбензо[b]тиофена в 13 мл сухого N,N-диметилформамида. Реакционную смесь перемешивают в течение 4 ч при комнатной температуре. Растворитель удаляют отгонкой при пониженном давлении и остаток обрабатывают 80 мл хлористого метилена. Полученный раствор промывают 2 раза по 50 мл воды, сушат над безводным сульфатом натрия, фильтруют и упаривают досуха при пониженном давлении, при этом получают 7,30 г неочищенного продукта. Полученный неочищенный продукт очищают колоночной хроматографией на силикагеле с использованием в качестве элюента градиента хлористый метилен/метанол. Полученную смолу (3,78 г) кристаллизуют из этилового эфира (18 мл). Твердое вещество отфильтровывают и сушат, при этом получают 2,61 г (выход 34,5%) (S)-(+)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола.
Результаты анализа:
ДСК: пик при 83,4°С
ИК-спектр: соответствует указанной структуре
1H-13С-ЯМР (ДМСО) спектр: соответствует указанной структуре
[α]D 20 (С=1%, МеОН)=+69
Пример 5: Мононитрат (R)-(-)-сертаконазола (мононитрат (R)-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола)
880 мг(2,01 ммоль)(R)-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола растворяют в 5 мл 96% этанола. К раствору добавляют 1 мл воды и нагревают при температуре 35-37°С. К полученному раствору добавляют 0,23 мл 60% азотной кислоты (3 ммоль, 1,5 экв.). Затем добавляют 3 мл воды и охлаждают сначала до комнатной температуры, а затем при 10°С в течение 1 ч. Полученное твердое вещество отфильтровывают, промывают 2 раза по 4 мл воды и сушат в вакууме в течение 24 ч, при этом получают 0,9 г (выход 89%) мононитрата (R)-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола.
Результаты анализа:
ДСК: пик при 116,87°С
ИК-спектр: соответствует указанной структуре
1H-13С-ЯМР (ДМСО) спектр: соответствует указанной структуре
[α]D 20 (С=1%, МеОН)=-85,00
Пример 6: Мононитрат (R)-(-)-сертаконазола (мононитрат R-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола
В колбу объемом 500 мл, оборудованную механической мешалкой, загружают 15,72 г R-(-)-1-(2,4-дихлорфенил)-2-имидазол-1-илэтанола, 45 мл толуола, 1,05 г гидросульфата тетрабутиламмония и 24,5 г 18 н. водного NaOH. Смесь нагревают при 35-40°С и эту температуру поддерживают в течение еще 15 мин. Затем добавляют раствор 3-бромметил-7-хлорбензо[b]тиофена в 376 мл толуола в течение 30 мин. В реакционной смеси поддерживают температуру от 37 до 40°С в течение 2,5 ч и затем добавляют воду. Органический слой промывают водой. После концентрирования при пониженном давлении неочищенный продукт растворяют в 150 мл абсолютного этанола. Затем медленно добавляют смесь 9,1 г 60% HNO3 и 130 мл воды и после завершения добавления реагентов реакционную смесь охлаждают до 0°С. Полученное твердое вещество отфильтровывают, перекристаллизовывают из смеси ацетон/этанол и сушат. Выход составляет 24,5 г (80%).
Пример 7: Мононитрат (S)-(+)-сертаконазола (мононитрат (S)-(+)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола)
2,35 мг (5,37 ммоль)(S)-(+)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола растворяют в 17 мл 96% этанола. К раствору добавляют 3 мл воды и нагревают при температуре 35-40°С. К полученному раствору добавляют 0,61 мл 60% азотной кислоты (8,06 ммоль, 1,5 экв.). Затем добавляют 13 мл воды и охлаждают сначала при комнатной температуре, а затем при 10°С в течение 1 ч. Полученное твердое вещество отфильтровывают, промывают 2 раза по 10 мл воды и сушат в вакууме в течение 24 ч, при этом получают 2,65 г (выход 98,5%) мононитрата (S)-(+)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазола.
Результаты анализа:
ДСК: пик при 168,91°С
ИК-спектр: соответствует указанной структуре
1H-13С-ЯМР (ДМСО) спектр: соответствует указанной структуре
[α]D 20 (С=1%, МеОН)=+89,00
Пример 8: Состав 1% крема
Пример 9: Состав 1% геля
Пример 10: Биологические данные
Величины минимальной ингибирующей концентрации (МИК) определяют с использованием модифицированного метода микроразбавлений М27-А, рекомендованного Национальным комитетом по клиническим лабораторным стандартам, в среде RPMI-1640 (фирмы Sigma), дополненной глюкозой до концентрации 2% и доведенной до рН 7,0 с помощью 0,165 М буферного раствора, содержащего морфолин-пропансульфоновую кислоту (MOPS). Из исходных растворов соединений готовят серийные двухкратные разведения в модифицированной среде RPMI-1640. Величины МИК определяют по минимальной концентрации лекарственного средства, при которой наблюдается ингибирование роста на 50% по сравнению с ростом контрольного микроорганизма. Микробиологическая активность R-(-)-сертаконазола по сравнению с S-(+)-энантиомером, который значительно менее активен, и с рацемическим сертаконазолом представлена в виде среднегеометрических величин в таблице. Число штаммов, использованных в экспериментах, показано в скобках рядом с названием каждого микроорганизма.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МОНОНИТРАТА СЕРТАКОНАЗОЛА И МОНОГИДРАТ МОНОНИТРАТА СЕРТАКОНАЗОЛА | 2005 |
|
RU2357965C2 |
| СПОСОБ ПОЛУЧЕНИЯ R-(-)-СЕРТАКОНАЗОЛА МОНОНИТРАТА И ПОЛУАЦЕТОНАТ R-(-)-СЕРТАКОНАЗОЛА МОНОНИТРАТА | 2005 |
|
RU2413728C2 |
| АМИНОТЕТРАЛИНОВЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2010 |
|
RU2546649C2 |
| 2-ТИОЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ИХ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИКЕ | 2003 |
|
RU2331638C2 |
| ПИРИМИДИЛЦИКЛОПЕНТАНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ AKT-ПРОТЕИНКИНАЗЫ | 2008 |
|
RU2486178C2 |
| ИНГИБИТОРЫ КИНАЗЫ | 2005 |
|
RU2348635C2 |
| МОДУЛЯТОРЫ РЕЦЕПТОРОВ МЕЛАНОКОРТИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В ЛЕКАРСТВЕННЫХ И КОСМЕТИЧЕСКИХ ПРЕПАРАТАХ ДЛЯ ЧЕЛОВЕКА | 2009 |
|
RU2589056C2 |
| 2-(Азаиндол-2-ил)бензимидазолы в качестве ингибиторов PAD4 | 2012 |
|
RU2611010C2 |
| Фармацевтически эффективные соединения, селективно ингибирующие изоформы миозина 2 | 2019 |
|
RU2817643C2 |
| ИНГИБИТОРЫ ТИРОЗИНФОСФАТАЗЫ БЕЛКА ЧЕЛОВЕКА И СПОСОБЫ ПРИМЕНЕНИЯ | 2007 |
|
RU2435763C2 |
Описывается R-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазол формулы (I) и его соли, в частности его мононитрат, 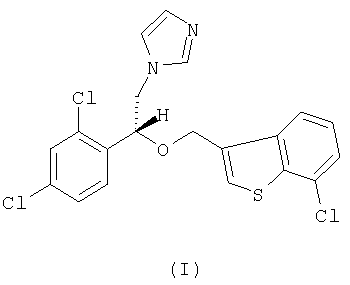 способ получения соединения формулы (I), композиция, обладающая противогрибковым действием, на основе соединения формулы (I) и применение соединения формулы (I) в качестве активного ингредиента противогрибковой композиции. Технический результат - соединение формулы (I) можно использовать в композициях для лечения грибковых инфекций у человека или животных и для борьбы с болезнями сельскохозяйственных культур. 5 н. и 10 з.п. ф-лы, 1 табл.
способ получения соединения формулы (I), композиция, обладающая противогрибковым действием, на основе соединения формулы (I) и применение соединения формулы (I) в качестве активного ингредиента противогрибковой композиции. Технический результат - соединение формулы (I) можно использовать в композициях для лечения грибковых инфекций у человека или животных и для борьбы с болезнями сельскохозяйственных культур. 5 н. и 10 з.п. ф-лы, 1 табл.
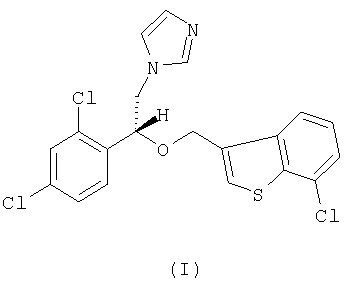
или его фармацевтически приемлемые соли.
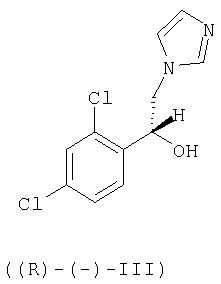
с 3-галогенметил-7-хлорбензо[b]тиофеном формулы (IV)
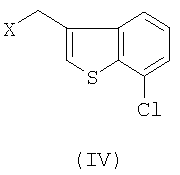
где X означает галоген, и по выбору обрабатывают полученный R-(-)-1-[2-(7-хлорбензо[b]тиофен-3-илметокси)-2-(2,4-дихлорфенил)этил]-1Н-имидазол солеобразующей кислотой.
| Одновибратор | 1978 |
|
SU748806A1 |
| Способ исследования рельефа с помощью щелевого осветителя | 1960 |
|
SU151477A1 |
| Способ получения 1-арил-2/1-имидазолил/алкильных эфиров,тиоэфиров или их солей | 1976 |
|
SU622405A3 |
Авторы
Даты
2006-05-10—Публикация
2003-02-04—Подача