Изобретение относится к органической химии, к способу получения алкиладамантанов путем алкилирования адамантана или смесей алкиладамантанов н-алканами.
Изобретение может быть использовано для производства ценных термостойких нетоксичных смазок или их компонентов, фрикционных систем, кабельного масла, трансмиссионных жидкостей, антимикробных присадок к смазочным маслам. (К.Kurisaki, Chem. Economy, Eng. Rev. 1976, 8, 12; Е.И.Багрий, Адамантаны: Получение, Свойства, Применение: Москва, 1989).
Известен способ получения алкиладамантанов алкилированием алкиладамантанолов гептенами под действием 20-кратного избытка 96%-ной серной кислоты. [Получение высших гомологов адамантана реакцией адаманта-1-ола с гептенами в серной кислоте (L.Vodika, J.Burkhard, J.Jonku. Collection of Chech. Chem. Comm. 1980, 45, 3, 835). При этом получают алкиладамантаны с одним (Ad'C7H15, m=17 и Ad'C14H29, m=24) и двумя адамантановыми циклами (Ad'C14H28Ad', m=34, где Ad'=незамещенный адамантановый цикл) с общим выходом 20% и выходом алкиладамантанов с суммарным числом атомов углерода в молекуле m=24 и 34 лишь 6%. Основными продуктами реакции являются олигомеры гептена.
Недостатками этого способа являются низкие выходы алкиладамантанов и особенно высших алкиладамантанов, большие количества побочных продуктов, некаталитический характер процесса, использование малодоступного адамантанола и большого избытка агрессивной концентрированной серной кислоты.
Другой способ синтеза высших алкиладамантанов основан на алкилировании 1,3-диметиладамантана и 1,3-диметиладамантан-5-ола н-алканами также под действием 96-105%-ной H2SO4 при 10-75°С. (Патент США 3646233). Продуктами реакций является смесь алкиладамантанов AdCn*(m≤20) и Ad2Сn*(m=32) (* Здесь и далее Ad = незамещенный или алкилированный адамантановый цикл, n - общее число алкильных групп, m - общее число атомов углерода в молекуле. Выходы алкиладамантанов в реакциях с 1,3-диметиладамантаном и 1,3-диметиладамантан-5-олом 10-15% и 40% за 25-40 ч соответственно. Более инертный адамантан в этих условиях не алкилируется.
Недостатком этого способа является необходимость использования труднодоступных производных адамантана, низкие выходы, проведение процесса в среде агрессивной серной кислоты, длительность реакций.
Описан способ получения смесей полиалкиладамантанов путем алкилирования адамантана n-алканами C7-C18 в присутствии катализатора СН3СОХ·2АIХ3 (Способ получения смеси высших алкиладамантанов. А.С. №1452074). Процесс проводят про 15-25°С в растворе CH2Cl2 в течение 2-4 ч при мольном отношении [алкан]:[адамантан]:[СН3СОХ·2AlX3]=(40-10):5:(1-0.6). Конверсии адамантана составляют 77-100%, общий выход алкиладамантанов 130-220%, а выход высших алкиладамантанов составляет 87-150% мас. на исходный адамантан. Этот способ выбран нами в качестве прототипа.
Недостатком этого способа является низкая технологичность из-за необходимости использования в качестве компонентов катализатора трудных в работе, легко гидролизующихся ацилгалогенидов, которые необходимо готовить перед опытом, применение больших количеств бромистого алюминия.
Задачей настоящего изобретения являлось создание более технологичного способа получения смесей полиалкиладамантанов с использованием более технологичных, промышленно доступных катализаторов, а также возможность получения более ценных продуктов.
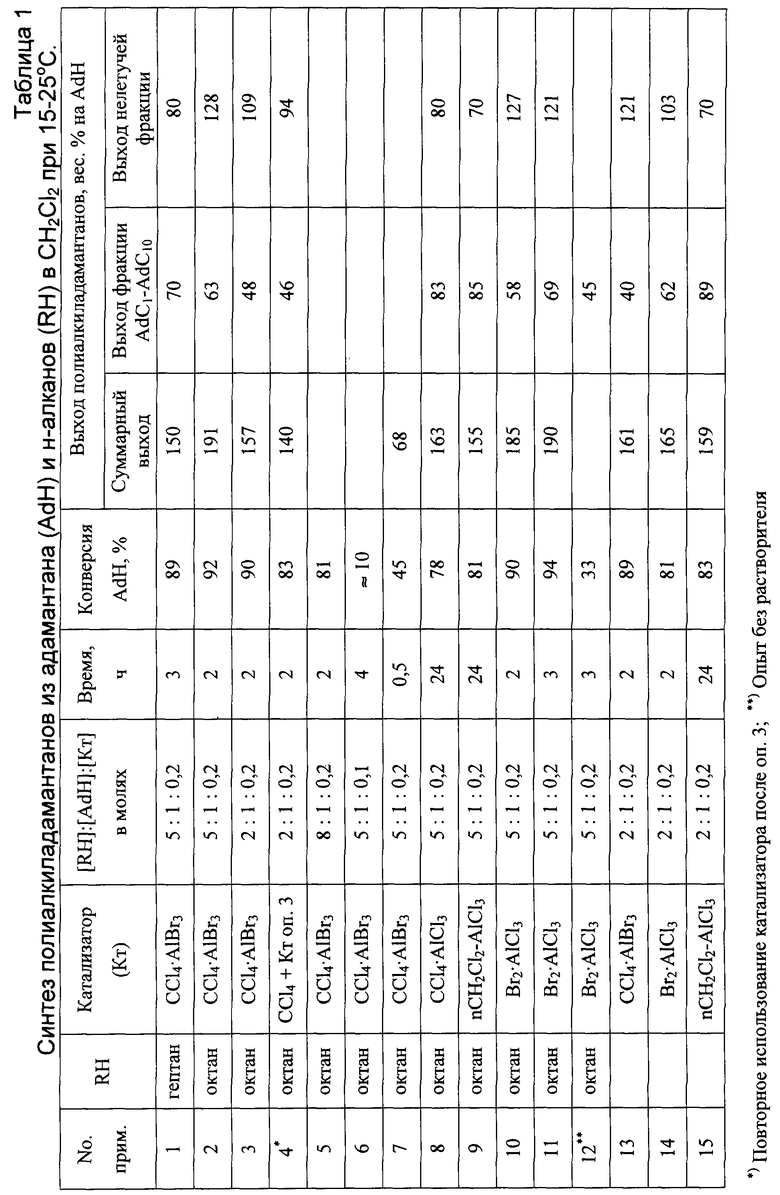
Поставленная задача решается тем, что проводят алкилирование адамантана или смеси алкиладамантанов с общим числом атомов углерода 10-20 в присутствии катализатора, представляющей собой эквимолярную смесь галогенида алюминия и галоидсодержащего промотора общей формулы AlX3·СрНr Xz, где Х=Cl, Br, р=0, r=0, z=2, либо р=1, r=0, z=4, либо р=1, r=2, z=2, и процесс проводят в растворе хлористого метилена при 15-25°С. Конверсии адамантана 78-94%. Выход алкиладамантанов AdkCn (k=1-4, m=11-70) составляет 120-190% мас. в расчете на исходный адамантан или смесь адамантанов.
Смеси полиалкиладамантанов получают путем перемешивания катализатора с адамантаном или смесью алкиладамантанов в растворе CH2Cl2 при 15-25°С в течение 2-24 часов. Применение CH2Cl2 является существенным для данного процесса. В отсутствии растворителя алкилирование адамантана происходит, однако конверсия адамантана вместо 92% снижается до 33% (примеры 2 и 12 в таблице 1). Использование в качестве растворителя CCl4 вместо CH2Cl2 приводит к полному ингибированию процесса. При использовании системы CCl2·AlBr3 галогенид алюминия может быть использован повторно (пример 4 в таблице 1). При повторном использовании катализатора реакция протекает с близкой конверсией и приводит к такому же набору продуктов, что и первая. Если катализатор вторично не используется, реакционную смесь гидролизуют водой, экстрагируют эфиром, эфирные вытяжки промывают водой, высушивают. Если катализатор используется повторно, после опыта нижний слой, содержащий катализатор, отделяют в делительной воронке, к нему прибавляют все исходные компоненты (за исключением галогенида алюминия) в тех же соотношениях и проводят процесс по стандартной методике.
Изучение состава летучей фракции, образующейся при алкилировании адамантана показало, что она представлена исключительно алкилдамантанами AdC1-C10, преимущественно моноалкиадамантанами, 40-50% которой составляет смесь AdC4 (преимущественно н-бутиладамантан) - AdC6. Качественный состав летучей фракции мало зависит от природы алкана и катализатора (Таблица 2).
Высшие труднолетучие и нелетучие алкиладамантаны представлены соединениями трех типов: с одним адамантановым циклом - AdCn и набором фрагментных ионов m/z: 135+n·14 (тип I), с двумя адамантановыми циклами, разделенными углеводородными цепочками Ad(CH2)n·Ad и набором m/z: 269+n·14 (тип II) и с тремя адамантановыми циклами, разделенными углеводородными цепочками, Ad(CH2)n"Ad(CH2)n"'Ad и m/z: 403+n·14, где n - суммарное число СН2-групп в молекуле (тип III) (таблица 3). Соединения типа I представлены алкиладамантанами вплоть до соединений с суммарным числом атомов углерода m=58 и m/z 807, алкиладамантаны типа II - вплоть до гомологов с m=45 и m/z=619 и алкиладамантаны типа III - до m=57 с m/z 781.
Алкилирование н-алканами C8-C12 под действием тех же катализаторов летучей фракции алкиладамантанов AdCn (n=1-10) с т.кип. 100°C при 1-2 мм (полученной алкилированием адамантана н-октаном) приводит к увеличению ее массы (120-170% мас. в расчете на исходную смесь, таблица 4) и существенному качественному изменению ее состава. После алкилирования эта смесь летучих алкиладамантанов превращается, в основном, в труднолетучие и нелетучие алкиладамантаны, содержание которых составляет от 55 до 88% от общего количества образовавшихся продуктов (таблица 4). Состав образовавшейся фракции летучих алкиладамантанов AdC1-С11, составляющей 45%-12% от суммы образовавшихся продуктов, также заметно отличен от исходной смеси повышенным содержанием полиалкилированных продуктов и более высоким процентом высших гомологов (таблица 5). Как видно из таблицы 5, процент AdC7-С11 в летучей фракции возрастает после алкилирования, как правило, в 1.7-2.3 раза (примеры 16-18, 21-24, 26). При этом использование декана вместо октана приводит к смесям с большим содержанием высших гомологов AdCn (n≥10):28% (реакция с октаном, пример 18) и 33% (реакция с деканом, пример 23) при катализе Br2·AlCl3 за 2 часа и 12% (реакция с октаном, пример 16) и 45% (реакция с деканом, пример 21) при катализе CCl4·AlCl3 за 24 часа. Труднолетучие и нелетучие продукты алкилирования AdC1-С10 представлены алкиладамантанами типа I-III, а также типа IV (таблица 6), V и VI (таблица 7). Среди алкиладамантанов II и III в этой фракции присутствуют более тяжелые гомологи по сравнению с теми, которые получаются в продуктах алкилирования адамантана: II - с m=50-64 и m/z вплоть до 885 и III - с m до 64 и m/z вплоть до 879. Алкиладамантаны типа IV, в небольшом количестве образующиеся при алкилировании алкиладамантанов (но не адамантана), содержат 4 адамантановых цикла, разделенных углеводородными цепочками; они характеризуются фрагментными ионами 537+n 14. Для типа IV m варьирует от 53 до 75 с m/z от 719 до 1027 (таблица 6). Наряду с алкиладамантанами I-IV, образуется небольшое количество алкиладамантанов, содержащих одно (тип V) и два тетрацикла (тип VI). Соединения группы V характеризуются наличием в масс-спектрах ионов брутто - формулами Ad2CnH2n-3, Ad3CnH2n-4, Ad4CnH2n-5, с m/z 519-1095, m=38-80. Соединения группы VI содержат последовательности ионов брутто-формулами Ad2CnH2n-5, Ad3CnH2n-6, Ad4CnH2n-7, m/z=587-1029, m=43-75.
Результаты по алкилированию адамантана алканами представлены в таблицах 1-3.
В таблице 1 приведены условия опытов и выходы образовавшихся алкиладамантанов, в таблицах 2-3 суммированы данные по составу алкиладамантанов: легкой фракции AdC1-AdC10 (таблица 2) и высших алкиладамантанов (таблица 3). Результаты по модификации смеси алкиладамантанов AdC1-AdC10 путем ее алкилирования алканами представлены в таблицах 4-7. В таблице 4 приведены условия опытов и выходы низших и высших алкиладамантанов. Таблица 5 демонстрирует изменение состава летучих алкиладамантанов AdC1-AdC10 после алкилирования, в таблице 6 представлены типы образующихся высших алкиладамантанов с 1-4 адамантановыми циклами, в таблице 7 приведены примеры тетрацикланов, образующихся из алкиладамантанов AdC1-AdC10.
Уменьшение времени реакции или количества катализатора по сравнению с заявленным нецелесообразно из-за снижения конверсии. Изменение температуры реакции по сравнению с заявленным интервалом мало сказывается на процессе, но требует энергозатрат. Увеличение количества алкана против заявленного нецелесообразно, поскольку не приводит ни к увеличению конверсии, ни к повышению выхода алкиладамантанов. В присутствии более устойчивых к крекингу алканов с n<7 конверсии адамантана снижаются до 40% и ниже, а выходы высших алкиладамантанов не превышают 10%. С другой стороны, использование алканов с n>12 также нецелесообразно, т.к. не вступившие в реакцию алканы (или их изомеры) трудно отделить от легкой фракции алкиладамантанов, и они будут неблагоприятно влиять на свойства этих продуктов. Существенным достоинством предложенного метода является применение каталитических систем значительно более технологичных, чем ранее описанные. Эти системы доступны, не требуют специальной очистки и специальных условий для эксплуатации.
Системы Р·nAlX3 (Р = галоидсодержащий промотор, n=1-2, X=Br, Cl), как было показано (И.С.Ахрем, А.В.Орлинков, Изв. АН, сер. хим., 1998, 47, 771; И.С.Ахрем, Изв. АН, сер. хим., 2003, 52, 2466), являются инициаторами крекинга, изомеризации, функционализации и других превращений насыщенных углеводородов. Методами квантовой химии показано (А.Л.Чистяков, И.В.Станкевич, И.С.Ахрем, Н.П.Гамбарян, М.Е.Вольпин, Изв. РАН, сер. хим., 2001, 50, 29.), что в системах CCl4·nAlX3 (и других родственных системах) могут генерироваться комплексы двух типов: неполярные донорно-акцепторные комплексы Cl3CCl→Y(Y=AIX3, AI2X6) и ионные тригалометильные комплексы Cl2CCl+Y-(Y=AIX4, AI2X7), в которых на атоме галоида сосредоточен значительный положительный заряд. Показано (А.Л.Чистяков, И.В.Станкевич, Н.П.Гамбарян, И.С.Ахрем, Изв. РАН, сер. хим., 2001, 49, 802), что в системах Br2·nА1Х3 возможно образование донорно-акцепторных комплексов Br-Br→n А1Х3, в которых на атоме брома сосредоточен большой положительный заряд, и связь Br-Br сильно растянута. Существенно, что высокую активность в алкилировании адамантанов проявляют сравнительно слабые электрофилы - эквимолярные комплексы на основе хлоридов алюминия и даже система CH2Cl2-AlCl3, самая малоактивная в ряду суперэлектрофилов на основе полигалометанов.
Важно, что при алкилировании адамантана или алкиладамантанов алканами преимущественно образуются наиболее ценные полиалкилированные адамантаны, содержащие алкильные группы у третичных атомов углерода адамантановых циклов. (И.С.Ахрем, А.В.Орлинков, С.В.Витт, М.Е.Вольпин, Докл. АН СССР, 1986, 288, 130).
Конверсию AdH и количественный анализ продуктов проводят методом ГЖХ на приборе Finnigan 9001 с использованием пламенно-ионизационного детектора и капиллярной кварцевой колонки DB-5.625 (30 м/3 мм) с применением гелия в качестве носителя, в условиях программирования температуры от 50-310°С с использованием эталона. Идентификацию летучих продуктов проводят с помощью метода ГЖХ-МС на приборе AEI MS 1073, снабженном аналогичной колонкой (энергия ионизации 70 eV). Для более детального изучения летучей фракции продуктов применяют развертку масс-спектров по фрагментным ионам. Труднолетучую и нелетучую фракцию алкиладамантанов (т.кип. > 320 град. С), остающуюся после отгонки летучих продуктов в вакууме (100 при 1-2 мм), анализируют методом масс-спектрометрии прямым вводом при 250-300 на приборе Termo Finnigan Polatis Q.
Примеры конкретного выполнения синтезов алкиладамантанов из адамантана и н-алканов
Пример 1.
В колбу помещают 1.06 г (4 ммоля) AlBr3, 0.61 г (4 ммоля) CCl4 в 1 мл. CH2Cl2. Смесь перемешивают 15 мин при комнатной температуре с помощью магнитной мешалки, после чего вводят в реакционную смесь 2.72 г (20 ммоля) адамантана и 10 г (100 ммоля) гептана. Реакционную смесь перемешивают при комнатной температуре 3 часа, затем гидролизуют, экстрагируют эфиром. Эфирные экстракты промывают водой до нейтральной реакции и высушивают. Конверсия адамантана (стандарт - декан) составляет 85%, выход смеси летучих алкиладамантанов AdC1-AdC10, по данным ГЖХ, 1.907 г (70%). Здесь и далее выходы алкиладамантанов даны в % мас. в расчете на исходный адамантан (таблица 1, пример 1). Состав летучей фракции приведен в таблице 2, пример 1. Общий выход алкиладамантанов после отгонки растворителя и других летучих продуктов (100°С при 1-2 мм) - 4.08 г (150%). После отгонки летучих алкилдамантанов при температуре до 100°С при 1-2 мм, остающиеся высшие алкилдамантаны составляют 2.19 г (50%), таблица 1, пример 1.
Пример 2.
В круглодонной колбе, снабженной дюаровским холодильником и капельной воронкой, к комплексу CCl4·AlBr3, приготовленному из 3.66 г (23.8 ммоля) CCl4 и 6.35 г (23.8 ммоля) AlBr3 в 9 мл СН2Cl2 при комнатной температуре при перемешивании в течение 15 минут, не прекращая перемешивания при той же температуре постепенно прибавляют 16.2 г адамантана (119 ммоля), а затем приливают из капельной воронки 67.98 г (595 ммоля) октана. После перемешивания в течении 2 часов при комнатной температуре смесь гидролизуют, экстрагируют эфиром, эфирные вытяжки промывают до нейтральной реакции. В аликвотной доле раствора с помощью стандарта определяют конверсию адамантана, которая составляет 92%. От полученной смеси алкиладамантанов 30.94 г (191%) отгоняют 10.2 г (63%) алкиладамантанов с т.кип. до 100°С при 1-2 мм. Остаток 20.73 г (128%). Выходы продуктов приведены в таблице 1, состав летучей фракции приведен в таблице 2, пример 2. Из данных ГЖХ-МС следует, что алкиладамантаны AdC4H9+AdC5H11+AdC6H13 составляют 42% от общего веса алкиладамантанов AdC1-AdC10 (21, 15 и 6% соответственно). Состав высших труднолетучих алкиладамантанов приведен в таблице 3, пример 2. Примеры 3, 5 и 6 (таблица 1) проводят аналогично примерам 1 и 2, но при другом соотношении реагентов.
Пример 4. Повторное использование катализатора
1. Проводят получение алкиладамантанов (таблица 1, пример 3), исходя из 1.9 г (14 ммоля) адамантана, 0.43 г (2.8 ммоля) CCl4, 0.75 г (2.8 ммоля) AlBr3, 3.2 г (28 ммоля) октана (мольное соотношение RH:AdH:КT=2:1:02). После завершения реакции органический слой отделяют в делительной воронке. После промывания и высушивания в органическом растворе определяют конверсию адамантана, выход низших и высших алкиладамантанов, состав летучих алкиладамантанов. Конверсия адамантана 90%, общий выход алкиладамантанов 2.98 г (157%), выход фракции AdC1-AdC10 - 0.91 г (48%), выход высших алкиладамантанов - 2.07 г (109%). Состав AdC1-AdC10 приведен в таблице 2.
2. Нижний слой, оставшийся после отделения органического слоя, переносят в колбу, добавляют к нему 043 г CCl4, 0.75 г AlBr3, 3.2 г (28 ммоля) октана в 1 мл CH2Cl2. Реакцию проводят аналогично примеру 3, при перемешивании реакционной смеси в течение 2 часов при комнатной температуре. Обработку опыта проводят аналогично примерам 1 и 2. Результаты приведены в таблицах 1 и 2, пример 4.
Опыт 7 проводят с октаном за 30 минут. Опыты 8 и 9 проводят за сутки с каталитическими системами CCl4·AlCl3 и n CH2Cl2·AlCl3 соответственно. Опыты 10 и 11 проводят за 2 и 3 часа, соответственно, с использованием в качестве каталитической системы Br2·AlCl3, опыт 12 проводят с октаном в отсутствии CH2Cl2. Опыты 13-15 проводят с деканом с каталитическими системами CCl4·AlBr3, Br2·AlCl3 и n CH2Cl2·AlCl3 соответственно. Результаты приведены в таблицах 1-3.
Примеры конкретного выполнения способа получения модифицированной смеси алкиладамантанов из смеси алкиладамантанов AdC1-С10 и н-алканов
В реакциях используют фракцию AdC1-С10 с т.кип до 100°C при 1-2 мм, полученную из октана в присутствии CCl4·AlBr3, содержащую AdC1-С3 15%, AdC4-С6 49%, AdC7-C10 35% (таблица 5). Молярное отношение реагентов (примеры 16-26) определяют из среднего молекулярного веса смеси алкиладамантанов (200), вычисленного на основании количественного анализа этой смеси по данным ГЖХ-МС. Выход образовавшихся легких алкиладамантанов определяют весовым методом, а также по данным ГЖХ со стандартом - додеканом после калибровки эталонной смеси AdC1-С10 - додекан. Общий выход летучей фракции алкиладамантанов (с т. кип. до 100°С при 1-2 мм) и высших адамантановых продуктов определяют весовым методом до и после отгонки легких продуктов до 100°С при 1-2 мм.
Пример 16
При комнатной температуре после перемешивания в течение 15 минут 0.51 г CCl4 и 0.44 г AlCl3 в 1,1 мл CH2Cl2 к реакционной смеси прибавляют 2.25 г смеси AdC1-С10 и 9.4 г октана (мольное отношение RH:AdH:CCl4AlCl3=7.3:1:0.29). Реакцию проводят при комнатной температуре 24 ч. Обработку и анализ реакционной смеси проводят аналогично опытам 1 и 2. Результаты приведены в таблицах 4-5. Опыты 17-27 проводят аналогично, и они отличаются природой алкана, типом каталитической системы, временем реакции и соотношением реагентов. Как следует из таблицы 4, содержание высших алкиладамантанов в продуктах алкилирования смеси AdC1-С10 под действием алканов C8-C12 в мольном соотношении RH:AdH:Кт=(7.3-0.9):1:(0.29-0.09) составляет от 42 до 88% (примеры 20 и 26) при общем выходе алкиладамантанов от 102 (пример 20) до 170% (примеры 18, 21, 24). Уменьшение количества алкана в 2 раза приводит к увеличению выхода алкилированных продуктов (примеры 17, 18). Уменьшение количества катализатора приводит к снижению общего выхода алкилированных продуктов. При мольном соотношении AdH:Кт=1:0.09 за 2 часа в присутствии системы Br2·AlCl3 увеличения веса алкиладамантанов почти не происходит, однако содержание тяжелых алкиладамантанов возрастает по сравнению с исходным на 42%. Системы Br2·AlCl3 и CCl4·AlCl3 проявляют близкую активность (примеры 18, 21). Соотношение низших и высших алкиладамантанов в опыте с CCl4 AlCl3 за 24 часа (пример 16) и с Br2·AlCl3 за 2 ч (пример 17) отличается незначительно. Длинноцепочечные алканы требуют большего количества катализатора, поскольку активность катализатора уменьшается с увеличением числа разрываемых связей (примеры 16, 24 и 27), однако при близких выходах алкиладамантанов содержание высших алкилированных продуктов возрастает с увеличением числа атомов углерода в молекуле алкана (C12>С10>С8), (примеры 27, 22, 16, а также 26, 18).
Преимущества предлагаемого метода от прототипа заключаются в следующем:
1) уменьшение содержание катализатора, по сравнению с прототипом количество AlX3 снижено в 2.5-4 раза;
2) использование более доступных и пригодных для производства катализаторов. Вместо галогенацилов (входящих в состав каталитических систем в прототипе), которые необходимо готовить непосредственно перед началом процесса, и реакции, с которыми требуют полного отсутствия влаги, в заявляемом методе в качестве компонентов каталитических систем используются полигалометаны или молекулярный бром - технически доступные соединения, не требующие ни специальной очистки, ни специальных условий для проведения процесса;
3) возможность позволяет получать смеси, содержащие более тяжелые алкиладамантаны AdkCn с числом адамантановых циклов k от 1 до 4 и m 11-70. В прототипе продукты представлены AdkCn (k=1, 2, m=11-41);
4) заявляемый метод позволяет модифицировать состав летучих алкиладамантанов путем алкилирования их алканами. В результате получают более ценные для практического использования смеси высших алкиладамантанов.
% мас.
| название | год | авторы | номер документа |
|---|---|---|---|
| 1,3,5,7-ТЕТРААЛКИЛАДАМАНТАНЫ В КАЧЕСТВЕ НОВЫХ ПРОИЗВОДНЫХ АДАМАНТАНА, СПОСОБ ПОЛУЧЕНИЯ 1,3,5,7-ТЕТРААЛКИЛАДАМАНТАНОВ И МОДИФИКАЦИИ СМЕСЕЙ ПОЛИАЛКИЛАДАМАНТАНОВ | 2008 |
|
RU2409545C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИБРОМАДАМАНТАНА | 2011 |
|
RU2455275C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-БРОМАДАМАНТАНА | 2009 |
|
RU2428408C2 |
| СПОСОБ ПОЛУЧЕНИЯ НИТРИЛА 1-АДАМАНТАНКАРБОНОВОЙ КИСЛОТЫ | 2006 |
|
RU2316540C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОР-3-ЦИАНОАДАМАНТАНА | 2009 |
|
RU2434848C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИХЛОРАДАМАНТАНА | 2000 |
|
RU2178401C2 |
| СПОСОБ КАТАЛИТИЧЕСКОЙ ИЗОМЕРИЗАЦИИ ЭНДО-ТЕТРАГИДРОДИЦИКЛОПЕНТАДИЕНА В ЭКЗО-ТЕТРАГИДРОДИЦИКЛОПЕНТАДИЕН | 2000 |
|
RU2191172C2 |
| СПОСОБ ПОЛУЧЕНИЯ РАЗВЕТВЛЕННЫХ АЛКАНОВ | 2006 |
|
RU2327677C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОРАДАМАНТАНА | 2011 |
|
RU2486169C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОР-3-АЦЕТИЛ- И 1,3-ДИХЛОР-5-АЦЕТИЛАДАМАНТАНОВ | 2000 |
|
RU2197467C2 |
Использование: органическая химия. Сущность: проводят алкилирование адамантана или смеси алкиладамантанов с общим числом атомов углерода 11-20 в растворе хлористого метилена при 15-25°С в присутствии каталитической системы, представляющей собой эквимолярную смесь галогенида алюминия и галоидсодержащего промотора общей формулы AlX3·СрНrXz, где Х=Cl, Br, р=0, r=0, z=2, либо р=1, r=0, z=4, либо р=1, r=2, z=2. Конверсии адамантана 78-94%. Технический результат: создание более технологичного способа получения смесей полиалкиладамантанов и возможность получения более ценных конечных продуктов. 7 табл.
Способ получения смесей полиалкиладамантанов путем алкилирования адамантанов н-алканами в присутствии катализатора в среде хлористого метилена при 15-25°, отличающийся тем, что проводят алкилирование адамантана или смеси алкиладамантанов с общим числом атомов углерода 11-20, а в качестве катализатора используют эквимолярную смесь галогенида алюминия и галоидсодержащего промотора общей формулы AIX3·CpHrXz, где Х=Cl, Br, р=0, r=0, z=2, либо р=1, r=0, z=4, либо р=1, r=2, z=2.
| СПОСОБ ПОЛУЧЕНИЯ СМЕСИ ВЫСШИХ АЛКИЛАДАМАНТАНОВ | 1987 |
|
SU1452074A1 |
Авторы
Даты
2006-05-27—Публикация
2005-02-02—Подача