Предлагаемое изобретение относится к области органической химии, в частности к способу получения нитрила 1-адамантанкарбоновой кислоты.
Нитрил 1-адамантанкарбоновой кислоты и его производные используются для синтеза полиуретанов, которые служат основой для создания светостойких полимерных материалов, дающих волокно типа «спандекс», отличающееся прозрачностью, низкой оптической плотностью, высокой устойчивостью к УФ-облучению и повышенной гидролитической стойкостью.
Нитрил 1-адамантанкарбоновой кислоты является исходным сырьем для получения таких ценных лекарств как амантадин (симметрел), ремантадин и кемантан (Е.И.Багрий. Адамантаны. - М.: Наука, 1989, 264 с. [1]; R.C.Fort, Adamantane: The Chemistry of Diamond Molecules. N.Y.: Dekker, 1976, 385 p. [2]).
Нитрил 1-адамантанкарбоновой кислоты (2) обычно получают методами, основанными на использовании производных адамантана (1), уже содержащих такие функциональные группы, как СООН, CONH2, Cl, Br, NC и т.д.
Нитрил 1-адамантанкарбоновой кислоты с почти количественным выходом образуется перегруппировкой из изонитрила методом вакуум-флаш-пиролиза при 540°С за 30 минут (M.Meier, C.Rüchardt, Tetrahedron Letters, V.25, N 32, 3441-3444 (1984) [3]).
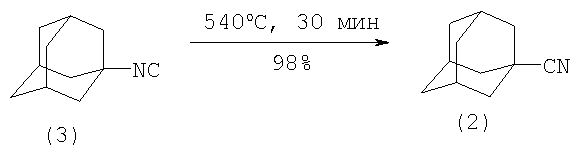
Недостатки метода:
1. Труднодоступность исходного изонитрила.
2. Высокая температура реакции.
Последовательным взаимодействием 1-оксиадамантил-3-карбоновой кислоты (4) с CH3CONH2 и Ac2O получен нитрил (1-ацетоксиадамантил-3)карбоновой кислоты (5) (Л.А.Зосим, Н.С.Верповский, А.Г.Юрченко. «Вестн. Киев. политехн. ин-та. Хим. машиностр. и технол.», №16, 3-6 (1979) [4]).

Смесь 2 г (4) и 5 г сухого ацетамида кипятят 6 ч, прибавляют 10 мл Ac2O и кипятят еще 16 ч, выливают в воду, в осадке получают (5) (выход 40%).
Недостатки метода:
1. Использование труднодоступных исходных соединений.
2. Значительная продолжительность реакции (22 ч).
3. Низкий выход целевого продукта (40%).
Из 1-бром-3-изопропиладамантил-5-карбоновой кислоты (6) последовательным действием SOCl2 и NH3 получают амид (1-бром-3-изопропиладамантил-5)карбоновой кислоты (7), обработка которого Ac2O приводит к образованию нитрила (1-бром-3-изопропиладамантил-5)карбоновой кислоты (8), превращенному действием Ag2CO3 в нитрил (1-изопропиладамантил-3)карбоновой кислоты (9) с выходом 40% [4]:

Смесь 2.6 г (6) и 4 мл SOCl2 выдерживают 16 ч, нагревают до 40°С (до полной гомогенизации раствора), отгоняют SOCl2 в вакууме при 40-45 мм рт. ст., остаток разбавляют бензолом и насыщают раствор аммиаком (NH3), через несколько часов промывают водой, сушат, фильтруют на колонке с Al2O3, после упаривания получают амид (7) с выходом 48%. Кипятят 18 ч 1 г (7) и 5 г Ac2O, упаривают в вакууме досуха, растворяют в гексане, пропускают через колонку с Al2O3, концентрированием выделяют нитрил (8) (выход 26%). Смесь 0.2 г (8), 1 г Ag2CO3, 4 мл воды и 0.5 мл ТГФ кипятят 1 час, осадок промывают эфиром, эфирный слой сушат, упаривают, из остатка на колонке с Al2O3 выделяют непрореагировавший (8) (элюент - бензол) и (9) (элюент - эфир). Выход нитрила (9) составляет 40%.
Недостатки метода:
1. Низкий выход целевого продукта.
2. Труднодоступность исходных реагентов.
3. Использование газообразного аммиака.
4. Выделение продуктов реакции на каждой стадии связано с их потерями.
5. Применение дорогостоящего Ag2CO3 на стадии дебромирования.
6. Использование агрессивного реагента SOCl2.
Несмотря на то что нитрилы адамантанового ряда известны, простейший нитрил 1-адамантанкарбоновой кислоты (2) был получен лишь в 1974 г. (Г.А.Швехгеймер, Л.К.Кузьмичева, С.С.Новиков. Изв. АН СССР. Сер. хим., №1, 144-148 (1974) [5]). Амид 1-адамантанкарбоновой кислоты (10) при кипячении с SOCl2 в бензоле почти количественно превращается в нитрил (2)
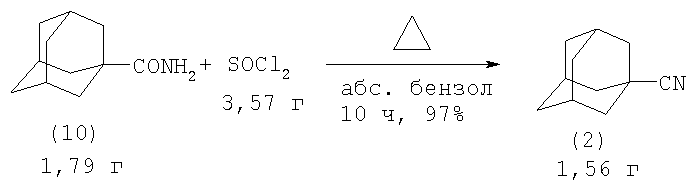
Смесь 1.70 г амида (10), 3.57 г SOCl2 и 5 мл абс. бензола кипятили 10 ч, охлаждали до ˜20°С, выливали на 25 г льда и добавляли 50%-ный раствор NaOH до слабощелочной реакции. Смесь экстрагировали эфиром, эфирный раствор промывали водой, сушили Na2SO4, растворитель удаляли в вакууме и получали 1.56 г (97%) нитрила 1-адамантанкарбоновой кислоты (2) [5].
Недостатки метода:
1. Необходимость использования абсолютированных растворителей.
2. Труднодоступность исходных реагентов.
4. Образование сточных вод, которые необходимо утилизировать, требует больших трудо- и энергозатрат.
Нитрил 1-адамантанкарбоновой кислоты получают обработкой адамантанола-1 двумя эквивалентами смеси цианид натрия-триметилхлорсилан (NaCN-Me3SiCl) и каталитическим количеством NaJ в растворе диметилформамида и ацетонитрила (ДМФА-CH3CN) (R.Davis, K.G.Untch. J. Org. Chem. V.46, N 14, 2985-2987 (1984) [6]).
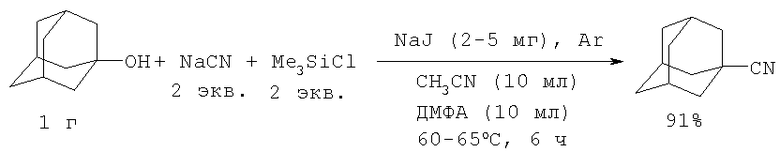
Недостатки метода:
1. Использование цианида натрия, являющегося сильнодействующим ядовитым веществом.
2. Образование большого количества неорганических отходов.
3. Использование избытка Me3SiCl, необходимость его удаления.
В работе (G.A.Olah, O.Farooq, G.K.S.Prakash, Synthesis (BRD), N 12, 1140-1142 (1985) [7]) описан одностадийный синтез 1-цианадамантана реакцией 1-хлор-(1-бром)адамантана с триметилсилилцианидом, катализируемой кислотой Льюиса. В качестве катализаторов использовались ZnCl4 или AlBr3.
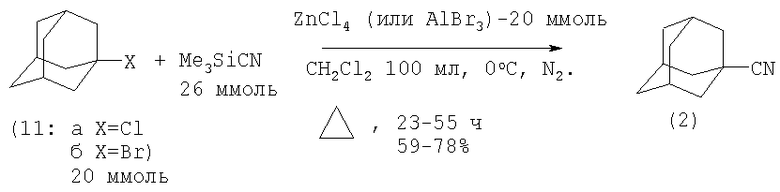
К раствору 20 ммолей (11) в 100 мл CH2Cl2 при 0°С в токе N2 прибавляют 20 ммолей AlBr3 или ZnCl4, затем при 0°С добавляют раствор 26 ммолей Me3SiCl в 20 мл CH2Cl2, смесь нагревают до 20°С, кипятят, выливают в ледяную воду, подкисляют 1 н. HCl, экстрагируют CH2Cl2, хроматографируют на колонке с Al2O3 (элюент - петролейный эфир), очищают перегонкой и возгонкой [7].
На основании сходства по трем признакам (исходный реагент - 1-бромадамантан, использование катализатора, образование в результате реакции нитрила 1-адамантанкарбоновой кислоты) за прототип взят метод синтеза нитрила 1-адамантанкарбоновой кислоты из галоидадамантанов и триметилсилилцианида, катализируемый кислотой Льюиса [7].
Прототип имеет следующие недостатки:
1. Умеренный выход целевого продукта.
2. Труднодоступность исходных реагентов.
3. Необходимость проведения реакции при низкой температуре (0°С).
4. Длительность процесса (23-55 часов).
5. Сложности в процессе выделения нитрила 1-адамантанкарбоновой кислоты из-за образования побочных продуктов.
6. Большой расход катализаторов - AlBr3, ZnCl4, которые используются в стехиометрических количествах относительно галогенидов адамантана.
7. Высокая токсичность триметилсилилцианида, которая усугубляется тем, что он легко гидролизуется водой с образованием синильной кислоты.
Авторами предлагается способ получения нитрила 1-адамантанкарбоновой кислоты, не имеющий указанных недостатков.
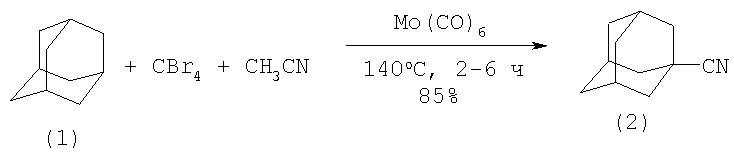
Сущность способа заключается в цианировании (нитрилировании) адамантана ацетонитрилом (который играет роль реагента и растворителя одновременно) под действием гексакарбонила молибдена [Мо(CO)6] в присутствии CBr4 при температуре 140°С в течение 2-6 часов, при мольном соотношении [Mo(CO)6]:[AdH]:[CBr4]:[CH3CN]=1:50÷100:50÷100:2000, предпочтительно 1:100:100:2000.
В оптимальных условиях при полной конверсии адамантана выход нитрила 1-адамантанкарбоновой кислоты достигает 85%, кроме нитрила (2) в реакционной смеси содержится 1-бромадамантан. В отсутствие CBr4 реакция нитрилирования не идет.
Существенные отличия предлагаемого способа от прототипа.
1. Для получения нитрила 1-адамантанкарбоновой кислоты используется гомогенный молибденсодержащий катализатор - Мо(СО)6 в концентрации 1%, катализирующий однореакторный процесс бромирования адамантана с помощью CBr4 и нитрилирования образующегося in situ 1-бромадамантана.
Преимущества предлагаемого метода.
1. Высокий выход целевого продукта.
2. Уменьшение продолжительности реакции (2-6 часов).
3. Селективность процесса.
4. Удешевление себестоимости и упрощение технологии в целом за счет уменьшения энерго- и трудозатрат.
Предлагаемый способ поясняется примерами.
ПРИМЕР 1. Реакции проводили в стеклянных ампулах (V=20 мл) или микроавтоклаве из нержавеющей стали (V=17 мл).
В микроавтоклав (ампулу) под аргоном помещали 0.1 ммоль Мо(СО)6, 10 ммоль адамантана, 5-10 ммоль CBr4 и 200 ммоль ацетонитрила, автоклав герметично закрывали (ампулу запаивали) и нагревали при 140°С в течение 2-6 часов. После окончания реакции микроавтоклав (ампулу) охлаждали до ˜20°С, вскрывали, реакционную массу фильтровали через слой силикагеля (2 г), непрореагировавший ацетонитрил отгоняли, остаток растворяли в дихлорметане и хроматографировали на колонке, заполненной оксидом алюминия II степени активности, элюируя смесью дихлорметан-гексан, 1:1 по объему. Основная фракция, после удаления растворителя, представляла собой кристаллы белого цвета с т.пл. 193-194°С, идентичные нитрилу (2) (выход 85%). Вторая фракция (элюент - дихлорметан) содержит 1-бромадамантан (выход 10-15%).
Выделенный нитрил 1-адамантанкарбоновой кислоты (2) имел следующие свойства: ИК-спектр (ν, см-1): 2250 (C≡N). Спектр ЯМР 1Н (CDCl3, б, м.д.): 1.75 (т, 6Н, 3СН2), 2.05 (м, 3Н, 3СН), 1.60 (т, 6Н, 3СН2). Спектр ЯМР 13С (CDCl3, б, м.д.): 29.51 (С-1), 39.20 (С-2, С-8, С-9), 26.43 (С-3, С-5, С-7), 35.07 (С-4, С-6, С-10), 124.33 (C≡N). Масс спектр, m/z (Jотн (%)): [М]+ отсут., 39(12), 41(12), 53(5), 55(5), 65(5), 67(10), 77(10), 79(21), 81(7), 91(7), 93(17), 97(7), 135(100). Найдено (%): С 82.01; Н 9.37; N 8.62. C11H15N. Вычислено (%): С 81.93; Н 9.38; N 8.69.
Другие примеры, подтверждающие способ, приведены в таблице 1.
Таблица 1
Синтез нитрила 1-адамантанкарбоновой кислоты из адамантана с помощью CBr4 и CH3CN под действием Мо(СО)6
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 1-БРОМАДАМАНТАНА | 2009 |
|
RU2428408C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИБРОМАДАМАНТАНА | 2011 |
|
RU2455275C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АЦЕТИЛАДАМАНТАНА | 2008 |
|
RU2408571C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-(1-АДАМАНТИЛ)АЦЕТАМИДА | 2008 |
|
RU2401828C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-(1-АДАМАНТИЛ)АЦЕТАМИДА | 2011 |
|
RU2455280C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОРАДАМАНТИЛ-3-ФОРМАМИДА (АМИДА 1-ХЛОРАДАМАНТИЛ-3-КАРБОНОВОЙ КИСЛОТЫ) | 2010 |
|
RU2455282C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АЦЕТИЛАДАМАНТАНА | 2008 |
|
RU2440326C2 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТАНОЛА-1 | 2005 |
|
RU2286332C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТАНОЛА-1 | 2010 |
|
RU2448942C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ГИДРОКСИАДАМАНТАН-4-ОНА (КЕМАНТАНА) | 2012 |
|
RU2507191C1 |
Изобретение относится к способу получения нитрила 1-адамантанкарбоновой кислоты общей формулы
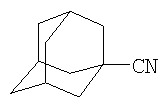
который заключается в том, что адамантан подвергают взаимодействию с ацетонитрилом в присутствии CBr4 под действием молибденсодержащего катализатора Мо(СО)6 при следующем мольном соотношении реагентов [Mo(CO)6]:[AdH]:[CBr4]:[CH3CN]=1:50÷100:50÷100:2000, при температуре 140°С в течение 2-6 ч. Способ позволяет получить целевой продукт с высоким выходом в оптимальных условиях. 1 табл.
Способ получения нитрила 1-адамантанкарбоновой кислоты общей формулы
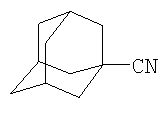
каталитическим транс-нитрилированием адамантана, отличающийся тем, что адамантан подвергают взаимодействию с ацетонитрилом в присутствии CBr4 под действием молибденсодержащего катализатора Мо(СО)6 при следующем мольном соотношении реагентов [Mo(CO)6]:[AdH]:[CBr4]:[CH3CN]=1:50÷100:50÷100:2000, при температуре 140°С в течение 2-6 ч.
| G.A.OLAH ЕТ AL., Lewis Acid-Catalyzed Preparation of Bridge-head Adamantanoid Nitriles from their Corresponding Halides and Trimethylsilyl Cyanide, SYNTHESIS, 1985, № 12, p.p.1140-1142 | |||
| R.DAVIS ET AL., Direct One-Step Conversion of Alcohols into Nitriles, J | |||
| ORG | |||
| CHEM., 1981, v.46, № 14, pp.2985-2987 | |||
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ НИТРИЛОВ | 2003 |
|
RU2240310C1 |
Авторы
Даты
2008-02-10—Публикация
2006-10-02—Подача