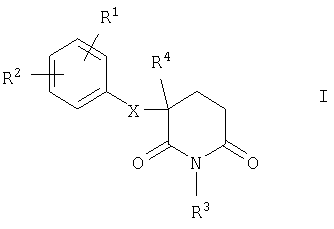
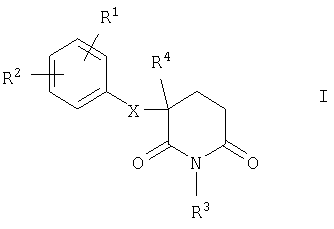
Настоящее изобретение относится к замещенным глутаримидам общей формулы I
к их получению, а также к их применению в лекарственных средствах.
В основе аутоиммунных заболеваний лежит реакция иммунной системы по отношению к гомологичным структурам. При этом исчезает обычно существующая толерантность по отношению к гомологичной ткани. При патогенезе различных аутоиммунных заболеваний наряду с антителами решающую роль играют прежде всего Т-лимфоциты и моноциты/макрофаги. Активированные моноциты/макрофаги выделяют множество различных способствующих воспалительным процессам медиаторов, прямо либо косвенно ответственных за разрушение пораженной аутоиммунным заболеванием ткани. Активация моноцитов/макрофагов происходит либо во взаимодействии с Т-лимфоцитами, либо через бактериальные продукты, такие как липополисахарид (ЛПС).
IL-12 представляет собой гетеродимерную молекулу, состоящую из ковалентно связанной р35 и р40-цепи. Эта молекула образуется антигенпредставляющими клетками (моноцитами/макрофагами, дендритными клетками, В-лимфоцитами). Образование IL-12 моноцитами/макрофагами инициируется либо различными микробными продуктами, такими как ЛПС, липопептиды, бактериальная ДНК, либо во взаимодействии с активированными Т-лимфоцитами (Trinchieri, Ann. Rev. Immunol. 13, с.251 (1995)). IL-12 играет ключевую роль в иммунорегуляции и ответственен за возникновение способствующих воспалительным процессам ТН1-иммунных реакций. Такая ТН1-иммунная реакция по отношению к собственным антигенам является причиной целого ряда тяжелых заболеваний.
Значение способствующих воспалениям цитокинов, таких как IL-12, для возникновения и течения воспалительных процессов и аутоиммунных заболеваний однозначно подтверждается результатами проведенных на животных экспериментов и первых клинических испытаний. В проводившихся на моделях животных исследованиях таких заболеваний, как ревматоидный артрит, множественный склероз, сахарный диабет, а также воспалительные заболевания кишечника, кожи и слизистых оболочек, была выявлена роль IL-12 в патофизиологии (Trembleau и др., Immunol. Today 16, с.383 (1995); Müller и др., J. Immunol. 155, с.4661 (1995); Neurath и др., J. Exp. Med. 182, стр.1281 (1995); Segal и др., J. Exp. Med. 187, с.537 (1998); Powrie и др., Immunity 3, с.171 (1995); Rudolphi и др., Eur. J. Immunol. 26, с.1156 (1996); Bregenholt и др., Eur. J. Immunol. 28, с.379 (1998)). Введением IL-12 удавалось инициировать соответствующую болезнь, а в случае нейтрализации эндогенного IL-12 наблюдалось ослабленное течение болезни вплоть до полного выздоровления животных. Что касается применения антител к IL-12 на человеке, то такие исследования предстоит еще проводить.
Резюмируя вышесказанное, можно отметить, что избыток IL-12 обусловливает патофизиологию многих воспалительных заболеваний. Поэтому работы по нормализации уровня IL-12 представляют большой терапевтический потенциал.
Кроме того, IL-12 участвует также в регуляции выживаемости клеток. Неконтролируемый рост клеток регулируется, в частности, апоптозом (запрограммированная гибель клеток). На Т-лимфоцитах было выявлено, что IL-12 обладает антиапоптозным действием и способствует выживаемости Т-клеток (Clerici и др., Ргос.Natl. Acad. Sci. USA 91, с.11811 (1994); Estaquier и др., Journ. Exp. Med. 182, с.1759 (1995)). Локальное сверхпродуцирование IL-12 может поэтому способствовать выживаемости раковых клеток. Следовательно, ингибиторы образования IL-12 обладают высоким терапевтическим потенциалом.
В заявке DE 19843793.5 описаны замещенные бензамиды с иммуномодуляторными свойствами, в которых циклосодержащие структурные фрагменты молекулы связаны между собой амидной связью. Недостаток амидной связи состоит в подверженности гидролизу при одновременной утрате соединением его активности.
С учетом вышеизложенного в основу настоящего изобретения была положена задача получить новые иммуномодуляторы, которые могли бы применяться для лечения и/или профилактики заболеваний, обусловленных образованием способствующего воспалительным процессам цитокина IL-12, и которые вместе с тем обладали бы повышенной устойчивостью к гидролизу.
Этим предъявляемым к создаваемым веществам требованиям отвечают определенные замещенные глутаримиды.
Объектом настоящего изобретения в соответствии с этим являются замещенные глутаримиды формулы I

в которой
Х обозначает группу формулы (CH2)n-(CR8R9)p-Z-(CR8R9)m, где
Z обозначает атом серы или кислорода, SO или SO2-группу, остаток NR8 (необязательно в виде N-оксида) или CR8R9-группу,
m и р обозначают 0 или 1,
n обозначает 0, 1, 2 или 3, при этом
m, n и р не могут одновременно обозначать 0,
R1 и R2 имеют идентичные либо разные значения и обозначают карбоксильную группу, сложноэфирную группу формулы COOR5 или ацильную группу формулы COR5, в которых R5 обозначает соответственно алкильную группу (прямоцепочечную либо разветвленную) с 1-6 С-атомами (необязательно замещенную COOR5 -группой и/или фенильной группой), С3-С7циклоалкильную группу или фенил либо бензил, или обозначают амидную группу формулы CONR6R7, в которой R6 и R7 имеют идентичные либо разные значения и представляют собой водород, алкильную группу (прямоцепочечную либо разветвленную) с 1-6 С-атомами (необязательно замещенную COOR5 -группой и/или фенильной группой), аллил, фенил или вместе с N-атомом образуют гидразидную группу, пирролидиновое, пиперидиновое, гексаметилениминовое, морфолиновое, тиоморфолиновое, пиперазиновое или N-метилпиперазиновое кольцо, или обозначают водород, бром, хлор, фтор, моно-, ди- либо трифторметильную, тритильную, гидрокси-, гидроксиметильную, трифторметокси-, нитро-, амино- (необязательно замещенную СН(=O)- или COR5- либо алкилсульфонильной группой) или диметиламиногруппу, алкильную или алкоксигруппу (прямоцепочечную либо разветвленную) с 1-6 С-атомами, амидиновую группу формулы NH-CH(=NH) или NH-C(=NH)R5, фенильную группу или сконденсированное бензольное кольцо (соответственно необязательно замещенное вышеуказанными атомами либо группами), за исключением тех случаев, когда Z обозначает CR8R9, R1 и R2 не могут одновременно представлять собой водород, и когда Z обозначает S, а m обозначает 0, не могут представлять собой метоксигруппу,
R3 обозначает водород, гидроксигруппу или группу формулы CH2-NR6R7, в которой R6 и R7 имеют указанные выше значения,
R4 обозначает водород, C1-С3 алкильную группу, атом фтора, дифтор- либо трифторметильную группу,
R8 обозначает водород, алкильную группу с 1-4 С-атомами (прямоцепочечную либо разветвленную), бензил или фенетил (необязательно замещенный вышеуказанными атомами либо группами), и
R9 имеет те же значения, что и R8, или обозначает сложноэфирную группу формулы COOR5, фенильную, гидрокси- или алкоксигруппу (прямоцепочечную либо разветвленную) с 1-4 С-атомами, атом фтора либо хрома или трифторметильную группу,
и их энантиомеры, смеси энантиомеров, рацематы, диастереомеры или смеси диастереоизомеров в виде их оснований или солей физиологически приемлемых кислот.
К предпочтительным относятся такие соединения по изобретению, в которых Х обозначает группы CH2-N и S-CH2, R1 обозначает карбоксильную группу, сложноэфирную группу указанной выше формулы COOR5, ацильную группу указанной выше формулы COR5 или амидную группу формулы CONR6R7, в которой R6 и R7 имеют идентичные либо разные значения и представляют собой водород, алкильную группу (прямоцепочечную либо разветвленную) с 1-6 С-атомами (необязательно замещенную, как указано выше), фенильную группу или вместе с N-атомом образуют гидразидную группу, пирролидиновое или морфолиновое кольцо, R2 обозначает водород, нитро- или аминогруппу, R3 обозначает водород, а R4 обозначает водород, метил или фтор.
Особенно предпочтительными являются следующие замещенные глутаримиды:
2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензойная кислота,
2[(3R)-(2,6-диоксопиперидин-3-иламино)метил]бензойная кислота,
2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]-N,N-диэтилбензамид,
(3S)-[2-морфолин-4-карбонил)бензиламино]пиперидин-2,6-дион,
метиловый эфир {2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензоиламино}уксусной кислоты,
2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензамид,
2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]-N-этилбензамид,
(3S)-[2-пирролидин-1-карбонил)бензиламино]пиперидин-2,6-дион,
гидразид 2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензойной кислоты,
2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]-N-фенилбензамид,
2-[(3R)-(2,6-диоксопиперидин-3-иламино)метил]-N-фенилбензамид,
2-[(3R)-(2,6-диоксопиперидин-3-иламино)метил]-N,N-диэтилбензамид,
2-[(3R)-(2,6-диоксопиперидин-3-иламино)метил]бензамид,
метиловый эфир 2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензойной кислоты,
бензиловый эфир 2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензойной кислоты,
метиловый эфир 2-(2,6-диоксопиперидин-3-илметилсульфанил)бензойной кислоты,
метиловый эфир 2-(2,6-диоксопиперидин-3-илметилсульфанил)-6-нитробензойной кислоты.
Еще одним объектом настоящего изобретения являются способы получения предлагаемых соединений общей формулы I.
Соединения общей формулы I, в которой R3 обозначает водород или гидроксигруппу, можно получать циклизацией производных глутаровой кислоты общей формулы II
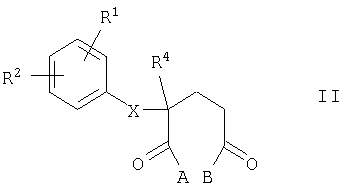
в которой X, R1, R2 и R4 имеют указанные выше значения, А представляет собой ОН, а В представляет собой NH2 или NHOH либо, наоборот, А имеет значения В, а В имеет значение А, в присутствии активирующих реагентов, таких, например, как карбонилдиимидазол. Если в соединении формулы I указанный при раскрытии значений Х радикал Z обозначает NH-группу, то циклизацию (замыкание цикла) предпочтительно проводить с помощью соединений формулы II, в которых NH-функция представлена в защищенном виде, например, с использованием в этих целях бензилоксикарбонильной группы, которую затем, например, с помощью раствора бромистого водорода в уксусной кислоте отщепляют при температурах в интервале от 20 до 40°С.
Если же А и В в формуле II представляют собой ОН, то сначала путем нагрева в уксусном ангидриде осуществляют циклизацию с образованием циклического ангидрида, из которого затем путем нагрева с мочевиной или каким-либо иным источником азота получают соединение формулы I, где R обозначает Н. Из этого соединения взаимодействием с параформальдегидом либо с водным раствором формальдегида и вторичным амином формулы HNR6R7, где R6 и R7 имеют указанные выше значения, можно получать соединения общей формулы I, в которой R3 обозначает CH2-NR6R7.
Соединения общей формулы I, где R3 обозначает Н, можно получить также из лактамов общей формулы III

в которой R1, R2, R4 и Х имеют указанные выше значения, путем окисления соединения формулы III до имида, предпочтительно с использованием в этих целях м-хлорнадбензойной кислоты или оксида рутения (IV)/периодата натрия.
В соединениях общей формулы I, в которых R1-R3 и Х имеют указанные выше значения, а R4 обозначает водород, этот водород по известным реакциям алкилирования или галогенирования может быть обменен на остальные заместители R4 в соответствии с указанными его значениями.
Если для группы Х в соединениях формулы I указано, что m обозначает 0, а Z представляет собой NR8, где R8 имеет указанные выше значения, и что n и p также имеют указанные выше значения, то названные соединения можно получать алкилированием α-аминоглутаримидов общей формулы IV
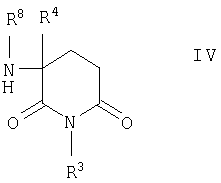
в которой R3, R4 и R5 имеют указанные выше значения, с помощью соединений общей формулы V

в которой R1, R2, R8, R9 n и р имеют указанные выше значения, a Y представляет собой атом хлора, брома либо иода или толуол-4-сульфонатную группу.
Те же соединения, в которых, кроме того, р обозначает 1, а R8 или R9 обозначают водород, можно получать также восстановительным аминированием из соединений общих формул VI и IV, в которых R1, R2, R4, R8 и n имеют указанные выше значения, а R3 обозначает водород или гидроксигруппу.


Восстановителями при этом служат предпочтительно борогидрид натрия, триацетоксиборогидрид натрия, цианоборогидрид натрия, комплекс боран-пиридин или каталитически активированный водород.
Если в группе Х соединения формулы I m обозначает 0, a Z представляет собой О, S или NR8, и при этом R8, n и р имеют указанные выше значения, то такие соединения также можно получать алкилированием соединения общей формулы VII
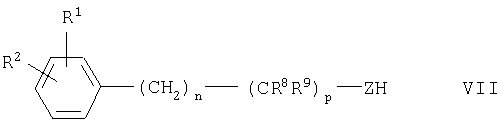
с помощью α-бромглутаримидов общей формулы VIII

в которой R3 и R4 имеют указанные выше значения.
Соединения общей формулы I, в которых R4 обозначает водород и в которых в группе Х n и р имеют указанные выше значения, m обозначает 1, Z представляет собой О, S или NR8, а в группе CR8R9 по меньшей мере один из радикалов R8 или R9 представляет собой водород, могут быть получены присоединением соединения общей формулы VII к 3-метиленглутаримиду общей формулы IX
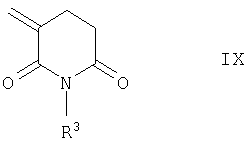
Эту реакцию целесообразно проводить в растворителях, таких как ацетонитрил или толуол, с добавлением третичных аминов, таких, например, как триэтиламин или диизопропилэтиламин, при температурах в интервале от 80 до 110°С.
В принципе из соединений формулы I, в которых R1 и/или R2 обозначают нитрогруппу, путем восстановления можно получать соединения формулы I, где R1 и/или R2 обозначают NH2. Восстановление осуществляют, например, с использованием каталитически активированного водорода в кислотосодержащих органических растворителях, таких как этиловый эфир уксусной кислоты, предпочтительно при этом применять палладиевые катализаторы. Согласно другому варианту восстановление можно осуществлять с помощью металлов, таких как олово или железо, в кислом растворе.
Если Z в группе Х представляет собой SO или SO2, то такие соединения формулы I можно получать постепенным (ступенчатым) окислением соответствующего тиоэфира (Z представляет собой S). В качестве окислителей могут использоваться пероксид водорода в уксуснокислом растворе, м-хлорнадбензойная кислота, трет-бутилгидропероксид или оксоны, при этом последние предпочтительно служат для получения сульфонов (Z представляет собой SO2). Окисление до сульфоксидов (Z представляет собой SO) можно осуществлять также асимметричным методом, в частности с использованием системы Шарплесса (Sharpless), соответственно реагента Дэвиса или с помощью ферментативных методов.
Если Z в группе Х представляет собой группу NR8, то эту последнюю можно переводить в соответствующий N-оксид, предпочтительно используя при этом в качестве окислителя пероксид водорода.
Предлагаемые в изобретении соединения обладают иммуномодуляторной активностью, которая проявляется в ингибировании продуцирования IL-12 активированными ЛПС моноцитами. Кроме того, эти соединения обладают по сравнению с уже известными соединениями более высокой устойчивостью к гидролизу. Они могут применяться для лечения и/или профилактики воспалительных и аутоиммунных заболеваний, а также онкогематологических заболеваний.
К заболеваниям названного типа относятся, в частности, дерматозы (например, атопический дерматит, псориаз, экземы), воспаления дыхательных путей (например, бронхит, пневмония, бронхиальная астма, РДСВ (респираторный дистресс-синдром взрослых), саркоидоз, силикоз/фиброз), воспаления желудочно-кишечного тракта (например, язвы двенадцатиперстной кишки, болезнь Крона, язвенный колит), а также такие заболевания, как гепатит, панкреатит, аппендицит, перитонит, нефрит, афтоз, конъюнктивит, кератит, увеит и ринит.
Понятие "аутоиммунные заболевания" включают среди прочих заболевания артритного характера (например, ревматоидный артрит, заболевания, связанные с HLA-B27 (локус антигена анкилозирующего спондилоартрита), болезнь Бехчета, а также множественный склероз, диабет в раннем возрасте или красная волчанка.
Другими показаниями к применению соединений по изобретению являются сепсис, бактериальный менингит, кахексия, реакции отторжения трансплантата, реакции "трансплантат против хозяина", а также реперфузионный синдром, атеросклероз и ангиопатии (например, дегенерация желтого пятна, диабетическая ретинопатия).
Помимо указанных, следует назвать далее гематологические заболевания, такие как множественная миелома и лейкозы, а также другие онкологические заболевания, такие, например, как глиобластома, рак предстательной железы и рак молочной железы, которые можно ингибировать снижением уровня IL-12.
Предлагаемые в изобретении лекарственные средства наряду с по меньшей мере одним соединением общей формулы I содержат в своем составе носители, наполнители, растворители, разбавители, красители и/или связующие. Выбор вспомогательных веществ, равно как и их используемые количества зависят от того, предназначается ли лекарственное средство для перорального, ректального применения, применения на глазах (интравитреально, интракамерально), назального, местного (включая буккальное и сублингвальное введение), вагинального или парентерального применения (включая подкожное, внутримышечное, внутривенное, интрадермальное, интратрахеальное и эпидуральное введение).
Для перорального введения пригодны композиции в виде таблеток, жевательных таблеток, драже, капсул, гранул, капель, настоек или сиропов; для парентерального, местного и ингаляционного применения могут назначаться растворы, суспензии, легко восстанавливаемые сухие композиции, а также аэрозоли. Лекарственными формами для применения на коже являются мази, кремы, гели и пасты. Для применения на глазах пригодны такие лекарственные формы, как капли, мази и гели. Пригодными для интрадермального введения являются композиции из предлагаемых соединений в депо-форме в растворенном виде, заделанными в пленку или в пластырь, необязательно с добавками средств, способствующих пенетрации. Из применяемых для перорального или интрадермального введения лекарственных форм соединения по изобретению могут высвобождаться постепенно, с замедлением, т.е. обладать пролонгированным действием.
Назначаемое пациентам количество активного вещества варьируют в зависимости от веса пациента, методики введения, показания к применению и степени тяжести заболевания. Обычно назначают от 1 до 150 мг/кг по меньшей мере одного соединения формулы I по изобретению.
Примеры
Ниже изобретение более подробно поясняется на примерах.
В качестве неподвижной фазы в хроматографии использовали силикагель 60 (0,040-0,063 мм) фирмы Е. Merck, Дармштадт. Соотношения в смеси элюентов указаны в объемном отношении (объем/объем). Субстанции анализировали по их температуре плавления и/или методом 1H-ЯМР-спектроскопии. Спектрограммы получали при 300 МГц с помощью прибора типа Gemini 300 фирмы Varian. Коэффициенты смещения указаны в част./млн (δ-шкала). В качестве внутреннего стандарта использовали тетраметилсилан (ТМС).
Пример 1
3-(2-хлорбензиламино)пиперидин-2,6-дион в виде гидрохлорида
Стадия 1
3-бромпиперидин-2,6-дион
10,2 г глутаримида, суспендированного в 20 мл хлороформа, смешивали с 4,5 мл брома и смесь в течение 90 мин перемешивали в закрытом сосуде при температуре ванны 110°С. После охлаждения сосуд открывали и продолжали перемешивание до тех пор, пока полностью не прекращалось выделение бромистого водорода. Затем реакционную смесь упаривали в вакууме, остаток растворяли в этаноле и повторно упаривали. В результате получили 17,1 г (99%) указанного в заголовке соединения в виде почти белых кристаллов с температурой плавления 76-83°С.
Стадия 2
3-(2-хлорбензиламино)пиперидин-2,6-дион в виде гидрохлорида
Раствор из 0,39 г полученного на стадии 1 продукта и 0,71 г 2-хлорбензиламина в 8 мл N,N-диметилформамида перемешивали при 20°С в течение 36 ч. После упаривания в вакууме маслянистый остаток растворяли в 25 мл метанола и этот раствор в течение 2 ч перемешивали с 1 г Amberlyst A-21. Затем отфильтровывали, фильтрат смешивали с 2 г силикагеля и упаривали досуха. Адсорбированное вещество подавали на хроматографическую колонку и продукт элюировали смесью этиловый эфир уксусной кислоты/циклогексан (в соотношении 1:2→1:1), содержавшей 1% триэтиламина. Образовавшийся после упаривания продуктовых фракций остаток растворяли в 10 мл метанола и раствор смешивали с 25 мл насыщенного хлористым водородом диэтилового эфира и диэтилового эфира соответственно. Выпавший в осадок гидрохлорид отделяли и перекристаллизовывали из метанола/диэтилового эфира. В результате получили 0,24 г (41% от теории) указанного в заголовке соединения в виде кристаллов с температурой плавления 217°С при разложении.
1Н-ЯМР (ДМСО-d6): 2,15-2,34 (1Н, m); 2,40-2,56 (1Н, m); 2,60-2,80 (2Н, m); 4,35 (1Н, t, J=13,5 Гц); 4,45 (2Н, d, J=13,8 Гц); 7,40-7,94 (4Н, m).
Пример 2
По методике, описанной в примере 1, стадия 2, и при использовании соответствующих бензиламинов аналогичным путем получили следующие соединения:
2.1: 3-(2-трифторметилбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: >250°С (разложение),
2.2: 3-(2,4-диметоксибензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 214°С (разложение),
2.3: 3-(2,6-дифторбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 208-215°С (разложение),
2.4: 3-(2,5-дифторбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 208°С (разложение),
2.5: 3-(3,5-дифторбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 230-236°С (разложение),
2.6: 3-[(нафт-1-илметил)амино]пиперидин-2,6-дион в виде гидрохлорида. температура плавления: 188°С (разложение),
2.7: 3-(2,3-дифторбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 206-212°С (разложение),
2.8: 3-(4-диметиламинобензиламино)пиперидин-2,6-дион в виде основания.
2.9: 3-(4-нитробензиламино)пиперидин-2,6-дион в виде гидрохлорида.
2.10: 3-(3-трифторметилбензиламино)пиперидин-2,6-дион в виде гидрохлорида.
2.11: 3-(3-трифторметоксибензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 199-201°С,
2.12: 3-[(нафт-2-илметил)амино]пиперидин-2,6-дион в виде основания, температура плавления: 120-125°С (разложение),
2.13: 3-(2-хлор-4-фторбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 241-242°С,
2.14: 3-(3-нитробензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: выше 240°С разложение,
2.15: 3-(2-хлор-6-метилбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 238-240°С,
2.16: 3-(2-метилбензиламино)пиперидин-2,6-дион в виде гидрохлорида. температура плавления: 235-240°С,
2.17: 3-(3,5-дихлорбензиламино)пиперидин-2,6-дион в виде гидрохлорида. температура плавления: 234-238°С,
2.18: 3-[3-фтор-5-(трифторметил)бензиламино]пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 241-243°С,
2.19: 3-(3-фторбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 231-235°С,
2.20: 3-(3-метилбензиламино)пиперидин-2,6-дион в виде гидрохлорида. температура плавления: 240-242°С,
2.21: 3-(4-трифторметилбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 252-255°С,
2.22: 3-[4-фтор-2-(трифторметил)бензиламино]пиперидин-2,6-дион в виде гидрохлорида, температура плавления: выше 241°С разложение,
2.23: 3-(4-фторбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 241-242°С,
2.24: 3-(4-трет-бутилбензиламино]пиперидин-2,6-дионв виде гидрохлорида, температура плавления: выше 239°С разложение,
2.25: 3-(3,5-диметилбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: выше 226°С разложение,
2.26: 3-(3-хлорбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 237-238°С,
2.27: 3-(4-метоксибензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: выше 227°С разложение,
2.28: 3-(2,4-дихлорбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 240-242°С,
2.29: 3-(2-фторбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 245-247°С,
2.30: 3-(2-бромбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 244-246°С,
2.31: 3-[2-фтор-5-(трифторметил)бензиламино]пиперидин-2,6-дион в виде гидрохлорида, температура плавления: выше 251°С разложение,
2.32: 3-(2,3-дихлорбензиламино]пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 246-248°С,
2.33: 3-(3,4-дихлорбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 252-254°С,
2.34: 3-[3,5-бис(трифторметил)бензиламино]пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 263-265°С,
2.35: 3-(3-бромбензиламино)пиперидин-2,6-дион в виде гидрохлорида. температура плавления: 229-232°С,
2.36: 3-(4-трифторметоксибензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 253-255°С,
2.37: 3-(4-хлорбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 262-265°С,
2.38: 3-(4-метилбензиламино]иперидин-2,6-дион в виде гидрохлорида, температура плавления: 256°С (разложение),
2.39: 3-(2-этоксибензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 208-212°С,
2.40: 3-(2.5-дихлорбензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 242-246°С,
2.41: 3-(3-метоксибензиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 217-219°С.
Все вышеуказанные соединения 2.1-2.41 представлены в виде рацемата.
Пример 3
3-(3-аминобензиламино)пиперидин-2,6-дион в виде гидрохлорида
0,56 г продукта из примера 2.14 в смеси из 17 мл этилового эфира уксусной кислоты и 0,85 мл 6н. соляной кислоты гидрировали при 20°С и давлении 4 бара в присутствии 0,17 г палладия на активированном угле (10% Pd). После поглощения теоретического количества водорода отфильтровывали от катализатора и фильтрат упаривали в вакууме. После перекристаллизации остатка из метанола получили 0,25 г (50% от теории) указанного в заголовке рацемического соединения в виде слегка окрашенных кристаллов с температурой плавления 236-239°С.
1H-ЯМР (ДМСО-d6): 2,05-2,20 (m, 1Н); 2,28-2,39 (m, 1H); 2,55-2,74 (m, 2H); 3,97-4,12 (q, 2H); 4,18-4,28 (m, 1H); 6,58-6,70 (m, 3Н); 7,02-7,11 (m, 1H).
Пример 4
По методике, описанной в примере 1, стадия 2, и при использовании соответствующих арилалкиламинов получили следующие соединения:
4.1: 3-фенетиламинопиперидин-2,6-дион в виде гидрохлорида, температура плавления: выше 220°С разложение,
4.2: 3-[2-(2-хлорфенил)этиламино]пиперидин-2,6-дион в виде гидрохлорида, температура плавления: 230°С (разложение),
4.3: 3-(4-фенилбутиламино)пиперидин-2,6-дион в виде гидрохлорида, температура плавления: выше 231°С разложение,
4.4: 3-(N-бензил-N-метиламино)пиперидин-2,6-дион в виде основания, температура плавления: 95-115°С,
4.5: 3-(метилнафт-1-илметиламино)пиперидин-2,6-дион в виде основания, температура плавления: 157-162°С.
Все вышеуказанные соединения 4.1-4.5 представлены в рацемической форме.
4.6: Метиловый эфир (2S)-[(3S)-или(3R-(2,6-диоксопиперидин-3-иламино)]фенилуксусной кислоты в виде гидрохлорида, температура плавления: 200-207°С,
4.7: метиловый эфир (2R-[(3S)-или(3R-(2,6-диоксопиперидин-3-иламино)] фенилуксусной кислоты в виде гидрохлорида, температура плавления: 171-177°С (разложение),
4.8: метиловый эфир (2S)-[(3R,S)-(2,6-диоксопиперидин-3-иламино)]-3-фенилпропионовой кислоты в виде гидрохлорида (смесь диастереомеров), температура плавления: 146-150°С (разложение).
Пример 5
3-бензиламинопиперидин-2,6-дион
А) Раствор из 0,50 г 3-аминопиперидин-2,6-диона [К. Fickentscher, Arch. Pharm. 307, стр.840-844 (1974)], 1,5 мл триэтиламина и 0,4 мл бензилбромида перемешивали в течение 20 ч при 20°С. Затем смесь упаривали, остаток растворяли в 50 мл водного раствора карбоната калия (10%-ного К2СО3) и раствор дважды экстрагировали этиловым эфиром уксусной кислоты порциями по 40 мл. Органические фазы промывали соответственно дистиллированной водой и насыщенным раствором хлорида натрия порциями по 50 мл, сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали посредством экспресс-хроматографии на силикагеле с использованием содержавшей 1% триэтиламина смеси этиловый эфир уксусной кислоты/циклогексан (в соотношении 2:1) в качестве элюента, получив в результате 0,21 г (26% от теории) указанного в заголовке соединения в виде вязкого масла.
Указанное в заголовке соединение в форме гидробромида в виде чистого S-энантиомера получали также следующим путем.
Б) Стадия 1
(2S)-(N-бензил-N-бензилоксикарбониламино)-4-карбамоилмасляная кислота
0,95 г (2S)-бензиламино-4-карбамоилмасляной кислоты [Е. Davidov и др., Isr. Journ. Chem. 7, стр.487-489 (1969)], растворенной в 4 мл 2-молярного водного раствора гидроксида натрия и 8 мл 1-молярного раствора гидрокарбоната натрия, при 20°С смешивали по каплям в течение 2,5 ч при перемешивании с 0,6 мл бензилового эфира хлормуравьиной кислоты. Затем дважды экстрагировали диэтиловым эфиром порциями по 20 мл. Водную фазу подкисляли концентрированной соляной кислотой до рН 2-3 и дважды экстрагировали этиловым эфиром уксусной кислоты порциями по 30 мл. Экстракты промывали дистиллированной водой, сушили над сульфатом натрия и упаривали в вакууме. После смешения маслянистого остатка с диэтиловым эфиром получили 0,55 г (37% от теории) указанного в заголовке соединения в виде бесцветных кристаллов с температурой плавления 98-99°С.
Стадия 2
(3S)-(N-бутил-N-бензилоксикарбониламино)пиперидин-2,6-дион
К раствору из 0,37 г продукта из стадии 1 в 2,5 мл сухого тетрагидрофурана по каплям добавляли раствор из 0,162 г N,N′-карбонилдиимидазола в 3 мл сухого тетрагидрофурана. Далее сначала в течение 3,5 ч нагревали с обратным холодильником, а затем еще в течение 3 ч при 20°С. Образовавшееся после выпаривания в вакууме растворителя масло растворяли в этиловом эфире уксусной кислоты и раствор последовательно промывали порциями по 20 мл 1-молярного водного раствора гидрокарбоната натрия, насыщенного раствора хлорида натрия и дистиллированной воды. Затем сушили над сульфатом натрия и упаривали в вакууме. В результате получили 0,23 г (65% от теории) указанного в заголовке соединения в виде кристаллов с температурой плавления 51-52°С.
Стадия 3
(3S)-бензиламинопиперидин-2,6-дион в виде гидробромида
Раствор из 0,15 г продукта из стадии 2 в 3 мл раствора бромистого водорода в уксусной кислоте (33% HBr) перемешивали в течение 1 ч при 20°С. Затем реакционную смесь сливали на 50 мл диэтилового эфира. Образующийся при этом осадок отделяли, промывали диэтиловым эфиром и сушили в вакууме. Таким путем получили 0,08 г (63% от теории) указанного в заголовке соединения в виде кристаллов с температурой плавления 228-230°С при разложении.
1Н-ЯМР (ДМСО-d6): 2,01-2,43 (m, 2H); 2,60-2,80 (m, 2H); 4,20-4,45 (m, 3H); 7,40-7,60 (m, 5H).
Пример 6
6.1: 2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензойная кислота в виде гидробромида
Стадия 1
2-[(1S)-(3-карбамоил-1-карбоксипропиламино)метил]бензойная кислота
К раствору из 1,46 г L-глутамина в 5 мл 2-молярного водного раствора гидроксида натрия добавляли суспензию из 1,65 г 2-формилбензойной кислоты в 5 мл этанола и 5 мл 2-молярного раствора гидроксида натрия. После 1-часового перемешивания смеси при 20°С ее охлаждали до 0°С и при интенсивном перемешивании порциями смешивали в течение 15 мин с 0,25 г борогидрида натрия. По истечении 90 мин добавляли еще 0,33 г 2-формилбензойной кислоты и 0,05 г борогидрида натрия. После 16-часового перемешивания при 20°С реакционную смесь подкисляли концентрированной соляной кислотой до рН 2 и охлаждали до 0°С. Образовавшийся осадок отделяли, промывали ацетоном и сушили в вакууме. В результате получили 0,87 г (31% от теории) указанного в заголовке соединения в виде кристаллов с температурой плавления 132-133°С.
Стадия 2
2-{(1S)-[N-бензилоксикарбонил-N-(3-карбамоил-1-карбоксипропил)амино]метил}бензойная кислота
По описанной в примере 5Б, стадия 1, методике из полученного на стадии 1 продукта аналогичным путем получили указанное в заголовке соединение в виде кристаллов с температурой плавления 103-104°С при разложении.
Стадия 3
2-{(3S)-[N-бензилоксикарбонил-N-(2,6-диоксопиперидин-3-ил)амино]метил}бензойная кислота
По описанной в примере 5Б, стадия 2, методике из продукта из стадии 2 аналогичным путем получили указанное в заголовке соединение в виде кристаллов с температурой плавления 71-73°С.
Стадия 4
2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензойная кислота в виде гидробромида
По описанной в примере 5Б, стадия 3, методике из продукта из стадии 3 аналогичным путем получили указанное в заголовке соединение в виде почти бесцветных кристаллов с температурой плавления 158-161°С.
1Н-ЯМР (ДМСО-d6): 2,00-2,25 (m, 1Н); 2,35-2,95 (m, 1H); 2,60-2,80 (m, 2H); 4,35-4,50 (m, 1H); 4,50-4,70 (m, 2H); 7,50-7,75 (m, ЗН); 8,00-8,10 (m, 1H).
6.2: 2-[(3R)-(2,6-диоксопиперидин-3-иламино)метил]бензойная кислота в виде гидробромида
Заменив L-глутамин в примере 6.1 на D-глутамин и используя описанную в примере 6.1, стадия 1, методику, аналогичным путем получили указанное в заголовке соединение в виде кристаллов с температурой плавления 148-152°С.
Пример 7
2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]-N,N-диэтилбензамид в виде гидробромида
Стадия 1
(3S)-[N-(2-диэтилкарбамоилбензил)-N-бензилоксикарбонил]амино-пиперидин-2,6-дион
Раствор из 1,00 г продукта из примера 6.1, стадия 3, 0,27 г N-метилморфолина и 0,46 г 2-хлор-4,6-диметокси-1,3,5-триазина в 7 мл сухого тетрагидрофурана перемешивали в течение 1 ч при 20°С. После добавления 0,19 г диэтиламина перемешивание продолжали еще в течение 7 ч. Затем путем разбавления хлороформом объем смеси доводили до 50 мл и последовательно промывали 25 мл 0,05 н. соляной кислоты, 25 мл 1-молярного водного раствора гидрокарбоната натрия и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом натрия и упаривали в вакууме. После очистки остатка с помощью экспресс-хроматографии на силикагеле с использованием этилового эфира уксусной кислоты и циклогексана (в соотношении 9:1) в качестве элюентов получили 0,36 г (32% от теории) указанного в заголовке соединения в виде кристаллов с температурой плавления 65-66°С.
Стадия 2
2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]-N,N-диэтилбензамид в виде гидробромида
0,30 г продукта из стадии 1 подвергали аналогично тому, как это описано выше в примере 5Б, стадия 3, взаимодействию с 3 мл раствора бромистого водорода в уксусной кислоте (33% HBr). После также аналогичной переработки и очистки путем перекристаллизации из метанола/диэтилового эфира получили 0,175 г (66% от теории) указанного в заголовке соединения в виде кристаллов с температурой плавления 119-120°С.
1Н-ЯМР (ДМСО-d6): 1,06 (t, J=7,5 Гц, 3Н); 1,21 (t, J=6,9 Гц, 3Н); 2,04-2,24 (m, 1H); 2,28-2,46 (m, 2H); 2,58-2,80 (m, 2H); 3,19 (dd, 2H); 3,51 (dd, 2H); 4,24 (s, 2H); 4,25-4,40 (m, 1H); 7,44 (d, 1H); 7,48-7,66 (m, 2H); 7,72 (d, 1H).
Пример 8
Заменив диэтиламин в примере 7, стадия 1, на другие амины, аммиак или гидразин, и используя описанную далее в примере 7 методику, аналогичным путем получили следующие соединения:
8.1: (3S)-[2-морфолин-4-карбонил)бензиламино]пиперидин-2,6-дион в виде гидробромида, температура плавления: 133-135°С,
8.2: метиловый эфир {2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]-бензоиламино} уксусной кислоты в виде гидробромида, температура плавления: 121-123°С,
8.3: 2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензамид в виде гидробромида, температура плавления: 155-156°С (разложение)
8.4: 2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]-N-этилбензамидв виде гидробромида, температура плавления: 144-146°С,
8.5: (3S)-[2-пирролидин-1-карбонил)бензиламино]пиперидин-2,6-дион в виде гидробромида, температура плавления: 136-138°С,
8.6: гидразид 2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензойной кислоты в виде гидробромида, температура плавления: 241-242°С,
8.7: 2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]-N-фенилбензамид в виде гидробромида, температура плавления: 136-138°С,
8.8: метиловый эфир (2R)-{(3S)-2-[(2,6-диоксопиперидин-3-иламино)метил]-бензоиламино}фенилуксусной кислоты в виде гидробромида, температура плавления: 149-151°С,
8.9: метиловый эфир (2S)-{(3S)-2-[(2,6-диоксопиперидин-3-иламино)метил]бензоиламино}фенилуксусной кислоты в виде гидробромида, температура плавления: 181-182°С,
8.10: 2-[(3R)-(2,6-диоксопиперидин-3-иламино)метил-N-фенилбензамид в виде гидробромида, температура плавления: 168-171°С,
8.11: 2-[(3R-(2,6-диоксопиперидин-3-иламино)метил]-N,N-диэтилбензамид в виде гидробромида, температура плавления: 128-132°С,
8.12: 2-[(3R-(2,6-диоксопиперидин-3-иламино)метил]бензамид в виде гидробромида, температура плавления: 232-233°С.
Пример 9
9.1: Метиловый эфир 2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензойной кислоты в виде гидробромида
Стадия 1
Метиловый эфир 2-{(3S)-[N-бензилоксикарбонил-N-(2,6-диоксопиперидин-3-ил)амино]метил}бензойной кислоты
Смесь из 0,60 г продукта из примера 6.1, стадия 3, и 0,25 г N,N'-карбонилдиимидазола в 5 мл сухого тетрагидрофурана перемешивали в течение 1,5 ч при 20°С. Затем к смеси добавляли 64 мкл метанола и перемешивание продолжали еще в течение 40 ч при 20°С. После выпаривания растворителя в вакууме остаток растворяли в 80 мл хлороформа и раствор промывали 1-молярным раствором гидрокарбоната натрия и дистиллированной водой. Далее сушили над сульфатом натрия и концентрировали в вакууме. После очистки остатка с помощью колоночной хроматографии на силикагеле с использованием хлороформа и ацетона (в соотношении 94:6) в качестве элюентов получили 0,32 г (51% от теории) указанного в заголовке соединения в виде вязкого масла.
Стадия 2
Метиловый эфир 2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензойной кислоты в виде гидробромида
За счет отщепления бензилоксикарбонильной защитной группы в продукте стадии 1 по описанной в примере 5Б, стадия 3, методике аналогичным путем получили указанное в заголовке соединение в виде кристаллов с температурой плавления 187°С.
1Н-ЯМР (ДМСО-d6): 2,07-2,30 (m, 1Н); 2,30-2,48 (m, 1H); 2,60-2,85 (m, 2H); 3,90 (s, 3Н); 4,40-4,70 (m, 3H); 7,58-7,78 (m, 3Н); 8,05 (d, J=8 Гц, 1H).
9.2: Бензиловый эфир 2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензойной кислоты
Заменив метанол в примере 9.1 на бензиловый спирт и используя описанную в этом примере методику, аналогичным путем получили указанное в заголовке соединение в виде белых кристаллов с температурой плавления 175-177°С.
Пример 10
3-фениламинометилпиперидин-2,6-дион
Раствор из 1,25 г 3-метиленпиперидин-2,6-диона [M.J.Wanner и G.-J.Koomen, Tetrahedron Lett. 33, стр.1513-1516 (1992)] в 100 мл ацетонитрила смешивали с 30 мл абсолютного триэтиламина и 2,75 мл свежедистиллированного анилина и смесь перемешивали в течение 16 ч при 80°С. После охлаждения добавляли 10 г силикагеля и концентрировали в вакууме. Остаток очищали экспресс-хроматографией на силикагеле с использованием трет-бутилметилового эфира и циклогексана (в соотношении 2:1) в качестве элюентов. В результате получили 1,87 г (86% от теории) указанного в заголовке соединения в виде кристаллов с температурой плавления 137°С.
1H-ЯМР (CDCl3): 1,84-1,99 (m, 1H); 2,08-2,17 (m, 1H); 2,49-2,64 (m, 1H); 2.73-2,83 (m, 2H); 3,41-3,50 (m, 1H); 3,60-3,70 (m, 1H); 6,64-6,80 (m, 3H); 7,17-7,29 (m, 2H).
Пример 11
Заменив анилин в примере 10 на другие амины и используя описанную в этом примере методику, при необязательном применении вместо системы растворителей ацетонитрил/триэтиламин смеси толуол/диизопропилэтиламин при температуре реакции 110°С, аналогичным путем получили следующие соединения:
11.1: 3-[(4-бромфениламино)метил]пиперидин-2,6-дион, температура плавления 149-150°С,
11.2: 3-[(3-трифторметилфениламино)метил]пиперидин-2,6-дион, температура плавления: 135-138°С,
11.3: 3-(нафт-1-иламинометил)пиперидин-2,6-дион, температура плавления: 145-148°С,
11.4: 3-(бифенил-4-иламинометил)пиперидин-2,6-дион, температура плавления: 135-138°С,
11.5: 3-[(3-метоксифениламино)метил]пиперидин-2,6-дион, вязкий продукт,
11.6: 3-[(4-тритилфениламино)метил]пиперидин-2,6-дион, температура плавления: 221-225°С,
11.7: этиловый эфир 3-[(2,6-диоксопиперидин-3-илметил)амино]бензойной кислоты, вязкий продукт,
11.8: 3-(бензиламинометил)пиперидин-2,6-дион, вязкий продукт,
11.9: 3-[(3-ацетилфениламино)метил]пиперидин-2,6-дион, температура плавления: 129-132°С,
11.10: 3-[(N-метил-N-фениламино)метил]пиперидин-2,6-дион, температура плавления: 132-134°С,
11.11: 3-{[(нафт-1-илметил)амино]метил}пиперидин-2,6-дион, вязкий продукт,
11.12: 3-[(2-метоксифениламино)метил]пиперидин-2,6-дион, вязкий продукт,
11.13: 3-[(4-метоксифениламино)метил]пиперидин-2,6-дион, температура плавления: 131-134°С,
11.14: метиловый эфир (2S)-[(2,6-диоксопиперидин-3-илметил)амино]-3-фенилпропионовой кислоты, вязкий продукт,
11.15: 2-[(2,6-диоксопиперидин-3-илметил)амино]бензамид, температура плавления: 203-206°С,
11.16: 3-[(4-ацетилфениламино)метил]пиперидин-2,6-дион, температура плавления: 160°С,
11.17: 3-[(3-бензоил-фениламино)метил]пиперидин-2,6-дион, температура плавления: 152-158°С,
11.18: метиловый эфир 4-[(2,6-диоксопиперидин-3-илметил)амино]бензойной кислоты, температура плавления: 142-144°С.
Пример 12
3-[(2-гидроксиметилфениламино)метил]пиперидин-2,6-дион
Стадия 1
3-{[2-трет-бутилдиметилсиланилоксиметил)фениламино]метил}пиперидин-2,6-дион
Заменив анилин в примере 10 на 2-(трет-бутилдиметилсиланилоксиметил)фениламин и используя описанную в этом примере методику, получили указанное в заголовке соединение в виде белых кристаллов с температурой плавления 85-87°С.
Стадия 2
3-[(2-гидроксиметилфениламино)метил]пиперидин-2,6-дион
К раствору из 0,20 г продукта из стадии 1 в 5 мл тетрагидрофурана добавляли 5 мл 1-молярного раствора тригидрата тетрабутиламмонийфторида в тетрагидрофуране. Затем в течение 3 ч перемешивали при 20°С, упаривали в вакууме и остаток очищали экспресс-хроматографией на силикагеле с использованием этилового эфира уксусной кислоты в качестве элюента. В результате получили 0,12 г (85% от теории) указанного в заголовке соединения в виде масла желтоватого цвета.
Пример 13
Заменив анилин в примере 10 на тиофенолы или меркаптаны и используя описанную в этом примере методику, аналогичным путем получили следующие соединения:
13.1: 3-фенилсульфанилметилпиперидин-2,6-дион, температура плавления: 98°С,
13.2: 3-фенетилсульфанилметилпиперидин-2,6-дион, температура плавления: 78°С,
13.3: метиловый эфир 2-(2,6-диоксопиперидин-3-илметил)сульфанил)бензойной кислоты, температура плавления: 142-144°С,
13.4: 3-бензилсульфанилметилпиперидин-2,6-дион, температура плавления: 105-107°С,
13.5: 3-(3-аминофенилсульфанилметил)пиперидин-2,6-дион, температура плавления: 133-135°С,
13.6: метиловый эфир 2-(2,6-диоксопиперидин-3-илметилсульфанил)-6-нитробензойной кислоты, температура плавления: 147-150°С.
Пример 14
Метиловый эфир 2-амино-6-(2,6-диоксопиперидин-3-илметилсульфанил)бензойной кислоты
Указанное в заголовке соединение получили каталитическим гидрированием продукта из примера 13.6 в присутствии палладия на активированном угле (10%-ный Pd) в условиях, аналогично описанным в примере 3.
Температура плавления 164-167°С.
Пример 15
3-фенилсульфанилметил-1-пиперидин-1-илметилпиперидин-2,6-дион
Раствор из 1,20 г продукта из примера 13.1 в 30 мл этанола смешивали с 0,52 мл водного раствора формальдегида (35%-ного) и 0,43 мл пиперидина. После 1-часового нагревания смеси с обратным холодильником ее упаривали в вакууме. Остаток растворяли в этиловом эфире уксусной кислоты и раствор смешивали с н-гексаном вплоть до момента образования кристаллического осадка, который затем отделяли и сушили в вакууме. В результате получили 1,23 г (74% от теории) указанного в заголовке соединения с температурой плавления 63-66°С.
1Н-ЯМР (ДМСО-d6): 1,37-1,47 (m, 6Н), 1,72-1,88 (m, 1H), 2,08-2,16 (m, 1H), 2,21-2,33 (m, 4H), 2,49-2,57 (m, 1H), 2,70-2,82 (m, 1H), 3,07-3,18 (m, 1H), 3,28-3,33 (m, 1H), 3,47-3,56 (m, 1H), 4,56-4,69 (m, 2H), 7,17-7,25 (m, 1H), 7,28-7,39 (m, 4H).
Стимуляция моноцитов человека липополисахаридом для секреции интерлейкина IL-12
Моноциты человека выделяли из мононуклеаров (одноядерных клеток) периферической крови (РВМС от англ. "peripheral blood mononuclear cells"), полученных центрифугированием в градиенте плотности Фиколла из гепаринизированной цельной крови. С этой целью клетки РВМС инкубировали с моноклональными антителами к специфичной по отношению к моноцитам поверхностной молекуле CD14, связанными с суперпарамагнитными микрошариками (фирма Miltenyi Biotech, Бергиш Гладбах). Для положительного отбора меченых моноцитов из смеси РВМС-клеток всю клеточную суспензию вносили в колонку с ферромагнитной матрицей-носителем и затем эту колонку помещали в магнитное поле. В результате клетки, содержащие микрошарики, связывались с матрицей, а немеченые клетки проходили сквозь колонку и их отбрасывали. После удаления матрицы из магнитного поля содержащие антитела клетки элюировали промывкой уже размагниченной колонки буфером. Чистота полученных таким путем CD14-положительной популяции моноцитов составляла приблизительно 95-98%. Эти моноциты с плотностью 106 клеток на мл культуральной среды (RPMI-среда, дополненная 10% фетальной телячьей сыворотки) инкубировали в течение 1 ч при 37°С и 5%-ном содержании СО2 с растворенными в ДМСО исследуемыми соединениями. После этого добавляли ЛПС из Е.coli из расчета 20 мкг/мл. По истечении 24 ч от культуральной среды отделяли бесклеточный супернатант, в котором определяли содержание интерлейкина IL-12.
Концентрацию IL-12 в отделенном от культуральной среды супернатанте определяли с помощью так называемого "сэндвич"-анализа ELISA с использованием двух моноклональных антител к IL-12 (фирма Biosource Europe, Флёрус, Бельгия). При анализе учитывалась эталонная стандартная кривая, полученная для IL-12 человека. Предел обнаружения интерлейкина IL-12 при указанном ELISA-анализе составлял 10 пг/мл.
Влияние исследуемых соединений на продуцирование IL-12 активированными ЛПС моноцитами
Представленные в таблице результаты однозначно подтверждают иммуномодуляторную эффективность замещенных глутаримидов. Они существенным образом подавляют синтез IL-12 активированными липополисахаридом моноцитами.
Примеры
Пример 16
Гидробромид N-{2-[(2,6-диоксопиперидин-3-иламино)метил]фенил}-ацетамида
Стадия 1.
2-[(2-ацетиламинобензил)бензилоксикарбониламино]-4-карбамоилмасляная кислота.
Раствор 0,98 г L-глутамина в 3,4 мл 2N щелочи вместе с 1,20 г N-(2-формилфенил)ацетамида растворяют в 10 мл метанола и 3,7 мл 1N щелочи, перемешивают 30 минут при 20°С и охлаждают до 0°С. Затем при перемешивании туда в течение 30 минут порциями добавляют 0,31 г боргидрида натрия. Перемешивают 16 часов при 0-5°С и затем смешивают с 14,2 мл водного раствора бикарбоната натрия. К полученному раствору через час прикапывают раствор 1,4 мл бензилоксикарбонилхлорида в 1,1 мл тетрагидрофурана и 2,5 мл 4N раствора щелочи. Перемешивают 2 часа при 20°С. Нейтральный реакционный раствор трижды экстрагируют диэтиловым эфиром и полученную водную фазу объединяют с 1N соляной кислотой до рН 1-2. После этого трижды экстрагируют по 20 мл этиловым эфиром уксусной кислоты. Оставшуюся органическую фазу промывают 20 мл насыщенного раствора хлорида натрия, сушат над сульфатом натрия и упаривают в вакууме.
Получают более 0,93 г названного в заголовке соединения.
Стадия 2
Бензиловый эфир (2-ацетиламинобензил)-(2,6-диоксопиперидин-3-ил)карбаминовой кислоты
Раствор 0,90 г продукта, полученного на стадии 1, в 6 мл безводного тетрагидрофурана добавляли к раствору 0,36 г карбонилдиимидазола в 3 мл абсолютного тетрагидрофурана и смесь кипятили с обратным холодильником в течение 4 ч. Растворитель выпаривали в вакууме, остаток переносили в 50 мл дистиллированной воды и трижды порциями по 50 мл экстрагировали этилацетатом. Экстракт промывали водой (3×50 мл) и насыщенным раствором хлорида натрия, сушили над сульфатом натрия и упаривали в вакууме. После очистки экспресс-хроматографией на силикагеле (элюент:этилацетат/циклогексан, 2:1) получали 0,25 г (11% в расчете на L-глутаминовую кислоту, использованную на стадии 1) указанного в заголовке соединения.
Стадия 3
Гидробромид {2-[(2,6-диоксопиперидин-3-иламино)метил]фенил}ацетамида
Суспензию 0,20 г продукта, полученного на стадии 2, в 1 мл уксусной кислоты смешивали с 1 мл раствора бромистого водорода в уксусной кислоте (33% HBr). Смесь перемешивали при 20°С в течение 1 ч, а затем выливали в 100 мл диэтилового эфира. После охлаждения до 0-5°С образующееся твердое вещество отделяли, промывали диэтиловым эфиром и высушивали в вакууме. После осаждения из метанола/диэтилового эфира получали 0,09 г (50% от теории) указанного в заголовке соединения. tпл. 152-156°C.
1Н-ЯМР (ДМСО-d6): δ 2,05-2,22 (m, 1H), 2,13 (s, 3Н), 2,35-2,74 (m, 1H), 2,69-2,74 (m, 2H), 4,26 (s, 2H), 4,43 (d, 1H), 7,33-7,60 (m, 4Н), 9,88 (s, 1H), 11,41 (s, 1H).
Пример 17
Гидробромид {2-[(2,6-диоксопиперидин-иламино)метил]фенил}формамида
Указанное в заголовке соединение получали аналогично тому, как описано в примере 16 (стадии 1-3) при замене на стадии 1 производного ацетамида на N-(2-фенилформил)формамид. tпл. 169-174°С.
Пример 18
Метиловый эфир 3-(2,6-диоксопиперидин-3-илметилсульфанил)-6-нитробензойной кислоты
Указанное в заголовке соединение получали аналогично тому, как описано в примере 10, при замене анилина на соответствующий меркаптан (формула X, где R1 в положении 3 означает СООСН3, a R3 в положении 4 означает NO2). tпл. 147-150°С.
Пример 19
Метиловый эфир 2-амино-5-(2,6-диоксопиперидин-3-илметилсульфанил)бензойной кислоты
Указанное в заголовке соединение получали гидрированием продукта, полученного, как описано в примере 18, в присутствии палладия на активированном угле (10% Pd) аналогично тому, как описано в примере 3. tпл. 164-167°C.
Стимуляция липополисахаридом секреции I1-12 моноцитами человека
Моноциты человека получали из моноядерных клеток периферической крови (РВМС), которые выделяли из гепаринизированной цельной крови центрифугированием в градиенте плотности фиколла. Для этого РВМС инкубировали в присутствии моноклональных антител, специфичных к мембранным CD14 моноцитов и иммобилизованных на сверхпарамагнитных микрогранулах (фирма Miltenyi Biotech, Bergisch Gladbach). Для положительной селекции меченых моноцитов из клеточной смеси РВМС клеточную суспензию наносили на колонку с ферромагнитным носителем (сорбентом) и помещали в магнитное поле. При этом клетки, несущие заряженные микрогранулы, связывались с сорбентом, а немеченые клетки проходили через колонку и отбрасывались. Затем колонку извлекали из магнитного поля и клетки, меченые антителами, элюировали из размагниченной колонки. Чистота полученной таким способом СD14-положительной популяции моноцитов составляла приблизительно от 95 до 98%. Полученные моноциты инкубировали при плотности клеток 106/мл культуральной среды (RPMI, содержащей 10% фетальной телячьей сыворотки) в присутствии анализируемых соединений, растворенных в ДМСО, при 37°С и в атмосфере 5% CO2 в течение 1 ч. Затем добавляли 20 мкг/мл ЛПС из Е.coli. Через 24 ч отбирали супернатант культуральной среды, не содержащий клеток, и определяли содержание IL-12. Концентрацию IL-12 в супернатанте определяли методом ИФА (ELISA) с использованием второго моноклонального IL-12-антитела (фирма Biosourse Europe, Fleurus, Бельгия). Калибровочную кривую строили с использованием IL-12 человека. Чувствительность ИФА метода (предел обнаружения IL-12) составлял 10 пг/мл.
Пример фармацевтического состава лекарственного средства по изобретению
1. Инъекционный раствор
1 г гидробромида метилового эфира 2-[(3S)-(диоксопиперидин-3-иламино)метил]бензойной кислоты растворяли при комнатной температуре в 1 л воды для инъекционных растворов, а затем придавали раствору изотонические свойства добавлением хлорида натрия.
2. Состав капсул
Твердые желатиновые капсулы заполняли гидробромидом 2-[(3S)-(диоксопиперидин-3-иламино)метил]бензамида:
Получали гомогенную смесь соединения с вспомогательными веществами и полученной смесью заполняли твердые желатиновые капсулы (размер 4) в количестве 105 мг на капсулу.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 4-АМИНОПИПЕРИДИНА | 2005 |
|
RU2396257C2 |
| НОВЫЕ ИМИДНЫЕ ПРОИЗВОДНЫЕ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2016 |
|
RU2772429C2 |
| ПРОИЗВОДНЫЕ 2-(2,6-ДИОКСОПИПЕРИДИН-3-ИЛ)ИЗОИНДОЛИНА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ВОСПАЛИТЕЛЬНЫХ ЦИТОКИНОВ | 1999 |
|
RU2200159C2 |
| ПРОИЗВОДНЫЕ 3-(5-ТЕТРАЗОЛИЛБЕНЗИЛ)АМИНОПИПЕРИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1994 |
|
RU2136675C1 |
| 6-, 7- ИЛИ 8-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ХИНАЗОЛИНОНА И КОМПОЗИЦИИ, ВКЛЮЧАЮЩИЕ ИХ, И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2008 |
|
RU2476432C2 |
| PROTAC, ЦЕЛЕНАПРАВЛЕННО ВОЗДЕЙСТВУЮЩИЕ НА ТАУ-БЕЛОК, И СВЯЗАННЫЕ С НИМИ СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2805523C2 |
| АРОИЛАМИНО- И ГЕТЕРОАРОИЛАМИНО-ЗАМЕЩЕННЫЕ ПИПЕРИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ GLYT-1 | 2010 |
|
RU2517701C2 |
| ЗАМЕЩЕННЫЕ 2,6-ДИОКСОПИПЕРИДИНЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБЫ СНИЖЕНИЯ УРОВНЕЙ TNF-α | 1997 |
|
RU2177944C2 |
| ЗАМЕЩЕННЫЕ 2,6-ДИОКСОПИПЕРИДИНЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБЫ СНИЖЕНИЯ УРОВНЕЙ TNF-АЛЬФА | 1997 |
|
RU2595250C1 |
| ПРОИЗВОДНЫЕ 5-ЗАМЕЩЕННОГО ХИНАЗОЛИНОНА, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2617989C2 |
Изобретение относится к замещенным глутаримидам общей формулы I
в которой Х обозначает группу формулы (CH2)n-(CR8R9)p-Z-(CR8R9)m, Z обозначает атом серы или кислорода, SO- или SO2-группу, остаток NR8 (необязательно в виде N-оксида) или CR8R9-группу, m и p обозначают 0 или 1, n обозначает 0, 1, 2 или 3, при этом m, n и р не могут одновременно обозначать 0.
R1 и R2 обозначают карбоксильную, сложноэфирную или ацильную группу и др.;
R3 обозначает водород, гидроксиксильную группу и др.;
R4 обозначает водород, C1-С3алкильную группу, фтор, трифторметил,
R8 и R9 обозначают водород, алкил, бензил и др., а также к их физиологически приемлемым солям.
Соединения формулы I обладают иммуномодуляторным действием и могут быть использованы для лечения ангиопатий и/или онконематологических заболеваний. 3 н. и 12 з.п. ф-лы, 1 табл.

в которой X обозначает группу формулы (CH2)n-(CR8R9)p-Z-(CR8R9)m,
где Z обозначает атом серы или кислорода, SO- или SO2-группу, остаток NR8 (необязательно в виде N-оксида) или CR8R9-группу,
m и р обозначают 0 или 1,
n обозначает 0, 1, 2 или 3, при этом
m, n и р не могут одновременно обозначать 0,
R1 и R2 имеют идентичные либо разные значения и обозначают карбоксильную группу, сложноэфирную группу формулы COOR5 или ацильную группу формулы COR5, в которых R обозначает соответственно алкильную группу (прямоцепочечную либо разветвленную) с 1-6 С-атомами (необязательно замещенную COOR5-группой и/или фенильной группой), С3-С7циклоалкильную группу или фенил либо бензил, или обозначает амидную группу формулы CONR6R7, в которой R6 и R7 имеют идентичные либо разные значения и представляют собой водород, алкильную группу (прямоцепочечную либо разветвленную) с 1-6 С-атомами (необязательно замещенную COOR5-группой и/или фенильной группой), аллил, фенил или вместе с N-атомом образуют гидразидную группу, пирролидиновое, пиперидиновое, гексаметилениминовое, морфолиновое, тиоморфолиновое, пиперазиновое или N-метилпиперазиновое кольцо, или обозначают водород, бром, хлор, фтор, моно-, ди-либо трифторметильную, тритильную, гидрокси-, гидроксиметильную, трифторметокси-, нитро-, амино-(необязательно замещенную СН(=O)- или COR5-либо алкилсульфонильной группой) или диметиламиногруппу, алкильную или алкоксигруппу (прямоцепочечную либо разветвленную) с 1-6 С-атомами, амидиновую группу формулы NH-CH(=NH) или NH-C(=NH)R5, фенильную группу или сконденсированное бензольное кольцо (соответственно необязательно замещенное вышеуказанными атомами либо группами), за исключением тех случаев, когда Z обозначает CR8R9, R1 и R2 не могут одновременно представлять собой водород и, когда Z обозначает S, a m обозначает 0, не могут представлять собой метоксигруппу,
R3 обозначает водород, гидроксигруппу или группу формулы СН2-NR6R7, в которой R6 и R7 имеют указанные выше значения,
R4 обозначает водород, C1-С3алкильную группу, атом фтора, дифтор- либо трифторметильную группу,
R8 обозначает водород, алкильную группу с 1-4 С-атомами (прямоцепочечную либо разветвленную), бензил или фенетил (необязательно замещенный вышеуказанными атомами либо группами), и
R9 имеет те же значения, что и R8, или обозначает сложноэфирную группу формулы COOR5, фенильную, гидрокси- или алкоксигруппу (прямоцепочечную либо разветвленную) с 1-4 С-атомами, атом фтора, либо хлора или трифторметильную группу,
и их энантиомеры, смеси энантиомеров, рацематы, диастереомеры или смеси диастереоизомеров в виде их оснований или солей физиологически приемлемых кислот.
2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензойная кислота,
2-[(3R)-(2,6-диоксопиперидин-3-иламино)метил]бензойная кислота,
2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]-N,N-диэтилбензамид,
(3S)-[2-морфолин-4-карбонил)бензиламино]пиперидин-2,6-дион, метиловый эфир {2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензоиламино}уксусной кислоты,
2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензамид,
2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]-N-этилбензамид,
(3S)-[2-пирролидин-1-карбонил)бензиламино]пиперидин-2,6-дион, гидразид 2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензойной кислоты,
2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]-N-фенилбензамид,
2-[(3R)-(2,6-диоксопиперидин-3-иламино)метил]-N-фенилбензамид,
2-[(3R)-(2,6-диоксопиперидин-3-иламино)метил]-N,N-диэтилбензамид,
2-[(3R)-(2,6-диоксопиперидин-3-иламино)метил]бензамид,
метиловый эфир 2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензойной кислоты,
бензиловый эфир 2-[(3S)-(2,6-диоксопиперидин-3-иламино)метил]бензойной кислоты,
метиловый эфир 2-(2,6-диоксопиперидин-3-илметилсульфанил)бензойной кислоты,
метиловый эфир 2-(2,6-диоксопиперидин-3-илметилсульфанил)-6-нитробензойной кислоты.

в которой X, R1, R2 и R4 имеют значения, указанные в п.1, или, если А означает ОН, а В означает NH2 или NHOH, либо, наоборот, А имеет значения, указанные для В, а В имеет значение, указанное для А,
циклизуют в присутствии активирующего агента, предпочтительно карбонилдиимидазола, или, если А и В одновременно означают ОН, то нагревают в ацетангидриде и полученные циклизацией ангидриды путем дальнейшего нагрева с мочевиной или каким-либо иным источником азота превращают в соединения формулы I, где R3 обозначает Н.

в которой R1, R2, R4 и Х имеют значения, указанные в п.1,
окисляют до соответствующего имида, предпочтительно м-хлорнадбензойной кислотой или оксидом рутения (IV)/периодата натрия.
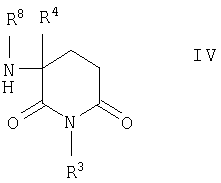
в которой R3, R4 и R8 имеют значения, указанные в п.1,
алкилируют соединениями общей формулы V

в которой R1, R2, R8, R9, n и p имеют значения, указанные в п.1, a Y представляет собой атом хлора, брома либо иода или толуол-4-сульфонатную группу.


в которых R1, R2, R4, R8, R9 и n имеют значения, указанные в п.1, a R3 обозначает водород или гидроксигруппу,
при этом в качестве восстановителей применяют предпочтительно борогидрид натрия, триацетоксиборогидрид натрия, цианоборогидрид натрия, комплекс боран-пиридин или каталитически активированный водород.

в которой R1 и R2 имеют значения, указанные в п.1,
алкилируют α-бромглутаримидами общей формулы VIII

в которой R3 и R4 имеют значения, указанные в п.1.
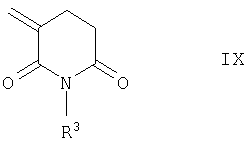
при этом реакцию осуществляют предпочтительно в растворителях, таких, как ацетонитрил или толуол, с добавлением третичных аминов, таких, как триэтиламин или диизопропилэтиламин, при температурах в интервале от 80 до 110°С.
| Способ получения 3-(N-фенилацетиламинопиперидин)-2,6-диона | 1990 |
|
SU1809830A3 |
| Огнетушитель | 0 |
|
SU91A1 |
| US 5114937 А, 19.05.1992. | |||
Авторы
Даты
2006-06-27—Публикация
2001-01-09—Подача