[Область техники]
[0001]
Настоящее изобретение относится к новому имидному производному, проявляющему селективное ингибирующее действие на продукцию MMP-9, и его фармацевтическому применению.
[Уровень техники]
[0002]
Матриксные металлопротеиназы (MMP) представляют собой группу ферментов, играющих ключевую роль в деградации соединительной ткани в живых организмах. Активность MMP регулируется каждым этапом 1) продукции латентного фермента (proMMP) путем экспрессии гена, 2) активации proMMP, 3) ингибирования активности TIMP, который представляет собой ингибитор активных ферментов. MMP включают MMP двух типов, гемостатического типа и индукционного типа, первый включает MMP-2 и MMP-14, и второй включает множество MMP, таких как MMP-1, 3, 9, 13 и т.д. В частности, была подтверждена усиленная продукция или экспрессия MMP-9 при ревматоидном артрите, остеоартрите, рассеянном склерозе, системной красной волчанке и воспалительных заболеваниях кишечника (неспецифическом язвенном колите, болезни Крона), и было предположено участие MMP-9 в указанных патологиях [Ann. Rheum. Dis., vol. 58, pages 691-697 (1999) (непатентный документ 1), J. Clin. Invest., vol. 92, pages 179-185 (1993) (непатентный документ 2), Arthritis Rheum., vol. 46, pages 2625-2631 (2002) (непатентный документ 3), Lancet Neurol., vol. 2, pages 747-756 (2003) (непатентный документ 4), Arthritis Rheum., vol. 50, pages 858-865 (2004) (непатентный документ 5), Journal of Leukocyte Biology, vol. 79, pages 954-962 (2006) (непатентный документ 9)].
[0003]
Кроме того, исходя из исследований на нокаутных по MMP мышах, было предположено, что MMP-9 вовлечена в образование и прогрессирование рака, и что MMP-9 играет важную роль в развитии артрита и разрушении суставов [J. Natl. Cancer Inst., vol. 94, 1134-1142 (2002) (непатентный документ 6), J. Immunol., vol. 169, 2643-2647 (2002) (непатентный документ 7)]. С другой стороны, MMP-2 обладает противовоспалительным действием, и, предположительно, механизм ее действия заключается в разрушении MCP-3, и тому подобное [Science, vol. 289, pages 1202-1206 (2000) (непатентный документ 8)]. Поэтому лекарственное средство, которое не влияет на продукцию MMP-2 и селективно супрессирует продукцию MMP-9, может рассматриваться в качестве нового терапевтического лекарственного средства.
В JP-A-2004-359657 (патентный документ 1) раскрыт лептомицин B, который представляет собой лекарственное средство, ингибирующее продукцию MMP-9, и его производное.
[0004]
Более того, WO 2010/050461 (патентный документ 2) и WO 2011/136292 (патентный документ 3) раскрывают соединения, которые ингибируют продукцию MMP-9. Однако кольцо, имеющее имидную структуру формулы (I) по настоящему изобретению, связывается с заместителем А через атом углерода, тогда как соединения, раскрытые в патентных документах 2 и 3, связываются с заместителями А и W через атом азота, и структуры различны.
[Список документов]
[Патентные документы]
[0005]
патентный документ 1: JP-A-2004-359657
патентный документ 2: WO 2010/050461
патентный документ 3: WO 2011/136292
[непатентный документ]
[0006]
непатентный документ 1: Ann. Rheum. Dis., vol. 58, pages 691-697 (1999)
непатентный документ 2: J. Clin. Invest., vol. 92, pages 179-185 (1993)
непатентный документ 3: Arthritis Rheum., vol. 46, pages 2625-2631 (2002)
непатентный документ 4: Lancet Neurol., vol. 2, pages 747-756 (2003)
непатентный документ 5: Arthritis Rheum., vol. 50, pages 858-865 (2004)
непатентный документ 6: J. Natl. Cancer Inst., vol. 94, pages 1134-1142 (2002)
непатентный документ 7: J. Immunol., vol. 169, pages 2643-2647 (2002)
непатентный документ 8: Science, vol. 289, pages 1202-1206 (2000)
непатентный документ 9: Journal of Leukocyte Biology, vol. 79, pages 954-962 (2006)
[Краткое описание сущности изобретения]
[Задачи, подлежащие решению настоящим изобретением]
[0007]
Задачей настоящего изобретения является предоставление низкомолекулярного соединения, которое подавляет продукцию MMP индукционного типа, в частности, MMP-9, и не подавляет продукцию MMP-2 гемостатического типа.
[Средства решения задач]
[0008]
Принимая во внимание упомянутые выше задачи, авторы настоящего изобретения провели интенсивные исследования в попытке обнаружить низкомолекулярное соединение, проявляющее ингибирующее действие на продукцию MMP-9. В результате авторы обнаружили, что имидное производное по настоящему изобретению подавляет продукцию MMP индукционного типа, в частности, MMP-9, и не ингибирует продукцию MMP-2 гемостатического типа, что привело к созданию настоящего изобретения.
Соответственно, настоящее изобретение описано ниже.
[1] Имидное производное, представленное следующей формулой (I)
[0009]
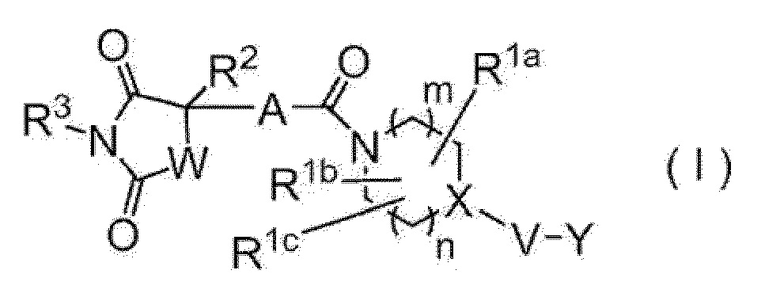
[0010]
где А представляет собой 5-членный гетероарилен, содержащий 1-3 атома, выбранных из атома азота, атома кислорода и атома серы, или фенилен или 6-членный гетероарилен, представленный следующей формулой,
[0011]

[0012]
где Z1, Z2, Z3 и Z4 являются одинаковыми или различными и каждый представляет собой атом углерода или атом азота,
эти фенилен и гетероарилен необязательно замещены одним или одинаковыми или различными 2 или 3 заместителями, выбранными из атома галогена; гидроксильной группы; нитро; циано; C1-C6 алкила, необязательно замещенного амино, необязательно моно- или дизамещенного C1-C6 алкилом, атомом галогена, гидроксильной группой или C1-C6 алкокси; C3-C6 циклоалкила, необязательно замещенного амино, необязательно моно- или дизамещенного C1-C6 алкилом, атомом галогена, гидроксильной группой или C1-C6 алкокси; амино, необязательно моно- или дизамещенного C1-C6 алкилом; и C1-C6 алкокси, необязательно замещенного амино, необязательно моно- или дизамещенного C1-C6 алкилом, атомом галогена, гидроксильной группой или C1-C6 алкокси, правая связь связана с карбонилом, а левая связь связана с четвертичным углеродом, связанным с R2,
R1a, R1b и R1c являются одинаковыми или различными и каждый представляет собой атом водорода; атом галогена; гидроксильную группу; циано; оксо; карбокси; C1-C6 алкил, необязательно замещенный амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой или C1-C6 алкокси; C1-C6 алкокси, необязательно замещенный амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой или C1-C6 алкокси; C2-C7 алкоксикарбонил; или аминокарбонил, необязательно моно- или дизамещенный C1-C6 алкилом; или два из R1a, R1b и R1c объединяются с образованием C3-C6 циклоалкила; или два из R1a, R1b и R1c объединяются с образованием насыщенной неароматической гетероциклической группы, содержащей 1-4 атома, выбранных из атома азота, атома кислорода и атома серы, и имеющей 3-7 составляющих кольцо атомов,
R2 представляет собой C1-C6 алкил, необязательно замещенный амино, необязательно моно- или дизамещенным C1-C6 алкилом, C3-C6 циклоалкилом, атомом галогена, гидроксильной группой или C1-C6 алкокси; C3-C6 циклоалкил, необязательно замещенный атомом галогена, гидроксильной группой, C1-C6 алкокси или амино; насыщенную неароматическую гетероциклическую группу, содержащую 1-4 атома, выбранных из атома азота, атома кислорода и атома серы, и имеющую 3-7 составляющих кольцо атомов; C6-C10 арил, необязательно замещенный заместителем В, показанным ниже; или гетероарил, содержащий 1-6 атомов, выбранных из атома азота, атома кислорода и атома серы, имеющий 5-10 составляющих кольцо атомов, и необязательно замещенный заместителем В, показанным ниже,
R3 представляет собой атом водорода; C1-C6 алкил, необязательно замещенный амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой, C1-C6 алкокси или C2-C7 ацилокси; C3-C6 циклоалкил; арилалкил, где C6-C10 арильный фрагмент необязательно замещен атомом галогена, гидроксильной группой, C1-C6 алкокси, C1-C6 алкилом или амино, и алкильный фрагмент имеет число атомов углерода 1-6; или гетероарилалкил, где гетероарильный фрагмент, содержащий 1-6 атомов, выбранных из атома азота, атома кислорода и атома серы, и имеющий 5-10 составляющих кольцо атомов, необязательно замещен атомом галогена, гидроксильной группой, C1-C6 алкокси, C1-C6 алкилом или амино, и алкильный фрагмент имеет число атомов углерода 1-6,
W представляет собой -N(Rx)-, где Rx представляет собой атом водорода или C1-C6 алкил, необязательно замещенный атомом галогена, гидроксильной группой, C1-C6 алкокси или C2-C7 ацилокси или метилен, необязательно замещенный атомом галогена, гидроксильной группой, C1-C6 алкилом или C1-C6 алкокси,
m+n равно 0, 1, 2 или 3,
X представляет собой атом углерода (любой из R1a, R1b и R1c может быть связан с атомом углерода, но атом углерода не замещен оксо) или атом азота (если V представляет собой связь, то атом азота может быть окислен с образованием N-оксида),
V представляет собой связь; карбонил; C1-C6 алкилен, необязательно замещенный атомом галогена, гидроксильной группой или C1-C6 алкокси; атом кислорода; или -N(RY)-, где RY представляет собой атом водорода, C1-C6 алкил или C2-C7 ацил,
Y представляет собой 5-членную кольцевую группу, 6-членную кольцевую группу, 5-членную кольцевую группу, замещенную 5-членной кольцевой группой, 5-членную кольцевую группу, замещенную 6-членной кольцевой группой, 6-членную кольцевую группу, замещенную 5-членной кольцевой группой, 6-членную кольцевую группу, замещенную 6-членной кольцевой группой, конденсированную кольцевую группу 5-членного кольца и 5-членного кольца, конденсированную кольцевую группу 5-членного кольца и 6-членного кольца или конденсированную кольцевую группу 6-членного кольца и 6-членного кольца (где 5-членное кольцо и 5-членная кольцевая группа содержит 0-4 атома, выбранные из атома азота, атома кислорода и атома серы, а остальное состоит из атома углерода, 6-членное кольцо и 6-членная кольцевая группа содержит 0-4 атома, выбранные из атома азота, атома кислорода и атома серы, а остальное состоит из атома углерода), и эти кольцевые группы необязательно замещены атомом галогена; гидроксильной группой; C1-C6 алкилом, необязательно замещенным амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой или C1-C6 алкокси; C3-C6 циклоалкилом, необязательно замещенным атомом галогена, гидроксильной группой, амино или C1-C6 алкилом; или C1-C6 алкокси, необязательно замещенным амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой, C1-C6 алкилом или C1-C6 алкокси:
заместитель B
атом галогена; гидроксильная группа; циано; C1-C6 алкил, необязательно замещенный амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой или C1-C6 алкокси; C3-C6 циклоалкил, необязательно замещенный атомом галогена, гидроксильной группой или амино; C1-C6 алкокси, необязательно замещенный амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой или C1-C6 алкокси; амино, необязательно моно- или дизамещенный C1-C6 алкилом или C3-C6 циклоалкилом,
или его фармакологически приемлемая соль (иногда сокращенно как «соединение (I)» в настоящем описании).
[2] Имидное производное по пункту [1], где A представляет собой фенилен или 6-членный гетероарилен, показанный ниже:
[0013]

[0014]
или его фармакологически приемлемая соль.
[3] Имидное производное по пункту [1] или [2], где Y представляет собой фенил, пиридил, пиразинил, пиридазинил, нафтил, хинолил или кольцевую группу, показанную ниже
[0015]
 ,
,
и
[0016]
эти кольцевые группы необязательно замещены атомом галогена; гидроксильной группой; C1-C6 алкилом, необязательно замещенным амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой или C1-C6 алкокси; C3-C6 циклоалкилом, необязательно замещенным атомом галогена, гидроксильной группой, амино или C1-C6 алкилом; или C1-C6 алкокси, необязательно замещенным амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой, C1-C6 алкилом или C1-C6 алкокси, или его фармакологически приемлемая соль.
[4] Имидное производное по любому из пунктов [1]-[3], где Y представляет собой фенил или пиридил, представленный следующей формулой
[0017]
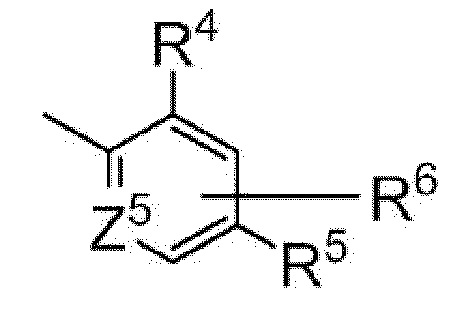
[0018]
где Z5 представляет собой атом углерода или атом азота,
R4 и R5 являются одинаковыми или различными и каждый представляет собой C1-C6 алкил, необязательно замещенный атомом галогена; или C3-C6 циклоалкил, необязательно замещенный атомом галогена, и
R6 представляет собой атом водорода; C1-C6 алкил, необязательно замещенный атомом галогена; или C3-C6 циклоалкил, необязательно замещенный атомом галогена, или
кольцевую группу, представленную следующей формулой
[0019]

[0020]
эти кольцевые группы необязательно замещены атомом галогена или C1-C6 алкилом,
или его фармакологически приемлемая соль.
[5] Имидное производное по любому из пунктов [1]-[4], где Y представляет собой фенил или пиридил, представленный следующей формулой
[0021]
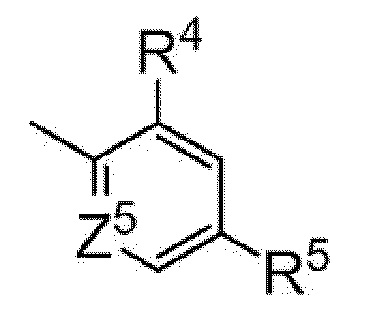
[0022]
где Z5 представляет собой атом углерода или атом азота и
R4 и R5 являются одинаковыми или различными и каждый представляет собой C1-C6 алкил; или C3-C6 циклоалкил, или его фармакологически приемлемая соль.
[6] Имидное производное по любому из пунктов [1]-[5], где Y представляет собой пиридил, представленный следующей формулой
[0023]

[0024]
где R4 и R5 являются одинаковыми или различными и каждый представляет собой C1-C6 алкил; или C3-C6 циклоалкил, или его фармакологически приемлемая соль.
[7] Имидное производное по любому из пунктов [1]-[6], где V представляет собой связь, или его фармакологически приемлемая соль.
[8] Имидное производное по любому из пунктов [1]-[7], где X представляет собой атом азота, или его фармакологически приемлемая соль.
[9] Имидное производное по любому из пунктов [1]-[8], где R1a, R1b и R1c представляют собой каждый атом водорода, или его фармакологически приемлемая соль.
[10] Имидное производное по любому из пунктов [1]-[9], где R2 представляет собой C1-C6 алкил и R3 представляет собой атом водорода, или его фармакологически приемлемая соль.
[11] Имидное производное по любому из пунктов [1]-[10], где W представляет собой -NH- или метилен, или его фармакологически приемлемая соль.
[12] Имидное производное по любому из пунктов [1]-[11], где W представляет собой -NH-, или его фармакологически приемлемая соль.
[13] (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-дион,
(R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-метилимидазолидин-2,4-дион,
(R)-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-дион,
(R)-5-метил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-дион,
(R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-дион,
5-изопропил-5-{2-метокси-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-дион,
(R)-5-{4-[(S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-дион,
(R)-5-{4-[(S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбонил]фенил}-5-этилимидазолидин-2,4-дион,
(R)-5-{4-[4-(3,5-диметилпиридин-2-ил)-2,2-диметилпиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-дион,
(R)-5-{4-[(S)-4-(3,5-диметилпиридин-2-ил)-3-метилпиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-дион,
5-трет-бутил-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-дион,
(R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-дион,
(R)-5-метил-5-{4-[4-(4-метилбензоил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-дион,
(R)-5-метил-5-[4-(4-п-толилоксипиперидин-1-карбонил]фенил}имидазолидин-2,4-дион,
(R)-5-изопропил-5-{4-[4-(5-метилпиридин-2-карбонил)пиперидин-1-карбонил]фенил]имидазолидин-2,4-дион,
(R)-5-изопропил-5-{4-[4-(6-метилбензофуран-3-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-дион,
(R)-5-{4-[4-(4,6-диметилбензофуран-3-ил)пиперидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-дион,
(R)-5-изопропил-5-{4-[4-(6-метилбензоксазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-дион,
(R)-5-{4-[4-(5,7-диметилиндазол-1-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-дион,
(R)-5-{4-[4-(4,6-диметил-1H-индазол-3-ил)пиперидин-1-карбонил]фенил}-5-метил-имидазолидин-2,4-дион,
(R)-5-метил-5-{4-[4-(1,4,6-триметил-1H-индазол-3-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-дион,
(R)-5-{4-[4-(4-фтор-6-метил-1H-индазол-3-ил)пиперидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-дион,
5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-(тетрагидропиран-4-ил)имидазолидин-2,4-дион, или
5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-дион.
[14] Фармацевтическая композиция, содержащая имидное производное по любому из пунктов [1]-[13] или его фармакологически приемлемую соль, и фармацевтически приемлемую добавку.
[15] Средство для ингибирования продукции ММР-9, содержащее имидное производное по любому из пунктов [1]-[13] или его фармакологически приемлемую соль.
[16] Лекарственное средство для профилактики и/или лечения аутоиммунного заболевания или воспалительного заболевания кишечника, содержащее имидное производное по любому из пунктов [1]-[13] или его фармакологически приемлемую соль.
[17] Лекарственное средство по пункту [16], где аутоиммунное заболевание представляет собой ревматоидный артрит, рассеянный склероз или системную красную волчанку.
[18] Лекарственное средство по пункту [16], где воспалительное заболевание кишечника представляет собой болезнь Крона или неспецифический язвенный колит.
[19] Лекарственное средство для профилактики и/или лечения остеоартрита, содержащее имидное производное по любому из пунктов [1]-[13] или его фармакологически приемлемую соль.
[20] Способ профилактики и/или лечения аутоиммунного заболевания или воспалительного заболевания кишечника, включающий введение имидного производного по любому из пунктов [1]-[13], или его фармакологически приемлемой соли.
[21] Способ по пункту [20], где аутоиммунное заболевание представляет собой ревматоидный артрит, рассеянный склероз или системную красную волчанку.
[22] Способ по пункту [20], где воспалительное заболевание кишечника представляет собой болезнь Крона или неспецифический язвенный колит.
[23] Способ профилактики и/или лечения остеоартрита, включающий введение имидного производного по любому из пунктов [1]-[13] или его фармакологически приемлемой соли.
[Эффект настоящего изобретения]
[0025]
Поскольку соединение по настоящему изобретению селективно подавляет продукцию MMP индукционного типа, в частности, MMP-9, и не ингибирует продукцию MMP-2 гемостатического типа, то оно является полезным в качестве лекарственного средства для профилактики и/или лечения аутоиммунных заболеваний, таких как ревматоидный артрит и тому подобное, воспалительных заболеваний кишечника (неспецифического язвенного колита, болезни Крона) и остеоартрита.
[Описание вариантов осуществления]
[0026]
Соединение по настоящему изобретению представляет собой вышеупомянутое имидное производное, представленное формулой (I), его фармакологически приемлемую соль или его гидрат или сольват. Далее описаны значения терминов, используемых в настоящем описании, и настоящее изобретение объясняется более подробно. Объяснение следующих терминов не ограничивает настоящее изобретение каким-либо образом.
[0027]
Атом галогена представляет собой атом фтора, атом хлора, атом брома или атом йода.
[0028]
C1-С6 Алкил представляет собой алкил с прямой или разветвленной цепью, и могут быть упомянуты метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, 3-метилбутил, неопентил, гексил, 2-этилбутил и тому подобное.
C1-C3 Алкил представляет собой алкил с прямой или разветвленной цепью, и могут быть упомянуты метил, этил, пропил, изопропил и тому подобное.
[0029]
Примеры C3-C6 циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил, метилциклопропил, этилциклопропил, метилциклобутил, этилциклобутил, метилциклопентил и тому подобное.
[0030]
Примеры C6-C10 арила включают фенил, нафтил и тому подобное.
[0031]
Арилалкил представляет собой вышеуказанный C1-C6 алкил, замещенный вышеуказанным C6-C10 арилом, и могут быть упомянуты бензил, фенэтил, фенилпропил, нафтилметил, нафтилэтил и тому подобное.
[0032]
Гетероарил, содержащий 1-6 атомов, выбранных из атома азота, атома кислорода и атома серы, и содержащий 5-10 составляющих кольцо атомов, представляет собой одновалентную группу, полученную из моноциклического ароматического гетероцикла, содержащего от 1 до 3 атомов азота, атомов кислорода и атомов серы, и содержащего 5 или 6 составляющих кольцо атомов, конденсированное кольцо указанного моноциклического ароматического гетероцикла и бензола и конденсированное кольцо одинаковых или различных указанных двух моноциклических ароматических гетероциклов. Конкретные примеры включают пирролил, фурил, тиенил, пиразолил, имидазолил, триазолил, тетразолил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил, фуразанил, пиридил, пиранил, тиопиранил, пиридазинил, пиримидинил, пиразинил, триазинил, тетразинил, индолил, изоиндолил, бензофурил, бензотиенил, индазолил, бензоксазолил, бензимидазолил, бензотиазолил, пирролопиридил, пиразолопиридил, имидазопиридил, пирролопиримидинил, пиразолопиримидинил, хинолил, изохинолил, хиноксалил, хиназолил и тому подобное.
5-членный гетероарилен, содержащий 1-3 атома, выбранных из атома азота, атома кислорода и атома серы, представляет собой двухвалентную группу, полученную из пиррола, пиразола, имидазола, триазола, тиофена, фурана, оксазола, изоксазола, тиазола, изотиазола и фуразана.
[0033]
Гетероарилалкил представляет собой вышеупомянутый C1-С6алкил, замещенный вышеупомянутым гетероарилом, содержащим 1-6 атомов азота, атомов кислорода и атомов серы, и содержащим 5-10 составляющих кольцо атомов.
[0034]
Насыщенная неароматическая гетероциклическая группа, содержащая 1-4 атома, выбранных из атома азота, атома кислорода и атома серы и, содержащая 3-7 составляющих кольцо атомов, представляет собой одновалентную группу, полученную из насыщенного моноциклического гетероцикла, содержащего от 1 до 4 атомов азота, кислорода атомов и атомов серы, и содержащего 3-7 составляющих кольцо атомов. Конкретные примеры включают азиридинил, азетидинил, пирролидинил, тетрагидрофурил, тетрагидротиенил, имидазолидинил, пиразолидинил, оксазолидинил, изоксазолидинил, тиазолидинил, изотиазолидинил, пиперидинил, тетрагидропиранил, тетрагидротиопиранил, пиперазинил, морфолинил, тиоморфолинил и тому подобное.
[0035]
C1-C6 Алкокси представляет собой алкоксигруппу с прямой или разветвленной цепью, и метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, вторичный бутокси, третичный бутокси, пентокси, 3-метилбутокси, неопентокси, гексилокси, 2-этилбутокси или тому подобное.
[0036]
C2-C7 Ацил представляет собой карбонил, замещенный вышеупомянутым C1-C6 алкилом, карбонил, замещенный вышеупомянутым C3-C6 циклоалкилом, или карбонил, замещенный фенилом. Его примеры включают ацетил, пропионил, бутирил, изобутирил, валерил, изовалерил, гексаноил, циклопропилкарбонил, циклопентилкарбонил, циклогексилкарбонил, бензоил и тому подобное.
[0037]
Примеры C2-С7 ацилокси включают ацетокси, этилкарбонилокси, пропилкарбонилокси, изопропилкарбонилокси, бутилкарбонилокси, изобутилкарбонилокси, вторичный бутилкарбонилокси, третичный бутилкарбонилокси, пентилкарбонилокси, неопентилкарбонилокси, гексилкарбонилокси, циклопропилкарбонилокси, циклобутилкарбонилокси, циклопентилкарбонилокси, циклогексилкарбонилокси, бензоилокси и тому подобное.
[0038]
Примеры C2-С7 алкоксикарбонила включают группу, где вышеупомянутый C1-С6 алкокси связан с карбонилом, и метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, пентоксикарбонил, 3-метилбутоксикарбонил, неопентоксикарбонил, гексилоксикарбонил, 2-этилбутоксикарбонил и тому подобное.
Примеры амино, необязательно моно- или дизамещенной C1-C6 алкилом, включают амино, метиламино, этиламино, пропиламино, изопропиламино, бутиламино, изобутиламино, вторичный бутиламино, третичный бутиламино, пентиламино, 3-метилбутиламино, неопентиламино, гексиламино, 2-этилбутиламино, диметиламино, этилметиламино, диэтиламино, метилпропиламино, этилпропиламино, дипропиламино и тому подобное.
[0039]
Аминокарбонил, необязательно моно- или дизамещенный C1-C6 алкилом, представляет собой карбонил, где аминовый фрагмент замещен вышеупомянутым амино, необязательно моно- или дизамещенным C1-C6 алкилом. Его конкретные примеры включают аминокарбонил, метиламинокарбонил, диметиламинокарбонил, этилметиламинокарбонил и тому подобное.
[0040]
C1-C6 Алкилен представляет собой алкилен с прямой или разветвленной цепью. Их примеры включают метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен, пропилен, этилэтилен и тому подобное.
5-Членное кольцо, содержащее 0-4 атома, выбранные из атома азота, атома кислорода и атома серы, и остаток, состоящий из атома углерода, представляет собой 5-членный карбоцикл или 5-членный гетероцикл, и 5-членная кольцевая группа, содержащая 0-4 атома, выбранные из атома азота, атома кислорода и атома серы, и остаток, состоящий из атома углерода, представляет собой 5-членную карбоциклическую группу или 5-членную гетероциклическую группу. Примеры 5-членного карбоцикла включают циклопентан, циклопентен, циклопентадиен и тому подобное, и примеры 5-членной карбоциклической группы включают моновалентную группу, полученную из вышеупомянутого 5-членного карбоцикла. 5-Членный гетероцикл включает 5-членный ароматический гетероцикл и 5-членный неароматический гетероцикл. То же самое относится к 5-членной гетероциклической группе. Примеры 5-членного гетероцикла включают пиррол, пиразол, имидазол, триазол, тетразол, фуран, тиофен, оксазол, изоксазол, тиазол, изотиазол, оксадиазол, тиадиазол, оксатиол, оксатиазол и эти кольца частично или полностью восстановлены и тому подобное, и примеры 5-членной гетероциклической группы включают одновалентную группу, полученную из вышеупомянутого 5-членного гетероцикла.
6-Членное кольцо, содержащее 0-4 атома, выбранные из атома азота, атома кислорода и атома серы, и остаток, состоящий из атома углерода, представляет собой 6-членный карбоцикл или 6-членный гетероцикл, и 6-членная кольцевая группа, содержащая 0-4 атома, выбранные из атома азота, атома кислорода и атома серы, и остаток, состоящий из атома углерода, представляет собой 6-членную карбоциклическую группу или 6-членную гетероциклическую группу. Примеры 6-членного карбоцикла включают бензол, циклогексан и тому подобное, и примеры 6-членной карбоциклической группы включают одновалентную группу, полученную из вышеупомянутого 6-членного карбоцикла. 6-членный гетероцикл включает 6-членный ароматический гетероцикл и 6-членный неароматический гетероцикл. То же самое относится к 6-членной гетероциклической группе. Примеры 6-членного гетероцикла включают пиран, тиопиран, пиридин, пиридазин, пиримидин, пиразин, триазин, тетразин, оксазин, тиоксазин, эти кольца частично или полностью восстановлены и тому подобное, и примеры 6-членной гетероциклической группы включают одновалентную группу, полученную из вышеупомянутого 6-членного гетероцикла.
[0041]
В настоящем описании число заместителей, при «необязательно замещенный», равно одному или нескольким, если не определено конкретно, и заместители могут быть одинаковыми или различными.
[0042]
Предпочтительные варианты осуществления вышеупомянутой формулы (I) поясняются ниже. А предпочтительно представляет собой тиенилен или фенилен или 6-членный гетероарилен, представленный
[0043]

[0044]
где Z1, Z2, Z3 и Z4 являются одинаковыми или различными и каждый представляет собой атом углерода или атом азота, и более предпочтительно фенилен или 6-членный гетероарилен. Более конкретно
[0045]

[0046]
являются предпочтительными, и
[0047]
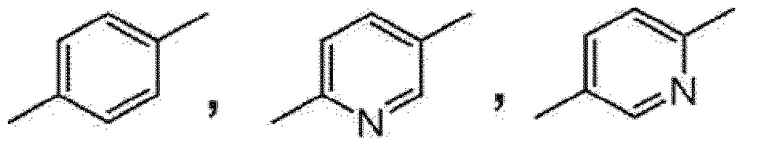
[0048]
являются более предпочтительными. В качестве особо предпочтительного примера A,
[0049]
[0050]
может быть упомянута.
Если A имеет заместитель, то заместитель предпочтительно представляет собой один или 2 или 3 одинаковых или различных заместителя, выбранных из атома галогена; гидроксильной группы; C1-C6 алкила, необязательно замещенного амино, необязательно моно- или дизамещенным C1-С6 алкилом, атомом галогена, гидроксильной группой или C1-С6 алкокси; и C1-С6 алкокси, необязательно замещенного амино, необязательно моно- или дизамещенного C1-С6алкилом, атомом галогена, гидроксильной группой или C1-С6 алкокси, более предпочтительно, один или 2 или 3 одинаковых или различных заместителя, выбранных из атома галогена; гидроксильную группу; C1-C6 алкил; и C1-C6 алкокси; еще более предпочтительно атом галогена или C1-C6 алкокси.
Если A содержит заместитель, то заместитель является таким, как указано выше, и незамещенный А также является предпочтительным вариантом.
[0051]
R1a, R1b и R1c являются одинаковыми или различными и каждый предпочтительно представляет собой атом водорода; гидроксильную группу; циано; C1-C6 алкил, необязательно замещенный амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой или C1-C6 алкокси; C2-C7 алкоксикарбонил; аминокарбонил, необязательно моно- или дизамещенный C1-C6 алкилом; или два из R1a, R1b и R1c объединяются с образованием циклоалкила, содержащего 3-6 составляющих кольцо атомов, более предпочтительно атом водорода; гидроксильную группу; циано; C1-C6 алкил, необязательно замещенный гидроксильной группой или C1-C6 алкокси; C2-C7 алкоксикарбонил; или два из R1a, R1b и R1c объединяются с образованием циклоалкильного кольца, имеющего 3-6 составляющих кольцо атомов. Когда два из R1a, R1b и R1c объединяются с образованием кольца, это предпочтительно спирокольцо. Особенно предпочтительным примером R1a является атом водорода или C1-C3 алкил, особенно предпочтительным примером R1b является атом водорода или C1-C3 алкил, и особенно предпочтительным примером R1c является атом водорода. В наиболее предпочтительном примере R1a, R1b и R1c представляют собой каждый атом водорода.
[0052]
R2 предпочтительно представляет собой C1-C6 алкил, необязательно замещенный амино, необязательно моно- или дизамещенным C1-C6 алкилом, C3-C6 циклоалкилом, атомом галогена, гидроксильной группой или C1-C6 алкокси; C3-C6 циклоалкил, необязательно замещенный атомом галогена, гидроксильной группой, C1-C6 алкокси или амино; насыщенную неароматическую гетероциклическую группу, содержащую 1-4 атома, выбранных из атома азота, атома кислорода и атома серы, и содержащую 3-7 составляющих кольцо атомов; C6-C10 арил; или гетероарил, содержащий 1-6 атомов, выбранных из атома азота, атома кислорода и атома серы, и имеющий 5-10 составляющих кольцо атомов, более предпочтительно C1-C6 алкил, необязательно замещенный амино, необязательно моно- или дизамещенным C1-C6 алкилом, C3-C6 циклоалкилом, атомом галогена, гидроксильной группой или C1-C6 алкокси; C3-C6 циклоалкил, необязательно замещенный атомом галогена, гидроксильной группой, C1-C6 алкокси или амино; насыщенную неароматическую гетероциклическую группу, содержащую 1-4 атома, выбранных из атома азота, атома кислорода и атома серы, и имеющую 3-7 составляющих кольцо атомов; или C6-C10 арил, более предпочтительно C1-C6 алкил, необязательно замещенный атомом галогена или C1-C6 алкокси; C3-C6 циклоалкил, необязательно замещенный C1-C6 алкокси; тетрагидропиранил; или фенил. Особенно предпочтительные примеры R2 включают C1-C6 алкил и тетрагидропиранил, и наиболее предпочтительным его примером является C1-C6 алкил. C1-C6 алкил в наиболее предпочтительном примере R2 представляет собой, в частности, метил, этил или изопропил.
[0053]
R3 предпочтительно представляет собой атом водорода; C1-C6 алкил, необязательно замещенный амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой, C1-C6 алкокси или C2-C7 ацилокси; или арилалкил, где C6-C10 арильный фрагмент необязательно замещен атомом галогена, гидроксильной группой, C1-C6 алкокси, C1-C6 алкилом или амино, и алкильный фрагмент имеет число атомов углерода 1-6, более предпочтительно атом водорода; или C1-C6 алкил, необязательно замещенным гидроксильной группой или C2-C7 ацилокси, еще более предпочтительно атомом водорода.
[0054]
В другом варианте осуществления настоящего изобретения R2 предпочтительно представляет собой C1-C6 алкил (например, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил) и R3 предпочтительно представляет собой атом водорода.
[0055]
W предпочтительно представляет собой -N(Rx)-, где Rx представляет собой атом водорода или C1-C6 алкил, необязательно замещенный гидроксильной группой, или метилен, более предпочтительно -NH- или метилен. Особенно предпочтительным примером W является -N(Rx)-, где Rx представляет собой атом водорода или C1-C6 алкил, необязательно замещенный гидроксильной группой, и -NH- является наиболее предпочтительным примером.
[0056]
m+n предпочтительно равно 0, 1 или 2, более предпочтительно 1 или 2, наиболее предпочтительно 2. В частности, m предпочтительно равно 0 или 1, а n предпочтительно равно 0 или 1. Предпочтительная комбинация m и n представляет собой более конкретно (0,0), (0,1) или (1,1) в виде (m,n), более предпочтительно (0,1) или (1,1), особенно предпочтительно (1,1).
[0057]
X предпочтительно представляет собой атом углерода или атом азота. В частности, когда m+n равно 0 или 1, предпочтительным является атом углерода. Когда m+n равно 2, предпочтительными являются и атом углерода и атом азота, и особенно предпочтительным является атом азота.
Конкретные предпочтительные комбинации m, n и X представляют собой
[0058]
[0059]
более конкретные предпочтительные примеры представляют собой
[0060]
 и
и
[0061]
особенно конкретный предпочтительный пример представляет собой
[0062]
 .
.
[0063]
V предпочтительно представляет собой связь, карбонил, C1-C6 алкилен, атом кислорода или -NH-, более предпочтительно связь, карбонил, метилен, атом кислорода или -NH-, еще более предпочтительно связь, карбонил, атом кислорода или -NH-. Особенно предпочтительные примеры V включают связь и карбонил, и наиболее предпочтительным примером является связь.
[0064]
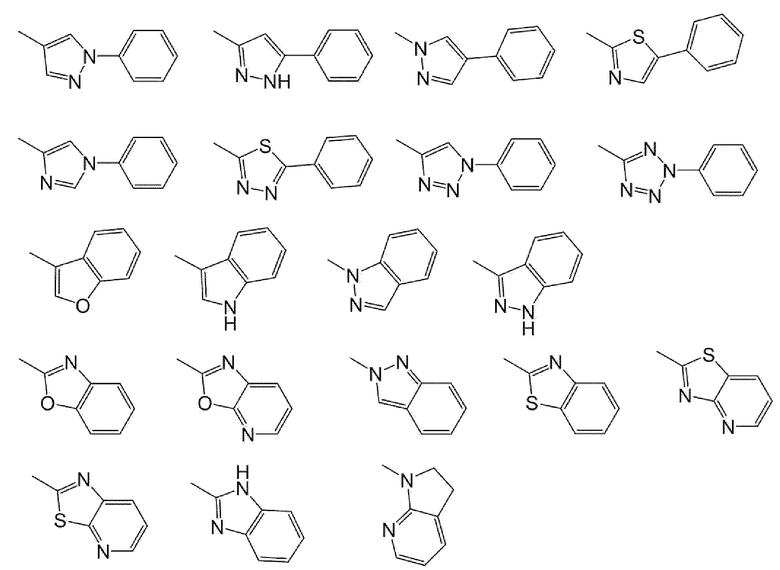
5-Членная кольцевая группа для Y предпочтительно представляет собой пирролил, дигидропирролил, пиразолил, имидазолил, триазолил, тетразолил, тиазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил или фурил.
6-Членная кольцевая группа для Y предпочтительно представляет собой фенил, пиридил, пиразинил или пиридазинил.
Y предпочтительно представляет собой фенил, пиридил, пиразинил, пиридазинил, нафтил, хинолил или кольцевую группу, показанную ниже
Y предпочтительно представляет собой фенил, пиридил, пиразинил, пиридазинил, нафтил, хинолил или кольцевую группу, показанную ниже
[0065]

[0066]
более предпочтительно фенил, пиридил или кольцевую группу, показанную ниже
[0067]
[0068]
наиболее предпочтительно фенил, пиридил или кольцевую группу, показанную ниже
[0069]
 .
.
[0070]
Особенно предпочтительным примером Y является пиридил, более конкретно
[0071]
 .
.
[0072]
Когда Y имеет заместитель, заместитель предпочтительно представляет собой атом галогена; C1-C6 алкил, необязательно замещенный амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой или C1-C6 алкокси; C3-C6 циклоалкил, необязательно замещенный атомом галогена, гидроксильной группой, амино или C1-C6 алкилом; или C1-C6 алкокси, необязательно замещенный амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой, C1-C6 алкилом или C1-C6 алкокси, более предпочтительно атомом галогена; C1-C6 алкил, необязательно замещенный атомом галогена; C3-C6 циклоалкил; или C1-C6 алкокси, еще более предпочтительно C1-C6 алкил; или C3-C6 циклоалкил. Особенно предпочтительным примером заместителя для Y является C1-C6 алкил, в частности, метил. Количество заместителей предпочтительно равно 2 или 3.
Особенно предпочтительные примеры Y, в частности, включают
[0073]

[0074]
и
[0075]

[0076]
является наиболее предпочтительным.
[0077]
В другом варианте осуществления настоящего изобретения Y предпочтительно представляет собой фенил или пиридил, представленный следующей формулой
[0078]

[0079]
где Z5 представляет собой атом углерода или атом азота,
R4 и R5 являются одинаковыми или различными и каждый представляет собой C1-C6 алкил (например, метил, этил), необязательно замещенный атомом галогена; или C3-C6 циклоалкил (например, циклопропил), необязательно замещенный атомом галогена,
R6 представляет собой атом водорода; C1-C6 алкил (например, метил), необязательно замещенный атомом галогена; или C3-C6 циклоалкил, необязательно замещенный атомом галогена
или кольцевую группу, представленную следующей формулой
[0080]
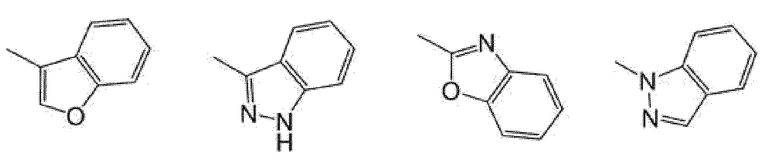
[0081]
(эти кольцевые группы необязательно замещены атомом галогена (например, атомом фтора, атомом хлора, атомом брома) или C1-C6 алкилом (например, метилом)), более предпочтительно фенилом или пиридилом, представленным следующей формулой
[0082]

[0083]
где Z5 представляет собой атом углерода или атом азота,
R4 и R5 являются одинаковыми или различными и каждый представляет собой C1-C6 алкил (например, метил, этил); или C3-C6 циклоалкил (например, циклопропил),
более предпочтительно, пиридил, представленный следующей формулой
[0084]
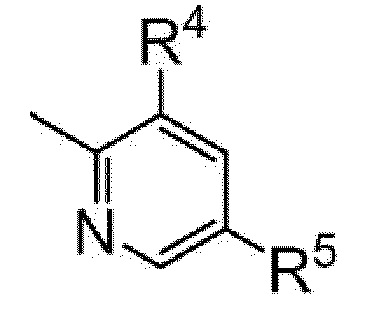
[0085]
где R4 и R5 являются одинаковыми или различными и каждый представляет собой C1-C6 алкил (например, метил, этил); или C3-C6 циклоалкил (например, циклопропил).
[0086]
Предпочтительные примеры соединения (I) включают следующие соединения.
[Соединение I-A]
Соединение (I), где А представляет собой 5-членный гетероарилен (например, тиенилен), содержащий 1-3 атома, выбранных из атома азота, атома кислорода и атома серы, или фенилен или 6-членный гетероарилен, представленный следующей формулой
[0087]
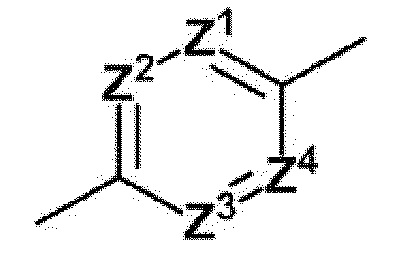
[0088]
где Z1=Z2=Z3=Z4=атом углерода; Z1=Z2=Z4=атом углерода и Z3=атом азота; или Z1=Z2=Z3=атом углерода и Z4=атом азота, и
эти фенилен и гетероарилен необязательно замещены одним или одинаковыми или различными 2 или 3 заместителями, выбранными из атома галогена (например, атома фтора, атома брома); гидроксильной группы; C1-C6 алкила (например, метила), необязательно замещенного 1-3 атомами галогена (например, атомом фтора); и C1-C6 алкокси (например, метокси, этокси), правая связь связана с карбонилом, а левая связь связана с четвертичным углеродом, связанным с R2,
R1a, R1b и R1c являются одинаковыми или различными и каждый представляет собой атом водорода; гидроксильную группу; циано; C1-C6 алкил (например, метил, этил, изопропил), необязательно замещенный одним или одинаковыми или различными 2 или 3 заместителями, выбранными из гидроксильной группы и C1-C6 алкокси (например, метокси); C2-C7 алкоксикарбонил (например, метоксикарбонил); аминокарбонил; или два из R1a, R1b и R1c объединяются с образованием C3-C6 циклоалкила (например, циклобутила),
R2 представляет собой C1-C6 алкил (например, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил), необязательно замещенный одним или одинаковыми или различными 2 или 3 заместителями, выбранными из атома галогена (например, атома фтора), гидроксильной группы и C1-C6 алкокси (например, метокси, этокси); C3-C6 циклоалкил (например, циклопропил, циклобутил), необязательно замещенный C1-C6 алкокси (например, метокси); насыщенную неароматическую гетероциклическую группу, содержащую 1-4 атома, выбранных из атома азота, атома кислорода и атома серы, и имеющую 3-7 составляющих кольцо атомов (например, тетрагидропиранил); или C6-C10 арил (например, фенил),
R3 представляет собой C1-C6 алкил (например, метил, этил), необязательно замещенный одним или одинаковыми или различными 2 или 3 заместителями, выбранными из атома водорода; гидроксильную группу и C2-C7 ацилокси (например, ацетокси, пропилкарбонилокси, трет-бутилкарбонилокси); или арилалкил, где C6-C10 арильный фрагмент необязательно замещен C1-C6 алкокси (например, метокси), и алкильный фрагмент имеет число атомов углерода 1-6 (например, бензил),
W представляет собой -N(Rx)-, где Rx представляет собой атом водорода или C1-C6 алкил (например, метил, этил), необязательно замещенный гидроксильной группой, или метилен,
m+n равно 0, 1 или 2,
X представляет собой атом углерода или атом азота,
V представляет собой связь; карбонил; алкилен (например, метилен), имеющий 1-6 атомов углерода; атом кислорода; или -N(RY)-, где RY представляет собой атом водорода и
Y представляет собой 6-членную кольцевую группу (например, фенил, пиридил, пиразинил, пиридазинил), 5-членную кольцевую группу (например, пиразолил, имидазолил, изоксазолил, тиазолил, оксадиазолил, триазолил, тиадиазолил, тетразолил), замещенную 6- членной кольцевой группой (например, фенил, пиридил), конденсированную кольцевую группу 5-членного кольца и 6-членное кольцо (например, бензоксазолил, бензоизоксазолил, бензимидазолил, бензотиазолил, бензоизотиазолил, бензофурил, оксазолопиридинил, тиазолопиридил, пирролопиридил, дигидропирролопиридил, индазолил, индолил) или конденсированную кольцевую группу 6-членного кольца и 6-членно кольцо (например, нафтил, хинолил) (где 5-членное кольцо и 5-членная кольцевая группа содержит 0-4 атома, выбранные из атома азота, атома кислорода и атома серы, а остальное состоит из атома углерода, 6-членное кольцо и 6-членная кольцевая группа содержит 0-4 атома, выбранные из атома азота, атома кислорода и атома серы, а остальное состоит из атома углерода), эти кольцевые группы необязательно замещены одним или одинаковыми или различными 2 или 3 заместителями, выбранными из атома галогена (например, атом фтора, атом хлора, атом брома); C1-C6 алкил (например, метил, этил), необязательно замещенный 1-3 атомами галогена (например, атомом фтора); C3-C6 циклоалкил (например, циклопропил); и C1-C6 алкокси (например, метокси).
[0089]
[Соединение I-B]
Соединение (I), где А представляет собой 5-членный гетероарилен (например, тиенилен), содержащий 1-3 атома, выбранных из атома азота, атома кислорода и атома серы, или фенилен или 6-членный гетероарилен, представленный следующей формулой
[0090]

[0091]
где Z1=Z2=Z3=Z4=атом углерода; или Z1=Z2=Z4=атом углерода и Z3=атом азота,
эти фенилен и гетероарилен необязательно замещены одним или одинаковыми или различными 2 или 3 заместителями, выбранными из атома галогена (например, атома фтора); гидроксильной группы; и C1-C6 алкила (например, метила), правая связь связана с карбонилом, а левая связь связана с четвертичным углеродом, связанным с R2,
R1a, R1b и R1c являются одинаковыми или различными и каждый представляет собой атом водорода; гидроксильную группу; циано; C1-C6 алкил (например, метил), необязательно замещенный одним или одинаковыми или различными 2 или 3 заместителями, выбранными из C1-C6 алкокси (например, метокси); C2-C7 алкоксикарбонил (например, метоксикарбонил); или два из R1a, R1b и R1c объединяются с образованием C3-C6 циклоалкила (например, циклобутила),
R2 представляет собой C1-C6 алкил (например, метил, этил, изопропил, трет-бутил), необязательно замещенный одним или одинаковыми или различными 2 или 3 заместителями, выбранными из атома галогена (например, атом фтора) и C1-C6 алкокси (например, метокси); C3-C6 циклоалкил (например, циклопропил, циклобутил), необязательно замещенный C1-C6 алкокси (например, метокси); насыщенную неароматическую гетероциклическую группу, содержащую 1-4 атома, выбранных из атома азота, атома кислорода и атома серы, и имеющую 3-7 составляющих кольцо атомов (например, тетрагидропиранил); или C6-C10 арил (например, фенил),
R3 представляет собой атом водорода; или C1-C6 алкил (например, метил), необязательно замещенный одним или одинаковыми или различными 2 или 3 заместителями, выбранными из C2-C7 ацилокси (например, ацетокси),
W представляет собой -N(Rx)-, где Rx представляет собой атом водорода или C1-C6 алкил (например, метил),
m+n равно 0, 1 или 2,
X представляет собой атом углерода или атом азота,
V представляет собой связь; карбонил; атом кислорода; или -N(RY)-, где RY представляет собой атом водорода, и
Y представляет собой 6-членную кольцевую группу (например, фенил, пиридил, пиразинил, пиридазинил), 5-членную кольцевую группу (например, пиразолил, имидазолил, тиазолил, триазолил, тиадиазолил, тетразолил), замещенный 6-членной кольцевой группой (например, фенилом), конденсированную кольцевую группу 5-членного кольца и 6-членное кольцо (например, бензоксазолил, бензимидазолил, бензотиазолил, бензофурил, оксазолопиридил, тиазолопиридил, дигидропирролопиридил, индазолил, индолил) (где 5-членное кольцо и 5-членная кольцевая группа содержит 0-4 атома, выбранные из атома азота, атома кислорода и атома серы, а остальное состоит из атома углерода, 6-членное кольцо и 6-членная кольцевая группа содержит 0-4 атома, выбранные из атома азота, атома кислорода и атома серы, а остальное состоит из атома углерода), эти кольцевые группы необязательно замещены одним или одинаковыми или различными 2 или 3 заместителями, выбранными из атома галогена (например, атом фтора); C1-C6 алкил (например, метил), необязательно замещенный 1-3 атомами галогена (например, атом фтора); и C3-C6 циклоалкил (например, циклопропил).
[0092]
[Соединение I-C]
Соединение (I), где А представляет собой фенилен, представленный следующей формулой
[0093]
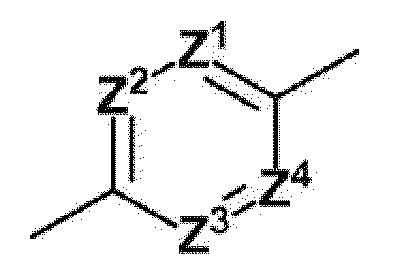
[0094]
где Z1=Z2=Z3=Z4=атом углерода,
фенилен необязательно замещен одним или одинаковыми или различными 2 или 3 заместителями, выбранными из атома галогена (например, фтора); и C1-C6 алкокси (например, метокси), правая связь связана с карбонилом, и левая связь связана с четвертичным углеродом, связанным с R2,
R1a, R1b и R1c являются одинаковыми или различными и каждый представляет собой атом водорода; или C1-C6 алкил (например, метил),
R2 представляет собой C1-C6 алкил (например, метил, этил, изопропил, трет-бутил); или насыщенную неароматическую гетероциклическую группу, содержащую 1-4 атома, выбранных из атома азота, атома кислорода и атома серы, и имеющую 3-7 составляющих кольцо атомов (например, тетрагидропиранил),
R3 представляет собой атом водорода,
W представляет собой -N(Rx)-, где Rx представляет собой атом водорода,
m+n равно 1 или 2,
X представляет собой атом углерода или атом азота,
V представляет собой связь; карбонил; атом кислорода; или -N(RY)-, где RY представляет собой атом водорода, и
Y представляет собой 6-членную кольцевую группу (например, фенил, пиридил) или конденсированную кольцевую группу 5-членного кольца и 6-членное кольцо (например, бензоксазолил, бензофурил, индазолил) (где 5-членное кольцо содержит 0-4 атома, выбранных из атома азота, атома кислорода и атома серы, а остальное состоит из атома углерода, 6-членное кольцо и 6-членная кольцевая группа содержит 0-4 атома, выбранные из атома азота, атома кислорода и атома серы, а остальное состоит из атома углерода), эти кольцевые группы необязательно замещены одним или одинаковыми или различными 2 или 3 заместителями, выбранными из атома галогена (например, атом фтора); C1-C6 алкил (например, метил); и C3-C6 циклоалкил (например, циклопропил).
[0095]
Примеры предпочтительных соединений соединения по настоящему изобретению включают соединения примеров 1-355, более предпочтительно соединения примеров 1, 3, 5, 6, 8, 22, 49, 50, 59, 80, 91, 124, 150, 152, 186, 240, 245, 257, 272, 276, 278, 280, 325 и 329.
[0096]
В настоящем изобретении «фармакологически приемлемая соль» конкретно не ограничена, при условии, что она приемлема в качестве лекарственного средства, и может быть упомянута соль неорганической кислоты, соль органической кислоты, соль щелочного металла, соль щелочноземельного металла, соль неорганического основания и соль органического основания. В настоящем описании соль также включает гидрат и сольват.
«Фармакологически приемлемый» в настоящем описании означает нечто, являющееся, в целом, безопасным и безвредным, и возможно неподходящее с биологической точки зрения, но предпочтительное согласно другим аспектам, и включает используемое для приготовления фармацевтических композиций, применимых в качестве лекарственного средства для людей, а также в качестве лекарственного средства в ветеринарии.
Хотя соединение по настоящему изобретению может быть получено посредством следующих способов, способы получения не являются ограничивающими.
Соединение (I) по настоящему изобретению может быть получено посредством следующих способов A, B, C, D, E или F.
(Способ A)
[0097]

[0098]
где значения символов определены выше.
Путем осуществления взаимодействия соединения, представленного формулой (II), с соединением, представленным формулой (III), может быть получено соответствующее соединение, представленное формулой (I). Реакцию проводят с использованием конденсирующего агента в подходящем растворителе при температуре от 0°C до комнатной температуры. Примеры конденсирующего агента включают 4-(4,6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолиния хлорида гидрат (DMT-MM), 1-этил-3-(3'-диметиламинопропил)карбодиимид гидрохлорид (WSC HCl) и тому подобное. Примеры растворителя включают метанол, N,N-диметилформамид, хлороформ, тетрагидрофуран и тому подобное. Реакция может быть промотирована путем добавления 1-гидроксибензотриазола (HOBt). Когда соединение, представленное формулой (III), образует соль с кислотой, взаимодействие проводят путем нейтрализации добавлением основания.
(Способ B)
[0099]

[0100]
где значения символов определены выше.
Путем осуществления взаимодействия соединения, представленного формулой (IV), с соединением, представленным формулой (III), получают соответствующее соединение, представленное формулой (I). Реакцию проводят с использованием основания в подходящем растворителе при температуре от 0°C до комнатной температуры. Примеры основания включают водный раствор гидроксида натрия, триэтиламин, N-метилморфолин, пиридин и тому подобное. Примеры растворителя включают тетрагидрофуран, диметоксиэтан, этилацетат, пиридин и тому подобное.
(Способ C)
Стадия 1
[0101]

[0102]
где P представляет собой аминозащитную группу, и другие символы определены выше.
Осуществляя процедуру удаления защитной группы P соединения, представленного формулой (V), получают соединение, представленное формулой (III). Когда, например, P в формуле представляет собой Boc-группу, реакцию проводят с использованием кислоты в подходящем растворителе при температуре от 0°C до комнатной температуры. Примеры кислоты включают хлороводород/этилацетат, хлороводород/1,4-диоксан и тому подобное. Примеры растворителя включают хлороформ, этилацетат, 1,4-диоксан, этанол, метанол и тому подобное.
Стадия 2
[0103]

[0104]
где значения символов определены выше.
Путем осуществления взаимодействия соединения, представленного формулой (II), с соединением, представленным формулой (III), может быть получено соответствующее соединение, представленное формулой (I). Реакцию проводят с использованием конденсирующего агента в подходящем растворителе при температуре от 0°C до комнатной температуры. Примеры конденсирующего агента включают 4-(4,6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолиния хлорида гидрат (DMT-MM), 1-этил-3-(3'-диметиламинопропил)карбодиимид гидрохлорид (WSC HCl) и тому подобное. Примеры растворителя включают метанол, N,N-диметилформамид, хлороформ, тетрагидрофуран и тому подобное. Реакция может быть промотирована путем добавления 1-гидроксибензотриазола (HOBt). Когда соединение, представленное формулой (III), образует соль с кислотой, взаимодействие проводят путем нейтрализации добавлением основания.
(Способ D: формула (I), где R3 представляет собой группу, отличную от атома водорода)
[0105]
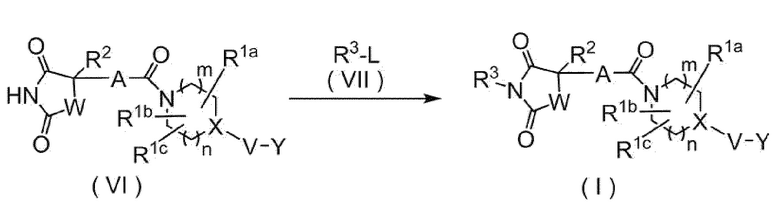
[0106]
где L представляет собой уходящую группу, такую как атом галогена и тому подобное, R3 представляет собой C1-C6 алкил, необязательно замещенный амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой, C1-C6 алкокси или C2-C7 ацилокси; C3-C6 циклоалкил; арилалкил, где C6-C10 арильный фрагмент необязательно замещен атомом галогена, гидроксильной группой, C1-C6 алкокси, C1-C6 алкилом или амино, и алкильный фрагмент имеет число атомов углерода 1-6; или гетероарилалкил, где гетероарильный фрагмент, содержащий 1-6 атомов, выбранных из атома азота, атома кислорода и атома серы, и имеющий 5-10 составляющих кольцо атомов, необязательно замещен атомом галогена, гидроксильной группой, C1-C6 алкокси, C1-C6 алкилом или амино и алкильный фрагмент имеет число атомов углерода 1-6, и значения других символов определены выше.
Путем осуществления взаимодействия соединения, представленного формулой (VI), с соединением, представленным формулой (VII), получают соответствующее соединение, представленное формулой (I). Реакцию проводят с использованием основания в подходящем растворителе при 0°C-100°C. Примеры основания включают карбонат калия, гидрокарбонат натрия и тому подобное. Примеры растворителя включают N,N-диметилформамид и тому подобное.
Когда R3 представляет собой C1-C6 алкил, необязательно замещенный амино, необязательно монозамещенным C1-C6 алкилом, вышеуказанную реакцию проводят с использованием формулы (VII), защищенной подходящей аминозащитной группой, и осуществляют снятие защиты с получением соответствующего соединения, представленного формулой (I).
(Способ E: формула (I), где W представляет собой -N(Rx)-, где Rx представляет собой C1-C6 алкил, необязательно замещенный заместителем, выбранным из атома галогена, гидроксильной группы и C1-C6 алкокси)
[0107]

[0108]
где P' представляет собой защитную группу, T представляет собой C1-C6 алкил, необязательно замещенный заместителем, выбранным из атома галогена, гидроксильной группы и C1-C6 алкокси, и другие символы являются такими, как определено выше.
Стадия 1
Путем осуществления взаимодействия соединения, представленного формулой (VIII), с соединением, представленным формулой (IX), получают соответствующее соединение, представленное формулой (Х). Реакцию проводят с использованием основания в подходящем растворителе при 0°C-100°C. Примеры основания включают карбонат калия, гидрокарбонат натрия и тому подобное. Примеры растворителя включают N,N-диметилформамид, тетрагидрофуран и тому подобное.
Стадия 2
Путем осуществления взаимодействия соединения, представленного формулой (Х), с соединением, представленным формулой (ХI), получают соответствующее соединение, представленное формулой (ХII). Реакцию проводят с использованием основания в подходящем растворителе при 0°C-100°C. Примеры основания включают карбонат калия, гидрид натрия и тому подобное. Примеры растворителя включают N,N-диметилформамид, тетрагидрофуран и тому подобное.
Стадия 3
Осуществляя процедуру удаления защитной группы P' соединения, представленного формулой (XII), получают соединение, представленное формулой (XIII). Например, когда P' в формуле представляет собой 4-метоксибензильную группу, реакцию проводят с использованием кислоты в подходящем растворителе при 0°C-100°C. Примеры кислоты включают трифторметансульфоновую кислоту, трифторметансульфоновый ангидрид и тому подобное. Примеры растворителя включают 1,2-дихлорэтан и тому подобное.
(способ F: формула (I), где R1a представляет собой C1-C6 алкил, замещенный гидроксильной группой)
Стадия 1
[0109]

[0110]
где Pʺ представляет собой гидроксилзащитную группу, U представляет собой алкилен, имеющий 1-6 атомов углерода, и значения других символов имеют значения, указанные выше.
Путем удаления защитных групп P, Pʺ соединения, представленного формулой (XIV), получают соединение, представленное формулой (XV). Например, когда P в формуле представляет собой Boc-группу, и Pʺ в формуле представляет собой TBS группу, реакцию проводят с использованием кислоты в подходящем растворителе при температуре от 0°C до комнатной температуры. Примеры кислоты включают хлороводород/этилацетат, хлороводород/1,4-диоксан и тому подобное. Примеры растворителя включают хлороформ, этилацетат, 1,4-диоксан, этанол, метанол и тому подобное.
Стадия 2
[0111]

[0112]
где R3 представляет собой атом водорода; C1-C6 алкил, необязательно замещенный амино, необязательно моно- или дизамещенным C1-C6 алкилом, атомом галогена, гидроксильной группой, C1-C6 алкокси или C2-C7 ацилокси; C3-C6 циклоалкил; арилалкил, где C6-C10 арильный фрагмент необязательно замещен атомом галогена, гидроксильной группой, C1-C6 алкокси, C1-C6 алкилом или амино, и алкильный фрагмент имеет число атомов углерода 1-6; или гетероарилалкил, где гетероарильный фрагмент, содержащий 1-6 атомов, выбранных из атома азота, атома кислорода и атома серы, и имеющий 5-10 составляющих кольцо атомов, необязательно замещен атомом галогена, гидроксильной группой, C1-C6 алкокси, C1-C6 алкилом или амино и алкильный фрагмент имеет число атомов углерода 1-6, и значения других символов определены выше.
Путем осуществления взаимодействия соединения, представленного формулой (II), с соединением, представленным формулой (ХV), может быть получено соответствующее соединение, представленное формулой (XVI). Реакцию проводят с использованием конденсирующего агента в подходящем растворителе при температуре от 0°C до комнатной температуры. Примеры конденсирующего агента включают 4-(4,6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолиния хлорида гидрат (DMT-MM), 1-этил-3-(3'-диметиламинопропил)карбодиимид гидрохлорид (WSC HCl) и тому подобное. Примеры растворителя включают метанол, N,N-диметилформамид, хлороформ, тетрагидрофуран и тому подобное. Реакция может быть промотирована путем добавления 1-гидроксибензотриазола (HOBt). Когда соединение, представленное формулой (XV), образует соль с кислотой, взаимодействие проводят путем нейтрализации добавлением основания.
Имидное производное формулы (I), которое получают вышеупомянутым способом, может быть очищено до любой степени чистоты посредством традиционно используемого способа очистки, например, концентрирования, экстракции, хроматографии, повторного осаждения, перекристаллизации и т.п. Кроме того, при необходимости, оно может быть преобразовано в фармакологически приемлемую соль посредством обработки кислотой или основанием и т.д. в подходящем растворителе (вода, спирт, эфир и т.д.). Кроме того, полученное соединение по настоящему изобретению или его фармакологически приемлемая соль могут быть преобразованы в его гидрат или сольват посредством обработки водой, содержащим воду растворителем или другим растворителем (например, спирт и т.д.).
[0113]
Имидное производное и его фармакологически приемлемая соль по настоящему изобретению включают рацемические соединения, стереоизомеры и смесь этих соединений, и включают меченные изотопами и меченные радиоактивными атомами соединения. Такие изомеры могут быть выделены путем стандартного метода разделения, включая фракционную кристаллизацию и хиральную колоночную хроматографию. Кроме того, соединение по настоящему изобретению содержит асимметричный атом углерода. Следовательно, оно включает энантиомер и диастереомер. Смесь диастереомеров может быть разделена на отдельные диастереомеры, основываясь на их физических/химических отличиях хорошо известным в данной области техники способом, например, при помощи хроматографии и/или фракционной кристаллизации. Энантиомер может быть отделен при помощи хиральной колоночной хроматографии или путем осуществления взаимодействия энантиомерного соединения с соответствующим оптически активным соединением с получением смеси диастереомеров, отделением каждого диастереомера и преобразованием каждого диастереомера в соответствующий энантиомер. Все такие изомеры, включая диастереомер, энантиомер и их смесь, являются частью соединения по настоящему изобретению.
[0114]
Соединение по настоящему изобретению обладает селективным супрессивным ингибирующим действием на продукцию MMP-9 и может быть применимо в качестве профилактического лекарственного средства или лекарства для терапии аутоиммунных заболеваний, таких как ревматоидный артрит, рассеянный склероз, системная красная волчанка и тому подобное, воспалительных заболеваний кишечника (неспецифический язвенный колит, болезнь Крона) или остеоартрита.
[0115]
В настоящем изобретении термин «профилактика» означает акт введения соединения по настоящему изобретению или содержащей соединение фармацевтической композиции индивиду с неразвитым заболеванием, состоянием или симптомом. Кроме того, термин «лечение» означает акт введения соединения по настоящему изобретению или содержащей соединение фармацевтической композиции индивиду с заболеванием, состоянием или симптомом. Таким образом, акт введения индивиду с заболеванием, состоянием или симптомом для предотвращения ухудшения симптома, и тому подобное, и для предотвращения обострения и рецидива является вариантом осуществления «лечения».
[0116]
Когда соединение по настоящему изобретению применяют в виде лекарственного средства, соединение по настоящему изобретению смешивают с фармацевтически приемлемой добавкой (эксципиентом, связующим средством, разрыхлителем, корригирующим веществом, ароматизатором, эмульгатором, разбавителем, солюбилизирующим веществом и тому подобным) с получением фармацевтической композиции, которая может быть введена перорально или парентерально. Фармацевтическая композиция может быть составлена общепринятым способом.
[0117]
В описании настоящего изобретения парентеральное введение включает подкожную инъекцию, внутривенную инъекцию, внутримышечную инъекцию, интраперитонеальную инъекцию, капельное или местное введение (внутрисуставное введение, трансдермальное введение, трансокулярное введение, транспульмонарное или бронхиальное введение, трансназальное введение, трансректальное введение, и тому подобное), и тому подобное.
[0118]
Дозу соединения по настоящему изобретению определяют в соответствии с возрастом, массой тела, общим состоянием здоровья, полом, рационом питания, временем введения, способом введения, скоростью выведения и степенью развития заболевания, лечение которого пациенты проходят в настоящий момент, и дополнительно принимая во внимание другие факторы. Хотя суточная доза соединения по настоящему изобретению варьирует в зависимости от состояния и массы тела пациента, вида соединения, способа введения и тому подобного, его вводят парентерально, например, в дозе приблизительно от 0,001 до 100 мг на пациента в сутки путем подкожного, внутривенного, внутримышечного, внутрисуставного, трансдермального, трансокулярного, транспульмонарного или бронхиального, трансназального или ректального введения, или путем перорального введения в дозе приблизительно от 0,01 до 1000 мг на пациента в сутки.
[Примеры]
[0119]
Настоящее изобретение объясняется более подробно в дальнейшем со ссылкой на примеры получения, примеры и экспериментальные примеры, которые никоим образом не ограничивают настоящее изобретение.
[0120]
Пример получения 1: Получение 4-(4-этил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0121]

[0122]
К 5-этил-5-(4-метилфенил)имидазолидин-2,4-диону (1,01 г) добавляли воду (40 мл), 1 н водный раствор гидроксида натрия (7,7 мл) и перманганат калия (2,26 г) и смесь перемешивали при комнатной температуре в течение 30 минут и при 80°C в течение 1 часа 30 минут. Реакционную смесь охлаждали до комнатной температуры и выливали в смесь льда и концентрированной хлористоводородной кислоты, добавляли этилацетат и насыщенный солевой раствор. После фильтрации через целит, фильтрат экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. После обработки активированным углем, фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (989 мг).
MS(ESI)m/z:249(M+H)+
[0123]
Пример получения 2: Получение 2-фтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0124]

[0125]
К 1-(3-фтор-4-метилфенил)этанону (5,20 г) добавляли этанол (20,6 мл) и 28% водный аммиак (15,5 мл), затем карбонат аммония (13,12 г), карбонат калия (5,66 г) и триметилсилилцианид (5,33 мл) и смесь перемешивали при комнатной температуре в течение 4 дней. Реакционную смесь охлаждали льдом и подкисляли путем добавления по каплям концентрированной хлористоводородной кислоты. Осажденное твердое вещество собирали фильтрованием с получением 5-(3-фтор-4-метилфенил)-5-метилимидазолидин-2,4-диона (7,02 г).
К полученному 5-(3-фтор-4-метилфенил)-5-метилимидазолидин-2,4-диону (3,00 г) добавляли воду (30 мл), 1 н водный раствор гидроксида натрия (27 мл) и перманганат калия (6,61 г) и смесь перемешивали при комнатной температуре в течение 30 минут и 80°C в течение 90 мин. Реакционную смесь охлаждали льдом, медленно добавляли этанол (30 мл) и смесь перемешивали при той же температуре в течение 10 мин и при комнатной температуре в течение 1 часа. После фильтрации через целит, фильтрат концентрировали при пониженном давлении, и выпаривали этанол. Оставшийся водный раствор охлаждали льдом и подкисляли концентрированной хлористоводородной кислотой. Добавляли хлорид натрия и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель выпаривали, к полученному остатку добавляли уксусную кислоту (50 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (2,05 г).
MS(ESI)m/z:251(M-H)-
[0126]
Пример получения 3: Получение 2-бром-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0127]

[0128]
К суспензии 1-(3-бром-4-метилфенил)этанона (3,97 г), этанола (7,5 мл), 28% водного аммиака (5,6 мл), карбоната аммония (7,16 г) и карбоната калия (3,08 г) добавляли триметилсилилцианид (2,79 мл) и смесь перемешивали при комнатной температуре в течение 16 часов и затем при 60°C в течение 6 часов. К реакционной смеси добавляли воду, и осажденный кристалл собирали фильтрованием с получением 5-(3-бром-4-метилфенил)-5-метилимидазолидин-2,4-диона (4,4 г).
Смешанный раствор полученного 5-(3-бром-4-метилфенил)-5-метилимидазолидин-2,4-диона (4,0 г) и перманганата калия (6,7 г) в 1 н водном растворе гидроксида натрия (28 мл) и воде (113 мл) перемешивали при 95°C в течение 2 часов и при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли этанол (20 мл) и смесь перемешивали в течение 1 часа. После фильтрации через целит, фильтрат концентрировали при пониженном давлении, и выпаривали этанол. Полученный водный раствор подкисляли 1н хлористоводородной кислотой и экстрагировали этилацетатом. Растворитель выпаривали, к полученному остатку добавляли уксусную кислоту (20 мл) и смесь перемешивали при 100°C в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (3,94 г).
MS(ESI)m/z:313(M+H)+
[0129]
Пример получения 4: Получение 5-(4-метил-2,5-диоксоимидазолидин-4-ил)пиридин-2-карбоновой кислоты
[0130]
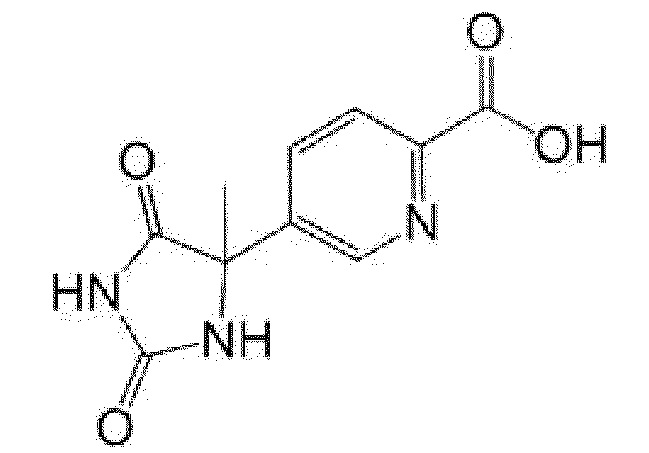
[0131]
К 1-(6-метилпиридин-3-ил)этанону (3,00 г) добавляли этанол (12 мл) и 28% водный раствор аммиака (9 мл) и затем карбонат аммония (8,53 г), карбонат калия (3,68 г) и триметилсилилцианид (3,46 мл) и смесь перемешивали при комнатной температуре в течение 5 дней. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли воду, и смесь нейтрализовали концентрированной хлористоводородной кислотой. Добавляли хлорид натрия и смесь экстрагировали этилацетатом/тетрагидрофуран. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и растворитель выпаривали. Полученный остаток перекристаллизовывали из смеси гексан/этилацетат с получением 5-метил-5-(6-метилпиридин-3-ил)имидазолидин-2,4-диона (4,18 г).
К полученному 5-метил-5-(6-метилпиридин-3-ил)имидазолидин-2,4-диону (3,67 г) добавляли воду (50 мл), 1 н водный раствор гидроксида натрия (21,5 мл) и перманганат калия (8,76 г) и смесь перемешивали при 60°C в течение 2 часов и 80°C в течение 3 часов. Реакционную смесь охлаждали до комнатной температуры, добавляли этанол (30 мл), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли активированный уголь и смесь фильтровали. Фильтрат концентрировали при пониженном давлении и выпаривали этанол. К остатку добавляли воду, и концентрированную хлористоводородную кислоту добавляли при охлаждении льдом (pH 4-5). Осадок собирали фильтрованием с получением указанного в заголовке соединения (3,27 г).
MS(ESI)m/z:236(M+H)+
[0132]
Пример получения 5: Получение 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0133]

[0134]
К 5-изопропил-5-(п-толил)имидазолидин-2,4-диону (450 мг) добавляли 1 н водный раствор гидроксида натрия (4,0 мл) и перманганат калия (920 мг) и смесь перемешивали при комнатной температуре в течение 3 часов и при 70°C в течение 2 часов. К реакционной смеси добавляли этанол при охлаждении льдом, и смесь перемешивали при в течение 3 часов. После фильтрации через целит, фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли воду и 1 н хлористоводородную кислоту и осадок собирали фильтрованием с получением указанного в заголовке соединения (350 мг).
MS(ESI)m/z:261(M-H)-
[0135]
Пример получения 6: Получение 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0136]

[0137]
К (R)-5-метил-5-(п-толил)имидазолидин-2,4-диону (2,21 г), синтезированному в соответствии с методом, описанным Chirality, 4, pages 400-403 (1992), добавляли перманганат калия (6,84 г), 1 н водный раствор гидроксида натрия (21,6 мл), воду (86 мл) и смесь перемешивали при 95°C в течение 4 часов. При комнатной температуре, добавляли этанол (20 мл) и смесь перемешивали в течение 1 часа. После фильтрации через целит, добавляли 1н хлористоводородную кислоту к фильтрату (приблизительно pH 4), и смесь экстрагировали этилацетатом. После промывки насыщенным солевым раствором, растворитель выпаривали при пониженном давлении. К остатку добавляли уксусную кислоту (50 мл) и смесь перемешивали при 110°C в течение 1 часа. Нерастворимый материал удаляли горячим фильтрованием горячей и фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (1,7 г).
MS(ESI)m/z:235(M+H)+
[0138]
Пример получения 7: Получение 4-(4-бутил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0139]

[0140]
К смеси 4-метилвалерофенона (1,00 г), карбоната аммония (2,18 г), карбоната калия (0,94 г) и 28% водного раствора аммиака (1,98 мл) последовательно добавляли этанол (2,84 мл) и триметилсилилцианид (0,851 мл) и смесь перемешивали при 60°C в течение 8 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением 5-бутил-5-(п-толил)имидазолидин-2,4-диона (0,449 г).
К полученному 5-бутил-5-(п-толил)имидазолидин-2,4-диону (0,444 г) добавляли 1 н водный раствор гидроксида натрия (3,6 мл), перманганат калия (0,853 г) и воду (14,4 мл) и смесь перемешивали при 95°C в течение 2 часов. Реакционной смеси давали остыть до комнатной температуры, добавляли этанол (3,4 мл) и смесь перемешивали в течение 1 часа. После фильтрации через целит, к фильтрату добавляли 1 н хлористоводородную кислоту (7,5 мл) и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,472 г).
MS(ESI)m/z:277(M+H)+
[0141]
Пример получения 8: Получение 2-метил-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0142]
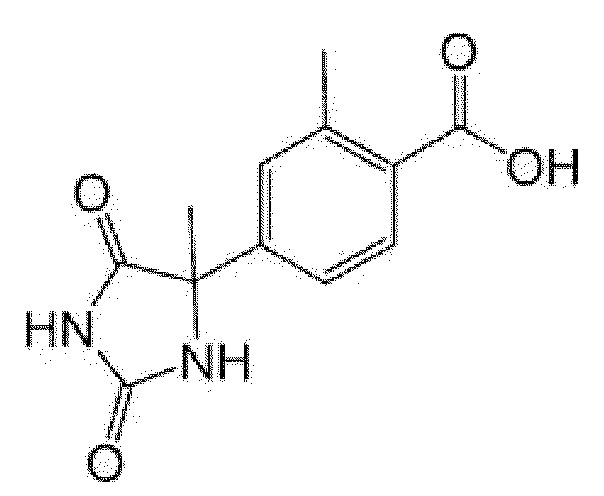
[0143]
К метиловому эфиру 4-ацетил-2-метилбензойной кислоты (1 г) добавляли этанол (4 мл), 28% водный раствор аммиака (3 мл), карбонат аммония (2 г), триметилсилилцианид (0,774 мл) и карбонат калия (0,863 г) и смесь перемешивали при 60°C в течение 6 часов. Добавляли 28% водный раствор аммиака (1,5 мл) и смесь перемешивали при 60°C в течение 1,5 часов. Реакционную смесь подкисляли добавлением воды и концентрированной хлористоводородной кислоты при охлаждении льдом, и осадок собирали фильтрованием. Полученный осадок суспендировали в гексане/этилацетате и собирали фильтрованием с получением метилового эфира 2-метил-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (0,975 г).
Полученный метиловый эфир 2-метил-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (0,872 г) растворяли в уксусной кислоте (13 мл), добавляли концентрированную хлористоводородную кислоту (13 мл) и смесь перемешивали при 80°C в течение 15 часов. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли воду и осадок собирали фильтрованием с получением указанного в заголовке соединения (0,794 г).
MS(ESI)m/z:247(M-H)-
[0144]
Пример получения 9: Получение 4-(4-метоксиметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0145]

[0146]
В потоке азота, раствор метилового эфира 4-(хлорформил)бензойной кислоты (2,17 г) в ацетонитриле (20 мл) охлаждали льдом, затем по каплям добавляли 0,6 M раствор (36,4 мл) гексана триметилсилилдиазометана, и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь охлаждали льдом, добавляли метанол (10 мл) и диэтиловый эфир трифторида бора (2,05 мл) и смесь перемешивали в течение 2 часов. К реакционной смеси добавляли этилацетат и органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением метилового эфира 4-(2-метоксиацетил)бензойной кислоты (1,68 г).
К полученному метиловому эфиру 4-(2-метоксиацетил)бензойной кислоты (916 мг) добавляли 28% аммониевую воду (2 мл) и этанол (5 мл), затем добавляли карбонат аммония (1,69 г), карбонат калия (1,22 г) и триметилсилилцианид (1,14 мл), и смесь перемешивали при комнатной температуре в течение 8 дней. Реакционную смесь охлаждали льдом, подкисляли путем добавления воды (10 мл) и концентрированной серной кислоты (30 мл) и перемешивали при 100°C в течение 2 часов и 120°C в течение 3 часов. При охлаждении льдом, к реакционной смеси добавляли насыщенный солевой раствор, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель выпаривали и к полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (759 мг).
MS(ESI)m/z:263(M-H)-
[0147]
Пример получения 10: Получение 4-(2,5-диоксо-4-трифторметилимидазолидин-4-ил)бензойной кислоты
[0148]
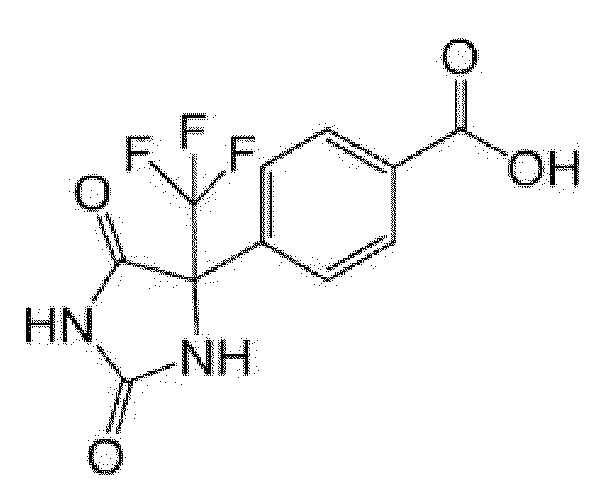
[0149]
К 4-(трифторацетил)бензойной кислоте (218 мг) добавляли 28% водный аммиак (1 мл) и воду (1 мл), затем добавляли карбонат аммония (768 мг), карбонат калия (828 мг) и триметилсилилцианид (0,52 мл), и смесь перемешивали при комнатной температуре в течение 4 часов и 80°C в течение 8 часов. Реакционную смесь охлаждали льдом, подкисляли добавлением концентрированной хлористоводородной кислоты, добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель выпаривали и к полученному остатку добавляли гексан/этилацетат. Осадок собирали фильтрованием с получением указанного в заголовке соединения (136 мг).
MS(ESI)m/z:287(M-H)-
[0150]
Пример получения 11: Получение 4-(4-циклопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0151]

[0152]
Метиловый эфир 4-циклопропанкарбонилбензойной кислоты (488 мг) растворяли в тетрагидрофуране (5 мл) и метаноле (3 мл) и, при охлаждении льдом добавляли 1 н водный раствор гидроксида натрия (3,59 мл) и смесь перемешивали в течение 30 минут и при комнатной температуре в течение 2 часов. Реакционную смесь охлаждали льдом, добавляли 1н хлористоводородную кислоту (5 мл), и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель выпаривали с получением 4-циклопропанкарбонилбензойной кислоты (441 мг).
К полученной 4-циклопропанкарбонилбензойной кислоте (433 мг) добавляли 28% водный аммиак (6 мл), воду (2 мл), карбонат аммония (2,62 г), карбонат калия (1,89 мг) и триметилсилилцианид (1,69 мл) и смесь перемешивали при 80°C в течение 34 часов. При охлаждении льдом, реакционную смесь подкисляли добавлением воды и концентрированной хлористоводородной кислоты, и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия, и растворитель выпаривали. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (589 мг).
MS(ESI)m/z:259(M-H)-
[0153]
Пример получения 12: Получение 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-2-фторбензойной кислоты
[0154]
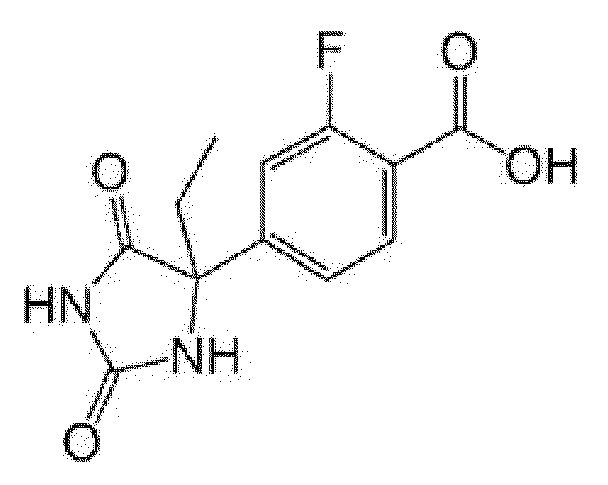
[0155]
К 1-(3-фтор-4-метилфенил)пропан-1-ону (3,84 г) добавляли этанол (30 мл), 28% водный аммиак (15 мл), карбонат аммония (6,82 г), карбонат калия (4,91 г) и триметилсилилцианид (4,6 мл) и смесь перемешивали при комнатной температуре в течение 20 часов и 80°C в течение 20 часов. Добавляли 28% водный аммиак (15 мл), карбонат аммония (6,82 г), карбонат калия (4,91 г) и триметилсилилцианид (4,6 мл) и смесь перемешивали при комнатной температуре в течение 4 дней. Реакционную смесь подкисляли добавлением воды и концентрированной хлористоводородной кислоты и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и растворитель выпаривали. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением 5-этил-5-(3-фтор-4-метилфенил)имидазолидин-2,4-диона (3,56 г).
К полученному 5-этил-5-(3-фтор-4-метилфенил)имидазолидин-2,4-диону (1,59 г) добавляли воду (16 мл), 12 н водный раствор гидроксида натрия (3,37 мл) и перманганат калия (3,30 г) и смесь перемешивали при 80°C в течение 2,5 часов. Реакционную смесь охлаждали льдом, добавляли этанол (15 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Оставшийся водный раствор подкисляли концентрированной хлористоводородной кислотой при охлаждении льдом. Добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом/тетрагидрофураном. Растворитель выпаривали и добавляли к полученному остатку уксусную кислоту (20 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,52 г).
MS(ESI)m/z:265(M-H)-
[0156]
Пример получения 13: Получение 4-(4-трет-бутил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0157]
[0158]
К смеси 2,2-диметил-1-(4-метилфенил)пропан-1-она (9,85 г), трет-бутанола (100 мл) и воды (50 мл) добавляли 4 н водный раствор гидроксида натрия (27,9 мл) и перманганат калия (30,91 г) и смесь перемешивали при 60°C в течение 3 дней. Реакционную смесь охлаждали льдом, добавляли этанол (100 мл), и смесь перемешивали при комнатной температуре. К реакционной смеси добавляли активированный уголь и смесь фильтровали. Фильтрат подкисляли концентрированной хлористоводородной кислотой, и смесь концентрировали при пониженном давлении (выпаривание этанола). Осадок собирали фильтрованием с получением 4-(2,2-диметилпропионил)бензойной кислоты (10,2 г).
К 4-(2,2-диметилпропионил)бензойной кислоте (4 г) добавляли 28% водный аммиак (20 мл), карбонат аммония (7,44 г), карбонат калия (5,36 г) и триметилсилилцианид (5,04 мл) и смесь перемешивали при микроволновом излучении при 120°C в течение 1 часа. Реакционную смесь подкисляли при охлаждении льдом посредством добавления концентрированной хлористоводородной кислоты. Осадок собирали фильтрованием с получением указанного в заголовке соединения (5,32 г).
MS(ESI)m/z:275(M-H)-
[0159]
Пример получения 14: Получение 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0160]
[0161]
(2R)-2-амино-2-(4-метилфенил)карбоновая кислота•гидрохлорид (965 мг) растворяли в воде (10 мл), добавляли цианид натрия (812 мг) и смесь перемешивали при комнатной температуре в течение 16,5 часов и 100°C в течение 2,5 часов. Реакционной смеси давали остыть до комнатной температуры, добавляли 1н хлористоводородную кислоту и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток растворяли в уксусной кислоте и смесь перемешивали при 70°C в течение 2,5 часов. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли 1н хлористоводородную кислоту и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением (R)-5-этил-5-(п-толил)имидазолидин-2,4-диона (720 мг).
К полученному (R)-5-этил-5-(п-толил)имидазолидин-2,4-диону (550 мг) добавляли 1 н водный раствор гидроксида натрия (7,5 мл), перманганат калия (996 мг) и воду (2,5 мл) и смесь перемешивали при 70°C в течение 2 часов. К реакционной смеси добавляли этанол, и смесь перемешивали при комнатной температуре в течение 20 мин. После фильтрации через целит, фильтрат концентрировали при пониженном давлении. К оставшемуся водному раствору добавляли 1н хлористоводородную кислоту (pH<2), и осадок собирали фильтрованием с получением указанного в заголовке соединения (560 мг).
MS(APCI)m/z:247(M-H)-
[0162]
Пример получения 15: Получение 2-фтор-4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0163]

[0164]
К 1-(3-фтор-4-метил-фенил)-2-метил-пропан-1-ону (4360 мг) добавляли этанол (5 мл), карбонат аммония (768 мг), карбонат калия (415 мг), 28% водный раствор аммиака (5 мл) и триметилсилилцианид (0,40 мл) и смесь перемешивали при 70°C в течение 8 часов. К реакционной смеси добавляли 1 н хлористоводородную кислоту (pH<2) и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением 5-(3-фтор-4-метилфенил)-5-изопропилимидазолидин-2,4-диона (390 мг).
Полученный 5-(3-фтор-4-метилфенил)-5-изопропилимидазолидин-2,4-дион (390 мг) растворяли в 1 н водном растворе гидроксида натрия (2,8 мл), добавляли перманганат калия (440 мг) и воду (5 мл) и смесь перемешивали при комнатной температуре в течение 9 часов. К реакционной смеси добавляли этанол и смесь перемешивали при комнатной температуре в течение 30 минут. После фильтрации через целит, фильтрат концентрировали при пониженном давлении. К оставшемуся водному раствору добавляли 1н хлористоводородную кислоту (pH<2), и осадок собирали фильтрованием с получением указанного в заголовке соединения (83 мг).
[0165]
Пример получения 16: Получение 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)бензойной кислоты
[0166]

[0167]
К смеси 1-(п-толил)бутан-1-она (4,87 г), карбоната аммония (11,5 г), карбоната калия (4,98 г), 28% водного раствора аммиака (10,5 мл) последовательно добавляли этанол (15 мл) и триметилсилилцианид (4,46 мл) и смесь перемешивали при 60°C в течение 15 часов. Реакционной смеси давали остыть до комнатной температуры, добавляли воду, и осадок собирали фильтрованием с получением 5-пропил-5-(п-толил)имидазолидин-2,4-диона (5,58 г).
К полученному 5-пропил-5-(п-толил)имидазолидин-2,4-диону (2,0 г) добавляли 1 н водный раствор гидроксида натрия (17,2 мл), воду (69 мл) и перманганат калия (4,08 г) и смесь перемешивали при 95°C в течение 2 часов. К реакционной смеси добавляли этанол, и смесь перемешивали при комнатной температуре в течение 1 часа. После фильтрации через целит, фильтрат концентрировали при пониженном давлении. К оставшемуся водному раствору добавляли концентрированную хлористоводородную кислоту (примерно pH 1), и осадок собирали фильтрованием с получением указанного в заголовке соединения (2,32 г).
MS(ESI)m/z:261(M-H)-
[0168]
Пример получения 17: Получение 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)-2-фторбензойной кислоты
[0169]

[0170]
К раствору 1-(3-фтор-4-метилфенил)бутан-1-она (997 мг) в этаноле (2,8 мл) добавляли карбонат аммония (2,13 г), карбонат калия (918 мг), 28% водный раствор аммиака (1,94 мл) и триметилсилилцианид (0,823 мл) и смесь перемешивали при 75°C в течение 2 часов и 60°C в течение 1 часа. Смесь оставляли стоять при комнатной температуре в течение ночи, добавляли 28% водный раствор аммиака (2 мл) и смесь перемешивали при 60°C в течение 6,5 часов. Реакционной смеси давали остыть до комнатной температуры, добавляли воду и осадок собирали фильтрованием с получением 5-(3-фтор-4-метилфенил)-5-пропилимидазолидин-2,4-диона (803 мг).
К полученному 5-(3-фтор-4-метилфенил)-5-пропилимидазолидин-2,4-диону (790 мг) добавляли 1 н водный раствор гидроксида натрия (6,31 мл), воду (25,3 мл), перманганат калия (1,50 г) и смесь перемешивали при 95°C в течение 1 часа. К реакционной смеси добавляли этанол, и смесь перемешивали при комнатной температуре в течение 1 часа. После фильтрации через целит, фильтрат концентрировали при пониженном давлении. Оставшийся водный раствор подкисляли концентрированной хлористоводородной кислотой, и экстрагировали этилацетатом. Растворитель выпаривали и к полученному остатку добавляли гексан/этилацетат. Осадок собирали фильтрованием с получением указанного в заголовке соединения (664 мг).
MS(ESI)m/z:279(M-H)-
[0171]
Пример получения 18: Получение 3-фтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0172]

[0173]
К суспензии 1-(2-фтор-4-метилфенил)этанона (5,53 г), этанола (14,5 мл), 28% водного аммиака (10 мл), карбоната аммония (13,9 г), карбоната калия (6,0 г) добавляли триметилсилилцианид (5,4 мл) и смесь перемешивали при 60°C в течение 2 часов и 80°C в течение 1,5 часов. К реакционной смеси добавляли воду, и осадок собирали фильтрованием с получением 5-(2-фтор-4-метилфенил)-5-метилимидазолидин-2,4-диона (4,69 г).
К полученному 5-(2-фтор-4-метилфенил)-5-метилимидазолидин-2,4-диону (4,69 г) добавляли перманганат калия (10,0 г), 1 н водный раствор гидроксида натрия (42 мл) и воду (168 мл) и смесь перемешивали при 95°C в течение 2,5 часов. К реакционной смеси добавляли этанол (40 мл) и смесь перемешивали при комнатной температуре. После фильтрации через целит, к фильтрату добавляли 1 н хлористоводородную кислоту (примерно pH 4), и осадок собирали фильтрованием с получением указанного в заголовке соединения (3,38 г).
MS(ESI)m/z:251(M-H)-
[0174]
Пример получения 19: Получение 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-2-метилбензойной кислоты
[0175]

[0176]
К суспензии 1-(4-бром-3-метилфенил)пропан-1-она (1,03 г), этанола (4,5 мл), 28% водного аммиака (1,5 мл), карбоната аммония (1,7 г), карбоната калия (746 мг) добавляли триметилсилилцианид (676 мкл) и смесь перемешивали при комнатной температуре в течение 2 часов и 60°C в течение 2 часов. К реакционной смеси добавляли триметилсилилцианид (169 мкл) и карбонат калия (186 мг) и смесь перемешивали при 60°C в течение 1 часа. К реакционной смеси добавляли воду, и осадок собирали фильтрованием с получением 5-(4-бром-3-метилфенил)-5-этилимидазолидин-2,4-диона (990 мг).
Смесь полученного 5-(4-бром-3-метилфенил)-5-этилимидазолидин-2,4-диона (985 мг), цианида цинка (233 мг), цинка (26 мг), 1,1'-бис(дифенилфосфино)ферроцена (183 мг), аддукта трис(дибензилиденацетон)дипалладий(0) хлороформ (171 мг) и N,N-диметилацетамида (10 мл) перемешивали при 130°C в течение 6,5 часов. К реакционной смеси добавляли воду и насыщенный водный раствор гидрокарбоната натрия и смесь фильтровали через целит. Фильтрат экстрагировали этилацетатом, и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-2-метилбензонитрила (360 мг).
К полученному 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-2-метилбензонитрилу (360 мг) добавляли уксусную кислоту (5 мл) и концентрированную хлористоводородную кислоту (5 мл) и смесь перемешивали при 80°C в течение 2 дней. К реакционной смеси добавляли концентрированную серную кислоту (2,0 мл) и смесь перемешивали при 100°C в течение 1 дня и при 120°C в течение 1 дня. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали, к полученному остатку добавляли воду, и осадок собирали фильтрованием с получением указанного в заголовке соединения в виде неочищенного продукта (270 мг).
MS(ESI)m/z:263(M+H)+
[0177]
Пример получения 20: Получение 4-(3-этил-2,5-диоксопирролидин-3-ил)бензойной кислоты
[0178]

[0179]
К 3-этил-3-(4-метилфенил)пирролидин-2,5-диону (2,0 г) добавляли воду (40 мл), добавляли 1 н водный раствор гидроксида натрия (18,41 мл) и перманганат калия (4,36 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли этанол (20 мл) и смесь перемешивали в течение 1 часа и фильтровали через целит. Фильтрат концентрировали при пониженном давлении и подкисляли путем добавления концентрированной хлористоводородной кислоты. Осадок собирали фильтрованием с получением указанного в заголовке соединения (1,63 г).
MS(ESI)m/z:246(M-H)-
[0180]
Пример получения 21: Получение 3-йод-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0181]

[0182]
К суспензии 1-(2-йод-4-метилфенил)этанона (3,9 г), этанола (7,5 мл), 28% водного аммиака (5 мл), карбоната аммония (5,7 г) и карбоната калия (2,5 г) добавляли триметилсилилцианид (2,81 мл) и смесь перемешивали при 60°C в течение 4,5 часов. К реакционной смеси добавляли воду, и осадок собирали фильтрованием с получением 5-(3-йод-4-метилфенил)-5-метилимидазолидин-2,4-диона (3,77 г).
К полученному 5-(3-йод-4-метилфенил)-5-метилимидазолидин-2,4-диону (1,65 г) добавляли 1 н водный раствор гидроксида натрия (10 мл), воду (40 мл) и перманганат калия (2,37 г) и смесь перемешивали при 95°C в течение 5 часов. К реакционной смеси добавляли этанол (10 мл) и смесь перемешивали при комнатной температуре и фильтровали через целит. Фильтрат подкисляли 1 н хлористоводородной кислотой и экстрагировали этилацетатом. Растворитель выпаривали и к полученному остатку добавляли уксусную кислоту (20 мл), и смесь перемешивали при 80°C в течение 3 часов. Смесь концентрировали при пониженном давлении, к полученному остатку добавляли гексан/этилацетат, и осадок собирали фильтрованием с получением указанного в заголовке соединения (1,39 г).
MS(ESI)m/z:361(M+H)+
[0183]
Пример получения 22: Получение 3-метокси-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0184]
[0185]
К 4-ацетил-3-метоксибензойной кислоте (0,5 г) добавляли воду (2,3 мл), карбонат аммония (0,99 г), карбонат калия (1,07 г), 28% водный аммиак (2,3 мл) и триметилсилилцианид (643 мкл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь подкисляли 1н хлористоводородной кислотой. Осадок собирали фильтрованием с получением указанного в заголовке соединения (0,466 г).
MS(APCI)m/z:265(M+H)+
[0186]
Пример получения 23: Получение 4-(4-гидроксиметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0187]
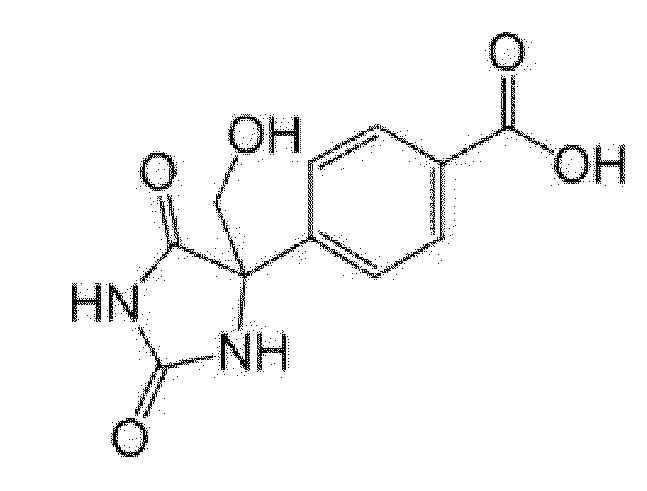
[0188]
К 4-(4-метоксиметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (200 мг), описанной в примере получения 9, добавляли 1 M раствор трибромид бора/дихлорметан (7,57 мл) и смесь перемешивали при комнатной температуре в течение 4 дней. Реакционную смесь охлаждали льдом, добавляли воду и нерастворимый материал отфильтровывали. Фильтрат концентрировали при пониженном давлении, к полученному остатку добавляли метанол, и смесь концентрировали при пониженном давлении. К полученному остатку добавляли уксусную кислоту (2 мл) и концентрированную хлористоводородную кислоту (2 мл) и смесь перемешивали при 80°C в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (126 мг).
MS(ESI)m/z:249(M-H)-, 251(M+H)+
[0189]
Пример получения 24: Получение 4-(4-этоксиметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0190]

[0191]
Раствор метил-4-(хлорформил)бензойной кислоты (6,00 г) в ацетонитриле (60 мл) охлаждали льдом, 0,6 M добавляли по каплям раствор триметилсилилдиазометан/гексан (75,5 мл) и смесь перемешивали при той же температуре в течение 30 минут и при комнатной температуре в течение 2 часов. Реакционную смесь охлаждали льдом, добавляли по каплям этанол (30 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:хлороформ) с получением метилового эфира 4-(2-диазоацетил)бензойной кислоты (4,83 г).
Метиловый эфир 4-(2-диазоацетил)бензойной кислоты (4,82 г) растворяли в тетрагидрофуране (50 мл) и метаноле (30 мл) и, при охлаждении льдом, добавляли 1 н водный раствор гидроксида натрия (32,5 мл), и смесь перемешивали при той же температуре в течение 30 минут и при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли 1 н хлористоводородную кислоту (50 мл) и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток растворяли в ацетонитриле (50 мл) и этаноле (50 мл) и, при охлаждении льдом, добавляли по каплям диэтиловый эфир трифторида бора (7 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь охлаждали льдом, добавляли солевой раствор и смесь экстрагировали этилацетатом. После обработки активированным углем, растворитель выпаривали с получением 4-(2-этоксиацетил)бензойной кислоты (4,25 г).
К 4-(2-этоксиацетил)бензойной кислоте (4,24 г) добавляли воду (20 мл), 28% водный аммиак (20 мл), карбонат аммония (7,83 г), карбонат калия (8,44 г) и триметилсилилцианид (5,29 мл) и смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь подкисляли концентрированной хлористоводородной кислотой и экстрагировали этилацетатом. Растворитель выпаривали, к полученному остатку добавляли 2 M раствора хлороводород/этанол (80 мл), и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии и колоночной хроматографии с NH (хлороформ:метанол) с получением этилового эфира 4-(4-этоксиметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (2,66 г).
К этиловому эфиру 4-(4-этоксиметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (2,64 г) при охлаждении льдом добавляли 1 н водный раствор гидроксида натрия (26 мл) и смесь перемешивали в течение 2 часов. К реакционной смеси добавляли 1 н хлористоводородную кислоту (30 мл) и осажденное твердое вещество собирали путем фильтрования с получением указанного в заголовке соединения (2,28 г).
MS(ESI)m/z:277(M-H)-
[0192]
Пример получения 25: Получение 4-[4-(1-метокси-1-метилэтил)-2,5-диоксоимидазолидин-4-ил]бензойной кислоты
[0193]

[0194]
В потоке азота, к раствору метилового эфира 4-(2-гидрокси-2-метилпропионил)бензойной кислоты (222 мг) в тетрагидрофуране (3 мл) добавляли при охлаждении льдом метилиодид (0,186 мл) и 60% гидрид натрия (160 мг) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду (3 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Смесь подкисляли 1н хлористоводородной кислотой и экстрагировали этилацетатом. После обработки активированным углем, растворитель выпаривали с получением метилового эфира 4-(2-метокси-2-метилпропионил)бензойной кислоты (234 мг).
К полученному метиловому эфиру 4-(2-метокси-2-метилпропионил)бензойной кислоты (225 мг) добавляли карбонат аммония (481 мг), карбонат калия (415 мг), триметилсилилцианид (0,389 мл) и 28% водный аммиак (2 мл) и смесь перемешивали при микроволновом излучении при 100°C в течение 50 мин. Реакционную смесь подкисляли добавлением воды и концентрированной хлористоводородной кислоты и экстрагировали этилацетатом/тетрагидрофураном. Растворитель выпаривали и к полученному остатку добавляли гексан/этилацетат. Осадок собирали фильтрованием с получением указанного в заголовке соединения (101,5 мг).
MS(ESI)m/z:291(M-H)-
[0195]
Пример получения 26: Получение 2,3-дифтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0196]

[0197]
К 1-(2,3-дифтор-4-метилфенил)этанону (2 г) добавляли этанол (6 мл), карбонат аммония (4,52 г), карбонат калия (1,95 г), 28% водный аммиак (4,1 мл) и триметилсилилцианид (1,8 мл) и смесь перемешивали при 60°C в течение 4 часов. Добавляли 28% водный аммиак (3 мл) и карбонат аммония (2,2 г) и смесь перемешивали при 60°C в течение 2 часов. К реакционной смеси добавляли воду и смесь перемешивали в течение 1 часа при охлаждении льдом. Осажденное твердое вещество собирали фильтрованием с получением 5-(2,3-дифтор-4-метилфенил)-5-метилимидазолидин-2,4-диона (2,2 г).
К полученному 5-(2,3-дифтор-4-метилфенил)-5-метилимидазолидин-2,4-диону (1 г) добавляли воду (33 мл), 1 н водный раствор гидроксида натрия (8,3 мл) и перманганат калия (1,97 г) и смесь перемешивали при 90°C в течение 3 часов. К реакционной смеси добавляли этанол (6 мл) и смесь перемешивали в течение 1 часа и фильтровали через целит. Фильтрат концентрировали при пониженном давлении, подкисляли 1н хлористоводородной кислотой и смесь экстрагировали этилацетатом. Растворитель выпаривали, к полученному остатку добавляли диизопропиловый эфир, и осадок собирали фильтрованием с получением указанного в заголовке соединения (0,91 г).
MS(APCI)m/z:269(M-H)-
[0198]
Пример получения 27: Получение 4-(4-изобутил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0199]

[0200]
К 4-(3-метилбутирил)бензойной кислоте (1,68 г) добавляли карбонат аммония (3,13 г), карбонат калия (1,35 г), 28% водный раствор аммиака (5,0 мл), этанол (6,7 мл) и триметилсилилцианид (1,21 мл) и смесь перемешивали при 60°C в течение 17 часов. К реакционной смеси добавляли карбонат аммония (1,565 г), карбонат калия (1,35 г), 28% водный раствор аммиака (1,0 мл), этанол (1,5 мл) и триметилсилилцианид (1,21 мл) и смесь перемешивали при 60°C в течение 24 часов. При охлаждении льдом, реакционную смесь подкисляли добавлением воды и концентрированной хлористоводородной кислоты, и осадок собирали фильтрованием. Полученный осадок суспендировали в гексане/этилацетате/этаноле и собирали путем фильтрования с получением указанного в заголовке соединения (1,91 г).
MS(ESI)m/z:275(M-H)-
[0201]
Пример получения 28: Получение 2-фтор-4-(4-метоксиметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0202]
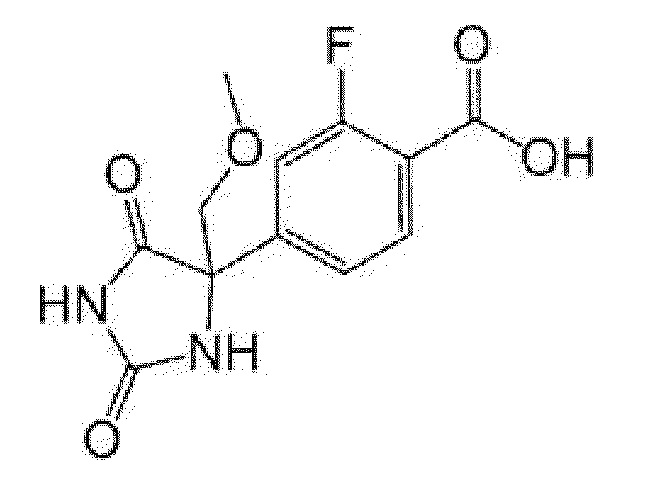
[0203]
К смеси 1-(3-фтор-4-метилфенил)-2-метоксиэтанона (2,11 г), карбоната аммония (4,18 г), карбоната калия (3,20 г), этанола (8,4 мл) и 28% водного аммиака (6,3 мл) добавляли триметилсилилцианид (3,10 мл) и смесь перемешивали при 60°C в течение 1,5 часов. Добавляли карбонат аммония (4,18 г), карбонат калия (3,20 г), этанол (8,4 мл), 28% водный аммиак (6,3 мл) и триметилсилилцианид (3,10 мл), и смесь перемешивали при 60°C в течение ночи. При охлаждении льдом, реакционную смесь подкисляли концентрированной хлористоводородной кислотой. Осадок собирали фильтрованием с получением 5-(3-фтор-4-метилфенил)-5-метоксиметилимидазолидин-2,4-диона (2,74 г).
К полученному 5-(3-фтор-4-метилфенил)-5-метоксиметилимидазолидин-2,4-диону (2,74 г) добавляли воду (27,4 мл), 12 н водный раствор гидроксида натрия (1,81 мл) и перманганат калия (3,60 г) и смесь перемешивали при комнатной температуре в течение 6 часов. Добавляли перманганат калия (3,42 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли этанол и смесь фильтровали через целит. Фильтрат концентрировали при пониженном давлении, к полученному остатку добавляли воду и концентрированную хлористоводородную кислоту, и осадок собирали фильтрованием с получением 2-фтор-4-(4-метоксиметил-2,5-диоксоимидазолин-4-ил)бензойной кислоты в виде неочищенного продукта (1,50 г).
К раствору полученного неочищенного продукта (1,03 г) 2-фтор-4-(4-метоксиметил-2,5-диоксоимидазолин-4-ил)бензойной кислоты в метаноле (15 мл) добавляли при охлаждении льдом концентрированную серную кислоту (5,15 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением метил 2-фтор-4-(4-метоксиметил-2,5-диоксоимидазолин-4-ил)бензоата (293 мг).
К полученному метил 2-фтор-4-(4-метоксиметил-2,5-диоксоимидазолин-4-ил)бензоату (293 мг) добавляли 1 н водный раствор гидроксида натрия (2,96 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли 1 н хлористоводородную кислоту, и осадок собирали фильтрованием с получением указанного в заголовке соединения (230 мг).
MS(ESI)m/z:281(M-H)-
[0204]
Пример получения 29: Получение 2-фтор-4-((R)-4-метил-2,5-диоксоимидазолидин-4ил)бензойной кислоты
[0205]

[0206]
К смешанному раствору 5-(3-фтор-4-метилфенил)-5-метилимидазолидин-2,4-диона (6,77 г), описанного в примере получения 2, воды (57,6 мл) и 1 н водного раствора гидроксида натрия (21,3 мл) добавляли (S)-1-фенилэтиламин (11,8 мл). Добавляли воду (49,4 мл) и этанол (12,1 мл) и осадок растворяли путем нагревания. Смеси давали остыть до комнатной температуры, и осадок собирали фильтрованием с получением (R)-5-(3-фтор-4-метилфенил)-5-метилимидазолидин-2,4-дион•(S)-1-фенилэтиламиновой соли в виде неочищенного продукта (2,67 г). К полученному неочищенному продукту (2,67 г) добавляли воду (40 мл) и смесь нагревали с обратным холодильником в течение 3 часов. Смеси давали остыть до комнатной температуры и осадок собирали фильтрованием с получением (R)-5-(3-фтор-4-метилфенил)-5-метилимидазолидин-2,4-дион•(S)-1-фенилэтиламиновой соли (2,23 г).
К (R)-5-(3-фтор-4-метилфенил)-5-метилимидазолидин-2,4-дион•(S)-1-фенилэтиламиновой соли (2,58 г) добавляли воду (77,4 мл) и 1н хлористоводородную кислоту (77,4 мл) и смесь перемешивали при комнатной температуре в течение 30 минут. Осажденное твердое вещество собирали фильтрованием с получением (R)-5-(3-фтор-4-метилфенил)-5-метилимидазолидин-2,4-диона (1,71 г).
К (R)-5-(3-фтор-4-метилфенил)-5-метилимидазолидин-2,4-диону (1,7 г) добавляли воду (17 мл), 12 н водный раствор гидроксида натрия (1,12 мл) и перманганат калия (2,24 г) и смесь перемешивали при комнатной температуре в течение 48 часов. К реакционной смеси добавляли этанол и смесь фильтровали через целит. Фильтрат концентрировали при пониженном давлении, к полученному остатку добавляли воду и концентрированную хлористоводородную кислоту, и осадок собирали фильтрованием. Полученный осадок суспендировали в гексане/этилацетате, и собирали путем фильтрования с получением указанного в заголовке соединения (1,49 г).
MS(ESI)m/z:251(M-H)-
[0207]
Пример получения 30: Получение 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)-3-фторбензойной кислоты
[0208]
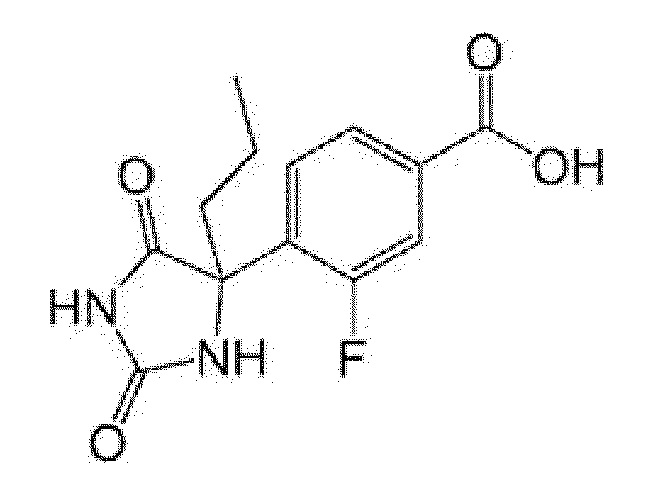
[0209]
При охлаждении льдом, к раствору 2-фтор-N-метокси-4,N-диметилбензамида (1,50 г) в тетрагидрофуране (20 мл) добавляли раствор н-пропилмагнийбромид/тетрагидрофуран (1,02 M) (8,0 мл) и смесь перемешивали в течение 2 часов. К реакционной смеси добавляли 1 н хлористоводородную кислоту (20 мл) и смесь экстрагировали этилацетатом. Полученный органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением 1-(2-фтор-4-метилфенил)бутан-1-она (677 мг).
К раствору 1-(2-фтор-4-метилфенил)бутан-1-она (675 мг) в этаноле (1,89 мл) добавляли карбонат аммония (1,44 г), карбонат калия (621 мг), 28% водный раствор аммиака (1,31 мл) и триметилсилилцианид (0,557 мл) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли 28% водный раствор аммиака (1,00 мл), карбонат аммония (1,00 г) и триметилсилилцианид (0,20 мл) и смесь перемешивали при 45°C в течение 9 часов. Реакционной смеси давали остыть до комнатной температуры, добавляли воду и осажденное твердое вещество собирали фильтрованием с получением 5-(2-фтор-4-метилфенил)-5-пропилимидазолидин-2,4-диона (572 мг).
К 5-(2-фтор-4-метилфенил)-5-пропилимидазолидин-2,4-диону (569 мг) добавляли 1 н водный раствор гидроксида натрия (4,54 мл), воду (18,2 мл) и перманганат калия (1,08 г) и смесь перемешивали при комнатной температуре в течение 15 часов и при 60°C в течение 3 часов. Реакционной смеси давали остыть до комнатной температуры, добавляли этанол и смесь перемешивали в течение 1 часа. После фильтрации через целит, фильтрат концентрировали при пониженном давлении для выпаривания этанола. При охлаждении льдом, к оставшемуся водному раствору добавляли концентрированную хлористоводородную кислоту (примерно pH 1), и осажденное твердое вещество собирали путем фильтрования с получением указанного в заголовке соединения (352 мг).
MS(ESI)m/z:279(M-H)-
[0210]
Пример получения 31: Получение 4-[2,5-диоксо-4-(3,3,3-трифторпропил)имидазолидин-4-ил]бензойной кислоты
[0211]

[0212]
К метиловому эфиру 4-(4,4,4-трифторбутирил)бензойной кислоты (200 мг) добавляли метанол (0,5 мл) и 1 н водный раствор гидроксида натрия (1,55 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли 1 н хлористоводородную кислоту (pH<2) и смесь экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 4-(4,4,4-трифторбутирил)бензойной кислоты (183 мг).
К полученной 4-(4,4,4-трифторбутирил)бензойной кислоте (180 мг) добавляли карбонат аммония (280 мг), карбонат калия (200 мг), 28% водный раствор аммиака (2,5 мл), этанол (2,5 мл) и триметилсилилцианид (0,15 мл) и смесь перемешивали при микроволновом излучении при 100°C в течение 2 часов. Реакционной смеси давали остыть до комнатной температуры, добавляли 1 н хлористоводородную кислоту (pH<2), и осадок собирали фильтрованием с получением указанного в заголовке соединения (169 мг).
[0213]
Пример получения 32: Получение 4-[2,5-диоксо-4-(тетрагидропиран-4-ил)имидазолидин-4-ил]бензойной кислоты
[0214]
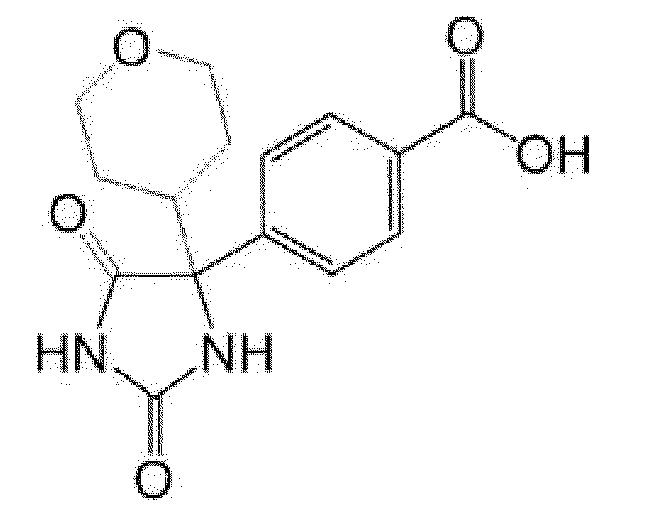
[0215]
К 4-(4-метилбензоил)оксану (0,2 г) добавляли карбонат аммония (0,377 г), карбонат калия (0,163 г), 28% водный раствор аммиака (0,343 мл), этанол (0,98 мл), воду (0,98 мл) и триметилсилилцианид (0,147 мл) и смесь перемешивали при 60°C в течение ночи. Добавляли карбонат аммония (0,377 г), карбонат калия (0,163 г), 28% водный раствор аммиака (0,343 мл) и триметилсилилцианид (0,147 мл), и смесь перемешивали при микроволновом излучении при 100°C в течение 2,5 часов. Добавляли карбонат аммония (0,377 г), карбонат калия (0,163 г), 28% водный раствор аммиака (0,343 мл) и триметилсилилцианид (0,147 мл) и смесь перемешивали при микроволновом излучении при 100°C в течение 1,5 часов. Реакционную смесь подкисляли 1н хлористоводородной кислотой и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. К полученному остатку добавляли гексан и осадок собирали фильтрованием с получением 5-(тетрагидропиран-4-ил)-5-(п-толил)имидазолидин-2,4-диона (0,186 г).
К полученному 5-(тетрагидропиран-4-ил)-5-(п-толил)имидазолидин-2,4-диону (0,180 г) добавляли 1 н водный раствор гидроксида натрия (0,132 мл), перманганат калия (0,332 г) и воду (0,528 мл) и смесь перемешивали при комнатной температуре в течение 11 часов. К реакционной смеси добавляли этанол (1,32 мл) и смесь фильтровали через целит. Фильтрат концентрировали при пониженном давлении, подкисляли 1н хлористоводородной кислотой, и экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением указанного в заголовке соединения (0,183 г).
MS(ESI)m/z:303(M-H)-
[0216]
Пример получения 33: Получение 4-(4-циклобутил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0217]
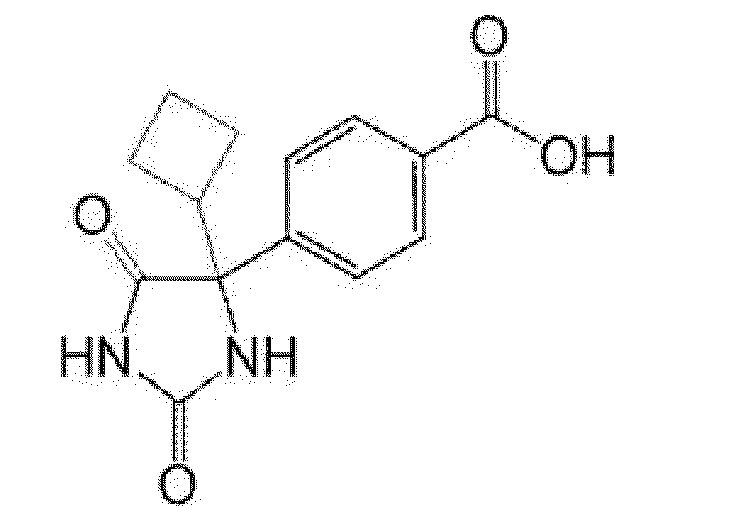
[0218]
К циклобутил(п-толил)метанону (4,75 г) добавляли карбонат аммония (10,47 г), карбонат калия (4,52 г), 28% водный раствор аммиака (9,54 мл), этанол (54,6 мл), воду (27,3 мл) и триметилсилилцианид (4,09 мл) и смесь перемешивали при 60°C в течение ночи. При охлаждении льдом, к реакционной смеси добавляли воду и осадок собирали фильтрованием. Полученный осадок растворяли в этилацетате, раствор промывали 1 н хлористоводородной кислотой и насыщенным солевым раствором, и сушили над безводным сульфатом магния. Растворитель выпаривали и к полученному остатку добавляли гексан, и осадок собирали фильтрованием с получением 5-циклобутил-5-п-толилимидазолидин-2,4-диона (3,64 г).
К полученному 5-циклобутил-5-п-толилимидазолидин-2,4-диону (3,64 г) добавляли 1 н водный раствор гидроксида натрия (298 мл), перманганат калия (4,94 г) и воду (119 мл) и смесь перемешивали при комнатной температуре в течение 16 часов и при 50°C в течение 6 часов. К реакционной смеси добавляли диметилсульфоксид (1,49 мл) и смесь фильтровали через целит. Фильтрат подкисляли 1 н хлористоводородной кислотой и осадок собирали фильтрованием с получением указанного в заголовке соединения (3,78 г).
MS(ESI)m/z:273(M-H)-
[0219]
Пример получения 34: Получение 4-(4-циклопропил-2,5-диоксоимидазолидин-4-ил)-2-фторбензойной кислоты
[0220]

[0221]
К раствору циклопропил(3-фтор-4-метилфенил)метанона (2,11 г) в этаноле (6,1 мл) последовательно добавляли карбонат аммония (4,66 г), карбонат калия (2 г), 28% водный раствор аммиака (4,24 мл) и триметилсилилцианид (1,8 мл) и смесь перемешивали при комнатной температуре в течение ночи и затем при 60°C в течение 4 часов. Добавляли 28% водный раствор аммиака (4,24 мл), карбонат аммония (4,66 г), триметилсилилцианид (1,8 мл), карбонат калия (2 г) и этанол (6,1 мл) и смесь перемешивали при 45°C в течение 6 часов и при 60°C в течение 7 часов. Реакционной смеси давали остыть до комнатной температуры, добавляли воду и смесь экстрагировали этилацетатом. Полученный органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле (гексан:этилацетат) с получением 5-циклопропил-5-(3-фтор-4-метилфенил)имидазолидин-2,4-диона (1,1 г).
К полученному 5-циклопропил-5-(3-фтор-4-метилфенил)имидазолидин-2,4-диону (1,08 г) добавляли 1 н водный раствор гидроксида натрия (9 мл), воду (36 мл) и перманганат калия (1,37 г) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли перманганат калия (500 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали через целит и полученный фильтрат подкисляли концентрированной хлористоводородной кислотой и разделяли хлороформом. Водный слой концентрировали при пониженном давлении и осажденное твердое вещество собирали путем фильтрования с получением указанного в заголовке соединения (500 мг).
MS(ESI)m/z:279(M+H)+
[0222]
Пример получения 35: Получение 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-3-метоксибензойной кислоты
[0223]
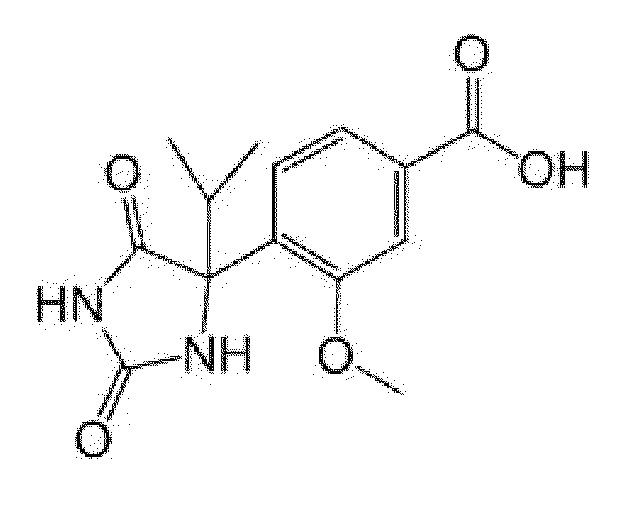
[0224]
1) Получение 4-изобутирил-3-метоксибензойной кислоты
К 1-(4-бром-2-метоксифенил)-2-метилпропан-1-ону (7,97 г) добавляли ацетат палладия (0,674 г), 1,1'-бис(дифенилфосфино)ферроцен (0,832 г), метанол (24,3 мл), N,N-диметилформамид (75 мл) и триэтиламин (8,36 мл) и смесь перемешивали в атмосфере монооксида углерода при 80°C в течение 5 часов. Реакционную смесь выливали в холодную воду и смесь экстрагировали этилацетатом. К органическому слою добавляли SH силикагель, активированный уголь и безводный сульфат натрия и смесь фильтровали. Фильтрат концентрировали при пониженном давлении, к полученному остатку добавляли воду и смесь экстрагировали диэтиловым эфиром. К органическому слою добавляли SH силикагель, активированный уголь и безводный сульфат натрия и смесь фильтровали. Фильтрат концентрировали при пониженном давлении с получением метилового эфира 4-изобутирил-3-метоксибензойной кислоты (7,015 г).
К раствору полученного метилового эфира 4-изобутирил-3-метоксибензойной кислоты (7,01 г) в тетрагидрофуране (148 мл) добавляли 2 н водный раствор гидроксида натрия (44,5 мл) и смесь перемешивали при комнатной температуре в течение 15 часов. Реакционную смесь концентрировали при пониженном давлении, и оставшийся водный раствор разделяли гексаном. Водный слой подкисляли 2 н хлористоводородной кислотой и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. К полученному остатку добавляли гексан/диизопропиловый эфир, и осадок собирали фильтрованием с получением 4-изобутирил-3-метоксибензойной кислоты (4,426 г).
[0225]
2) Получение 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-3-метоксибензойной кислоты
К 4-изобутирил-3-метоксибензойной кислоте (0,571 г), описанной в вышеупомянутом 1), добавляли воду (2,3 мл), карбонат аммония (1,98 г), карбонат калия (1,07 г), 28% водный аммиак (4,6 мл) и триметилсилилцианид (1,29 мл) и смесь перемешивали при 60°C в течение 8 часов. Реакционную смесь подкисляли 1 н хлористоводородной кислотой и осажденное твердое вещество собирали фильтрованием с получением 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-3-метоксибензойной кислоты (0,69 г).
MS(APCI)m/z:293(M+H)+
[0226]
Пример получения 36: Получение 4-[4-(2-метоксиэтил)-2,5-диоксоимидазолидин-4-ил]бензойной кислоты
[0227]
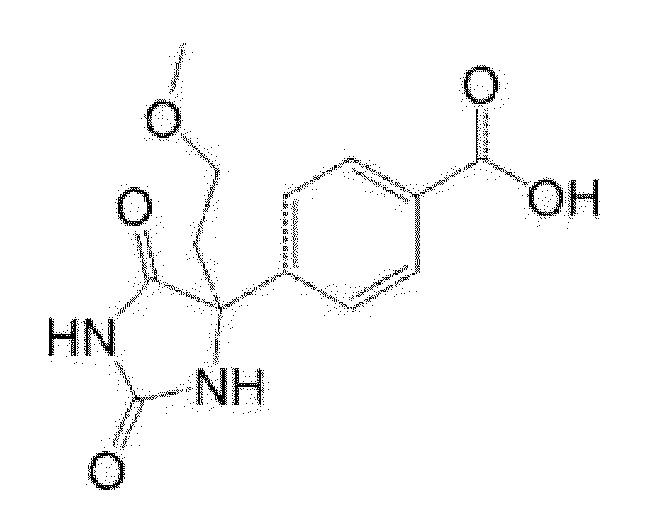
[0228]
К 3-метокси-1-(4-метилфенил)пропан-1-ону (651 мг) и карбонату аммония (1,24 г) добавляли карбонат калия (0,949 г), этанол (2,6 мл), 28% водный аммиак (2 мл) и триметилсилилцианид (893 мкл) и смесь перемешивали при 60°C в течение ночи. При охлаждении льдом, реакционную смесь подкисляли концентрированной хлористоводородной кислотой. Осадок собирали фильтрованием с получением 5-(2-метоксиэтил)-5-(п-толил)имидазолидин-2,4-диона (690 мг).
К полученному 5-(2-метоксиэтил)-5-(п-толил)имидазолидин-2,4-диону (670 мг) добавляли воду (6,7 мл), 12 н водный раствор гидроксида натрия (0,45 мл) и перманганат калия (0,9 г) и смесь перемешивали при комнатной температуре в течение 30 часов. Добавляли перманганат калия (0,86) и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь охлаждали льдом, добавляли этанол и смесь перемешивали при комнатной температуре в течение 30 минут. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении.
К полученному остатку добавляли воду и концентрированную хлористоводородную кислоту, и смесь фильтровали. Фильтрат экстрагировали смешанным растворителем из хлороформа и этанола. Органический слой сушили над безводным сульфатом магния, и растворитель выпаривали с получением указанного в заголовке соединения в виде неочищенного продукта (280 мг).
MS(ESI)m/z:277(M-H)-
[0229]
Пример получения 37: Получение 4-(2,5-диоксо-4-фенилимидазолидин-4-ил)бензойной кислоты
[0230]

[0231]
К п-бензоилбензойной кислоте (2 г) добавляли карбонат аммония (3,4 г), карбонат калия (3,67 г), триметилсилилцианид (2,3 мл), 28% водный аммиак (10 мл), воду (10 мл) и метанол (20 мл) и смесь перемешивали при 60°C в течение ночи. Добавляли карбонат аммония (3,4 г), карбонат калия (3,67 г), триметилсилилцианид (2,3 мл), 28% водный аммиак (10 мл) и метанол (10 мл) и смесь перемешивали при 60°C в течение ночи. Кроме того, добавляли карбонат калия (2,44 г) и триметилсилилцианид (2,3 мл), и смесь перемешивали при 60°C в течение ночи.
При охлаждении льдом, реакционную смесь подкисляли добавлением воды и концентрированной хлористоводородной кислоты и смесь экстрагировали этилацетатом. Растворитель выпаривали, к полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (2,6 г).
MS(ESI)m/z:295(M-H)-
[0232]
Пример получения 38: Получение 4-[4-(2-метокси-1,1-диметилэтил)-2,5-диоксоимидазолидин-4-ил]бензойной кислоты
[0233]

[0234]
К раствору 3-метокси-2,2-диметилпропановой кислоты (2 г) в хлороформе (20 мл) добавляли при охлаждении льдом оксалилхлорид (1,95 мл) и N,N-диметилформамид (одна капля), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли толуол (50 мл), 4-(метоксикарбонил)фенилборную кислоту (2 г), трикалийфосфат (4,72 г), бис(трициклогексилфосфин)палладий(II) дихлорид (390 мг) и воду (0,6 мл) и смесь перемешивали в потоке азота в течение 30 минут при нагревании с обратным холодильником. Реакционную смесь охлаждали до комнатной температуры, добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над сульфатом натрия и растворитель выпаривали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением метилового эфира 4-(3-метокси-2,2-диметилпропионил)бензойной кислоты (570 мг). К полученному метиловому эфиру 4-(3-метокси-2,2-диметилпропионил)бензойной кислоты (560 мг) добавляли метанол (5 мл), тетрагидрофуран (5 мл) и 1 н водный раствор гидроксида натрия (4,5 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли этилацетат и осуществляли обратную экстракцию с использованием воды и водного раствора карбоната калия. Разделенный водный слой объединяли, подкисляли концентрированной хлористоводородной кислотой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и растворитель выпаривали при пониженном давлении с получением 4-(3-метокси-2,2-диметилпропионил)бензойной кислоты (518 мг).
К 4-(3-метокси-2,2-диметилпропионил)бензойной кислоте (503 мг) добавляли карбонат аммония (1,02 г), карбонат калия (1,47 г), триметилсилилцианид (831 мкл), 28% водный раствор аммиака (6 мл) и воду (3 мл) и смесь перемешивали при микроволновом излучении при 150°C в течение 1 часа. Добавляли триметилсилилцианид (831 мкл) и смесь перемешивали при микроволновом излучении при 150°C в течение 1 часа. Кроме того, добавляли карбонат калия (1,47 г), триметилсилилцианид (1662 мкл) и 28% водный раствор аммиака (3 мл) и смесь перемешивали при микроволновом излучении при 150°C в течение 2 часов. К реакционной смеси добавляли воду и этилацетат, и смесь подкисляли концентрированной хлористоводородной кислотой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и растворитель выпаривали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (552 мг).
MS(ESI)m/z:307(M+H)+
[0235]
Пример получения 39: Получение 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-3-метилбензойной кислоты
[0236]

[0237]
К 1-(4-бром-2-гидроксифенил)-2-метилпропан-1-ону (12,89 г) добавляли 1,1'-бис(дифенилфосфино)ферроцен (2,94 г), ацетат дипалладия(II) (595 мг), N,N-диметилформамид (133 мл), метанол (42,9 мл) и триэтиламин (22,2 мл) и смесь перемешивали в атмосфере монооксида углерода при 80°C в течение 14 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Экстракт сушили над безводным сульфатом натрия и растворитель выпаривали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением метилового эфира 3-гидрокси-4-изобутирилбензойной кислоты (10,14 г).
К раствору полученного метилового эфира 3-гидрокси-4-изобутирилбензойной кислоты (5 г) в дихлорметане (225 мл) добавляли N,N-диизопропилэтиламин (19,6 мл) и N-фенилбис(трифторметансульфонимид) (16,1 г) и смесь перемешивали при комнатной температуре в течение 20 часов. Добавляли N-фенилбис(трифторметансульфонимид) (9,0 г) и смесь перемешивали при комнатной температуре в течение 33 часов. Кроме того, добавляли N-фенилбис(трифторметансульфонимид) (9,0 г) и N,N-диизопропилэтиламин (5 мл), и смесь перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь промывали водой и насыщенным солевым раствором, сушили над сульфатом натрия, и растворитель выпаривали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии на силикагеле (гексан:этилацетат) с получением метилового эфира 4-изобутирил-3-трифторметансульфонилоксибензойной кислоты (7,99 г).
К полученному метиловому эфиру 4-изобутирил-3-трифторметансульфонилоксибензойной кислоты (7 г) добавляли аддукт [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид•дихлорметан (806 мг), карбонат калия (6,82 г), 1,4-диоксан (132 мл) и 2,4,6-триметилбороксин (5,5 мл) и смесь перемешивали в атмосфере аргона при 110°C в течение 3 часов. При комнатной температуре, к реакционной смеси добавляли активированный уголь и силикагель без тяжелых металлов (SH силикагель), и смесь фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением метилового эфира 4-изобутирил-3-метилбензойной кислоты (3,97 г).
К полученному метиловому эфиру 4-изобутирил-3-метилбензойной кислоты (2,2 г) добавляли метанол (5 мл), 1 н водный раствор гидроксида натрия (15 мл) и тетрагидрофуран (8 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь выливали в воду со льдом и добавляли 1 н хлористоводородную кислоту. Осажденное твердое вещество собирали фильтрованием с получением 4-изобутирил-3-метилбензойной кислоты. К полученной 4-изобутирил-3-метилбензойной кислоте добавляли этанол (5 мл), 28% водный раствор аммиака (3,5 мл), карбонат аммония (3,8 г), карбонат калия (1,66 г) и триметилсилилцианид (1,5 мл) и смесь перемешивали при 60°C в течение 8 часов. Добавляли триметилсилилцианид (3,75 мл) и карбонат калия (6,9 г) и смесь перемешивали при 80-100°C в течение 1 дня. Кроме того, добавляли триметилсилилцианид (3,75 мл) и карбонат калия (6,9 г), и смесь перемешивали при 60°C в течение 1 дня. Реакционную смесь нейтрализовали концентрированной хлористоводородной кислотой и экстрагировали этилацетатом. Растворитель выпаривали при пониженном давлении, к полученному остатку добавляли 1н хлористоводородную кислоту, воду и метанол, и осадок собирали фильтрованием с получением указанного в заголовке соединения в виде неочищенного продукта (943 мг).
MS(ESI)m/z:275(M-H)-
[0238]
Пример получения 40: Получение 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-3-фторбензойной кислоты
[0239]

[0240]
К 1-(4-бром-2―фторфенил)пропан-1-ону (2,3 г) добавляли этанол (5 мл), 28% водный раствор аммиака (3,5 мл), карбонат аммония (3,8 г), карбонат калия (1,66 г) и триметилсилилцианид (1,5 мл) и смесь перемешивали при 50°C в течение приблизительно 5 часов. Добавляли триметилсилилцианид (0,25 мл), карбонат калия (830 мг) и 28% водный раствор аммиака (1,5 мл) и смесь перемешивали при 60°C в течение 8 часов. К реакционной смеси добавляли воду, и осадок собирали фильтрованием. Полученный осадок суспендировали в диэтиловом эфире/гексане и собирали фильтрованием с получением 5-(4-бром-2-фторфенил)-5-этилимидазолидин-2,4-диона (795 мг).
К полученному 5-(4-бром-2-фторфенил)-5-этилимидазолидин-2,4-диону (789 мг) добавляли цианид цинка (450 мг), цинк (25 мг), 1,1'-бис(дифенилфосфино)ферроцен (177 мг), трис(дибензилиденацетон)дипалладий(0) (146 мг) и N,N-диметилформамид (10 мл) и смесь перемешивали при 130°C в течение 7 часов. Реакционную смесь очищали при помощи колоночной хроматографии (гексан:этилацетат). Растворитель выпаривали и к полученному остатку добавляли гексан/этилацетат. Осадок собирали фильтрованием с получением 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-3-фторбензонитрила (225 мг).
К полученному 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-3-фторбензонитрилу (220 мг) добавляли уксусную кислоту (1 мл), концентрированную хлористоводородную кислоту (1 мл) и концентрированную серную кислоту (1 мл) и смесь перемешивали при 120°C в течение 8,5 часов. Добавляли воду и осажденное твердое вещество собирали путем фильтрования с получением указанного в заголовке соединения (211 мг).
MS(ESI)m/z:265(M-H)-
[0241]
Пример получения 41: Получение 4-(3-метил-2,5-диоксопирролидин-3-ил)бензойной кислоты
[0242]

[0243]
К 3-метил-3-(4-метилфенил)пирролидин-2,5-диону (698 мг) добавляли 1 н водный раствор гидроксида натрия (7,0 мл), воду (28 мл) и перманганат калия (1,09 г) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли этанол и смесь перемешивали при комнатной температуре в течение 2 часов и фильтровали через целит. Фильтрат концентрировали при пониженном давлении, к полученному остатку добавляли уксусную кислоту (50 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 6 часов. К реакционной смеси добавляли толуол (50 мл), устанавливали ловушку Дина-Старка и смесь нагревали с обратным холодильником в течение 1 часа. Растворитель выпаривали, добавляли уксусную кислоту (50 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 6 часов. Растворитель выпаривали при пониженном давлении, к полученному остатку добавляли воду и насыщенный солевой раствор, и смесь экстрагировали тетрагидрофураном. Полученный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (512 мг).
MS(ESI)m/z:232(M-H)-
[0244]
Пример получения 42: Получение 4-[4-(3-метоксипропил)-2,5-диоксоимидазолидин-4-ил]бензойной кислоты
[0245]
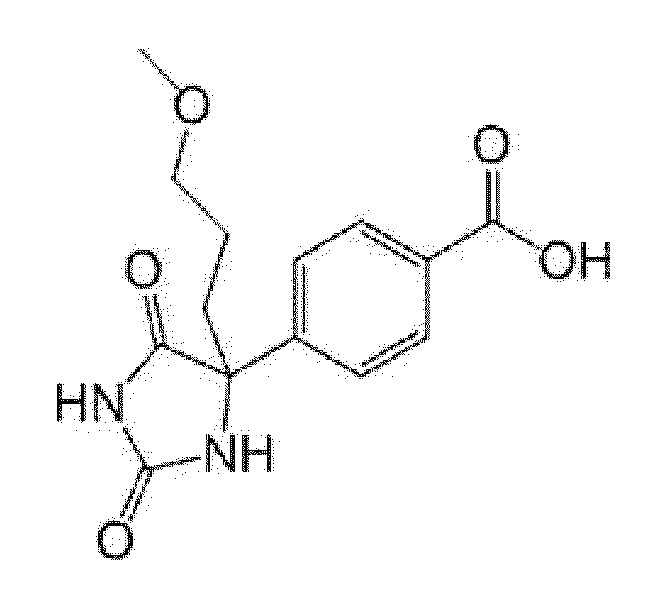
[0246]
К раствору 4-метоксимасляной кислоты (2,0 г) в хлороформе (20 мл) добавляли N,N-диметилформамид (0,17 мл) и оксалилхлорид (2,41 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, реакционную смесь концентрировали при пониженном давлении. К полученному остатку добавляли тетрагидрофуран (30 мл), 4-(этоксикарбонил)фенилцинк бромид (0,5 M, раствор тетрагидрофурана) (23,4 мл) и бис(трифенилфосфин)палладий(II) дихлорид (0,41 г) и смесь перемешивали при комнатной температуре в течение 2 часов и при 60°C в течение 2 часов. К реакционной смеси добавляли 1 н хлористоводородную кислоту и смесь экстрагировали диэтиловым эфиром. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель выпаривали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением этил 4-(4-метоксибутирил)бензоата (830 мг).
К полученному этил 4-(4-метоксибутирил)бензоату (830 мг) добавляли этанол (8 мл), тетрагидрофуран (8 мл) и 1 н водный раствор гидроксида натрия (6,6 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли этилацетат и смесь подвергали обратной экстракции водой и водным раствором гидрокарбоната натрия. Разделенные водные слои объединяли и подкисляли концентрированной хлористоводородной кислотой. Осадок собирали фильтрованием с получением 4-(4-метоксибутирил)бензойной кислоты (490 мг).
К полученной 4-(4-метоксибутирил)бензойной кислоте (480 мг) добавляли этанол (1,9 мл), карбонат аммония (0,78 г), карбонат калия (0,597 г), 28% водный аммиак (1,4 мл), триметилсилилцианид (0,562 мл) и смесь перемешивали при 60°C в течение ночи. Реакционную смесь подкисляли концентрированной хлористоводородной кислотой при охлаждении льдом, и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель выпаривали и к полученному остатку добавляли гексан/этилацетат. Осадок собирали фильтрованием с получением указанного в заголовке соединения (650 мг).
MS(ESI)m/z:293(M+H)+
[0247]
Пример получения 43: Получение 5-(4-трет-бутил-2,5-диоксоимидазолидин-4-ил)пиридин-2-карбоновой кислоты
[0248]
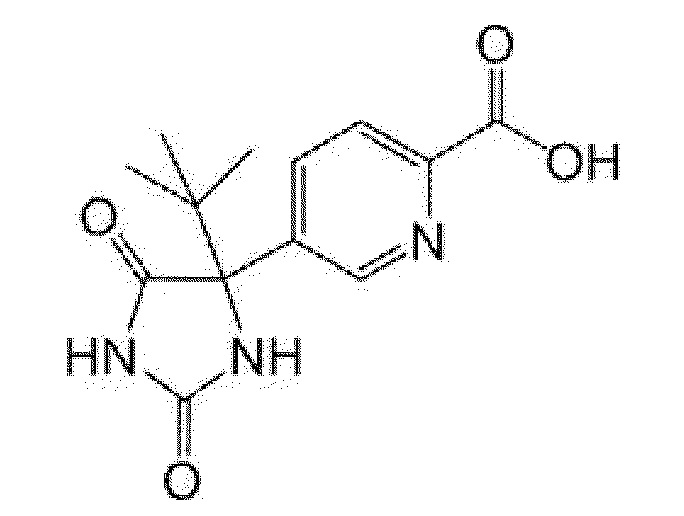
[0249]
К 2,2-диметил-1-(6-метилпиридин-3-ил)пропан-1-ону (674 мг) добавляли этанол (5,4 мл), 28% водный аммиак (4 мл), карбонат аммония (1,33 г), карбонат калия (1,02 г), триметилсилилцианид (0,959 мл) и смесь перемешивали при микроволновом излучении при 130°C в течение 1 часа. Реакционную смесь нейтрализовали добавлением воды и концентрированной хлористоводородной кислотой, и осадок собирали фильтрованием с получением 5-трет-бутил-5-(6-метилпиридин-3-ил)имидазодин-2,4-диона (403 мг).
К полученному 5-трет-бутил-5-(6-метилпиридин-3-ил)имидазодин-2,4-диону (403 мг) добавляли воду (4 мл), 12 н водный раствор гидроксида натрия (0,272 мл) и перманганат калия (0,54 г) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли перманганат калия (128 мг) и смесь перемешивали при комнатной температуре в течение 2 часов, и при 50°C в течение ночи. Кроме того, добавляли перманганат калия (128 мг) и смесь перемешивали при 50°C в течение 7 часов. К реакционной смеси добавляли этанол и смесь фильтровали через целит. Фильтрат нейтрализовали концентрированной хлористоводородной кислотой и концентрировали при пониженном давлении. К полученному остатку добавляли воду и смесь экстрагировали смешанным растворителем из этилацетата и тетрагидрофурана. Растворитель выпаривали и к полученному остатку добавляли гексан/этилацетат. Осадок собирали фильтрованием с получением указанного в заголовке соединения (247 мг).
MS(ESI)m/z:278(M+H)+
[0250]
Пример получения 44: Получение 4-[4-(1-метоксициклопропил)-2,5-диоксоимидазолидин-4-ил]бензойной кислоты
[0251]

[0252]
В потоке азота, раствор 1-гидроксициклопропанкарбоновой кислоты (1,41 г) в хлороформе (14 мл) охлаждали льдом, добавляли оксалилхлорид (2,08 мл) и N,N-диметилформамид (одна капля) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли толуол (40 мл), 4-(метоксикарбонил)фенилборную кислоту (2,18 г), трикалийфосфат (5,59 г) и бис(трициклогексилфосфин)палладий(II) дихлорид (426 мг) и, в потоке азота, смесь перемешивали при 60°C в течение 1 часа и при 80°C в течение 1 часа. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением метилового эфира 4-(1-метоксициклопропанкарбонил)бензойной кислоты (325 мг).
К полученному метиловому эфиру 4-(1-метоксициклопропанкарбонил)бензойной кислоты (315 мг) добавляли метанол (3 мл), тетрагидрофуран (3 мл) и 1 н водный раствор гидроксида натрия (2,68 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь подкисляли 1 н хлористоводородной кислотой, добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом, экстракт сушили над сульфатом натрия, и растворитель выпаривали с получением 4-(1-метоксициклопропанкарбонил)бензойной кислоты (232 мг).
К полученной 4-(1-метоксициклопропанкарбонил)бензойной кислоте (225 мг) добавляли карбонат аммония (490 мг), карбонат калия (423 мг), триметилсилилцианид (0,398 мл) и 28% водный аммиак (2 мл) и смесь перемешивали при микроволновом излучении при 80°C в течение 30 минут и при 100°C в течение 1 часа. Реакционную смесь подкисляли концентрированной хлористоводородной кислотой, добавляли воду и смесь экстрагировали смешанным растворителем из этилацетата и тетрагидрофурана. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (283 мг).
MS(ESI)m/z:289(M-H)-
[0253]
Пример получения 45: Получение 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0254]

[0255]
1) Получение 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты•(R)-(+)-1-фенилэтиламиновой соли
К 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (200 мг), описанной в примере получения 5, добавляли воду (8 мл), 1 н водный раствор гидроксида натрия (0,458 мл) и (R)-1-фенилэтиламин (59 мкл) и смесь перемешивали при 110°C. После подтверждения полного растворения смеси давали остыть до комнатной температуры, и осажденное твердое вещество собирали фильтрованием с получением 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты•(R)-(+)-1-фенилэтиламиновой соли в виде неочищенного продукта (76,4 мг). К полученной 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте•(R)-(+)-1-фенилэтиламиновой соли в виде неочищенного продукта (76,3 мг) добавляли воду (3 мл) и смесь перемешивали при 80°C в течение 20 минут. Смеси давали остыть до комнатной температуры и осажденное твердое вещество собирали фильтрованием с получением 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты•(R)-1-фенилэтиламиновой соли (37,2 мг, 99,7%э.и.).
[0256]
2) Получение 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту•(R)-1-фенилэтиламиновую соль (55,36 г, 97,1%э.и.), полученную способом, аналогичным вышеупомянутому 1), суспендировали в воде (250 мл) и подкисляли (pH 1-2) 1н хлористоводородной кислотой (155 мл). Смесь перемешивали при комнатной температуре в течение 1 часа и осадок собирали фильтрованием с получением 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (32,42 г, 98,7%э.и.).
MS(ESI)m/z:263(M+H)+
[0257]
Пример получения 46: Получение 6-(4-трет-бутил-2,5-диоксоимидазолидин-4-ил)никотиновой кислоты
[0258]
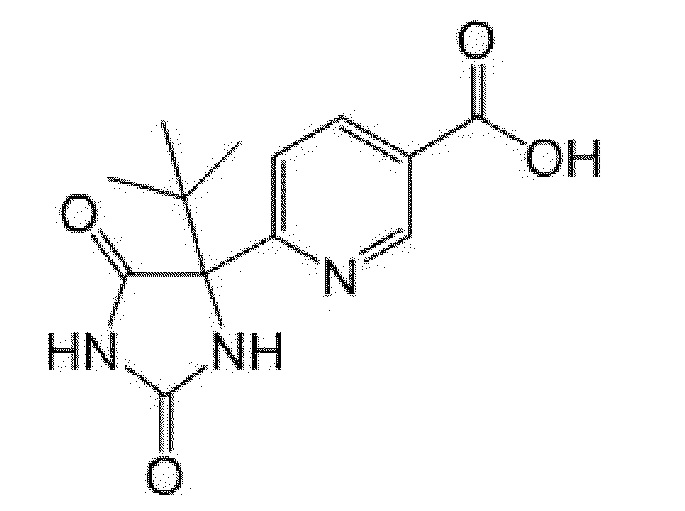
[0259]
К 2,2-диметил-1-(5-метилпиридин-2-ил)пропан-1-ону (0,3 г) добавляли воду (1 мл), этанол (1 мл), 28% водный раствор аммиака (0,592 мл), карбонат аммония (0,65 г), карбонат калия (0,327 г) и триметилсилилцианид (0,296 мл) и смесь перемешивали при микроволновом излучении при 130°C в течение 1 часа. Реакционную смесь нейтрализовали концентрированной хлористоводородной кислотой и добавляли воду. Осадок собирали фильтрованием с получением 5-трет-бутил-5-(5-метилпиридин-2-ил)имидазолидин-2,4-диона (0,287 г).
К полученному 5-трет-бутил-5-(5-метилпиридин-2-ил)имидазолидин-2,4-диону (0,281 г) добавляли 1 н водный раствор гидроксида натрия (2,28 мл), воду (9,12 мл) и перманганат калия (0,396 г) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли перманганат калия (54 мг) и смесь перемешивали при 40°C в течение 25 часов. К реакционной смеси добавляли диметилсульфоксид (0,024 мл) и смесь фильтровали через целит. Фильтрат подкисляли 1 н хлористоводородной кислотой (pH 4-5) и фильтровали. Фильтрат экстрагировали этилацетатом/тетрагидрофуран. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде неочищенного продукта (74 мг).
MS(ESI)m/z:276(M-H)-
[0260]
Пример получения 47: Получение 4-(4-метил-2,5-диоксоимидазолидин-4-ил)-2-трифторметилбензойной кислоты
[0261]
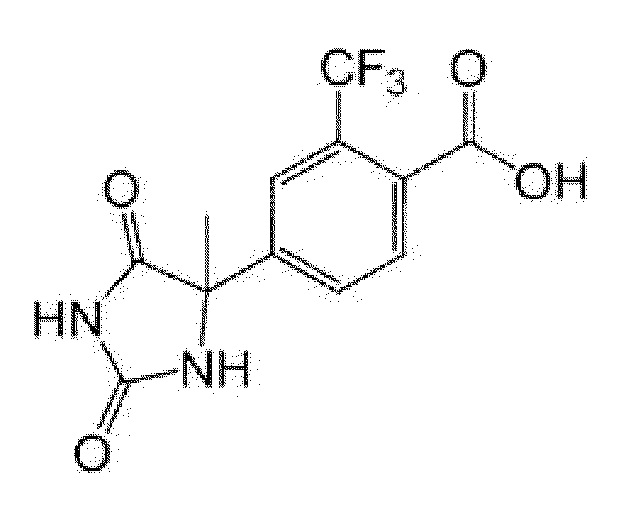
[0262]
К 1-[4-бром-3―(трифторметил)фенил]этан-1-ону (3,2 г) добавляли этанол (12 мл), 28% водный аммиак (6 мл), карбонат аммония (4,6 г), карбонат калия (3,3 г) и триметилсилилцианид (3 мл) и смесь перемешивали при комнатной температуре в течение 1,5 часов и при 50°C в течение 2 часов. Добавляли воду (6 мл) и смесь перемешивали при 50°C в течение 1,5 часов. Кроме того, добавляли триметилсилилцианид (1,5 мл), карбонат калия (1,65 г), карбонат аммония (2,3 г) и 28% водный аммиак (3 мл), и смесь перемешивали при 50°C в течение 4 часов. К реакционной смеси добавляли воду и осажденное твердое вещество собирали фильтрованием с получением 5-(4-бром-3-трифторметилфенил)-5-метилимидазолидин-2,4-диона (3,2 г).
К полученному 5-(4-бром-3-трифторметилфенил)-5-метилимидазолидин-2,4-диону (3,2 г) добавляли цианид цинка (2,8 г), цинк (134 мг), 1,1'-бис(дифенилфосфино)ферроцен (526 мг), трис(дибензилиденацетон)дипалладий(0) (430 мг) и N,N-диметилформамид (32 мл) и смесь перемешивали при 130°C в течение 7 часов. К реакционной смеси добавляли хлороформ, и смесь фильтровали через целит. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением 4-(4-метил-2,5-диоксоимидазолидин-4-ил)-2-трифторметилбензонитрила (1,36 г).
К полученному 4-(4-метил-2,5-диоксоимидазолидин-4-ил)-2-трифторметилбензонитрилу (1,36 г) добавляли уксусную кислоту (5 мл), концентрированную хлористоводородную кислоту (5 мл) и концентрированную серную кислоту (3 мл) и смесь перемешивали при 120°C в течение 6 часов. Добавляли уксусную кислоту (1 мл) и концентрированную серную кислоту (2 мл) и смесь перемешивали при 120°C в течение 8 часов. Кроме того, добавляли уксусную кислоту (2 мл) и концентрированную хлористоводородную кислоту (2 мл) и смесь перемешивали при 120°C. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали, к полученному остатку добавляли уксусную кислоту (3 мл), концентрированную хлористоводородную кислоту (1 мл) и концентрированную серную кислоту (3 мл) и смесь перемешивали при микроволновом излучении при 120°C в течение 1,5 часов и при 150°C в течение 3 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали при пониженном давлении с получением указанного в заголовке соединения в виде неочищенного продукта (410 мг).
MS(ESI)m/z:301(M-H)-
[0263]
Пример получения 48: Получение 2-гидрокси-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0264]

[0265]
К 1-(4-бром-3―метоксифенил)этанону (1,36 г) добавляли этанол (3 мл), 28% водный аммиак (3 мл), карбонат аммония (2,26 г), карбонат калия (1,63 г) и триметилсилилцианид (1,48 мл) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли воду (3 мл) и смесь перемешивали при комнатной температуре в течение 4 часов и при 50°C в течение 3 часов. Кроме того, добавляли 28% водный аммиак (3 мл), карбонат аммония (1,13 г), карбонат калия (815 мг) и триметилсилилцианид (0,74 мл) и смесь перемешивали при 50°C в течение 3 часов. К реакционной смеси добавляли воду и смесь концентрировали при пониженном давлении пока твердое вещество не осаждалось. Осадок собирали фильтрованием с получением 5-(4-бром-3-метоксифенил)-5-метилимидазолидин-2,4-диона (1,21 г).
К полученному 5-(4-бром-3-метоксифенил)-5-метилимидазолидин-2,4-диону (1,21 г) добавляли цианид цинка (1,19 г), цинк (56 мг), 1,1'-бис(дифенилфосфино)ферроцен (222 мг), трис(дибензилиденацетон)дипалладий(0) (183 мг) и N,N-диметилформамид (13 мл) и смесь перемешивали при 130°C в течение 8 часов. Добавляли цинк (280 мг), 1,1'-бис(дифенилфосфино)ферроцен (222 мг) и трис(дибензилиденацетон)дипалладий(0) (183 мг) и смесь перемешивали при 130°C в течение 8 часов. Кроме того, добавляли 1,1'-бис(дифенилфосфино)ферроцен (222 мг) и трис(дибензилиденацетон)дипалладий(0) (183 мг) и смесь перемешивали при 150°C в течение 8 часов. К реакционной смеси добавляли хлороформ и смесь фильтровали через целит. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (гексан:этилацетат) с получением 2-метокси-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензонитрила (420 мг).
К полученному 2-метокси-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензонитрилу (420 мг) добавляли уксусную кислоту (3 мл), концентрированную хлористоводородную кислоту (3 мл), концентрированную серную кислоту (3 мл) и смесь перемешивали при микроволновом излучении при 150°C в течение 2 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и к полученному остатку добавляли воду, и осадок собирали фильтрованием с получением указанного в заголовке соединения (133 мг).
MS(ESI)m/z:249(M-H)-
[0266]
Пример получения 49: Получение 4-(3-изопропил-2,5-диоксопирролидин-3-ил)бензойной кислоты
[0267]

[0268]
1) Получение 3-изопропил-3-(п-толил)пирролидин-2,5-диона
К раствору метилового эфира 3-метил-2-(п-толил)масляной кислоты (5,2 г) в тетрагидрофуране (94 мл) добавляли по каплям при охлаждении до -78°С диизопропиламид лития (2 M, раствор гептан/тетрагидрофуран/этилбензол) (18,91 мл) и смесь перемешивали в течение 1 часа. Добавляли раствор бромацетонитрила (5,04 мл) в тетрагидрофуране (10 мл) и смесь перемешивали при -78°C в течение 2 часов. К реакционной смеси добавляли водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан/этилацетат) с получением метилового эфира 2-цианометил-3-метил-2-(п-толил)масляной кислоты (5,81 г).
К полученному метиловому эфиру 2-цианометил-3-метил-2-(п-толил)масляной кислоты (500 мг) добавляли этанол (5 мл), 30% водный раствор пероксида водорода (5,68 мл), 1 н водный раствор гидроксида натрия (5,56 мл) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли 30% водный раствор пероксида водорода (5,68 мл) и смесь перемешивали при комнатной температуре в течение ночи. Кроме того, добавляли 30% водный раствор пероксида водорода (5,68 мл) и смесь перемешивали при комнатной температуре в течение ночи. Кроме того, добавляли этанол (5 мл), 30% водный раствор пероксида водорода (5,68 мл) и 1 н водный раствор гидроксида натрия (5,56 мл) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли бисульфит натрия и смесь подкисляли концентрированной хлористоводородной кислотой. Осадок собирали фильтрованием с получением 3-изопропил-3-(п-толил)пирролидин-2,5-диона (314 мг).
[0269]
2) Получение 4-(3-изопропил-2,5-диоксопирролидин-3-ил)бензойной кислоты
К 3-изопропил-3-(п-толил)пирролидин-2,5-диону (720 мг, см. вышеупомянутый 1)) добавляли воду (7,2 мл), 1 н водный раствор гидроксида натрия (6,23 мл) и перманганат калия (1,42 г) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли перманганат калия (676 мг) и смесь перемешивали при комнатной температуре в течение 3,5 часов. К реакционной смеси добавляли этанол (6 мл) и смесь перемешивали в течение 1 часа и фильтровали через целит. Фильтрат концентрировали при пониженном давлении для выпаривания этанола. Оставшийся водный раствор подкисляли концентрированной хлористоводородной кислотой и экстрагировали смешанным растворителем хлороформа и метанола. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (375 мг).
MS(ESI)m/z:260(M-H)-
[0270]
Пример получения 50: Получение 6-(3-метил-2,5-диоксопирролидин-3-ил)никотиновой кислоты
[0271]

[0272]
1) Получение этилового эфира 6-(трет-бутоксикарбонилцианометил)никотиновой кислоты
К этиловому эфиру 6-хлорникотиновой кислоты (11 г) добавляли трет-бутил цианоацетатный эфир (8,88 мл), N,N-диметилформамид (100 мл) и карбонат калия (19,7 г) и смесь перемешивали при 95°C в течение 11 часов. Добавляли трет-бутил цианоацетатный эфир (4 мл) и карбонат калия (10 г) и смесь перемешивали при 95°C в течение 4 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Полученный остаток разбавляли водой, при охлаждении льдом, добавляли 1н хлористоводородную кислоту (примерно pH 4), и осадок собирали фильтрованием. Полученный осадок суспендировали в диэтиловом эфире и собирали фильтрованием с получением этилового эфира 6-(трет-бутоксикарбонилцианометил)никотиновой кислоты (16,228 г).
[0273]
2) Получение этилового эфира 6-(трет-бутоксикарбонилцианометилметил)никотиновой кислоты
К смешанному раствору этилового эфира 6-(трет-бутоксикарбонилцианометил)никотиновой кислоты (1 г), описанного в вышеупомянутом 1) и карбоната калия (1,43 г) в N,N-диметилформамиде (70 мл) добавляли метилиодид (0,24 мл) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли метилиодид (0,11 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Полученный органический слой концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением этилового эфира 6-(трет-бутоксикарбонилцианометилметил)никотиновой кислоты (951 мг).
[0274]
3) Получение 6-(3-метил-2,5-диоксопирролидин-3-ил)никотиновой кислоты
К этиловому эфиру 6-(трет-бутоксикарбонилцианометилметил)никотиновой кислоты (300 мг), описанному в вышеупомянутом 2), добавляли монтмориллонит K10 (100 мг) и толуол (6 мл) и смесь перемешивали при 100°C в течение 3 часов и кипятили с обратным холодильником в течение 2 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении с получением этилового эфира 6-(цианометилметил)никотиновой кислоты (193 мг).
Раствор полученного этилового эфира 6-(цианометилметил)никотиновой кислоты (189 мг) в тетрагидрофуране (3 мл) добавляли к суспензии гидрида натрия (40,8 мг, 60% в масле) в тетрагидрофуране (2 мл) при комнатной температуре с перемешиванием. Затем, реакционную смесь перемешивали при 90°C в течение 30 минут, и добавляли метилбромацетатный эфир (0,094 мл) при комнатной температуре. Реакционную смесь перемешивали при 90°C в течение 1 часа, и обрабатывали насыщенным водным раствором хлорида аммония при комнатной температуре. Смесь экстрагировали этилацетатом, и полученный органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением этилового эфира 6-(цианометоксикарбонилметилметилметил)никотиновой кислоты (220 мг).
К полученному этиловому эфиру 6-(цианометоксикарбонилметилметилметил)никотиновой кислоты (216 мг) добавляли уксусную кислоту (13 мл) и концентрированную серную кислоту (0,64 мл) и смесь перемешивали при 140°C в течение 16 часов. После завершения реакции, реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли воду и смесь экстрагировали этилацетатом. Полученный органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 6-(3-метил-2,5-диоксопирролидин-3-ил)никотиновой кислоты (85 мг).
MS(ESI)m/z:235(M+H)+
[0275]
Пример получения 51: Получение 6-(3-этил-2,5-диоксопирролидин-3-ил)никотиновой кислоты
[0276]
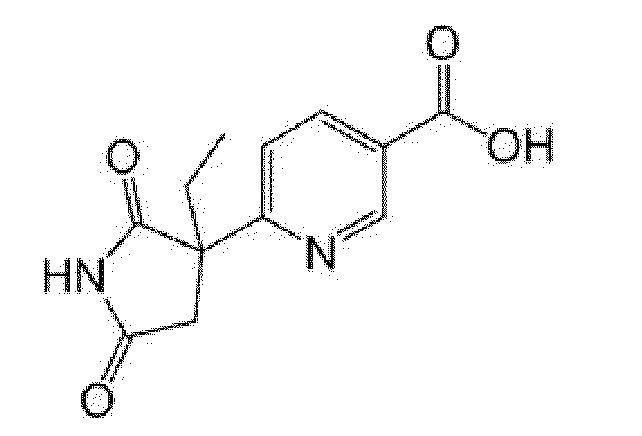
[0277]
Используя этиловый эфир 6-(трет-бутоксикарбонилцианометил)никотиновой кислоты (1,00 г), описанный в примере получения 50, 1) и этилиодид (0,608 мл), реакции и обработки, аналогичные тем, которые описаны в примере получения 50, 2), осуществляли с получением этилового эфира 6-(1-трет-бутоксикарбонил-1-цианопропил)никотиновой кислоты (1,05 г).
Используя полученный этиловый эфир 6-(1-трет-бутоксикарбонил-1-цианопропил)никотиновой кислоты (500 мг) и метилбромацетатный эфир (0,152 мл), реакции и обработки, аналогичные тем, которые описаны в примере получения 50, 3), осуществляли с получением указанного в заголовке соединения (155 мг).
MS(ESI)m/z:249(M+H)+, 247(M-H)-
[0278]
Пример получения 52: Получение 6-(3-изопропил-2,5-диоксопирролидин-3-ил)никотиновой кислоты
[0279]

[0280]
К смешанному раствору этилового эфира 6-(трет-бутоксикарбонилцианометил)никотиновой кислоты (1 г), описанного в примере получения 50, 1) и карбоната калия (1,43 г) в N,N-диметилформамиде (70 мл) добавляли 2-йодпропан (0,376 мл) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли 2-йодпропан (1,03 мл) и смесь перемешивали при 70°C в течение 28 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Полученный органический слой концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии на силикагеле (гексан:этилацетат) с получением этилового эфира 6-(1-трет-бутоксикарбонил-1-циано-2-метилпропил)никотиновой кислоты (1,02 г).
Используя полученный этиловый эфир 6-(1-трет-бутоксикарбонил-1-циано-2-метилпропил)никотиновой кислоты (500 мг) и метилбромацетатный эфир (0,151 мл), реакции и обработки, аналогичные тем, которые описаны в примере получения 50, 3), осуществляли с получением указанного в заголовке соединения (145 мг).
MS(ESI)m/z:263(M+H)+, 261(M-H)-
[0281]
Пример получения 53: Получение 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-3-метоксибензойной кислоты
[0282]
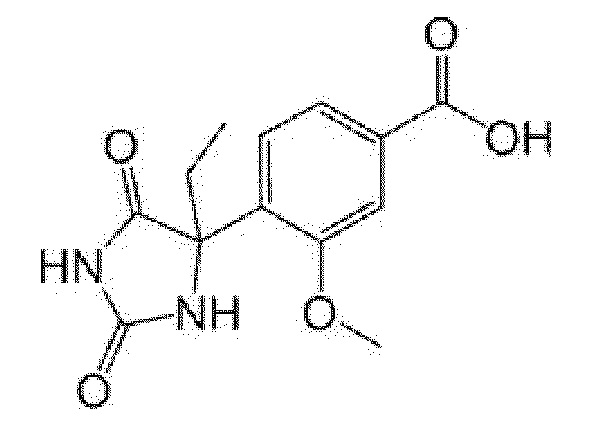
[0283]
К 1-(4-бром-2-метоксифенил)пропан-1-ону (7,33 г) добавляли ацетат палладия (0,339 г), 1,1'-бис(дифенилфосфино)ферроцен (1,672 г), этанол (35,2 мл), N,N-диметилформамид (125 мл) и триэтиламин (8,4 мл) и смесь перемешивали в атмосфере монооксида углерода при 80°C в течение 6 часов. К реакционной смеси добавляли воду (150 мл) и этилацетат (150 мл) и смесь перемешивали при комнатной температуре в течение ночи. После фильтрации через целит, фильтрат экстрагировали этилацетатом. Органический слой концентрировали при пониженном давлении, к полученному остатку добавляли толуол и нерастворимый материал удаляли фильтрованием. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (гексан/этилацетат) с получением этилового эфира 3-метокси-4-пропионилбензойной кислоты (6,166 г).
Полученный этиловый эфир 3-метокси-4-пропионилбензойной кислоты (1,0 г) растворяли в этаноле (10 мл) и тетрагидрофуране (10 мл), добавляли 1 н водный раствор гидроксида натрия (8,89 мл) и смесь перемешивали при комнатной температуре в течение 4,5 часов. К реакционной смеси добавляли 1 н хлористоводородную кислоту (10 мл) и смесь экстрагировали смешанным раствором хлороформа и метанола. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением 3-метокси-4-пропионилбензойной кислоты (639 мг).
К полученной 3-метокси-4-пропионилбензойной кислоте (620 мг) добавляли карбонат аммония (1,075 г), карбонат калия (0,823 г), этанол (1,5 мл), 28% водный аммиак (2,5 мл) и триметилсилилцианид (0,774 мл) и смесь перемешивали при микроволновом излучении при 120°C в течение 1,5 часов. Реакционную смесь подкисляли добавлением воды и концентрированной хлористоводородной кислоты при охлаждении льдом (примерно pH 2). Осажденное твердое вещество собирали путем фильтрования с получением указанного в заголовке соединения (825 мг).
MS(ESI)m/z:277(M-H)-
[0284]
Пример получения 54: Получение 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)-3-метоксибензойной кислоты
[0285]

[0286]
К 1-(4-бром-2-метоксифенил)бутан-1-ону (5,7 г) добавляли ацетат палладия (0,249 г), 1,1'-бис(дифенилфосфино)ферроцен (1,23 г), этанол (25,9 мл), N,N-диметилформамид (55 мл) и триэтиламин (6,2 мл) и смесь перемешивали в атмосфере монооксида углерода при 80°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры, добавляли этилацетат и смесь фильтровали через целит. Фильтрат промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением этилового эфира 4-бутирил-3-метоксибензойной кислоты (4,662 г).
Полученный этиловый эфир 4-бутирил-3-метоксибензойной кислоты (1,0 г) растворяли в этаноле (10 мл) и тетрагидрофуране (10 мл), добавляли 1 н водный раствор гидроксида натрия (8,39 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли 1 н хлористоводородную кислоту (10 мл) и смесь экстрагировали смешанным раствором хлороформа и метанола. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением 4-бутирил-3-метоксибензойной кислоты (636 мг).
К полученной 4-бутирил-3-метоксибензойной кислоте (620 мг) добавляли карбонат аммония (1,007 г), карбонат калия (0,771 г), этанол (1,5 мл), 28% водный аммиак (2,5 мл) и триметилсилилцианид (0,726 мл) и смесь перемешивали при микроволновом излучении при 120°C в течение 1,5 часов. Реакционную смесь подкисляли добавлением воды и концентрированной хлористоводородной кислоты при охлаждении льдом. Осажденное твердое вещество собирали путем фильтрования с получением указанного в заголовке соединения (755 мг).
MS(ESI)m/z:291(M-H)-
[0287]
Пример получения 55: Получение 4-(4-дифторметил-2,5-диоксоимидазолидин-4-ил)-3-метоксибензойной кислоты
[0288]
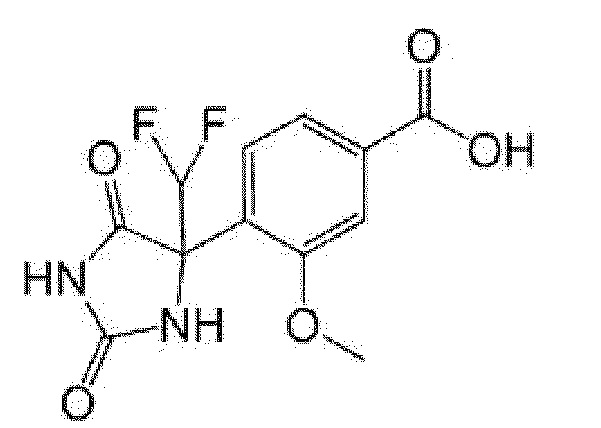
[0289]
К 1-(4-бром-2-метоксифенил)этанону (26,15 г) добавляли ацетат палладия (1,28 г), 1,1'-бис(дифенилфосфино)ферроцен (6,32 г), этанол (133 мл), N,N-диметилформамид (290 мл) и триэтиламин (31,8 мл) и смесь перемешивали в атмосфере монооксида углерода при 80°C в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К полученному остатку добавляли этилацетат и SH силикагель и, после фильтрации через целит, фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением этилового эфира 4-ацетил-3-метоксибензойной кислоты (23,0 г).
К раствору полученного этилового эфира 4-ацетил-3-метоксибензойной кислоты (5 г) в циклогексане (45 мл) добавляли н-бутиламин (4,45 мл), молекулярное сито 4A (5 г) и трифторуксусную кислоту (каталитическое количество), и смесь перемешивали при кипячении с обратным холодильником в течение 18 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали диизопропиловым эфиром. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель выпаривали и полученный остаток (6,36 г) растворяли в ацетонитриле (110 мл). Добавляли сульфат натрия (2,25 г) и Selectfluor (21 г), и смесь перемешивали при кипячении с обратным холодильником в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры, добавляли 6 н хлористоводородную кислоту (20 мл) и смесь перемешивали в течение 15 мин и экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением этилового эфира 4-(2,2-дифторацетил)-3-метоксибензойной кислоты (3,39 г).
Полученный этиловый эфир 4-(2,2-дифторацетил)-3-метоксибензойной кислоты (1,0 г) растворяли в этаноле (10 мл) и тетрагидрофуране (10 мл), добавляли 1 н водный раствор гидроксида натрия (8,13 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли 1 н хлористоводородную кислоту (10 мл) и смесь экстрагировали смешанным раствором хлороформа и метанола. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением 4-(2,2-дифторацетил)-3-метоксибензойной кислоты (667 мг).
К полученной 4-(2,2-дифторацетил)-3-метоксибензойной кислоте (620 мг) добавляли карбонат аммония (0,973 г), карбонат калия (0,745 г), 28% водный аммиак (2,5 мл) и триметилсилилцианид (0,701 мл) и смесь перемешивали при микроволновом излучении при 120°C в течение 1,5 часов. Реакционную смесь подкисляли добавлением воды и концентрированной хлористоводородной кислоты при охлаждении льдом и смесь экстрагировали смешанным раствором хлороформа и метанола. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (80 мг).
MS(ESI)m/z:299(M-H)-
[0290]
Пример получения 56: Получение 3-этокси-4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0291]
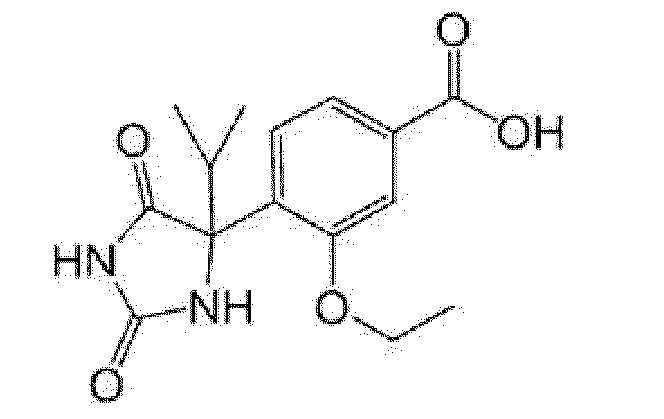
[0292]
1-(4-бром-2-гидроксифенил)-2-метилпропан-1-он (4,35 г) растворяли в ацетоне (89,5 мл), добавляли карбонат калия (11,13 г) и этилиодид (4,3 мл) и смесь перемешивали при 60°C в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором (50 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением 1-(4-бром-2-этоксифенил)-2-метилпропан-1-она (5,23 г).
К полученному 1-(4-бром-2-этоксифенил)-2-метилпропан-1-ону (5,23 г) добавляли ацетат палладия (0,25 г), 1,1'-бис(дифенилфосфино)ферроцен (1,13 г), этанол (23,7 мл), N,N-диметилформамид (40,6 мл) и триэтиламин (5,7 мл) и смесь перемешивали в атмосфере монооксида углерода при 80°C в течение 4 часов. К реакционной смеси добавляли воду, и смесь экстрагировали диэтиловым эфиром. Органический слой фильтровали через целит и фильтрат сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением этилового эфира 3-этокси-4-изобутирилбензойной кислоты (3,94 г).
Полученный этиловый эфир 3-этокси-4-изобутирилбензойной кислоты (680 мг) растворяли в этаноле (6,8 мл) и тетрагидрофуране (6,8 мл), добавляли 1 н водный раствор гидроксида натрия (5,4 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли 1 н хлористоводородную кислоту (10 мл) и смесь экстрагировали смешанным раствором хлороформа и метанола. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением 3-этокси-4-изобутирилбензойной кислоты (118 мг). Фильтрат концентрировали при пониженном давлении, к полученному остатку добавляли гексан/диизопропиловый эфир и осадок собирали фильтрованием с получением 3-этокси-4-изобутирилбензойной кислоты (403 мг).
К полученной 3-этокси-4-изобутирилбензойной кислоте (495 мг) добавляли карбонат аммония (0,756 г), карбонат калия (0,579 г), 28% водный аммиак (2 мл), этанол (1 мл) и триметилсилилцианид (0,545 мл) и смесь перемешивали при микроволновом излучении при 120°C в течение 3,5 часов. Реакционную смесь подкисляли добавлением воды и концентрированной хлористоводородной кислоты при охлаждении льдом, и осажденное твердое вещество собирали путем фильтрования с получением указанного в заголовке соединения (615 мг).
MS(ESI)m/z:305(M-H)-
[0293]
Пример получения 57: Получение 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-5-метокси-2-метилбензойной кислоты
[0294]
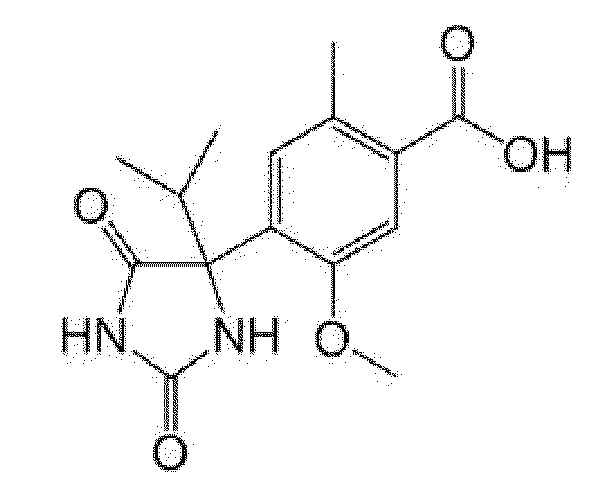
[0295]
К суспензии хлорида алюминия (5,33 г) в дихлорметане (50 мл) добавляли раствор 3-бром-4-метиланизола (5,36 г) в дихлорметане (10 мл) при охлаждении льдом и смесь перемешивали в течение 5 мин. К реакционной смеси добавляли изобутирилхлорид, и смесь перемешивали при охлаждении льдом в течение 45 мин. К реакционной смеси добавляли воду со льдом, добавляли 6 н хлористоводородную кислоту и смесь экстрагировали хлороформом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением 1-(4-бром-2-метокси-5-метилфенил)-2-метилпропан-1-она (4,86 г).
К полученному 1-(4-бром-2-метокси-5-метилфенил)-2-метилпропан-1-ону (500 мг) добавляли карбонат аммония (0,666 г), карбонат калия (0,51 г), 28% водный аммиак (4 мл), этанол (5 мл) и триметилсилилцианид (0,48 мл) и смесь перемешивали при микроволновом излучении при 130°C в течение 1,5 часов. Добавляли карбонат аммония (0,666 г), карбонат калия (0,51 г), 28% водный аммиак (2 мл) и триметилсилилцианид (0,48 мл) и смесь перемешивали при микроволновом излучении при 130°C в течение 2 часов. Кроме того, добавляли карбонат аммония (0,666 г), карбонат калия (0,51 г), 28% водный аммиак (2 мл) и триметилсилилцианид (0,48 мл) и смесь перемешивали при микроволновом излучении при 130°C в течение 1 часа. Реакционную смесь подкисляли добавлением воды и концентрированной хлористоводородной кислоты при охлаждении льдом (примерно pH 3) и осадок собирали фильтрованием. Полученный осадок суспендировали в гексане/этилацетате и собирали фильтрованием с получением 5-(4-бром-2-метокси-5-метилфенил)-5-изопропилимидазолидин-2,4-диона (508 мг).
К полученному 5-(4-бром-2-метокси-5-метилфенил)-5-изопропилимидазолидин-2,4-диону (300 мг) добавляли цианид цинка (124 мг), цинк (5,8 мг), 1,1'-бис(дифенилфосфино)ферроцен (49 мг), трис(дибензилиденацетон)дипалладий(0) (40 мг) и N,N-диметилформамид (3 мл) и смесь перемешивали при микроволновом излучении при 150°C в течение 1 часа. К реакционной смеси добавляли воду и этилацетат и смесь фильтровали через целит. Фильтрат экстрагировали этилацетатом, и органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-5-метокси-2-метилбензонитрила (250 мг).
К полученному 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-5-метокси-2-метилбензонитрилу (245 мг) добавляли 1,4-диоксан (1,47 мл) и 6 н хлористоводородную кислоту (1,42 мл) и смесь перемешивали при кипячении с обратным холодильником в течение ночи. Реакционную смесь концентрировали при пониженном давлении для выпаривания 1,4-диоксана. К полученному остатку добавляли уксусную кислоту (1,47 мл) и смесь перемешивали при микроволновом излучении при 150°C в течение 2 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (114 мг).
MS(ESI)m/z:305(M-H)-
[0296]
Пример получения 58: Получение 5-гидрокси-4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-2-метилбензойной кислоты
[0297]
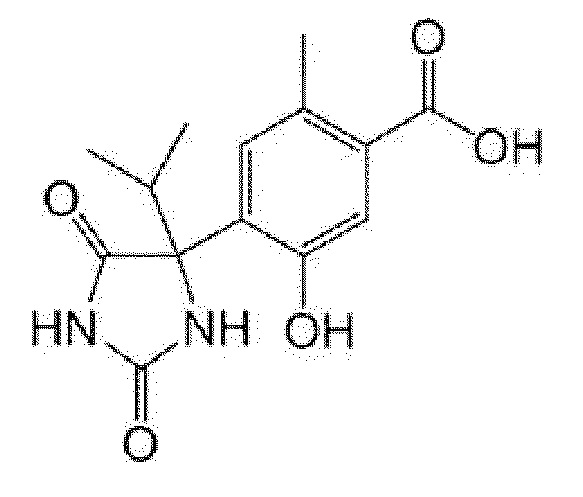
[0298]
Полученный продукт, полученный в примере получения 57, очищали с помощью колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (16,3 мг).
MS(ESI)m/z:291(M-H)-
[0299]
Пример получения 59: Получение 2-фтор-4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-5-метоксибензойной кислоты
[0300]

[0301]
К 1-(4-бром-5-фтор-2-гидроксифенил)-2-метилпропан-1-ону (6,63 г) добавляли ацетон (130 мл), карбонат калия (5,27 г) и метилиодид (4,8 мл) и смесь перемешивали при 60°C в течение 3 часов. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением 1-(4-бром-5-фтор-2-метоксифенил)-2-метилпропан-1-она (5 г).
К полученному 1-(4-бром-5-фтор-2-метоксифенил)-2-метилпропан-1-ону (5 г) добавляли ацетат палладия (0,204 г), 1,1'-бис(дифенилфосфино)ферроцен (1 г), метанол (14,7 мл), N,N-диметилформамид (46 мл) и триэтиламин (5,1 мл) и смесь перемешивали в атмосфере монооксида углерода при 80°C в течение 17 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Безводный сульфат натрия и SH силикагель добавляли к органическому слою и смесь фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением метилового эфира 2-фтор-4-изобутирил-5-метоксибензойной кислоты (2,3 г).
К полученному метиловому эфиру 2-фтор-4-изобутирил-5-метоксибензойной кислоты (1 г) добавляли метанол (2 мл), тетрагидрофуран (3 мл) и 1 н водный раствор гидроксида натрия (6 мл) и смесь перемешивали при комнатной температуре в течение 3,5 часов. К реакционной смеси добавляли 1 н хлористоводородную кислоту и осадок собирали фильтрованием с получением 2-фтор-4-изобутирил-5-метоксибензойной кислоты (790 мг).
К полученной 2-фтор-4-изобутирил-5-метоксибензойной кислоте (786 мг) добавляли карбонат аммония (1,57 г), карбонат калия (1,37 г), 28% водный аммиак (1,7 мл), воду (1,7 мл) и триметилсилилцианид (1,23 мл) и смесь перемешивали при микроволновом излучении при 100°C в течение 1 часа. Добавляли 28% водный аммиак (0,5 мл) и триметилсилилцианид (0,41 мл) и смесь перемешивали при микроволновом излучении при 120°C в течение 1,5 часов. Реакционную смесь подкисляли 3 н хлористоводородной кислотой и осадок собирали фильтрованием. Полученный осадок промывали водой и диэтиловым эфиром с получением указанного в заголовке соединения (608 мг).
MS(ESI)m/z:309(M-H)-
[0302]
Пример получения 60: Получение 4-[4-(1,1-дифторэтил)-2,5-диоксоимидазолидин-4-ил]-3-метоксибензойной кислоты
[0303]
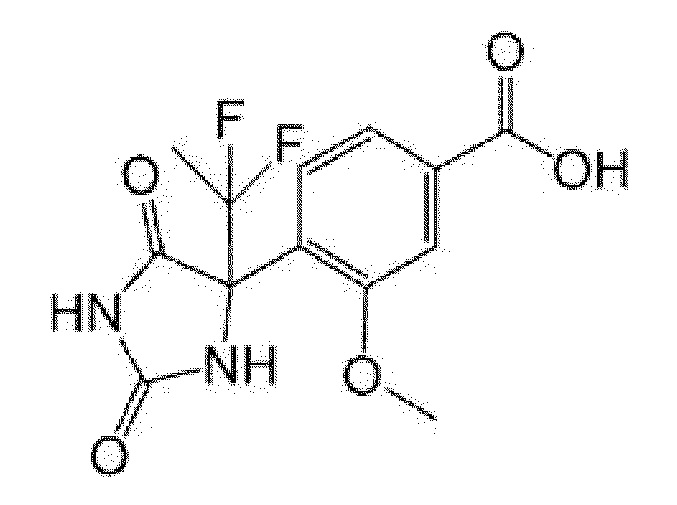
[0304]
К этиловому эфиру 3-метокси-4-пропионилбензойной кислоты (3,55 г), описанному в примере получения 53, добавляли н-бутиламин (2,2 г), молекулярные сита 4A (3,55 г), циклогексан (35 мл) и трифторуксусную кислоту (каталитическое количество), и смесь нагревали с обратным холодильником в атмосфере аргона при перемешивании в течение 20,5 часов. Реакционную смесь фильтровали и промывали диизопропиловым эфиром. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток растворяли в ацетонитриле (50 мл), добавляли сульфат натрия (1,5 г) и Selectfluor (11,71 г) и смесь перемешивали при кипячении с обратным холодильником в течение 4 часов. Реакционную смесь охлаждали до комнатной температуры, добавляли 6 н хлористоводородную кислоту (10 мл) и смесь перемешивали при комнатной температуре в течение 10 мин и экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением этилового эфира 4-(2,2-дифторпропионил)-3-метоксибензойной кислоты (3,284 г).
К полученному этиловому эфиру 4-(2,2-дифторпропионил)-3-метоксибензойной кислоты (544 мг) добавляли этанол (1 мл), тетрагидрофуран (2 мл) и 1 н водный раствор гидроксида натрия (3 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли 1 н хлористоводородную кислоту при охлаждении льдом, и осажденное твердое вещество собирали фильтрованием с получением 4-(2,2-дифторпропионил)-3-метоксибензойной кислоты (381 мг).
К полученной 4-(2,2-дифторпропионил)-3-метоксибензойной кислоте (378 мг) добавляли карбонат аммония (744 мг), карбонат калия (642 г), 28% водный аммиак (0,75 мл), воду (0,75 мл) и триметилсилилцианид (0,581 мл) и смесь перемешивали при микроволновом излучении при 100°C в течение 1 часа. К реакционной смеси добавляли 3 н хлористоводородную кислоту при охлаждении льдом, и осажденное твердое вещество собирали путем фильтрования с получением указанного в заголовке соединения (423 мг).
MS(ESI)m/z:313(M-H)-
[0305]
Пример получения 61: Получение 4-(4-трет-бутил-2,5-диоксоимидазолидин-4-ил)-3-метоксибензойной кислоты
[0306]
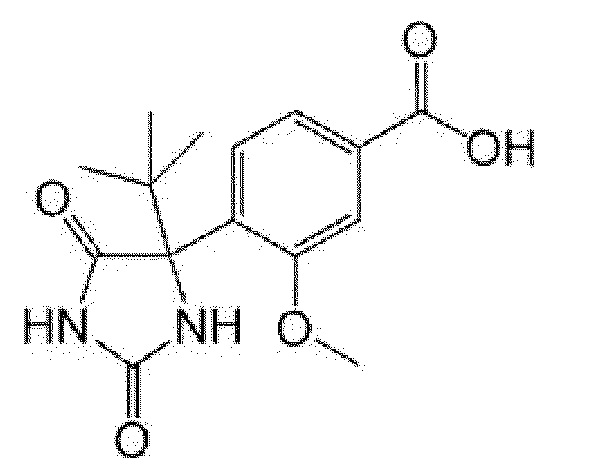
[0307]
К раствору 4-изобутирил-3-метоксибензойной кислоты (600 мг), описанной в примере получения 35, 1), и трет-бутанола (60 мг) в тетрагидрофуране (12 мл) добавляли гидрид натрия (432 мг, 60% в масле) при охлаждении льдом, и смесь перемешивали в атмосфере азота при комнатной температуре в течение 3 часов. К реакционной смеси добавляли метилиодид (0,336 мл) при охлаждении льдом, и смесь перемешивали в атмосфере азота при комнатной температуре в течение 1 часа. Добавляли трет-бутанол (60 мг) и метилиодид (0,336 мл) и смесь перемешивали в атмосфере азота при 50°C в течение 3 часов. К реакционной смеси добавляли 1 н водный раствор гидроксида натрия (3 мл) и смесь перемешивали при комнатной температуре в течение ночи и подкисляли 1н хлористоводородной кислотой. Добавляли бисульфит натрия и насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении. К полученному остатку добавляли карбонат аммония (1,73 г), карбонат калия (1,49 г), триметилсилилцианид (1,4 мл) и 28% водный аммиак (10 мл) и смесь перемешивали при микроволновом излучении при 100°C в течение 1 часа и при 135°C в течение 1 часа. Добавляли триметилсилилцианид (2,8 мл) и смесь перемешивали при микроволновом излучении при 135°C в течение 2 часов. Кроме того, добавляли триметилсилилцианид (2,8 мл) и смесь перемешивали при микроволновом излучении при 135°C в течение 2 часов. К реакционной смеси добавляли воду, этилацетат и карбонат калия, и смесь фильтровали через целит. Фильтрат подкисляли концентрированной хлористоводородной кислотой при охлаждении льдом и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и обрабатывали активированным углем. Растворитель выпаривали и к полученному остатку добавляли гексан/этилацетат. Осадок собирали фильтрованием с получением указанного в заголовке соединения (673 мг).
MS(ESI)m/z:305(M-H)-
[0308]
Пример получения 62: Получение 4-(4-дифторметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0309]

[0310]
К метиловому эфиру 4-(2,2-дифторацетил)бензойной кислоты (1,7 г) добавляли метанол (16 мл), тетрагидрофуран (5 мл) и 1 н водный раствор гидроксида натрия (24 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении, добавляли воду и 1н хлористоводородную кислоту к полученному водному раствору, и осадок собирали фильтрованием с получением 4-(2,2-дифторацетил)бензойной кислоты (496 мг).
К полученной 4-(2,2-дифторацетил)бензойной кислоте (496 мг) добавляли карбонат аммония (960 мг), карбонат калия (691 мг), 28% водный аммиак (5 мл), воду (5 мл) и триметилсилилцианид (0,625 мл) и смесь перемешивали при микроволновом излучении при 80°C в течение 1 часа. Добавляли карбонат аммония (480 мг), карбонат калия (345 мг) и триметилсилилцианид (0,312 мл) и смесь перемешивали при микроволновом излучении при 80°C в течение 1,5 часов. К реакционной смеси добавляли воду и концентрированную хлористоводородную кислоту (примерно pH 1), и смесь экстрагировали этилацетатом и хлороформом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (72 мг).
MS(ESI)m/z:271(M+H)+, 269(M-H)-
[0311]
Пример получения 63: Получение 4-(4-фторметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0312]

[0313]
К метиловому эфиру 4-ацетилбензойной кислоты (6,3 г) добавляли метанол (170 мл) и Selectfluor (25 г) и смесь кипятили с обратным холодильником при перемешивании в течение 2 дней. После фильтрации через целит, фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли хлороформ и смесь фильтровали (нерастворимый материал удаляли). Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (гексан:этилацетат) с получением метилового эфира 4-(2-фтор-1,1-диметоксиэтил)бензойной кислоты (5,4 г).
Полученный метиловый эфир 4-(2-фтор-1,1-диметоксиэтил)бензойной кислоты (5,4 г) растворяли в метаноле (44 мл) и тетрагидрофуране (15 мл), добавляли 1 н водный раствор гидроксида натрия (67 мл) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 6 часов. При охлаждении льдом, к реакционной смеси добавляли 2 н хлористоводородную кислоту и смесь перемешивали в течение 1 часа и осадок собирали фильтрованием. К полученному осадку (4,8 г) добавляли дихлорметан (45 мл) и трифторуксусную кислоту (10 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Осадок собирали фильтрованием с получением 4-(2-фторацетил)бензойной кислоты (3,68 г).
К полученной 4-(2-фторацетил)бензойной кислоте (910 мг) добавляли карбонат аммония (1,2 г), карбонат калия (2,07 г), 28% водный аммиак (9 мл), воду (9 мл) и триметилсилилцианид (1,8 мл) и смесь перемешивали при микроволновом излучении при 80°C в течение 1,5 часов. К реакционной смеси добавляли хлористоводородную кислоту и осадок собирали фильтрованием. Полученный осадок перекристаллизовывали из смешанного растворителя из этанола и воды с получением указанного в заголовке соединения (730 мг).
MS(ESI)m/z:251(M-H)-
[0314]
Пример получения 64: Получение 6-(3-метоксиметил-2,5-диоксопирролидин-3-ил)никотиновой кислоты
[0315]

[0316]
К этиловому эфиру 6-(трет-бутоксикарбонилцианометил)никотиновой кислоты (6,1 г), описанному в примере получения 50, 1) добавляли N,N-диметилформамид (400 мл), карбонат калия (8,71 г) и этилбромацетат (4,4 мл) и смесь перемешивали при 70°C в течение 1 часа и при комнатной температуре в течение ночи. Реакционную смесь фильтровали через целит, к фильтрату добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением 1-трет-бутилового эфира 4-этилового эфира 2-циано-2-(5-этоксикарбонилпиридин-2-ил)янтарной кислоты (6,222 г).
К полученному 1-трет-бутиловому эфиру 4-этиловому эфиру 2-циано-2-(5-этоксикарбонилпиридин-2-ил)янтарной кислоты (6,2 г) добавляли толуол (50 мл) и монтмориллонит K10 (2 г) и смесь перемешивали при 120°C в течение 1,5 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением этилового эфира 6-[циано(этоксикарбонилметил)метил]никотиновой кислоты (4,086 г).
К раствору полученного этилового эфира 6-[циано(этоксикарбонилметил)метил]никотиновой кислоты (0,5 г) в N,N-диметилформамиде (9 мл) добавляли при охлаждении льдом гидрид натрия (60% в масле) (0,145 г) и смесь перемешивали при охлаждении льдом в течение 30 минут и при комнатной температуре в течение 40 мин. При охлаждении льдом, добавляли хлорметил метиловый эфир (0,272 мл) и смесь перемешивали при комнатной температуре в течение 8 часов. Реакционную смесь выливали в воду со льдом и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением этилового эфира 6-[циано(этоксикарбонилметил)(метоксиметил)метил]никотиновой кислоты (0,335 г).
К полученному этиловому эфиру 6-[циано(этоксикарбонилметил)(метоксиметил)метил]никотиновой кислоты (0,171 г) добавляли этанол (3 мл), водный раствор пероксида водорода (0,982 мл) и 1 н водный раствор гидроксида натрия (1,6 мл) и смесь перемешивали при комнатной температуре в течение ночи. При охлаждении льдом, к реакционной смеси добавляли 5% водный раствор бисульфита натрия и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь экстрагировали тетрагидрофураном. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (0,087 г).
MS(ESI)m/z:265(M+H)+
[0317]
Пример получения 65: Получение 4-[(R)-1-(2,2-диметилпропионилоксиметил)-4-метил-2,5-диоксоимидазолидин-4-ил]бензойной кислоты
[0318]
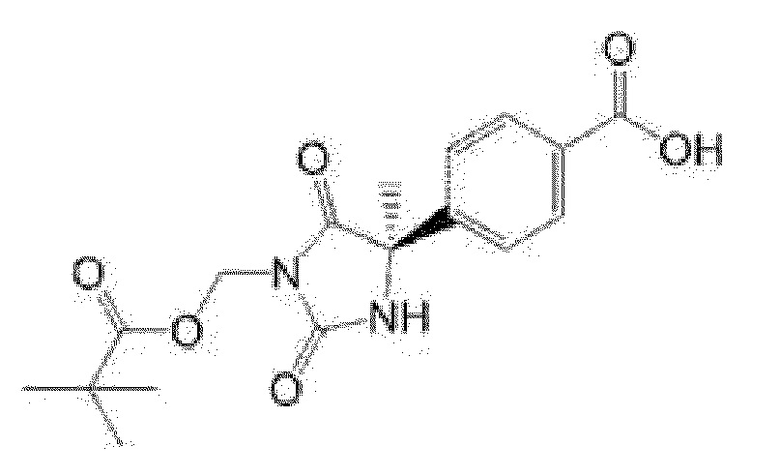
[0319]
4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (1,5 г) примера получения 6, 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (1,842 г) и 4-диметиламинопиридин (0,156 г) растворяли в дихлорметане (30 мл), добавляли бензиловый спирт (1,326 мл) и смесь перемешивали при комнатной температуре в течение 3 дней. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением бензилового эфира 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензоата (0,903 г).
К раствору полученного бензилового эфира 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензоата (450 мг) в N,N-диметилформамиде (5 мл) добавляли карбонат калия (230 мг) и хлорметил 2,2-диметилпропионат (0,211 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением бензилового эфира 4-[(R)-1-(2,2-диметилпропионилоксиметил)-4-метил-2,5-диоксоимидазолидин-4-ил]бензоата (512 мг).
К раствору полученного бензилового эфира 4-[(R)-1-(2,2-диметилпропионилоксиметил)-4-метил-2,5-диоксоимидазолидин-4-ил]бензоата (512 мг) в метаноле (10 мл) добавляли 10% палладированный уголь (100 мг) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (400 мг).
MS(ESI)m/z:349(M+H)+, 347(M-H)-
[0320]
Пример получения 66: Получение 5-(4-изопропил-2,5-диоксоимидазолидин-4-ил)тиофен-2-карбоновой кислоты
[0321]

[0322]
К 5-изобутирилтиофен-2-карбоновой кислоте (172 мг) добавляли карбонат аммония (417 мг), карбонат калия (240 мг), триметилсилилцианид (0,226 мл) и 28% водный аммиак (2 мл) и смесь перемешивали при микроволновом излучении при 100°C в течение 2 часов. Реакционную смесь выливали в воду со льдом, подкисляли концентрированной хлористоводородной кислотой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (207 мг).
MS(ESI)m/z:267(M-H)-
[0323]
Пример получения 67: Получение 2-(пиперидин-4-ил)-2H-индазол•2 гидрохлорида
[0324]

[0325]
К 2-нитробензальдегиду (377 мг) добавляли трет-бутиловый эфир 4-аминопиперидин-1-карбоновой кислоты (500 мг), безводный сульфат магния (1 г) и этанол (12 мл) и смесь перемешивали при 90°C в течение 3,5 часов. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли триэтилфосфит (4 мл) и смесь перемешивали при микроволновом излучении при 150°C в течение 40 мин. Реакционную смесь очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-(индазол-2-ил)пиперидин-1-карбоновой кислоты (490 мг).
Полученный трет-бутиловый эфир 4-(индазол-2-ил)пиперидин-1-карбоновой кислоты (490 мг) растворяли в 1,4-диоксане (2,5 мл), добавляли 4 н раствор хлороводорода/1,4-диоксана (2,5 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, растворитель выпаривали с получением указанного в заголовке соединения (439 мг).
MS(ESI)m/z:202(M+H)+
[0326]
Пример получения 68: Получение 5-хлор-2-(пиперидин-4-ил)-2H-индазол•2 гидрохлорида
[0327]
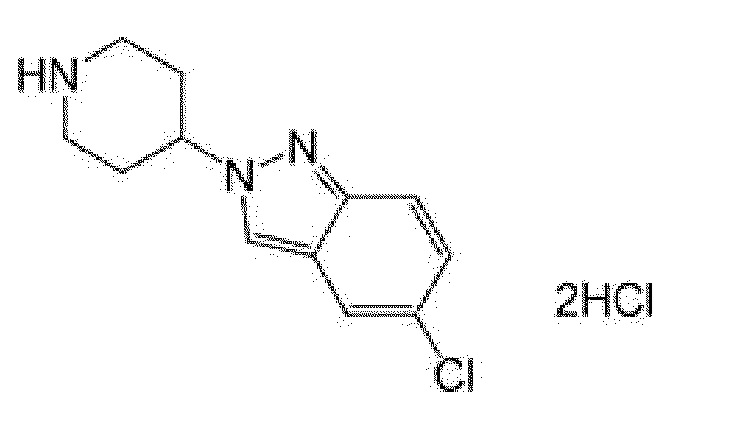
[0328]
К 5-хлор-2-нитробензальдегиду (465 мг) добавляли трет-бутиловый эфир 4-аминопиперидин-1-карбоновой кислоты (500 мг) и ацетонитрил (10 мл) и смесь перемешивали при микроволновом излучении при 80°C в течение 10 минут. Добавляли триэтилфосфит (4,3 мл) и смесь перемешивали при микроволновом излучении при 130°C в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-(5-хлориндазол-2-ил)пиперидин-1-карбоновой кислоты (495 мг).
Полученный трет-бутиловый эфир 4-(5-хлориндазол-2-ил)пиперидин-1-карбоновой кислоты (490 мг) растворяли в 1,4-диоксане (2,4 мл), добавляли 4 н раствор хлороводорода/1,4-диоксана (2,4 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, растворитель выпаривали с получением указанного в заголовке соединения (432 мг).
MS(ESI)m/z:236(M+H)+
[0329]
Пример получения 69: Получение 5-бром-2-(пиперидин-4-ил)-2H-индазол•2 гидрохлорида
[0330]

[0331]
К 5-бром-2-нитробензальдегиду (1,15 г) добавляли трет-бутиловый эфир 4-аминопиперидин-1-карбоновой кислоты (1 г) и ацетонитрил (10 мл) и смесь перемешивали при микроволновом излучении при 80°C в течение 10 мин. Добавляли триэтилфосфит (8,5 мл) и смесь перемешивали при микроволновом излучении при 130°C в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-(5-броминдазол-2-ил)пиперидин-1-карбоновой кислоты (1,22 г).
Полученный трет-бутиловый эфир 4-(5-броминдазол-2-ил)пиперидин-1-карбоновой кислоты (150 мг) растворяли в 1,4-диоксане (1,5 мл), добавляли 4 н раствор хлороводорода/1,4-диоксана (1,5 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, растворитель выпаривали с получением указанного в заголовке соединения (135 мг).
MS(ESI)m/z:280(M+H)+
[0332]
Пример получения 70: Получение 5-метил-2-(пиперидин-4-ил)-2H-индазол•2 гидрохлорида
[0333]

[0334]
Используя 5-метил-2-нитробензальдегид (206 мг) и трет-бутиловый эфир 4-аминопиперидин-1-карбоновой кислоты (250 мг), реакции и обработки, аналогичные тем, которые описаны в примере получения 68, осуществляли с получением указанного в заголовке соединения в виде неочищенного продукта (196 мг).
MS(ESI)m/z:216(M+H)+
[0335]
Пример получения 71: Получение 3,5-дихлор-2-(5-пиперидин-4-ил[1,3,4]оксадиазол-2-ил)пиридин•2 гидрохлорида
[0336]

[0337]
К трет-бутиловому эфиру 4-гидразинокарбонилпиперидин-1-карбоновой кислоты (500 мг) добавляли 3,5-дихлорпиридин-2-карбоновую кислоту (475 мг), 1-гидроксибензотриазол (420 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (590 мг), триэтиламин (575 мкл) и хлороформ (10 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением трет-бутилового эфира 4-[N'-(3,5-дихлорпиридин-2-карбонил)гидразинокарбонил]пиперидин-1-карбоновой кислоты (525 мг).
К полученному трет-бутиловому эфиру 4-[N'-(3,5-дихлорпиридин-2-карбонил)гидразинокарбонил]пиперидин-1-карбоновой кислоты (520 мг) добавляли п-толуолсульфонил хлорид (356 мг), тетрагидрофуран (10 мл) и триэтиламин (350 мкл) и смесь перемешивали при микроволновом излучении при 80°C в течение 1 часа. Реакционную смесь очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-[5-(3,5-дихлорпиридин-2-ил)[1,3,4]оксадиазол-2-ил]пиперидин-1-карбоновой кислоты (327 мг).
К полученному трет-бутиловому эфиру 4-[5-(3,5-дихлорпиридин-2-ил)[1,3,4]оксадиазол-2-ил]пиперидин-1-карбоновой кислоты (300 мг) добавляли 1,4-диоксан (3 мл) и 4 н раствор хлороводорода/1,4-диоксана (3 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, растворитель выпаривали с получением указанного в заголовке соединения (255 мг).
MS(ESI)m/z:299(M+H)+
[0338]
Пример получения 72: Получение 5-метил-2-(2-пиперидин-4-илтиазол-5-ил)пиридин•гидрохлорида
[0339]
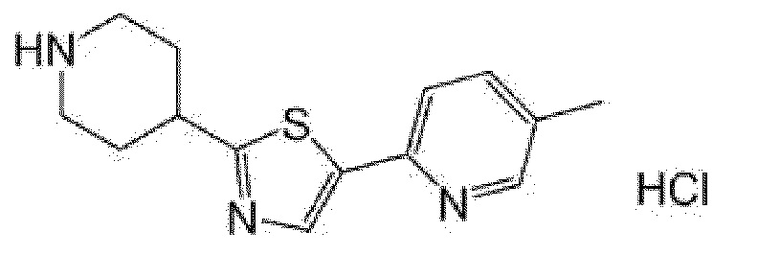
[0340]
К трет-бутиловому эфиру 4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (1,5 г) добавляли тетракис(трифенилфосфин)палладий(0) (280 мг), тетрагидрофуран (20 мл), 2-бромтиазол (955 мг) и 2 M водный раствор карбоната натрия (1,65 мл) и смесь перемешивали в атмосфере азота при 100°C в течение 6,5 часов. Реакционную смесь очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-(тиазол-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (557 мг).
К полученному трет-бутиловому эфиру 4-(тиазол-2-ил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (520 мг) добавляли этанол (10 мл) и 10% палладий/уголь (смоченный 53,5% воды) (260 мг) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-(тиазол-2-ил)пиперидин-1-карбоновой кислоты (480 мг).
В атмосфере азота, к раствору бис(пинаколато)диборона (535 мг), (1,5-циклооктадиен)(метокси)иридия(I) димеру (58 мг) и 4,4'-ди-трет-бутил-2,2'-бипиридина (94 мг) в тетрагидрофуране (7 мл) добавляли раствор трет-бутилового эфира 4-(тиазол-2-ил)пиперидин-1-карбоновой кислоты (470 мг) в тетрагидрофуране (3 мл) и смесь перемешивали при 70°C в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-[5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)тиазол-2-ил]пиперидин-1-карбоновой кислоты (407 мг).
К трет-бутиловому эфиру 4-[5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)тиазол-2-ил]пиперидин-1-карбоновой кислоты (390 мг) добавляли 2-бром-5-метилпиридин (222 мг), аддукт [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид•дихлорметан (41 мг), толуол (7,8 мл) и 2M водный раствор карбоната натрия (1 мл) и смесь перемешивали в атмосфере азота при 90°C в течение 1,5 часов. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-[5-(5-метилпиридин-2-ил)тиазол-2-ил]пиперидин-1-карбоновой кислоты (232 мг).
К полученному трет-бутиловому эфиру 4-[5-(5-метилпиридин-2-ил)тиазол-2-ил]пиперидин-1-карбоновой кислоты (225 мг) добавляли 1,4-диоксан (2,3 мл) и 4 н раствор хлороводорода/1,4-диоксана (2,3 мл) и смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали и к полученному остатку добавляли диизопропиловый эфир, и осадок собирали фильтрованием с получением указанного в заголовке соединения (115 мг).
MS(ESI)m/z:260(M+H)+
[0341]
Пример получения 73: Получение трет-бутилового эфира (2S,4S)-2-(трет-бутилдиметилсиланилоксиметил)-4-(2,4-диметилфениламино)пирролидин-1-карбоновой кислоты
[0342]
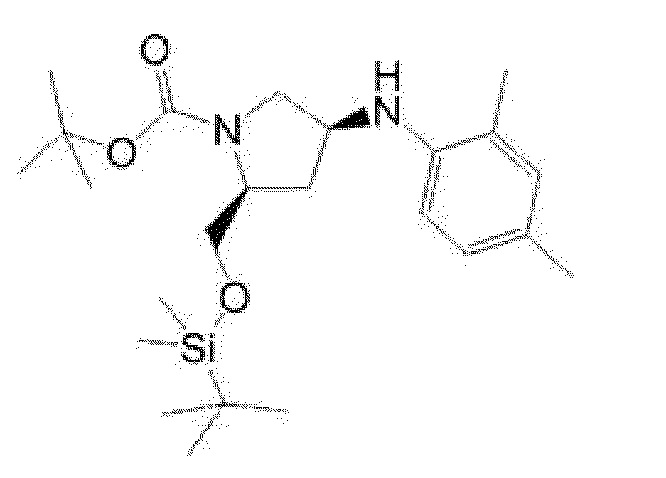
[0343]
К трет-бутиловому эфиру (2S,4S)-4-амино-2-(трет-бутилдиметилсиланилоксиметил)пирролидин-1-карбоновой кислоты (200 мг) добавляли 2,4-диметилбромбензол (134 мг), трис(дибензилиденацетон)дипалладий(0) (28 мг), 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (38 мг), трет-бутоксид натрия (87 мг) и толуол (4 мл) и смесь перемешивали в атмосфере азота при 80°C в течение 5 часов. Реакционную смесь очищали при помощи колоночной хроматографии на силикагеле (гексан:этилацетат) с получением указанного в заголовке соединения (220 мг).
MS(ESI)m/z:435(M+H)+
[0344]
Пример получения 74: Получение 3,5-диметил-2',3',5',6'-тетрагидро-1'H-[2,4']бипиридинил-4'-ол•2 гидрохлорида
[0345]
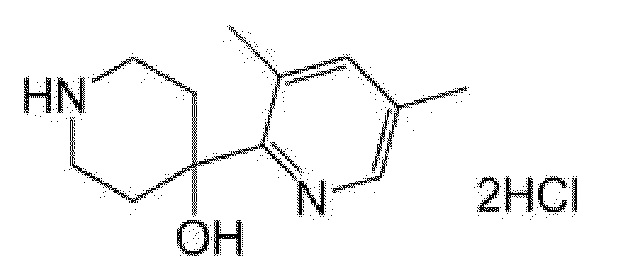
[0346]
К раствору 2-бром-3,5-диметилпиридина (2,0 г) в тетрагидрофуране (30 мл) добавляли при охлаждении при -78°C 1,59 M раствор н-бутиллитий/гексан (7,04 мл) и смесь перемешивали в течение 1 часа. Добавляли раствор 1-(трет-бутоксикарбонил)-4-пиперидона (2,23 г) в тетрагидрофуране (40 мл) и смесь перемешивали при -78°C в течение 30 минут. Реакционную смесь нагревали до комнатной температуры, добавляли насыщенный водный раствор карбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) и колоночной хроматографии с NH (гексан:этилацетат) с получением трет-бутилового эфира 4'-гидрокси-3,5-диметил-3',4',5',6'-тетрагидро-2'H-[2,4']бипиридинил-1'-карбоновой кислоты (1,69 г).
К раствору полученного трет-бутилового эфира 4'-гидрокси-3,5-диметил-3',4',5',6'-тетрагидро-2'H-[2,4']бипиридинил-1'-карбоновой кислоты (1,69 г) в этилацетате (10 мл) добавляли 4 н раствор хлороводорода/этилацетата (10 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Осадок собирали фильтрованием с получением указанного в заголовке соединения (1,384 г).
MS(ESI)m/z:207(M+H)+
[0347]
Пример получения 75: Получение 4-[5-(2,4-диметилфенил)[1,3,4]оксадиазол-2-ил]пиперидин•гидрохлорида
[0348]

[0349]
К трет-бутиловому эфиру 4-(гидразинокарбонил)пиперидин-1-карбоновой кислоты (1 г) добавляли 2,4-диметилбензойную кислоту (802 мг), 1-гидроксибензотриазол (833 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (1,182 г) и N,N-диметилформамид (10 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-[N'-(2,4-диметилбензоил)гидразинокарбонил]пиперидин-1-карбоновой кислоты (979 мг).
К раствору полученного трет-бутилового эфира 4-[N'-(2,4-диметилбензоил)гидразинокарбонил]пиперидин-1-карбоновой кислоты (979 мг) в тетрагидрофуране (15 мл) добавляли реагент Бургесса (1,243 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-[5-(2,4-диметилфенил)[1,3,4]оксадиазол-2-ил]пиперидин-1-карбоновой кислоты (923 мг).
К раствору полученного трет-бутилового эфира 4-[5-(2,4-диметилфенил)[1,3,4]оксадиазол-2-ил]пиперидин-1-карбоновой кислоты (923 мг) в 1,4-диоксане (10 мл) добавляли 4 н раствор хлороводорода/1,4-диоксана (6,46 мл) и смесь перемешивали при комнатной температуре в течение ночи. Осадок собирали фильтрованием с получением указанного в заголовке соединения (688 мг).
MS(ESI)m/z:258(M+H)+
[0350]
Пример получения 76: Получение 5-метил-2-(5-пиперидин-4-ил-2H-пиразол-3-ил)пиридин•2 гидрохлорида
[0351]
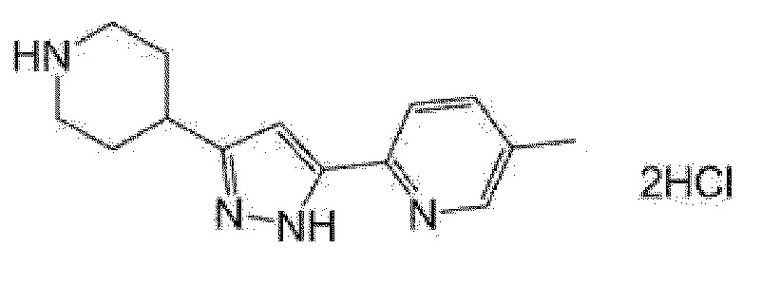
[0352]
Трет-бутиловый эфир 4-ацетилпиперидин-1-карбоновой кислоты (1,353 г) растворяли в тетрагидрофуране (10 мл) и добавляли N,N-диметилформамид (5 мл) и гидрид натрия (60% в масле) (524 мг). Смесь перемешивали при комнатной температуре в течение 10 мин, добавляли метиловый эфир 5-метилпиридин-2-карбоновой кислоты (900 мг) и смесь перемешивали при 60°C в течение 3 часов. К реакционной смеси добавляли водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-[3-(5-метилпиридин-2-ил)-3-оксопропионил]пиперидин-1-карбоновой кислоты (1,121 г).
Полученный трет-бутиловый эфир 4-[3-(5-метилпиридин-2-ил)-3-оксопропионил]пиперидин-1-карбоновой кислоты (1,121 г) растворяли в этаноле (10 мл) и метаноле (10 мл), добавляли гидразин•1 гидрат (0,394 мл) и смесь перемешивали при комнатной температуре в течение 3 дней. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-[5-(5-метилпиридин-2-ил)-1H-пиразол-3-ил]пиперидин-1-карбоновой кислоты (0,87 г).
К полученному трет-бутиловому эфиру 4-[5-(5-метилпиридин-2-ил)-1H-пиразол-3-ил]пиперидин-1-карбоновой кислоты (870 мг) добавляли 1,4-диоксан (15 мл) и 4 н раствор хлороводорода/1,4-диоксана (6,35 мл) и смесь перемешивали при комнатной температуре в течение ночи. Осадок собирали фильтрованием с получением указанного в заголовке соединения (826 мг).
MS(ESI)m/z:243(M+H)+
[0353]
Пример получения 77: Получение 4-[5-(п-толил)-1H-пиразол-3-ил]пиперидина
[0354]
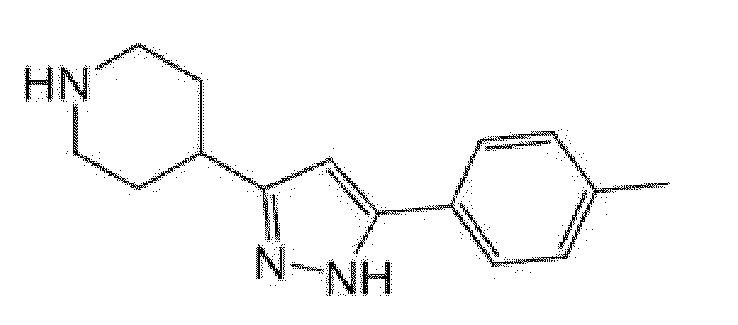
[0355]
К раствору 1-[(бензилокси)карбонил]пиперидин-4-карбоновой кислоты (4 г) в дихлорметане (20 мл) добавляли при охлаждении льдом оксалилхлорид (1,6 мл) и N,N-диметилформамид (каталитическое количество), и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении с получением бензилового эфира 4-(хлоркарбонил)пиперидин-1-карбоновой кислоты.
К раствору 4-метилацетофенона (3,1 г) в тетрагидрофуране (40 мл) добавляли при охлаждении при -78°C литий бис(триметилсилил)амид (около 0,5 моль/л, раствор тетрагидрофурана) (45,6 мл) и смесь перемешивали в течение 30 минут. К реакционной смеси добавляли раствор вышеуказанного бензилового эфира 4-(хлоркарбонил)пиперидин-1-карбоновой кислоты в тетрагидрофуране (40 мл) и смесь перемешивали в течение 3,5 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением бензилового эфира 4-[3-оксо-3-(п-толил)пропионил]пиперидин-1-карбоновой кислоты (3,91 г).
К раствору полученного бензилового эфира 4-[3-оксо-3-(п-толил)пропионил]пиперидин-1-карбоновой кислоты (500 мг) в этаноле (5 мл) добавляли гидразин•1 гидрат (0,32 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли воду, и осадок собирали фильтрованием с получением бензилового эфира 4-[5-(п-толил)-1H-пиразол-3-ил]пиперидин-1-карбоновой кислоты (168 мг).
К полученному бензиловому эфиру 4-[5-(п-толил)-1H-пиразол-3-ил]пиперидин-1-карбоновой кислоты (160 мг) добавляли метанол (3 мл), тетрагидрофуран (3 мл) и 10% палладированный уголь (32 мг) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (100 мг).
MS(ESI)m/z:242(M+H)+
[0356]
Пример получения 78: Получение 4-[2-(п-толил)-2H-тетразол-5-ил]пиперидина
[0357]

[0358]
1) Получение 4-метилбензолдиазоний хлорида
К раствору 4-метиланилина (500 мг) и концентрированной хлористоводородной кислоты (0,6 мл) в 50% этаноле (5 мл) добавляли при не более чем 5°C раствор нитрита натрия (321,9 мг) в воде (1 мл) (получение раствора 4-метилбензолдиазония хлорида).
[0359]
2) Получение 4-[2-(п-толил)-2H-тетразол-5-ил]пиперидина
К раствору 1-(трет-бутоксикарбонил)-4-пиперидинкарбоксальдегида (2 г) в этаноле (30 мл) добавляли п-толуолсульфонилгидразид (1,7 г) и смесь перемешивали при 30°C в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли диизопропиловый эфир (20 мл) и этилацетат (10 мл) и осадок собирали фильтрованием с получением трет-бутилового эфира 4-(п-толуолсульфонилгидразонометил)пиперидин-1-карбоновой кислоты (3 г).
К раствору полученного трет-бутилового эфира 4-(п-толуолсульфонилгидразонометил)пиперидин-1-карбоновой кислоты (1,7 г) в пиридине (10 мл) непосредственно добавляли по каплям при охлаждении при -10°С до -15°С реакционный раствор вышеуказанного 1) (раствор 4-метилбензолдиазоний хлорида) в течение не менее 30 мин. Смесь перемешивали при 0°C в течение 2 часов, выливали в воду и экстрагировали дихлорметаном. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (диизопропиловый эфир:этилацетат) с получением трет-бутилового эфира 4-[2-(п-толил)-2H-тетразол-5-ил]пиперидин-1-карбоновой кислоты (300 мг).
К раствору полученного трет-бутилового эфира 4-[2-(п-толил)-2H-тетразол-5-ил]пиперидин-1-карбоновой кислоты (100 мг) в 1,4-диоксане (5 мл) добавляли 4 н раствор хлороводорода/1,4-диоксана (5 мл) и смесь перемешивали при 35°C в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении, полученный остаток подщелачивали (рН 9) с помощью 1 н водного раствора гидроксида натрия. Смесь экстрагировали дихлорметаном и органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением 4-[2-(п-толил)-2H-тетразол-5-ил]пиперидина (60 мг).
MS(APCI)m/z:244(M+H)+
[0360]
Пример получения 79: Получение 4-[1-(п-толил)-1H-[1,2,3]триазол-4-ил]пиперидин•2 гидрохлорида
[0361]

[0362]
К трет-бутиловому эфиру 4-этинилпиперидин-1-карбоновой кислоты (1,00 г) добавляли аскорбат натрия (0,757 г), сульфат меди•5 гидрат (0,239 мг), тетрагидрофуран (30 мл), воду (10 мл) и 1-азидо-4-метилбензол (10 мл) и смесь перемешивали при комнатной температуре в течение 3 дней. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-[1-(п-толил)-1H-[1,2,3]триазол-4-ил]пиперидин-1-карбоновой кислоты (0,861 мг).
К полученному трет-бутиловому эфиру 4-[1-(п-толил)-1H-[1,2,3]триазол-4-ил]пиперидин-1-карбоновой кислоты (0,86 мг) добавляли 1,4-диоксан (7 мл), метанол (10 мл) и 4 н раствор хлороводорода/1,4-диоксана (3,14 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли этилацетат, и осадок собирали фильтрованием с получением указанного в заголовке соединения (0,807 г).
MS(ESI)m/z:243(M+H)+
[0363]
Пример получения 80: Получение 4-[1-(п-толил)-1H-имидазол-4-ил]пиперидин•2 гидрохлорида
[0364]

[0365]
К трет-бутиловому эфиру 4-(1H-имидазол-4-ил)пиперидин-1-карбоновой кислоты (370 мг) добавляли 4-иодотолуол (0,23 мл), карбонат калия (407 мг), йодид меди (42 мг), 8-гидроксихинолин (32 мг) и диметилсульфоксид (7 мл) и смесь перемешивали при 100°C в течение 3 дней. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-[1-(п-толил)-1H-имидазол-4-ил]пиперидин-1-карбоновой кислоты (277 мг).
К полученному трет-бутиловому эфиру 4-[1-(п-толил)-1H-имидазол-4-ил]пиперидин-1-карбоновой кислоты (270 мг) добавляли 1,4-диоксан (3 мл), метанол (1 мл) и 4 н раствор хлороводорода/1,4-диоксана (0,99 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (253 мг).
MS(ESI)m/z:242(M+H)+
[0366]
Пример получения 81: Получение 3,5-диметил-1',2',3',4',5',6'-гексагидро[2,4']бипиридинил•2 гидрохлорида
[0367]
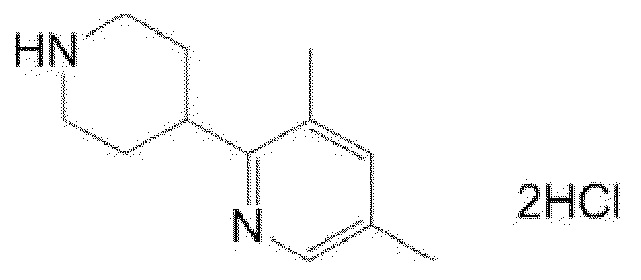
[0368]
К 2-бром-3,5-диметилпиридину (6,62 г) добавляли пинаколовый эфир N-Boc-1,2,3,6-тетрагидропиридин-4-бороновой кислоты (10 г), карбонат натрия (7,54 г), 1,4-диоксан (50 мл), воду (50 мл) и тетракис(трифенилфосфин)палладий(0) (1,87 г) и смесь перемешивали в потоке азота при 100°C в течение 5 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия и обрабатывали активированным углем. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 3,5-диметил-3',6'-дигидро-2'H-[2,4']бипиридинил-1'-карбоновой кислоты (8,93 г).
Полученный трет-бутиловый эфир 3,5-диметил-3',6'-дигидро-2'H-[2,4']бипиридинил-1'-карбоновой кислоты (8,8 г) растворяли в этаноле (100 мл), добавляли 10% палладированный уголь и смесь перемешивали в атмосфере водорода в течение 29 часов. Реакционную смесь фильтровали, фильтрат концентрировали при пониженном давлении с получением трет-бутилового эфира 3,5-диметил-3',4',5',6'-тетрагидро-2'H-[2,4']бипиридинил-1'-карбоновой кислоты (8,58 г).
К трет-бутиловому эфиру 3,5-диметил-3',4',5',6'-тетрагидро-2'H-[2,4']бипиридинил-1'-карбоновой кислоты (8,55 г) добавляли 2 н раствор хлороводорода/метанола (70 мл) и смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь концентрировали при пониженном давлении и к полученному остатку добавляли смешанный растворитель метанола и этилацетата. Осадок собирали фильтрованием с получением указанного в заголовке соединения (7,9 г).
MS(ESI)m/z:191(M+H)+
[0369]
Пример получения 82: Получение 4-(2,4-диметилфенил)пиперидин•гидрохлорида
[0370]
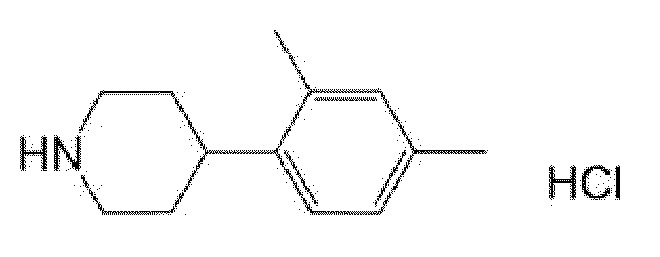
[0371]
К 4-(2,4-диметилфенил)пиперидин-4-олу (450 мг) добавляли трифторуксусную кислоту (10 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении и полученный остаток растворяли в метаноле (15 мл). Добавляли 10% палладированный уголь (250 мг) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 5 часов. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли 2 н раствор хлороводорода/метанола и смесь концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (211 мг).
MS(ESI)m/z:190(M+H)+
[0372]
Пример получения 83: Получение 3',5'-диметил-3,4,5,6-тетрагидро-2H-[1,2']бипиразинила
[0373]

[0374]
К 2-хлор-3,5-диметилпиразину (2,8 г) добавляли 1-(трет-бутоксикарбонил)пиперазин (3,7 г), ацетат палладия(II) (225 мг), 2-(дициклогексилфосфино)-2',4',6'-триизопропилбифенил (953 мг), трет-бутоксид натрия (2,7 г) и толуол (40 мл) и смесь перемешивали при кипячении с обратным холодильником в течение 8 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 3',5'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-карбоновой кислоты (5 г).
Полученный трет-бутиловый эфир 3',5'-диметил-2,3,5,6-тетрагидро-[1,2']бипиразинил-4-карбоновой кислоты (5 г) растворяли в хлороформе (15 мл), добавляли 4 н раствор хлороводорода/этилацетата (15 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли этилацетат (100 мл) и осадок собирали фильтрованием с получением 3',5'-диметил-3,4,5,6-тетрагидро-2H-[1,2']бипиразинил•гидрохлорида (3,3 г).
К полученному 3',5'-диметил-3,4,5,6-тетрагидро-2H-[1,2']бипиразинил•гидрохлориду (1,86 г) добавляли насыщенный водный бикарбонат натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии с NH (этилацетат:метанол) с получением указанного в заголовке соединения (960 мг).
MS(ESI)m/z:193(M+H)+
[0375]
Пример получения 84: Получение 3,4,5-триметил-6-пиперазин-1-илпиридазина
[0376]

[0377]
К 3-хлор-4,5,6-триметилпиридазину (300 мг) добавляли 1-(трет-бутоксикарбонил)пиперазин (428 мг), ацетат палладия (22 мг), 2-(дициклогексилфосфино)-2',4',6'-триизопропилбифенил (182,6 мг), трет-бутоксид натрия (276 мг) и толуол (4 мл) и смесь перемешивали при 110°C в течение 4 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:этилацетат) с получением трет-бутилового эфира 4-(4,5,6-триметилпиридазин-3-ил)пиперазин-1-карбоновой кислоты (297 мг).
Полученный трет-бутиловый эфир 4-(4,5,6-триметилпиридазин-3-ил)пиперазин-1-карбоновой кислоты (297 мг) растворяли в этилацетате (3 мл) и добавляли 4 н раствор хлороводорода/этилацетата (2,6 мл). Смесь перемешивали при комнатной температуре в течение 3 часов и осадок собирали фильтрованием. К полученному осадку добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагировали хлороформом/метанолом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (этилацетат:метанол) с получением указанного в заголовке соединения (68,4 мг).
MS(ESI)m/z:207(M+H)+
[0378]
Пример получения 85: Получение (3,5-диметилпиридин-2-ил)пиперидин-4-иламина
[0379]
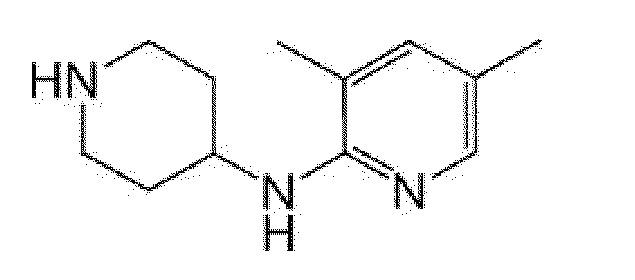
[0380]
К 2-бром-3,5-диметилпиридину (1 г) добавляли 4-амино-1-(трет-бутоксикарбонил)пиперидин (1,29 г), трис(дибензилиденацетон)дипалладий(0) (250 мг), 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (330 мг), трет-бутоксид натрия (770 мг) и толуол (8 мл) и смесь перемешивали при 120°C в течение ночи. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (гексан:этилацетат) с получением трет-бутилового эфира 4-(3,5-диметилпиридин-2-иламино)пиперидин-1-карбоновой кислоты (1,499 г).
Полученный трет-бутиловый эфир 4-(3,5-диметилпиридин-2-иламино)пиперидин-1-карбоновой кислоты (610 мг) растворяли в хлороформе (3 мл), добавляли трифторуксусную кислоту (2 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь загружали для ионообменной хроматографии, промывали метанолом и элюировали 1 н раствором аммиака/метанола с получением указанного в заголовке соединения (317,8 мг).
MS(APCI)m/z:206(M+H)+
[0381]
Пример получения 86: Получение 3,5-диметил-2-((S)-пирролидин-3-илокси)пиридина
[0382]
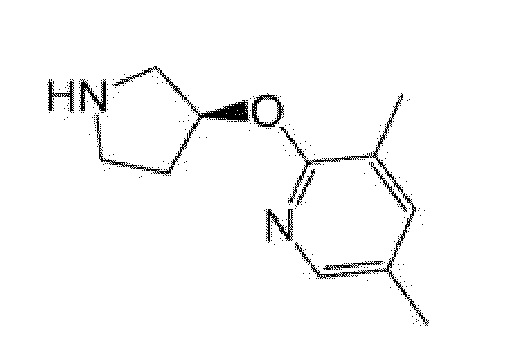
[0383]
К раствору (S)-1-(трет-бутоксикарбонил)-3-гидроксипирролидина (2,26 г) и 2,3,5-трихлорпиридина (2,2 г) в N,N-диметилформамиде (20 мл) добавляли при охлаждении льдом гидрид натрия (60% в масле) (507 мг) и смесь перемешивали при комнатной температуре. После завершения реакции, добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира (S)-3-(3,5-дихлорпиридин-2-илокси)пирролидин-1-карбоновой кислоты (3,74 г).
К полученному трет-бутиловому эфиру (S)-3-(3,5-дихлорпиридин-2-илокси)пирролидин-1-карбоновой кислоты (3,74 г) добавляли 2,4,6-триметилбороксин (4,7 мл), ацетат палладия(II) (252 мг), фторид калия (5,21 г), 2-дициклогексилфосфино-2',6'-диметоксибифенил (922 мг) и 1,4-диоксан (38 мл) и смесь кипятили с обратным холодильником при перемешивании в течение 4 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира (S)-3-(3,5-диметилпиридин-2-илокси)пирролидин-1-карбоновой кислоты (2,96 г).
Полученный трет-бутиловый эфир (S)-3-(3,5-диметилпиридин-2-илокси)пирролидин-1-карбоновой кислоты (2,96 г) растворяли в дихлорметане (15 мл), добавляли трифторуксусную кислоту (7,6 мл) при охлаждении льдом, и смесь перемешивали при комнатной температуре. После завершения реакции, к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Растворитель выпаривали с получением указанного в заголовке соединения (1,5 г).
MS(ESI)m/z:193(M+H)+
[0384]
Пример получения 87: Получение 5-метил-1-пирролидин-3-ил-2,3-дигидро-1H-пирроло[2,3-b]пиридина
[0385]

[0386]
К раствору 2,3-дигидро-7-азаиндола (2,8 г) и 1-(трет-бутоксикарбонил)-3-оксопирролидина (5,44 г) в метаноле (28 мл) добавляли при охлаждении льдом уксусную кислоту (4,67 мл) и цианоборгидрид натрия (1,76 г) и смесь перемешивали при комнатной температуре в течение 1,5 часов. Добавляли 1-(трет-бутоксикарбонил)-3-оксопирролидин (3 г) и смесь перемешивали при комнатной температуре в течение 1,5 часов. Добавляли 2 н водный раствор гидроксида натрия (80 мл) и смесь концентрировали при пониженном давлении для выпаривания метанола. Оставшийся водный раствор экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К полученному остатку добавляли этилацетат, и смесь снова экстрагировали 1н хлористоводородной кислотой. Водный слой нейтрализовали водным раствором гидроксида натрия и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 3-(2,3-дигидропирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбоновой кислоты (2,96 г).
Полученный трет-бутиловый эфир 3-(2,3-дигидропирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбоновой кислоты (2 г) растворяли в N,N-диметилформамиде (20 мл), N-бромсукцинимид (1,26 г) добавляли при охлаждении льдом и смесь перемешивали в течение 2 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением трет-бутилового эфира 3-(5-бром-2,3-дигидропирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбоновой кислоты (2,77 г).
К полученному трет-бутиловому эфиру 3-(5-бром-2,3-дигидропирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбоновой кислоты (1,2 г) добавляли 2,4,6-триметилбороксин (4,24 мл), ацетат палладия(II) (73,2 мг), фторид калия (757 мг), 2-дициклогексилфосфино-2',6'-диметоксибифенил (268 мг) и 1,4-диоксан (12 мл) и смесь кипятили с обратным холодильником при перемешивании в течение 1,5 часов. К реакционной смеси добавляли воду и смесь фильтровали через целит. Фильтрат экстрагировали этилацетатом и экстракт сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 3-(5-метил-2,3-дигидропирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбоновой кислоты (792 мг).
К полученному трет-бутиловому эфиру 3-(5-метил-2,3-дигидропирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбоновой кислоты (100 мг) добавляли этилацетат (0,5 мл), этанол (0,5 мл) и 4 н раствор хлороводорода/этилацетата (1,6 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагировали смешанным раствором хлороформа и метанола. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток отделяли с помощью ВЭЖХ с использованием XBridge Prep C18 OBD (10 ммоль/л водного раствора карбоната аммония, ацетонитрил). Полученный раствор экстрагировали смешанным растворителем из хлороформа и метанола. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением указанного в заголовке соединения (22,1 мг).
MS(ESI)m/z:204(M+H)+
[0387]
Пример получения 88: Получение (3,5-диметилпиридин-2-ил)-(S)-пирролидин-3-иламин•2 гидрохлорида
[0388]

[0389]
К 2-бром-3,5-диметилпиридину (10,26 г) добавляли (S)-1-(трет-бутоксикарбонил)-3-аминопирролидин (10,27 г), трис(дибензилиденацетон)дипалладий(0) (505 мг), 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (1 г), трет-бутоксид натрия (7,24 г) и толуол (180 мл) и смесь перемешивали при 80°C в течение 3 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат). Растворитель выпаривали, к полученному остатку добавляли этилацетат (50 мл), 4 н раствор хлороводорода/1,4-диоксана (50 мл) и метанол (10 мл) и смесь перемешивали при комнатной температуре в течение 2,5 часов. К реакционной смеси добавляли диэтиловый эфир, и супернатант удаляли декантацией. К полученному остатку добавляли этилацетат/этанол и осадок собирали фильтрованием с получением указанного в заголовке соединения (11,9 г).
MS(ESI)m/z:192(M+H)+
[0390]
Пример получения 89: Получение 5-метил-1-пиперидин-4-ил-1H-пирроло[2,3-b]пиридина
[0391]

[0392]
К раствору бензилового эфира 4-(гидрокси)пиперидин-1-карбоновой кислоты (2 г), 5-бром-1H-пирроло[2,3-b]пиридина (1,12 г) и трифенилфосфина (2,97 г) в тетрагидрофуране (30 мл) добавляли при охлаждении льдом диизопропил азодикарбоксилат (2,2 мл). Смесь перемешивали при комнатной температуре в течение ночи, к реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и смесь фильтровали (осажденный оксид трифенилфосфина удаляли). Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (гексан:этилацетат) и колоночной хроматографии с NH (гексан:этилацетат) с получением бензилового эфира 4-(5-бромпирроло[2,3-b]пиридин-1-ил)пиперидин-1-карбоновой кислоты (650 мг).
К полученному бензиловому эфиру 4-(5-бромпирроло[2,3-b]пиридин-1-ил)пиперидин-1-карбоновой кислоты (640 мг) добавляли 2,4,6-триметилбороксин (504 мг), ацетат палладия(II) (35 мг), фторид калия (359 мг), 2-дициклогексилфосфино-2',6'-диметоксибифенил (127 мг) и 1,4-диоксан (10 мл) и смесь перемешивали при кипячении с обратным холодильником в течение 2 часов. Добавляли 2,4,6-триметилбороксин (272 мг) и смесь перемешивали при кипячении с обратным холодильником в течение 2 часов. К реакционной смеси добавляли воду и этилацетат, и смесь фильтровали через целит. Фильтрат экстрагировали этилацетатом, органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением бензилового эфира 4-(5-метилпирроло[2,3-b]пиридин-1-ил)пиперидин-1-карбоновой кислоты (476 мг).
К раствору полученного бензилового эфира 4-(5-метилпирроло[2,3-b]пиридин-1-ил)пиперидин-1-карбоновой кислоты (380 мг) в этаноле (15 мл) добавляли 7,5% палладированный уголь (114 мг) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 7 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (этилацетат:метанол) с получением указанного в заголовке соединения (207 мг).
MS(ESI)m/z:216(M+H)+
[0393]
Пример получения 90: Получение 5-метил-1-(S)-пирролидин-3-ил-2,3-дигидро-1H-пирроло[2,3-b]пиридина
[0394]

[0395]
К раствору бензилового эфира (R)-3-гидроксипирролидин-1-карбоновой кислоты (2 г) и 5-бром-1H-пирроло[2,3-b]пиридина (1,78 г) в толуоле (25 мл) добавляли при нагревании при 80°C раствор цианометилентрибутилфосфорана (4,364 г) в толуоле (7 мл). Смесь перемешивали при 110°C в течение 5 часов и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (гексан:этилацетат) с получением бензилового эфира (S)-3-(5-бромпирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбоновой кислоты (2,78 г).
К полученному бензиловому эфиру (S)-3-(5-бромпирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбоновой кислоты (1,3 г) добавляли 2,4,6-триметилбороксин (2,26 г), ацетат палладия(II) (156 мг), фторид калия (1,61 г), 2-дициклогексилфосфино-2',6'-диметоксибифенил (570 мг) и 1,4-диоксан (40 мл) и смесь перемешивали при кипячении с обратным холодильником в течение 1 часа. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением бензилового эфира (S)-3-(5-метилпирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбоновой кислоты (2,32 г).
Полученный бензиловый эфир (S)-3-(5-метилпирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбоновой кислоты (1,3 г) растворяли в уксусной кислоте (12 мл), добавляли цианоборгидрид натрия (1,22 г) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли цианоборгидрид натрия (1,22 г) и смесь перемешивали при комнатной температуре в течение 3 дней. К реакционной смеси добавляли при охлаждении льдом 2 н водный раствор гидроксида натрия (50 мл). Смесь подщелачивали карбонатом калия и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением бензилового эфира (S)-3-(5-метил-2,3-дигидропирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбоновой кислоты (2,78 г).
Полученный бензиловый эфир (S)-3-(5-метил-2,3-дигидропирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбоновой кислоты (1,12 г) растворяли в этаноле (15 мл), добавляли 7,5% палладированный уголь (336 мг) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 2 дней. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Полученный остаток растворяли в этаноле (20 мл), добавляли 7,5% палладированный уголь (448 мг) и смесь перемешивали в атмосфере водорода при комнатной температуре 4 дня. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (этилацетат:метанол) с получением указанного в заголовке соединения (479 мг).
MS(ESI)m/z:204(M+H)+
[0396]
Пример получения 91: Получение 5-метил-1-(S)-пирролидин-3-ил-1H-пирроло[2,3-b]пиридина
[0397]

[0398]
Бензиловый эфир (S)-3-(5-метилпирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбоновой кислоты (1,02 г), полученный методом синтеза, описанным в примере получения 90, растворяли в этаноле (15 мл), добавляли 7,5% палладированный уголь (306 мг) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 8 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (этилацетат:метанол) с получением указанного в заголовке соединения (460 мг).
MS(ESI)m/z:202(M+H)+
[0399]
Пример получения 92: Получение трет-бутилового эфира 3-(3,5-диметилпиридин-2-иламино)азетидин-1-карбоновой кислоты
[0400]

[0401]
К 2-бром-3,5-диметилпиридин (1 г) добавляли 1-(трет-бутоксикарбонил)-3-аминоазетидин (1,11 г), трис(дибензилиденацетон)дипалладий(0) (250 мг), 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (330 мг), трет-бутоксид натрия (770 мг) и толуол (8 мл) и смесь перемешивали при 120°C в течение ночи. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (гексан:этилацетат) с получением указанного в заголовке соединения (965 мг).
MS(APCI)m/z:278(M+H)+
[0402]
Пример получения 93: Получение (5-метилпиридин-2-ил)пиперидин-4-илметанон•2 гидрохлорида
[0403]
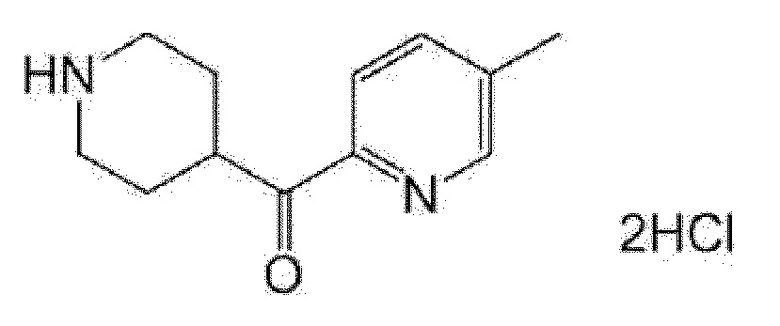
[0404]
К раствору 2-бром-5-метилпиридина (4,04 г) в толуоле (70 мл) добавляли при -78°C раствор н-бутиллития/гексана (1,6 M) (16,9 мл). Смесь перемешивали при -78°C в течение 10 мин и добавляли раствор трет-бутилового эфира 4-(метоксиметилкарбамоил)пиперидин-1-карбоновой кислоты (6,4 г) в толуоле (10 мл). Смесь перемешивали при -78°C в течение 30 минут, к реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-(5-метилпиридин-2-карбонил)пиперидин-1-карбоновой кислоты (4,03 г).
К раствору полученного трет-бутилового эфира 4-(5-метилпиридин-2-карбонил)пиперидин-1-карбоновой кислоты (4,02 г) в хлороформе (66 мл) добавляли 4 н раствор хлороводорода/этилацетата (33 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли гексан и осадок собирали фильтрованием с получением указанного в заголовке соединения (3,61 г).
MS(ESI)m/z:205(M+H)+
[0405]
Пример получения 94: Получение (3R,4R)-4-(3,5-диметилпиридин-2-иламино)пирролидин-3-ол•2 гидрохлорида
[0406]

[0407]
К трет-бутиловому эфиру (3R,4R)-3-амино-4-гидроксипирролидин-1-карбоновой кислоты (1,35 г) добавляли дихлорметан (67 мл), диизопропилэтиламин (4,1 мл), 3,5-диметилпиридин-N-оксид (986 мг) и бромтрис(пирролидино)фосфоний гексафторфосфат (3,73 г) и смесь перемешивали при комнатной температуре в течение 6,5 часов. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Органический слой концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира (3R,4R)-3-(3,5-диметилпиридин-2-иламино)-4-гидроксипирролидин-1-карбоновой кислоты (1 г).
К полученному трет-бутиловому эфиру (3R,4R)-3-(3,5-диметилпиридин-2-иламино)-4-гидроксипирролидин-1-карбоновой кислоты (1 г) добавляли хлороформ (10 мл) и 4 н раствор хлороводорода/этилацетата (8,3 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (1 г).
MS(ESI)m/z:208(M+H)+
[0408]
Пример получения 95: Получение 5,7-диметил-1-(R)-пирролидин-3-ил-1H-индазола
[0409]

[0410]
(S)-1-(трет-бутоксикарбонил)-3-гидроксипирролидин (853 мг), 3-йод-5,7-диметил-1H-индазол (620 мг) и трифенилфосфин (1195 мг) растворяли в тетрагидрофуране (12 мл), диизопропил азодикарбоксилат (0,897 мл) добавляли при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли диизопропиловый эфир и смесь фильтровали (осадок удаляли). Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (гексан:этилацетат) с получением трет-бутилового эфира (R)-3-(3-йод-5,7-диметилиндазол-1-ил)пирролидин-1-карбоновой кислоты (442 мг).
К раствору полученного трет-бутилового эфира (R)-3-(3-йод-5,7-диметилиндазол-1-ил)пирролидин-1-карбоновой кислоты (435 мг) в этаноле (8,9 мл) добавляли 10% палладированный уголь (44 мг) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли 1 н водный раствор гидроксида натрия (1,97 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли воду и этилацетат и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением трет-бутилового эфира (R)-3-(5,7-диметилиндазол-1-ил)пирролидин-1-карбоновой кислоты (309 мг).
К трет-бутиловому эфиру (R)-3-(5,7-диметилиндазол-1-ил)пирролидин-1-карбоновой кислоты (361 мг), полученному вышеуказанным способом, и способом, подобным вышеуказанному способу, добавляли 1,4-диоксан (5,4 мл) и 4 н раствор хлороводорода/1,4-диоксана (2,86 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли насыщенный водный раствор гидрокарбоната натрия (примерно pH 8) при охлаждении льдом и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением указанного в заголовке соединения (239 мг).
MS(ESI)m/z:216(M+H)+
[0411]
Пример получения 96: Получение 5,7-диметил-2-пиперидин-4-ил-2H-индазол•гидрохлорида
[0412]

[0413]
1) Получение трет-бутилового эфира 4-(3-йод-5,7-диметилиндазол-2-ил)пиперидин-1-карбоновой кислоты и трет-бутилового эфира 4-(3-йод-5,7-диметилиндазол-1-ил)пиперидин-1-карбоновой кислоты
К раствору 3-йод-5,7-диметил-1H-индазола (300 мг), 1-(трет-бутоксикарбонил)-4-гидроксипиперидина (488 мг), трифенилфосфина (578 мг) в тетрагидрофуране (6 мл) добавляли при охлаждении льдом диэтил азодикарбоксилат (40% раствор толуола, около 2,2 моль/л) (1,002 мл) и смесь перемешивали при комнатной температуре в течение 3,5 часов. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли диизопропиловый эфир и смесь фильтровали (осадок удаляли). Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (гексан:этилацетат) с получением трет-бутилового эфира 4-(3-йод-5,7-диметилиндазол-2-ил)пиперидин-1-карбоновой кислоты (226,5 мг) и трет-бутилового эфира 4-(3-йод-5,7-диметилиндазол-1-ил)пиперидин-1-карбоновой кислоты (227,4 мг).
При анализе методом ВЭЖХ Acqity UPLC BEH C18(Waters) (2 мм×50 мм, подвижная фаза A: 0,05% муравьиная кислота/вода, подвижная фаза B: 0,05% муравьиная кислота/ацетонитрил, градиент: B 5%→98% 1 мин, поток: 0,6 мл/мин), время удерживания составляло 1,38 мин и 1,36 мин, соответственно.
[0414]
2) Получение 5,7-диметил-2-пиперидин-4-ил-2H-индазол•гидрохлорида
К трет-бутиловому эфиру 4-(3-йод-5,7-диметилиндазол-2-ил)пиперидин-1-карбоновой кислоты (222 мг), описанному в вышеупомянутом 1), добавляли метанол (4 мл), тетрагидрофуран (2 мл), 2 н водный раствор гидроксида натрия (0,488 мл) и 10% палладированный уголь (22 мг) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. К полученному остатку добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-(5,7-диметилиндазол-2-ил)пиперидин-1-карбоновой кислоты (154 мг).
К полученному трет-бутиловому эфиру 4-(5,7-диметилиндазол-2-ил)пиперидин-1-карбоновой кислоты (150 мг) добавляли 1,4-диоксан (2,2 мл) и 4 н раствор хлороводорода/1,4-диоксана (1,14 мл) и смесь перемешивали при комнатной температуре в течение 1,5 часов. Добавляли 4 н раствор хлороводорода/1,4-диоксана (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли диэтиловый эфир и осадок собирали фильтрованием с получением 5,7-диметил-2-пиперидин-4-ил-2H-индазол•гидрохлорида (150,7 мг).
MS(ESI)m/z:230(M+H)+
[0415]
Пример получения 97: Получение 5,7-диметил-1-пиперидин-4-ил-1H-индазол•гидрохлорида
[0416]

[0417]
Используя трет-бутиловый эфир 4-(3-йод-5,7-диметилиндазол-1-ил)пиперидин-1-карбоновой кислоты (223 мг), описанный в примере получения 96, 1), реакции и обработки, аналогичные тем, которые описаны в примере получения 96, 2), осуществляли с получением указанного в заголовке соединения (116,5 мг).
MS(ESI)m/z:230(M+H)+
[0418]
Пример получения 98: Получение 4,6-диметил-3-пиперидин-4-ил-1H-индазола
[0419]
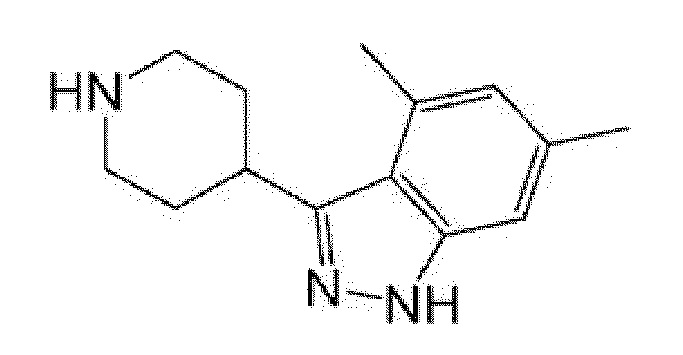
[0420]
1) Получение трет-бутилового эфира 4-[(2,4-дибром-6-фторфенил)гидроксиметил]пиперидин-1-карбоновой кислоты
К раствору диизопропиламина (1,21 мл) в тетрагидрофуране (8 мл) добавляли при -78°C раствор н-бутиллитий/гексан (2,65 моль/л, 3,33 мл). Смесь перемешивали при 0°C в течение 10 мин, и добавляли раствор 1,3-дибром-5-фторбензола (2 г) в тетрагидрофуране (25 мл) при -78°C. Смесь перемешивали при -78°C в течение 30 минут и добавляли раствор 1-Boc-4-пиперидинкарбоксальдегида (1,85 г) в тетрагидрофуране (32 мл). Смесь перемешивали при 0°C в течение 6,5 часов, насыщенный водный раствор хлорида аммония добавляли к реакционной смеси и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (гексан:этилацетат) с получением трет-бутилового эфира 4-[(2,4-дибром-6-фторфенил)гидроксиметил]пиперидин-1-карбоновой кислоты (2,04 г).
[0421]
2) Получение трет-бутилового эфира 4-(2,4-дибром-6-фторбензоил)пиперидин-1-карбоновой кислоты
К раствору оксалилхлорида (0,63 мл) в дихлорметане (8 мл) добавляли при охлаждении при -78°C раствор диметилсульфоксида (0,785 мл) в дихлорметане (2 мл). Смесь перемешивали при не более чем -50°C в течение 5 мин, и добавляли раствор трет-бутилового эфира 4-[(2,4-дибром-6-фторфенил)гидроксиметил]пиперидин-1-карбоновой кислоты (1,72 г) в дихлорметане (10 мл), описанный в вышеупомянутом 1). Смесь перемешивали при не более чем -50°C в течение 20 мин, добавляли триэтиламин (3,08 мл) и смесь перемешивали при комнатной температуре в течение 5 мин. К реакционной смеси добавляли воду и насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-(2,4-дибром-6-фторбензоил)пиперидин-1-карбоновой кислоты (1,714 г).
[0422]
3) Получение трет-бутилового эфира 4-(4,6-дибром-1H-индазол-3-ил)пиперидин-1-карбоновой кислоты
К трет-бутиловому эфиру 4-(2,4-дибром-6-фторбензоил)пиперидин-1-карбоновой кислоты (3,74 г), полученному способом, аналогичным вышеупомянутому 2), добавляли этанол (74,8 мл) и гидразин•1 гидрат (4,68 мл) и смесь перемешивали при кипячении с обратным холодильником в течение ночи. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли воду и осадок собирали фильтрованием. Полученный осадок перекристаллизовывали из этанола с получением трет-бутилового эфира 4-(4,6-дибром-1H-индазол-3-ил)пиперидин-1-карбоновой кислоты (2,664 г).
[0423]
4) Получение трет-бутилового эфира 4-[4,6-дибром-1-(2-триметилсиланилэтоксиметил)-1H-индазол-3-ил]пиперидин-1-карбоновой кислоты
К раствору трет-бутилового эфира 4-(4,6-дибром-1H-индазол-3-ил)пиперидин-1-карбоновой кислоты (900 мг), полученного способом, аналогичным вышеупомянутому 3), в N,N-диметилформамиде (18 мл) добавляли при охлаждении льдом гидрид натрия (60% в масле) (102 мг). Смесь перемешивали в течение 3 мин и добавляли 2-(хлорметокси)этилтриметилсилан (0,482 мл). При охлаждении льдом, смесь перемешивали в течение 1 часа, к реакционной смеси добавляли воду, и смесь экстрагировали смешанным растворителем из этилацетата и гексана. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-[4,6-дибром-1-(2-триметилсиланилэтоксиметил)-1H-индазол-3-ил]пиперидин-1-карбоновой кислоты (869 мг).
[0424]
5) Получение трет-бутилового эфира 4-[4,6-диметил-1-(2-триметилсиланилэтоксиметил)-1H-индазол-3-ил]пиперидин-1-карбоновой кислоты
трет-Бутиловый эфир 4-[4,6-дибром-1-(2-триметилсиланилэтоксиметил)-1H-индазол-3-ил]пиперидин-1-карбоновой кислоты (130 мг), описанный в вышеупомянутом 4), метилбороновую кислоту (52,8 мг) и ацетат палладия(II) (5 мг) растворяли в сухом тетрагидрофуране (2,2 мл), добавляли фторид калия (102,5 мг) и 2-дициклогексилфосфино-2',6'-диметоксибифенил (18,1 мг) и смесь перемешивали в атмосфере азота при 70°C в течение 10 часов. Вновь, аналогичную реакцию проводили, с использованием трет-бутилового эфира 4-[4,6-дибром-1-(2-триметилсиланилэтоксиметил)-1H-индазол-3-ил]пиперидин-1-карбоновой кислоты (740 мг), описанного в вышеупомянутом 4), и метилбороновой кислоты (300,6 мг). Эти две реакционные смеси объединяли и полученный раствор фильтровали через NH-силикагель. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (гексан:этилацетат) с получением трет-бутилового эфира 4-[4,6-диметил-1-(2-триметилсиланилэтоксиметил)-1H-индазол-3-ил]пиперидин-1-карбоновой кислоты (617 мг).
[0425]
6) Получение 4,6-диметил-3-пиперидин-4-ил-1H-индазола
трет-Бутиловый эфир 4-[4,6-диметил-1-(2-триметилсиланилэтоксиметил)-1H-индазол-3-ил]пиперидин-1-карбоновой кислоты (320 мг), описанный в вышеупомянутом 5), растворяли в 1,4-диоксане (6,4 мл), добавляли 4 н раствор хлороводорода/1,4-диоксана (1,7 мл) и смесь перемешивали при 50°C в течение 5,5 часов. Добавляли 4 н раствор хлороводорода/1,4-диоксана (1,7 мл) и смесь перемешивали при 80°C в течение 26 часов. Кроме того, добавляли 4 н раствор хлороводорода/1,4-диоксана (1,7 мл), и смесь перемешивали при 80°C в течение 25 часов. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли этилацетат и осадок собирали фильтрованием. К полученному твердому веществу добавляли 1 н водный раствор гидроксида натрия (5 мл) и смесь экстрагировали хлороформом. Органический слой концентрировали при пониженном давлении, к полученному остатку добавляли диэтиловый эфир и осадок собирали фильтрованием с получением указанного в заголовке соединения (150 мг).
MS(ESI)m/z:230(M+H)+
[0426]
Пример получения 99: Получение 1,4,6-триметил-3-пиперидин-4-ил-1H-индазол•гидрохлорида
[0427]

[0428]
К раствору трет-бутилового эфира 4-(4,6-дибром-1H-индазол-3-ил)пиперидин-1-карбоновой кислоты (800 мг, см. пример получения 98) в N,N-диметилформамиде (16 мл) добавляли при охлаждении льдом гидрид натрия (60% в масле) (91 мг). При охлаждении льдом, смесь перемешивали в течение 3 мин, и добавляли метилиодид (0,152 мл). При охлаждении льдом, смесь перемешивали в течение 1,5 часов, К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-(4,6-дибром-1-метил-1H-индазол-3-ил)пиперидин-1-карбоновой кислоты (748 мг).
К полученному трет-бутиловому эфиру 4-(4,6-дибром-1-метил-1H-индазол-3-ил)пиперидин-1-карбоновой кислоты (748 мг) добавляли метилбороновую кислоту (377 мг), ацетат палладия(II) (35 мг), сухой тетрагидрофуран (16 мл), фторид калия (732 мг) и 2-дициклогексилфосфино-2',6'-диметоксибифенил (129 мг) и смесь перемешивали в атмосфере азота при 70°C в течение 19 часов. Реакционную смесь очищали при помощи колоночной хроматографии с NH (этилацетат) и колоночной хроматографией (гексан:этилацетат) с получением трет-бутилового эфира 4-(1,4,6-триметил-1H-индазол-3-ил)пиперидин-1-карбоновой кислоты (485,6 мг).
Полученный трет-бутиловый эфир 4-(1,4,6-триметил-1H-индазол-3-ил)пиперидин-1-карбоновой кислоты (481 мг) растворяли в 1,4-диоксане (4,8 мл), добавляли 4 н раствор хлороводорода/1,4-диоксана (3,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли диэтиловый эфир и осадок собирали фильтрованием с получением указанного в заголовке соединения (449 мг).
MS(ESI)m/z:244(M+H)+
[0429]
Пример получения 100: Получение 4-фтор-6-метил-3-пиперидин-4-ил-1H-индазола
[0430]

[0431]
К трет-бутиловому эфиру 4-(2,4-дибром-6-фторбензоил)пиперидин-1-карбоновой кислоты (3,74 г, см. пример получения 98) добавляли этанол (75 мл) и гидразин•1 гидрат (4,68 мл) и смесь перемешивали при кипячении с обратным холодильником в течение ночи. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли воду и осадок собирали фильтрованием. Полученный осадок перекристаллизовывали из этанола (35 мл) и осадок (трет-бутиловый эфир 4-(4,6-дибром-1H-индазол-3-ил)пиперидин-1-карбоновой кислоты) собирали путем фильтрования. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (гексан:этилацетат) с получением трет-бутилового эфира 4-(6-бром-4-фтор-1H-индазол-3-ил)пиперидин-1-карбоновой кислоты (121 мг).
К раствору трет-бутилового эфира 4-(6-бром-4-фтор-1H-индазол-3-ил)пиперидин-1-карбоновой кислоты (170 мг), полученного вышеуказанным способом, и способом, подобным вышеуказанному способу, в N,N-диметилформамиде (3 мл) добавляли при охлаждении льдом гидрид натрия (60% в масле) (20 мг). Смесь перемешивали при 0°C в течение 1 мин и добавляли 2-(хлорметокси)этилтриметилсилан (0,09 мл). Смесь перемешивали при 0°С в течение 20 мин, к реакционной смеси добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом/диэтиловым эфиром. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-[6-бром-4-фтор-1-(2-триметилсиланилэтоксиметил)-1H-индазол-3-ил]пиперидин-1-карбоновой кислоты (131 мг).
Полученный трет-бутиловый эфир 4-[6-бром-4-фтор-1-(2-триметилсиланилэтоксиметил)-1H-индазол-3-ил]пиперидин-1-карбоновой кислоты (130 мг), метилбороновую кислоту (37 мг) и ацетат палладия(II) (6 мг) растворяли в сухом тетрагидрофуране (2 мл), добавляли фторид калия (71 мг) и 2-дициклогексилфосфино-2',6'-диметоксибифенил (20 мг) и смесь перемешивали в атмосфере азота при 70°C в течение 20 часов. Реакционную смесь фильтровали через NH-силикагель. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (гексан:этилацетат) с получением трет-бутилового эфира 4-[4-фтор-6-метил-1-(2-триметилсиланилэтоксиметил)-1H-индазол-3-ил]пиперидин-1-карбоновой кислоты (52,6 мг).
К полученному трет-бутиловому эфиру 4-[4-фтор-6-метил-1-(2-триметилсиланилэтоксиметил)-1H-индазол-3-ил]пиперидин-1-карбоновой кислоты (52 мг) добавляли 4 н раствор хлороводорода/1,4-диоксана (5 мл) и смесь перемешивали при 70°C в течение 4,5 часов. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли 1,4-диоксан (3 мл) и 28% водный аммиак (1 мл) и смесь перемешивали при 90°C в течение 3 часов и при 70°C в течение ночи. К реакционной смеси добавляли 1 н водный раствор гидроксида натрия и смесь экстрагировали хлороформом. Органический слой концентрировали при пониженном давлении с получением указанного в заголовке соединения (32 мг).
MS(ESI)m/z:234(M+H)+
[0432]
Пример получения 101: Получение метилового эфира (2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-2-карбоновой кислоты •2 гидрохлорида
[0433]

[0434]
1-трет-Бутиловый эфир 2-метиловый эфир (2S,4S)-4-аминопирролидин-1,2-дикарбоновой кислоты (150 мг) растворяли в дихлорметане (2,5 мл), добавляли диизопропилэтиламин (0,32 мл), 3,5-диметилпиридин-N-оксид (60,5 мг) и бромтрис(пирролидино)фосфоний гексафторфосфат (298 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь очищали при помощи колоночной хроматографии с NH (гексан:этилацетат) с получением 1-трет-бутилового эфира 2-метилового эфира (2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-1,2-дикарбоновой кислоты (74 мг).
К полученному 1-трет-бутиловому эфиру 2-метиловому эфиру (2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-1,2-дикарбоновой кислоты (70 мг) добавляли 1,4-диоксан (0,7 мл) и 4 н раствор хлороводорода/1,4-диоксана (1,4 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (84 мг).
MS(ESI)m/z:250(M+H)+
[0435]
Пример получения 102: Получение [(2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-2-ил]метанол•2 гидрохлорида
[0436]

[0437]
1-трет-бутиловый эфир 2-метиловый эфир (2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-1,2-дикарбоновой кислоты (310 мг, см. пример получения 101) растворяли в тетрагидрофуране (6,2 мл) и метаноле (3,1 мл) и добавляли хлорид лития (113 мг) и боргидрид натрия (104 мг) при охлаждении льдом. Смесь перемешивали при комнатной температуре в течение ночи и к реакционной смеси добавляли 1н хлористоводородную кислоту (5 мл). Смесь концентрировали при пониженном давлении, к полученному остатку добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира (2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-гидроксиметилпирролидин-1-карбоновой кислоты (261 мг).
Полученный трет-бутиловый эфир (2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-гидроксиметилпирролидин-1-карбоновой кислоты (150 мг) растворяли в 1,4-диоксане (1,5 мл), добавляли 4 н раствор хлороводорода/1,4-диоксана (3 мл), и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (133 мг).
MS(ESI)m/z:222(M+H)+
[0438]
Пример получения 103: Получение (3,5-диметилпиридин-2-ил)((3S,5R)-5-метилпирролидин-3-ил)амин•2 гидрохлорида
[0439]
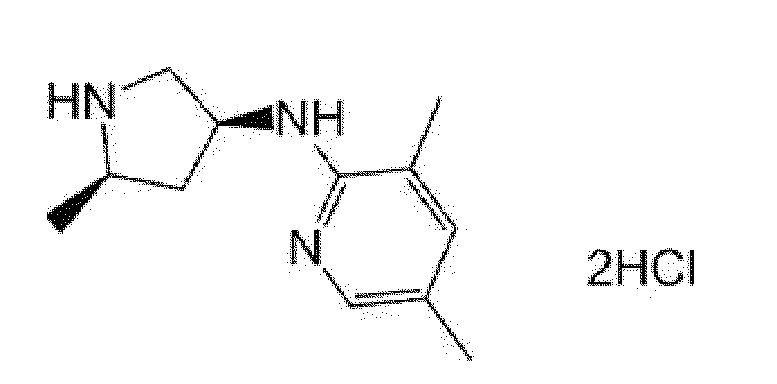
[0440]
К трет-бутиловому эфиру (2R,4S)-4-амино-2-метилпирролидин-1-карбоновой кислоты (368 мг) добавляли дихлорметан (7 мл), диизопропилэтиламин (1,2 мл), 3,5-диметилпиридин-N-оксид (226 мг), бромтрис(пирролидино)фосфоний гексафторфосфат (1114 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, Полученный остаток очищали при помощи колоночной хроматографии с NH (гексан:этилацетат) с получением трет-бутилового эфира (2R,4S)-4-(3,5-диметилпиридин-2-иламино)-2-метилпирролидин-1-карбоновой кислоты (298 мг).
Полученный трет-бутиловый эфир (2R,4S)-4-(3,5-диметилпиридин-2-иламино)-2-метилпирролидин-1-карбоновой кислоты (295 мг) растворяли в 1,4-диоксане (3 мл), добавляли 4 н раствор хлороводорода/1,4-диоксана (3 мл) и смесь перемешивали при комнатной температуре в течение 1,5 часов. Реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (264 мг).
[0441]
Пример получения 104: Получение (3,5-диметилпиридин-2-ил)((3S,5S)-5-метилпирролидин-3-ил)амин•2 гидрохлорида
[0442]
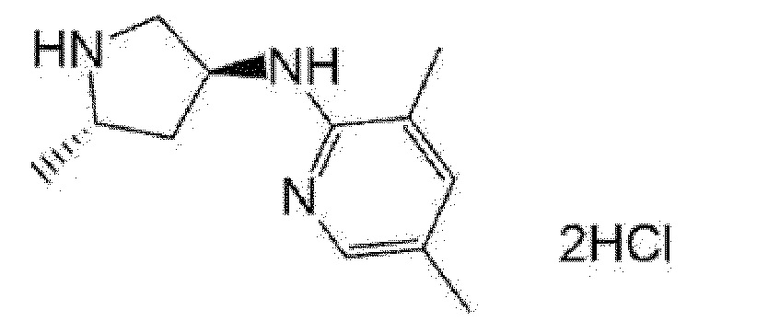
[0443]
трет-Бутиловый эфир (2S,4S)-4-амино-2-метилпирролидин-1-карбоновой кислоты (280 мг) растворяли в дихлорметане (6 мл), добавляли диизопропилэтиламин (0,913 мл), 3,5-диметилпиридин-N-оксид (172 мг) и бромтрис(пирролидино)фосфоний гексафторфосфат (847 мг) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли 3,5-диметилпиридин-N-оксид (86 мг) и бромтрис(пирролидино)фосфоний гексафторфосфат (325 мг) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток очищали при помощи колоночной хроматографии с NH (гексан:этилацетат) с получением трет-бутилового эфира (2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-метилпирролидин-1-карбоновой кислоты (192 мг).
К полученному трет-бутиловому эфиру (2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-метилпирролидин-1-карбоновой кислоты (190 мг) добавляли 1,4-диоксан (1,9 мл) и 4 н раствор хлороводорода/1,4-диоксана (1,9 мл) и смесь перемешивали при комнатной температуре в течение 3,5 часов. Реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (182 мг).
[0444]
Пример получения 105: Получение метилового эфира (2S,3S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-2-карбоновой кислоты•2 гидрохлорида
[0445]
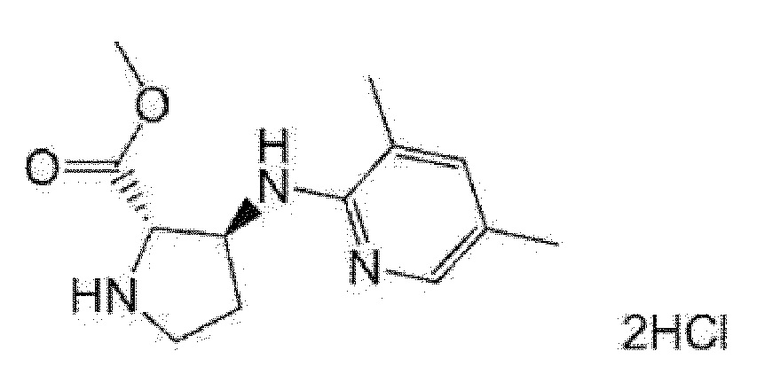
[0446]
К раствору 1-трет-бутилового эфира 2-метилового эфира (2S,3R)-3-гидроксипирролидин-1,2-дикарбоновой кислоты (3,31 г) и трифенилфосфина (5,31 г) в тетрагидрофуране (48 мл) добавляли при охлаждении льдом раствор диизопропил азодикарбоксилата (4,09 г) в тетрагидрофуране (10 мл). Затем, при охлаждении льдом, добавляли раствор дифенилфосфорилазида (4,35 мл) в тетрагидрофуране (10 мл) и смесь перемешивали при комнатной температуре в течение 6,5 часов. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением 1-трет-бутилового эфира 2-метилового эфира (2S,3S)-3-азидопирролидин-1,2-дикарбоновой кислоты (3,31 г).
К раствору полученного 1-трет-бутилового эфира 2-метилового эфира (2S,3S)-3-азидопирролидин-1,2-дикарбоновой кислоты (3,31 г) в метаноле (33 мл) добавляли 10% палладированный уголь (0,33 г) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 5,5 часов. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (гексан:этилацетат) с получением 1-трет-бутилового эфира 2-метилового эфира (2S,3S)-3-аминопирролидин-1,2-дикарбоновой кислоты (1,44 г).
К полученному 1-трет-бутиловому эфиру 2-метиловому эфиру (2S,3S)-3-аминопирролидин-1,2-дикарбоновой кислоты (450 мг) добавляли дихлорметан (7 мл), диизопропилэтиламин (1,2 мл), 3,5-диметилпиридин-N-оксид (250 мг) и бромтрис(пирролидино)фосфоний гексафторфосфат (1116 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии с NH (гексан:этилацетат) с получением 1-трет-бутилового эфира 2-метилового эфира (2S,3S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1,2-дикарбоновой кислоты (215 мг).
Полученный 1-трет-бутиловый эфир 2-метиловый эфир (2S,3S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1,2-дикарбоновой кислоты (215 мг) растворяли в 1,4-диоксане (2,15 мл), добавляли 4 н раствор хлороводорода/1,4-диоксана (2,15 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (213 мг).
MS(ESI)m/z:250(M+H)+
[0447]
Пример получения 106: Получение (2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-2-карбоновой кислоты амид•2 гидрохлорида
[0448]

[0449]
К 1-трет-бутиловому эфиру 2-метиловому эфиру (2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-1,2-дикарбоновой кислоты (480 мг, см. пример получения 101) добавляли этанол (4,8 мл) и 1 н водный раствор гидроксида натрия (2,75 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли 1 н хлористоводородную кислоту (2,75 мл) и смесь концентрировали при пониженном давлении с получением 1-трет-бутилового эфира (2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-1,2-дикарбоновой кислоты (640 мг).
К полученному 1-трет-бутиловому эфиру (2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-1,2-дикарбоновой кислоты (230 мг) добавляли хлорид аммония (183 мг), 1-гидроксибензотриазол (140 мг), 1―этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (200 мг), хлороформ (5 мл) и триэтиламин (0,67 мл) и смесь перемешивали при комнатной температуре в течение 6 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира (2S,4S)-2-карбамоил-4-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбоновой кислоты (172 мг).
К полученному трет-бутиловому эфиру (2S,4S)-2-карбамоил-4-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбоновой кислоты (70 мг) добавляли 1,4-диоксан (0,7 мл) и 4 н раствор хлороводорода/1,4-диоксана (0,7 мл) и смесь перемешивали при комнатной температуре в течение 6,5 часов. Реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (66 мг).
MS(ESI)m/z:235(M+H)+
[0450]
Пример получения 107: Получение (3,5-диметилпиридин-2-ил)((3S,5S)-5-метоксиметилпирролидин-3-ил)амин•2 гидрохлорида
[0451]

[0452]
К трет-бутиловому эфиру (2S,4S)-4-амино-2-метоксиметилпирролидин-1-карбоновой кислоты (300 мг) добавляли 2-бром-3,5-диметилпиридин (291 мг), трис(дибензилиденацетон)дипалладий(0) (30 мг), 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (41 мг), трет-бутоксид натрия (188 мг) и толуол (6 мл) и смесь перемешивали при 80°C в течение 6 часов. Реакционную смесь очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира (2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-метоксиметилпирролидин-1-карбоновой кислоты (489 мг).
Полученный трет-бутиловый эфир (2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-метоксиметилпирролидин-1-карбоновой кислоты (435 мг) растворяли в 1,4-диоксане (4,4 мл), добавляли 4 н раствор хлороводорода/1,4-диоксана (4,4 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (492 мг).
MS(ESI)m/z:236(M+H)+
[0453]
Пример получения 108: Получение 2-[(2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-2-ил]пропан-2-ол•2 гидрохлорида
[0454]

[0455]
К раствору 1-трет-бутилового эфира 2-метилового эфира (2S,4R)-4-гидроксипирролидин-1,2-дикарбоновой кислоты (3 г) в тетрагидрофуране (40 мл) добавляли при охлаждении льдом 3 M раствор метилмагнийбромид/диэтиловый эфир (14,3 мл). Смесь перемешивали при охлаждении льдом в течение 15 минут и при комнатной температуре в течение 3 часов. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. К полученному остатку добавляли гексан/диизопропиловый эфир и осадок собирали фильтрованием с получением трет-бутилового эфира (2S,4R)-4-гидрокси-2-(1-гидрокси-1-метилэтил)пирролидин-1-карбоновой кислоты (2,68 г).
К раствору полученного трет-бутилового эфира (2S,4R)-4-гидрокси-2-(1-гидрокси-1-метилэтил)пирролидин-1-карбоновой кислоты (2,68 г), 4-(диметиламино)пиридина (0,13 г) и триэтиламина (3,05 мл) в дихлорметане (45 мл) добавляли при охлаждении льдом раствор метансульфонилхлорида (1,01 мл) в дихлорметане (10 мл). При охлаждении льдом, смесь перемешивали в течение 1,5 часов, и реакционную смесь концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира (2S,4R)-2-(1-гидрокси-1-метилэтил)-4-метансульфонилоксипирролидин-1-карбоновой кислоты (3,31 г).
Полученный трет-бутиловый эфир (2S,4R)-2-(1-гидрокси-1-метилэтил)-4-метансульфонилоксипирролидин-1-карбоновой кислоты (3,31 г) растворяли в ацетонитриле (37 мл), добавляли тетрабутиламмоний азид (4,7 г) и смесь перемешивали при 80°C в течение 8,5 часов. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира (2S,4S)-4-азидо-2-(1-гидрокси-1-метилэтил)пирролидин-1-карбоновой кислоты (1,73 г).
К раствору полученного трет-бутилового эфира (2S,4S)-4-азидо-2-(1-гидрокси-1-метилэтил)пирролидин-1-карбоновой кислоты (1,73 г) в этаноле (32 мл) добавляли 10% палладированный уголь (0,17 г) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 3,5 часов. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира (2S,4S)-4-амино-2-(1-гидрокси-1-метилэтил)пирролидин-1-карбоновой кислоты (1,324 г).
Полученный трет-бутиловый эфир (2S,4S)-4-амино-2-(1-гидрокси-1-метилэтил)пирролидин-1-карбоновой кислоты (250 мг) растворяли в дихлорметане (4 мл), добавляли диизопропилэтиламин (0,67 мл), 3,5-диметилпиридин-N-оксид (139 мг) и бромтрис(пирролидино)фосфоний гексафторфосфат (620 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира (2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-(1-гидрокси-1-метилэтил)пирролидин-1-карбоновой кислоты (265 мг).
Полученный трет-бутиловый эфир (2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-(1-гидрокси-1-метилэтил)пирролидин-1-карбоновой кислоты (260 мг) растворяли в 1,4-диоксане (3 мл) и добавляли 4 н раствор хлороводорода/1,4-диоксана (3 мл) при охлаждении льдом. При охлаждении льдом, смесь перемешивали в течение 1 часа и при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения (265 мг).
MS(ESI)m/z:250(M+H)+
[0456]
Пример получения 109: Получение 4-(4-п-толилпиразол-1-ил)пиперидин•гидрохлорида
[0457]
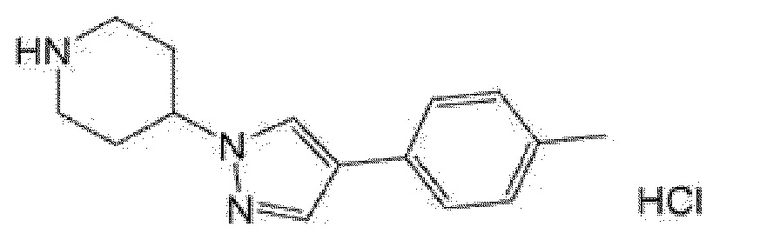
[0458]
К трет-бутиловому эфиру 4-(4-бромпиразол-1-ил)пиперидин-1-карбоновой кислоты (208 мг) добавляли 4-метилфенилбороновую кислоту (95 мг), N,N-диметилформамид (3,2 мл), 2 M водный раствор карбоната натрия (946 мкл) и комплекс [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид λ дихлорметан (26 мг) и смесь перемешивали при 80°C. После завершения реакции, добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-[4-(п-толил)пиразол-1-ил]пиперидин-1-карбоновой кислоты (139 мг).
Полученный трет-бутиловый эфир 4-[4-(п-толил)пиразол-1-ил]пиперидин-1-карбоновой кислоты (138 мг) растворяли в 1,4-диоксане (2 мл), добавляли 4 н раствор хлороводорода/1,4-диоксана (1,01 мл) и смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали и к полученному остатку добавляли этилацетат, и осадок собирали фильтрованием с получением указанного в заголовке соединения (112,6 мг).
MS(ESI)m/z:242(M+H)+
[0459]
Пример получения 110: Получение 1-(3,5-диметилпиридин-2-ил)-3-метилпиперазина
[0460]
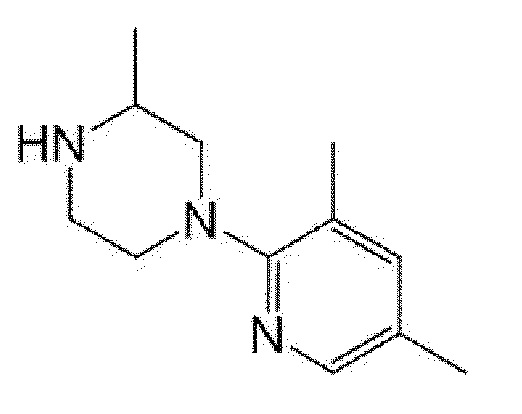
[0461]
К смеси трет-бутилового эфира 2-метилпиперазин-1-карбоновой кислоты (2 г), 2-бром-3,5-диметилпиридина (1,95 г), трис(дибензилиденацетон)дипалладий(0) (183 мг), rac-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (250 мг) и трет-бутокси-натрия (1,3 г) добавляли толуол (33 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 8 часов. Реакционную смесь охлаждали и фильтровали через целит. Фильтрат выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-(3,5-диметилпиридин-2-ил)-2-метилпиперазин-1-карбоновой кислоты (1,61 г). Полученный трет-бутиловый эфир 4-(3,5-диметилпиридин-2-ил)-2-метилпиперазин-1-карбоновой кислоты (1,61 г) растворяли в этилацетате (10 мл), добавляли 4 н раствор хлороводорода/этилацетата (10 мл) и метанол (2 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, растворитель выпаривали, к полученному остатку добавляли 1 н водный раствор гидроксида натрия и смесь экстрагировали этилацетатом. Растворитель выпаривали с получением указанного в заголовке соединения (1,17 г).
MS(ESI)m/z:206(M+H)+
[0462]
Пример получения 111: Получение (R)-1-(3,5-диметилпиридин-2-ил)-2-метилпиперазин•2 гидрохлорида
[0463]

[0464]
1) Получение трет-бутилового эфира (R)-4-(3,5-диметилпиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты
К раствору трет-бутилового эфира (R)-3-метилпиперазин-1-карбоновой кислоты (500 мг), 3,5-диметилпиридин-N-оксида (246 мг) и N,N-диизопропилэтиламина (1,3 мл) в тетрагидрофуране (8 мл) добавляли бромтрис(пирролидино)фосфоний гексафторфосфат (1,21 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением трет-бутилового эфира (R)-4-(3,5-диметилпиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты (387 мг).
MS(ESI)m/z:306(M+H)+
[0465]
2) Получение (R)-1-(3,5-диметилпиридин-2-ил)-2-метилпиперазин•2 гидрохлорида
трет-Бутиловый эфир (R)-4-(3,5-диметилпиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты (197 мг, см. вышеупомянутый 1)) растворяли в этилацетате (1,3 мл), добавляли 4 н раствор хлороводорода/этилацетата (1,3 мл) и метанол (1,3 мл), и смесь перемешивали при комнатной температуре. После завершения реакции, растворитель выпаривали с получением указанного в заголовке соединения (199 мг).
MS(ESI)m/z:206(M+H)+
[0466]
Пример получения 112: Получение трет-бутилового эфира (R)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбоновой кислоты
[0467]
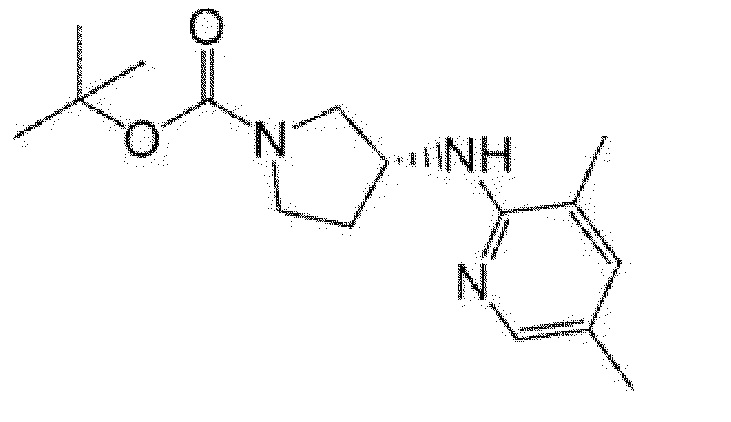
[0468]
К 2-бром-3,5-диметилпиридину (204 мкл) добавляли трет-бутиловый эфир (R)-3-аминопирролидин-1-карбоновой кислоты (350 мкл), трис(дибензилиденацетон)дипалладий(0) (73,8 мг), rac-2,2'-бис(дифенилфосфино)-1,1'-бинафтил (100,4 мг), трет-бутокси-натрий (232,4 мг) и толуол (4 мл) и смесь перемешивали при 120°C в течение 7 часов. Реакционную смесь охлаждали и фильтровали через целит. Фильтрат концентрировали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (459 мг).
MS(APCI)m/z:292(M+H)+
[0469]
Пример получения 113: Получение (3,5-диметилпиридин-2-ил)-(R)-пирролидин-3-иламина
[0470]
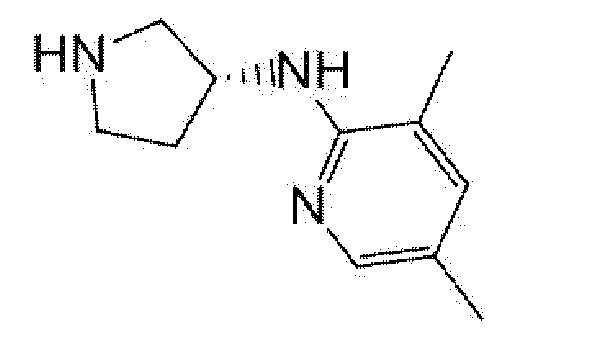
[0471]
К раствору трет-бутилового эфира (R)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбоновой кислоты (454 мг), описанному в примере получения 112, в хлороформе (3 мл) добавляли трифторуксусную кислоту (2,09 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, реакционную смесь разбавляли метанолом, загружали для ионообменной хроматографии, промывали метанолом и элюировали 1 н раствором аммиака/метанола с получением указанного в заголовке соединения (280 мг).
MS(APCI)m/z:192(M+H)+
[0472]
Пример получения 114: Получение 4-((S)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0473]
[0474]
Используя 4-(4-изопропил-2,5-диоксо-имидазолидин-4-ил)бензойную кислоту (10,45 г), описанную в примере получения 5, и (S)-1-фенилэтиламин (2,89 г), способ, аналогичный способу получения 45, осуществляли с получением 4-((S)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты•(S)-1-фенилэтиламиновой соли (2,15 г).
К полученной 4-((S)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте•(S)-1-фенилэтиламиновой соли (1 г) добавляли воду (10 мл) и 1 н хлористоводородную кислоту (10 мл). Осадок собирали фильтрованием с получением указанного в заголовке соединения (635 мг).
MS(ESI)m/z:263(M+H)+
[0475]
Пример получения 115: Получение трет-бутилового эфира (S)-4-(3,5-диметилпиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты
[0476]

[0477]
К раствору трет-бутилового эфира (S)-3-метилпиперазин-1-карбоновой кислоты (2,5 г), 3,5-диметилпиридин-N-оксида (1,23 г) в тетрагидрофуране (40 мл) добавляли N,N-диизопропилэтиламин (6,4 мл), бромтрис(пирролидино)фосфоний гексафторфосфат (6 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением трет-бутилового эфира (S)-4-(3,5-диметилпиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты (1,27 г).
MS(ESI)m/z:306(M+H)+
[0478]
Пример получения 116: Получение 1-(3,5-диметилпиридин-2-ил)-3,3-диметилпиперазин•2 гидрохлорида
[0479]
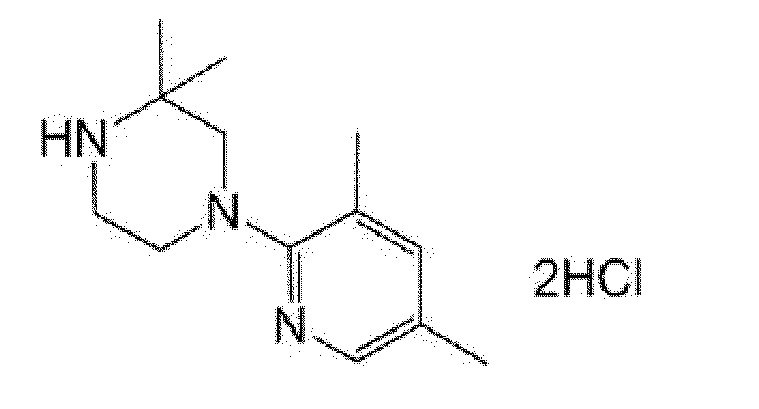
[0480]
Используя 3,5-диметилпиридин-N-оксид (574 мг) и трет-бутиловый эфир 2,2-диметилпиперазин-1-карбоновой кислоты (1 г), реакции и обработки, аналогичные тем, которые описаны в примере получения 115, осуществляли с получением трет-бутилового эфира 4-(3,5-диметилпиридин-2-ил)-2,2-диметилпиперазин-1-карбоновой кислоты (1,11 г).
Полученный трет-бутиловый эфир 4-(3,5-диметилпиридин-2-ил)-2,2-диметилпиперазин-1-карбоновой кислоты (1,1 г) растворяли в этилацетате (7 мл), добавляли 4 н раствор хлороводорода/этилацетата (7 мл) и метанол (7 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, растворитель выпаривали с получением указанного в заголовке соединения (1,03 г).
MS(ESI)m/z:220(M+H)+
[0481]
Пример получения 117: Получение трет-бутилового эфира (R)-4-(3,5-диметилпиридин-2-ил)-2-метилпиперазин-1-карбоновой кислоты
[0482]
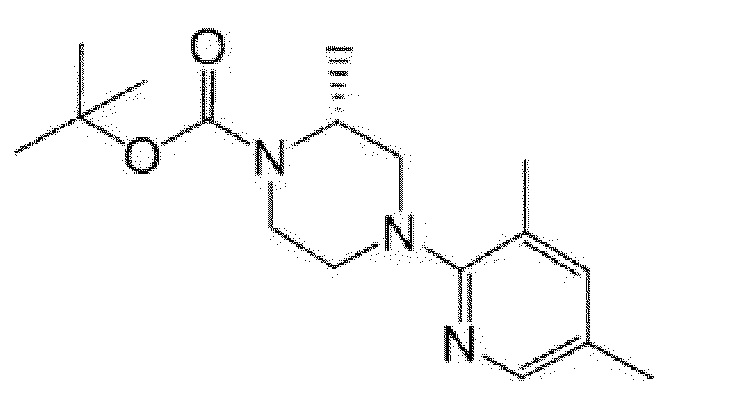
[0483]
К смеси трет-бутилового эфира (R)-2-метилпиперазин-1-карбоновой кислоты (1 г), 2-бром-3,5-диметилпиридина (975 мг), трис(дибензилиденацетон)дипалладий(0) (92 мг), rac-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (125 мг) и трет-бутокси-натрия (650 мг) добавляли толуол (17 мл) и смесь перемешивали при микроволновом излучении при 130°C в течение 2 часов. Реакционную смесь очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (220 мг).
MS(ESI)m/z:306(M+H)+
[0484]
Пример получения 118: Получение (R)-1-(3,5-диметилпиридин-2-ил)-3-метилпиперазин•2 гидрохлорида
[0485]
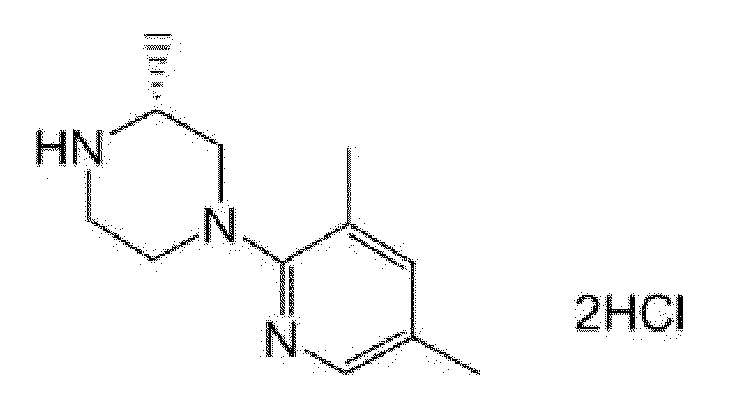
[0486]
трет-Бутиловый эфир (R)-4-(3,5-диметилпиридин-2-ил)-2-метилпиперазин-1-карбоновой кислоты (220 мг), описанный в примере получения 117, растворяли в этилацетате (1,5 мл), добавляли 4 н раствор хлороводорода/этилацетата (1,5 мл) и метанол (1,5 мл), и смесь перемешивали при комнатной температуре. После завершения реакции, растворитель выпаривали с получением указанного в заголовке соединения (198 мг).
MS(ESI)m/z:206(M+H)+
[0487]
Пример получения 119: Получение (R)-1-(3,5-диметилпиридин-2-ил)-3-метилпиперазина
[0488]

[0489]
К трет-бутиловому эфиру (R)-4-(3,5-диметилпиридин-2-ил)-2-метилпиперазин-1-карбоновой кислоты (2,4 г), описанному в примере получения 117, добавляли дихлорметан (50 мл) и трифторуксусную кислоту (10 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, растворитель выпаривали, к полученному остатку добавляли водный раствор гидроксида натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и осажденное твердое вещество отфильтровывали. Фильтрат концентрировали и полученный остаток очищали при помощи колоночной хроматографии на силикагеле с NH-покрытием (этилацетат:гексан) с получением указанного в заголовке соединения (1,08 г).
MS(ESI)m/z:206(M+H)+
[0490]
Пример получения 120: Получение трет-бутилового эфира 4-(3,5-диметилпиридин-2-ил)-3-гидроксиметилпиперазин-1-карбоновой кислоты
[0491]

[0492]
К трет-бутиловому эфиру 3-гидроксиметилпиперазин-1-карбоновой кислоты (1,5 г) добавляли тетрагидрофуран (28 мл), бромтрис(пирролидино)фосфоний гексафторфосфат (3,4 г), 3,5-диметилпиридин-N-оксид (690 мг) и N,N-диизопропилэтиламин (3,58 мл) и смесь перемешивали при комнатной температуре в течение 4,5 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (773 мг).
MS(ESI)m/z:322(M+H)+
[0493]
Пример получения 121: Получение 1-(3,5-диметилпиридин-2-ил)-2-метоксиметилпиперазин•2 гидрохлорида
[0494]

[0495]
К раствору трет-бутилового эфира 4-(3,5-диметилпиридин-2-ил)-3-гидроксиметилпиперазин-1-карбоновой кислоты (440 мг), описанному в примере получения 120, и метилиодиду (96 мкл) в N,N-диметилформамиде (7 мл) добавляли при 0°C гидрид натрия (60% в жидкой дисперсии парафинов) (62 мг) и смесь перемешивали при комнатной температуре. После завершения реакции, к реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением трет-бутилового эфира 4-(3,5-диметилпиридин-2-ил)-3-метоксиметилпиперазин-1-карбоновой кислоты (245 мг).
Это соединение (245 мг) растворяли в метилацетате (2 мл) и метаноле (2 мл), добавляли 4 н раствор хлороводорода/этилацетата (2 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, растворитель выпаривали с получением указанного в заголовке соединения (230 мг).
MS(ESI)m/z:236(M+H)+
[0496]
Пример получения 122: Получение (R)-1-(3,5-диметилпиридин-2-ил)-3-этилпиперазин
[0497]

[0498]
К раствору трет-бутилового эфира (R)-2-этилпиперазин-1-карбоновой кислоты (1 г) и 3,5-диметилпиридин-N-оксида (546 мг) в тетрагидрофуране (18 мл) добавляли N,N-диизопропилэтиламин (3 мл) и бромтрис(пирролидино)фосфоний гексафторфосфат (2,8 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением трет-бутилового эфира (R)-4-(3,5-диметилпиридин-2-ил)-2-этилпиперазин-1-карбоновой кислоты (1,11 г).
Полученный трет-бутиловый эфир (R)-4-(3,5-диметилпиридин-2-ил)-2-этилпиперазин-1-карбоновой кислоты (1,11 г) растворяли в этилацетате (5 мл), добавляли 4 н раствор хлороводорода/этилацетата (5 мл) и метанол (5 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, добавляли водный раствор гидроксида натрия и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали с получением указанного в заголовке соединения (735 мг).
MS(ESI)m/z:220(M+H)+
[0499]
Пример получения 123: Получение трет-бутилового эфира (S)-4-(3,5-диметилпиридин-2-ил)-2-гидроксиметилпиперазин-1-карбоновой кислоты
[0500]

[0501]
К трет-бутиловому эфиру (S)-2-гидроксиметилпиперазин-1-карбоновой кислоты (950 мг) добавляли тетрагидрофуран (17 мл), 3,5-диметилпиридин-N-оксид (515 мг), N,N-диизопропилэтиламин (2,8 мл) и бромтрис(пирролидино)фосфоний гексафторфосфат (2,67 г) и смесь перемешивали при комнатной температуре в течение 5,5 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (640 мг).
MS(ESI)m/z:322(M+H)+
[0502]
Пример получения 124: Получение трет-бутилового эфира (S)-4-(3,5-диметилпиридин-2-ил)-2-метоксиметилпиперазин-1-карбоновой кислоты
[0503]
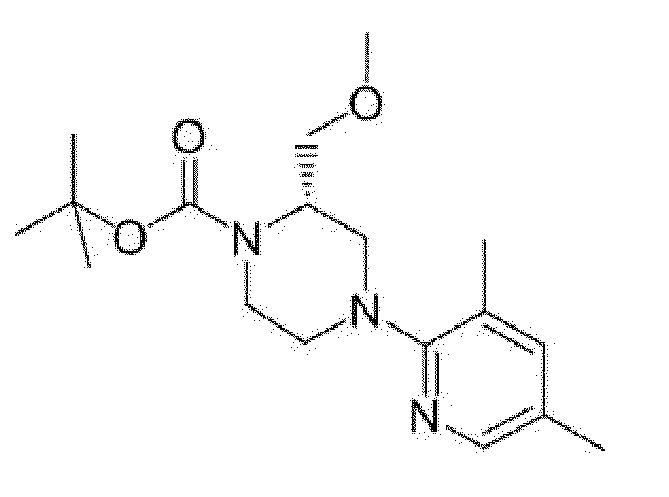
[0504]
1) К раствору трет-бутилового эфира (S)-4-(3,5-диметилпиридин-2-ил)-2-гидроксиметилпиперазин-1-карбоновой кислоты (83 мг), описанному в примере получения 123, и метилиодида (20 мкл) в N,N-диметилформамиде (1,3 мл) добавляли при 0°C гидрид натрия (60% в масле) (11,3 мг) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали с получением неочищенного продукта.
[0505]
2) Используя трет-бутиловый эфир (S)-4-(3,5-диметилпиридин-2-ил)-2-гидроксиметилпиперазин-1-карбоновой кислоты (90 мг), описанный в примере получения 123, метилиодид (18 мкл), реакции и обработки, аналогичные тем, которые описаны в вышеупомянутом 1), осуществляли с получением неочищенного продукта.
Полученные неочищенные продукты 1) и 2) объединяли и очищали с помощью колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (97 мг).
MS(ESI)m/z:336(M+H)+
[0506]
Пример получения 125: Получение 8-(3,5-диметилпиридин-2-ил)-5,8-диазаспиро[3.5]нонана
[0507]

[0508]
К раствору 5,8-диазаспиро[3.5]нонан•2 гидрохлорида (350 мг) и 3,5-диметилпиридин-N-оксида (205 мг) в тетрагидрофуране (7 мл) добавляли N,N-диизопропилэтиламин (1,73 мл) и бромтрис(пирролидино)фосфоний гексафторфосфат (1,07 г) и смесь перемешивали при комнатной температуре в течение 5 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (176 мг).
MS(ESI)m/z:232(M+H)+
[0509]
Пример получения 126: Получение (S)-1-(3,5-диметилпиридин-2-ил)-3-метилпиперазина
[0510]
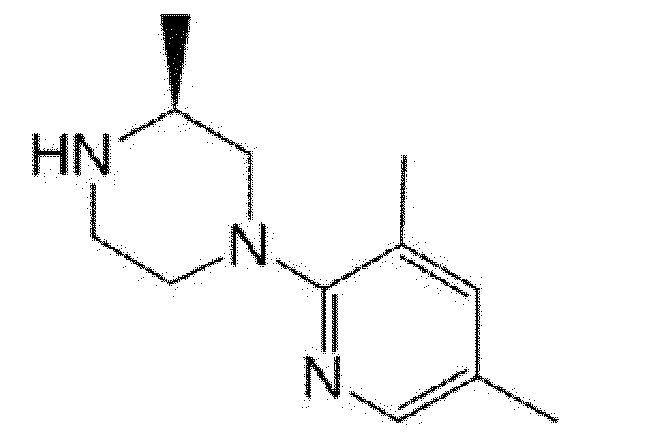
[0511]
К раствору трет-бутилового эфира (S)-2-метилпиперазин-1-карбоновой кислоты (2,0 г), 3,5-диметилпиридин-N-оксида (1,2 г) в тетрагидрофуране (40 мл) добавляли N,N-диизопропилэтиламин (6,4 мл) и бромтрис(пирролидино)фосфоний гексафторфосфат (6,06 г) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением трет-бутилового эфира (S)-4-(3,5-диметилпиридин-2-ил)-2-метилпиперазин-1-карбоновой кислоты (2,49 г).
К полученному трет-бутиловому эфиру (S)-4-(3,5-диметилпиридин-2-ил)-2-метилпиперазин-1-карбоновой кислоты (2,49 г) добавляли этилацетат (15 мл), метанол (15 мл) и 4 н раствор хлороводорода/этилацетата (13 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, добавляли 1 н водный раствор гидроксида натрия и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (1,31 г).
MS(ESI)m/z:206(M+H)+
[0512]
Пример получения 127: Получение [(R)-1-(3,5-диметилпиридин-2-ил)пиперазин-2-ил]метанола
[0513]

[0514]
Используя трет-бутиловый эфир (R)-3-гидроксиметилпиперазин-1-карбоновой кислоты (5 г) и 3,5-диметилпиридин-N-оксид (2,7 г), реакции и обработки, аналогичные тем, которые описаны в примере получения 126, осуществляли с получением указанного в заголовке соединения (1,16 г).
MS(ESI)m/z:222(M+H)+
[0515]
Пример получения 128: Получение [(S)-1-(3,5-диметилпиридин-2-ил)пиперазин-2-ил]метанол•2 гидрохлорида
[0516]
[0517]
Используя трет-бутиловый эфир (S)-3-гидроксиметилпиперазин-1-карбоновой кислоты (730 мг) и 3,5-диметилпиридин-N-оксид (395 мг), реакции и обработки, аналогичные тем, которые описаны в примере получения 115, осуществляли с получением указанного в заголовке соединения (230 мг).
MS(ESI)m/z:220(M+H)+
[0518]
Пример получения 129: Получение 1-трет-бутилового эфира 2-метилового эфира (S)-4-(3,5-диметилпиридин-2-ил)пиперазин-1,2-дикарбоновой кислоты
[0519]

[0520]
К 1-трет-бутиловому эфиру 2-метиловому эфиру (S)-пиперазин-1,2-дикарбоновой кислоты (2,6 г) добавляли метиленхлорид (42 мл), N,N-диизопропилэтиламин (6,8 мл), 3,5-диметилпиридин-N-оксид (1,24 г) и бромтрис(пирролидино)фосфоний гексафторфосфат (6,42 г) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли бромтрис(пирролидино)фосфоний гексафторфосфат (676 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (1,52 г).
MS(ESI)m/z:350(M+H)+
[0521]
Пример получения 130: Получение метилового эфира (S)-4-(3,5-диметилпиридин-2-ил)пиперазин-2-карбоновой кислоты
[0522]
[0523]
Используя 1-трет-бутиловый эфир 2-метиловый эфир (S)-пиперазин-1,2-дикарбоновой кислоты (2,4 г) и 3,5-диметилпиридин-N-оксид (1,07 г), реакции и обработки, аналогичные тем, которые описаны в примере получения 126, осуществляли с получением указанного в заголовке соединения (620 мг).
MS(ESI)m/z:250(M+H)+
[0524]
Пример получения 131: Получение (S)-1-(3,5-диметилпиридин-2-ил)-2-метилпиперазин•2 гидрохлорида
[0525]

[0526]
Трет-бутиловый эфир (S)-4-(3,5-диметилпиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты (1,27 г), описанный в примере получения 115, растворяли в этилацетате (8 мл), добавляли 4 н раствор хлороводорода/этилацетата (8 мл) и метанол (8 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, растворитель выпаривали с получением указанного в заголовке соединения (1,39 г).
MS(ESI)m/z:206(M+H)+
[0527]
Пример получения 132: Получение 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензоил хлорида
[0528]
[0529]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (1,44 г), описанной в примере получения 45, добавляли 1,4-диоксан (11 мл) и тионилхлорид (1,16 мл) и смесь перемешивали при 80°C в течение 3 часов. Растворитель выпаривали с получением указанного в заголовке соединения (1,48 г).
[0530]
Пример получения 133: Получение трет-бутилового эфира (S)-2-карбамоил-4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбоновой кислоты
[0531]

[0532]
К метиловому эфиру (S)-4-(3,5-диметилпиридин-2-ил)пиперазин-2-карбоновой кислоты (700 мг), описанному в примере получения 130, добавляли этанол (4 мл) и 1 н водный раствор гидроксида натрия (4 мл). Смесь перемешивали при комнатной температуре в течение 4 часов и добавляли 1н хлористоводородную кислоту (4 мл) при 0°C. Растворитель выпаривали, к полученному остатку добавляли хлорид аммония (5 эквивалентов), хлороформ (10 мл), 1―этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (1,5 эквивалента), 1-гидроксибензотриазол (1,5 эквивалента) и триэтиламин (7 эквивалентов) и смесь перемешивали при комнатной температуре. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (420 мг).
MS(ESI)m/z:335(M+H)+
[0533]
Пример получения 134: Получение 4-[1-(п-толил)-1H-пиразол-4-ил]пиперидина
[0534]
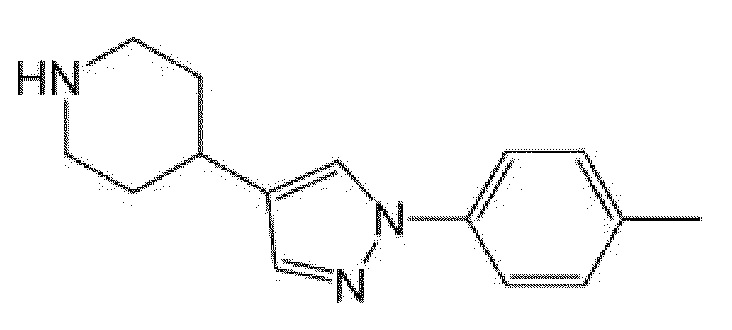
[0535]
К пинаколовому эфиру N-Boc-1,2,5,6-тетрагидропиридин-4-бороновой кислоты (927,6 мг) добавляли 1,2-диметоксиэтан (10 мл), воду (5 мл), карбонат натрия (953,9 мг), 4-бром-1-(п-толил)пиразол (711,3 мг) и комплекс [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) дихлорид•дихлорметан (122,5 мг) и смесь перемешивали при 90°C в течение 6 часов. К реакционной смеси добавляли воду и этилацетат, и смесь фильтровали через целит и экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением трет-бутилового эфира 4-[1-(п-толил)-1H-пиразол-4-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (651,6 мг).
Полученный трет-бутиловый эфир 4-[1-(п-толил)-1H-пиразол-4-ил]-3,6-дигидро-2H-пиридин-1-карбоновой кислоты (300 мг) растворяли в этаноле, и смесь преобразовывали в H-cube (производства ThalesNano) (катализатор: Pd-C, температура: 60°C, скорость потока: 1 мл/мин). Растворитель выпаривали с получением трет-бутилового эфира 4-[1-(п-толил)-1H-пиразол-4-ил]пиперидин-1-карбоновой кислоты (297,8 мг).
К полученному трет-бутиловому эфиру 4-[1-(п-толил)-1H-пиразол-4-ил]пиперидин-1-карбоновой кислоты (297,8 мг) добавляли метанол (2 мл) и 4 н раствор хлороводорода/1,4-диоксана (1,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. После завершения реакции, добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Растворитель выпаривали с получением указанного в заголовке соединения (193,1 мг).
MS(ESI)m/z:242(M+H)+
[0536]
Пример получения 135: Получение (1-бензоилпиперидин-4-ил)(2-гидрокси-4-метилфенил)метанона
[0537]
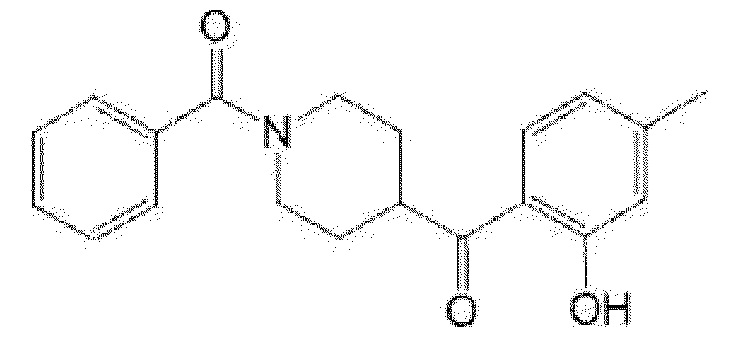
[0538]
К раствору 3-метилфенола (13 г), 1-бензоилпиперидин-4-карбонил хлорида (31 г) в 1,2-дихлорэтане (250 мл) добавляли хлорид алюминия (50 г) с перемешиванием и смесь нагревали с обратным холодильником в течение 1,5 часов. Реакционную смесь выливали в воду со льдом и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии с получением указанного в заголовке соединения (18 г).
[0539]
Пример получения 136: Получение 4-(6-метилбензофуран-3-ил)пиперидин•гидрохлорида
[0540]
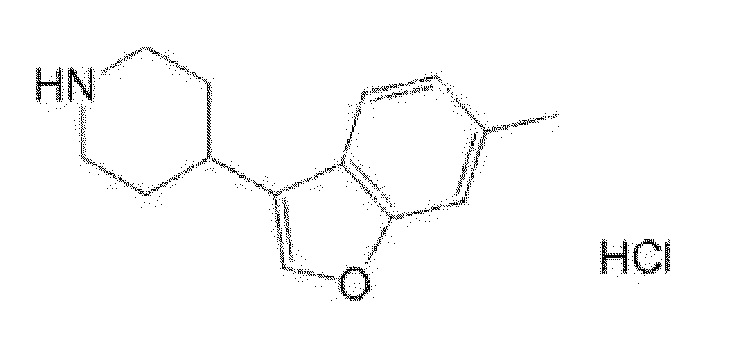
[0541]
К (1-бензоилпиперидин-4-ил)(2-гидрокси-4-метилфенил)метанону (18 г), описанному в примере получения 135, добавляли N,N-диметилформамид (100 мл), гидрид натрия (60% в жидкой дисперсии парафинов) (4,5 г) и этилбромацетат (13 мл) и смесь перемешивали при 100°C в течение 30 минут и экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии с получением этилового эфира 3-(1-бензоилпиперидин-4-ил)-6-метилбензофуран-2-карбоновой кислоты (5 г).
К полученному этиловому эфиру 3-(1-бензоилпиперидин-4-ил)-6-метилбензофуран-2-карбоновой кислоты (5 г) добавляли этанол (20 мл), гидроксид натрия (5 г) и воду (30 мл) и смесь перемешивали при нагревании. Смесь нейтрализовали хлористоводородной кислотой и экстрагировали этилацетатом. Растворитель выпаривали, к полученному остатку (30 г) добавляли хинолин (50 мл) и медь (0,5 г) и смесь перемешивали при 180°C в течение 3 часов. Добавляли хлористоводородную кислоту и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии с получением [4-(6-метилбензофуран-3-ил)пиперидин-1-ил)фенилметанона (2 г).
К полученному [4-(6-метилбензофуран-3-ил)пиперидин-1-ил)фенилметанону (2 г) добавляли концентрированную хлористоводородную кислоту (25 мл) и уксусную кислоту (25 мл) и смесь перемешивали при нагревании с обратным холодильником в течение 12 часов. Растворитель выпаривали с получением указанного в заголовке соединения (1,1 г).
[0542]
Пример получения 137: Получение (1-бензоилпиперидин-4-ил)(2-гидрокси-3,5-диметилфенил)метанона
[0543]

[0544]
2,4-Диметилфенол (14 г) растворяли в тетрагидрофуране (100 мл), добавляли триэтиламин (30 мл) и 1-бензоилпиперидин-4-карбонил хлорид (30 г), и смесь перемешивали при комнатной температуре. После завершения реакции, смесь экстрагировали этилацетатом. Растворитель выпаривали, к полученному остатку добавляли (24 г) хлорид алюминия (40 г) и смесь перемешивали при 120°C в течение 15 мин. При охлаждении к реакционной смеси добавляли лед и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии с получением указанного в заголовке соединения (18 г).
[0545]
Пример получения 138: Получение 4-(5,7-диметилбензофуран-3-ил)пиперидин•гидрохлорида
[0546]
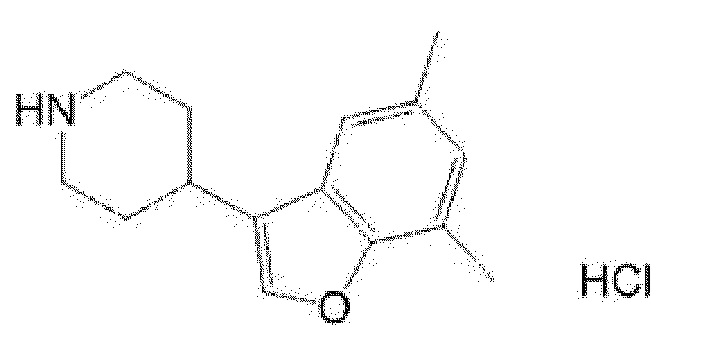
[0547]
Используя (1-бензоилпиперидин-4-ил)(2-гидрокси-3,5-диметилфенил)метанон (18 г), описанный в примере получения 137, и этилбромацетат (6 мл), реакции и обработки, аналогичные тем, которые описаны в примере получения 136, осуществляли с получением указанного в заголовке соединения (4,5 г).
[0548]
Пример получения 139: Получение (1-бензоилпиперидин-4-ил)(2-гидрокси-4,5-диметилфенил)метанона
[0549]
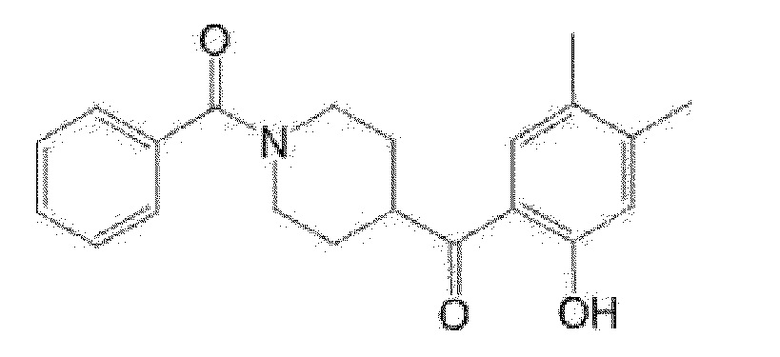
[0550]
Используя 3,4-диметиланизол (24 г) и 1-бензоилпиперидин-4-карбонил хлорид (46 г), реакции и обработки, аналогичные тем, которые описаны в примере получения 135, осуществляли с получением указанного в заголовке соединения (40 г).
[0551]
Пример получения 140: Получение 4-(5,6-диметилбензофуран-3-ил)пиперидин•гидрохлорида
[0552]
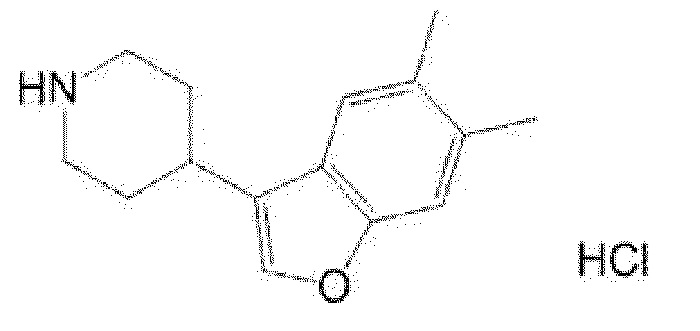
[0553]
Используя (1-бензоилпиперидин-4-ил)(2-гидрокси-4,5-диметилфенил)метанон (15 г), описанный в примере получения 139, и этилбромацетат (5 мл), реакции и обработки, аналогичные тем, которые описаны в примере получения 136, осуществляли с получением указанного в заголовке соединения (2,7 г).
[0554]
Пример получения 141: Получение (1-бензоилпиперидин-4-ил)(2-гидрокси-4,6-диметилфенил)метанона
[0555]

[0556]
Используя 1-бензоилпиперидин-4-карбонил хлорид (50 г) и 3,5-диметилфенол (25 г), реакции и обработки, аналогичные тем, которые описаны в примере получения 137, осуществляли с получением указанного в заголовке соединения (35 г).
[0557]
Пример получения 142: Получение 4-(4,6-диметилбензофуран-3-ил)пиперидин•гидрохлорида
[0558]

[0559]
Используя (1-бензоилпиперидин-4-ил)(2-гидрокси-4,6-диметилфенил)метанон (35 г), описанный в примере получения 141, и этилбромацетат (13 мл), реакции и обработки, аналогичные тем, которые описаны в примере получения 136, осуществляли с получением указанного в заголовке соединения (8 г).
[0560]
Пример получения 143: Получение 1-метил-4-пиперазин-1-ил-1H-индазол•2 гидрохлорида
[0561]

[0562]
К смеси трет-бутилового эфира пиперазин-1-карбоновой кислоты (2,65 г), 4-((E)-1-бромпропенил)-1-метил-5-винил-1H-пиразола (2 г), трис(дибензилиденацетон)дипалладия(0) (86,8 мг), rac-2,2'-бис(дифенилфосфино)-1,1'-бинафтила (88,5 мг) и трет-бутокси-натрия (1,3 г) добавляли толуол (35 мл) и смесь перемешивали при нагревании с обратным холодильником. После завершения реакции, добавляли насыщенный водный раствор гидрокарбоната натрия и этилацетат. После фильтрации через целит, фильтрат экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-(1-метил-1H-индазол-4-ил)пиперазин-1-карбоновой кислоты (2,46 г). К трет-бутиловому эфиру 4-(1-метил-1H-индазол-4-ил)пиперазин-1-карбоновой кислоты (2,46 г) добавляли этилацетат (16 мл), метанол (3,2 мл) и 4 н раствор хлороводорода/этилацетата (16,5 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, растворитель выпаривали и к полученному остатку добавляли этилацетат. Осажденное твердое вещество собирали путем фильтрования с получением указанного в заголовке соединения (2,24 г).
MS(ESI)m/z:217(M+H)+
[0563]
Пример получения 144: Получение 5-метил-2-(пиперидин-4-ил)оксазоло[5,4-b]пиридина
[0564]

[0565]
К 1-[(бензилокси)карбонил]пиперидин-4-карбоновой кислоте (2 г) добавляли метиленхлорид (25 мл), пиридин (1,54 мл) и тионилхлорид (0,72 мл) и смесь перемешивали при комнатной температуре в течение 1 часа. К реакционной смеси добавляли раствор 3-амино-2-хлор-6-пиколина (1,192 г), 4-(диметиламино)пиридина (46 мг) и триэтиламина (2,11 мл) в метиленхлориде (15 мл) и смесь перемешивали при комнатной температуре в течение 2,5 часов. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением бензилового эфира 4-(2-хлор-6-метилпиридин-3-илкарбамоил)пиперидин-1-карбоновой кислоты (2,996 г).
К полученному бензиловому эфиру 4-(2-хлор-6-метилпиридин-3-илкарбамоил)пиперидин-1-карбоновой кислоты (1,5 г) добавляли карбонат калия (1,6 г) и N,N-диметилформамид (30 мл) и смесь перемешивали при микроволновом излучении при 200°C в течение 20 мин. Реакционную смесь фильтровали, фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (гексан:этилацетат) с получением бензилового эфира 4-(5-метилоксазоло[5,4-b]пиридин-2-ил)пиперидин-1-карбоновой кислоты (1,068 г).
К полученному бензиловому эфиру 4-(5-метилоксазоло[5,4-b]пиридин-2-ил)пиперидин-1-карбоновой кислоты (1,06 г) добавляли этанол (21 мл) и 10% палладий на угле (смоченный 53,5% воды) (530 мг) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (582 мг).
MS(ESI)m/z:218(M+H)+
[0566]
Пример получения 145: Получение 6-метил-2-(пиперидин-4-ил)тиазоло[4,5-b]пиридина
[0567]
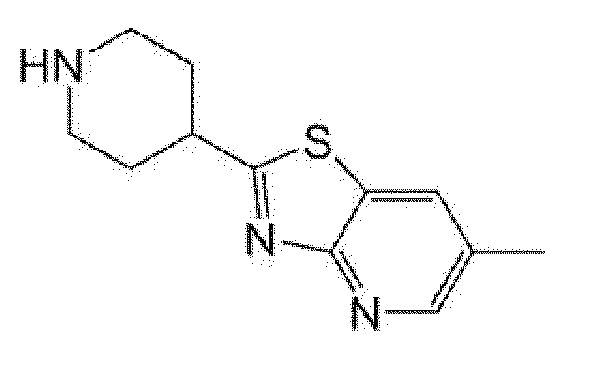
[0568]
К 1-[(бензилокси)карбонил]пиперидин-4-карбоновой кислоте (3 г) добавляли метиленхлорид (40 мл), пиридин (2,3 мл) и тионилхлорид (1,08 мл) и смесь перемешивали при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли раствор 2-амино-3-бром-5-метилпиридина (2,13 г), 4-(диметиламино)пиридин (69 мг) и триэтиламина (3,2 мл) в метиленхлориде (20 мл) и смесь перемешивали при комнатной температуре в течение 5,5 часов. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель выпаривали, к полученному остатку добавляли диэтиловый эфир и осадок собирали фильтрованием с получением бензилового эфира 4-(3-бром-5-метилпиридин-2-илкарбамоил)пиперидин-1-карбоновой кислоты (2,285 г).
К полученному бензиловому эфиру 4-(3-бром-5-метилпиридин-2-илкарбамоил)пиперидин-1-карбоновой кислоты (2,28 г) добавляли реагент Лавессона (3,21 г) и толуол (45 мл) и смесь перемешивали при 70°C в течение 1 часа. Реакционную смесь очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением бензилового эфира 4-(3-бром-5-метилпиридин-2-илтиокарбамоил)пиперидин-1-карбоновой кислоты (1,774 г).
К полученному бензиловому эфиру 4-(3-бром-5-метилпиридин-2-илтиокарбамоил)пиперидин-1-карбоновой кислоты (1,7 г) добавляли карбонат цезия (2,48 г) и N,N-диметилформамид (34 мл) и смесь перемешивали при микроволновом излучении при 160°C в течение 20 мин. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением бензилового эфира 4-(6-метилтиазоло[4,5-b]пиридин-2-ил)пиперидин-1-карбоновой кислоты (1,291 г).
К полученному бензиловому эфиру 4-(6-метилтиазоло[4,5-b]пиридин-2-ил)пиперидин-1-карбоновой кислоты (600 мг) добавляли трифторуксусную кислоту (18 мл) и тиоанизол (1,8 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении, и полученный остаток разделяли между водой и диэтиловым эфиром. Водный слой нейтрализовали насыщенным водным раствором гидрокарбоната натрия и смесь экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия, и растворитель выпаривали с получением указанного в заголовке соединения в виде неочищенного продукта (821 мг).
[0569]
Пример получения 146: Получение 5-метил-2-(пиперидин-4-ил)тиазоло[5,4-b]пиридин⋅трифторацетата
[0570]

[0571]
К бензиловому эфиру 4-(2-хлор-6-метилпиридин-3-илкарбамоил)пиперидин-1-карбоновой кислоты (1,42 г) добавляли реагент Лавессона (2,22 г) и толуол (30 мл) и смесь перемешивали при 70°C в течение 3 часов. Реакционную смесь очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением бензилового эфира 4-(5-метилтиазоло[5,4-b]пиридин-2-ил)пиперидин-1-карбоновой кислоты (603 мг).
К полученному бензиловому эфиру 4-(5-метилтиазоло[5,4-b]пиридин-2-ил)пиперидин-1-карбоновой кислоты (600 мг) добавляли трифторуксусную кислоту (18 мл) и тиоанизол (1,8 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде неочищенного продукта (2236 мг).
[0572]
Пример получения 147: Получение 1-(3,5-дициклопропилпиридин-2-ил)пиперазин•2 гидрохлорида
[0573]

[0574]
К раствору 2,3,5-трихлорпиридина (12,1 г), 1-Boc-пиперазина (14,9 г) в толуоле (80 мл) добавляли N,N-диметилформамид (40 мл) и карбонат калия (22 г) и смесь перемешивали при 120°C в течение 7 часов. Реакционную смесь охлаждали, добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-(3,5-дихлорпиридин-2-ил)пиперазин-1-карбоновой кислоты (13,08 г).
К полученному трет-бутиловому эфиру 4-(3,5-дихлорпиридин-2-ил)пиперазин-1-карбоновой кислоты (5,3 г) добавляли толуол (160 мл), воду (16 мл), бис(трициклогексилфосфин)палладий(II) дихлорид (0,59 г), трикалийфосфат (16,9 г) и циклопропилбороновую кислоту (4,13 г) и смесь перемешивали при 100°C. После завершения реакции, добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением трет-бутилового эфира 4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбоновой кислоты (3,12 г).
Полученный трет-бутиловый эфир 4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбоновой кислоты (3,11 г) растворяли в этилацетате (10 мл), добавляли 4 н раствор хлороводорода/этилацетата (10 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат). Растворитель выпаривали и полученный остаток растворяли в этилацетате (20 мл) и добавляли 4 н раствор хлороводорода/этилацетата (4,5 мл). Осадок собирали фильтрованием с получением указанного в заголовке соединения (1,91 г).
[0575]
Пример получения 148: Получение 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты
[0576]

[0577]
4-(4-Метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (24,4 г) растворяли в тетрагидрофуране (488 мл), добавляли цинхонин (16,87 г) и смесь перемешивали при комнатной температуре в течение 8 часов. Осажденное твердое вещество собирали путем фильтрования и сушили при пониженном давлении. К полученному неочищенному продукту (26,42 г) добавляли 1н хлористоводородную кислоту (150 мл) и смесь перемешивали при комнатной температуре в течение 6 часов. Осадок собирали фильтрованием с получением 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (9,39 г, 99,6%э.и.).
[0578]
Пример 1: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0579]
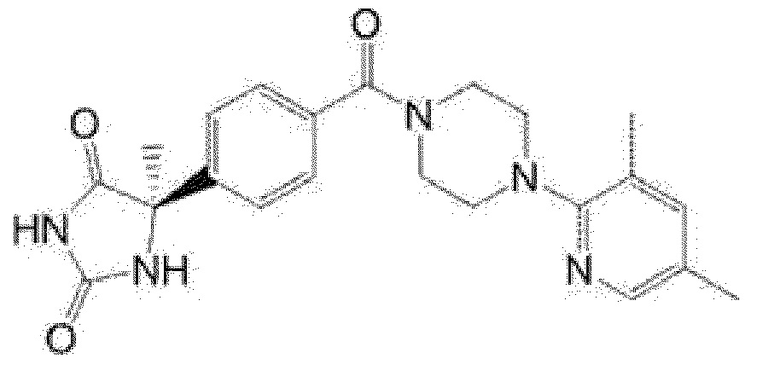
[0580]
4-((R)-4-Метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (230 мг), описанную в примере получения 6, 1-(3,5-диметилпиридин-2-ил)пиперазин (188 мг) и 1-гидроксибензотриазол (139 мг) растворяли в N,N-диметилформамиде (3,3 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (200 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол). Растворитель выпаривали и полученный остаток перекристаллизовывали из смешанного растворителя из этанола и воды с получением указанного в заголовке соединения (224,2 мг).
MS(APCI)m/z:408(M+H)+
[0581]
Пример 2: Синтез (R)-5-{4-[4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0582]
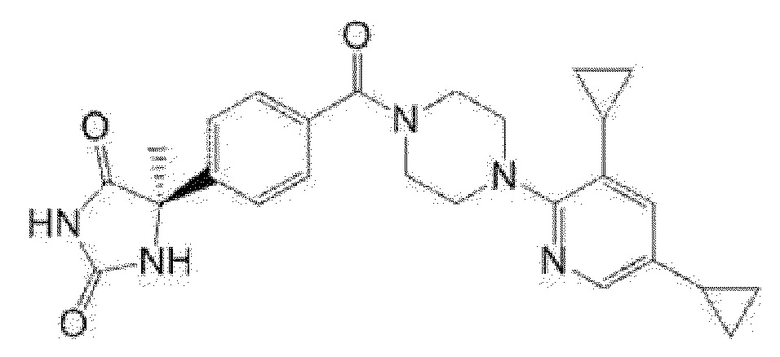
[0583]
4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (80 мг), описанную в примере получения 6, 1-(3,5-дициклопропилпиридин-2-ил)пиперазин (83 мг) и 1-гидроксибензотриазол (48,5 мг) растворяли в N,N-диметилформамиде (1,2 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (68,8 мг), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (80,3 мг).
MS(APCI)m/z:460(M+H)+
[0584]
Пример 3: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-метилимидазолидин-2,4-диона
[0585]

[0586]
2-Фтор-4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (790 мг), описанную в примере получения 29, 1-(3,5-диметилпиридин-2-ил)пиперазин (784,7 мг), 1-гидроксибензотриазол (507,9 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (780,7 мг) растворяли в смешанном растворителе хлороформа (23,7 мл) и N,N-диметилформамида (7,9 мл), добавляли триэтиламин (960,5 мкл) и смесь перемешивали при комнатной температуре. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (1210 мг).
MS(APCI)m/z:426(M+H)+
[0587]
Пример 4: Синтез (R)-5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0588]

[0589]
4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (100 мг), описанную в примере получения 6, 1-(5-этил-3-метилпиридин-2-ил)пиперазин (87,7 мг) и 1-гидроксибензотриазол (60,6 мг) растворяли в N,N-диметилформамиде (1,5 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (85,9 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат: метанол) с получением указанного в заголовке соединения (138 мг).
MS(APCI)m/z:422(M+H)+
[0590]
Пример 5: Синтез (R)-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0591]

[0592]
4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (100 мг), описанную в примере получения 6, 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (92,8 мг) и 1-гидроксибензотриазол (60,6 мг) растворяли в N,N-диметилформамиде (1,5 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (85,9 мг), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (152,3 мг).
MS(APCI)m/z:434(M+H)+
[0593]
Пример 6: Синтез (R)-5-метил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0594]

[0595]
4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (100 мг), описанную в примере получения 6, 1-(3,5,6-триметилпиридин-2-ил)пиперазин (87,7 мг) и 1-гидроксибензотриазол (60,6 мг) растворяли в N,N-диметилформамиде (2,5 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (85,9 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (99,5 мг).
MS(APCI)m/z:422(M+H)+
[0596]
Пример 7: Синтез (R)-5-{4-[4-(2,4-диметилфенил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0597]

[0598]
4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (100 мг), описанную в примере получения 6, 1-(2,4-диметилфенил)пиперазин (81,2 мг) и 1-гидроксибензотриазол (60,6 мг) растворяли в N,N-диметилформамиде (1,5 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (85,9 мг), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (130,5 мг).
MS(APCI)m/z:407(M+H)+
[0599]
Пример 8: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0600]

[0601]
4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (2,88 г), описанную в примере получения 45, растворяли в N,N-диметилформамиде (43,9 мл), добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (2,75 г), 1-гидроксибензотриазол (1,63 г), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (2,32 г) и N,N-диизопропилэтиламин (4,21 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и осадок собирали фильтрованием. Полученный осадок перекристаллизовывали из смешанного растворителя из этанола и воды с получением указанного в заголовке соединения (3,84 г).
MS(ESI)m/z:436(M+H)+
[0602]
Пример 9: Синтез (R)-5-{4-[4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-диона и (S)-5-{4-[4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-диона
[0603]
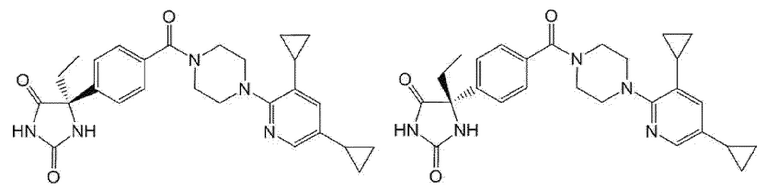
[0604]
4-(4-Этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (70 мг), описанную в примере получения 1, 1-(3,5-дициклопропилпиридин-2-ил)пиперазин (75 мг), 1-гидроксибензотриазол (37,8 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (80 мг) и диизопропилэтиламин (1 мл) растворяли в N,N-диметилформамиде (5 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) с получением 5-{4-[4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-диона (78,6 мг).
Полученный 5-{4-[4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-дион (70 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IC (тетрагидрофуран/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 28,9 мг (MS(APCI)m/z:474(M+H)+) и соединение с большим временем удерживания 28,7 мг (MS(APCI)m/z:474(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, тетрагидрофуран/этанол/диэтиламин=10/90/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 5,5 мин и 11,1 мин.
[0605]
Пример 10: Синтез (R)-5-этил-5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона и (S)-5-этил-5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0606]

[0607]
4-(4-Этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (75 мг), описанную в примере получения 1, 1-(5-этил-3-метилпиридин-2-ил)пиперазин (75 мг), 1-гидроксибензотриазол (40 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (86 мг) и диизопропилэтиламин (1 мл) растворяли в N,N-диметилформамиде (4 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) с получением 5-этил-5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона (125 мг).
Полученный 5-этил-5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-дион (98 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IC (тетрагидрофуран/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 35,7 мг (MS(APCI)m/z:436(M+H)+) и соединение с большим временем удерживания 35,2 мг (MS(APCI)m/z:436(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, тетрагидрофуран/этанол/диэтиламин=10/90/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 5,4 мин и 9,7 мин.
[0608]
Пример 11: Синтез (R)-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-диона и (S)-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-диона
[0609]

[0610]
4-(4-Этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (75 мг), описанную в примере получения 1, 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (80 мг), 1-гидроксибензотриазол (40 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (86 мг) и диизопропилэтиламин (1 мл) растворяли в N,N-диметилформамиде (4 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) с получением 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-диона (103,6 мг).
Полученный 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-дион (98 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IC (тетрагидрофуран/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 34,4 мг (MS(APCI)m/z:448(M+H)+) и соединение с большим временем удерживания 19,9 мг (MS(APCI)m/z:448(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, тетрагидрофуран/этанол/диэтиламин=10/90/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 5,6 мин и 10,8 мин.
[0611]
Пример 12: Синтез (R)-5-{4-[4-(2,4-диметилфенил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-диона и (S)-5-{4-[4-(2,4-диметилфенил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-диона
[0612]
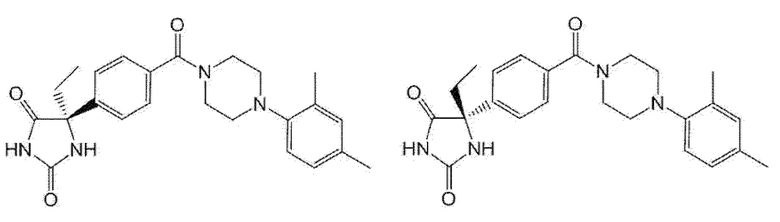
[0613]
4-(4-Этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (75 мг), описанную в примере получения 1, 1-(2,4-диметилфенил)пиперазин (70 мг, CAS:1013-76-9), 1-гидроксибензотриазол (40 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (86 мг) и диизопропилэтиламин (1 мл) растворяли в N,N-диметилформамиде (4 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) с получением 5-{4-[4-(2,4-диметилфенил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-диона (116,1 мг).
Полученный 5-{4-[4-(2,4-диметилфенил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-дион (106 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IC (тетрагидрофуран/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 36,8 мг (MS(APCI)m/z:421(M+H)+) и соединение с большим временем удерживания 37,8 мг (MS(APCI)m/z:421(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, тетрагидрофуран/этанол/диэтиламин=10/90/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 5,3 мин и 10,8 мин.
[0614]
Пример 13: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-диона и (S)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-диона
[0615]

[0616]
3-Фтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (252 мг), описанную в примере получения 18, растворяли в тетрагидрофуране (10 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (230 мг), 1-гидроксибензотриазол (162 мг) и 1-(3,5-диметилпиридин-2-ил)пиперазин (230 мг), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-диона (343 мг).
Полученный 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-дион(рацемат) (98 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IA (тетрагидрофуран/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 47,2 мг (MS(APCI)m/z:426(M+H)+) и соединение с большим временем удерживания 37,4 мг (MS(APCI)m/z:426(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IA-3 (4,6 мм×150 мм, тетрагидрофуран/этанол/диэтиламин=10/90/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 5,8 мин и 7,6 мин.
[0617]
Пример 14: Синтез (R)-5-этил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона и (S)-5-этил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0618]

[0619]
4-(4-Этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (55 мг), описанную в примере получения 1, 1-(3,5,6-триметилпиридин-2-ил)пиперазин (58 мг) и 1-гидроксибензотриазол (32 мг) растворяли в N,N-диметилформамиде (2 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (45 мг), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением 5-этил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона (85,4 мг).
Полученный 5-этил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-дион (85,4 мг) разделяли с помощью колонки среднего давления с использованием CHIRALFLASH (Daicel) IC (тетрагидрофуран/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 42,5 мг (MS(APCI)m/z:436(M+H)+) и соединение с большим временем удерживания 37 мг (MS(APCI)m/z:436(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC (4,6 мм×100 мм, тетрагидрофуран/этанол/диэтиламин=10/90/0,1, поток 0,3 мл/мин), время удерживания составляло, соответственно, 6,8 мин и 13,4 мин.
[0620]
Пример 15: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метоксифенил}-5-метилимидазолидин-2,4-диона
[0621]

[0622]
3-Метокси-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (132 мг), описанную в примере получения 22, 1-(3,5-диметилпиридин-2-ил)пиперазин (105 мг) и 1-гидроксибензотриазол (74 мг) растворяли в N,N-диметилформамиде (1,7 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (105 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (122,2 мг).
MS(APCI)m/z:438(M+H)+
[0623]
Пример 16: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2,3-дифторфенил}-5-метилимидазолидин-2,4-диона
[0624]
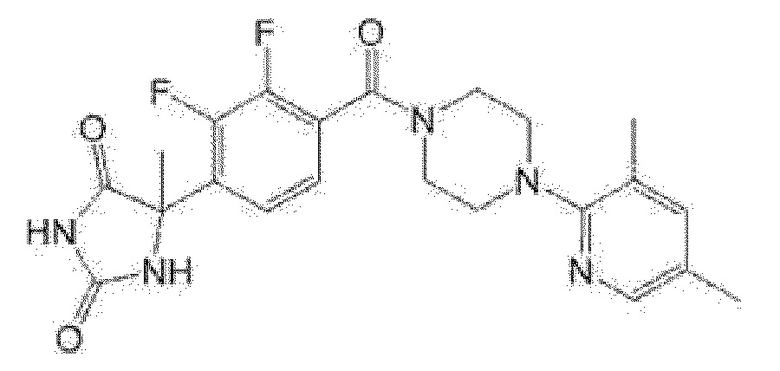
[0625]
2,3-Дифтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (135 мг), описанную в примере получения 26, 1-(3,5-диметилпиридин-2-ил)пиперазин (105 мг) и 1-гидроксибензотриазол (74 мг) растворяли в N,N-диметилформамиде (1,7 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (105 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (149 мг).
MS(APCI)m/z:444(M+H)+
[0626]
Пример 17: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метоксифенил}-5-изопропилимидазолидин-2,4-диона
[0627]
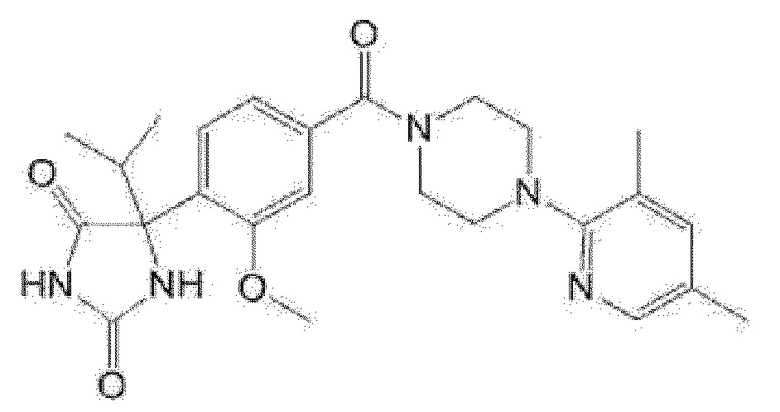
[0628]
4-(4-Изопропил-2,5-диоксоимидазолидин-4-ил)-3-метоксибензойную кислоту (146 мг), описанную в примере получения 35, 1-(3,5-диметилпиридин-2-ил)пиперазин (105 мг) и 1-гидроксибензотриазол (74 мг) растворяли в N,N-диметилформамиде (1,7 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (105 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (152,9 мг).
MS(APCI)m/z:466(M+H)+
[0629]
Пример 18: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-гидроксифенил}-5-метилимидазолидин-2,4-диона
[0630]

[0631]
К 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метоксифенил}-5-метилимидазолидин-2,4-диону (100 мг), описанному в примере 15, добавляли дихлорметан (6 мл) и добавляли 1 моль/л раствор трибромида бора в дихлорметане (1,2 мл) при перемешивании с охлаждением при -78°C, и смесь перемешивали в процессе повышения температуры до комнатной температуры. Реакционную смесь выливали в воду со льдом, нейтрализовали гидрокарбонатом натрия и экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат: метанол) с получением указанного в заголовке соединения в виде неочищенного продукта (54 мг). Полученный неочищенный продукт (54 мг) разделяли с помощью ВЭЖХ с использованием XBridge Prep C18 OBD (Waters) (10 ммоль/л водного раствора карбоната аммония, ацетонитрил). После экстракции этилацетатом, растворитель выпаривали с получением указанного в заголовке соединения (20,8 мг).
MS(APCI)m/z:424(M+H)+
[0632]
Пример 19: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-(2-гидроксиэтил)-5-метилимидазолидин-2,4-диона
[0633]

[0634]
(R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-дион (204 мг), описанный в примере 1, растворяли в N,N-диметилформамиде (1 мл), добавляли 2-бромэтанол (43 мкл) и карбонат калия (90 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат: метанол) с получением указанного в заголовке соединения (74,6 мг).
MS(ESI)m/z:452(M+H)+
[0635]
Пример 20: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-гидроксифенил}-5-изопропилимидазолидин-2,4-диона
[0636]

[0637]
К 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метоксифенил}-5-изопропилимидазолидин-2,4-диону (100 мг), описанному в примере 17, добавляли дихлорметан (6 мл) и добавляли 1 моль/л раствор трибромида бора в дихлорметане (2,2 мл) при перемешивании с охлаждением при -78°C, и смесь перемешивали в процессе повышения температуры до комнатной температуры. Реакционную смесь выливали в воду со льдом, нейтрализовали гидрокарбонатом натрия и экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (60,4 мг).
MS(APCI)m/z:452(M+H)+
[0638]
Пример 21: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-2-метоксифенил}-5-изопропилимидазолидин-2,4-диона
[0639]
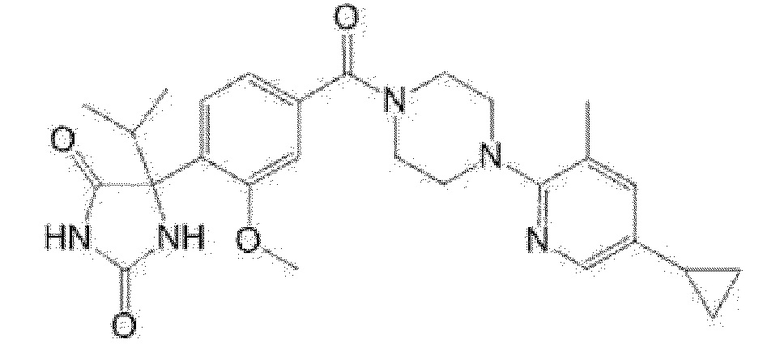
[0640]
4-(4-Изопропил-2,5-диоксоимидазолидин-4-ил)-3-метоксибензойную кислоту (146 мг), описанную в примере получения 35, 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин•гидрохлорид (140 мг), 1-гидроксибензотриазол (74 мг) и триэтиламин (0,17 мл) растворяли в N,N-диметилформамиде (1,7 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (105 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (205,1 мг).
MS(APCI)m/z:492(M+H)+
[0641]
Пример 22: Синтез 5-изопропил-5-{2-метокси-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0642]

[0643]
4-(4-Изопропил-2,5-диоксоимидазолидин-4-ил)-3-метоксибензойную кислоту (146 мг), описанную в примере получения 35, 1-(3,5,6-триметилпиридин-2-ил)пиперазин (113 мг) и 1-гидроксибензотриазол (74 мг) растворяли в N,N-диметилформамиде (1,7 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (105 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (190,7 мг).
MS(APCI)m/z:480(M+H)+
[0644]
Пример 23: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метоксифенил}-5-изопропилимидазолидин-2,4-диона и (S)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метоксифенил}-5-изопропилимидазолидин-2,4-диона
[0645]

[0646]
5-{4-[4-(3,5-Диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метоксифенил}-5-изопропилимидазолидин-2,4-дион (186 мг, см. пример 17) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IC (гексан/хлороформ/2-пропанол) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 83,6 мг (MS(APCI)m/z:466(M+H)+) и соединение с большим временем удерживания 82,2 мг (MS(APCI)m/z:466(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, гексан/2-пропанол/тетрагидрофуран/диэтиламин=60/20/20/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 7,7 мин и 9,7 мин.
[0647]
Пример 24: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-1-(2-гидроксиэтил)-5-метилимидазолидин-2,4-диона
[0648]
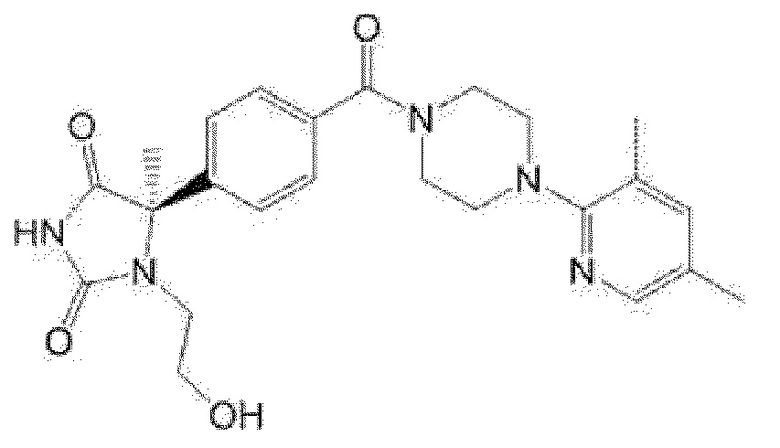
[0649]
(R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-дион (300 мг), описанный в примере 1, растворяли в N,N-диметилформамиде (1,5 мл), добавляли 4-метоксибензил хлорид (0,12 мл), карбонат калия (132 мг) и калий йодид (12 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-(4-метоксибензил)-5-метилимидазолидин-2,4-диона (242,1 мг).
Полученный (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-(4-метоксибензил)-5-метилимидазолидин-2,4-дион (242,1 мг) и 2-(2-бромэтокси)тетрагидропиран (152 мкл) растворяли в N,N-диметилформамиде (2 мл), гидрид натрия (60% в жидкой дисперсии парафинов) (44 мг) добавляли при охлаждении льдом, и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-(4-метоксибензил)-5-метил-1-[2-(тетрагидропиран-2-илокси)этил]имидазолидин-2,4-диона (262 мг).
Полученный (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-(4-метоксибензил)-5-метил-1-[2-(тетрагидропиран-2-илокси)этил]имидазолидин-2,4-дион (262 мг) растворяли в 1,2-дихлорэтане (7 мл), добавляли трифторметансульфоновую кислоту (0,5 мл) и смесь перемешивали при 70°C. После завершения реакции, добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (52,9 мг).
MS(APCI)m/z:452(M+H)+
[0650]
Пример 25: Синтез (R)-5-{4-[4-(6-фторбензо[d]изоксазол-3-ил)пиперидин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-диона и (S)-5-{4-[4-(6-фторбензо[d]изоксазол-3-ил)пиперидин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-диона
[0651]

[0652]
4-(4-Фторметил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (168 мг), описанную в примере получения 63, 6-фтор-3-(пиперидин-4-ил)бензо[d]изоксазол (147 мг) и 1-гидроксибензотриазол (99 мг) растворяли в N,N-диметилформамиде (1 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (140 мг), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением 5-{4-[4-(6-фторбензо[d]изоксазол-3-ил)пиперидин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-диона (205,3 мг).
Полученный 5-{4-[4-(6-фторбензо[d]изоксазол-3-ил)пиперидин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-дион (167 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IC (гексан/метанол/тетрагидрофуран) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 62,8 мг (MS(APCI)m/z:455(M+H)+) и соединение с большим временем удерживания 64,1 мг (MS(APCI)m/z:455(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, гексан/метанол/тетрагидрофуран=60/20/20, поток 0,5 мл/мин), время удерживания составляло, соответственно, 6,6 мин и 12,4 мин.
[0653]
Пример 26: Синтез (R)-5-{4-[4-(6-фторбензо[d]изоксазол-3-ил)пиперидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0654]
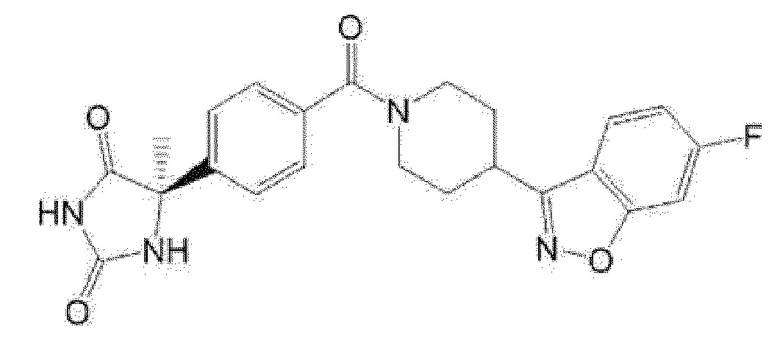
[0655]
4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (117 мг), описанную в примере получения 6, 6-фтор-3-(пиперидин-4-ил)бензо[d]изоксазол (111 мг) и 1-гидроксибензотриазол (74,3 мг) растворяли в N,N-диметилформамиде (1 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (105 мг), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (196,3 мг).
MS(APCI)m/z:437(M+H)+
[0656]
Пример 27: Синтез (R)-5-этил-5-{4-[4-(1-п-толил-1H-пиразол-4-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[0657]

[0658]
4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (61,7 мг), описанную в примере получения 14, 4-[1-(п-толил)-1H-пиразол-4-ил]пиперидин (60 мг), описанный в примере получения 134, и 1-гидроксибензотриазол (35,3 мг) растворяли в N,N-диметилформамиде (1,5 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (50 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (98 мг).
MS(APCI)m/z:472(M+H)+
[0659]
Пример 28: Синтез (R)-5-метил-5-{4-[4-(1-п-толил-1H-пиразол-4-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[0660]
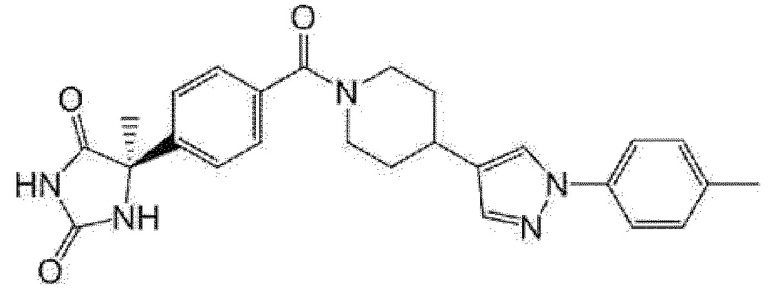
[0661]
4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (58,2 мг), описанную в примере получения 6, 4-[1-(п-толил)-1H-пиразол-4-ил]пиперидин (60 мг), описанный в примере получения 134, и 1-гидроксибензотриазол (35,3 мг) растворяли в N,N-диметилформамиде (1,5 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (50 мг), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (92,8 мг).
MS(APCI)m/z:458(M+H)+
[0662]
Пример 29: Синтез (R)-5-изопропил-5-{4-[4-(1-п-толил-1H-пиразол-4-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[0663]

[0664]
4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (79,4 мг), описанную в примере получения 45, 4-[1-(п-толил)-1H-пиразол-4-ил]пиперидин (73 мг), описанный в примере получения 134, и 1-гидроксибензотриазол (42,9 мг) растворяли в N,N-диметилформамиде (1,5 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (60,9 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (109,4 мг).
MS(APCI)m/z:486(M+H)+
[0665]
Пример 30: Синтез 5-{3-бром-4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0666]

[0667]
2-Бром-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (118 мг), описанную в примере получения 3, растворяли в тетрагидрофуране (2 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (76 мг), 1-гидроксибензотриазол (108 мг) и 1-(3,5-диметилпиридин-2-ил)пиперазин (72 мг), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (130 мг).
MS(ESI)m/z:486(M+H)+
[0668]
Пример 31: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-метилимидазолидин-2,4-диона
[0669]

[0670]
К 2-метил-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (150 мг), описанной в примере получения 8, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин (127,1 мг), 1-гидроксибензотриазол (98 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (150,6 мг), хлороформ (2 мл) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (191,3 мг).
MS(ESI)m/z:422(M+H)+
[0671]
Пример 32: Синтез (R)-5-{2-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона и (S)-5-{2-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0672]
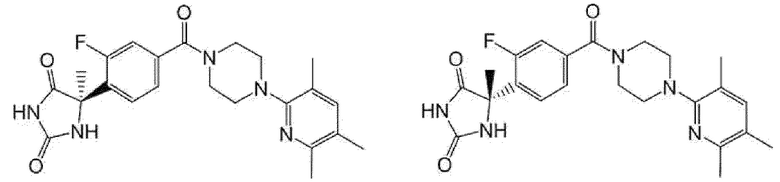
[0673]
3-Фтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (126 мг), описанную в примере получения 18, растворяли в тетрагидрофуране (5 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (115 мг), 1-гидроксибензотриазол (162 мг), 1-(3,5,6-триметилпиридин-2-ил)пиперазин (113 мг) и триэтиламин (168 мкл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением 5-{2-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона (172 мг).
Полученный 5-{2-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-дион (150 мг) разделяли с помощью колонки среднего давления с использованием CHIRALFLASH (Daicel) IA (этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 51,5 мг (MS(ESI)m/z:440(M+H)+) и соединение с большим временем удерживания 34,6 мг (MS(ESI)m/z:440(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IA (4,6 мм×100 мм, этанол/диэтиламин=100/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 4,6 мин и 6,6 мин.
[0674]
Пример 33: Синтез (R)-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-диона и (S)-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-диона
[0675]
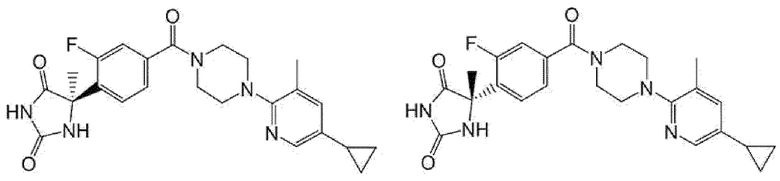
[0676]
3-Фтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (126 мг), описанную в примере получения 18, растворяли в тетрагидрофуране (5 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (115 мг), 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (130 мг) и 1-гидроксибензотриазол (162 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-диона (219 мг).
Полученный 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-дион (150 мг) разделяли с помощью колонки среднего давления с использованием CHIRALFLASH (Daicel) IA (этанол/диэтиламин/тетрагидрофуран) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 48,5 мг (MS(APCI)m/z:452(M+H)+) и соединение с большим временем удерживания 61 мг (MS(APCI)m/z:452(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IA (4,6 мм×100 мм, тетрагидрофуран/этанол/диэтиламин=10/90/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 4,8 мин и 7,8 мин.
[0677]
Пример 34: Синтез (R)-5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-диона и (S)-5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-диона
[0678]
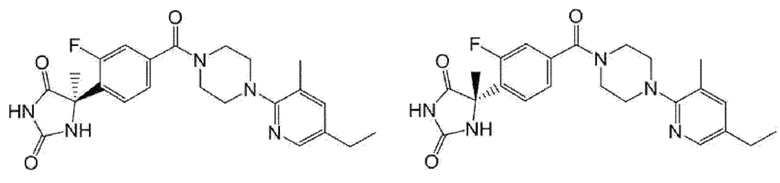
[0679]
3-Фтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (126 мг), описанную в примере получения 18, растворяли в тетрагидрофуране (5 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (115 мг), 1-(5-этил-3-метилпиридин-2-ил)пиперазин (130 мг) и 1-гидроксибензотриазол (162 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением 5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-диона (196 мг).
Полученный 5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-дион (150 мг) разделяли с помощью колонки среднего давления с использованием CHIRALFLASH (Daicel) IA (этанол/диэтиламин/тетрагидрофуран) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 37,5 мг (MS(APCI)m/z:440(M+H)+) и соединение с большим временем удерживания 34,5 мг (MS(APCI)m/z:440(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IA (4,6 мм×100 мм, тетрагидрофуран/этанол/диэтиламин=10/90/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 4,1 мин и 5,9 мин.
[0680]
Пример 35: Синтез (R)-5-{4-[4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-диона и (S)-5-{4-[4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-диона
[0681]

[0682]
3-Фтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (126 мг), описанную в примере получения 18, растворяли в тетрагидрофуране (5 мл), добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (115 мг), 1-гидроксибензотриазол (162 мг), 1-(3,5-дициклопропилпиридин-2-ил)пиперазин•2 гидрохлорид (190 мг) и триэтиламин (168 мкл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением 5-{4-[4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-диона (60 мг).
Полученный 5-{4-[4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-метилимидазолидин-2,4-дион (60 мг) разделяли с помощью колонки среднего давления с использованием CHIRALFLASH (Daicel) IA (гексан/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 18 мг (MS(ESI)m/z:478(M+H)+) и соединение с большим временем удерживания 16 мг (MS(ESI)m/z:478(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IA-3 (4,6 мм×150 мм, этанол/диэтиламин=100/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 11,0 мин и 25,9 мин.
[0683]
Пример 36: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-этилимидазолидин-2,4-диона и (S)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-этилимидазолидин-2,4-диона
[0684]
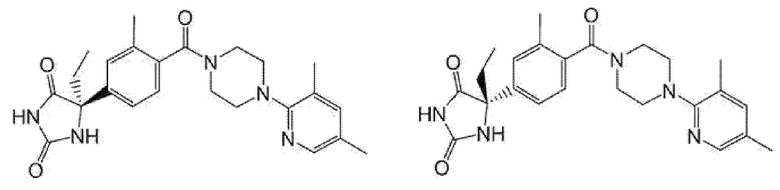
[0685]
К 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-2-метилбензойной кислоте в виде неочищенного продукта (209 мг), описанной в примере получения 19, добавляли тетрагидрофуран (8 мл), N,N-диметилформамид (1 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (183 мг), 1-гидроксибензотриазол (129 мг), 1-(3,5-диметилпиридин-2-ил)пиперазин (190 мг) и триэтиламин (278 мкл) и смесь перемешивали при комнатной температуре в течение 8 часов. К реакционной смеси добавляли воду и осажденное твердое вещество собирали путем фильтрования. Полученный неочищенный продукт очищали с помощью колоночной хроматографии (хлороформ:метанол) с получением 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-этилимидазолидин-2,4-диона (130 мг).
Полученный 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-этилимидазолидин-2,4-дион (110 мг) разделяли с помощью колонки среднего давления с использованием CHIRALFLASH (Daicel) IA (тетрагидрофуран/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 34 мг (MS(ESI)m/z:436(M+H)+) и соединение с большим временем удерживания 45 мг (MS(ESI)m/z:436(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, гексан/этанол/диэтиламин=10/90/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 7,4 мин и 15,9 мин.
[0686]
Пример 37: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метилфенил}-5-изопропилимидазолидин-2,4-диона и (S)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метилфенил}-5-изопропилимидазолидин-2,4-диона
[0687]
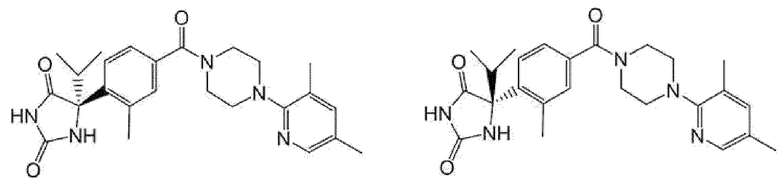
[0688]
К 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-3-метилбензойной кислоте в виде неочищенного продукта (138 мг), описанной в примере получения 39, добавляли тетрагидрофуран (5 мл), 1-гидроксибензотриазол (81 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (115 мг), триэтиламин (168 мкл) и 1-(3,5-диметилпиридин-2-ил)пиперазин (115 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат:метанол) с получением 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метилфенил}-5-изопропилимидазолидин-2,4-диона (137 мг).
Полученный 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метилфенил}-5-изопропилимидазолидин-2,4-дион (119 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IF (тетрагидрофуран/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 59,4 мг (MS(APCI)m/z:450(M+H)+) и соединение с большим временем удерживания 59 мг (MS(APCI)m/z:450(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, тетрагидрофуран/этанол/диэтиламин=5/95/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 8,0 мин и 6,3 мин.
[0689]
Пример 38: Синтез (R)-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-этилимидазолидин-2,4-диона и (S)-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-этилимидазолидин-2,4-диона
[0690]
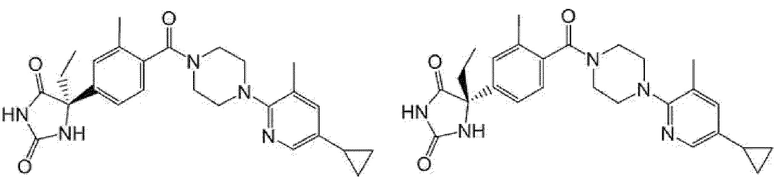
[0691]
К 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-2-метилбензойной кислоте в виде неочищенного продукта (131 мг), описанной в примере получения 19, добавляли тетрагидрофуран (5 мл), триэтиламин (168 мкл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (115 мг), 1-гидроксибензотриазол (81 мг), 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (130 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-этилимидазолидин-2,4-диона. Полученный 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-этилимидазолидин-2,4-дион разделяли с помощью колонки среднего давления с использованием CHIRALFLASH (Daicel) IC (этанол/диметиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 18,5 мг (MS(ESI)m/z:462(M+H)+) и соединение с большим временем удерживания 17,8 мг (MS(ESI)m/z:462(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, этанол/диэтиламин=100/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 7,2 мин и 14,5 мин.
[0692]
Пример 39: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-этилимидазолидин-2,4-диона и (S)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-этилимидазолидин-2,4-диона
[0693]

[0694]
К 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-3-фторбензойной кислоте (133 мг), описанной в примере получения 40, добавляли тетрагидрофуран (5 мл), триэтиламин (168 мкл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (115 мг), 1-гидроксибензотриазол (81 мг), 1-(3,5-диметилпиридин-2-ил)пиперазин (115 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-этилимидазолидин-2,4-диона (75 мг).
Полученный 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-этилимидазолидин-2,4-дион (55 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IF (гексан/этанол/тетрагидрофуран/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 16,1 мг (MS(APCI)m/z:440(M+H)+) и соединение с большим временем удерживания 16,1 мг (MS(APCI)m/z:440(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IF-3 (4,6 мм×150 мм, гексан/этанол/тетрагидрофуран/диэтиламин=40/30/30/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 7,0 мин и 8,3 мин.
[0695]
Пример 40: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-2-метилфенил}-5-изопропилимидазолидин-2,4-диона
[0696]

[0697]
К 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-3-метилбензойной кислоте в виде неочищенного продукта (138 мг), описанной в примере получения 39, добавляли тетрагидрофуран (5 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (115 мг), 1-гидроксибензотриазол (81 мг), триэтиламин (168 мкл), 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (123 мг) и смесь перемешивали при комнатной температуре в течение 6,5 часов. Реакционную смесь очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (118 мг).
MS(ESI)m/z:476(M+H)+
[0698]
Пример 41: Синтез 5-изопропил-5-{2-метил-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0699]
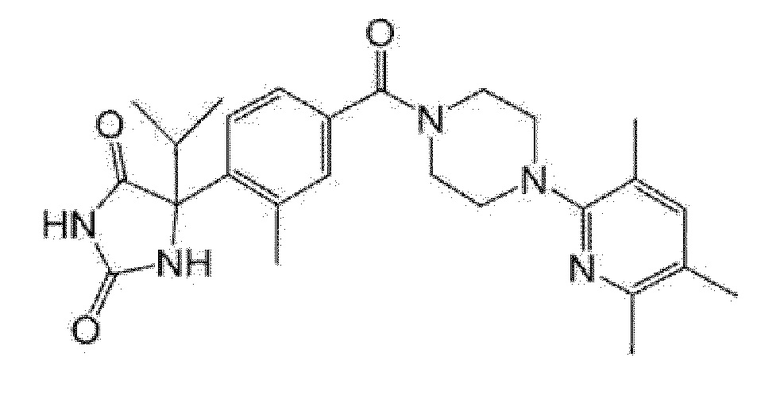
[0700]
Используя 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-3-метилбензойную кислоту в виде неочищенного продукта (138 мг), описанную в примере получения 39, 1-(3,5,6-триметилпиридин-2-ил)пиперазин (130 мг), реакции и обработки, аналогичные тем, которые описаны в примере 40, осуществляли с получением указанного в заголовке соединения (85 мг).
MS(ESI)m/z:464(M+H)+
[0701]
Пример 42: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-этилимидазолидин-2,4-диона
[0702]
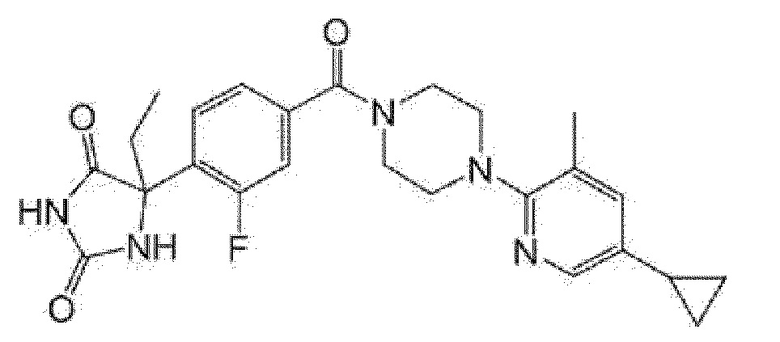
[0703]
К 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-3-фторбензойной кислоте (67 мг), описанной в примере получения 40, добавляли тетрагидрофуран (2,5 мл), триэтиламин (87 мкл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (58 мг), 1-гидроксибензотриазол (40 мг), 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин•гидрохлорид (76 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (85 мг).
MS(ESI)m/z:466(M+H)+
[0704]
Пример 43: Синтез 5-этил-5-{2-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0705]

[0706]
К 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-3-фторбензойной кислоте (62 мг), описанной в примере получения 40, добавляли тетрагидрофуран (2,3 мл), N,N-диметилформамид (3 мл), триэтиламин (405 мкл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (53 мг), 1-гидроксибензотриазол (74 мг) и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (60 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (35 мг).
MS(ESI)m/z:454(M+H)+
[0707]
Пример 44: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-5-фтор-2-метоксифенил}-5-изопропилимидазолидин-2,4-диона
[0708]

[0709]
К 2-фтор-4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-5-метоксибензойной кислоте (310 мг), описанной в примере получения 59, добавляли тетрагидрофуран (10 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (230 мг), 1-гидроксибензотриазол (162 мг), триэтиламин (350 мкл) и 1-(3,5-диметилпиридин-2-ил)пиперазин (230 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду, и осадок собирали фильтрованием с получением указанного в заголовке соединения (380 мг).
MS(ESI)m/z:484(M+H)+
[0710]
Пример 45: Синтез 5-(1,1-дифторэтил)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метоксифенил}имидазолидин-2,4-диона
[0711]

[0712]
К 4-[4-(1,1-дифторэтил)-2,5-диоксо-имидазолидин-4-ил]-3-метоксибензойной кислоте (157 мг), описанной в примере получения 60, добавляли тетрагидрофуран (5 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (115 мг), N,N-диметилформамид (2 мл), 1-гидроксибензотриазол (81 мг), триэтиламин (175 мкл) и 1-(3,5-диметилпиридин-2-ил)пиперазин (115 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (77 мг).
MS(ESI)m/z:488(M+H)+
[0713]
Пример 46: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-5-фтор-2-гидроксифенил}-5-изопропилимидазолидин-2,4-диона
[0714]
[0715]
К 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-5-фтор-2-метоксифенил}-5-изопропилимидазолидин-2,4-диону (242 мг), описанному в примере 44, добавляли 1,2-дихлорэтан (10 мл) и смесь охлаждали до 0°C с перемешиванием. Добавляли 1 моль/л раствор трибромида бора в дихлорметане (2,5 мл) и смесь перемешивали в процессе повышения температуры до комнатной температуры. При микроволновом излучении, смесь перемешивали при 40°C в течение 1,5 часов и при 80°C в течение 1,5 часов, добавляли толуол (2 мл) и 1 моль/л раствор трибромида бора в дихлорметане (2,5 мл), и смесь перемешивали при 80°C в течение 1,5 часов. После перемешивания при комнатной температуре в течение ночи, реакционную смесь выливали в водный раствор гидрокарбоната натрия и экстрагировали хлороформом. Растворитель выпаривали и полученный остаток отделяли с помощью ВЭЖХ с использованием XBridge Phenyl (0,05% трифторуксусная кислота/вода, 0,05% трифторуксусная кислота/ацетонитрил). К полученному раствору добавляли водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Растворитель выпаривали с получением указанного в заголовке соединения (21 мг).
MS(ESI)m/z:470(M+H)+
[0716]
Пример 47: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропил-3-(4-метоксибензил)имидазолидин-2,4-диона
[0717]
[0718]
1) Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
4-(4-Изопропил-2,5-диоксо-имидазолидин-4-ил)бензойную кислоту (180 мг), описанную в примере получения 5, 1-(3,5-диметилпиридин-2-ил)пиперазин (160 мг), 1-гидроксибензотриазол (92 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (150 мг) и диизопропилэтиламин (2,3 мл) растворяли в N,N-диметилформамиде (7 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) с получением 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона (240 мг).
MS(ESI)m/z:436(M+H)+
[0719]
2) Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропил-3-(4-метоксибензил)имидазолидин-2,4-диона
К 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диону (217 мг, см. вышеупомянутый 1)) добавляли карбонат калия (90 мг), N,N-диметилформамид (5 мл), калий йодид (8,3 мг) и 4-метоксибензил бромид (109 мкл) и смесь перемешивали при комнатной температуре. После завершения реакции, добавляли воду и осажденное твердое вещество собирали фильтрованием с получением 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропил-3-(4-метоксибензил)имидазолидин-2,4-диона (278 мг).
MS(ESI)m/z:556(M+H)+
[0720]
Пример 48: Синтез (R)-5-дифторметил-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона и (S)-5-дифторметил-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0721]

[0722]
К 4-(4-дифторметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (270 мг), описанной в примере получения 62, добавляли тетрагидрофуран (10 мл), 1-гидроксибензотриазол (162 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (230 мг), триэтиламин (350 мкл), 1-(3,5-диметилпиридин-2-ил)пиперазин (230 мг) и N,N-диметилформамид (3 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением 5-дифторметил-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона (221 мг).
Полученный 5-дифторметил-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-дион (220 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IF (2-пропанол/тетрагидрофуран/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 57 мг (MS(ESI)m/z:444(M+H)+) и соединение с большим временем удерживания 94 мг (MS(ESI)m/z:444(M+H)+).
При анализе с использованием CHIRALPAK (Daicel) IF-3 (4,6 мм×50 мм, 2-пропанол/тетрагидрофуран/диэтиламин=85/15/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 5,6 мин и 10,9 мин.
[0723]
Пример 49: Синтез (R)-5-{4-[(S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0724]

[0725]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (136 мг), описанной в примере получения 45, добавляли тетрагидрофуран (5 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (115 мг), 1-гидроксибензотриазол (81 мг), триэтиламин (280 мкл), (3,5-диметил-пиридин-2-ил)-(S)-пирролидин-3-иламин λ 2 гидрохлорид (158 мг), описанный в примере получения 88, и N,N-диметилформамид (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (131 мг).
MS(ESI)m/z:436(M+H)+
[0726]
Пример 50: Синтез (R)-5-{4-[(S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбонил]фенил}-5-этилимидазолидин-2,4-диона
[0727]

[0728]
Используя 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (124 мг), описанную в примере получения 14, и (3,5-диметил-пиридин-2-ил)-(S)-пирролидин-3-иламин•2 гидрохлорид (158 мг), описанный в примере получения 88, реакции и обработки, аналогичные тем, которые описаны в примере 49, осуществляли с получением указанного в заголовке соединения (102 мг).
MS(ESI)m/z:422(M+H)+
[0729]
Пример 51: Синтез (R)-5-{4-[(S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0730]

[0731]
Используя 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (117 мг), описанную в примере получения 6, и (3,5-диметил-пиридин-2-ил)-(S)-пирролидин-3-иламин•2 гидрохлорид (158 мг), описанный в примере получения 88, реакции и обработки, аналогичные тем, которые описаны в примере 49, осуществляли с получением указанного в заголовке соединения (45 мг).
MS(ESI)m/z:408(M+H)+
[0732]
Пример 52: Синтез (R)-5-{4-[(S)-4-(3,5-диметилпиридин-2-ил)-2-метилпиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона и (R)-5-{4-[(R)-4-(3,5-диметилпиридин-2-ил)-2-метилпиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0733]

[0734]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (262 мг), описанной в примере получения 45, добавляли тетрагидрофуран (10 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (230 мг), 1-гидроксибензотриазол (162 мг), триэтиламин (350 мкл), 1-(3,5-диметилпиридин-2-ил)-3-метилпиперазин (226 мг), описанный в примере получения 110, и N,N-диметилформамид (3 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)-2-метилпиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона (339 мг).
Полученный (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)-2-метилпиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-дион (150 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IF (этанол/тетрагидрофуран/диэтиламин) с получением указанных выше обоих диастереомеров (соединение с коротким временем удерживания 71,8 мг (MS(ESI)m/z:450(M+H)+) и соединение с большим временем удерживания 63,8 мг (MS(ESI)m/z:450(M+H)+).
При анализе с использованием CHIRALPAK (Daicel) IF-3 (4,6 мм×150 мм, этанол/тетрагидрофуран/диэтиламин=90/10/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 11,8 мин и 13,5 мин.
[0735]
Пример 53: Синтез (R)-5-{4-[(S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-диона и (S)-5-{4-[(S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-диона
[0736]

[0737]
К 4-(4-фторметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (126 мг), описанной в примере получения 63, добавляли (3,5-диметил-пиридин-2-ил)-(S)-пирролидин-3-иламин λ 2 гидрохлорид (158,5 мг), описанный в примере получения 88, тетрагидрофуран (5 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (115 мг), 1-гидроксибензотриазол (81 мг), триэтиламин (315 мкл) и N,N-диметилформамид (1,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением 5-{4-[(S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-диона (95 мг).
Полученный 5-{4-[(S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-дион (55 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IC (гексан/этанол/диэтиламин) с получением указанных выше обоих диастереомеров (соединение с коротким временем удерживания 13,5 мг (MS(ESI)m/z:426(M+H)+) и соединение с большим временем удерживания 14,1 мг (MS(ESI)m/z:426(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, гексан/этанол/диэтиламин=10/90/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 5,7 мин и 10,1 мин.
[0738]
Пример 54: Синтез (R)-5-{4-[(R)-4-(3,5-диметилпиридин-2-ил)-3-метилпиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0739]

[0740]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (186 мг), описанной в примере получения 45, добавляли (R)-1-(3,5-диметилпиридин-2-ил)-2-метилпиперазин•2 гидрохлорид (198 мг), описанный в примере получения 111, тетрагидрофуран (7 мл), 1-гидроксибензотриазол (144 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (204 мг), триэтиламин (446 мкл) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (220 мг).
MS(ESI)m/z:450(M+H)+
[0741]
Пример 55: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-диона и (S)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-диона
[0742]

[0743]
К 4-(4-фторметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (252 мг), описанной в примере получения 63, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин (230 мг), тетрагидрофуран (10 мл), 1-гидроксибензотриазол (162 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (230 мг), триэтиламин (350 мкл) и N,N-диметилформамид (1,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-диона (288 мг).
Полученный 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-дион (200 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IF (2-пропанол/тетрагидрофуран/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 85 мг (MS(ESI)m/z:426(M+H)+) и соединение с большим временем удерживания 80 мг (MS(ESI)m/z:426(M+H)+).
При анализе с использованием CHIRALPAK (Daicel) IF-3 (4,6 мм×50 мм, 2-пропанол/тетрагидрофуран/диэтиламин=80/20/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 5,5 мин и 8,9 мин.
[0744]
Пример 56: Синтез (R)-5-{4-[(R)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0745]
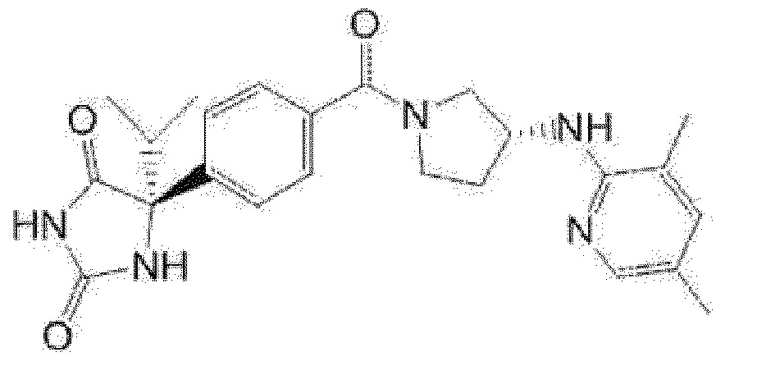
[0746]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (131 мг), описанной в примере получения 45, добавляли (3,5-диметилпиридин-2-ил)-(R)-пирролидин-3-иламин (131 мг), описанный в примере получения 113, тетрагидрофуран (5 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (143 мг), 1-гидроксибензотриазол (101 мг), триэтиламин (174 мкл) и N,N-диметилформамид (0,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения в виде неочищенного продукта. Полученный неочищенный продукт разделяли с помощью ВЭЖХ с использованием Cosmosil Cholester (0,05% трифторуксусная кислота/вода, 0,05% трифторуксусная кислота/ацетонитрил). К полученному раствору добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагировали хлороформом. Растворитель выпаривали с получением указанного в заголовке соединения (103 мг).
MS(ESI)m/z:436(M+H)+
[0747]
Пример 57: Синтез (S)-5-{4-[(S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0748]

[0749]
К 4-((S)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте) (131 мг), описанной в примере получения 114, добавляли (3,5-диметил-пиридин-2-ил)-(S)-пирролидин-3-иламин•2 гидрохлорид (158 мг), описанный в примере получения 88, тетрагидрофуран (5 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (115 мг), 1-гидроксибензотриазол (81 мг), триэтиламин (315 мкл) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (159 мг).
MS(ESI)m/z:436(M+H)+
[0750]
Пример 58: Синтез 5-{4-[(S)-4-(3,5-диметилпиридин-2-ил)-3-метилпиперазин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-диона
[0751]

[0752]
К 4-(4-фторметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (76 мг), описанной в примере получения 63, добавляли (S)-1-(3,5-диметилпиридин-2-ил)-2-метилпиперазин•2 гидрохлорид (116 мг), описанный в примере получения 131, тетрагидрофуран (3 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (75 мг), 1-гидроксибензотриазол (53 мг) и триэтиламин (189 мкл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (65 мг).
MS(ESI)m/z:440(M+H)+
[0753]
Пример 59: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)-2,2-диметилпиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0754]

[0755]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (169 мг), описанной в примере получения 45, добавляли 1-(3,5-диметилпиридин-2-ил)-3,3-диметилпиперазин•2 гидрохлорид (198 мг), описанный в примере получения 116, тетрагидрофуран (6,4 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (160 мг), 1-гидроксибензотриазол (105 мг), триэтиламин (405 мкл) и N,N-диметилформамид (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду, и осадок собирали фильтрованием с получением указанного в заголовке соединения (219 мг).
MS(ESI)m/z:464(M+H)+
[0756]
Пример 60: Синтез (R)-5-{4-[(S)-4-(3,5-диметилпиридин-2-ил)-3-метилпиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0757]

[0758]
К 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (70 мг), описанной в примере получения 6, добавляли (S)-1-(3,5-диметилпиридин-2-ил)-2-метилпиперазин•2 гидрохлорид (83 мг), описанный в примере получения 131, тетрагидрофуран (3 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (75 мг), 1-гидроксибензотриазол (50 мг), триэтиламин (189 мкл) и N,N-диметилформамид (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (30 мг).
MS(ESI)m/z:422(M+H)+
[0759]
Пример 61: Синтез (R)-5-{4-[(R)-4-(3,5-диметилпиридин-2-ил)-2-метилпиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0760]

[0761]
К 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (70 мг), описанной в примере получения 6, добавляли (R)-1-(3,5-диметилпиридин-2-ил)-3-метилпиперазин•2 гидрохлорид (87 мг), описанный в примере получения 118, N,N-диметилформамид (4 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (75 мг), 1-гидроксибензотриазол (53 мг) и триэтиламин (189 мкл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (46 мг).
MS(ESI)m/z:422(M+H)+
[0762]
Пример 62: Синтез (R)-5-фторметил-5-{4-[4-(5-метилпиридин-2-иламино)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона и (S)-5-фторметил-5-{4-[4-(5-метилпиридин-2-иламино)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[0763]

[0764]
К 4-(4-фторметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (76 мг), описанной в примере получения 63, добавляли тетрагидрофуран (3 мл), (5-метилпиридин-2-ил)пиперидин-4-иламин (57 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (75 мг), 1-гидроксибензотриазол (53 мг), триэтиламин (105 мкл) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением 5-фторметил-5-{4-[4-(5-метилпиридин-2-иламино)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона (62,2 мг).
Полученный 5-фторметил-5-{4-[4-(5-метилпиридин-2-иламино)пиперидин-1-карбонил]фенил}имидазолидин-2,4-дион (40 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IC (гексан/2-пропанол/тетрагидрофуран/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 13,5 мг (MS(ESI)m/z:426(M+H)+) и соединение с большим временем удерживания 12,7 мг (MS(ESI)m/z:426(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, гексан/2-пропанол/тетрагидрофуран/диэтиламин=60/20/20/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 6,7 мин и 11,6 мин.
[0765]
Пример 63: Синтез 5-{4-[(R)-4-(3,5-диметилпиридин-2-ил)-2-метилпиперазин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-диона
[0766]

[0767]
К 4-(4-фторметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (76 мг), описанной в примере получения 63, добавляли (R)-1-(3,5-диметилпиридин-2-ил)-3-метилпиперазин (80 мг), описанный в примере получения 119, тетрагидрофуран (3 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (75 мг), 1-гидроксибензотриазол (53 мг) и триэтиламин (210 мкл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (75 мг).
MS(ESI)m/z:440(M+H)+
[0768]
Пример 64: Синтез метилового эфира (S)-4-(3,5-диметилпиридин-2-ил)-1-[4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензоил]пиперазин-2-карбоновой кислоты
[0769]
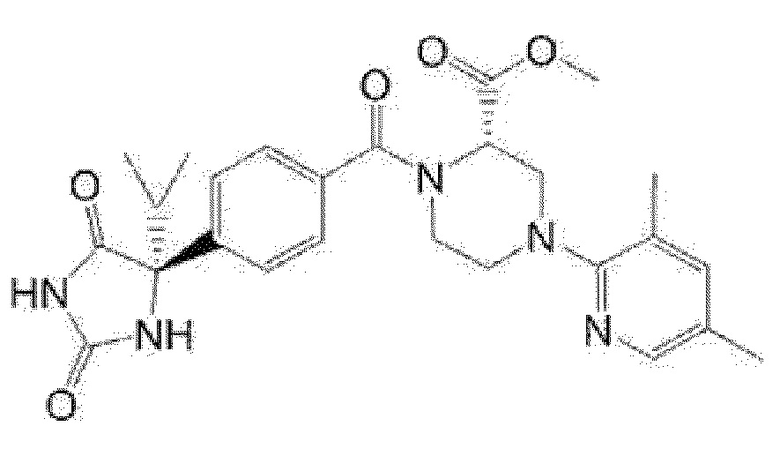
[0770]
К метиловому эфиру (S)-4-(3,5-диметилпиридин-2-ил)пиперазин-2-карбоновой кислоты (620 мг), описанному в примере получения 130, добавляли 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (465 мг), описанную в примере получения 45, тетрагидрофуран (18 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (440 мг), 1-гидроксибензотриазол (310 мг) и триэтиламин (620 мкл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (581 мг).
MS(ESI)m/z:494(M+H)+
[0771]
Пример 65: Синтез (R)-5-{4-[8-(3,5-диметилпиридин-2-ил)-5,8-диазаспиро[3.5]нонан-5-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0772]
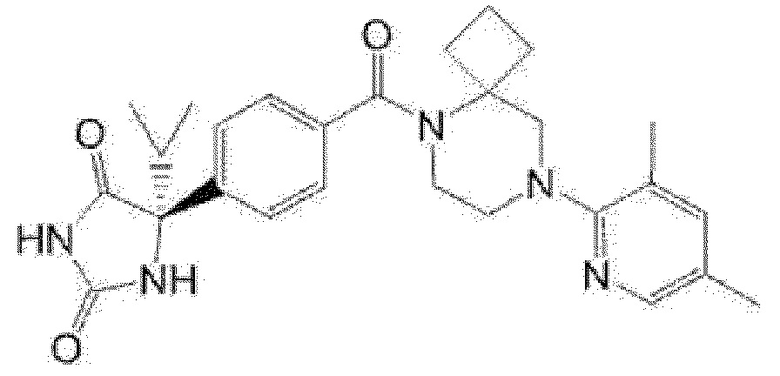
[0773]
К раствору 5,8-диазаспиро[3.5]нонан•2 гидрохлорида (199 мг) и 3,5-диметилпиридин-N-оксида (117 мг) в тетрагидрофуране (4 мл) добавляли N,N-диизопропилэтиламин (980 мкл) и бромтрис(пирролидино)фосфоний гексафторфосфат (606 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли N,N-диизопропилэтиламин (341 мкл), 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (262 мг), описанную в примере получения 45, и бромтрис(пирролидино)фосфоний гексафторфосфат (466 мг) и смесь перемешивали при комнатной температуре в течение 8 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (89,2 мг).
MS(ESI)m/z:476(M+H)+
[0774]
Пример 66: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)-3-метоксиметилпиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0775]
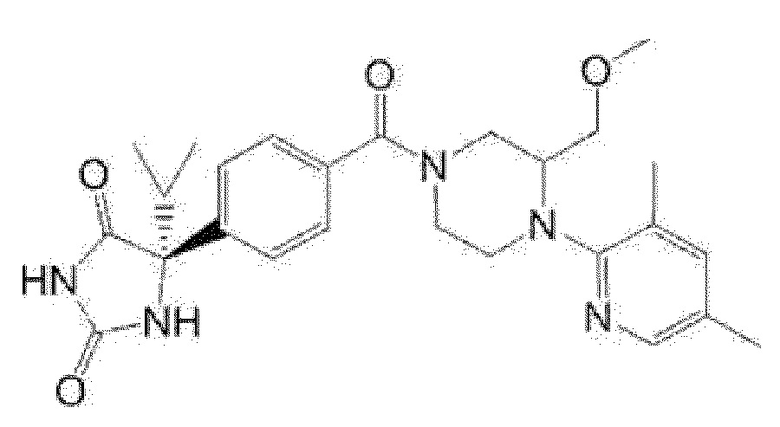
[0776]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (52 мг), описанной в примере получения 45, добавляли 1-(3,5-диметилпиридин-2-ил)-2-метоксиметилпиперазин•2 гидрохлорид (62 мг), описанный в примере получения 121, тетрагидрофуран (2 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (50 мг), 1-гидроксибензотриазол (35 мг) и триэтиламин (126 мкл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (53 мг).
MS(ESI)m/z:480(M+H)+
[0777]
Пример 67: Синтез (R)-5-{4-[(R)-4-(3,5-диметилпиридин-2-ил)-2-этилпиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0778]

[0779]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (131 мг), описанной в примере получения 45, добавляли (R)-1-(3,5-диметилпиридин-2-ил)-3-этилпиперазин (109 мг), описанный в примере получения 122, тетрагидрофуран (5 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (125 мг), 1-гидроксибензотриазол (88 мг) и триэтиламин (178 мкл) и смесь перемешивали при комнатной температуре в течение 5,5 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (132 мг).
MS(ESI)m/z:464(M+H)+
[0780]
Пример 68: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)-2,2-диметилпиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0781]
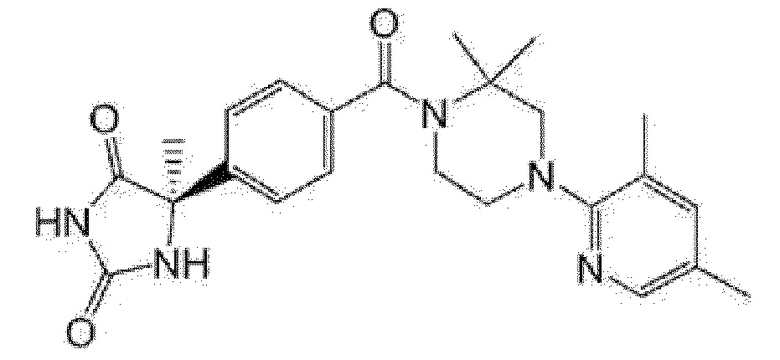
[0782]
К 1-(3,5-диметилпиридин-2-ил)-3,3-диметилпиперазин•2 гидрохлориду (88 мг), описанному в примере получения 116, добавляли тетрагидрофуран (3 мл), 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (70 мг), описанную в примере получения 6, триэтиламин (189 мкл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (75 мг) и 1-гидроксибензотриазол (53 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (87 мг).
MS(ESI)m/z:436(M+H)+
[0783]
Пример 69: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)-2,2-диметилпиперазин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-диона
[0784]

[0785]
К 1-(3,5-диметилпиридин-2-ил)-3,3-диметилпиперазин•2 гидрохлориду (146 мг), описанному в примере получения 116, добавляли тетрагидрофуран (5 мл), 4-(4-фторметил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (126 мг), описанную в примере получения 63, триэтиламин (314 мкл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (125 мг) и 1-гидроксибензотриазол (88 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (112 мг).
MS(ESI)m/z:454(M+H)+
[0786]
Пример 70: Синтез (R)-5-{4-[(S)-4-(3,5-диметилпиридин-2-ил)-2-метоксиметилпиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0787]

[0788]
Трет-бутиловый эфир (S)-4-(3,5-диметилпиридин-2-ил)-2-метоксиметилпиперазин-1-карбоновой кислоты (97 мг), описанный в примере получения 124, растворяли в метилацетате (1,5 мл) и добавляли метанол (1,5 мл) и 4 н раствор хлороводорода/этилацетата (1,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали, к полученному остатку добавляли тетрагидрофуран (3 мл), триэтиламин (182 мкл), 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (76 мг), описанную в примере получения 45, 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (72 мг) и 1-гидроксибензотриазол (51 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (46 мг).
MS(ESI)m/z:480(M+H)+
[0789]
Пример 71: Синтез (R)-5-{4-[8-(3,5-диметилпиридин-2-ил)-5,8-диазаспиро[3.5]нонан-5-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0790]
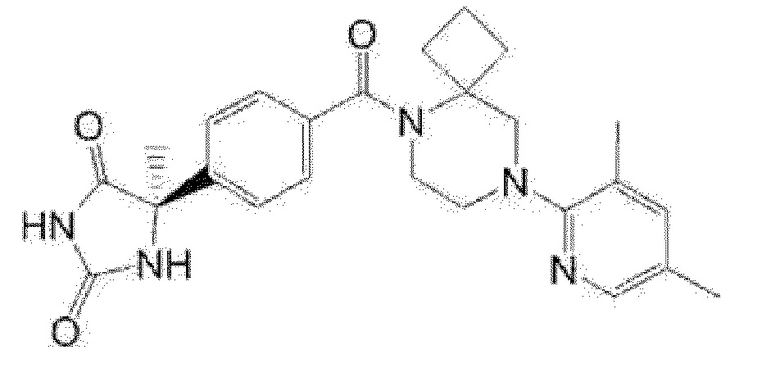
[0791]
К 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (70 мг), описанной в примере получения 6, добавляли тетрагидрофуран (3 мл), 8-(3,5-диметилпиридин-2-ил)-5,8-диазаспиро[3.5]нонан (70 мг), описанный в примере получения 125, 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (75 мг), 1-гидроксибензотриазол (53 мг) и триэтиламин (105 мкл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (76 мг).
MS(ESI)m/z:448(M+H)+
[0792]
Пример 72: Синтез 5-{4-[(S)-4-(3,5-диметилпиридин-2-ил)-2-метилпиперазин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-диона
[0793]

[0794]
К 4-(4-фторметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (76 мг), описанной в примере получения 63, добавляли тетрагидрофуран (3 мл), (S)-1-(3,5-диметилпиридин-2-ил)-3-метилпиперазин (62 мг), описанный в примере получения 126, триэтиламин (105 мкл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (75 мг) и 1-гидроксибензотриазол (53 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (71 мг).
MS(ESI)m/z:440(M+H)+
[0795]
Пример 73: Синтез (R)-5-{4-[(R)-4-(3,5-диметилпиридин-2-ил)-3-гидроксиметилпиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0796]
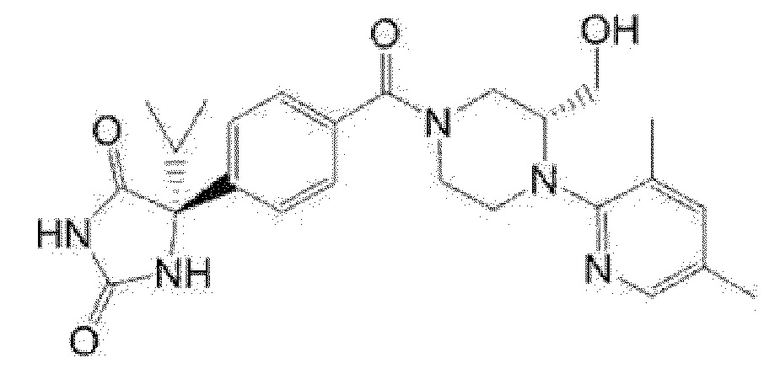
[0797]
К [(R)-1-(3,5-диметилпиридин-2-ил)пиперазин-2-ил]метанолу (110 мг), описанному в примере получения 127, добавляли 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (130 мг), описанную в примере получения 45, тетрагидрофуран (5 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (125 мг), 1-гидроксибензотриазол (90 мг) и триэтиламин (175 мкл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (115 мг).
MS(ESI)m/z:466(M+H)+
[0798]
Пример 74: Синтез (R)-5-{4-[(S)-4-(3,5-диметилпиридин-2-ил)-3-гидроксиметилпиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0799]

[0800]
К [(S)-1-(3,5-диметилпиридин-2-ил)пиперазин-2-ил]метанол•2 гидрохлориду (88 мг), описанному в примере получения 128, добавляли 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (80 мг), описанную в примере получения 45, тетрагидрофуран (3 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (75 мг), 1-гидроксибензотриазол (53 мг) и триэтиламин (188 мкл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (60 мг).
MS(ESI)m/z:466(M+H)+
[0801]
Пример 75: Синтез (R)-5-изопропил-5-{4-[4-(7-метилбензоксазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[0802]

[0803]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (79 мг), описанной в примере получения 45, добавляли 7-метил-2-(пиперидин-4-ил)-1,3-бензоксазол (65 мг), тетрагидрофуран (3 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (86 мг), 1-гидроксибензотриазол (60 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (82 мг).
MS(ESI)m/z:461(M+H)+
[0804]
Пример 76: Синтез (R)-5-метил-5-{4-[4-(5-п-толил[1,3,4]оксадиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[0805]

[0806]
К 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (117 мг), описанной в примере получения 6, добавляли 4-[5-(4-метилфенил)-1,3,4-оксадиазол-2-ил]пиперидин (73 мг), тетрагидрофуран (3 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (75 мг), 1-гидроксибензотриазол (53 мг) и триэтиламин (105 мкл) и смесь перемешивали при комнатной температуре. После завершения реакции, к реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (85,3 мг).
MS(ESI)m/z:460(M+H)+
[0807]
Пример 77: Синтез (R)-5-этил-5-{4-[4-(5-o-толил[1,3,4]оксадиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[0808]

[0809]
К 4-((R)-4-этил-2,5-диоксо-имидазолидин-4-ил)бензойной кислоте (50 мг), описанной в примере получения 14, добавляли 4-[5-(2-метилфенил)-1,3,4-оксадиазол-2-ил]пиперидин (48 мг), тетрагидрофуран (2 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (58 мг), 1-гидроксибензотриазол (40 мг) и триэтиламин (70 мкл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (90 мг).
MS(ESI)m/z:474(M+H)+
[0810]
Пример 78: Синтез 5-фторметил-5-{4-[4-(5-o-толил[1,3,4]оксадиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[0811]
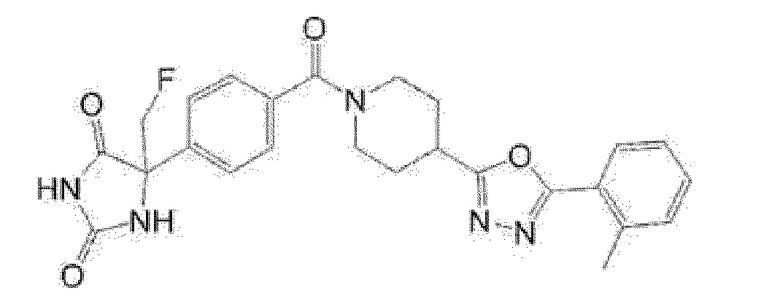
[0812]
Используя 4-[5-(2-метилфенил)-1,3,4-оксадиазол-2-ил]пиперидин (48 мг) и 4-(4-фторметил-2,5-диоксо-имидазолидин-4-ил)бензойную кислоту (46 мг), описанную в примере получения 63, реакции и обработки, аналогичные тем, которые описаны в примере 77, осуществляли с получением указанного в заголовке соединения (67 мг).
MS(ESI)m/z:478(M+H)+
[0813]
Пример 79: Синтез (R)-5-изопропил-5-{4-[4-(5-фенил[1,3,4]оксадиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[0814]

[0815]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (79 мг), описанной в примере получения 45, добавляли 4-(5-фенил-1,3,4-оксадиазол-2-ил)пиперидин (70 мг), тетрагидрофуран (3 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (75 мг), 1-гидроксибензотриазол (53 мг), триэтиламин (105 мкл) и N,N-диметилформамид (0,3 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (85 мг).
MS(ESI)m/z:474(M+H)+
[0816]
Пример 80: Синтез (R)-5-{4-[(S)-4-(3,5-диметилпиридин-2-ил)-3-метилпиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0817]

[0818]
Трет-бутиловый эфир (S)-4-(3,5-диметилпиридин-2-ил)-3-метилпиперазин-1-карбоновой кислоты (140 мг), описанный в примере получения 115, растворяли в этаноле (2,5 мл), добавляли 4 н раствор хлороводорода/этилацетата (2,5 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, добавляли воду и 1 н водный раствор гидроксида натрия, и смесь экстрагировали этилацетатом. Растворитель выпаривали с получением (S)-1-(3,5-диметилпиридин-2-ил)-2-метилпиперазина (103 мг).
К полученному (S)-1-(3,5-диметилпиридин-2-ил)-2-метилпиперазину (103 мг) добавляли 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (128 мг), описанную в примере получения 45, тетрагидрофуран (5 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (115 мг), 1-гидроксибензотриазол (81 мг), триэтиламин (174 мкл) и N,N-диметилформамид (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (97 мг).
MS(ESI)m/z:450(M+H)+
[0819]
Пример 81: Синтез (R)-5-изопропил-5-{4-[4-(5-п-толил[1,3,4]оксадиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[0820]
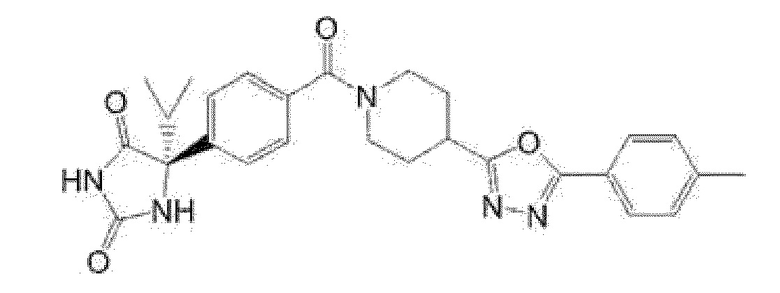
[0821]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензоил хлориду (126 мг), описанному в примере получения 132, добавляли пиридин (1,5 мл), 4-[5-(4-метилфенил)-1,3,4-оксадиазол-2-ил]пиперидин•трифторацетат (102 мг) и смесь перемешивали при 80°C в течение 8 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом и хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (70 мг).
MS(ESI)m/z:488(M+H)+
[0822]
Пример 82: Синтез (R)-5-изопропил-5-{4-[4-(5-o-толил[1,3,4]оксадиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[0823]

[0824]
Используя 4-[5-(2-метилфенил)-1,3,4-оксадиазол-2-ил]пиперидин•трифторацетат (102 мг) и 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензоил хлорид (210 мг), описанный в примере получения 132, реакции и обработки, аналогичные тем, которые описаны в примере 81, осуществляли с получением указанного в заголовке соединения (65 мг).
MS(ESI)m/z:488(M+H)+
[0825]
Пример 83: Синтез (S)-4-(3,5-диметилпиридин-2-ил)-1-[4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензоил]пиперазин-2-карбонитрила
[0826]
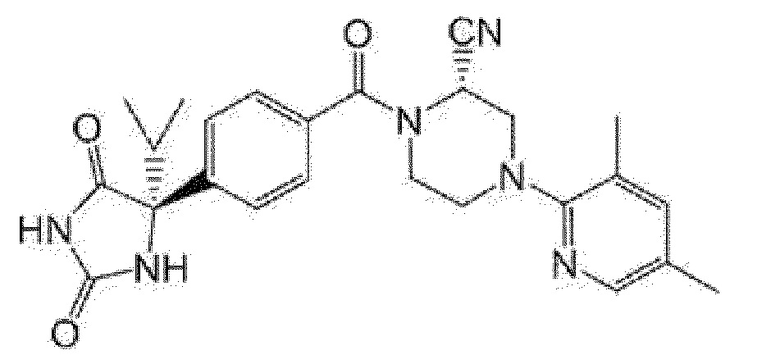
[0827]
Используя трет-бутиловый эфир (S)-2-карбамоил-4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбоновой кислоты (420 мг), описанный в примере получения 133, и 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (328 мг), описанную в примере получения 45, реакции и обработки, аналогичные тем, которые описаны в примере 70, осуществляли с получением (S)-4-(3,5-диметилпиридин-2-ил)-1-[4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензоил]пиперазин-2-карбоновой кислоты амида (390 мг) (MS(ESI)m/z:479(M+H)+).
К раствору полученного (S)-4-(3,5-диметилпиридин-2-ил)-1-[4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензоил]пиперазин-2-карбоновой кислоты амида (300 мг) и триэтиламина (524 мкл) в тетрагидрофуране (3,1 мл) добавляли трифторуксусный ангидрид (260 мкл) при 0°C. Смесь перемешивали при комнатной температуре в течение ночи и добавляли триэтиламин (262 мкл) и трифторуксусный ангидрид (130 мкл), и смесь перемешивали при 0°C в течение 2 часов. К реакционной смеси добавляли карбонат калия (650 мг) и воду (1 мл) и смесь перемешивали при 40°C в течение 0,5 часа. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (этилацетат:гексан) с получением указанного в заголовке соединения (162 мг).
MS(ESI)m/z:461(M+H)+
[0828]
Пример 84: Синтез 5-{4-[4-(2,4-диметилфенил)пиперидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0829]
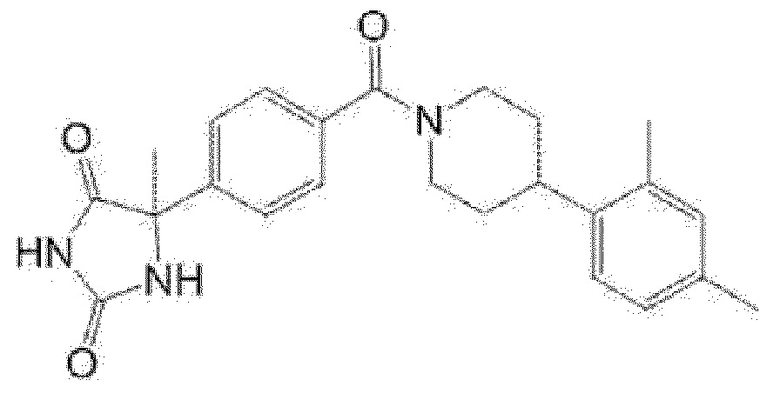
[0830]
К смеси 4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (70 мг), 4-(2,4-диметилфенил)пиперидин•гидрохлорида (68 мг), описанного в примере получения 82, 1-гидроксибензотриазола (49 мг) и хлороформа (2 мл) добавляли триэтиламин (0,050 мл) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (75 мг) и смесь перемешивали при комнатной температуре в течение 2 дней. К реакционной смеси добавляли этилацетат и органический слой промывали насыщенным солевым раствором и сушили над сульфатом натрия. Растворитель выпаривали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (83 мг).
MS(ESI)m/z:406(M+H)+
[0831]
Пример 85: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-метилимидазолидин-2,4-диона
[0832]
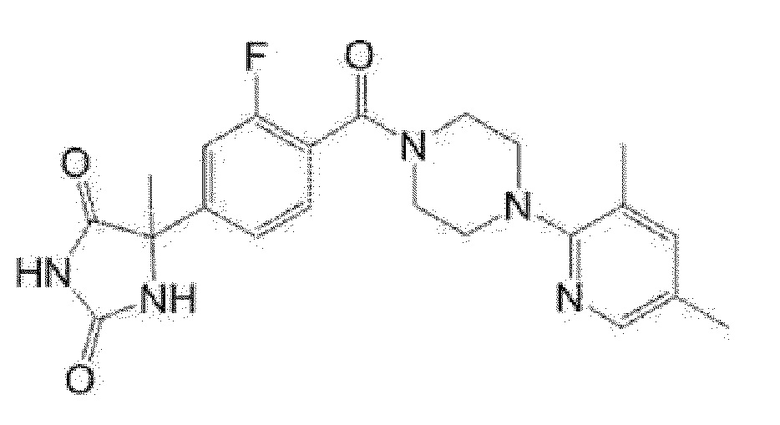
[0833]
К смеси 2-фтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (93 мг), описанной в примере получения 2, 1-(3,5-диметилпиридин-2-ил)пиперазина (70 мг), 1-гидроксибензотриазола (59 мг) и хлороформа (2 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (91 мг) и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) и колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (105,9 мг).
MS(ESI)m/z:426(M+H)+
[0834]
Пример 86: Синтез (S)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метоксиметилимидазолидин-2,4-диона и (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метоксиметилимидазолидин-2,4-диона
[0835]
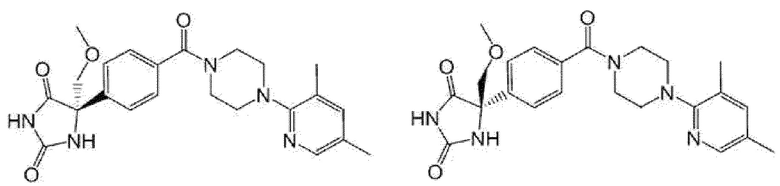
[0836]
К смеси 4-(4-метоксиметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (113 мг), описанной в примере получения 9, 1-(3,5-диметилпиридин-2-ил)пиперазина (90 мг), 1-гидроксибензотриазола (69 мг) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (123 мг) и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) и колоночной хроматографии (хлороформ:метанол) с получением 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метоксиметилимидазолидин-2,4-диона (129 мг).
Полученный 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метоксиметилимидазолидин-2,4-дион (100 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IC (этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 44 мг (MS(ESI)m/z:438(M+H)+) и соединение с большим временем удерживания 44 мг (MS(ESI)m/z:438(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, этанол/диэтиламин=100/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 9,3 мин и 14,8 мин.
[0837]
Пример 87: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-трифторметилимидазолидин-2,4-диона
[0838]

[0839]
К смеси 4-(2,5-диоксо-4-трифторметилимидазолидин-4-ил)бензойной кислоты (123 мг), описанной в примере получения 10, 1-(3,5-диметилпиридин-2-ил)пиперазина (90 мг), 1-гидроксибензотриазола (69 мг) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (123 мг) и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) и колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (83 мг).
MS(ESI)m/z:462(M+H)+
[0840]
Пример 88: Синтез 5-циклопропил-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0841]

[0842]
К смеси 4-(4-циклопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (111 мг), описанной в примере получения 11, 1-(3,5-диметилпиридин-2-ил)пиперазина (90 мг), 1-гидроксибензотриазола (69 мг) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (123 мг) и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) и колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (102 мг).
MS(ESI)m/z:434(M+H)+
[0843]
Пример 89: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-этилимидазолидин-2,4-диона
[0844]
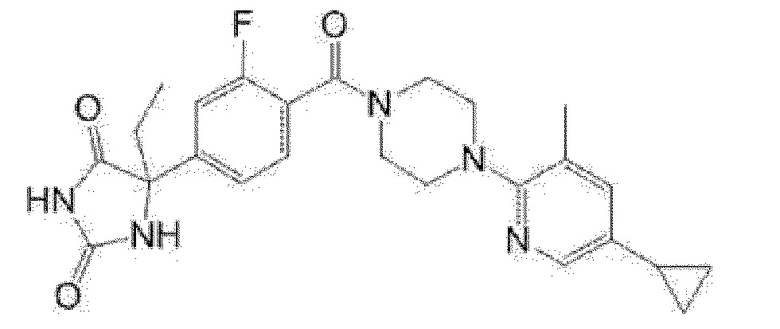
[0845]
К смеси 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-2-фторбензойной кислоты (150 мг), описанной в примере получения 12, 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазина (246 мг), 1-гидроксибензотриазола (114 мг), триэтиламина (0,235 мл) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (216 мг) и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) и колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (115 мг).
MS(ESI)m/z:466(M+H)+
[0846]
Пример 90: Синтез 5-трет-бутил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0847]
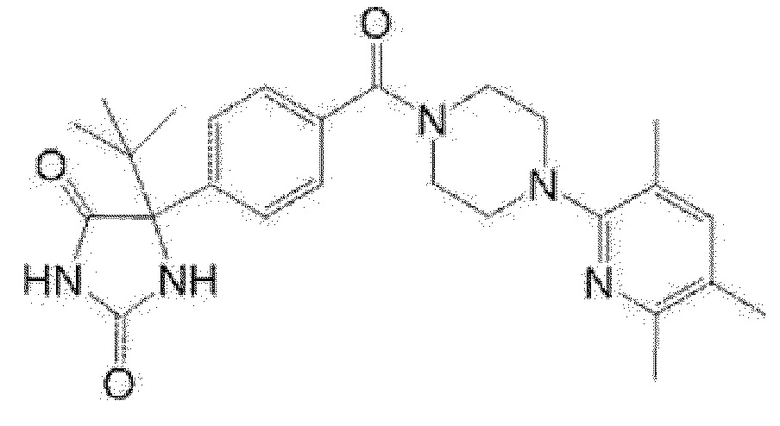
[0848]
К смеси 4-(4-трет-бутил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (120 мг), описанной в примере получения 13, 1-(3,5,6-триметилпиридин-2-ил)пиперазина (134 мг), 1-гидроксибензотриазола (76 мг), триэтиламина (0,121 мл) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (125 мг) и смесь перемешивали при комнатной температуре в течение 2 дней. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над сульфатом натрия, и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) и колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (192 мг).
MS(ESI)m/z:464(M+H)+
[0849]
Пример 91: Синтез 5-трет-бутил-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0850]
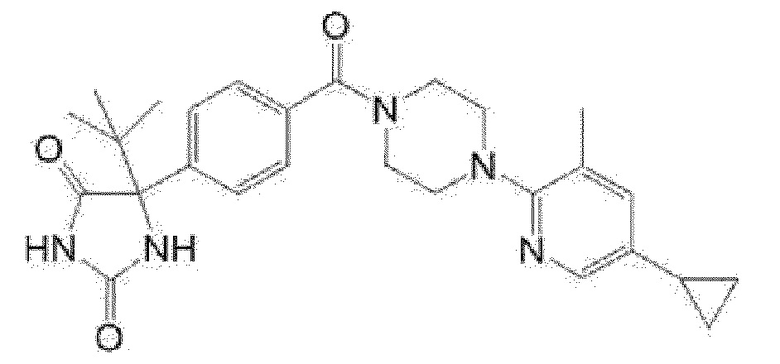
[0851]
Используя 4-(4-трет-бутил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (120 мг), описанную в примере получения 13, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (142 мг), реакции и обработки, аналогичные тем, которые описаны в примере 90, осуществляли с получением указанного в заголовке соединения (160 мг).
MS(ESI)m/z:476(M+H)+
[0852]
Пример 92: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-гидроксиметилимидазолидин-2,4-диона
[0853]

[0854]
К смеси 4-(4-гидроксиметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (125 мг), описанной в примере получения 23, 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорида (228 мг), 1-гидроксибензотриазола (101 мг), триэтиламина (0,279 мл), хлороформа (3 мл) и N,N-диметилформамида (1 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (153 мг) и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (89 мг).
MS(ESI)m/z:424(M+H)+
[0855]
Пример 93: Синтез 5-этил-5-{3-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0856]

[0857]
Используя 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-2-фторбензойную кислоту (150 мг), описанную в примере получения 12, и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (232 мг), реакции и обработки, аналогичные тем, которые описаны в примере 89, осуществляли с получением указанного в заголовке соединения (183 мг).
MS(ESI)m/z:454(M+H)+
[0858]
Пример 94: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-этилимидазолидин-2,4-диона
[0859]
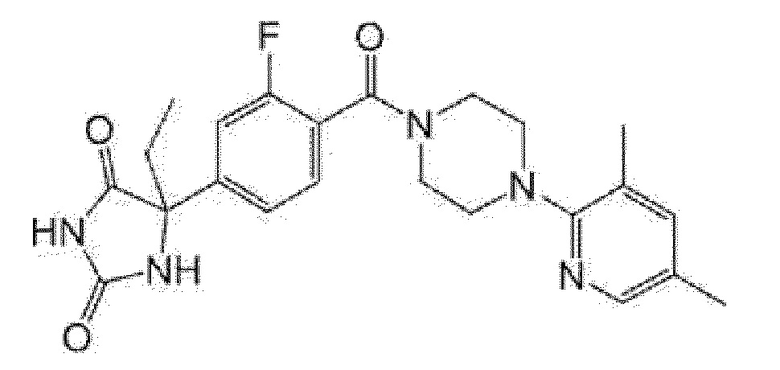
[0860]
Используя 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-2-фторбензойную кислоту (150 мг), описанную в примере получения 12, и 1-(3,5-диметилпиридин-2-ил)пиперазин (215 мг), реакции и обработки, аналогичные тем, которые описаны в примере 89, осуществляли с получением указанного в заголовке соединения (103 мг).
MS(ESI)m/z:440(M+H)+
[0861]
Пример 95: Синтез 5-трет-бутил-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0862]
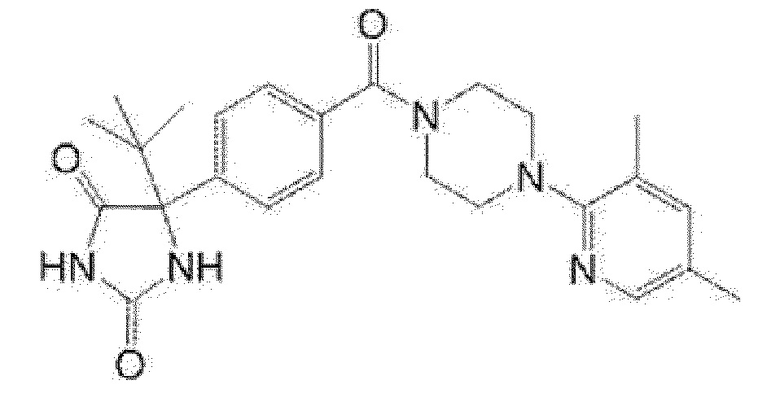
[0863]
К смеси 4-(4-трет-бутил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (120 мг), описанной в примере получения 13, 1-(3,5-диметилпиридин-2-ил)пиперазина (125 мг), 1-гидроксибензотриазола (76 мг), триэтиламина (0,121 мл) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (125 мг) и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь очищали при помощи колоночной хроматографии (хлороформ:метанол) и колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (123 мг).
MS(ESI)m/z:450(M+H)+
[0864]
Пример 96: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-(1-метокси-1-метилэтил)имидазолидин-2,4-диона
[0865]

[0866]
К смеси 4-[4-(1-метокси-1-метилэтил)-2,5-диоксоимидазолидин-4-ил]бензойной кислоты (99 мг), описанной в примере получения 25, 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорида (116 мг), 1-гидроксибензотриазола (60 мг), триэтиламина (0,142 мл) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (97 мг) и смесь перемешивали при комнатной температуре в течение 3 часов. Реакционную смесь очищали при помощи колоночной хроматографии (хлороформ:метанол) и колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (133 мг).
MS(ESI)m/z:466(M+H)+
[0867]
Пример 97: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-этоксиметилимидазолидин-2,4-диона
[0868]

[0869]
К 4-(4-этоксиметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (150 мг), описанной в примере получения 24, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (160 мг), 1-гидроксибензотриазол (87 мг), триэтиламин (0,225 мл), хлороформ (3 мл) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (155 мг) и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь очищали при помощи колоночной хроматографии (хлороформ:метанол) и колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (218 мг).
MS(ESI)m/z:452(M+H)+
[0870]
Пример 98: Синтез 5-этоксиметил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0871]

[0872]
К смеси 4-(4-этоксиметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (150 мг), описанной в примере получения 24, 1-(3,5,6-триметилпиридин-2-ил)пиперазина (144 мг), 1-гидроксибензотриазола (87 мг), триэтиламина (0,151 мл) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (155 мг) и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) и колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (197 мг).
MS(ESI)m/z:466(M+H)+
[0873]
Пример 99: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-этоксиметилимидазолидин-2,4-диона
[0874]
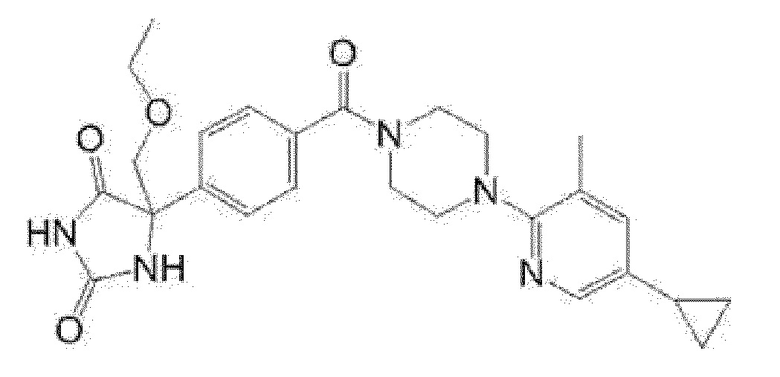
[0875]
Используя 4-(4-этоксиметил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (150 мг), описанную в примере получения 24, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (152 мг), реакции и обработки, аналогичные тем, которые описаны в примере 98, осуществляли с получением указанного в заголовке соединения (207 мг).
MS(ESI)m/z:478(M+H)+
[0876]
Пример 100: Синтез 5-трифторметил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0877]

[0878]
К смеси 4-(2,5-диоксо-4-трифторметилимидазолидин-4-ил)бензойной кислоты (150 мг), описанной в примере получения 10, 1-(3,5,6-триметилпиридин-2-ил)пиперазина (128 мг), 1-гидроксибензотриазола (84 мг), триэтиламина (0,145 мл) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (150 мг) и смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь очищали при помощи колоночной хроматографии (хлороформ:метанол) и колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (72 мг).
MS(ESI)m/z:476(M+H)+
[0879]
Пример 101: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-трифторметилимидазолидин-2,4-диона
[0880]
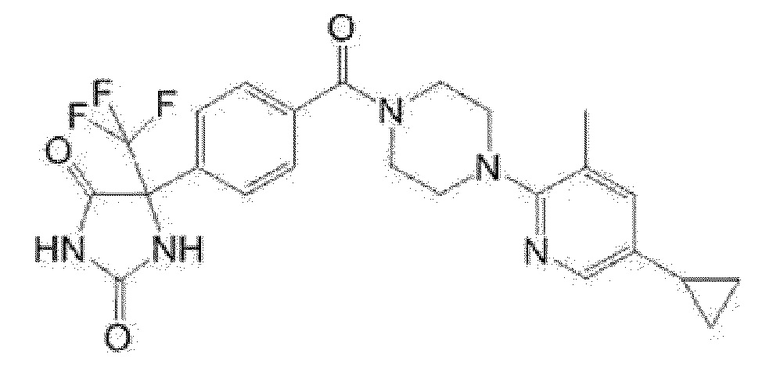
[0881]
Используя 4-(2,5-диоксо-4-трифторметилимидазолидин-4-ил)бензойную кислоту (150 мг), описанную в примере получения 10, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (136 мг), реакции и обработки, аналогичные тем, которые описаны в примере 100, осуществляли с получением указанного в заголовке соединения (89 мг).
MS(ESI)m/z:488(M+H)+
[0882]
Пример 102: Синтез 5-метоксиметил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0883]

[0884]
К смеси 4-(4-метоксиметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (145 мг), описанной в примере получения 9, 1-(3,5,6-триметилпиридин-2-ил)пиперазина (140 мг), 1-гидроксибензотриазола (92 мг), триэтиламина (0,158 мл) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (163 мг) и смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь очищали при помощи колоночной хроматографии (хлороформ:метанол) и колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (149 мг).
MS(ESI)m/z:452(M+H)+
[0885]
Пример 103: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метоксиметилимидазолидин-2,4-диона
[0886]

[0887]
Используя 4-(4-метоксиметил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (145 мг), описанную в примере получения 9, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (148 мг), реакции и обработки, аналогичные тем, которые описаны в примере 102, осуществляли с получением указанного в заголовке соединения (148 мг).
MS(ESI)m/z:464(M+H)+
[0888]
Пример 104: Синтез 5-циклопропил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0889]

[0890]
К смеси 4-(4-циклопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (130 мг), описанной в примере получения 11, 1-(3,5,6-триметилпиридин-2-ил)пиперазина (123 мг), 1-гидроксибензотриазола (81 мг), триэтиламина (0,139 мл) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (144 мг) и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь очищали при помощи колоночной хроматографии (хлороформ:метанол) и колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (167 мг).
MS(ESI)m/z:448(M+H)+
[0891]
Пример 105: Синтез 5-циклопропил-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0892]

[0893]
Используя 4-(4-циклопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (130 мг), описанную в примере получения 11, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (130 мг), реакции и обработки, аналогичные тем, которые описаны в примере 104, осуществляли с получением указанного в заголовке соединения (168 мг).
MS(ESI)m/z:460(M+H)+
[0894]
Пример 106: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-фенилимидазолидин-2,4-диона
[0895]

[0896]
К смеси 4-(2,5-диоксо-4-фенилимидазолидин-4-ил)бензойной кислоты (150 мг), описанной в примере получения 37, 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазина (121 мг), 1-гидроксибензотриазола (82 мг), триэтиламина (0,155 мл) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (146 мг) и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь очищали при помощи колоночной хроматографии (хлороформ:метанол) и колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (71 мг).
MS(ESI)m/z:496(M+H)+
[0897]
Пример 107: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-фенилимидазолидин-2,4-диона
[0898]

[0899]
К смеси 4-(2,5-диоксо-4-фенилимидазолидин-4-ил)бензойной кислоты (150 мг), описанной в примере получения 37, 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорида (127 мг), 1-гидроксибензотриазола (82 мг), триэтиламина (0,232 мл) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (146 мг) и смесь перемешивали при комнатной температуре в течение 2 дней. Реакционную смесь очищали при помощи колоночной хроматографии на силикагеле с NH-покрытием (хлороформ:метанол) и колоночной хроматографии на силикагеле (хлороформ:метанол) с получением указанного в заголовке соединения (63 мг).
MS(ESI)m/z:470(M+H)+
[0900]
Пример 108: Синтез 5-фенил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0901]

[0902]
Используя 4-(2,5-диоксо-4-фенилимидазолидин-4-ил)бензойную кислоту (150 мг), описанную в примере получения 37, и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (114 мг), реакции и обработки, аналогичные тем, которые описаны в примере 106, осуществляли с получением указанного в заголовке соединения (58 мг).
MS(ESI)m/z:484(M+H)+
[0903]
Пример 109: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-(2-метокси-1,1-диметилэтил)имидазолидин-2,4-диона
[0904]
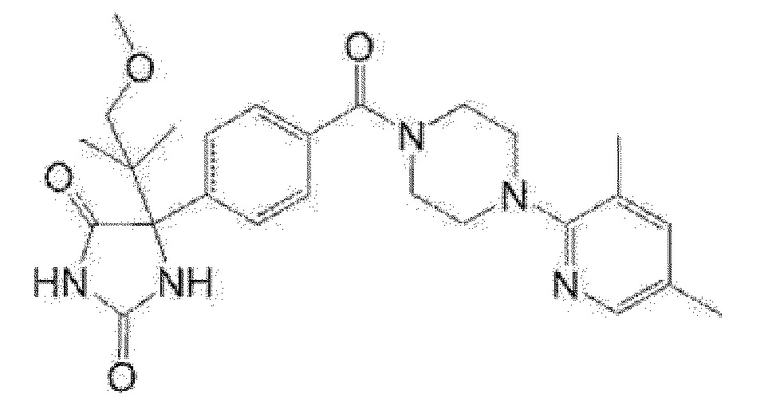
[0905]
К смеси 4-[4-(2-метокси-1,1-диметилэтил)-2,5-диоксоимидазолидин-4-ил]бензойной кислоты (120 мг), описанной в примере получения 38, 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорида (107 мг), 1-гидроксибензотриазола (64 мг), триэтиламина (0,164 мл) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (90 мг) и смесь перемешивали при комнатной температуре 4 дня. Реакционную смесь очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) и колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (153 мг).
MS(ESI)m/z:480(M+H)+
[0906]
Пример 110: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-(2-метокси-1,1-диметилэтил)имидазолидин-2,4-диона
[0907]

[0908]
К смеси 4-[4-(2-метокси-1,1-диметилэтил)-2,5-диоксоимидазолидин-4-ил]бензойной кислоты (120 мг), описанной в примере получения 38, 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазина (102 мг), 1-гидроксибензотриазола (64 мг), триэтиламина (0,109 мл) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (90 мг) и смесь перемешивали при комнатной температуре в течение 4 дней. Реакционную смесь очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) и колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (162 мг).
MS(ESI)m/z:506(M+H)+
[0909]
Пример 111: Синтез 5-(2-метокси-1,1-диметилэтил)-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0910]

[0911]
Используя 4-[4-(2-метокси-1,1-диметилэтил)-2,5-диоксоимидазолидин-4-ил]бензойную кислоту (120 мг), описанную в примере получения 38, и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (97 мг), реакции и обработки, аналогичные тем, которые описаны в примере 110, осуществляли с получением указанного в заголовке соединения (167 мг).
MS(ESI)m/z:494(M+H)+
[0912]
Пример 112: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-(1-метоксициклопропил)имидазолидин-2,4-диона
[0913]

[0914]
К смеси 4-[4-(1-метоксициклопропил)-2,5-диоксоимидазолидин-4-ил]бензойной кислоты (80 мг), описанной в примере получения 44, 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорида (75 мг), 1-гидроксибензотриазола (45 мг), триэтиламина (58 мг) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (64 мг) и смесь перемешивали при комнатной температуре в течение 18 часов. Реакционную смесь очищали при помощи колоночной хроматографии и колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (92 мг).
MS(ESI)m/z:464(M+H)+
[0915]
Пример 113: Синтез 5-трет-бутил-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метоксифенил}имидазолидин-2,4-диона
[0916]
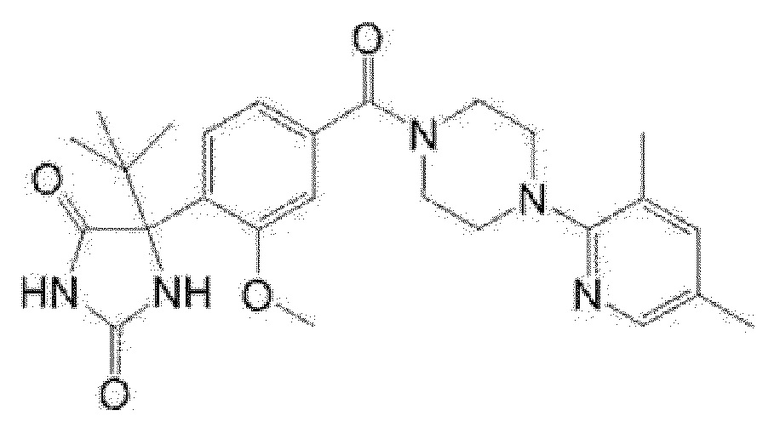
[0917]
К смеси 4-(4-трет-бутил-2,5-диоксоимидазолидин-4-ил)-3-метоксибензойной кислоты (100 мг), описанной в примере получения 61, 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорида (149 мг), 1-гидроксибензотриазола (90,3 мг), диизопропилэтиламина (0,142 мл) и хлороформа (3 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (125 мг) и смесь перемешивали при комнатной температуре в течение 20 часов. Реакционную смесь очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) и колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (94,6 мг).
MS(ESI)m/z:480(M+H)+
[0918]
Пример 114: Синтез 5-{5-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]тиофен-2-ил}-5-изопропилимидазолидин-2,4-диона
[0919]
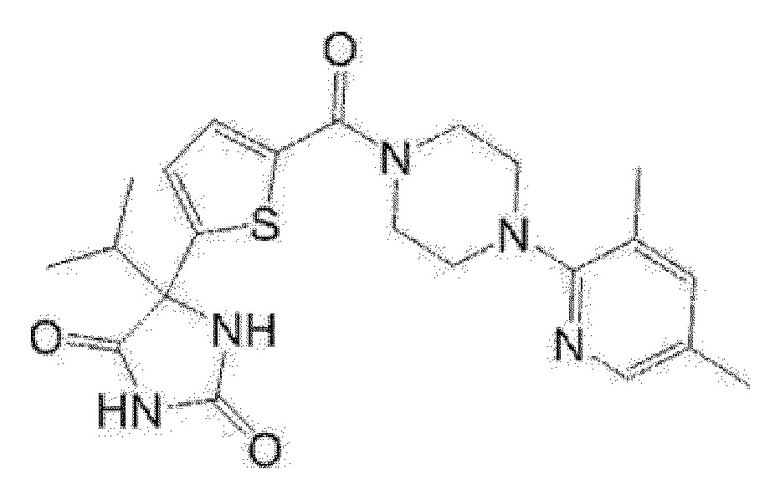
[0920]
К смеси 5-(4-изопропил-2,5-диоксоимидазолидин-4-ил)тиофен-2-карбоновой кислоты (50 мг), описанной в примере получения 66, 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорида (50,9 мг), 1-гидроксибензотриазола (30 мг), триэтиламина (0,052 мл) и хлороформа (1,5 мл) добавляли 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (50 мг) и смесь перемешивали при комнатной температуре в течение 24 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. К полученному остатку добавляли гексан/этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (63,5 мг).
MS(ESI)m/z:442(M+H)+, 440(M-H)-
[0921]
Пример 115: Синтез 5-{4-[4-(2,4-диметилфенил)пиперазин-1-карбонил]-3-фторфенил}-5-метилимидазолидин-2,4-диона
[0922]
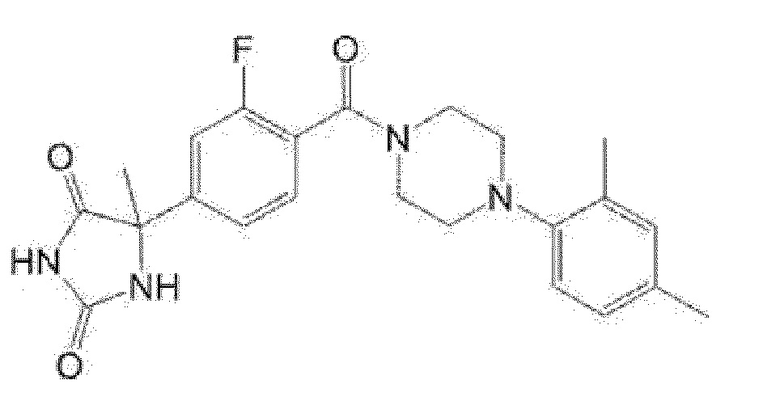
[0923]
К раствору 1-(2,4-диметилфенил)пиперазина (114 мг) в N,N-диметилформамиде (4 мл) добавляли 2-фтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (126 мг), описанную в примере получения 2, 1-гидроксибензотриазол (67 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (170 мг) и диизопропилэтиламин (0,2 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (198 мг).
MS(ESI)m/z:425(M+H)+
[0924]
Пример 116: Синтез 5-{4-[4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-метилимидазолидин-2,4-диона
[0925]
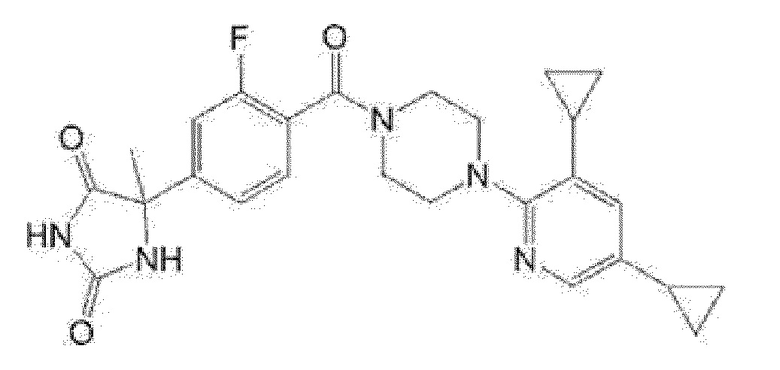
[0926]
Используя 2-фтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (126 мг), описанную в примере получения 2, и 1-(3,5-дициклопропилпиридин-2-ил)пиперазин•2 гидрохлорид (189 мг), описанный в примере получения 147, реакции и обработки, аналогичные тем, которые описаны в примере 115, осуществляли с получением указанного в заголовке соединения (183 мг).
MS(ESI)m/z:478(M+H)+
[0927]
Пример 117: Синтез (R)-5-{3-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона и (S)-5-{3-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[0928]

[0929]
Используя 2-фтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (126 мг), описанную в примере получения 2, и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (123 мг), реакции и обработки, аналогичные тем, которые описаны в примере 115, осуществляли с получением 5-{3-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона (183 мг).
Полученный 5-{3-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-дион (120 мг) разделяли с помощью колонки среднего давления с использованием CHIRALFLASH (Daicel) IA (гексан/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 52 мг (MS(ESI)m/z:440(M+H)+) и соединение с большим временем удерживания 51 мг (MS(ESI)m/z:440(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IA-3 (4,6 мм×150 мм, гексан/этанол/диэтиламин=10/90/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 5,5 мин и 7,7 мин.
[0930]
Пример 118: Синтез (R)-5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-метилимидазолидин-2,4-диона и (S)-5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-метилимидазолидин-2,4-диона
[0931]

[0932]
Используя 2-фтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (126 мг), описанную в примере получения 2, и 1-(5-этил-3-метилпиридин-2-ил)пиперазин (123 мг), реакции и обработки, аналогичные тем, которые описаны в примере 115, осуществляли с получением 5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-метилимидазолидин-2,4-диона (207 мг).
Полученный 5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-метилимидазолидин-2,4-дион (132 мг) разделяли с помощью колонки среднего давления с использованием CHIRALFLASH (Daicel) IA (гексан/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 38,7 мг (MS(ESI)m/z:440(M+H)+) и соединение с большим временем удерживания 12,7 мг (MS(ESI)m/z:440(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IA-3 (4,6 мм×150 мм, этанол/диэтиламин=100/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 6,3 мин и 12,4 мин.
[0933]
Пример 119: Синтез (R)-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-метилимидазолидин-2,4-диона и (S)-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-метилимидазолидин-2,4-диона
[0934]

[0935]
Используя 2-фтор-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (126 мг), описанную в примере получения 2, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (130 мг), реакции и обработки, аналогичные тем, которые описаны в примере 115, осуществляли с получением 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-метилимидазолидин-2,4-диона (158 мг).
Полученный 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-метилимидазолидин-2,4-дион (106 мг) разделяли с помощью колонки среднего давления с использованием CHIRALFLASH (Daicel) IA (гексан/этанол/диэтиламин=10/90/0,1) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 30,8 мг (MS(ESI)m/z:452(M+H)+) и соединение с большим временем удерживания 31,5 мг (MS(ESI)m/z:452(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IA-3 (4,6 мм×150 мм, этанол/диэтиламин=100/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 10,4 мин и 18,3 мин.
[0936]
Пример 120: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-изопропилимидазолидин-2,4-диона
[0937]

[0938]
К 2-фтор-4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (83 мг), описанной в примере получения 15, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин (68 мг), N,N-диметилформамид (5 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (80 мг), 1-гидроксибензотриазол (40 мг) и диизопропилэтиламин (0,08 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (128 мг).
MS(ESI)m/z:454(M+H)+
[0939]
Пример 121: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-(3,3,3-трифторпропил)имидазолидин-2,4-диона
[0940]

[0941]
К 4-[2,5-диоксо-4-(3,3,3-трифторпропил)имидазолидин-4-ил]бензойной кислоте (100 мг), описанной в примере получения 31, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (86 мг), N,N-диметилформамид (3 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (90 мг), 1-гидроксибензотриазол (43 мг) и диизопропилэтиламин (0,13 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (49,3 мг).
MS(ESI)m/z:490(M+H)+
[0942]
Пример 122: Синтез 5-{3-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[0943]

[0944]
К 2-фтор-4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (47 мг), описанной в примере получения 15, добавляли 1-(3,5,6-триметилпиридин-2-ил)пиперазин (42 мг), N,N-диметилформамид (3 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (48 мг), 1-гидроксибензотриазол (22 мг) и диизопропилэтиламин (0,06 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (46,6 мг).
MS(ESI)m/z:468(M+H)+
[0945]
Пример 123: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-изопропилимидазолидин-2,4-диона
[0946]
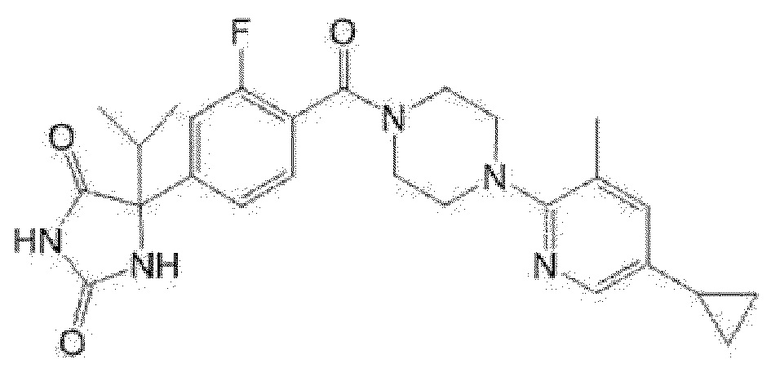
[0947]
Используя 2-фтор-4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (51 мг), описанную в примере получения 15, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (47 мг), реакции и обработки, аналогичные тем, которые описаны в примере 122, осуществляли с получением указанного в заголовке соединения (51,3 мг).
MS(ESI)m/z:480(M+H)+
[0948]
Пример 124: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-диона
[0949]

[0950]
4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (250 мг), описанную в примере получения 14, 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (270 мг), 1-гидроксибензотриазол (135 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (280 мг) и диизопропилэтиламин (0,4 мл) растворяли в N,N-диметилформамиде (10 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (367 мг).
MS(ESI)m/z:422(M+H)+
[0951]
Пример 125: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-метилимидазолидин-2,4-диона и (S)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-метилимидазолидин-2,4-диона
[0952]
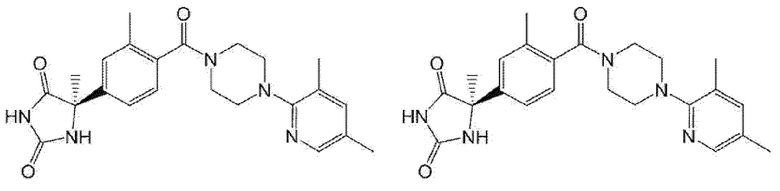
[0953]
К 2-метил-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (150 мг), описанной в примере получения 8, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин (127 мг), 1-гидроксибензотриазол (98 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (150 мг), хлороформ (2 мл) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду, смесь экстрагировали этилацетатом, и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-метилимидазолидин-2,4-диона (191 мг).
Полученный 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-метилимидазолидин-2,4-дион (100 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IC (этанол/диэтиламин=100/0,1) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 49 мг (MS(ESI)m/z:422(M+H)+)) и соединение с большим временем удерживания 50 мг (MS(ESI)m/z:422(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, этанол/диэтиламин=100/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 7,3 мин и 11,0 мин.
[0954]
Пример 126: Синтез 5-метил-5-{3-метил-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0955]

[0956]
К 2-метил-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (50 мг), описанной в примере получения 8, добавляли 1-(3,5,6-триметилпиридин-2-ил)пиперазин (45,5 мг), 1-гидроксибензотриазол (33 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (50 мг), хлороформ (1,5 мл) и N,N-диметилформамид (0,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом, и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат:метанол). Растворитель выпаривали и к полученному остатку добавляли гексан/этилацетат. Осадок собирали фильтрованием с получением указанного в заголовке соединения (48,6 мг).
MS(ESI)m/z:436(M+H)+
[0957]
Пример 127: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-метилимидазолидин-2,4-диона
[0958]

[0959]
Используя 2-метил-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (50 мг), описанную в примере получения 8, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (48,1 мг), реакции и обработки, аналогичные тем, которые описаны в примере 126, осуществляли с получением указанного в заголовке соединения (56,4 мг).
MS(ESI)m/z:448(M+H)+
[0960]
Пример 128: Синтез 5-{4-[4-(5-этил-3-метил-пиридин-2-ил)-пиперазин-1-карбонил]-3-метил-фенил}-5-метил-имидазолидин-2,4-диона
[0961]
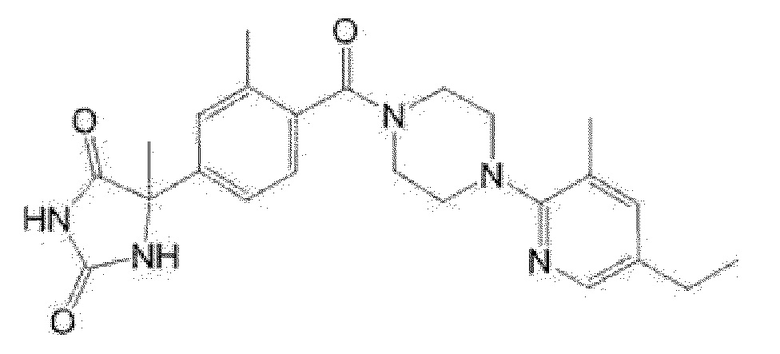
[0962]
Используя 2-метил-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (50 мг), описанную в примере получения 8, и 1-(5-этил-3-метилпиридин-2-ил)пиперазин (45,5 мг), реакции и обработки, аналогичные тем, которые описаны в примере 126, осуществляли с получением указанного в заголовке соединения (61,7 мг).
MS(ESI)m/z:436(M+H)+
[0963]
Пример 129: Синтез 5-{4-[4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбонил]-3-метилфенил}-5-метилимидазолидин-2,4-диона
[0964]
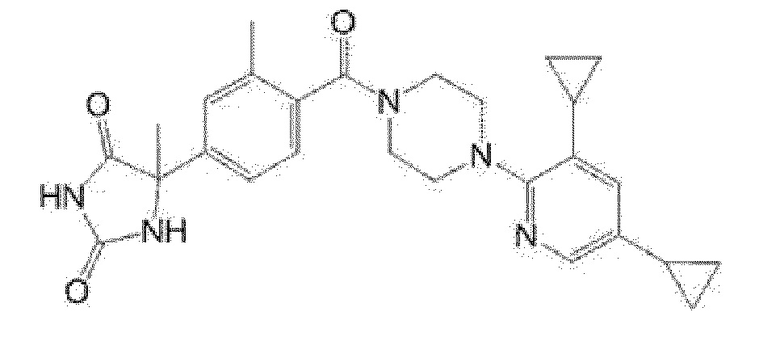
[0965]
К 2-метил-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (50 мг), описанной в примере получения 8, добавляли 1-(3,5-дициклопропилпиридин-2-ил)пиперазин•2 гидрохлорид (70 мг), описанный в примере получения 147, 1-гидроксибензотриазол (33 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (50 мг), N,N-диметилформамид (0,5 мл) и триэтиламин (59 мкл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду, смесь экстрагировали этилацетатом, и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат:метанол). Растворитель выпаривали и к полученному остатку добавляли гексан/этилацетат. Осадок собирали фильтрованием с получением указанного в заголовке соединения (45,4 мг).
MS(ESI)m/z:474(M+H)+
[0966]
Пример 130: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изобутилимидазолидин-2,4-диона
[0967]

[0968]
К 4-(4-изобутил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (80 мг), описанной в примере получения 27, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин (61 мг), 1-гидроксибензотриазол (47 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (72 мг), хлороформ (2,5 мл) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду, смесь экстрагировали этилацетатом и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат:метанол). Растворитель выпаривали и к полученному остатку добавляли гексан/этилацетат. Осадок собирали фильтрованием с получением указанного в заголовке соединения (94 мг).
MS(ESI)m/z:450(M+H)+
[0969]
Пример 131: Синтез 5-изобутил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0970]
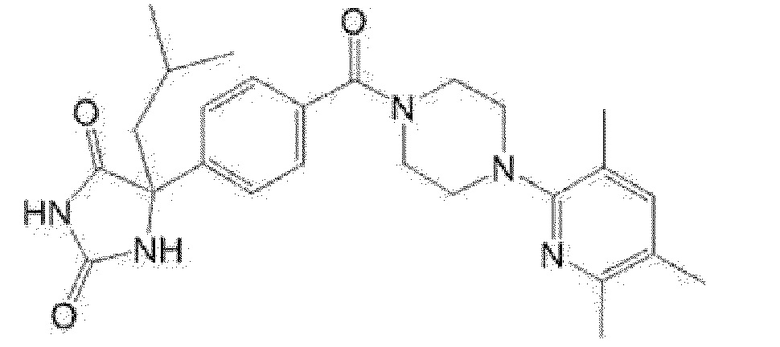
[0971]
Используя 4-(4-изобутил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (80 мг), описанную в примере получения 27, и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (89 мг), реакции и обработки, аналогичные тем, которые описаны в примере 130, осуществляли с получением указанного в заголовке соединения (73 мг).
MS(ESI)m/z:464(M+H)+
[0972]
Пример 132: Синтез 5-{4-[4-(2,4-диметилфенил)пиперазин-1-карбонил]фенил}-5-изобутилимидазолидин-2,4-диона
[0973]

[0974]
К 4-(4-изобутил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (80 мг), описанной в примере получения 27, добавляли 1-(2,4-диметилфенил)пиперазин (61 мг), 1-гидроксибензотриазол (47 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (72 мг) и хлороформ (2,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду, смесь экстрагировали этилацетатом и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (80 мг).
MS(ESI)m/z:449(M+H)+
[0975]
Пример 133: Синтез 5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изобутилимидазолидин-2,4-диона
[0976]

[0977]
К 4-(4-изобутил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (80 мг), описанной в примере получения 27, добавляли 1-(5-этил-3-метилпиридин-2-ил)пиперазин (65 мг), 1-гидроксибензотриазол (47 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (72 мг), хлороформ (2,5 мл) и N,N-диметилформамид (0,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду, смесь экстрагировали этилацетатом и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат:метанол). Растворитель выпаривали и к полученному остатку добавляли гексан/этилацетат. Осадок собирали фильтрованием с получением указанного в заголовке соединения (95,8 мг).
MS(ESI)m/z:464(M+H)+
[0978]
Пример 134: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изобутилимидазолидин-2,4-диона
[0979]
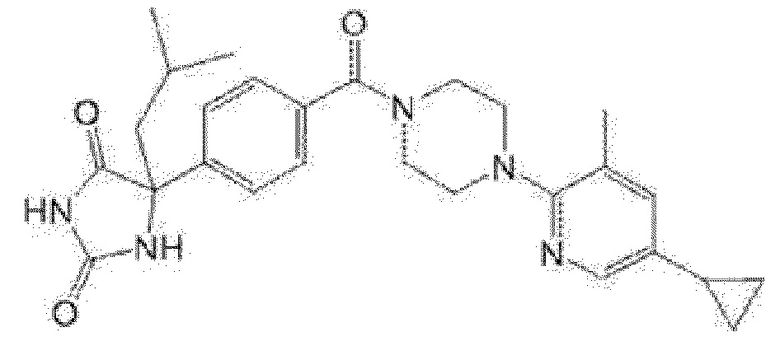
[0980]
Используя 4-(4-изобутил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (80 мг), описанную в примере получения 27, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (69 мг), реакции и обработки, аналогичные тем, которые описаны в примере 133, осуществляли с получением указанного в заголовке соединения (101 мг).
MS(ESI)m/z:476(M+H)+
[0981]
Пример 135: Синтез 5-{4-[4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изобутилимидазолидин-2,4-диона
[0982]
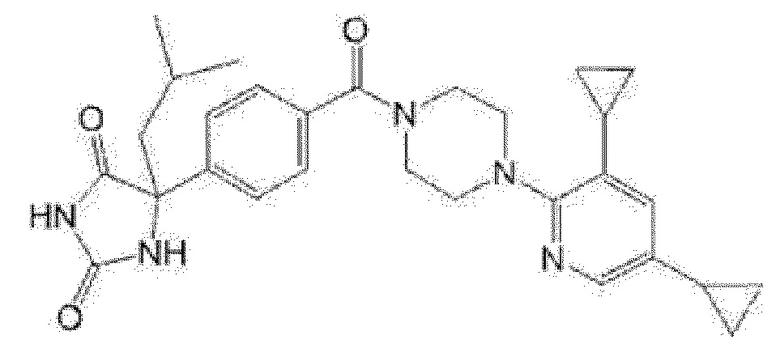
[0983]
Используя 4-(4-изобутил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (80 мг), описанную в примере получения 27, и 1-(3,5-дициклопропилпиридин-2-ил)пиперазин•2 гидрохлорид (101 мг), описанный в примере получения 147, реакции и обработки, аналогичные тем, которые описаны в примере 132, осуществляли с получением указанного в заголовке соединения (94,6 мг).
MS(ESI)m/z:502(M+H)+
[0984]
Пример 136: Синтез 5-[4-(3',5'-диметил-2,3,5,6- тетрагидро[1,2']бипиразинил-4-карбонил)фенил]-5-изопропилимидазолидин-2,4-диона
[0985]

[0986]
К 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (50 мг), описанной в примере получения 5, добавляли 3,5-диметил-3,4,5,6-тетрагидро-2H-[1,2']бипиразинил (40 мг), описанный в примере получения 83, 1-гидроксибензотриазол (31 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (48 мг), хлороформ (3 мл) и N,N-диметилформамид (0,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду, смесь экстрагировали хлороформом и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол). Растворитель выпаривали и к полученному остатку добавляли гексан/этилацетат. Осадок собирали фильтрованием с получением указанного в заголовке соединения (46 мг).
MS(ESI)m/z:437(M+H)+
[0987]
Пример 137: Синтез 5-трет-бутил-5-[4-(3',5'-диметил-2,3,5,6-тетрагидро[1,2']бипиразинил-4-карбонил)фенил]имидазолидин-2,4-диона
[0988]
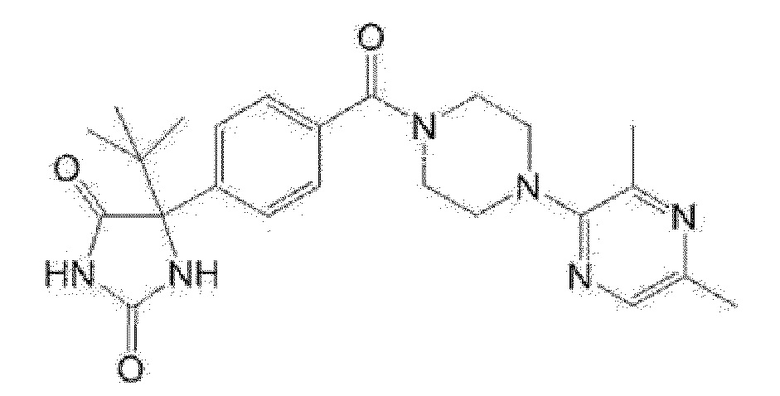
[0989]
Используя 4-(4-трет-бутил-2,5-диоксо-имидазолидин-4-ил)бензойную кислоту (50 мг), описанную в примере получения 13, и 3,5-диметил-3,4,5,6-тетрагидро-2H-[1,2']бипиразинил (38 мг), описанный в примере получения 83, реакции и обработки, аналогичные тем, которые описаны в примере 136, осуществляли с получением указанного в заголовке соединения (55 мг).
MS(ESI)m/z:451(M+H)+
[0990]
Пример 138: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метокси-5-метилфенил}-5-изопропилимидазолидин-2,4-диона
[0991]

[0992]
К 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-5-метокси-2-метилбензойной кислоте (103 мг), описанной в примере получения 57, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (84,2 мг), 1-гидроксибензотриазол (54,5 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (83,8 мг), тетрагидрофуран (3 мл) и триэтиламин (0,056 мл) и смесь перемешивали при комнатной температуре в течение 7 часов. К реакционной смеси добавляли воду, и осадок собирали фильтрованием. Полученный осадок суспендировали в гексане/этилацетате и собирали путем фильтрования с получением указанного в заголовке соединения (110,9 мг).
MS(ESI)m/z:480(M+H)+
[0993]
Пример 139: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)-пиперазин-1-карбонил]-2-гидрокси-5-метилфенил}-5-изопропил-имидазолидин-2,4-диона
[0994]

[0995]
К 5-гидрокси-4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)-2-метилбензойной кислоте (11 мг), описанной в примере получения 58, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (9,4 мг), 1-гидроксибензотриазол (6,1 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (9,4 мг), тетрагидрофуран (2 мл) и триэтиламин (6,3 мкл) и смесь перемешивали при комнатной температуре в течение 7 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический растворитель сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (13,4 мг).
MS(ESI)m/z:466(M+H)+
[0996]
Пример 140: Синтез (R)-5-этил-5-{4-[4-(4,5,6-триметилпиридазин-3-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[0997]

[0998]
К 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (24 мг), описанной в примере получения 14, добавляли 3,4,5-триметил-6-(пиперазин-1-ил)пиридазин (20 мг), описанный в примере получения 84, тетрагидрофуран (2 мл), 1-гидроксибензотриазол (16 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (24 мг) и N,N-диметилформамид (0,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом/метанол. Органический растворитель концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (25,5 мг).
MS(ESI)m/z:437(M+H)+
[0999]
Пример 141: Синтез (R)-5-изопропил-5-{4-[4-(4,5,6-триметилпиридазин-3-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1000]
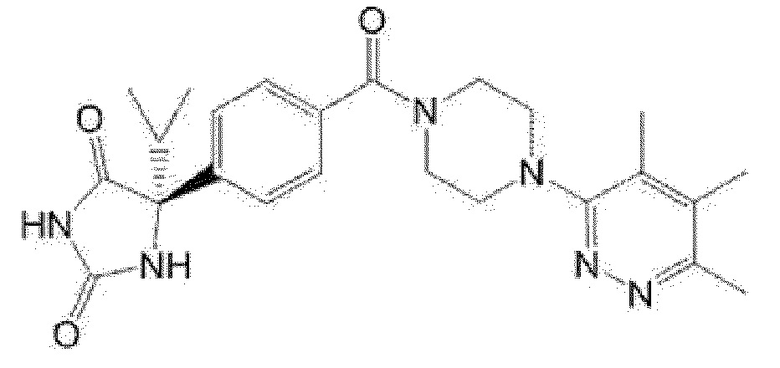
[1001]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (25,4 мг), описанную в примере получения 45, и 3,4,5-триметил-6-(пиперазин-1-ил)пиридазин (20 мг), описанный в примере получения 84, реакции и обработки, аналогичные тем, которые описаны в примере 140, осуществляли с получением указанного в заголовке соединения (25,1 мг).
MS(ESI)m/z:451(M+H)+
[1002]
Пример 142: Синтез (R)-5-изопропил-5-{4-[4-(5-метилпиридин-2-илокси)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1003]

[1004]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (50 мг), описанной в примере получения 45, добавляли 5-метил-2-(пиперидин-4-илокси)пиридин (36,7 мг), тетрагидрофуран (1,5 мл), 1-гидроксибензотриазол (31 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (48 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом/метанол. Органический растворитель сушили над безводным сульфатом магния, концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (80,2 мг).
MS(ESI)m/z:437(M+H)+
[1005]
Пример 143: Синтез (R)-5-изопропил-5-{4-[4-(5-метилпиридин-2-иламино)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1006]

[1007]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (50 мг), описанную в примере получения 45, и (5-метил-пиридин-2-ил)-пиперидин-4-ил-амин (36,5 мг), реакции и обработки, аналогичные тем, которые описаны в примере 142, осуществляли с получением указанного в заголовке соединения (60,4 мг).
MS(ESI)m/z:436(M+H)+
[1008]
Пример 144: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-иламино)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1009]

[1010]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (50 мг), описанную в примере получения 45, и (3,5-диметилпиридин-2-ил)пиперидин-4-иламин (39 мг), описанный в примере получения 85, реакции и обработки, аналогичные тем, которые описаны в примере 142, осуществляли с получением указанного в заголовке соединения (84,5 мг).
MS(ESI)m/z:450(M+H)+
[1011]
Пример 145: Синтез (R)-5-изопропил-5-{4-[4-(4-метилбензоил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1012]

[1013]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (50 мг), описанную в примере получения 45, и 4-(4-метилбензоил)пиперидин (39 мг), реакции и обработки, аналогичные тем, которые описаны в примере 142, осуществляли с получением указанного в заголовке соединения (46,3 мг).
MS(ESI)m/z:448(M+H)+
[1014]
Пример 146: Синтез (R)-5-{4-[(S)-3-(3,5-диметилпиридин-2-илокси)пирролидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1015]
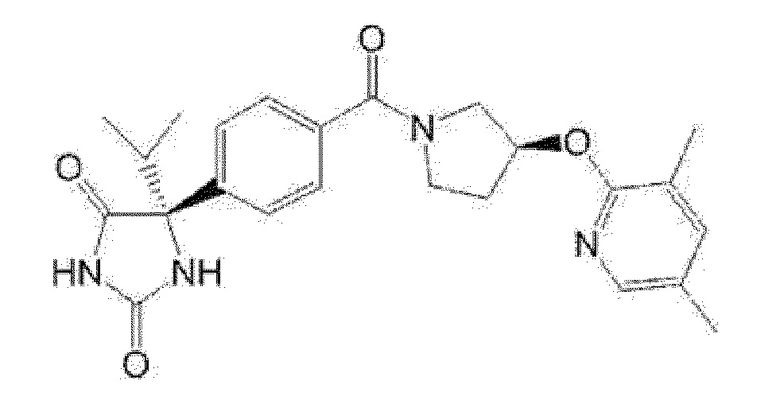
[1016]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (50 мг), описанной в примере получения 45, добавляли 3,5-диметил-2-((S)-пирролидин-3-илокси)пиридин (37 мг), описанный в примере получения 86, тетрагидрофуран (1,5 мл), 1-гидроксибензотриазол (31 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (48 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду, и осадок собирали фильтрованием. Полученный осадок суспендировали в гексане/этилацетате и собирали путем фильтрования с получением указанного в заголовке соединения (79,8 мг).
MS(ESI)m/z:437(M+H)+
[1017]
Пример 147: Синтез (R)-5-изопропил-5-{4-[3-(5-метил-2,3-дигидропирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1018]

[1019]
4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (32,3 мг), описанную в примере получения 45, 5-метил-1-пирролидин-3-ил-2,3-дигидро-1H-пирроло[2,3-b]пиридин (25 мг), описанный в примере получения 87, тетрагидрофуран (1,5 мл), 1-гидроксибензотриазол (20 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (31 мг) добавляли, и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол). Растворитель выпаривали и полученный остаток разделяли с помощью ВЭЖХ, используя XBridge Prep C18 OBD (Waters) (10 ммоль/л водный раствор карбоната аммония, ацетонитрил) с получением указанного в заголовке соединения (20,4 мг).
MS(ESI)m/z:448(M+H)+
[1020]
Пример 148: Синтез (R)-5-изопропил-5-[4-(4-п-толилоксипиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1021]

[1022]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (50 мг), описанную в примере получения 45, и 4-(4-метилфенокси)пиперидин (36,5 мг), реакции и обработки, аналогичные тем, которые описаны в примере 146, осуществляли с получением указанного в заголовке соединения (70,7 мг).
MS(ESI)m/z:436(M+H)+
[1023]
Пример 149: Синтез (R)-5-метил-5-{4-[4-(5-метилпиридин-2-иламино)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1024]

[1025]
Добавляли 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (30 мг), описанную в примере получения 6, (5-метилпиридин-2-ил)(пиперидин-4-ил)амин (24,5 мг), 1-гидроксибензотриазол (20,8 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (31,9 мг) и тетрагидрофуран (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (47,2 мг).
MS(ESI)m/z:408(M+H)+
[1026]
Пример 150: Синтез (R)-5-метил-5-{4-[4-(4-метилбензоил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1027]
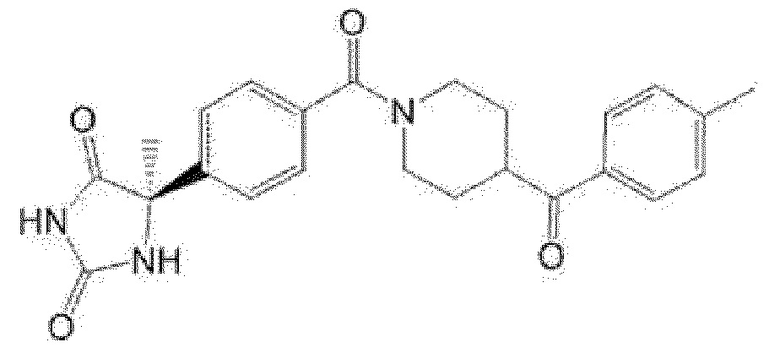
[1028]
Используя 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (30 мг), описанную в примере получения 6, и 4-(4-метилбензоил)пиперидин (26 мг), реакции и обработки, аналогичные тем, которые описаны в примере 149, осуществляли с получением указанного в заголовке соединения (33,5 мг).
MS(ESI)m/z:420(M+H)+
[1029]
Пример 151: Синтез 5-фторметил-5-{4-[4-(4-метилбензоил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1030]

[1031]
К 4-(4-фторметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (50 мг), описанной в примере получения 63, добавляли 4-(4-метилбензоил)пиперидин (40,3 мг), 1-гидроксибензотриазол (32,1 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (49,4 мг) и тетрагидрофуран (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (22,6 мг).
MS(ESI)m/z:438(M+H)+
[1032]
Пример 152: Синтез (R)-5-метил-5-[4-(4-п-толилоксипиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1033]

[1034]
Используя 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (30 мг), описанную в примере получения 6, и 4-(4-метилфенокси)пиперидин (24,5 мг), реакции и обработки, аналогичные тем, которые описаны в примере 149, осуществляли с получением указанного в заголовке соединения (46,9 мг).
MS(ESI)m/z:408(M+H)+
[1035]
Пример 153: Синтез 5-фторметил-5-[4-(4-п-толилоксипиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1036]
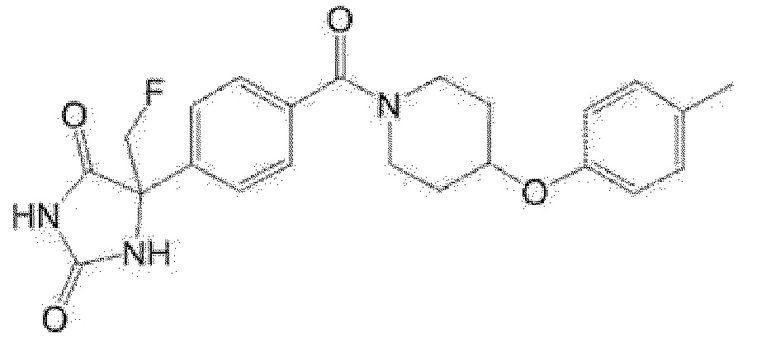
[1037]
Используя 4-(4-фторметил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (50 мг), описанную в примере получения 63, и 4-(4-метилфенокси)пиперидин (37,9 мг), реакции и обработки, аналогичные тем, которые описаны в примере 151, осуществляли с получением указанного в заголовке соединения (79,4 мг).
MS(ESI)m/z:426(M+H)+
[1038]
Пример 154: Синтез 3-{4-[(S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбонил]фенил}-3-этилпирролидин-2,5-диона
[1039]
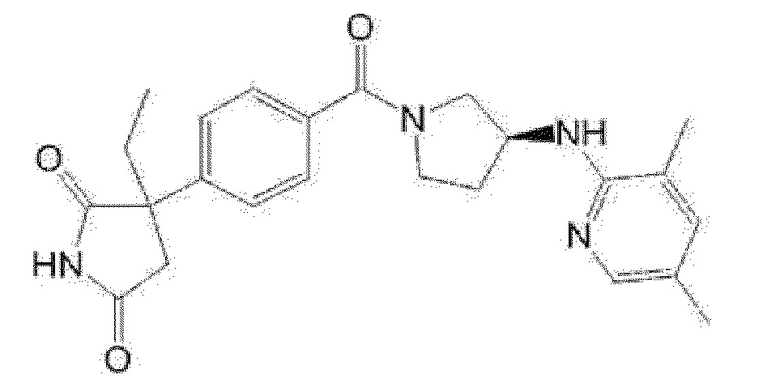
[1040]
К 4-(3-этил-2,5-диоксопирролидин-3-ил)бензойной кислоте (100 мг), описанной в примере получения 20, добавляли (3,5-диметилпиридин-2-ил)-(S)-пирролидин-3-иламин•2 гидрохлорид (106,9 мг), описанный в примере получения 88, 1-гидроксибензотриазол (65,6 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (100,8 мг), тетрагидрофуран (4,5 мл) и триэтиламин (0,118 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол). Растворитель выпаривали и полученный остаток разделяли с помощью ВЭЖХ с использованием Capcellpak C18 UG80 (0,05% трифторуксусная кислота/вода, 0,05% трифторуксусная кислота/ацетонитрил) с получением указанного в заголовке соединения (110,5 мг).
MS(ESI)m/z:421(M+H)+
[1041]
Пример 155: Синтез (R)-5-изопропил-5-{4-[(S)-3-(5-метилпиридин-2-иламино)пирролидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1042]

[1043]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (30 мг), описанной в примере получения 45, добавляли (5-метилпиридин-2-ил)-(S)-пирролидин-3-иламин (20,3 мг), 1-гидроксибензотриазол (18,5 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (28,5 мг) и тетрагидрофуран (2,5 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (46,2 мг).
MS(ESI)m/z:422(M+H)+
[1044]
Пример 156: Синтез (R)-5-фторметил-5-{4-[4-(5-метилпиридин-2-илокси)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона и (S)-5-фторметил-5-{4-[4-(5-метилпиридин-2-илокси)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1045]

[1046]
Используя 4-(4-фторметил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (100 мг), описанную в примере получения 63, и 5-метил-2-(пиперидин-4-илокси)пиридин (76,2 мг), реакции и обработки, аналогичные тем, которые описаны в примере 151, осуществляли с получением 5-фторметил-5-{4-[4-(5-метилпиридин-2-илокси)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона (170 мг).
Полученный 5-фторметил-5-{4-[4-(5-метил-пиридин-2-илокси)-пиперидин-1-карбонил]-фенил}-имидазолидин-2,4-дион (170 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IF (гексан/этанол/тетрагидрофуран/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 77,4 мг (MS(ESI)m/z:427(M+H)+) и соединение с большим временем удерживания 74,7 мг (MS(ESI)m/z:427(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IF-3 (4,6 мм×150 мм, гексан/этанол/тетрагидрофуран/диэтиламин=50/30/20/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 8,8 мин и 10,9 мин.
[1047]
Пример 157: Синтез (R)-5-изопропил-5-{4-[4-(5-метилпирроло[2,3-b]пиридин-1-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1048]

[1049]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (50 мг), описанной в примере получения 45, добавляли 5-метил-1-пиперидин-4-ил-1H-индол (41 мг), описанный в примере получения 89, 1-гидроксибензотриазол (31 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (48 мг) и тетрагидрофуран (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол). Растворитель выпаривали и полученный остаток разделяли с помощью ВЭЖХ, используя XBridge Prep C18 OBD (Waters) (10 ммоль/л водный раствор карбоната аммония, ацетонитрил) с получением указанного в заголовке соединения (65,1 мг).
MS(ESI)m/z:460(M+H)+
[1050]
Пример 158: Синтез (R)-5-изопропил-5-{4-[(S)-3-(5-метил-2,3-дигидропирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1051]
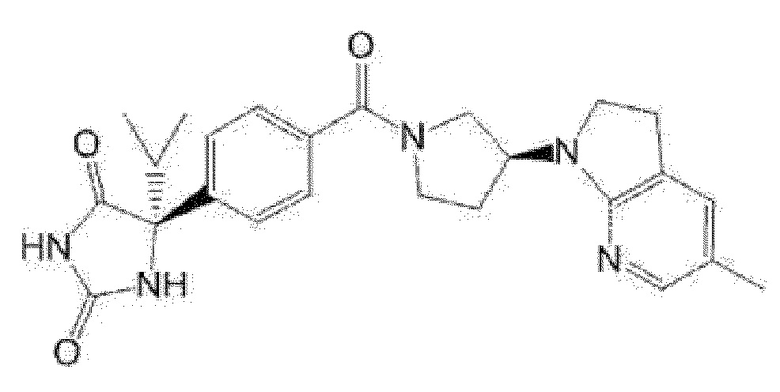
[1052]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (50 мг), описанную в примере получения 45, и 5-метил-1-(S)-пирролидин-3-ил-2,3-дигидро-1H-пирроло[2,3-b]пиридин (39 мг), описанный в примере получения 90, реакции и обработки, аналогичные тем, которые описаны в примере 157, осуществляли с получением указанного в заголовке соединения (63,4 мг).
MS(ESI)m/z:448(M+H)+
[1053]
Пример 159: Синтез (R)-5-изопропил-5-{4-[(S)-3-(5-метилпирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1054]

[1055]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (50 мг), описанную в примере получения 45, и 5-метил-1-(S)-пирролидин-3-ил-1H-пирроло[2,3-b]пиридин (38 мг), описанный в примере получения 91, реакции и обработки, аналогичные тем, которые описаны в примере 157, осуществляли с получением указанного в заголовке соединения (72,3 мг).
MS(ESI)m/z:446(M+H)+
[1056]
Пример 160: Синтез (R)-5-метил-5-{4-[(S)-3-(5-метил-2,3-дигидропирроло[2,3-b]пиридин-1-ил)пирролидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1057]

[1058]
К 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (50 мг), описанной в примере получения 6, добавляли 5-метил-1-(S)-пирролидин-3-ил-2,3-дигидро-1H-пирроло[2,3-b]пиридин (43 мг), описанный в примере получения 90, тетрагидрофуран (2 мл), 1-гидроксибензотриазол (35 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (53 мг) и триэтиламин (0,06 мл) и смесь перемешивали при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли воду и насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол). Растворитель выпаривали и полученный остаток отделяли с помощью ВЭЖХ с использованием XBridge Prep C18 OBD (Waters) (10 ммоль/л водного раствора карбоната аммония, ацетонитрил) с получением указанного в заголовке соединения (39,6 мг).
MS(ESI)m/z:420(M+H)+
[1059]
Пример 161: Синтез (R)-5-(4-{4-[5-(4-фторфенил)-[1,3,4]оксадиазол-2-ил]пиперидин-1-карбонил}фенил)-5-изопропилимидазолидин-2,4-диона
[1060]
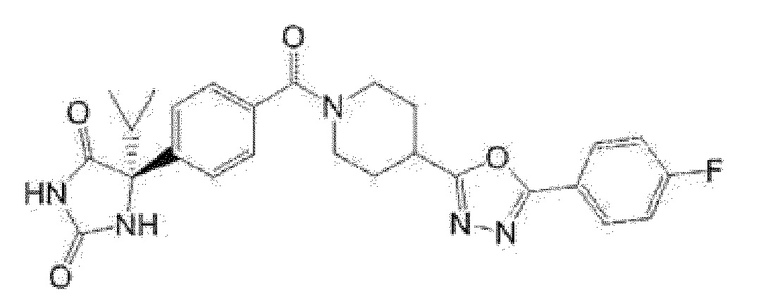
[1061]
4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (70 мг), описанную в примере получения 45, 2-(4-фторфенил)-5-(пиперидин-4-ил)-1,3,4-оксадиазол (79 мг), 1-гидроксибензотриазол (54 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (79 мг) растворяли в N,N-диметилформамиде (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (95 мг).
MS(APCI)m/z:492(M+H)+
[1062]
Пример 162: Синтез (R)-5-(4-{4-[5-(2,4-диметилфенил)-[1,3,4]оксадиазол-2-ил]пиперидин-1-карбонил}фенил)-5-метилимидазолидин-2,4-диона
[1063]

[1064]
4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (80 мг), описанную в примере получения 6, 4-[5-(2,4-диметилфенил)-[1,3,4]оксадиазол-2-ил]пиперидин •гидрохлорид (131 мг), описанный в примере получения 75, 1-гидроксибензотриазол (69 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (98 мг) растворяли в хлороформе (3 мл), добавляли триэтиламин (0,142 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (этилацетат:метанол) с получением указанного в заголовке соединения (70 мг).
MS(ESI)m/z:474(M+H)+
[1065]
Пример 163: Синтез (R)-5-(4-{4-[5-(2,4-диметилфенил)-[1,3,4]оксадиазол-2-ил]пиперидин-1-карбонил}фенил)-5-этилимидазолидин-2,4-диона
[1066]

[1067]
Используя 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (80 мг), описанную в примере получения 14, и 4-[5-(2,4-диметилфенил)-[1,3,4]оксадиазол-2-ил]пиперидин•гидрохлорид (123 мг), описанный в примере получения 75, реакции и обработки, аналогичные тем, которые описаны в примере 162, осуществляли с получением указанного в заголовке соединения (104 мг).
MS(ESI)m/z:488(M+H)+
[1068]
Пример 164: Синтез (R)-5-изопропил-5-(4-{4-[5-(5-метилпиридил-2-ил)-1H-пиразол-3-ил]пиперидин-1-карбонил}фенил)имидазолидин-2,4-диона
[1069]

[1070]
4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (73 мг), описанную в примере получения 45, 5-метил-2-(5-пиперидин-4-ил-2H-пиразол-3-ил)пиридин•2 гидрохлорид (80 мг), описанный в примере получения 76, 1-гидроксибензотриазол (51 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (73 мг) растворяли в хлороформе (3 мл), добавляли триэтиламин (0,106 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (этилацетат:метанол) с получением указанного в заголовке соединения (77 мг).
MS(ESI)m/z:487(M+H)+
[1071]
Пример 165: Синтез 3-этил-3-{5-[4-(5-п-толил-1H-пиразол-3-ил)пиперидин-1-карбонил]пиридин-2-ил]пирролидин-2,5-диона
[1072]

[1073]
Используя 6-(3-этил-2,5-диоксопирролидин-3-ил)никотиновую кислоту (64 мг), описанную в примере получения 51, и 4-[5-(п-толил)-1H-пиразол-3-ил]пиперидин (60 мг), описанный в примере получения 77, реакции и обработки, аналогичные тем, которые описаны в примере 164, осуществляли с получением указанного в заголовке соединения (61 мг).
MS(ESI)m/z:472(M+H)+
[1074]
Пример 166: Синтез (R)-5-[4-(3,5-диметил-3',4',5',6'-тетрагидро-2'H-[2,4']бипиридинил-1'-карбонил)фенил]-5-изопропилимидазолидин-2,4-диона
[1075]
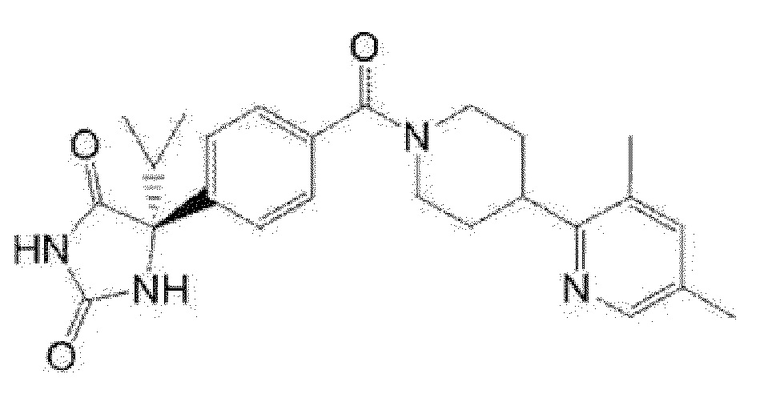
[1076]
4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (80 мг), описанную в примере получения 45, 3,5-диметил-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил•2 гидрохлорид (96 мг), описанный в примере получения 81, 1-гидрокси-7-азабензотриазол (62 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (88 мг) растворяли в дихлорметане (3 мл), добавляли триэтиламин (0,127 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (этилацетат:метанол) с получением указанного в заголовке соединения (101 мг).
MS(ESI)m/z:435(M+H)+
[1077]
Пример 167: Синтез (R)-5-[4-(3,5-диметил-3',4',5',6'-тетрагидро-2'H-[2,4']бипиридинил-1'-карбонил)фенил]-5-этилимидазолидин-2,4-диона
[1078]

[1079]
Используя 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (80 мг), описанную в примере получения 14, и 3,5-диметил-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил•2 гидрохлорид (102 мг), описанный в примере получения 81, реакции и обработки, аналогичные тем, которые описаны в примере 166, осуществляли с получением указанного в заголовке соединения (125 мг).
MS(ESI)m/z:421(M+H)+
[1080]
Пример 168: Синтез 2,2-диметилпропионовая кислота (R)-4-{4-[4-(5,7-диметилиндазол-2-ил)пиперидин-1-карбонил]фенил}-4-метил-2,5-диоксоимидазолидин-1-илметилового эфира
[1081]
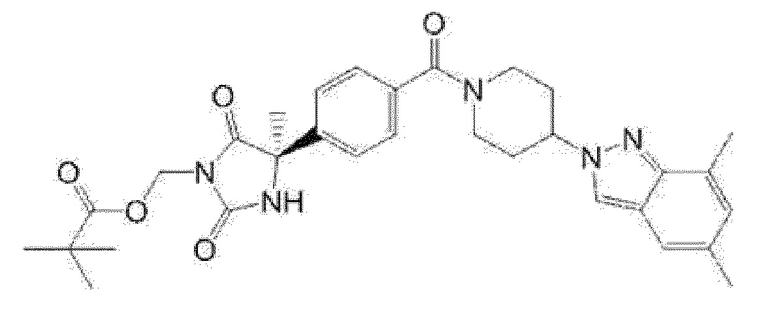
[1082]
4-[(R)-1-(2,2-диметилпропионилоксиметил)-4-метил-2,5-диоксоимидазолидин-4-ил]бензойную кислоту (80 мг), описанную в примере получения 65, 5,7-диметил-2-пиперидин-4-ил-2H-индазол•гидрохлорид (67 мг), описанный в примере получения 96, 1-гидрокси-7-азабензотриазол (47 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (66 мг) растворяли в дихлорметане (3 мл), добавляли триэтиламин (0,096 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (этилацетат:метанол) с получением указанного в заголовке соединения (128 мг).
MS(ESI)m/z:560(M+H)+
[1083]
Пример 169: Синтез (R)-5-метил-5-{4-[4-(2-п-толил-2H-тетразол-5-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1084]

[1085]
4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (80 мг), описанную в примере получения 6, 4-[2-(п-толил)-2H-тетразол-5-ил]пиперидин (100 мг), описанный в примере получения 78, 1-гидрокси-7-азабензотриазол (70 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (98 мг) растворяли в дихлорметане (3 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (этилацетат:метанол) с получением указанного в заголовке соединения (147 мг).
MS(ESI)m/z:460(M+H)+
[1086]
Пример 170: Синтез (R)-5-этил-5-{4-[4-(2-п-толил-2H-тетразол-5-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1087]

[1088]
Используя 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (80 мг), описанную в примере получения 14, и 4-[2-(п-толил)-2H-тетразол-5-ил]пиперидин (94 мг), описанный в примере получения 78, реакции и обработки, аналогичные тем, которые описаны в примере 169, осуществляли с получением указанного в заголовке соединения (137 мг).
MS(ESI)m/z:474(M+H)+
[1089]
Пример 171: Синтез 3-метоксиметил-3-{5-[4-(5-п-толил-1H-пиразол-3-ил)пиперидин-1-карбонил]пиридин-2-ил}пирролидин-2,5-диона
[1090]

[1091]
6-(3-Метоксиметил-2,5-диоксопирролидин-3-ил)никотиновую кислоту (51 мг), описанную в примере получения 64, 4-[5-(п-толил)-1H-пиразол-3-ил]пиперидин (42 мг, см. пример получения 77), 1-гидрокси-7-азабензотриазол (36 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (50 мг) растворяли в дихлорметане (3 мл) и смесь перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (этилацетат:метанол) с получением указанного в заголовке соединения (12 мг).
MS(ESI)m/z:488(M+H)+
[1092]
Пример 172: Синтез (R)-5-метил-5-{4-[4-(1-п-толил-1H-[1,2,3]триазол-4-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1093]
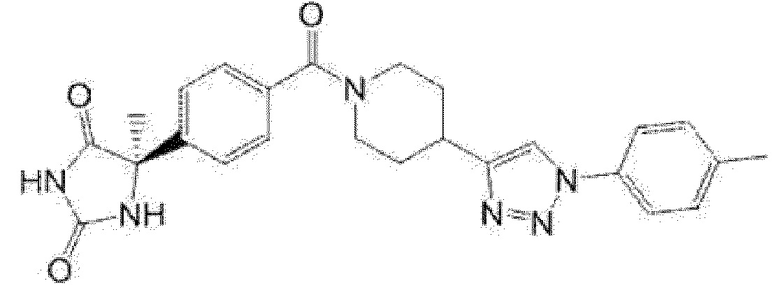
[1094]
4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (80 мг), описанную в примере получения 6, 4-[1-(п-толил)-1H-[1,2,3]триазол-4-ил]пиперидин•2 гидрохлорид (118 мг), описанный в примере получения 79, 1-гидрокси-7-азабензотриазол (70 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (98 мг) растворяли в дихлорметане (3 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (этилацетат:метанол) с получением указанного в заголовке соединения (154 мг).
MS(ESI)m/z:459(M+H)+
[1095]
Пример 173: Синтез (R)-5-этил-5-{4-[4-(1-п-толил-1H-[1,2,3]триазол-4-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1096]

[1097]
Используя 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (80 мг), описанную в примере получения 14, и 4-[1-(п-толил)-1H-[1,2,3]триазол-4-ил]пиперидин•2 гидрохлорид (112 мг), описанный в примере получения 79, реакции и обработки, аналогичные тем, которые описаны в примере 172, осуществляли с получением указанного в заголовке соединения (149 мг).
MS(ESI)m/z:473(M+H)+
[1098]
Пример 174: Синтез (R)-5-метил-5-{4-[4-(1-п-толил-1H-имидазол-4-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1099]
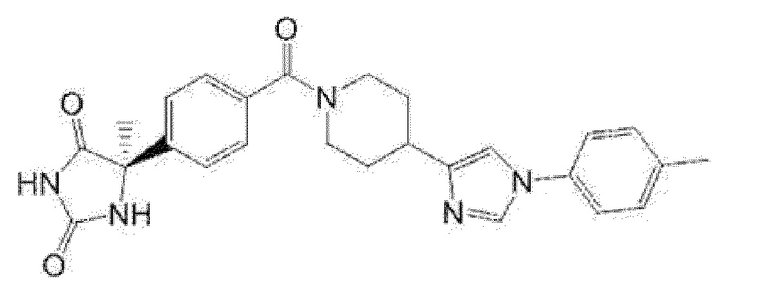
[1100]
4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (72 мг), описанную в примере получения 6, 4-[1-(п-толил)-1H-имидазол-4-ил]пиперидин•2 гидрохлорид (80 мг), описанный в примере получения 80, 1-гидрокси-7-азабензотриазол (52 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (73 мг) растворяли в дихлорметане (3 мл), добавляли триэтиламин (0,106 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (этилацетат:метанол) с получением указанного в заголовке соединения (109 мг).
MS(ESI)m/z:458(M+H)+
[1101]
Пример 175: Синтез (R)-5-этил-5-{4-[4-(1-п-толил-1H-имидазол-4-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1102]
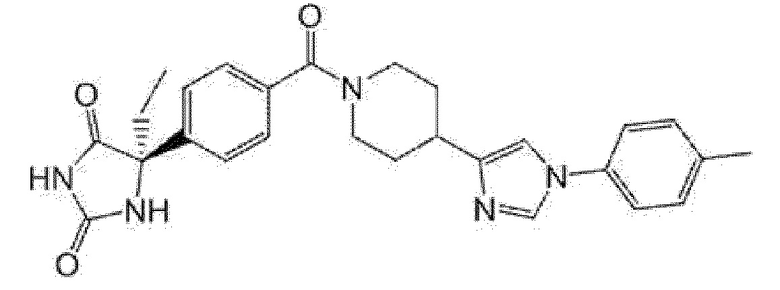
[1103]
Используя 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (76 мг), описанную в примере получения 14, и 4-[1-(п-толил)-1H-имидазол-4-ил]пиперидин•2 гидрохлорид (80 мг), описанный в примере получения 80, реакции и обработки, аналогичные тем, которые описаны в примере 174, осуществляли с получением указанного в заголовке соединения (115 мг).
MS(ESI)m/z:472(M+H)+
[1104]
Пример 176: Синтез (R)-5-[4-(3,5-диметил-3',4',5',6'-тетрагидро-2'H-[2,4']бипиридинил-1'-карбонил)фенил]-5-метилимидазолидин-2,4-диона
[1105]

[1106]
Используя 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (80 мг), описанную в примере получения 6, и 3,5-диметил-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил•2 гидрохлорид (108 мг), описанный в примере получения 81, реакции и обработки, аналогичные тем, которые описаны в примере 166, осуществляли с получением указанного в заголовке соединения (139 мг).
MS(ESI)m/z:407(M+H)+
[1107]
Пример 177: Синтез 5-[4-(3,5-диметил-3',4',5',6'-тетрагидро-2'H-[2,4']бипиридинил-1'-карбонил)-2-фторфенил]-5-этилимидазолидин-2,4-диона
[1108]

[1109]
4-(4-Этил-2,5-диоксоимидазолидин-4-ил)-3-фторбензойную кислоту (150 мг), описанную в примере получения 40, 3,5-диметил-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил•2 гидрохлорид (178 мг), описанный в примере получения 81, 1-гидрокси-7-азабензотриазол (115 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (162 мг) растворяли в дихлорметане (3 мл), добавляли триэтиламин (0,235 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (этилацетат:метанол) с получением указанного в заголовке соединения (247 мг).
MS(ESI)m/z:439(M+H)+
[1110]
Пример 178: Синтез 5-этил-5-{2-фтор-4-[4-(1-п-толил-1H-[1,2,3]триазол-4-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1111]

[1112]
Используя 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-3-фторбензойную кислоту (150 мг), описанную в примере получения 40, и 4-[1-(п-толил)-1H-[1,2,3]триазол-4-ил]пиперидин•2 гидрохлорид (195 мг), описанный в примере получения 79, реакции и обработки, аналогичные тем, которые описаны в примере 177, осуществляли с получением указанного в заголовке соединения (265 мг).
MS(ESI)m/z:491(M+H)+
[1113]
Пример 179: Синтез 3-[5-(3,5-диметил-3',4',5',6'-тетрагидро-2'H-[2,4']бипиридинил-1'-карбонил)пиридин-2-ил]-3-этилпирролидин-2,5-диона
[1114]

[1115]
Используя 6-(3-этил-2,5-диоксопирролидин-3-ил)никотиновую кислоту (170 мг), описанную в примере получения 51, и 3,5-диметил-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил•2 гидрохлорид (216 мг), описанный в примере получения 81, реакции и обработки, аналогичные тем, которые описаны в примере 166, осуществляли с получением указанного в заголовке соединения (266 мг).
MS(ESI)m/z:421(M+H)+
[1116]
Пример 180: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-гидроксифенил}-5-метилимидазолидин-2,4-диона
[1117]

[1118]
Используя 2-гидрокси-4-(4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (123 мг), описанную в примере получения 48, и 1-(3,5-диметилпиридин-2-ил)пиперазин (113 мг), реакции и обработки, аналогичные тем, которые описаны в примере 42, осуществляли с получением указанного в заголовке соединения (92 мг).
MS(ESI)m/z:424(M+H)+
[1119]
Пример 181: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-(2-метоксиэтил)имидазолидин-2,4-диона
[1120]
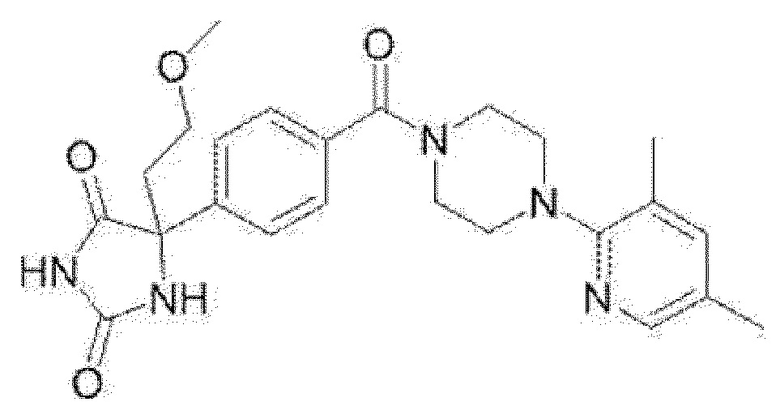
[1121]
К 4-[4-(2-метоксиэтил)-2,5-диоксоимидазолидин-4-ил]бензойной кислоте в виде неочищенного продукта (280 мг), описанной в примере получения 36, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (145,7 мг), хлороформ (8,4 мл), N,N-диметилформамид (2,8 мл), 1-гидроксибензотриазол (93,7 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (143,1 мг) и триэтиламин (178,4 мкл) и смесь перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (этилацетат: метанол) с получением указанного в заголовке соединения (135 мг).
MS(ESI)m/z:452(M+H)+
[1122]
Пример 182: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропил-1-метилимидазолидин-2,4-диона
[1123]

[1124]
5-{4-[4-(3,5-Диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропил-3-(4-метоксибензил)имидазолидин-2,4-дион (260 мг, см. пример 47) растворяли в N,N-диметилформамиде (4,7 мл), добавляли гидрид натрия (60% в жидкой дисперсии парафинов) (23 мг) и метилиодид (35 мкл) в атмосфере азота, и смесь перемешивали при комнатной температуре. После завершения реакции, к реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали с получением 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропил-3-(4-метоксибензил)-1-метилимидазолидин-2,4-диона (256 мг).
Полученный 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропил-3-(4-метоксибензил)-1-метилимидазолидин-2,4-дион (256 мг) растворяли в 1,2-дихлорэтане (4,7 мл), добавляли трифторметансульфоновый ангидрид (366 мкл) и смесь перемешивали при 70°C. После завершения реакции, водный раствор гидрокарбоната натрия добавляли при охлаждении льдом и смесь экстрагировали хлороформом. Растворитель выпаривали, к полученному остатку добавляли гексан и осадок собирали фильтрованием с получением указанного в заголовке соединения (67 мг).
MS(ESI)m/z:450(M+H)+
[1125]
Пример 183: Синтез 5-[4-(3,5-диметил-3',4',5',6'-тетрагидро-2'H-[2,4']бипиридинил-1'-карбонил)фенил]-5-фторметилимидазолидин-2,4-диона
[1126]
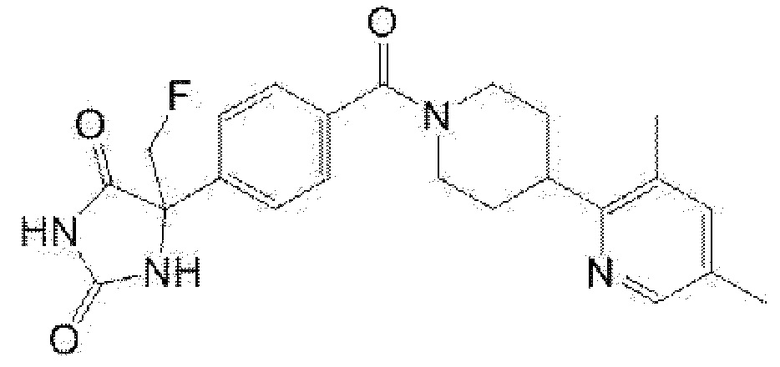
[1127]
Используя 4-(4-фторметил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (150 мг), описанную в примере получения 63, и 3,5-диметил-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил•2 гидрохлорид (188 мг), описанный в примере получения 81, реакции и обработки, аналогичные тем, которые описаны в примере 166, осуществляли с получением указанного в заголовке соединения (202 мг).
MS(ESI)m/z:425(M+H)+
[1128]
Пример 184: Синтез 3-[5-(3,5-диметил-3',4',5',6'-тетрагидро-2'H-[2,4']бипиридинил-1'-карбонил)пиридин-2-ил]-3-изопропилпирролидин-2,5-диона
[1129]
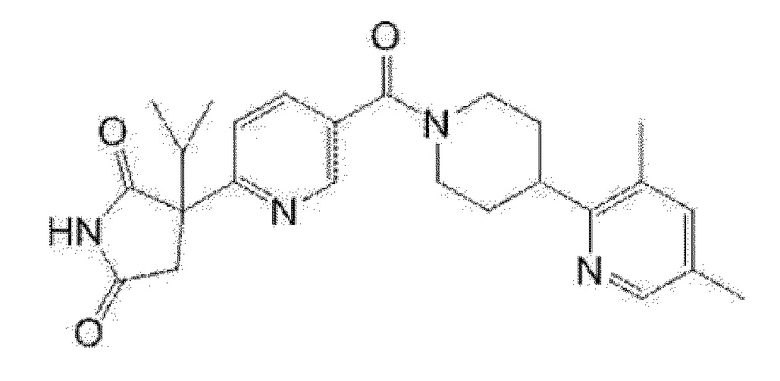
[1130]
Используя 6-(3-изопропил-2,5-диоксопирролидин-3-ил)никотиновую кислоту (90 мг), описанную в примере получения 52, и 3,5-диметил-1',2',3',4',5',6'-гексагидро-[2,4']бипиридинил•2 гидрохлорид (108 мг), описанный в примере получения 81, реакции и обработки, аналогичные тем, которые описаны в примере 166, осуществляли с получением указанного в заголовке соединения (149 мг).
MS(ESI)m/z:435(M+H)+
[1131]
Пример 185: Синтез (R)-5-{4-[3-(3,5-диметилпиридин-2-иламино)азетидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-дион•гидрохлорида
[1132]
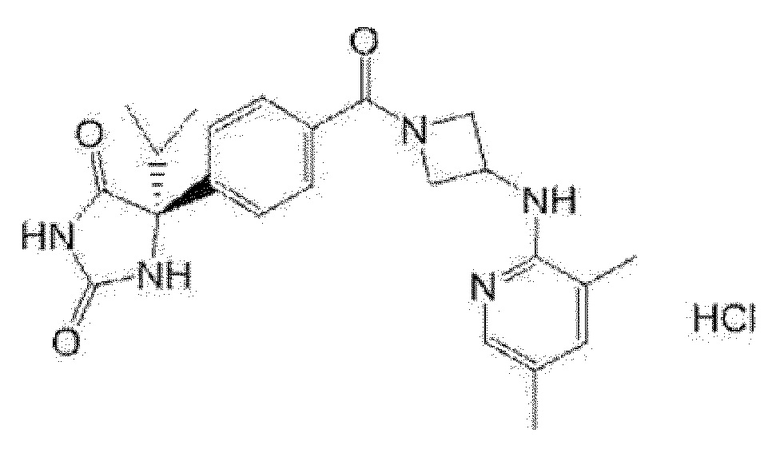
[1133]
Трет-бутиловый эфир 3-(3,5-диметилпиридин-2-иламино)азетидин-1-карбоновой кислоты (122 мг), описанный в примере получения 92, растворяли в хлороформе (3 мл), добавляли 4 н раствор хлороводорода/этилацетата (1,1 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (105 мг), описанную в примере получения 45, 1-гидроксибензотриазол (65 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (92 мг), N,N-диметилформамид (4 мл) и триэтиламин (0,223 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния, и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением масла. Полученное масло растворяли в этилацетате и добавляли 4 н раствор хлороводорода/этилацетата (0,2 мл). Растворитель выпаривали с получением указанного в заголовке соединения (90 мг).
MS(APCI)m/z:422(M+H)+
[1134]
Пример 186: Синтез (R)-5-изопропил-5-{4-[4-(5-метилпиридин-2-карбонил)пиперидин-1-карбонил]фенил]имидазолидин-2,4-диона
[1135]

[1136]
4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (105 мг), описанную в примере получения 45, (5-метилпиридин-2-ил)пиперидин-4-илметанон•2 гидрохлорид (122 мг), описанный в примере получения 93, 1-гидроксибензотриазол (81 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (115 мг) растворяли в тетрагидрофуране (4 мл), добавляли триэтиламин (0,233 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (101 мг).
MS(ESI)m/z:449(M+H)+
[1137]
Пример 187: Синтез (R)-5-{4-[(3R,4R)-3-(3,5-диметилпиридин-2-иламино)-4-гидроксипирролидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1138]
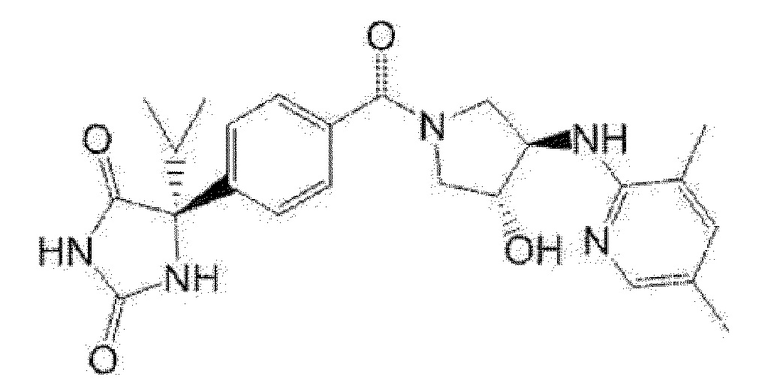
[1139]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (105 мг), описанную в примере получения 45, и (3R,4R)-4-(3,5-диметилпиридин-2-иламино)пирролидин-3-ол•2 гидрохлорид (134 мг), описанный в примере получения 94, реакции и обработки, аналогичные тем, которые описаны в примере 186, осуществляли с получением указанного в заголовке соединения (85 мг).
MS(ESI)m/z:452(M+H)+
[1140]
Пример 188: Синтез (R)-5-этил-5-{4-[4-(5-п-толуил-1H-пиразол-3-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1141]
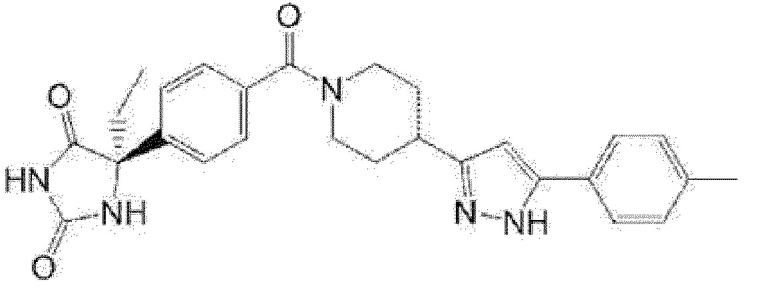
[1142]
Используя 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (75 мг), описанную в примере получения 14, и 4-[5-(п-толил)-1H-пиразол-3-ил]пиперидин (101 мг), описанный в примере получения 77, реакции и обработки, аналогичные тем, которые описаны в примере 186, осуществляли с получением указанного в заголовке соединения (34 мг).
MS(ESI)m/z:472(M+H)+
[1143]
Пример 189: Синтез метилового эфира (2S,4S)-4-(3,5-диметилпиридин-2-иламино)-1-[4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензоил]пирролидин-2-карбоновой кислоты
[1144]

[1145]
Смесь 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (48,8 мг), описанной в примере получения 45, метилового эфира (2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-2-карбоновой кислоты•2 гидрохлорида (60 мг), описанного в примере получения 101, 1-гидроксибензотриазола (37,7 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорида (53,5 мг), триэтиламина (0,104 мл) и N,N-диметилформамида (1,2 мл) перемешивали при комнатной температуре в течение 7,5 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (73 мг).
MS(APCI)m/z:494,6(M+H)+
[1146]
Пример 190: Синтез (R)-5-{4-[(2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-гидроксиметилпирролидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1147]
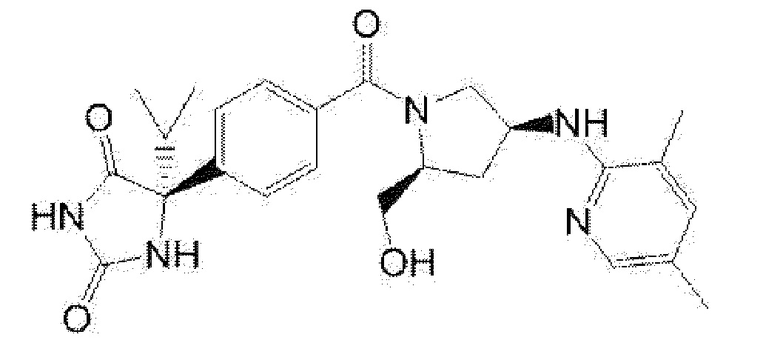
[1148]
[(2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-2-ил]метанол•2 гидрохлорид, описанный в примере получения 102, растворяли в N,N-диметилформамиде (1,8 мл), добавляли N,O-бис(триметилсилил)ацетамид (76,3 мг) и триэтиламин (0,175 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (82 мг), описанную в примере получения 45, 1-гидроксибензотриазол (65 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (90 мг) и смесь перемешивали при комнатной температуре в течение 2,5 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (63 мг).
MS(APCI)m/z:466(M+H)+
[1149]
Пример 191: Синтез (R)-5-{4-[(2R,4S)-4-(3,5-диметилпиридин-2-иламино)-2-метилпирролидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1150]

[1151]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (75,4 мг), описанную в примере получения 45, и (3,5-диметилпиридин-2-ил)((3S,5R)-5-метилпирролидин-3-ил)амин•2 гидрохлорид (80 мг), описанный в примере получения 103, реакции и обработки, аналогичные тем, которые описаны в примере 189, осуществляли с получением указанного в заголовке соединения (68 мг).
MS(APCI)m/z:450(M+H)+
[1152]
Пример 192: Синтез 3-{5-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]пиридин-2-ил}-3-метоксиметилпирролидин-2,5-диона
[1153]
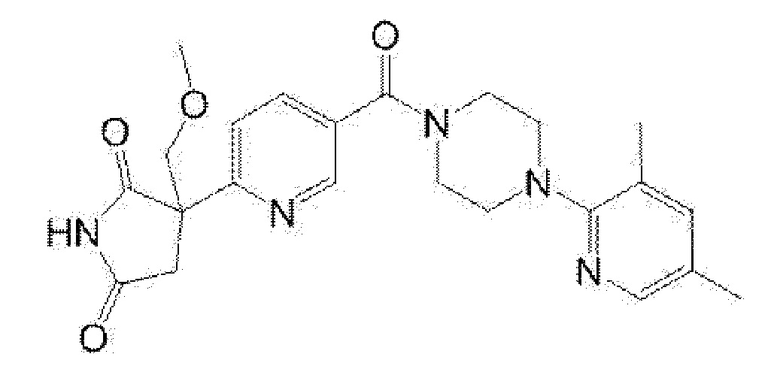
[1154]
К 6-(3-метоксиметил-2,5-диоксопирролидин-3-ил)никотиновой кислоте (83 мг), описанной в примере получения 64, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин (78,8 мг), N,N-диметилформамид (5 мл), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (66,3 мг), 1-гидроксибензотриазол•1 гидрат (46,8 мг) и триэтиламин (0,087 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (75 мг).
MS(ESI)m/z:438(M+H)+
[1155]
Пример 193: Синтез (R)-5-{4-[(2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-метилпирролидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1156]

[1157]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (75,4 мг), описанную в примере получения 45, и (3,5-диметилпиридин-2-ил)((3S,5S)-5-метилпирролидин-3-ил)амин•2 гидрохлорид (80 мг), описанный в примере получения 104, реакции и обработки, аналогичные тем, которые описаны в примере 189, осуществляли с получением указанного в заголовке соединения (61 мг).
MS(APCI)m/z:450(M+H)+
[1158]
Пример 194: Синтез 3-{5-[(S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-1-карбонил]пиридин-2-ил}-3-метоксиметилпирролидин-2,5-диона
[1159]

[1160]
Используя 6-(3-метоксиметил-2,5-диоксопирролидин-3-ил)никотиновую кислоту (200 мг), описанную в примере получения 64, и (3,5-диметилпиридин-2-ил)((S)-пирролидин-3-ил)амин•2 гидрохлорид (220 мг), описанный в примере получения 88, реакции и обработки, аналогичные тем, которые описаны в примере 189, осуществляли с получением указанного в заголовке соединения (268 мг).
MS(ESI)m/z:438(M+H)+
[1161]
Пример 195: Синтез метилового эфира (2S,3S)-3-(3,5-диметилпиридин-2-иламино)-1-[4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензоил]пирролидин-2-карбоновой кислоты
[1162]
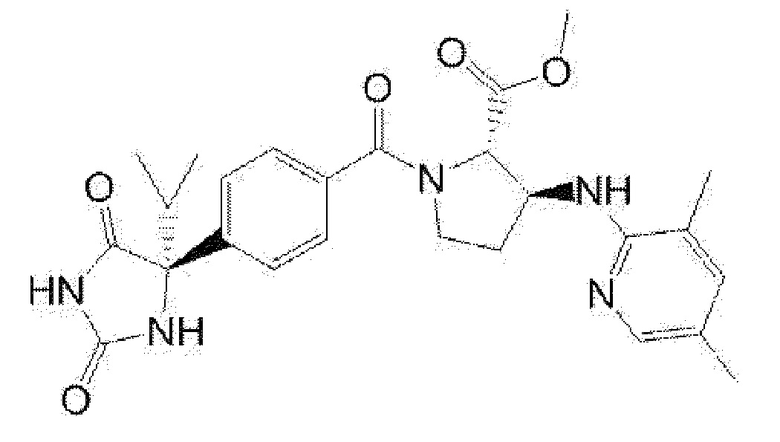
[1163]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (75,4 мг), описанную в примере получения 45, и метиловый эфир (2S,3S)-3-(3,5-диметилпиридин-2-иламино)пирролидин-2-карбоновой кислоты•2 гидрохлорид (80 мг), описанный в примере получения 105, реакции и обработки, аналогичные тем, которые описаны в примере 189, осуществляли с получением указанного в заголовке соединения (36 мг).
MS(ESI)m/z:494(M+H)+
[1164]
Пример 196: Синтез (R)-5-{4-[(2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-гидроксиметилпирролидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[1165]

[1166]
[(2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-2-ил]метанол•2 гидрохлорид (100 мг), описанный в примере получения 102, растворяли в N,N-диметилформамиде (2 мл), добавляли N,O-бис(триметилсилил)ацетамид (90 мг) и триэтиламин (0,190 мл) и смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (96 мг), описанную в примере получения 6, 1-гидроксибензотриазол (69 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (98 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли 1 н водный раствор гидроксида натрия и насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (58 мг).
MS(APCI)m/z:438(M+H)+
[1167]
Пример 197: Синтез амида (2S,4S)-4-(3,5-диметилпиридин-2-иламино)-1-[4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензоил]пирролидин-2-карбоновой кислоты
[1168]

[1169]
К амиду (2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-2-карбоновой кислоты•2 гидрохлориду (64 мг), описанному в примере получения 106, добавляли 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (60 мг), описанную в примере получения 45, 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (60 мг), 1-гидроксибензотриазол (42 мг), N,N-диметилформамид (1,3 мл) и триэтиламин (0,12 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (79 мг).
MS(ESI)m/z:479(M+H)+
[1170]
Пример 198: Синтез (2S,4S)-4-(3,5-диметилпиридин-2-иламино)-1-[4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензоил]пирролидин-2-карбонитрила
[1171]
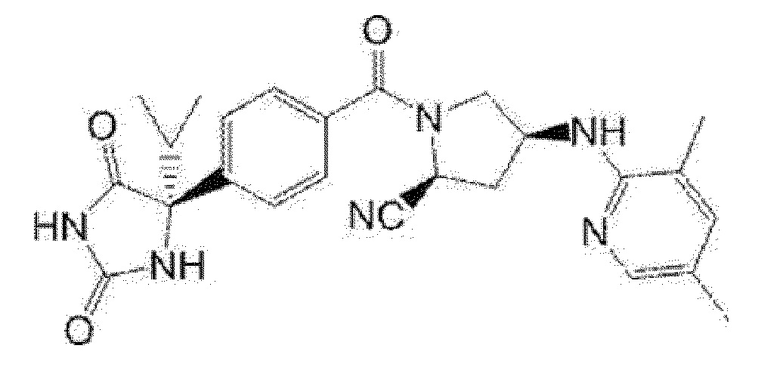
[1172]
Амид (2S,4S)-4-(3,5-диметилпиридин-2-иламино)-1-[4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензоил]пирролидин-2-карбоновой кислоты (60 мг), описанный в примере 197, растворяли в тетрагидрофуране (2,4 мл), добавляли триэтиламин (0,055 мл) и трифторуксусный ангидрид (0,035 мл) при охлаждении льдом, и смесь перемешивали в течение 5,5 часов в процессе повышения температуры до комнатной температуры. К реакционной смеси добавляли трифторуксусный ангидрид (0,035 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (32 мг).
MS(ESI)m/z:461(M+H)+
[1173]
Пример 199: Синтез (R)-5-{4-[(2R,4S)-4-(3,5-диметилпиридин-2-иламино)-2-метилпирролидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[1174]
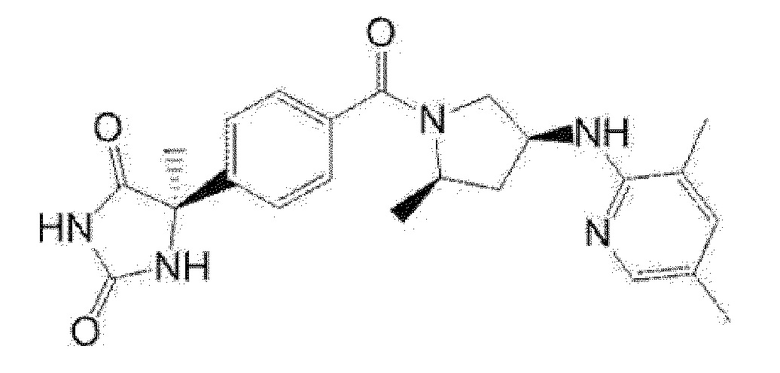
[1175]
К (3,5-диметилпиридин-2-ил)((3S,5R)-5-метилпирролидин-3-ил)амин•2 гидрохлориду (60 мг), описанному в примере получения 103, добавляли 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (61 мг), описанную в примере получения 6, 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (62 мг), 1-гидроксибензотриазол (44 мг), хлороформ (0,6 мл), тетрагидрофуран (0,6 мл) и триэтиламин (0,12 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (42 мг).
MS(ESI)m/z:422(M+H)+
[1176]
Пример 200: Синтез (R)-5-{4-[(2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-метоксиметилпирролидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1177]
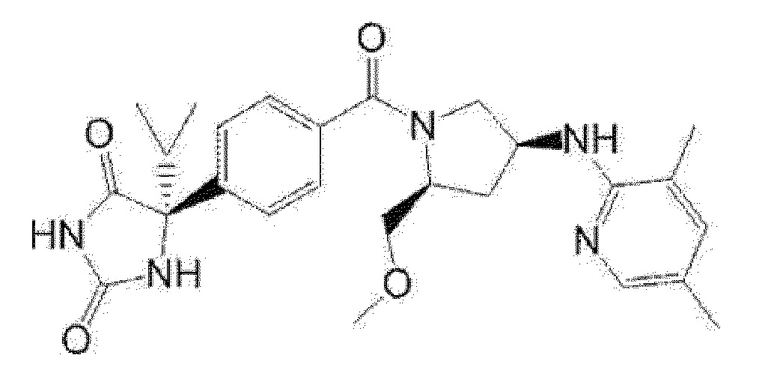
[1178]
К (3,5-диметилпиридин-2-ил)((3S,5S)-5-метоксиметилпирролидин-3-ил)амин•2 гидрохлориду (80 мг), описанному в примере получения 107, добавляли 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (75 мг), описанную в примере получения 45, 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (75 мг), 1-гидроксибензотриазол (53 мг), хлороформ (1,2 мл), тетрагидрофуран (1,2 мл) и триэтиламин (0,145 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (91 мг).
MS(ESI)m/z:480(M+H)+
[1179]
Пример 201: Синтез (R)-5-{4-[(2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-метоксиметилпирролидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[1180]

[1181]
Используя 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (67 мг), описанную в примере получения 6, и (3,5-диметилпиридин-2-ил)((3S,5S)-5-метоксиметилпирролидин-3-ил)амин•2 гидрохлорид (80 мг), описанный в примере получения 107, реакции и обработки, аналогичные тем, которые описаны в примере 200, осуществляли с получением указанного в заголовке соединения (90 мг).
MS(ESI)m/z:452(M+H)+
[1182]
Пример 202: Синтез (R)-5-{4-[(2S,4S)-4-(2,4-диметилфениламино)-2-гидроксиметилпирролидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1183]

[1184]
К трет-бутиловому эфиру (2S,4S)-2-(трет-бутилдиметилсиланилоксиметил)-4-(2,4-диметилфениламино)пирролидин-1-карбоновой кислоты (220 мг), описанному в примере получения 73, добавляли 1,4-диоксан (2,2 мл) и 4 н раствор хлороводорода/1,4-диоксана (2,2 мл). Смесь перемешивали при комнатной температуре в течение 2,5 часов и концентрировали при пониженном давлении. К полученному остатку (60 мг) добавляли 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (61 мг), описанную в примере получения 45, 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (67 мг), 1-гидроксибензотриазол (47 мг), хлороформ (0,6 мл), тетрагидрофуран (0,6 мл) и триэтиламин (0,098 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (23 мг).
MS(ESI)m/z:465(M+H)+
[1185]
Пример 203: Синтез (R)-5-{4-[(2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-(1-гидрокси-1-метилэтил)пирролидин-1-карбонил)фенил]-5-изопропилимидазолидин-2,4-диона
[1186]

[1187]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (49 мг), описанную в примере получения 45, и 2-[(2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-2-ил]пропан-2-ол•2 гидрохлорид (60 мг), описанный в примере получения 108, реакции и обработки, аналогичные тем, которые описаны в примере 200, осуществляли с получением указанного в заголовке соединения (60 мг).
MS(ESI)m/z:494(M+H)+
[1188]
Пример 204: Синтез 3-{5-[(2R,4S)-4-(3,5-диметилпиридин-2-иламино)-2-метилпирролидин-1-карбонил]пиридин-2-ил}-3-метоксиметилпирролидин-2,5-диона•2 гидрохлорида
[1189]

[1190]
К (3,5-диметилпиридин-2-ил)((3S,5R)-5-метилпирролидин-3-ил)амин•2 гидрохлориду (80 мг), описанному в примере получения 103, добавляли 6-(3-метоксиметил-2,5-диоксопирролидин-3-ил)никотиновую кислоту (84 мг), описанную в примере получения 64, 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (83 мг), 1-гидроксибензотриазол (58 мг), хлороформ (1,2 мл), тетрагидрофуран (1,2 мл) и триэтиламин (0,16 мл) и смесь перемешивали при комнатной температуре в течение 8 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол). Растворитель выпаривали, полученный остаток растворяли в этилацетате и добавляли 4 н раствор хлороводорода/этилацетата. Осадок собирали фильтрованием с получением указанного в заголовке соединения (100 мг).
MS(ESI)m/z:452(M+H)+
[1191]
Пример 205: Синтез (R)-5-{4-[3-(2,4-диметилбензил)пирролидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1192]
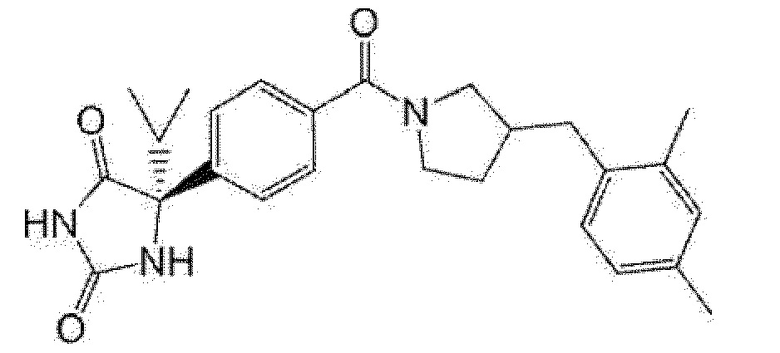
[1193]
К 3-(2,4-диметилбензил)пирролидину (100 мг) добавляли хлороформ (2 мл), триэтиламин (0,295 мл), 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (140 мг), описанную в примере получения 45, 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (150 мг) и 1-гидроксибензотриазол (107 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (104 мг).
MS(ESI)m/z:434(M+H)+
[1194]
Пример 206: Синтез (R)-5-{4-[(2S,4S)-4-(3,5-диметилпиридин-2-иламино)-2-(1-гидрокси-1-метилэтил)пирролидин-1-карбонил)фенил]-5-метилимидазолидин-2,4-диона
[1195]

[1196]
К 2-[(2S,4S)-4-(3,5-диметилпиридин-2-иламино)пирролидин-2-ил]пропан-2-ол•2 гидрохлориду (80 мг), описанному в примере получения 108, добавляли 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (64 мг), описанную в примере получения 6, 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (72 мг), 1-гидроксибензотриазол (50 мг), хлороформ (1,6 мл) и триэтиламин (0,14 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (78 мг).
MS(ESI)m/z:466(M+H)+
[1197]
Пример 207: Синтез (R)-5-[4-(4-индазол-2-илпиперидин-1-карбонил)фенил]-5-изопропилимидазолидин-2,4-диона
[1198]

[1199]
К 2-(пиперидин-4-ил)-2H-индазол•2 гидрохлориду (80 мг), описанному в примере получения 67, добавляли 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (98 мг), описанную в примере получения 45, 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (97 мг), 1-гидроксибензотриазол (70 мг), хлороформ (1,6 мл) и триэтиламин (190 мкл) и смесь перемешивали при комнатной температуре. После завершения реакции, добавляли насыщенный водный раствор гидрокарбоната натрия и хлороформ, и осадок собирали фильтрованием. Полученный осадок суспендировали в этаноле/воде и собирали фильтрованием с получением указанного в заголовке соединения (110 мг).
MS(ESI)m/z:446(M+H)+
[1200]
Пример 208: Синтез (R)-5-{4-[4-(5-хлориндазол-2-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1201]
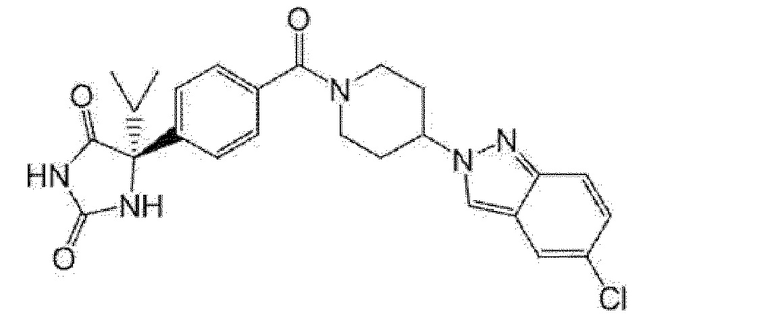
[1202]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (85 мг), описанную в примере получения 45, и 5-хлор-2-(пиперидин-4-ил)-2H-индазол•2 гидрохлорид (80 мг), описанный в примере получения 68, реакции и обработки, аналогичные тем, которые описаны в примере 207, осуществляли с получением указанного в заголовке соединения (105 мг).
MS(ESI)m/z:480(M+H)+
[1203]
Пример 209: Синтез (R)-5-{4-[4-(5-броминдазол-2-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1204]

[1205]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (73 мг), описанную в примере получения 45, и 5-бром-2-(пиперидин-4-ил)-2H-индазол•2 гидрохлорид (80 мг), описанный в примере получения 69, реакции и обработки, аналогичные тем, которые описаны в примере 207, осуществляли с получением указанного в заголовке соединения (78 мг).
MS(ESI)m/z:524(M+H)+
[1206]
Пример 210: Синтез (R)-5-{4-[4-(5-броминдазол-2-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1207]

[1208]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (70 мг), описанную в примере получения 45, и 5-метил-2-(пиперидин-4-ил)-2H-индазол•2 гидрохлорид в виде неочищенного продукта (60 мг), описанный в примере получения 70, реакции и обработки, аналогичные тем, которые описаны в примере 207, осуществляли с получением указанного в заголовке соединения (65 мг).
MS(ESI)m/z:460(M+H)+
[1209]
Пример 211: Синтез (R)-5-метил-5-{4-[4-(5-метилиндазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1210]

[1211]
Используя 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (61 мг), описанную в примере получения 6, и 5-метил-2-(пиперидин-4-ил)-2H-индазол•2 гидрохлорид в виде неочищенного продукта (60 мг), описанный в примере получения 70, реакции и обработки, аналогичные тем, которые описаны в примере 206, осуществляли с получением указанного в заголовке соединения (67 мг).
MS(ESI)m/z:432(M+H)+
[1212]
Пример 212: Синтез (R)-5-изопропил-5-{4-[4-(2-метилбензоил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1213]
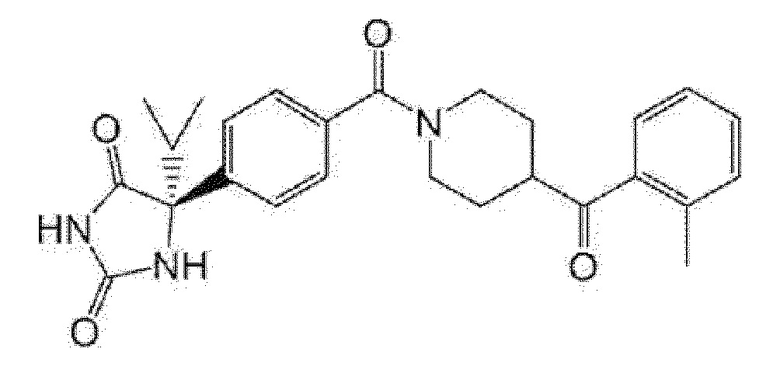
[1214]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (97 мг), описанную в примере получения 45, и (пиперидин-4-ил)(o-толил)метанон (81 мг), реакции и обработки, аналогичные тем, которые описаны в примере 205, осуществляли с получением указанного в заголовке соединения (84 мг).
MS(ESI)m/z:448(M+H)+
[1215]
Пример 213: Синтез (R)-5-(4-{4-[5-(3,5-дихлорпиридин-2-ил)[1,3,4]оксадиазол-2-ил]пиперидин-1-карбонил}фенил)-5-изопропилимидазолидин-2,4-диона
[1216]

[1217]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (62 мг), описанную в примере получения 45, и 3,5-дихлор-2-(5-пиперидин-4-ил[1,3,4]оксадиазол-2-ил)пиридин•2 гидрохлорид (80 мг), описанный в примере получения 71, реакции и обработки, аналогичные тем, которые описаны в примере 206, осуществляли с получением указанного в заголовке соединения (59 мг).
MS(ESI)m/z:543(M+H)+
[1218]
Пример 214: Синтез (R)-5-этил-5-{4-[4-(5-метилбензотиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1219]

[1220]
К 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (72 мг), описанной в примере получения 14, добавляли 5-метил-2-(пиперидин-4-ил)-1,3-бензотиазол (80 мг), 1-гидроксибензотриазол (70 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (100 мг), триэтиламин (145 мкл) и хлороформ (1,6 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (91 мг).
MS(ESI)m/z:463(M+H)+
[1221]
Пример 215: Синтез (R)-5-метил-5-(4-{4-[5-(5-метилпиридин-2-ил)тиазол-2-ил]пиперидин-1-карбонил}фенил)имидазолидин-2,4-диона
[1222]

[1223]
К 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (42 мг), описанной в примере получения 6, добавляли 5-метил-2-(2-пиперидин-4-илтиазол-5-ил)пиридин•гидрохлорид (55 мг), описанный в примере получения 72, 1-гидроксибензотриазол (34 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (48 мг), триэтиламин (70 мкл) и хлороформ (1,1 мл) и смесь перемешивали при комнатной температуре в течение ночи. Добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали хлороформом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (49 мг).
MS(ESI)m/z:476(M+H)+
[1224]
Пример 216: Синтез (R)-5-этил-5-(4-{4-[5-(5-метилпиридин-2-ил)тиазол-2-ил]пиперидин-1-карбонил}фенил)имидазолидин-2,4-диона
[1225]

[1226]
Используя 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (42 мг), описанную в примере получения 14, и 5-метил-2-(2-пиперидин-4-илтиазол-5-ил)пиридин•гидрохлорид (55 мг), описанный в примере получения 72, реакции и обработки, аналогичные тем, которые описаны в примере 215, осуществляли с получением указанного в заголовке соединения (46 мг).
MS(APCI)m/z:490(M+H)+
[1227]
Пример 217: Синтез (R)-5-{3-фтор-4-[4-(6-метилбензоксазол-2-ил)пиперидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[1228]
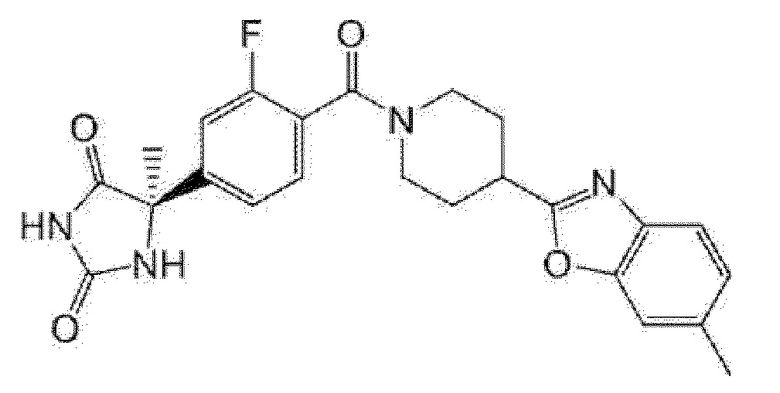
[1229]
Используя 2-фтор-4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (93 мг) описанную в примере получения 29, и 6-метил-2-(пиперидин-4-ил)-1,3-бензоксазол (80 мг), реакции и обработки, аналогичные тем, которые описаны в примере 214, осуществляли с получением указанного в заголовке соединения (46 мг).
MS(ESI)m/z:451(M+H)+
[1230]
Пример 218: Синтез (R)-5-этил-5-{4-[4-(5-метилоксазоло[5,4-b]пиридин-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1231]

[1232]
Используя 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (95 мг), описанную в примере получения 14, и 5-метил-2-(пиперидин-4-ил)оксазоло[5,4-b]пиридин (81 мг), описанный в примере получения 144, реакции и обработки, аналогичные тем, которые описаны в примере 214, осуществляли с получением указанного в заголовке соединения (110 мг).
MS(ESI)m/z:448(M+H)+
[1233]
Пример 219: Синтез (R)-5-этил-5-{4-[4-(6-метилтиазоло[4,5-b]пиридин-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1234]

[1235]
Используя 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (89 мг), описанную в примере получения 14, и 6-метил-2-(пиперидин-4-ил)тиазоло[4,5-b]пиридин в виде неочищенного продукта (152 мг), описанный в примере получения 145, реакции и обработки, аналогичные тем, которые описаны в примере 214, осуществляли с получением указанного в заголовке соединения (59 мг).
MS(ESI)m/z:464(M+H)+
[1236]
Пример 220: Синтез (R)-5-изопропил-5-{4-[4-(6-метилтиазоло[4,5-b]пиридин-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1237]

[1238]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (135 мг), описанную в примере получения 45, и 6-метил-2-(пиперидин-4-ил)тиазоло[4,5-b]пиридин в виде неочищенного продукта (200 мг), описанный в примере получения 145, реакции и обработки, аналогичные тем, которые описаны в примере 214, осуществляли с получением указанного в заголовке соединения (112 мг).
MS(ESI)m/z:478(M+H)+
[1239]
Пример 221: Синтез (R)-5-изопропил-5-{4-[4-(5-метилоксазоло[5,4-b]пиридин-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1240]

[1241]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (105 мг), описанной в примере получения 45, добавляли 5-метил-2-(пиперидин-4-ил)оксазоло[5,4-b]пиридин (80 мг), описанный в примере получения 144, 1-гидроксибензотриазол (75 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (105 мг), триэтиламин (155 мкл) и хлороформ (1,6 мл) и смесь перемешивали при комнатной температуре. После завершения реакции, добавляли насыщенный водный раствор гидрокарбоната натрия и осадок собирали фильтрованием. Полученный осадок суспендировали в этаноле/воде и собирали фильтрованием с получением указанного в заголовке соединения (117 мг).
MS(ESI)m/z:462(M+H)+
[1242]
Пример 222: Синтез (R)-5-изопропил-5-{4-[4-(5-метилтиазоло[5,4-b]пиридин-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1243]

[1244]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (115 мг), описанную в примере получения 45, и 5-метил-2-(пиперидин-4-ил)тиазоло[5,4-b]пиридин•трифторацетат в виде неочищенного продукта (500 мг), описанный в примере получения 146, реакции и обработки, аналогичные тем, которые описаны в примере 221, осуществляли с получением указанного в заголовке соединения (114 мг).
MS(ESI)m/z:478(M+H)+
[1245]
Пример 223: Синтез (R)-5-метил-5-{4-[4-(6-метилбензотиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1246]
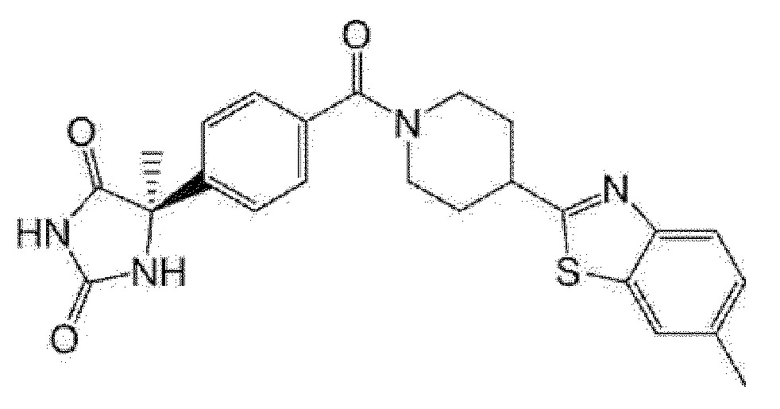
[1247]
Используя 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (78 мг), описанную в примере получения 6, и 6-метил-2-(пиперидин-4-ил)-1,3-бензотиазол•гидрохлорид (80 мг), реакции и обработки, аналогичные тем, которые описаны в примере 214, осуществляли с получением указанного в заголовке соединения (100 мг).
MS(ESI)m/z:449(M+H)+
[1248]
Пример 224: Синтез (R)-5-этил-5-{4-[4-(6-метилбензотиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1249]

[1250]
Используя 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (81 мг), описанную в примере получения 14, и 6-метил-2-(пиперидин-4-ил)-1,3-бензотиазол•гидрохлорид (80 мг), реакции и обработки, аналогичные тем, которые описаны в примере 214, осуществляли с получением указанного в заголовке соединения (107 мг).
MS(ESI)m/z:463(M+H)+
[1251]
Пример 225: Синтез (R)-5-изопропил-5-{4-[4-(6-метилбензотиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1252]

[1253]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (105 мг), описанную в примере получения 45, и 6-метил-2-(пиперидин-4-ил)-1,3-бензотиазол•гидрохлорид (80 мг), реакции и обработки, аналогичные тем, которые описаны в примере 221, осуществляли с получением указанного в заголовке соединения (103 мг).
MS(ESI)m/z:477(M+H)+
[1254]
Пример 226: Синтез 3-метоксиметил-3-{5-[4-(6-метилбензотиазол-2-ил)пиперидин-1-карбонил]пиридин-2-ил}пирролидин-2,5-диона
[1255]

[1256]
Используя 6-(3-метоксиметил-2,5-диоксопирролидин-3-ил)никотиновую кислоту (87 мг), описанную в примере получения 64, и 6-метил-2-(пиперидин-4-ил)-1,3-бензотиазол•гидрохлорид (80 мг), реакции и обработки, аналогичные тем, которые описаны в примере 214, осуществляли с получением указанного в заголовке соединения (101 мг).
MS(ESI)m/z:479(M+H)+
[1257]
Пример 227: Синтез (R)-5-изопропил-5-{4-[4-(5-фенил[1,3,4]тиадиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1258]

[1259]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (52,5 мг), описанной в примере получения 45, добавляли 4-(5-фенил[1,3,4]тиадиазол-2-ил)пиперидин•гидрохлорид (56,4 мг), 1-гидроксибензотриазол (28,4 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (40,3 мг) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и водой, и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (92 мг).
MS(APCI)m/z:490(M+H)+
[1260]
Пример 228: Синтез (R)-5-[4-(4-бензоксазол-2-илпиперидин-1-карбонил)фенил]-5-изопропилимидазолидин-2,4-диона
[1261]
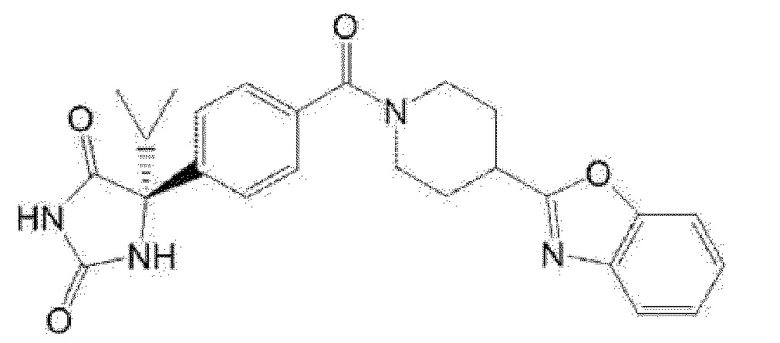
[1262]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 2-пиперидин-4-илбензоксазол (40,5 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (78 мг).
MS(APCI)m/z:447(M+H)+
[1263]
Пример 229: Синтез (R)-5-изопропил-5-{4-[4-(4-метилбензил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1264]
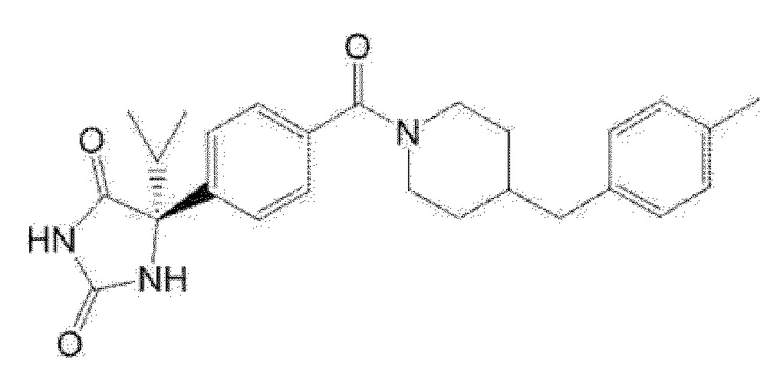
[1265]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (100 мг), описанной в примере получения 45, добавляли 4-(4-метилбензил)пиперидин (95 мг), 1-гидроксибензотриазол (51 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (110 мг), триэтиламин (0,064 мл) и N,N-диметилформамид (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь экстрагировали этилацетатом/гексаном. Органический слой промывали 10% водным раствором лимонной кислоты и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (117 мг).
MS(ESI)m/z:434(M+H)+
[1266]
Пример 230: Синтез (R)-5-изопропил-5-{4-[4-(5-метоксибензо[d]изоксазол-3-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1267]
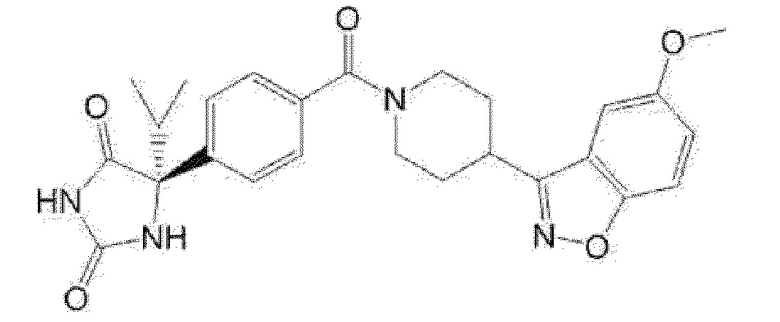
[1268]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 5-метокси-3-(4-пиперидил)-1,2-бензизоксазол•гидрохлорид (28,4 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (64 мг).
MS(APCI)m/z:477(M+H)+
[1269]
Пример 231: Синтез (R)-5-{4-[4-(4,6-диметилбензофуран-3-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1270]
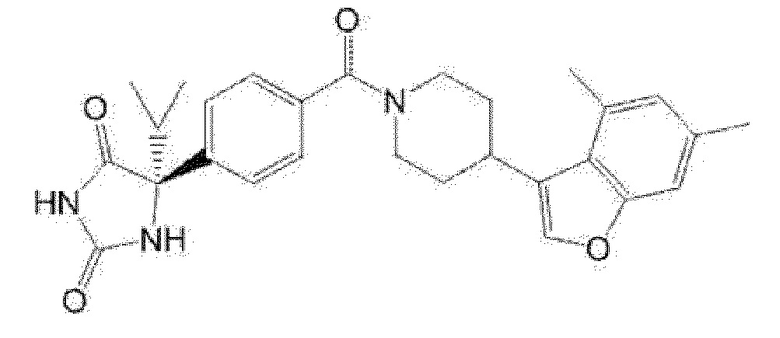
[1271]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (52,5 мг), описанной в примере получения 45, добавляли 4-(4,6-диметилбензофуран-3-ил)пиперидин•гидрохлорид (53,2 мг, см. пример получения 142), 1-гидроксибензотриазол (28,4 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (40,3 мг) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:этилацетат) с получением указанного в заголовке соединения (90 мг).
MS(APCI)m/z:474(M+H)+
[1272]
Пример 232: Синтез (R)-5-{4-[4-(5,6-диметилбензофуран-3-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1273]

[1274]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 4-(5,6-диметилбензофуран-3-ил)пиперидин•гидрохлорид (53,2 мг, см. пример получения 140), реакции и обработки, аналогичные тем, которые описаны в примере 231, осуществляли с получением указанного в заголовке соединения (92 мг).
MS(APCI)m/z:474(M+H)+
[1275]
Пример 233: Синтез (R)-5-{4-[4-(5,7-диметилбензофуран-3-ил)-пиперидин-1-карбонил]-фенил}-5-изопропилимидазолидин-2,4-диона
[1276]

[1277]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 4-(5,7-диметил-бензофуран-3-ил)пиперидин•гидрохлорид (53,2 мг, см. пример получения 138), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (73 мг).
MS(APCI)m/z:474(M+H)+
[1278]
Пример 234: Синтез (R)-5-{4-[4-(6-фторбензофуран-3-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1279]
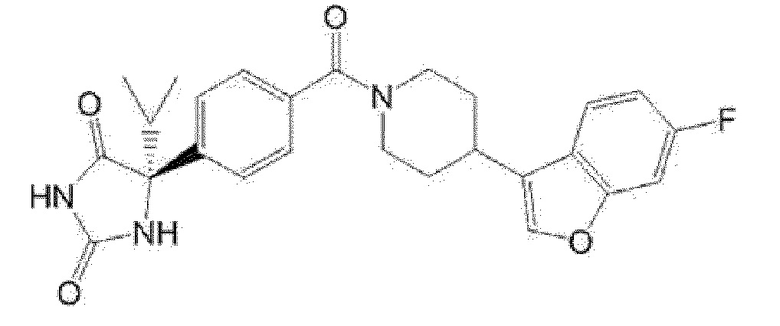
[1280]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 4-(6-фтор-1-бензофуран-3-ил)пиперидин (43,9 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (47 мг).
MS(APCI)m/z:464(M+H)+
[1281]
Пример 235: Синтез (R)-5-{4-[4-(5-фторбензо[d]изоксазол-3-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1282]
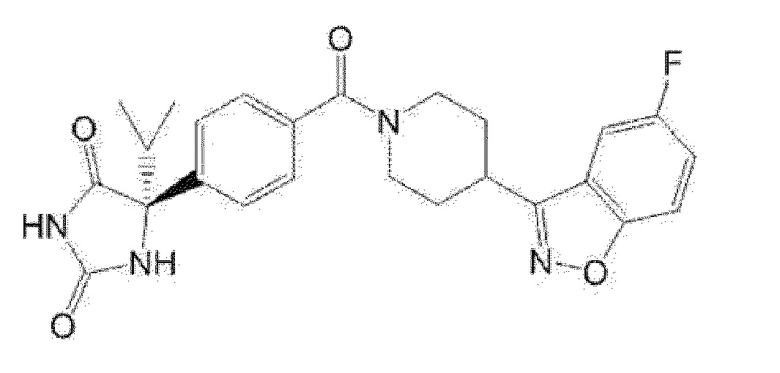
[1283]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 5-фтор-3-(4-пиперидинил)-1,2-бензизоксазола (44 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (60 мг).
MS(APCI)m/z:465(M+H)+
[1284]
Пример 236: Синтез (R)-5-{4-[4-(5-хлорбензо[d]изоксазол-3-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1285]
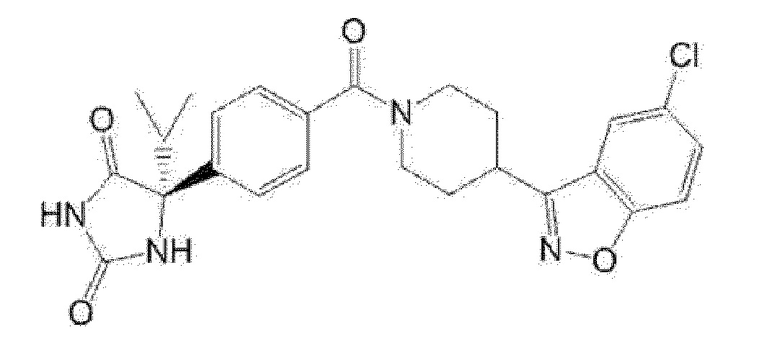
[1286]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 5-хлор-3-(пиперидин-4-ил)бензо[d]изоксазол (47,3 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (67 мг).
MS(APCI)m/z:481(M+H)+
[1287]
Пример 237: Синтез (R)-5-{4-[4-(5-хлорбензофуран-3-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1288]

[1289]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (52,5 мг), описанной в примере получения 45, добавляли 4-(5-хлорбензофуран-3-ил)пиперидин (47,1 мг), 1-гидроксибензотриазол (28,4 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (40,3 мг) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (59 мг).
MS(APCI)m/z:480(M+H)+
[1290]
Пример 238: Синтез (R)-5-{4-[4-(6-фторбензо[d]изоксазол-3-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1291]

[1292]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 6-фтор-3-(4-пиперидинил)-1,2-бензизоксазол (44 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (60 мг).
MS(APCI)m/z:465(M+H)+
[1293]
Пример 239: Синтез (R)-5-изопропил-5-{4-[4-(5-метилбензофуран-3-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1294]
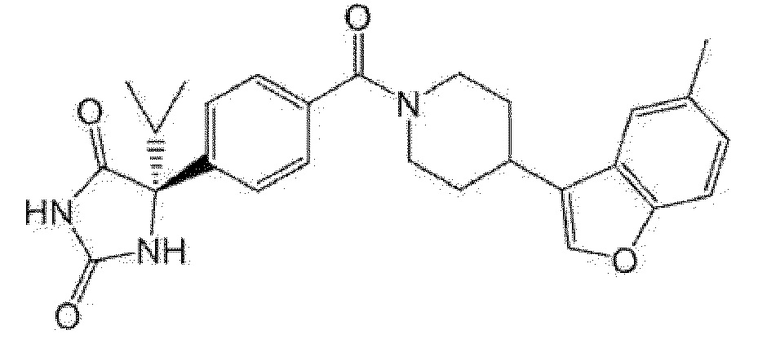
[1295]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 4-(5-метил-1-бензофуран-3-ил)пиперидин (43,1 мг), реакции и обработки, аналогичные тем, которые описаны в примере 237, осуществляли с получением указанного в заголовке соединения (56 мг).
MS(APCI)m/z:460(M+H)+
[1296]
Пример 240: Синтез (R)-5-изопропил-5-{4-[4-(6-метилбензофуран-3-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1297]

[1298]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 4-(6-метилбензофуран-3-ил)пиперидин•гидрохлорид (43,1 мг, см. пример получения 136), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (60 мг).
MS(APCI)m/z:460(M+H)+
[1299]
Пример 241: Синтез (R)-5-(4-{4-[5-(4-хлорфенил)[1,3,4]оксадиазол-2-ил]пиперидин-1-карбонил}фенил)-5-изопропилимидазолидин-2,4-диона
[1300]

[1301]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 4-[5-(4-хлорфенил)-1,3,4-оксадиазол-2-ил]пиперидин•гидробромид (68,9 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (9 мг).
MS(APCI)m/z:508(M+H)+
[1302]
Пример 242: Синтез (R)-5-изопропил-5-[4-(4-нафталин-2-илпиперидин-1-карбонил)фенил]имидазолидин-2,4-диона
[1303]
[1304]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 4-(2-нафтил)пиперидин•гидрохлорид (49,6 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (86 мг).
MS(APCI)m/z:456(M+H)+
[1305]
Пример 243: Синтез (R)-5-изопропил-5-{4-[4-(1-метил-1H-бензимидазол-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1306]

[1307]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (52,5 мг), описанной в примере получения 45, добавляли 1-метил-2-(пиперазин-1-ил)-1H-бензимидазол• 2 гидрохлорид (57,8 мг), 1-гидроксибензотриазол (28,4 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (40,3 мг) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (70 мг).
MS(APCI)m/z:461(M+H)+
[1308]
Пример 244: Синтез (R)-5-[4-(4-бензотиазол-2-илпиперидин-1-карбонил)фенил]-5-изопропилимидазолидин-2,4-диона
[1309]

[1310]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 2-(4-пиперидинил)-1,3-бензотиазол (43,7 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (70 мг).
MS(APCI)m/z:463(M+H)+
[1311]
Пример 245: Синтез (R)-5-{4-[4-(4,6-диметилбензофуран-3-ил)пиперидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[1312]

[1313]
К 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (50 мг), описанной в примере получения 6, добавляли 4-(4,6-диметилбензофуран-3-ил)пиперидин•гидрохлорид (57 мг, см. пример получения 142), 1-гидроксибензотриазол (29 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (53 мг), триэтиламин (59 мкл) и дихлорметан (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (54 мг).
MS(ESI)m/z:446(M+H)+
[1314]
Пример 246: Синтез (R)-5-метил-5-{4-[4-(6-метилбензофуран-3-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1315]

[1316]
К 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (50 мг), описанной в примере получения 6, добавляли 4-(6-метилбензофуран-3-ил)пиперидин•гидрохлорид (46 мг, см. пример получения 136), 1-гидроксибензотриазол (29 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (53 мг), триэтиламин (0,03 мл) и дихлорметан (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (33 мг).
MS(ESI)m/z:432(M+H)+
[1317]
Пример 247: Синтез (R)-5-изопропил-5-{4-[4-(1-метил-1H-индазол-4-ил)пиперазин-1-карбонил]фенил)имидазолидин-2,4-диона
[1318]
[1319]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (52,5 мг), описанной в примере получения 45, добавляли 1-метил-4-пиперазин-1-ил-1H-индазол• 2 гидрохлорид (57,8 мг), описанный в примере получения 143, 1-гидроксибензотриазол (28 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (40 мг), триэтиламин (0,056 мл) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным водным раствором гидрокарбоната натрия, и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (85 мг).
MS(APCI)m/z:461(M+H)+
[1320]
Пример 248: Синтез (R)-5-{4-[4-(5-фтор-1-метил-1H-индол-3-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1321]

[1322]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 5-фтор-1-метил-3-пиперидин-4-ил-1H-индол (46,5 мг), реакции и обработки, аналогичные тем, которые описаны в примере 231, осуществляли с получением указанного в заголовке соединения (79 мг).
MS(APCI)m/z:477(M+H)+
[1323]
Пример 249: Синтез (R)-5-{4-[4-(6-фторбензо[d]изотиазол-3-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1324]

[1325]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 6-фтор-3-(пиперидин-4-ил)бензо[d]изотиазол (47,3 мг), реакции и обработки, аналогичные тем, которые описаны в примере 231, осуществляли с получением указанного в заголовке соединения (43 мг).
MS(APCI)m/z:481(M+H)+
[1326]
Пример 250: Синтез (R)-5-{4-[4-(6-фтор-1-метил-1H-индазол-3-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1327]

[1328]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 6-фтор-1-метил-3-(пиперидин-4-ил)-1H-индазол (47,7 мг), реакции и обработки, аналогичные тем, которые описаны в примере 243, осуществляли с получением указанного в заголовке соединения (72 мг).
MS(APCI)m/z:478(M+H)+
[1329]
Пример 251: Синтез (R)-5-{4-[4-(6-фтор-1H-индазол-3-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1330]
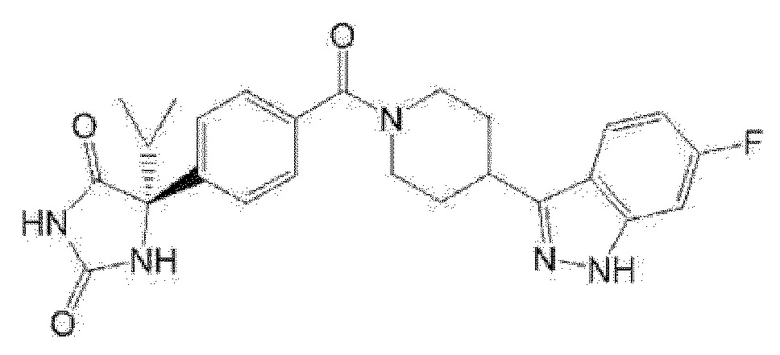
[1331]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 6-фтор-3-(пиперидин-4-ил)-1H-индазол (43,9 мг), реакции и обработки, аналогичные тем, которые описаны в примере 243, осуществляли с получением указанного в заголовке соединения (72 мг).
MS(APCI)m/z:464(M+H)+
[1332]
Пример 252: Синтез (R)-5-[4-(4-бензо[d]изоксазол-3-илпиперазин-1-карбонил)фенил]-5-изопропилимидазолидин-2,4-диона
[1333]

[1334]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 3-пиперазин-1-ил-1,2-бензизоксазол (40,6 мг), реакции и обработки, аналогичные тем, которые описаны в примере 231, осуществляли с получением указанного в заголовке соединения (75 мг).
MS(APCI)m/z:448(M+H)+
[1335]
Пример 253: Синтез (R)-5-{4-[4-(6-хлорбензо[d]изотиазол-3-ил)пиперазин-1-карбонил)фенил]-5-изопропилимидазолидин-2,4-диона
[1336]
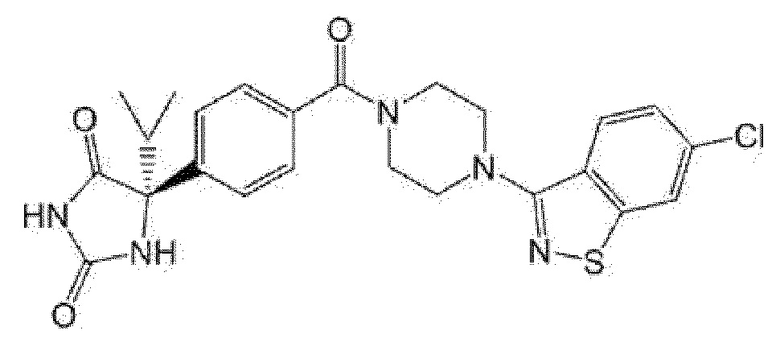
[1337]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 6-хлор-3-(пиперазин-1-ил)бензо[d]изотиазол (50,8 мг), реакции и обработки, аналогичные тем, которые описаны в примере 231, осуществляли с получением указанного в заголовке соединения (99 мг).
MS(APCI)m/z:498(M+H)+
[1338]
Пример 254: Синтез (R)-5-изопропил-5-{4-[4-(4-фенилтиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1339]
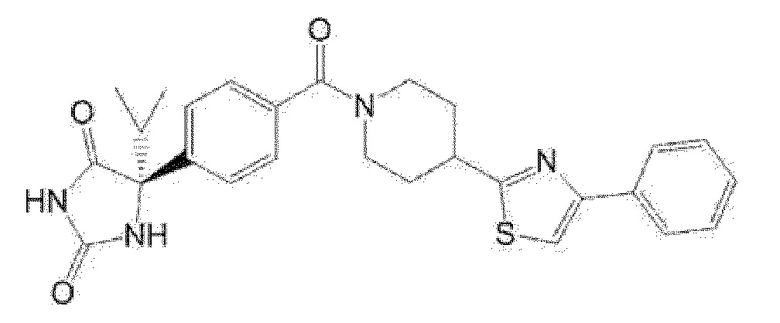
[1340]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (52,5 мг), описанной в примере получения 45, добавляли 4-(4-фенил-1,3-тиазол-2-ил)пиперидин (48,9 мг), 1-гидроксибензотриазол (28,4 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (40,3 мг) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии с NH (хлороформ:метанол) с получением указанного в заголовке соединения (15 мг).
MS(APCI)m/z:489(M+H)+
[1341]
Пример 255: Синтез (R)-5-изопропил-5-[4-(4-хинолин-2-илпиперазин-1-карбонил)фенил]имидазолидин-2,4-диона
[1342]

[1343]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 2-(пиперазин-1-ил)хинолин (42,7 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (74 мг).
MS(APCI)m/z:458(M+H)+
[1344]
Пример 256: Синтез (R)-5-{4-[4-(6-хлор-5-метилбензоксазол-2-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1345]

[1346]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 6-хлор-5-метил-2-пиперидин-4-ил-1,3-бензоксазол (50,1 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (79 мг).
MS(APCI)m/z:495(M+H)+
[1347]
Пример 257: Синтез (R)-5-изопропил-5-{4-[4-(6-метилбензоксазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1348]

[1349]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 6-метил-2-(пиперидин-4-ил)-1,3-бензоксазол (43,3 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (76 мг).
MS(APCI)m/z:461(M+H)+
[1350]
Пример 258: Синтез (R)-5-изопропил-5-{4-[4-(4-метилбензоксазол-2-ил)пиперидин-1-карбонил]фенил}-имидазолидин-2,4-диона
[1351]

[1352]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 4-метил-2-пиперидин-4-ил-1,3-бензоксазол (43,3 мг), реакции и обработки, аналогичные тем, которые описаны в примере 231, осуществляли с получением указанного в заголовке соединения (79 мг).
MS(APCI)m/z:461(M+H)+
[1353]
Пример 259: Синтез (R)-5-изопропил-5-{4-[4-(5-фенилтиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1354]
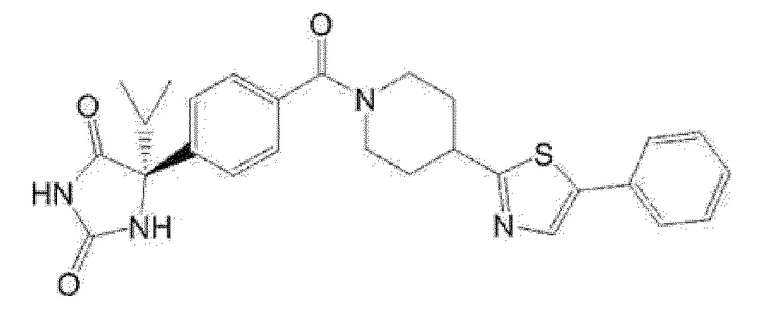
[1355]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 4-(5-фенилтиазол-2-ил)пиперидин (48,9 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (94 мг).
MS(APCI)m/z:489(M+H)+
[1356]
Пример 260: Синтез (R)-5-изопропил-5-{4-[4-(3-фенилизоксазол-5-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1357]

[1358]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 4-(3-фенилизоксазол-5-ил)пиперидин (45,7 мг), реакции и обработки, аналогичные тем, которые описаны в примере 237, осуществляли с получением указанного в заголовке соединения (39 мг).
MS(APCI)m/z:473(M+H)+
[1359]
Пример 261: Синтез (R)-5-{4-[4-(1H-индол-2-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1360]

[1361]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 2-(пиперидин-4-ил)-1H-индол (40,1 мг), реакции и обработки, аналогичные тем, которые описаны в примере 237, осуществляли с получением указанного в заголовке соединения (74 мг).
MS(APCI)m/z:445(M+H)+
[1362]
Пример 262: Синтез (R)-5-изопропил-5-{4-[4-(5-трифторметилбензотиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1363]
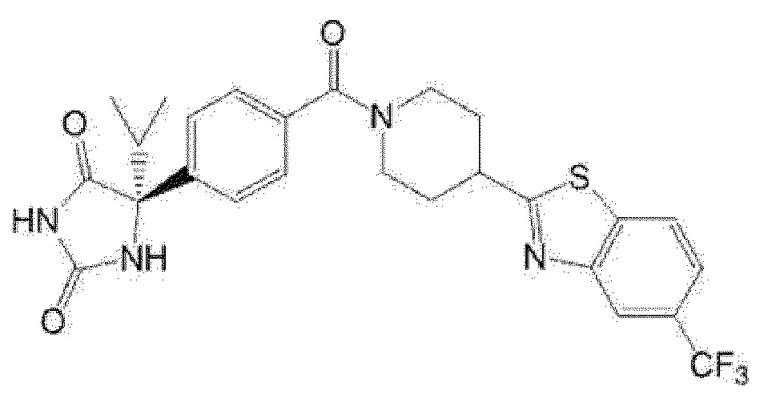
[1364]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 2-(пиперидин-4-ил)-5-(трифторметил)-1,3-бензотиазол (57,1 мг), реакции и обработки, аналогичные тем, которые описаны в примере 237, осуществляли с получением указанного в заголовке соединения (97 мг).
MS(APCI)m/z:531(M+H)+
[1365]
Пример 263: Синтез (R)-5-{4-[4-(5-хлорбензоксазол-2-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1366]

[1367]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 5-хлор-2-(пиперидин-4-ил)-1,3-бензоксазол (47,3 мг), реакции и обработки, аналогичные тем, которые описаны в примере 237, осуществляли с получением указанного в заголовке соединения (77 мг).
MS(APCI)m/z:481(M+H)+
[1368]
Пример 264: Синтез (R)-5-изопропил-5-{4-[4-(5-метилбензотиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1369]

[1370]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 5-метил-2-(пиперидин-4-ил)-1,3-бензотиазол (46,5 мг), реакции и обработки, аналогичные тем, которые описаны в примере 237, осуществляли с получением указанного в заголовке соединения (84 мг).
MS(APCI)m/z:477(M+H)+
[1371]
Пример 265: Синтез (R)-5-(4-{4-[5-(4-хлорфенил)-1H-пиразол-3-ил]пиперидин-1-карбонил}фенил}-5-изопропилимидазолидин-2,4-диона
[1372]

[1373]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,5 мг), описанную в примере получения 45, и 4-[5-(4-хлорфенил)-1H-пиразол-3-ил]пиперидин (52,4 мг), реакции и обработки, аналогичные тем, которые описаны в примере 243, осуществляли с получением указанного в заголовке соединения (97 мг).
MS(APCI)m/z:506(M+H)+
[1374]
Пример 266: Синтез (R)-5-изопропил-5-[4-(4-нафталин-2-илпиперазин-1-карбонил)фенил]имидазолидин-2,4-диона
[1375]

[1376]
К 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (52,5 мг), описанной в примере получения 45, добавляли 1-(нафталин-2-ил)пиперазин•гидрохлорид (52,4 мг), 1-гидроксибензотриазол (28,4 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (40,3 мг), триэтиламин (0,028 мл) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (97 мг).
MS(APCI)m/z:457(M+H)+
[1377]
Пример 267: Синтез (R)-5-метил-5-{4-[4-(6-метилбензоксазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1378]
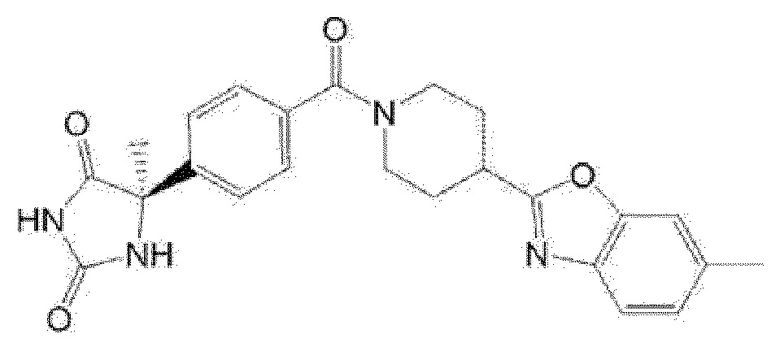
[1379]
Используя 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (46,8 мг), описанную в примере получения 6, и 6-метил-2-пиперидин-4-ил-1,3-бензоксазол (43,3 мг), реакции и обработки, аналогичные тем, которые описаны в примере 254, осуществляли с получением указанного в заголовке соединения (58 мг).
MS(APCI)m/z:433(M+H)+
[1380]
Пример 268: Синтез (R)-5-метил-5-{4-[4-(5-трифторметилбензотиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1381]
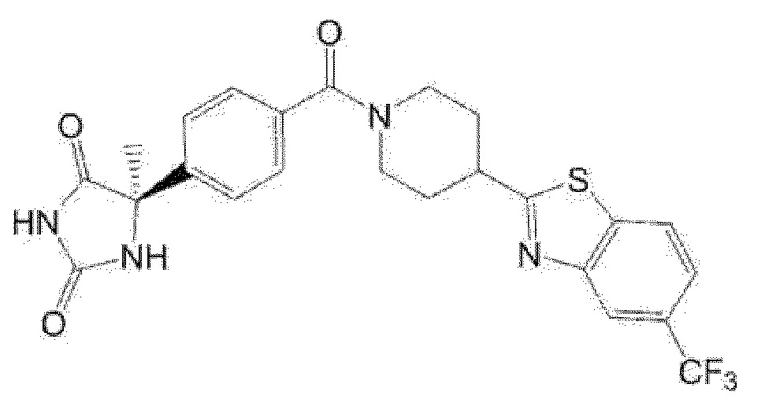
[1382]
Используя 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (46,8 мг), описанную в примере получения 6, и 2-(пиперидин-4-ил)-5-(трифторметил)-1,3-бензотиазол (57,3 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (67 мг).
MS(APCI)m/z:503(M+H)+
[1383]
Пример 269: Синтез (R)-5-(4-{4-[5-(4-хлорфенил)-1H-пиразол-3-ил]пиперидин-1-карбонил}фенил)-5-метилимидазолидин-2,4-диона
[1384]

[1385]
Используя 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (46,8 мг), описанную в примере получения 6, и 4-[5-(4-хлорфенил)-1H-пиразол-3-ил]пиперидин (52,4 мг), реакции и обработки, аналогичные тем, которые описаны в примере 227, осуществляли с получением указанного в заголовке соединения (91 мг).
MS(APCI)m/z:478(M+H)+
[1386]
Пример 270: Синтез (R)-5-изопропил-5-{4-[4-(1-метил-1H-бензимидазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1387]

[1388]
К смеси 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (67 мг), описанной в примере получения 45, 1-метил-2-пиперидин-4-ил-1H-бензоимидазол•2 гидрохлорида (70 мг), 1-гидроксибензотриазола (39 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорида (56 мг) и хлороформа (3 мл) добавляли триэтиламин (0,102 мл) и смесь перемешивали при комнатной температуре в течение 3,5 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (хлороформ:метанол) с получением указанного в заголовке соединения (71,3 мг).
MS(ESI)m/z:460(M+H)+
[1389]
Пример 271: Синтез (R)-5-{4-[4-(5,7-диметилиндазол-2-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1390]
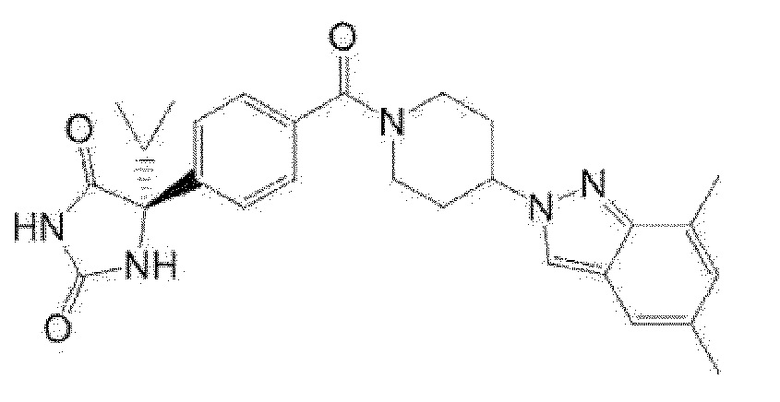
[1391]
К смеси 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (52 мг), описанной в примере получения 45, 5,7-диметил-2-пиперидин-4-ил-2H-индазол•гидрохлорида (50 мг), описанного в примере получения 96, 1-гидроксибензотриазола (31 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорида (43 мг) и хлороформа (1 мл) добавляли триэтиламин (0,058 мл) и смесь перемешивали при комнатной температуре в течение 3,5 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (хлороформ:метанол) с получением указанного в заголовке соединения (51,2 мг).
MS(ESI)m/z:474(M+H)+
[1392]
Пример 272: Синтез (R)-5-{4-[4-(5,7-диметилиндазол-1-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1393]

[1394]
Используя 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52 мг), описанную в примере получения 45, и 5,7-диметил-1-пиперидин-4-ил-1H-индазол•гидрохлорид (50 мг), описанный в примере получения 97, реакции и обработки, аналогичные тем, которые описаны в примере 271, осуществляли с получением указанного в заголовке соединения (73,4 мг).
MS(ESI)m/z:474(M+H)+
[1395]
Пример 273: Синтез (R)-5-{4-[4-(5,7-диметилиндазол-2-ил)пиперидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[1396]

[1397]
Используя 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (46 мг), описанную в примере получения 6, и 5,7-диметил-2-пиперидин-4-ил-2H-индазол•гидрохлорид (50 мг), описанный в примере получения 96, реакции и обработки, аналогичные тем, которые описаны в примере 271, осуществляли с получением указанного в заголовке соединения (43,3 мг).
MS(ESI)m/z:446(M+H)+
[1398]
Пример 274: Синтез (R)-5-{4-[4-(5,7-диметилиндазол-1-ил)пиперидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[1399]

[1400]
Используя 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (46 мг), описанную в примере получения 6, и 5,7-диметил-1-пиперидин-4-ил-1H-индазол•гидрохлорид (50 мг), описанный в примере получения 97, реакции и обработки, аналогичные тем, которые описаны в примере 271, осуществляли с получением указанного в заголовке соединения (59,3 мг).
MS(ESI)m/z:446(M+H)+
[1401]
Пример 275: Синтез (R)-5-{4-[4-(4,6-диметил-1H-индазол-3-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1402]
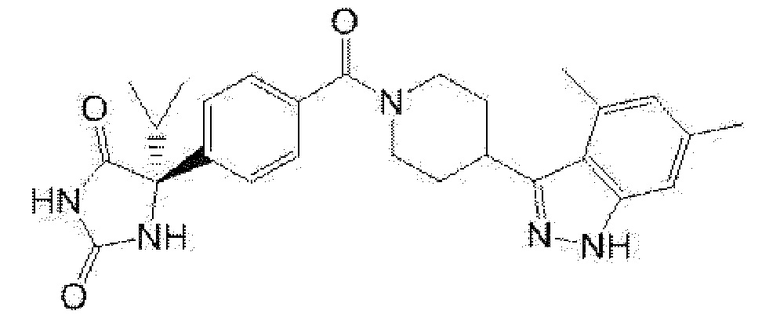
[1403]
Смесь 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (14,4 мг), описанной в примере получения 45, 4,6-диметил-3-пиперидин-4-ил-1H-индазола (12 мг), описанного в примере получения 98, 1-гидроксибензотриазола (8,5 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорида (12 мг), триэтиламина (0,01 мл) и хлороформа (0,2 мл) перемешивали при комнатной температуре в течение 6 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (хлороформ:метанол) с получением указанного в заголовке соединения (18,0 мг).
MS(ESI)m/z:474(M+H)+
[1404]
Пример 276: Синтез (R)-5-{4-[4-(4,6-диметил-1H-индазол-3-ил)пиперидин-1-карбонил]фенил}-5-метил-имидазолидин-2,4-диона
[1405]

[1406]
К смеси 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (46 мг), описанной в примере получения 6, 4,6-диметил-3-пиперидин-4-ил-1H-индазола (50 мг), описанного в примере получения 98, 1-гидроксибензотриазола (31 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорида (43 мг), хлороформа (1 мл) добавляли триэтиламин (0,029 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (хлороформ:метанол) с получением указанного в заголовке соединения (72,3 мг).
MS(ESI)m/z:446(M+H)+
[1407]
Пример 277: Синтез (R)-5-изопропил-5-{4-[4-(1,4,6-триметил-1H-индазол-3-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1408]
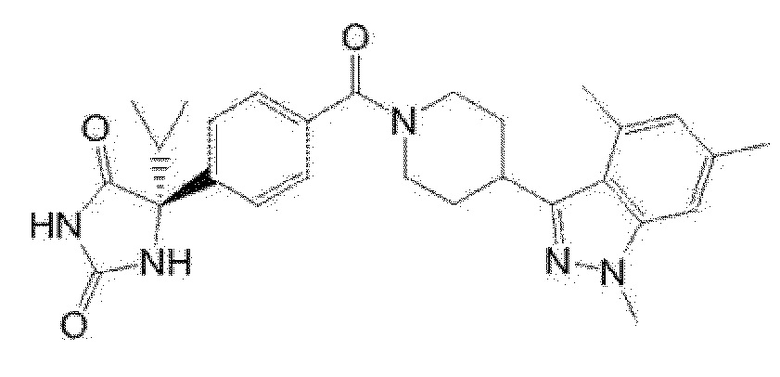
[1409]
Смесь 4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (52,2 мг), описанной в примере получения 45, 1,4,6-триметил-3-пиперидин-4-ил-1H-индазол•гидрохлорида (60 мг), описанного в примере получения 99, 1-гидроксибензотриазола (30,8 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорида (43,6 мг), триэтиламина (0,085 мл) и хлороформа (1,2 мл) перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (хлороформ:метанол) с получением указанного в заголовке соединения (50,9 мг).
MS(ESI)m/z:488(M+H)+
[1410]
Пример 278: Синтез (R)-5-метил-5-{4-[4-(1,4,6-триметил-1H-индазол-3-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1411]

[1412]
Используя 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (46,7 мг), описанную в примере получения 6, и 1,4,6-триметил-3-пиперидин-4-ил-1H-индазол•гидрохлорид (60 мг), описанный в примере получения 99, реакции и обработки, аналогичные тем, которые описаны в примере 277, осуществляли с получением указанного в заголовке соединения (49 мг).
MS(ESI)m/z:460(M+H)+
[1413]
Пример 279: Синтез (R)-5-{4-[4-(5-хлорбензотиазол-2-ил)пиперидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[1414]

[1415]
Смесь 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (50 мг), описанной в примере получения 6, 5-хлор-2-пиперидин-4-ил-1,3-бензотиазола (51 мг), 1-гидроксибензотриазола (33 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорида (47 мг), триэтиламина (0,037 мл) и хлороформа (1 мл) перемешивали при комнатной температуре в течение 5 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (хлороформ:метанол) с получением указанного в заголовке соединения (49,7 мг).
MS(ESI)m/z:469(M+H)+
[1416]
Пример 280: Синтез (R)-5-{4-[4-(4-фтор-6-метил-1H-индазол-3-ил)пиперидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[1417]

[1418]
К смеси 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (28 мг), описанной в примере получения 6, 4-фтор-6-метил-3-пиперидин-4-ил-1H-индазола (32 мг), описанного в примере получения 100, 1-гидроксибензотриазола (18 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорида (26 мг) и хлороформа (1 мл) добавляли триэтиламин (0,034 мл) и смесь перемешивали при комнатной температуре в течение 5 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (хлороформ:метанол) с получением указанного в заголовке соединения (18 мг).
MS(ESI)m/z:450(M+H)+
[1419]
Пример 281: Синтез (R)-5-метил-5-{4-[4-(5-п-толуил-1H-пиразол-3-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1420]

[1421]
Смесь 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (102 мг), описанной в примере получения 6, 4-(5-п-толил-1H-пиразол-3-ил)пиперидина (96 мг), описанного в примере получения 77, 1-гидроксибензотриазола (67 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорида (96 мг), триэтиламина (69 мкл) и хлороформа (1 мл) перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и хлороформ, и смесь декантировали. Осадок промывали водой, добавляли этанол, и полученный раствор этанола концентрировали при пониженном давлении. Органический слой супернатанта также концентрировали при пониженном давлении. Полученный остаток объединяли и смесь очищали колоночной хроматографией (хлороформ:метанол) с получением указанного в заголовке соединения (125 мг).
MS(ESI)m/z:458(M+H)+
[1422]
Пример 282: Синтез (R)-5-{4-[4-(2,3-диметилфенил)пиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1423]

[1424]
К 4-((R)-4-изопропил-2,5-диоксо-имидазолидин-4-ил)бензойной кислоте (76 мг), описанной в примере получения 45, добавляли 1-(2,3-диметилфенил)пиперазин•гидрохлорид (63,5 мг), 1-гидроксибензотриазол (37,3 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (52,9 мг), триэтиламин (39 мкл) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (94 мг).
MS(APCI)m/z:435(M+H)+
[1425]
Пример 283: Синтез (R)-5-{4-[4-(3,4-диметилфенил)пиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1426]

[1427]
К 4-((R)-4-изопропил-2,5-диоксо-имидазолидин-4-ил)бензойной кислоте (76 мг), описанной в примере получения 45, добавляли 1-(3,4-диметилфенил)пиперазин (53,3 мг), 1-гидроксибензотриазол (37,3 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (52,9 мг) и N,N-диметилформамид (1 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли насыщенный солевой раствор и смесь экстрагировали этилацетатом. Органический слой концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (91 мг).
MS(APCI)m/z:435(M+H)+
[1428]
Пример 284: Синтез (R)-5-изопропил-5-{4-[4-(3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1429]

[1430]
Используя 4-((R)-4-изопропил-2,5-диоксо-имидазолидин-4-ил)бензойную кислоту (76 мг), описанную в примере получения 45, и 1-(3-метилпиридин-2-ил)пиперазин (49,6 мг), реакции и обработки, аналогичные тем, которые описаны в примере 283, осуществляли с получением указанного в заголовке соединения (83 мг).
MS(APCI)m/z:422(M+H)+
[1431]
Пример 285: Синтез (R)-5-{4-[4-(2,6-диметилфенил)пиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1432]

[1433]
Используя 4-((R)-4-изопропил-2,5-диоксо-имидазолидин-4-ил)бензойную кислоту (79 мг), описанную в примере получения 45, и 1-(2,6-диметилфенил)пиперазин (68,9 мг), реакции и обработки, аналогичные тем, которые описаны в примере 283, осуществляли с получением указанного в заголовке соединения (68 мг).
MS(ESI)m/z:435(M+H)+
[1434]
Пример 286: Синтез 5-{4-[4-(2,4-диметилфенил)пиперазин-1-карбонил]фенил}-5-пропилимидазолидин-2,4-диона
[1435]
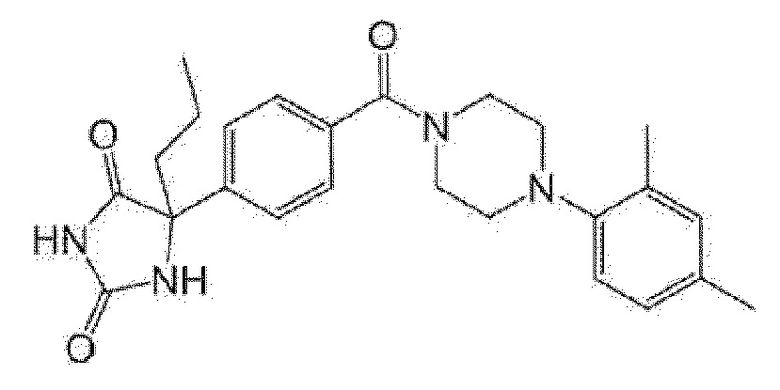
[1436]
К 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)бензойной кислоте (200 мг), описанной в примере получения 16, добавляли 1-(2,4-диметилфенил)пиперазин (145 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (176 мг), 1-гидроксибензотриазол•1 гидрат (103 мг), N,N-диметилформамид (5 мл) и триэтиламин (0,213 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли воду, и смесь экстрагировали хлороформом. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (241 мг).
MS(ESI)m/z:435(M+H)+
[1437]
Пример 287: Синтез 5-пропил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1438]
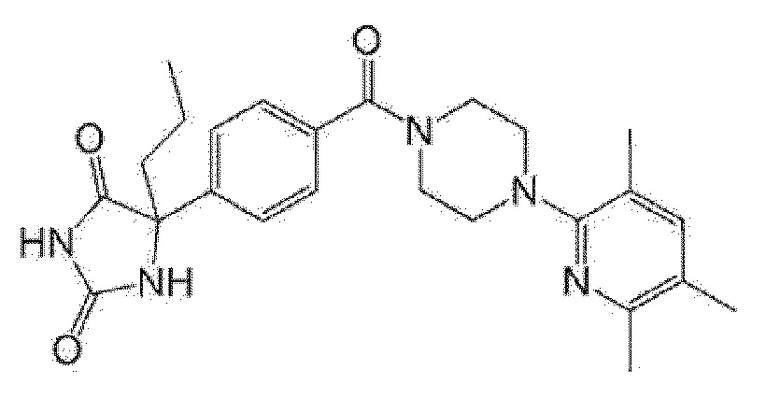
[1439]
Используя 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)бензойную кислоту (200 мг), описанную в примере получения 16, и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (157 мг), реакции и обработки, аналогичные тем, которые описаны в примере 286, осуществляли с получением указанного в заголовке соединения (163 мг).
MS(ESI)m/z:450(M+H)+
[1440]
Пример 288: Синтез 5-{4-[4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-пропилимидазолидин-2,4-диона
[1441]

[1442]
К 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)бензойной кислоте (200 мг), описанной в примере получения 16, добавляли 1-(3,5-дициклопропилпиридин-2-ил)пиперазин•2 гидрохлорид (213 мг), описанный в примере получения 147, 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (176 мг), 1-гидроксибензотриазол•1 гидрат (103 мг), N,N-диметилформамид (5 мл) и триэтиламин (0,426 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли воду, и смесь экстрагировали хлороформом. Полученный органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (157 мг).
MS(ESI)m/z:488(M+H)+
[1443]
Пример 289: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-пропилимидазолидин-2,4-диона
[1444]
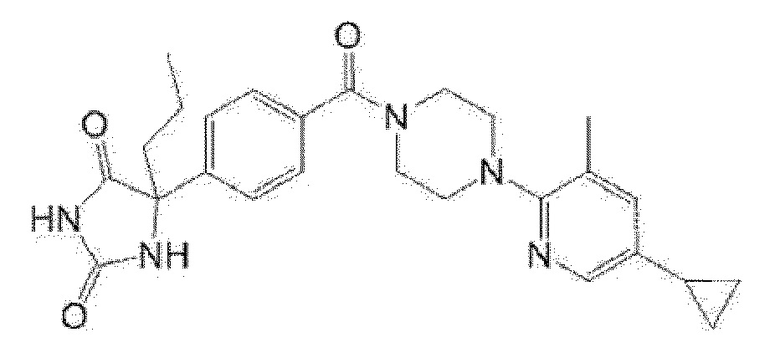
[1445]
Используя 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)бензойную кислоту (100 мг), описанную в примере получения 16, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (83 мг), реакции и обработки, аналогичные тем, которые описаны в примере 286, осуществляли с получением указанного в заголовке соединения (132 мг).
MS(ESI)m/z:462(M+H)+
[1446]
Пример 290: Синтез 5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-пропилимидазолидин-2,4-диона
[1447]

[1448]
Используя 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)бензойную кислоту (100 мг), описанную в примере получения 16, и 1-(5-этил-3-метилпиридин-2-ил)пиперазин (79 мг), реакции и обработки, аналогичные тем, которые описаны в примере 286, осуществляли с получением указанного в заголовке соединения (131 мг).
MS(ESI)m/z:450(M+H)+
[1449]
Пример 291: Синтез 3-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-метилпирролидин-2,5-диона
[1450]

[1451]
К 4-(3-метил-2,5-диоксопирролидин-3-ил)бензойной кислоте (209 мг), описанной в примере получения 41, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин (256 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (257 мг), 1-гидроксибензотриазол•1 гидрат (181 мг), N,N-диметилформамид (10 мл) и триэтиламин (0,375 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали хлороформом. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (183 мг).
MS(ESI)m/z:407(M+H)+
[1452]
Пример 292: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-пропилимидазолидин-2,4-диона
[1453]

[1454]
К 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)-2-фторбензойной кислоте (100 мг), описанной в примере получения 17, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин (68,3 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (82,1 мг), 1-гидроксибензотриазол•1 гидрат (48,2 мг), N,N-диметилформамид (5 мл) и триэтиламин (0,1 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (136 мг).
MS(ESI)m/z:454(M+H)+
[1455]
Пример 293: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-пропилимидазолидин-2,4-диона
[1456]

[1457]
Используя 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)-2-фторбензойную кислоту (100 мг), описанную в примере получения 17, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (77,6 мг), реакции и обработки, аналогичные тем, которые описаны в примере 292, осуществляли с получением указанного в заголовке соединения (143 мг).
MS(ESI)m/z:480(M+H)+
[1458]
Пример 294: Синтез 5-{3-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-пропилимидазолидин-2,4-диона
[1459]

[1460]
Используя 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)-2-фторбензойную кислоту (100 мг), описанную в примере получения 17, и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (73,3 мг), реакции и обработки, аналогичные тем, которые описаны в примере 292, осуществляли с получением указанного в заголовке соединения (79 мг).
MS(ESI)m/z:468(M+H)+
[1461]
Пример 295: Синтез (R)-5-пропил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона и (S)-5-пропил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1462]
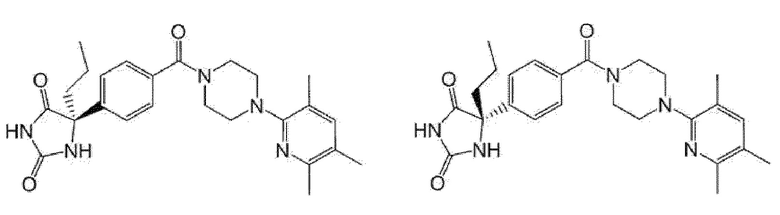
[1463]
5-пропил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-дион (122 мг, см. пример 287) разделяли с помощью колонки среднего давления с использованием CHIRALFLASH (Daicel) IC (гексан/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 28 мг (MS(ESI)m/z:450(M+H)+) и соединение с большим временем удерживания 32 мг (MS(ESI)m/z:450(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, гексан/этанол/диэтиламин=10/90/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 7,9 мин и 13,9 мин.
[1464]
Пример 296: Синтез (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-пропилимидазолидин-2,4-диона и (S)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-пропилимидазолидин-2,4-диона
[1465]

[1466]
К 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)бензойной кислоте (400 мг), описанной в примере получения 16, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин (293 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (353 мг), 1-гидроксибензотриазол•1 гидрат (207 мг), N,N-диметилформамид (10 мл) и триэтиламин (0,43 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении, к полученному остатку добавляли воду и смесь экстрагировали этилацетатом. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель выпаривали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-пропилимидазолидин-2,4-диона (484 мг).
Полученный 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-пропилимидазолидин-2,4-дион (300 мг) разделяли с помощью колонки среднего давления с использованием CHIRALFLASH (Daicel) IC (гексан/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 149 мг (MS(ESI)m/z:436(M+H)+) и соединение с большим временем удерживания 143 мг (MS(ESI)m/z:436(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, гексан/этанол/диэтиламин=10/90/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 8,8 мин и 16,6 мин.
[1467]
Пример 297: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-пропилимидазолидин-2,4-диона
[1468]

[1469]
К 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)-3-фторбензойной кислоте (120 мг), описанной в примере получения 30, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин (90 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (90,3 мг), 1-гидроксибензотриазол•1 гидрат (63,6 мг), N,N-диметилформамид (5 мл) и триэтиламин (0,12 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (166 мг).
MS(ESI)m/z:454(M+H)+
[1470]
Пример 298: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-2-фторфенил}-5-пропилимидазолидин-2,4-диона
[1471]

[1472]
Используя 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)-3-фторбензойную кислоту (120 мг), описанную в примере получения 30, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (102 мг), реакции и обработки, аналогичные тем, которые описаны в примере 297, осуществляли с получением указанного в заголовке соединения (174 мг).
MS(ESI)m/z:480(M+H)+
[1473]
Пример 299: Синтез 5-{2-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-пропилимидазолидин-2,4-диона
[1474]
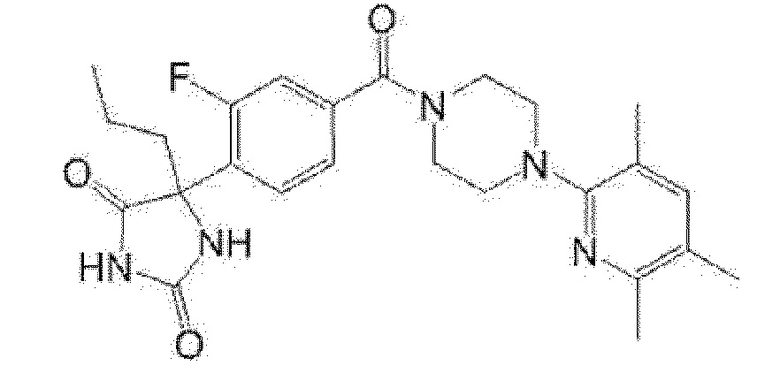
[1475]
К 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)-3-фторбензойной кислоте (101 мг), описанной в примере получения 30, добавляли 1-(3,5,6-триметилпиридин-2-ил)пиперазин (96,7 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (90 мг), 1-гидроксибензотриазол•1 гидрат (63,6 мг), N,N-диметилформамид (5 мл) и триэтиламин (0,12 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (130 мг).
MS(ESI)m/z:468(M+H)+
[1476]
Пример 300: Синтез 5-циклопропил-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}имидазолидин-2,4-диона
[1477]
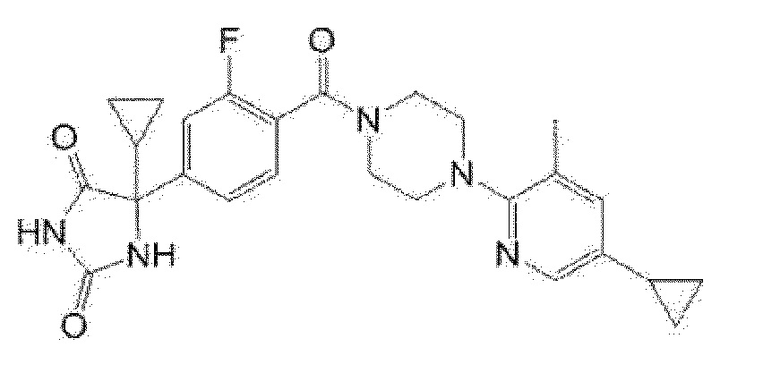
[1478]
Используя 4-(4-циклопропил-2,5-диоксоимидазолидин-4-ил)-2-фторбензойную кислоту (150 мг), описанную в примере получения 34, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (129 мг), реакции и обработки, аналогичные тем, которые описаны в примере 297, осуществляли с получением указанного в заголовке соединения (207 мг).
MS(ESI)m/z:478(M+H)+
[1479]
Пример 301: Синтез 5-циклопропил-5-{3-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1480]

[1481]
Используя 4-(4-циклопропил-2,5-диоксоимидазолидин-4-ил)-2-фторбензойную кислоту (150 мг), описанную в примере получения 34, и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (122 мг), реакции и обработки, аналогичные тем, которые описаны в примере 297, осуществляли с получением указанного в заголовке соединения (205 мг).
MS(ESI)m/z:466(M+H)+
[1482]
Пример 302: Синтез 3-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-метилпирролидин-2,5-диона
[1483]
[1484]
Используя 4-(3-метил-2,5-диоксопирролидин-3-ил)бензойную кислоту (150 мг), описанную в примере получения 41, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин•гидрохлорид (245 мг), реакции и обработки, аналогичные тем, которые описаны в примере 291, осуществляли с получением указанного в заголовке соединения (151 мг).
MS(ESI)m/z:433(M+H)+
[1485]
Пример 303: Синтез 3-метил-3-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}пирролидин-2,5-диона
[1486]
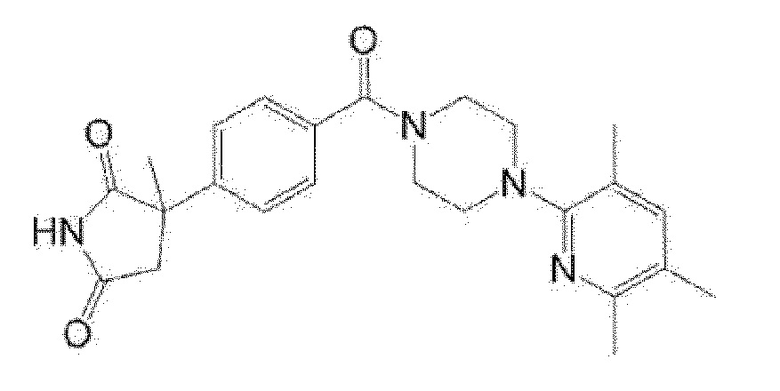
[1487]
Используя 4-(3-метил-2,5-диоксопирролидин-3-ил)бензойную кислоту (150 мг), описанную в примере получения 41, и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (198 мг), реакции и обработки, аналогичные тем, которые описаны в примере 291, осуществляли с получением указанного в заголовке соединения (134 мг).
MS(ESI)m/z:421(M+H)+
[1488]
Пример 304: Синтез 5-циклопропил-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}имидазолидин-2,4-диона
[1489]
[1490]
Используя 4-(4-циклопропил-2,5-диоксоимидазолидин-4-ил)-2-фторбензойную кислоту (150 мг), описанную в примере получения 34, и 1-(3,5-диметилпиридин-2-ил)пиперазин (113 мг), реакции и обработки, аналогичные тем, которые описаны в примере 297, осуществляли с получением указанного в заголовке соединения (133 мг).
MS(ESI)m/z:452(M+H)+
[1491]
Пример 305: Синтез (R)-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-пропилимидазолидин-2,4-диона и (S)-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-пропилимидазолидин-2,4-диона
[1492]
[1493]
5-{4-[4-(5-Циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-пропилимидазолидин-2,4-дион (90 мг, см. пример 289) разделяли с помощью колонки среднего давления с использованием CHIRALFLASH (Daicel) IC (этанол/гексан/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 30 мг (MS(ESI)m/z:462(M+H)+) и соединение с большим временем удерживания 32 мг (MS(ESI)m/z:462(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, этанол/диэтиламин=100/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 8,5 мин и 15,0 мин.
[1494]
Пример 306: Синтез (R)-3-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-метилпирролидин-2,5-диона и (S)-3-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-метилпирролидин-2,5-диона
[1495]

[1496]
3-{4-[4-(3,5-Диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-метилпирролидин-2,5-диона (168 мг, см. пример 291) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) ID (тетрагидрофуран/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 79,3 мг (MS(ESI)m/z:407(M+H)+) и соединение с большим временем удерживания 78,6 мг (MS(ESI)m/z:407(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) ID-3 (4,6 мм×150 мм, тетрагидрофуран/этанол/диэтиламин=20/80/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 7,6 мин и 10,0 мин.
[1497]
Пример 307: Синтез 3-{5-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]пиридин-2-ил}-3-метилпирролидин-2,5-диона
[1498]
[1499]
К 6-(3-метил-2,5-диоксопирролидин-3-ил)никотиновой кислоте (40 мг), описанной в примере получения 50, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин (42,8 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (36 мг), 1-гидроксибензотриазол•1 гидрат (25,4 мг), N,N-диметилформамид (3 мл) и триэтиламин (0,048 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (58 мг).
MS(ESI)m/z:408(M+H)+
[1500]
Пример 308: Синтез 3-{5-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]пиридин-2-ил}-3-изопропилпирролидин-2,5-диона
[1501]

[1502]
К 6-(3-изопропил-2,5-диоксопирролидин-3-ил)никотиновой кислоте (52,7 мг), описанной в примере получения 52, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин (50,3 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (42,4 мг), 1-гидроксибензотриазол•1 гидрат (30 мг), N,N-диметилформамид (3 мл) и триэтиламин (0,056 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (75 мг).
MS(ESI)m/z:436(M+H)+
[1503]
Пример 309: Синтез 5-[4-(4'-гидрокси-3,5-диметил-3',4',5',6'-тетрагидро-2'H-[2,4']бипиридинил-1'-карбонил)фенил]-5-изопропилимидазолидин-2,4-диона
[1504]

[1505]
4-((R)-4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (52,7 мг), описанную в примере получения 45, 3,5-диметил-2',3',5',6'-тетрагидро-1'H-[2,4']бипиридинил-4'-ол•2 гидрохлорид (58,9 мг), описанный в примере получения 74, 1-гидроксибензотриазол•1 гидрат (28,5 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (40,5 мг) и триэтиламин (0,084 мл) растворяли в N,N-диметилформамиде (3 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (74 мг).
MS(ESI)m/z:451(M+H)+
[1506]
Пример 310: Синтез (R)-3-{5-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]пиридин-2-ил}-3-метоксиметилпирролидин-2,5-диона и (S)-3-{5-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]пиридин-2-ил}-3-метоксиметилпирролидин-2,5-диона
[1507]

[1508]
3-{5-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]пиридин-2-ил}-3-метоксиметилпирролидин-2,5-дион (397 мг, см. пример 192) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IA (2-пропанол/тетрагидрофуран/уксусная кислота) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 186 мг (MS(ESI)m/z:438(M+H)+) и соединение с большим временем удерживания 188 мг (MS(ESI)m/z:438(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IA-3 (4,6 мм×150 мм, 2-пропанол/тетрагидрофуран/уксусная кислота =90/10/0,5, поток 0,5 мл/мин), время удерживания составляло, соответственно, 6,6 мин и 8,5 мин.
[1509]
Пример 311: Синтез (R)-3-{5-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]пиридин-2-ил}-3-этилпирролидин-2,5-диона и (S)-3-{5-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]пиридин-2-ил}-3-этилпирролидин-2,5-диона
[1510]

[1511]
6-(3-этил-2,5-диоксопирролидин-3-ил)никотиновую кислоту (500 мг, см. пример получения 51), 1-(3,5-диметилпиридин-2-ил)пиперазин (425 мг), 1-гидроксибензотриазол•1 гидрат (300 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (425 мг) растворяли в N,N-диметилформамиде (30 мл), добавляли триэтиламин (0,56 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением 3-{5-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]пиридин-2-ил}-3-этилпирролидин-2,5-диона (868 мг).
Полученный 3-{5-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]пиридин-2-ил}-3-этилпирролидин-2,5-дион (862 мг) разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IA (2-пропанол/тетрагидрофуран/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 449 мг (MS(ESI)m/z:422(M+H)+) и соединение с большим временем удерживания 446 мг (MS(ESI)m/z:422(M+H)+)).
При анализе с использованием CHIRALPAK (Daicel) IA-3 (4,6 мм×50 мм, 2-пропанол/тетрагидрофуран/диэтиламин=70/30/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 5,1 мин и 11,1 мин.
[1512]
Пример 312: Синтез 5-бутил-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1513]

[1514]
К раствору 1-(3,5-диметилпиридин-2-ил)пиперазина (48 мг) в N,N-диметилформамиде (0,5 мл) добавляли 4-(4-бутил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (69 мг), описанную в примере получения 7, 1-гидроксибензотриазол (37 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (53 мг) и диизопропилэтиламин (0,049 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением с получением указанного в заголовке соединения (55 мг).
MS(APCI)m/z:450(M+H)+
[1515]
Пример 313: Синтез 5-бутил-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1516]
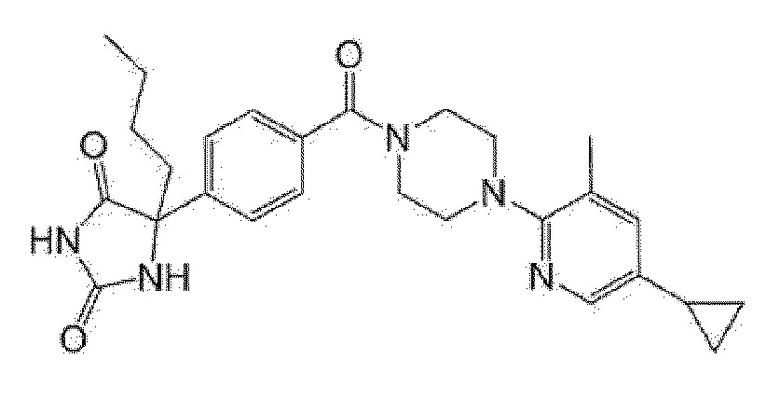
[1517]
К раствору 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазина (54 мг) в N,N-диметилформамиде (0,5 мл) добавляли 4-(4-бутил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (69 мг), описанную в примере получения 7, 1-гидроксибензотриазол (37 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (53 мг) и диизопропилэтиламин (0,049 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат и хлороформ:метанол) с получением указанного в заголовке соединения (73 мг).
MS(ESI)m/z:476(M+H)+
[1518]
Пример 314: Синтез 5-бутил-5-{4-[4-(5-этил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1519]

[1520]
Используя 4-(4-бутил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (69 мг), описанную в примере получения 7, и 1-(5-этил-3-метилпиридин-2-ил)пиперазин (51 мг), реакции и обработки, аналогичные тем, которые описаны в примере 313, осуществляли с получением указанного в заголовке соединения (77 мг).
MS(ESI)m/z:464(M+H)+
[1521]
Пример 315: Синтез 5-бутил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1522]
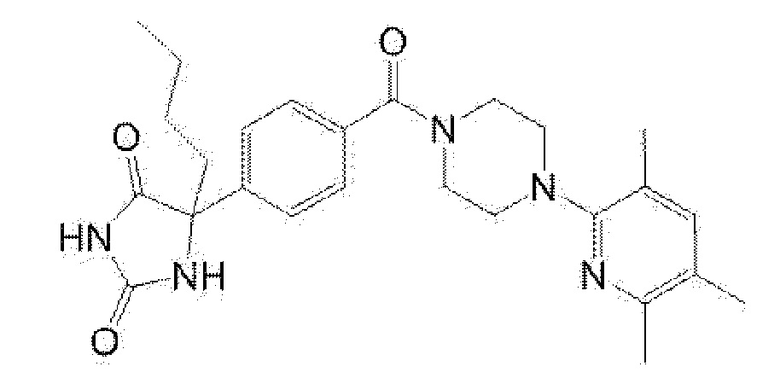
[1523]
Используя 4-(4-бутил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (69 мг), описанную в примере получения 7, и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (51 мг), реакции и обработки, аналогичные тем, которые описаны в примере 313, осуществляли с получением указанного в заголовке соединения (43 мг).
MS(ESI)m/z:464(M+H)+
[1524]
Пример 316: Синтез 5-бутил-5-{4-[4-(3,5-дициклопропилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1525]

[1526]
Используя 4-(4-бутил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (69 мг), описанную в примере получения 7, и 1-(3,5-дициклопропилпиридин-2-ил)пиперазин•2 гидрохлорид (79 мг), описанный в примере получения 147, реакции и обработки, аналогичные тем, которые описаны в примере 313, осуществляли с получением указанного в заголовке соединения (67 мг).
MS(ESI)m/z:502(M+H)+
[1527]
Пример 317: Синтез 5-бутил-5-{4-[4-(2,4-диметилфенил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1528]

[1529]
К 4-(4-бутил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (111 мг), описанной в примере получения 7, добавляли 1-(2,4-диметилфенил)пиперазин (76 мг), N,N-диметилформамид (0,8 мл), 1-гидроксибензотриазол (59 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (84 мг) и диизопропилэтиламин (0,077 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия, и растворитель выпаривали. К полученному остатку добавляли этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (93 мг).
MS(ESI)m/z:449(M+H)+
[1530]
Пример 318: Синтез 3-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-этилпирролидин-2,5-диона
[1531]
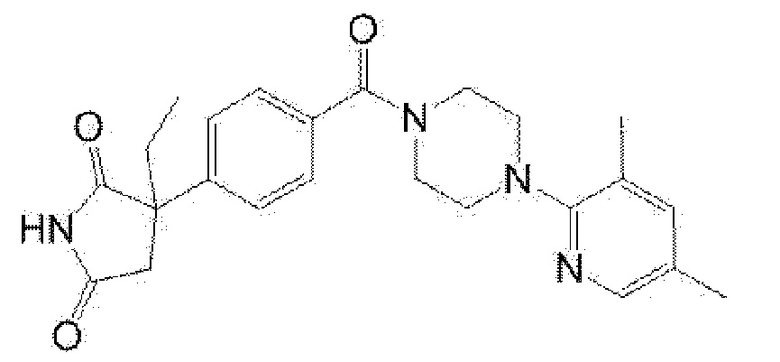
[1532]
К 4-(3-этил-2,5-диоксопирролидин-3-ил)бензойной кислоте (240 мг), описанной в примере получения 20, добавляли N,N-диметилформамид (2 мл), 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (251 мг), 1-гидроксибензотриазол (149 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (211 мг) и диизопропилэтиламин (0,383 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и растворитель выпаривали. К полученному остатку добавляли этанол/воду, и осадок собирали фильтрованием с получением указанного в заголовке соединения (229 мг).
MS(ESI)m/z:419(M-H)-
[1533]
Пример 319: Синтез 3-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-этил-1-метилпирролидин-2,5-диона
[1534]

[1535]
К 3-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-этилпирролидин-2,5-диону (25 мг), описанному в примере 318, добавляли N,N-диметилформамид (0,25 мл), карбонат калия (24 мг) и метилиодид (8,4 мг) и смесь перемешивали при комнатной температуре в течение 1,5 часов. К реакционной смеси добавляли этилацетат и смесь фильтровали. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (гексан:этилацетат) с получением указанного в заголовке соединения (23 мг).
MS(ESI)m/z:435(M+H)+
[1536]
Пример 320: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-(тетрагидропиран-4-ил)имидазолидин-2,4-диона
[1537]

[1538]
К 4-[2,5-диоксо-4-(тетрагидропиран-4-ил)имидазолидин-4-ил]бензойной кислоте (183 мг), описанной в примере получения 32, добавляли N,N-диметилформамид (1,32 мл), 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (165 мг), 1-гидроксибензотриазол (99 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (140 мг) и диизопропилэтиламин (0,253 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом натрия. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (107 мг).
MS(ESI)m/z:476(M-H)-
[1539]
Пример 321: Синтез 5-циклобутил-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1540]

[1541]
4-(4-Циклобутил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (247 мг), описанную в примере получения 33, 1-(3,5-диметилпиридин-2-ил)пиперазин (251 мг), 1-гидроксибензотриазол (149 мг) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (211 мг) растворяли в N,N-диметилформамиде (4,0 мл), добавляли диизопропилэтиламин (0,383 мл), и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и осадок собирали фильтрованием. Полученный осадок растворяли в этилацетате, сушили над безводным сульфатом натрия, и растворитель выпаривали. К полученному остатку добавляли этилацетат и осадок собирали фильтрованием с получением указанного в заголовке соединения (312 мг).
MS(ESI)m/z:446(M-H)-
[1542]
Пример 322: Синтез 5-циклобутил-5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1543]
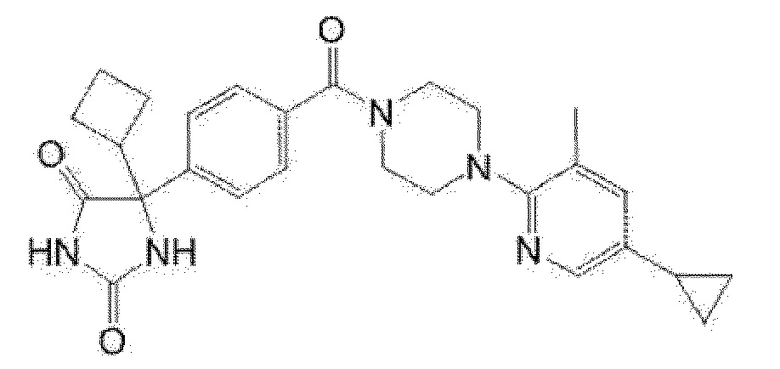
[1544]
Используя 4-(4-циклобутил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (247 мг), описанную в примере получения 33, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (239 мг), реакции и обработки, аналогичные тем, которые описаны в примере 321, осуществляли с получением указанного в заголовке соединения (255 мг).
MS(ESI)m/z:472(M-H)-
[1545]
Пример 323: Синтез 5-циклобутил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1546]
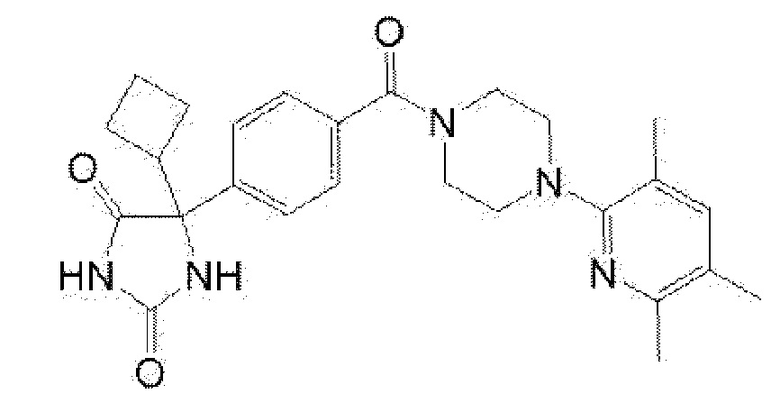
[1547]
Используя 4-(4-циклобутил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (247 мг), описанную в примере получения 33, и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (226 мг), реакции и обработки, аналогичные тем, которые описаны в примере 321, осуществляли с получением указанного в заголовке соединения (315 мг).
MS(ESI)m/z:460(M-H)-
[1548]
Пример 324: Синтез (R)-3-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-этилпирролидин-2,5-диона и (S)-3-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-этилпирролидин-2,5-диона
[1549]
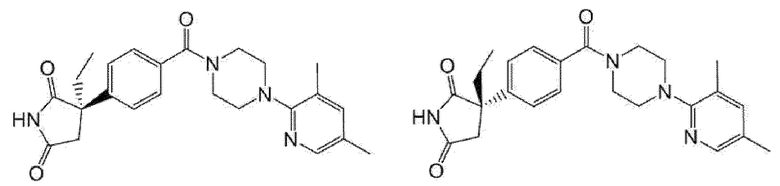
[1550]
3-{4-[4-(3,5-Диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-этилпирролидин-2,5-дион (169 мг), описанный в примере 318, разделяли с помощью ВЭЖХ с использованием CHIRALPAK (Daicel) IC (тетрагидрофуран/этанол/диэтиламин) с получением указанных выше обоих энантиомеров (соединение с коротким временем удерживания 76 мг (MS(ESI)m/z:419(M-H)-) и соединение с большим временем удерживания 74 мг (MS(ESI)m/z:419(M-H)-).
При анализе с использованием CHIRALPAK (Daicel) IC-3 (4,6 мм×150 мм, тетрагидрофуран/этанол/диэтиламин=15/85/0,1, поток 0,5 мл/мин), время удерживания составляло, соответственно, 7,3 мин и 8,6 мин.
[1551]
Пример 325: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-(тетрагидропиран-4-ил)имидазолидин-2,4-диона
[1552]

[1553]
К 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазину (172 мг) добавляли N,N-диметилформамид (3,2 мл), 4-[2,5-диоксо-4-(тетрагидропиран-4-ил)имидазолидин-4-ил]бензойную кислоту (239 мг), описанную в примере получения 32, 1-гидроксибензотриазол (107 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (151 мг) и диизопропилэтиламин (0,138 мл) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель выпаривали и к полученному остатку добавляли гексан/этилацетат. Осадок собирали фильтрованием с получением указанного в заголовке соединения (186 мг).
MS(ESI)m/z:502(M-H)-
[1554]
Пример 326: Синтез 5-(тетрагидропиран-4-ил)-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-диона
[1555]
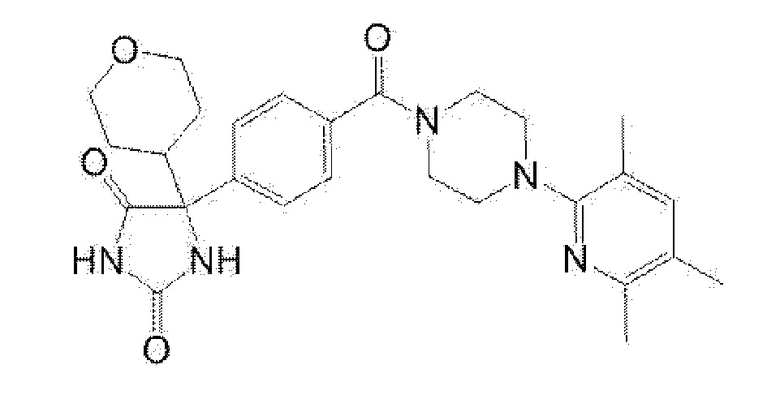
[1556]
Используя 4-[2,5-диоксо-4-(тетрагидропиран-4-ил)имидазолидин-4-ил]бензойную кислоту (239 мг), описанную в примере получения 32, и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (162 мг), реакции и обработки, аналогичные тем, которые описаны в примере 325, осуществляли с получением указанного в заголовке соединения (180 мг).
MS(ESI)m/z:490(M-H)-
[1557]
Пример 327: Синтез 5-трет-бутил-5-{5-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]пиридин-2-ил}имидазолидин-2,4-диона
[1558]
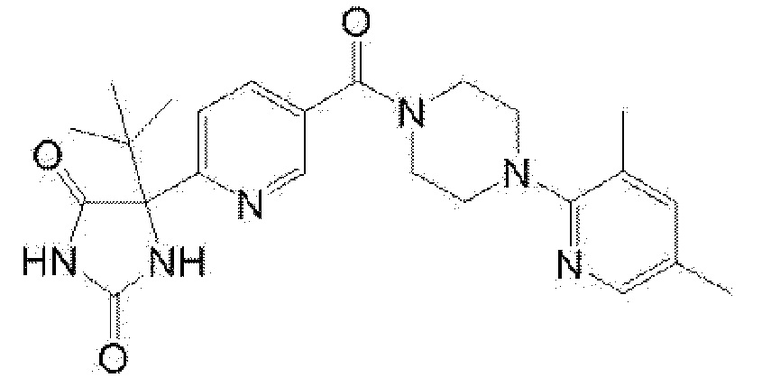
[1559]
Используя 6-(4-трет-бутил-2,5-диоксоимидазолидин-4-ил)никотиновую кислоту в виде неочищенного продукта (119 мг, см. пример получения 46) и 1-(3,5-диметилпиридин-2-ил)пиперазин (108 мг), реакции и обработки, аналогичные тем, которые описаны в примере 321, осуществляли с получением указанного в заголовке соединения (88 мг).
MS(ESI)m/z:451(M+H)+
[1560]
Пример 328: Синтез 5-изопропил-5-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}имидазолидин-2,4-дион
[1561]

[1562]
Смесь 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (100 мг), описанной в примере получения 5, 1-(3,5,6-триметилпиридин-2-ил)пиперазина (86,1 мг), 1-гидроксибензотриазола (61,8 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорида (95 мг), хлороформа (3 мл) и N,N-диметилформамида (1 мл) перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали и полученный остаток очищали при помощи колоночной хроматографии (гексан:этилацетат) с получением указанного в заголовке соединения (131,5 мг).
MS(ESI)m/z:450(M+H)+
[1563]
Пример 329: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона
[1564]

[1565]
Используя 4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (100 мг), описанную в примере получения 5, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (91,1 мг), реакции и обработки, аналогичные тем, которые описаны в примере 328, осуществляли с получением указанного в заголовке соединения (102,9 мг).
MS(ESI)m/z:462(M+H)+
[1566]
Пример 330: Синтез 3-этил-3-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}пирролидин-2,4-диона
[1567]

[1568]
Используя 4-(3-этил-2,5-диоксопирролидин-3-ил)бензойную кислоту (150 мг), описанную в примере получения 20, и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (137 мг), реакции и обработки, аналогичные тем, которые описаны в примере 328, осуществляли с получением указанного в заголовке соединения (106 мг).
MS(ESI)m/z:435(M+H)+
[1569]
Пример 331: Синтез 3-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-этилпирролидин-2,4-диона
[1570]

[1571]
Используя 4-(3-этил-2,5-диоксопирролидин-3-ил)бензойную кислоту (150 мг), описанную в примере получения 20, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (145 мг), реакции и обработки, аналогичные тем, которые описаны в примере 328, осуществляли с получением указанного в заголовке соединения (101,6 мг).
MS(ESI)m/z:447(M+H)+
[1572]
Пример 332: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-метоксиметилимидазолидин-2,4-диона
[1573]

[1574]
К 2-фтор-4-(4-метоксиметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (95 мг), описанной в примере получения 28, добавляли 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (84,3 мг), хлороформ (2,8 мл), N,N-диметилформамид (1 мл), 1-гидроксибензотриазол (54,6 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (83,9 мг) и триэтиламин (0,103 мл) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (60,3 мг).
MS(ESI)m/z:456(M+H)+
[1575]
Пример 333: Синтез 5-{3-фтор-4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метоксиметилимидазолидин-2,4-диона
[1576]

[1577]
Смесь 2-фтор-4-(4-метоксиметил-2,5-диоксоимидазолидин-4-ил)бензойной кислоты (85 мг), описанной в примере получения 28, 1-(3,5,6-триметилпиридин-2-ил)пиперазина (68 мг), 1-гидроксибензотриазола (48,8 мг), 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорида (75,1 мг), хлороформа (2,6 мл) и N,N-диметилформамида (0,8 мл) перемешивали при комнатной температуре в течение 4 часов. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (хлороформ:метанол) с получением указанного в заголовке соединения (75,6 мг).
MS(ESI)m/z:470(M+H)+
[1578]
Пример 334: Синтез 5-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]-3-фторфенил}-5-метоксиметилимидазолидин-2,4-диона
[1579]

[1580]
Используя 2-фтор-4-(4-метоксиметил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (85 мг), описанную в примере получения 28, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин (72 мг), реакции и обработки, аналогичные тем, которые описаны в примере 333, осуществляли с получением указанного в заголовке соединения (74,9 мг).
MS(ESI)m/z:482(M+H)+
[1581]
Пример 335: Синтез 5-трет-бутил-5-{6-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]пиридин-3-ил}имидазолидин-2,4-диона
[1582]

[1583]
Используя 5-(4-трет-бутил-2,5-диоксоимидазолидин-4-ил)пиридин-2-карбоновую кислоту (240 мг), описанную в примере получения 43, и 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (216,8 мг), реакции и обработки, аналогичные тем, которые описаны в примере 332, осуществляли с получением указанного в заголовке соединения (256,7 мг).
MS(ESI)m/z:451(M+H)+
[1584]
Пример 336: Синтез 3-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-изопропилпирролидин-2,5-диона
[1585]

[1586]
Используя 4-(3-изопропил-2,5-диоксопирролидин-3-ил)бензойную кислоту (120 мг), описанную в примере получения 49, и 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (112,8 мг), реакции и обработки, аналогичные тем, которые описаны в примере 332, осуществляли с получением указанного в заголовке соединения (156 мг).
MS(ESI)m/z:435(M+H)+
[1587]
Пример 337: Синтез 3-изопропил-3-{4-[4-(3,5,6-триметилпиридин-2-ил)пиперазин-1-карбонил]фенил}пирролидин-2,5-диона
[1588]
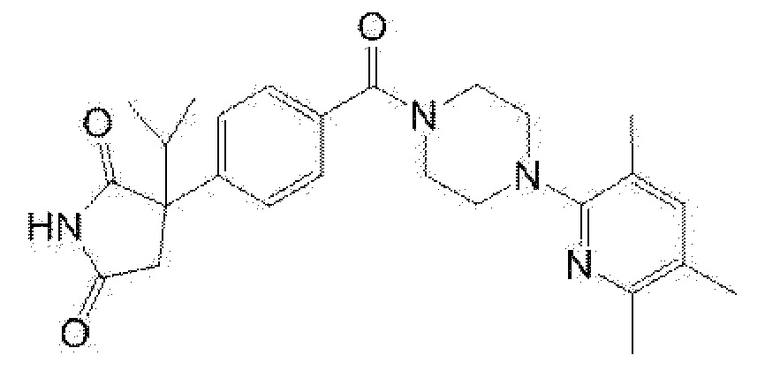
[1589]
Используя 4-(3-изопропил-2,5-диоксопирролидин-3-ил)бензойную кислоту (120 мг), описанную в примере получения 49, и 1-(3,5,6-триметилпиридин-2-ил)пиперазин (101,6 мг), реакции и обработки, аналогичные тем, которые описаны в примере 333, осуществляли с получением указанного в заголовке соединения (140 мг).
MS(ESI)m/z:449(M+H)+
[1590]
Пример 338: Синтез 3-{4-[4-(5-циклопропил-3-метилпиридин-2-ил)пиперазин-1-карбонил]фенил}-3-изопропилпирролидин-2,5-диона
[1591]
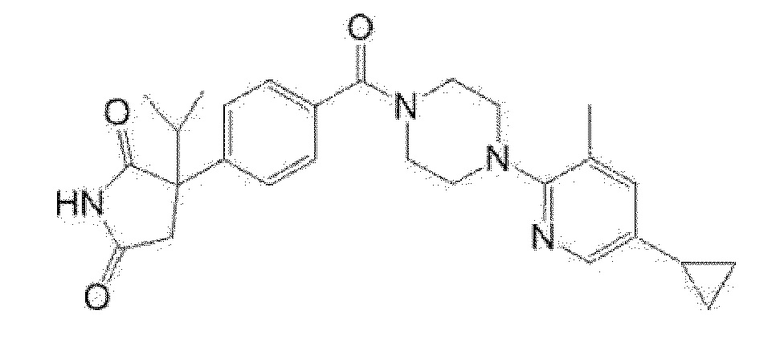
[1592]
Используя 4-(3-изопропил-2,5-диоксопирролидин-3-ил)бензойную кислоту (120 мг), описанную в примере получения 49, и 1-(5-циклопропил-3-метилпиридин-2-ил)пиперазин•гидрохлорид (125,6 мг), реакции и обработки, аналогичные тем, которые описаны в примере 332, осуществляли с получением указанного в заголовке соединения (146 мг).
MS(ESI)m/z:461(M+H)+
[1593]
Пример 339: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метоксифенил}-5-этилимидазолидин-2,4-диона
[1594]

[1595]
Используя 4-(4-этил-2,5-диоксоимидазолидин-4-ил)-3-метоксибензойную кислоту (220 мг), описанную в примере получения 53, и 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (198,1 мг), реакции и обработки, аналогичные тем, которые описаны в примере 332, осуществляли с получением указанного в заголовке соединения (157 мг).
MS(ESI)m/z:452(M+H)+
[1596]
Пример 340: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метоксифенил}-5-пропилимидазолидин-2,4-диона
[1597]
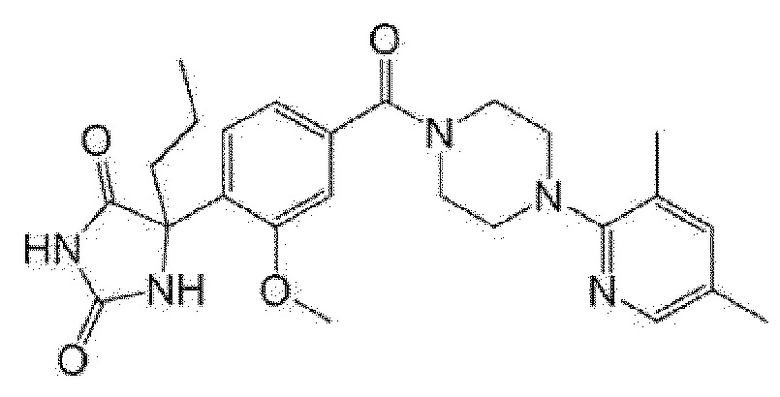
[1598]
Используя 4-(2,5-диоксо-4-пропилимидазолидин-4-ил)-3-метоксибензойную кислоту (220 мг), описанную в примере получения 54, и 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (188,5 мг), реакции и обработки, аналогичные тем, которые описаны в примере 332, осуществляли с получением указанного в заголовке соединения (289 мг).
MS(ESI)m/z:466(M+H)+
[1599]
Пример 341: Синтез 5-дифторметил-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-метоксифенил}имидазолидин-2,4-диона
[1600]

[1601]
Используя 4-(4-дифторметил-2,5-диоксоимидазолидин-4-ил)-3-метоксибензойную кислоту (150 мг), описанную в примере получения 55, и 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (125,2 мг), реакции и обработки, аналогичные тем, которые описаны в примере 332, осуществляли с получением указанного в заголовке соединения (199 мг).
MS(ESI)m/z:474(M+H)+
[1602]
Пример 342: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-2-этоксифенил}-5-изопропилимидазолидин-2,4-диона
[1603]

[1604]
Используя 3-этокси-4-(4-изопропил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (180 мг), описанную в примере получения 56, и 1-(3,5-диметилпиридин-2-ил)пиперазин•гидрохлорид (147,2 мг), реакции и обработки, аналогичные тем, которые описаны в примере 332, осуществляли с получением указанного в заголовке соединения (127,3 мг).
MS(ESI)m/z:480(M+H)+
[1605]
Пример 343: Синтез 3-{5-[4-(4,6-диметилбензофуран-3-ил)пиперидин-1-карбонил]пиридин-2-ил}-3-метоксиметилпирролидин-2,5-диона
[1606]

[1607]
К 6-(3-метоксиметил-2,5-диоксопирролидин-3-ил)никотиновой кислоте (55 мг), описанной в примере получения 64, добавляли 4-(4,6-диметилбензофуран-3-ил)пиперидин•гидрохлорид (55 мг, см. пример получения 142), 1-гидроксибензотриазол (28 мг), дихлорметан (2 мл), триэтиламин (0,058 мл) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (52 мг) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия, и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (гексан:этилацетат) с получением указанного в заголовке соединения (77,3 мг).
MS(ESI)m/z:476(M+H)+
[1608]
Пример 344: Синтез (R)-5-{4-[(R)-3-(5,7-диметилиндазол-1-ил)пирролидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона
[1609]
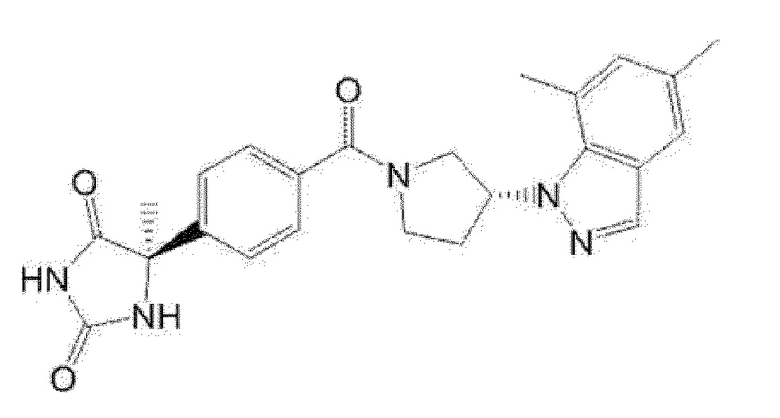
[1610]
К 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (73 мг), описанной в примере получения 6, добавляли 5,7-диметил-1-(R)-пирролидин-3-ил-1H-индазол (67 мг), описанный в примере получения 95, 1-гидроксибензотриазол (42 мг), дихлорметан (1,4 мл), триэтиламин (0,044 мл) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (78 мг) и смесь перемешивали при комнатной температуре. После завершения реакции, к реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (хлороформ:метанол) с получением указанного в заголовке соединения (95,5 мг).
MS(ESI)m/z:432(M+H)+
[1611]
Пример 345: Синтез (R)-5-метил-5-{4-[4-(6-метил-1H-индол-3-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1612]
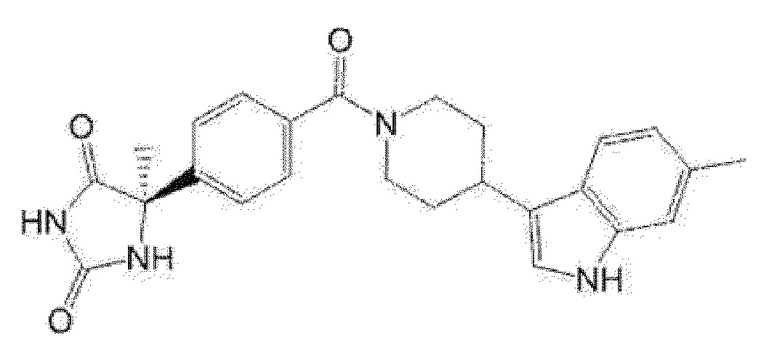
[1613]
Используя 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (56 мг), описанную в примере получения 6, и 6-метил-3-пиперидин-4-ил-1H-индол (52 мг), реакции и обработки, аналогичные тем, которые описаны в примере 344, осуществляли с получением указанного в заголовке соединения (34 мг).
MS(ESI)m/z:431(M+H)+
[1614]
Пример 346: Синтез (R)-5-метил-5-{4-[4-(4-п-толуилпиразол-1-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1615]
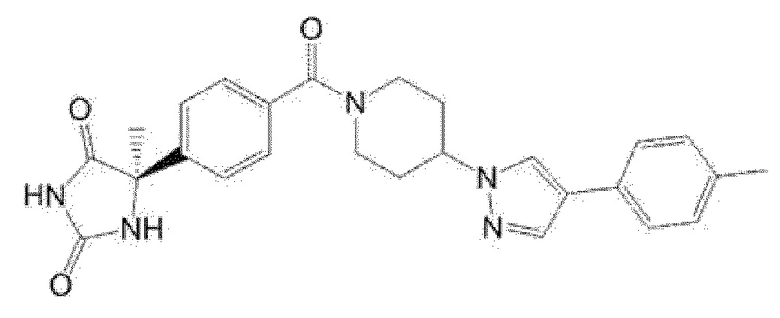
[1616]
К 4-((R)-4-метил-2,5-диоксоимидазолидин-4-ил)бензойной кислоте (59,6 мг), описанной в примере получения 6, добавляли 4-(4-п-толуилпиразол-1-ил)пиперидин•гидрохлорид (71 мг), описанный в примере получения 109, 1-гидроксибензотриазол (34 мг), дихлорметан (1,2 мл), триэтиламин (89 мкл) и 1-этил-3-(3'-диметиламинопропил)карбодиимид•гидрохлорид (63 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор гидрокарбоната натрия и смесь фильтровали с помощью фазового сепаратора. Фильтрат концентрировали при пониженном давлении и полученный остаток очищали колоночной хроматографией (хлороформ:метанол) с получением указанного в заголовке соединения (71,9 мг).
MS(ESI)m/z:458(M+H)+
[1617]
Пример 347: Синтез (R)-5-{4-[4-(5,7-диметилиндазол-2-ил)пиперидин-1-карбонил]фенил}-5-этилимидазолидин-2,4-диона
[1618]

[1619]
Используя 4-((R)-4-этил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (57,4 мг), описанную в примере получения 14, 5,7-диметил-2-пиперидин-4-ил-2H-индазол•гидрохлорид (61 мг), описанный в примере получения 96, и дихлорметан (2 мл), реакции и обработки, аналогичные тем, которые описаны в примере 346, осуществляли с получением указанного в заголовке соединения (82,6 мг).
MS(ESI)m/z:460(M+H)+
[1620]
Пример 348: Синтез (R)-5-{4-[4-(5,7-диметилиндазол-2-ил)пиперидин-1-карбонил]фенил}-5-фторметилимидазолидин-2,4-диона
[1621]

[1622]
Используя 4-(4-фторметил-2,5-диоксоимидазолидин-4-ил)бензойную кислоту (55 мг), описанную в примере получения 63, 5,7-диметил-2-пиперидин-4-ил-2H-индазол•гидрохлорид (58 мг), описанный в примере получения 96, и дихлорметан (2 мл), реакции и обработки, аналогичные тем, которые описаны в примере 346, осуществляли с получением указанного в заголовке соединения (57,5 мг).
MS(ESI)m/z:464(M+H)+
[1623]
Пример 349: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]-3-трифторметилфенил}-5-метилимидазолидин-2,4-диона
[1624]

[1625]
Используя 4-(4-метил-2,5-диоксоимидазолидин-4-ил)-2-трифторметилбензойную кислоту в виде неочищенного продукта (150 мг), описанную в примере получения 47, и 1-(3,5-диметилпиридин-2-ил)пиперазин (115 мг), реакции и обработки, аналогичные тем, которые описаны в примере 42, осуществляли с получением указанного в заголовке соединения (52 мг).
MS(ESI)m/z:476(M+H)+
[1626]
Пример 350: Синтез уксусной кислоты (R)-4-{4-[4-(5,7-диметилиндазол-2-ил)пиперидин-1-карбонил]фенил]-4-метил-2,5-диоксоимидазолидин-1-илметилового эфира
[1627]
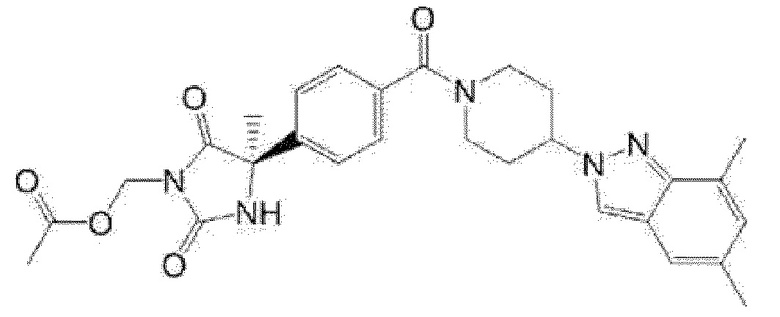
[1628]
(R)-5-{4-[4-(5,7-диметилиндазол-2-ил)пиперидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-дион (120 мг, см. пример 273) и карбонат калия (45 мг) растворяли в N,N-диметилформамиде (2 мл), добавляли хлорметилацетат (31 мг) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и растворитель выпаривали. Полученный остаток очищали при помощи колоночной хроматографии (этилацетат:метанол) с получением указанного в заголовке соединения (39 мг).
MS(ESI)m/z:518(M+H)+
[1629]
Пример 351: Синтез масляной кислоты (R)-4-{4-[4-(5,7-диметилиндазол-2-ил)пиперидин-1-карбонил]фенил}-4-метил-2,5-диоксоимидазолидин-1-илметилового эфира
[1630]

[1631]
Используя (R)-5-{4-[4-(5,7-диметилиндазол-2-ил)пиперидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-дион (120 мг, см. пример 273) и хлорметил бутират (39 мг), реакции и обработки, аналогичные тем, которые описаны в примере 350, осуществляли с получением указанного в заголовке соединения (54 мг).
MS(ESI)m/z:546(M+H)+
[1632]
Пример 352: Синтез (R)-5-изопропил-5-{4-[4-(6-метил-1H-индол-3-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-диона
[1633]

[1634]
Используя 4-((R)-4-изопропил-2,5-диоксо-имидазолидин-4-ил)бензойную кислоту (53 мг), описанную в примере получения 45, и 6-метил-3-пиперидин-4-ил-1H-индол (43 мг), реакции и обработки, аналогичные тем, которые описаны в примере 344, осуществляли с получением указанного в заголовке соединения (54,5 мг).
MS(ESI)m/z:459(M+H)+
[1635]
Пример 353: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропил-3-метилимидазолидин-2,4-диона
[1636]

[1637]
К 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диону (435 мг, см. пример 47, 1)) добавляли карбонат калия (180 мг), N,N-диметилформамид (10 мл) и метилиодид (75 мкл) и смесь перемешивали при комнатной температуре в течение 7 часов. После завершения реакции, добавляли воду и осадок собирали фильтрованием с получением указанного в заголовке соединения (382 мг).
MS(ESI)m/z:450(M+H)+
[1638]
Пример 354: Синтез 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропил-1,3-диметилимидазолидин-2,4-диона
[1639]

[1640]
К 5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропил-3-метилимидазолидин-2,4-диону (225 мг), описанному в примере 353, добавляли в атмосфере азота N,N-диметилформамид (5 мл), гидрид натрия (60% в жидкой дисперсии парафинов) (24 мг) и метилиодид (37 мкл) и смесь перемешивали при комнатной температуре. После завершения реакции, к реакционной смеси добавляли воду и смесь экстрагировали этилацетатом. Растворитель выпаривали при пониженном давлении, к полученному остатку добавляли этилацетат/гексан, и осадок собирали фильтрованием с получением указанного в заголовке соединения (206 мг).
MS(ESI)m/z:464(M+H)+
[1641]
Пример 355: Синтез 2,2-диметилпропионовая кислота (R)-4-метил-2,5-диоксо-4-{4-[4-(5-п-толил-[1,3,4]оксадиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-1-илметилового эфира
[1642]

[1643]
Используя (R)-5-метил-5-{4-[4-(5-п-толуил[1,3,4]оксадиазол-2-ил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-дион (80 мг), описанный в примере 76, и хлорметил 2,2-диметилпропионат (28 мг), реакции и обработки, аналогичные тем, которые описаны в примере 350, осуществляли с получением указанного в заголовке соединения (66 мг).
MS(ESI)m/z:574(M+H)+
[1644]
Экспериментальный пример 1: Действие стимулированных TNFα человека клеток THP-1 на продукцию proMMP-9
Клетки THP-1 (клеточная линия моноцитарного лейкоза человека) корректировали разбавлением до 1×107 клеток/мл в культуральной среде (10% эмбриональной бычьей сыворотки/среда RPMI1640) и помещали в 96-луночный планшет. Планшет уравновешивали в условиях 37°C/5% CO2, и добавляли в него культуральную среду, содержащую TNFα человека (конечная концентрация 10 нг/мл) и тестируемое соединение. После инкубации в условиях 37°C/5% CO2 в течение 24 ч культуральную среду центрифугировали и отбирали культуральный супернатант, который подвергали следующему измерению.
Количественный анализ proMMP-9 в культуральном супернатанте
Концентрацию proMMP-9 в отобранном культуральном супернатанте количественно определяли с использованием коммерчески доступного реагента для измерений (производства GE Healthcare, MMP-9, Human, Biotrak ELISA System).
Расчет степени супрессии proMMP-9
Степень супрессии proMMP-9 тестируемым соединением рассчитывали по следующей формуле:
% супрессии =100-((Test-Min)/(Max-Min)×100)
где Max представляет собой концентрацию proMMP-9 в отобранном культуральном супернатанте, полученную при стимуляции TNFα человека без добавления тестируемого соединения (добавлен только растворитель)
Min представляет собой концентрацию proMMP-9 в отобранном культуральном супернатанте без добавления тестируемого соединения (добавлен только растворитель) и без стимуляции TNFα человека, и
Test представляет собой концентрацию proMMP-9 в отобранном культуральном супернатанте, полученное при стимуляции TNFα человека при добавлении тестируемого соединения.
Кроме того, концентрация тестируемого соединения, требуемая для подавления продукции proMMP-9 стимулированными TNFα человека клетками THP-1 на 50% (значение IC50), рассчитывали, исходя из 3 значений степени супрессии proMMP-9 при концентрации тестируемого соединения 5, 50 и 500 нмоль/л или 1, 10 и 100 нмоль/л.
[1645]
Экспериментальный пример 2: Действие клеток THP-1 на продукцию proMMP-2 гемостатического типа
Клетки THP-1 (клеточная линия моноцитарного лейкоза человека) корректировали разбавлением до 1×107 клеток/мл в культуральной среде (10% эмбриональной бычьей сыворотки/среда RPMI1640) и помещали в 96-луночный планшет. Планшет уравновешивали в условиях 37°C/5% CO2, и добавляли в него культуральную среду, содержащую тестируемое соединение. После инкубации в условиях 37°C/5% CO2 в течение 24 ч культуральную среду центрифугировали и отбирали культуральный супернатант, который подвергали следующему измерению.
Количественный анализ proMMP-2 в культуральном супернатанте
Концентрацию proMMP-2 в отобранном культуральном супернатанте количественно определяли с использованием коммерчески доступного реагента для измерений (производства GE Healthcare, MMP-2, Human, Biotrak ELISA System).
Расчет степени супрессии proMMP-2
Степень супрессии proMMP-2 тестируемым соединением рассчитывали по следующей формуле:
% супрессии =100-((Test/Cont)×100).
где Cont представляет собой концентрацию proMMP-2 в культуральном супернатанте без добавления тестируемого соединения (добавлен только растворитель), и Test представляет собой концентрацию proMMP-2 в культуральном супернатанте при добавлении тестируемого соединения.
Кроме того, концентрация тестируемого соединения, требуемая для подавления продукции proMMP-2 на 50% (значение IC50), рассчитывали, исходя из 3 значений степени супрессии proMMP-2 при концентрациях тестируемого соединения 0,1, 1 и 10 мкмоль/л.
Результаты для соединений примеров по настоящему изобретению в экспериментальном примере 1 показаны в таблице 1, и результаты экспериментального примера 2 показаны в таблице 2.
[1646]
Таблица 1
[1647]
Таблица 2
[1648]
MMP-9 продуцируется стимулированными клетками в виде прекурсора proMMP-9, внеклеточно активируется и проявляет физиологическую активность в виде MMP-9. То есть, оценка подавления продуцированного клетками proMMP-9 означает оценку подавления продукции MMP-9. То же применимо к MMP-2, и оценка подавления продуцированного клетками proMMP-2 означает оценку подавления продукции MMP-2.
[1649]
Экспериментальный пример 3 Супрессивное действие на повреждение коленного сустава в отсутствие маркера в модели индуцированного монойодуксусной кислотой остеоартрита на крысах
Раствор монойодуксусной кислоты (0,3 мг/25 мкл) вводили в полость коленного сустава задней правой лапы анестезированных крыс (LEW, самцы, в возрасте 7 недель). Тестируемое соединение вводили перорально в дозе 1 мг/кг один раз в сутки, начиная сразу после введения монойодуксусной кислоты и по 4-ые сутки. На 5-ые сутки холодный фосфатный буфер (20 мкл) вводили в правую полость коленного сустава подвергнутых эвтаназии крыс и собирали промывку полости сустава. Концентрацию маркера повреждения суставов COMP (олигомерный матриксный белок хряща) в промывке полости сустава определяли с использованием коммерчески доступного реагента для измерения (Animal COMP ELISA Kit производства Anamer Medical).
Расчет степени супрессии маркера повреждения суставов COMP
Степень супрессии COMP тестируемого соединения рассчитывали по следующей формуле:
% супрессии =100-((Test-Min)/(Max-Min)×100)
где Max представляет собой концентрацию COMP в промывке полости сустава группы с патологией, которой вводили раствор монойодуксусной кислоты (пероральное введение только растворителя), Min представляет собой концентрацию COMP в промывке полости сустава нормальной группы без обработки (пероральное введение только растворителя), и Test представляет собой концентрацию COMP в промывке полости сустава группы введения тестируемого соединения.
Результаты для соединений примеров по настоящему изобретению в экспериментальном примере 3 приведены в таблице 3 ниже.
[1650]
Таблица 3
(%)
[1651]
Результаты экспериментального примера 3 для соединений, описанных в патентном документе 3 (WO 2011/136292), показаны в следующей таблице 4.
[1652]
Таблица 4
(%)
[1653]
Верхняя панель показывает структуры соединений по настоящему изобретению, а нижняя панель показывает структуры соединений, описанных в патентном документе 3, как показано ниже. При сравнении структур соединений по настоящему изобретению и соединений, описанных в патентном документе 3, они отличаются тем, что самый левый гетероцикл и остаток связаны через атом углерода в соединении по настоящему изобретению, тогда как они связаны через атом азота в соединениях, описанных в патентном документе 3. При сравнении структур примера 1, который представляет собой соединение по настоящему изобретению, и примера 450, описанного в патентном документе 3, они являются полностью одинаковыми, за исключением того, что положение связывания оставшейся части с самым левым гетероциклом отличается. То же самое относится к структурам примера 8, который представляет собой соединение по настоящему изобретению, и примера 571, описанного в патентном документе 3. При сравнении степеней супрессии маркера повреждения суставов COMP примера 1, который представляет собой соединение по настоящему изобретению, и соединения примера 450, описанного в патентном документе 3, соединение по настоящему изобретению было, по меньшей мере, в 5 раз превосходящим. При сравнении степеней супрессии маркера повреждения суставов COMP примера 8, который представляет собой соединение по настоящему изобретению, и примера 571, описанного в патентном документе 3, соединение по настоящему изобретению было, по меньшей мере, в 30 раз превосходящим. 10-кратное превосходство по отношению к примеру 571, описанному в патентном документе 3, означает подавление 55,3% при 0,3 мг/кг и 30-кратное превосходство означает подавление 55,3% при 0,1 мг/кг. Однако пример 8, который представляет собой соединение по настоящему изобретению, показал подавление 84,3% при 0,1 мг/кг.
[1654]
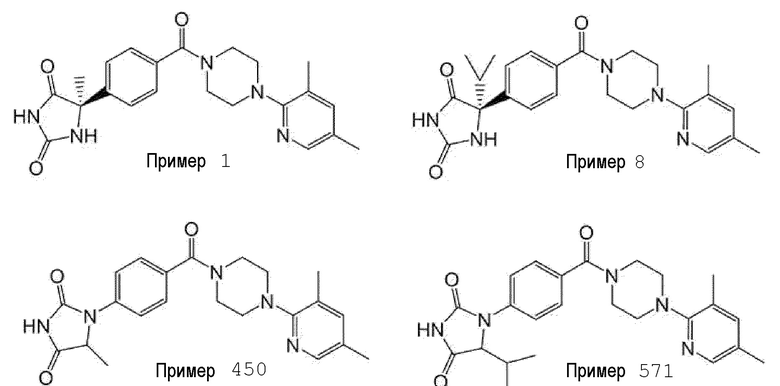
[1655]
Экспериментальный пример 4 Супрессивное действие на показатель энтерита (индекс активности болезни, DAI) на модели колита, индуцированного декстран серной кислотой, у мышей
Мышам (C57BL/6J, самцы, в возрасте 6 недель) давали свободно глотать 2,0% (мас./об.) раствора декстрана и серной кислоты в течение 5 суток, раствор заменяли водой, и патологию оценивали на 10-ые сутки. Тестируемое соединение перорально вводили дважды в день в дозе 30 мг/кг в течение 5 суток приема внутрь раствора декстрана и серной кислоты, а затем до 10-го дня. В дни 3, 5, 7 и 10 с начала теста снижение массы тела, консистенцию стула и степень скрытой крови или общего кровотечения, соответственно, оценивали в 0-4 балла, и среднее от общего балла было принято как индекс активности болезни (DAI), индекс патологии энтерита. Диагностические показатели оценки консистенции стула и оценки скрытой крови или общего кровотечения были следующими.
[1656]
Таблица 5
[1657]
Результаты оценки показаны с помощью площади под кривой (AUC), рассчитанной с использованием DAI на 3, 5, 7 и 10 сутки.
Результаты соединений примеров по настоящему изобретению в экспериментальном примере 4 приведены в таблице 6 ниже.
[1658]
Таблица 6
[1659]
Как видно из результатов экспериментальных примеров 1 и 2, соединение по настоящему изобретению обладает селективным супрессивным действием на продукцию MMP-9 и представляет собой в высшей степени безопасное соединение, демонстрирующее пониженное проявление побочных эффектов, вызванных подавлением продукции MMP-2. Кроме того, соединение по настоящему изобретению обладает супрессивным действием на повреждение коленного сустава в отсутствие маркера в модели индуцированного монойодуксусной кислотой остеоартрита (экспериментальный пример 3), и следовательно оно является полезным в качестве профилактического и/или терапевтического лекарственного средства для остеоартрита. Ввиду супрессивного действия на показатель энтерита на модели колита, индуцированного декстран серной кислотой (экспериментальный пример 4), кроме того, соединение является полезным в качестве лекарственного средства для профилактики и/или лечения воспалительных заболеваний кишечника (неспецифический язвенный колит, болезнь Крона).
[Промышленная применимость]
[1660]
Соединение по настоящему изобретению селективно подавляет продукцию MMP индукционного типа, в частности, MMP-9, и не подавляет продукцию MMP-2 гемостатического типа. Таким образом, оно является полезным в качестве лекарственного средства для профилактики и/или лечения аутоиммунных заболеваний, таких как ревматоидный артрит и тому подобное, воспалительных заболеваний кишечника (неспецифический язвенный колит, болезнь Крона) или остеоартрит.
Настоящая заявка основана на заявке на патент No. 2015-138105, поданной в Японии, полное содержание которой включено в настоящий документ.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ АМИДНЫЕ ПРОИЗВОДНЫЕ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2011 |
|
RU2574409C2 |
| НОВОЕ ПРОИЗВОДНОЕ ПИРИДИНА И ПРОИЗВОДНОЕ ПИРИМИДИНА (3) | 2006 |
|
RU2362771C1 |
| АЗАБЕНЗИМИДАЗОЛЬНЫЕ СОЕДИНЕНИЯ И ФАРМКОМПОЗИЦИЯ | 2019 |
|
RU2804485C2 |
| СУЛЬФОНАМИДНОЕ ПРОИЗВОДНОЕ И ЕГО МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ | 2013 |
|
RU2607081C2 |
| ПРОИЗВОДНЫЕ ДИГИДРОПИРИДИНА | 2005 |
|
RU2372337C2 |
| ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ЦЕЛЕНАПРАВЛЕННОЙ ДЕГРАДАЦИИ ПОЛИПЕПТИДОВ БЫСТРО УСКОРЕННОЙ ФИБРОСАРКОМЫ | 2019 |
|
RU2830173C2 |
| 1-ГИДРОКСИИМИНО-3-ФЕНИЛ-ПРОПАНЫ | 2011 |
|
RU2579114C9 |
| НОВОЕ БИЦИКЛИЧЕСКОЕ ИЛИ ТРИЦИКЛИЧЕСКОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ | 2015 |
|
RU2702113C2 |
| ИНГИБИТОРЫ ОКСАЗИНМОНОАЦИЛГЛИЦЕРИНЛИПАЗЫ (MAGL) | 2019 |
|
RU2794334C2 |
| ПРОИЗВОДНОЕ ГИДАНТОИНА | 2013 |
|
RU2678984C2 |
Изобретение относится к области органической химии, а именно к имидному производному формулы (I) или к его фармакологически приемлемой соли, где А представляет собой 5-членный гетероарилен, содержащий 1 атом серы, или фенилен, где фенилен необязательно замещен одним или одинаковыми или различными 2 заместителями, выбранными из атома галогена; гидроксильной группы и C1-C6 алкила, правая связь связана с карбонилом, а левая связь связана с четвертичным углеродом, связанным с R2; R1a, R1b и R1c являются одинаковыми или различными и каждый представляет собой атом водорода; гидроксильную группу; циано; C1-C6 алкил, необязательно замещенный одним заместителем, выбранным из C1-C6 алкокси; или два из R1a, R1b и R1c объединяются с образованием C3-C6 циклоалкила; R2 представляет собой C1-C6 алкил, необязательно замещенный одним или одинаковыми или разными 2 или 3 заместителями, выбранными из атома галогена и C1-C6 алкокси; C3-C6 циклоалкил, необязательно замещенный C1-C6 алкокси; насыщенную неароматическую гетероциклическую группу, содержащую 1 атом кислорода и имеющую 6 составляющих кольцо атомов; или C6-C10 арил; R3 представляет собой атом водорода или C1-C6 алкил; W представляет собой -N(Rx)-, где Rx представляет собой атом водорода или C1-C6 алкил; m+n равно 0, 1 или 2; X представляет собой атом углерода или атом азота; V представляет собой связь; карбонил; атом кислорода; или -N(RY)-, где RY представляет собой атом водорода и Y представляет собой 6-членную кольцевую группу, 5-членную кольцевую группу, замещенную 6-членной кольцевой группой, или конденсированную кольцевую группу 5-членного кольца и 6-членного кольца, где 5-членное кольцо и 5-членная кольцевая группа содержит 1-4 атома, выбранные из атома азота, атома кислорода и атома серы, а остальное состоит из атома углерода, 6-членное кольцо и 6-членная кольцевая группа содержит 0-2 атома азота, а остальное состоит из атома углерода, и эти кольцевые группы необязательно замещены одним или одинаковыми или разными 2 или 3 заместителями, выбранными из атома галогена; C1-C6 алкила, необязательно замещенного 3 атомами галогена; и С3-С6 циклоалкила. Также изобретение относится к конкретным соединениям, фармацевтической композиции, средству для супрессии продукции ММР-9 и лекарственному средству на основе соединения формулы (I), а также к способу лечения и/или профилактики указанных заболеваний. Технический результат: получены новые гетероциклические соединения, обладающие ингибирующим действием на продукцию MMP-9 и являющиеся полезными в качестве лекарственного средства для профилактики и/или лечения аутоиммунных заболеваний, таких как ревматоидный артрит и тому подобное, воспалительных заболеваний кишечника (неспецифический язвенный колит, болезнь Крона) или остеоартрита. 8 н. и 14 з.п. ф-лы, 6 табл., 358 пр.
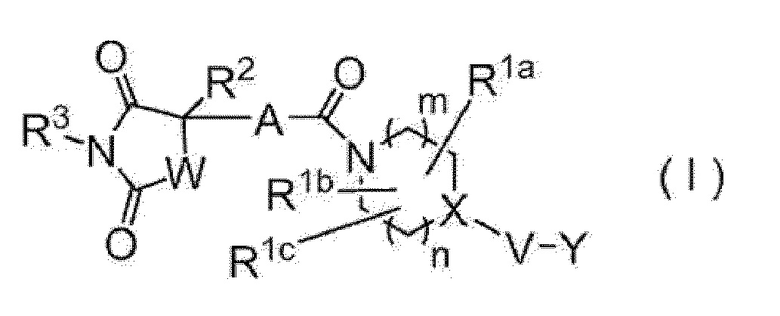
1. Имидное производное, представленное следующей формулой (I)

где А представляет собой 5-членный гетероарилен, содержащий 1 атом серы, или фенилен,
где фенилен необязательно замещен одним или одинаковыми или различными 2 заместителями, выбранными из атома галогена; гидроксильной группы и C1-C6 алкила, правая связь связана с карбонилом, а левая связь связана с четвертичным углеродом, связанным с R2,
R1a, R1b и R1c являются одинаковыми или различными и каждый представляет собой атом водорода; гидроксильную группу; циано; C1-C6 алкил, необязательно замещенный одним заместителем, выбранным из C1-C6 алкокси; или два из R1a, R1b и R1c объединяются с образованием C3-C6 циклоалкила;
R2 представляет собой C1-C6 алкил, необязательно замещенный одним или одинаковыми или разными 2 или 3 заместителями, выбранными из атома галогена и C1-C6 алкокси; C3-C6 циклоалкил, необязательно замещенный C1-C6 алкокси; насыщенную неароматическую гетероциклическую группу, содержащую 1 атом кислорода и имеющую 6 составляющих кольцо атомов; или C6-C10 арил;
R3 представляет собой атом водорода или C1-C6 алкил;
W представляет собой -N(Rx)-, где Rx представляет собой атом водорода или C1-C6 алкил,
m+n равно 0, 1 или 2,
X представляет собой атом углерода или атом азота,
V представляет собой связь; карбонил; атом кислорода или -N(RY)-, где RY представляет собой атом водорода, и
Y представляет собой 6-членную кольцевую группу, 5-членную кольцевую группу, замещенную 6-членной кольцевой группой, или конденсированную кольцевую группу 5-членного кольца и 6-членного кольца, где 5-членное кольцо и 5-членная кольцевая группа содержит 1-4 атома, выбранные из атома азота, атома кислорода и атома серы, а остальное состоит из атома углерода, 6-членное кольцо и 6-членная кольцевая группа содержит 0-2 атома азота, а остальное состоит из атома углерода, и эти кольцевые группы необязательно замещены одним или одинаковыми или разными 2 или 3 заместителями, выбранными из атома галогена; C1-C6 алкила, необязательно замещенного 3 атомами галогена; и С3-С6 циклоалкила;
или его фармакологически приемлемая соль.
2. Имидное производное по п. 1, где A представляет собой фенилен, или его фармакологически приемлемая соль.
3. Имидное производное по п. 1 или 2, где Y представляет собой фенил, пиридил, пиразинил, пиридазинил или кольцевую группу, показанную ниже
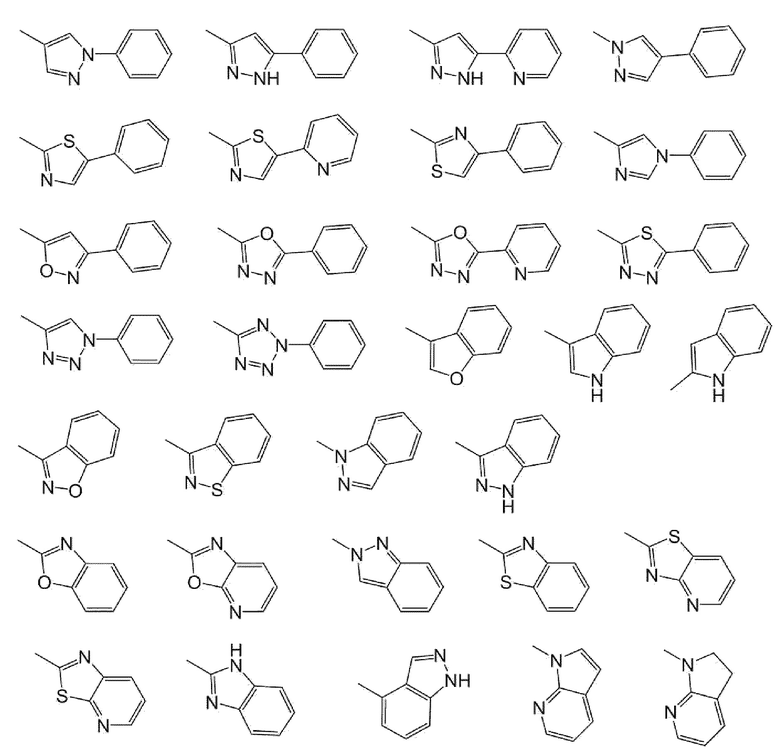 , и
, и
эти кольцевые группы необязательно замещены одним или одинаковыми или разными 2 или 3 заместителями, выбранными из атома галогена; C1-C6 алкила, необязательно замещенного 3 атомами галогена; и C3-C6 циклоалкилом,
или его фармакологически приемлемая соль.
4. Имидное производное по любому из пп. 1-3, где Y представляет собой фенил или пиридил, представленный следующей формулой
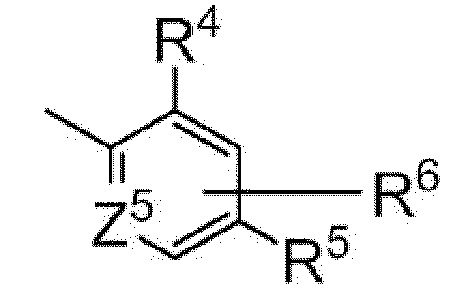
где Z5 представляет собой атом углерода или атом азота,
R4 и R5 являются одинаковыми или различными и каждый представляет собой C1-C6 алкил, необязательно замещенный 3 атомами галогена; или C3-C6 циклоалкил, и
R6 представляет собой атом водорода; C1-C6 алкил, необязательно замещенный 3 атомами галогена; или C3-C6 циклоалкил, или
кольцевую группу, представленную следующей формулой

эти кольцевые группы необязательно замещены атомом галогена или C1-C6 алкилом,
или его фармакологически приемлемая соль.
5. Имидное производное по любому из пп. 1-4, где Y представляет собой фенил или пиридил, представленный следующей формулой

где Z5 представляет собой атом углерода или атом азота, и
R4 и R5 являются одинаковыми или различными и каждый представляет собой C1-C6 алкил или C3-C6 циклоалкил, или его фармакологически приемлемая соль.
6. Имидное производное по любому из пп. 1-5, где Y представляет собой пиридил, представленный следующей формулой
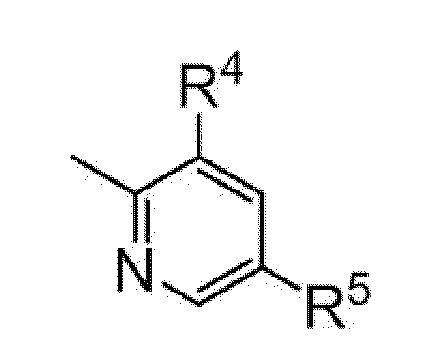
где R4 и R5 являются одинаковыми или различными и каждый представляет собой C1-C6 алкил или C3-C6 циклоалкил, или его фармакологически приемлемая соль.
7. Имидное производное по любому из пп. 1-6, где V представляет собой связь, или его фармакологически приемлемая соль.
8. Имидное производное по любому из пп. 1-7, где X представляет собой атом азота, или его фармакологически приемлемая соль.
9. Имидное производное по любому из пп. 1-8, где R1a, R1b и R1c представляют собой каждый атом водорода, или его фармакологически приемлемая соль.
10. Имидное производное по любому из пп. 1-9, где R2 представляет собой C1-C6 алкил и R3 представляет собой атом водорода, или его фармакологически приемлемая соль.
11. Имидное производное по любому из пп. 1-10, где W представляет собой -NH-, или его фармакологически приемлемая соль.
12. Соединение, выбранное из следующих:
(R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-дион,
(R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-дион,
(R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-этилимидазолидин-2,4-дион,
(R)-5-метил-5-{4-[4-(4-метилбензоил)пиперидин-1-карбонил]фенил}имидазолидин-2,4-дион,
(R)-5-метил-5-[4-(4-п-толилоксипиперидин-1-карбонил]фенил}имидазолидин-2,4-дион,
(R)-5-{4-[4-(5,7-диметилиндазол-1-ил)пиперидин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-дион,
(R)-5-{4-[4-(4-фтор-6-метил-1H-индазол-3-ил)пиперидин-1-карбонил]фенил}-5-метилимидазолидин-2,4-дион.
13. Фармацевтическая композиция, обладающая ингибирующим действием на продукцию MMP-9, содержащая эффективное количество имидного производного по любому из пп. 1-12 или его фармакологически приемлемую соль и фармацевтически приемлемую добавку.
14. Средство для супрессии продукции ММР-9, содержащее имидное производное по любому из пп. 1-12 или его фармакологически приемлемую соль.
15. Лекарственное средство для профилактики и/или лечения аутоиммунного заболевания или воспалительного заболевания кишечника, содержащее имидное производное по любому из пп. 1-12 или его фармакологически приемлемую соль.
16. Лекарственное средство по п. 15, где аутоиммунное заболевание представляет собой ревматоидный артрит, рассеянный склероз или системную красную волчанку.
17. Лекарственное средство по п. 15, где воспалительное заболевание кишечника представляет собой болезнь Крона или неспецифический язвенный колит.
18. Лекарственное средство для профилактики и/или лечения остеоартрита, содержащее имидное производное по любому из пп. 1-12 или его фармакологически приемлемую соль.
19. Способ профилактики и/или лечения аутоиммунного заболевания или воспалительного заболевания кишечника, включающий введение (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона или его фармакологически приемлемой соли.
20. Способ по п. 19, где аутоиммунное заболевание представляет собой ревматоидный артрит, рассеянный склероз или системную красную волчанку.
21. Способ по п. 19, где воспалительное заболевание кишечника представляет собой болезнь Крона или неспецифический язвенный колит.
22. Способ профилактики и/или лечения остеоартрита, включающий введение (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-метилимидазолидин-2,4-диона, или (R)-5-{4-[4-(3,5-диметилпиридин-2-ил)пиперазин-1-карбонил]фенил}-5-изопропилимидазолидин-2,4-диона, или его фармакологически приемлемой соли.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| US 8816079 B2, 26.08.2014 | |||
| СПОСОБ ПОЛУЧЕНИЯ ФЕНИЛИМИДАЗОЛИДИНОНОВ | 1972 |
|
SU453839A3 |
| В.Г.Беликов "Фармацевтическая химия", учебное пособие, 2007, Москва, "МЕДпресс-информ", стр.27-29. | |||
Авторы
Даты
2022-05-19—Публикация
2016-07-08—Подача