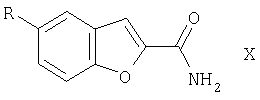
Изобретение относится к производным бензофурана формулы I
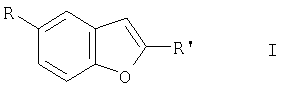
в которой
R представляет собой L,
R' представляет собой 2-R2-5-R3-пиррол-1-илкарбонил, CON(C2H5)2, CON (CH2C6H5)2, CON[CO2С(СН3)3]2,
L представляет собой Br,
R1, R4 в каждом случае независимо друг от друга являются Н, бензил или другой аминозащитной группой,
R2, R3 в каждом случае независимо друг от друга являются Н или алкилом, имеющим 1-6 С атомов,
R5, R6 в каждом случае независимо друг от друга являются алкилом, имеющим 1-6 С атомов,
Hal представляет собой F, Cl, Br или I,
а также их соли.
Подобные соединения описаны в DE 4333254 и DE 19514567.
В основе изобретения лежит цель - обнаружить новые соединения, которые могут применяться, в частности, в качестве промежуточных материалов при синтезе лекарственных препаратов, а также могут непосредственно применяться для получения медикаментов.
Было обнаружено, что соединения формулы I и их соли являются важными промежуточными продуктами для получения лекарственных препаратов и в то же время имеют фармакологические свойства. Таким образом, они проявляют, например, воздействие на центральную нервную систему.
Изобретение относится к производным бензофурана формулы I и их солям.
Ранее и далее радикалы R1, R2, R3, R4, R5, R6, R, R', L, Q и Q' имеют значения, указанные для формул I-V, если не указано другое.
В вышеприведенной формуле А имеет от 1 до 4, предпочтительно 1, 2 или 3, С атомов. А предпочтительно является метилом или этилом, более того пропилом или изопропилом, а также дополнительно бутилом, изобутилом, втор.-бутилом или трет-бутилом. Радикал Ph представляет собой фенил.
В соединениях формулы [sic] I, II, V, VI и VII L, Q и Q' представляют собой предпочтительно Cl, Br, I или активную модифицированную ОН группу, такую, как, например, активированный сложный эфир, имидазолид или алкилсульфонилокси, имеющую 1-6 С атомов (предпочтительно метилсульфонилокси) или арилсульфонилокси, имеющую 6-10 С атомов (предпочтительно фенил- или п-толилсульфонилокси).
Выражение "аминозащитная группа" широко известно и относится к группам, пригодным для защиты (для блокирования) аминогруппы от химических реакций, но которые можно легко удалять после желаемой химической реакции, проведенной в отношении других позиций в молекуле. Типичными такими группами являются, в частности, незамещенные ацильная, арильная, аралкоксиметильная или арадкильная группы. Так как аминозащитные группы удаляют после желаемой реакции (или последовательности реакций), их природа и размер таким образом несущественны; предпочтительными группами, тем не менее, являются группы, имеющие 1-20, в частности 1-8, атомов. Выражение "ацильная группа" необходимо интерпретировать в широком смысле в связи с данным методом и данными соединениями. Оно включает ацильные группы, происходящие из алифатических, аралифатических, ароматических или гетероциклических карбоксильных кислот, а также, в частности, алкоксикарбонильную, арилоксикарбонильную и в особенности аралкоксикарбонильную группы. Примерами ацильных групп такого типа являются алканоил, такой как ацетил, пропионил, бутирил; аралканоил, такой как фенилацетил; ароил, такой как бензоил или толуил; арилоксиалканоил, такой как феноксиацетил; алкоксикарбонил, такой как метоксикарбонил, этоксикарбонил, 2,2,2-трихлороэтоксикарбонил, ВОС (трет-бутоксикарбонил), 2-йодоэтоксикарбонил; аралкилоксикарбонил, такой как CBZ (карбобензоксикарбонил, также называемый "Z"), 4-метоксибензилоксикарбонил, FMOC (9-фторэнилметоксикарбонил); арилсульфонил, такой как Mtr (4-метокси-2,3,6-триметилфенилсульфонил). Предпочтительными аминозащитными группами являются ВОС и Mtr, и дополнительно CBZ или FMOC.
Соединения формулы I могут иметь один или более хиральных центров и таким образом встречаться в нескольких стереоизомерных формах. Формула I включает все эти формы.
Изобретение далее относится к методу получения производных бензофурана формулы I по п.1 и их солей, отличающемуся тем, что
а) для получения соединений формулы 1,
в которой
R представляет собой Cl, Br, I, 1-пиперазинил или 4-R1-пиперазинил
и
R' представляет собой 2-R2-5-R3-пиррол-1-илкарбонил, 4-R4-пиперазин-1-илкарбонил, 1,4-дигидробензо [d] [1,2]-оксазин-3-илкарбонил или 3,4-дигидробензо-1Н-фталазин-2-илкарбонил,
соединение формулы II
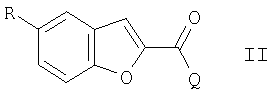
в которой
R представляет собой Cl, Br, I, 1-пиперазинил или 4-R1-пиперазинил и
Q представляет собой Cl, Br, I или свободную или активную функционально модифицированную ОН группу,
и R1 имеет значение, указанное в п.1
подвергают реакции с соединением формулы III

в которой
R' представляет собой 2-R2-5-R3-пиррол-1-ил, 4-R4-пиперазин-1-ил, 1,4-дигидробензо[d][1,2]оксазин-3-ил или 3,4-дигидробензо-1H-фталазин-2-ил,
и R2, R3 и R4 имеют значения, указанные в п.1,
или
b) для получения соединений формулы I,
в которой
R представляет собой Cl, Br, I, 1-пиперазинил или 4-R1-пиперазинил
и
R' представляет собой -СН=С(R5R6), бензофуран-2-ил-С≡С-, -С(Hal)3 или -CO-C(Hal)3,
и R1, R5 и R6 имеют значения, указанные и п.,
i) соединение формулы IV
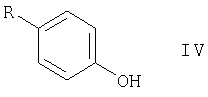
в которой
R представляет собой Cl, Br, I, 1-пиперазинил или 4-R1-пиперазинил, подвергают реакции с соединением формулы V
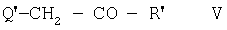
в которой
R' представляет собой -CH=C(R5R6), бензофуран-2-ил-С≡С-, -С(Hal)3 или -СО-С(Hal)3,
и Q' представляет собой Cl, Br, I или свободную или активную функционально модифицированную ОН группу,
и R5 и R6 имеют значения, указанные в п.1,
или
ii) соединение формулы Va
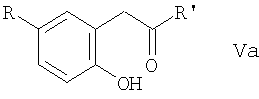
в которой R и R' имеют значения, указанные в п.i), циклизируют,
или
c) соединение формулы I, в которой R представляет собой 1-пиперазиниловый радикал, переводят введением аминозащитной группы в другое соединение формулы I, в которой R представляет собой 4-R1-пиперазиниловый радикал, в котором R1 представляет собой аминозащитную группу,
или
d) соединение формулы I,
в которой R представляет собой 4-R1-пиперазинильную группу, в которой R1 представляет собой бензил или другую аминозащитную группу,
переводят удалением бензильной или аминозащитной группы и соединение формулы I, в которой R1 представляет собой 1-пиперазинил,
или
е) в соединении формулы I радикал R переводят в другой радикал R
при помощи, например,
i) замещения атома Br ОН,
ii) этерификации ОН группы или
iii) замещения атома Br 4-Rl-пиперазинильной группой, в которой R1 представляет собой бензил или аминозащитную группу, и/или основание формулы I переводят в его соли обработкой кислотой.
Соединения формулы I, а также исходные вещества для их получения в других случаях получают по методам, известным сами по себе, таким как описанные в литературе (напр., в стандартных работах, таких как Houben-Weyl, Metoden der organischen Chemie [Методы органической химии], Georq-Thieme-Verlag, Stuttgart), а именно при реакционных условиях, которые известны и пригодны для упомянутых реакций. В этом случае также можно применять варианты, известные сами по себе, но не упомянутые здесь более детально.
При желании, исходные вещества также можно получать in situ, таким образом, чтобы их можно было не выделять из реакционной смеси, а немедленно подвергать дальнейшим реакциям для получения соединений формулы I.
В соединениях формулы II, радикал О представляет собой предпочтительно Cl или Br; тем не менее, он также может представлять собой I, ОН или активную модифицированную ОН группу, такую как алкилсульфонилокси, имеющую 1-6 C атомов (предпочтительно метилсульфонилокси) или арилсульфонилокси, имеющую 6-10 С атомов (предпочтительно фенил- или р-толилсульфонилокси, 1- или 2-нафталенсульфонилокси). В соединениях формулы II, радикал R представляет собой предпочтительно Br или 4-бензилпиперазинил. Соедиения формулы II в некоторых случаях известны; неизвестные соединения можно легко получить аналогично известным соединениям.
Реакция соединений формулы II с соединениями формулы III протекает согласно способам, таким как известные из литературы для алкилирования аминов. Соединения можно соединять вместе без присутствия растворителя, при необходимости, в закрытой трубе или в автоклаве. Тем не мене, также возможно проведение реакции между соединениями в присутствии растворителя. Пригодными инертными растворителями являются, например, углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилен; хлорированные углеводороды, такие как трихлороэтилен, 1,2-дихлороэтан, карбонтетрахлорид, хлороформ или дихлорометан; спирты, такие как метанол, этанол, изопропанол, н-пропанол, н-бутанол или трет-бутанол; эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан; гликолевые эфиры, такие как этиленглнколь монометиловый или моноэтиловый эфир (метилгликоль или этилгликоль), этиленгликольдиметиловый эфир (диглим); кетоны, такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид или диметилформамид (ДМФ); нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид (ДМСО); карбондисульфид; нитросоединения, такие как нитрометан или нитробензол; сложные эфиры, такие как этилацетат, а также необязательно смеси растворителей друг с другом или смеси с водой.
Прибавление кислотносвязывающего агента, например, гидроксида, карбоната или бикарбоната щелочного металла или щелочно-земельного металла или другой соли слабой кислоты щелочных металлов или щелочно-земельных металлов, предпочтительно калия, натрия или кальция, или прибавлением органического основания, такого как триэтиламин, диметиламин, пиридин или квинолин или избытка аминного компонента может быть предпочтительным. В зависимости от применяемых условий, время реакции может составлять от нескольких минут до 14 дней, а температура реакции составлять от 0 до 150°С, обычно между 20 и 130°С.
В соединениях формулы V, радикал Q' предпочтительно представляет собой Cl или Br; тем не менее, он также может представлять собой I, ОН или активную модифицированную ОН группу, такую как алкилсульфонилокси, имеющую 1-6 С атомов (предпочтительно метилсульфонилокси) или арилсульфонилокси, имеющую 6-10 С атомов (предпочтительно фенил- или п-толилсульфонилокси, или 1- или 2-нафтален-сульфонилокси).
В соединениях формулы IV, радикал R предпочтительно представляет собой Br или 4-бензилпиперазинил.
Реакция соединений формулы IV с соединениями формулы V протекает согласно способам, известным из литературы для алкилирования фенолов.
Соединения формулы VI в некоторых случаях известны; неизвестные соединения можно легко получить аналогично известным соединениям. Циклизацию проводят по общеизвестным способам.
Удаление аминозащитной группы из соединения формулы I - в зависимости от применяемой защитной группы - проводят, например, применяя сильные кислоты, целесообразно при использовании TFA (трифторуксусной кислоты) или хлорной кислоты, а также используя другие сильные неорганические кислоты, такие как гидрохлорная кислота или серная кислота, сильные органические карбоксильные кислоты, такие как трихлороуксусная кислота или сульфоновые кислоты, такие как бензол- или н-толуолсульфоновая кислота. Присутствие дополнительного инертного растворителя возможно, но не всегда необходимо.
Пригодными инертными растворителями предпочтительно являются органические растворители, например, карбоксильные кислоты, такие как уксусная кислота, эфиры, такие как тетрагидрофуран или диоксан, амиды, такие как диметилформамид, галогенированные углеводороды, такие как дихлорометан, кроме того, также спирты, такие как метанол, этанол или изопропанол и вода. Кроме того, возможны смеси вышеупомянутых растворителей. TFA предпочтительно применяют в избытке, без добавления другого растворителя, хлорную кислоту в форме смеси уксусной кислоты и 70% хлорной кислоты в пропорции 9:1. Температуры реакции целесообразно устанавливать между приблизительно от 0 до приблизительно 50°; предпочтительно реакцию проводят при 15-30°.
Группу ВОС предпочтительно удаляют, используя TFA в дихлорометане или используя приблизительно 3-5Н гидрохлорную кислоту в диоксане при 15-30°.
Гидрогенолитически удаляемые защитные группы (напр., CBZ или бензил) можно удалять, например, обработкой водородом в присутствии катализатора (напр., катализатора из благородного металла, такого как палладий, целесообразно на основе, такой как углерод). Пригодными растворителями являются указанные выше, в частности, например, спирты, такие как метанол или этанол или амиды, такие как DMF. Гидрогенолиз обычно проводят при температурах в рамках приблизительно от 0 до 100° и давлениях в рамках приблизительно от 1 до 200 бар, предпочтительно при 20-30° и 1-10 бар.
Соединения формулы I, в которой R' представляет собой N,N-ди(трет-бутилоксикарбонил)аминокарбонил, предпочтительно получают реакцией незащищенного аминокарбонильного соединения,
в котором
R представляет собой 4-R1-пиперазинил или L,
L [лакуна] значение, указанное в п.1, и
R' представляет собой бензил или другую аминозащитную группу,
с (ВОС)2О и инертном растворителе, таким как, например, ТГФ или диоксан с добавлением основания, такого как, например, диэтиламин и предпочтительно в каталитическом количестве диметиламинопиридин.
Основание формулы I может быть переведено в объединенную кислотно-аддитивную соль с использованием кислоты, например, реагированием эквивалентных количеств основания и кислоты в инертном растворителе, таком как этанол и последующим выпариванием. Пригодными кислотами для этой реакции, в частности, являются кислоты, дающие физиологически приемлемые соли. Таким образом, могут применяться неорганические кислоты, напр., серная кислота, азотная кислота, гидрогалогеновые кислоты, такие как гидрохлорная кислота или гидробромная кислота, фосфорные кислоты, такие как ортофосфорная кислота, сульфаминовая кислота, более того, органические кислоты, в частности, алифатические, алициклические, аралифатические, ароматические или гетероциклические моно- или полиосновные карбоксильные, сульфоновые или серные кислоты, напр., муравьиная кислота, уксусная кислота, пропионовая кислота, пиваловая кислота, диэтилуксусная кислота, малоновая кислота, сукциновая кислота, пимеловая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, виннокаменная кислота, яблочная кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метан- или этансульфоновая кислота, этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, нафталенмоно- и -дисульфиновая кислоты, лаурилсерная кислота. Соли с физиологически неприемлемыми кислотами, напр., пикраты, можно применять для выделения и/или очистки соединений формулы I.
С другой стороны, соединения формулы I могут быть переведены с применением оснований (напр., гидроксида или карбоната натрия или калия) в соответствующие соли металлов, в частности, щелочных металлов или щелочно-земельных металлов, или в соответствующие соли аммония.
Далее изобретение относится к применению соединений формулы I в качестве промежуточных продуктов для синтеза лекарственных препаратов. Соответствующие лекарственные препараты описаны, например, в DE 4333254.
Изобретение, в частности, относится к применению соединений формулы I в качестве промежуточных продуктов для синтеза лекарственных препаратов, которые оказывают воздействие на центральную нервную систему. 1-[4-(5-Цианоиндол-3-ил)бутил]-4-(2-карбамоилбензофуран-5-ил)пиперазин и его соли особенно предпочтительны для упоминания здесь.
Соответственно, изобретение относится в частности, к применению соединений формулы I по п.1,
в которой
R представляет собой Cl, Br, I или 4-R1-пиперазинил,
R' представляет собой 2-R2-5-R3-пиррол-1-илкарбонил, 4-R4-пиперазин-1-илкарбонил, 1,4-дигидробензо[d][1,2]оксазин-3-илкарбонил или 3,4-дигидробензо-1Н-фталазин-2-илкарбонил,
R1 представляет собой бензил или другую аминозащитиую группу,
R4 представляет собой Н, бензил или другую аминозащитную группу,
R2, R3 в каждом случае независимо друг от друга являются Н или алкилом, имеющим 1-6 С атомов,
в синтезе
1-[4-(5-цианоиндол-3-ил)бутил]-4-(2-карбамоилбензо-фуран-5-ил)пиперазина и его солей, отличающемся тем, что
3-R-6-гидроксибензальдегид,
в котором R представляет собой Cl, Br или I,
подвергают реакции с соединением формулы VI
 ,
,
в которой Х представляет собой Cl, Br, I или свободную или функционально модифицированную ОН группу,
Q представляет собой ОН или OR'' и
R'' представляет собой алкил, имеющий 1-6 C атомов,
для получения соединения формулы VII
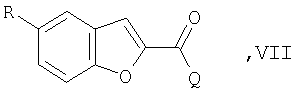
в которой
R представляет собой Cl, Br или I,
и Q имеет указанные значения,
при этом в полученном в результате соединении Q переводится в Cl, Br, I или функционально модифицированную ОН группу,
при этом полученное соединение подвергают реакции с соединением формулы III
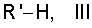
в которой
R' представляет собой 2-R2-5-R3-пиррол-1-илкарбонил, 4-R4-пиперазин-1-илкарбонил, 1,4-дигидробензо[d][1,2]оксазин-3-илкарбонил или 3,4-дигидробензо-1Н-фталазин-2-илкарбонил,
и R2, R3 и R4 имеют указанные значения, для получения соединения формулы I,
в которой
R представляет собой Cl, Br или I,
R' представляет собой 2-R2-5-RЗ-пиррол-1-илкарбонил, 4-R4-пиперазин-1-илкарбонил, 1,4-дигидробензо[d][1,2]оксазин-3-илкарбонил или 3,4-дигидробензо-1Н-фталазин-2-илкарбонил,
R4 представляет собой H, бензил или другую аминозащитную группу,
R2, R3 в каждом случае независимо друг от друга представляют собой Н или алкил, имеющий 1-6 С атомов,
при этом в полученном соединении формулы I радикал R переводят в другой радикал R,
реакцией при катализе переходным металлом с соединением формулы VIII
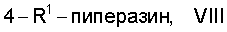
в которой
R1 представляет собой бензил или другую аминозащитную группу,
для получения соединения формулы I,
в которой
R представляет собой 4-R1-пиперазинил,
R' представляет собой 2-R2-5-R3-пиррол-1-илкарбонил, 4-R4-пиперазин-1-илкарбонил, 1,4-дигидробензо[d][1,2]оксазин-3-илкарбонил или 3,4-дигидробензо-1H-фталазин-2-илкарбонил,
R1 представляет собой бензил или другую аминозащитную группу,
R4 представляет собой Н, бензил или другую аминозащитную группу,
R2, R3 в каждом случае независимо друг от друга представляют собой Н или алкил, имеющий 1-6 С атомов,
при этом полученное соединение формулы I
i) сначала переводят основным гидролизом в соединение формулы IX и/или его кислотно-аддитивную соль

в которой
R представляет собой 4-R1-пиперспинил и
R1 представляет собой бензил или другую аминозащитную группу,
а затем переводят в соединение формулы Х
в которой
R представляет собой 4-R1-пиперазинил и
R1 представляет собой бензил или другую аминозащитную группу,
или
ii) переводят непосредственно используя аммиак в соединение формулы Х

в которой
R представляет собой 4-Rl-пиперазинил и
R1 представляет собой бензил или другую аминозащитную группу,
при этом полученное соединение формулы Х переводят в 5-(1-пиперазинил)бензофуран-2-карбоксамид или кислотно-аддитивную соль удалением аминозащитной группы R1, и при этом 5-(1-пиперазинил)бензофуран-2-карбоксамид подвергают реакции с 3-(4-хлоробутил)-5-цианоиндолом для получения 1-[4-(5-цианоиндол-3-ил)бутил]-4-(2-карбамоилбензофуран-5-ил)пиперазина и необязательно переводят в его кислотно-аддитивную соль.
3-(4-Хлоробутил)-5-цианоиндол описан в DE 4101686; 1-[4-(5-цианоиндол-3-ил)бутил]-4-(2-карбамоилбензофуран-5-ил)пиперазин описан в DE 4333254.
Выше и ниже все температуры указаны в °С. В последующих примерах "обычная обработка" обозначает: добавляют воду, при необходимости рН раствора устанавливают между 2 и 10, в зависимости от состава конечного продукта, и экстрагируют этилацетатом или дихлорометаном, органическую фазу отделяют, сушат над сульфатом натрия, выпаривают и очищают хроматографией на силикагеле и/или кристаллизацией. Rf значения на силикагеле.
Пример 1
(2,5-Диметилпиррол-1-ил)-5-бромобензофуран-2-илметанон

0,3 г гидрида натрия (60% суспензия в парафиновом масле) вводят в 10 мл. ТГФ и 0,5 мл [sic] 2, 5-диметилпиррола в 10 мл. ТГФ добавляют по каплям (5 минут). После перемешивания при 50°С на протяжении 1 часа, образуется красноватая суспензия. 1,3 г 5-бромобензофуран-2-карбонилхлорида в 10 мл. ТГФ [sic] добавляют по каплям при 25°С (5 минут) и затем смесь перемешивают на протяжении 2 часов. Затем следует добавление 100 мл полностью деионизированной воды и 100 мл этилацетата.
Отделенную органическую фазу дополнительно промывают 2х по 100 мл воды и концентрируют в вакууме. После хроматографии на силикагеле (элюэнт гептан/этилацетат 4:1), из оставшегося масла получается 700 мг желтых кристаллов (выход 44%), т.пл. 115-116°С.
Пример 2
Диэтиламид 5-бромобензофуран-2-карбоксиловой кислоты
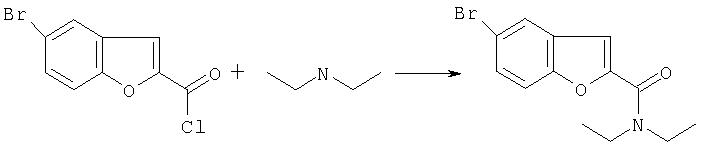
1,3 г 5-бромобензофуран-2-карбонилхлорида, 1 мл [sic] этилдиизопропиламина и 30 мл [sic] толуола смешивают и к коричневому добавляют 0,62 мл диэтиламина при перемешивании. Образуется осадок при слегка экзотермической реакции. Через 5 минут смесь обрабатывали 30 мл полностью деионизированной водой и фазы разделяли. Органическую фазу промывали 1) 20 мл 1Н HCl. 2) 20 мл 1Н NaOH. 3) 20 мл воды и затем 20 мл насыщенного раствора NaCl, а затем освобождали от компонентов растворителя в вакууме. После хроматографии на силикагеле оставшееся желтоватое масло образуется в элюэнте MtBэфире/гептане 2:1 [sic].
Окончательная масса: 1,3 г бесцветных кристаллов [sic] (выход: 88%), т.пл. 79-81°.
Пример 3
N-(5-Бромобензофуран-2-карбонил)имидоликарбонат ди-трет-бутила

12 г 5-бромобензофуран-2-карбоксамида, 23,5 мл ВОС2O, 600 мг DMAP и 8 мл триэтиламина вводят в 100 мл ТГФ при 20°С. При эндотермической реакции через 3 часа образуется прозрачный оранжевый раствор. Его нагревают до 25°С и обрабатывают 100 мл воды и 100 мл этилацетата. Органическую фазу отделяют и дважды промывают водой и 100 мл насыщенного раствора хлорида натрия. Органическую фазу концентрируют и образуется смесь масла и кристаллов (22 г/выход 40 г). После кристаллизации неочищенного продукта из 160 мл этанола, получают 9,0 г желтых кристаллов, т.пл. 138-139°.
Пример 4
Дибензиламид 5-бромобензофуран-2-карбоновой кислоты
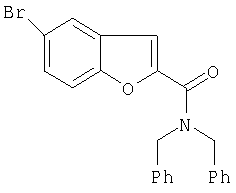
Раствор 50 мл толуола и 7,9 г дибензиламина по каплям добавляют при перемешивании при 50-60°С в течение 10 мин к 5,2 г 5-бромобензофуран-2-карбонилхлорида в 100 мл толуола. Получают бесцветное твердое вещество. После того как покапельное добавление закончено, смесь дополнительно перемешивают при 100-110°С следующие 3 часа. После охлаждения до 10°С, твердый продукт (хлорид дибензиламмония) отфильтровывают от раствора. Фильтрат затем обрабатывают смесью 150 мл воды и 10 г карбоната натрия и тщательно встряхивают. Органическую фазу отделяют, снова промывают 100 мл воды, сушат, используя сульфат натрия, и фильтруют. Фильтрат концентрируют на роторном испарителе в вакууме до получения остатка (остаток: 9,5 г). После перекристаллизации из 100 мл метанола, после выделения остается 6,5 г продукта (выход 77%) т.пл. 114-115°.
Пример 5
Дибензиламид 5-(4-бензилпиперазин-1-ил)бензофуран-2-карбоновой кислоты
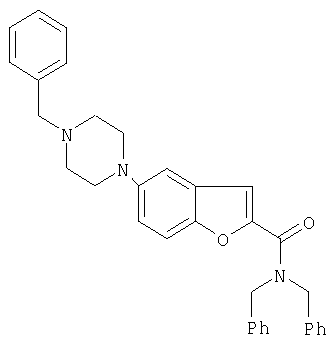
0,06 мг Pd2DBA3 [sic] и 0,007 г 2-дициклогексил-фосфино-2'-диметиламинобифенила в 40 мл толуола перемешивали в атмосфере азота при 25°С на протяжении 20 мин. 1,58 г дибензиламида 5-бромо-2, 3-дигидробензофуран-2-карбоксиловой кислоты, затем добавляют 0,98 г 1-бензилпиперазина и 1,43 г трет-бутилата натрия и смесь перемешивают при 120°С на протяжении 2 часов. Охлажденную реакционную смесь добавляют при перемешивании к смеси 150 мл воды и 5 мл 37% соляной кислоты [sic]. Реакционную смесь нейтрализуют 100 мл этилацетата. Комбинированные органические фазы сушат при помощи 5 г сульфата натрия и фильтрат концентрируют в вакууме до получения вязкого остатка (1,8 г неочищенного продукта). Неочищенный продукт растворяют в 100 мл этилацетата, очищают активированным углем и фильтруют. Добавлением 25 мл 2-молярной этаноловой соляной кислоты пиперазиновый продукт осаждают в виде гидрохлорида, фильтруют, кристаллы промывают 10 мл этилацетата и сушат в вакууме при 40°С.
Окончательная масса: 1,5 г/выход 53%, т. пл. 196-198°.
Пример 6
Цис/транс-1,2-Ди(5-бромобензофуран)-2-илэтен
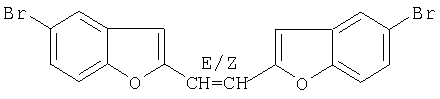
А) Получение диэфира
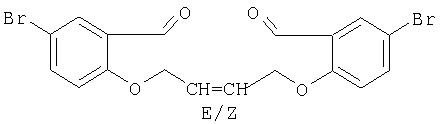
Соединение получают реакцией 5-бромосалицилальдегида с Cl-СН2-СН=СН-СН2-Cl.
В) Производное дибензофурана получают циклизацией.
Пример 7
2,2'-Этиндиил-бис-5-бромобензофуран

А) Получение диэфира
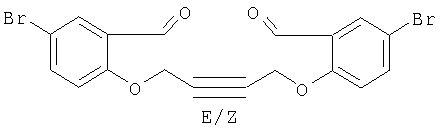
Реакция 5-бромосалицилальдегида с Cl-CH2-CC-CH2-Cl.
B) Циклизация диэфира.
Пример 8
Дебензилирование дибензиламида 5-(4-бензилпиперазин-1-ил)бензофуран-2-карбоновой кислоты, полученного по примеру 5.
1 г дибензиламида 5-(4-бензилпиперазин-1-ил)бензофуран-2-карбоновой кислоты растворяют в 20 г тетрагидрофурана и 5%-ной уксусной кислоты. К полученному раствору добавляют 5%-ный Pd/C (10 мас.%), который перемешивают под давлением водорода 1-2 бар примерно в течение 14 часов при 30-40°С. После обычной обработки реакционной смеси получают 5-(1-пиперазинил)-беобонзофуран-2-карбоксамид.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 5-(1-ПИПЕРАЗИНИЛ)БЕНЗОФУРАН-2-КАРБОКСАМИДА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2000 |
|
RU2266292C2 |
| СПОСОБ ПОЛУЧЕНИЯ 3-АЛКАНОИЛ- И 3-АЛКИЛИНДОЛОВ | 1999 |
|
RU2260589C2 |
| БЕНЗОФУРАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1996 |
|
RU2159238C2 |
| ПРОИЗВОДНЫЕ АМИДОВ И МОЧЕВИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ ВТОРИЧНОГО ПОГЛОЩЕНИЯ 5-HT И ЛИГАНДОВ 5-HT1B/1D | 1998 |
|
RU2211216C2 |
| ПРОИЗВОДНЫЕ ПИПЕРАЗИНА, ХАРАКТЕРИЗУЮЩИЕСЯ МУЛЬТИМОДАЛЬНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ БОЛИ | 2014 |
|
RU2709482C1 |
| ИНДОЛ-3-ИЛ-КАРБОНИЛ-АЗАСПИРОПРОИЗВОДНЫЕ В КАЧЕСТВЕ АНТАГОНИСТОВ РЕЦЕПТОРА ВАЗОПРЕССИНА | 2006 |
|
RU2418801C2 |
| ПРОИЗВОДНЫЕ БЕНЗАМИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2194044C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЗАМЕЩЕННОГО БЕНЗОФУРАНА ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫХ СОЛЕЙ | 1993 |
|
RU2098415C1 |
| СПОСОБ ПОЛУЧЕНИЯ F-БФА И ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ | 2019 |
|
RU2776178C1 |
| НОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ | 2004 |
|
RU2412190C2 |
Изобретение относится к новым производным бензофурана формулы 1:
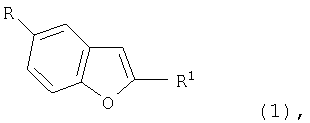
где R представляет собой L, R1 представляет собой 2-R2-5-R3-пиррол-1-илкарбонил, CON(C2H5)2, CON(CH2C6H5)2, CON[CO2С(СН3)3]2, L представляет собой Br, R2 и R3 в каждом случае независимо друг от друга являются алкилом, имеющим 1-6 С атомов, а также их солям. Эти соединения являются промежуточными продуктами в синтезе лекарственных препаратов, оказывающих влияние на центральную нервную систему, например 1-[4-(5-цианоиндол-3-ил)бутил]-4-карбамоилбензофуран-5-ил)пиперазина. Технический результат - получение новых промежуточных продуктов, позволяющих получать лекарственные препараты, такие как 1-[4-(5-цианоиндол-3-ил)бутил]-4-карбамоилбензофуран-5-ил)пиперазин более доступным способом. 1 н. и 3 з.п. ф-лы.
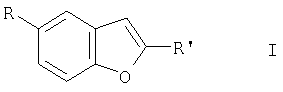
в которой
R представляет собой L,
R' представляет собой 2-R2-5-R3-пиррол-1-илкарбонил,
CON(C2H5)2, CON(СН2С6Н5)2, CON[CO2C(СН3)3]2,
L представляет собой Br,
R2, R3 в каждом случае независимо друг от друга являются алкилом, имеющим 1-6 С атомов,
а также их соли.
(5-бромобензофуран-2-ил)-(2,5-диметилпирролил)метанон и его соли.
| WO 7900426 А, 12.07.1979 | |||
| WO 9429290 А, 22.12.1994 | |||
| Волновая герметичная передача-муфта | 1973 |
|
SU648767A2 |
Авторы
Даты
2006-06-27—Публикация
2000-06-29—Подача